Настоящее изобретение относится к способу получения диагностических средств, содержащих полые (в частности, белковые) микрокапсулы и предназначенных для улучшения визуализации при помощи ультразвука.
Тот факт, что пузырьки воздуха в теле человека могут использоваться в электрокардиографии, известен уже достаточно давно. Для этой цели можно вводить в поток крови жидкости, содержащие пузырьки (см. статью Офира с сотр. в "UItrasonic Imaging" 2, 67 - 77 (1980)), авторы которой стабилизировали пузырьки в коллагеновой мембране, патент США N 4446442 ( на имя Шеринга) и Европейскую патентную заявку EP-131540 (также на имя Шеринга) и Европейские патентные заявки EP-224934 и EP-324938, в которых описано использование пузырьков, полученных обработкой ультразвуком раствора альбумина. Однако распределение пузырьков по размерам явно не поддается контролю и пузырьки исчезают в случае, когда они подвергаются давлению, имеющемуся в левом желудочке сердца (см. Шапиро с сотр. J. Am. CoII. Cardiology 16(7), 1603 - 1607 (1990)).
В Европейской патентной заявке EP-52575 описано применение для этой же цели твердых частиц, которые содержат захваченный ими газ, причем указанный газ выделяется из частиц в потоке крови.
В Европейской патентной заявке EP-458745 описан способ получения наполненных газом или воздухом микрошариков посредством межфазной полимеризации синтетических полимеров, например полилактидов и полигликолидов. В патентной заявке WO-0-61/12823 (на имя фирмы "Дельта") описан аналогичный способ с использованием альбумина. Уитли с сотр. (Biomaterials 11.713-717 (1990)) описан способ ионотропного гелеобразования альгината с получением микропузырьков диаметром свыше 30 мкм. В патентной заявке WO-91/09629 описано использование липосом в качестве контрастного агента при ультразвуковой диагностике.
Авторами данного изобретения обнаружено, что способ распыления раствора агента, способствующего образованию микрокапсул с последующим переводом получаемых микрокапсул в нерастворимое состояние, приводит к получению продукта с улучшенными свойствами. Пжиборовский с сотр. (Eur. J. NucI. Med, 7,71-72 (1982)) описали способ получения микрошариков из альбумина из сыворотки человека (АСЧ) посредством сушки при распылении для введения радиоактивной метки и последующего использования при сцинтиграфической визуализации состояния легких. При этом не указано, что микрошарики полые, а при воспроизведении данного способа авторами настоящего изобретения были получены только твердые микрошарики. Однако если шарики не являются полыми, то они не могут использоваться при эхокардиографии. Кроме того, микрошарики получают согласно одностадийному способу, который авторы настоящего изобретения нашли непригодным для получения микрокапсул, пригодных для эхокардиографии, при использовании указанного способа согласно имеющемуся уровню техники необходимо удалять из микрокапсул несденатурированный альбумин (чего не нужно делать при использовании способа согласно настоящему изобретению) и при этом получают микрошарики с широким диапазоном размеров, в результате чего необходима дополнительная стадия просеивания. Однако способ Пжиборовского с сотр. не только не является очевидным в случае выбора способа для получения микрокапсул, пригодных для визуализации при ультразвуковой диагностике, но и частицы, получаемые в соответствии с ним, не пригодны для этой цели. Авторами данного изобретения предложены значительные улучшения по сравнению с этим способом согласно имеющемуся уровню техники.
В статье Пжиборовского с сотр. приведено описание двух более ранних способов получения частиц альбумина для сцинтиграфии легких. Олдричем и Джонстоном (Inf. J. AppI. Pad. Isof. 25, 15 - 18, (1974)) описано использование вращающегося диска для получения частиц диаметром 3 - 70 мкм, которые денатурируют в горячем масле. Затем масло удаляют и частицы метят радиоизотопами. Раджу с сотр. (Isotopenpraxis 14(2), 57 - 61 (1978)) использовали тот же способ, однако денатурирование альбумина осуществляли посредством простого нагревания частиц. Ни в одном из указанных случаев не содержится упоминания о полых микрокапсулах, и получаемые согласно имеющемуся уровню техники частицы не пригодны для эхокардиографии.
Один из аспектов настоящего изобретения предусматривает способ, включающий первую стадию распыления раствора или дисперсии материала, способного образовывать стенки капсул, с целью получения микрокапсул.
Предпочтительно полученный таким способом продукт подвергают на второй стадии обработке с уменьшением его растворимости в воде по крайней мере извне по отношению к указанным микрокапсулам.
Указанные две стадии могут осуществляться в виде единого процесса, или же промежуточный продукт после первой стадии можно собрать и отдельно обработать на второй стадии. Эти две возможности ниже упоминаются как одностадийный или двухстадийный способ.
Материал, способный к образованию стенок, и условия осуществления способа должны быть подобраны таким образом, чтобы продукт был практически нетоксичным и неиммуногенным при условиях его использования, что совершенно очевидно зависит от вводимой дозы и продолжительности обработки. Материал, способный к образованию стенок, может представлять собой производное крахмала, синтетический полимер, например трет-бутилоксикарбонилметилполиглютамат (согласно патенту США N 4883398), или полисахарид, например полидекстрозу.
Обычно материал, способный к образованию стенок, можно выбирать из числа наиболее гидрофильных, биоразлагаемых, физиологически совместимых полимеров. В число подобных полимеров входят полисахариды с низкой растворимостью в воде, полилактиды и полигликолиды и их сополимеры, сополимеры лактидов и лактонов, например ε -капролактама, δ -валеролактона, полипептиды и белки, например желатин, коллаген, глобулины и альбумины. В число прочих пригодных согласно настоящему изобретению полимеров входят поли-(орто) эфиры (см., например, патенты США N 4093709, 4131648, 4138344 и 4180646), полимолочные и полигликолевые кислоты и их сополимеры, например ДЕКСОН и (см. статью Дж. Хеллера, Biomaterials 1, 51 (1980)) сополимер DL-лактида и д-капролактона), сополимер DL-лактида и δ -валеролактона, сополимер DL-лактида и γ -бутиролактона, полиалкилцианакрилаты, полиамиды, полиоксибутират, полидиоксанон, поли- β -аминокетоны (см. Polymer 23, 1693 (1982)), полифосфазены (см. Science, 193) 1214 (1976)) и полиангидриды. Описание биоразложимых полимеров можно найти в статье Р.Лангера с сотр. (Macromol. Chem. Phys. C 23, 61-125 (1983)). В качестве материала, способного к образованию стенок, можно использовать полиаминокислоты и их производные, например частичные сложные эфиры с низшими спиртами или гликолями. Одним из примеров подобных полимеров является поли (трет- бутилглютамат). Можно использовать также сополимеры с другими аминокислотами, например метионином, лейцином, валином, пролином, глицином, аланином. В настоящее время появились сообщения о некоторых новых производных полиглютаминовой и полиаспарагиновой кислот, обладающих свойствами управляемой биоразлагаемости (см. заявку WO-87/03891, патент США N 4888398 и Европейский патент EP-130935, содержание которых включено в данное описание в качестве справочного материала). Указанные полимеры (и сополимеры с другими аминокислотами) имеют общую формулу следующего вида:
-(NH-CHA-CO)x(NH-CHX-CO)y
в которой X представляет собой боковую цепь аминокислотного остатка, а A представляет собой группу формулы -(CH2)nCOOR1R2COCOR (II), в которой R1 и R2 представляют собой атом водорода или низшие алкилы, а R представляет собой алкильный или ароматический радикал, или R и R1 могут быть связаны между собой посредством замещенного или незамещенного связующего фрагмента с образованием 5- или 6-членного кольца. A может также представлять собой группу общей формулы:
-(CH2)nCOO-CHR1COOR (I) и
-(CH2)nCO(NH-CHX-CO)mNH-CH-(COOH)- (CH2)pCOOH (III)
и соответствующие ангидриды. Во всех указанных формулах n, m и p представляют собой небольшие целые числа (не превышающие 5), а x и y также представляют собой целые числа, соответствующие молекулярным весам не менее 5000.
Отмеченные выше полимеры пригодны для получения микрошариков согласно настоящему изобретению, причем в зависимости от природы заместителей R, R1, R2 и X свойства стенок могут регулироваться по таким параметрам, как, например, прочность, эластичность и способность к биоразложению. Так, например, X может представлять собой метил (аланин), изопропил (валин), изобутил (лейцин и изолейцин) и бензил (фенилаланин).
Предпочтительно способный к образованию стенок материал имеет белковую природу. Так, например, он может представлять собой коллаген, желатин и (сывороточный) альбумин, причем в каждом из случаев предпочтительно человеческого происхождения (т. е. полученные у человека или соответствующие по структуре человеческому белку). Наиболее предпочтительно он представляет собой альбумин сыворотки человека (АСЧ), полученный из донорской крови, или, в идеальном случае, в результате ферментации микроорганизмов (включая линии клеток), которые предварительно трансформируют или трансфецируют для экспрессии альбумина человека.
Способы экспрессии альбумина человека (термин, который включает также аналоги и фрагмента альбумина человека, например описанные в Европейской патентной заявке EP-322094, и полимеры мономерного альбумина) описаны, например, в Европейской патентной заявке EP-201239 и Европейской патентной заявке EP-286424, которые включены в данное описание в качестве справочного материала. "Аналоги и фрагменты" альбумина сыворотки человека включают все полипептиды (I), которые способны к образованию микрокапсул согласно настоящему изобретению и (II), у которых непрерывная область аминокислотной последовательности (составляющая по меньшей мере 50%, предпочтительно по меньшей мере 75%, 80%, 90% и 96%) является по меньшей мере на 80% гомологичной (предварительно по меньшей мере на 90%, 95% или 99% гомологичной) с непрерывной областью альбумина сыворотки человека (составляющей по меньшей мере 50%, предпочтительно по меньшей мере 75%, 80%, 90% или 95%). Особенно предпочтительным является альбумин сыворотки человека, полученный способом рекомбинантных ДНК. Таким образом альбумин сыворотки человека может быть получен в результате экспрессии кодирующей альбумин сыворотки человека нуклеотидной последовательности в дрожжах или другом микроорганизме, с последующей очисткой продукта в соответствии с известными способами. Подобный материал не содержит жирных кислот, содержащихся в материалах, полученных из сыворотки. Предпочтительно альбумин сыворотки человека должен практически не содержать жирных кислот, т.е. содержать их в количестве менее 1% от уровня содержания жирных кислот в материалах, полученных из сыворотки. Предпочтительным является случай, при котором жирные кислоты в альбумине сыворотки человека не могут быть обнаружены.
При последующем описании предпочтительных вариантов используется термин "белок", поскольку белок является предпочтительным согласно настоящему изобретению, однако следует понимать, что можно использовать и прочие описанные выше биосовместимые материалы, способные к образованию стенок.
Раствор или суспензия белка предпочтительно имеет концентрацию от 0,1 до 50% (мас/объем), более предпочтительно - содержит от примерно 5,0 до 25,0% белка, в особенности в тех случаях, когда белок представляет собой альбумин. Концентрация около 20% является оптимальной. Можно использовать также смеси материалов, способных к образованию стенок, в этом случае проценты в последних двух предложениях относятся к общему содержанию материалов, способных к образованию стенок.
Композиция для распыления может содержать вещества, отличные от материалов, способных к образованию стенок, и растворителя или жидкого носителя. Так водная фаза может содержать 1 - 20 мас.% водорастворимых гидрофильных соединений, например сахаров и полимеров в качестве стабилизаторов, включая, например, поливиниловый спирт (ПВС), поливинилпирролидон (ПВП), полиэтиленгликоль (ПЭГ), желатин, полиглютаминовую кислоту и полисахариды, например крахмал, декстран, агар-агар, ксентан и им подобные агенты. Аналогичные водные фазы можно использовать в качестве жидкого носителя, в котором конечный продукт в виде микрошариков суспендируют перед использованием. Можно применять эмульгаторы (в количестве 0,1 - 5 мас.%), включая наиболее пригодные с физиологической точки зрения эмульгаторы, например яичный лецитин или соевый лецитин, или синтетические лецитины, например насыщенные синтетические лецитины, в частности димиристоилфосфатидилхолин, дипальметоилфосфатидилхолин или дистеароилфосфатидилхолин, или ненасыщенные синтетические лецитины, в частности диолеилфосфатидилхолин или дилинолеилфосфатидилхолин. В число эмульгаторов входят также поверхностно-активные средства, например свободные жирные кислоты, сложные эфиры жирных кислот и полиоксалкиленовых производных, например полиоксипропиленгликоля и полиоксиэтиленгликоля, простые эфиры жирных спиртов и полиоксиалкиленгликолей, сложные эфиры жирных кислот и полиоксиалкилированного сорбита, мыла, глицерин-полиалкиленстеарат, глицерин-полиоксиэтиленрицинолеат, гомополимеры и сополимеры полиалкиленгликолей, полиэтоксилированные соевое масло и касторовое масло, а также гидрогенизированные производные, простые и сложные эфиры сахарозы или других карбогидратов с жирными кислотами, жирными спиртами, которые могут быть дополнительно полиоксиалкилированными, моно-, ди- и триглицериды насыщенных и ненасыщенных жирных кислот, глицериды соевого масла и сахарозы.
Добавки можно вводить в состав стенок микрошариков с целью модификации таких физических свойств, как способность образовывать дисперсии, эластичность и водопроницаемость.
В числе полезных добавок можно отметить соединения, которые могут "гидрофобизовать" стенки с целью уменьшения водопроницаемости, например жиры, воски и высокомолекулярные углеводороды. Добавки, которые улучшают дисперсионную способность микрошариков в предназначенном для инъекций жидком носителе, представляют собой амфифатические соединения, например фосфолипиды, они также увеличивают водопроницаемость и скорость биораспада.
Добавки, которые увеличивают эластичность стенок, представляют собой пластификаторы, например изопропиилмиристат и ему подобные вещества. Другая группа также очень полезных добавок состоит из полимеров, родственных полимерному материалу стенок, но имеющих низкий молекулярный вес. Так, например, при использовании сополимеров производных полимолочной/полигликолевой кислот в качестве материала для образования стенок свойства указанных стенок могут быть улучшены (в отношении мягкости и биоразложимости) посредством введения в качестве добавок полигликолидов или полиактидов низкого молекулярного веса (от 1000 до 15000 Дальтонов). Полезной смягчающей добавкой является также полиэтиленгликоль среднего или низкого молекулярного веса (например, ПЭГ-2000).
Количество добавок, вводимых в стенки, может меняться в широких пределах и зависит от конкретной необходимости. В некоторых случаях добавки не требуются вообще, в других случаях количества добавки могут достигать примерно 20 мас.% от веса стенок.
Раствор или дисперсия (предпочтительно раствор) белка, который в дальнейшем в данном описании упоминается как "белковый препарат", распыляют и сушат при распылении с использованием любого подходящего способа, который приводит к получению отдельных микрокапсул диаметром 1,00 - 50,0 мкм. Этим значениям должны соответствовать по меньшей мере 90% всех микрокапсул, измерение диаметра осуществляют посредством устройства "Каултер" Мастер Сайзер 11". Термин "микрокапсулы" относится к полым частицам, окружающим определенное пространство, которое заполнено газом или паром, но не содержит каких-либо твердых материалов. Ячеистые частицы, напоминающие кондитерские изделия, производимые в Великобритании под фирменным названием "Мальтезерс", при этом не образуются. Необходимость в том, чтобы внутреннее пространство было полностью закрыто, отсутствует (хотя это и является предпочтительным), также не является необходимым, чтобы микрокапсулы имели точно сферическую форму, хотя обычно они являются шариками. В случае, если микрокапсулы не имеют сферической формы, указанные выше значения диаметров относятся к диаметру, соответствующему сферической микрокапсуле, имеющей ту же массу и окружающей тот же объем полости, что и несферическая микрокапсула.
Распыление включает образование аэрозоли белкового препарата, например, в результате пропускания указанного препарата через по меньшей мере одну фильеру под давлением внутрь (или при использовании центробежного распылителя - непосредственно в) камеры с теплым воздухом или другим инертным газом. Указанная камера должна быть достаточно большой для того, чтобы самые большие из введенных в нее капель не ударялись о стенки до того, как они высохнут, газ или пар в камере должен быть чистым (предпочтительно стерильным и не содержащим пирогенных компонентов) и нетоксичным при введении в поток крови в количествах, соответствующих тем, в которых он вводится в микрокапсулах при эхокардиографии. Скорость испарения жидкости из белкового препарата должна быть достаточно высокой для того, чтобы образовывались полые микрокапсулы, но не настолько высокой, чтобы эти микрокапсулы разрывались. Скорость испарения можно контролировать посредством изменения скорости потока газа, концентрации белка в белковом препарате, изменения природы жидкого носителя скорости подачи раствора и, что наиболее важно, посредством изменения температуры газа, захватываемого аэрозолем. При концентрации альбумина в воде, равной 15 - 25%, входная температура газа, равная по меньшей мере примерно 100oC, предпочтительно по меньшей мере примерно 110oC, обычно достаточна для того, чтобы обеспечить образование полостей, причем температура может достигать 250oC без разрыва капсул. Оптимальным значением, по крайней мере для альбумина, является температура в пределах от 180 до 240oC, предпочтительно в пределах от 210 до 230oC, и наиболее предпочтительно - около 220oC. При одностадийном варианте способа согласно настоящему изобретению температура может быть достаточной для перевода в нерастворимое состояние по меньшей мере части (обычно с внешней части) материала для образования стенок, а часто и практически всего указанного материала без образования стенок. Поскольку температура газа, захваченного аэрозолем, зависит также от скорости, с которой происходит подача аэрозоля, и от содержания жидкости в белковом препарате, может быть необходимым контроль за температурой на выходе, чтобы обеспечить надлежащую температуру в камере. Выходная температура в 40 - 150oC является при этом подходящей. Если рассмотреть прочие факторы, то следует отметить, что регулирование скорости потока является не столь полезным, как контроль остальных параметров процесса.
При осуществлении двухстадийного варианта способа получаемые на промежуточном этапе микрокапсулы обычно содержат 96 - 98% мономерного альбумина сыворотки человека и имеют ограниченное время жизни in vivo для цели визуализации при ультразвуковом тестировании. Однако их можно либо непосредственно использовать для визуализации при ультразвуковом тестировании, либо сохранять и транспортировать перед осуществлением второй стадии двухстадийного варианта способа согласно настоящему изобретению. Такой вариант также является одним из аспектов изобретения.
На второй стадии способа получаемые на промежуточном этапе микрокапсулы закрепляют и делают их менее водорастворимыми, в результате чего они становятся пригодными более долгое время, поскольку они не столь хорошо растворимы в воде, и более инертными, поскольку они не обладают свойствами биоразлагаемости. На данной стадии происходит также упрочнение микрокапсул таким образом, что они приобретают способность противостоять внешним воздействиям при введении, а также сжатию в сосудистой системе и давлению крови в желудочке сердца. Если микрокапсулы разрываются, то они дают менее интенсивный сигнал. Шнайдер с сотр. Invest Radiol, 26, 134-139 (1992) показали, что микрошарики из альбумина согласно имеющемуся уровню техники, используемые для визуализации при ультразвуковом тестировании, не обладают должной прочностью и быстро теряют способность давать сигнал в случае, когда они подвергаются давлениям, типичным для левого желудочка сердца. Вторая стадия способа может протекать с использованием тепла (например, микроволнового излучения, обычного теплового излучения или горячего воздуха), ионизирующего излучения (например, при дозе гамма-излучения 10,0 - 100,0 кГрей), или химической сшивки с использованием, например, формальдегида, глютаральдегида, окиси этилена или прочих средств сшивки белка, ее осуществляют с использованием практически сухих микрокапсул, полученных на первой стадии, или суспензии указанных микрокапсул в жидкости, в которой они нерастворимы, например в подходящем растворителе. При одностадийном варианте способа согласно настоящему изобретению сшивающий агент, например глютаральдегид, можно распылять в камере для сушки распылителя или же можно вводить в белковый препарат непосредственно перед устройством для распыления. В альтернативном варианте температура в камере может быть достаточно высокой для того, чтобы сделать микрокапсулы нерастворимыми.
Целевой продукт при его измерении тем же способом, что и в случае промежуточных микрокапсул, может при желании состоять из микрокапсул, имеющих диаметр в пределах от 0,05 до 50,0 мкм, однако при использовании способа согласно настоящему изобретению могут достигаться диапазоны размеров от 0,1 до 20,0 мкм и особенно предпочтительный с точки зрения использования для эхокардиографии диапазон от 1,0 до 8,0 мкм. Авторами найдено, что размер частиц в пределах от примерно 0,5 до 3,0 мкм может оказаться наиболее предпочтительным для получения малоконтрастного изображения и для использования при получении допплеровского цветного изображения, тогда как размер в пределах от примерно 4,0 до 6,0 мкм может дать лучшие результаты при получении контрастных изображений. Необходимо принимать во внимание тот факт, что вторая стадия обработки может изменять размер микрокапсул, полученных на первой стадии способа.
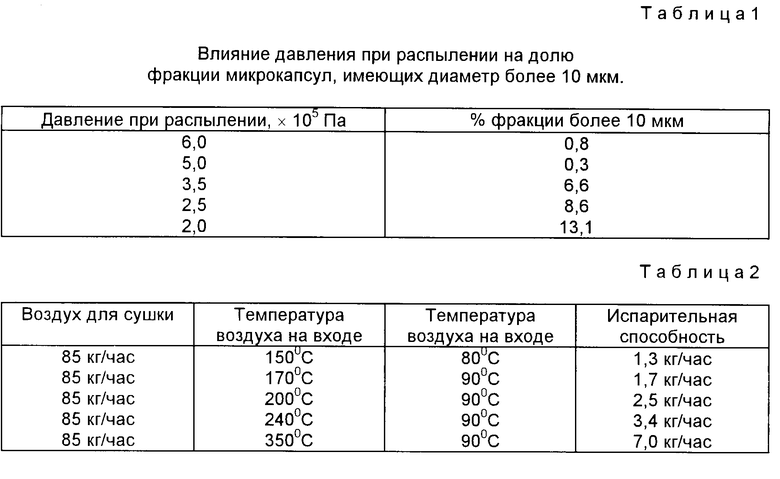
Обнаружено, что способ согласно настоящему изобретению можно регулировать при его осуществлении с целью получения микрокапсул с желаемыми характеристиками. Так давление, при котором осуществляется подача раствора белка в фильеру распылителя, может меняться, например, в пределах 1,0 - 10,0 • 105 Па, предпочтительно в пределах 2,0 - 6,0 • 105 Па, и наиболее предпочтительно равняться примерно 5 • 105 Па. Прочие параметры могут меняться в пределах, приведенных как выше, так и ниже в данном описании, Таким способом могут быть получены новые микрокапсулы.
Еще один аспект согласно настоящему изобретению предусматривает полые микрокапсулы, в которых свыше 30%, предпочтительно свыше 40%, 50%, или 60% указанных микрокапсул имеет диаметр в пределах диапазона в 2 мкм, и по меньшей мере 90%, предпочтительно 95% или 99%, имеют размер в пределах от 1,0 до 8,0 мкм.
Таким образом внутренний диапазон четвертичного отклонения размера частиц может равняться 2 мкм при значении медианы диаметра, равном 3,5, 4,0, 4,5, 5,0, 5,5, 6,0 или 6,5 мкм.
Таким образом по меньшей мере 30%, 40%, 50% или 60% микрошариков могут иметь диаметр в пределах 1,5 - 3,5 мкм, 2,0 - 4,0 мкм, 3,0 - 5,0 мкм, 4,0 - 6,0 мкм, 5,0 - 7,0 мкм или 6,0 - 8,0 мкм. Предпочтительно указанный процент частиц имеет значение диаметра, укладывающееся в пределах 1 мкм, т.е. в диапазонах 1,5 - 2,5 мкм, 2,0 - 3,0 мкм, 3,0 - 4,0 мкм, 4,0 - 5,0 мкм, 5,0 - 6,0, 6,0 - 7,0 мкм или 7,0 - 8,0 мкм.
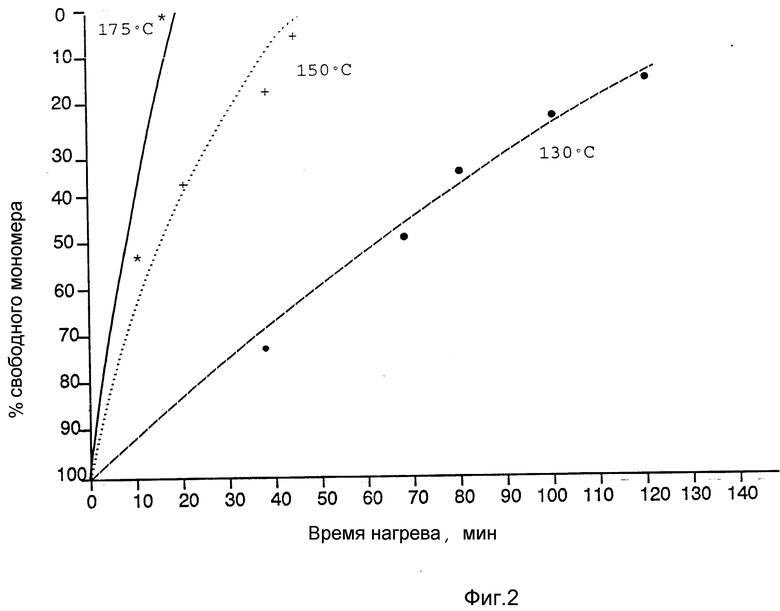
Еще один аспект согласно настоящему изобретению предусматривает полые микрошарики с белковыми стенками, в которых по меньшей степени 90%, предпочтительно по меньше мере 95% или 99% указанных микрошариков имеют диаметр в пределах 1,0 - 8,0 мкм, по меньшей мере 90%, предпочтительно по меньшей мере 95% или 99% указанных микрошариков имеют толщину стенок 40 - 500 нм, предпочтительно 100 - 500 нм, и по меньшей мере 50% белка в стенках микрошариков находятся в сшитом состоянии. Предпочтительно по меньшей мере 75%, 90%, 95%, 98,0%, 98,5% или 99% белка находится в сшитом состоянии таким образом, чтобы иметь возможность противостоять экстракции 1%-ным раствором соляной кислоты в течение 2 мин. Экстрагированный белок определяют с использованием набора реагентов для анализов белков "Коомасси Блю" (Брэдфорд). Степень сшивки контролируют, изменяя нагрев, облучение или степень химической обработки. В процессе сшивки белковый мономер подвергается связыванию между собой и быстро становится нечувствительным к процессу простого растворения, что подтверждается данными высокоэффективной жидкостной гель-хроматографии (ЖХВД) или гель-электрофореза. Продолжение обработки приводит к дальнейшей сшивке уже сшитого материала таким образом, что он становится нечувствительным к экстракции HCl в описанных выше условиях. В процессе нагревания до 175oC микрошарики альбумина сыворотки человека согласно настоящему изобретению теряют примерно 99% экстрагируемого соляной кислотой белка в течение 20 мин, тогда как при 150oC 20-минутный нагрев приводит к удалению только примерно 5% экстрагируемого соляной кислотой белка, 30-минутный нагрев - 47,5%, 40-минутный нагрев - 83%, 60-минутный нагрев - 93% и 100-минутный нагрев - 97,8% экстрагируемого соляной кислотой белка. Для достижения приемлемого уровня сшивки, следовательно, можно нагревать микрошарики при 175oC в течение по меньшей мере 17 - 20 мин, при 150oC - в течение по меньшей мере 80 мин и при прочих температурах в течение соответственно более продолжительного или более короткого промежутка времени.
Еще один аспект согласно настоящему изобретению предусматривает полые микрошарики диаметром главным образом в пределах 1,0-10,0 мкм, причем по меньшей мере 10% микрошариков при суспендировании их в воде сохраняется без разрыва, повреждения или заполнения водой при приложении к ним в течение 0,25 с давления 2,66 • 105 Па. Максимальное давление при прохождении левого желудочка человека составляет примерно 200 мм рт.ст. (2,66 • 105 Па). Предпочтительно 50%, 75%, 90% или 100%, уцелевших в результате воздействия указанного выше давления в 2,66 • 105 Па, приложенного в соответствии с описанным выше способом в течение 0,25 с микрошариков, сохраняют способность давать эхо-сигнал. При опытах in vito примерно такой же процент частиц сохраняет способность давать эхо-сигнал при однократном прохождении через оба желудочка сердца.
Пригодные для инъекции микрошарики согласно настоящему изобретению можно хранить в сухом состоянии в присутствии или в отсутствие добавок, предназначенных для улучшения сохранности и предотвращения коалесценции. В качестве подобных добавок можно применять от 0,1 до 25 мас.% водорастворимых, пригодных с физиологической точки зрения соединений, таких как маннит, галактоза, лактоза, ксантан, агар-агар, крахмал, ПВП, полиглютаминовую кислоту, поливиниловый спирт (ПВС) и желатин. Время полезного существования микрошариков в предназначенной для инъекций жидкой фазе, т.е. промежуток времени, на протяжении которого могут наблюдаться достаточно интенсивные эхографические сигналы, можно регулировать в пределах от нескольких минут до нескольких месяцев в зависимости от необходимости, этот контроль может быть осуществлен посредством регулирования пористости, растворимости или степени сшивки в стенках. Данные параметры регулируют посредством соответствующего подбора материала для образования стенок и добавок, а также путем подбора скорости испарения и температуры в камере сушки при распылении.
С целью сведения к минимуму процессов агломерации микрокапсул указанные микрокапсулы можно сшивать при измельчении инертным эксципиентом с использованием центробежной мельницы "Фритч", оборудованной ситом на 0,5 мм, или воздушной струйной мельницы "Глен Крестон". В число подходящих эксципиентов входят тонкоизмельченные порошки, инертные и пригодные для внутривенного введения, например порошки лактозы, глюкозы, маннита, сорбита, галактозы, мальтозы или хлорида натрия. После измельчения смесь микрокапсул с эсципиентом можно перевести в суспензию в водной среде для облегчения удаления нефункциональных или дефектных микрокапсул. После восстановления водной фазы желательно включить в состав композиции следовые количества поверхностно-активного агента для предотвращения агломераци. В число пригодных для этой цели поверхностно-активных средств входят анионные, катионные и неионные средства, такие как полоксамеры, сорбита - новые сложные эфиры, полисорбаты и лецитин.
Суспензию микрокапсул можно оставить для всплывания компонента на поверхность или подвергнуть центрифугированию для осаждения дефектных частиц, имеющих дефекты поверхности, которые при использовании будут заполняться жидкостью и не будут более давать сигнала.
Суспензию микрокапсул можно вновь перемещать для того, чтобы убедиться в однородности распределения частиц, подвергнуть промывке и вновь приготовить композицию в буферном растворе, пригодном для внутривенного введения, например в 0,15 М растворе хлорида натрия-0,01 мМ ТРИС с pH 7,0. Суспензию можно разделить на аликвоты для сушки при замораживании и последующей стерилизации, например, посредством гамма-излучения, нагрева в сухом состоянии или обработки окисью этилена.
Альтернативный способ дезагломерации переведенных в нерастворимое состояние микрокапсул состоит в переводе их в суспензию непосредственно в водной среде, содержащей поверхностно- активный агент, принадлежащий к группе, состоящей из полиоксанов, сорбитановых сложных эфиров, полисорбатов и лецитина. Дезагломерацию можно осуществить посредством использования подходящего гомогенизатора.
Суспензию микрокапсул можно оставить до всплывания компоненты на поверхность, или подвергнуть центрифугированию для осаждения дефектных частиц в соответствии с описанным выше способом и подвергнуть дальнейшей обработке также в соответствии с описанным выше способом.
Хотя микрокапсулы согласно настоящему изобретению можно хранить и распространять в сухом состоянии, обычно они имеют небольшое время жизни после инъекции, и может быть удобно распространять также продукт в виде готовых к употреблению композиций, т.е. суспензий микрошариков в водном жидком носителе, готовом для инъекций.
Однако в общем случае продукт поставляют и хранят в виде сухого порошка и переводят в суспензию в подходящей стерильной, не обладающей пирогенными свойствами жидкости непосредственно перед использованием. Суспензию обычно вводят посредством инъекции примерно 1,0-10,0 мл композиции в подходящую вену, например в локтевую вену, или другой кровеносный сосуд. Применимы концентрации микрокапсул от 1,0 • 105 до 1,0 • 1012 частиц/мл, предпочтительные концентрации лежат в диапазоне от примерно 5,0 • 105 до 5,0 • 109 частиц/мл.
Хотя визуализация ультразвукового изображения может осуществляться в случае различных системных органов животных и человека, одним из наиболее важных вариантов ее применения является получение изображений тканей миокарда и токов крови или кровеносной системы.
Техническое оборудование для ультразвукового сканирования состоит из устройств для сканирования и визуализации. Указанное оборудование дает визуальное изображение определенной зоны, в данном случае области сердца человека. Обычно приемник-преобразователь помещают непосредственно на кожу человека над областью, для которой осуществляют визуализацию. Сканирующее устройство включает различные электронные компоненты, в том числе ультразвуковой преобразователь. Преобразователь дает на выходе ультразвуковые волны, с помощью которых осуществляется секторное сканирование области сердца. Ультразвуковые волны отражаются различными частями области сердца и принимаются приемником-преобразователем, обработка сигнала производится в соответствии с известным способом обработки эхо-импульсов. После обработки сигналы подаются в устройство для визуализации (также хорошо известное согласно имеющемуся уровню техники) для получения изображения.
При осуществлении способа согласно настоящему изобретению после того, как пациент "подготовлен" и сканер помещен на соответствующую область, пациенту вводят суспензию микрокапсул, например, путем инъекции в вену кисти руки. Контрастное средство перетекает через вену в правую венозную область сердца, через главную легочную артерию, ведущую к легким, через легкие, по капиллярным сосудам, в легочную вену и, наконец, в левое предсердие и полость левого желудочка сердца.
При использовании микрокапсул согласно настоящему изобретению наблюдения и установка диагноза может быть осуществлена в зависимости от промежутка времени, необходимого для того, чтобы кровь проследовала через легкие, от состояния кровеносной системы, от размера левого предсердия, способности митрального клапана (отделяющего левое предсердие и левый желудочек) к пропусканию крови, от размеров камеры в полости левого желудочка и от нарушений нормального движения стенок. После контрастного средства путем инъекции и достижения им левого желудочка можно проанализировать работоспособность клапана аорты, а также долю объема, выходящего из левого желудочка. Наконец, контрастное средство в ткани указывает на то, какие именно области (если таковые вообще существуют) не снабжаются кровью в достаточной степени.
В общем подобный набор визуальных изображений может помочь диагностированию необычных характеристик тока крови в области сердца, работоспособности клапанов, размера сердечной камеры и движения стенок, а также служит потенциальным индикатором кровоснабжения миокарда.
Микрокапсулы согласно настоящему изобретению дают возможность для визуализации изображений левой половины сердца посредством внутривенных инъекций. Микрокапсулы альбумина при их введении путем инъекции в периферическую вену сохраняют способность для прохождения через легкие. Это и приводит к получению электрокардиографических данных о полости левого желудочка, а также ткани миокарда.
Помимо кратко описанного выше устройства для сканирования существуют другие типы сканеров, примерами которых могут служить описанные в патентах США N 4134554 и N 4315435, содержание которых введено в данное описание в качестве справочного материала. В основном указанные патенты относятся к различным способам, включая динамическую эхографию по сечениям (ДЭ) для получения последовательных изображений в двух измерениях поперечных сечений тонких слоев тела человека или животного посредством ультразвуковой энергии при скорости, достаточной для осуществления динамической визуализации движущихся органов, типы устройств, используемых для динамической эхографии, обычно называют сканерами для динамической эхографии, они излучают и принимают короткие звуковые импульсы в форме узких лучей или линий. Сила отраженного сигнала является функцией от времени, происходит превращение ее положения с учетом номинальной скорости звука и результат отображают на катодной телевизионной трубке или другом подходящем устройстве по типу, аналогичному появлению изображения на дисплее радара или гидролокатора. Хотя динамическая эхография может использоваться для получения изображений различных органов, включая печень, мочевой пузырь, поджелудочную железу и почки, ее часто используют для визуализации тканей и основных кровеносных сосудов сердечно-сосудистой системы.
Микрокапсулы можно использовать для визуализации широкого круга зон организма даже в тех случаях, когда их вводят путем инъекции в периферическую вену. В число подобных зон входят (не ограничивая тем самым их перечень) : (1) система вен, обслуживающих сердце, (2) ткань миокарда и характеристики прохода крови в процессе тестирования при упражнениях на топчаке или при других подобных испытаниях и (3) ткань миокарда после перорального приема или внутривенного введения лекарственных препаратов, предназначенных для усиления притока крови к тканям. Кроме того, микрокапсулы могут использоваться для отображения изменений в проходе крови через ткани миокарда, вызванных внешним вмешательством, например в случае (1) пересадки коронарной артерии, (2) ангиопластики (пластической операции) коронарной артерии (расширение суженной артерии посредством введения шариков), (3) использования тромболитических средств (например, стрептокиназы) для рассасывания сгустков в коронарных артериях, или (4) при дефектах прохождения крови или отрицательных изменениях, вызванных текущим сердечным приступом.
Кроме того, при снятии ангиограммы сердца (или снятии цифровой ангиограммы) введение микрокапсул может обеспечить получение данных по прохождению крови через ткани, которые могут, в свою очередь, дополнить и улучшить данные, полученные в процессе снятия ангиограммы, которая обеспечивает только снятие анатомических характеристик кровеносных сосудов.
Посредством использования микрокапсул согласно настоящему изобретению возможно улучшение качества изображения при использовании применяемых в настоящее время методов визуализации и/или получение изображений нового типа для других не относящихся к сердечно-сосудистой системе органов, включая печень, селезенку и почки, данный метод позволяет наблюдать за током крови и его характеристики, которые не было ранее возможно визуализировать с использованием ультразвуковой диагностики согласно имеющемуся уровню техники.
Предпочтительные варианты настоящего изобретения описаны ниже посредством конкретных примеров и информации, приведенной на фиг. 1, где представлено перспективное изображение спереди и сбоку части устройства для сушки при распылении, используемого на первой стадии способа согласно настоящему изобретению.
На фиг. 2 приведен график, иллюстрирующий возможность регулирования степени фиксации стенок микрошариков (в случае альбумина) посредством изменения температуры и время нагрева на второй стадии способа, а на фиг. 3 приведен график, иллюстрирующий возможность изменения способности микрошариков противостоять воздействию давления посредством изменения продолжительности времени нагрева на второй стадии способа согласно настоящему изобретению.
Пример 1.
Подходящее устройство для сушки при распылении (см. фиг. 1) поставляется фирмой "Нитро Атомайзер", Шеберг, Дания под фирменным обозначением "Мобайл Минор".
Устройство состоит из центробежного измельчителя (типа M-02/B "Минор"), приводимого в действие воздушной турбиной при минимальном давлении воздуха 4 бар и максимальном 6 бар. При давлении 6 бар достигается скорость ротора измельчителя около 33000 об/мин. Включение и отсекание пуска сжатого воздуха в измельчитель достигается посредством клапана, выведенного на панель управления. Максимальное потребление сжатого воздуха в измельчителе составляет 17 нм/ч. при давлении 6 бар. Все части, находящиеся в контакте с жидким потоком и порошком, выполнены из нержавеющей стали AISI-316, за исключением питательной магистрали насоса и ротора измельчителя, которые изготовлены из нержавеющей стали AISI-329, способной противостоять высоким значением центробежного ускорения.
Внутренняя поверхность сушильной камеры выполнена из нержавеющей стали AISI-316, тщательно изолирована материалом "Роквул" и покрыта с внешней стороны обшивкой из мягкой стали. Сушильная камера обеспечена боковым освещением и обзорным стеклом для наблюдения в процессе работы. Крышка сушильной камеры изготовлена из нержавеющей стали AISI-316, а ее внешняя часть - из нержавеющей стали AISI-304.
Распределитель воздуха изготовлен из нержавеющей стали AISI-304 и предназначен для распределения воздуха в сушильной камере для достижения наилучшего эффекта при сушке. Воздушный канал, изготовленный из нержавеющей стали AISI-316, обеспечивает отвод в поперечном направлении отработанного воздуха и порошка в циклон, который изготовлен из нержавеющей стали AISI-316 и предназначен для разделения порошка и воздуха.
Запорный клапан представляет собой дроссельную задвижку, также изготовленную из нержавеющей стали AISI-316 и имеющую прокладку из силиконовой резины, он используется для выгрузки порошка из нижней части циклона в стеклянную емкость для порошка, плотно прилегающую к циклону снизу посредством пружинного прижима.
Вентилятор изготовлен из силумина, оборудован трехфазным короткозамкнутым асинхронным электродвигателем мощностью 0,25 кВт, V-образный ленточный транспортер с предохранительным кожухом осуществляет транспортировку воздуха и порошка через сушильную камеру и циклон.
Воздухонагреватели нагревают сухой воздух посредством электричества (общее потребление 7,5 кВт/ч., изменяемое в любых пределах) и могут обеспечивать температуру газа на входе до примерно 350oC, хотя обычно такая температура слишком высока для получения микрокапсул согласно настоящему изобретению.
В устройство можно включить оборудование для распыления в двух жидких средах, изготовленное из нержавеющей стали AISI-316 и состоящее из входной магистрали с держателем для сплава и самого сопла, которое размещают в верхней части сушильной камеры. Оборудование включает водо-масляный сепаратор, понижающий редуктор и манометр для подачи сжатого воздуха к соплу для двух жидких сред. Потребление сжатого воздуха: 8-15 кг-ч при давлении 0,5-2,0 бар (0,5-2,0 • 105 Па).
Подходящим питательным насосом для подачи исходной композиции для получения стенок в измельчающее устройство является перистальтический насос. Этот насос оборудован двигателем (1 • 220 В, 50 Гц, 0,18 кВт) и регулировочным устройством для ручной непрерывной регулировки. Подачная магистраль из силиконового шлака проведена от питающего резервуара (для местной подачи) через питательный насос в устройство для распыления.
Абсолютный воздушный фильтр, состоящий из предварительного фильтра, основания фильтра из нержавеющей стали и абсолютного воздушного фильтра, используют для обработки впускаемого сухого воздуха для его полной очистки.
20%-ный раствор стерильного и не содержащего пирогенных компонентов альбумина сыворотки человека в не содержащей пирогенных компонентов воде (пригодной для инъекций) перекачивают в сопло устройства для распыления в двух жидких средах, смонтированное в промышленном устройстве для сушки распылением, описанном выше. Скорость подачи посредством перистальтического насоса поддерживают на уровне примерно 10 мл/мин таким образом, чтобы при температуре воздуха на входе, равной 220oC, температура воздуха на выходе поддерживалась на уровне 95oC.
Сжатый воздух подают в сопло устройства для распыления в двух жидких средах при давлении 2,0-6,0 бар (2,0-6,0 • 105 Па). При этом диапазоне давлений получают микрокапсулы со средним размером 4,25-6,2 мкм.
Обычно увеличение среднего размера частиц (при уменьшенном давлении распыления) приводит к увеличению количества микрокапсул, имеющих размер более 10 мкм (см. табл. 1)
На второй стадии способа 5 г микрокапсул нагревают в стеклянном стакане с использованием сушильного шкафа "Галленкамп". Температура 175oC в течение 1 ч. является достаточной для получения микрокапсул со 100%-ной фракцией, о чем свидетельствуют данные ЖХВД. Эффект указанной фиксации состоит в увеличении in vitro времени половинного гашения отражательной способности (способности давать эхосигнал) с нескольких секунд до свыше 30 мин. При изменении температуры и продолжительности выдерживания можно изменять степень фиксации от примерно 5 до 100%. Примеры профилей термической фиксации при различных температурах приведены на фиг. 2.
После термической фиксации микрокапсулы дезагломерируют и диспергируют в воде одним из двух способов. Способ 1 включает вначале смешивание зафиксированных термическим способом шариков с равным по весу количеством тонкоизмельченной лактозы (средний размер частиц 5 мкм). Полученную смесь затем пропускают через центробежную мельницу "фритч" с ситом 0,5 мм и 12-зубчатым ротором. Измельченные шарики собирают и пропускают через мельницу во второй раз для того, чтобы иметь уверенность в том, что смешивание закончено. Измельченный порошок затем вновь переводят в суспензию в воде, содержащей 1 мг/мл "Плюроник" F-86". Обычно 10 г микрокапсул и лактозы добавляют к 100 мл воды и "Плюроник F-86". Второй способ дезагломерации включает добавление 5 г зафиксированных термическим способом микрокапсул к 100 мл воды, содержащей 100 мг "Плюроник F-86". Микрокапсулы диспергируют с использованием гомогенизатора "Сильверсон" (модель L-4R с 2,54-см кольцевым гомогенизационным зондом и ситом с высокой срезающей способностью) и гомогенизируют в течение 60 с.
Вновь переведенные в суспензию шарики разделяют на неповрежденные (содержащие газ) и разрушенные шарики с использованием способа флотации. Содержащие газ шарики всплывают на поверхность в течение 1 ч., их декантируют от нижней фазы, которая не содержит необходимого газа.
Процесс разделения можно ускорить посредством центрифугирования. Центрифугирование в течение 30 с при 5000g достаточно для разделения двух фракций.
После разделения целые микрокапсулы сушат при замораживании в присутствии лактозы и "Плюроник F-86". Оптимальные условия для сушки при замораживании включает перевод в суспензию 30 мг микрокапсул в 5 мл воды, содержащей 50 мг лактозы и 5 мг "Плюроник F-86". Высушенные при замораживании микрокапсулы можно вновь переводить в дисперсию в жидкости (например, воде, солевом растворе) с получением монодисперсного распределения.
Пример 2.
Повторяют процесс согласно примеру 1 с небольшими изменениями на первой стадии: вместо сопла для распыления в двух жидких средах используют центробежный распылитель, температура на входе составляет 150oC (при том, что температура воздуха на выходе все еще поддерживают на уровне 105oC), и сжатый воздух подают в сопло при давлении 1,0-6,0 • 105 Па. Ротор вращается со скоростью 20-40000 об/мин и дает капли, а затем и микрокапсулы со средним диаметром в диапазоне 1,0-8,0 мкм.
Пример 3.
Вторую стадию способа согласно примерам 1 и 2 изменяют следующим образом. Небольшую аликвоту микрокапсул (0,5 г) нагревают в микроволновой печи таким образом, чтобы они получили дозу микроволнового излучения с частотой 2500 Гц в 300-350 Вт/ч. Получены таким способом микрокапсулы, в которых 90-95% мономерного альбумина сыворотки человека нерастворимо (о чем свидетельствуют данные гель-хроматографии), в результате подобной термической фиксации происходит увеличение in vitro времени половинного гашения отражательной способности (способности давать эхо-сигнал) с нескольких секунд до свыше 30 мин.
Пример 4.
Вторую стадию способа согласно примерам 1 и 2 изменяют следующим образом. Небольшую аликвоту микрокапсул (0,5 г) запаивают под аргоном в стеклянную ампулу. Ампулу охлаждают до 4oC и облучают гамма-излучением (кобальт - 60) таким образом, чтобы микрокапсулы получили дозу гамма-излучения в 15,0 кГрей. Облучение приводит к получению микрокапсул, в которых 10-15% мономерного альбумина сыворотки человека нерастворимо.
Пример 5.
Вторую стадию способа согласно примерам 1 и 2 изменяют следующим образом. Небольшую аликвоту микрокапсул (0,5 г) запаивают под аргоном в стеклянную ампулу. Ампулу охлаждают до 4oC и облучают гамма-излучением (кобальт - 60) таким образом, чтобы микрокапсулы получили дозу гамма-излучения в 50,0 кГрей. После облучения микрокапсул выдерживают в кислороде при 50oC в течение 6 ч. Облучение приводит к получению микрокапсул, в которых 50-60% мономерного альбумина сыворотки человека нерастворимо.
Пример 6.
Вторую стадию способа согласно примерам 1 и 2 изменяют следующим образом. Небольшую аликвоту микрокапсул (0,5 г) вновь переводят в суспензию в 5 мл этанола, хлороформа или хлористого метилена, содержащего а) 1,5 % глютаральдегида, б) 2,0% дифталоилхлорида или в) 5,0 % формальдегида.
Микрокапсулы перемешивают в течение различного времени от 10 мин до 3 ч. Затем микрокапсулы отделяют фильтрованием и тщательно промывают в исходном органическом буфере, содержащем 5% этаноламина, с целью удаления избытка сшивающего агента. Наконец, микрокапсулы промывают органическим растворителем и сушат в вакууме с целью удаления любых остаточных растворителей. Степень перевода в нерастворимое состояние может меняться при обработке данным способом в пределах от 5 до 100%, в результате подобной фиксации происходит увеличение in vitro времени половинного гашения отражательной способности (способности давать эхо-сигнал) с 1-2 мин до более чем 1 ч.
Пример 7.
Две независимые стадии получения микрокапсул и перевода их оболочки в нерастворимое состояние могут быть объединены в виде единого способа. В этом примере образование микрокапсул и перевод в нерастворимое состояние полимерного материала достигаются одновременно в процессе сушки при распылении.
Раствор альбумина сыворотки человека подают посредством перистальтического насоса в небольшую камеру для проведения реакции с применением отдельной линии подачи 5%-ного раствора подходящего агента сшивки, например глютаральдегида, дифталоилхлорида или формальдегида. Время пребывания в реакционной камере подбирают таким образом, чтобы достигалось первоначальное образование аддукта между сшивающим агентом и белком, но предотвращалось образование внутрибелковых сшивок. После выхода из реактора смесь подают непосредственно в сопло устройства для распыления в двух жидких средах, оборудованное в специальным образом адаптированном устройстве для сушки при распылении, пригодном для работы с летучими растворителями. Условия сушки при распылении соответствуют приведенным в примере 1. Затем микрокапсулы выдерживают в сухом состоянии при комнатной температуре, давая образоваться внутрибелковым сшивкам, и затем переводят в суспензию в этаноле, содержащем 5% этаноламина, для гашения остатка сшивающего агента. После тщательной промывки микрокапсул их сушат в вакууме для удаления остатков растворителя.
Пример 8.
Определение свободного мономерного альбумина сыворотки человека в микрокапсулах.
1 мл этанола добавляют к 100 мг микрокапсул в 20-мл стеклянном пузырьке и подвергают обработке ультразвуком в течение 30 с. К полученной суспензии добавляют 19 мл воды. Смесь центрифугируют на рычажной микроцентрифуге "Джилсон" в течение 20 с и исследуют прозрачную фракцию. Исследование осуществляют посредством автоматической загрузки 50 мл указанной фракции в жидкостный хроматограф для ЖХВД "Шимадзу LC-6A" и хроматографируют на колонке для гель-хроматографии (TSK) при скорости потока 1 л/мин с использованием буфера на основе фосфата натрия (pH 7,0)
При этом регистрируют высоты пиков, соответствующих мономерному альбумину сыворотки человека, и используют полученные данные для определения концентрации мономера с применением кривой для стандартов мономерного альбумина сыворотки человека в пределах концентрации от 1 до 10 мг/мл.
Процент свободного мономерного альбумина сыворотки человека рассчитывают посредством измерения концентрации мономера в зафиксированных микрокапсулах и выражения полученного значения в виде процентной доли от концентрации мономера в незафиксированных микрокапсулах. Полученные результаты приведены на фиг. 2.
Нагревание высушенных при распылении микрокапсул в печи (как это описано в примере 1) приводит к уменьшению детектируемого количества мономера (фиг. 2). Это уменьшение детектируемого количества мономерного альбумина сыворотки человека обусловлено денатурированием и сшивкой мономерного альбумина сыворотки человека с получением нерастворимых полимеров, которые не могут быть обнаружены посредством описанного выше метода ЖХВД.
При использовании метода ЖХВД для наблюдения за уровнем содержания альбумина сыворотки человека из приведенных на фиг. 2 данных видно, что спустя 15 мин выдерживания в микрокапсулах из альбумина сыворотки человека более не содержится мономерного альбумина сыворотки человека. Однако остается возможность для образования дальнейших сшивок в микрокапсулах из альбумина сыворотки человека при дальнейшем нагревании.
Подобное продолжительное нагревание приводит к увеличенному содержанию сшивок в микрокапсулах, которое, в свою очередь, приводит к увеличению их прочности, что делает микрокапсулы более устойчивыми к воздействию давления.
При тщательном регулировании температуры и времени выдерживания можно получать микрокапсулы с регулируемой степенью сшивки (и соответственно способностью противостоять воздействию давления).
Пример 9.
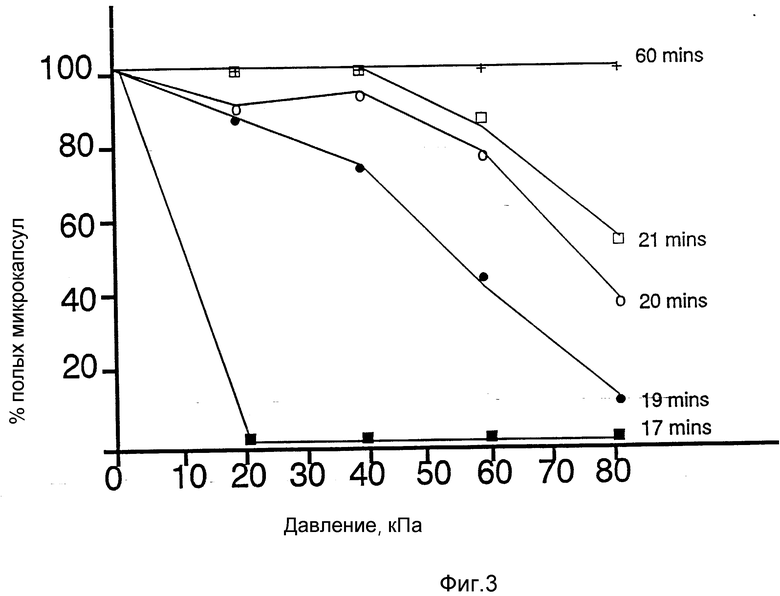
Влияние времени выдерживания при 175oC на способность микрокапсул из альбумина сыворотки человека противостоять воздействию давления.
Партию микрокапсул из альбумина сыворотки человека разделяют на аликвоты по 5 г и прогревают при 175oC на протяжении различных промежутков времени, получая зависимость, приведенную на фиг. 3.
После термической фиксации определяют количество свободного мономера согласно описанному в примере 8 способу. Для каждого из времен обработки, приведенных на фиг. 3, не удается обнаружить детектируемое количество мономерного альбумина сыворотки человека.
Зафиксированные термическим способом микрокапсулы подвергают дезагрегации с использованием центробежной мельницы "Фритч" (согласно описанному выше способу), целые микрокапсулы, содержащие воздух, отделяют описанным ранее методом флотации. Отделенные микрокапсулы переводят в суспензию в воде, содержащей "Плюроник F-86" (1 мг/мл) при концентрации 0,5 • 10 капсул/мл.
Вновь переведенные в суспензию содержащие воздух микрокапсулы подвергают воздействию увеличенного атмосферного давления посредством приложения давления, выдавливая указанную суспензию через шприц на 50 мл в закрытую емкость (25 мл емкость из полистирола).
Для каждого из заданных давлений берут индивидуальную суспензию, которую подвергают воздействию данного давления, и выдерживают под нагрузкой в течение 5 с, после чего сбрасывают давление. Для каждой из суспензий испытания по приложению повышенного давления осуществляют в серии из 3 опытов. Давление в закрытой емкости оценивают посредством ручного манометра типа RS.
После приложения давления суспензии микрокапсул подвергают исследованию под микроскопом с анализом изображений и определяют процент содержащих воздух и не содержащих воздух микрокапсул. Анализ проводят только в том случае, если содержащие воздух микрокапсулы являются функциональными при улучшении контраста при визуализации ультразвукового сигнала.
Как следует из фиг. 3, микрокапсулы, фиксируемые при 175oC, в течение 60 мин в соответствии со способом, описанным в примере 1, стабильны при всех значениях давления, которым их подвергают в ходе данного эксперимента.
При аккуратном регулировании времени выдержки при данной температуре (175oC) можно получать партии микрокапсул с различной степенью сшивки, которые, в свою очередь, будут способны противостоять различному увеличенному внешнему давлению.
При использовании тщательной регулировки степени сшивки посредством подбора надлежащей продолжительности и температуры выдерживания можно получать партии содержащих воздух микрокапсул, предназначенных для того, чтобы они могли выдерживать определенное увеличенное давление. Температура, используемая для сшивки материала микрокапсул, может меняться в практически неограниченных пределах, также и время выдерживания.
Пример 10.
Классификация микрокапсул.
Преимущество способа согласно настоящему изобретению заключается в том, что он позволяет регулировать среднее значение размера микрокапсул или их распределение по размерам. Однако можно производить и дополнительный отбор желаемых фракций по размерам, например при использовании метода флотации. В однородной дисперсии микрошариков у более крупных частиц будет наблюдаться тенденция к более быстрому всплытию на поверхность по сравнению с более мелкими частицами вследствие более низкой плотности (они содержат больше заключенного в них воздуха) более крупных частиц. Следовательно, при стоянии дисперсии распределение частиц по размерам меняется со временем на любом уровне глубины.
Микрокапсулы переводят в дисперсию в 2000 мл водного раствора, содержащего 6% (мас/объем) хлорида натрия и 0,1% (мас/объем) "Плюроник F-68", в стеклянной бутылке, обеспечивающей высоту столба жидкости примерно 165 мм. Трубку для отбора образцов помещают в 50 мм ниже верхнего уровня жидкости, извлекая через нее пробы через определенные промежутки времени.
Посредством изменения времени стояния и концентрации хлорида натрия можно получить различные распределения частиц по размерам и отобрать микрокапсулы диаметром до 2 мкм.
Другие способы "жидкостной" классификации включают гидродинамическую хроматографию и фракционирование в потоке под воздействием поля. "Сухие" способы основаны на принципах декантации и разделены в пересекающихся потоках, имеются промышленные образцы подобных устройств для классификации под обозначениями "Микросплит" (фирма "Бритиш Рем"), "Зигзаг" (фирма "Альпин") и "Турбо" (фирма "Ниссин"). Классификатор струйного типа, производимый фирмой "Нитетцу Майнинг", использует другой принцип (эффект Коанда), который также может обеспечить хорошие результаты при классификации микрокапсул.
Дополнительные детали устройства распылителя.
На фиг. 1 цифрой 1 обозначено питающее устройство. Цифрой 2 обозначен потолочный распределитель воздуха, обеспечивающий эффективный контроль за потоком воздуха. Спиральный поток воздуха направляют вокруг лопастного дискового распылителя. Цифрой 3 обозначен вращающийся распылитель или сопло распылителя. Цифрой 4 обозначена магистраль из нержавеющей стали, которую легко отделять с целью очистки. Цифрой 5 обозначены ступеньки для доступа к верхней части камеры. Цифрой 6 обозначен выключатель воздушного клапана для активации пневматического подъемного устройства, поднимающего крышку камеры. Цифрой 7 обозначен высокоэффективный циклон из нержавеющей стали, в котором происходит разделение порошка и отработанного воздуха для сушки. Цифрой 8 обозначен стеклянный сосуд, в котором собирают порошок. Цифрой 9 обозначена центральная панель управления. Цифрой 10 обозначен центробежный вентилятор для выхлопа с трехфазным двигателем. Цифрой 11 обозначена заслонка для регулировки потока воздуха, а цифрой 12 обозначен электронагреватель воздуха, который обеспечивает температуру воздуха для сушки на уровне до 350oC. Температуру воздуха для сушки можно регулировать непрерывно с использованием таймера, градуированного в процентах. Максимальное потребление энергии = 7,5 кВт.
Испарительная способность показана в табл. 2.
Вес и размеры установки: вес: 280 кг; длина: 1800 мм; высота: 2200 мм; ширина: 925 мм.
Питание: установка может функционировать только при наличии трехфазного тока (50 или 60 Гц) при вариантах напряжения 440, 415, 400, 380, 220 и 220В.
Все части, входящие в контакт с жидкостью или продуктом, изготовлены из кислотостойкой нержавеющей стали AISI-316.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИГОТОВЛЕНИЕ ПОЛЫХ МИКРОКАПСУЛ | 1995 |
|
RU2193397C2 |
| ВЫСУШЕННЫЕ РАСПЫЛЕНИЕМ МИКРОЧАСТИЦЫ КАК ТЕРАПЕВТИЧЕСКИЕ НОСИТЕЛИ | 1995 |
|
RU2147226C1 |
| МИКРОКАПСУЛЫ | 2004 |
|
RU2359662C2 |
| СПОСОБ ПОЛУЧЕНИЯ МИКРОКАПСУЛ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ ГРУППЫ ЦЕФАЛОСПОРИНОВ В ПОЛУДАНЕ | 2012 |
|
RU2514111C2 |
| СПОСОБ ПОЛУЧЕНИЯ МИКРОКАПСУЛ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ ГРУППЫ ЦЕФАЛОСПОРИНОВ В КОНЖАКОВОЙ КАМЕДИ В ТЕТРАГИДРОФУРАНЕ | 2012 |
|
RU2508095C2 |
| СПОСОБ ПОЛУЧЕНИЯ МИКРОКАПСУЛ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ ГРУППЫ ПЕНИЦИЛЛИНОВ В КАППА-КАРАГИНАНЕ | 2013 |
|
RU2546516C2 |
| СПОСОБ ПОЛУЧЕНИЯ МИКРОКАПСУЛ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ ГРУППЫ ЦЕФАЛОСПОРИНОВ В КОНЖАКОВОЙ КАМЕДИ В ХЛОРОФОРМЕ | 2012 |
|
RU2491939C1 |
| СПОСОБ ПОЛУЧЕНИЯ МИКРОКАПСУЛ БИОПАГА-Д В ПЕКТИНЕ | 2013 |
|
RU2563618C2 |
| СПОСОБ ПОЛУЧЕНИЯ МИКРОКАПСУЛ БИОПАГА-Д В ПЕКТИНЕ | 2014 |
|
RU2561586C1 |
| СПОСОБ ПОЛУЧЕНИЯ МИКРОКАПСУЛ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ ГРУППЫ ЦЕФАЛОСПОРИНОВ В КОНЖАКОВОЙ КАМЕДИ В ГЕПТАНЕ | 2012 |
|
RU2542511C2 |
Способ получения диагностического средства, содержащего полые микрокапсулы, включает стадию распыления в нагретой газовой среде раствора или дисперсии материала, способного к образованию стенок микрокапсул, в жидком носителе. Затем жидкий носитель испаряется. Раствор или дисперсию используют в концентрации от 0,1 до 50 мас.%/объем. Подают на стадию распылительной сушки под давлением (1 - 10) • 105Па. Газ нагревают до достижения температуры на входе в камеру распылительной сушки 100 - 250oС, а на выходе - 40 - 150oС. Полученные полые микрокапсулы можно дополнительно обрабатывать для уменьшения их водорастворимости по меньшей мере с внешней стороны капсул путем нагревания или облучения или химической сшивки. В качестве материала, способного к образованию стенок микрокапсул, используют белок, например коллаген или желатин или сывороточный альбумин. Полученные полые микрокапсулы используют для визуализации при ультразвуковой диагностике. 6 с. и 10 з.п.ф-лы, 3 ил., 2 табл.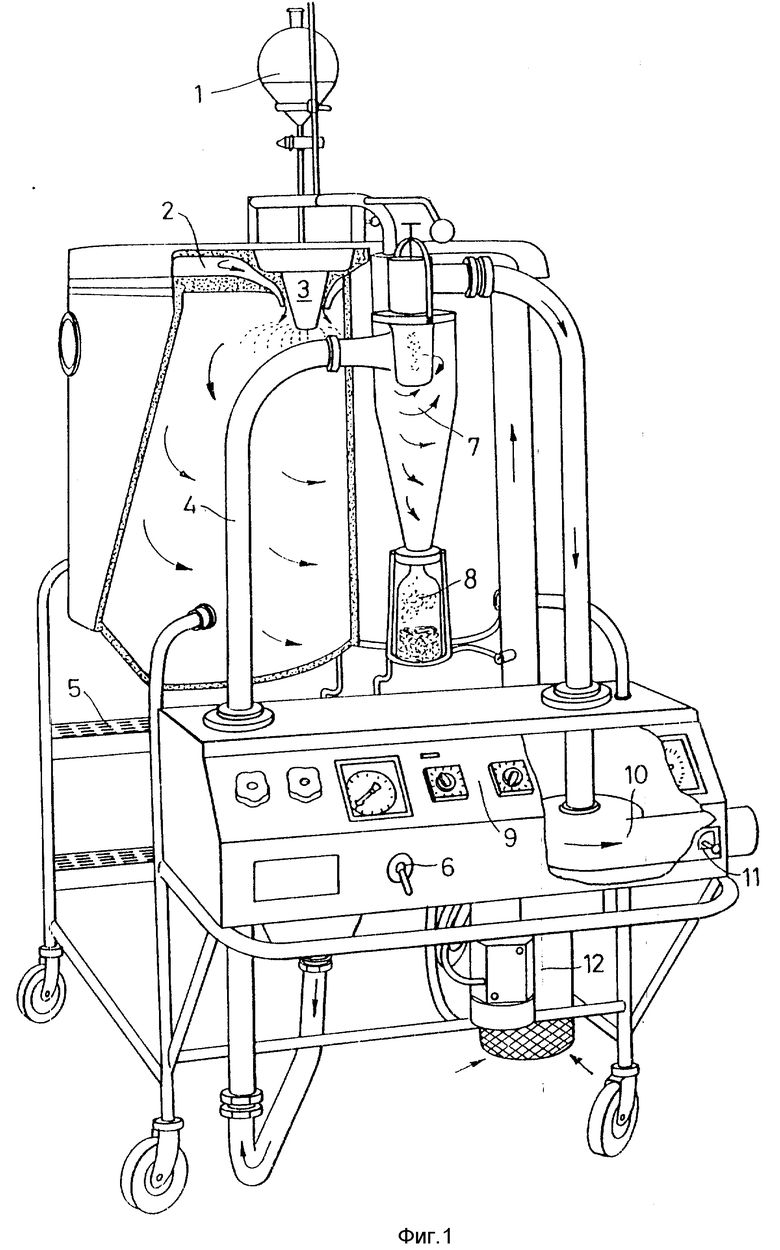
| Eur.J.Nucl | |||
| Med., 1982, 7, c | |||
| Контрольный стрелочный замок | 1920 |
|
SU71A1 |
| ИНЖЕКТОР МНОГОЗАРЯДНЫХ ИОНОВ | 0 |
|
SU324938A1 |
Авторы
Даты
1998-04-27—Публикация
1992-04-10—Подача