Изобретение относится к области экспериментальной биологии, а именно к способам моделирования состояния стресса у лабораторных животных.
Известен способ нагрева кроликов в специальном воздушном термостате при +44oС (ректальная температура +42,5oС) для последующего изучения белкового синтеза в лимфоцитах [1].
Недостатком данного способа является более длительное время нагрева тела животного до требуемой ректальной температуры, а также то, что при нагреве тела животного включаются физиологические механизмы терморегуляции.
Известен также способ нагрева крыс до состояния теплового шока (ректальная температура +41...+42oС) на нагревательной электрической подушке с предварительным введением нембутала для последующего изучения трансляционной термотолерантности [2].
Недостатком является то, что при таком способе требуется значительно больше времени для того, чтобы температура тела животного достигла необходимой величины. Так, ректальная температура поднимается до +41...+42oС через 15 мин. В связи с тем, что при нагреве тела животного включаются физиологические механизмы терморегуляции, появляются такие явления, как потоотделение и одышка у животных. Кроме того, сложнее визуально отслеживать, получило ли животное тепловой удар, следствием которого является состояние теплового шока.
Целью изобретения является создание оптимального и быстрого способа нагрева тела экспериментального животного (сокращение времени) до температуры, приводящей к развитию состояния теплового шока, для изучения его влияния на сопротивление сосудов печени и другие функциональные характеристики при перфузии in situ. Сокращение времени нагрева происходит за счет более равномерного нагрева всего тела животного.
Поставленная цель достигается тем, что животное под воздействием дроперидола помещают в индивидуальной клетке в проточную водяную баню, к которой подключен ультратермостат, обеспечивающий постоянную циркуляцию воды нужной температуры +43...+45oС через емкость с животным. При этом ректальная температура поднимается до необходимой величины +42...+44±0,5oС соответственно в течение 1,5-2 мин. При такой температуре тела животное выдерживают в водяной бане 20-25 мин.
При таком быстром способе увеличения температуры не включаются механизмы терморегуляции, а животное нагревается в воде как физическое тело.
Спустя 1 час после извлечения животного из воды и содержания его при комнатной температуре развиваются типичные клинические симптомы теплового шока (угнетение, отказ от корма и воды, нарушение терморегуляции). При таком способе моделирования состояния теплового шока хорошим визуальным признаком нарушения терморегуляции является шерстный покров, который после извлечения животного из воды продолжительное время не обсыхает.
Пример 1. В эксперименте использовали белых беспородных крыс обоего пола массой 150-200 г. Животным непосредственно перед началом воздействия внутрибрюшинно вводился 0,25% раствор дроперидола (0,1 мл на 100 г массы), после чего они помещались в индивидуальных клетках в проточную водяную баню с температурой воды +43,0. ..+45oС на 20-25 мин. Ректальная температура тела при этом через 1,5-2 мин повышалась до +42,0...+44±0,5oС и удерживалась на таком уровне весь период времени, пока животное находилось в водяной бане. В контрольной группе температура воды составляла +37,0oС (ректальная - +38,0±0,4oС). Все последующие манипуляции осуществлялись спустя 1, 6 и 18 часов восстановительного периода после теплового шока.
В течение 18 часов после извлечения из водяной бани крысы выдерживались на голодной диете со свободным доступом к воде. Наркотизировались тиопенталом натрия, и осуществлялась нерециркуляционная безгемоглобиновая перфузия печени in situ по Хемсу раствором Кребса-Хензелейта на бикарбонатном буфере с добавлением 5 мМ D-глюкозы. Поступающий перфузат насыщался карбогеном (95% O2 и 5% СО2) в оксигенаторе пузырькового типа и подавался через v. portae со скоростью 20±1,5 мл в 1 мин перистальтическим насосом. Температура входящего раствора +37,5±0,2oС; рН 7,320±0,03. Сосудистое сопротивление органа рассчитывалось по отношению артериального давления (мм водного столба) к скорости подачи перфузата (мл/мин), скорость потребления кислорода (мкмоль•мин-1 на орган) - по разнице парциального давления кислорода в перфузате на входе и выходе из органа.
Значимых различий в динамике показателей сосудистого (фиг.1) у самцов не отмечалось, лишь спустя 1 час после развития состояния теплового шока уровень значений был выше, чем в остальных сериях эксперимента. В то же время при перфузии печени самок уровень значений сосудистого сопротивления в контрольной серии значительно ниже, чем в контроле у самцов (р<0,02). Через 1 час после теплового шока показатели сосудистого сопротивления органа имели противоположную тенденцию относительно контрольных значений и более высокий уровень (р<0,02). Наиболее значительные отличия наблюдались при перфузии печени самок спустя 6 часов после теплового шока (р<0,001). Исходный уровень превышал контроль в 1,5 раза. Динамика сосудистого сопротивления спустя 18 часов после теплового шока напоминала таковую на 1-ом часе, но уровень значений был несколько выше (р<0,02).
Таким образом, сосудистое сопротивление органа при перфузии печени самцов после моделирования состояния теплового шока в водяной бане характеризовалось более высоким уровнем относительно этого показателя у самок, но большей стабильностью во всех проведенных сериях эксперимента. Реакция сосудов печени самок на тепловой шок имела выраженные различия по срокам восстановительного периода и тем не менее низкий общий уровень относительно сосудистого сопротивления печени самцов.
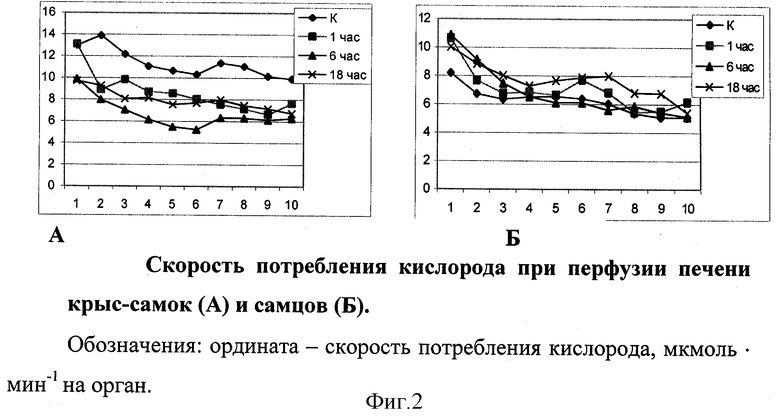
Динамика сопротивления сосудов печени на разные сроки восстановительного периода после теплового шока находилась в обратной зависимости от скорости потребления кислорода органом. Так, уровень значений скорости потребления кислорода печенью самцов в контрольной серии эксперимента был ниже, чем при перфузии печени самок (фиг.2, р<0,02).
К 1-ому часу после гипертермического воздействия этот показатель у самцов в момент начала перфузии превышал контрольные значения, но в динамике перфузии значимых различий между данными сериями эксперимента не наблюдалось. В то же время у самок скорость потребления кислорода на этот срок после воздействия была ниже контрольного значения и имела в ряде случаев противоположные тенденции в динамике перфузии (р<0,02).
Спустя 6 часов восстановительного периода у самцов скорость потребления кислорода практически не отличалась от таковой при перфузии через 1 час после воздействия. В случае перфузии печени самок на этот срок восстановительного периода, данный показатель характеризовался наиболее низкими значениями относительно остальных серий эксперимента (р<0,001).
К 18 часам скорость потребления кислорода перфузируемой печенью самцов была близка по своим значениям к уровню этого показателя при перфузии через 1 час после воздействия. Такой же была динамика скорости потребления кислорода печенью самок, хотя исходный уровень практически совпадал со значениями на 6-ти часах после моделирования теплового шока.
Следовательно, моделирование теплового шока in vivo в водяной бане приводит к изменениям спустя 1, 6 и 18 часов сосудистого сопротивления и скорости потребления кислорода перфузируемой печенью крыс обоего пола.
Преимуществом предлагаемого способа является сокращение времени нагрева тела животного: в прототипе ректальная температура экспериментального животного до +42...+44 +0,5oС поднимается (как показали наши исследования) в течение 15 мин, а в предлагаемом способе - за 1,5-2 мин за счет более равномерного прогрева тела животного.
В прототипе увеличение температуры тела животного сопровождается включением физиoлoгичecкиx механизмов терморегуляции (одышка и т.д.), в прелагаемом - животное нагревается как физическое тело равномерно со всех сторон.
Предлагаемый способ можно также использовать для оценки метаболического и функционального состояния органов, например, желчеотделение печени, образование мочевины в печени, поглощение и выделение глюкозы и других субстратов и метаболитов углеводного обмена печени, почек и других органов.
Полученные результаты по данному способу могут быть использованы для последующего изучения патогенеза состояния шока и разработки способов его коррекции.
Источники информации
1. Х. А. Ульмасов и др. Индукция белкового синтеза в лимфоцитах млекопитающих при гипертермии. Биохимия, 1990, т. 55, вып. 5, с. 801-806.
2. De Maio A., Beck S.C., Buchman T.G. "Induction of translational thermotolerance in liver of thermally stressed rats", Eur. Journ. Biochem., 1993, V. 218 (2): p. 413-420.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВЫРАЩИВАНИЯ ПТИЦЫ | 2000 |
|
RU2191504C2 |
| СПОСОБ КОРРЕКЦИИ ГИПОТРОФИИ ПЛОДА ПРИ МЕТАБОЛИЧЕСКОМ АЦИДОЗЕ МАТЕРИ | 2000 |
|
RU2177792C1 |
| ИНДУКЦИОННЫЙ ЭЛЕКТРОВОДОНАГРЕВАТЕЛЬ | 2001 |
|
RU2191954C2 |
| ИНДУКЦИОННЫЙ ЭЛЕКТРОВОДОНАГРЕВАТЕЛЬ | 2001 |
|
RU2191326C2 |
| УСТРОЙСТВО ДЛЯ МЕЧЕНИЯ ЖИВОТНЫХ | 1993 |
|
RU2062570C1 |
| СПОСОБ ТЕПЛОВОЙ ОБРАБОТКИ ТУШЕК ПТИЦЫ ПЕРЕД СНЯТИЕМ ОПЕРЕНИЯ | 1992 |
|
RU2043723C1 |
| Способ гипотермической оксигенированной перфузии в трансплантации печени и почки | 2021 |
|
RU2773291C1 |
| СПОСОБ ВЫДЕЛЕНИЯ ГЕПАТОЦИТОВ ЖИВОТНЫХ С ПОЙКИЛОТЕРМНОЙ СИСТЕМОЙ ТЕРМОРЕГУЛЯЦИИ (АМФИБИИ, ЧЕРЕПАХИ) | 2008 |
|
RU2391398C2 |
| ЭЛЕКТРОВОДОНАГРЕВАТЕЛЬ | 2000 |
|
RU2187765C2 |
| ЭЛЕКТРОВОДОНАГРЕВАТЕЛЬ | 2000 |
|
RU2190166C2 |
Изобретение относится к экспериментальной биологии. Внутрибрюшинно вводят 0,1 мг 0,25% раствора дроперидола на 100 г массы тела животного. Затем животное помещают в индивидуальной клетке в проточную водяную баню с температурой воды +43-+45oС. Доводят ректальную температуру животного до +42-+44 ±0,5oС за 1,5-2 мин. Выдерживают животное при этой температуре в течение 20-25 мин до теплового шока (удара). Способ позволяет равномерно нагреть тело животного, не включая механизмы терморегуляции. 2 ил.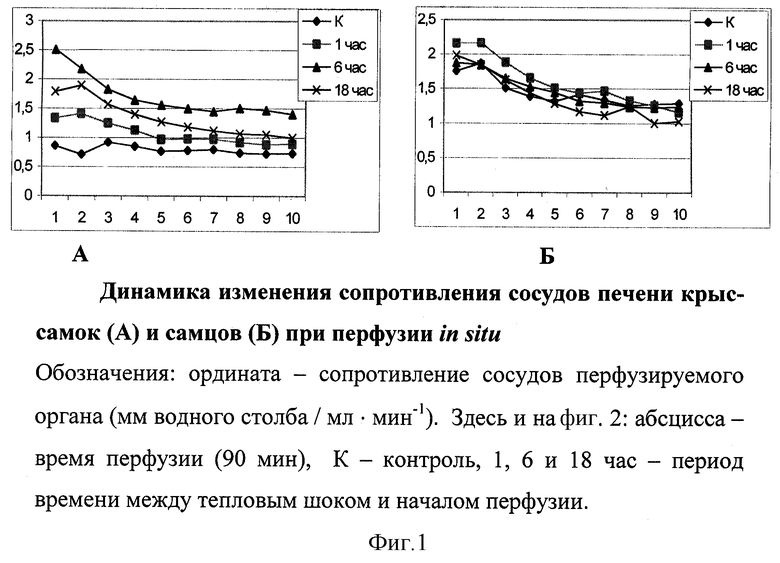
Способ моделирования состояния теплового шока у лабораторных животных in vivo для последующего исследования метаболизма печени, включающий нагрев тела животного с предварительным введением нейролептиков, отличающийся тем, что предварительно внутрибрюшинно вводят 0,1 мг 0,25% раствора дроперидола на 100 г массы тела, а затем животное помещают в индивидуальной клетке в проточную водяную баню с температурой воды +43-+45oС, доводят ректальную температуру животного до +42-+44±0,5oС за 1,5-2 мин и выдерживают при этой температуре в течение 20-25 мин до теплового шока (удара).
| Способ моделирования гипертермии | 1987 |
|
SU1534491A1 |
| De Maio A., Beck S.C., Buchman T.G | |||
| "Induction of translational thermotolerance in liver of thermally stressed rats", Eur | |||
| Joum | |||
| Biochem., 1993 Dec V | |||
| Прибор для измерения силы звука | 1920 |
|
SU218A1 |
| СТАНОК ДЛЯ ИЗГОТОВЛЕНИЯ ГАЛЕЙ | 1923 |
|
SU413A1 |
Авторы
Даты
2002-11-20—Публикация
2001-03-22—Подача