Изобретение относится к способу выделения технеция из азотного раствора технеция посредством электролиза.
Более конкретно, изобретение относится к выделению технеция-99, имеющего химическую формулу ТсО4 -, также называемого Тс(VII), или пертехнетат, из азотнокислого раствора посредством электроосаждения металлического технеция, соответствующего Тс(0), также называемого Тсмет, и ТсО2•Н2О, соответствующего Тс (IV).
Азотные растворы технеция представляют собой, например, растворы, полученные при повторной переработке облученного ядерного топлива, и большей частью при обработке радиоактивных отходов. С помощью способа изобретения можно также снизить бета-активность этих азотнокислых растворов.
За этим способом выделения может следовать процесс стеклования с целью хранения технеция, извлеченного из этих растворов.
Способ изобретения находит применение, например, при выделении технеция-99 из растворов, полученных в результате процесса противоточной жидкостно-жидкостной экстракции "Purex" ("ПУРЕКС") для повторной переработки облученного ядерного топлива. В этом процессе раствор концентрированной азотной кислоты используют в качестве экстрагирующего раствора, и концентрация технеция-99, накапливающегося в этом растворе, может достигать от 150 до 200 мг/л при концентрациях азотной кислоты, которые могут быть вплоть до 3,5-4,5 моль/л. Этот экстрагирующий раствор может также содержать, в виде следов, другие элементы, полученные при сгорании ядерного топлива, такие, как 106Ru, 134Cs, 137Cs, 144Се, 154Eui, 125Sb.
Пример результатов анализа различных химических продуктов, присутствующих в экстрагирующем растворе процесса "ПУРЕКС":
HNO3, моль/л - 3,5-4,5
Технеций (VII), мг/л - 150-200
Рутений-106, мкКи/л - 50
Сурьма-125, мкКи/л - 2,5
Цезий-134*, мкКи/л - 40
Цезий-137, мкКи/л - 50
Церий-144, мкКи/л - 40
Европий-154, мкКи/л - 5
Технеций, содержащийся в этих растворах, не может быть собран посредством процесса испарения водной фазы, поскольку такой процесс приводит к потере большей части технеция в форме летучего HTcO4.
Технеций-99 в растворе, благодаря своей ионной структуре, имеет свойства электролита, т. е. под действием электрического поля в электролизере (электролитической ячейке) он будет перемещаться по направлению к катоду, на котором он восстанавливается. Приведенные ниже уравнения химических реакций (1) и (2) иллюстрируют электролиз водного раствора технеция-99 или ТсO4.
TсO4 -+8H++4е--->Тc3++4Н2O;
Тс3++3е--->Тсмет; (1)
ТСO4 -+8H++3е--->Тс4++4Н2O;
Тc4++4OН- катодный-->Тс2•2Н2О. (2)
Из этих уравнений (1) и (2) видно, что теоретически на катоде образуется осадок смеси или смешанный осадок из металлического Тс, представленного в уравнении (1) в виде Тсмет и ТсО2•2Н2О в соответствии с уравнением (2).
Два типа выходов можно рассчитать, чтобы оценить этот процесс электролиза: - химический выход электролиза, определяемый как отношение количества (в мг) технеция Тсмет и/или ТсО2•2Н2О, осажденных на катоде, к количеству (в мг) технеция-99, присутствующего в растворе до электролиза; - фарадеевский выход электролиза по току, определяемый как отношение количества кулонов, прошедших через электролизер, к количеству Тс, осажденного на поверхности катода.
Из приведенных выше двух уравнений реакций (1) и (2) видно, что количества Тсмет и ТсО2•2Н2О, осажденных на катоде, и, следовательно, химический выход электролиза зависят, во-первых, от концентрации технеция в начале электролиза и, во-вторых, от рН водного раствора технеция. Когда концентрация технеция возрастает, химический и фарадеевский выходы металлического Тс увеличиваются, и когда рН возрастает, химический и фарадеевский выходы Тс уменьшаются.
Концентрация технеция и рН раствора электролита также оказывают влияние на устойчивость химических форм технеция с пониженными (II) и (IV) валентностями по отношению к реакции гидролиза. Какое-либо изменение концентрации Тс в растворе не изменяет химический и фарадеевский выходы электроосаждения. С другой стороны, когда рН раствора увеличивается, концентрации гидролизованных химических форм Тс (III, IV), включая ТсО(ОН) и ТсО(ОН)2, возрастают, что приводит к снижению химического выхода процесса.
Кроме того, в отношении рН было показано, что, когда концентрация ионов Н+ в растворе для электролиза выше 0,1 М, т.е., когда рН этого раствора составляет менее 1, электроосаждение TcO2•2H2O существенно снижается из-за его сильной растворимости в кислотной среде.
Кроме того, электроосаждение металлического Тс в водном растворе на катоде модифицирует электрохимические свойства последнего, в частности, оно может вызвать снижение перенапряжения водорода, т.е. повышение скорости электрохимического разложения молекул воды, приводящее к возрастанию рН раствора.
Перенапряжение водорода определяется как разность между термодинамическим значением потенциала гальванической пары Н+/H2 (Е=0) и значением потенциала, сверх которого в реальной системе происходит эффективное образование водорода. Значение перенапряжения водорода характеризует скорость электрохимического разложения воды во время электролиза водных растворов.
Снижение перенапряжения водорода, т. е. ускорение электрохимического разложения воды, можно наблюдать во время электролиза, сопровождающегося образованием осадка металла на катоде.
Такая электрохимическая модификация может вызвать быструю гидролизную реакцию электроосажденных соединений.
Уровень техники
US-A-3374157 раскрывает способ электроосаждения металлического технеция на металлическую подложку с целью получения источника технеция-99.
Электроосаждение металлического технеция проводят, используя 150 мл раствора серной кислоты, содержащего технеций-99 в форме пертехнетата аммония и комплексообразующий агент, стабилизирующий ионы пертехнетата. Описанными комплексообразующими агентами являются щавелевая кислота, лимонная кислота, винная кислота, глутаровая кислота, малоновая кислота, янтарная кислота и их аммониевые соли. Эти комплексообразующие агенты предназначены для повышения химического выхода образования металлического Тс. Рн этого раствор находится между 1 и 2, и металлический технеций электроосаждается на металлическую подложку, такую как медь, никель, алюминий, серебро, золото, нержавеющая сталь и платина.
Один из недостатков этого способа заключается в том, что комплексообразующий агент, стабилизирующий ионы пертехнетата, замедляет скорость гидролиза ионов Тс (III) и Тс (IV) и в то же самое время сдвигает потенциал электроосаждения технеция в направлении отрицательных значений, снижая таким образом фарадеевский выход технеция по току и повышая TcO2•2Н2О при осаждении на металлическую подложку.
Кроме того, в указанной ссылке описано количественное электроосаждение металлического Тс на металлическую подложку, но не описано выделение технеция-99 из азотнокислого раствора.
В азотнокислом растворе присутствие ионов нитратов усложняет механизм электрохимического восстановления технеция-99.
Приведенные ниже уравнения реакций (3), (4), (5) и (6) иллюстрируют различные возможные электрохимические реакции во время электролиза раствора электролита, содержащего технеций-99, в присутствии ионов нитратов:
NО3 -+3H++2е--->HNO2+Н2O; (3)
Tc(III)+ NO2 -+2H+-->Tc(IV)+NO+H2O; (4)
Тc(IV)+NO2 -+2Н+-->Tc(V)+NО+Н2О; (5)
Tc(III)+NO3 -+2Н+-->Tc(VII)+NО2 -+Н2О; (6)
Уравнение реакции (3) иллюстрирует катодное восстановление ионов нитрата в азотистой кислоте HNO2 во время электролиза.
Уравнения реакций (4) и (5) иллюстрируют окисление ионов Тc(II) и Тc(IV) азотистой кислотой с образованием ионов Тc(IV) и Тc(V) соответственно.
Уравнение реакции(6) иллюстрирует медленную реакцию между ионами Тc (III) и ионами NO3 -, ведущую к дополнительному образованию азотистой кислоты в растворе для электролиза.
Увеличение концентрации азотистой кислоты во время электролиза способствует протеканию реакций (4) - (6) и повышает растворимость ТсО2•2Н2О, т.е. Тc(IV), и образование водорода.
Кроме того, химические реакции, представленные уравнениями реакций 3-6, показывают снижение рН раствора для электролиза. Это падение рН приводит к гидролизу ионов Тc(III) и Тc(IV) и к образованию электрохимических неактивных соединений, таких, как ТсО(ОН)2, (ТсО(ОН)2)2 или ТсО(ОН), что вызывает падение выхода технеция при электроосаждении.
В источнике (Brodda B.O., Lammertz H., Merz E., Radiochemica Acta, 1984, v. 37, стр. 213-216) описан тест по электролитическому восстановлению технеция-99 в 0,1 М азотной среде. Использовавшийся для электролиза раствор содержит Тc(VII) в количестве 7•10-3 М. Электролизер содержит платиновый анод и циркониевый катод. Плотность тока составляла 40 А/м2. Черный аморфный осадок, идентифицированный как ТсО2•Н2О, образовывался на катоде. Этот источник использован в преамбуле пункта 1 формулы настоящего изобретения.
Целью настоящего изобретения является обеспечение способа выделения технеция-99 из азотнокислого раствора технеция, состоящего из подвергаемого электролизу азотнокислого раствора для электроосаждения технеция на катоде, при чем указанный способ также содержит следующие стадии:
удаление нитратов из азотнокислого раствора технеция с получением раствора а) технеция, содержащего небольшое количество нитратов или не содержащего нитратов,
регулировка рН раствора технеция а) до рН приблизительно 5,5 - 7,5 с получением раствора b) технеция и
выделение технеция из раствора b) путем катодного электроосаждения указанного технеция путем электролиза.
Азотнокислый раствор технеция-99 может иметь, например, концентрацию нитратов приблизительно 3,5-4,5 моль/л и концентрацию технеция 150-200 мг/л. Этот раствор можно получить, например, при переработке облученного ядерного топлива, используя процесс "ПУРЕКС".
Удаление нитратов из азотнокислого раствора технеция, далее называемое денитрованием, можно проводить с муравьиной кислотой или с формальдегидом в присутствии катализатора.
Указанное удаление можно осуществить, используя формальдегид, щавелевую кислоту, метанол, сахар и т.д., и в общем случае с органическими соединениями, содержащими одну или более из групп, выбранных из группы, содержащей -ОН, -СОН и/или -СООН, возможно, в присутствии катализатора.
Используемый катализатор может быть катализатором, содержащим платину, например катализатор 1% Pt/SiO2.
Во время денитрования технеций сохраняется с валентностью (VII), скорость реакции технеция на присутствие муравьиной кислоты очень низкая, и ионы технеция с пониженной валентностью, которые появляются в растворе, повторно окисляются азотистой кислотой, которая представляет собой промежуточный продукт денитрования.
Один пример денитрования раствора муравьиной кислотой описан в источнике А. V. Ananiev, NRC4, 4th International Conference on Nuclear and Radiochemistry, vol. II, St. Malо Франция, сентябрь 1996 г. Согласно этому источнику денитрование проводят в управляемом термостатом стеклянном реакторе с флегмой. Одну часть катализатора 1% Pt/SiO2 (мас.%) вводят в этот реактор с азотнокислым раствором, подлежащим денитрованию, при этом концентрация этого азотного раствора известна. Затем в реактор добавляют концентрированную муравьиную кислоту в стехиометрическом количестве или выше к количеству нитратов, присутствующих в растворе, которые необходимо денитровать. Смесь азотнокислого раствора, катализатора и муравьиной кислоты подвергают перемешиванию путем барботирования азотом и доводят до приблизительно 60-80oС в течение примерно 90 мин. Получают раствор, в котором нитраты не могут быть обнаружены с помощью потенциометрии, т.е. их концентрация составляет менее 10-4 моль/л.
В соответствии со способом изобретения муравьиную кислоту добавляют, предпочтительно, в избыточном количестве по отношению к ионам нитрата азотнокислого раствора технеция. После удаления нитратов из этого раствора до регулирования значения рН производят корректировку избыточной муравьиной кислоты, состоящую из удаления этого избытка, например, испарением муравьиной кислоты.
Таким путем получают раствор технеция, называемый раствором а), который, по существу, свободен от нитратов.
Денитрование азотнокислого раствора технеция-99 обеспечивает низкую постоянную концентрацию азотистой кислоты во время электролиза.
Упомянутый ранее раствор а) затем подвергают регулировке его значения рН до рН приблизительно 5,5-7,5, предпочтительно до рН от приблизительно 6 до 7,4, с получением раствора b) технеция. Эту регулировку проводят с использованием реагента, выбранного с учетом ограничений, связанных с процессом нисходящего потока при выделении технеция для его хранения.
Например, применение гидроокисей щелочных металлов для регулировки рН оказывается невозможным, если после процесса выделения технеция следует процесс стеклования, поскольку их присутствие в отходах нарушает стеклование.
В соответствии со способом изобретения эту регулировку предпочтительно проводить, используя основание (СН3)4NОН. Это основание (СН3)4NОН (тетраметиламмоний) выбрано, поскольку соединения технеция-99, связанные с катионами тетраалкиламмония с более длинными (-СН2-) цепями, имеют недостаточную растворимость в водных растворах.
Предпочтительно, реагент для регулировки рН используют в твердой форме, чтобы исключить увеличение объема раствора.
Регулировка рН раствора технеция, в соответствии со способом изобретения, представляется важной, поскольку подтверждено, что выход технеция при электроосаждении весьма чувствителен к этому параметру, и наилучшие выходы достигаются в растворах с рН приблизительно 5,5-7,5. Кроме того, небольшое электроосаждение технеция наблюдалось или оно отсутствовало во время электролиза формиатного раствора с рН менее чем 2.
Кроме того, регулировка рН раствора приводит к уменьшению растворимости ТсО2•2Н2О, электроосажденного во время электролиза и, следовательно, к повышению выхода технеция при электроосаждении.
С помощью способа изобретения можно показать, что ионы формиата, из денитрования азотнокислого раствора технеция стабилизируют комплексы Тс(III) и Тс(IV) и что ионы тетраметиламмония, используемые для регулировки рН денитрованного раствора повышают растворимость этих комплексов в водном растворе.
Денитрование и регулировка рН, в соответствии со способом изобретения, могут приводить к образованию раствора тетраметиламмониевого формиата, содержащего подлежащий выделению технеций. В этом случае концентрация тетраметиламмониевого формиата, гарантирующая избыток комплексообразующих ионов по отношению к технецию для исключения гидролиза Тс(III) и Tc(IV), составляет, предпочтительно, 1 М.
Следующей стадией является стадия выделения технеция из раствора b) посредством катодного электроосаждения указанного технеция путем электролиза указанного раствора b) в электролизере.
В соответствии со способом изобретения электролизер содержит, по меньшей мере, одно анодное отделение и, по меньшей мере, одно катодное отделение.
В соответствии со способом изобретения раствор b) технеция помещают в катодное отделение электролизера, а в анодное отделение этого электролизера добавляют раствор, который является совместимым для электролиза.
Совместимым раствором для электролиза может быть, например, раствор НСlO4, H2SO4 или раствор азотной кислоты, предпочтительно раствор азотной кислоты. Азотная кислота выбрана с целью упрощения процесса переработки отходов, получающихся в результате осуществления способа настоящего изобретения.
Анодное и катодное отделения предпочтительно разделены мембраной, пропитанной катионитом, с целью исключения потока ионов технеция с валентностями (III) и (IV) из катодного отделения (катодных отделений) в направлении анодного отделения (анодных отделений) и ионов НСОО- из анодного отделения (анодных отделений) по направлению к катодному отделению (катодным отделениям), с последующим их повторным окислением в Tc(VII) и ТсО2 соответственно. В самом деле, такое повторное окисление приводит к заметному снижению химического выхода электроосаждения технеция.
Мембрана, пропитанная катионитом, может быть любой мембраной любого типа, имеющей катионообменные свойства, предпочтительно, используемой мембраной является мембрана "Nafion 417" (зарегистрированное торговое название). Эта мембрана была выбрана на основе анализа электрических и механических характеристик различных мембран, описанных в источнике Aldrichimica Acta, 1986, vol. 19, стр. 76.
Катионообменная мембрана также обеспечивает создаваемый постоянный поток ионов Н+ из анодного отделения (анодных отделений) по направлению к катодному отделению (катодным отделениям), вследствие чего сохраняется постоянная кислотность раствора в катодном отделении.
Кроме того, вследствие разделения анодного и катодного отделений с помощью катионообменной мембраны совместимый раствор, содержащийся в анодном отделении (анодных отделениях), можно использовать без замены для 10-15 последовательных тестов электроосаждения.
Анодное и катодное отделения электролизера содержат, по меньшей мере, один анод и, по меньшей мере, один катод соответственно.
Анод может быть изготовлен из платины или графита. Предпочтительно, анод является платиновым. Если анод выполнен из графита, при продолжительности электролиза свыше 1 ч падение потенциала на границе раздела между графитом и совместимым раствором 1 М HNО3 не должно превышать 600 мВ. Если, же это падение потенциала превышает 600 мВ, может наблюдаться механическая деструкция анода из-за образования мелкого графитового порошка, загрязняющего анодное отделение.
В случае выполнения катода из графита, графит имеет две важные электрохимические характеристики:
- Первая характеристика заключается в том, что перенапряжение водорода на графитовом электроде является высоким, т.е. находится в области - 560 мВ/СВЭ (СВЭ - стандартный водородный электрод), что позволяет получить высокие фарадеевские выходы Тc по току.
- Вторая характеристика заключается в большой удельной площади поверхности графита. Электроосаждение Тcмет и/или ТсО2•2Н2О на катоде модифицирует площадь поверхности последнего, создавая проблему снижения перенапряжения водорода. С использованием графита можно решить эту проблему и сохранить постоянное перенапряжение водорода.
Следовательно, выбор графитового катода, имеющего большую удельную площадь поверхности, позволяет поддерживать высокие фарадеевские выходы электроосаждения по току в течение продолжительных промежутков времени и, следовательно, исключить гидролиз Тc до более низких значений валентности в предкатодном слое. Предкатодный слой представляет собой слой, в котором протекают электрохимические реакции, т.е. перенос электронов из катода к соединениям, которые восстанавливаются в водной фазе.
В соответствии со способом изобретения отношение площади поверхности S катода к объему V раствора для электролиза в катодном отделении может составлять менее 0,3 см-1, предпочтительно 0,2-0,5 см-1, более предпочтительно 0,25-0,49 см-1. Когда это отношение S/V уменьшается, фарадеевский химический выход и скорость электроосаждения также снижаются.
Это отношение S/V может быть более 0,5 см-1, и увеличение этого отношения может увеличивать эффективность электроосаждения технеция.
В соответствии со способом изобретения электролизер может также содержать стандартный электрод для измерения потенциала анода и/или катода. Этот стандартный электрод является, предпочтительно, водородным электродом, также называемым стандартным водородным электродом (СВЭ). С помощью этого электрода, помещенного, например, в катодное отделение, можно измерять потенциал катода во время электролиза.
Электролиз раствора b) проводят путем пропускания постоянного тока между анодoм, и катодом. Прохождение непрерывного тока приводит к электроосаждению технеция в форме Тсмет и/или ТсО2•2Н20 в соответствии с уравнениями химических реакций (1) и (2), представленными ранее.
Согласно способу изобретения катодный потенциал поддерживается постоянным в течение электролиза, предпочтительно, между 0,56 В и 1,36, В по отношению к СВЭ. Постоянный катодный потенциал во время электролиза дает возможность проводить процесс электроосаждения при гальваностатической скорости. Использование катодного потенциала от -0,56 до -1,36 В/СВЭ повышает химический выход электроосаждения технеция и ускоряет электроосаждение технеция. Снижение катодного потенциала до значений, меньших чем приблизительно -1,36 В/СВЭ, не приводит к повышению выхода электроосаждения технеция.
В соответствии с изобретением диапазон катодного потенциала от -1,16 до -1,36 В/СВЭ, соответствующий плотностям тока 30-50 А/см2, соответственно обеспечивает химический выход технеция при электроосаждении выше 95%.
С помощью способа изобретения можно получить химический выход электроосаждения технеция выше 95%, при продолжительности электролиза 2 ч, используя азотнокислый: раствор, содержащий НNО3 в количестве 4,2 моль/л и технеций в количестве 220 мг/л.
Технеций электроосаждается на катоде в форме Тсмет и/или TcO2•2Н2О и может быть собран, например, путем погружения катода в кипящий раствор перекиси водорода.
В описании настоящего изобретения более низкие валентности Тс представляют степени окисления +III и +IV. Эти валентности являются малоустойчивыми в водных растворах. Их химическое состояние в растворе исследовано недостаточно. Предполагается, что в нейтральной среде, т.е. при рН между 5,0 и 8,0, следующие соединения Тс (IV) могут сосуществовать: ТсО(ОН)+, ТсО(ОН)2 и полимеризованная гидроокись (ТсО(ОН)2)2. Концентрация различных химических форм определяется суммарной концентрацией Тс и значением рН. Добавление к этой системе комплексообразующих ионов, например формиатных ионов, приводит к более сложным механизмам реакции гидролиза. Точные данные по составу ионов Tc(IV, III) в водном растворе в присутствии формиатных ионов в технической и научной литературе не обнаружены.
Другие особенности и преимущества изобретения можно более ясно увидеть при рассмотрении следующих примеров, которые приведены с иллюстративной целью и не являются ограничивающими, со ссылками на приложенные чертежи, на которых:
фиг. 1 представляет схему электролизера для электроосаждения технеция в соответствии со способом изобретения; и
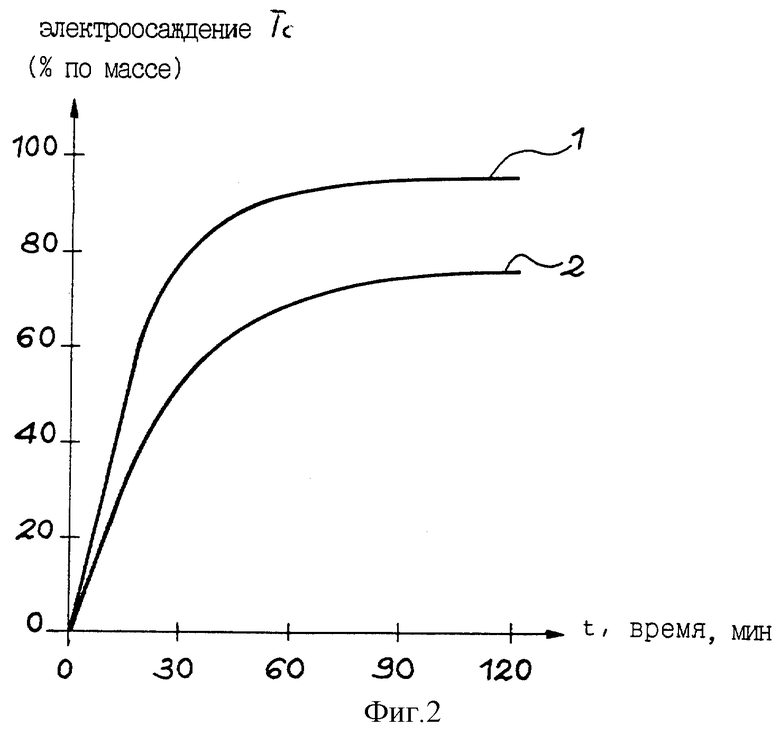
фиг. 2 представляет график кинетики электроосаждения технеция относительно катодного потенциала, выраженной в массовых процентах технеция, электроосажденного на катоде, в зависимости от времени электролиза (в мин) для двух различных отношений S/V, где S - площадь поверхности катода электролизepa (см2), и V - объем раствора электролита в катодном отделении (см3).
Пример 1: выделение технеция из азотнокислого раствора технеция, полученного из процесса экстракции "ПУРЕКС".
В этом примере используют азотный раствор технеция, содержащий 4,2 моль/л НNO3 и 220 мг/л технеция-99 или Тc (VII).
a) стадия денитрования:
10 мл этого азотнокислого раствора обрабатывают чистой муравьиной кислотой НСООН при соотношении концентраций [НСООН]/[НNО3]=1,5 в присутствии платинового катализатора 1% Pt/SiO2.
Катализатор 1% Pt/SiO2 получают путем вымачивания силикагеля в растворе H2PtCl6, с последующим восстановлением платины гидразином.
Денитрование осуществляют в управляемом термостатом стеклянном реакторе с флегмой. Катализатор 1% Pt/SiO2 вводят в реактор с азотнокислым раствором до достижения объемного отношения твердое вещество (катализатор)/жидкость (азотный раствор) 0,125.
Затем в реактор добавляют концентрированную муравьиную кислоту для получения раствора а), содержимое реактора перемешивают путем пропускания пузырьков газообразного азота при температуре 70oС в течение приблизительно 90 мин.
Потенциометрический анализ раствора а) показал, что он не содержит следов НNО3. Кроме того, в продолжение этого денитрования концентрация Тс(VII) не изменялась.
b) регулировка рН раствора а).
Регулировку рН раствора а) осуществляют добавлением к этому раствору 18,8 г гидроокиси тетраметиламмония в твердом виде с получением смеси.
Эту смесь перемешивают до полного растворения гидроокиси тетраметиламмония, и рН можно отрегулировать более точно до значения 7,32 путем добавления нескольких капель молярного раствора гидроокиси тетраметиламмония, чтобы получить раствор b).
с) выделение технеция.
Выделение технеция из этого раствора b) осуществляют путем катодного электроосаждения указанного технеция электролизом раствора b) в электролизере.
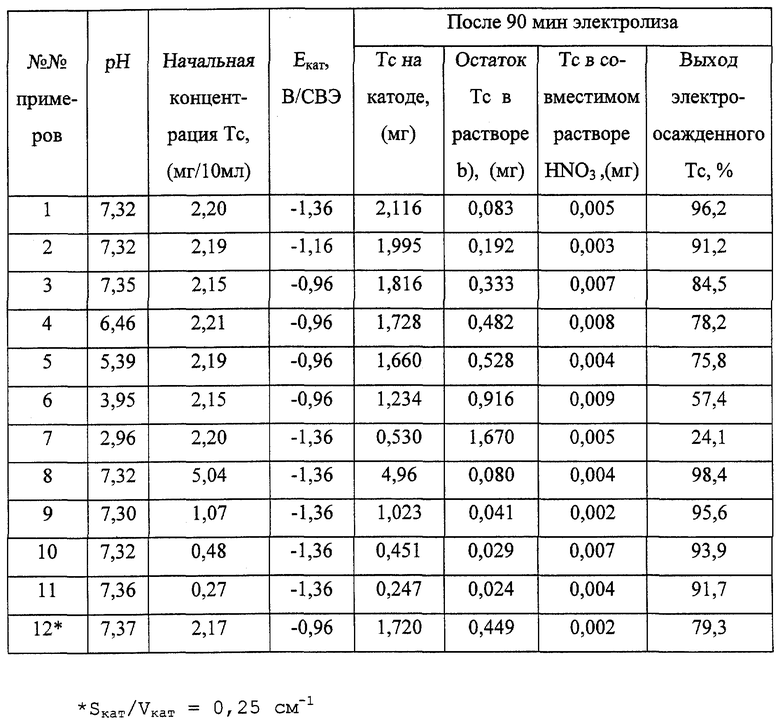
Схема электролизера, использованного в этом примере, приведена на фиг.1. Указанный электролизер 1 содержит катодное отделение 3 и два анодных отделения 5.
В катодном отделении размещены графитовый катод 9, стандартный электрод 13 в насыщенной каломели и магнитная мешалка 19 для раствора b). На этой фиг.1 раствор b) обозначен цифрой 6.
Каждое из анодных отделений содержит анод 11 из платины.
Катодное отделение 3 отделено от анодных отделений 5 посредством катионообменных мембран 7 типа "Nafion 417" (зарегистрированное торговое название).
Катодное отделение 3 и анодные отделения 5 закрыты крышками 15, имеющими отверстия 16 для впуска газа и отверстия 17 для выпуска газа, для удаления кислорода, растворенного в электролите, и для дополнительного перемешивания во время электролиза, и с проходами для анодов 11, катода 9 и стандартного электрода 13 в насыщенной каломели.
Полученный ранее раствор b) вводят в катодное отделение 3. Отношение S/V составляет 0,5 см-1, при этом S - площадь поверхности катода, и V - объем раствора b).
Анодные отделения 5 заполняют раствором электролита 4, совместимым для электролиза с раствором b). Раствор 4 представляет собой 1 моль/л раствор азотной кислоты HNO3.
Электролиз проводят путем пропускания постоянного тока между анодами и катодом, чтобы во время электролиза сохранить постоянный катодный потенциал - 1,36 В/СВЭ, соответствующий плотности тока 40 А/м2.
Выход электроосажденного технеция рассчитывают путем измерения уменьшения бета-активности раствора b) в катодном отделении, используя сцинтилляционный анализ жидкости.
В этом примере для значения рН раствора b) в катодном отделении 7,32, начальной концентрации технеция-99 до электролиза, составлявшей 2,2 мг/10 мл, при катодном потенциале Екат=-1,36 В/СВЭ и отношении S/V=0,5 см-1 количество технеция в форме Тсмет и ТсО2•2Н20, электроосажденного на катоде после 90 мин, составляет 2,116 мг, что соответствует выходу 96,2%.
Количество технеция, оставшегося в растворе b) после электролиза, составляет 0,083 мг, при этом во время электролиза технеций в количестве 0,005 мг перешел в анодное отделение.
Результаты этого примера сведены в таблицу.
Примеры 2-11
В этих примерах исследовали влияние изменений концентрации технеция Tc(VII) в растворе b) в начальной стадии электролиза на выход технеция, электроосажденного на катоде, влияние изменений рН раствора b) в начальной стадии электролиза на выход технеция, электроосажденного на катоде; и влияние изменений катодного потенциала относительно стандартного водородного электрода, Екат/СВЭ, на выход технеция, электроосажденного на катоде.
Эти примеры выполняют таким же образом, как и пример 1, изменяя, по меньшей мере, одни из вышеупомянутых параметров: концентрацию Тс(VII) в растворе b) от 0,25 до 2,5 мг/10 мл, значение рН от 5,5 до 7,5 и катодный потенциал Екат/СВЭ от -0,96 до -1,36 В/СВЭ.
Результаты примеров 2-11 сведены в таблицу.
Из этих примеров видно, что выходы технеция при электроосаждении выше чем 95%, можно получить после электролиза денитрованных растворов технеция с концентрациями технеция (VII) от 250 мг/л (т.е. 2,50 мг/10 мл в электролизере), при регулировании рН приблизительно от 5,5 до 7,5 и постоянном катодном потенциале Екат в пределах от -1,36 до -1,16 В/СВЭ.
Кроме того, накопление Тс в анодном отделении в этих примерах не превышало 65 мг/л.
Дополнительные измерения к описанным в этих примерах выхода электроосаждения технеция относительно рН электролита (раствора b) показали, что в кислотных растворах с рН менее чем 1,5-3,5 выход не превышает 14-18% соответственно при времени электролиза 2 ч.
Максимальные значения выходов измерены при значениях рН между 5,5 и 7,5, и более точно - между 6,0 и 7,4.
При рН, превышающих 8, во время электролиза в растворе для электролиза в катодном отделении появляется черный осадок, снижающий выход электроосажденного технеция.
Когда концентрация технеция в растворе b) до электролиза выше чем 5 мг/10 мл, во время электролиза в растворе для электролиза в катодном отделении также появляется черный осадок.
Пример 12.
Этот пример иллюстрирует влияние изменений отношения площади поверхности катода S к объему V раствора b) в катодном отделении на химический выход технеция, электроосажденного на катоде. Раствор b) для электролиза содержит 2,17 мг технеция (VII) для объема 10 мл, рН регулировали до значения 7,37, к катоду прикладывался потенциал -0,96 В/СВЭ. Отношение S/V=0,25 см-1.
Результаты этого примера 12 приведены в таблице вместе с результатами примеров 1-11, описанными выше.
Из примера 12 хорошо видна важность отношения S/V для выхода технеция, электроосажденного на катоде. Когда S/V снижается, выход электроосаждения также снижается.
Пример 13.
Этот пример относится к исследованию кинетики электроосаждения технеция на катоде в зависимости от катодного потенциала Екат, измеренного по отношению к стандартному водородному электроду (в В). Катодный потенциал изменялся от -0,56 В/СВЭ до -1,36 В/СВЭ.
Кинетика электроосаждения технеция исследовалась для отношения S/V=0,25 см-1 и для отношения S/V=0,50 см-1.
Раствор b), использовавшийся в этом примере, содержал 2 мг технеция на 10 мл раствора b), и его рН было доведено до 7,37.
На фиг.2 показаны результаты этого примера, т.е. кривая (1) кинетики для отношения S/V= 0,50 см-1 и кривая (2) кинетики для отношения S/V=0,25 см-1. На этих кривых представлено количество (в массовых процентах) электроосажденного технеция в зависимости от времени (в минутах).
Из кривых (1) и (2) кинетики видно, что изменение катодного потенциала в пределах от -0,56 В/СВЭ до -1,36 В/СВЭ повышает и ускоряет выход процесса. Максимальный выход электроосаждения достигается при катодном потенциале -1,36 В/СВЭ для продолжительности электролиза 90 мин. Этот выход равен (96,2±3,1)%.
Уменьшение катодного потенциала до значений ниже -1,36 В/СВЭ не приводит к повышению выхода электроосаждения, а вызывает отделение электроосажденного Тс от катода. В самом деле, когда катодный потенциал уменьшается до значений, ниже -1,36 В/СВЭ, на поверхности этого катода выделяется газообразный водород и рассеивает электроосажденный Тс в раствор катодного отделения в форме мелких черных частиц, в результате чего снижается химический выход электролиза.
Из кривых (1) и (2) кинетики хорошо видно, что после 90 мин электролиза при катодном потенциале Екат= -1,36 В/СВЭ получают выход электроосаждения технеция выше 90%, если отношение S/V=0,5 см-1, тогда как для отношения S/V= 0,25 см-1 при тех же самых условиях этот выход сохраняется равным приблизительно 80%.
Пример 14.
Катодное электроосаждение технеция из азотнокислого раствора технеция с использованием способа из уровня техники, описанного в патенте US-A-3374157.
Использовавшийся в этом примере раствор представляет собой раствор, содержащий 10-6-10-5 моль/л Тс (VII), 1 моль (NН4)2SO4 и 0,1 моль/л щавелевой кислоты. Этот раствор приводит к выделению технеция на катоде, от 85 до 90% после 8 ч электролиза при катодном потенциале -1,36 В/СВЭ.
Изобретение относится к способу выделения технеция из азотнокислого раствора технеция с помощью катодного электроосаждения технеция электролизом. В соответствии со способом изобретения азотнокислый раствор технеция подвергают денитрованию, а его рН регулируют перед электролизом до значения приблизительно 5,5-7,5. Электролиз проводят при катодном потенциале приблизительно от - 1,36 до - 1,16 В/СВЭ. Отношение площади поверхности катода S к объему раствора технеция для электролиза может находиться в пределах 0,25 - 0,50 см-1. Денитрование ведут с использованием соединения, выбранного из группы, содержащей муравьиную кислоту, формальдегид, щавелевую кислоту, метанол, этанол, сахар, органические соединения, включающие одну или более групп, выбранных из группы, содержащей -OH, -СОН и -СООН, в присутствии катализатора с получением раствора технеция, содержащего мало или не содержащего нитратов. Способ позволяет повысить выход по току технеция из азотнокислых растворов. 12 з.п. ф-лы, 2 ил., 1 табл.
| BRODDA B.O | |||
| Radiochemica Acta | |||
| Колосниковая решетка с чередующимися неподвижными и движущимися возвратно-поступательно колосниками | 1917 |
|
SU1984A1 |
| Способ извлечения технеция-99 из азотнокислых растворов | 1974 |
|
SU483449A1 |
| Способ крашения тканей | 1922 |
|
SU62A1 |
| US 3922231 А, 25.11.1975. | |||
Авторы
Даты
2002-12-20—Публикация
1998-07-03—Подача