Настоящее изобретение относится к способу получения недифференцированной клетки.
В частности, настоящее изобретение относится к способу получения недифференцированной клетки из более коммитированной клетки.
Кроме того, настоящее изобретение относится к использованию недифференцированной клетки согласно изобретению для получения новой, более коммитированной клетки, т.е. рекоммитированной клетки.
Настоящее изобретение также относится к использованию недифференцированной клетки согласно изобретению или рекоммитированной клетки согласно изобретению, которая бы оказывала влияние (прямо или косвенно, посредством использования полученных из нее продуктов) на иммунную систему, такое как облегчение симптомов, связанных с иммунологическим состоянием или заболеванием, или частичное или полное излечение от иммунологического состояния или заболевания.
В качестве введения, дифференцировка представляет собой процесс, в результате которого структуры и функции клеток прогрессивно коммутируются в более специализированные клетки; к таким процессам относится образование Т-клеток или В-клеток. Следовательно, по мере того как клетки становятся более коммитированными, они становятся более специализированными.
Напротив, ретродифференцировка представляет собой процесс, в результате которого структуры и функции клеток прогрессивно меняются в сторону менее специализированных клеток.
Недифференцированные клетки способны дифференцироваться в многих направлениях, т.е. они способны дифференцироваться в два или более типов специализированных клеток. Типичным примером недифференцированной клетки является стволовая клетка.
Напротив, дифференцированные клетки неспособны дифференцироваться в многих направлениях. Типичным примером дифференцированной клетки является Т-клетка.
Существует много недифференцированных клеток и дифференцированных клеток, обнаруженных in vivo, и общая наука богата общими представлениями о них.
В качестве примера, можно сделать ссылку, наряду с другими, на Levitt and Mertelsman, 1995 (Haematopoietic Stem Cells, published Marcel Dekker Inc. , страницы 45-59) и Roitt et al. (Immunology, 4th Edition, Eds. Roitt, Brostoff and Male, 1996, Publ. Mosby, глава 10).
Вкратце, однако, примеры недифференцированных клеток включают в себя лимфогематопоэтические клетки-предшественники (LPC). LPC включают в себя плюрипотентные стволовые клетки (PSC), лимфоидные стволовые клетки (LSC) и миелоидные стволовые клетки (MSC). LSC и MSC образуются в результате дифференцировки PSC. Следовательно, LSC и MSC являются более коммитированными, чем PSC.
Примеры дифференцированных клеток включают в себя Т-клетки, В-клетки, эозинофилы, базофилы, нейтрофилы, мегакариоциты, моноциты, эритроциты, гранулоциты, тучные клетки и лимфоциты.
Т-клетки и В-клетки образуются в результате дифференцировки LSC. Следовательно, Т-клетки и В-клетки являются более коммитированными, чем LSC.
Эозинофилы, базофилы, нейтрофилы, мегакариоциты, моноциты, эритроциты, гранулоциты, тучные клетки, естественные клетки-киллеры (NK) и лимфоциты образуются в результате дифференцировки MSC. Следовательно, каждые из этих клеток являются более коммитированными, чем MSC.
Антигены связаны с недифференцированными и дифференцированными клетками. Термин "связаны" здесь означает, что речь идет о клетках, экспрессирующих или способных экспрессировать либо представляющих или способных быть индуцированными для представления антигена, или содержащих соответствующий антиген(ы).
Большинство недифференцированных клеток и дифференцированных клеток включают в себя антигены класса I и/или антигены класса II главного комплекса гистосовместимости (МНС). Если эти антигены связаны с указанными выше клетками, то они называются клетками Класса I+ и/или клетками Класса II+.
Каждый специфический антиген, связанный с недифференцированной клеткой или с дифференцированной клеткой, может действовать в качестве маркера. Следовательно, различные типы клеток можно отличить друг от друга на основании связанного с ними конкретного антигена (антигенов) или на основании определенной комбинации связанных антигенов.
Примеры этих маркерных антигенов включают в себя антигены CD34, CD19 и CD3. При наличии на клетке этих антигенов клетки называются соответственно CD34+, CD19+ и CD3+. Если эти антигены отсутствуют, такие клетки называются CD34-, CD19- и CD3-.
Более подробно, PSC представляют собой клетки CD34+. LSC представляют собой летки DR+, CD34+ и TdТ+. MSC представляют собой клетки CD34+, DR+, CD13+, CD33+, CD7+ и TdT+. B-клетки представляют собой клетки CDl9+, CD21+, CD22+ и DR+. Т-клетки представляют собой клетки CD2+, CD3+ и либо CD4+, либо CD8+. Незрелые лимфоциты представляют собой клетки CD4+ и CD8+. Активированные Т-клетки представляют собой клетки DR+. Естественные клетки-киллеры (NK) представляют собой клетки CD56+ и CDl6+. Т-лимфоциты представляют собой клетки CD7+. Лейкоциты представляют собой клетки CD45+. Гранулоциты представляют собой клетки CD13+ и CD33+. Моноциты-макрофаги представляют собой клетки CD14+ и DR+.
Следовательно, по наличию перечисленных выше антигенных маркеров можно идентифицировать определенные типы клеток (например, то, является ли клетка недифференцированной клеткой или дифференцированной клеткой) и специализацию этого типа клеток (например, является ли эта клетка Т-клеткой или В-клеткой).
Общая концепция ретродифференцировки не нова. Действительно, в 1976 г. Jose Uriel (Cancer Research, 36, 4269-4275. November 1976) представил обзор на эту тему, в котором он писал: "ретродифференцировка представляется обычным адаптационным процессом для поддержания клеточной целостности в противодействие агентам различной этиологии (физическим, химическим и вирусным). Сохраняя всю информацию, закодированную в их геноме, клетки, подвергающиеся ретродифференцировке, теряют морфологическое и функциональное разнообразие в результате процесса самоделеции цитоплазматических структур и перехода к более юному типу экспрессии гена. Это приводит к прогрессирующему развитию униформности первоначально различных клеточных фенотипов и к снижению реактивности на регуляторные сигналы, действующие на взрослые клетки. Ретродифференциацировка в норме балансируется противоположно направленным процессом реонтогенеза, который имеет тенденцию восстанавливать конечный фенотип, когда начинается реверсия. Это объясняет, почему ретродифференцировка остается неизменно ассоциированной с клеточной регенерацией и восстановлением тканей."
Uriel (там же) затем продолжил обсуждение опубликованных случаев ретродифференцировки таких, как работа Gurdon, относящаяся к ядрам из клеток кишечного эпителия головастиков Xenopus (Advances in Morphogenesis, 1966, vol. 4, рр. 1-43. New York Academic Press, Eds Abercombie and Bracher), и работа Bresnick, относящаяся к регенерации печени (Methods in Cancer Research, 1971, vol. 6, рр. 347-391).
Uriel (там же) также сообщил о работе, относящейся к изолированным паренхиматозным клеткам печени для культур in vitro. По Uriel: "В отличие от результатов, полученных на гепатоцитах плода или новорожденных, а также при использовании гепатоцитов из регенерирующей печени или из установленных гепатом, было трудно получить постоянную линию из взрослых гепатоцитов в покое".
Uriel также сообщил о видимой ретродифференцировке при раке, причем он заявил: "биохимические фенотипы многих опухолей проявляют аналогичные изменения реверсии к незрелости... во время предраковой стадии канцерогенеза печени, происходит также ретродифференцировка клеток".
Более свежие данные о ретродифференцировке включают в себя работу Minoru Fukunda (Cancer Research, 1981, vol. 41, рр. 4621-4628). Fukunda вызывал специфические изменения профиля гликопротеинов клеточной поверхности линии клеток лейкоза человека К562 с помощью использования способствующего развитию опухолей форболового эфира 12-O-тетрадеканоилфорбол-13-ацетата (ТРА). По Fukunda, TPA, по-видимому, вызывает стадию ретродифференцировки клеток лейкоза человека К562.
Наряду с этим Hass et al. (Cell Growth & Differentiation, 1991, vol. 2, pp. 541-548) сообщили о долгосрочной культуре дифференцированных под действием ТРА клеток лейкоза U-937 в отсутствие форболового эфира в течение 32-36 дней, что в результате привело к процессу ретродифференцировки, и что ретродифференцированные клетки отделялись от субстрата и повторно начинали пролиферацию.
Еще один случай ретродифференцировки содержится в работе Curtin and Snell (Вr. J. Cancer, 1983, vol. 48, pp. 495-505). Эти исследователи сравнивали ферментативные изменения, происходящие во время вызванного диэтилнитрозамином гепатоканцерогенеза и регенерации печени после частичной гепатэктомии, с нормальной печеночной дифференцировкой. Эти исследователи обнаружили изменения активности ферментов во время канцерогенеза, которые были аналогичны ступенчатому устранению дифференцировки. По данным этих исследователей полученные ими результаты свидетельствуют о том, что лежащий в основе процесс ретродифференцировки является общим как для процесса гепатоканцерогенеза, так и для регенерации печени.
Позднее Chastre et al. (FEBS Letters, 1985, vol. 188, number 2, pp. 2810-2811) сообщили о ретродифференцировке субклона толстой кишки человека НТ29-18.
Еще позднее Kobayashi et al. (Leukaemia Research, 1994, vol. 18, no. 12, pp. 929-933) сообщили об установлении ретродифференцированной клеточной линии (RD-1) из одиночной клетки крысиного миеломоноцитарного лейкоза, которая дифференцировалась в макрофагоподобную клетку под действием липополисахарида (LPS).
В соответствии с современным представлением, подтвержденным положениями, изложенными на странице 911 книги Molecular Biology of the Cell (pub. Garland Publishers Inc. , 1983), и позднее по Levitt and Mertelsman (там же), стволовая клетка, такая как PSC, имеет следующие четыре характеристики:
i) она является недифференцированной клеткой, т.е. она не является окончательно дифференцированной;
ii) она способна делиться без ограничений;
iii) она способна дать развитие дифференцированному потомству, такому как дифференцированные клетки, упомянутые ранее, и
iv) когда она делится, каждая дочерняя клетка имеет выбор: она может либо оставаться в виде PSC, как и родительская клетка, либо может встать на путь, необратимо ведущий к окончательной дифференцировке.
Следует подчеркнуть последнее свойство, а именно то что в соответствии с общими положениями в этой области знаний, как только недифференцированная клетка дифференцируется в более коммитированную клетку, она затем не может ретродифференцироваться. Это представление было даже поддержано положениями Uriel (там же), Fukunda (там же), Hass et al. (там же), Curtin and Snell (там же), Chastre et al. (там же) и Коbayashi et al. (там же); эти исследователи вызывали ретродифференцировку определенных типов дифференцированных клеток, но при этом эти клетки оставались коммитированными к одной и той же линии, и они не ретродифференцировались в недифференцированные клетки.
Поэтому в соответствии с научными представлениями до настоящего изобретения считалось, что невозможно получить недифференцированные клетки, такие как стволовые клетки, из более коммитированных клеток. Однако настоящее изобретение показывает, что это представление неточное и что можно получить недифференцированные клетки из более коммитированных клеток.
Таким образом, в соответствии с первым аспектом настоящего изобретения предусматривается способ получения недифференцированной клетки, причем способ включает в себя контактирование более коммитированной клетки с агентом, который вызывает ретродифференцировку более коммитированной клетки в недифференцированную клетку.
В соответствии со вторым аспектом настоящего изобретения предусматривается способ, включающий в себя контактирование более коммитированной клетки с агентом, который вызывает ретродифференцировку более коммитированной клетки в недифференцированную клетку, и затем коммитирование недифференцированной клетки в рекоммитированную клетку.
Термин "рекоммитированная клетка" означает клетку, полученную из недифференцированной клетки, т.е. новую, более коммитированную клетку.
В соответствии с третьим аспектом настоящего изобретения предусмотрено получение недифференцированной клетки в соответствии со способом настоящего изобретения.
В соответствии с четвертым аспектом настоящего изобретения предусматривается получение недифференцированной клетки в соответствии со способом настоящего изобретения в качестве - или при получении - лекарственного средства.
В соответствии с пятым аспектом настоящего изобретения предполагается применение недифференцированной клетки, полученной в соответствии со способом настоящего изобретения, в производстве лекарственного препарата для лечения иммунологического расстройства или заболевания.
В соответствии с шестым аспектом настоящего изобретения предусматривается получение рекоммитированной клетки в соответствии со способом настоящего изобретения.
В соответствии с седьмым аспектом настоящего изобретения предусматривается получение рекоммитированной клетки в соответствии со способом настоящего изобретения в качестве - или при получении - лекарственного средства.
В соответствии с восьмым аспектом настоящего изобретения предполагается получение рекоммитированной клетки, полученной в соответствии со способом настоящего изобретения, в производстве лекарственного препарата для лечения иммунологического расстройства или заболевания.
В соответствии с девятым аспектом настоящего изобретения предусмотрена более коммитированная клетка, имеющая прикрепленный к ней агент, который может вызвать ретродифференцировку более коммитированной клетки в недифференцированную клетку.
В соответствии с десятым аспектом настоящего изобретения предусмотрена клетка CD19+ и CD3+.
Таким образом, в своем самом широком смысле настоящее изобретение основано на крайне неожиданном открытии, что можно получить недифференцированную клетку из более коммитированной клетки.
Настоящее изобретение имеет большое значение, поскольку теперь становится возможным получить недифференцированные клетки из более коммитированных клеток и затем использовать эти недифференцированные клетки в качестве - или для получения - лекарственных средств - либо in vitro, либо in vivo, либо их комбинаций - для лечения расстройств.
Настоящее изобретение имеет также то преимущество, что можно коммитировать недифференцированную клетку, полученную путем ретродифференцировки в рекоммитированную клетку, такую как новая дифференцированная клетка, с целью коррекции или удаления первоначальной, более коммитированной, клетки или для коррекции или удаления ее продукта.
Предпочтительно, если более коммитированная клетка способна ретродифференцироваться в недифференцированную клетку I+-Класса и/или II+-Класса МНС.
Предпочтительно, когда более коммитированная клетка способна ретродифференцироваться в недифференцированную клетку, содержащую антиген стволовой клетки.
Предпочтительно, если более коммитированная клетка способна ретродифференцироваться в недифференцированную клетку CD34+.
Предпочтительно, если более коммитированная клетка способна ретродифференцироваться в лимфогематопоэтическую клетку-предшественник.
Предпочтительно, если более коммитированная клетка способна ретродифференцироваться в плюрипотентную стволовую клетку.
Недифференцированная клетка может содержать любые компоненты, которые имеют отношение к представлению антигена, его захвату или распознаванию. Предпочтительно, когда недифференцированная клетка представляет собой клетку I+-Класса и/или II+-Класса МНС.
Предпочтительно, когда недифференцированная клетка содержит антиген стволовой клетки.
Предпочтительно, если недифференцированная клетка представляет собой недифференцированную клетку CD34+.
Предпочтительно, если недифференцированная клетка представляет собой лимфогематопоэтическую клетку-предшественник.
Предпочтительно, если недифференцированная клетка представляет собой плюрипотентную стволовую клетку.
Более коммитированная клетка может содержать любые компоненты, которые имеют отношение к представлению антигена, его захвату или распознаванию. Предпочтительно, чтобы недифференцированная клетка являлась клеткой I+-Kлacca и/или II+-Класса МНС.
Предпочтительно, когда агент действует внеклеточно по отношению к более коммитированной клетке.
Предпочтительно, когда более коммитированная клетка содержит рецептор, который может быть оперативно связываем агентом, и в котором агент оперативно связывает рецептор.
Предпочтительно, чтобы рецептор являлся рецептором клеточной поверхности.
Предпочтительно, чтобы рецептор содержал α-компонент и/или β-компонент.
Предпочтительно, чтобы рецептор содержал β-цепь, имеющую гомологичные участки.
Предпочтительно, чтобы рецептор содержал по меньшей мере гомологичные участки β-цепи HLA-DR.
Предпочтительно, чтобы рецептор содержал α-цепь, имеющую гомологичные участки.
Предпочтительно, чтобы рецептор содержал по меньшей мере гомологичные участки α-цепи HLA-DR.
Предпочтительно, когда агент представляет собой антитело к рецептору.
Предпочтительно, чтобы агент представлял собой моноклональное антитело к рецептору.
Предпочтительно, когда агент представляет собой антитело, предпочтительно, моноклональное антитело, к гомологичным участкам β-цепи HLA-DR.
Предпочтительно, чтобы агент представлял собой антитело, предпочтительно моноклональное антитело, к гомологичным участкам α-цепи HLA-DR.
Предпочтительно, когда агент используется в комбинации с модификатором биологического ответа.
Предпочтительно, чтобы модификатор биологического ответа представлял собой алкилирующий агент.
Предпочтительно, если алкилирующий агент представляет собой или включает в себя циклофосфамид.
В одном предпочтительном аспекте более коммитированная клетка представляет собой дифференцированную клетку.
Предпочтительно, чтобы более коммитированная клетка являлась любой из В-клеток или Т-клеток.
В альтернативном предпочтительном аспекте более коммитированная клетка представляет собой более зрелую недифференцированную клетку.
В одном предпочтительном аспекте, когда недифференцированная клетка коммитирована в рекоммитированную клетку, рекоммитированная клетка относится к той же линии, что и более коммитированная клетка перед ретродифференцировкой.
В другом предпочтительном аспекте, когда недифференцированная клетка коммитирована в рекоммитированную клетку, рекоммитированная клетка относится к другой линии, нежели более коммитированная клетка перед ретродифференцировкой.
Предпочтительно, чтобы рекоммитированная клетка являлась любой из В-клеток, Т-клеток или гранулоцитов.
Предпочтительно, когда способ представляет собой способ in vitro.
Предпочтительно, когда агент модулирует экспрессию гена МНС, причем предпочтительно, если агент модулирует экспрессию МНС Класса I+ и/или МНС Класса II+.
Агент оперативно вовлекает более коммитированную клетку для ретродифференцировки этой клетки в недифференцированную клетку. В этом отношении агент для ретродифференцировки более коммитированной клетки в недифференцированную клетку может действовать в прямом контакте или непрямом контакте с более коммитированной клеткой.
Примером прямого контакта является то, когда более коммитированная клетка имеет по меньшей мере один рецептор на своей поверхности, такой как β-цепь, которая имеет гомологичные участки (участки, которые обычно имеют такую же или подобную последовательность), тем, которые могут быть обнаружены на В-клетках и в которых агент вступает в прямой контакт с рецептором клеточной поверхности. Другим примером является то, когда более коммитированная клетка имеет рецептор на своей поверхности, такой как α-цепь, которая имеет участки, гомологичные таковым, обнаруживаемым на Т-клетках, и на которых агент вступает в прямой контакт с рецептором клеточной поверхности.
Примером непрямого контакта является то, когда более коммитированная клетка имеет по меньшей мере два рецептора на своей клеточной поверхности, и контакт агента с одним из рецепторов воздействует на другой рецептор, который вызывает ретродифференцировку более коммитированной клетки.
Агент для ретродифференцировки более коммитированной клетки в недифференцированную клетку может быть химическим соединением или композицией. Предпочтительно, однако, когда агент способен вступать в контакт с рецептором на поверхности более коммитированной клетки. Например, предпочтительные агенты включают в себя любой один или более агентов из числа циклического аденозинмонофосфата (сАМР), молекулы CD4, молекулы CD8, части или всего рецептора Т-клетки, лиганда (фиксированного или свободного), пептида, рецептора Т-клетки (TCR), антитела, перекрестно реактивного антитела, моноклонального антитела или поликлонального антитела.
Если агент представляет собой антитело, перекрестно реактивное антитело, моноклональное антитело или поликлональное антитело, то предпочтительно, чтобы агент представлял собой любое одно или более из антитела, перекрестно реактивного антитела, моноклонального антитела или поликлонального антитела к любому одному или более из числа β-цепи антигена II класса МНС, β-цепи антигена HLA-DR МНС, α-цепи антигена I класса или II класса МНС, α-цепи антигена HLA-DR МНС, α- и β-цепи антигена II класса МНС или антигена I класса МНС. Примером подходящего антитела является CR3/43 (поставляемого Dako).
Более коммитированная клетка представляет собой любую клетку, происходящую из или которая может происходить из недифференцированной клетки.
Таким образом, в одном предпочтительном аспекте более коммитированная клетка представляет собой также недифференцированную клетку. Поэтому в качество примера недифференцированная клетка может быть лимфоидной стволовой клеткой или миелоидной стволовой клеткой, а недифференцированная клетка представляет собой плюрипотентную стволовую клетку.
В другом аспекте более коммитированная клетка представляет собой дифференцированную клетку, такую как клетка CFC-Т, клетка CFC-B, клетка CFC-Eosin, клетка CFC-Bas, клетка CFC-GM, клетка CFC-MEG, клетка BFC-E, клетка CFC-E, Т-клетка, В-клетка, эозинофил, базофил, нейтрофил, моноцит, мегакариоцит или эритроцит, а недифференцированная клетка представляет собой миелоидную стволовую клетку, лимфоидную стволовую клетку или плюрипотентную стволовую клетку.
Если более коммитированная клетка представляет собой дифференцированную клетку, то предпочтительно, чтобы дифференцированная клетка являлась В-лимфоцитом (активированным или неактивированным), Т-лимфоцитом (активированным или неактивированным), клеткой из линии макрофагов-моноцитов, содержащей ядро клеткой, способной экспрессировать антигены класса I или антигены класса II, клеткой, в которой может быть индуцирована экспрессия антигенов класса I или класса II, или энуклеированной клеткой (т.е. клеткой, которая не содержит ядро, такой как эритроцит).
В альтернативных предпочтительных вариантах дифференцированная клетка выбирается из любой группы клеток, включающей в себя крупные гранулярные лимфоциты, нуль-лимфоциты и естественные клетки-киллеры, каждая из которых экспрессирует рецепторы клеточной поверхности CD56 и/или CD16.
Дифференцированная клетка может даже быть образована путем нуклеации энуклеированной клетки.
Агент может действовать внутриклеточно внутри более коммитированной клетки. Однако предпочтительно, когда агент действует внеклеточно по отношению к более коммитированной клетке.
В предпочтительном варианте агент оперативно занимает рецептор, присутствующий на поверхности более коммитированной клетки, причем рецептор может быть экспрессирован более коммитированной клеткой, наподобие рецептора, которая способна экспрессировать более коммитированную клетку.
Предпочтительно, если рецептор представляет собой антиген Класса I или Класса II главного комплекса гистосовместимости (МНС). В предпочтительных вариантах рецептор клеточной поверхности представляет собой любой из числа рецептора HLA-DR, рецептора DM, рецептора DP, рецептора DQ, рецептора HLA-А, рецептора HLA-B, рецептора HLA-C, рецептора HLA-E, рецептора HLA-F или рецептора HLA-G.
В наиболее предпочтительных вариантах реализации рецептор клеточной поверхности представляет собой рецептор HLA-DR.
Предпочтительно этап контактирования включает в себя вступление агента во взаимодействие с любым одним или более из числа гомологичных участков α-цепи антигенов I класса, гомологичных участков α-цепи антигенов II класса, рецептора CD4 клеточной поверхности, рецептора CD8 клеточной поверхности, гомологичных участков β-цепи антигенов II класса в присутствии лимфоцитов, гомологичных участков α-цепи антигенов I класса в присутствии лимфоцитов или гомологичных участков α-цепи антигенов II класса в присутствии лимфоцитов.
Предпочтительно, если этап контактирования происходит в присутствии модификатора биологического ответа.
Предпочтительно, когда модификатор биологического ответа представляет собой один или более модуляторов, таких как иммуномодулятор, фактор роста, цитокин, рецептор клеточной поверхности, гормон, нуклеиновая кислота, нуклеотидная последовательность, антиген или пептид.
В предпочтительном варианте реализации настоящего изобретения недифференцированная клетка затем коммитируется в рекоммитированную клетку, такую как дифференцированная клетка.
Рекоммитированная клетка может относиться к той же линии, что и более коммитированная клетка, из которой была получена недифференцированная клетка.
Альтернативно рекоммитированная клетка может относиться к другой линии, чем более коммитированная клетка, из которой получена недифференцированная клетка.
Кроме того, настоящее изобретение также включает в себя способ согласно изобретению получения недифференцированной клетки, который включает в себя коммитирование недифференцированной клетки в рекоммитированную клетку и затем слияние рекоммитированной клетки с миеломой. Это обеспечивает экспрессию in vitro больших количеств желаемого продукта, такого как антитело или антиген, или гормон и т.д.
Другие аспекты настоящего изобретения включают в себя следующее.
Применение любого из агентов настоящего изобретения для получения недифференцированной клетки из более коммитированной клетки.
Применение недифференцированной клетки, полученной в соответствии со способом настоящего изобретения, для получения любого моноклонального или поликлонального, или специфического антитела из В-лимфоцита или Т-лимфоцита; клетки из линии макрофагов-моноцитов; содержащей ядро клетки, способной экспрессировать антигены класса I или класса II; клетки, способной к индукции экспрессии антигенов класса I или класса II; энуклеированной клетки или апоптотической клетки.
Применение недифференцированной клетки, полученной в соответствии со способом настоящего изобретения, для получения эффекторных Т-лимфоцитов из В-лимфоцитов и/или наоборот.
Применение недифференцированной клетки, полученной в соответствии со способом настоящего изобретения, для получения любого одного или более из числа лекарственных препаратов, таких как лекарственный препарат, включающий в себя или полученный из В-лимфоцита, Т-лимфоцита, клетки макрофагально-моноцитарной линии, содержащей ядро клетки, способной экспрессировать антигены класса I или класса II; клетки, способной к индукции экспрессии антигенов класса I или класса II или энуклеированной клетки.
Настоящее изобретение также включает в себя способы, использующие указанные выше применения и продукты или композиции, полученные в результате таких способов.
Настоящее изобретение также включает в себя лекарственный препарат, содержащий недифференцированную клетку в соответствии с настоящим изобретением или продукт, полученный из нее, смешанный с подходящим растворителем, носителем или наполнителем.
В одном предпочтительном варианте реализации лекарственный препарат включает в себя антитело или антиген, полученный из недифференцированной клетки в соответствии с настоящим изобретением, смешанный с подходящим растворителем, носителем или наполнителем.
Предпочтительно, чтобы лекарственный препарат предназначался для лечения любого из следующих состояний: рак, аутоиммунные заболевания, заболевания крови, клеточная или тканевая регенерация, регенерация органов, лечение трансплантатов органов или тканей или врожденных нарушений метаболизма.
В предпочтительном варианте реализации настоящее изобретение относится к способу введения гена в геном недифференцированной клетки, причем способ включает в себя введение гена в более коммитированную клетку и затем получение недифференцированной клетки с помощью способа в соответствии с настоящим изобретением, посредством чего ген присутствует в недифференцированной клетке.
В более предпочтительном варианте реализации настоящее изобретение относится к способу введения гена в геном недифференцированной клетки, причем способ включает в себя вставку гена в геном более коммитированной клетки и затем получение недифференцированной клетки способом согласно изобретению, посредством чего ген присутствует в недифференцированной клетке.
В еще более предпочтительном варианте реализации настоящее изобретение относится к способу введения гена в недифференцированную клетку, причем способ включает в себя вставку гена в геном более коммитированной клетки и затем получение недифференцированной клетки с помощью способа в соответствии с настоящим изобретением, в результате чего ген присутствует в геноме недифференцированной клетки.
Настоящее изобретение охватывает недифференцированную клетку, полученную с помощью любого из этих способов настоящего изобретения.
Как уже упоминалось, настоящее изобретение также охватывает лекарственный препарат, содержащий недифференцированную клетку, полученную любым из этих способов, смешанную с подходящим растворителем, носителем или наполнителем. С таким лекарственным препаратом недифференцированная клетка может быть использована для получения преимущественно более коммитированной клетки, такой как клетка, имеющая правильную геномную структуру, для облегчения любых симптомов или состояний, вызванных или связанных с более коммитированной клеткой, имеющей неправильную геномную структуру.
Таким образом, настоящее изобретение также обеспечивает способ устранения приобретенной мутации из более коммитированной клетки, причем этот способ включает в себя образование недифференцированной клетки способом согласно изобретению, превращающий недифференцированную клетку в рекоммитированную клетку, в результате которого устройство или перестройка генома и/или ядра клетки вызывает устранение мутации.
Предпочтительно ген вставляется в иммуноглобулиновый участок или участок TCR генома.
Альтернативно недифференцированная клетка может использоваться для получения более коммитированной клетки, которая продуцирует агент, который излечивает симптомы или состояния, вызванные или связанные с более коммитированной клеткой, имеющей неправильную геномную структуру.
Например, настоящее изобретение может быть использовано для получения антител или рецепторов Т-клеток к антигену, который экспрессируется более коммитированной клеткой, которая ретродифференцировалась в недифференцированную клетку. В этом отношении антиген может быть фетоспецифическим антигеном или перекрестие реактивным фетоспецифическим антигеном.
Настоящее изобретение также включает в себя способ контролирования уровней недифференцированных клеток и более коммитированных клеток. Например, настоящее изобретение включает в себя способ, включающий в себя образование недифференцированной клетки способом согласно изобретению, и затем активацию гена апоптоза для воздействия на недифференцированную клетку так, чтобы вызвать ее гибель.
В одном предпочтительном варианте реализации настоящего изобретения более коммитированная клетка не является раковой клеткой. В другом предпочтительном варианте реализации настоящего изобретения агент не является ни канцерогенным, ни способным стимулировать злокачественный рост.
Настоящее изобретение также охватывает способ лечения пациента, страдающего заболеванием или расстройством, связанным с дефективной клеткой или нежелательной клеткой, причем способ включает в себя получение недифференцированной клетки путем контактирования более коммитированной клетки с агентом, который вызывает ретродифференцировку более коммитированной клетки в недифференцированную клетку, а затем необязательно коммитирование недифференцированной клетки в рекоммитированную клетку; в этом способе недифференцированная клетка, или рекоммитированная клетка, воздействует на дефективную клетку или нежелательную клетку для облегчения симптомов заболевания или расстройства или для излечения пациента с заболеванием или состоянием.
В результате настоящее изобретение относится к получению недифферецированной клетки из более коммитированной клетки.
Теперь настоящее изобретение будет описано в виде примера, в котором будет делаться ссылка на следующие чертежи:
на фиг.1, которая представляет собой микроскопическое изображение клеток перед применением способа настоящего изобретения;
на фиг. 2, которая представляет собой микроскопическое изображение клеток, полученных с помощью способа настоящего изобретения;
на фиг. 3, которая представляет собой микроскопическое изображение клеток, полученных способом согласно изобретению, но при меньшем увеличении;
на фиг.4, которая представляет собой микроскопическое изображение клеток перед применением способа настоящего изобретения;
на фиг. 5, которая представляет собой микроскопическое изображение клеток, полученных способом согласно изобретению;
на фиг. 6, которая представляет собой микроскопическое изображение клеток, полученных способом согласно изобретению.
А. МАТЕРИАЛЫ И МЕТОДЫ
ПАЦИЕНТЫ
В трубках с лавандовыми верхушками, содержащими ЭДТА, были получены пробы крови пациентов с В-клеточным хроническим лимфолейкозом, пациентов с дефицитом антител (включая дефицит IgА и сцепленные с Х-хромосомой гипогаммаглобулинемии у детей), пациентов с ВИЧ-инфекциями и синдромом СПИД, пациента с инфекцией цитомегаловируса (ЦМВ), пациента с ходжкинской лимфомой, пациента с острым Т-клеточным лейкозом, 6-дневного младенца с ходжкинской лимфомой, пациента с острым Т-клеточным лейкозом, 6-дневного младенца с бластоцитозом, различных пациентов с различными инфекциями и клиническими состояниями, пуповинная кровь, костный мозг и обогащенные препараты В-лимфоцитов здоровых доноров крови.
КЛИНИЧЕСКИЕ И ЭКСПЕРИМЕНТАЛЬНЫЕ СОСТОЯНИЯ
Клинические и экспериментальные условия лечения пациентов, включая различные типы обработки образцов их крови, описаны в таблице 1. Лейкоцитарную формулу (WBC) получали с использованием счетчика Кольтера, и она включена в ту же таблицу.
ОБРАБОТКА КРОВИ
После взятия образцы крови обрабатывали чистым моноклональным антителом к гомологичному участку β-цепи антигена HLA-DR (DAKO) и оставляли для смешивания на многоголовочном роллере при комнатной температуре в течение максимум 24 часов. Некоторые пробы сначала смешивали на многоголовочном роллере в течение 15 минут, после чего их оставляли для инкубации в инкубаторе при 22oС. Концентрация моноклонального антитела, добавляемого в образцы крови, колебалась от 10 до 50 мкл/мл крови.
Кроме того, применяли другие способы обработки при тех же концентрациях, и они включали в себя добавление моноклонального антитела к гомологичному участку α-цепи антигена HLA-DR, моноклонального антитела к гомологичному участку антигенов класса I, моноклонального антитела к CD4, моноклонального антитела к CD8 и иммобилизованного на ПЭ моноклонального антитела к гомологичному участку β-цепи антигена HLA-DR.
Другие способы обработки включали в себя одновременное добавление к образцам крови моноклональных антител к гомологичным участкам α- и β-цепей антигена HLA-DR.
Кроме того, к образцам крови добавляли алкилирующие агенты, такие как циклофосфамид в комбинации с чистым моноклональным антителом к гомологичному участку β-цепи антигена HLA-DR.
После этих способов обработки образцы крови окрашивали набором меченых моноклональных антител в соответствии с инструкциями производителя и затем проводили анализ с использованием проточной цитометрии.
Периоды инкубации с моноклональными антителами колебались в интервалах от 2, 4, 6, 12 до 24 часов.
МЕЧЕНЫЕ АНТИТЕЛА
Следующие моноклональные антитела были использованы для выявления следующих маркеров на клетках с помощью проточной цитометрии: CD19 и CD3, CD4 и CD8, DR и CD3, CD56&16 и CD3, CD45 и CD14, CD8 и CD3, CD8 и CD28, контроль с помощью одновременной пробы (IgG1 FITC + IgG2a PE), CD34 и CD2, CD7 и CD13& 33, CD10 и CD25, CD5 и CDIO, CD5 и CD21, CD7 и CD5, CD13 и CD20, CD23 и CD57 и CD25 и CD45 RA (Becton & Dickenson and DAKO).
Анализ образцов крови каждого пациента как обработанных, так и необработанных проводили с использованием большинства компонентов из указанного выше набора для определения характера иммунофенотипических изменений, которые сопровождали различные типы обработки, и они проводились раздельно на различных аликвотах одного и того же образца крови. Окрашивание и анализ необработанных образцов и образцов после других контрольных способов обработки проводили одновременно.
ПРОТОЧНАЯ ЦИТОМЕТРИЯ
Окрашивание и лизирование цельных образцов крови проводили в соответствии с инструкциями производителя. Проточный цитометрический анализ проводили на FACScan@ с помощью либо одновременного теста, либо компьютерной программы PAINT A GATE (BDIS), которая включала в себя отрицательные контроли при обратном прослеживании. В файлах списочного типа накапливали и хранили информацию о 10000-20000 сеансах обработки.
МОРФОЛОГИЯ
Морфологию анализировали с использованием микроскопии и окрашивания по Wright.
В. РЕЗУЛЬТАТЫ
НАБОР CD19 и CD3
Обработка образцов крови моноклональным антителом к гомологичному участку β-цепи HLA-DR всегда уменьшала относительное количество клеток CD19+. Этот маркер представляет собой общий В-клеточный антиген (см. таблицу). Этот антиген присутствует на всех В-лимфоцитах человека на всех стадиях созревания, но он утрачивается на окончательно дифференцированных плазматических клетках. Следовательно, это является показателем того, что В-клетки претерпели ретродифференцировку в недифференцированные клетки.
Такая же обработка вызывала резкое увеличение относительного количества клеток CD3+, особенно в крови пациентов с В-клеточным лимфолейкозом (B-CLL), которое всегда сопровождалось увеличением относительного количества клеток CD3-CD19-. CD3 присутствует на всех зрелых Т-лимфоцитах и на 65-85% тимоцитов. Этот маркер всегда обнаруживается в ассоциации с α-/β- или гамма/дельта рецепторами Т-клеток (TCR), и вместе эти комплексы важны в процессе передачи сигналов внутрь клетки. Следовательно, это является показателем того, что В-клетки ретродифференцировались в недифференцированные клетки и затем коммитировались в новые дифференцированные клетки, а именно Т-клетки.
В обработанной крови пациентов с B-CLL появился новый клон клеток, совместно экспрессирующий маркеры CD19 и CD3-, т.е. клетки CD19+ и CD3+ (см. карту 1, пациент 2, 3 и 4 через 2, 6 и 24 часа после начала обработки). У других пациентов с различными состояниями выявлено увеличение относительного количества этих клонов клеток. Эти клетки были исключительно крупными и обильно гранулированными, и на их клеточной мембране были экспрессированы крайне высокие уровни CD19. Представляется, что маркер CD3 экспрессирован на этих клетках на уровнях, аналогичных уровням, экспрессированным на нормальных зрелых лимфоцитах.
В таблице 2 пациенты под номерами 2, 3 и 4 в действительности являются номерами, представляющими одного и того же пациента, и их обозначение было просто предназначено для иллюстрации влияния обработки на кровь с течением времени (экспериментальное и клиническое состояние этого пациента показано в таблице 1).
Представляется, что клоны CD19+ и CD3+ в обработанных образцах уменьшаются с течением времени, достигая первоначальных уровней, которые были определены в необработанном образце с интервалами 2 , 6 и 24 часа.
Другой тип клетки того же размера и зернистости был обнаружен в обработанных образцах, и эти клетки имели высокие уровни CD19, экспрессированных на их поверхности, но были отрицательны по маркеру CD3 и богаты рецепторами FC. Однако оказалось, что относительное количество этих клеток уменьшалось
со временем. Интересно, что через 24 ч после обработки образца крови (2, 3 и 4) наблюдалось уменьшение относительного количества клеток CD19-CD3- (в группе клеток, увеличение количества которых первоначально наблюдалось через 2 и 6 ч после обработки образцов крови. Однако наблюдалось уменьшение количества популяций лейкоцитов при подсчете колтеровской формулы при обработке крови моноклональным антителом к гомологичному участку β-цепи антигена HLA-DR. Эти данные свидетельствуют о том, что этот тип обработки вызывает развитие атипичных клеток, которые нельзя выявить с помощью счетчика Колтера (таблица 1), но может обнаруживаться при измерении с помощью проточной цитометрии, которая подсчитывает клетки на основании поверхностных маркеров, размера и зернистости. Кроме того, эти атипичные клетки выявлялись с помощью анализа морфологии с использованием красителя Wright под микроскопом. Графики проточной цитометрии этих феноменов представлены на графиках (1, 2, 3 и 4), и представляется, что иммунофенотипические изменения, полученные после обработки образцов крови, свидетельствуют о том, что лимфоциты CD19+ и CD3+ представляют собой связанную друг с другом группу клеток, но остаются отличными по относительной экспрессии CD19 и CD3 от стволовых клеток.
В таблице 2 пациент под номерами 5 и 6 является одним и тем же пациентом, но анализ обработанного и необработанного образцов крови контролировался в динамике и в одно и то же время (см. таблицу 1).
В крови пациентов со злокачественными В-клеточными заболеваниями выявлены аналогичные тенденции иммунофенотипических изменений при сравнении с кровью пациентов с B-CLL, но изменения не были выражены в той же степени. Однако относительное и абсолютное количество В-лимфоцитов и положительных по классу II МНС клеток в крови этих пациентов крайне низкое по сравнению с тем, которое обнаружено в крови пациентов с B-CLL.
У двух братьев со сцепленной с Х-хромосомой детской гипогаммаглобулинемией, у которых был дефицит В-клеток, были выявлены различные иммунофенотипические изменения в относительном количестве клеток СD3+ после обработки их крови. У младшего брата, которому было 2 месяца и который не был болен, после обработки крови было выявлено незначительное увеличение относительного количества клеток CD3+, которое сопровождалось уменьшением относительного количества клеток CD3- и CD19-. С другой стороны, у другого брата, которому было 2 года, который был крайне болен и у которого было относительно высокое количество активированных Т-клеток, экспрессирующих антигены DR, было выявлено уменьшение количества клеток CD3+ после обработки его крови. Никакие другие маркеры не использовались для измерения других возможных иммунофенотипических изменений, потому что образцы крови, полученные у этих двух пациентов, были крайне малы (таблица 2, ID43/BD и 04/BD).
У пациента 91 в таблице 2 выявляется уменьшение относительного количества клеток CD3+ после обработки крови, которое сопровождалось увеличением относительного количества клеток CD3- и CD19-. Однако при анализе других поверхностных маркеров, таких как CD4 и CD8 (см. таблицу 3), было отмечено, что у пациента имеется высокое относительное число клеток CD4+CD8+ в крови, это было отмечено перед обработкой образцов крови моноклональным антителом к β-цепи антигена DR, и количество этих дважды позитивных клеток заметно снижалось после обработки крови. Кроме того, когда был проведен анализ других маркеров, было отмечено, что относительное число клеток CD3+ возросло (см. таблицу 4).
В обогащенном препарате В-лимфоцитов, полученном от здоровых доноров крови, после обработки образцов крови моноклональным антителом к β-цепи антигенов DR, выявлено резкое увеличение относительного числа клеток CD3+, которое всегда сопровождалось уменьшением относительного количества клеток CD19+ и увеличением относительного количества клеток CD19-CD3-. Дальнейший анализ с использованием маркеров, таких как CD4 и CD8, выявил сопутствующее увеличение относительного количества этих маркеров. Однако в обогащенном препарате Т-лимфоцитов тех же доноров крови после обработки тем же моноклональным антителом таких же изменений обнаружено не было.
НАБОР CD4 и CD8
Антиген CD4 представляет собой рецептор вируса иммунодефицита человека. Молекула CD4 связывает антиген класса II МНС в В2-домене - участке, который аналогичен сайтам связывания CD8 с антигенами класса I. Связывание CD4 с антигеном класса II усиливает реактивность Т-клеток к антигенам, как и связывание CD8 с антигенами класса I. Антигены CD8 присутствуют на субпопуляции суппрессорных/цитотоксических Т-лимфоцитов человека, так же как и на субпопуляции лимфоцитов естественных киллеров (NK) и на большинстве нормальных тимоцитов. Антигены CD4 и CD8 совместно экспрессированы на тимоцитах, и эти клетки теряют все маркеры по мере созревания в Т-лимфоциты.
При анализе маркеров CD4 и CD8 (см. ниже) и в большинстве образцов крови, представленных в таблице 2, возникает тип окрашивания, который подтверждает наличие процесса ретродифференцировки В-лимфоцитов в недифференцированные клетки и последующей дифференцировки в Т-лимфоциты.
Клетки CD4+CD8-, которые представляют собой дважды позитивные клетки, всегда появлялись после обработки образцов крови моноклональным антителом к гомологичному участку β-цепи, и количество этих типов клеток заметно возрастало в крови обработанных образцов пациентов с B-CLL, но они всегда отсутствовали в необработанных образцах (см. таблицу 3 и карты 1, 2, 3 и 4). В тех же образцах также отмечалось одновременное увеличение относительного количества одиночно позитивных клеток, таких как клетки CD8+ и CD4+. Кроме того, отмечалось резкое снижение относительного количества клеток CD4-CD8-, - которое, по крайней мере в случае B-CLL, соответствует В-клеткам - в обработанных образцах по сравнению с необработанными образцами, которые оставались на одном и том же уровне при измерении в динамике. Однако определение относительного количества клеток CD4+CD8+ в динамике в обработанных образцах показало, что было сопутствующее возрастание количества одиночно позитивных клеток со снижением относительного количества дважды позитивных клеток. Этот тип фенотипического изменения характерен для тимического развития клеток - предшественников линии Т-лимфоцитов в тимусе (пациент номер 2, 3 и 4). Антиген CD4 присутствует на субпопуляциях Т-лимфоцитов хелперов/индукторов (CD4+CD3+) и большинстве нормальных тимоцитов. Однако этот антиген присутствует с низкой плотностью на клеточной поверхности моноцитов и в цитоплазме моноцитов и макрофагов (CD3-CD4+).
После обработки в различных образцах крови отмечено различное влияние на клетки с относительно низким количеством CD4+. Представляется, что обработка не влияет на относительное количество этого типа клеток в образцах крови пациентов с B-CLL по сравнению с необработанными образцами. Такие низкие уровни экспрессии CD4 обнаружены на моноцитах и на тимоцитах на очень ранних стадиях развития.
У пациента HIV+ 25 после обработки выявлено существенное увеличение количества дважды позитивных клеток, экспрессирующих одновременно CD4 и CD8. С другой стороны, у пациента 91 после обработки выявлено уменьшение количества этого подтипа клеток, и наблюдение такого феномена зависит от времени. Наблюдалось увеличение относительного количества клеток CD8+ в необработанных образцах крови пациентов с B-CLL при измерении в динамике, тогда как в те же самые периоды наблюдалось уменьшение относительного количества CD4+-клeтoк и клеток с низким содержанием CD4+ (таблица 3, пациент 2, 3 и 4).
НАБОР DR И CD3
Маркеры DR присутствуют на моноцитах, дендритных клетках, В-клетках и активированных Т-лимфоцитах.
В обработанных и необработанных пробах, проанализированных с использованием этого набора, выявлены иммунофенотипические изменения, подобные изменениям, полученным, когда пробы крови анализировали с использованием маркеров CD19 и CD3 (см. таблицу 2), и эти антигены, как указано ранее, представляют собой соответственно В- и Т-клеточные маркеры.
Представляется, что обработка крови моноклональными антителами влияет на относительное количество В-лимфоцитов DR+, так что уровень клеток DR+ уменьшается. Напротив, относительное количество клеток CD3+ (Т-клеток) значительно увеличивается (см. таблицу 4 и карту). Кроме того, относительное количество активированных Т-клеток увеличивалось в большинстве обработанных проб крови пациентов с B-CLL, и на эти типы клеток оказывались различные воздействия в обработанных образцах пациентов с другими состояниями. Кроме того, относительное количество DR высоко положительных клеток DR появлялось в значительных количествах обработанных образцов пациентов с B-CLL и у 6-дневного младенца с увеличенным содержанием бластов DR+CD34+ в крови. Однако следует отметить, что бласты, которые присутствовали в крови этого пациента, были отрицательны по Т- и В-клеточным маркерам до и после обработки, но становились более позитивными по антигенам миелоидной линии после обработки. Относительное количество клеток DR-CD34- увеличивалось в большинстве обработанных образцов крови, и было пропорционально увеличению относительного количества клеток CD3+ (Т-клеток) и обратно пропорционально уменьшению относительного количества клеток DR+ (В-клеток).
НАБОР CD56&16 И CD3
Маркеры CD56& CD16 обнаруживаются на гетерогенной группе клеток, субпопуляции лимфоцитов, известной в целом как крупные гранулярные лимфоциты и лимфоциты - естественные киллеры (NK). Антиген CD16 экспрессирован практически на всех покоящихся лимфоцитах NK и слабо экспрессирован на некоторых Т-лимфоцитах CD3+ от определенных лиц. Этот антиген обнаруживается на гранулоцитах в меньшем количестве и ассоциирован с лимфоцитами, содержащими крупные азурофильные гранулы. Антиген CD16 представляет собой рецептор III IgG FC.
Различное количество лимфоцитов CD16+ экспрессирует либо антиген CD57, либо с низкой плотностью антиген CD8, либо оба антигена. У большинства лиц фактически нет перекрывания с другими антигенами Т-лимфоцитов, такими как антигены CD5, CD4 или CD3. Антиген CD56 присутствует по существу на всех покоящихся и активированных лимфоцитах CD16+ NK, и эти субпопуляции клеток осуществляют цитотоксичность, не ограниченную главным комплексом гистосовместимости.
Иммунотипирование обработанных и необработанных образцов крови пациентов с B-CLL и некоторых других пациентов с другими состояниями показало увеличение относительного количества клеток, совместно экспрессирующих антигены CD56& CD16, которые были сильно гранулированы и имели средний размер (см. таблицу 5 и карты 1, 2, 3 и 4). Эти наблюдения также сопровождались выраженным увеличением относительного количества клеток, экспрессирующих только антиген CD3 (без экспрессии маркеров CD56 и CD16), и клеток, совместно экспрессирующих маркеры CD56&CD16 и CD3.
В таблице 5 номера пациента 2, 3 и 4 представляют собой одну и ту же пробу крови, но проанализированную соответственно через 2, 6 и 24 часа (до и после обработки). Эта проба показывает, что обработка крови моноклональным антителом к гомологичному участку β-цепи антигена DR, как представляется, вызывает спонтанную выработку клеток CD56+ и CD16+, клеток CD3+ и CD56+ и клеток CD16+CD3-, и эти наблюдения всегда сопровождались исчезновением маркеров В-клеток (CD19, DR, CD56, CD16-CD3-).
Продолжающийся в динамике анализ этой пробы крови до и после обработки показал, что со временем уровни клеток CD56+ и CD16+ снижались, а уровень клеток CD3+ со временем возрастал.
В образцах крови пациента 7 с B-CLL не было выявлено каких-либо изменений количества клеток, экспрессирующих антигены CD56, CD16 и CD3, по сравнению с иммунофенотипическими изменениями, наблюдавшимися в обработанных и необработанных пробах, и это связано с тем, что количество добавленного моноклонального антитела было крайне низким по сравнению с количеством В-лимфоцитов. Однако обработка пробы крови этого пациента в отдельном случае соответствующим количеством моноклонального антитела показала значительное увеличение относительного числа клеток СD3+, СD56+&CD16+ и CD56+ и CDl6+CD3+.
Образцы крови других пациентов с другими состояниями показали различные изменения в уровне этих клеток, и, как представляется, это зависит от количества В-лимфоцитов, присутствующих в крови перед обработкой, длительности обработки и, вероятно, от клинического состояния пациентов.
НАБОР CD45 и CD14
Антиген CD45 присутствует на всех лейкоцитах человека, включая лимфоциты, моноциты, полиморфноядерные клетки, эозинофилы и базофилы в периферической крови, тимусе, селезенке и небных миндалинах, и предшественники лейкоцитов в костном мозге.
CD14 присутствует на 70-93% нормальных моноцитов периферической крови, на 77-90% фагоцитов плевральной или брюшинной жидкости. Этот антиген слабо экспрессирован на гранулоцитах и не существует на нестимулированных лимфоцитах, активированных митогеном Т-лимфоцитах, эритроцитах или тромбоцитах.
Антиген CD45 представляет собой семейство белковых тирозинфосфатаз, и эта молекула взаимодействует с внешними стимулами (антигенами) и влияет на передачу сигнала через членов семейства Scr, ведущую к регуляции роста и дифференцировки клеток.
Участие β-цепи антигенов DR в обработанных пробах крови, особенно в образцах, полученных у пациентов с B-CLL, свидетельствует о том, что такая обработка воздействует на уровень антигенов CD45 на В-лимфоцитах. Представляется, что иммунофенотипические изменения в целом, которые имеют место при стимуляции β-цепи антигена DR, обусловливают появление различных типов клеток, которые могут быть разделены на основе уровня экспрессии CD45 и CD14, а также морфологии по данным определения прямого рассеяния и бокового рассеяния (соответственно размер и зернистость), и эти результаты представлены в таблице 6 и картах (1, 2, 3, 4 и 5).
При обработке относительное количество клеток с низким уровнем CD45 (при сравнении с необработанными пробами) значительно увеличивалось, так же как относительное количество клеток, совместно экспрессирующих антигены CD45 и CD14. Этот тип иммунофенотипических изменений совпадал с уменьшением относительного количества клеток с высоким уровнем CD45 (по сравнению с необработанными пробами). Однако эта последняя популяция клеток может далее разделяться на основе морфологии и степени экспрессии CD45. Один тип клеток был крайне многочисленным и имел крайне высокие уровни антигена CD45 по сравнению с остальными клетками, представленными в картах (см. карты 1, 2, 3 и 4). При анализе этого набора после обработки в динамике (см. таблицу, пациент 2, 3 и 4, и карты) относительное количество клеток CD45+ первоначально резко падало со временем, вызывая появление клеток с низким уровнем CD45. Однако анализ крови через 24 часа показал противоположную ситуацию.
Пробы 5 и 7 выявляют иммунофенотипические изменения, противоположные тем, которые были получены с другими пробами, взятыми у других пациентов с B-CLL, и это связано с тем, что анализ проб проводился на гораздо более ранних стадиях инкубации с моноклональным антителом. Фактически последовательный анализ образцов крови после обработки свидетельствует о том, что иммунофенотипические изменения, происходящие c В-лимфоцитами, являются зависимыми от времени, потому что они отражают стадию развития, и иммунофенотипические изменения, определенные во время X, не будут такими же, как во время Х-плюс (будучи индуцированными, они не являются неизменными). Однако эти типы изменений должны происходить более строго определенным образом в организме, иначе бы возникла иммунопатология. Влияние обработки проб крови от других пациентов со злокачественными заболеваниями, не связанными с В-клетками, показывает различные изменения иммунофенотипов клеток, и это связано с тем, что В-лимфоциты присутствуют в меньшем количестве. Однако обработка обогащенных фракций В-лимфоцитов, полученных у здоровых доноров крови, показывает иммунофенотипические изменения, аналогичные изменениям, полученным при B-CLL с большим количеством В-лимфоцитов.
НАБОР CD8 И CD3
Антигенная детерминанта CD8 взаимодействует с молекулами класса I МНС, что приводит к возросшей адгезии между Т-лимфоцитами CD8+ и клетками-мишенями. Этот тип взаимодействия усиливает активацию покоящихся лимфоцитов. Антиген CD8 соединен с белковой протеинкиназой (p56ick), и в свою очередь комплекс CD8/p56ick может играть роль в активации Т-лимфоцитов.
Обработка проб крови, полученных у пациентов с B-CLL, моноклональным антителом к В-цепи, вызывает значительное увеличение относительного количества клеток, положительных по CD3CD8 и CD3 (весьма вероятно, положительных по CD4CD3), что более ясно указывает на то, что двойные положительные клетки, генерированные первоначально, подвергаются развитию в зрелые Т-лимфоциты. Это процесс, который может быть прямо измерен с помощью антигенов CD19 и DR и косвенно - с помощью антигенов CD8-CD3-. Представляется, что динамическая серийная оценка образцов обработанной крови одного и того же пациента согласуется с процессом, который идентичен развитию тимоцитов (таблица 7, пациент 2, 3 и 4, и карта 1).
Относительное количество клеток CD8+ со временем возрастает в обработанных и необработанных образцах, но в большей степени в необработанных образцах. С другой стороны, относительное количество клеток СD8+CD3+ уменьшается со временем в необработанных образцах. Однако относительное количество клеток CD3+ увеличивается в обработанных образцах крови при измерении в динамике, и эти типы клеток высоко соответствуют одиночно позитивным клеткам CD4+CD3+, более зрелой форме тимоцитов. Кроме того, поскольку эти образцы были также иммунофенотипированы другими наборами (упомянутыми выше в таблицах 3, 4, 5 и 6), общие изменения активно вовлекают В-клетки в генерацию предшественников и потомков Т-лимфоцитов.
Пробы крови от пациента с B-CLL (номер 2, 3 и 4, таблицы 1, 2, 3, 4, 5, 6, 7) в отдельных аликвотах не обрабатывали ничем, обрабатывали связанным с ПЭ моноклональным антителом к гомологичному участку β-цепи антигена DR и несвязанной формой того же моноклонального антитела. При сравнении обработка антигеном, связанным с ПЭ, не указывает на изменения относительного количества клеток, положительных по CD3, и связанных маркеров, таких как CD4, которые наблюдались в значительных количествах, когда тот же образец крови был обработан несвязанной формой антитела. Однако при измерении в динамике отмечалось увеличение количества клеток, положительных по CD45, без экспрессии антигена DR на их поверхности (см. таблицу 8). Эти данные были аналогичны данным, полученным в необработанных пробах при иммунофенотипировании в динамике (таблица 6). Кроме того, относительное количество клеток, экспрессирующих низкий уровень CD45, со временем уменьшалось - феномен, который также отмечался в необработанных пробах (при измерении в динамике) одного и того же пациента (см. карту 1А).
С. СРАВНЕНИЕ ВЛИЯНИЯ ДРУГИХ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ С РАЗЛИЧНОЙ СПЕЦИФИЧНОСТЬЮ НА Т-ЛИМФОПОЭЗ
НАБОР CD19 И CD3
Обработка образцов крови моноклональным антителом к гомологичному участку α-цепи антигена DR и гомологичному участку антигенов Класса I MHC уменьшала количество клеток CD3+ и увеличивала количество клеток CD19+. Обработка той же крови моноклональным антителом к гомологичному участку β-цепи антигена DR уменьшала количество клеток CD19+ и увеличивала количество клеток CD3+. Обработка последним моноклональным антителом с циклофосфамидом выявила такой же эффект (таблица 14, пациент 5/6 с B-CLL через 2 ч после обработки).
Продолжающийся анализ клеток CD19+ и CD3+ в тех же образцах выявил дальнейшее увеличение относительного количества клеток CD3+ только в крови, обработанной моноклональным антителом к гомологичному участку β-цепи антигена DR (таблица 14, пациент 5/6 с B-CLL, через 24 ч после обработки). Однако продолжающийся анализ (через 24 часа, пациент 5/6, таблица 14) проб крови, обработанных циклофосфамидом плюс моноклональное антитело к β-цепи антигена DR, выявило устранение изменений относительного количества клеток CD19+ и CD3+ по сравнению с количеством, наблюдавшимся после периода инкубации 2 часа в точно таких же условиях.
В целом обработка образцов крови одного и того же пациента моноклональным антителом к гомологичному участку α-цепи антигена DR или моноклональным антителом к гомологичному участку α-цепи антигена класса I показывает увеличение относительного количества клеток CD19+ (общий В-маркер) при сравнении с необработанным образцом. Относительное количество клеток CD19-CD3- незначительно уменьшалось в пробах крови, обработанных моноклональным антителом к гомологичному участку α-цепи антигена DR или моноклональным антителом к антигенам класса I (см. таблицу 14 и карты 2, 3 и 4). Обработка образцов крови пациента 09 моноклональным антителом к антигенам класса I увеличивала относительное количество клеток CD3+ и слегка уменьшала относительное количество клеток CD19+ и CD19-CD3-. Однако обработка обогащенного препарата В-лимфоцитов, полученных у здоровых доноров крови, моноклональным антителом к гомологичному участку β-цепи или α-цепи антигена DR показала иммунофенотипические изменения, аналогичные изменениям, полученным у пациента с B-CLL.
Лечение пациента с HIV+ и дефицитом IgA моноклональным антителом к β-цепи антигена DR увеличивала относительное количество клеток CD3+ и слегка уменьшала относительное количество клеток CD19+. Однако обработка того же образца крови моноклональным антителом к гомологичному участку антигена класса I не давала такого же эффекта. Обработка образцов крови, полученных у пациентов (34/BD и 04/BD) с дефицитом В-клеток, показала различные иммунофенотипические изменения при обработке моноклональным антителом к гомологичному участку β-цепи антигена DR, антигенам класса I и антигену CD4.
НАБОР CD4 И CD8
Образцы крови, анализ которых проводили с использованием набора CD19 и CD3 (таблица 14), также иммунотипировали набором CD4 и CD8 (таблица 15). Представляется, что оба набора согласуются и подтверждают друг друга. Инкубация в течение 2 часов образцов крови пациентов с B-CLL (таблица 15, пациенты 5/6 и 10, карты 2, 3 и 4) моноклональным антителом к гомологичному участку β-цепи антигена DR или этим моноклональным антителом плюс циклофосфамид увеличивала относительное количество клеток CD8+ и CD4+ и клеток, экспрессирующих оба маркера. С другой стороны, обработка тех же образцов моноклональным антителом к гомологичному участку α-цепи антигена DR или к гомологичному участку α-цепи антигена класса I, не вызывала таких же эффектов.
Сравнение иммунофенотипических тенденций, полученных после периодов инкубации 2 и 24 часа с моноклональным антителом к гомологичному участку β-цепи антигена DR плюс циклофосфамид, выявила обратные изменения относительного количества клеток, положительных по CD4 и CD8 (таблица 15, пациент 5/6 с B-CLL через 2 и 24 часа), и такие изменения соответствовали изменениям, полученным при анализе такого же образца крови с набором CD19 и CD3 (таблица 14, тот же пациент). Более поздние данные показывают, что последующая дифференцировка обратима, поскольку недифференцированные клетки могут дифференцироваться в Т-лимфоциты или В-лимфоциты.
НАБОР DR И CD3
Иммунофенотипические изменения, полученные с набором DR и CD3 (таблица 16), подтверждают данные, полученные с набором CD19 и CD3 (таблицы 14 и 15 и карты 2, 3 и 4), которые следовали за обработкой тех же образцов крови моноклональными антителами к гомологичному участку бета- или альфа-фрагмента антигена DR или моноклональным антителом к антигенам класса I или моноклональным антителом к β-цепи антигена DR плюс циклофосфамид при анализе через 2 часа.
На основании этих результатов представляется, что моноклональное антитело к гомологичному участку β-цепи антигена DR обладает высокой способностью запускать выработку клеток, позитивных по CD3, из клеток DR+.
Кроме того, обработка наподобие той, при которой вовлекается α-цепь антигенов DR или β-фрагмент молекулы в комбинации с циклофосфамидом (длительное время инкубации), способствовали увеличению относительного количества клеток CD19+ или клеток DR+.
НАБОР CD56&16 И CD3
Обработка проб крови, особенно проб больных с B-CLL с высоким уровнем В-лимфоцитов, моноклональным антителом к гомологичному участку β-цепи антигена DR увеличивала относительное количество клеток, позитивных по CD56&16.
У этих пациентов относительное количество клеток CD3+ и CD56+ и CD16+CD3- также возрастало после обработки образцов крови моноклональным антителом к β-цепи, подтверждая ранее имевшиеся наблюдения, отмеченные при таком же воздействии, когда такие же образцы крови анализировали наборами CD3 и CD19 и DR и CD3.
НАБОР CD45 И CD14
Образцы крови, обработанные моноклональными антителами к β- и α-цепям антигена DR или к β-цепи плюс циклофосфамид или к антигенам класса I, анализировали также набором CD45 и CD14 (таблица 18). Определение низкого по CD45, высокого по CD45 и среднего по CD45 является произвольным. Обработка образца крови 5/6 (через 2 часа) моноклональными антителами к β-цепи антигена DR или этим моноклональным антителом плюс циклофосфамид генерировала клетки, низкие по CD45+, и увеличивала относительное количество клеток со средним уровнем CD45+. Однако первая из указанных обработок увеличивала относительное количество клеток с высоким уровнем CD45+, а последняя из указанных обработок уменьшала относительное количество клеток со средним уровнем CD45+, и эти изменения, как оказалось, зависели от времени.
В образцах крови от пациента 5/6 и 10 (B-CLL) после обработки моноклональным антителом к антигенам класса I выявлено уменьшение относительного количества клеток со средним уровнем CD45+, и аналогичные данные были отмечены в образцах крови 09 и HIV+ после такой же обработки по сравнению с необработанными пробами. Обработка образцов крови пациентов с HIV+ и IgA/D моноклональным антителом к антигену класса I приводила к увеличению относительного числа клеток с низким уровнем CD45+ по сравнению с необработанными образцами или образцами, обработанными моноклональным антителом к β-цепи антигена DR. Однако в образцах крови этих пациентов выявлено уменьшение относительного числа клеток со средним уровнем CD45+ после обработки моноклональным антителом к гомологичным участкам β-цепи антигена DR. Количество клеток со средним уровнем CD45+ в пробах крови пациента IgA/D после обработки моноклональным антителом к антигену класса I возрастало. Клетки, которые были очень большими, насыщенными гранулами и экспрессировали интенсивные уровни антигена CD45, отмечались в образцах крови, обработанных моноклональным антителом к гомологичному участку β-цепи антигена DR антигенов класса II МНС (см. карты 1,2, 3, 4 и 5).
НАБОР CD8 И CD28
Антиген CD8 присутствует приблизительно на 60-80% Т (CD3+)-лимфоцитах периферической крови, 50% Т-лимфоцитах CD8+ и 5% незрелых тимоцитах CD3-. Во время созревания тимоцитов экспрессия антигена CD28 возрастает от низкой плотности на большинстве зрелых тимоцитов CD4+CD8+ до более высокой плотности на фактически всех зрелых тимоцитах CD3+, CD4+ или CD8+. Клеточная активация далее усиливает плотность антигена CD28. Экспрессия CD28 также делит лимфоциты CD8+ на две функциональные группы. Лимфоциты CD8+CD28+ опосредуют аллоантиген-специфическую цитотоксичность, которая ограничена классом I главного комплекса гистосовместимости (МНС). Подавление клеточной пролиферации опосредовано субпопуляцией CD8+CD28+. Антиген CD28 представляет молекулу клеточной адгезии и функционирует в качестве лиганда для антигена В7/ВВ-1, который присутствует на активированных В-лимфоцитах.
Обработка образцов крови пациентов (таблица 19, пациенты 5/6 и 8) с В-CLL моноклональным антителом к гомологичному участку β-цепи антигена DR увеличивала относительное число клеток CD8+, CD28+ и CD8+CD28+, а все другие виды обработки не увеличивали.
НАБОР CD34 И CD2
Антиген CD34 присутствует на незрелых гематопоэтических клетках-предшественниках и всех гематопоэтических колониеобразующих клетках в костном мозге, включая унипотентные (CFU-GM, BFU-E) и плюрипотентные предшественники (CFU-GEMM, CFU-Mix и CFU-бласт). CD34 также экспрессируется на стромальных клетках-предшественниках. В- и Т-лимфоидные предшественники с терминальной дезоксинуклеотидилтрансферазой (TdT) в нормальном костном мозге являются CD34-. Антиген CD34 присутствует на ранних миелоидных клетках, которые экспрессируют антиген CD33, но не имеют антигенов CD14 и CD15, и на ранних эритроидных клетках, которые экспрессируют антиген CD71 и слабо экспрессируют антиген CD45. Антиген CD34 также обнаруживается на капиллярных эндотелиальных клетках и приблизительно на 1% тимоцитов человека. Нормальные лимфоциты, моноциты, гранулоциты и тромбоциты периферической крови не экспрессируют антиген CD34. Плотность антигена CD34 является самой высокой на ранних гематопоэтических клетках-предшественниках и снижается по мере созревания клеток. Антиген отсутствует на полностью дифференцированных гематопоэтических клетках.
Некоммитированными клетками-предшественниками CD34+ являются CD38-, DR-, и они не имеют специфичных для линии антигенов, таких как CD71, CD33, CD10 и CD5, тогда как клетки CD34+, которые являются линейно коммитированными, с большой плотностью экспрессируют антиген CD38.
Большинство клеток CD34- реципрокно экспрессируют либо антиген CD45RO, либо антиген CD45RA. Приблизительно 60% клеток острого В-лимфоидного лейкоза и острого миелоидного лейкоза экспрессируют антиген CD34. Антиген не экспрессируется на клетках хронического лимфолейкоза (В- или Т-линии) или лимфом. Антиген CD2 присутствует на Т-лимфоцитах и субпопуляции лимфоцитов - естественных киллеров (NK).
Результаты показаны на картах 2, 3 и 5.
Анализ образцов крови пациента с B-CLL (таблица 20, пациент 5/6 через 2 часа) после обработки моноклональными антителами к β-цепи антигена DR или α-цепи того же антигена выявил выраженное увеличение относительного числа клеток CD34+ и CD34-CD2- после обработки первым из указанных антител. Поскольку те же образцы крови были иммунотипированы упомянутыми выше наборами (см. таблицы от 14 до 19) по другим маркерам, наблюдаемое здесь увеличение относительного числа клеток CD34+ и CD34-CD2-, как оказалось, совпадает с увеличением относительного числа одиночно позитивных (SP) клеток CD4+CD8+, CD8+CD3+ и CD4+CD3+. Более того, эти данные, которые вероятнее всего являются исключительными в плане вовлечения β-цепи антигена HLA-DR, прямо подтверждают, что процесс запускает Т-лимфопоэз через регрессию В-лимфоцитов.
При анализе такой же обработки через 24 часа уровни клеток CD34+, как представляется, снижались для обеспечения дальнейшего увеличения относительного числа Т-лимфоцитов. Процесс ретродифференцировки, который первоначально обеспечивал Т-лимфопоэз, может быть отменен для обеспечения В-лимфопоэза. Первый из указанных феноменов наблюдался после 2-часового периода инкубации с моноклональным антителом к β-цепи антигена HLA-DR с циклофосфамидом, тогда как последний из указанных процессов был отмечен после 24 часового времени инкубации при той же обработке в той же пробе (карта 2).
Обработка проб крови пациента HIV+ (таблица 20, пациент HIV+) моноклональным антителом к β-цепи антигена HLA-DR значительно увеличивала относительное количество клеток CD34+ и CD2+CD34+, и это же давала совместная обработка того же образца крови моноклональным антителом к β-цепи антигена HLA-DR и моноклональным антителом к α-цепи того же антигена. Однако обработка этого образца крови моноклональным антителом к α-цепи антигена HLA-DR не влияла на уровень клеток CD34+. Обработка проб крови от 6-дневного младенца (BB/ST, таблица 20), который обследовался в то время для выявления лейкоза и у которого было очень большое количество атипичных клеток (бластов) в крови, моноклональным антителом к β-цепи антигена HLA-DR или моноклональным антителом к α-цепи того же антигена или же обоими этими моноклональными антителами, добавляемыми вместе, приводила к следующим иммунофенотипическим изменениям.
При анализе необработанных проб крови относительное число клеток CD34+ и DR+ заметно увеличивалось, и далее при обработке моноклональным антителом к β-цепи увеличивалось относительное число клеток CD34+, однако было отмечено уменьшение этого показателя после обработки моноклональным антителом к α-цепи антигена HLA-DR или обработки моноклональными антителами к α- и β-цепям молекулы при их совместном добавлении. Однако последняя обработка увеличивала относительное число клеток CD34+CD2+, и происходило противоположное, когда тот же образец крови был обработан только моноклональным антителом к β-цепи антигена HLA-DR. При анализе обработанных и необработанных аликвот крови одного и того же пациента через 24 часа относительное число клеток CD34+ уменьшалось при всех указанных выше способах обработки, за исключением того, что оно поддерживалось на гораздо более высоком уровне при обработке моноклональным антителом к β-цепи антигена HLA-DR. Последняя обработка продолжала снижать относительное число клеток CD34+CD2+через 24 часа.
Эти результаты показывают, что вовлечение антигена HLA-DR через β-цепь способствует продукции большего количества клеток CD34+ из пула CD2+CD34- или из более зрелых типов клеток, таких как В-лимфоциты пациентов с B-CLL, и эти результаты показывают, что этот тип обработки вызывает ретродифференцировку. Однако иммунофенотипирование проб крови через 24 часа свидетельствует о том, что эти типы клеток, вероятнее всего, в целом принадлежат к другой линии, а в этом случае клетки, очевидно, принадлежат или, скорее, сами по себе коммитируются в миелоидную линию, что наблюдалось при анализе пробы крови, обработанной набором CD7 и CD13&33.
Морфология изменяет иммунофенотипические характеристики В-лимфоцитов B-CLL и обогащенных фракций здоровых лиц (с использованием бусин CD19) после обработки моноклональными антителами к гомологичным участкам β-цепи антигенов класса II МНС. Они сопровождались изменением морфологии В-лимфоцитов. Наблюдалось, что В-лимфоциты, колонизирующие стеклянные покровные стекла, в необработанных мазках крови замещались гранулоцитами, моноцитами, большими количествами примитивно выглядевших клеток и имевших ядра эритроцитов. Ни в обработанных, ни в необработанных мазках крови не наблюдалось картины митоза или значительной гибели клеток.
Результаты, представленные в таблице 20, также демонстрируют еще одну важную находку, состоящую в том, что в соответствии со способами настоящего изобретения можно получить недифференцированную клетку путем ретродифференцировки более зрелой недифференцированной клетки.
D. МИКРОФОТОГРАФИИ
В дополнение к испытанию антигена, как указано выше, способ согласно изобретению контролировался визуально с помощью микроскопа.
В этой связи на фиг.1 представлена микрофотография дифференцированных В-клеток перед применением способа согласно изобретению. На фиг.2 представлена микрофотография недифференцированных клеток, полученных путем ретродифференцировки В-клеток в соответствии с настоящим изобретением, в котором агентом было моноклональное антитело к гомологичным участкам β-цепи антигена HLA-DR. Недифференцированные клетки представлены темно-окрашенными группами клеток. На фиг. 3 представлена микрофотография тех же недифференцированных клеток, но при меньшем увеличении.
Таким образом, фиг.1-3 иллюстрируют ретродифференцировку В-клеток в недифференцированные стволовые клетки с помощью способа настоящего изобретения.
На фиг.4 представлена микрофотография дифференцированных В-клеток перед использованием способа настоящего изобретения. На фиг.5 представлена микрофотография недифференцированных клеток, полученных путем ретродифференцировки В-клеток в соответствии с настоящим изобретением, причем использованным агентом было моноклональное антитело к гомологичным участкам β-цепи антигена HLA-DR. И в этом случае недифференцированные клетки представлены темно окрашенными группами клеток. На Фиг.6 представлена микрофотография образования дифференцированных гранулоцитарных клеток из тех же недифференцированных клеток, что и на фиг.5.
Таким образом, фиг. 4-6 иллюстрируют ретродифференцировку В-клеток в недифференцированные стволовые клетки с помощью способа настоящего изобретения с последующим превращением недифференцированных клеток в новые дифференцированные клетки, относящиеся к линии, отличной от исходных дифференцированных клеток.
Ретродифференцировка Т-клеток в недифференцированные стволовые клетки с помощью способа настоящего изобретения с последующим превращением недифференцированных клеток в новые дифференцированные клетки, относящиеся к линии, отличной от исходных дифференцированных клеток, также прослеживалась с помощью микроскопии.
Е. РЕЗЮМЕ
Вкратце, примеры описывают эксперименты in vitro, в которых выявлены крайне интересные явления, связанные с онтогенезом и развитием Т- и В-лимфоцитов, которые могут быть использованы при генерации стволовых клеток для воздействия на лимфогематопоэз в пробах периферической крови в течение нескольких часов.
Обработка образцов периферической крови, полученных у пациентов с В-клеточным хроническим лимфолейкозом (B-CLL) с высоким уровнем В-лимфоцитов, моноклональным антителом к гомологичному участку β-цепи антигенов класса II вызывала выраженное увеличение относительного числа одиночно позитивных (SP) Т-лимфоцитов и их предшественников, которые были дважды позитивными по маркерным антигенам тимоцитов CD4 и CD8, причем эти клетки экспрессировались одновременно. Однако эти феномены всегда сопровождались значительным уменьшением относительного числа В-лимфоцитов. Этого не наблюдалось, когда те же пробы крови обрабатывали моноклональными антителами к гомологичному участку α-цепи антигенов класса II или к гомологичному участку антигенов класса I.
Как оказалось, обработка цельной крови, полученной у пациентов с В-клеточным хроническим лимфолейкозом (CLL), моноклональным антителом к гомологичному участку В-цепи антигена HLA-DR вызывала развитие Т-лимфопоэза. Этот процесс был отмечен появлением дважды позитивных клеток, совместно экспрессирующих маркеры CD4 и CD8, появлением клеток, экспрессирующих CD34, и одновременным увеличением количества одиночно позитивных лимфоцитов CD4+CD3+ и CD8+CD3+. Более того, иммунофенотипические изменения, которые имели место при генерации таких клеток, были идентичны изменениям, характерным для развития тимоцитов, особенно при изучении в динамике.
Процентное содержание дважды позитивных клеток (DP), генерируемых после 2-часового периода инкубации цельной крови с моноклональным антителом к гомологичным участкам β-цепи антигена DR, уменьшалось со временем, и эти явления сопровождались увеличением процентного содержания одиночно позитивных клеток CD4+CD3+ и CD8+CD3+ одновременно, также и на более поздних сроках, α- и β-цепи TCR были также экспрессированы на этих типах клеток.
Наблюдали постоянную потерю В-лимфоцитами маркеров, таких как CD19, CD21, CD23, IgM и DR, и это совпадало с появлением клеток CD34+ и CD34+CD2+, увеличением количества клеток CD7+, увеличением количества клеток CD8+CD28- и CD28+, увеличением количества клеток CD25+, появлением клеток CD10- и CD34+ и CD34+ и клеток CD19+, увеличением количества клеток CD5+ и клеток, экспрессирующих низкие уровни антигена CD45. Эти изменения были следствием обработки крови моноклональным антителом к гомологичному участку β-цепи антигена HLA-DR.
Иммунофенотипические изменения, связанные с такой обработкой, согласуются с ретродифференцировкой и последующим коммитированием (т.е. рекоммитированием) В-лимфоцитов, потому что большинство лейкоцитов в крови пациентов с B-CLL перед обработкой были В-лимфоцитами. Кроме того, В-лимфоциты пациентов с B-CLL, превращение которых в Т-лимфоциты было индуцировано после обработки циклофосфамидом и моноклональным антителом к β-цепи антигена HLA-DR, можно было снова вернуть к В-лимфоцитному фенотипу после длительной инкубации при такой обработке.
При анализе образцов, обработанных антителом к гомологичному участку β-цепи антигена HLA-DR, с использованием наборов CD16&56 и CD3 и CD8 и CD3 относительное число клеток, экспрессирующих эти маркеры, постоянно увеличивается, причем прирост клеток согласуется с таковым, определяем при применении таких наборов как CD19 и CD3 и DR и CD3. Исследование надосадочной жидкости обработанных и необработанных образцов крови пациентов с инфекцией HIV с использованием нефелометрии и иммуноэлектрофореза позволило выявить повышенные уровни IgG, указывающие на то, что В-клетки, должно быть, прошли через стадию плазматических клеток. Увеличение относительного числа всех указанных выше клеток также сопровождалось появлением клеток среднего размера, насыщенных гранулами, экспрессирующих антигены CD56&16 в крайне больших количествах. Наблюдалось транзиторное появление других клеток, которые были очень крупными и насыщены гранулами, и они были позитивными по CD34 и дважды позитивными по маркерам CD4 CD8. Наблюдались также другие транзиторные клетки, и они были крупными и зернистыми и позитивными по рецепторам CD3 и CD19. CD25, который присутствовал на большинстве В-лимфоцитов, был утрачен и стал экспрессироваться вновь образованными Т-лимфоцитами, увеличение количества которых наблюдалось всегда.
Клетки CD28+CD8+ и CD28+ появлялись после обработки цельной крови пациентов с B-CLL моноклональным антителом к гомологичному участку В-цепи антигена DR. Эти данные получены вследствие обработки крови антителом к гомологичному участку β-цепи антигена HLA-DR.
Т-лимфопоэз, генерированный таким образом, также наблюдался в периферической крови здоровых доноров крови, пуповинной крови, костном мозге пациентов с различными инфекциями, включая лиц с HIV+ и пациентов со СПИДом, в обогащенных фракциях В-лимфоцитов, полученных из проб крови здоровых доноров крови, пациентов с дефицитом IgA и других пациентов с различными другими состояниями. Кроме того, анализ миелоидных маркеров в образцах крови двух пациентов с B-CLL, обработанных антителом к гомологичному участку β-цепи антигена HLA-DR, показал значительное увеличение относительного числа клеток, экспрессирующих миелоидные маркеры, такие как CD13 и CD33. Эти маркеры совместно экспрессировались с антигенами CD56&16 или CD7. Однако на отдельной популяции клеток наблюдалось относительное количество клеток CD7+ с маркерами Т-лимфоцитов и без миелоидных антигенов. Именно эти изменения не отмечались в необработанных образцах или в образцах, обработанных моноклональными антителами к антигенам класса I или к гомологичному участку α-цепи антигена HLA-DR (см. карты 2 и 3). Эти окончательные результаты свидетельствуют о том, что В-лимфоциты, однажды запущенные через β-цепь антигена HLA-DR, способны не только к обратному развитию в клетки-предшественники Т-лимфоцитов, но также способны существовать в рамках миелоидной и эритроидной линий.
Следует отметить, что стволовые клетки, которые получены с помощью способа настоящего изобретения, могут быть стволовыми клетками любой ткани и не обязательно ограничены лимфогематопоэтическими клетками-предшественниками.
Другие модификации настоящего изобретения будут очевидны для специалистов в этой области.
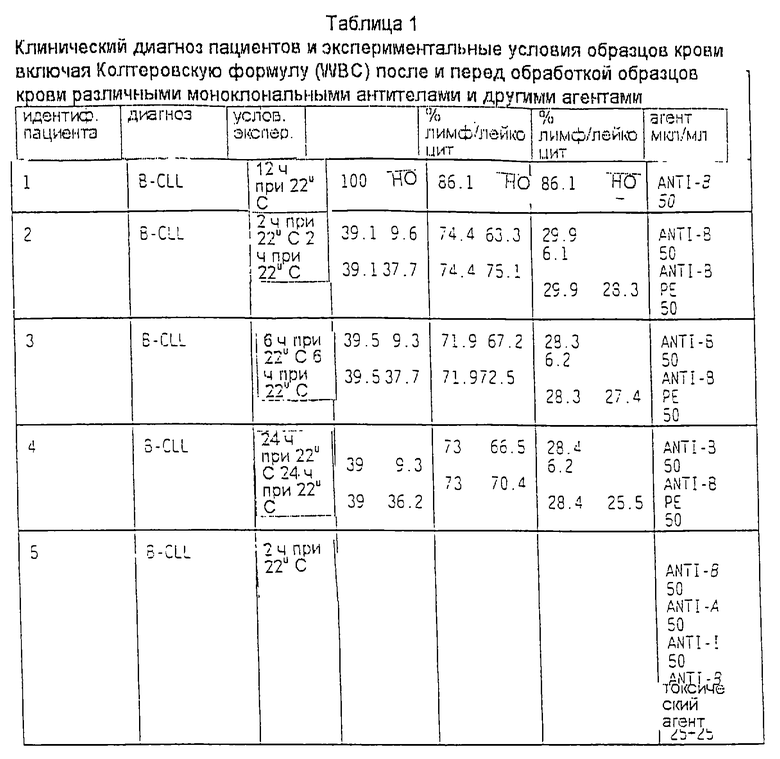
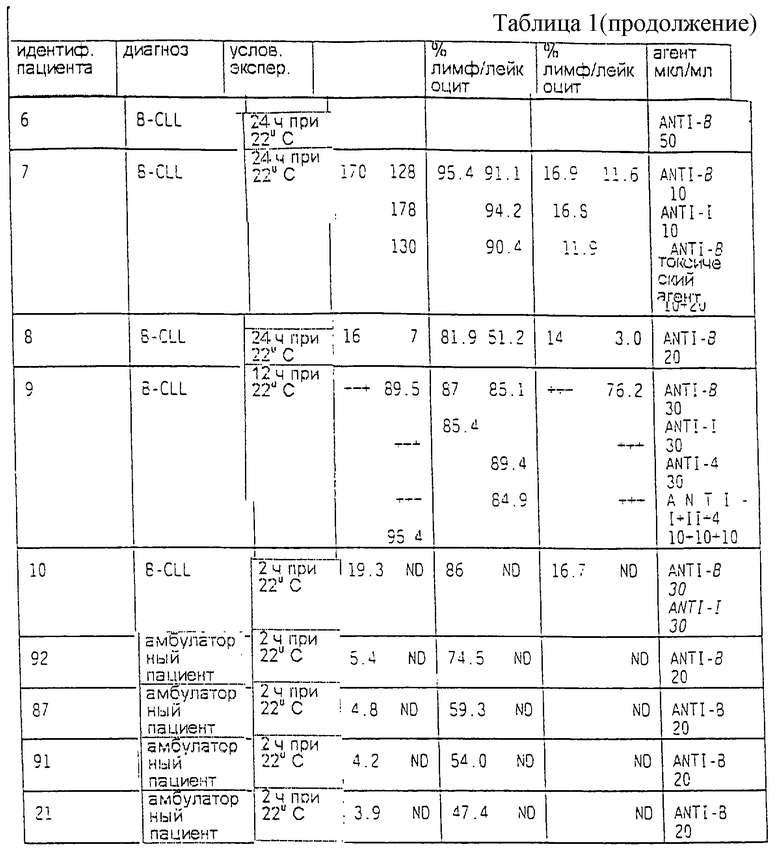
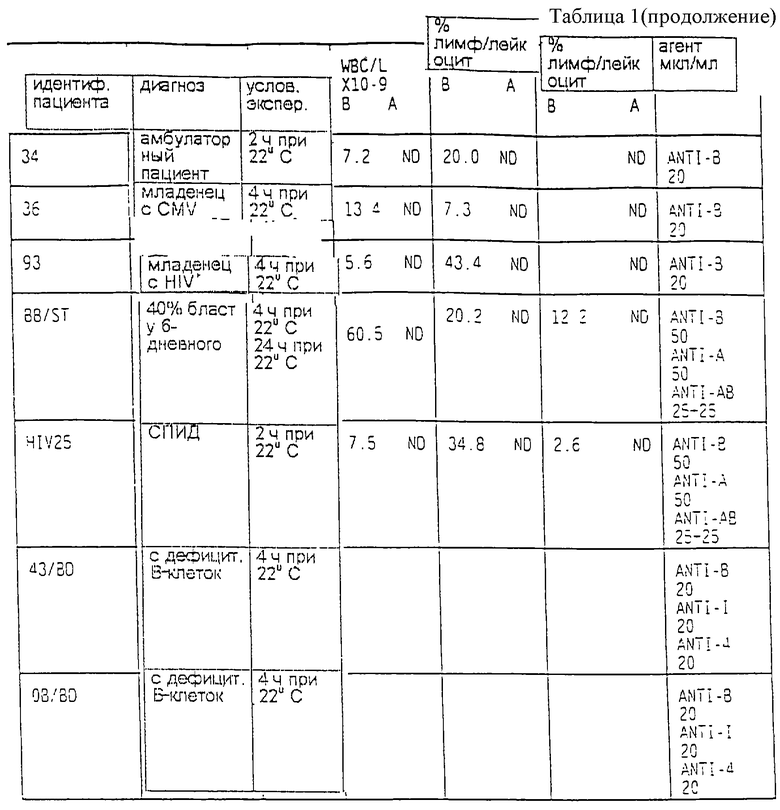

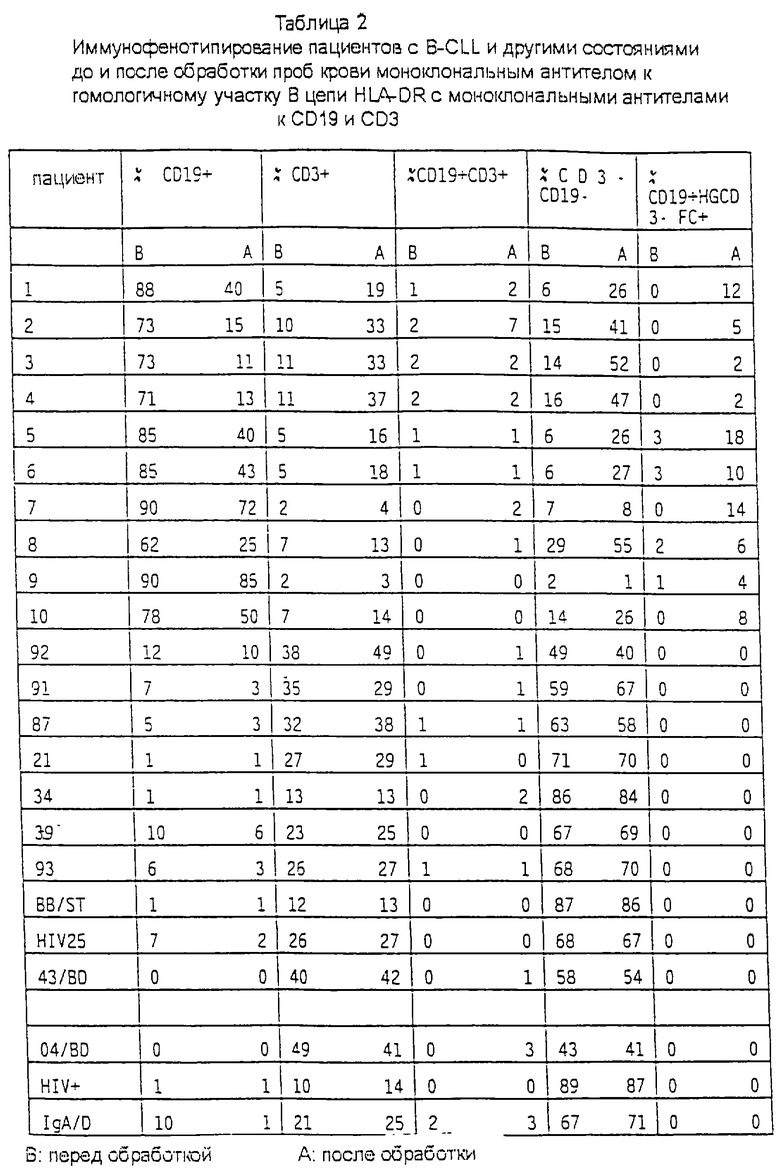
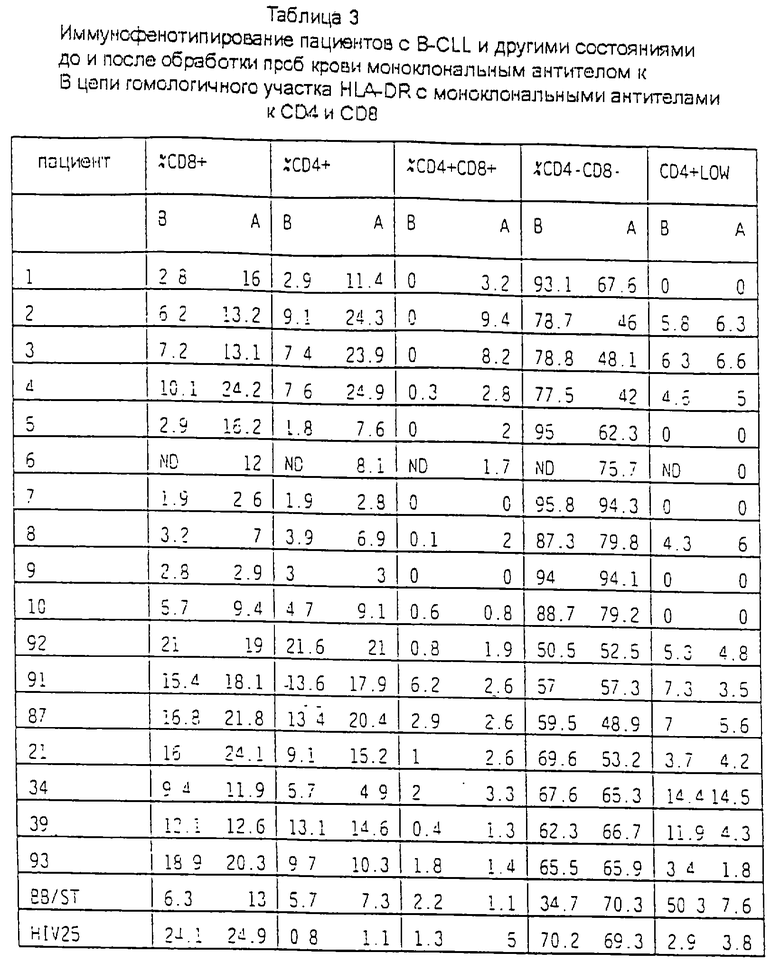
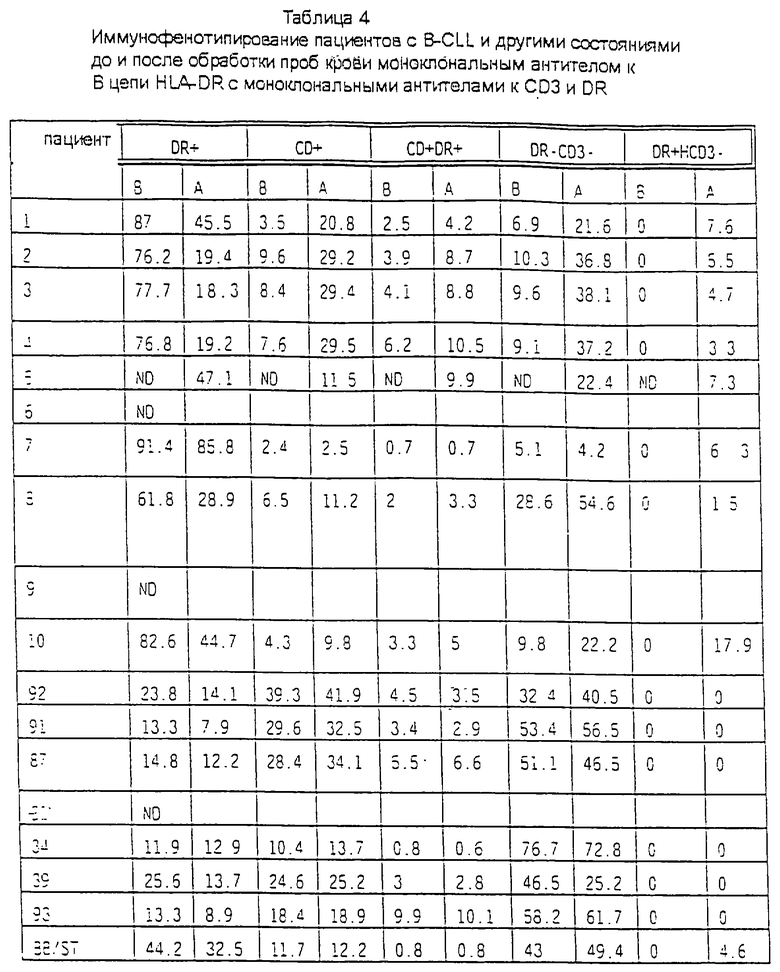
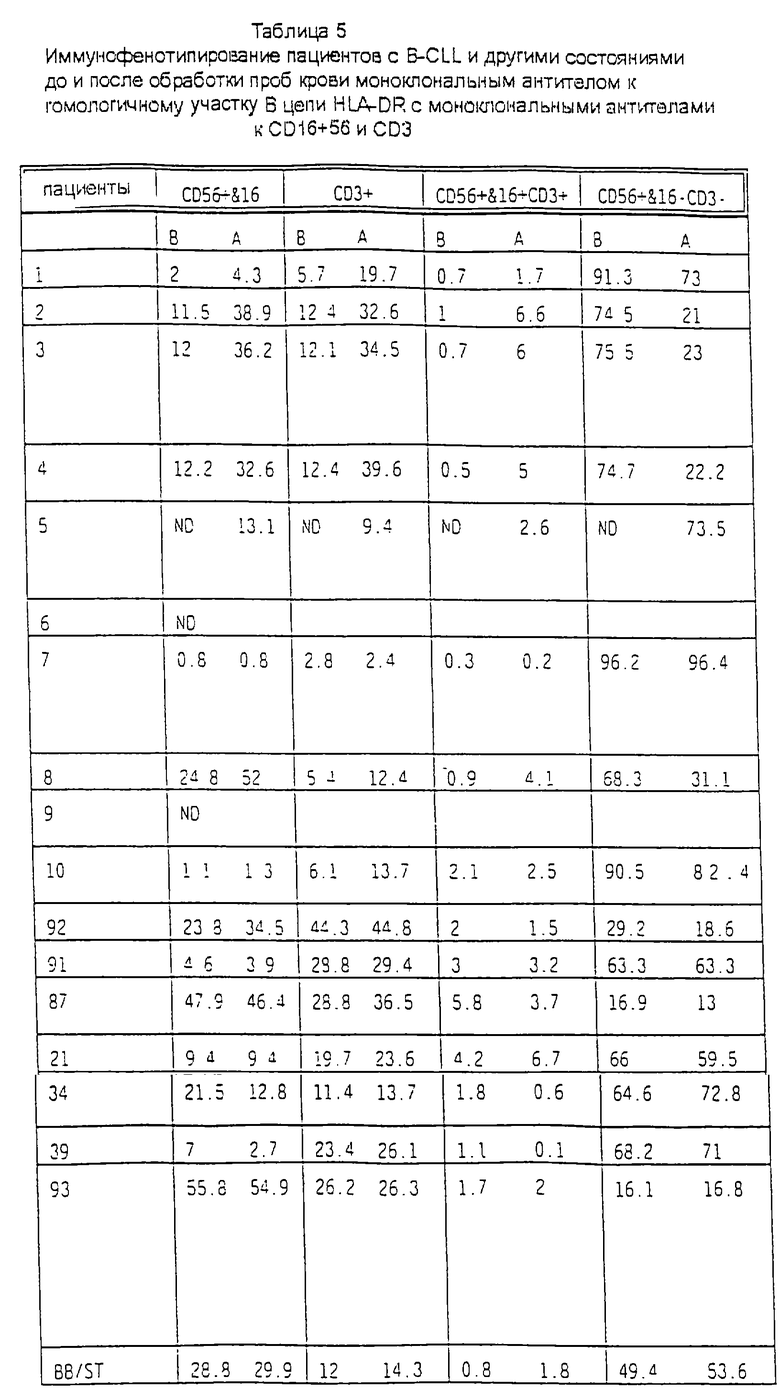
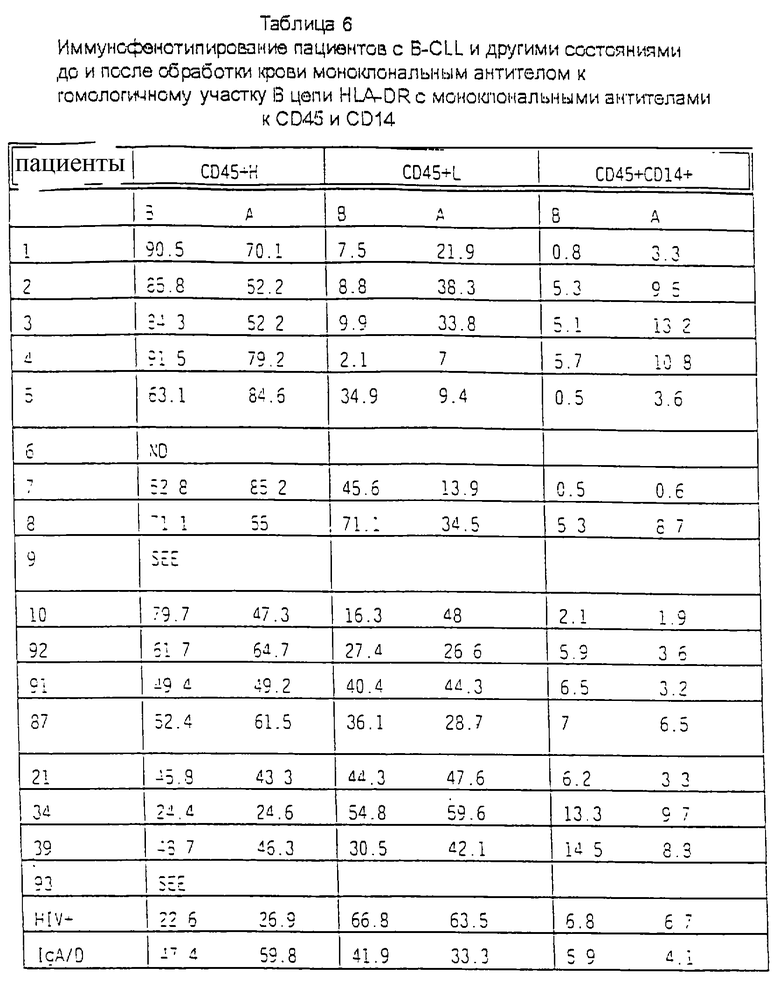
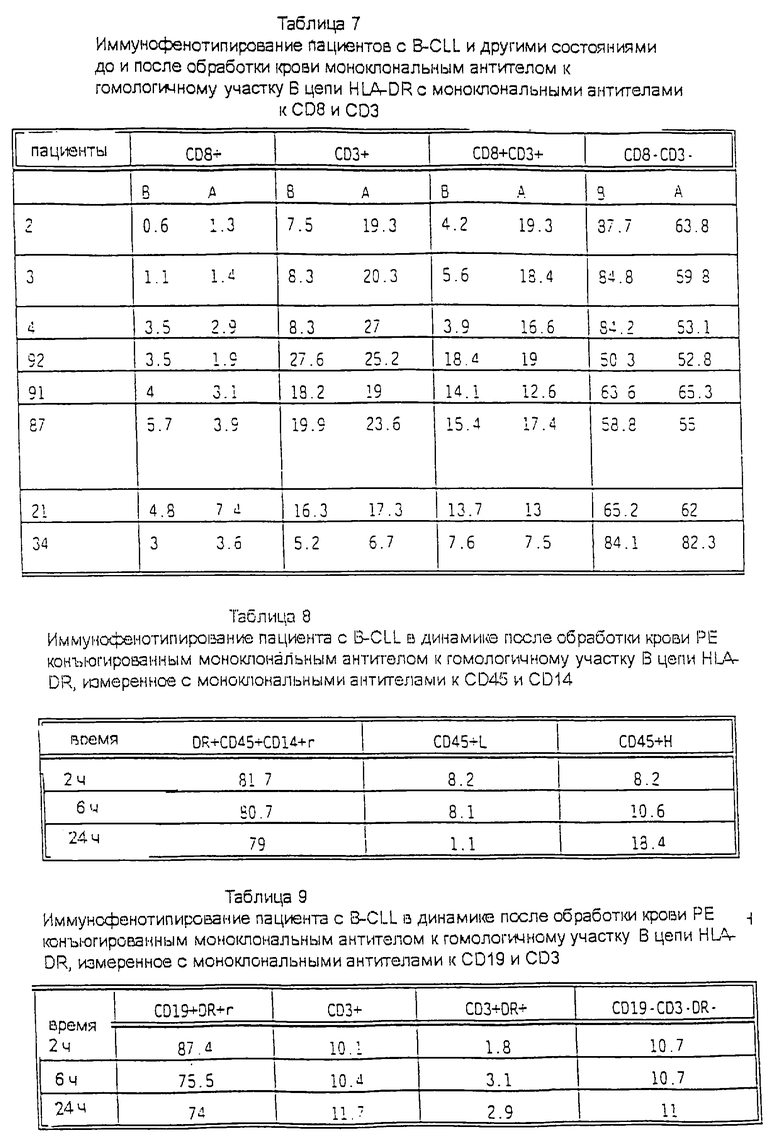
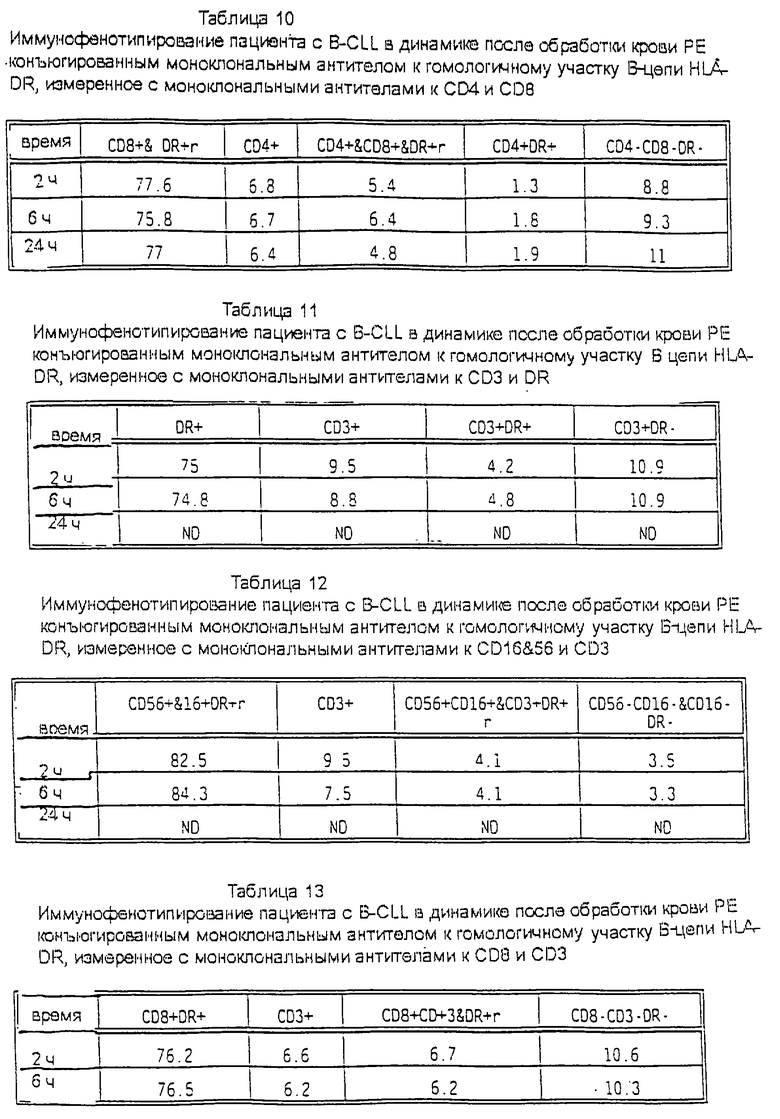

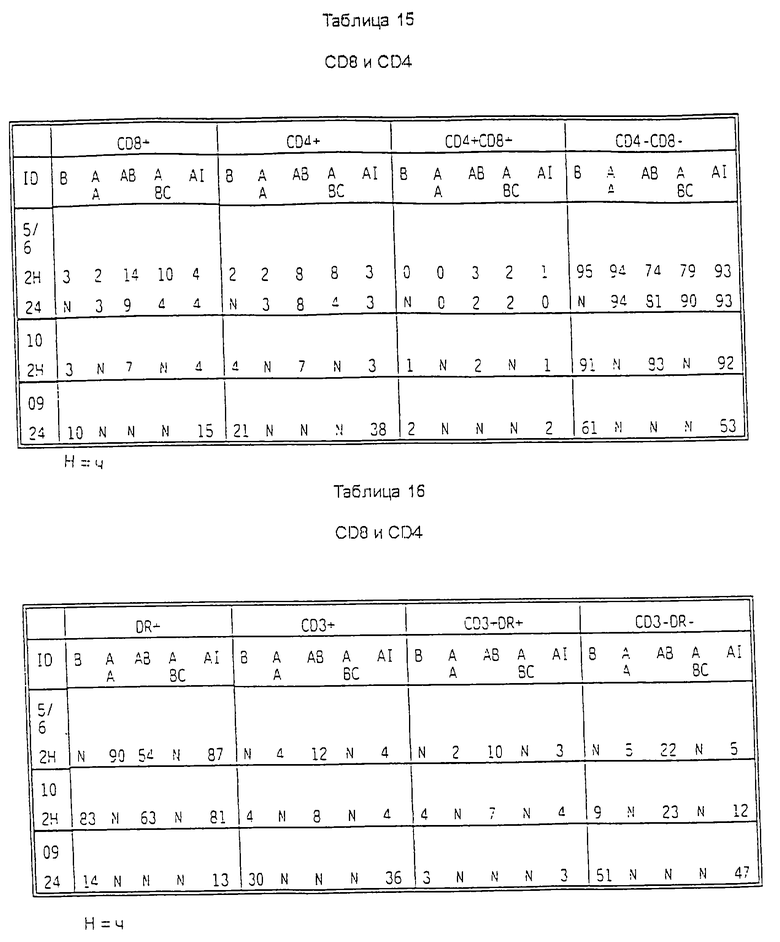
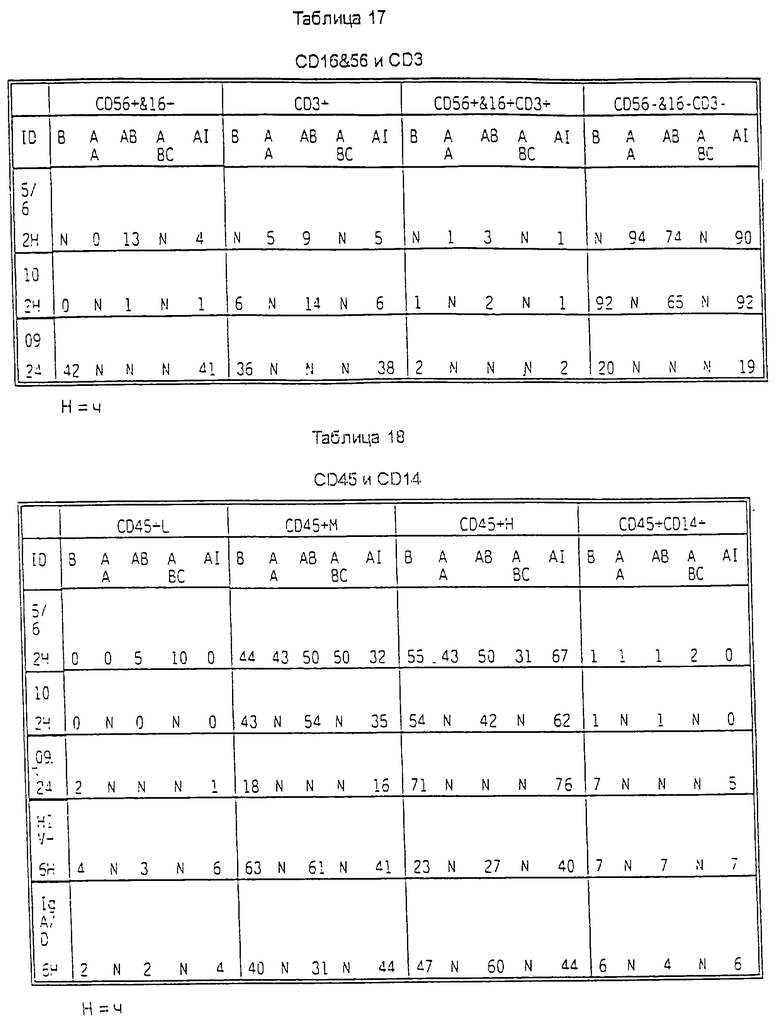
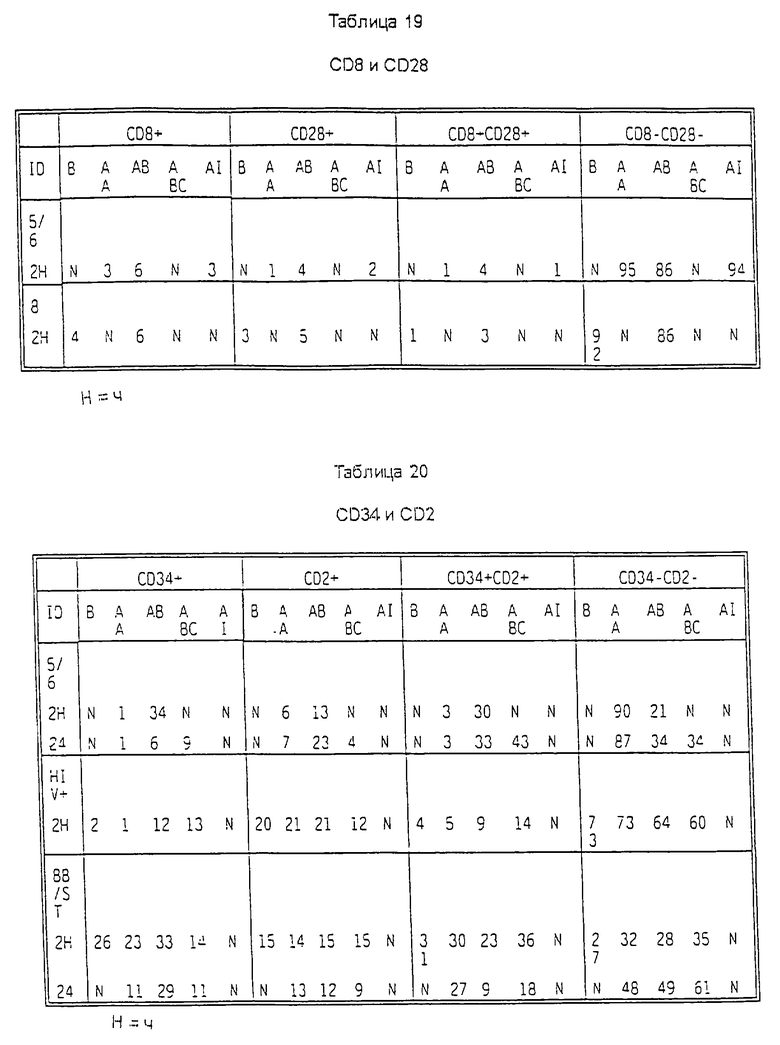

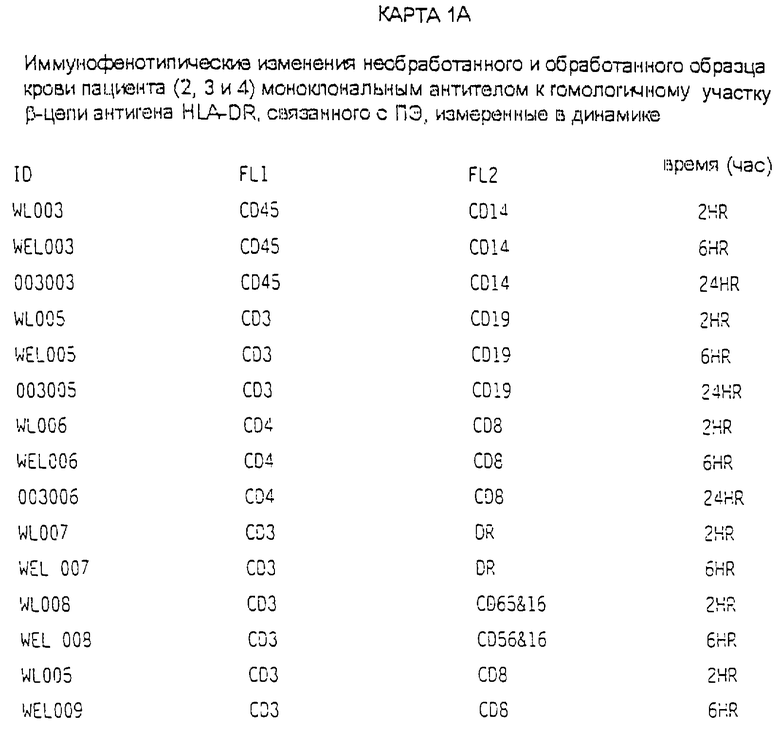
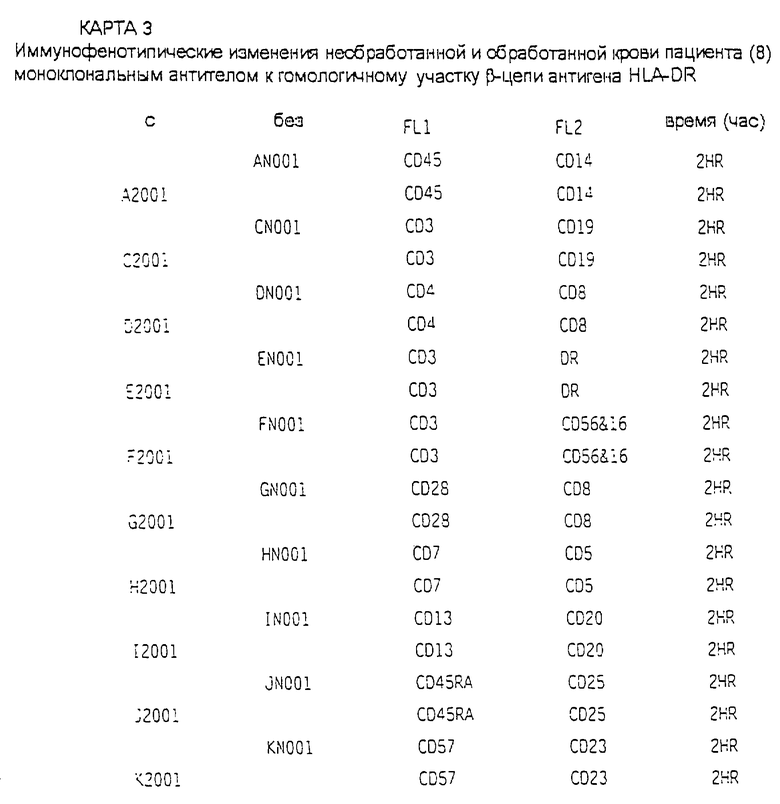

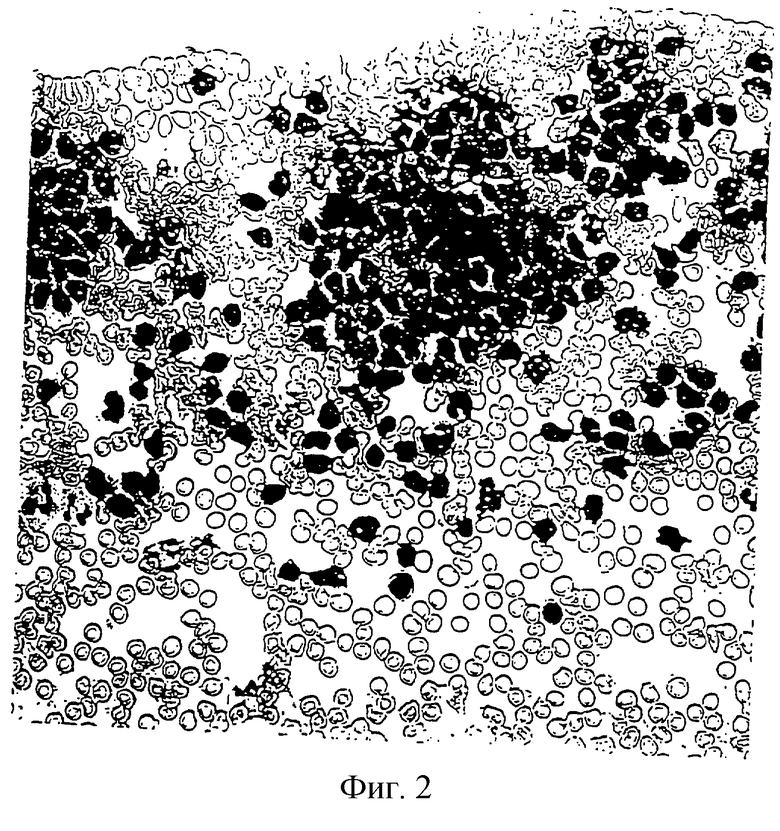

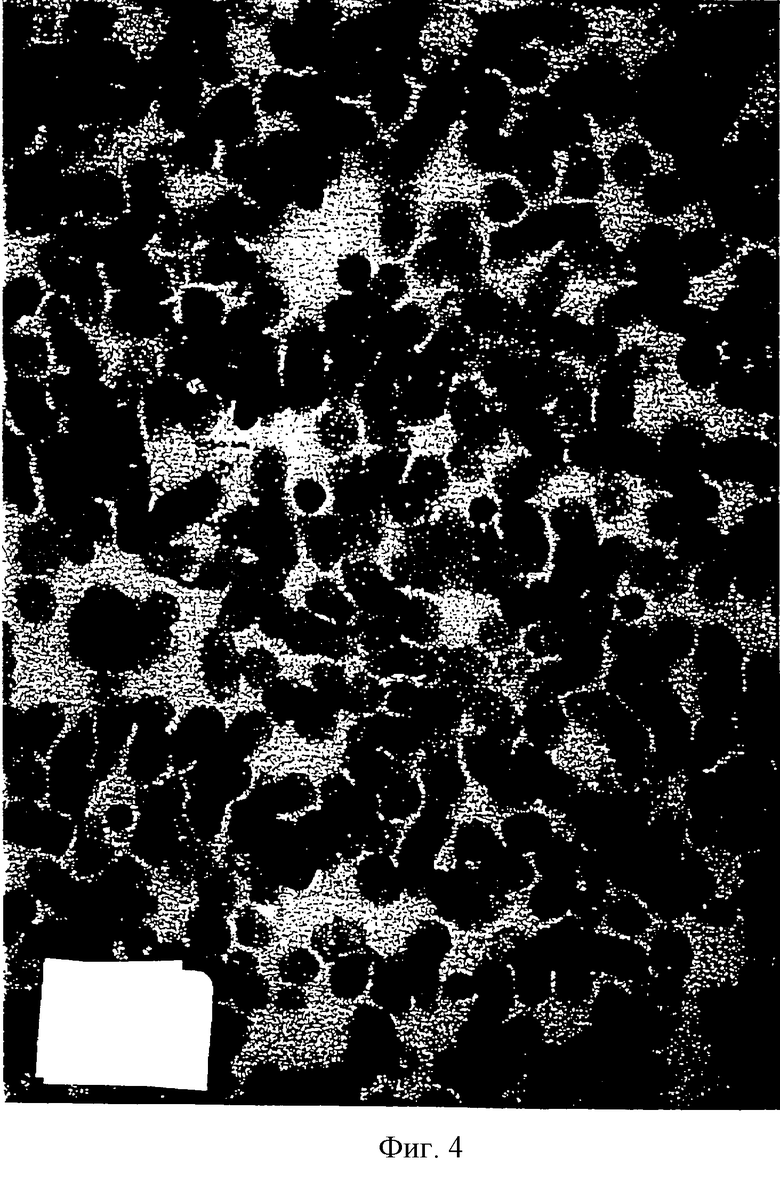
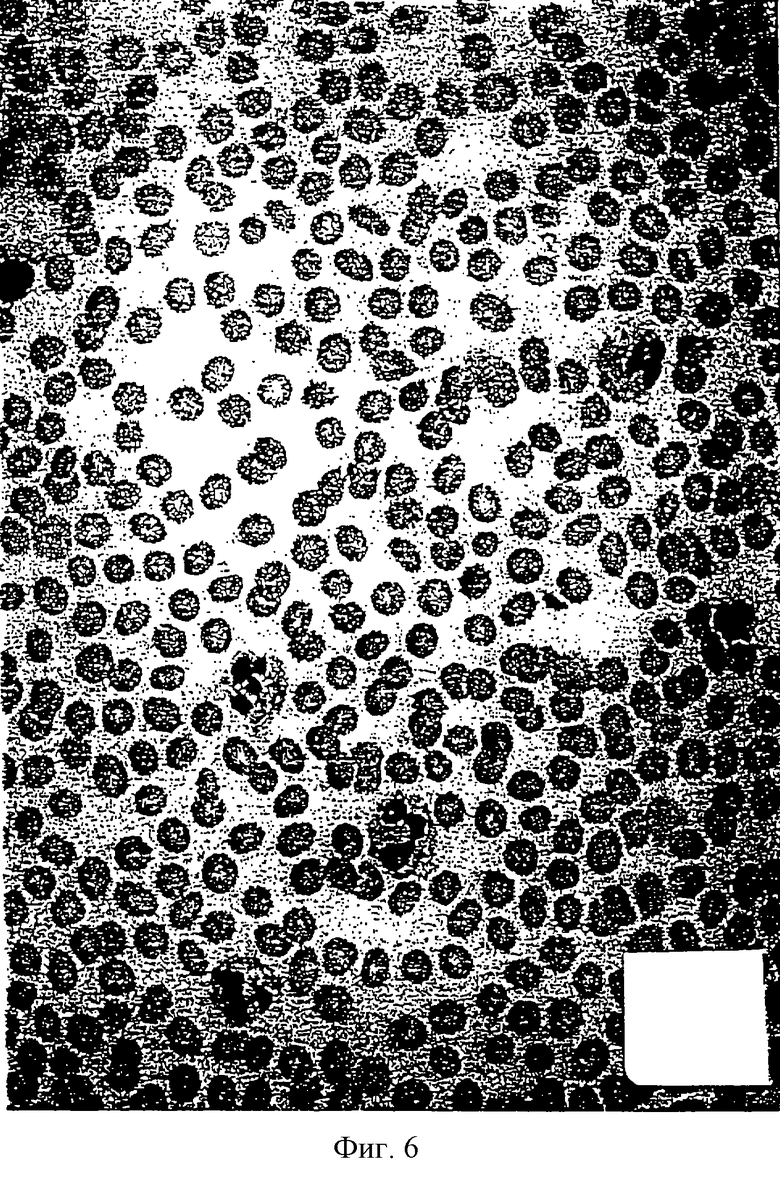
Изобретение относится к медицине и касается способа получения недифференцированной клетки. Сущность изобретения включает прямое или непрямое контактирование более коммитированной клетки, чем недифференцированная клетка с агентом, который вызывает ретродифференцировку более коммитированной клетки в недифференцированную. Преимущество изобретения заключается в разработке способа получения недифференцированных клеток из более коммитированных, 3 с. и 34 з.п.ф-лы, 20 табл., 6 ил.
| US 5132222 A, 21.07.1992 | |||
| US 5229115 A, 20.07.1993 | |||
| US 5436151 A, 25.07.1995 | |||
| Пожарный двухцилиндровый насос | 0 |
|
SU90A1 |
| Экономайзер | 0 |
|
SU94A1 |
| Экономайзер | 0 |
|
SU94A1 |
Авторы
Даты
2003-11-10—Публикация
1996-01-31—Подача