Данное изобретение относится к разработке стратегически важной и новой противомикробной композиции, включающей лекарственные средства на основе α-артитера, хинолонов и подобных соединений, которая может применяться в качестве лекарственной композиции перспективного поколения, направленной против инфекций и одновременно для противодействия развитию у бактерий устойчивости путем присущего механизма действия для устранения устойчивых клеток.
Со времени открытия пенициллина Александром Флеммингом в области разработки новых лекарственных средств произошли многочисленные изменения. При повышенном и беспорядочном применении лекарств инфекционные агенты имеют тенденцию становиться устойчивыми к ним посредством различных механизмов инактивации молекул лекарственных средств, которые в противном случае подавляют инфекционные агенты путем ингибирования их жизненно-важных процессов. Из большого количества ингибиторных молекул только некоторые используются в качестве лекарственных средств, так как применение многих из них не является безопасным для человека и животных. Таким образом, поиск лекарственных препаратов является более медленным процессом, чем развитие новых устойчивых штаммов инфекционных агентов. Это происходит в результате того, что мутации происходят самопроизвольно случайным образом, но благодаря давлению отбора, происходящего под влиянием непрерывного присутствия/введения антибиотиков, устойчивые организмы пролиферируют неограниченно, нивелируя действие молекул лекарственных средств. Для того чтобы избежать опасности возникновения устойчивости к лекарственному средству, существующие лекарственные средства с минимальными побочными эффектами, которые, как доказано, являются безопасными при потреблении человеком, для повышения эффективности обычно подвергали химической модификации. Это привело к разработке первого поколения, второго поколения и третьего поколения лекарственных средств/антибиотиков в противовес параллельному развитию устойчивости к лекарственному средству. Кроме модифицирования структуры, в настоящем изобретении разработан новый, простой способ, который представляет собой введение комбинации лекарственных средств, т.е. лекарственные средства первого поколения могут применяться с другим безопасным соединением, таким образом, что чувствительные бактерии могут быть убиты антибиотиком первого поколения, а устойчивые, если таковые имеют место, могут быть убиты вторым соединением, и, наоборот, клетки, устойчивые против второго соединения, убивает первый антибиотик, причем соотношение устойчивость/чувствительность имеет генетическую основу.
В данном изобретении с целью подавления опасности возникновения устойчивости у бактерий авторы используют уникальный набор известных соединений с различными и специфическими противоположными способами воздействия. Данное изобретение является новым с точки зрения использования комбинации двух известных молекул с целью не только подавления/уничтожения бактерий, но также для предотвращения появления устойчивых штаммов вследствие их противоположного действия, когда одна молекула убивает бактерии, устойчивые к другой молекуле, и наоборот, что в конечном счете приводит к предотвращению развития устойчивости самой по себе. Данное явление, заключающееся в наличии чувствительности клеток к одному соединению при развитии устойчивости к другому, и наоборот, управляется генетически и, следовательно, представляет собой самоподдерживающийся процесс, который достигается в данном изобретении, причем правильный вид противомикробных молекул устанавливается посредством изучения конкретных мутаций.
α- и β-Артитеры синтезируют из дигидроартемицина этерификацией этанолом. Данные соединения ранее разрабатывались как противомалярийные лекарственные средства в Индии в Центральном институте медицинских и ароматических растений (CIMAP), Lucknow, и в Центральном исследовательском институте лекарственных средств (CDRI), Lucknow, India, после III фазы клинических испытаний. Также была определена абсолютная стереохимия артитеров в положении С-12, и было обнаружено, что они в 2-3 раза более активны, чем артемицин. В патентной заявке США №09/176204 было показано, что соединение α-артитер может специфично уничтожать некоторые устойчивые к лекарственным средствам бактерии, следовательно, он может применяться в качестве антибиотика.
Фермент ДНК-гираза является необходимым для роста бактерий, так как он участвует в репликации ДНК и, следовательно, в клеточном делении. Данный фермент временно разрывает цепи ДНК и вводит витки отрицательной суперспирали посредством АТФ-зависимого процесса. Фермент ДНК-гираза Е. coli представляет собой тетрамер, включающий две субъединицы А и В. Субъединица А является чувствительной к налидиксовой кислоте, однако, некоторые мутации в данной субъединице делают бактерии устойчивыми к налидиксовой кислоте. В указанной патентной заявке США было показано, что α-артитер не убивает нормальные бактерии дикого типа, но устойчивые к налидиксовой кислоте и другим фторхинолонам мутанты (с модифицированной гиразой) обладают высокой чувствительностью к α-артитеру, тогда как бактерии с нормальной субъединицей А уничтожаются налидиксовой кислотой.
Важно также отметить, что во всем мире Mycobacterium tuberculosis каждый год инфицируют приблизительно десять миллионов человек, приводя к гибели приблизительно трех миллионов, что делает данные бактерии наиболее распространенной причиной смертности в мире, вызываемой одиночными инфекционными агентами. Хинолоны и производные фторхинолоны являются частью традиционной химиотерапии против туберкулеза.
Было показано, что хинолоны ингибируют активность ДНК-гиразы, таким образом, что происходит релаксация ДНК, суперспирализованной в процессе репликации ДНК. Отдельные исследователи показали, что точечные мутации в гене gyr А, локализованные в очень маленьком участке, между 0 и 400 нуклеотидами гена gyr А, являются ответственными за устойчивость к хинолону, приобретенную разными штаммами Е. coli, отбиравшимися либо in vitro, либо in vivo. Механизмы устойчивости, развивающиеся в результате мутаций в гене gyr А Mycobacteria, сходны с механизмами, наблюдающимися у Е. coli. Механизм устойчивости к хинолону является в достаточной степени похожим у Е. coli, Mycobacteria, H. influenzae и у многих других бактерий.
В предыдущем изобретении заявители обнаружили новое свойство α-артитера, которое состоит в том, что он является эффективным против gyr-мутантных штаммов (Nalr) E. coli, но неэффективным против штаммов дикого типа (Nal5). В результате заявители решили объединить уже вышедший из употребления хинолон, налидиксовую кислоту с α-артитером с целью получения композиции, предотвращающей развитие устойчивости к ней.
Также является важным, что данные соединения и их активность по отдельности являются уже известными (хинолоны с 1960 г., а α-артитер с даты подачи заявки США). Но активность комбинации данных двух соединений не была опубликована до настоящего дня, и заявители разработали композицию, которая является дешевой, безопасной и в которой уже тестированные антибиотики могут использоваться в тандеме с уже испытанным безопасным соединением α-артитером. Результаты были полностью доказаны экспериментными данными в указанном направлении. Две молекулы в данных сочетаниях, убивая бактерии, устойчивые против одной из них, не позволяют никаким устойчивым штаммам/мутантам пролиферировать, что составляет основу развития устойчивости к лекарственным препаратам у микробов.
Основной задачей данного изобретения является разработка новой противомикробной композиции, включающей α-артитер, хинолоны и подобные лекарственные препараты.
Другой задачей является создание новой противомикробной композиции, которая может применяться для противодействия развитию устойчивости самой по себе.
Другой задачей является разработка противомикробной композиции, способной убивать бактерии, устойчивые к традиционным лекарственным препаратам, и предотвращать пролиферацию устойчивых или мутантных штаммов бактерий.
Краткое содержание изобретения
Данное изобретение относится к созданию стратегической и новой композиции, включающей α-артитер, хинолоны и подобные препараты, которая может использоваться как лекарственный(е) препарат(ы) перспективного поколения для противодействия развитию устойчивости самой по себе, так как потенциально она может использоваться для лечения инфекционных заболеваний, особенно, в тех случаях, когда, как известно, устойчивые к лекарственным препаратам штаммы появляются очень часто. Уникальностью и наиболее полезным признаком композиции является то, что, композиция представляет собой комбинацию α-артитера и хинолоновых лекарственных средств, причем спонтанные мутанты, у которых возникает устойчивость к хинолонам или их производным, уничтожаются α-артитером, и в то же время любой из устойчивых к α-артитеру штаммов становится высоко чувствительным к налидиксовой кислоте и, следовательно, уничтожается ею посредством такого комбинирования. Новая композиция ингибирует развитие устойчивости, возникающей в результате мутации в гене gyr А бактерий, в данной композиции один компонент представляет собой α-артитер, а другим может быть налидиксовая кислота или любой из фторхинолонов (включая ципрофлоксацин, норфлоксацин, левофлоксацин, спарфлоксацин, оксфлоксацин, ломефлоксацин и др.), или соединения подобной природы, устойчивость к которым может развиваться подобным способом.
Соответственно, данное изобретение относится к противомикробной композиции четвертого поколения, пригодной для ингибирования устойчивости к лекарственным препаратам, причем упомянутая композиция включает два компонента, где одним из компонентов является α-артитер, а другим компонентом являются лекарственные хинолоны или их производные.
В одном воплощении изобретения используемое хинолоновое соединение представляет собой, без ограничения, налидиксовую кислоту.
В другом воплощении соотношение α-артитера и хинолонов в композиции составляет приблизительно от 8:1 до 20:1.
В следующем воплощении хинолоновые производные выбраны из группы фторхинолонов, включающих ципрофлоксацин, норфлоксацин, левофлоксацин, спарфлоксацин, оксфлоксацин и ломефлоксацин.
В следующем воплощении концентрация налидиксовой кислоты составляет, по меньшей мере, 50 мкг/мл.
В очередном воплощении концентрация α-артитера в композиции составляет приблизительно от 2 мкг до 500 мкг/мл.
В следующем воплощении концентрация α-артитера в композиции составляет приблизительно 400 мкг/мл.
В следующем воплощении концентрация хинолоновых лекарственных средств в композиции составляет приблизительно от 0,5 мг до 500 мг.
В очередном воплощении указанная композиция дополнительно включает растворитель.
В другом воплощении нейтрализованное стерильное растительное масло присутствует в качестве растворителя в количестве, составляющем, по меньшей мере, 1 мл.
В следующем воплощении указанные компоненты обладают ДНК-гираза-ингибиторной активностью против мутантов, устойчивых к одному из соединений.
В другом воплощении указанные компоненты выбраны из ингибиторов ДНК-гиразы с противодействующими свойствами, направленными против мутантов, устойчивых к первому и второму компонентам, т.е., к α-артитеру и хинолонам, их производным или подобным соединениям.
В следующем воплощении композиция обладает активностью, ингибирующей репликацию ДНК у прокариотов, и, следовательно, применяется как противомикробная лекарственная композиция четвертого поколения.
В следующем воплощении используемый второй компонент может представлять собой хинолоновое лекарственное средство первого поколения, выбранное, без ограничения, из налидиксовой кислоты и оксалиновой кислоты.
В следующем воплощении используемый второй компонент может представлять собой хинолоновое лекарственное средство второго поколения, выбранное, без ограничения, из ципрофлоксацина, норфлоксацина, левофлоксацина, спарфлоксацина и оксфлоксацина.
В следующем воплощении используемый второй компонент может представлять собой хинолоновое лекарственное средство третьего поколения, выбранное, без ограничения, из ломефлоксацина, тозуфлоксацина, темафлоксацина.
В другом воплощении упомянутая композиция может применяться вместо лекарственных средств первого, второго и третьего поколений против устойчивых, а также чувствительных, инфекций.
В очередном воплощении упомянутая композиция может применяться для предотвращения развития устойчивости к лекарственным средствам первого, второго и третьего поколений.
Далее, данное изобретение относится к созданию антимикробной композиции четвертого поколения для ингибирования устойчивости к лекарственным средствам, причем упомянутый способ включает смешивание α-артитера и лекарственных хинолонов или их производных.
В одном воплощении способа соотношение α-артитера и хинолонов в композиции составляет приблизительно от 8:1 до 20:1.
В другом воплощении способа используемое хинолоновое соединение представляет собой, без ограничения, налидиксовую кислоту.
В следующем воплощении способа хинолоновые производные выбраны из группы фторхинолонов, включающих ципрофлоксацин, норфлоксацин, левофлоксацин, спарфлоксацин, оксфлоксацин и ломефлоксацин.
В следующем воплощении способа концентрация налидиксовой кислоты составляет, по меньшей мере, 50 мкг/мл.
В очередном воплощении способа концентрация α-артитера в композиции составляет приблизительно от 2 мкг до 500 мкг/мл.
В следующем воплощении способа концентрация α-артитера в композиции составляет приблизительно 400 мкг/мл.
В следующем воплощении способа концентрация хинолоновых лекарственных средств в композиции составляет приблизительно от 0,5 до 500 мг.
В одном воплощении способа нейтрализованное стерильное растительное масло используется в качестве основы в количестве, составляющем, по меньшей мере, 1 мл.
Для точного определения изобретения авторы разработали новую композицию или лекарственную систему для успешного ограничения развития устойчивости, обусловленной появлением мутантов, возникающих в результате применения налидиксовой кислоты (или любой будущей устойчивости, которая будет развиваться в результате применения α-артитера, если соединения будут применяться отдельно), в результате лечения бактериальной инфекции композицией. Так как испытания данных соединений на безопасный уровень применения для человека уже проведены, комбинированное лекарственное средство может быть разработано и непосредственно применено для борьбы с инфекциями и одновременно для ограничения угрозы возникновения устойчивости.
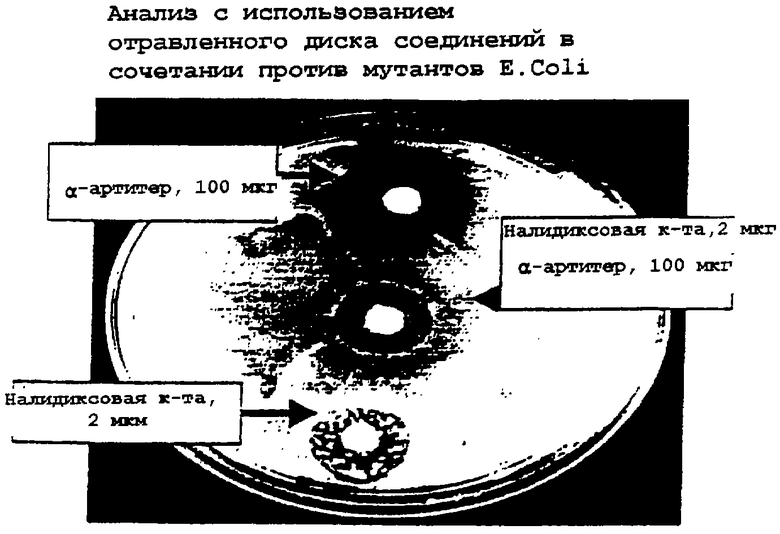
В других экспериментах заявители использовали различные комбинации налидиксовой кислоты и α-артитера в анализах с применением дисковой диффузии и бульона для мутантов как Mycobacterium smegmatis, так и Е. coli. В случае каждого применения одиночного соединения появление устойчивых колоний наблюдалось в пределах зоны ингибирования, создаваемой отравленными дисками. Но в случае дисков, содержащих сочетание (включающее половинную концентрацию каждого компонента), в зоне уничтожения/ингибирования возникновения каких-либо колоний не наблюдалось даже при продолжительной инкубации (см. чертеж). Среди различных концентраций налидиксовой кислоты (от 2 до 500 мкг) и α-артитера (от 20 до 2000 мкг) композиции, содержащие налидиксовую кислоту и α-артитер в соотношении 16:1, являлись наиболее активными против обоих микроорганизмов. Таким образом, данная комбинация - налидиксовая кислота:α-артитер в соотношении 16:1 является высокоэффективной для предотвращения развития у бактерий устойчивости к любой из двух лекарственных молекул. Однако другие соотношения и комбинации также могут предотвращать появление устойчивости, но на различных уровнях.
Далее, следует отметить, что указанные соединения согласно данному изобретению уже применяются для потребления человеком и данные по безопасности применения таких соединений уже известны. В качестве известного примера из предыдущего уровня техники (Asthana, О.Р., Srivastava, J.S. and Valecha, N., 1997. Current status of the artemisinin derivatives in the treatment of malaria with focus on arteether. Journal of Parasitic Diseases. 21:1-12), смесь α/β артитеров давали в дозах 150 мг (одна доза в день, в течение 3 дней) в виде внутримышечной инъекции для лечения устойчивости к лекарственным препаратам и случаев церебральной малярии. Препараты для упомянутых инъекций получали в нейтрализованном растительном масле. В экспериментах, проводимых авторами данного изобретения, оба соединения, то есть α-артитер и хинолоны, демонстрировали наилучшую активность при рН 7,0 (нейтральный). Следовательно, композицию данного изобретения можно использовать для лечения бактериальных инфекций, особенно, случаев, когда, как известно, устойчивость к лекарственным препаратам появляется с высокой частотой. Указанная композиция может применяться для предотвращения развития у бактерий устойчивости к антибиотикам в результате случайных мутаций. Таким образом, различные классы хинолоновых лекарственных средств могут быть введены вместе с α-артитером в форме для инъекций, полученной путем суспендирования соединения в нейтрализованном растительном масле. Хинолоновые лекарственные средства в составе композиции могут быть введены в различных дозах, варьирующих от 0,5 до 500 мг. Композиция
1. α-Артитер (от 2 до 500 мг).
2. Хинолоновые лекарственные средства (от 0,5 до 500 мг).
3. Нейтрализованное растительное масло, по меньшей мере, 1 мл.
Хинолоновые лекарственные средства включают налидиксовую кислоту, ципрофлоксацин, норфлоксацин, левофлоксацин, спарфлоксацин, оксфлоксацин, ломефлоксацин и др.
Таким образом, данное изобретение относится к новой композиции, включающей противомикробные соединения, ингибирующие развитие устойчивости в результате мутации в гене gyr А бактерий, в которой одним компонентом является α-артитер, а другим может быть налидиксовая кислота или фторхинолоны (включая ципрофлоксацин, норфлоксацин, левофлоксацин, спарфлоксацин, оксфлоксацин, ломефлоксацин и др.), или соединения подобной природы, к которым развивается устойчивость.
В другом воплощении данного изобретения компоненты новой композиции не ограничиваются α-артитером или налидиксовой кислотой.
В следующем воплощении, данное изобретение относится к композиции, в которой соединения обладают активностью, ингибирующей репликацию ДНК у прокариотов, и, следовательно, могут применяться в качестве эффективной лекарственной композиции перспективного поколения.
В другом воплощении данного изобретения компонентами композиций могут являться ингибиторы ДНК-гиразы с противодействующими свойствами, направленными против мутантов, развивающих устойчивость к любому из двух лекарственных средств комбинации, которое включает α-артитер и хинолоновые производные.
В следующем воплощении, данное изобретение относится к новой композиции, в которой компонентами композиций могут быть α-артитер (от 2 до 500 мг), хинолоновые лекарственные средства (от 0,5 до 500 мг) и нейтрализованное стерильное растительное масло, по меньшей мере, 1 мл.
Краткое описание чертежа
Данное изобретение далее иллюстрируется со ссылкой на сопровождающий чертеж, где представлен анализ действия композиции данного изобретения на мутанты Е. coli с использованием отравленных дисков.
Нижеследующие эксперименты демонстрируют примеры данного изобретения для иллюстрации некоторых воплощений данного изобретения и не должны истолковываться как огранивающие каким-либо образом объем данного изобретения. Данные эксперименты в основном проводятся для применения противодействующих свойств хинолонов, таких как налидиксовая кислота, и α-артитера, направленных против мутантных штаммов, устойчивых к одному из соединений, и определения эффективности при подавлении бактерий и предотвращения развития устойчивости.
Пример 1: Мониторинг появления мутантов Nalr.
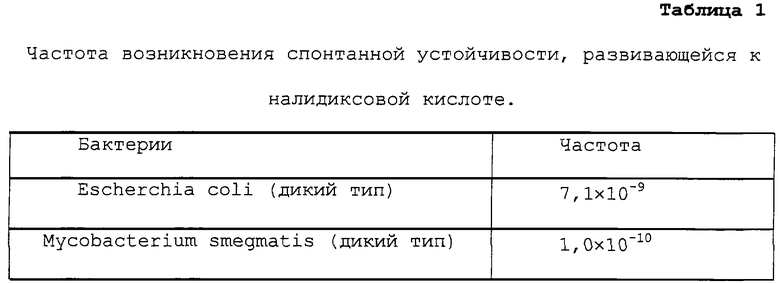
В одном эксперименте авторы заявки вначале определяли частоту спонтанных мутаций у бактерий Escherchia coli (Kumar, S. 1976. Journal of Bacteriology, 125: 545-555) и Mycobacterium smegmatis (Snapper, S.B., Melton, R.E., Mustafa, S., Kieser, T. and Jacobs, W.R., 1990, Molecular Microbiology, 4: 1911-1919), приводящих к последующему развитию устойчивости, посредством селекции в присутствии данных лекарственных препаратов. Бульонные культуры бактерий с известными титрами разбавляли и помещали на отравленную агарную среду, содержащую 50 мкг/мл налидиксовой кислоты, и для оценки частоты развития устойчивости к лекарственному препарату (Nalr) считали развившиеся в результате устойчивые колонии (таблица 1).
Пример 2: Мониторинг появления α-артитерных мутантов.
Далее, для определения частоты появления спонтанных мутантов Escherchia coli и Mycobacterium smegmatis, устойчивых к α-артитеру, в качестве штаммов дикого типа при выделении колоний, устойчивых к α-артитеру, авторы заявки использовали мутанты, устойчивые к налидиксовой кислоте, полученные в предыдущем примере, так как они были чувствительными к α-артитеру. Бульонные культуры мутантных бактерий (Nalr) с известными титрами разбавляли и помещали в чашки Петри, содержащие 1000 мкг/мл α-артитера, и для определения частоты считали развившиеся в результате устойчивые колонии (таблица 2).

Пример 3: Исследование противоположного действия налидиксовой кислоты и α-артитера, применяющихся в сочетании, против мутантов, устойчивых к одному из соединений.
Бульонные культуры помещали на отравленный комбинацией агар, отмечали, что устойчивые колонии не были обнаружены при выращивании в присутствии 50 мкг/мл налидиксовой кислоты и 1000 мкг/мл α-артитера ни для какого из устойчивых мутантов, т.е. мутантов, устойчивых к налидиксовой кислоте и α-артитеру по отдельности или вместе.
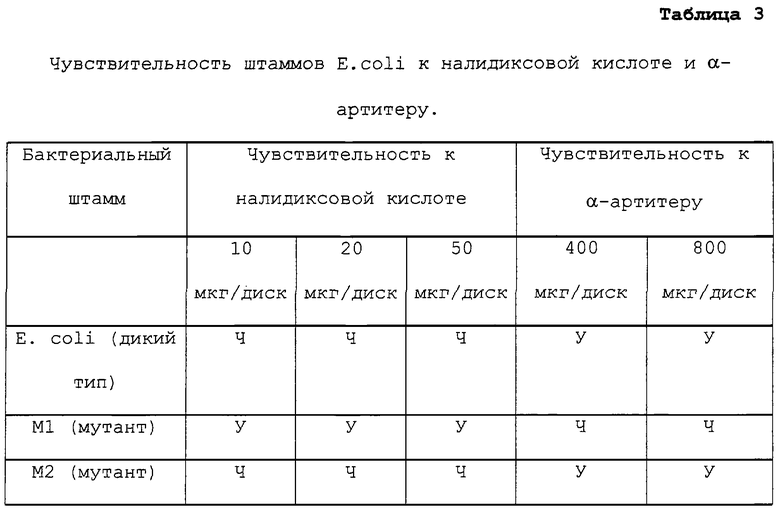
Так как патогены всегда пытаются противодействовать воздействию лекарственного препарата путем генетического изменения своего организма посредством мутации(й) в области гена, являющегося мишенью лекарственного препарата, для эффективного применения лекарственного препарата необходимо уничтожить данные мутантные устойчивые клетки. Поэтому оценивали устойчивый к лекарственным препаратам мутантный штамм (Ml) на устойчивость к налидиксовой кислоте (штаммы дикого типа являются устойчивыми к налидиксовой кислоте). Данный мутантный штамм, развившийся из дикого типа, является дефектным по gyr А субъединице, что подтверждено мобилизацией плазмиды, несущей ген gyr А дикого типа. Интересно, что мутант gyr А-, развившийся из дикого типа, является чувствительным к соединению α-артитеру, но устойчивым к налидиксовой кислоте. Подобным образом второй мутант (М2), развившийся из мутантного штамма gyr A- (Nalr), становится чувствительным к налидиксовой кислоте, будучи устойчивым к α-артитеру (таблица 3). Было отмечено, что неизменно среди всех тестируемых штаммов, штаммы, устойчивые к налидиксовой кислоте, являются чувствительными к α-артитеру, а штаммы, чувствительные к налидиксовой кислоте, являются устойчивыми к α-артитеру. Комбинация данных лекарственных средств, в которой оба компонента объединены вместе, предотвращает развитие устойчивости. Это происходит вследствие того, что устойчивость к налидиксовой кислоте развивается в результате мутации gyr А и мутанты уничтожаются α-артитером, тогда как устойчивые к α-артитеру штаммы автоматически становятся чувствительными к налидиксовой кислоте и, следовательно, уничтожаются налидиксовой кислотой, и таким путем все спонтанно устойчивые бактерии могут быть ограничены.
Пример 4: Корреляция между уровнями устойчивости и чувствительности.
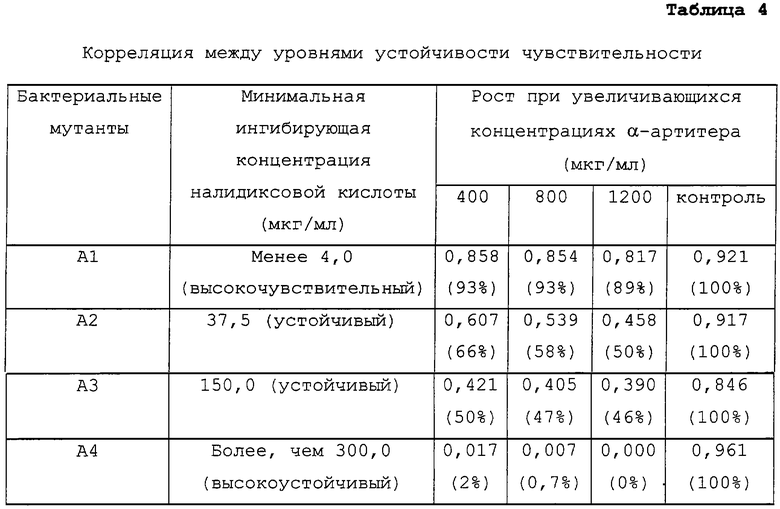
Для определения корреляции между чувствительностью к налидиксовой кислоте и α-артитеру заявители отобрали культуры Escherchia coli, устойчивые к налидиксовой кислоте в различных концентрациях. На основе минимальной ингибирующей концентрации (MIC) налидиксовой кислоты мутантов Escherchia coli распределяли по группам: высокочувствительные (MIC менее или равна 10 мкг/мл), устойчивые (MIC составляет от 10 до 200 мкг/мл), высокоустойчивые (MIC более или равна 200 мкг/мл).
Затем данные штаммы исследовали на чувствительность к α-артитеру путем оценки их роста (по поглощению света при длине волны 620 нанометров) в присутствии увеличивающихся концентраций α-артитера. Данные по поглощению превращали в процент роста, принимая поглощение в контрольном образце за 100%. Затем рост количественно определяли следующим образом: 1) более 80% роста: мутант является высоко устойчивым к α-артитеру; 2) от 20 до 80% роста: мутант является среднеустойчивым к α-артитеру; 3) менее 20% роста: мутант является чувствительным к α-артитеру. Экспериментальные данные показывают, что мутанты Escherchia coli, которые обладают высокой устойчивостью к налидиксовой кислоте, с другой стороны, являются высокочувствительными к α-артитеру. Другими словами, мутанты Escherchia coli, наиболее устойчивые к налидиксовой кислоте, наиболее эффективно уничтожаются α-артитером (таблица 4) и наоборот.
Пример 5: Оценка развития штаммов, устойчивых к комбинации, путем совместного культивирования штаммов с разной устойчивостью.
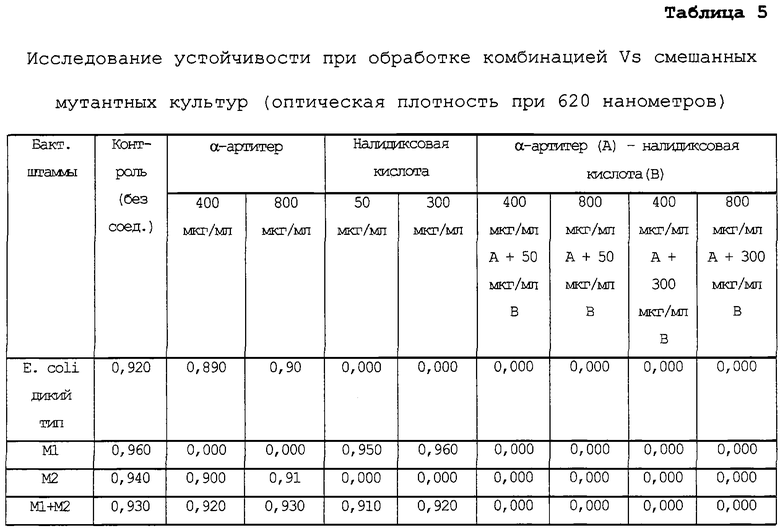
В последующих экспериментах заявитель анализировал рост мутантных штаммов отдельно и при совместном культивировании по сравнению с диким типом в присутствии отдельных соединений и их комбинации. Как видно из таблицы 5, отдельные мутанты являются чувствительными либо к налидиксовой кислоте, либо к α-артитеру отдельно, но при обработке комбинацией этих соединений рост не наблюдается ни в индивидуальных мутантных штаммах, ни в смеси мутантов, что говорит об отсутствии развития как двойной, как и одиночной устойчивости у штаммов, обладающих чувствительностью, одиночной устойчивостью или смешанных.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТИМОЛСОДЕРЖАЩАЯ КОМПОЗИЦИЯ, ПОЛЕЗНАЯ ДЛЯ ЛЕЧЕНИЯ УСТОЙЧИВЫХ К ЛЕКАРСТВЕННЫМ СРЕДСТВАМ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ | 2000 |
|
RU2245719C2 |
| СОСТАВ И СПОСОБ ПОЛУЧЕНИЯ ГЛАЗНОЙ МАЗИ | 2012 |
|
RU2531937C2 |
| СОСТАВ И СПОСОБ ПОЛУЧЕНИЯ ГЛАЗНЫХ КАПЕЛЬ | 2014 |
|
RU2595837C2 |
| Фармацевтическая комбинированная композиция для лечения гнойных ран на основе фторхинолонов (варианты) | 2016 |
|
RU2682171C2 |
| МЕСТНОЕ АНТИМИКРОБНОЕ СРЕДСТВО | 2007 |
|
RU2336877C1 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБ ЛЕЧЕНИЯ МАСТИТОВ | 2013 |
|
RU2659430C2 |
| АЭРОЗОЛЬНЫЕ ФТОРХИНОЛОНЫ И ИХ ПРИМЕНЕНИЯ | 2006 |
|
RU2428986C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pDUALREP2 И ШТАММ, ТРАНСФОРМИРОВАННЫЙ ЕЮ ДЛЯ ВЫЯВЛЕНИЯ ВЕЩЕСТВ И СМЕСЕЙ, ИНГИБИРУЮЩИХ БИОСИНТЕЗ БЕЛКА И/ИЛИ ВЫЗЫВАЮЩИХ SOS-ОТВЕТ У БАКТЕРИЙ | 2016 |
|
RU2620074C1 |
| АЛЬГИНАТНЫЕ ОЛИГОМЕРЫ ДЛЯ ПРИМЕНЕНИЯ В ПРЕОДОЛЕНИИ МНОЖЕСТВЕННОЙ ЛЕКАРСТВЕННОЙ УСТОЙЧИВОСТИ У БАКТЕРИЙ | 2010 |
|
RU2582938C2 |
| КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АНТИБИОТИК И ДИСПЕРГИРУЮЩЕЕ СРЕДСТВО ИЛИ АНТИАДГЕЗИВНЫЙ АГЕНТ | 2011 |
|
RU2607660C2 |
Изобретение относится к области медицины и может быть использовано для в качестве лекарственной композиции для противодействия развитию устойчивости, для лечения инфекционных заболеваний и для ингибирования устойчивости, развившейся в результате мутации в гене gyr А бактерий. Сущностью изобретения является разработка новой композиции, включающей α-артитер, налидиксовую кислоту и хинолоновые лекарственные средства и способ получения такой композиции. Техническим результатом является расширение арсенала противомикробных средств. 2 с. и 25 з.п. ф-лы, 5 табл., 1 ил.
| ЕР 0464233 А, 08.01.1992 | |||
| ЕР 03628810 А, 11.04.1990 | |||
| Микробиология и иммунология | |||
| /Под ред | |||
| А.А.Воробьева | |||
| - М.: Медицина, 1999, с | |||
| Устройство для разметки подлежащих сортированию и резанию лесных материалов | 1922 |
|
SU123A1 |
Авторы
Даты
2004-12-10—Публикация
2000-03-28—Подача