Область изобретения
Настоящее изобретение относится к использованию эмалевого матрикса, производных эмалевого матрикса и/или протеинов эмалевого матрикса в качестве терапевтического и/или профилактического агентов. Эти вещества являются активными ранозаживляющими, антибактериальными и/или противовоспалительными агентами.
Предпосылки изобретения
Протеины эмалевого матрикса, такие как те, которые присутствуют в эмалевом матриксе, чаще всего известны как предшественники эмали. Эмалевые протеины и производные эмалевого матрикса ранее были описаны в патентной литературе как вызывающие образование твердых тканей (т.е. образующие эмали, патент США №4672032 (Slavkin), или образующие связи между твердыми тканями (ЕР-В-0337967 и ЕР-В-0263086). Так, более ранние исследования концентрировали внимание только на регенерации твердых тканей, тогда как настоящее изобретение имеет дело с благоприятным воздействием на залечивание мягких тканей ран и антибактериальное и противовоспалительное действие, которые оказались неожиданными.
Описание изобретения
Настоящее изобретение основано на обнаружении того факта, что эмалевый матрикс, производные эмалевого матрикса и/или протеины эмалевого матрикса (термин "активное эмалевое вещество" также используется далее для обозначения эмалевого матрикса, производных эмалевого матрикса или протеинов эмалевого матрикса) являются полезными агентами для ускорения или улучшения залечивания ран мягких тканей (т.е. не минерализованных тканей), таких как ткани, содержащие коллаген или эпителий, включая кожу и слизистую оболочку, мышцы, кровеносные и лимфатические сосуды, нервные ткани, железы, связки, глаза и хрящи. Как показано в экспериментальном разделе, эмалевый матрикс, производные эмалевого матрикса и/или протеины эмалевого матрикса демонстрируют исключительно благоприятное действие при лечении или профилактике ран мягких тканей.
Соответственно, настоящее изобретение относится к использованию препаратов активного эмалевого вещества для получения фармацевтических или косметических композиций i) для залечивания ран, ii) для улучшения эалечивания ран, и/или iii) для регенерации и/или восстановления мягких тканей.
В другом аспекте настоящее изобретение относится к способу улучшения залечивания ран или к ускорению регенерации и/или восстановления мягких тканей, причем способ включает введение нуждающемуся в этом индивидууму терапевтически или профилактически эффективного количества активного эмалевого вещества.
Кроме того, как было обнаружено, эмалевый матрикс, производные эмалевого матрикса и протеины эмалевого матрикса обладают антибактериальными и/или противовоспалительными свойствами, которые можно использовать для лечения различных состояний как мягких, так и твердых (т.е. минерализованных) тканей.
В других аспектах настоящее изобретение относится к использованию препаратов активного эмалевого вещества для получения фармацевтических композиций для профилактики и/или лечения инфекций или воспалений.
Лечение ран
Раны и/или язвы обычно находятся на поверхности кожи или слизистой оболочки или являются результатом разрыва органа ("удар"). Раны могут быть результатом дефектов или поражений мягких тканей или скрытых состояний. Регенерация экспериментально спровоцированных периодонтальных ран была описана ранее авторами и не относится к объему настоящего изобретения. В контексте настоящего изобретения термин "кожа" относится ко всей внешней поверхности организма животных, включая людей, и включает интактную или почти интактную кожу, так же, как и поврежденную поверхность кожи. Термин "слизистая оболочка" относится к неповрежденной или поврежденной слизистой оболочке животных, таких как человек, и может относиться к слизистой оболочке рта, щек, носа, легких, глаз, желудочно-кишечного тракта, к вагинальной или ректальной слизистой оболочке.
В контексте настоящего изобретения термин "рана" обозначает поражение организма с нарушением нормальной целостности структуры тканей. Термин также охватывает такие термины как "воспаление", "поражение", "некроз" и "язва". Обычно термин "воспаление" является популярным термином для почти любых поражений кожи или мембран слизистой оболочки, а термин "язва" относится к локальному дефекту или образованию полости на поверхности органа или ткани, что вызывает образование струпьев некротической ткани. Поражения относятся к любому дефекту тканей. Некроз относится к мертвой ткани, образующейся в результате инфекции, травмы, воспаления или инфарктов.
Термин "рана" в том смысле, как использован в контексте настоящего изобретения, обозначает любую рану (см. далее классификацию ран) и на любой конкретной стадии процесса залечивания, включая стадию до того, как началось какое-либо залечивание, или даже до того, как нанесены некоторые раны, подобные хирургическим разрезам (профилактическая обработка).
Примерами ран, которые можно предотвратить и/или излечить в соответствии со способом настоящего изобретения, являются, например, асептические раны, раны, полученные в результате контузий, резаные раны, рваные раны, не проникающие раны (т.е. раны, при которых отсутствует нарушение кожи, но происходит поражение расположенных ниже структур), открытые раны, проникающие раны, перфорированные раны, колотые раны, септические раны, подкожные раны и т.д. Примерами воспалений являются, например, пролежни, стоматиты, пигментация, обморожения, воспаления от ударов. Примерами язв являются, например, пептические язвы, язвы двеннадцатиперстной кишки, язвы желудка, подагрические язвы, диабетические язвы, гипертензивные ишемические язвы, застойные язвы, ulcus cruris (язвы вен), подъязычные язвы, язвы под слизистой оболочкой, симптоматические язвы, трофические язвы, язвы, зарождающиеся в тропиках, язвы венерического происхождения, например, вызываемые гонореей (включая уретриты, эндоцервециты и проктиты). Условия, связанные с ранами или воспалениями, которые можно с успехом лечить в соответствии со способом настоящего изобретения, включают ожоги, сибирскую язву, столбняк, газовую гангрену, скарлатину, рожу, сикоз, фолликулиты, контагиозное импетиго или буллезное импетиго и т.д. Часто происходит некоторое перекрывание при использовании терминов "рана" и "язва" и "рана" и "воспаление", и, кроме того, термины часто используют произвольно. Поэтому, как было указано ранее, в контексте настоящего изобретения термин "рана" охватывает термины "язва", "поражение", "воспаление" и "инфаркт", и эти термины равноправно используют, если нет других указаний.
Типы ран, которые можно лечить по способу настоящего изобретения включают также i) обычные раны, такие как, например, хирургические, травматического происхождения, инфекционные, ишемические, термические, химического происхождения и буллезные раны; ii) раны, специфические для полости рта, такие как раны после удаления, эндодонтные раны, особенно в связи с лечением цист и абсцессов, в связи с язвами и поражениями бактериального, вирусного или автоиммунного происхождения, раны механического, химического, термического, инфекционного происхождения и лихеноидные раны; герпетические язвы, стоматит aphtosa, острые некротирующие язвенные гингивиты и синдром ожога рта служат конкретными примерами; и iii) раны на коже, такие как, например, неоплазмы, ожоги (например, химические, термические), поражения (бактериальные, вирусные, автоиммунологические), укусы и хирургические разрезы. Другим способом классификации ран может быть следующий: i) небольшие потери ткани в результате хирургических разрезов, небольшие потертости и слабые укусы; или ii) значительные потери ткани. Последняя группа включает ишемические язвы, воспаления от давления, фистулы, рваные раны, сильные укусы, термические ожоги и раны на донорских участках (в мягких и твердых тканях) и инфаркты.
Эффект залечивания активного эмалевого вещества, как было обнаружено, представляет интерес в связи с ранами, которые встречаются в полости рта. Такие раны могут быть физическими повреждениями или травмами, связанными с хирургическими операциями в полости рта, включая периодонтальную хирургию, удаление зуба (зубов), эндодонтное лечение, вживление зубных имплантатов, создание или использование протезов и т.п. Далее в экспериментальном разделе продемонстрировано благоприятное действие активного эмалевого вещества на такие раны. Кроме того, наблюдается эффект залечивания мягких тканей.
В полости рта залечивание ран, подобных язвочкам, травматическим ранам, ранам, связанным с герпесом, также улучшается после нанесения активного эмалевого вещества. Раны травматического происхождения и раны, связанные с герпесом, могут, естественно, быть расположены на других частях тела, а не в полости рта.
В других аспектах настоящего изобретения раны, которые можно обработать профилактически и/или лечить, выбирают из группы, состоящей из асептических ран, инфарктов, ушибленных ран, резаных ран, рваных ран, непроникающих ран, открытых ран, проникающих ран, перфорированных ран, колотых ран, септических ран и подкожных ран.
Другими ранами, которые имеют значение в связи с настоящим изобретением, являются язвы ишемического происхождения, поражения в результате сдавливания, фистулы, раны от сильных укусов, термические ожоги и раны донорских участков.
Язвы ишемического происхождения и поражения в результате сдавливания представляют собой раны, которые обычно заживают очень медленно, и особенно в таких случаях более качественное и более быстрое залечивание, естественно, имеет большое значение для пациента. Кроме того, стоимость лечения пациентов с такими ранами значительно снижается, если лечение идет более качественно и происходит быстрее.
Раны на донорском участке представляют собой раны, которые, например, возникают в связи с переносом твердой ткани с одной части тела на другую часть тела, например, в связи с трансплантацией. Раны, образующиеся в результате таких операций, являются очень болезненными и поэтому более качественное залечивание является особенно ценным.
Термин "кожа" используют в очень широком смысле, и он охватывает эпидермальный слой кожи и - в тех случаях, когда поверхность кожи более или менее повреждена - также дермальный слой кожи. Без учета stratum corneum эпидермальный слой кожи является внешним (эпителиальным) слоем, а более глубоко расположенный слой соединительной ткани кожи называют дермисом.
Так как кожа является наиболее открытой частью тела, она особенно подвержена различного типа поражениям, таким как разрывы, разрезы, истирания, ожоги и обморожения, или поражениям, возникающим в результате различных заболеваний. Кроме того, большая поверхность кожи обычно нарушается при несчастных случаях. Однако из-за важных барьерных и физиологических свойств кожи целостность кожи является важной для нормального самочувствия индивидуума, и любые нарушения или разрывы представляют проблему, которую должен решить организм для защиты своего последующего существования.
Помимо поражений на коже поражения могут также существовать во всех типах тканей (т.е. мягких и твердых тканей). Поражения на мягких тканях, включая поражения мембран слизистой оболочки и/или кожи, особенно важны в связи с настоящим изобретением.
Залечивание ран на мембранах кожи или слизистой оболочки претерпевает ряд стадий, что приводит к восстановлению или регенерации мембран кожи или слизистой оболочки. В последние годы регенерацию и восстановление разделяют как два типа залечивания, которые могут иметь место. Регенерацию можно определить как биологический процесс, при котором строение и функции утраченной ткани полностью обновляются. С другой стороны восстановление представляет собой биологический процесс, в результате которого непрерывность разрушенной ткани восстанавливается за счет новых тканей, которые не повторяют строение и функции утраченных.
Большинство ран залечивают восстановлением, что означает, что новая образующаяся ткань структурно и химически отличается от исходной ткани (рубцовая ткань). На ранней стадии восстановления ткани одним из процессов, который имеет место почти всегда, является образование временной соединительной ткани на участке поражения ткани. Этот процесс начинается с образования нового внеклеточного коллагенового матрикса за счет фибробластов. Затем этот новый коллагеновый матрикс служит подложкой для соединительной ткани во время окончательного процесса залечивания. Конечной стадией залечивания является (для большинства тканей) образование рубца, содержащего соединительную ткань. В тканях, которые обладают регенеративными свойствами, таких как, например, кожа и костная ткань, конечная стадия залечивания включает регенерацию исходной ткани. Эта регенерированная ткань часто также имеет некоторые характеристики рубца, например утолщение зажившего перелома кости.
В обычных условиях организм обеспечивает механизмы залечивания пораженной кожи или слизистой оболочки для восстановления целостности кожного барьера или слизистой оболочки. Процесс восстановления даже для небольших поражений или ран может занять промежуток времени от нескольких часов и дней до нескольких недель. Однако при наличии язв процесс залечивания может быть очень медленным, и рана может существовать в течение длительного времени, то есть месяцы или даже годы.
Стадии залечивания ран обычно включают воспаление (обычно в течение 1-3 дней), миграцию (обычно 1-6 дней), пролиферацию (обычно 3-24 дня) и вызревание (обычно 1-12 месяцев). Процесс залечивания является сложным и хорошо организованным физиологическим процессом, который включает миграцию, пролиферацию и дифференциацию различных типов клеток, а также синтез компонентов матриксов. Процесс залечивания можно подразделить на следующие три фазы:
i) Гемостаз и воспаление
Если тромбоциты находятся вне системы циркуляции и экспонированы тромбину и коллагену, они активируются и образуют агрегаты. Так, тромбоциты инициируют процесс восстановления за счет образования агрегатов и образования временных препятствий для обеспечения гемостаза и предотвращения вторжения бактерий. Активированные тромбоциты инициируют систему коагуляции и высвобождают факторы роста, подобные полученному из тромбоцитов фактору роста (PDGF), эпидермальным факторам роста (EGFs) и факторам трансформирования роста (TGFs).
Первыми клетками, которые занимают поверхность раны, являются нейтрофилы, за которыми следуют моноциты, которые активируются макрофагами.
Основной ролью нейтрофилов является, по-видимому, очищение раны или защита раны от загрязняющих бактерий и улучшение залечивания раны путем удаления мертвых клеток и тромбоцитов. Инфильтрация нейтрофилов ослабевает примерно за первые 48 часов, при условии, что в ране не осталось бактериального загрязнения. Избыток нейтрофилов фагоцитируется тканевыми макрофагами, поступающими из циркулирующего объема образующихся в крови моноцитов. Считают, что макрофаги важны для эффективного залечивания ран и что они также ответственны за фагоцитоз патогенных организмов и очищение от кусочков тканей. Кроме того, они выделяют множество факторов, участвующих в последующих актах процесса залечивания. Макрофаги привлекают фибробласты, которые начинают выработку коллагена.
ii) Образование гранулированной ткани и реэпителизация
Через 48 часов после ранения фибробласты начинают пролиферировать и мигрировать в раневое пространство из соединительной ткани на краях раны. Фибробласты продуцируют коллагены и гликозаминогликаны, и наряду с этим низкое давление кислорода в ране стимулирует пролиферацию эндотелиальных клеток. Эндотелиальные клетки являются источником образования новой сети капилляров.
Коллагеназы и активаторы плазминогена секретируются из кератиноцитов. Если рану оставляют не потревоженной и хорошо снабжаемой кислородом и питательными веществами, кератиноциты будут поступать в рану. Считают, что кератиноциты мигрируют только на живую ткань, и, соответственно, кератиноциты поступают в участки, расположенные под мертвой тканью и корочкой раны.
Поверхность раны затем уменьшается за счет сжатия.
iii) Реконструкция кожи
Как только заканчивается реэпитализация, начинается реконструкция ткани. Эта фаза, которая длится несколько лет, восстанавливает прочность раневой ткани.
Все из вышеуказанных процессов залечивания занимают значительное время. На скорость залечивания влияет отсутствие инфицирования раны, общее состояние здоровья индивидуума, присутствие чужеродных тел и т.д. Некоторые патологические состояния, такие как инфекция, мацерация, обезвоживание, общее плохое состояние здоровья и недостаток питания могут привести к образованию таких хронических язв, как, например, ишемические язвы.
До тех пор, пока, по крайней мере, не происходит поверхностное залечивание, остается риск продолжения или новой инфекции. Поэтому чем быстрее заживет рана, тем скорее устранится риск.
Таким образом, большую ценность представляет любая процедура, которая может повлиять на скорость залечивания раны.
Кроме того, так как почти все процессы восстановления тканей включают раннее образование соединительной ткани, стимуляция этого и последующих процессов предлагаются для улучшения залечивания тканей.
В контексте настоящего изобретения термин "клиническое залечивание" используют для того, чтобы обозначить ситуацию, когда визуально не наблюдается нарушения ткани, и присутствуют только отдельные следы воспаления, такие как легкое покраснение и отдельное опухание ткани. Кроме того, боль не чувствуется, когда орган находится в состоянии покоя или к нему не прикасаются.
Как указано выше, изобретение относится к использованию эмалевого матрикса, производных эмалевого матрикса и/или протеинов эмалевого матрикса в качестве агента для залечивания ран, т.е. агента, который ускоряет, стимулирует или промотирует залечивание кожных ран или ран слизистой оболочки. Соответственно важным использованием является также использование в качестве агентов для регенерации тканей и/или восстанавливающих агентов. Кроме того, благодаря эффекту залечивания ран, эмалевый матрикс, производные эмалевого матрикса и/или протеины эмалевого матрикса обладают способностью снятия болевых ощущений.
Традиционно наиболее часто использовали сухие или влажно-сухие повязки для лечения ран. Их постепенно заменяют влажной средой, используя окклюзивные повязки. Для успешного восстановления или замены утраченной части тела процессы залечивания ран, фиброзов и микробных вторжений должны быть сбалансированы. Многие доступные средства для борьбы с инфекцией сбалансированы с лечением ран. Задержка в залечивании ран или воспалений может обострить фиброз. Более того, ранее предполагалось, что факторы роста, подобные эпидермальному фактору роста (EGF), трансформирующему рост фактору-α (TGF-α), полученному из тромбоцитов фактору роста (PDGF), факторам роста фибробластов (FGFs), включающим кислотный фактор роста фибробластов (α-FGF) и щелочной фактор роста фибробластов (β-TGF), трансформирующий рост фактор-β (TGF-β), и инсулиноподобные факторы роста (IGF-1 и IGF-2) являются проводниками процесса залечивания ран, и их часто указывают как промоторы залечивания ран; однако, они могут реально промотировать фиброз, который, в свою очередь, может способствовать успешному заживлению. Даже несмотря на то, что ускоренное залечивание является многообещающим в плане снижения риска инфекции и возникновения воспаления, которое может привести к образованию рубца, терапевтические попытки ускорить нормальный процесс залечивания ран имеет относительно малый успех. Это, по-видимому, связано с тем, что процесс восстановления включает согласованное участие целого ряда факторов, см. выше.
И наконец, авторы настоящего изобретения наблюдали, что различные клеточные культуры фибробластов (эмбриональных, кожных, полученных из периодонтального лигамента, рыбьих или птичьих), продуцируются в два раза больше чем TGFβ1 в клеточных культурах, стимулированных EMDOGAIN® по сравнению с не стимулированными культурами при анализе, например, с помощью ELISA в образце из культуральной среды (Пример 1 далее). Увеличение наблюдается после 24 часов культивирования, но становится более очевидным в последующие дни (дни 2 и 3). После второго дня возрастает также клеточная пролиферация в клеточных культурах, стимулированных EMDOGAIN®. Аналогичное, но менее выраженное увеличение продуцирования TGFβ1 наблюдается для эпителиальных клеток человека. Так как TGFβ1, по-видимому, играет центральную роль в эпителизации раневых поверхностей, эти открытия подтверждают концепцию настоящего изобретения.
В полости рта использование повязок является обычной практикой. Это повязки традиционного типа, например, Surgi-pads для остановки кровотечения и Coe-Pack периодонтальные повязки (Сое Laboratories, the GC Group, Chicago, Usa) для открытых ран, марля, пропитанная раствором антибиотика, которую помещают в лунку после удаления зуба, и которая требует удаления через несколько дней, когда начинается залечивание. Промывание антисептиками, такими как хлоргексидин, регулярно используют после операций в полости рта. Иногда прописывают также антибиотики для приема внутрь или для поверхностного применения.
Обычно следует учитывать специальные предосторожности в связи с лечением ран, такие как например соображения стерильности, проблемы загрязнений, правильное наложение бандажей/повязок и т.д., что обычно требует, чтобы лечение/наложение осуществляли профессиональные медицинские сестры или т.п. Так, лечение ран часто становится очень дорогостоящей операцией, если агент для залечивания раны необходимо наносить несколько раз в день. Желательное уменьшение стоимости лечения при залечивании ран может быть поэтому достигнуто, если наносить агент можно было бы реже, или если усовершенствовать процессы залечивания, что привело бы к уменьшению промежутка времени, необходимого для залечивания раны.
Авторы настоящего изобретения теперь обнаружили, что эмалевый матрикс, производные эмалевого матрикса и/или протеины эмалевого матрикса обладают залечивающими раны свойствами. Кроме того, имеются указания, что нанесение эмалевого матрикса, производных эмалевого матрикса и/или протеинов эмалевого матрикса приводит к улучшению процесса залечивания ран. В частности, авторы наблюдали, что после нанесения протеинов эмалевого матрикса и/или производных эмалевого матрикса стадия воспаления сокращается, и менее заметны такие типичные признаки, как тепло, покраснение, отек и боль, и новые ткани образуются быстрее. Наблюдаемое время для залечивания ран (например, после хирургических операций) значительно сокращается по сравнению со временем, необходимым для залечивания без использования эмалевого матрикса, производных эмалевого матрикса и/или протеинов эмалевого матрикса.
Терапевтическая и/или профилактическая активность эмалевого матрикса, производных эмалевого матрикса и/или протеинов эмалевого матрикса, естественно, может быть доказана с помощью in vivo тестов с использованием подопытных животных или людей (см. экспериментальный раздел далее). Однако показания эффективности и/или активности эмалевого матрикса, производных эмалевого матрикса и/или протеинов эмалевого матрикса можно получить, осуществляя относительно простые тесты in vitro, такие как тесты с использованием культуры клеток.
Кроме того, существует несколько параметров, которые можно использовать для оценки эффекта залечивания ран. Эти параметры включают:
- Компьютерную планиметрию (оценка скорости залечивания открытой раны);
- Лазерное допплеровское изображение (оценка перфузии раны);
- Тензиометрию (оценка прочности раны);
- Гистопатологию/цитологию (оценка тканей и жидкостей раны с помощью микроскопа);
- Биохимию (HPLC/RIA) (оценка различных лекарств и биохимических компонентов залечивания ран);
- Электродиагностику (оценка взаимосвязи залечивания ран и иннервации);
- Сцинтиграфию (получение изображения ткани раны с помощью радионуклидов).
В связи с лечением ран/язв весьма важными являются удаление отмерших частиц и очищение раны. Считают, что очищение и/или удаление отмерших частиц ран/язв является необходимым условием для процесса залечивания, и, кроме того, если наносят агенты, способствующие залечиванию ран, такие агенты должны проявлять свое действие на свежей и живой ткани, а не на мертвой ткани или на загрязненной ткани. Отмершие частицы или некротическую ткань можно обработать, по крайней мере, четырьмя различными способами: i) удалить отмершие частицы острым предметом, ii) удалить их механическим путем, iii) удалить отмершие частицы с помощью ферментов, iv) осуществить автолитическое удаление отмерших частиц.
Поэтому настоящее изобретение относится также к использованию способа удаления отмерших частиц в сочетании с использованием эмалевого матрикса, производных эмалевого матрикса и/или протеинов эмалевого матрикса для залечивания или профилактики ран. Такая комбинированная терапия включает следующие две стадии, а именно i) способ удаления отмерших частиц и ii) нанесение эмалевого матрикса, производных эмалевого матрикса, и/или протеинов эмалевого матрикса, и эти две стадии можно осуществлять многократно при необходимости и в любом удобном порядке.
Когда из раны уже удалены отмершие частицы, эмалевый матрикс, производные эмалевого матрикса и/или протеины эмалевого матрикса можно наносить или непосредственно на рану, или в рану, или их можно наносить в форме любой подходящей фармацевтической композиции, такой как например сухой или влажной, в виде повязки в которую были включены эмалевый матрикс, производные эмалевого матрикса и/или протеины эмалевого матрикса. Эмалевый матрикс, производные эмалевого матрикса и/или протеины эмалевого матрикса естественно можно наносить в связи с очищением раны.
Как будет обсуждаться далее, эмалевый матрикс, производные эмалевого матрикса и/или протеины эмалевого матрикса можно использовать как они есть, или их можно использовать в виде подходящего препарата или фармацевтической композиции.
Эффект уменьшения инфекции
В следующем аспекте настоящего изобретения эмалевый матрикс, производные эмалевого матрикса и/или протеины эмалевого матрикса используют в качестве терапевтических или профилактических агентов, обладающих противомикробным действием. Эмалевый матрикс, производные эмалевого матрикса и/или протеины эмалевого матрикса демонстрируют свойства уменьшения инфекции.
В контексте настоящего изобретения термин эффект уменьшения инфекции относится к лечебному или профилактическому воздействию эмалевого матрикса, производных эмалевого матрикса и/или протеинов эмалевого матрикса на инфекцию в ткани индивидуума, когда ткань индивидуума обрабатывают эмалевым матриксом, производными эмалевого матрикса и/или протеинами эмалевого матрикса.
Термин "инфекция" относится к вторжению и размножению микроорганизмов в тканях организма или накоплению на тканях, что может быть клинически незаметным, или приведет к локальному поражению клеток из-за конкурирующего метаболизма, ферментов, токсинов внутриклеточного размножения или реакции антиген-антитело.
В соответствии с настоящим изобретением инфекция, которую необходимо предотвратить и/или вылечить, может быть вызвана микроорганизмом. Микроорганизмы, представляющие интерес в связи с настоящим изобретением, включают бактерии, вирусы, дрожжи, плесень, простейших и риккетсии.
В настоящем контексте термин "антибактериальное действие" означает, что рост бактерий подавляется или бактерии разрушаются. Этот термин не ограничен конкретными бактериями, но охватывает вообще любые бактерии. Однако настоящее изобретение сфокусировано на i) патогенных бактериях, которые вызывают заболевания у млекопитающих, включая человека, и/или ii) бактериях, которые обычно присутствуют в организме млекопитающего, и которые в некоторых условиях могут вызывать нежелательные состояния организма.
Соответственно, настоящее изобретение относится к использованию активного эмалевого вещества для профилактики или лечения роста бактерий на поверхности организма, такой как кожа, поверхность слизистой оболочки или на поверхности ногтей или на поверхности зубов.
Общее и конкретное описание бактериальных условий, с которыми приходится бороться
Эмалевый матрикс, производные эмалевого матрикса и/или протеины эмалевого матрикса можно использовать для лечения инфекции, вызываемой бактериями, наряду с присутствием антимикробных агентов или без них. Грам-отрицательные бактерии, с которыми нужно бороться с помощью активного эмалевого вещества, могут быть такими как Neisseria (напр., N. meningitis, N. gonorrhoeae), и Acinetobacter или палочками, такими как Bacteroides (напр., В.fragilis), Bordetella (напр., В.pertussis, В.parapertussis), Brucella (напр., В.melitentis, В.abortus Bang, В.suis), Campylobacter (напр., С.jejunl, С.coli, С.fetus), Citrobacter, Enterobacter, Escherichia (напр., Е.coli), Haemophilus (напр., H.influenzae, H.para-influenzae), Klebsiella (напр., К.pneumoniae), Legionella (напр., - L. pneumophila), Pasteurella Снапр., P.yersinia, P.multocida), Proteus (напр., P.mirabilis, P. vulgaris), Pseudomonas (напр., P.aeruginosa, P. pseudomallei, P.mallei), Salmonella (напр., S.enteritidis, S.Infantitis, S.Dublin, S.typhi, S.paratyphi, S.schottmulleri, S.choleraesuis, S.typhimurium, или любым из других 2500 серотипов), Serratia (напр., S.marscences, S.liquifaciens), Shigella (напр., S.sonnei, S.flexneri, S.dysenteriae, S.boydii), Vibrio (напр., V.cholerae, V. el tor), и Yersinia (напр., Y. enterocolitica, Y. pseudotuberculosis, Y. pestis). Грам-положительные бактерии, с которыми можно бороться с помощью активного эмалевого вещества могут быть кокками, такими как Streptococcus (напр., S.pneumoniae, S.viridans, S.faecalis, S.pyogenes), Staphylococcus (напр., S.aureus, S.epidermidis, S.saprophyticus, S.albus), и палочками, такими как Actinomyces (напр., A.israelli), Bacillus (напр., В.cereus, В.subtilis, В.anthracis), Clostridium (напр., С.botulinum, С.tetani, С.perfringens, С.difficile), Corynebacterium (напр., С.diphtheriae), Listeria, и Providencia. Другие бактерии, вызывающие инфекцию, включают Propionobacterium acne и Pityosporon ovale.
Эмалевый матрикс, производные эмалевого матрикса и/или протеины эмалевого матрикса можно также использовать для лечения инфекций, вызываемых спирохетами, такими как напр. Borrelia, Leptospira, Treponema или Pseudomonas.
Антимикробные агенты, которые можно использовать вместе с эмалевым матриксом, производными эмалевого матрикса и/или протеинами эмалевого матрикса, могут быть антимикробными агентами, которые обладают антимикробным действием за счет ингибирования синтеза стенок клеток, такими как β-лактамы и ванкомицин, предпочтительно пенициллины, такие как амдиноциллин, ампициллин, амоксициллин, азлоциллин, бакампициллин, бензатин пенициллин G, карбенициллин, хлоксациллин, циклациллин, диклоксациллин, метициллин, мезлоциллин, нафциллин, оксациллин, пенициллин G, пенициллин V, пиперациллин и тикарциллин.
Цефалоспорины, такие как лекарства первого поколения цефадроксил, цефазолин, цефалексин, цефалотин, цефапирин и цефрадин, лекарства второго поколения цефаклор, цефамандол, цефоницид, цефоранид, цефокситин и цефуроксим, или цефалоспорины третьего поколения цефоперазон, цефотаксим, цефотетан, цефтазидим, цефтизоксим, цефтриаксон и моксалактам; карбафенемы, такие как имипенем; или монобактамы, такие как азтреонам.
Другие антимикробные лекарства, которые действуют за счет ингибирования синтеза протеинов, такие как хлорамфеникол; другие тетрациклины, предпочтительно демеклоциклин, доксициклин, метациклин, миноциклин и окситетрациклин; аминогликозиды, такие как амикацин, гентамицин, канамицин, неомицин, нетилмицин, паромомицин, спектиномицин, стрептомицин и тобрамицин; полимиксины, такие как колистин, колистиматат и полимиксин В, и эритромицины и линкомицины; антимикробные агенты, которые действуют за счет ингибирования синтеза нуклеиновых кислот, в частности сульфонамиды, такие как сульфацитин, сульфадиазин, сульфизоксазол, сульфаметоксазол, сульфаметизол и сульфапиридин; триметоприм, хинолонез, новобиоцин, пириметамин и рифампин.
В специфическом варианте настоящего изобретения инфекция присутствует в полости рта, и такой инфекцией может быть бактериальное состояние.
Бактерии, которые находятся в полости рта, ингибируют при контакте или борются с ними каким-либо другим способом. Примеры их (но не состояния) включают
- бактерии, вызывающие кариес, напр., Streptococcus mutans, Lactobacillus ssp.;
- бактерии, вызывающие периодонтальные заболевания, напр., Actinobaclllus actinomycetemcomitans, Porphyromonas gingivalis, Prevotella intermedia, Peptostreptococcus micros, Campylobacter (Fusobacteria, Staphylococci), B. for-sythus;
- бактерии, вызывающие альвеолиты и т.д., напр., Staphylococcus, Actinomyces и Bacillus;
- бактерии, вызывающие периапикальные поражения, напр., Spirochetes и все вышеперечисленные.
Противовоспалительное действие
Настоящее изобретение относится также к использованию эмалевого матрикса, производных эмалевого матрикса и/или протеинов эмалевого матрикса в качестве терапевтических или профилактических агентов, обладающих противовоспалительным действием.
Некоторые лекарства используют для подавления проявлений воспалений, включая адренокортикостероиды, большую группу, включающую так называемые не стероидные противовоспалительные лекарства или NSAIDs, и такие лекарства, как агенты, подавляющие иммунную систему. Адренокортикостероиды, и особенно глюкокортикоиды, обладают потенциальными противовоспалительными действиями, если их используют в фармакологических дозах. Они специфически ингибируют раннюю сосудистую фазу воспалительного процесса, уменьшая проницаемость сосудов, и тем самым, миграцию гранулоцитов. Глюкокортикоиды препятствуют также позднему воспалительному и восстановительному процессам, так как они ингибируют пролиферацию мезенхимальных клеток и продуцирование внеклеточных макромолекул, включая протеогликаны и коллаген. Было показано экспериментально, что глюкокортикоиды ингибируют, например, функцию макрофагов, продуцирование гуморальных антител, клеточный иммунитет и, возможно, выделение лизосомальных ферментов.
Серьезность поражения тканей может зависеть от реакции антиген/антитело организма, так же, как и от степени удержания продуктов воспалительного процесса в поврежденном участке. Накопление медиаторов локального воспаления ускоряет процесс. В большинстве случаев процесс протекает медленно, с иммуноинфильграцией тканей и образованием грануляционной ткани, которая содержит воспаленные клетки.
В контексте настоящего изобретения термин "противовоспалительное действие" обозначает противодействие воспалению или его подавление.
Общее и конкретное описание типа воспалительных состояний, которые нужно лечить
Воспалительные состояния, которые нужно лечить в соответствии с настоящим изобретением, могут, естественно, быть любыми воспалительными состояниями в/на любой части тела или любыми воспалительными состояниями, наблюдающимися в мягких или твердых тканях. В одном из вариантов изобретения воспалительные состояния существуют в полости рта. Примерами воспалительных состояний в полости рта служат альвеолиты, хеилиты, костный некроз (после травмы), переломы.
В другом варианте изобретения воспалительные состояния наблюдаются в костном донорском сайте. В третьем варианте изобретения воспалительные состояния наблюдаются условия в полости суставов. Примерами таких воспалительных состояний служат ревматоидные артриты и родственные состояния.
Антибактериальные свойства в сравнении с противовоспалительными свойствами
В противоположность многим используемым в настоящее время антибиотикам, протеины эмалевого матрикса не ставят под угрозу залечивание ран, и быстрое залечивание ран, в свою очередь, не оставляет места для развития хронических или длительных воспалительных процессов. Кроме того, перестройка соответствующих тканей, такая как описана после нанесения производных эмалевого матрикса на периодонтальные дефекты, очевидно предпочтительна из-за быстрого залечивания ран без бактерий или воспалительных реакций.
Нанесение эмалевого матрикса, производных эмалевого матрикса и/или протеинов эмалевого матрикса приводит к быстрому залечиванию ран после хирургических операций, возможно за счет создания поверхности, которая в контакте с бактериями ингибирует их рост, но в то же самое время повышает миграцию фибробластов и синтез коллагена. Если воспалительная стадия сокращается, такие типичные признаки, как тепло, покраснение, отек и боль становятся менее заметными.
Эмалевый матрикс, производные эмалевого матрикса и/или протеины эмалевого матрикса
Эмалевый матрикс является предшественником эмали и может быть получен из любого подходящего природного источника, т.е. от млекопитающего, у которого зубы находятся в стадии развития. Подходящими источниками являются развивающиеся зубы забитых животных, таких как, например, телят, поросят или ягнят. Другим источником является, например, рыбья чешуя.
Эмалевый матрикс можно получить из развивающихся зубов, как раскрыто ранее (ЕР-В-0337967 и ЕР-В-0263086). Эмалевый матрикс соскребают и приготавливают производные эмалевого матрикса, например, экстрагируя водным раствором, таким как буфер, разбавленная кислота или основание, или смесь вода/растворитель, с последующим исключением по размерам, обессоливанием или с помощью других стадий очистки, необязательно с последующей сушкой вымораживанием. Ферменты можно дезактивировать термообработкой или растворителями, и в этом случае производные можно хранить в виде жидкости без сушки вымораживанием.
В контексте настоящего изобретения производные эмалевого матрикса представляют собой производные эмалевого матрикса, которые включают один или несколько протеинов эмалевого матрикса, или части таких протеинов, продуцируемых природно, путем изменения сплайсинга или процессинга, или либо ферментативным, либо химическим расщеплением естественной длины протеинов, либо путем синтеза полипептидов in vitro или in vivo (рекомбинантные ДНК-методики или культивирование диштоидных клеток). Производные протеинов эмалевого матрикса включают также полипептиды или протеины, родственные эмалевому матриксу. Полипептиды или протеины могут быть связаны с подходящей биоразлагаемой молекулой носителя, такой как полиаминокислоты или полисахариды, или их комбинации. Кроме того, термин "производные эмалевого матрикса" охватывает также аналогичные вещества, полученные синтетическим путем.
Протеины являются биологическими макромолекулами, состоящими из аминокислотных остатков, связанных вместе пептидными связями. Протеины, как линейные полимеры аминокислот, называют также полипептидами. Обычно протеины содержат 50-800 аминокислотных остатков, и, следовательно, имеют молекулярный вес в интервале от около 6000 до около нескольких сотен тысяч Дальтон или более. Небольшие протеины называют пептидами или олигопептидами.
Протеины эмалевого матрикса являются протеинами, которые обычно присутствуют в эмалевом матриксе, т.е. предшественнике эмали (Ten Cate: Oral Histology, 1994; Robinson: Eur. J. Oral Science, Jan. 1998, 106 Suppl. 1:282-91), или протеинами, которые можно получить, расщепляя такие протеины. Обычно такие протеины имеют молекулярный вес ниже 120000 Дальтон, и включают амелогенины, неамелогенины, обогащенные пролином неамелогенины, амелины (амелобластин, шеатлин) и тафтелины.
Примерами протеинов для использования в соответствии с настоящим изобретением являются амелогенины, обогащенные пролином не амелогенины, тафтелин, тафт протеины, сывороточные протеины, протеины слюны, амелин, амеобластин, шеатлин, их производные и их смеси. Препараты, содержащие активное эмалевое вещество для использования в соответствии с настоящим изобретением, могут также содержать, по крайней мере, два из перечисленных выше протеинсодержащих веществ. Коммерческий продукт, включающий амелогенины и возможно другие протеины эмалевого матрикса, продается под маркой EMDOGAIN® (Biora АВ).
Вообще, основные протеины эмалевого матрикса известны как амелогенины. Они составляют около 90% (маc/маc) матриксных протеинов. Остальные 10% (маc/маc) включают обогащенные протеином неамелогенины, тафтелин, тафт протеины, сывороточные протеины, и, по крайней мере, один из протеинов слюны; однако, могут присутствовать и другие протеины, такие как например, амелин (амелобластин, шеатлин), которые были идентифицированы в связи с эмалевым матриксом. Кроме того, различные протеины можно синтезировать и/или процессировать в нескольких различных размерах (т.е. различных молекулярных масс). Так, было обнаружено, что основные протеины эмалевого матрикса, амелогенины, имеют различные размеры, а вместе они образуют надмолекулярные агрегаты. Они являются заметно гидрофобными веществами, которые в физиологических условиях образуют агрегаты. Они могут нести на себе или служить подложками для других протеинов или пептидов.
Другие протеинсодержащие вещества также рассматриваются как подходящие для использования в соответствии с настоящим изобретением. Примеры включают такие протеины, как обогащенные пролином протеины и полипролин. Другими примерами веществ, которые рассматривают как пригодные для использования в рамках настоящего изобретения являются агрегаты таких протеинов, производные эмалевого матрикса и/или протеинов эмалевого матрикса, а также метаболиты эмалевого матрикса, производных эмалевого матрикса и/или протеинов эмалевого матрикса. Эти метаболиты могут быть любого размера в интервале от размеров самих протеинов до размеров коротких пептидов.
Как было указано ранее, протеины, полипептиды или пептиды, пригодные для использования в соответствии с настоящим изобретением, обычно имеют молекулярный вес, самое большее, около 120 кДа, как например, максимум 100 кДа, 90 кДа, 80 кДа, 70 кДа или 60 кДа по данным SDS Page электрофореза.
Протеины для использования в рамках настоящего изобретения обычно присутствуют в форме препаратов, в которых содержание активного эмалевого вещества находится в интервале от около 0,05% (мас)/(мас) до 100% (мас)/(мас), как например около 5-99% (мас)/(мас), около 10-95% (мас)/(мас), около 15-90% (мас)/(мас), около 20-90% (мас)/(мас), около 30-90% (мас)/(мас), около 40-85% (мас)/(мас), около 50-80% (мас)/(мас), около 60-70% (мас)/(мас), около 70-90% (мас)/(мас) или около 80-90% (мас)/(мас).
Препарат активного эмалевого вещества для использования в способе настоящего изобретения может также содержать смесь активных эмалевых веществ различного молекулярного веса.
Протеины эмалевого матрикса можно подразделить на высокомолекулярную часть и низкомолекулярную часть, и было обнаружено, что точно определенная фракция протеинов эмалевого матрикса обладает ценными свойствами в отношении лечения периодонтальных дефектов (т.е. периодонтальных ран). Эта фракция содержит протеины, экстрагируемые уксусной кислотой, которые обычно называют амелогенинами, и которые составляют низкомолекулярную часть эмалевого матрикса (см. ЕР-В-0337967 и ЕР-В-0263086).
Как обсуждалось выше, низкомолекулярная часть эмалевого матрикса обладает подходящей активностью для индуцирования связывания между твердыми тканями в периодонтальных дефектах. Однако в настоящем контексте активные протеины не ограничены низкомолекулярной частью эмалевого матрикса. В настоящее время предпочтительны протеины включают протеины эмалевого матрикса, такие как амелогенин, амелин, тафтелин и т.д. с молекулярной массой (по данным, определенным in vitro с помощью SDS-PAGE) ниже чем около 60000 Дальтон, но протеины с молекулярной массой выше 60000 Дальтон также обладают обещающими характеристиками в качестве кандидатов для залечивания ран, в качестве антибактериальных и/или противовоспалительных агентов.
Соответственно ожидается, что активные эмалевые вещества для использования в соответствии с настоящим изобретением имеют молекулярную массу вплоть до около 40000, например, молекулярную массу от около 5000 до около 25000.
В объем настоящего изобретения включены также пептиды, раскрытые в WO 97/02730, т.е. пептиды, которые включают, по крайней мере, один элемент последовательности, выбранной из группы, состоящей из тетрапептидов DGEA (Asp-Gly-Glu-Ala), VTKG (Val-Thr-Lys-Gly), EKGE (Glu-lys-Gly-Glu) и DKGE (Asp-Lys-Gly-Glu), и который далее содержит аминокислотную последовательность, в которой последовательная цепочка из 20 аминокислот идентична по крайней мере на 80% цепочке аминокислот, имеющей ту же длину и выбранную из группы, состоящей из аминокислотной последовательности, представленной в последовательности ИД №1 и последовательности, состоящей из аминокислот 1-103 последовательности ИД №1 и аминокислот 6-324 последовательности ИД №2.
Под термином "идентичность последовательности" подразумевают идентичность в последовательности аминокислот, совпадающих по идентичности и положению с аминокислотами пептидов. Пробел, который рассматривают как не идентичный для одной или более из аминокислот, считают подходящим.
Такие пептиды могут включать от 6 до 300 аминокислот, например, по крайней мере, 20 аминокислот, по крайней мере, 30 аминокислот, например, по крайней мере 60 аминокислот, по крайней мере 90 аминокислот, по крайней мере 120 аминокислот, по крайней мере 150 аминокислот или, по крайней мере, 200 аминокислот.
Способ выделения протеинов эмалевого матрикса включает экстрагирование протеинов и удаление ионов кальция и фосфата из солюбилизированного гидроксиапатита подходящим способом, например, гель-фильтрацией, диализом или ультрафильтрацией (см. например, Janson, J-C & Ryden, L. (Eds.) Protein purification, VCH Publishers 1989 и Harris, ELV (Angal, S. Protein purification methods - A practical approach, IRL Press, Oxford 1990).
Типичный лиофилизированный протеиновый препарат может содержать в основном или исключительно вплоть до 70-90% амелогенинов с молекулярной массой от 40000 до 5000 Дальтон, причем 10-30% составляют более мелкие пептиды, соли и остаточная вода. Основные полосы протеинов находятся у 20 кДа, 12-14 кДа и около 5 кДа.
Выделяя протеины, например осаждением, с помощью ионообменной хроматографии, препаративного электрофореза, гель-проникающей хроматографии, хроматографии с обращенной фазой или афинной хроматографии, можно выделить амелогенины с различной молекулярной массой.
Комбинации амелогенинов различных молекулярных масс могут меняться от преимущественно соединений с 20 кДа до агрегации амелогенинов с множеством различных молекулярных масс от 40 до 5 кДа, и до преимущественно соединений с 5 кДа. Другие протеины эмалевого матрикса, такие как амелин, тафтелин, или протеолитические ферменты, обычно находящиеся в эмалевом матриксе, могут быть добавлены и могут переноситься агрегатом амелогенинов.
В качестве альтернативного источника производных эмалевого матрикса или протеина можно также использовать обычно применяемые синтетические способы, хорошо известные специалистам, или использовать культивируемые клетки или бактерии, модифицированные с помощью рекомбинантных ДНК-методик (см. например, Sambrook, J. et al.: Molecular Cloning, Cold Spring Harbor Laboratory Press, 1989).
Физико-химические свойства эмалевого матрикса, производных эмалевого матрикса и/или протеинов эмалевого матрикса
Обычно эмалевый матрикс, производные эмалевого матрикса и/или протеины эмалевого матрикса являются гидрофобными веществами, т.е. менее растворимыми в воде, особенно при повышенных температурах. Обычно эти протеины растворимы при не физиологических значениях рН и при низкой температуре, такой как около 4-20°С, тогда как они образуют агрегаты и осаждаются при температуре тела (35-37°С) и нейтральных значениях рН.
Эмалевый матрикс, производные эмалевого матрикса и/или протеины эмалевого матрикса для использования в способе настоящего изобретения включают также активное эмалевое вещество, где, по крайней мере, часть активного эмалевого вещества находится в форме агрегатов, или после нанесения in vivo способна образовывать агрегаты. Размер частиц агрегатов находится в интервале значений от около 20 нм до около 1 мкм.
Предполагается, что характеристики растворимости эмалевого матрикса, производных эмалевого матрикса и/или протеинов эмалевого матрикса играют важную роль в связи с профилактической и терапевтической активностями веществ. Если композицию, содержащую эмалевый матрикс, производные эмалевого матрикса и/или протеины эмалевого матрикса (далее также называемые "активное эмалевое вещество" в качестве общего термина) вводить, например, человеку, протеиновые вещества будут осаждаться, так как рН имеет значение преимущественно существующее в физиологических условиях. Так образуется слой эмалевого матрикса, производных эмалевого матрикса и/или протеинов эмалевого матрикса на участке нанесения, и этот слой (который может быть также молекулярным слоем в тех случаях, когда образовались агрегаты) трудно смыть в физиологических условиях. Кроме того, благодаря биоадгезивным свойствам веществ (см. далее) осажденный слой прочно связан с тканью также на границе между осажденным слоем и тканью. Таким образом, протеинсодержащий слой покрывает ткань, на которую был нанесен эмалевый матрикс, производные эмалевого матрикса и/или протеины эмалевого матрикса или их композиции, и активные вещества эмали сохраняются на месте в течение продолжительного промежутка времени, т.е. нет необходимости вводить активные эмалевые вещества через короткие промежутки времени. Кроме того, слой, образованный in situ, можно почти сравнить с окклюзивной повязкой, т.е. образовавшийся слой защищает ткань, на которой этот слой образовался, от окружающей среды. В случае раневых тканей, инфицированных тканей или воспаленных тканей такой слой защищает ткани от дальнейшего загрязнения микроорганизмами, присутствующими в окружающей среде. Кроме того, протеинсодержащий слой может проявить свое действие путем непосредственного контакта с тканями или с микроорганизмами, присутствующими в тканях, на тканях или у тканей.
Для того чтобы облегчить образование протеинового слоя in situ после нанесения, может оказаться выгодным включить подходящее буферное вещество в фармацевтическую или косметическую композицию эмалевого матрикса, производных эмалевого матрикса и/или протеинов эмалевого матрикса; цель такого буферного вещества должна состоять в том, чтобы избежать растворения активного эмалевого вещества на участке нанесения.
Эмалевый матрикс, производные эмалевого матрикса и/или протеины эмалевого матрикса, как наблюдали (авторы настоящего изобретения), обладают биоадгезовными свойствами, т.е. они обладают способность прикрепляться к поверхности кожи или поверхности слизистой оболочки. Эти свойства имеют наибольшую ценность в связи с терапевтическим и/или профилактическим лечением, по крайней мере, по следующим причинам:
- профилактически и/или терапевтически активное вещество (вещества) может сохраняться на участке нанесения в течение длительного промежутка времени (т.е. i) можно уменьшить частоту введения, ii) достигается контролируемый эффект выделения вещества и/или iii) улучшается локальное лечение на участке нанесения);
- эти вещества могут сами использоваться в качестве носителей для других профилактически или терапевтически активных веществ, так как носитель, содержащий эмалевый матрикс, производные эмалевого матрикса и/или протеины эмалевого матрикса, может быть приготовлен как биоадгезивный носитель (т.е. новая биоадгезивная система доставки лекарств на основе эмалевого матрикса, производных эмалевого матрикса и/или протеинов эмалевого матрикса).
Теории в отношении механизма действия
Эмалевый матрикс является примером внеклеточного протеинового матрикса, который пристает к минеральным поверхностям, а также к содержащим протеин поверхностям. При физиологических значениях рН и температуре протеины образуют нерастворимые надмолекулярные агрегаты (Fincham et al. в J. Struct. Biol. 1994 March-April; 112(2):103-9 и в J.Struct. Biol. 1995 July-August; 115(1):50-9), которые постепенно разлагаются под действием протеолитических ферментов (это происходит как in vivo так и in vitro, при условии, что протеазы не подверглись инактивации).
Последние наблюдения того, что эмалевый матрикс образуется и временно присутствует в процессе образования корней и корневого цемента, помогают объяснить, каким образом нанесение эмалевого матрикса, производных эмалевого матрикса и/или протеинов эмалевого матрикса промотирует восстановление периодентальной ткани. Однако наблюдения, которые лежат в основе настоящего изобретения, о том, что эмалевый матрикс, производные эмалевого матрикса и/или протеины эмалевого матрикса также оказывают положительное воздействие на залечивание дефектов мягких тканей, подобно залечиванию ран, оказалось весьма неожиданным. То же относится и к наблюдениям в отношении антиинфекционного и противовоспалительного действия.
Во многих случаях остатки эмалевого матрикса обнаруживаются в свежеминерализованной верхушке, когда зуб прорезается в полость рта. Это можно объяснить тем, что новый зуб мог бы быть очень подвержен нападению бактерий, обычно присутствующих в полости рта, если бы он не имел естественной защиты во время этой начальной фазы.
Нанесение несолюбилизирующегося эмалевого матрикса, производных эмалевого матрикса и/или протеинов эмалевого матрикса, обладающих антибактериальными и/или противовоспалительными свойствами, на раневую поверхность ускорит и улучшит залечивание.
Как показано далее в экспериментальном разделе, агрегаты эмалевого матрикса, производных эмалевого матрикса и/или протеинов эмалевого матрикса препятствуют росту бактерий путем ингибирования при контакте, тогда как экспонированные клетки, по-видимому, реагируют на эмалевый матрикс как на нормальное окружение, которое подавляет воспалительные реакции.
В соответствии с настоящим изобретением эмалевый матрикс, производные эмалевого матрикса и/или протеины эмалевого матрикса можно использовать для лечебных целей, так же, как и для профилактики. Кроме того, эмалевый матрикс, производные эмалевого матрикса и/или протеины эмалевого матрикса можно использовать вместе с другими активными лекарственными веществами, такими как, например, антибактериальные, противовоспалительные, антивирусные, противогрибковые вещества, или в сочетании с факторами роста, такими как, например, TGFβ, PDGF, IGF, FGF, фактор роста кератиноцитов или их пептидные аналоги (считают, что EGF промотирует залечивание, усиливая миграцию и деление эпителиальных клеток; кроме того, EGF увеличивает количество фибробластов в ранах, что приводит к увеличению выработки коллагена). Ферменты - либо исходно присутствующие в эмалевом матриксе или его препаратах, либо добавленные - также можно использовать в комбинации с эмалевым матриксом, производными эмалевого матрикса и/или протеинами эмалевого матрикса, особенно это относится к протеазам.
Препарат активного эмалевого вещества обычно приготавливают в виде фармацевтической или косметической композиции. Такая композиция, естественно, может состоять из протеинового препарата или может далее содержать фармацевтически или косметически приемлемый эксципиент. Наиболее подходящими эксципиентами для использования в фармацевтических или косметических композициях являются пропиленгликольальгинат или гиалуроновая кислота или их соли или производные.
Фармацевтические и/или косметические композиции
Далее приведены примеры подходящих композиций, содержащих активное эмалевое вещество (вещества). В зависимости от предполагаемого использования активного эмалевого вещества (веществ) композиция может быть фармацевтической или косметической композицией. В дальнейшем термин "фармацевтическая композиция" будет использоваться как включающий косметические композиции, а также композиции, относящиеся к так называемой промежуточной области между фармацевтическими и косметическими композициями, а именно космецевтическим композициям.
Для введения индивидууму (животному или человеку) эмалевый матрикс, производные эмалевого матрикса и/или протеины эмалевого матрикса (в дальнейшем обозначаемые как "активное эмалевое вещество") и/или их препараты предпочтительно приготавливают в виде фармацевтической композиции, содержащей активное эмалевое вещество и, необязательно, один или более из фармацевтически приемлемых эксципиентов.
Эти композиции могут быть в форме, например, твердых, полутвердых или жидких композиций, таких как, например:
биоабсорбируемые пластыри, drenches, повязки, гидрогельные повязки, гидроколлоидные повязки, пленки, пены, листы, бандажи, пластыри, устройства доставки, имплантаты,
порошки, гранулы, грануляты, капсулы, агарозные или хитозановые шарики, таблетки, пилюли, хлопья, микрокапсулы, микросферы, наночастицы,
спреи, аэрозоли, ингаляционные устройства,
гели, гидрогели, пасты, мази, кремы, мыла, суппозитории, вагитории, зубные пасты,
растворы, дисперсии, суспензии, эмульсии, смеси, лосьоны, элексиры для полоскания рта, шапмуни, растворы для клизм,
наборы, содержащие два отдельных контейнера, причем один из контейнеров содержит активное эмалевое вещество необязательно в смеси с другим активным лекарственным веществом и/или фармацевтически приемлемым эксципиентом, а второй контейнер содержит подходящую среду, которую нужно добавить к содержимому первого контейнера перед использованием для получения готовой к использованию композиции;
и в других подходящих формах, таких как, например, имплантаты или покрытия имплантатов, или в форме, подходящей для использования в связи с имплантацией или трансплантацией.
Композиции для нанесения на кожу или на слизистую оболочку считаются наиболее важными в связи с настоящим изобретением. Так, композиция активного эмалевого вещества, которую нужно ввести, может быть адаптирована для введения любым подходящим способом, например, поверхностно (на кожу), перорально, за щеку, через нос, через ухо, ректально или вагинально, или путем нанесения на полость тела, например на корень зуба или в канал корня зуба. Кроме того, композицию можно адаптировать для введения в связи с хирургической операцией, например, в связи с разрезом внутри тела для промотирования залечивания внутренних ран и повреждений мягких тканей.
Как было указано ранее, композиция активного эмалевого вещества (веществ) может быть полезной при хирургических операциях, например, для локального нанесения (например, в полости рта) в форме геля, пленки или сухой таблетки, или как раствор для промывания или средство для обработки пастами или кремами тканей или поверхностей для предотвращения заражения бактериями. В связи с хирургическими операциями или имплантацией в области канала корня зуба можно использовать пасту для того, чтобы закрыть полость.
Эти композиции можно приготовить в соответствии с обычной фармацевтической практикой, см., например, "Remington′s Pharmaceutical Sciences" и "Encyclopedia of Pharmaceutical Technology" edited by Swarbrick, J.(J.C. Boylan, Marcel Dekker, Ink., New York, 1988.
Как было указано выше, нанесение композиции, включающей активное эмалевое вещество, предполагается на кожу или на слизистую оболочку. Естественно возможны и другие варианты нанесения, такие как, например, нанесение на зубные протезы, на протезы, имплантаты и нанесения в полости тела, такие как полости рта и носа и в вагинальную полость. Слизистую оболочку выбирают, предпочтительно, из слизистой полости рта, щек, носа, уха, ректальной и вагинальной лизистой оболочки. Кроме того, наносить композицию можно непосредственно на рану или внутрь ее, или на другие поражения мягких тканей.
Кроме того, большое значение имеет внесение внутрь дентальных/стоматологических участков. Соответствующими примерами служат нанесения в периодонтальные (дентальные) карманы, на десны или на раны десен, или на другие раны, расположенные в полости рта, или в связи с хирургическими операциями в полости рта.
Предполагается также, что благодаря описанным здесь антибактериальным свойствам активного эмалевого вещества может оказаться выгодным наносить композиции на зубы или корни зубов для предотвращения кариеса и/или бляшек. В пользу такого использования было показано (Weinmann, J.P. et al: Hereditary disturbances of enamel formation and calcification, J.Am.Dent. Ass. 32:397-418, 1945; Sundell S, Hereditary amelogenesis imperfecta. Аn epidemiological, genetic and clinical study in a Swedish child population, Swed Dent J. Suppl. 1986; 31: 1-38), что зубы, которые неправильно развиваются (amelogenesis imperfecta) и соответственно содержат большие количества амелогенина, заметно устойчивы в отношении кариеса.
Фармацевтическая композиция, содержащая активное эмалевое вещество, служит системой доставки лекарств. В контексте настоящего изобретения термин "система доставки лекарств" обозначает фармацевтическую композицию (фармацевтическая композиция или дозированная форма), которая после введения доставляет активное вещество в организм человека или животного. Так, термин "система доставки лекарств" охватывает простые фармацевтические композиции, такие как кремы, мази, жидкости, порошки, таблетки и т.д., а также более сложные композиции, такие как спреи, пластыри, бандажи, повязки, устройства и т.д.
Помимо активного эмалевого вещества фармацевтическая композиция для использования в соответствии с настоящим изобретением может включать фармацевтически или косметически приемлемые эксципиенты.
Фармацевтически или косметически приемлемым эксципиентом является вещество, которое практически безвредно для индивидуума, которому должна быть введена эта композиция. Такие эксципиенты обычно удовлетворяют требованиям документов о здоровье нации. В официальных фармакопеях, таких как British Pharmacopoeia, the United States of America Pharmacopoeia and The European Pharmacopoeia, сформулированы стандарты для фармацевтически приемлемых эксципиентов.
Подходит ли фармацевтически приемлемый эксципиент для использования в фармацевтической композиции, обычно зависит от того, какого типа дозовую форму выбирают для конкретного типа раны. Далее приводятся примеры подходящих фармацевтически приемлемых эксципиентов для использования в различных типах композиций для использования в соответствии с настоящим изобретением.
Далее приводится обзор соответствующих фармацевтических композиций для использования в соответствии с настоящим изобретением. Этот обзор основан на конкретных способах введения. Однако следует учитывать, что в тех случаях, когда фармацевтически приемлемый эксципиент может быть использован в различных дозовых формах или композициях, использование конкретного фармацевтически приемлемого эксципиента не ограничивается конкретной дозовой формой или конкретной функцией эксципиента.
Выбор фармацевтически приемлемого эксципиента (эксципиентов) в композиции для использования в соответствии со способом настоящего изобретения и его оптимальная концентрация обычно не могут быть предсказаны и должны определяться на основании экспериментальной оценки конечной композиции. Однако специалисты в области фармацевтических композиций могут найти рекомендации, например, в "Remington′s Pharmaceutical Sciencs", 18th Edition, Mack Publishing Comраnу, Easton, 1990.
Композиции для локального нанесения
Для нанесения на слизистую оболочку или на кожу композиции для использования в соответствии со способом настоящего изобретения могут содержать обычные не токсичные фармацевтически приемлемые носители и эксципиенты, включая микросферы и липосомы.
Композиции для использования в соответствии со способом настоящего изобретения включают все типы твердых, полутвердых и жидких композиций. Наиболее важными конкретными композициями являются, например, пасты, мази, гидрофильные мази, кремы, гели, гидрогели, растворы, эмульсии, суспензии, лосьоны, линименты, шампуни, желе, мыла, палочки, спреи, порошки, пленки, пены, тампоны, губки (например, коллагеновые губки), прокладки, повязки (такие, как, например, абсорбирующие повязки на раны), drenches, бандажи, пластыри и системы для доставки через кожу.
Фармацевтически приемлемые эксципиенты могут включать растворители, буферирующие агенты, консерванты, увлажнители, хелатирующие агенты, антиоксиданты, стабилизаторы, эмульгирующие агенты, суспендирующие агенты, гель-образующие агенты, основы для мазей, агенты, облегчающие проникновение, ароматизаторы и защищающие кожу агенты.
Примерами растворителей служат, например, вода, спирты, растительные масла или масла из продуктов моря (например, такие съедобные масла, как миндальное масло, касторовое масло, масло какао, кокосовое масло, кукурузное масло, масло из семян хлопчатника, льняное масло, оливковое масло, пальмовое масло, арахисовое масло, масло из маковых семян, рапсовое масло, кунжутное масло, соевое масло, подсолнечное масло и чайное масло), минеральные масла, жирные масла, жидкий парафин, полиэтиленгликоли, пропиленгликоли, глицерин, жидкие полиалкилсилоксаны и их смеси.
Примерами буферирующих агентов являются, например, лимонная кислота, уксусная кислота, винная кислота, молочная кислота, гидрофосфорная кислота, диэтиламин и т.д.
Подходящими примерами консервантов для использования в композициях настоящего изобретения являются парабены, такие как метил, этил, пропил парагидроксибензоат, бутилпарабен, изобутилпарабен, изопропилпарабен, сорбат калия, сорбиновая кислота, бензойная кислота, метилбензоат, феноксиэтанол, бронопол, бронидокс, MDM гидантоин, йодопропинил бутилкарбамат, ЕDТА, бензалконийхлорид и бензиловый спирт, или смеси консервантов.
Примерами увлажнителей являются глицерин, пропиленгликоль, сорбит, молочная кислота, мочевина и их смеси.
Примерами хелатирующих агентов являются натрий EDTA и лимонная кислота.
Примерами антиоксидантов являются бутилированный гидроксианизол (ВНФ), аскорбиновая кислота и их производные, токоферол и его производные, цистеин и их смеси.
Примерами эмульгирующих агентов являются природные смолы, например, смола акации или смола трагакант; природные фосфатиды, например, соевый лецитин; производные сорбитанмоноолеата; жиры волокон; спирты волокон; сложные сорбитановые эфиры; моноглицериды; жирные спирты; сложные эфиры жирных кислот (например триглицериды жирных кислот); и их смеси.
Примерами суспендирующих агентов являются, например, целлюлозы и производные целлюлоз, такие как, например, карбоксиметилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, каррагенан, смола акации, аравийская камедь, трагакант и их смеси.
Примерами оснований для гелей, повышающих вязкость агентов или компонентов, которые способны поглощать образующийся в ранах экссудат, являются: жидкий парафин, полиэтилен, жирные масла, коллоидная двуокись кремния или окись алюминия, цинковые мыла, глицерин, пропиленгликоль, трагакант, карбоксивиниловые полимеры, магний-алюминиевые силикаты, Carbopol®, гидрофильные полимеры, такие как, например производные крахмала или целлюлозы, такие как, например, карбоксиметилцеллюлоза, гидроксиэтилцеллюлоза и другие производные целлюлозы, набухающие от воды гидроколлоиды, каррагенаны, гиалуронаты (например, гиалуронатный гель, необязательно содержащий хлорид натрия), и альгинаты, включая пропиленгликольальгинат.
Примерами оснований для мазей являются пчелиный воск, парафин, цетанол, цетилпальмитат, растительные масла, сложные сорбитановые эфиры жирных кислот (Span), полиэтиленгликоли и продукты конденсации сложных сорбитановых эфиров жирных кислот и этиленоксида, например, полиоксиэтиленсорбитанмоноолеат (Tween).
Примерами гидрофобных или эмульгируемых в воде оснований для мазей являются парафины, растительные масла, животные жиры, синтетические глицериды, воски, ланолин и жидкие полиалкилсилоксаны.
Примерами гидрофильных оснований для мазей являются твердые макроголи (полиэтиленгликоли).
Другими примерами оснований для мазей являются триэтаноламиновые мыла, сульфатированные жирные спирты и полисорбаты.
Примерами порошковых компонентов являются: альгинат, коллаген, лактоза, порошки, которые способны образовывать гели после нанесения на рану (абсорбируют жидкость/эксудат раны). Обычно порошки, предназначенные для нанесения на обширные открытые раны, должны быть стерильными и присутствующие в них частицы должны быть тонко измельченными.
Примерами других эксципиентов являются полимеры, такие как карамелоза, натрийкарамелоза, гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, пектин, ксантангум, смола бобов локусты, смола акации, желатин, карбомер, эмульгаторы, подобные витамину Е, глицерилстеараты, цетанилглюкозид, коллаген, каррагенан, гиалуронаты и альгинаты и хитозаны.
Повязки и/или бандажи также являются важными системами доставки активного эмалевого вещества. Если повязки используют в дозированной форме, активное эмалевое вещество может быть скомбинировано с другими материалами/ингредиентами до или во время изготовления повязок, например, за счет погружения повязки в раствор или дисперсию активного эмалевого вещества, или путем нанесения раствора или дисперсии активного эмалевого вещества на повязку распылением. В другом варианте активное эмалевое вещество можно наносить на повязку в форме порошка. Повязки могут быть в форме абсорбирующих повязок на раны, которые должны поглощать экссудат из ран. Повязки могут быть также в форме гидрогельных повязок (например, сшитых полимеров, таких как, например, Intra-site®, который содержит карбоксиметилцеллюлозу, пропиленгликоль или полисахариды, дисахариды и протеины), или в форме окклюзивных повязок, таких как, например, альгинаты, хитозан, гидрофильные полиуретановые пленки, коллагеновые листы, пластинки, порошки, пены или губки, пены (например, полиуретан или силикон), гидроколлоиды (например, карбоксиметилцеллюлоза, CMC), повязки на основе коллагена и гиалуроновой кислоты, включая их комбинации.
Альгинат, хитозан и гидроколлоидные повязки поглощают эксcудат из раны, когда их помещают на рану. При этом они образуют водный гель на поверхности раны, и считают, что этот гель благоприятен для залечивания раны благодаря тому, что он сохраняет влагу в ране.
Представляется, что активное эмалевое вещество может быть включено в тканевый адгезив, который также включает, например, фибриноген и тромбин и необязательно Фактор XIII или другой фактор коагуляции плазмы для обеспечения гемостаза. Тканевый адгезив можно либо получить в виде предварительной смеси активного эмалевого вещества, фибриногена и необязательно Фактора XIII, причем тромбин добавляют к предварительной смеси непосредственно перед тем, как тканевый адгезив наносят на рану. В другом варианте предварительную смесь фибриногена и активного эмалевого вещества и необязательно Фактор XIII можно наносить на рану перед нанесением тромбина. In situ тромбин превращает фибриноген в фибрин, тем самым воспроизводя процесс коагуляции, который естественно происходит при залечивании раны. Присутствие активного эмалевого вещества в тканевом адгезиве может служить для ускорения процесса залечивания ран, как обсуждалось выше. Коммерческим продуктом, подходящим для включения активного эмалевого вещества, является Tisseel®, двухкомпонентный фибриновый уплотнитель, производимый Immuno, AG, Vienna, Austria.
В рецептурах зубных паст или жидкостей для полоскания рта, или других композиций, предназначенных для нанесения на зубы или корни зубов, активное эмалевое вещество может присутствовать либо в растворенном состоянии в носителе со слегка кислым значением рН, либо в виде дисперсии в носителе с нейтральным значением рН. Следует учитывать, что в процессе использования активное эмалевое вещество может образовывать защитный слой на поверхности зубов, тем самым предотвращая прикрепление бактерий, служащих причиной кариеса (см. пример 4 далее). В таких препаратах для ухода за зубами активное эмалевое вещество может быть вместе с одним или более из соединений, которые обладают предотвращающим кариес действием, особенно фтором или другими следовыми элементами, такими как ванадий или молибден. При нейтральных значения рН следовой элемент, как считают, связан с (например, ионной связью) или включен в активное эмалевое вещество, из которого он выделяется, осуществляя свое профилактическое действие, когда активное эмалевое вещество растворено при рН около 5,5 или менее, например, за счет кислоты, которую выделяют вызывающие кариес бактерии.
Указанные выше композиции для локального применения лучше всего пригодны для непосредственного нанесения на раны, или они могут быть удобны для нанесения на или для введения в соответствующее отверстие (отверстия) тела, например, ректальное, уретральное, вагинальное отверстия, в ухо, в нос или в полость рта. Такую композицию можно просто нанести непосредственно на участок, подлежащий обработке, такой как, например, слизистая оболочка, или любым другим удобным способом нанесения.
Композиции, которые, как было доказано, играют важную роль при локальном нанесении, являются такими композициями, которые обладают тиксотропными свойствами, т.е. на вязкость композиции влияет, например, встряхивание или перемешивание, так, что вязкость композиции в момент нанесения может уменьшаться, а после нанесения композиции вязкость повышается так, что композиция остается на участке нанесения.
Композиции для использования в полости рта, или для нанесения на слизистую оболочку или кожу
Подходящие композиции для использования в соответствии со способом настоящего изобретения могут также быть в форме суспензий, эмульсий или дисперсий. Такие композиции содержат активное эмалевое вещество в смеси с диспергирующим или смачивающим агентом, суспендирующим агентом, и/или одним или более из консервантов и другими фармацевтически приемлемыми эксципиентами. Такие композиции можно будет также использовать для доставки активного эмалевого вещества, например, на интактную или поврежденную слизистую оболочку, такую как, например слизистая полости рта, щеки, носа, ректальная или вагинальная слизистая оболочка, или для нанесения на интактную или поврежденную кожу или раны.
Подходящими диспергирующими или смачивающими агентами являются, например, природные фосфатиды, например, лецитин или лецитин сои; продукты конденсации этиленоксида, например, с жирной кислотой, алифатическим спиртом с длинной цепочкой, или производного частичного сложного эфира, полученного из жирных кислот и гекситола или ангидрида гекситола, например, полиоксиэтиленстеаратом, полиоксиэтиленсорбитолмоноолеатом, полиоксиэтиленсорбитанмоноолеатом и т.д.
Подходящими суспендирующими агентами являются, например, природные смолы, например смола акации, ксантангам или смола трагаканта; целлюлозы, такие как, например, натрийкарбоксиметилцеллюлоза, микрокристаллическая целлюлоза (например, Avicel® RC 591, метилцеллюлоза); альгинаты и хитозаны, такие как, например, альгинат натрия, и т.д.
Подходящими примерами консервантов для использования в соответствии со способом настоящего изобретения являются те же, что были указаны выше.
Композиции для использования в соответствии со способом настоящего изобретения можно также вводить перорально. Подходящие композиции для перорального использования могут быть в форме композиций с измельченными частицами или в форме твердых, полутвердых или жидких дозовых форм.
Композиции для перорального использования включают твердые дозовые формы, такие как, например, порошки, гранулы, грануляты, саше, таблетки, капсулы, шипучие таблетки, жевательные таблетки, пастилки, таблетки с мгновенным выделением и таблетки с регулируемым выделением, а также жидкости или жидкие композиции, такие как, например, растворы, суспензии, эмульсии, дисперсии и смеси. Кроме того, композиции могут быть в форме порошков, диспергируемых порошков, или гранул, пригодных для приготовления водных суспензий в результате добавления жидкой среды, такой как, например, водная среда.
Что касается твердых дозированных форм для перорального (или локального) использования, композиция для использования в соответствии со способом настоящего изобретения содержит активное эмалевое вещество и еще любое активное вещество необязательно в смеси с одним или более из фармацевтически приемлемых эксципиентов. Этими эксципиентами могут быть, например:
инертные разбавители или наполнители, такие как сахароза, сорбит, сахар, маннит, микрокристаллическая целлюлоза, крахмалы, включая картофельный крахмал, карбонат кальция, хлорид натрия, лактоза, фосфат кальция, сульфат кальция или фосфат натрия;
гранулирующие и разрыхляющие агенты, например производные целлюлозы, включая микрокристаллическую целлюлозу, крахмалы, включая картофельный крахмал, натрийкроскарамеллоза, альгинаты или альгиновая кислота и хитозаны;
связующие агенты, например, сахарозу, глюкозу, сорбит, акацию, альгиновую кислоту, альгинат натрия, желатин, крахмал, прежелатинизированный крахмал, микрокристаллическую целлюлозу, магний-алюминий силикат, натрийкарбоксиметилцеллюлозу, метилцеллюлозу, гидроксипропилметилцеллюлозу, этилцеллюлозу, поливинилпирролидон, поливинилацетат или полиэтиленгликоль; и хитозаны;
смазывающие агенты, включая скользящие и антиадгезивы, например, стеарат магния, стеарат цинка, стеариновую кислоту, двуокись кремния, гидрированные растительные масла или тальк.
Другими фармацевтически приемлемыми эксципиентами могут быть красители, вкусовые агенты, пластификаторы, увлажнители, буферирующие агенты и т.д.
В тех случаях, когда фармацевтическая композиция представлена в форме твердой дозовой формы в единичной дозовой форме (например, в форме таблетки или капсулы), единичная дозовая форма может быть с нанесенным покрытием, подобным одному или более из покрытий, указанных далее.
В тех случаях, когда фармацевтическая композиция представлена в форме таблетки, капсулы или композиции из множества единиц, композиция или отдельные единицы или таблетка или капсула, содержащая отдельные единицы, может быть покрыта, например, сахарной оболочкой, пленкой (например, на основе гидроксипропилметилцеллюлозы, метилцеллюлозы, метил-гидроксиэтилцеллюлозы, гидроксипропилцеллюлозы, карбоксиметилцеллюлозы, сополимеров акрилата (Eudragit), полиэтиленгликолей и/или поливинилпирролидона) или желудочной оболочкой (на основе сополимера метакриловой кислоты (Eudragit), ацетатфталата целлюлозы, гидроксипропилметилцеллюлозы фталата, гидроксипропилметилцеллюлозы ацетат сукцината, поливинилацетат фталата, шеллака и/или этилцеллюлозы).
Кроме того, может быть использован материал, обеспечивающий замедленное выделение, такой как моностеарат глицерина или дистеарат глицерина.
Композиции для ректального и/или вагинального использования
Для нанесения на ректальную или вагинальную слизистую оболочку подходящие композиции для использования в соответствии со способом настоящего изобретения включают суппозитории (эмульсионного или суспензионного типа), препараты для клизм и ректальные желатиновые капсулы (растворы или суспензии). Основы для соответствующих фармацевтически приемлемых суппозиториев включают масло какао, этерифицированные жирные кислоты, глицеринированный желатин и различные водорастворимые или диспергируемые основания, подобные полиэтиленгликолям, и сложные эфиры полиоксиэтиленсорбитановых жирных кислот. Могут быть включены различные добавки, например усиливающие действие агенты или поверхностно-активные агенты.
Назальные композиции
Для нанесения на слизистую оболочку носа (а также на слизистую оболочку полости рта) подходят такие композиции в соответствии со способом настоящего изобретения, как спреи и аэрозоли для ингаляции. В типичных назальных композициях активное эмалевое вещество присутствует в форме измельченных частиц, необязательно диспергированных в подходящем носителе. Фармацевтически приемлемые носители и эксципиенты и необязательно другие фармацевтически приемлемые материалы, присутствующие в композиции, такие как разбавители, усиливающие действие агенты, вкусовые агенты, консерванты и т.д., все выбирают в соответствии с обычной фармацевтической практикой специалисты в области приготовления фармацевтических препаратов.
Дозы эмалевого матрикса, производных эмалевого матрикса и/или протеинов эмалевого матрикса
В фармацевтических композициях для использования в соответствии со способом настоящего изобретения на коже или слизистой оболочке активное эмалевое вещество обычно присутствует в концентрации в интервале от около 0,01% до около 99,9% (мас)/(мас). Количество наносимой композиции обычно должно соответствовать количеству полного протеина на см2 раны/кожи/ткани, соответствующему от около 0,01 мг/см2 до около 20 мг/см2, например от около 0,1 мг/см2 до около 15 мг/см2.
Количество наносимой композиции зависит от концентрации активного эмалевого вещества в композиции и от скорости выделения активного эмалевого вещества из композиции, но обычно бывает в интервале, соответствующем самое большее около 15-20 мг/см2.
В тех случаях, когда активное эмалевое вещество вводят в форме жидких композиций, концентрация активного эмалевого вещества в композиции находится в интервале значений от около 0,1 до около 50 мг/мл. В некоторых случаях могут быть желательны более высокие концентрации, и они могут достигать величин, по крайней мере, около 100 мг/мл.
Если композицию вводят в полость рта, уместны следующие дозы:
Экспериментально вызванные дефектные участки (у обезьян) в полости рта обычно имеют размер от около 4×2×5-6 мм, чему соответствует 50 мкл, или от около 0,025 до около 0,15 мг полного протеина/см2 или около 2,5-15 мг/см2. Обычно наносят вплоть до 0,5, например, 0,4, 0,3, 0,2 или 0,1 мл композиции с концентрацией около 1-40 мг/мл, например, 5-30 мг/мл.
Дефектные участки у людей в полости рта и связанные с периодонтальными заболеваниями обычно имеют размер около 5-10×2-4×5-10 мм, чему соответствует около 200 мкл и обычно наносят максимально около 0,5-1 мл, например, около 0,2-0,3 мл на зуб композиции с концентрацией около 1-40 мг полного протеина/мл, например, 5-30 мг/мл. 0,2-0,3 мг/мл соответствует около 6 мг протеина на 25-100 мм2 или около 0,1 мг/мм2, если рассчитывать только на поверхность корня. Обычно вносят избыточный объем, чтобы обеспечить покрытие всей поверхности. Даже нанесение нескольких слоев потребует всего лишь части вышеуказанных количеств.
Обычно около 0,1-0,5 мл, например около 0,15-0,3 мл, или около 0,25-0,35 мл композиции, включающей активное эмалевое вещество, вносят в дефектные объемы экстракционных альвеол (полости после удаления зубов). Концентрация активного эмалевого вещества в композиции обычно составляет около 1-40 мг полного протеина/мл, например, 5-30 мг/мл. Если вносят 0,3-0,4 мл такой композиции для зуба мудрости, этот объем соответствует около 0,1 мг/см2 (объем альвеолы рассчитывают как цилиндр с радиусом 5 мм и высотой 20 мм).
Концентрация активного эмалевого вещества в фармацевтической композиции зависит от конкретного эмалевого вещества, его эффективности, тяжести заболевания подлежащего лечению или профилактике, и возраста и состояния пациента. Способы определения подходящих концентраций активного эмалевого вещества в фармацевтической композиции хорошо известны специалистам в этой области, и их можно осуществить в соответствии с рекомендациями для хорошей клинической практики (GCP) или инструкциями Investigational New Drug Exemtion ("IND") как описано, например, в International Standard ISO/DIS 14155 Clinical investigation of medical devices, 1944 и ICH (International Committee for Harmonisation): Harmonised tripartite guideline for good clinical practice, Brookwood Medical Publications, Ltd, Surrey, UK, 1996. Специалисты, естественно, используя способы, описанные в стандартных справочниках, руководства и рекомендации, описанные выше, а также обычные общие знания в этой области, смогут выбрать точный дозовый режим, который следует осуществить для любого активного эмалевого вещества и/или выбрать другие активные вещества и дозовые формы, используя просто рутинные экспериментальные способы.
В других аспектах изобретение относится к способам для i) профилактики и/или лечения ран, ii) уменьшения инфекции и iii) профилактики и/или лечения воспалений, причем эти способы включают введение нуждающемуся в этом лечении млекопитающему эффективного количества активного эмалевого вещества.
Как должно быть понятно, подробности и детали, относящиеся к использованию активного эмалевого вещества для профилактики и/или лечения ран, будут такими же, как, или аналогичными подробностям и деталям, относящимся к другим аспектам использования (антибактериальный и противовоспалительный аспекты), и способам обсуждавшихся выше аспектов, и это означает, что там, где только это возможно, указанные выше утверждения, касающиеся активного эмалевого вещества, препаратов, содержащих активное эмалевое вещество и фармацевтических композиций, содержащих активное эмалевое вещество, приготовления i) активного эмалевого вещества, ii) препаратов, содержащих активное эмалевое вещество, iii) фармацевтических композиций, содержащих активное эмалевое вещество, также как и улучшения свойств и применений применяют mutatis mutandis ко всем аспектам настоящего изобретения.
Краткое описание чертежей
Далее настоящее изобретение раскрыто со ссылкой на прилагаемые чертежи, где
Фиг.1 представляет график, демонстрирующий ДНК-синтез в человеческих PDL клетках, стимулированных EMD, или в не стимулированных клетках;
Фиг.2 представляет график, демонстрирующий TGF-β1 продуцирование в человеческих PDL клетках, стимулированных EMD и в не стимулированных клетках;
Фиг.3 представляет схематическое изображение проточной камеры и компьютерной системы, использованной в проточном эксперименте, описанном в примерах 3 и 4 далее;
Фиг.4, 5 и 6 представляют графики, демонстрирующие результаты трех различных экспериментов, демонстрирующих прикрепление Actinomyces viscosus к стеклянным пластинкам, обработанным EMD и уксусной кислотой, соответственно;
Фиг.7, 8 и 9 представляют графики, демонстрирующие результаты трех различных экспериментов, демонстрирующих прикрепление Streptococcus mutans к стеклянным пластинкам, обработанным EMD и уксусной кислотой, соответственно;
Фиг.10А представляет фотографию рентгенограммы, демонстрирующей постоперационное повреждение после удаления зуба мудрости;
Фиг.10В представляет фотографию рентгенограммы, демонстрирующей регенерацию лигамента после обработки EMD, как раскрыто в примере 12 далее.
Экспериментальный раздел
Материалы и способы
Производное эмалевого матрикса, EMDOGAIN® (от BIORA АВ 3-205 12 Maimo, Sweden, содержащего 30 мг высушенного замораживанием протеина эмалевого матрикса (сокращаемого далее как EMD) и 1 мл раствора носителя (пропиленгликольальгинат), которые смешаны перед нанесение, если только протеин и носитель не тестируют отдельно. Весовое соотношение составляет около 85/5/10 между основными пиками на 20, 14 и 5 кДа, соответственно.
Термообработанный EMD представляет собой EMD, который нагревали в течение 3 часов при температуре примерно 80°С для инактивации остатков протеаз.
Амелогениновый 20 кДа протеин и пептид амелогенина с высоким содержанием тирозина (TRAP) 5 кДа отделяют от EMD, используя ВЭЖХ гельпроникающую хроматографию (TSK G-2000 SW, уравновешенный 30% ацетонитрилом в 0,9% NaCl), и очищают с помощью хроматографии с обращенной фазой (Pro-RPC, HR 5/10, Pharmacia-Upjohn, Sweden), используя градиент ацетонитрила. Затем разделенные протеин/полипептиды добавляют в различных количествах к раствору носителя EMDOGAIN®, если их не тестируют отдельно.
Гиалуроновая кислота была НМТ-0028 (MB 990000) от Seikagaku Corporation, Tokyo, Japan.
Бактерии и дрожжи все вначале выделили у пациентов, классифицировали по метаболическим и антигенным характеристикам в соответствии со стандартными процедурами. Виды использованных бактерий и дрожжей перечислены далее в таблице.
Сывороточный альбумин (бычий) и коллаген типа 1 (бычий) оба были получены от Sigma, St. Louis, U.S.A.
Все агаровые пластины были "Brain Hart Infusion agar" от Difco, дополненные красными кровяными клетками человека (100 мл на литр агара).
Пример 1
Клеточная пролиферация и продуцирование TGF-β1 (трансформирующего фактора роста-β1) у клеток PDL, обработанных EMDOGAIN®
Исходный раствор EMD приготавливают, растворяя ампулу (содержащую 30 мг EMD) в 3 мл стерильно профильтрованной 0,1% НАс. 60 мкл EMD исходного раствора добавляют к 6000 мкл Дюльбекко модифицированной среды Игла, содержащей 10% фетальной телячьей сыворотки и 1% раствора пенициллинстрептомицина. 300 мкл этой смеси добавляют в каждую из 96 ячеек микротитровальных пластин (NUNC A/S, Denmark, Cat # 167008). 1000 клеток человеческого периодонтального лигамента (PDL) (полученных из периодонтальных тканей здоровых людей, претерпевших удаление малых коренных зубов по соображениям ортодонтии, и культивированных практически по способу Somerman et al. J. Dental Res. 67, 1988, p. 66-70), добавляют в каждую из ячеек, и инкубируют при 37°С, 5% СО2 в течение 5 дней.
PDL клетки, использованные в качестве контролей, культивируют в Дюльбекко модифицированной среде Игла практически описанным выше способом, но без EMD.
После инкубирования клетки подвергают клеточному пролиферационному иммуноанализу, измеряя включение 5-бром-2′-деоксиуридина (BrdU) в соответствии с инструкциями изготовителей (Boehringer Mannheim, Cat # 1647 229). В этой процедуре объединяют BdrU вместо тимидина в растущих клетках ДНК. Объединение определяют с помощью ELISA анализа, и количество BrdU, определенное в этом анализе, является показателем скорости ДНК синтеза, и соответственно скорости клеточной пролиферации PDL клеток.
Результаты, представленные на Фиг.1, свидетельствуют о том, что PDL клетки, культивируемые в присутствии EMD, демонстрируют значительно более высокую скорость пролиферации, нежели PDL клетки, культивируемые без EMD.
К 100 мкл клеточной надосадочной жидкости из микротитровальной пластины добавляют 20 мкл 1н. НСl с последующим инкубированием в течение 10 минут при комнатной температуре. Инкубационную смесь нейтрализуют 20 мкл 1н. NaOH/0,5 M HEPES. 100 мкл этой смеси добавляют к 400 мкл буфера разбавления. 200 мкл разбавления обрабатывают с помощью ELISA, используя QuantikinesТМ (набор Cat # DB 100) от R&D Systems, UK, в соответствии с инструкциями изготовителей.
Результаты, представленные на Фиг.2, демонстрируют заметное увеличение TGF-βl продуцирование в PDL клетках, инкубированных с EMD, по отношению к PDL клеткам, которые не инкубировались с EMD.
Пример 2
Исследование роста микроорганизмов в присутствии производных эмалевого матрикса и протеинов эмалевого матрикса
Цель этого примера сводится к демонстрации ингибирующего влияния производных эмалевого матрикса и протеинов эмалевого матрикса на рост микробов in vitro.
Протеины, использованные в этом примере, растворяют в буферированном фосфатом физиологическом растворе (PBS) с установленным за счет уксусной кислоты значеним рН 5,5. Используемые микробы суспендируют в PBS рН 6,8 до конечной концентрации с ОП600=0,4 (оптическая плотность).
50 мкл EMDOGAIN® (30 мг EMD в 1 мл PGA) и 50 мкл EMD, термообработанного EMD, EMD фракций А, В, С и Н (все по 10 мг протеина на мл PBS буфера) капают на агарную пластину и дают высохнуть на воздухе на поверхности пластины (9 см диаметр, стандартный агар для определения устойчивости, с добавлением добавок в соответствии с индивидуальными требованиями микробов). Гомогенную суспензию микробов (1 мл, ОП280=0,5) добавляют, распределяя суспензию по верху агарных пластин, и эти пластины инкубируют при 35°С в течение 3 дней (аэробные культуры) или 14 дней (анаэробные культуры) в СО2 обогащенной атмосфере или в анаэробных условиях в соответствии с индивидуальными требованиями для роста. Все культуры инспектируют ежедневно. Коллаген типа 1 и сывороточный альбумин (оба бычьи) тестируют в тех же условиях, что и контроли. Неразбавленный пропиленгликольальгинат (PGA-EMD носитель), PBS буфер и гиалуроновую кислоту (НА-альтернативный EMD носитель) также наносят в качестве негативных контролей.
Полученные результаты представлены в таблице 1. Только эмалевый матрикс или протеины или производные эмалевого матрикса ингибируют рост некоторых микробов. Не существует каких-либо следов диффузных зон вокруг протеинов, что указывает на то, что нанесенные EMD протеины агрегируют на поверхности агара, и что только рост микробов в непосредственном контакте с протеинами оказывается ингибированным. Если образцы собирают с зон ингибирования и культивируют в жидкой среде (LB бульон с добавками), можно возобновить монокультуры исходных микробов, что позволяет предположить, что активные протеины не являются микробицидными. Все тестированные контроли были негативными, указывая на отсутствие неспецифического механизма влияния на результаты.
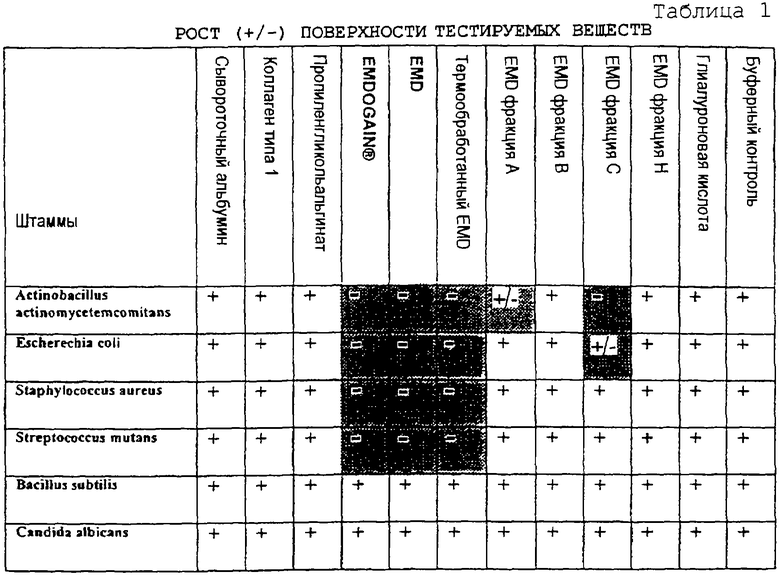
В Таблице 1:
EMD фракция А: в основном амелогенин ≈26-20 кДа
EMD фракция В: ≈17-13кДа
ЕМD фракция С: ≈10-5 кДа
EMD фракция Н: все протеины в EMD имеют молекулярную массу выше 27 кДа;
+ означает нормальный рост микробов;
- означает полное ингибирование роста микробов;
+/- означает некоторое ингибирование роста по сравнению с негативными контролями.
Все представленные в таблице результаты получены на второй день (аэробные культуры) или после пяти дней (анаэробные культуры) инкубирования.
Эти результаты показывают, что если EMD, содержащим протеины или пептиды, предоставить возможность образовывать агрегаты на поверхности, они могут ингибировать рост некоторых грам-отрицательных палочек и некоторых грам-положительных кокков. На основании основных поведенческих характеристик EMD протеинов (ref. jpc) и так как их действие не является микробицидным, разумное объяснение наблюдаемого явления состоит в том, что агрегаты протеинов образуют нерастворимый барьер, который отделяет микробы от необходимого для роста субстрата (субстратов).
Пример 3
Влияние EMD на скорость прикрепления Actinomyces viscosus in vitro
Введение
Изучали действие EMD на начальное прикрепление Actinomyces viscosus, обитающего во рту организма, который во множестве встречается в зубном налете, но который обычно не связывают с тяжелыми периодонтитами. Хотя этот организм может образовывать агрегаты с Porphiromonas gingivalis и может таким образом оказывать влияние на образование колоний на поверхности корней с потенциальными периодонтальными патогенами, Actinomyces ssp были обнаружены в относительно большом количестве в здоровых субгингвальных участках (эти наблюдения совпадают с данными Liljemark et al., Microbiol. Immunol. 8, 1993, p. 5-15, которые обнаружили, что после периодонтальной обработки количество Actinomyces ssp. значительно увеличивается). Haffajee et al., J. Clin. Periodont. 24, 1997, p. 767-776, заключили из микробиологических подсчетов в субгингвальных бляшках, что у субъектов с хорошей реакцией на начальную периодонтальную обработку относительно велико количество A.viscosus и T.denticola.
Материалы
Actinomyces viscosus HG85 были предоставлены Dr. A. J. van Winkelhoff (Dept. of Oral Microbiology, ACTA). EMDOGAIN® был предоставлен BIORA (Malrno, Sweden). RBS детергент поставлен Fluka (Fluka Chemie AG, Buchs, Switzerland).
Рост и сбор бактерий
Actinomyces viscosus инокулируют из кровяных агаровых пластин в порционной культуре в среде бульона Schaedler′s в течение 24 часов при 37°С. Эту культуру используют для инокуляции второй культуры в среде бульона Schaedler′s, которую оставляют для роста на 16 часов. Клетки собирают центрифугированием (5 мин при 6500 g) и промывают дважды деминерализованной водой. Затем микроорганизмы обрабатывают ультразвуком в течение 20 сек при 30 Ватт (Vibra Cell model 375, Sonics and Materials Inc., Danbury, CT, USA) для разрушения цепочек и агрегатов бактерий. Обработку ультразвуком осуществляют периодически, при этом охлаждая в бане со льдом и водой. Клетки подсчитывают, используя счетчик клеток Burker-Turker. И наконец, Astinomyces viscosus суспендируют в адгезионном буфере (2 мМ фосфат калия, 50 мМ хлорид калия и 1 мМ хлорид кальция, рН 6,8).
Нанесение покрытия на стеклянные пластины
Стеклянные пластины тщательно очищают ультразвуком в 5% RBS детергенте, тщательно промывают водопроводной водой, промывают метанолом и, наконец, промывают дистиллированной водой. Эта процедура обеспечивает угол контакта с водой 0 градусов. EMD растворяют в 0,01 М уксусной кислоте в концентрации 7,5 мг/мл. Стеклянные пластины делят на две части, используя тефлоновый маркер (DAKO A/S, Glostrup, Denmark). На одну сторону наносят уксусную кислоту (0,01 М); 250 мкг EMD наносят на другую сторону. Стеклянные пластины сушат воздухом в вентилируемой камере в течение 4-6 часов.
Проточный эксперимент
Проточная камера и компьютерная система, использованные в этом эксперименте, схематически представлены на Фиг.3. Перед каждым экспериментом все ампулы и проточную камеру заполняют адгезионным буфером, заботясь о том, чтобы система не содержала пузырьков воздуха. Стеклянные пластины с нанесенным покрытием образуют нижнюю часть проточной камеры. Скорость потока устанавливают 2,5 мл/мин (что сравнимо со средней скоростью истечения слюны у человека). Бактериальная суспензия циркулирует в системе примерно 3-4 часа, и подсчитывают количество бактерий, прикрепившихся к субстрату. Осуществляют три независимых эксперимента. Все эксперименты осуществляют при 3×108 клеток на 250 мл адгезионного буфера. Во время экспериментов изображения получают каждые 10-15 минут с 6 заранее определенных участков как контрольных, так и покрытых EMD пластин. Высота канала параллельной проточной камеры была 0,6 мм.
Результаты анализа
После подсчета на всех изображениях прикрепившихся клеток данные выражают как количество бактерий на квадратный сантиметр. Для каждого эксперимента конечное число микроорганизмов на см2 используют для статистического анализа (t-тест Стьюдента для параллельных наблюдений, используя n как количество экспериментов).
Результаты
Эксперимент 1 (Фиг.4) свидетельствует о постепенном повышении количества прикрепившихся микроорганизмов, особенно во время первых 150 мин в потоке. После этого промежутка времени количество микроорганизмов, прикрепившихся к EMD, достигает плато 2,0×106 бактерий на см2, что примерно в четыре раза выше, чем на стеклянной пластине, которая была обработана уксусной кислотой.
Также в эксперименте 2 (Фиг.5) EMD очень сильно стимулирует прикрепление Actinomyces viscosus к субстрату.
Однако в начале эксперимента эффект был менее выражен. Возможно, что это связано с более низкой плотностью организмов, использованных в проточной системе. Через 90 минут количество бактерий, прикрепившихся к EMD постепенно повышается по сравнению с контролем, достигая максимума 1,4×106 на см2 через 3 часа, что соответствует трехкратному превышению.
Третий эксперимент (Фиг.6) демонстрирует стимуляцию прикрепления Astinomyces viscosus к EMD покрытию через 5 минут течения. EMD индуцирует быстрое увеличение количества прикрепившихся организмов в течение первых 45 минут. После этого прикрепление продолжается постепенно. Прикрепление к стороне, обработанной уксусной кислотой, происходит аналогично, но количество прикрепившихся микроорганизмов значительно меньше. Через 200 мин количество прикрепившихся к EMD покрытию оказывается в два раза выше, чем к поверхности, обработанной уксусной кислотой.
Рассматривая вместе все 3 эксперимента можно считать доказанными различия со статистической значимостью (р<0,05).
Из полученных результатов следует, что EMD, использованный в качестве покрытия на стеклянной поверхности, обладает заметным стимулирующим действием in vitro на прикрепление Actinomyces viscosus. Хотя до сих пор не известно, какие факторы ответственны за это усиленное начальное прикрепление, предполагают, что организмы взаимодействуют с пролиновыми остатками, которые в изобилии присутствуют в амелогениновом компоненте коммерческой протеиновой смеси. Бактериальная адгезия часто определяется специфическим протеин-пептид и лектин-углевод распознаванием. Известно, что Actinomyces viscosus с их фимбриями типа 1 могут связываться с богатыми пролином протеинами, подобно богатым пролином протеинам слюны (PRP) и коллагенам типов I и III.
Специфические взаимодействия между EMD и некоторыми находящимися во рту микроорганизмами могут иметь важные последствия для состава биопленки в полости рта, так как экология бляшек может измениться. Если экологические сдвиги можно осуществить в направлении промотирования организмов, не связанных с периодонтальными заболеваниями, нанесение EMD может привести к улучшению состояния периодонта, просто за счет такого действия. Это естественно находится в стороне от других благоприятных эффектов EMD.
Пример 4
Влияние EMD на скорость прикрепления Streptococcus mutans in vitro
Введение
Существует множество доказательств причинной роли бляшкообразующих организмов в патогенезе заболеваний в полости рта, таких как периодонтит и кариес. В соответствии с существующей моделью супрагингивального бляшкообразования считают, что Streptococcus spp. являются основными организмами, образующими колонии на поверхности зубов. Затем бляшки развиваются в результате роста бактерий и дальнейшего присоединения бактерий других видов. Такое присоединение может происходить за счет образования связей между бактериями или может быть опосредствовано молекулами слюны. Образование бляшек облегчается также за счет продуцирования внеклеточных макромолекул. Streptococcus mutans в настоящее время считают одним из видов биопленки, который должен привлечь серьезное внимание из-за его связи с кариесом зубов. Хотя некоторые грам-положительные бактерии (т.е. Streptococcus mutans), как было показано, вызывают утрату альвеолярной кости у гнотобиологических животных, эти микроорганизмы, по-видимому, не вносят основного вклада в экологию развивающихся периодентальных карманов. Тем не менее, потенциально патологические микроорганизмы должны быть способны как сопротивляться защитным и иммунным механизмам хозяина, так и инициировать разрушение тканей организма хозяина.
Материалы
Streptococcus mutans NS был любезно предоставлен Dr. H. van der Mei (Materia Technica, University of Groningen). EMDOGAIN® был предоставлен BIORA (Malmo, Sweden). Детергент RBSТМ был закуплен у Fluka (Fluka Chemie AG, Buchs, Switzerland).
Рост и сбор бактерий
Streptococcus mutans инокулируют из кровяных агаровых пластин в порционной культуре в среде бульона Todd Hewitt в течение 24 часов при 37°С. Эту культуру используют для инокулирования второй культуры в среде бульона Todd Hewitt, которую оставляют для роста на 16 часов. Клетки собирают центрифугированием (5 мин при 6500 g) и промывают дважды деминерализованной водой. Затем микроорганизмы обрабатывают ультразвуком в течение 20 сек при 30 Ватт (Vibra Cell model 375, Sonics and Materials Inc., Danbury, CT, USA) для разрушения цепочек и агрегатов бактерий. Обработку ультразвуком осуществляют периодически, при этом охлаждая в бане со льдом и водой. Клетки подсчитывают, используя счетчик клеток Burker-Turker. И наконец Streptococcus mutans суспендируют в адгезионном буфере (2 мМ фосфат калия, 50 мМ хлорид калия и 1 мМ хлорид кальция, рН 6,8).
Нанесение покрытия на стеклянные пластины
Стеклянные пластины тщательно очищают ультразвуком в 5% RBS детергенте, тщательно промывают водопроводной водой, промывают метанолом и, наконец, промывают дистиллированной водой. Эта процедура обеспечивает угол контакта с водой 0 градусов. EMD растворяют в 0,01 М уксусной кислоте в концентрации 7,5 мг/мл. Стеклянные пластины делят на две части, используя тефлоновый маркер (DAKO A/S, Glostrup, Denmark). На одну сторону наносят уксусную кислоту (0,01 М); 250 мкг EMD наносят на другую сторону. Стеклянные пластины сушат воздухом в вентилируемой камере в течение 4-6 часов.
Проточный эксперимент
Проточная камера и компьютерная система, использованные в этом эксперименте, схематически представлены на Фиг.3. Перед каждым экспериментом все ампулы и проточную камеру заполняют адгезионным буфером, заботясь о том, чтобы система не содержала пузырьков воздуха. Стеклянные пластины с нанесенным покрытием образуют нижнюю часть проточной камеры. Скорость потока устанавливают 2,5 мл/мин (что сравнимо со средней скоростью истечения слюны у человека). Бактериальная суспензия циркулирует в системе примерно 3-4 часа, и подсчитывают количество бактерий прикрепившихся к субстрату. Осуществляют три независимых эксперимента. Все эксперименты осуществляют при 3×108 клеток на 250 мл адгезионного буфера. Во время экспериментов изображения получают каждые 10-15 минут с 6 заранее определенных участков как контрольных, так и покрытых EMD пластин. Высота канала параллельной проточной камеры была 0,6 мм.
Результаты анализа
После подсчета прикрепившихся клеток на всех изображениях данные выражают как количество бактерий на квадратный сантиметр. Для каждого эксперимента конечное число микроорганизмов на см2 используют для статистического анализа (t-тест Стьюдента для параллельных наблюдений, используя n как количество экспериментов).
Результаты
В каждом из трех экспериментов EMD демонстрирует ингибирующее действие на скорость прикрепления Streptococcus mutans (Фиг.7, 8, 9; р<0,05). Ингибирование доходит до примерно 40-70% по сравнению с обработанными уксусной кислотой контролями.
Первый эксперимент (Фиг.7) уже через 10 минут протекания демонстрирует ингибирование количества прикрепившихся Streptococcus mutans к стеклянной поверхности, покрытой EMD. После 3 часов прикрепление было ингибировано примерно на 60% по сравнению с контролем.
Во втором эксперименте (Фиг.8) EMD начинает ингибировать прикрепление Streptococcus mutans спустя 1,5 часа протекания. Количество Streptococcus mutans, прикрепившихся к EMD, достигает плато 0,5 миллиона на см2 через 40 минут протекания. Через 3,5 часа это количество составляет около 25% по сравнению с контролем.
Третий эксперимент (Фиг.9) демонстрирует ингибирование прикрепления Streptococcus mutans под влиянием EMD уже с начала процедуры протекания. Как в эксперименте 1, степень ингибирования достигает 60% от контрольной величины после 3 часов протекания.
Настоящее исследование показывает, что EMD обладает значительным ингибирующим действием на прикрепление Streptococcus mutans к стеклянной поверхности. Возможным объяснением такого ингибирования может быть присутствие гидрофобных соединений в EMD смеси. Одним из протеинов, которые в избытке присутствуют в смеси, является амелогенин, протеин, который содержит, помимо кислой гидрофильной С-терминальной последовательности, гидрофобный сердечник, содержащий 100-300 остатков, обогащенных пролином, лейцином, метионином и глутамином. Saito et al., Arch. Oral Biol. 42, 1997, p. 539-545, обнаружили, что прикрепление различных штаммов Streptococcus mutans к иммобилизованным гидрофобным протеинам (OAIS) ингибируется. Авторы приписали эффект отрицательному заряду на клеточной поверхности микроорганизмов (как в случае Streptococcus mutans). Другие характеристики поверхности также могут влиять на прикрепление к субстрату. Streptococcus mutans содержит поверхностный антиген I/II, который содержит N-терминальную часть, особенно богатую аланином, и включает тандемные повторы. Этот участок, как предсказывают, является альфа-спиральным, адаптированным к спираль-спиральной конформации, и может отвечать за гидрофобность клеточной поверхности, связанную с экспрессией антигена I/II.
Пример 5
Влияние EMD на рост некоторых периопатогенов
Prevotella Intermedia и Porphyromonas qingivalis предварительно инкубируют в течение 10-16 часов при 37°С в тиогликолятном бульоне, дополненном 0,5 мг/л витамина К и 5 мг/л гемина, в аэробных условиях, создаваемых GasPakPlus оболочками в соответствующих емкостях. Когда ОП600 культур достигает величины 0,1-0,2, что соответствует клеточным плотностям 106-107 кфе (колонии формирующих единиц) на мл, отбирают 100 мкл аликвоты, и бактерии осаждают центрифугированием. Бактерии повторно суспендируют в 100 мкл свежеприготовленной смеси сыворотки человека и стерильного физиологического раствора, и суспензии, содержащие 105-106 клеток переносят в стерильные 1,5 мл склянки Эппендорфа, и смешивают с (i) 100 мкл EMD препарата (3 мг EMD в 0,1 мл PGA (пропиленгликольальгината)), (ii) 100 мкл PGA носителя или (iii) 100 мкл смеси сыворотка/раствор NaCl в качестве контроля роста. 10 мкл аликвоты для анализа роста отбирают после 0, 3, 6 и 24 часов. Эти аликвоты сериально разбавляют стерильным 0,9% раствором NaCl, и по 10 мкл со стадий разбавления помещают на агар Schaedler. Условия культивирования те же, что и для прекультур. Агаровые пластины инкубируют в течение 3-4 дней и последовательно рассчитывают кфе и плотности клеток (кфе/мл). Все эксперименты повторяют по 6 раз.
Результаты (представлены как кфе/мл в процентах от концентрации в момент времени 0).
Контрольные культуры в различные моменты времени
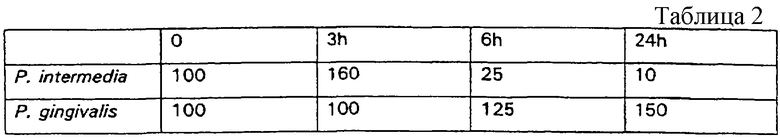
Культуры в присутствии PGA носителя в различные моменты времени
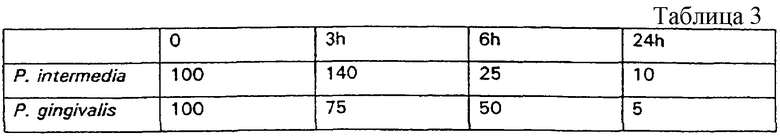
Культуры в присутствии EMD в различные моменты времени
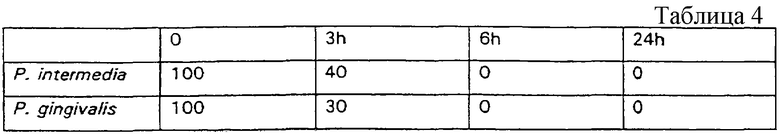
Культуры заметно ингибированы в результате присутствия EMD по сравнению с контролями с одним носителем или без какого-либо добавления EMD.
Пример 6
Исследование улучшенного залечивания мягких тканей ран под действием EMDOGAIN® после периодонтальной хирургии
Целью этого эксперимента является демонстрация влияния производных эмалевого матрикса и протеинов эмалевого матрикса улучшенного залечивания мягких тканей ран после периодонтальной хирургии.
Экспериментальные дефекты в маргинальном периодонте в более чем 50 зубах обезьян макак создают, удаляя зубной цемент, периодонтальную мембрану и маргинальную альвеолярную кость до цервикоапикального расстояния примерно 5 мм зубоврачебным буром. Затем на экспериментальные дефекты либо ничего не наносят (контроль), либо наносят производное эмалевого матрикса (полученное из EMDOGAIN® либо как невосстановленный лиофилизированный порошок, либо как восстановленную композицию). Концентрация протеинов в восстановленной композиции составляет около 5-30 мг/мл, и наносимый объем находится в интервале от около 0,1 до около 0,2 мл на каждый дефект.
Залечивание ран визуально оценивают в течение последующих 8 недель. В дефектах, в которые был нанесен EMDOGAIN®, происходило хорошее залечивание (не было покраснения или отеков) и после 2 недель наблюдались незначительные бляшки после удаления швов, хорошее залечивание и небольшие гингивиты после 5 недель, и залечивание без осложнений после 8 недель, по окончании эксперимента. Напротив, контрольные дефекты продемонстрировали воспаления с западениями и обильными бляшками после 2 недель, со значительными западениями и гингивитами как после 5, так и после 8 недель.
Пример 7
Исследование влияния на залечивание ран производных эмалевого матрикса и протеинов эмалевого матрикса после периодонтальной хирургии
Целью этого эксперимента является демонстрация влияния производных эмалевого матрикса и протеинов эмалевого матрикса на быстрое залечивание ран у пациентов после периодонтальной хирургии.
55 пациентов, которые нуждались в периодонтальной хирургии, разделили на две группы, для одной осуществили обычную операцию модифицированным способом Widman лоскута (20 пациентов), а для другой группы тот же способ был дополнен нанесением EMDOGAIN® (35 пациентов) (концентрация составила 30 мг протеина/мл, и около 0,3 мл наносили на зуб). Ни одному из пациентов во время операции не вводили антибиотики, но все были инструктированы о необходимости применения асептического (хлоргексидин) ежедневного полоскания.
При удалении швов проводился активный опрос пациентов (1-3 недели после операции). Тогда как трое (15%) пациентов из контрольной группы имели послеоперационные осложнения, которые потребовали приема антибиотиков, только одному (3%) из группы обработанных EMDOGAIN® пациентов понадобился антибиотик.
Пример 8
Исследование влияния производных эмалевого матрикса и протеинов эмалевого матрикса на залечивание ран после удаления зубов
Целью этого эксперимента является демонстрация влияния производных эмалевого матрикса и протеинов эмалевого матрикса на залечивание ран у пациентов после удаления третьего коренного зуба.
Пациентам в возрасте 30 лет и старше с симметричным повреждением или полусимметричным повреждением мандибулярного третьего коренного зуба, требующего удаления, произвели удаление третьего коренного зуба, причем в одном случае классическим способом, включающим подъем вертикального лоскута для осуществления необходимой остеоктомии и разреза, тогда как в другом случае осуществили удаление, и альвеолы заполнили EMDOGAIN® перед наложением швов. Всем пациентам ввели антибиотики (3 г амоксициллина или 1 г эритромицина) за 1-2 часа до операции, а после операции ввели ибупрофен (600 мг×3). Они были проинструктированы о необходимости полоскания хлоргексидином (0-1% 10 мл×2) в течение 4 недель.
Швы удалили через 2 недели. Залечивание под действием EMDOGAIN® и контрольные участки оценивались как пациентом, так и дантистом. В одном центре 9 пациентам провели контралатеральное удаление с применением EMDOGAIN® или без него. У одного пациента наблюдалось небольшое раздражение от швов на двух участках, тогда как другой пациент испытывал сильную боль только на контрольном участке, но никаких проблем не было на участке, обработанном EMDOGAIN®. В другом центре у трех пациентов из шести были боли только на контрольных участках. И наконец, в третьем центре у одного пациента было серьезное осложнение, альвеолит, который был диагностирован на контрольном участке. Обработанный EMDOGAIN® участок зажил без проблем. У другого пациента было небольшое раздражение от швов на обоих участках после удаления, но только контрольный участок был воспаленным и болезненным и требовал повторной ирригации физиологическим раствором и введения обезболивающих агентов.
Эти клинические результаты показывают, что введение EMDOGAIN® в экстракционные альвеолы после сложных удалений зубов может улучшить залечивание и уменьшить часто возникающие в противном случае болезненные отеки.
Пример 9
Исследование влияния производных эмалевого матрикса и протеинов эмалевого матрикса на залечивание alveolitis sicca
Целью этого эксперимента является демонстрация влияния производных эмалевого матрикса и протеинов эмалевого матрикса на залечивание alveolitis sicca (сухой карман).
После удаления 35 radix relicta мужчина пациент в возрасте 70 лет испытывал сильную боль и отек в связи с альвеолой после удаления. При обследовании дантистом стало ясно, что у него развилось состояние, alveolitis sicca, при котором начальная коагуляция оказалась нарушенной и стенки кости альвеолы некрозировали. Соседние костные и мягкие ткани были воспалены.
У пациента в истории болезни была сердечная недостаточность и он принимал антикоагулянт Marevan. В результате такого состояния у него была пониженная циркуляция периферической крови. Он также регулярно выкуривал по несколько сигарет в день.
Альвеолит лечили традиционным способом, удаляя некротическую костную ткань и вызывая новое кровотечение. Кроме того, мобилизовали десну и для закрытия альвеолы наложили шов. Затем пациента лечили пенициллином (апоциллин 660 мг, 2 таблетки утром и вечером в течение семи дней) для борьбы с инфекцией и также инструктировали о необходимости полоскания рта дважды в день раствором хлоргексидина. Спустя 5 дней после окончания приема антибиотика, пациент при осмотре в клинике все еще испытывал достаточно сильную боль. Обследование операционного участка проводили визуально, пальпированием и зондированием, что показало, что альвеолит сохраняется, и что присутствует больше некротической костной ткани. Рентгеновское исследование выявило деструкцию кости и некроз на всем протяжении вниз к апикальной части альвеолы. Операционное поле еще раз вычистили, и образовавшееся костное поражение заполнили EMDOGAIN® (30 мг/мл, макс. 0,5 мл было внесено), и новый шов наложили на десну для того, чтобы закрыть альвеолу. Не было проведено никакой дополнительной обработки, но пациенту предписали продолжать полоскание раствором хлоргексидина. Два дня спустя пациент сообщил в клинику, что как боль, так и отек исчезли. Клиническое исследование и удаление шва через неделю после обработки EMDOGAIN® выявило хорошее залечивание без следов некротической ткани или воспаления, и интактная десна без красноты или отечности покрывала область раны. При пальпировании и зондировании не было кровотечения или боли. Не наблюдалось ни дурного запаха, ни вкуса, ни экссудата. У пациента не было жалоб на боль или другие симптомы.
Пример 10
Исследование профилактического действия производных эмалевого матрикса и протеинов эмалевого матрикса на aiveolitis sicca
Целью этого эксперимента является демонстрация профилактического действия производных эмалевого матрикса и протеинов эмалевого матрикса на aiveolitis sicca.
У 82-летней пациентки произошел разлом в длину корня зуба 44. Этот зуб служил основанием моста между зубами 35 и 46, и претерпел эндотоническую обработку за несколько лет до этого. Клинически десна, окружающая зуб, была воспалена и наблюдался карман десны на всем протяжении до верхушки зуба со стороны языка. Рентгенологическое исследование выявило серьезный периодонтит зуба 44.
У пациентки было хорошее состояние полости рта, но из-за состояния сердца ее лечили Marevan (антикоагулянт), что легко провоцировало кровотечение из десны при зондировании. За шесть месяцев до этого случая пациентке удалили с помощью операции зуб 35 из-за сильного периодонтита. После этой операции она длительное время испытывала состояние alveolitis sicca. Она была очень обеспокоена возможностью повторения таких же послеоперационных осложнений, какие она уже испытала раньше, и после удаления зуба 44. Ее проинформировали, что комбинация ее почтенного возраста, лечения Marevan, инфицированного корня и кармана десны сильно увеличивает риск послеоперационных осложнений, таких как альвеолит, но что альтернативы хирургическому удалению фрагментов зуба нет.
Пациентка согласилась на удаление 44 зуба, и, в качестве эксперимента, ей провели профилактическую обработку EMDOGAIN® для предотвращения развития alveolitis sicca. Пациентке под анестезией разрезали и удалили щечную кость для удаления фрагмента корня, чтобы не ослаблять мост. После удаления пустую альвеолу механически очистили и заполнили EMDOGAIN® (30 мг/мл, макс. 0,5 мл ввели), и лоскут вернули на место одним швом. В тот же вечер пациентка сообщила (по телефону) о длительном кровотечении из операционного поля (перед операцией лечение Marevan не было прекращено), но другие симптомы отсутствовали. Когда через 5 дней после операции удаляли шов, мягкая ткань операционной зоны была полностью залечена. Пациентка не жаловалась на какие-либо симптомы подобные боли или отеку после операции, и была вообще очень довольна лечением.
Пример 11
Исследование влияния производных эмалевого матрикса и протеинов эмалевого матрикса на залечивание посттравматических осложнений
Целью этого эксперимента является демонстрация влияния производных эмалевого матрикса и протеинов эмалевого матрикса на залечивание у пациента посттравматических осложнений.
После несчастного случая пациенту наложили лигатуру на верхние передние зубы в клинике скорой помощи. Дантист обнаружил, что 11 и 21 зубы мертвы, 12 и 22 зубы имеют mesioincisal разрушения класса I или II. Край десны был сильно воспален и плохо прилегал к поверхности зубов. Пациент испытывал боль, и осложнения в виде отсутствия чувствительности, отека и плохого вкуса и запаха во рту. Были также свидетельства поражения периодонтального лигамента в апикальных участках зубов 11 и 21. Оба центральных резца были очищены и корни заполнены свежей смесью Са(ОН)2.
Спустя 4 недели залечивание ран все еще считалось неудовлетворительным. Состояние перешло в хроническое воспаление, и зубы посчитали потерянными. Стандартным лечением такого состояния должно было бы быть удаление всех четырех резцов и замена их мостом или имплантатами. Однако пациент настойчиво возражал против такого лечения, и в последней попытке спасти зубы осуществили gingival flap операцию на всех четырех поврежденных зубах (11, 12, 21, 22). Использовали две ампулы EMDOGAIN® (60 мг в 3 мл).
Самое большее 0,2 мл EMDOGAIN® (30 мг/мл) на зуб нанесли шприцем перед тем, как лоскуты пришили обратно 7 швами; 4 шва удалили через 5 дней после операции. Наблюдалось заметное улучшение субъективного и клинического состояний. Пациент больше не страдал от боли, чувство онемения прошло, и не было больше дурного запаха или вкуса от поврежденного участка. Спустя 2 недели удалили остальные швы. На десне не было каких-либо следов воспаления, и у пациента не было осложнений. Десну зондировали и не обнаружили никаких следов воспаления; она плотно прилегала к зубам, и/или альвеолярной кости, она была розового цвета (не ярко-красная, как бывает на воспаленных участках) и с нормальными (без отеков) межзубными сосочками. Кроме того, наблюдалось заметное улучшение как во вновь появившемся периодонтальном лигаменте в поврежденных частях зубов, так и в отложении новой альвеолярной кости по данным рентгенологического исследования.
Пример 12
Залечивание травматических ран на соседних зубах и нервах
Сообщение о случае
У 39 летней пациентки наблюдался тяжелый перикоронит вокруг ее нижнего левого зуба мудрости (38). В общественной стоматологической клинике зуб частично удалили, оставив апикальную половину зуба в челюсти с последующим ятрогенным переломом зуба. С болью пациентка обратилась к специалисту в области хирургии на следующий день для хирургического удаления осколка зуба.
Через два дня после удаления пришла к своему постоянному дантисту на осмотр. У нее была опухоль слева и непроходящая и полная блокировка левого мандибулярного нерва. Клиническое исследование и рентгеновские снимки показали, что во время операции была сильно повреждена сверлом челюстная кость, апикальная треть дистального корня зуба 37 и до мандибулярного нервного канала (см. рентгенограмму Фиг.10А). При зондировании глубина кармана в направлении зуба 37 составила 25 мм от верха коронки зуба, который был после апекса дистального корня.
В попытке вызвать залечивание кости и нерва и регенерацию утраченного периодонтального лигамента на зубе 37 операционную рану вскрыли и тщательно очистили. После удаления мелких частиц физиологическим раствором экспонированную кость, поверхность дистального корня 37 и мандибулярный нерв покрыли EMDOGAIN® (30 мг/мл, нанесли в избытке, примерно 1 мл) и края раны сшили вместе тремя швами. Пациентке предписали полоскать рот раствором хлоргексидина (Corsodyl®) дважды в день в течение следующих пяти дней и начали пять дней профилактического лечения пенициллином (Ампициллин, 660 мг×4).
Через 10 дней пациентка вернулась для проверки и удаления швов. К этому времени отек исчез, и залечивание мягких тканей было очень хорошим. Однако наблюдалась полная анестезия мандибулярного нерва, и пациентке сообщили, что прогноз в отношении нарушенного нерва неопределенен. В этот момент анестезия делала невозможным проверить жизненность зуба 37. Обычно повреждение корня, подобное тому, которое имело место здесь, приводит к некрозу пульпы и анкилозу зуба. Для предотвращения таких осложнений показано эндодонтное лечение. Однако для того, чтобы посмотреть, может ли экспериментальное лечение вызвать залечивание периодонтального лигамента, пациентка согласилась оставить зуб без лечения на некоторое время. Затем пациентка подвергалась ежемесячному осмотру.
Два месяца спустя после контрольного осмотра у пациентки появилась локальная гиперчувствительность в ее левой верхней губе, знак залечивания нерва. Мягкая ткань в области 37-38 была прекрасно залечена без рубцов. Рентгеновское исследование выявило образование новой кости в экстракционной альвеоле. Зуб 37 и окружающая ткань все еще страдали от анестезии.
Через 4 месяца после лечения анестезия прошла, и зуб 37 демонстрировал жизнеспособность, но при этом и гиперчувствительность, как чувствительность к температуре, так и при электротестировании. Рентгеновское исследование показало, что заполнение костью экстракционной альвеолы значительно и что наблюдаются следы периодонтальной регенерации на дистальном корне зуба 37.
Через 5 месяцев после лечения EMDOGAIN® жизнеспособность зуба 37 при тестах оказалась нормальной. К этому времени на рентгеновском снимке была видна полная регенерация функционального периодонтального лигамента (Фиг.1В) и вновь образованная альвеолярная кость нормального вида заполнила костные дефекты и экстракционную альвеолу. Следы анкилоза отсутствовали. Зондирование глубины кармана в дистальном направлении зуба 37 составило лишь 10 мм, что было примерно на 1 мм ниже цементоэмалевого соединения. После этого контроля пациентку признали полностью здоровой и предписали обычную ежегодную проверку.
Комментарии
Полное и быстрое залечивание травматических ран на соседних зубах и нервах после хирургического удаления зуба мудрости - явление редкое. Обычные осложнения столь тяжелые, как было указано выше, заканчиваются полным удалением поврежденного зуба, или, по крайней мере, эндодонтным удалением пульпы зуба и пломбировкой корня с последующим залечиванием кости с алкилозом. Залечивание разрушенного нерва обычно занимает 8-12 месяцев, если вообще происходит, и часто некоторые участки парэстезии присутствуют в течение нескольких лет. Быстрота и высокое качество описанного выше залечивания весьма необычно, и его следует рассматривать как признак способности EMDOGAIN® залечивать раны.
Рентгеновское исследование
А: Пациентка через 2 дня после удаления зуба 38. Отмечается большой дефект в дистальном направлении зуба 37 и вовлечение миндабулярного канала. Кроме того, альвеолярная кость дистобуккальная у зуба 37 удалена во время операции.
В: Пациентка через 5 месяцев после операции. Отмечены следы полного функционального периодонтального лигамента (lamina dura) в дефекте на дистальной части корня зуба 37. Следов анкилоза нет. Очертания мандибулярного канала теперь видны, а экстракционная альвеола полностью заполнена костью. Также отмечается новая дистобуккальная альвеолярная кость, формирующаяся вокруг зуба 37.
Пример 13
Исследование влияния производных эмалевого матрикса и протеинов эмалевого матрикса на залечивание ulcus cruris (венозные язвы)
Пациент 1
Пациентом был мужчина 1926 г. рождения, в истории болезни которого был повторяющийся тромбоз с плохим посттромботическим синдромом и рецидивом венозных язв. Его лечили системно антикоагулянтными производными кумарина, а язвы обрабатывали локально Crupodex (декстрановый мономер) BIOGAL и 3%-ным раствором борной кислоты.
К моменту начала лечения EMDOGAIN® у него была венозная овальная язва размером 5×4 см и глубиной 0,5 мм, которая была на стадии гранулирования при очень плохой эпителизации.
Рану продезинфицировали 3% H2O2 и нанесли каплями 500 мкл EMDOGAIN®, который равномерно распределили с помощью стерильной палочки. EMDOGAIN® оставили на 10 минут на воздухе, а затем рану покрыли Inadine (Johnson&Johnson) Rayon повязкой, пропитанной 10% повидон-йодной мазью.
Спустя 5 дней произошла эпителизация в проксимальной части язвы, и язва уменьшилась на 1,8×2,2 см, и не было никаких следов побочных реакций (воспалений). EMDOGAIN® не наносили. Через 12 дней произошла дальнейшая эпителизация в проксимальной части, и новая эпителизация в латеральной части заняла площадь около 2×2 см. Почти вся язва зарубцевалась. Нанесено 400 мкл EMDOGAIN®.
После 19 дней произошла дальнейшая эпителизация в проксимальной и латеральной частях язвы, но не в дистальной части, где язва оставалась достаточно глубокой (около 1 мм). Более половины язвы было зарубцовано. 300 мкл EMDOGAIN® было нанесено. С начала лечения EMDOGAIN® пациент не чувствовал никакой боли в язве, в отличие от того, что было перед началом лечения EMDOGAIN®. Затем EMDOGAIN® наносили раз в неделю до 40 дня (по 200 мкл), и язву посчитали полностью зарубцевавшейся после 47 дней.
Пациент 2
Пациентка 1949 г. рождения с варикозом, хронической венозной недостаточностью и рецидивирующими венозными язвами. У нее была множественная аллергия на фармацевтические препараты (лекарства, медикаменты), а также excema varicosum. Раньше ее лечили локально каплями Otosporin (полимиксин В сульфат + неомицинсульфат + гидрокортизон) и компрессами с гидрокортизоном.
В момент начала ее лечения EMDOGAIN® ее венозная язва имела диаметр 1 см и глубину 2 мм. Нанесли 300 мкл EMDOGAIN®.
Спустя 5 дней эпителизация составила 2 мм вокруг раны (по окружности) и не было побочной реакции (воспаления). EMDOGAIN® не наносили. Через 12 дней размер язвы уменьшился до примерно 2 мм в диаметре. Нанесли 100 мкл EMDOGAIN®.
Через 19 дней диаметр язвы все еще оставался около 2 мм, но дно было хорошо гранулировано, и язва уже не была столь глубокой (около 0,2 мм). Нанесли 100 мкл EMDOGAIN®.
У той же пациентки на другой ноге была другая язва около 0,3×1 см. Нанесли 200 мкл EMDOGAIN®.
Через 7 дней наблюдалась новая эпителизация и хорошая грануляция на дне язвы, а размер язвы уменьшился до около 0,2×0,5 см.
Затем по 100 мкл EMDOGAIN® наносили на каждую язву раз в неделю до 40 дня, и решили, что язвы полностью залечены на 47 день. Никаких аллергических реакций на EMDOGAIN® не наблюдалось.
Другая язва образовалась на той же ноге с размером около 0,5×0,3 см; на нее нанесли 100 мкл EMDOGAIN®.
Пациентка 3
Пациентка 1929 г. рождения с глубоким венозным тромбозом после рожистого воспаления, и к моменту начала лечения EMDOGAIN® у нее была очень крупная ulcus cruris размером около 15×19 см на стадии развития, причем эту язву считали почти безнадежной после различных способов лечения. 700 мкл EMDOGAIN® нанесли на участок около 3 см от верхнего края.
Через 7 дней не наблюдалось эпителизации, но обработанный участок был более прозрачным (более структурированным) с небольшим размытым участком гранулирования, на этом участке не было болевых ощущений, и не было следов дальнейшего развития. На тот же самый участок нанесли 700 мкл EMDOGAIN®.
Через 4 недели у пациентки развилась инфекция, по-видимому вызванная Pseudomonas, в дистальной части язвы, которая не была обработана EMDOGAIN®. Нанесли 700 мкл EMDOGAIN®. Инфекция исчезла через 7 дней.
Пациентка 4
Пациентка 1947 г. рождения с варикозом с поверхностным тромбофлебитом после рожистого воспаления, к моменту начала лечения EMDOGAIN® имела ulcus cruris размером около 2×0,8 см. Дно язвы было чистым, но без грануляции. Нанесли 300 мкл EMDOGAIN®.
Через 7 дней размер язвы уменьшился до около 0,7×0,3 см и наблюдались эпителизация по всей окружности и грануляция на дне. Нанесли 200 мкл EMDOGAIN®, а затем по 100 мкл EMDOGAIN® раз в неделю в течение 5 недель. Через 5 недель язву считали полностью вылеченной.
Пример 14
EMDOGAIN® как помощь при нехирургическом периодонтальном лечении на участках плоской поверхности
Задача
Целью исследования является оценка возможности того, что нанесение EMDOGAIN® может улучшить лечебный результат нехирургического периодонтального лечения. Конкретная цель этого исследования состоит в оценке влияния на участках плоской поверхности.
Схема исследований
Это исследование проводили как интраиндивидуальный длительный тест длительностью 6 месяцев. Исследования были дважды слепые, split-mouth, с контролем плацебо и статистической обработкой.
Субъекты
14 пациентов, обратившихся в стоматологическую клинику (Clinic of Periodontics, Department of Periodontology, Goteborg University) для лечения умеренно развитого периодонтального заболевания.
Критерии для включения:
- по крайней мере, 3 участка плоской зубной поверхности в каждом из двух контралатеральных квадрантов с зондируемой глубиной кармана равной, или более 5 мм, и, по крайней мере, одной парой участков с глубиной зондирования, равной или более 6 мм;
- выбранные зубы должны иметь живую пульпу, что определяют с помощью термической или электрической стимуляции, или, если они подвергались лечению канала, должны быть асимптоматичны и без технических дефектов.
Лечение
После основного обследования для всех пациентов устроили презентацию, снабдили их инструкциями о правильных контрольных измерениях супрагингвальных бляшек. Осуществили удаление камня и планировку корней.
Когда кровотечение из карманов прекратилось, 24% EDTA гель (полученный от Biora AB, Sweden) ввели в карманы на 2 минуты. Карманы затем тщательно промыли физиологическим раствором, а затем ввели либо тестируемое соединение (EMDOGAIN®), либо контрольное вещество (PGA гель).
Оценка
Основные исследования проводили на 1, 2, 3, 8, 24 неделю; учитывались следующие переменные:
1. Гигиеническое состояние полости рта - наличие/отсутствие бляшек;
2. Состояние десен - (Показатель для десен; Loe 1967);
3. Зондируемая глубина кармана;
4. Зондируемый уровень прикрепления;
5. Кровотечение при зондировании - наличие/отсутствие (15 сек);
6. Гиперчувствительность дентина - проверка струей воздуха (да/нет);
7. Степень дискомфорта - регистрируют в 1, 2 и 3 неделю исследований, используя 10 см << Visual Analogue Scale (VAS).
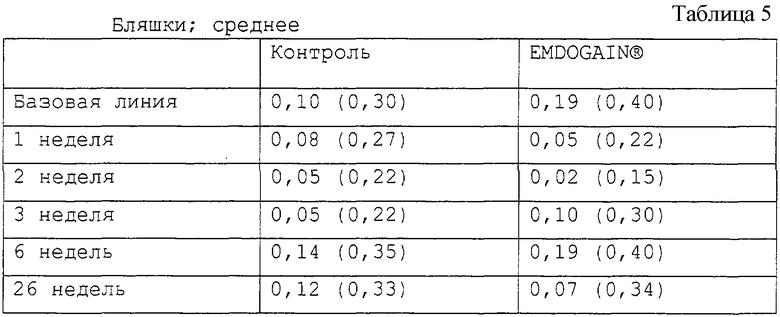
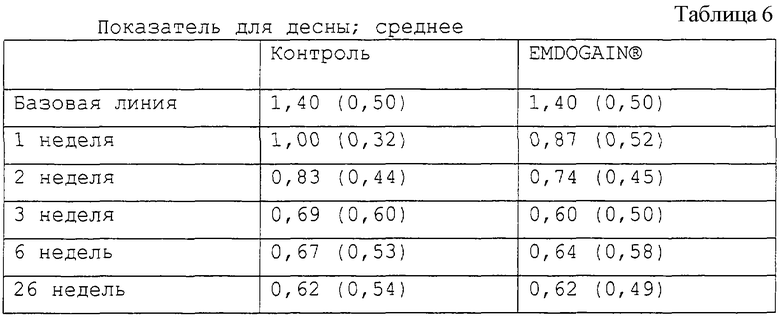
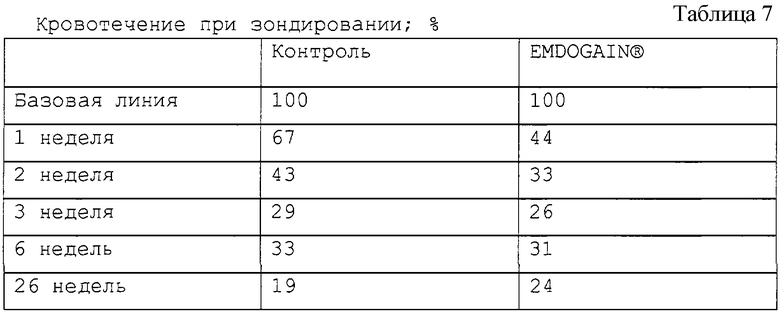
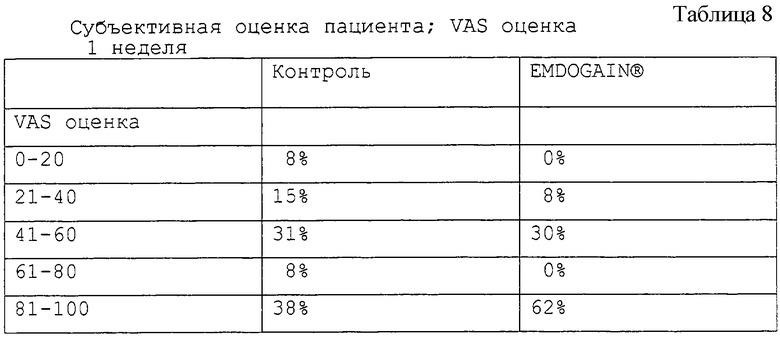
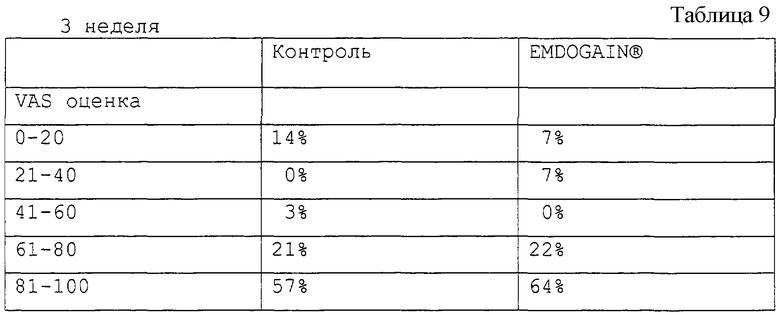
Выводы
У пациентов было меньше послеоперационных проблем, меньше было кровотечение, меньше бляшек и улучшился показатель для десен. Эти результаты подтверждают эффект залечивания ран EMDOGAIN®.
Пример 15
Пилотные исследования залечивания ран на свиньях
Введение
Цель
Целью этого пилотного исследования является оценка процесса залечивания глубоких резаных (split-thickness) ран у свиней, и оценка влияния EMD на эти раны.
Причины выбора вида животных
Свиней выбрали в качестве тестовой модели, так как этот вид животных, как было доказано, служит хорошей моделью для оценки залечивания ран у людей.
Материалы и методы
Животные
Эксперимент осуществили на 4 самках SPF свиней (скрещенные породы Дании, Йоркшира и Duroc). В начале периода акклиматизации вес тела животных составил около 35 кг.
Период акклиматизации составил 1 неделю, в течение которой животных ежедневно обследовали, чтобы исключить животных в плохом состоянии. Все наблюдения регистрировали.
Содержание
Исследования проводили в помещении для животных, снабжаемом профильтрованным воздухом при температуре 21±3°С, относительной влажности 55±15% и десятикратном обмене воздуха в час. Помещение освещалось с цикличностью 12 часов свет и 12 часов темнота. Свет включали с 06 до 18 часов.
Животных содержали в отдельных загородках.
Подстилка
В качестве подстилки использовали опилки древесины мягких пород “LIGNOCEL Н 3/4” от Hahn & Со, D-24796 Breden-bek-Kronsburg. Регулярно проводили анализ на возможные загрязнения.
Корма
Коммерчески доступный корм для свиней "Altromin 9033" от Chr. Petersen A/S, DK-4100 Ringsted давали дважды в день (примерно по 800 г). Регулярно проводили анализ на основные питательные компоненты и соответственные возможные загрязнения.
Питьевая вода
Дважды в день животным давали домашнего качества питьевую воду. Регулярно проводили анализ на возможные загрязнения.
Нанесение ран
Раны наносили в день 1. Животных анестезировали Stresnil® Vet. Janssen, Belgium (40 мг азаперона/мл, 1 мл/10 кг) и Atropin DAK, Denmark (1 мг атропина/мл, 0,5 мл/10 кг), в виде одной внутримышечной инъекции с последующим внутривенным введением Hypnodil® Janssen, Belgium (50 мг метомидата/мл, около 2 мл).
Выбривают дорсо-латеральный участок с каждой стороны-спины животного, промывают мылом и водой, дезинфицируют 70% этанолом, который смывают стерильным физиологическим раствором, и наконец осушают стерильной марлей.
На подготовленной поверхности делают восемь ран в глубину (25×25×0,4 мм), по 4 с каждой стороны спины, используя ACCU-Dermatom (GA 630, Aesculap®). Раны нумеруют от 1 (ближайшая к голове) до 4 (ближайшая к хвосту) с левой стороны животного и 5 (ближайшая к голове) до 8 (ближайшая к хвосту) с правой стороны животного.
Свернувшуюся кровь удаляют стерильной марлей.
Непосредственно перед операцией, примерно через 8 часов после операции, и при необходимости впоследствии животным внутримышечно вводят Anorfin® A/S GEA, Denmark (0,3 мг бупренорфина/мл, 0,04 мл/кг).
Дозировка
После нанесения ран осуществляют следующую обработку (см. табл.10).

А=контроль
В=EMD
Примерно за 15 минут до введения дозы приготавливают EMD композицию в соответствии с инструкциями изготовителя. EMD композицию нужно использовать в течение 2 часов после приготовления. Для обработки ран В, EMD наносят в виде тонкого слоя на поверхность раны. Одну ампулу EMD используют на 4 раны.
Перевязка ран
Раны покрывают Tegaderm®. Эту повязку накрывают марлевым бандажом, который фиксируют Fixomul®. Повязку, марлю и Fixomul® удерживают сетчатым "чулком на туловище". Band-a-rete® (Tesval, Italy). Повязки контролируют в основной день.
Повязки заменяют на 2 день (всем животным) и на 3 день (животным под №3 и 4).
Перед каждой заменой животных анестезируют внутримышечной инъекцией в шею (1,0 мл/10 кг веса тела) смесью Zoletil 50® Vet., Vibac, France (125 мг тилетамина и 125 мг золазепама в 5 мл растворителя, 5 мл) Rompun® Vet., Bayer, Germany (20 мг ксилазина/мл, 6,5 мл) и Methadon® DAK, Nycomed DAK, Denmark (10 мг метадона/мл, 2,5 мл).
Наблюдения за ранами
Каждую из ран наблюдали и фотографировали на 2 день (у всех животных), на 3 день (у всех животных) и на 4 день (у животных №3 и 4). Оценивали степень экссудации и воспаления. Внешний вид эпидермиса описывали подробно.
Клинические признаки
Все видимые признаки болезненного состояния и поведенческие изменения регистрировали ежедневно. Любые отклонения от нормы регистрировали с указанием времени наступления изменения, длительности и интенсивности.
Вес тела
Животных взвешивали по прибытии, в день нанесения ран, и в конце исследований.
Окончательные наблюдения
На третий день (около 56 часов после нанесения ран) животных 1 и 2 умерщвляют, вскрывая подключичную вену и артерию после того, как оглушают выстрелом из пистолета.
На четвертый день (около 72 часов после нанесения ран) животных №3 и №4 умерщвляют, вскрывая подключичную вену и артерию после того, как оглушают выстрелом из пистолета.
Взятие образцов тканей
Каждую из ран вырезают в виде блока, отделенного от скелетной мышечной ткани. Если происходит какое-либо прилипание к расположенной ниже скелетной мышце, часть этой мышцы включают в материал для фиксации. Каждый из блоков фиксируют в буферированном фосфатом нейтральном 4% формальдегиде.
Гистологические препараты
После фиксации четыре представительных образца из всех ран заключают в парафин, нарезают минимальной толщиной 5 мкм, и окрашивают гематоксилином и эозином. После окрашивания слайды рассматривают в световой микроскоп, используя решетку. Это позволяет измерить полную длину раны и длину эпителизированной поверхности. Отношение выражают в процентах раны, покрытой эпителиальными клетками на слайд. Получают средние значения для каждой раны, после чего рассчитывают средние значения для группы.
Статистика
Данные обрабатывают, получая групповые средние значения и стандартные отклонения, где необходимо. Возможные выбросы также определяют. После этого каждую непрерывную переменную тестируют на гомогенность средних отклонений в тесте Бартлетта. Если средние отклонения гомогенны, осуществляют дисперсионный анализ для переменной. Если имеются какие-либо заметные различия, оценивают возможные межгрупповые различия с помощью теста Dunnett′s. Если средние отклонения гетерогенны, каждую переменную тестируют на номальность методом Shapiro-Wilk. В случае нормального распределения возможные межгрупповые расхождения определяют с помощью t-теста Стьюдента, в противном случае возможные межгрупповые расхождения оценивают с помощью теста Kruskal-Wallis′s. Если находят заметные межгрупповые расхождения, осуществляют последующее определение групп с помощью теста Wilcoxon Rank-Sum.
Статистический анализ осуществлен в соответствии с SAS® процедурой (версия 6.12), описанной в "SAS/STAT® User′s Guide, version 6, Fourth Edition, Vol. 1+2", 1989, SAS Institute Inc., Cary, North Carolina 27513, USA.


| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ НА ОСНОВЕ БЕЛКОВ МАТРИКСА ЗУБНОЙ ЭМАЛИ ДЛЯ МОДУЛЯЦИИ ИММУННОГО ОТВЕТА | 2002 |
|
RU2295972C2 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ХРОНИЧЕСКОГО ПАРОДОНТИТА | 2014 |
|
RU2552911C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ТЯЖЕЛОГО ПАРОДОНТИТА | 2007 |
|
RU2343858C1 |
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА ДЛЯ СТИМУЛИРОВАНИЯ СОЕДИНЕНИЯ МЕЖДУ ЧАСТЯМИ ЖИВОЙ МИНЕРАЛИЗОВАННОЙ ТКАНИ | 1990 |
|
RU2008915C1 |
| СПОСОБ УМЕНЬШЕНИЯ ВОСПАЛЕНИЯ ТКАНИ РОТОВОЙ ПОЛОСТИ С ИСПОЛЬЗОВАНИЕМ ЭКСТРАКТА МАГНОЛИИ | 2005 |
|
RU2406522C2 |
| КОМПОЗИЦИИ ДЛЯ УХОДА ЗА ПОЛОСТЬЮ РТА, СОДЕРЖАЩИЕ КОМБИНАЦИИ АНТИБАКТЕРИАЛЬНЫХ АГЕНТОВ И АГЕНТОВ, ИЗМЕНЯЮЩИХ РЕАКЦИЮ ОРГАНИЗМА-НОСИТЕЛЯ | 2007 |
|
RU2448711C2 |
| КОМПОЗИЦИЯ И СПОСОБЫ ДЛЯ УХОДА ЗА ПОЛОСТЬЮ РТА НА ОСНОВЕ MORINDA CITRIFOLIA | 2004 |
|
RU2324472C2 |
| ЭЛЕКТРОГЕНЕРИРУЮЩИЕ ЧАСТИЦЫ И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2471492C2 |
| КОМПОЗИЦИИ КАРБОНАТНЫХ СОЕДИНЕНИЙ, ПРЕПЯТСТВУЮЩИХ ОБРАЗОВАНИЮ БИОПЛЕНКИ, ДЛЯ ИСПОЛЬЗОВАНИЯ ПРИ УХОДЕ ЗА ПОЛОСТЬЮ РТА | 2009 |
|
RU2526912C2 |
| МЕСТНОЕ НАНЕСЕНИЕ И ПРЕПАРАТЫ ЭРИТРОПОЭТИНА ДЛЯ ЗАЖИВЛЕНИЯ КОЖНЫХ РАН | 2008 |
|
RU2465003C2 |
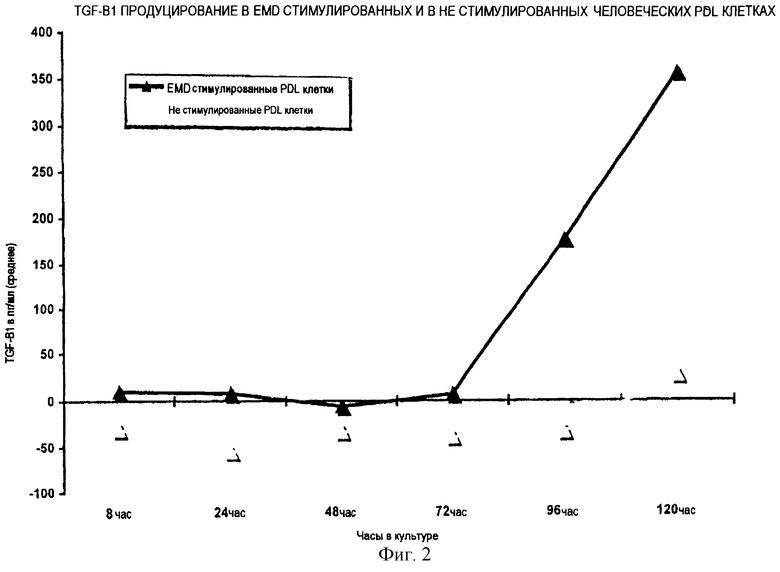
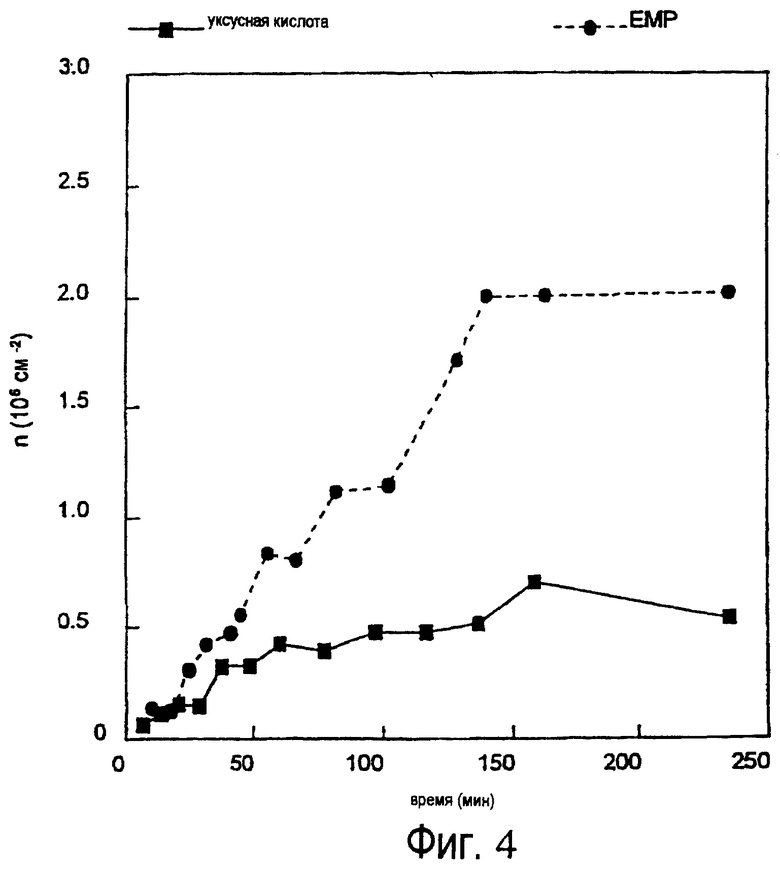
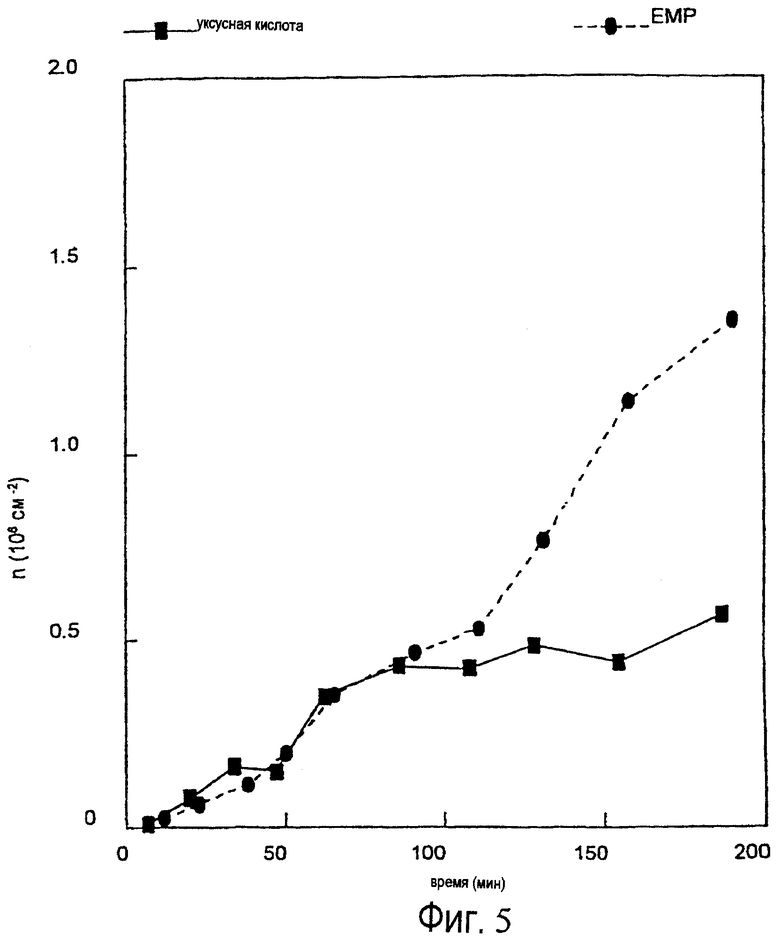
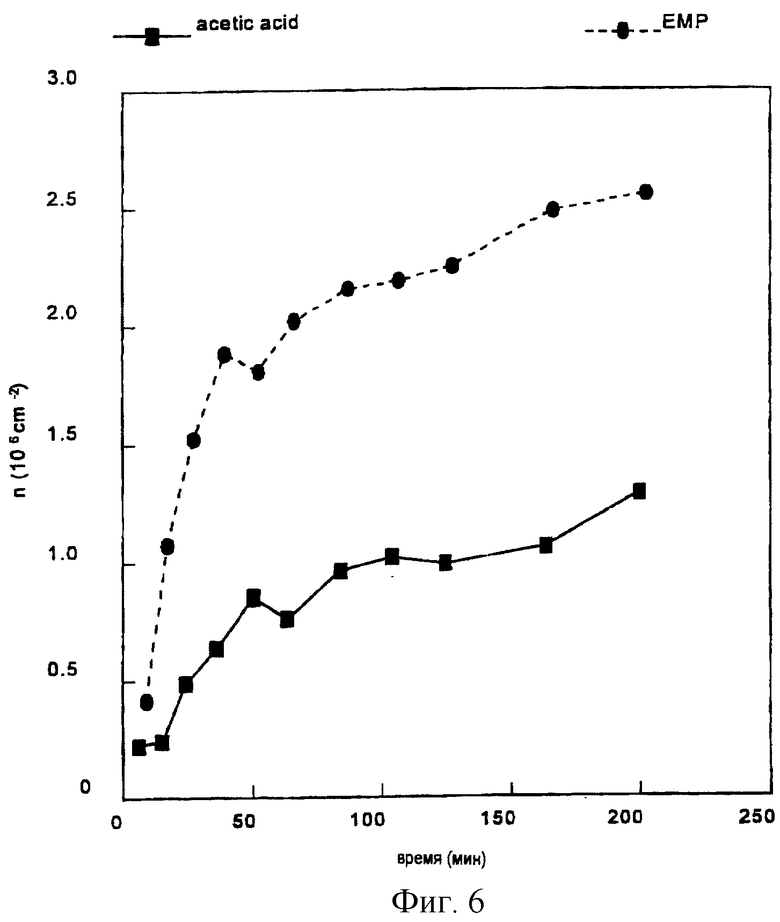

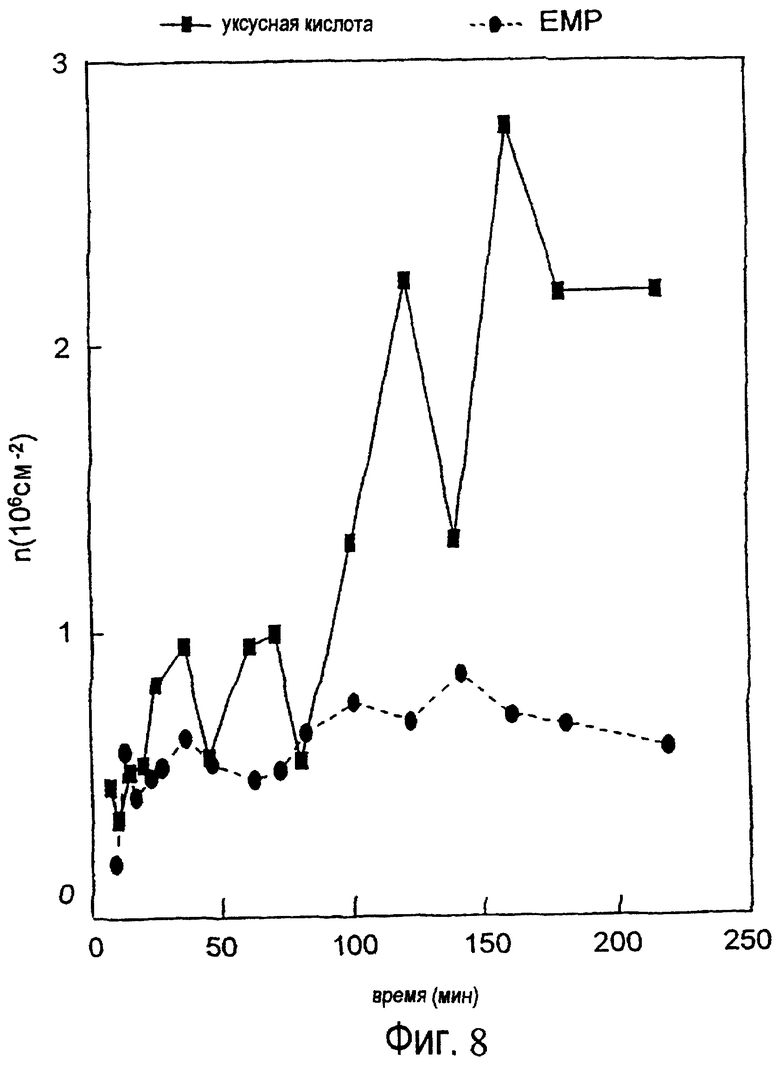
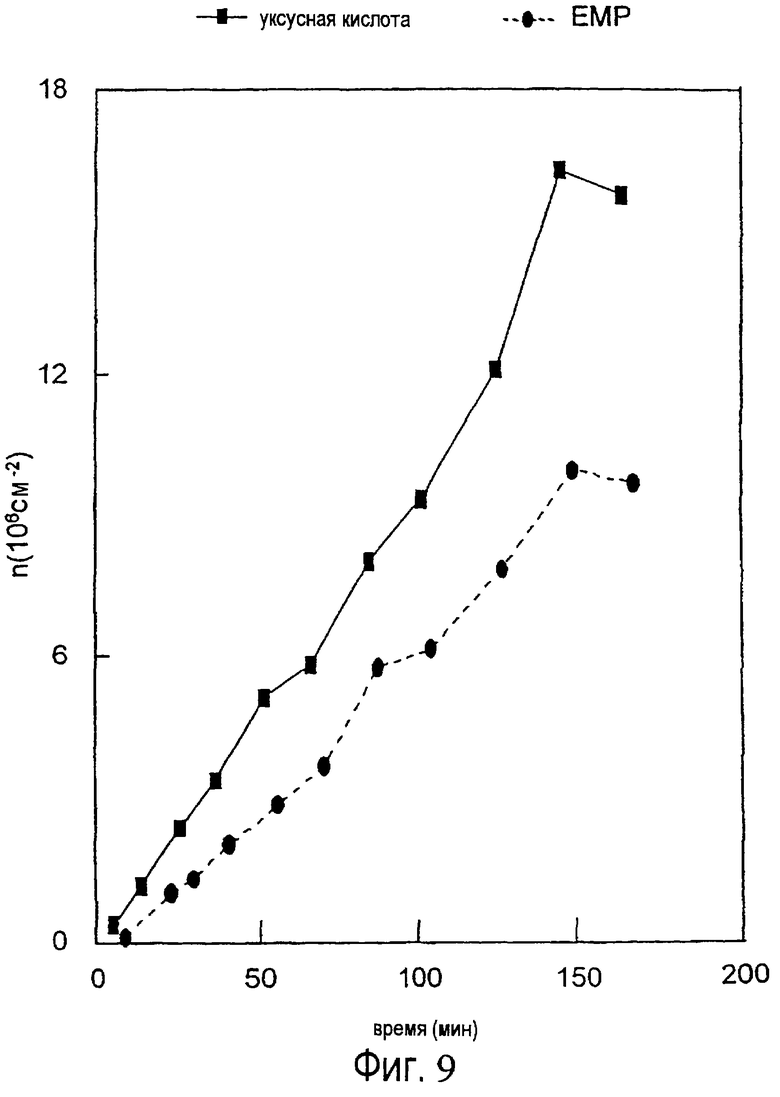

Предложено: новая композиция матриксных протеинов для лечения язв, пролежней, свищей, укусов, ран донорных участков и для лечения или профилактики бактериальных инфекционных заболеваний кожи или слизистой оболочки, а также соответствующий способ лечения. Активным веществом композиций предложены белки-предшественники зубной эмали, представляющие собой амелогенины, неамелогенины, обогащенные пролином неамелогенины, амелины и тафтелины, их производные и смеси (перечень последовательностей аминокислот представлен). Изобретение расширяет арсенал средств указанного назначения. 3 с. и 27 з.п.ф-лы, 10 ил., 10 табл.
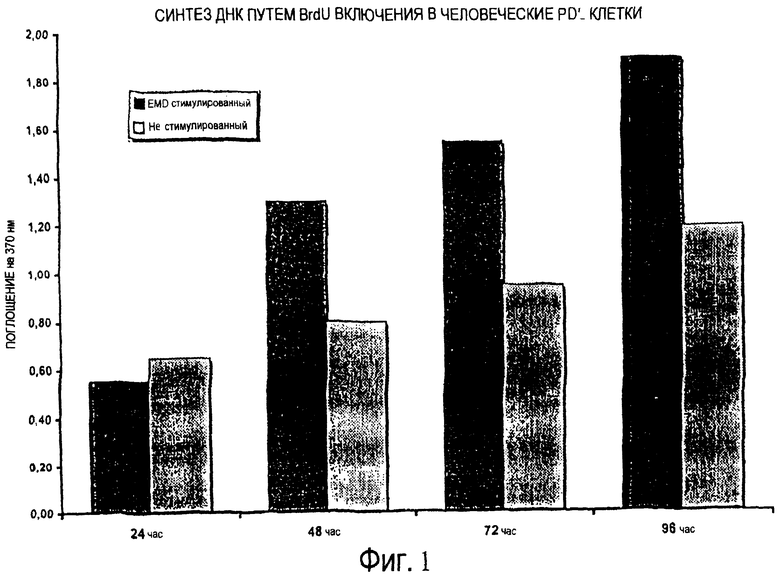
Приоритет по пунктам:
| Способ лечения язв желудка и двенадцатиперстной кишки | 1985 |
|
SU1398869A1 |
| Рабочее колесо центробежного погружного насоса | 1952 |
|
SU98529A1 |
| ЭЛЕКТРОДОДЕРЖАТЕЛЬ ВАКУУМНОЙ ДУГОВОЙ ЭЛЕКТРОНЕЧИ | 0 |
|
SU337967A1 |
| Реферат АБД Medline: Fincham AG et al., Self-assembly of a recombinant amelogenin protein generates supramolecular structures | |||
| J Struct Biol | |||
| Прибор для охлаждения жидкостей в зимнее время | 1921 |
|
SU1994A1 |
| Реферат АБД Medline: Fincham AG et al | |||
| Evidence for amelogenin "nanospheres" as functional components of secretory-stage enamel matrix | |||
| J Struct Biol | |||
| Топка с качающимися колосниковыми элементами | 1921 |
|
SU1995A1 |
| Реферат АБД Medline: Moradian-Oldak J et al., A review of the aggregation properties of a recombinant amelogenin | |||
| Connect Tissue Res | |||
| Топка с качающимися колосниковыми элементами | 1921 |
|
SU1995A1 |
| Review. | |||
Авторы
Даты
2004-12-10—Публикация
1999-02-26—Подача