Область техники, к которой относится изобретение
Данное изобретение относится к области микробиологии и в частности к новым микроорганизмам семейства Lactobacillaceae, в частности микроорганизмам рода Lactobacillus, которые можно применять для предупреждения или лечения диареи. Данное изобретение также относится к использованию указанных микроорганизмов для приготовления принимаемого средства для предупреждения или лечения диареи.
Уровень техники
Организмы, продуцирующие в качестве основного метаболического компонента молочную кислоту, хорошо известны. Такие бактерии могут быть обнаружены в молоке или в обрабатывающих молоко устройствах, соответственно живых или разлагающихся растениях, а также в кишечнике человека и животных. Эти микроорганизмы, объединяемые под термином “молочно-кислые бактерии”, представляют довольно негомогенную группу и содержат, например, роды Lactococcus, Lactobacillus, Streptococcus, Bifidobacterium, Pediococcus и т.д.
Молочно-кислые бактерии также используют в качестве ферментирующих агентов для консервирования пищевых продуктов при низком рН под воздействием продуктов ферментации, образующихся во время их ферментативной активности, для ингибирования роста портящих пищевые продукты бактерий. Для этой цели молочно-кислые бактерии использовали для приготовления множества различных пищевых продуктов из молока, таких как сыр, йогурт и другие ферментируемые молочные продукты.
Совсем недавно молочно-кислые бактерии привлекли большое внимание тем, что были обнаружены некоторые штаммы, полезные для человека и животных при приеме внутрь. В частности, было обнаружено, что определенные штаммы родов Lactobacillus или Bifidobacterium способны заселять слизистую оболочку кишечника и способствовать поддержанию здоровья человека и животного.
В этом отношении, в ЕР 0768375 описаны специфические штаммы рода Bifidobacterium, которые способны приживаться в качестве кишечной флоры и могут прикрепляться к кишечным клеткам. Сообщается, что бифидобактерии способствуют иммуномодуляции, конкурентно устраняя адгезию патогенных бактерий к клеткам кишечника и способствуя тем самым поддержанию здоровья человека.
Во время последних нескольких лет исследование сосредоточилось также на потенциальном применении молочно-кислых бактерий в качестве симбиотических агентов. Под симбиотическими агентами понимают жизнеспособные микробные препараты, стимулирующие здоровье человека путем сохранения природной микрофлоры кишечника. Микробный препарат признается симбиотическим агентом в том случае, если известны его эффективные микробы и их способ действия. Считается, что симбиотические агенты присоединяются к слизистой оболочке кишечника, заселяют кишечный тракт и, по-видимому, предотвращают прикрепление к нему вредных микроорганизмов. Критическая предпосылка для их действия заключается в том, что они должны достигать слизистой оболочки кишечника в правильной и жизнеспособной форме и не разрушаться в верхней части желудочно-кишечного тракта, в частности, под действием низкого рН желудка.
В этом отношении, в WO 97/00078 в качестве симбиотического агента описан специфический штамм, названный Lactobacillus GG (АТСС 53103). Этот микроорганизм применяют, в частности, в способе предупреждения или лечения индуцируемых пищевыми продуктами аллергических реакций, причем его вводят реципиенту вместе с пищевым продуктом, который был подвергнут гидролизной обработке пепсином и/или трипсином. Выбранный штамм Lactobacillus характеризуется адгезивными и колонизирующими свойствами и обладает экзопротеазной ферментативной активностью, так что белковый материал, содержащийся в вводимом пищевом продукте, дополнительно гидролизуется посредством протеаз, секретируемых этим штаммом Lactobacillus. Способ, обсуждаемый в этом документе, будет в конечном счете приводить к поглощению кишечником белкового материала, который не обнаруживает уже существенного количества аллергенного материала.
Кроме того, в ЕР 0577903 рассмотрено на применение молочно-кислых бактерий, способных замещать Heliobacter pylori, инфекционного агента, способствующего развитию язвы, для приготовления средства для терапевтического или профилактического лечения язвы, связанной с действием Heliobacter pylori.
Сущность изобретения
Полезные свойства молочно-кислых бактерий делают необходимым поиск и обнаружение новых штаммов молочно-кислых бактерий, полезных для здоровья человека и/или животных.
Таким образом, задача данного изобретения состоит в поиске новых бактериальных штаммов, обладающих свойствами, полученными для человека и/или животных.
Вышеуказанная проблема была решена при обнаружении новых микроорганизмов, а именно молочно-кислых бактерий рода Lactobacillus, обладающих способностью прикрепляться к слизистой оболочке кишечника, заселять ее и предотвращать инфекцию эпителиальных клеток кишечника ротавирусами.
Согласно предпочтительному варианту, обнаруженные штаммы Lactobacillus способны расти в присутствии до 0,4% солей желчных кислот, так что они могут легко проходить через желудочно-кишечный тракт и оставаться активными.
В соответствии с еще одним предпочтительным вариантом молочно-кислые бактерии выбирают из группы, состоящей из Lactobacillus rhamnosus или Lactobacillus paracasei, предпочтительно Lactobacillus paracasei и более предпочтительно Lactobacillus parasei CNCM I-2116.
Было показано, что микроорганизмы данного изобретения проявляют следующие свойства: являются грамположительными, каталаза-отрицательными, отрицательными по NН3-формы аргинина и отрицательными по продуцированию СО2. Они продуцируют L(+)-молочную кислоту, способны расти в присутствии желчных солей в концентрации до около 0,4% и могут предотвращать инфекцию эпителиальных клеток ротавирусами.
Новые микроорганизмы могут быть использованы для приготовления различных принимаемых внутрь средств, таких как молоко, йогурт, творог, ферментированное молоко, продукты на основе ферментированного молока, ферментированные продукты на основе зерновых злаков, сухое молоко, детское питание, в количестве от около 105 КОЕ/г до около 1011 КОЕ/г средства. Сокращение КОЕ означает “колониеобразующая единица”, которая определяется как число колоний бактериальных клеток, обнаруживаемых на чашках с агаровой средой.
Таким образом, данное изобретение обеспечивает принимаемые внутрь средства, представляющие собой пищевой продукт или фармацевтический препарат, содержащие по меньшей мере один из штаммов Lactobacillus, характеризующийся вышеуказанными признаками.
Для приготовления принимаемого внутрь средства по изобретению по меньшей мере один из штаммов Lactobacillus данного изобретения добавляют в принимаемое внутрь средство в количестве от около 105 КОЕ/г до около 1011 КОЕ/г, предпочтительно от около 106 КОЕ/г до около 1010 КОЕ/г, более предпочтительно от около 107 КОЕ/г до около 109 КОЕ/г.
В случае фармацевтического препарата этот продукт может быть приготовлен в форме таблеток, жидких бактериальных суспензий, высушенных пероральных добавок, увлажненных пероральных добавок, сухого продукта для введения через трубку или жидкого продукта для введения через трубку с количеством Lactobacillus вплоть до около 1012 КОЕ/г, предпочтительно от около 107 КОЕ/г до около 1011 КОЕ/г, более предпочтительно от около 107 КОЕ/г до около 1010 КОЕ/г.
Активность новых микроорганизмов в кишечнике индивидуума зависит от количества этих микроорганизмов. То есть, чем больше количество микроорганизмов содержится в принимаемом внутрь средстве (пищевой материал или фармацевтическая композиця), тем выше защитная или лечебная активность данного средства. Поскольку новые микроорганизмы являются безвредными для людей и животных и были выделены из фекалий ребенка, существенное их количество может быть включено в средство таким образом, чтобы по существу значительная часть кишечника индивидуума была заселена (колонизирована) новыми микроорганизмами.
Перечень фигур
Фиг.1. Скрининг клеточной культуры для определения защитных свойств бактериальных штаммов против ротавируса.
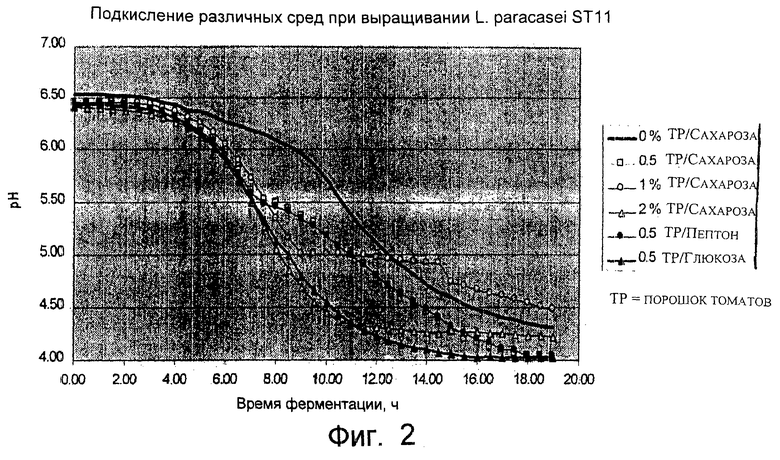
Фиг.2. Подкисление различных сред при выращивании штамма L. paracasei CNCM I-2116 (названного ST11).
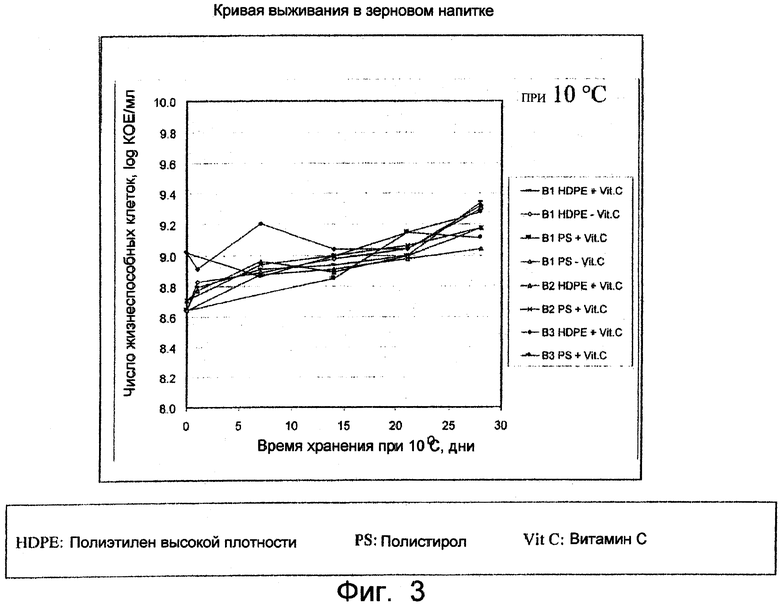
Фиг.3. Кривая выживания L. paracasei ST11 при 10°С в течение 30 дней.
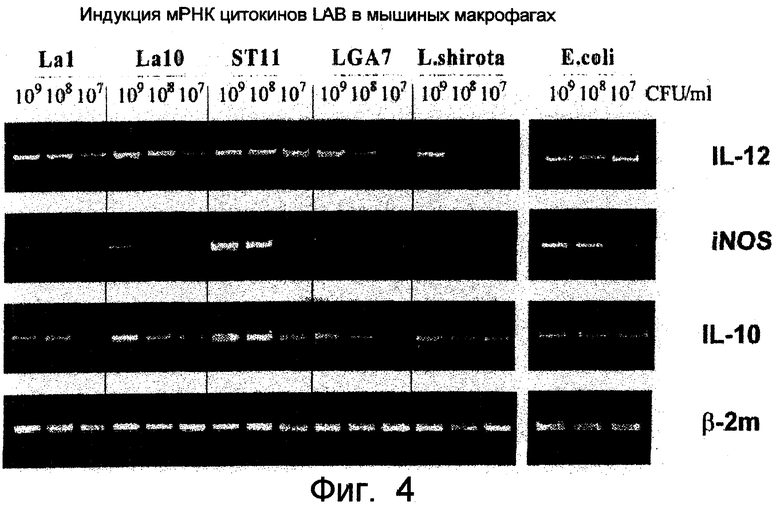
Фиг.4. Распределение мРНК IL-12 и IL-10 в мышиных прикрепленных клетках, полученных из костного мозга, после инкубации этих клеток с серийными разведениями ST11.
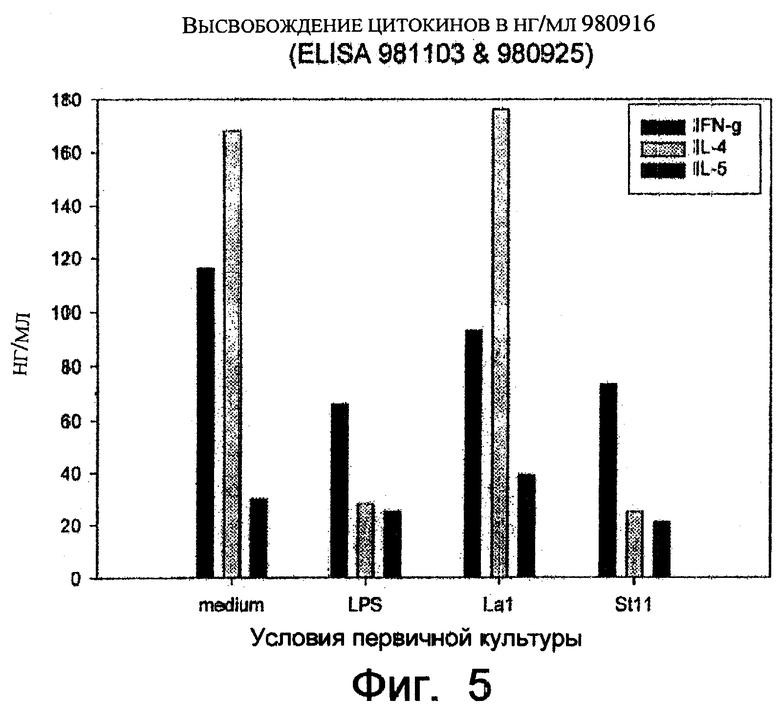
Фиг.5. Уменьшение продуцирования IL-4 при дифференцировке Th2.
Раскрытие изобретения
Во время интенсивных исследований, приведших к данному изобретению, авторы изобретения исследовали фекалии младенцев и выделили из них много разных бактериальных штаммов. Выделенные штаммы затем испытывали на способность предотвращать инфекцию эпителиальных клеток ротавирусами, о которых известно, что они вызывают диарею.
Несколько бактериальных родов, включающих в себя Lactobacillus, Lactococcus, Streptococcus, скринировали на ингибирующую ротавирус активность. Тесты на ингибирующую активность проводили на трех серотипах ротавируса, включающих основные этиологические агенты вирусной диареи человека (серотипами G1, G3 и G4).
Различные молочно-кислые бактерии выращивали в подходящей среде, такой как MRS, Hugo-Jago или М17, при температуре от около 30 до 40°С, соответствующей их оптимальной температуре роста. После достижения стационарной фазы бактерии собирали центрифугированием и ресуспендировали в физиологическом растворе NaCl. Между различными тестами бактериальные клетки хранили в замороженном виде (-20°С).
Исходные штоки различных ротавирусов готовили инфицированием конфлюэнтных монослоев клеток. Ротавирусы инкубировали перед инфицированием. Клетки инфицировали 20 инфекционными дозами для культуры ткани.
Для оценки антиротавирусной активности использовали два различных метода. Согласно одному методу, различные бактериальные штаммы испытывали на их способность взаимодействовать непосредственно с ротавирусом, тогда как в другом методе определяли бактериальные штаммы, которые взаимодействуют с клеточными рецепторами ротавируса.
Первый метод был основан на контактировании бактериальной суспензии с различным ротавирусными штаммами в подходящей среде. Затем смесь вирус-бактерия наносили на клеточный монослой недифференцированных клеток НТ-29 аденомы ободочной кишки человека и инкубирование продолжали, после чего оценивали репликацию вируса.
Второй метод был основан на инкубации бактериальной суспензии сначала с клеточным монослоем недифференцированных клеток НТ-29 аденомы ободочной кишки человека с последующим добавлением вируса. После повторной инкубации оценивали репликацию вируса.
Репликация ротавируса может быть легко оценена гисто-иммунологическим окрашиванием белков ротавируса в инфицированных клетках.
Бактериальный штамм обладает ингибирующей ротавирус активностью, если при инокуляции ротавирусом совместно с изучаемым бактериальным штаммом число инфицированных клеток уменьшалось на 90% по сравнению с инокуляцией только ротавирусом.
В ходе исследования было обнаружено, что из 260 проанализированных бактериальных штаммов только 9 существенно ингибировали репликацию ротавирусов. Было установлено, что эти бактерии принадлежали к подвидам rhamnosus или paracasei рода Lactobacillus. Также было обнаружено, что один штамм, названный Lactobacillus paracasei ST11, депонированный в соответствии с условиями Будапештского Договора с депозитным номером NCC 2461 (1-2116), является чрезвычайно эффективным в предотвращении инфекции клеток человека ротавирусом. Кроме того, этот штамм обладает превосходными ростовыми характеристиками, что подтверждается подкислением культуральных сред при выращивании этого штамма. Этот штамм обладал также хорошей кривой выживания при хранении при температуре около 10°С, что делает его превосходным кандидатом для включения введения в принимаемые внутрь средства (пищевые продукты или фармацевтические композиции), подлежащие хранению в холодильнике.
Кроме описанного выше открытия, авторы также неожиданно обнаружили, что штаммы данного изобретения обладают противоаллергической активностью, поскольку влияют на синтез различных иммунологических медиаторов.
Общепризнанно, что гуморальные иммунные реакции и аллергические реакции опосредуются CD4+ Т-клетками с фенотипом Th2. Th2-клетки характеризуются продуцированием больших количеств интерлейкина 4 (IL-4), цитокина, необходимого для секреции IgE, который является основным классом антител, участвующим в аллергических реакциях.
Дифференцировка Тh2-клеток нарушается IFN-γ цитокином, продуцируется взаимоисключающей ТH1-субпопуляцией CD4+ Т-клеток. Указанные Тh1-клетки, в свою очередь, индуцируются интерлейкином 12 (IL-12). Было показано, что в противоположность этому IL-10, другой цитокин, оказывает сильное супрессирующее действие на пролиферацию Тh1-клеток, и, как предполагают, что он играет роль в иммуносупрессивных механизмах.
В целом, как IL-12, так и IL-10 оказывают сильные модулирующие действия на развитие CD4+ Т-клеток путем влияния на развитие Th1-субпопуляции. IL-12 является ключевым регуляторным цитокином для индукции дифференцировки Th1 и, следовательно, ингибирует генерирование Тh2-ответов. Основным путем ингибирования Тh2-клеток считается, следовательно, стимуляция синтеза IL-12 вспомогательньми клетками.
Хорошо известно, что некоторые компоненты грамотрицательных бактерий, такие как LPS (липополисахарид), индуцируют синтез больших количеств IL-12 в прикрепленных клетках, таких как макрофаги и дендритные клетки. В соответствии с этим было обнаружено, что грамотрицательные бактерии могут сильно смещать CD4+ Т-клеточную дифференцировку в направлении Thi-фенотипа.
Микроорганизм ST11 как пример штаммов Lactobacillus данного изобретения исследовали на потенциальную активность индуцировать цитокины, участвующих в регуляции дифференцировки CD4+ Т-клеток. В частности, исследовали действие ST11 на фенотип CD4+ Т-клеток, подвергающихся Тh2-дифференцировке.
В этой связи способность ST11 индуцировать синтез мРНК, кодирующих эти регуляторные цитокины в мышиных прикрепленных клетках, полученных из костного мозга, сравнивали с 4 другими штаммами Lactobacillus и контрольными грамотрицательными бактериями (Е. coli К 12). Содержание мРНК измеряли полуколичественной ОТ-ПЦР (RT-PCR) после 6 часов инкубации этих клеток с бактериальными штаммами в разведении от 107 до 109 КОЕ/мл.
Было показано, что хотя все штаммы Lactobacillus могли в некоторой степени индуцировать транскрипцию мРНК IL-12, ST11 оказался наиболее сильным индуктором, поскольку сильный сигнал ПЦР удавалось детектировать даже при самых высоких разведениях бактерий. Фактически, способность ST11 индуцировать транскрипцию мРНК IL-12 была такой же сильной, что и способность Е. coli. Индукция мРНК IL-10 была обычно более низкой, чем мРНК IL-12, так как сигнал удавалось детектировать при более низких разведениях. Тем не менеее, ST11 был наиболее сильным индуктором мРНК IL-10 по сравнению с другими штаммами Lactobacillus и контролем Е. coli.
Таким образом, было установлено, что ST11 является эффективным индуктором иммунорегуляторных цитокинов, участвующих в дифференцировке CD4+ Т-клеток. Его сильная активность индукции IL-12 делает его кандидатом для ингибирования Тh2-реакций, и его измеряемая индукция IL-10 может предотвращать воспалительные процессы.
Кроме описанного выше открытия, также изучали, оказывает ли ST11 ингибирующее действие на CD4+ Т-клети, подвергающиеся Тh2-дифференцировке, и положительное действие на функции Тh1. Использовали хорошо известную систему для анализа дифференцировки клеток, в которой предшественник CD4+ Т-клеток поликлонально активировали и модулировали направление либо Тh1, либо Тh2-дифференцировки, в зависимости от типа модулятора, добавленного к культуральной среде. Тh1/Тh2-дифференцировку индуцировали в течение 7-дней в первичной культуре, после чего клетки повторно индуцировали в течение 2 дней во вторичной культуре, содержащей только среду, и приобретение специфического фенотипа (Тh1 или Th2) оценивали при определении количества двух типов цитокинов, продуцируемых в супернатанте (IFN-γ или IL-4).
Известно, что предшественник CD4+ Т-клеток, выделенный из мышей BALB/c, предпочтительно дифференцируют в преобладающий фенотип Th2 (высокое содержание IL-4, низкое содержание IFN-γ во вторичных культуральных супернатантах) при активации в нейтральных условиях (среда без добавок в первичной культуре). Этот фенотип мог быть полностью обращен в фенотип Th1 (высокое содержание IFN-γ, низкое содержание IL-4) при добавлении блокирующего моноклонального антитела к IL-4 к первичной культуре.
Для исследования потенциальной роли ST11 в ингибировании фенотипа Th2 предшественник CD4+ Т-клеток, выделенный из мышей BALB/c, активировали в присутствии прикрепленных клеток костного мозга в качестве вспомогательных клеток в первичной культуре.
Клетки культивировали либо в среде без добавок, в присутствии 1 мг/мл LPS, в присутствии 108 КОЕ/мл ST11 или в присутствии 108 КОЕ/мл другого Lactobacillus. После инкубации клетки промывали, CD4+ Т-клетки один раз очищали и повторно стимулировали во вторичной культуре в среде без добавок.
Цитокины, продуцируемые дифференцированными CD4+ Т-клетками, определяли через 2 дня. Как и ожидалось, клетки, которые дифференцировались в присутствии без добавок среды, развивали доминантный фенотип Th2. Добавление ST11 к первичным культурам модулировало Тh2-дифференцировку, поскольку приводило к 8-кратному уменьшению IL-4. Сходное по величине ингибирование наблюдалось в культурах, дифференцировашихся в присутствии LPS. В противоположность этому, другой проанализированный штамм Lactobacillus не оказывал существенного влияния на содержание IL-4. Интересно, что содержание IFN-γ не увеличивалось при добавлении ST11 в первичные культуры.
В целом, ST11 специфически подавлял продуцирование IL-4 CD4+ Т-клетками, подвергающимися Тh2-дифференцировке, но не увеличивал значимо секрецию IFN-γ. Факт, что ST11 не увеличивал продерецию IFN-γ, может быть связан с его способностью индуцировать IL-10, приводящей к тому, что он может поддерживать низкое воспалительное действие, несмотря на его активность против Th2.
Таким образом авторам удалось показать, что ST11 является одним из штаммов Lactobacillus с хорошим анти-Тh2 профилем, что делает их превосходными кандидатами для их использования в качестве бактериальных штаммов с антиаллергической, симбиотической активностью.
Сведения, подтверждающие возможность осуществления изобретения
Далее изобретение будет описано с использованием примеров.
Среды и растворы:
MRS (Difco)
Hugo-Jago (триптон Difco 30 г/л, дрожжевой экстракт Difco 10 г/л, лактоза Difco 5 г/л, К2НРO4 6 г/л, мясной экстракт Difco 2 г/л, агар Difco 2 г/л)
М17 (Difco)
М199 (Seromed)
Раствор Рингера (Oxoid)
PBS (NaCl 8 г/л, КСl 0,2 г/л, Na2HPO4 1,15 г/л, К2НРO4 0,2 г/л)
Триптоза-фосфатный бульон (Flow)
Раствор Трипсин-ЕDТА (Seromed)
Ротавирус Wa человека (серотип G1) и обезьяний ротавирус SA-11 (серотип G3) был получен от Р.A. Offit, Children’s Hospital of Philadelphia, USA Реассорциированный DS-IxRRV вирус был получен от A.Kapikan, NIH Bethesda, USA Ротавирус Hochi человека ceротипа 4 был получен от Р. Bachmann, University of Munich, Germany.
Пример 1
Выделение молочно-кислых бактерий из фекалий младенцев
Свежие фекалии собирали из пеленок 16 здоровых младенцев в возрасте 15-27 дней. 1 г свежих фекалий помещали в анаэробные условия для транспортировки в лабораторию и в пределах 2 часов от взятия проб готовили серийные разведения в растворе Рингера и высевали их на селективные среды. Для выделения молочно-кислых бактерий MRS-агар антибиотиками (фосфомицин 80 мкг/мл, сульфаметоксазол 93 мкг/мл, триметоприм 5 мкг/мл) инкубировали при 37°С в течение 48 часов. Колонии отбирали случайным образом и очищали. Физиологическую и генетическую характеристику проводили на изолятах.
Пример 2
Определение антиротавирусной активности штаммов
Несколько бактериальных штаммов, включая Lactobacillus, Lactocjccus, Streptococcus, и тестировали на антиротавирусную активность в тесте ингибирования в культуре клеток. Род Lactococcus был представлен единственным видом (Lc. lactis), состоящим из двух подвидов (Lc. lactis supsp. lactis и cremoris). Всего было проанализировано 30 штаммов. Род Streptococcus был представлен единственным видом (S. Thermophilus) с 45 штаммами. Род Leuconostoc и Propionibacterium были представлены только единственными видами (6 штаммами), тогда как род Enterococcus и род Staphylococcus были представлены, каждый, двумя видами и в целом 17 штаммами.
Всего на ингибирующую ротавирус активность были испытаны 260 бактериальных штаммов.
Метод 1
30 мкл бактериальной суспензии, содержащей в среднем 3×106 бактерий, смешивали с 70 мкл среды Ml 99, содержащей 10% триптоза-фосфатного бульона (Flow) и 5% раствора трипсин-EDTA (Seromed) (разведенным 1:4 для клеток НТ-29) и 100 мкл вируса в среде Ml 99 с вышеуказанными добавками. Смесь вирус-бактерия инкубировали 1 час при 4°С и 1 час при 37°С. Недифференцированные клетки НТ-29 аденомы ободочной кишки человека, растущие в виде конфлюэнтного монослоя в 96-луночных микротитрационных планшетах, промывали три раза PBS, рН 7,2. Смесь вирус-бактерия наносили на эти клетки и микротитрационные планшеты инкубировали 18 часов в СO2-термостате (Heraeus). Репликацию вируса оценивали, как описано ниже.
Метод 2
30 мкл бактериальной суспензии (см. выше) смешивали с 70 мкл среды М199, содержащей 10% триптоза-фосфатного бульона (Flow) и 5% раствора трипсин-EDTA (Seromed) (разведенным 1:4 для клеток НТ-29) и наносили непосредственно на клетки в микротитрационных планшетах. После одного часа инкубации при 37°С 100 мкл вируса в среде M199 с вышеуказанными добавками добавляли к клеткам в микротитрационных планшетах и инкубировали 18 часов в СО2-термостате (Heraeus). Репликацию вируса оценивали, как описано ниже.
Репликацию вируса оценивали при помощи гисто-иммунологического окрашивания белков ротавируса в инфицированных клетках, как описано далее.
Спустя один день после инфекции, культуральную среду удаляли из микротитрационных планшетов и клетки фиксировали абсолютным спиртом в течение 10 минут. Этанол удаляли и планшеты трижды промывали PBS. Затем в каждую лунку добавляли 50 мкл кроличьей антиротавирусной сыворотки (в основном против белка VP6), (ISREC University of Lausanne), разведенной 1:2000 в PBS, и инкубировали 1 час при 37°С с покровным стеклом для предотвращения. Антисыворотку удаляли и планшеты трижды промывали PBS. Затем в каждую лунку добавляли 50 мкл козьей антисыворотки против кроличьего иммуноглобулина G (IgG), конъюгированной с пероксидазой (GAR-IgG-PO; Nordic), разведенной 1:500 в PBS и планшеты инкубировали 1 час при 37°С. Сыворотку удаляли и планшеты трижды промывали PBS. Затем в каждую лунку добавляли 100 мкл смеси субстрата, содержащей 10 мл 0,05 М Трис-НСl (рН 7,8), 1 мл Н2О2 (30% особо чистой, разбавленной 1:600 в Н2О; Merck) и 200 мкл 3-амино-9-этилкарбазола (0,1 г/10 мл этанола, хранящегося в виде аликвот 200 мкл при -80°С; Sigma). Планшеты инкубировали по меньшей мере 30 минут при комнатной температуре. Субстрат удаляли и в каждую лунку добавляли 200 мкл Н2О для остановки реакции. Очаги инфицированных клеток считали под инвертационным микроскопом (Diavert; Leitz).
Только очень небольшое число бактериальных штаммов взаимодействовали с ротавирусами. Лишь 9 из 260 первоначально отобранных бактериальных штаммов ингибировали репликацию ротавируса по крайней мере в одном методе. Lactobacillus paracasei NCC 2461 (ST11) показал чрезвычайно высокую активность против Ротавируса серотипа 1, ротавируса SA-11 серотипа 3 и ротавируса Hochi серотипа 4.
Пример 3
Свойства ST11
ST11 инкубировали в модельном желудочном соке. Модельный желудочный сок готовили суспендированием пепсина (3 г/л) в стерильном солевом растворе (0,5% мас./об.) и доведением рН до 2,0 и 3,0 соответственно концентрированной НСl.
ST11 выращивали в указанных выше средах и определяли устойчивость микроорганизмов.
Результаты суммированы в таблице I.
ST11 характеризовался следующими свойствами в соответствии со способами, описанными в Genera of lactic acid bacteria, Ed. B.J.B. Wood and W.H. Holzapfel, Blackie A&P.
- грамположительные,
- каталаза-отрицательные,
- отрицательные по NН3-форме аргинина,
- отрицательные по продуцированию СО2,
- продуцирующие L(+)-молочную кислоту,
- растущие в присутствии солей желчных кислот в
концентрации до приблизительно 0,4%.
Пример 4
Рост ST11 при различных условиях
ST11 инкубировали при 37°С в среде на основе томатов (4% порошок томатов, ресуспендированный в дистиллированной воде), с сахарозой (0,0,5, 1 или 2%) или соевым пептоном (0,5%) или глюкозой (0,5%), в течение различных периодов времени.
Результаты показаны на фиг.2.
ST11 добавляли в количестве 2,5% к среде, состоящей из рисовой муки (3%), пшеничной муки (2%) и сахарозы (3%) и инкубировали при 37°С до рН 4,4. После охлаждения продукт упаковывали с добавлением или без добавления витамина С и хранили при 10°С.
Пример 5
Индукция синтеза мРНК IL-12 и IL-10 в мышиных прикрепленных клетках посредством ST11
Клетки костного мозга выделяли из бедренной и большеберцовой костей 8-недельных, не содержащих конкретного патогена мышей C57BL/6, инкубировали при концентрации 2×106 клеток/мл в среде RPMI (Gibco), содержащей 10% фетальной телячьей сыворотки, 1 мМ L-глутамина, 12 мМ Hepes, 0,05 мМ 2-меркаптоэтанола, 100 Е/мл пенициллина и 100 мкг/мл стрептомицина (все реагенты из Gibco), 12 часов при 37°С в атмосфере 5% СO2. Неприкрепленные клетки удаляли 3 последовательными промывками теплой культуральной средой, а оставшиеся прикрепившиеся клетки инкубировали при концентрации 106 клеток/мл в течение 6 часов в присутствии или в отсутствие бактерий. Предварительно было определено, что 6 часов являются оптимальной временным интервалом для определения синтеза мРНК цитокинов мышиными прикрепленными клетками в ответ на LPS. Бактерии добавляли при различных концентрациях в диапазоне от 109 до 107 КОЕ/мл. Бактерии выращивали и хранили, как указано выше.
В конце 6-часового периода культивирования клетки выделяли центрифугированием и лизировали с использованием набора реагентов TRIzol (GibcoBRL, Cat. No. 15596-018) в соответствии с инструкциями изготовителя. Тотальную РНК осаждали изопропанолом и обратно транскрибировали в кДНК в течение 90 минут при 42°С с использованием 200 Е обратной транскриптазы (Superscript II, BRL) в реакционном объеме 40 мкл, содержащем 200 мМ Трис рН 8,3, 25 мМ КСl, 1 мкг/мл олиго-d(Т)15 (Boehringer Mannheim), 1 мМ ДТТ (Воеhringer Mannheim), 4 мМ каждого из dNTP (Boehringer Mannheim) и 40 Е/мл Rnasin (Promega). Использовали ПЦР-праймеры и условия, уже описанные в Kopf et al. (Journal of Experimental Medicine 1996 Sep. 1:184(3):1127-36). Количества кДНК нормализовали в пробах с использованием праймеров, специфических (β-2-микроглобулина) (гены домашнего хозяйства). ПЦР-продукты разделяли в 2% агарозном геле и полосы анализировали под УФ.
Как показано на фигуре 4, ST11 оказывал самое сильное ингибирующее действие на синтез мРНК IL-12 и IL-10, сравнимое с наблюдаемым для положительного контроля (Е. coli). Различия лучше всего видны при самых низких концентрациях бактерий (107 КОЕ/мл).
Пример 6
Супрессия синтеза IL-4 ST11
CD4+ Т-клетки выделяли из селезенки не содержащих конкретного патогена BALB/c мышей с использованием набора MiniMACS из Miltenui Biotec (Cat. No. 492-01). CD4+ Т-клетки культивировали при концентрации 2×105 клеток/мл в среде RPMI, содержащей 10% фетальной телячьей сыворотки, 1 мМ L-глутамина, 12 мМ Hepes, 0,05 мМ 2-меркаптоэтанола, 100 Е/мл пенициллина и 100 мкг/мл стрептомицина, и активировали на протяжении одной недели сшиванием со связанными с планшетом моноклональными антителами против CD3 (клон 2С11) и CD28 (клон 37, 51), оба антитела от Pharmingen. Во время первичной культуры CD4+ Т-клетки сокультивировали с прикрепленными клетками костного мозга (выделенными, как описано выше) в качестве вспомогательных клеток в среде, содержащей 108 КОЕ/мл Lal или 1 мг/мл LPS или в среде без добавок. Затем клетки промывали и CD4+ Т-клетки выделяли с использованием набора MiniMACS и повторно стимулировали во вторичной культуре, в среде без добавок. Цитокины, продуцируемые дифференцированными CD4+ Т-клетками, определяли в супернатантах через 2 дня с использованием сэндвич-ELISA (наборы от Endogen и Pharmingen).
Результаты показаны на фиг.5. Клетки, дифференцировавшиеся в присутствии без добавок среды, обладали доминатным фенотипом Th2, характеризующимся высоким содержанием IL-4. Добавление ST11 к первичным культурам модулировало дифференцировку Th2, поскольку приводило к 8-кратному снижению продуцирования IL-4. Сходное ингибирование наблюдалось в культурах, дифференцировавшихся в присутствии LPS. В противоположность этому, другие штаммы Lactobacillus не оказывали существенного влияния на содержание IL-4. Интересно, что содержание IFN-γ не увеличивалось при добавлении ST11 в первичные культуры.
Как можно видеть из приведенных выше данных, штаммы данного изобретения вполне могут быть использованы для приготовления принимаемого внутрь пищевого и/или фармацевтического средства с использованием ценных свойств этих микроорганизмов.
Пример 7
Штамм ST11 исследовали в клинических испытаниях на жителях предместья Guatemala City на способность влиять на передачу и протекание острой диареи дождливого сезона, которой страдают большинство детей этой области. Всего 203 ребенка в возрасте от 35 до 70 месяцев были зарегистрированы для исследования и получали целевую дозу 1010 жизнеспособных микроорганизмов (ST11) или плацебо на протяжении периода кормления 29 дней. Дети, отобранные как для введения пробы, так и для введения плацебо соответственно, имели типичные характеристики недостаточности веса и роста соответствующего возраста, обусловленные истощением.
Перед началом испытания по кормлению у детей дошкольного возраста проводили оценку безопасности на основании исследований in vitro и in vivo. Исследования in vitro показали картину устойчивости к антибиотикам, сходную с таковой у других Lactobacillus, используемых для пищевого применения, и не образовывали биогенных аминов при деградации муцина (слизистого секрета) и не деконъюгировали соли желчных кислот. В клинических испытаниях с плацебо, в которых участвовали 42 взрослых волонтера, ST11 хорошо переносился и не индуцировал вредных эффектов, таких как метеоризм, частота стула в день и консистенция стула; уровни белков острой фазы в сыворотке не вызывали никакого беспокойства в отношении потенциальной воспалительной реакции.
Пробы и плацебо были приготовлены в виде подушечек (sachet) в производственном предприятии Nestle Product Technology Center в Konolfingen, Switzerland и доставлены в холодильнике в Гватемалу. Каждая подушечка весом 10 г состояла из имеющего вкус шоколода ароматизированного носителя и либо 0,2 г ST11 (1010 КОЕ), либо, в случае плацебо, 0,2 г молочного порошка. Имеющий вкус шоколада ароматизированный носитель состоял из какао-порошка, сахара, лецитина сои, ванилина и корицы. Подушечки хранили при 4-6°С до двух часов перед использованием. Перед использованием подушечку необходимо было растворить в 100 мл воды, расфасованной также компанией Nestle, не содержащей бактериального загрязнения.
В соответствии с условиями испытания диарея была определена как наличие трех или более жидких или не имеющих формы дефекаций на протяжении периода 24 часов. Диарейный приступ был определен как событие, которое давало свидетельство диареи (3 диарейных дефекации на протяжении 24 часов). Его общую продолжительность в часах рассчитывали от момента первых трех показательных дефекаций до появления первого оформленного стула или периода 24 часов без какой-либо дефекации. Для ребенка, чтобы иметь “новый” приступ, должны пройти 48 часов от конца первого приступа. Если это не происходит, то это рассматривается продолжением того же самого приступа и затем для оценки используют общую продолжительность. Был случай, когда ребенок испытывал один или более документированных приступа диареи на протяжении 29-дневного периода наблюдения. Интенсивность диарейного приступа основывается на общем числе производимых жидких стулов. Элементы тяжести приступа характеризуются присутствием крови, слизи или гноя в стуле вместе с симптомами лихорадки и рвоты. Интенсивность 7 стулов за 24 часа или необходимость вмешательства профессионала в клинике, Центре здоровья или больнице также характеризуют приступ как тяжелый.
Когда диарейный приступ диагностировали системой контроля, образец диарейного стула собирали для микроскопического исследования и культивирования для идентификации потенциальных этиологических патогенов для данного приступа. Образец диагностировали на ротавирусный антиген, Giardia и Е. histolytica, в случае дизентерийной пробы, и на бактериальные патогены, в том числе Shigella, Salmonella, Aeromonas, Plesiomonas shigelloides, E. coli и, возможно, V. cholerae.
Во время периода исследования брали пробы для испытания жизнеспособности включенных микроорганизмов во время периода введения. Было показано, что ST11 оставался жизнеспособным в подушечках во время всего исследования, так что и в конце исследования подушечки были способны передавать 1010 жизнеспособных микроорганизмов при реконституировании водой.
Данное изобретение выявило, что проба, содержащая симбиотический микроорганизм, могла уменьшать возникновение диареи, в противоположность контрольной группе (плацебо), приблизительно на 30%. Но в контрольной группе также было обнаружено снижение числа возникновений диареи по сравнению с нормальной популяцией, не получающей ни проб, ни плацебо, соответственно. Это может быть частично объяснено тем, что дети получали дополнительное полезное питание и не содержащую загрязнений воду. Однако, так как это исследование выполняли в полевых условиях, явно можно сделать вывод, что ST11 может уменьшать возникновение диареи in vivo.

Изобретение относится к биотехнологии, может быть использовано в пищевой промышленности и медицине при профилактике и/или лечении заболеваний, связанных с диареей. Штамм Lactobacillus paracasei CNCM I-2116 (NCC 2461) способен прикрепляться к слизистой оболочке кишечника млекопитающегося и расти в присутствии до 0,4% солей желчных кислот и предотвращать заражение эпителиальных клеток кишечника ротавирусами. Средство характеризуется содержанием от 1·105 до 1·1012 КОЕ штамма L. paracasei I-2116 (NCC 2461) средства и пищевого продукта, выбранного из молока, йогурта, творога, сыра, сухого молока, детского питания или фармацевтического препарата, выбранного из жидкой бактериальной суспензии, сухой пероральной добавки, жидкой пероральной добавки, сухого продукта для кормления через трубку или жидкого продукта для кормления через трубку. Изобретение обеспечивает повышенную жизнеспособность штамма при его использовании и эффективность в предотвращении адгезии к кишечным клеткам и инвазии в кишечнике клетки патогенных микроорганизмов, вызывающих диарею. 2 н. и 1 з.п. ф-лы, 5 ил., 1 табл.
| EP 0577903 А, 12.01.1994 | |||
| WO 9806411 А, 19.02.1998 | |||
| US 5837238 А, 17.11.1998 | |||
| ШТАММ МОЛОЧНОКИСЛЫХ БАКТЕРИЙ LACTOBACILLUS ACIDOPHILUS И КОМПОЗИЦИЯ ПРОТИВ ДИАРЕИ | 1993 |
|
RU2126446C1 |
| WO 9735596 А1, 02.10.1997 | |||
| ШЕНДЕРОВ Б.А | |||
| Медицинская микробная экология и функциональное питание, т.11., М.Грантъ, 1998, с.91-99. | |||
Авторы
Даты
2005-02-27—Публикация
2000-03-02—Подача