Изобретение относится к области медицины, в частности к эхокардиографическим исследованиям, и может быть использовано для получения более точных характеристик состояния и степени поражения сердечно-сосудистой системы новорожденного.
Изменение сократительной способности миокарда является отражением патологических процессов в мышце сердца. Ее расчет позволяет оценить степень поражения миокарда и его резервные возможности.
Применяемые в настоящее время способы расчета характеристик сердечно-сосудистой системы и кровенаполнения сердца не позволяют решить все проблемы, возникающие в диагностике состояния новорожденных. Особый интерес представляет анализ данных эхокардиографического исследования, дающего информацию о сократительной функции сердца и позволяющий оценить степень механических дефектов и повреждений его стенок.
Известны стандартные методы расчета сократительной функции желудочков сердца на основе такого параметра как фракция выброса /10/. Широкое применение такой способ получил, благодаря простоте расчета и возможности оценки общей сократимости. Расчет осуществляется по следующей формуле (I):
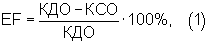
где КДО, КСО - конечно-диастолический и конечно-систолический объем по формуле Тейчхольца (Teickolz);
EF - фракция выброса.
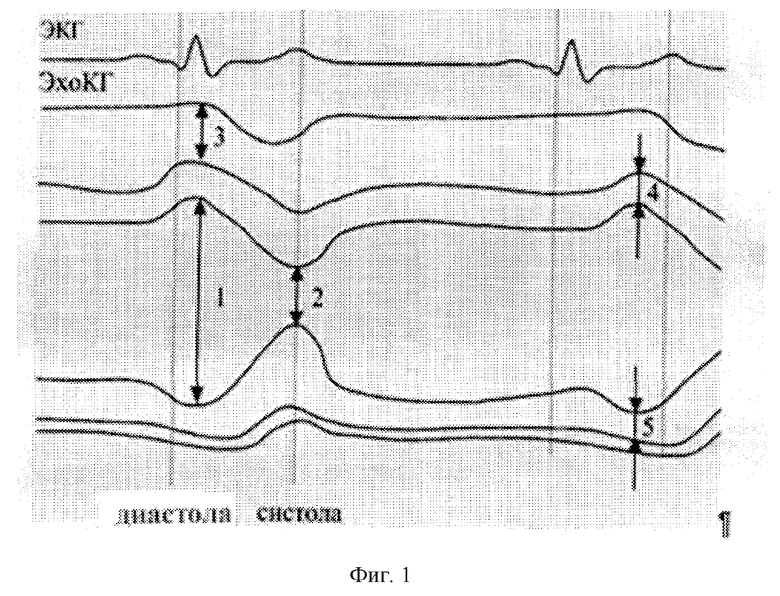
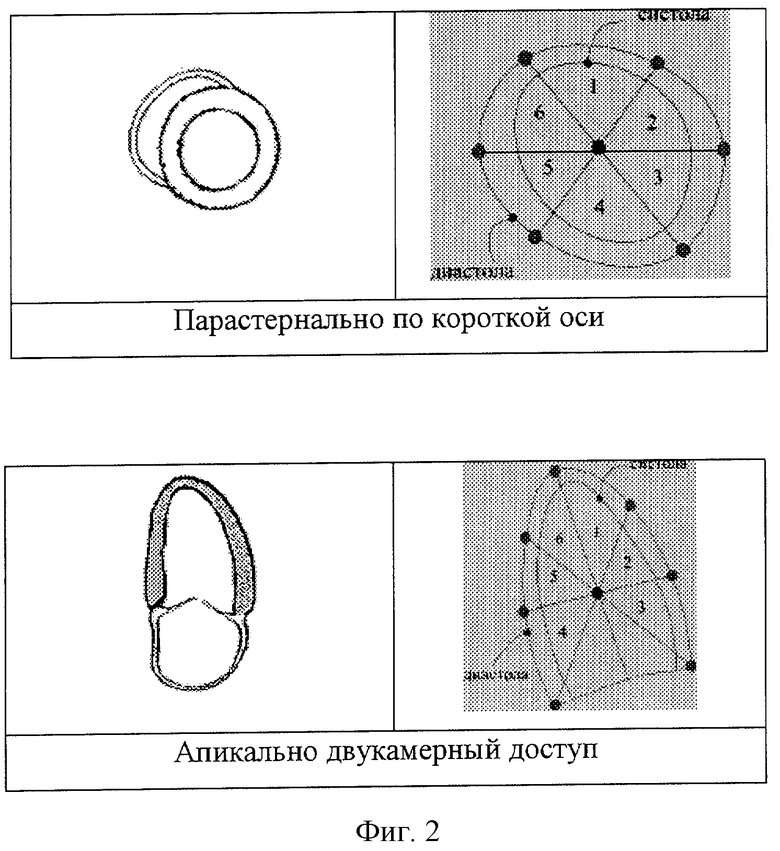
Измерения проводятся в М-режиме эхокардиографа в парастернальной проекции датчика по длинной оси (фиг.1, 2)
Основными недостатками способа является:
1. отсутствие информации о сократимости стенок в других стандартных эхокардиографических проекциях желудочков сердца;
2. не позволяет обнаруживать локальное нарушение сократимости и прослеживать ее изменение по всему контуру желудочка сердца;
3. невозможность их применения для расчета объема правого желудочка, связанная как с особенностями его ультразвуковой визуализации, так и сложностью его формы.
Свободным от некоторых перечисленных недостатков и наиболее близким к предлагаемому можно считать метод расчета региональной сократимости миокарда по 18 секторам /3, 9/ (прототип), применяемый для диагностики ишемической болезни сердца. Он основан на разбиении криволинейной фигуры, образованной внутренним контуром желудочка сердца в систолу и диастолу на 6 угловых сегментов в каждой из трех стандартных проекциях /4, 5, 6, 7, 8, 20, 25/. Выбор сегментов обусловлен распределением коронарных артерий в стенке миокарда желудочков сердца. Сократимость каждого плоского сегмента вычисляется по формуле (2):
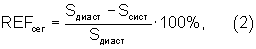
где S - площадь сегмента стенки миокарда в соответствующей фазе;
REF - региональная фракция выброса.
Такая система позволяет выявлять участки с нарушением сократимости и, сопоставляя их с зонами коронарного кровоснабжения, локализовать патологию или топику поражения. В настоящее время такой метод является стандартным для диагностики ишемической болезни сердца, а также развития инфаркта миокарда.
Способ реализуется следующей последовательностью действий
1. датчик устанавливается в одной из трех эхокардиографических проекций (парастернально по короткой и длинной оси и апикально с четырехкамерным доступом);
2. смещением датчика добиваются хорошей визуализации внутреннего контура желудочков;
3. фиксируют изображения желудочков в систоле и диастоле;
4. маркером выделяют линию контура желудочка на систолическом и диастолическом изображениях;
5. после совмещения фигур, образованных линиями контуров в геометрическом центре тяжести, выделяют 6 круговых сегментов (фиг.2);
6. расчет сократимости производят по следующей формуле (2);
7. по полученным результатам судят о функциональном состоянии миокарда.
Применение метода расчета региональной сократимости миокарда для новорожденных в типовой интерпретации не имеет диагностического значения в связи с рядом причин.
Период новорожденности (неонатальный период) характеризуется перестройкой сердечно-сосудистой системы (ССС), легочного кровотока /1, 23/. В целом кровообращение новорожденного можно охарактеризовать как нестабильное.
Одной из актуальных проблем перинатальной кардиологии является поражение ССС у новорожденного вследствие перенесенной внутриутробной, интранатальной либо перинатальной гипоксии, которая сопровождается транзиторной ишемией миокарда /11-13, 15-18, 21,22/. Частота встречаемости указанной патологии среди младенцев, перенесших перинатальную гипоксию, колеблется от 40 до 70% /12, 13, 15-18/. В результате гипоксии у плода и новорожденного нарушается вегетативная регуляция сердца и сосудов, в том числе и коронарных. Возникающие нарушения вызывают изменения в энергетическом обмене миокарда, приводя к быстрому снижению его сократительной функции. Этому способствуют такие анатомо-физиологические особенности, как гиперкатехоламинемия, рассыпной тип коронарных артерий и физиологически низкое образование макроэргов в митохондриях кардиомиоцитов, преобладание углеводного компонента обмена /12-18/.
Результатом гипоксического повреждения миокарда может быть очаговая дистрофия. В дальнейшем дистрофические процессы имеют двоякое развитие: полное восстановление функции либо формирование очагового кардиосклероза /12, 13/. Сохранение вегетативной дисфункции может приводить к формированию стойких вегетовисцеральных и вегетососудистых нарушений, одним из проявлений которых является функциональная кардиопатия /23/ или цереброкардиальный синдром /2/. Клиническая картина постгипоксической дезадаптации ССС новорожденного полиморфна и часто маскируется под другие заболевания, создавая дифференциально-диагностические трудности, а тяжесть состояния пациентов колеблется от минимальной до тяжелой /12, 13, 15-18, 21-24/.
Стандартный способ определения региональной сократимости миокарда у новорожденных имеет следующие недостатки:
1. локализация сегментов не соответствует зонам ветвления коронарных артерий новорожденных;
2. усреднение зон сократимости до 6 сегментов не позволяет получить представления о локальной сократимости миокарда и следовательно выявить очаги дистрофии;
Цель изобретения - повышение информативности и диагностической ценности эхокардиографического исследования новорожденных.
Основным преимуществом предлагаемого способа диагностики является возможность его использования для обследования новорожденных. Это достигается уменьшением размеров круговых секторов до 1 градуса, причем это число постоянно для каждого обследования. Значение в 1 градус выбрано с учетом максимальной неровности линии контура желудочка, т.е. в пределах 1 градуса сегмент стенки можно считать круговым. Локализация размеров участка сократимости позволяет получить детальное представление о распределении зон сократимости по всему контуру желудочка.
Способ реализуется следующей последовательностью действий:
1. датчик устанавливается в одной из трех эхокардиографических проекций (парастернально по короткой и длинной оси и апикально с четырехкамерным доступом);
2. смещением датчика добиваются хорошей визуализации внутреннего контура желудочков;
3. фиксируют изображения желудочков в систоле и диастоле;
4. маркером выделяют линию контура желудочка на систолическом и диастолическом изображениях;
5. после совмещения фигур, образованных линиями контуров в точке геометрического центра тяжести, круговым движением луча, исходящего из этой точки, производят сканирование контуров фигур с шагом в 1 градус;
6. в точках пересечения ставят метки, таким образом образуя единичные угловые сегменты (фиг.3);
7. сократимость сегментов вычисляют по формуле:
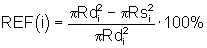
где i=0, 1...359 - шаг разбивки в градусах;
REF(i) - функция сократимости миокарда левого желудочка;
Rdi, Rsi - радиус-вектор локальной диастолической(d) и систолической(s) сократимости в i-том круговом сегменте, причем начало вектора совпадает с геометрическим центром тяжести совмещенных кривых, а конец - с точкой пересечения луча, исходящего из геометрического центра тяжести совмещенных замкнутых кривых, с каждой из них соответственно;
8. получают график распределения сократительной функции и по его форме судят о местах нарушения локальной сократимости и их влияния на соседние участки стенки.
Пример 1.
Ребенок П. поступил в стационар в возрасте 7 дней из родильного дома. Мальчик от молодых родителей, мать курит, во время беременности получала лечение по поводу сифилиса. Течение беременности осложнено вагинозом во II и III триместре, легким гестозом в III триместре. Роды I, срочные. Родился доношенный мальчик с задержкой внутриутробного развития по гипопластическому типу ( внутриутробная гипотрофия II степени), оценка по шкале Апгар 7/8 баллов.
При поступлении состояние ребенка средней тяжести за счет умеренной интоксикации, пиодермии, омфалита, со стороны центральной нервной системы (ЦНС) - синдром общемозговых расстройств, изменения со стороны сердечно-сосудистой системы(ССС) заключались в приглушенности сердечных тонов. В ходе дополнительного ЭКГ-обследования на 8 день жизни выявлено нарушение процессов реполяризации в миокарде, при кардиоинтервалографии - умеренная симпатикотония с оптимальным уровнем активности регуляторных систем, с помощью УЗИ сердца диагностирована дополнительная трабекула в левом желудочке, сократительная способность миокарда соответствовала возрастной норме.
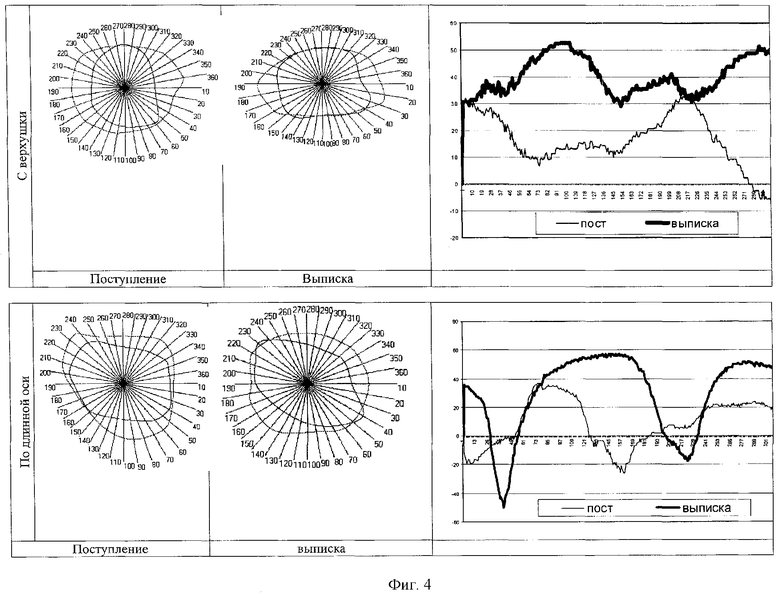
При оценке региональной сократимости миокарда (РСМ) в четырехкамерной проекции с верхушки сердца колебания ее составили от (-8,81 усл.ед) до (32, 43 усл.ед.), по длинной оси - от (-26,4 усл.ед) до (37,03 усл.ед). РСМ была максимальной в срединноапикальносептальном сегменте миокарда при локации сердца с верхушки, при УЗИ по длинной оси высокие показатели РСМ отмечались в переднебазальном и переднеапикальном септальных сегментах, а также в апикальном и подклапанном. Минимальными показатели РСМ при верхушечном доступе были в нижнемедиальном сегменте, а при локации по длинной оси - в срединноапикальносептальном сегменте (см. фиг.4).
Мальчик получал лечение по общепринятой схеме согласно нозологии. При контрольном обследовании через 2 недели состояние ребенка оценивалось как удовлетворительное, пупочная ранка зажила, кожа очистилась, со стороны ЦНС - повышеная нервно-рефлекторная возбудимость. Данные дополнительных инструментальных исследований соответствовали возрастным нормативам. При контрольном исследовании РСМ (доступ с верхушки) показатели ее значительно повысились, составляя 28,57-52,63 усл.ед., минимальные значения ее соответствовали расположению центрального фиброзного тела и фиброзного кольца митрального клапана, максимальные - верхушечному сегменту. При парастернальном исследовании по длинной оси выявлен существенный разброс показателей РСМ: наибольшие(52,23-57,14 усл.ед.) в подклапанном, переднебазальном и переднеапикальном септальных сегментах, наименьшие(-17,36 усл.ед) на границе апикального и срединноапикальносептального сегментов(см. фиг.4).
Пример 2.
Мальчик М. переведен в стационар из родильного дома в возрасте 6 дней. Ребенок от молодых родителей, III беременности(в анамнезе у матери I беременность - неразвивающаяся, II - медицинский аборт). Настоящая беременность протекала с поздним гестозом(патологическая прибавка массы тела, маловодие, преждевременное старение плаценты, хроническая фетоплацентарная недостаточность). Роды первые, срочные. Родился доношенный мальчик со средними показателями физического развития, оценкой по шкале Апгар 7/8 баллов. В течение первых суток жизни состояние ребенка ухудшилось: вялость сменялась возбуждением, стонал, с 5 суток - рвота съеденной пищей.
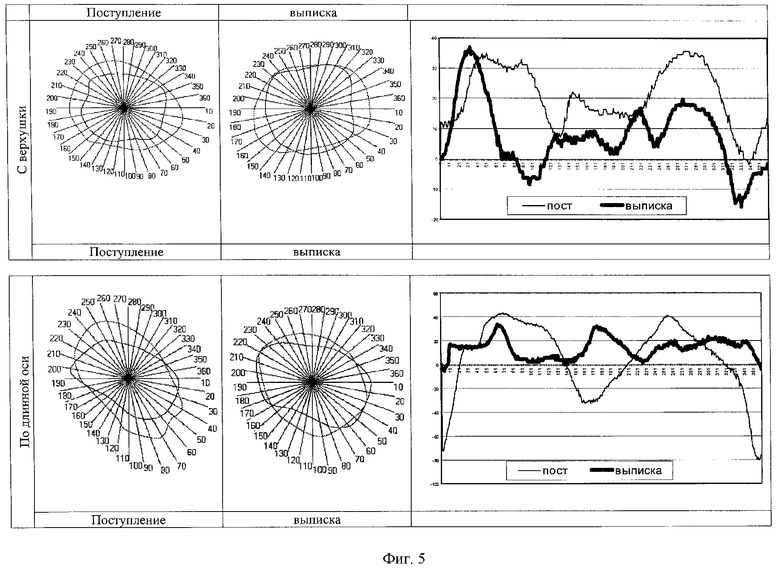
При поступлении в стационар состояние мальчика тяжелое за счет выраженной интоксикации, рвоты, явлений пупочного васкулита, желтухи, яркой неврологической симптоматики в виде вегетовисцеральных расстройств и возбуждения. Кожа иктерична с синюшным оттенком, яркие акроцианоз и мраморность. Тоны сердца глухие, аритмичные. В ходе инструментального обследования выявлены: усиление легочного рисунка на фоне повышеной прозрачности легочной ткани(рентгенограмма органов грудной полости), синусовая тахибрадиаритмия (200-120 ударов в минуту), перегрузка правых отделов сердца, нарушение процессов реполяризации в миокарде (ЭКГ), преобладание парасимпатического отдела вегетативной нервной системы (ИНРС-27, 211), функциональное напряжение регуляторных систем организма (КИГ), гиперкинетический тип гемодинамики, дополнительная трабекула в левом желудочке(УЗИ сердца), признаки кровоизлияния в мозг (НСГ), гастроэзофагит, пилороспазм (ФЭГДС). Показатели РСМ при доступе с верхушки колебались от (-1,73 усл.ед.) до 35,61 усл.ед. Наибольшие показатели характерны для верхушечного сегмента миокарда, минимальные - для нижнелатерального. При парастернальном доступе по длинной оси показатели РСМ составляли (-79, 94 усл.ед.)-41,13 усл.ед. Максимальные цифры регистрировались в верхушечном сегменте, минимальные - в переднебазальном, срединноапикальносептальном и подклапанном(см. фиг.5).
Ребенок получал комплексную терапию, направленную на коррекцию выявленной патологии.
При контрольном обследовании через 2 недели состояние мальчика улучшилось: стал более активным, появились аппетит и устойчивая прибавка в массе, тоны сердца стали звучными и ясными. Сохранялись вегетовисцеральные расстройства (мраморность кожи, нечастые срыгивания), повышенная нервно-рефлекторная возбудимость. ЭКГ-исследование, НСГ, УЗИ сердца, рентгенограмма органов грудной полости соответствовали возрастным нормам. Улучшились показатели КИГ: ИНРС увеличился в 2,5 раза, активность регуляторных систем стала оптимальной. Показатели РСМ при верхушечном доступе стали максимальными в септальнолатеральном сегменте миокарда (36,84 усл.ед.), минимальными показатели по-прежнему регистрировались в нижнелатеральном сегменте (-15,94). При исследовании РСМ по длинной оси наибольшей она оказалась в верхушечном и срединноапикальносептальном сегментах (24,60-31,95 усл.ед.), наименьшей (0-7,21 усл.ед.) - в подклапанном сегменте(см. фиг.5).
Необходимо отметить, что подобный способ наиболее эффективен в системах сочетающих возможности типового эхокардиографа и персонального компьютера под управлением специальной программой. Таким образом, предложенный способ позволяет достичь следующего положительного эффекта:
- локализация участка поражения миокарда;
- установление более точного диагноза;
- подбор корригирующей терапии;
- возможность динамического наблюдения,
Источники информации
1. Adams J.M. Neonatology. The science and practice of pediatric cardiology. Garson A., Bricer J.T., McNamara D G. Philadelphia-London: Lea & Febiger 1993; 3: 2477-2489.
2. Ажкамалов С.И., Белопасов В.В. Цереброкардиальный синдром у детей раннего возраста (дифференциальная диагностика)// Российский вестник перинатологии и педиатрии, 1998, 5, с.26-28.
3. Бащинский С.Е. Стресс-эхокардиография: новые возможности в диагностике ишемической болезни сердца// Кардиология, 1992, 2, с.64-69 - прототип.
4. Бокерия Л.А., Бузиашвили Ю.И., Асымбекова Э.У. и соавт. Стресс-эхокардиография с добутамином в диагностике спящего (гибернированного) миокарда у больных ИБС с дисфункцией левого желудочка по результатам хирургического лечения//Грудная и сердечно-сосудистая хирургия, 1999, 2, с.4-10.
5. Гаврилов А.В., Сандриков В.А., Калайдзидис Я.Л. и соавт. Автоматизированная компьютерная система для трехмерной визуализации ультразвуковых изображений в медицине//Ультразвуковая диагностика, 1996, 1, с.6-13.
6. Gerard T. Wilkins, M.B., ChB., James F.Southern, Ph.D., Christopher Y. Choong, M.B. B. Chir., Ph. D., James d. Thomas, M.D., John T. Fallon, M.D., Arthur E. Weyman, M.D. Correlation Between echocardiographic endocardial surface mapping of abnormal wall motion and patologic infarct size in autopsied hearts. Circulation 77,5, 978-987, 1988.
7. Gerald W. Dorn II M.D., Richard Donner M.D., Micael E. Assey M.D., James F. Spann Jr. M.D., Henry B. Wiles M.D., Blase A. Carabello, M.D. Aiterations in left ventricular geometry, wall stress, and ejection performance after correction of congenital aortic stenosis. Circulation 78,6, 1358-1364, 1988.
8. Дядык А.И., Багрий А.Э., Лебедев И.А. и соавт. Стресс-эхокардиография //Кардиология, 1996, 1, с.57-60.
9. Kirk T. Spenser, M.D., James Bednarz, B.S., Patric G. Rafter M.D., Claudia Korsarz, D.V.M., Roberto M. Lang, M.D. Use of harmonic imaging without echocfrdio graphic contrast to improve two-dimensional image quality. The American journal of cardiology, 1998; 82, 15: 794-799 - прототип.
10. Клиническая эхокардиография у детей и подростков//под редакцией Воробьева
11. Кравцова Л.А., Школьникова М.А., Балан П.В. с соавт. Сравнительный анализ влияний гипоксии на характеристики ЭКГ у детей первых месяцев жизнии экспериментальных животных//Вестник аритмологии, 2000, 18, с.45-48.
12. Котлукова Н.П., Лукина Л.И., Тихонова С.В., Хузина О.М. Нарушение сердечного ритма и проводимости у новорожденных и грудных детей. В кн. "Актуальные вопросы кардиологии детского возраста" под ред. Белозерова Ю.М.//Москва, 1997, с.16-24.
13.Котлукова Н.П., Лукина Л.И., Жданова Л.И. с соавт. О некоторых особенностях постгипоксической транзиторной дисфункции миокарда. В кн.:. "Актуальные вопросы кардиологии детского возраста" под ред. Белозерова Ю.М.//Москва, 1997, с.28-33.
14. Летунов С.П., Первушин В.Ю. Сосуды сердца плодов и новорожденных человека//Архив анатомии, гистологии и эмбриологии, т.XCVI, 1989, 2, с.33-38.
15. Прахов А.В., Мурашко Е.В. Клинико-электрокардиографические особенности транзиторной ишемии миокарда у новорожденных., перенесших перинатальную гипоксию//Педиатрия, 1996, 1, с.38-41.
16. Прахов А.В. Транзиторная ишемия миокарда новорожденных, перенесших перинатальную гипоксию//Педиатрия, 1996, 1, с.97-99.
17. Прахов А.В. Синдром транзиторной ишемии миокарда у новорожденных, перенесших перинатальную гипоксию." Нижний Новгород, 1996.
18. Прахов А.В. Ишемия и инфаркты миокарда новорожденных детей. - Нижний Новгород, 1998.
19. Прахов В.А., Гапоненко В.А., Игнашина Е.Г. Болезни сердца плода и новорожденного ребенка. - Нижний Новгород, 2001.
20. Рябова Т.Р., Рябов В.В., Соколов А.А. и соавт. Динамика структурно-геометрических и функциональных показателей левого желудочка в ранние и поздние сроки инфаркта миокарда//Ультразвуковая и функциональная диагностика, 2001, 3, с.54-59.
21. Симонова Л.В., Котлукова Н.П., Гайдукова Н.В. и соавт. Постгипоксическая дезадаптация сердечно-сосудистой системы у детей//Российский вестник перинатологии и педиатрии, 2001, 2, с.8-12.
22. Симонова Л.В., Котлукова Н.П., Ерофеева М.Е. с соавт. Постгипоксический синдром дезадаптации сердечно-сосудистой системы у новорожденных и детей раннего возраста// Педиатрия, 2000, 3, с.17-21.
23. Таболин В.А., Котлукова Н.П., Симонова Л.В. с соавт. Актуальные проблемы перинатальной кардиологии//Педиатрия, 2000, 5, с.13-18.
24. Физиология и патология сердечно-сосудистой системы у детей первого года жизни//Под ред. Школьниковой М.А., Кравцовой Л.А. - М., 2002,. - с.58-68.
25. Shunji Kurotobi M.D., Tetsuya Sano M.D., Hiroaki Naito M.D., Tohru Matsushita M.D., Makota Takeuchi M.D., Shigetoyo Kogaki M.D., Jun Arisawa M.D., Hikaru Matsuda M.D., Shintaro Okada M.D. Regional ventricular systolic abnormalities caustd by a rudimentary chamber in patients with univentricular hearts.The American journal of cardiology, 1998; 82, 1: 86-92.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЦЕНКИ ВАРИАНТОВ РЕМОДЕЛИРОВАНИЯ МИОКАРДА У НОВОРОЖДЕННЫХ ИЗ ГРУППЫ ПЕРИНАТАЛЬНОГО РИСКА | 2009 |
|
RU2419094C1 |
| СПОСОБ ДИАГНОСТИКИ НАРУШЕНИЯ ФУНКЦИИ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ У НОВОРОЖДЕННЫХ ИЗ ГРУППЫ ПЕРИНАТАЛЬНОГО РИСКА | 2001 |
|
RU2235508C2 |
| СПОСОБ ОЦЕНКИ ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ МИОКАРДА ЛЕВОГО ЖЕЛУДОЧКА С ПОМОЩЬЮ ОПРЕДЕЛЕНИЯ ИНДЕКСА ДИСФУНКЦИИ СЕРДЕЧНОЙ МЫШЦЫ | 2000 |
|
RU2182459C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ У БОЛЬНЫХ С ИБС В ПОСТИНФАРКТНЫЙ ПЕРИОД | 2004 |
|
RU2269922C1 |
| СПОСОБ ОЦЕНКИ СОКРАТИТЕЛЬНОЙ ФУНКЦИИ МИОКАРДА | 2001 |
|
RU2221492C2 |
| СПОСОБ ДИАГНОСТИКИ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА | 2000 |
|
RU2182464C2 |
| СПОСОБ ДИАГНОСТИКИ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА | 2004 |
|
RU2245680C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ МИОКАРДИАЛЬНОЙ НЕДОСТАТОЧНОСТИ | 2010 |
|
RU2460463C2 |
| СПОСОБ ОЦЕНКИ СОСТОЯНИЯ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ У ДЕТЕЙ С ИНСУЛИНЗАВИСИМЫМ САХАРНЫМ ДИАБЕТОМ | 2002 |
|
RU2250463C2 |
| Способ выбора хирургического лечения у больных с хронической постинфарктной аневризмой левого желудочка на дооперационном этапе | 2022 |
|
RU2797959C1 |
Изобретение относится к медицине, кардиологии, педиатрии. Проводят ультразвуковую регистрацию изображения левого желудочка сердца новорожденных в систолическую и диастолическую фазу сердечного цикла. Совмещают две замкнутые кривые, образованные контурами левого желудочка в систолу и диастолу. Полученные кривые разбивают на сегменты лучами, исходящими из геометрического центра тяжести совмещенных кривых, с шагом в 1 градус. По оригинальной математической формуле рассчитывают значение регионарной сократимости миокарда левого желудочка. Способ позволяет получить представление о распределении сократимости в желудочке новорожденного. 5 ил.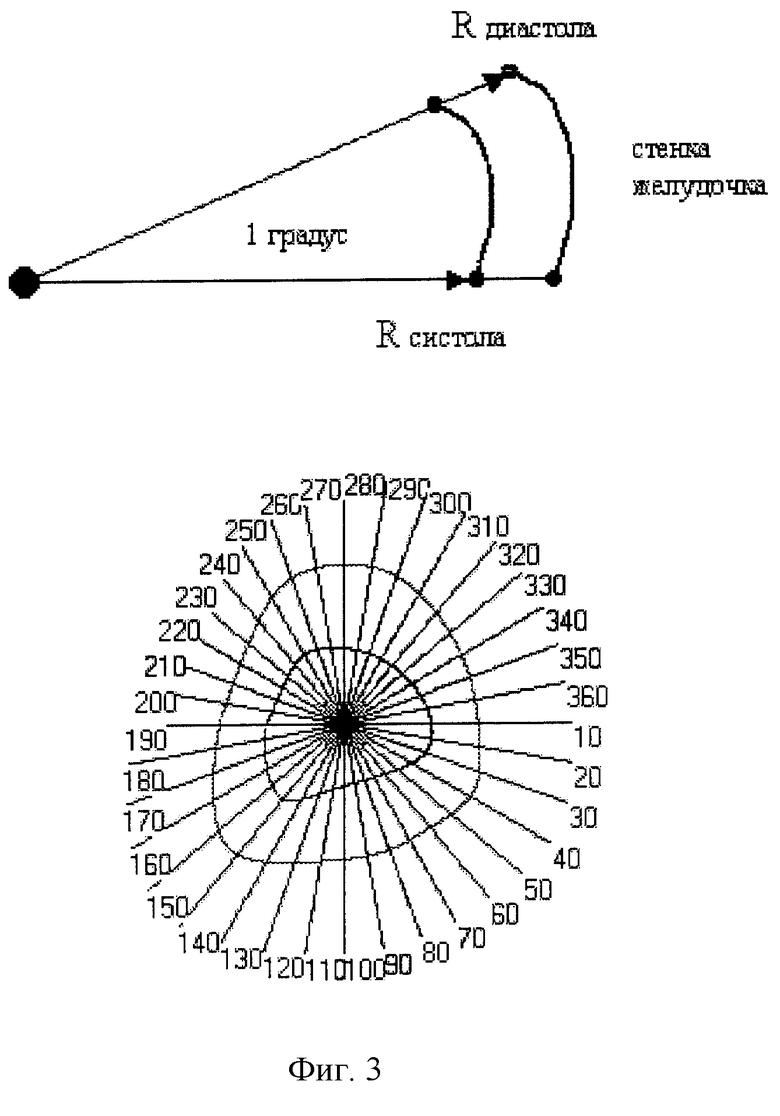
Способ эхокардиографической диагностики поражения миокарда новорожденных, заключающийся в регистрации ультразвукового изображения левого желудочка сердца в парастернальной проекции по длинной оси и четырехкамерной проекции с верхушки в систолическую и диастолическую фазу кардиоцикла, определении внутреннего контура полости левого желудочка в каждую из фаз в каждой проекции, совмещении двух замкнутых кривых, образованных контурами левого желудочка в систолу и диастолу в одной проекции по геометрическому центру тяжести, отличающийся тем, что полученные кривые разбивают на сегменты лучами, исходящими из геометрического центра тяжести совмещенных кривых, с шагом в 1 градус с последующим расчетом значения регионарной сократимости REF(i) миокарда левого желудочка по формуле
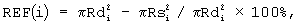
где i=0, 1...359 - шаг разбивки в градусах,
REF(i) - функция сократимости миокарда левого желудочка,
Rdi, RSi - радиус локальной диастолической (d) и систолической (s) сократимости в i-м круговом сегменте,
причем начало вектора совпадает с геометрическим центром тяжести совмещенных кривых, а конец - с точкой пересечения луча, исходящего из геометрического центра тяжести совмещенных замкнутых кривых, с каждой из них соответственно.
| KIRK E., et al., Use of harmonic imaging with echocardiography contrast, The Amer | |||
| J | |||
| Cardiology, 1998, 82, 15, 794-799 | |||
| СПОСОБ ОЦЕНКИ ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ МИОКАРДА ЛЕВОГО ЖЕЛУДОЧКА С ПОМОЩЬЮ ОПРЕДЕЛЕНИЯ ИНДЕКСА ДИСФУНКЦИИ СЕРДЕЧНОЙ МЫШЦЫ | 2000 |
|
RU2182459C2 |
| СПОСОБ ДИАГНОСТИКИ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА | 2000 |
|
RU2182464C2 |
| ШИЛЛЕР Н., ОСИПОВ М.А., Клиническая эхокардиография, М., 1993, с.74-82. | |||
Авторы
Даты
2005-12-27—Публикация
2002-12-30—Подача