Настоящее изобретение касается новых галеновых составов, в частности, новых галеновых составов, в которых активный ингредиент представляет собой труднорастворимый активный агент, например, макролид, или, в частности, циклический поли-N-метилированный ундекапептид или пептолид класса циклоспоринов (см., например, публикации патентов Великобритании №2222770 и 2257359А и аналоги).
Из указанных публикаций патентов Великобритании известно, что использование циклоспоринов вызывает высокоспецифические затруднения в отношении введения их в целом и галеновых составов, в частности, например, проблемы стабильности, лекарственной биодоступности и непостоянства реакции на введенную дозу как у одного, так и у различных пациентов.
Для преодоления этих и подобных им трудностей в публикациях патентов Великобритании №2222770 и 2257359А предложены описание галеновых составов с циклоспорином в качестве активного ингредиента в форме микроэмульсии или микроэмульсионного предконцентрата. Подобные составы обычно включают 1) гидрофильную фазу, 2) липофильную фазу и 3) поверхностно-активное вещество.
В соответствии с настоящим изобретением неожиданно было обнаружено, что особо стабильная микроэмульсия или микроэмульсионный предконцентрат галеновых составов с труднорастворимыми активными агентами, обладающие наиболее интересными характеристиками в плане биодоступности и уменьшенным разбросом в показателях параметров биодоступности как у одного, так и у различных субъектов, могут быть получены с применением гидрофильной фазы, включающей диметилизосорбид.
Было предложено (WO 94/05312) применение диметилизосорбида для получения циклоспоринсодержащих составов, но только в форме комплексных составов. Круг компонентов этих рассмотренных составов точно определен, поэтому очевидно, что авторы WO 94/05312 полагали, что активными будет только ограниченное число составов на основе диметилизосорбида. Так, в примерах 1, 2 и 6 в WO 94/05312 описывается состав, содержащий диметилизосорбид с эмульгатором - олеиловым эфиром ангидроманнита (Montanide 103), другим эмульгатором - цитроглицеридом (Axol C62), липогелем - алюминий-магний гидроксистеаратом (Gilugel MIG) и глицеридом короткоцепочечной жирной кислоты (Miglyol 812) или маслом расторопши. Диметилизосорбид описан только как растворитель, и нет указания на то, что он может быть использован в качестве компонента гидрофильной фазы микроэмульсии. Авторы WO 94/05312 не сумели раскрыть его возможности в этом отношении.
В соответствии с настоящим изобретением неожиданно было установлено, что подобные микроэмульсионные составы вопреки накопленному в данной области опыту действительно могут быть приготовлены на практике с включением диметилизосорбида в качестве компонента гидрофильной фазы.
Настоящее изобретение в одном из своих аспектов охватывает фармацевтический состав, представляющий собой микроэмульсионный предконцентрат, включающий труднорастворимый активный агент и носитель, содержащий:
1) гидрофильную фазу, которая включает диметилизосорбид и/или низший алкилалкановый эфир;
2) липофильную фазу;
3) поверхностно-активное вещество.
Предпочтительным является состав в форме "микроэмульсионного предконцентрата" такого типа, который обеспечивает получение микроэмульсий типа м/в (масло-в-воде). Тем не менее состав может существовать и в форме микроэмульсии, которая дополнительно содержит водную фазу, предпочтительно воду.
"Микроэмульсионный предконцентрат" по определению, принятому в данном описании, представляет собой состав, который спонтанно образует микроэмульсию в водной среде, например, воде, при разведении, например, от 1:1 до 1:10, или в желудочном соке после перорального применения.
"Микроэмульсия" представляет собой прозрачную или в основном прозрачную коллоидную дисперсную систему, формирующуюся спонтанно или в основном спонтанно при приведении ее компонентов в контакт. Микроэмульсия термодинамически стабильна и содержит диспергированные частицы размером менее чем приблизительно 2000 Å. Как правило, микроэмульсии содержат капельки или частицы, имеющие среднее значение диаметра менее чем приблизительно 1500 Å, обычно менее 10 нм, как правило, более 10 нм, и стабильны свыше 24 часов. Дополнительные характеристики можно найти в вышеупомянутой заявке на патент Великобритании №2222770.
Указанная липофильная фаза может содержать от 5 до 85 вес.% носителя, например, от 10 до 85%; предпочтительно от 15 до 70 вес.%, более предпочтительно от 20 до 60 вес.% и еще более предпочтительно около 25 вес.%.
Указанное поверхностно-активное вещество может содержать от 5 до 80 вес.% носителя; предпочтительно от 10 до 70 вес.%, более предпочтительно от 20 до 60 вес.%, и еще более предпочтительно около 40 вес.%.
Указанная гидрофильная фаза может содержать от 5 до 50 вес.% носителя, например, от 10 до 50%; предпочтительно от 15 до 40 вес.%, более предпочтительно от 20 до 35 вес.%.
Указанный активный агент может быть представлен в весовом количестве приблизительно до 20% от веса состава. Указанный активный агент предпочтительно представлен в количестве от 1 до 15% от веса состава, например, приблизительно от 2 до 10%.
Предпочтительно, когда указанным труднорастворимым активным агентом является липофильное лекарственное средство, например циклоспорин или макролид. Используемый здесь термин "труднорастворимый" понимается в том смысле, что растворимость в воде при 20°С составляет менее 0,01 вес.%/объем.
Циклоспорины, к которым применимо настоящее изобретение, имеют фармацевтическое применение, например, в качестве иммуносупрессоров, антипаразитарных средств и средств реверсирования множественной лекарственной устойчивости, они известны из уровня техники, в частности, циклоспорин А (также известный как и обозначаемый здесь и далее как Ciclosporin); циклоспорин G, [O-(2-гидроксиэтил)-(D)Ser]8-Ciclosporin; и [3'-дезгидрокси-3'-кетоMeBmt]1-[Val]2-Ciclosporin. Предпочтительным является Ciclosporin.
Используемый здесь термин "макролид" относится к макроциклическому лактону, например, соединению, имеющему 12-членное или состоящее из большего числа членов лактоновое кольцо. Особый интерес представляют "лактамные макролиды", то есть макроциклические соединения, имеющие лактамную (амидную) связь в макроцикле в дополнение к лактоновой (эфирной) связи, например, лактамные макролиды, продуцируемые микроорганизмами рода Streptomyces, а именно рапамицин, аскомицин и FK506, а также их многочисленные производные и аналоги. Было показано, что подобные лактамные макролиды обладают интересными фармацевтическими свойствами, в частности, иммуносупрессорными и противовоспалительными.
Рапамицин является иммуносупрессорным лактамным макролидом, который продуцируется Streptomyces hygroscopicus. Структура рапамицина описана [Kesseler H. et al., 1993; Helv. Chim. Acta, 76, 117]. Указанная структура описана в формуле А:

[см., например, McAlpine J.B. et al., J. Antibiotics (1991) 44: 688; Schreiber S.L. et al., J. Am. Chem. Soc. (1991) 113: 7433; патент США №3929992]. (Для рапамицина были предложены различные схемы нумерации. При указании названия специфических производных рапамицина во избежание путаницы данные названия приводятся со ссылкой на рапамицин с использованием схемы нумерации формула А). Рапамицин является очень сильным иммуносупрессором и, как было также показано, обладает противоопухолевой и антигрибной активностями. Однако его применение в качестве фармацевтического средства ограничивается его очень низкой и изменчивой биодоступностью, равно как и его высокой токсичностью. Кроме того, рапамицин очень плохо растворим, что затрудняет приготовление стабильных галеновых составов. Известны многочисленные производные рапамицина. Известны [WO 94/02136] некоторые 16-О-замещенные рапамицины. Известны 40-О-замещенные рапамицины [US 5258389 и WO 94/09010 (О-арил- и О-алкилрапамицин); WO 92/05179 (эфиры карбоновых кислот), US 5118677 (амидные эфиры), US 5118678 (карбаматы), US 5100883 (фторированные эфиры), US 5151413 (ацетали), US 5120842 (силиловые эфиры), WO 93/11130 (метиленрапамицин и производные), WO 94/02136 (метоксипроизводные), WO 94/02385 и WO 95/14023 (алкенильные производные)]. Известен (US 5256790) 32-O-дигидрорапамицин или замещенный рапамицин, например, в US 5256790.
Рапамицин и его структурно-близкие аналоги и производные названы общим термином "рапамицины".
Аскомицины, среди которых наиболее хорошо известны FK506 и аскомицин, составляют другой класс лактамных макролидов, многие из которых обладают сильной иммуносупрессорной и противовоспалительной активностью. FK506 представляет собой лактамный макролидный иммуносупрессор, продуцируемый Streptomyces tsukubaensis №9993. Структура FK506 приведена в приложении к 11-ому изданию Мерк Индекса (1989) в пункте А5 (Merck Index). Аскомицин описан, например, в патенте США №3244592. Синтезировано большое число производных аскомицина и FK506, включая галогенированные производные, как, например, 33-эпихлор-33-дезоксиаскомицин (ЕР 427680). Аскомицин, FK506 и их структурно-близкие аналоги и производные названы общим термином "аскомицины".
Таким образом, макролид может являться рапамицином или его О-замещенным производным, в котором гидроксильная группа циклогексильного кольца рапамицина заменена на -OR1, где R1 является гидроксиалкилом, гидроалкоксиалкилом, ациламиноалкилом и аминоалкилом; например, 40-О-(2-гидрокси)-этилрапамицином, 40-О-(3-гидрокси)пропилрапамицином, 40-О-[2-(2-гидрокси)этокси]-этилрапамицином и 40-О-(2-ацетаминоэтил)рапамицином.
Предпочтительным соединением является 40-О-(2-гидрокси)этилрапамицин (WO 94/09010).
Примерами соединений класса FK506 являются соединения, упомянутые выше. Они включают, например, FK506, аскомицин и другие существующие в природе соединения. Кроме этого они включают синтетические аналоги.
Предпочтительное соединение класса FK506 описано (ЕР 427680, например, пример 66а), оно известно также как 33-эпихлор-33-дезоксиаскомицин. Другие предпочтительные соединения также описаны (ЕР 465426 и ЕР 569337, например, соединение примера 71 в ЕР 569337).
Компонент гидрофильной фазы включает диметилизосорбид и/или низший алкил-алкановый эфир. Термин низший алкил следует понимать как охватывающий алкилы, содержащие цепь от C1 до С4, например, этил. Термин алкановый эфир следует понимать как включающий ацетат и пропионат. Предпочтительным является этилацетат. Растворимость этилацетата в воде при комнатной температуре составляет 8,5 г на 100 мл. Предпочтительно, чтобы растворимость низший алкил-алкановых эфиров в воде при комнатной температуре составляла примерно от 1 до 30 г/100 мл.
Гидрофильная фаза может также включать дополнительный компонент, который может быть выбран из Transcutol (имеющего формулу С2Н5-[О(CH2)2]2-OH), Glycofurol (известного также как эфир тетрагидрофурфурилового спирта и полиэтиленгликоля) и 1,2-пропиленгликоля. Гидрофильная фаза может включать и другие гидрофильные дополнительные компоненты, например, низшие спирты типа этанола. Эти дополнительные компоненты обычно вводятся как частичные заменители других компонентов гидрофильной фазы. Несмотря на то, что применение этанола в составах не является существенным, было обнаружено, что он дает особое преимущество, когда необходимо приготовить составы в виде капсул из мягкого желатина. Это обусловлено улучшенными характеристиками хранения, в частности, уменьшением риска выпадения в осадок активного агента после инкапсуляции. Таким образом, устойчивость при хранении можно повысить путем применения этанола или какого-либо другого дополнительного компонента в качестве дополнительного ингредиента гидрофильной фазы. Этанол может составлять от 0 до 60% от веса гидрофильной фазы, предпочтительно от 20 до 55% по весу и более предпочтительно приблизительно от 50 до 50% по весу. В гидрофильную фазу также могут быть введены небольшие количества жидких полиэтиленгликолей.
Диметилизосорбид известен также как 3,6-диангидро-2,5-диО-метил-D-глюцит. Он производится фирмой ICI American Inc. под коммерческим названием Arlasolve DMI. Обладает следующими физико-химическими свойствами:
Известно (GB 2222770) широкое разнообразие компонентов липофильной фазы, пригодных для использования в настоящем изобретении. Предпочтительными компонентами липофильной фазы являются триглицериды среднецепочечных жирных кислот, смешанные моно-, ди-, триглицериды и трансэтерифицированные этоксилированные растительные масла.
Известны соответствующие триглицериды среднецепочечных жирных кислот, они имеются в продаже под торговыми названиями Captex, Myritol, Capmul, Neobee и Mazol; наиболее предпочтителен Miglyol 812. Miglyol 812 представляет собой фракционированное кокосовое масло, содержащее триглицериды каприл-каприновой кислоты с приблизительным значением молекулярного веса, составляющим 520 дальтон. Состав жирных кислот: максимальное содержание С6 приблизительно 3%, С8 - приблизительно от 50 до 65%, С10 - приблизительно от 30 до 45%, максимальное содержание С12 составляет 5%; кислотное число равно приблизительно 0,1; число омыления равно приблизительно от 330 до 345; максимальное значение йодного числа равно 1. Mygliol 812 производится фирмой Huels.
Данные триглицериды описаны [Fielder H.P. "Lexikon der Hilfsstoffe fur Pharmazie, Kosmetik und angrenzende Gebiete", Editio Cantor, D-7960 Aulendorf, издание 3-е, исправленное и дополненное (1989)].
Смешанные моно-, ди-, триглицериды предпочтительно включают смеси моно-, ди- и триглицеридов С12-20 жирных кислот, главным образом смешанные моно-, ди- и триглицериды C16-18 жирных кислот. Жирные кислоты, входящие в состав смешанных моно-, ди- и триглицеридов, могут включать остатки как насыщенных, так и ненасыщенных жирных кислот. Предпочтительным, тем не менее, является преобладание остатков ненасыщенных жирных кислот, в частности, остатков С18 жирных кислот. Приемлемо, чтобы смешанные моно-, ди- и триглицериды содержали по меньшей мере 60%, предпочтительно по меньшей мере 75%, более предпочтительно по меньшей мере 85% по весу моно-, ди- и триглицеридов С18 ненасыщенных жирных кислот (например, линоленовой, линолевой и олеиновой кислот). Также приемлемо, чтобы смешанные моно-, ди- и триглицериды содержали менее 20%, например, приблизительно от 15% до 10% по весу или менее, моно-, ди- и триглицеридов насыщенных жирных кислот (например, пальмитиновой и стеариновой кислот).
Предпочтительным является преобладание в составе смешанных моно-, ди- и триглицеридов моно- и диглицеридов, например, когда моно- и диглицериды составляют по меньшей мере 50%, более предпочтительно по меньшей мере 70% от общего веса липофильной фазы. Более предпочтительным является содержание моно- и диглицеридов, составляющее по меньшей мере 75% (например, приблизительно 80% или 85%) от веса липофильной фазы.
Предпочтительно моноглицериды составляют приблизительно от 25 до 50%, в расчете на общий вес липофильной фазы всех смешанных моно-, ди-, триглицеридов. Более предпочтительным является содержание моноглицеридов, составляющее приблизительно от 30 до 40% (например, от 35 до 40%).
Предпочтительно диглицериды составляют приблизительно от 30 до 60% (в расчете на общий вес липофильной фазы) всех смешанных моно-, ди-, триглицеридов. Более предпочтительным является содержание диглицеридов, составляющее приблизительно от 40 до 55% (например, от 48 до 50%).
Приемлемым является содержание триглицеридов в составе смешанных моно-, ди-, триглицеридов, составляющее по меньшей мере 5%, но не более чем приблизительно 25%, в расчете на общий вес липофильной фазы. Более предпочтительным является содержание триглицеридов, составляющее приблизительно от 7,5 до 15% (например, от 9 до 12%).
Смешанные моно-, ди-, триглицериды могут быть получены путем смешивания индивидуальных моно-, ди- или триглицеридов в определенном соотношении. Обычно, однако, они содержат продукты трансэтерификации растительных масел, например, миндального, арахисового, оливкового, персикового, пальмового или предпочтительно кукурузного масла, масла подсолнечника или масла сафлора, и наиболее предпочтительно кукурузного масла, с глицерином.
Подобные продукты трансэтерификации обычно могут быть получены известными способами (GB 2257359 и/или WO 94/09211).
В случае изготовления мягких желатиновых капсул предпочтительным является предварительное удаление остатков глицерина для получения "по существу чистой от глицерина партии продукта".
Из очищенных продуктов трансэтерификации кукурузного масла и глицерина получают (GB 2257359 и/или WO 94/09211) наиболее подходящие смешанные моно-, ди- и триглицериды, называемые здесь в дальнейшем как "рафинированное масло".
В альтернативном случае липофильная фаза может содержать, например, фармацевтически приемлемое масло, предпочтительно с ненасыщенным компонентом, например, растительное масло или рыбий жир.
В альтернативном случае липофильная фаза может содержать соответствующим образом трансэтерифицированные этоксилированные растительные масла, получаемые, например, в результате взаимодействия различных натуральных растительных масел (например, кукурузного, косточкового, миндального, арахисового, оливкового, соевого, подсолнечного масла, масла сафлора, пальмового масла или их смесей) с полиэтиленгликолями со средним значением молекулярного веса от 200 до 800 в присутствии соответствующего катализатора. Такие способы получения известны из уровня техники (см., например, патент США 3288824). Наиболее предпочтительным является трансэтерифицированное этоксилированное кукурузное масло.
Трансэтерифицированные этоксилированные растительные масла известны и имеются в продаже под торговым названием LABRAFIL (H.Fiedler, loc cit, vol.2, page 707). Примеры включают LABRAFIL M 2125 CS (получаемый из кукурузного масла и имеющий значение кислотного числа менее 2, число омыления от 155 до 175, значение HLB (гидрофильно-липофильного баланса) от 3 до 4, а йодное число - от 90 до 100) и LABRAFIL M 1994 CS (получаемый из косточкового масла и имеющий значение кислотного числа около 2, число омыления от 145 до 175, йодное число от 60 до 90). Также может быть использован LABRAFIL М 2130 CS (представляющий собой продукт трансэтерификации C12-18 глицерида и полиэтиленгликоля, температура плавления которого составляет приблизительно от 35 до 40°С, значение кислотного числа менее 2, число омыления - от 185 до 200, а иодное число - менее 3). Предпочтительным трансэтерифицированным этоксилированным растительным маслом является LABRAFIL M2125 CS, который можно приобрести, например, в Gattefosse, Saint-Priest Cedex, Франция.
Примерами подходящих поверхностно-активных веществ для применения в соответствии с настоящим изобретением являются:
i) продукты взаимодействия природного или гидрогенизированного касторового масла и этиленоксида. Реакция взаимодействия между природным или гидрогенизированным касторовым маслом и этиленоксидом может быть осуществлена при приблизительном молярном соотношении реагентов от 1:35 до 1:60 и возможном удалении из продуктов полиэтиленгликольного компонента. Подобные разнообразные поверхностно-активные вещества имеются в продаже. Полиэтиленгликольгидрогенизированные касторовые масла, имеющиеся в продаже под торговым названием CREMOPHOR, являются особенно приемлемыми. Наиболее приемлемыми являются CREMOPHOR RH 40, имеющий число омыления приблизительно от 50 до 60, кислотное число менее 1, содержание воды (по Фишеру) приблизительно менее 2%, значение nD 60 приблизительно от 1,453 до 1,457 и HLB приблизительно от 14 до 16; и CREMOPHOR RH 60, имеющий число омыления приблизительно от 40 до 50, кислотное число менее 1, приблизительное значение йодного числа менее 1, содержание воды (по Фишеру) приблизительно от 4,5 до 5,5%, значения nD 25 приблизительно от 1,453 до 1,457 и HLB приблизительно от 15 до 17. Особенно предпочтительным продуктом данного класса является CREMOPHOR RH 40. Приемлемыми также являются полиэтиленгликолевые касторовые масла, такие как имеющиеся в продаже под торговым названием CREMOPHOR EL, имеющий значение молекулярного веса (по данным испарительной осмометрии), равное 1630, число омыления приблизительно от 65 до 70, кислотное число приблизительно 2, йодное число приблизительно от 28 до 32 и значение nD 25 приблизительно от 1,471.
Сходные или идентичные продукты, которые также можно использовать, имеются в продаже под торговыми названиями NIKKOL (например, NIKKOL НСО-40 и НСО-60), MAPEG (например, MAPEG CO-40h), INCROCAS (например, INCROCAS 40) и TAGAT (например, эфиры полиоксиэтиленглицерина и жирных кислот, а именно, TAGAT RH 40; и TAGAT ТО - триолеат полиоксиэтиленглицерина, имеющий значение HLB, равное 11,3; предпочтительным является TAGAT ТО). Более подробно описание этих поверхностно-активных веществ можно найти в Fiedler loc. cit.
ii) Эфиры полиоксиэтиленсорбитана и жирных кислот, например, моно- и трилауриловые, пальмитиловые, стеариловые и олеиловые эфиры, известные (Fiedler, loc. cit., стр.1300-1304) и коммерчески доступные под торговым названием TWEEN, включая продукты TWEEN:
20 [полиоксиэтилен(20)сорбитанмонолаурат],
21 [полиоксиэтилен(4)сорбитанмонолаурат],
40 [полиоксиэтилен(20)сорбитанмонопальмитат],
60 [полиоксиэтилен(20)сорбитанмоностеарат],
65 [полиоксиэтилен(20)сорбитантристеарат],
80 [полиоксиэтилен(20)сорбитанмоноолеат],
81 [полиоксиэтилен(5)сорбитанмоноолеат],
85 [полиоксиэтилен(20)сорбитантриолеат].
Особенно предпочтительными продуктами данного класса являются TWEEN 40 и TWEEN 80.
iii) Эфиры жирных кислот и полиоксиэтилена, например, эфиры стеариновой кислоты и полиоксиэтилена, типа известного и имеющегося в продаже под торговым названием MYRJ (Fiedler, loc. cit. 2, стр.834-835). Особенно предпочтительным продуктом данного класса является MYRJ 52, имеющий значение D25 приблизительно равное 1,1, температуру плавления приблизительно от 40 до 44°С, величину HLB приблизительно равную 16,9, приблизительное значение кислотного числа от 0 до 1 и число омыления - от 25 до 35.
iv) Сополимеры и блок-сополимеры полиоксиэтилен-полиоксипропилен типа известных и имеющихся в продаже под торговыми названиями PLURONIC, EMKALYX и POLOXAMER (Fiedler, loc. cit., 2, стр.959). Особенно предпочтительным продуктом данного класса является PLURONIC F68, имеющий температуру плавления приблизительно 52°С и молекулярный вес приблизительно от 6800 до 8975. Другим предпочтительным продуктом данного класса является POLOXAMER 188.
v) Диоктилсульфосукцинат или ди-(2-этилгексил)-сукцинат (Fiedler, loc. cit., 1, стр.107-108).
vi) Фосфолипиды, в особенности лецитины (Fiedler, loc. cit., 2, стр.943-944). Приемлемые лецитины включают, в частности, лецитины сои.
vii) Моно- и диэфиры жирных кислот и пропиленгликоля, например, пропиленгликольдикаприлат (также известный и имеющийся в продаже под торговым названием MIGLYOL 840), пропиленгликольдилаурат, пропиленгликольгидроксистеарат, пропиленгликольизостеарат, пропиленгликольлаурат, пропиленгликольрицинолеат, пропиленгликольстеарат и т.д. (Fiedler, loc. cit., 2, стр.808-809).
Предпочтительно отбираются поверхностно-активные вещества, имеющие значение гидрофильно-липофильного баланса (HLB), равное по меньшей мере 10, например, Cremophor.
Предпочтительно, чтобы относительное соотношение компонента(ов) гидрофильной фазы, липофильной фазы и поверхностно-активного вещества лежало внутри области "микроэмульсии" на стандартной тройной диаграмме. Полученные таким образом составы представляют собой микроэмульсионные предконцентраты высокой стабильности, при добавлении к воде способные образовывать микроэмульсии со средним размером частиц <1500 Å (150 нм).
Данные составы микроэмульсионных предконцентратов, например, составы из приводимых далее примеров, могут демонстрировать хорошие показатели стабильности, выявленные в стандартных проверках на стабильность, например, стабильность при хранении сроком до одного, двух или трех лет и даже более. Составы микроэмульсионных предконцентратов по данному изобретению образуют микроэмульсии, стабильные, например, до одного дня или более.
Фармацевтический состав также может включать другие добавки или ингредиенты, например, антиокислители (такие как аскорбилпальмитат, бутилгидроксианизол (ВНА), бутилгидрокситолуол (ВНТ) и токоферолы) и/или консерванты. Эти добавки или ингредиенты присутствуют в количестве приблизительно от 0,05 до 1% по весу от общего веса данного состава. Фармацевтический состав также может содержать подсластители или ароматизаторы в количестве приблизительно до 2,5 или 5% по весу, отнесенном к общему весу такого состава. Предпочтительным антиокислителем является α-токоферол (витамин Е).
Фармацевтические составы проявляют особо полезные свойства при пероральном применении; так, показатели консистенции и высокого уровня биодоступности, полученные в стандартных тестах на биодоступность, оказываются, например, в 2-4 раза выше, чем таковые для эмульсий. Эти тесты проводят на животных, например, крысах или собаках, либо на здоровых добровольцах с использованием ВЭЖХ или набора специфических или неспецифических моноклональных антител для определения уровня лекарственной субстанции, например, макролида, в крови. Так, указанный в примере 1 состав, введенный перорально собакам, может давать неожиданно высокие значения Cmax, определенные с помощью ELISA (иммуноферментный твердофазный анализ) с использованием моноклонального антитела.
Также неожиданной оказалась высокая прогнозируемость таких фармакокинетических параметров, как абсорбция и уровень в крови, что сделало возможным исключить или снизить проблемы при введении, связанные с мигрирующей абсорбцией. Кроме того, фармацевтические составы эффективно взаимодействуют с тензидными веществами, например, желчными солями, присутствующими в желудочно-кишечном тракте. Это означает, что фармацевтические составы полностью диспергируемы в водных системах, содержащих подобные природные тензиды, и, таким образом, способны к образованию микроэмульсионных систем in situ, которые оказываются стабильными и не характеризуются осаждением активного агента или другим разрушением тонкой структуры макрочастиц. Действие фармацевтических составов при пероральном введении остается в основном независимым и/или незатронутым относительным присутствием или отсутствием желчных солей в любой конкретный момент времени или у любого данного индивидуума.
Составы по данному изобретению уменьшают непостоянство реакции на введенную дозу как для одного, так и между различными пациентами.
В следующем аспекте данное изобретение предусматривает способ получения определенного выше фармацевтического состава, заключающийся в приведении (1) гидрофильной фазы; (2) липофильной фазы; и (3) поверхностно-активного вещества в состояние однородной смеси и добавлении активного агента, например, циклоспорина или соединения класса макролидов. При необходимости состав может быть сформирован в форме единичной дозы, например, расфасовкой данного состава в желатиновые капсулы.
Вместе с компонентами (1), (2) и (3) или вместе либо после добавления активного агента могут быть смешаны возможные дополнительные компоненты или добавки, в частности, дополнительный компонент гидрофильной фазы, например этанол.
С целью получения микроэмульсии указанный состав можно смешивать с водой или растворителем на основе воды.
Авторы настоящей заявки рассматривают также составы микроэмульсионных предконцентратов, которые могут не содержать рафинированного рыбьего жира и/или этанола, и/или трансэтерифицированного этоксилированного растительного масла.
Авторы установили, что макролиды, в частности, 40-O-(2-гидрокси)этилрапамицин, нестабильны в процессе хранения и могут быть подвержены целому ряду разнообразных реакций деградации. Так, например, после нескольких дней хранения можно идентифицировать один или большее число продуктов деградации, используя, например, ВЭЖХ. Хотя еще необходимо дальнейшее изучение путей деградации, авторы полагают, что может происходить разрыв лактонового кольца в макролиде.
Авторы настоящей заявки идентифицировали 40-O-(2-гидрокси)этилрапамицин-2,3,4-секокислоту как основной продукт деградации 40-O-(2-гидрокси)этилрапамицина. 40-O-(2-гидрокси)этилрапамицин-2,34-секокислота, обозначаемая здесь и далее как секокислота, имеет следующую структуру:

К настоящему времени установлено, что стабильные составы, содержащие макролиды, могут быть получены помещением макролида в кислую среду. При этом подразумевается, что составы стабильны, если вещество лекарства-макролида остается в основном интактным рожденным после нескольких дней или недель хранения при комнатной температуре (25°С).
В другом аспекте данное изобретение предусматривает фармацевтический состав, содержащий макролид и кислоту.
Термин макролид употребляется в том же значении, которое описано ранее.
Предпочтительные макролиды имеют по меньшей мере одну структуру, изображенную на схеме:

В качестве примеров можно указать упомянутые выше и предпочтительно рапамицин или 40-O-(2-гидрокси)этилрапамицин.
Указанная кислота может быть растворима в липидах и/или этаноле. Кислота может быть, например, жирной кислотой, в частности, олеиновой кислотой. Указанная кислота может являться карбоновой кислотой, например, моно-, ди- или трикарбоновой кислотой, и предпочтительно моно- или дикарбоновой. Указанная кислота может содержать одну или несколько гидрофильных групп, например, гидроксильных групп, и предпочтительно одну или две гидрофильные группы. Приемлемые кислоты для использования в данном изобретении включают малоновую, фумаровую, малеиновую, D-яблочную, L-яблочную, лимонную, аскорбиновую, янтарную, щавелевую, бензойную или молочную кислоты, либо кислоту с подобным значением рКа, например, 2-7. Предпочтительными являются малоновая, щавелевая, лимонная и молочная кислоты. Малоновая кислота наиболее предпочтительна.
Предпочтительное количество кислоты можно определить с помощью обычных экспериментов. Весовое отношение макролида к кислоте в составе по данному изобретению может иметь значение до 20:1, например, от 1:5 до 5:1, в частности, 1:1. Указанная кислота может присутствовать в количестве между 0,05% и 5% от веса состава.
Макролид может присутствовать в количестве от 1 до 15% от веса состава.
Тип фармацевтического состава не является критичным. Он может представлять собой твердую субстанцию, но предпочтительной является жидкая форма. Макролид, например, может быть введен в микроэмульсионный предконцентрат или эмульсионный предконцентрат, определенные выше, и объединен с некоторым количеством кислоты. Такой стабилизированной кислотой состав можно вводить энтерально, например перорально, а именно в виде капсулы или раствора для питья, либо парентерально, а именно в виде инфузионного концентрата. Пероральное введение предпочтительно.
В следующем аспекте данное изобретение предусматривает применение кислоты для стабилизации макролида в фармацевтическом составе.
В другом аспекте данное изобретение предусматривает способ стабилизации макролида в фармацевтическом составе, включающий смешивание кислоты с макролидом.
Таким образом, данное изобретение предполагает получение стабильных составов, содержащих макролиды. Могут быть достигнуты хорошая биодоступность лекарства и снижение непостоянства реакции на введенную дозу как для одного, так и между различными пациентами.
Эффективность всех фармацевтических составов по настоящему изобретению можно наблюдать в стандартных клинических тестах, например, по известным показаниям о дозах активного агента, дающих его эквивалентные уровни в крови; например, при введении доз в интервале от 2,5 мг до 1000 мг активного агента в день на 75 кг веса млекопитающего, а именно взрослого человека, и на стандартных модельных животных. Повышенную биодоступность активного агента, обеспеченную данными составами, можно наблюдать в стандартных тестах на животных или в клинических испытаниях, например, описанных выше.
Оптимальная доза активного агента для введения конкретному пациенту должна быть тщательно подобрана, так как восприимчивость и метаболизм макролидного соединения, например рапамицина, у разных индивидуумов могут отличаться. Может оказаться целесообразным фиксировать уровни активного агента в плазме крови с помощью радиоиммуноанализа, анализа с использованием моноклональных антител либо другими приемлемыми традиционными способами. Доза макролида обычно варьирует в интервале от 1 до 1000 мг в день, например, от 2,5 мг до 1000 мг в день для взрослого пациента весом 75 кг, предпочтительно от 25 мг до 500 мг, с оптимальной дозой приблизительно от 50 до 100 мг в день. Успешные результаты получены при введении приблизительно 75 мг в день, например, в виде двух капсул, одной, содержащей 50 мг, и другой, содержащей 25 мг; или трех капсул, каждой по 25 мг. Дозы циклоспорина могут составлять от 25 до 1000 мг в день (предпочтительно от 50 мг до 500 мг), а доза FK506 - от 2,5 мг до 1000 мг в день (предпочтительно от 10 мг до 250 мг). Для введения 40-O-(2-гидрокси)этилрапамицина рекомендована доза, лежащая между 0,5 и 5 мг/кг веса тела/день.
Фармацевтические составы предпочтительно объединяют в виде единичной дозы, например, заполняя ими оболочки капсул для перорального введения. Капсульные оболочки могут представлять собой капсульные оболочки из мягкого или твердого желатина. Если фармацевтический состав существует в виде единичной дозы, то каждая единичная доза будет содержать, соответственно, от 10 до 100 мг активного агента, более предпочтительно от 10 до 50 мг, например, 15, 20, 25 или 50 мг. Такие единичные дозы приемлемы для введения от одного до пяти раз ежедневно в зависимости от конкретной цели лечения, фазы лечения и т.п.
Однако, при необходимости, фармацевтические составы могут быть выполнены в виде растворов для питья и могут включать воду или любую другую водную систему, чтобы обеспечить получение микроэмульсионных систем, пригодных для питья.
Данные фармацевтические составы оказываются особенно полезными для лечения и профилактики состояний, описанных на стр.40 и 41 в ЕР 427680 и на стр.5 и 6 в РСТ/ЕР93/02604.
Указанные фармацевтические составы особо полезны для:
а) лечения и профилактики отторжения трансплантатов органов или тканей, например, для лечения реципиентов следующих трансплантатов: сердца, легкого, объединенных сердца и легкого, печени, почек, панкреатической железы, кожи или роговицы. Данные фармацевтические составы также показаны для предотвращения реакции "трансплантат против хозяина", каковая иногда имеет место при трансплантации костного мозга;
б) лечения и профилактики аутоиммунной болезни и воспалительных состояний, в частности, воспалительных состояний с этиологией, включающей аутоиммунную составляющую типа артрита (например, ревматоидного артрита, хронического прогрессирующего артрита и деформирующего артрита) и ревматических заболеваний; и
в) лечения множественной лекарственной устойчивости (MDR).
Кроме того, данные макролидные активные агенты проявляют противоопухолевую и антигрибную активность и, следовательно, указанные фармацевтические составы могут использоваться в качестве противоопухолевых и антигрибных агентов.
Содержание всех ссылок, упомянутых выше, особенно касающихся соединений, служащих примером (прототипом), дается здесь в виде справки, а каждое из приводимых в пример соединений может быть использовано в качестве макролида в примерах, проиллюстрированных ниже.
Примеры
Дальнейшее изложение представляет собой описание посредством примеров, относящееся только к составам по данному изобретению. Содержание компонентов, если не указано особо, представлено в весовых процентах для каждого состава.
Примеры 1-20
Дальнейшее изложение представляет собой описание посредством примеров, относящееся только к составам на основе микроэмульсионных предконцентратов по данному изобретению, в которых гидрофильная фаза включает в себя DMI или этилацетат.
Примеры 1 и 2 иллюстрируют составы в виде единичной дозы, пригодные для применения, например, для профилактики отторжения трансплантата или для лечения аутоиммунных заболеваний, и предназначенные для введения в количестве от 1 до 5 единичных доз в день. Примеры описаны с конкретной ссылкой на Ciclosporin, но эквивалентные составы могут быть получены с применением любого макролида или другого активного агента.
Пример 1
Приготовление единичных доз лекарственных форм для перорального введения
Готовится партия из 1000 капсул.
Циклоспорин растворяют при перемешивании при комнатной температуре в (1), к полученному раствору также при перемешивании добавляют (2) и (3). Порциями полученной смеси объемом по 0,5 мл заполняют либо капсулы размера 1 из твердого желатина, которые запечатывают, используя, например, технику QualiSeal, либо мягкие желатиновые капсулы.
Составы, содержащие 50 и 100 мг Ciclosporin, готовят аналогично, применяя остальные указанные ингредиенты в указанных количествах.
В данном примере рафинированное масло эквивалентно "рафинированному глицерин-трансэтерифицированному кукурузному маслу", не содержащему примесей глицерина (GB 2257359 и WO 94/09211).
Пример 2
Приготовление перорального раствора для питья
Состав готовят аналогично примеру 1 в расчете на объем 5 литров, этанол при желании может быть заменен на эквивалентное количество диметилизосорбида.
Примеры 3-19
Составы с циклоспорином А готовят с использованием в качестве липофильной фазы:
Miglyol 812 (от компании Huls) - в примерах 3-9;
глицерида кукурузного масла (моно-, ди- и триглицериды из рафинированного кукурузного масла) - в примерах 10-17; и
Labrafil 2125 CS (от компании Gattefosse) - в примерах 18 и 19.
В последующих примерах для обозначения диметилизосорбида используется сокращение DMI.
Наполнитель готовят путем смешивания компонентов друг с другом. Затем в носителе при перемешивании растворяют циклоспорин А.
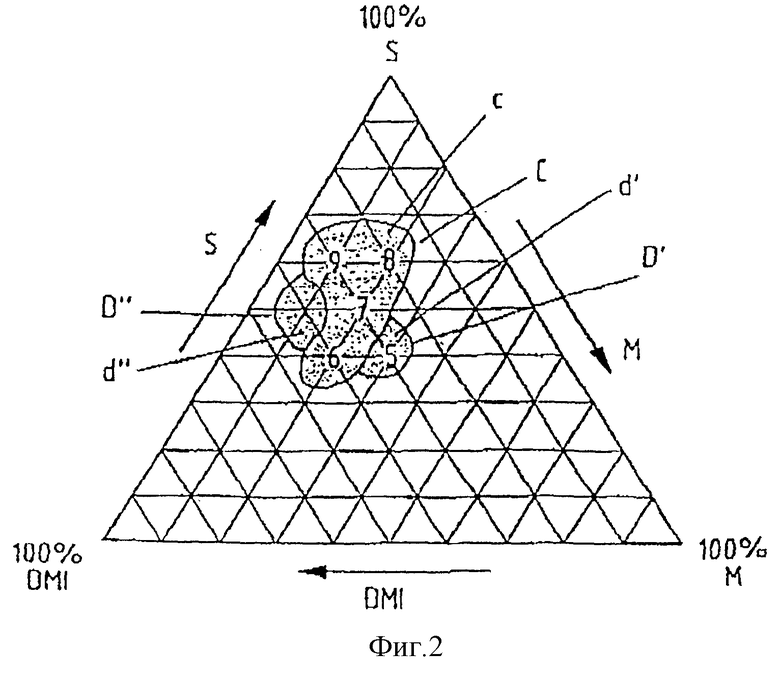
На фиг.1-5 представлены тройные диаграммы относительных концентраций каждого из гидрофильных, липофильных и поверхностно-активных компонентов. Относительная концентрация DMI увеличивается от 0% у правого края диаграммы до 100% - в левом нижнем углу, как указано стрелкой. Относительная концентрация поверхностно-активного вещества, обозначенного на фиг.1-5 сокращенно буквой S, увеличивается от базовой линии диаграммы до 100% на вершине, как указано стрелкой. Относительная концентрация липофильной фазы увеличивается от 0% вдоль левого края диаграммы до 100% - в нижнем правом углу, как указано стрелкой. Линиями внутри диаграммы обозначен 10%-ный прирост от 0% в каждом углу до 100% в соответствующем верхнем положении.
Таким образом, теоретический состав, включающий 50% липофильной фазы и 50% DMI, изображается на диаграмме в виде точки посередине базовой линии.
Относительные соотношения главных компонентов наполнителя для предпочтительных составов по настоящему изобретению лежат внутри областей а и b, отмеченных, соответственно, линиями А и В на фиг.1; областей с, d' и d'', отмеченных, соответственно, линиями С, D' и D'' на фиг.2; области е, отмеченной линией Е на фиг.3; области f, отмеченной линией F на фиг.4, и области g, отмеченной линией G на фиг.5.
На фиг.1 и 2 Miglyol 812 обозначен сокращенно буквой М. На фиг.3 и 4 глицерид кукурузного масла обозначен сокращенно буквой CG. На фиг.5 Labrafil 2125 CS обозначен сокращенно буквой L.
Измерение размеров частиц проводят при 20°С при разведении 60 мкл состава в 1 мл воды методом корреляционной фотонной спектроскопии, используя, например, Malvern ZetaSizer №3 от Malvern Instruments.
Примеры 3-9
Последующие составы, содержащие циклоспорин А, готовят, используя Miglyol 812. Этанол в составах из примеров 3 и 4 присутствует в количестве 10% по весу.
Для составов 3 и 4 не наблюдается никакого разделения фаз, составы прозрачны. При разведении водой в отношении 1:1 и 1:10 по объему, состав из примера 3 остается прозрачным. Состав из примера 4 опалесцирует при разведении водой в отношении 1:1 и 1:10 (1 объемная часть состава, 10 объемных частей воды). На фиг.1 изображены тройные диаграммы для составов 3 (область а) и 4 (область b).
Ни для одного из составов 5-9 не наблюдается никакого разделения фаз, составы прозрачны. При разведении водой в отношении 1:1 и 1:10 по объему, составы из примеров 5-9 остаются прозрачными. На фиг.2 изображены тройные диаграммы для каждого из составов 5-9 (области с, d' и d'').
Примеры 10-17
Составы, содержащие циклоспорин А, в примерах 10-17 готовят, используя глицерид кукурузного масла. Этанол в составах из примеров 10 и 11 присутствует в количестве 10% по весу.
Для составов 10 и 11 не наблюдается никакого разделения фаз, составы прозрачны. При разведении водой в отношении 1:1 и 1:10 по объему, составы из примеров 10 и 11 остаются прозрачными (1 часть состава, 10 частей воды). На фиг.3 изображены тройные диаграммы для составов 10 и 11 (область е).
Ни для одного из составов 12-17 не наблюдается никакого разделения фаз, составы прозрачны. При разведении водой в отношении 1:10 по объему (1 часть состава, 10 частей воды) составы из примеров 12-17 остаются прозрачными. При разведении водой в отношении 1:1 составов из примеров 12-15 и 17 остаются прозрачными, а в составе из примера 19 появляется опалеспенция.
На фиг.4 изображены тройные диаграммы составов 12-17 (область f).
Примеры 18 и 19
Составы, содержащие циклоспорин А, в примерах 18 и 19 готовят, используя в качестве липофильной фазы Labrafil 2125 CS.
Для составов 18 и 19 не наблюдается никакого разделения фаз, составы прозрачны. При разведении водой в отношении 1:1 и 1:10 (1 часть состава, 10 частей воды по объему) состав из примера 19 остается прозрачным. При разведении водой в отношении 1:1 и 1:10 состава из примера 18 появляется опалеспенция. На фиг.5 изображена тройная диаграмма для состава 19 (область g).
Для составов 3-19 проводят измерение распределения частиц по размерам. Во всех составах максимальный размер частиц составляет менее 70 нм. Z-среднее значение размера частиц лежит в интервале от 22,0 до 32,6 нм. Значение индекса полидисперсности лежит в интервале от 0,076 до 1,164.
Примеры 20-24
Микроэмульсионные предконцентраты готовят, используя этилацетат в качестве гидрофильной фазы. Для образования эмульсии составы разводят водой в отношении 1:1, а также добавляя 10 частей воды на 1 часть состава.
По данным визуального наблюдения каждый из составов 21-24 после разведения образует прозрачную и стабильную микроэмульсию.
Хранение
Неразбавленные составы из примеров 1-24 остаются стабильными, то есть не наблюдается никакого осаждения или кристаллизации по меньшей мере в течение одного месяца хранения при комнатной температуре. По истечении 2 месяцев хранения при комнатной температуре составы из примеров 5, 6, 7, 12 и 18 остаются прозрачными.
Примеры 25-27
Микроэмульсионные предконцентраты готовят и хранят при комнатной температуре в течение 12 месяцев:
Пример 25
По истечении 12 месяцев хранения не наблюдается никакого осаждения или кристаллизации.
Пример 26
По истечении 12 месяцев хранения не наблюдается никакого осаждения или кристаллизации.
Пример 27
По истечении 12 месяцев хранения не наблюдается никакого осаждения или кристаллизации.
Циклоспорин А может быть заменен в любом из составов, описанных в примерах 1-27, другим циклоспорином или макролидом, например, рапамицином, 40-O-(2-гидрокси)этилрапамицином, 33-эпихлор-33-дезоксиаскомицином или соединением из примера 71 из ЕР 569337.
Примеры 28-32
Далее следует описание в примерах только составов на основе макролидов, стабилизированных кислотой.
Пример 28
Активный агент класса FK 506 или класса рапамицина, например, 40-O-(2-гидрокси)этилрапамицин, вводят в микроэмульсионный предконцентрат следующего состава, выраженного в весовых процентах: 2% активного агента, 2% малоновой, молочной или фамоновой кислоты, 44% Cremophor RH40, 26,4% моно-, ди-, триглицеридов кукурузного масла, 17,6% 1,2-пропиленгликоля и 10% этанола.
Тесты на стабильность по истечении 3 месяцев показали, что состав с малоновой кислотой содержал к этому времени 98% активного агента, а без малоновой кислоты - только 73%.
Примеры 29 и 30
Микроэмульсионные предконцентраты готовят, используя в качестве активного агента 40-O-(2-гидрокси)этилрапамипин в примерах 29а и 29б и рапамицин в примерах 30а и 30б. В примере 29 активный агент 40-O-(2-гидрокси)этилрапамицин сокращенно обозначен "активным агентом R".
Содержание интактного лекарственного средства и продукт деградации определяли методом ВЭЖХ с ошибкой измерения ±2%.

Содержание основного продукта деградации указано в скобках. Основной продукт деградации рапамицина назван секорапамицином.
Приведенные выше примеры демонстрируют, что малоновая кислота оказывает ярко выраженное стабилизирующее действие на 40-O-(2-гидрокси)этилрапамицин и рапамицин.
Пример 31
Состав из примера 29а смешивают с малоновой кислоты в концентрациях, лежащих в интервале между 0,05% и 5% по весу. Высокостабилизирующий эффект наблюдается с малоновой кислотой в интервале концентраций от 0,25 до 0,75% от веса состава.
Пример 32
Концентрат для инфузии готовят, используя следующий состав:
После хранения при 25°С в течение 4 недель измерение содержания активного ингредиента дает значение 99,6%. Данный результат демонстрирует стабилизирующее влияние лимонной кислоты на 40-O-(2-гидрокси)этилрапамицин.
В приведенных выше примерах 28-32 активный агент может быть заменен на 33-эпихлор-33-дезоксиаскомицин или на соединение 71 из ЕР 569337.
| название | год | авторы | номер документа |
|---|---|---|---|
| МИКРОЭМУЛЬСИОННЫЙ ПРЕДКОНЦЕНТРАТ | 1995 |
|
RU2181054C2 |
| ПРЕДВАРИТЕЛЬНО ПРИГОТОВЛЕННЫЕ ЭМУЛЬСИОННЫЕ КОНЦЕНТРАТЫ, СОДЕРЖАЩИЕ ЦИКЛОСПОРИН ИЛИ МАКРОЛИД | 1999 |
|
RU2235554C2 |
| СТАБИЛИЗАЦИЯ МАКРОЛИДОВ | 1999 |
|
RU2243769C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРОДУКТ ТРАНСЭТЕРИФИКАЦИИ КУКУРУЗНОГО МАСЛА ГЛИЦЕРИНОМ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1992 |
|
RU2143919C1 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2011 |
|
RU2639482C2 |
| МЯГКАЯ ЖЕЛАТИНОВАЯ КАПСУЛА (ВАРИАНТЫ) И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ | 1994 |
|
RU2140783C1 |
| МИКРОЭМУЛЬСИОННЫЙ ПРЕДКОНЦЕНТРАТ АНАЛОГА ЦИКЛОСПОРИНА | 2002 |
|
RU2317067C2 |
| ВКЛЮЧАЮЩИЕ ЦИКЛОСПОРИН КОМПОЗИЦИИ, ПРАКТИЧЕСКИ НЕ СОДЕРЖАЩИЕ МАСЛА | 2000 |
|
RU2249461C2 |
| ПРЕДКОНЦЕНТРАТ МИКРОЭМУЛЬСИИ | 2002 |
|
RU2278657C2 |
| ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ, СОДЕРЖАЩИЙ ЦИКЛОСПОРИН, И ЕГО ПРИМЕНЕНИЕ | 2001 |
|
RU2301679C2 |



Изобретение относится к фармацевтическому составу, к применению фармацевтического состава, к применению карбоновой кислоты для стабилизации макролида в этом составе и способ стабилизации макролида. Изобретение предусматривает фармацевтический состав для энтерального или парентерального введения, содержащий макролид и кислоту. Изобретение позволяет решить проблему деградации макролидов во время хранения. 3 н. и 20 з.п. ф-лы, 5 ил.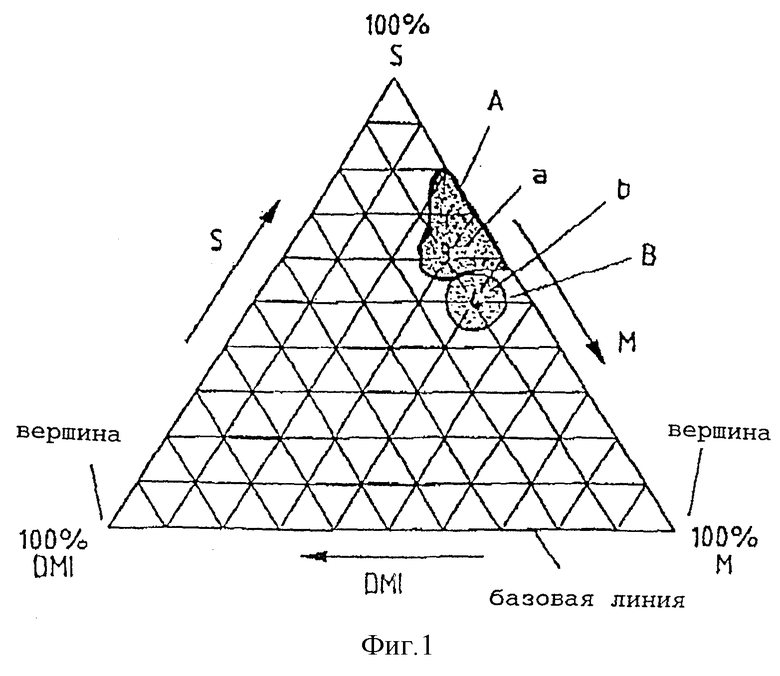
(i) рапамицин или его производное;
(ii) 33-эпихлор-33-дезоксиаскомицин или
(iii) {[1E-(1R,3R,4R)]1R,4S,5R,6S,9R,10E,13S,15S,16R,17S,19S,20S}-9-этил-6,16,20-тригидрокси-4-[2-(4-гидрокси-3-метокси-циклогексил)-1-метилвинил]-15,17-диметокси-5,11,13,19-тетраметил-3-окса-22-азатрицикло[18.6.1.0(1,22)]гептакос-10-ен-2,8,21,27-тетраон,
и, что кислотой является монокарбоновая кислота, включающая одну или более гидрофильных групп; дикарбоновая кислота; или трикарбоновая кислота, в которой кислота присутствует в количестве от 0,05 до 5% от общего веса композиции и весовое отношение макролида к кислоте составляет до 20:1.
a) в качестве иммуносупрессора;
б) в качестве противовоспалительного агента;
в) в качестве антипролиферативного агента.
а) лечения и профилактики отторжения трансплантантов органов и тканей;
б) для предотвращения реакции «трансплантат против хозяина»;
в) для лечения и профилактики аутоиммунной болезни и воспалительных состояний;
г) для лечения множественной лекарственной устойчивости (MDR);
д) в качестве противоопухолевого агента;
е) в качестве антигрибного агента.
a) реципиентов следующих трансплантатов сердца, легкого, объединенных сердца и легкого, печени, почек, панкреатической железы, кожи или роговицы;
б) реакции трансплантат против хозяина, каковая иногда имеет место при трансплантации костного мозга;
в) воспалительных состояний с этиологией включающей аутоиммунную составляющую типа артрита;
г) артриты, ревматоидные артриты, хронического прогрессирующего артрита, деформирующего артрита;
д) ревматических заболеваний;
е) аутоиммунных гематологических расстройств, гемофилическая анемия, апластическая анемия, чистая красная клеточная анемия и идиопластическая тромбоцитопения, системная эритематозная волчанка; полихондрия, скреродермия, грануломатоз Ведженера, дерматозмикоз, хронические активные гепатиты, миастения в тяжелой форме, псориаз, синдром Стивена-Джонса, идеопатический спру, аутоиммунное воспалительное кишечное заболевание, язвенные колиты, болезнь Крона, эндокринная окулонапатия, болезнь Грейва, саркоидоз, мультисклероз, первичные билатеральные циррозы, юношеские диабеты (диабеты меллитус типа I), уевит (передний и задний), сухие кератоконъюктевиты и весенние кератоконъюктевиты, внутритканевые легочные фиброзы, прориазные артриты, гломерунефриты (с и без нефротического синдрома, идиоматического нефротического синдрома или минимального изменения нефропатии) и юношеские дерматомикозы;
ж) астма;
з) опухоли, гиперпролиферативное расстройство кожи;
и) воспаление, вызванное действием стероидов;
к) инфекция;
л) передозировка FK-506, рапамицина, новых иммуносупрессивных соединений и других макрофилин-связывающих иммуносупрессантов, или для повышения эффективности других химиотерапевтических агентов при лечении и контроле мультиустойчивых условий, мультиустойчивого рака, мультиустойчивого СПИДа.
(i) рапамицин или его производное;
(ii) 33-эпихлор-33-дезоксиаскомицин или
(iii) {[1E-(1R,3R,4R)]1R,4S,5R,6S,9R,10E,13S,15S,16R,17S,19S,20S}-9-этил-6,16,20-тригидрокси-4-[2-(4-гидрокси-3-метокси-циклогексил)-1-метилвинил]-15,17-диметокси-5,11,13,19-тетраметил-3-окса-22-азатрицикло[18.6.1.0(1,22)]гептакос-10-ен-2,8,21,27-тетраон,
включающее получение композиции посредством смешивания макролида и кислоты с получением композиции, где кислота присутствует в количестве от 0,05 до 5% от общего веса композиции и весовое отношение макролида к кислоте составляет до 20:1.
(i) рапамицин или его производное;
(ii) 33-эпихлор-33-дезоксиаскомицин или
(iii) {[1E-(1R,3R,4R)]1R,4S,5R,6S,9R,10E,13S,15S,16R,17S,19S,20S}-9-этил-6,16,20-тригидрокси-4-[2-(4-гидрокси-3-метокси-циклогексил)-1-метилвинил]-15,17-диметокси-5,11,13,19-тетраметил-3-окса-22-азатрицикло[18.6.1.0(1,22)]гептакос-10-ен-2,8,21,27-тетраон,
и предусматривающий получение композиции посредством смешивания макролида и монокарбоновой кислоты, включающей одну или более гидрофильных групп; дикарбоновой кислоты или трикарбоновой кислоты с получением композиции, где кислота присутствует в количестве от 0,05 до 5% от общего веса композиции и весовое отношение макролида к кислоте составляет до 20:1.
а) в качестве иммуносупрессора,
б) в качестве противовоспалительного агента;
в) в качестве антипролиферативного агента.
а) лечения и профилактики отторжения трансплантантов органов и тканей;
б) для предотвращения реакции «трансплантат против хозяина»;
в) для лечения и профилактики аутоиммунной болезни н воспалительных состояний;
г) для лечения множественной лекарственной устойчивости (MDR);
д) в качестве противоопухолевого агента;
е) в качестве антигрибного агента.
а) реципиентов следующих трансплантатов сердца, легкого, объединенных сердца и легкого, печени, почек, панкреатической железы, кожи или роговицы;
б) реакции трансплантат против хозяина, каковая иногда имеет место при трансплантации костного мозга;
в) воспалительных состояний с этиологией включающей аутоиммунную составляющую типа артрита;
г) артриты, ревматоидные артриты, хронические прогрессирующие артриты. деформирующего артрита;
д) ревматических заболеваний;
е) аутоиммунных гематологических расстройств, гемофилическая анемия, апластическая анемия, чистая красная клеточная анемия и идиопластическая тромбоцитопения, системная эритематозная волчанка; полиходрия, скреродома, грануломатоз Ведженера, дерматозмикози, хронические активные гепатиты, миастения в тяжелой форме, псориаз, синдром Стивена-Джонса, идеопатический спру, аутоиммунное воспалительное кишечное заболевание, язвенные колиты, болезнь Крона, эндокринная окулопатия, болезнь Грейва, саркоидоз, мультисклероз, первичные билатеральные циррозы, юношеские диабеты (диабеты меллитус типа I), уевнт (передний и задний), сухие кератоконъюктевиты и весенние кератоконъюктевиты, внутритканевые легочные фиброзы, прориазные артриты, гломерунефриты (с и без нефротического синдрома, идиоматического нефротического синдрома или минимального изменения нефропатии) и юношеские дерматомикозы;
ж) астма;
з) опухоли, гиперпролиферативное расстройство кожи;
и) воспаление, вызванное действием стероидов;
к) инфекция;
л) передозировка FK-506, рапамицина, новых иммуносупрессивных соединений и других макрофилин-связывающих иммуносупрессантов, или для повышения эффективности других химиотерапевтических агентов при лечении и контроле мультиустойчивых условий, мультиустойчивого рака, мультиустойчивого СПИДа.
| ЕР 0589843 А1, 30.03.1994 | |||
| Экономайзер | 0 |
|
SU94A1 |
| МАШКОВСКИЙ М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, 1993, ч.2, с.206-207 | |||
| Прокатная клеть кварто | 1976 |
|
SU569337A1 |
Авторы
Даты
2007-02-10—Публикация
1995-10-25—Подача