Описание
Настоящее изобретение относится к гигиеническим тканям, которые предстоит использовать для восстановления и поддержания благоприятной микробной флоры на коже и мочеполовой области в комбинации с очисткой и уходом за указанными областями.
Предпосылки изобретения
Мочеполовая область содержит сложную микробную экосистему, включающую более чем 50 различных видов бактерий (Hill et al., Scand. J. Urol. Nephrol. 1984; 86 (suppl.) 23-29). Доминирующими видами в указанной области являются продуцирующие молочную кислоту бактерии, относящиеся к роду Lactobacillus. Указанные представители, продуцирующие молочную кислоту, важны для удерживания здоровой микробной флоры в данных областях и действуют в качестве пробиотических бактерий с антагонистическим эффектом против видов патогенных микробов. Продуцирующие молочную кислоту бактерии ингибируют рост и заселение другими микроорганизмами, занимая подходящие ниши для заселения, образуя биологические пленки и конкурируя за доступные питательные вещества, исключая, таким образом, колонизацию вредными микроорганизмами. Продукция ферментов, таких как гидропероксидаза, и специфических ингибирующих веществ, таких как токсины и бактериоцины, и органических кислот (включая молочную кислоту и уксусную кислоту), которые снижают рН, также ингибирует заселение другими микроорганизмами. Однако микробную экосистему здорового индивидуума можно нарушить применением антибиотиков у людей, страдающих диабетом, во время гормональных изменений, таких как во время беременности или использования контрацептивов с эстрогеном, во время менструации, после менопаузы и т.д. Микроорганизмы могут также распространяться из анального отверстия на мочеполовую область, вызывая посредством этого инфекции. Это приводит к нарушению нормальной микробной флоры и оставляет индивидуума восприимчивым к микробным инфекциям, которые вызывают вагинит, инфекции мочевых путей и обычные кожные инфекции. Микроорганизмы, обычно связанные с указанным видом инфекций, относятся к родам Escherichia, Enterococcus, Psedomonas, Proteus, Klebsiella, Streptococcus, Staphylococcus, Gardnerella и Candida. Женщинам угрожает особый риск ввиду более короткого расстояния у них между анальным отверстием и мочеполовым трактом; особый риск угрожает молодым женщинами, у которых еще нет хорошо развитой микрофлоры в мочеполовой области, и пожилым женщинами, у которых больше нет защитной флоры.
Аналогично мочеполовой области, кожа заселена рядом организмов, которые формируют ее нормальную флору. Число и вид организмов варьирует между различными участками кожи. Это, вместе со структурным барьером кожи, обеспечивает хозяина отличной защитой против внедряющихся микробов. Количество бактерий на коже варьирует от нескольких сотен на 1 см2 на сухих поверхностях предплечья и спины до десяток тысяч на 1 см2 на влажных областях, таких как подмышечная область и паховая область. Указанная нормальная флора играет важную роль в предотвращении заселения кожи «чужеродными» организмами, но ее тоже следует держать под контролем во избежание кожных инфекций.
Staphylococcus aureus представляет собой самую частую причину небольших кожных инфекций, таких как фурункулы или абсцессы, а также более тяжелой послеоперационной раневой инфекции. Лечение включает дренаж, и этого обычно достаточно по поводу небольших поражений, но дополнительно можно назначить антибиотики, когда инфекция является тяжелой, и у пациента имеется лихорадка. Синдром токсического шока представляет собой системную инфекцию штаммами S.aureus, которые продуцируют токсин синдрома токсического шока. Заболевание стало выраженным вследствие его связи с использованием тампонов здоровыми женщинами, но оно не ограничивается женщинами и может возникнуть в результате инфекции S.aureus на не генитальных участках.
Другие обычные кожные инфекции вызваны Streptococus pyogenes (стрептококки группы А). Организмы приобретаются посредством контакта с другими людьми с инфицированными повреждениями кожи, и они могут сначала заселиться и размножаться на здоровой коже перед внедрением через небольшие разрывы эпителия и развитием повреждений. Лечение пенициллином или эритромицином может быть необходимо для борьбы с инфекцией.
Propionibacterium acnes обнаруживают на здоровой коже человека. Больше не считают, что данный организм вызывает угри, но ему отводили роль в воспалении угрей.
Malassezia (ранее именовавшиеся Pityrosporum) представляют собой, вероятно, универсальных обитателей кожных покровов головы и грудной клетки у взрослых людей. Известно, что виды указанного организма участвуют в возникновении кожных заболеваний - себоррейного дерматита и отрубевидного лишая - и играют роль в этиологии тяжелой перхоти. Указанные дрожжи могут также играть роль в обострении атопического дерматита.
Так называемые дерматомикозные инфекции кожи могут быть вызваны дерматофитными грибами, например, Tricophyton, Epidermophyton и Microsporum.
Относительная сухость большинства областей кожи ограничивает рост Candida, которые поэтому обнаруживают в низких количествах на здоровой коже. Однако Candida быстро заселяют поврежденную кожу и участки кожи между пальцами (прилегающие друг к другу участки кожи, которые являются влажными и становятся потертыми). Candida также заселяют слизистую оболочку ротовой полости и влагалища, и их избыточный рост может привести к заболеванию в данных участках (так называемый кандидозный стоматит и молочница влагалища). C. albicans связана с «пеленочным» дерматитом. Исследование показало, что на повреждения, вызванные C.albicans, оказывает выраженное влияние рН, причем более низкий рН дает меньше повреждений (B. Runeman, Acta Derm Venereol 2000; 80: 421-424).
Одним путем уменьшения проблемы, связанной с описанным выше видом инфекций, является наличие хорошей личной гигиены. Однако избыточное использование чистящих средств не только уменьшает количество вредных микробов, но может повредить благоприятную микробную флору, снова делая ее восприимчивой к патогенным видам, которые заселяют ткани и вызывают инфекции. Альтернативно, было обнаружено, что нанесение продуцирующих молочную кислоту бактерий на мочеполовую область и кожу для преодоления конкуренции патогенных видов и содействия восстановлению и поддержанию благоприятной микробной флоры в указанных областях может представлять собой средство для успешного лечения и профилактики микробных инфекций.
Предполагали, что доставку продуцирующих молочную кислоту бактерий можно осуществить посредством абсорбирующих изделий, таких как пеленки, гигиенические салфетки, выстилки трусов и тампоны, как описано, например, в WO97/02846, WO99/17813, WO99/45099 и WO00/35502. Однако абсорбирующие изделия не всегда могут быть оптимальным путем нанесения, поскольку ношение абсорбирующего изделия часто воспринимают как связанное с неудобством, постоянством ношения и проявлением греющего эффекта. Данный путь нанесения может также быть неудобным, поскольку для поддержания эффективности лечения или профилактического эффекта часто необходимо повторное нанесение продуцирующих молочную кислоту бактерий. Указанные продукты также нельзя использовать для доставки бактерий в другие области тела, кроме мочеполовой области. Поэтому для некоторых видов применения может быть удобнее наносить продуцирующие молочную кислоту бактерии другими средствами, а не абсорбирующими изделиями. Вторая проблема, связанная с нанесением продуцирующих молочную кислоту бактерий посредством абсорбирующих изделий, связана с изготовлением таких изделий, поскольку все возможные варианты и размеры изделия необходимо поставлять с бактериями. Поэтому нанесение посредством изделия, которое можно использовать без индивидуальных подгонок, может обеспечить преимущество при изготовлении перед абсорбирующими изделиями.
Однако основная проблема, связанная с предоставлением изделий, предназначенных для использования с целью переноса продуцирующих молочную кислоту бактерий, состоит в том, что бактерии должны сохранить жизнеспособность во время транспорта и хранения изделий. Продуцирующие молочную кислоту бактерии быстро утрачивают жизнеспособность во влажных условиях, и поэтому важно, чтобы изделия не контактировали с влагой. Одним путем частичного преодоления указанной проблемы была поставка изделий с лиофилизированными продуцирующими молочную кислоту бактериями, благодаря чему предоставлялись изделия длительного хранения, содержащие жизнеспособные продуцирующие молочную кислоту бактерии. Однако все еще необходимо защищать бактерии против влаги в течение периода времени от изготовления до использования.
Альтернативно, исследовательские эксперименты показали, что хранение в стерильном вазелиновом масле приводит к более высокому уровню жизнеспособных клеток молочных бактерий после 8 мес. хранения, хотя выживание бактериальных клеток не обсуждается в контексте переноса бактерий на кожу (Arkadeva et al., N A. Nauchnye Doklady Vysshei Shkoly. Biologicheskie Nauki, 1983, 2:101-104). Напротив, Stoianova et al. (Mikrobiologiia, 2000, 69:98-104) обнаружили, что погружение в минеральное масло не было эффективным для сохранения жизнеспособности продуцирующих молочную кислоту бактерий. Существуют дополнительные примеры комбинации продуцирующих молочную кислоту бактерий и жировой композиции, хотя в них не описано воздействие жировой композиции на выживание. В WO01/13956 описаны фармацевтические композиции, включающие эмульгированное масло, антимикробные агенты и/или Bacillus coagulans, предназначенные для использования в способах противомикробного лечения. Однако целью использования композиций, описанных в WO01/13956, является лечение микробных инфекций добавлением компонентов, которые убивают нежелательные микроорганизмы, и эмульгированное масло не добавляют для увеличения выживания бактерий, включенных в композиции. Публикация WO92/13577 относится к тампону или к гигиенической салфетке, которая покрыта соединением с адгезивными свойствами, и к которому в последующем добавляют бактерии, прикрепляющиеся к адгезивному соединению.
Публикация WO92/13577 не относится ни к гигиеническим тканям, ни к каким-либо упоминаниям о композиции, содержащей бактерии, суспендированные в липидной фазе. Патент США № 4518696 описывает, что суспензии, включающие молочнокислые бактерии, можно стабилизировать диспергированием бактерий в подсолнечном масле. Однако патент США № 4518696 относится к области предоставления препаратов молочнокислых бактерий для перорального введения животным.
Таким образом, можно сделать вывод, что еще существует необходимость в разработке изделий для доставки продуцирующих молочную кислоту бактерий на кожу и мочеполовую область, которые удобно использовать, которые приводят к эффективному переносу бактерий к области, на которую их наносят, и которые можно хранить в течение длительным периодов времени без утраты жизнеспособности бактериальных клеток.
Цель изобретения
Целью настоящего изобретения является предоставление удобного устройства для доставки продуцирующих молочную кислоту бактерий на кожу и мочеполовую область. Это достигают предоставлением гигиенической ткани, включающей жизнеспособные продуцирующие молочную кислоту бактерии, которые можно использовать для очистки и ухода за кожей, при этом одновременно доставляя продуцирующие молочную кислоту бактерии для восстановления и поддержания благоприятной микрофлоры на коже и мочеполовой области. Для предоставления изделий, которые можно хранить в течение длительных периодов времени без утраты жизнеспособности продуцирующих молочную кислоту бактерий, бактериальные клетки суспендируют в липиде, который защищает бактерии от влаги. Целью настоящего изобретения является также предоставление непроницаемых для влаги упаковочных единиц, включающих гигиеническую ткань изобретения.
Сущность изобретения
Настоящее изобретение относится к гигиенической ткани, предназначенной для использования для очистки и ухода за кожей и мочеполовой областью одновременно с доставкой ею продуцирующих молочную кислоту бактерий, посредством этого восстанавливая и поддерживая здоровую микробную флору в указанных областях. Гигиеническая ткань характеризуется тем, что она импрегнирована композицией, содержащей продуцирующую молочную кислоту бактерию/бактерии, суспендированные в липиде, и, необязательно, дополнительный компонент (компоненты). Авторы настоящего изобретения, к удивлению, обнаружили, что инкапсуляция молочнокислой бактерии в липид обеспечивает лишенную влаги среду, удерживающую бактерию в форме, которая приводит к увеличенной продолжительности жизни, высокой частоте переноса на кожу при сохраняющейся способности к выживанию и росту на коже. Поэтому с использованием указанного подхода выживание бактерий усиливалось во время длительного хранения. Гигиеническая ткань настоящего изобретения также улучшала эффективность переноса бактерии, продуцирующей молочную кислоту, на кожу и мочеполовую область, в то время как липид служил в качестве очищающего агента со свойствами, обеспечивающими уход за кожей. Кроме того, изобретение относится к непроницаемой упаковочной единице, включающей описанные выше гигиенические ткани.
Краткое описание чертежей
На всех чертежах 1.00Е+02 представляет собой 1,00х102, 1.00Е+03 представляет собой 1,00х103 и т.д.
На фиг.1 показано выживание Lactobacillus plantarum 931 в оливковом масле на гигиенической ткани Spun Lace Dupot (•) и SCA Absbond (▪).
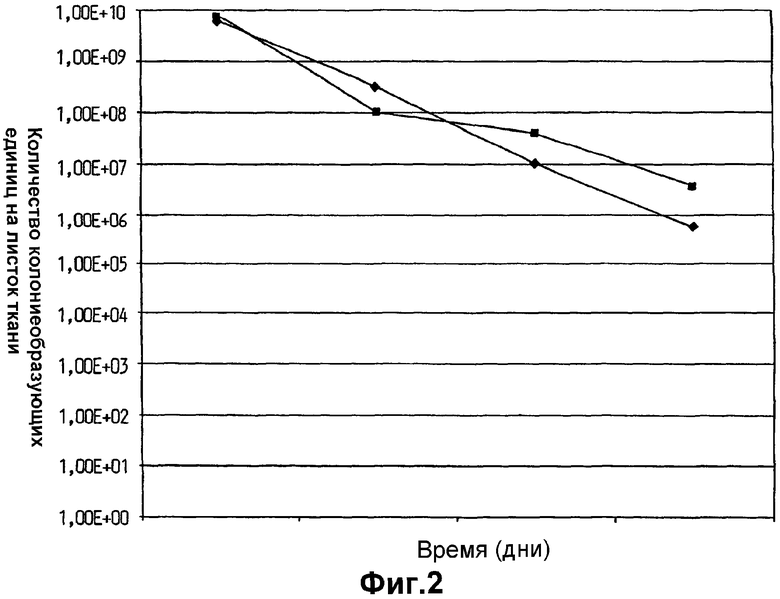
На фиг.2 показано выживание Lactobacillus plantarum 931 в суспензиях воды и оливкового масла на гигиенических тканях Spun Lace Dupot. (•) - 10% оливковое масло в воде, (▪) - 30% оливковое масло в воде.
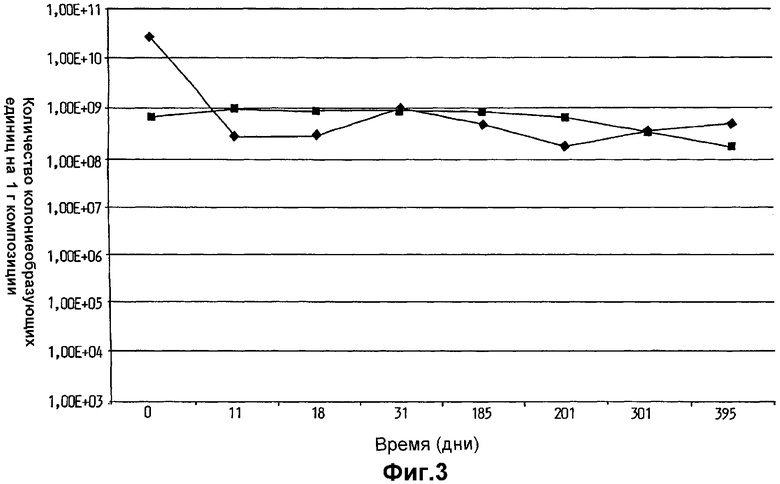
На фиг.3 показано выживание Lactobacillus plantarum 931 в оливковом масле (•) и в масле семян капусты (▪).
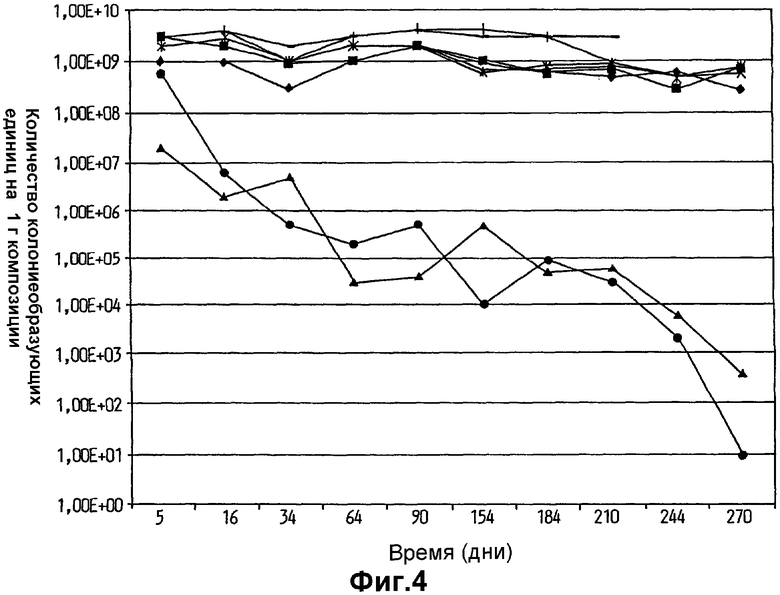
На фиг.4 показано выживание Lactobacillus plantarum 931 в липидах с различными химическими композициями. (•) - вазелин, (▪) - парафин, (▴) - глицерин, (х) - оливковое масло, (*) - диметикон, (● Alkoline MCM,  - Akomed R,
- Akomed R,  Akorex L.
Akorex L.
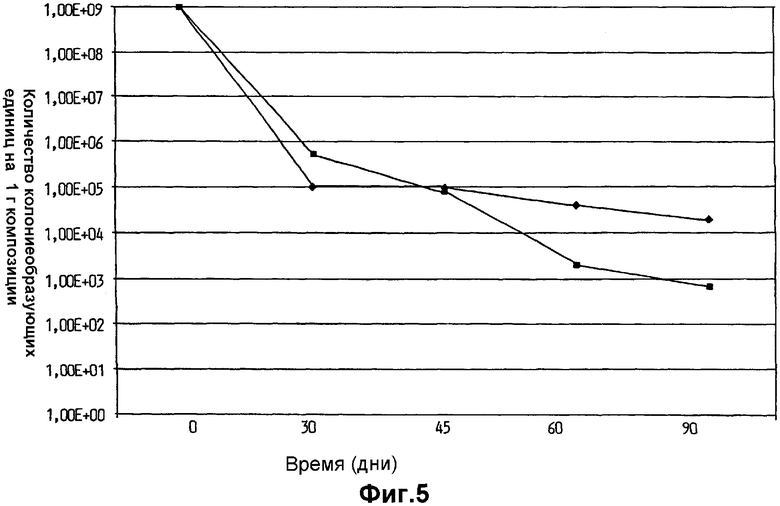
На фиг.5 показано выживание Lactobacillus plantarum 931 в суспензиях воды и оливкового масла. (•) - 10% оливковое масло в воде и (▪) - 30% оливковое масло в воде.
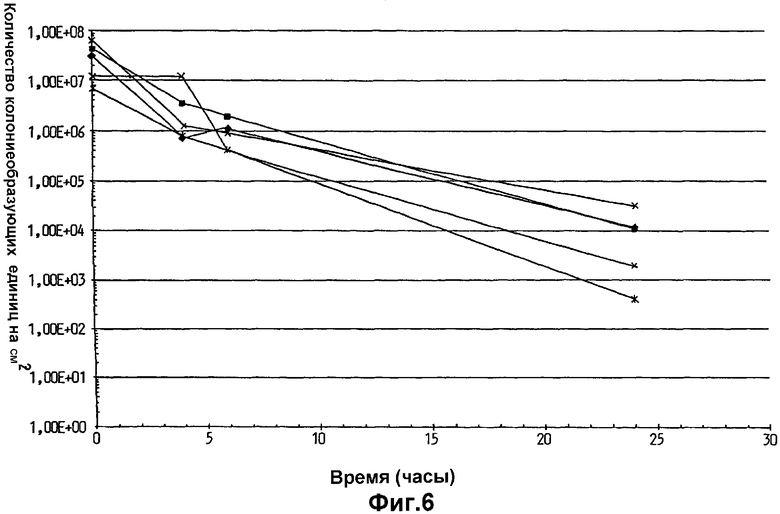
На фиг.6 показана эффективность переноса и выживаемость на коже Lactobacillus plantarum 931, суспендированной в оливковом масле, на гигиенических тканях, использованных у пяти различных индивидуумов.
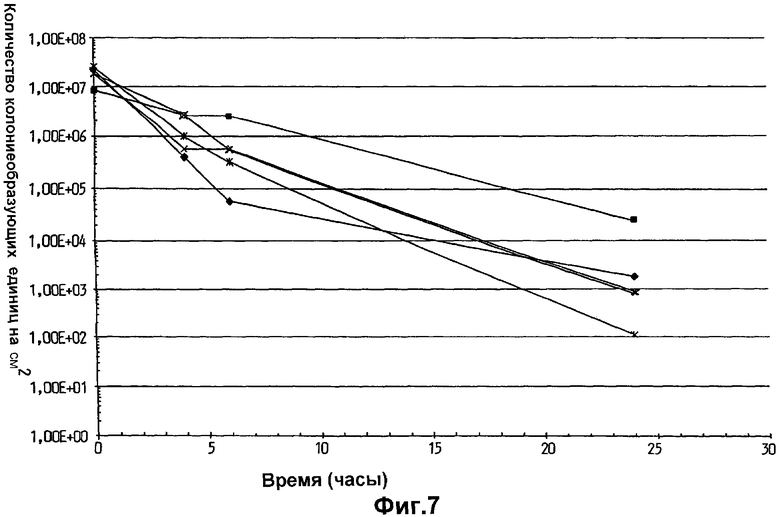
На фиг.7 показана эффективность переноса и выживаемость на коже Lactobacillus plantarum 931, суспендированной в парафиновом масле, на гигиенических тканях, использованных у пяти различных индивидуумов.
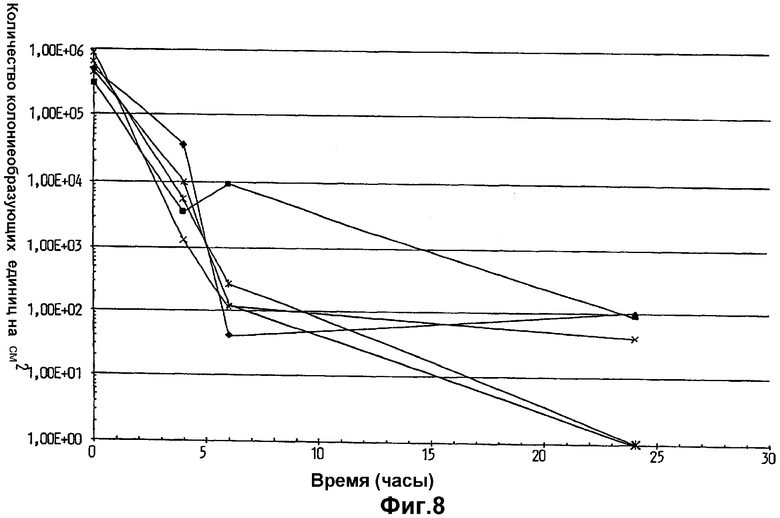
На фиг.8 показана эффективность переноса и выживаемость на коже Lactobacillus plantarum 931, суспендированной в воде Milli Q, на гигиенических тканях, использованных у пяти различных индивидуумов.
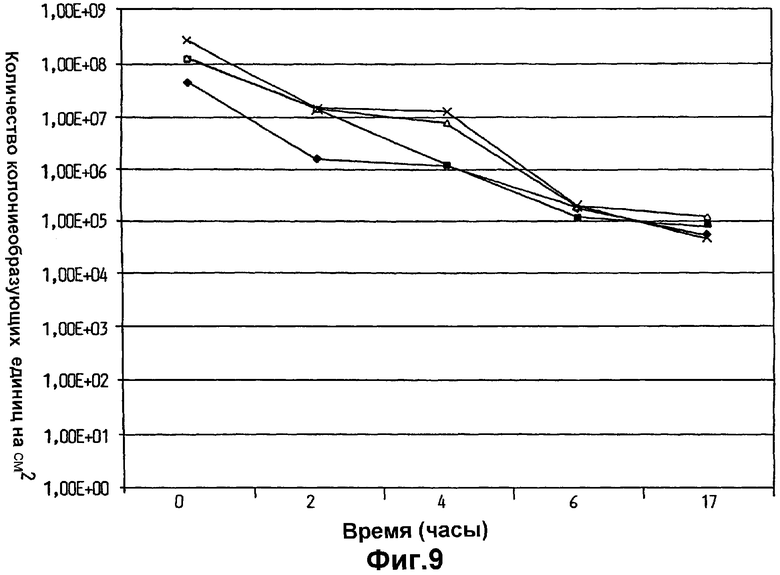
На фиг.9 показан перенос и выживание Lactobacillus plantarum 931, суспендированной в оливковом масле, в уретре после нанесения посредством листка ткани, использованного в мочеполовой области у четырех различных индивидуумов.
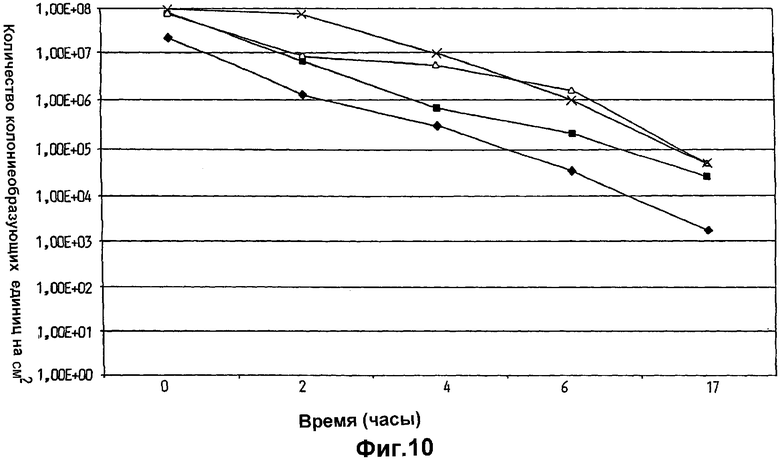
На фиг.10 показан перенос и выживание Lactobacillus plantarum 931, суспендированной в оливковом масле, в промежности после нанесения посредством листка ткани, использованного в мочеполовой области у четырех различных индивидуумов.
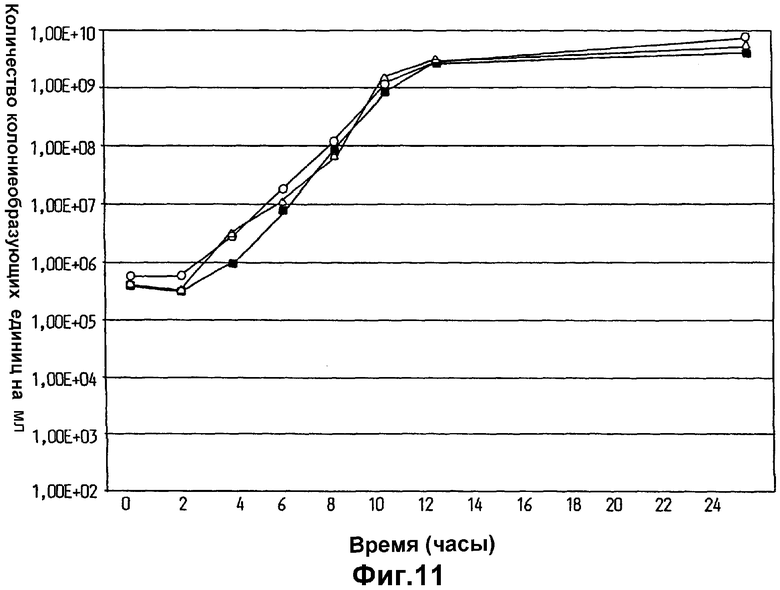
На фиг.11 показана скорость роста клеток Lactobacillus plantarum 931 после хранения в оливковом масле на листке ткани (▵0), по сравнению со скоростью роста вновь инокулированных клеток L. Plantarum 931 из культуры, выращивавшейся в течение ночи (▪).
Определения
Под «гигиенической тканью» подразумевается любое устройство для протирания кожи, например кусок материи для мытья, накладка, небольшое полотенце, салфетка, влажная салфетка и им подобные.
Под «матрицей» подразумевается любое естественное или синтетическое волокно, такое как войлок, ватин, вискоза, целлюлоза, регенерированная целлюлоза, полиэфир, полиолефиновые волокна, ткань и им подобные, или пена.
Предпочтительный «продуцирующий молочную кислоту бактериальный штамм» для цели настоящего изобретения включает бактерии из родов Lactobacillus, Lactococcus и Pediococcus. Предпочтительно выбранная используемая бактерия относится к видам Lactococcus lactis, Lactobacillus acidophilus, Lactobacillus curvatus или Lactobacillus plantarum. Еще предпочтительнее продуцирующая молочную кислоту бактерия представляет собой Lactobacillus plantarum 931 (депозит DSM № 11918).
Под липидом подразумевается нерастворимая в воде молекула с жировыми свойствами. Подходящие липиды для настоящего изобретения включают липиды, полученные из нефти, синтетические липиды и липиды животного и растительного происхождения.
Под «дополнительным компонентом» подразумеваются агенты, обычно добавляемые к продуктам для ухода за кожей, такие как средства для ухода, агенты, абсорбирующие воду, буферные агенты, поддерживающие уровень рН (слабые органические или неорганические кислоты, такие как молочная кислота, аскорбиновая кислота, лимонная кислота или борная кислота), ароматическое вещество, антиоксиданты, гидрокортизон, другие противовоспалительные стероиды и т.д. Дальнейшие детали о подходящих агентах, обычно добавляемых к продуктам для ухода за кожей, даны в Harry's Cosmeticology 8th ed., Ed by M.M. Rieger, Chemical Publishing Co., Inc., New York, 2000.
Под «непроницаемой для влаги упаковочной единицей» подразумевается упаковочная единица, имеющая самую высокую скорость передачи водяного пара, равную 6 г/м2/календарный день, в соответствии с нормативами ASTME 398-83.
Термин "водная активность" отражает содержание или долю влаги, которая при нормальных условиях может находиться в состоянии обмена с окружением.
Водная активность определяется по формуле
Aw=P/P0,
где Р - парциальное давление водного пара над образцом при определенной температуре и Р0 - парциальное давление водного пара чистой воды при той же самой температуре.
Подробное описание изобретения
Гигиеническая ткань, представленная в настоящем изобретении, предназначена для использования с целью очистки и одновременно восстановления и поддержания здоровой микробной флоры на коже и в мочеполовой области. Предоставленная гигиеническая ткань может быть составлена из матрицы, включающей любое естественное или синтетическое волокно, такое как войлок, ватин, вискоза, целлюлоза, регенерированная целлюлоза, полиэфир, полиолефиновые волокна, ткань и им подобные, или пена, или их комбинации. Содержание воды в матрице гигиенической ткани составляет предпочтительно 10% мас. или менее, предпочтительнее, 5% мас. или менее, а наиболее предпочтительно - 1% мас. или менее. Гигиеническую ткань импрегнируют суспензией продуцирующей молочную кислоту бактерии в липиде. Липид инкапсулирует бактерии (неионные, амфотерные и анионные ПАВ), буферные агенты, поддерживающие уровень рН (слабые органические или неорганические кислоты, такие как молочная кислота, аскорбиновая кислота, лимонная кислота или борная кислота), ароматическое вещество, антиоксиданты, гидрокортизон и другие противовоспалительные стероиды.
Количество липидной суспензии продуцирующих молочную кислоту бактерий на ткани составляет 0,5-95% мас.
Количество пробиотических бактерий на гигиенической ткани составляет предпочтительно 104-1011 колониеобразующих единиц (CFU), а предпочтительнее 106-1011 CFU. Препарат продуцирующих молочную кислоту бактерий предпочтительно предоставлен в высушенном виде, предпочтительно в виде лиофилизированного порошка. Бактерии можно также предоставить в микроинкапсулированных формах. Предпочтительно водная активность бактериального препарата составляет 0,30 или менее, предпочтительно 0,25 или менее, наиболее предпочтительно - 0,20 или менее.
Водная активность - количество доступной и реакционноспособной, воды и этот показатель варьирует в интервале от 0 до 1,0. Бактерии быстро размножаются при высоких значениях водной активности, т.е. более чем приблизительно 0,8. При более низкой активности, между приблизительно 0,8 и 0,3, рост бактерий ограничен, а при самых низких значениях, соответствующих величине водной активности, равной 0, большинство бактерий погибает. При водной активности ниже приблизительно 0,3 бактерии находятся в "законсервированном" состоянии.
Препарат, в котором один или несколько штаммов бактерий, продуцирующих молочную кислоту, имеет водную активность приблизительно 0,3 или менее, обеспечивает нахождение бактерий в "законсервированном" состоянии, т.е. бактерия находится в жизнеспособной форме, но не проявляет метаболической активности.
В одном предпочтительном варианте реализации пробиотический продуцирующий молочную кислоту бактериальный штамм с антагонистическим эффектом выбирают из родов Pedicoccus, Lactobacillus или Lactococcus, включая их комбинации. Продуцирующий молочную кислоту бактериальный штамм предпочтительно выделяют с кожи или мочеполовой области здорового лица.
В другом предпочтительном варианте реализации пробиотический бактериальный штамм с антагонистическим эффектом представляет собой, по меньшей мере, штамм Lactobacillus plantarum.
В еще более предпочтительном варианте реализации пробиотический бактериальный штамм с антагонистическим эффектом представляет собой, по меньшей мере, штамм Lactobacillus plantarum 931 (депозит DSM № 11918).
Подходящие липиды для настоящего изобретения поддерживают выживание хранящихся клеток таким образом, что максимальное уменьшение количества культивируемых клеток составляет 3 логарифмические единицы после 12 месяцев хранения. Подходящие липиды для настоящего изобретения предпочтительно имеют содержание воды 5 % мас. или менее, предпочтительно 3 % мас. или менее, наиболее предпочтительно 1 % мас. или менее.
Предпочтительнее, подходящие липиды поддерживают выживание хранящихся клеток таким образом, что максимальное уменьшение количества культивируемых клеток составляет 2 логарифмические единицы после 12 месяцев хранения.
Наиболее предпочтительно подходящие липиды поддерживают выживание хранящихся клеток таким образом, что максимальное уменьшение количества культивируемых клеток составляет 1 логарифмическую единицу после 12 месяцев хранения.
Подходящие липиды обеспечивают возможность переноса бактерий на кожу в количестве 105 или более культивируемых клеток на 1 см2.
Предпочтительнее, подходящие липиды обеспечивают возможность переноса бактерий на кожу в количестве 106 или более культивируемых клеток на 1 см2.
Наиболее предпочтительно подходящие липиды обеспечивают возможность переноса бактерий на кожу в количестве 107 или более культивируемых клеток на 1 см2.
Подходящие липиды также характеризуются поддержанием выживания бактериальных клеток на коже таким образом, что 102 или более культивируемых клеток на 1 см2 можно выделить через 12 ч после доставки путем использования гигиенической ткани.
Предпочтительнее, подходящие липиды поддерживают выживание бактериальных клеток на коже таким образом, что 103 или более культивируемых клеток на 1 см2 можно выделить через 12 ч после доставки путем использования гигиенической ткани.
Наиболее предпочтительно подходящие липиды поддерживают выживание бактериальных клеток на коже таким образом, что 104 или более культивируемых клеток на 1 см2 можно выделить через 12 ч после доставки путем использования гигиенической ткани.
Подходящие липиды для настоящего изобретения включают липиды, полученные из нефти, такие как жидкий парафин (минеральные масла, парафиновые масла и вазелиновые масла), петролатум (вазелин и петролатум), микрокристаллический воск, озокерит, церезин и парафины. Альтернативно, можно использовать синтетические липиды, такие как диметикон, циклометикон, и сложные силиконовые эфиры, такие как цетеарилметикон. Третьей альтернативой является использование липидов животного или растительного происхождения, которые обычно представляют собой триглицериды. Естественно встречающиеся липиды животного или растительного происхождения часто представляют собой смеси моно-, ди- и триглицеридов и свободных жирных кислот. Липиды могут быть очищенными, гидрированными, рафинированными, модифицированными и использоваться отдельно или в различных смесях. Примеры подходящих исходных липидов животного происхождения включают пчелиные воски, эмульгируемое масло, молочные липиды, ланолин, масло печени акулы и жир. Примеры подходящих исходных липидов растительного происхождения включают масло ядра абрикосовой косточки, арахисовое масло, масло/воск авокадо, воск восковницы пенсильванской, масло семян черной смородины, масло семян бурачника, масло бразильского ореха, масло камелии Sinensis, канделильский воск, карнаубский воск, касторовое масло, масло какао, масло кокосового ореха, кукурузное масло, масло хлопковых семян, масло семян розы собачьей, масло семян энотеры, масло виноградных семян, масло иллипе, воск жасмина, воск жожоба, воск лаванды колосковой, масло льняного семени, оливковое масло, апельсиновый воск, пальмовое масло, масло пальмового ядра, масло земляного ореха, рисовый воск, масло сафлоры красильной, масло кунжутных семян, масло сального дерева, масло соевых бобов, воск семян подсолнечника, масло сладкого миндаля и масло ростков пшеницы. Липиды можно использовать отдельно или в смесях, включающих, по меньшей мере, два липида.
Предпочтительно в настоящем изобретении используют жидкий липид.
Более предпочтительные липиды включают оливковое масло, канолу, масло кокосового ореха, масло пальмового ядра, масло земляного ореха, масло соевых бобов, диметикон, парафиновой масло и петролатум. Данные липиды особенно предпочтительны, поскольку они обеспечивают высокое выживание молочнокислых бактерий и высокие скорости переноса бактерий на кожу и мочеполовую область. Кроме того, указанные липиды оказывают положительные эффекты на кожу; они оказывают смягчающий эффект, проявляют защищающие кожу свойства и являются нетоксичными и не аллергенными. Все предпочтительные липиды представляют собой липиды не животного происхождения.
Для защиты пробиотических бактерий от влаги во время хранения и транспортировки гигиеническую ткань предпочтительно предоставляют отдельно упакованной в непроницаемую для влаги упаковочную единицу. Упаковочную единицу можно изготовить несколькими различными путями. Важно, чтобы используемый материал не имел проницаемость для пара, превышающую 6 г/м2/календарный день, в соответствии с нормативами ASTME 398-83 при 37,8°С и относительной влажности 90%. Подходящие материалы, которые следует использовать для получения непроницаемой упаковочной единицы, включают полиэтилен, полипропилен, полиэфир, полиамид, поливиниловый спирт и аналогичные полимеры, алюминиевую фольгу, окись алюминия, окись кремния и им подобные. Для изготовления упаковочного материала, который имеет хорошую прочность в отношении износа и который можно легко запаивать, менее дорогой материал можно использовать в качестве наружных слоев, защищающих от износа, и/или в качестве внутренних герметизирующих слоев. Например, упаковочная единица может включать внутренний материал, который обеспечивает возможность получения хорошей укупорки, например, полиэтилен, полипропилен, бутилакрилат, винилацетат или воск, промежуточный материал, который состоит из непроницаемого для влаги материала, и более прочный наружный барьерный материал, например полиэтилен или полипропилен. После помещения гигиенической ткани, включающей липидную суспензию, содержащую продуцирующие молочную кислоту бактерии, все отверстия упаковочной единицы следует загерметизировать. Важно, чтобы швы не имели проницаемость для влаги, превышающую таковую самого упаковочного материала. Дополнительные детали по конструкции подходящих непроницаемых упаковочных материалов приведены в публикации WO00/76878, которая включена сюда в качестве ссылки.
ПРИМЕР 1
Выживание Lactobacillus plantarum 931 в оливковом масле на гигиенических тканях
Препарат лиофилизированных клеток Lactobacillus plantarum 931 в снятом молоке измельчали до образования порошка из тонко измельченных частиц. 10 г порошка L. plantarum 931 добавляли к 120 мл оливкового масла (чистое оливковое масло высшего качества Filippo BERIO) и встряхивали до образования однородного раствора. Добавляли дополнительное аликвотное количество 80 мл оливкового масла и полученные 200 мл раствора перемешивали вихревой мешалкой приблизительно в течение 2 мин. Бактериальную суспензию держали при комнатной температуре в течение 3 ч при перемешивании дважды в час. Листки ткани (Spun Lace Dupont и SCA Absbond) разрезали на квадраты 6х4 см и помещали в стерильные лотки из нержавеющей ткани. На каждый листок ткани для его покрытия каплями наносили 2 мл бактериальной суспензии. Листок ткани складывали посередине, затем снова от длинной стороны к середине и упаковывали в мешочки из фольги, края которых заваривали. Отбирали образцы для определения исходной концентрации бактерий и остающиеся мешочки хранили при комнатной температуре для исследований жизнеспособности.
В качестве сравнения с хранением клеток L. plantarum 931 в оливковом масле L. plantarum 931 хранили в суспензиях воды и оливкового масла на гигиенических тканях. Их получали энергичным смешиванием 2,5 г лиофилизированных клеток L. plantarum 931 (полученных, как описано выше) с 45 мл воды Milli Q и 5 мл оливкового масла (Filippo BERIO, Italy) или 35 мл воды Milli Q и 15 мл оливкового масла для получения суспензий соответственно приблизительно с 10 или 30% маслом. Бактериальные масляно-водные суспензии наносили на листки ткани (Spun Lace Dupont) для исследований выживания бактерий. На каждый листок ткани (6х7 см) для его покрытия каплями наносили 1 мл бактериальной суспензии. Листок ткани складывали посередине, затем снова от длинной стороны к середине и упаковывали в мешочки из фольги, края которых заваривали. Отбирали образцы для определения исходной концентрации бактерий и остающиеся мешочки хранили при комнатной температуре в темноте для исследований жизнеспособности.
Для испытания жизнеспособности клеток L. Plantarum 931 после хранения в течение различных периодов времени на листке ткани листок ткани переносили в сужающийся книзу мешочек и 10 мл 0,9% NaCl распределяли по листку ткани. Мешочек в течение 3 мин подвергали активным воздействиям. Содержимое мешочка затем переносили в пробирки, при необходимости разводили в 0,9% NaCl и немедленно наносили на чашки со средой Rogosa, Количество колоний подсчитывали после 2 д инкубации при 37°С в 5% СО2 в воздухе. 2 листка ткани анализировали на каждую дату взятия проб.
Выживаемость L. plantarum 931 в оливковом масле на гигиенических тканях в течение общего периода времени 1 год и 3 месяца показана на фиг.1. Выживаемость клеток L. plantarum 931, хранившихся в указанных условиях, была очень высокая для обоих испытанных вариантов листков ткани. При сравнении, хранение масляно-водных суспензий (10 и 30% оливкового масла в воде) бактерий на листке ткани (фиг.2) привело к быстрому уменьшению жизнеспособности при падении более чем на 103 порядков величины в течение непосредственно изученного трехмесячного периода времени.
ПРИМЕР 2
Выживание L. plantarum 931 в липидах с различными химическими композициями
497 мг порошка L.plantarum 931 в снятом молоке, полученного, как описано в примере 1, смешивали с 5 мл оливкового масла (чистое оливковое масло высшего качества Filippo BERIO) или масла семян капусты (Felix AB, Sweden). рН масла составил приблизительно 5. Масло семян капусты также содержало, в дополнение к маслу семян капусты, лимонную кислоту и витамин А и D. Суспензии перемешивали вихревой мешалкой в течение 1 мин и давали возможность находиться в состоянии покоя в течение 1 мин. Это повторяли еще 4 раза. Бактериальные суспензии держали в течение 4 ч при комнатной температуре при перемешивании дважды в час. Затем суспензии делили на аликвотные количества по 1 мл и хранили в стерильных, коричневых стеклянных флакончиках. Определяли исходные концентрации бактерий в суспензиях. Флакончики хранили в темном месте при комнатной температуре и нормальной влажности воздуха, варьирующей от 30 до 60%.
В дополнение к описанному выше эксперименту, для дальнейшего сравнения выживания L.plantarum 931 в липидах с различными композициями, 2 г лиофилизированных клеток L. plantarum 931 в снятом молоке (2х1010 колониеобразующих единиц/г) смешивали или с 40 мл, или с 40 г различных липидных композиций, в зависимости от консистенции липидов. Испытанными липидами были: белый вазелин (петролатум, Apoteket AB, Umea, Sweden), парафин (вазелиновое масло, Apoteket AB, Gothenburg, Sweden), глицерин («глицерин», максимальное содержание воды 0,5%, Apoteket AB, Gothenburg, Sweden), оливковое масло («Olea Europea», холодной прессовки, Apoteket AB, Gothenburg, Sweden), диметикон (Dimethicone, 350 cSt., Dow Corning 200/350 S fluid, Kebo Lab, Sweden) и Akoline MCM (моно-диглицерид среднецепочечных жирных кислот; преимущественно каприловая и каприновая кислоты, Karlshamns AB, Sweden), Akomed R (каприловый/каприновый триглицерид из кокосового ореха и/или масел ядер пальмовых косточек, дезодорированный, Karlshamns AB, Sweden), и Akorex L (масло канола, частично гидрированное, дезодорированное, Karlshamns AB, Sweden). Образцы хранили в стерильных, коричневых стеклянных флакончиках при комнатной температуре в темноте при нормальной влажности воздуха (относительной влажности, варьирующей от 30 до 60%). Для установления количества жизнеспособных клеток L.Plantarum 931 после различных периодов времени хранения 1 г образцов переносили в сужающийся книзу мешочек и добавляли 9 мл 0,9% NaCl. Мешочек затем подвергали активным воздействиям в течение 3 мин. Содержимое мешочка переносили в пробирки, при необходимости разводили в NaCl и культивировали на чашках со средой MRS при 37°С в 5% СО2 в воздухе в течение двух дней.
В качестве сравнения с хранением клеток L.plantarum 931 в различных липидах клетки L.plantarum 931 также хранили в суспензиях воды и оливкового масла. Их получали энергичным смешиванием 2,5 г лиофилизированных клеток L.plantarum 931 (полученных, как описано выше) с 45 мл воды Milli Q и 5 мл оливкового масла (Filippo BERIO, Italy) или 35 мл воды Milli Q и 15 мл оливкового масла для получения суспензий приблизительно с 10 или 30 % масла соответственно. Образцы хранили в стерильных пластиковых флакончиках при комнатной температуре при нормальной влажности воздуха (относительной влажности, варьирующей от 30 до 60%). Для испытания выживания через различные интервалы времени образцы отбирали из флакончиков, разводили в 0,9% NaCl и инкубировали при 37°С в 5% СО2 в воздухе в течение 2 д.
На фиг.3 показан необычно высокий уровень выживаемости клеток L.plantarum 931 в оливковом масле и в масле семян капусты в течение изученного периода времени, составившего более одного года. Хранение в вазелине, парафине, диметиконе, Akoline MCM, Akomed R и Akorex L также привело к высокому выживанию в течение продолжительных периодов времени (фиг.4). Однако хранение в более гидрофильном глицерине привело к выраженному уменьшению выживания с течением времени (фиг.4). Также Akoline MCM, который, как известно, имеет бактериостатические свойства, не мог поддержать выживание клеток (фиг.4). Кроме того, видно, что хранение в более гидрофильной среде, обеспеченной в масляно-водных суспензиях (фиг.5), приводит к очень быстрому исходному уменьшению жизнеспособности более чем на 102 порядков величины в течение первого месяца хранения. В течение изученных следующих двух месяцев уменьшение показателей выживаемости выходило на плато, но все же уменьшение выживания гораздо выше, чем наблюдалось, когда бактериальные клетки хранили в липиде.
ПРИМЕР 3
Исследование эффективности переноса на кожу и показателей выживаемости на коже L.plantarum 931, суспендированных в оливковом масле, парафиновом масле или воде Milli Q
2,00 г лиофилизированных L.plantarum 931 помещали в стерильный стеклянный флакончик и добавляли оливковое масло, парафиновое масло или воду Milli Q. Суспензии встряхивали до формирования однородных растворов и оставляли при комнатной температуре в течение 4 ч. Листки ткани с L.plantarum 931 готовили, разрезая листы ткани на куски размером 7х8 см и нанося каплями по 2 мл различных бактериальных суспензий, полученных, как описано выше, для покрытия ткани. Листки ткани складывали посередине, затем снова от длинной стороны к середине и упаковывали в мешочки из фольги, края которых заваривали. Отбирали образцы для определения исходной концентрации бактерий и остающиеся мешочки хранили при комнатной температуре для исследований жизнеспособности. 2 из приготовленных листов ткани с L.plantarum 931 для каждого препарата использовали на сгибах верхней конечности у пяти лиц (т.е. одну ткань использовали для трех лиц и еще одну для двух). Перед испытанием отбирали пробы для того, чтобы удостовериться в исходном присутствии клеток L.plantarum 931 на коже. У каждого индивидуума на один сгиб руки наносили полоску листка ткани с L.plantarum 931 в воде Milli Q и листок ткани с L.plantarum 931 в оливковом масле аналогичным образом использовали на другом сгибе руки. Затем брали пробы с кожи для выявления присутствия клеток L.plantarum 931 через 0, 4, 6 и 24 ч после нанесения полосок. Процедура взятия проб была следующей: стерильную палочку с ватным тампоном погружали в 0,9% NaCl и прокатывали 4 раза по области 1 см2 в участке нанесения бактерий. Затем палочку погружали в 1 мл 0,9% NaCl и перемешивали. Образцы разводили в 0,9% NaCl и сразу наносили на чашки со средой Rogosa. Чашки инкубировали при 37°С в 5% СО2 в воздухе в течение 2 д. Через 24 часа сгиб руки, куда наносили клетки L.plantarum 931 в воде Milli Q, споласкивали раствором Sumabac (Diversey Lever, Huddinge, Sweden) и листок ткани с клетками L.plantarum 931 в парафиновом масле наносили полоской на сгиб руки, пробу с которого, как и ранее, брали через 0, 4, 6 и 24 ч после нанесения полоски для оценки количества клеток L.plantarum 931 на коже.
Как показано на фиг.6-8, количество клеток L.plantarum 931, перенесенных на кожу, было обычно более чем в 10 раз выше, когда бактерии суспендировали в оливковом (фиг.6) или парафиновом масле (фиг.7), по сравнению со случаями, когда их суспендировали в воде Milli Q (фиг.8). Поэтому было продемонстрировано, что суспендирование бактерий в липиде вместо воды увеличивало показатели переноса бактерий на кожу. Также, как только клетки L.plantarum 931 оказывались на коже, липид также увеличивал выживание бактерий, поскольку исходное падение количества бактерий замедлялось, и конечный уровень бактерий на коже через 24 ч был гораздо выше после использования ткани, где бактерии были суспендированы в оливковом или парафиновом масле (фиг.6 и 7), по сравнению с тем, что было обнаружено, когда в качестве суспендирующего агента использовали воду (фиг.8).
ПРИМЕР 4
Перенос L.plantarum 931, суспендированных в оливковом масле, нанесенных на листок ткани, используемый в мочеполовой области
Бактериальную суспензию готовили добавлением 5,051 г порошка L.plantarum 931 (полученного, как описано в примере 1) к 100 мл оливкового масла (чистое оливковое масло высшего качества Filippo BERIO). Порошок сначала добавляли к 75 мл оливкового масла и встряхивали для образования однородного раствора перед добавлением еще 25 мл с последующим перемешиванием вихревой мешалкой в течение 2 мин. Бактериальную суспензию держали при комнатной температуре в течение 2 ч при перемешивании дважды в час. Готовили листок ткани и инокулировали бактериями, как описано в примере 1. 4 девочкам листком ткани обрабатывали мочеполовую область. Образцы брали из уретры и промежности с использованием стерильных ватных палочек перед использованием листка ткани для того, чтобы удостовериться в исходном присутствии молочнокислых бактерий. Затем образцы брали сразу после обработки и через 2, 4, 6 и 17 ч для мониторинга переноса и выживания молочнокислых бактерий погружением стерильной палочки, снабженной ватным тампоном, в MRS-бульон и прокаткой ее 3 раза по области 1 см2 в участке нанесения бактерий. Затем палочку клали в 1 мл MRS-бульона. Таким же образом палочку прокатывали по уретре по области в 1/4 см2 и клали в другую пробирку с MRS-бульоном. Образцы наносили на чашки со средой Rogosa, содержащей 128 мкг/мл ванкомицина. Чашки инкубировали при 37°С в 5% СО2 в воздухе в течение 2 д.
Девочкам не разрешали принимать ванну или душ в течение исследования, но их не инструктировали в любом другом отношении. Результаты, показанные на фиг.9 и 10, демонстрируют, что имелся высокий уровень переноса L.plantarum 931 в уретру (фиг.9) и промежность (фиг.10), и что удивительно большое количество бактерий оставалось в указанных областях в течение изученного периода времени.
ПРИМЕР 5
Жизнеспособность L.plantarum 931 после хранения в оливковом масле на гигиенической ткани
Рост L.plantarum 931, суспендированных в оливковом масле на листках ткани, которые хранились в течение 6 д., сравнивали с ростом L.plantarum 931, которые не были суспендированы и не хранились в оливковом масле. Листки ткани смачивали 10 мл 0,9% NaCl и в течение 3 мин подвергали активным воздействиям в сужающемся книзу мешочке. Затем раствор переносили в пробирки и 10 мкл засевали в 10 мл MRS-бульона. За концентрацией бактерий следили в течение роста при 37°С в воздухе с 5% СО2 подсчетом количества колониеобразующих единиц (CFU) и количественным определением оптической плотности (OD) через 0, 2, 4, 6, 8, 10, 12 и 24 ч. Для анализа брали двойные образцы. Результаты, показанные на фиг.11, демонстрируют, что способность роста клеток L.plantarum 931, которые суспендировали и хранили в оливковом масле на листке ткани, такая же хорошая, как и роста клеток из выращивавшейся в течение ночи культуры L.plantarum 931. Соответственно, хранение в оливковом масле не оказывало отрицательного воздействия на клетки L.plantarum 931.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЙ ПРОДУКТ | 2004 |
|
RU2339406C2 |
| Lactobacillus fermentum Ess-1, DSM17851, И ЕГО ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРОФИЛАКТИКИ КАНДИДОЗА И ИНФЕКЦИЙ МОЧЕВЫХ ПУТЕЙ | 2006 |
|
RU2413761C1 |
| АДСОРБИРУЮЩЕЕ ИЗДЕЛИЕ | 2005 |
|
RU2382655C1 |
| ПОЛИМЕРНАЯ МАТРИЦА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ, ГИГИЕНИЧЕСКОЕ ИЗДЕЛИЕ И НАБОР, СОДЕРЖАЩИЙ ПОЛИМЕРНУЮ МАТРИЦУ | 2004 |
|
RU2352627C2 |
| АДСОРБИРУЮЩЕЕ ИЗДЕЛИЕ | 2005 |
|
RU2380118C1 |
| ШТАММ LACTOBACILLUS PLANTARUM DSM 11918 И ЕГО ПРИМЕНЕНИЕ ДЛЯ ПРОФИЛАКТИКИ И/ИЛИ ЛЕЧЕНИЯ МОЧЕПОЛОВЫХ ИНФЕКЦИЙ | 1999 |
|
RU2224017C2 |
| ПРОБИОТИЧЕСКИЕ ШТАММЫ Lactobacillus (ВАРИАНТЫ) И ИХ ПРИМЕНЕНИЕ | 2003 |
|
RU2316586C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНОГО КОМПОНЕНТА ДЛЯ СРЕДСТВА, ПРЕДНАЗНАЧЕННОГО ДЛЯ УХОДА ЗА КОЖЕЙ, И КОМПОНЕНТ, ПОЛУЧЕННЫЙ ЭТИМ СПОСОБОМ | 2009 |
|
RU2440096C2 |
| ГИГИЕНИЧЕСКОЕ ИЗДЕЛИЕ, СОДЕРЖАЩЕЕ ЛАКТОБАКТЕРИИ В ГИДРОФИЛЬНОМ НОСИТЕЛЕ | 2007 |
|
RU2433835C2 |
| ПРОДУКТ И ПРЕПАРАТ, СОДЕРЖАЩИЙ МОЛОЧНО-КИСЛЫЕ БАКТЕРИИ | 1998 |
|
RU2212902C2 |
Настоящее изобретение относится к медицине, конкретно к гигиенической ткани, предназначенной для очистки и ухода за кожей и мочеполовой областью с одновременной доставкой ею продуцирующих молочную кислоту бактерий, посредством этого восстанавливая и поддерживая здоровую микробную флору в указанных областях. Гигиеническая ткань характеризуется тем, что она импрегнирована композицией, включающей продуцирующую молочную кислоту бактерию/бактерии, суспендированные в липиде, и, необязательно, дополнительные компоненты. Инкапсуляция молочнокислой бактерии в липиде обеспечивает лишенную влаги среду, которая увеличивает выживание молочнокислых бактерий, удерживающую бактерию в форме, обеспечивающей способность к росту после доставки на кожу. Гигиенические ткани, включающие продуцирующие молочную кислоту бактерии, можно хранить в течение длительных периодов времени. Гигиеническая ткань настоящего изобретения также улучшает эффективность переноса бактерии, продуцирующей молочную кислоту, на кожу и мочеполовую область. Кроме того, липид обеспечивает функцию очистки таким образом, что кожа очищается одновременно с доставкой молочнокислых бактерий. 2 н. и 10 з.п. ф-лы, 11 ил.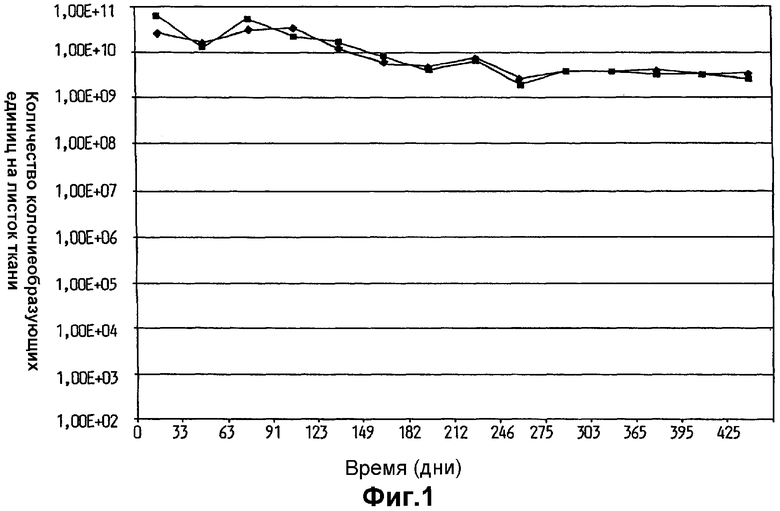
A) препарата одного или более бактериальных штаммов, продуцирующих молочную кислоту, причем указанный препарат имеет водную активность 0,30 или менее, предпочтительно 0,25 или менее, наиболее предпочтительно 0,20 или менее; и
B) липидной фазы, предпочтительно жидкой липидной фазы, включающей, по меньшей мере, один липид, где липид выбран из группы, состоящей из оливкового масла, масла канола, масла кокосового ореха, масла пальмового ядра, масла земляного ореха, масла соевых бобов, диметикона, парафинового масла и петролатума.
| Способ консервирования сетематериалов | 1954 |
|
SU113956A1 |
| ДЕЗИНФИЦИРУЮЩАЯ КОМПОЗИЦИЯ, СПОСОБ ПРОВЕДЕНИЯ ДЕЗИНФЕКЦИИ И ПРОТИРОЧНЫЙ МАТЕРИАЛ | 1997 |
|
RU2152984C2 |
| СПОСОБ УСИЛЕНИЯ ЛЕЧЕБНОГО ЭФФЕКТА ЛЕКАРСТВЕННЫХ СРЕДСТВ | 1997 |
|
RU2104032C1 |
Авторы
Даты
2007-09-20—Публикация
2002-12-12—Подача