Способ стимулирования основных биохимических реакций организма для лечения и регенерации тканей может быть применен в медицине при лечении болезней, при которых имеют место нарушения энергетического обмена в клетках, ослабление ферментативных процессов, нарушение регенеративной функции пораженных тканей. Способ лечения применяется для терапии ожоговых поражений тканей как вследствие термического воздействия, так и при химическом воздействии, а также при поражении проникающими жесткими излучениями, например γ, α, β - излучениями, приводящими к образованию злокачественных опухолей, лейкемии. Также способ может быть использован при лечении парадонтозов и парадонтитов, при ремиссии после местно-пластических операций на лице и может быть использован при лечении других болезней того же класса.
Известно изобретение «Способ воздействия на клетки электромагнитным излучением», патент RU №2197303, опубл. 27.01.2003, МПК A61N 5/02, при котором воздействие производят наложением электромагнитных полей от электромагнитного поля проводника. Изобретение позволяет получить более широкий диапазон электромагнитного излучения, которое активизирует деятельность здоровых клеток, вызывает разрушение злокачественных опухолевых клеток и капсулирование злокачественных опухолей. Однако воздействие на клетку излучением СВЧ может привести к нежелательным побочным эффектам, т.к. строго не определен частотный диапазон с контролируемой мощностью излучения. Этот способ не позволяет получить достаточно широкий диапазон электромагнитного поля воздействия на клетки живых организмов, который бы совпадал с близкой к резонансной частоте их колебаний.
Известно изобретение «Способ лечения поврежденных биологических тканей путем воздействия на область очага физическими факторами», патент RU №2226412, опубл. 04.10.2004, МПК A61N 5/02, при котором воздействие осуществляют высокочастотным электромагнитным полем, образованным амплитудно-модулированным синусоидальным сигналом с несущей частотой в диапазоне частот 100-1000 кГц и частотой модуляции, постоянно меняющейся в диапазоне 50-8000 Гц. Способ позволяет увеличивать мощность излучения, при котором ток, индуцируемый в биологической ткани, распространяется преимущественно по сосудам и межтканевым щелям, огибая при этом клетки. При этом достигается увеличение лечебного эффекта путем ускорения регенерации биологических тканей. Однако резонансный колебательный контур не обеспечивает резонанса по всему диапазону колебательных процессов внутри клетки, который охватывает частотный интервал от единиц герц до терагерц. При воздействии электромагнитными волнами предлагаемой частоты, которое ограничено небольшой глубиной проникновения миллиметровых волн, излучение не достигнет глубоких слоев пораженных тканей, тогда как в приповерхностных тканях будут разрушаться мембраны как пораженных клеток, так и здоровых.
Наиболее близким к предложенному способу является изобретение «Способ волновой терапии», патент RU №2229906, опубл. 06.10.2004, МПК A61N 5/02, A61N 5/06, в котором осуществляют воздействие электромагнитным излучением с одновременным плавным изменением частоты во всем диапазоне воздействующего сигнала, воздействие осуществляют в диапазоне частот от 30 ГГц до 3 ТГц при излучаемой мощности 10-11-10-10 Вт. При этом воздействие излучения с такими частотами сопровождается резонансным откликом организма и коррекцией нарушенного гомеостаза. Однако резонансный колебательный контур не обеспечивает резонанса по всему диапазону колебательных процессов внутри клетки. Кроме того, излучение данной частоты не достигает глубоких слоев пораженных биотканей, вследствие чего не достигается необходимый терапевтический эффект.
Для стимулирования основных биохимических реакций организма для лечения и регенерации тканей необходимо обеспечить фотобиохимические реакции на молекулярном уровне, которые обеспечивают перевод клеток (их молекул, атомов) в возбужденное состояние путем подвода к ним извне определенной порции энергии на частоте, близкой к резонансной частоте колебаний клеточных мембран. Причем данные колебательные процессы в клетке характеризуются набором собственных "характеристических частот". Кроме того, у пораженных, например злокачественных клеток, а также клеток, подвергшихся термическому или химическому ожогу, диапазон частот смещен относительно соответствующего диапазона частот здоровых клеток.
Если облучать клетки с помощью излучения в узком диапазоне частот, даже если этот частотный диапазон близок к резонансной частоте колебаний одной из ее мембран, то это обеспечивает «жесткую тряску» других мембран клетки, что может привести к их разрушению. Поскольку клетка имеет свой диапазон резонансных частот, то требуется обеспечить резонанс как наружной мембраны, так и внутренних мембран. При этом биологически корректное добавление энергии ускоряет реакцию основного переноса белков между клеточными мембранами во внутри- и межклеточном пространстве. При этом мембраны пораженных клеток будут разрушаться и выноситься из организма с кровотоком.
Техническим результатом предложенного способа является облучение биотканей всем диапазоном терагерцовых частот при увеличении глубины их проникновения, что приводит к фотостимулированию биохимических реакций вследствие совпадения частоты терагерцового излучения с резонансными частотами колебаний межклеточных (и внутриклеточных мембран) и белковых молекул. Таким образом, техническим результатом является увеличение эффективности заживления пораженных биотканей путем облучения в терагерцовом диапазоне.
Технический результат достигается за счет облучения в диапазоне терагерцовых частот, в качестве несущей которых выступает излучение инфракрасного диапазона длин волн. За счет несущего инфракрасного излучения (ИК) обеспечивается увеличение глубины проникновения терагерцовых частот в биоткани, что, в свою очередь, повышает эффективность фотостимулируемых биохимических реакций вследствие совпадения частоты терагерцового излучения с резонансными частотами колебаний межклеточных (и внутриклеточных мембран) и белковых молекул.
Технический результат достигается следующим способом. Стимулируют основные биохимические реакции организма для лечения и регенерации биотканей. Способ состоит в том, что облучают участки кожи терагерцовым излучением в диапазоне от 0,02 до 8 ТГц, в качестве несущей которого выступает инфракрасное излучение 1 до 56 мкм.
Данный способ обеспечивает технический результат за счет того, что основными реакциями с участием аденозинтрифосфата (АТФ), которые обеспечивают увеличение кровотока и являются:
1. Основной реакцией с выделением энергии является реакция трансформации аденозинтрифосфата (АТФ) в аденозиндифосфат (АДФ) в клетке, при этом выделяемая энергия стимулирует реакцию трансформации гуанозиндифосфата (ГДФ) в гуанозинтрифосфат (ГТФ). Данная реакция, ответственная за транспорт белков внутри и вне клеток, протекает вследствие влияния фермента АТФазы. Кроме того, вышеописанная реакция может стимулироваться при воздействии излучения инфракрасного диапазона длин волн. Однако эффективность фотостимуляции данной реакции невелика, если использовать непрерывное ИК-облучение. В случае применения ИК-излучения, модулированного в терагерцовом диапазоне, согласованного (в резонансе) с частотами колебательных процессов внутри клетки, эффективность фотостимулированных реакций возрастает на порядки. Кроме того, использование ИК-излучения в качестве несущей терагерцового излучения существенно увеличивает проникновение последнего в биоткани.
2. Реакция транспорта кислорода в миоглобине и гемоглобине, при протекании которой осуществляется изменение спинового состояния кислорода при захвате и уходе с иона железа. Данная реакция также управляется АТФазой. Кроме того, ИК-излучение повышает эффективность данной реакции. Однако эффективность его воздействия невысока, если излучение не выступает в качестве несущей терагерцового излучения, частота которого соответствует частоте колебаний пиридинового кольца в геме.
3. Возбуждение водородных связей альфа-спирали белка происходит также под воздействием АТФазы. Кроме того, ИК-излучение также приводит к возбуждению водородных связей. При использовании ИК излучения, модулированного в терагерцовом диапазоне, согласованного (в резонансе) с частотами колебательных процессов внутри клетки, эффективность фотостимулированных реакций возрастает на порядки.
Причем заявленный технический результат может быть обеспечен только при увеличении глубины проникновения излучения в заданном диапазоне частот.
При накоплении энергии в клетке начинает работать солитонный механизм передачи энергии между возбужденными белковыми молекулами.
При облучении терагерцовым излучением с использованием в качестве несущей ИК-излучение указанные выше процессы регулировали за счет регуляции суммарного (совокупного) среднего потока световой мощности (мВт/м2) и длительности облучения.
В качестве примеров, иллюстрирующих повышение эффективности лечения пораженных тканей путем облучения терагерцовым излучением, приведены следующие клинические результаты.
Пример. 1.
Пациент с диагнозом ожог 2-ой степени грудной клетки в возрасте 28 лет. Непосредственно область ожога подвергалась облучению электромагнитным излучением с частотой 0,048 ТГц. В качестве несущей использовалось инфракрасное излучение с длиной волны 1-56 мкм. Облучение проводилось по одному сеансу в день, длительностью 22,5 мин, в течение 10 дней. Облучение осуществлялось одним источником излучения.
Контроль за состоянием кровообращения в области раны производился методом реографии здоровых участков кожного покрова на расстоянии от края раны 1-3 мм.
При изучении реографических данных учитывали
1) реографический индекс РИ (норма 0,07-0,09),
2) показатель тонического напряжения сосудов ПТН (норма 15-18%),
3) индекс периферической резистентности сосудов ИПР (норма 70-80%). До начала лечения реографические показатели составляли РИ=0,04; ПТН=22; ИПР=91. После проведения лечения реографические показатели составляли РИ=0,09; ПТН=16; ИПР=86.
Пример.2.
Пациентка с диагнозом ожог 1-ой степени предплечья в возрасте 35 лет.
Непосредственно область ожога подвергалась облучению электромагнитным излучением с частотой 7,01 ТГц. В качестве несущей использовалось инфракрасное излучение с длиной волны 1-56 мкм. Облучение проводилось по одному сеансу в день, длительностью 22,5 мин, в течение 10 дней. Облучение осуществлялось одним источником излучения.
До начала лечения реографические показатели составляли РИ=0,03; ПТН=23; ИПР=89. После проведения лечения реографические показатели составляли РИ=0,07; ПТН=17; ИПР=79.
На основании проведенных клинических испытаний подтверждено повышение эффективности заживления пораженных в результате термического воздействия тканей, что контролировалось методом реографии путем наблюдения за состоянием кровообращения в области пораженных тканей.
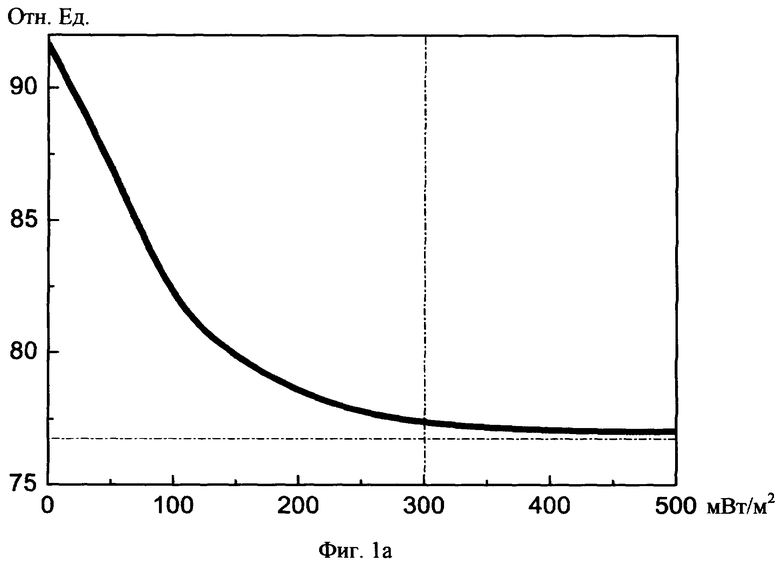
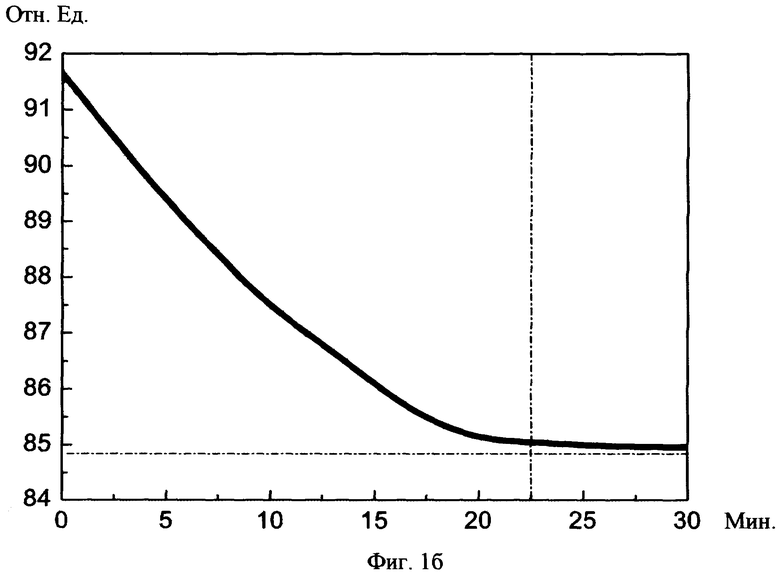
На фиг.1а, б изображены графики снижения индекса периферической резистенстности сосудов до нормы в зависимости от суммарного среднего потока световой мощности и суммарной длительности сеансов соотвественно.
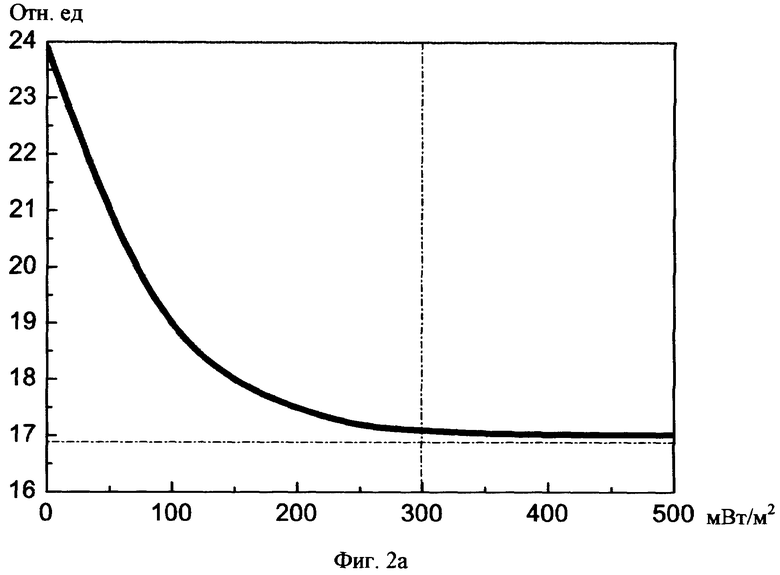
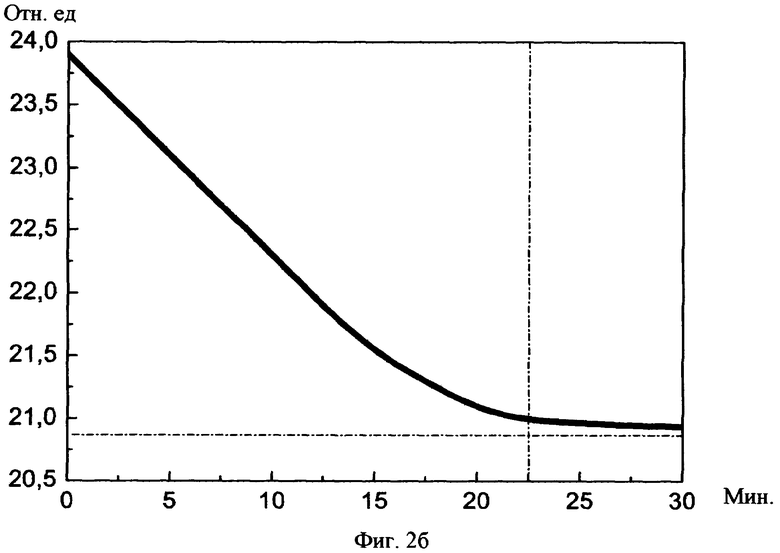
На фиг.2а, б изображены графики снижения показателя тонического напряжения сосудов до нормы в зависимости от суммарного среднего потока световой мощности и суммарной длительности сеансов соотвественно.
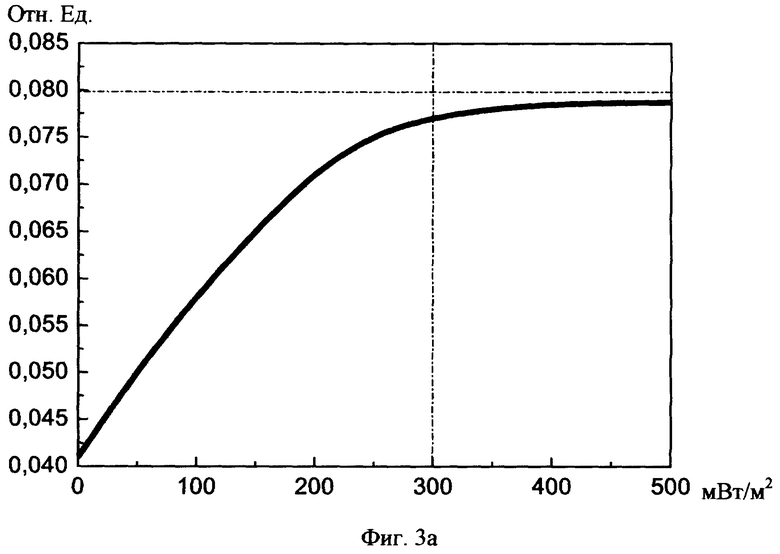
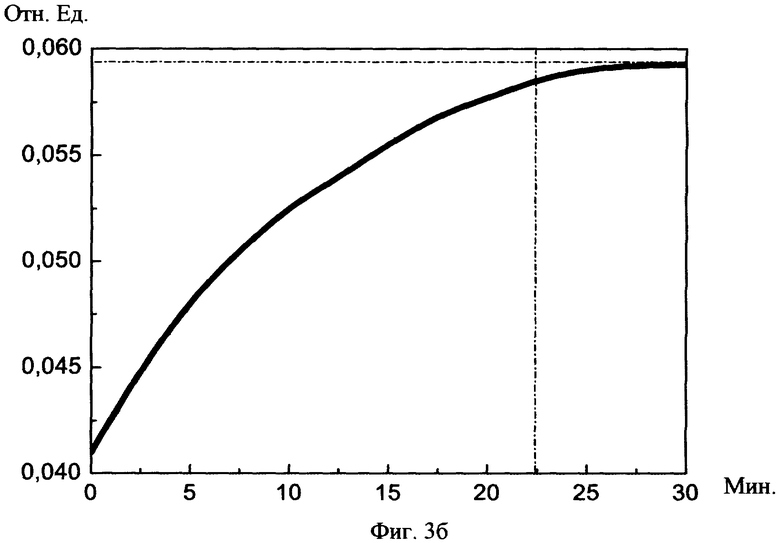
На фиг.3а, б изображены графики увеличения реографического индекса до нормы в зависимости от суммарного среднего потока световой мощности и суммарной длительности сеансов соотвественно.
При изучении исследовательских данных учитывали: 1) реографический индекс РИ (норма 0,07-0,09), 2) показатель тонического напряжения сосудов ПТН (норма 15-18%), 3) индекс периферической резистентности сосудов ИПР (норма 70-80%).
Таким образом, доказано значительное повышение эффективности заживления пораженных тканей за счет фотостимулирования биохимических реакций вследствие совпадения частоты терагерцового излучения с резонансными частотами колебаний межклеточных (и внутриклеточных мембран) и белковых молекул, что, в свою очередь, обеспечивает вывод пораженных клеток из организма с увеличенным кровотоком. Применение предложенного способа лечения приводило не только к ускорению заживления пораженных тканей, но и отсутствию осложнений в виде воспалительного процесса и связанных с ним сосудистых расстройств.
Панель для лечения и регенерации тканей
Изобретение относится к медицине и медицинской технике. Может применяться в качестве устройства для существенного ускорения передачи энергии за счет увеличения площади воздействия на пораженные ткани при кризисных ситуациях, когда необходимо существенно увеличить поверхность заживления (при поражении на больших площадях) при том же времени воздействия на больного и достижении быстрого заживляющего эффекта. В противном случае, длительный болевой шок может вызвать необратимые процессы в виде комы. В частности, данное устройство можно использовать при шоковой терапии.
Известно изобретение «Аппарат для воздействия на биологические объекты электромагнитным полем в квч-частотном диапазоне», патент RD №2032430, опубл. 04.10.1995, МПК A61N 5/02, включающий n источников, фиксированных по частоте электромагнитных излучений с возможностью модуляции по частоте и работы в непрерывном режиме, при этом 2<n<5. Каждый из n источников выполнен с возможностью пространственного расположения. КВЧ диапазон излучения обеспечивает резонанс по части спектра резонансной частоты клеток. Однако не обеспечивает резонанса или совпадения с характеристическими частотами по всему диапазону колебательных процессов внутри клетки, что может привести к осложнениям. Кроме того, в предлагаемом устройстве каждый излучатель настроен дискретно на свою частоту и устройство в целом не обеспечивает нужного диапазона частот излучения на большой площади поражения. Кроме того, устройство не обеспечивает множества источников возбуждения в биотканях, а следовательно, не приводит к взрывному эффекту диффузионных процессов в клетках.
Наиболее близким к предложенному техническому решению является изобретение «Устройство для физиотерапевтического лечения», патент RU №2238773, опубл. 27.10.2004, МПК A61N 5/02, состоящее из источника питания, М источников электромагнитных колебаний, М - модуляторов, усилителя мощности. Каждый источник электромагнитных колебаний выполнен в виде автогенераторов, каждый из которых настроен на свою несущую частоту, выбираемую в диапазоне 100-1000 кГц. Однако источники не обеспечивают терагерцовую частоту излучения. Кроме того, за счет того, что каждый излучатель настроен дискретно на свою частоту, устройство не обеспечивает нужного диапазона частот излучения, которые бы гарантированно обеспечивали резонанс или совпадения с характеристическими частотами по всему диапазону колебательных процессов внутри клеток на всей пораженной площади. Кроме того, устройство не обеспечивает множества источников возбуждения в биотканях, что не приводит к взрывному эффекту диффузионных процессов в клетках.
Известно, что весь спектр частот колебания отдельных частей клетки, например внутренних и наружных мембран клетки, а также белковых молекул, характеризуется своим диапазоном резонансных частот. При этом резонансные частоты частей клетки значительно отличаются друг от друга по величине этих частот. Однако невозможно перенести необходимое количество энергии требуемого диапазона внутрь пораженных тканей, поскольку терагерцовое излучение обладает малой проницаемостью.
Данное обстоятельство приводит к тому, что требуются широкие диапазоны частот облучения при их значительной глубине проникновения вглубь тканей. В противном случае требуемого эффекта заживления в глубине пораженных тканей не достичь, так как не будет достигнут перенос внутрь пораженной ткани биологически корректного количества энергии, которое ускорит реакцию основного переноса белков между клеточными мембранами во внутри- и межклеточном пространстве. Если же значительно увеличивать суммарный средний поток световой мощности облучения, тогда возможно еще большее поражение наружных слоев ткани. При этом процесс усложняется большой площадью поражения. В тяжелых случаях, когда поражены обширные и глубокие участки ткани, невозможно достичь требуемого эффекта заживления с помощью одного источника терагерцового излучения, в качестве несущей которого выступает излучение инфракрасного диапазона длин волн.
При кризисных ситуациях, когда необходимо сохранить время воздействия на больного излучением, но при этом достичь заживляющего эффекта за промежуток времени, не больший, чем этот эффект достигается при малых площадях поражения тканей, т.е. достичь взрывного характера диффузионных процессов внутри клеток и межклеточном пространстве, которые ответственны за транспорт белков, требуется использовать множество источников возбуждения клеток. Невозможно просто увеличить суммарный средний поток световой мощности одиночного источника излучения, т.к. при значительном увеличении потока световой мощности, в приповерхностных тканях будут разрушаться мембраны как пораженных клеток, так и здоровых. Кроме того, поскольку ИК излучение не достигнет глубоких слоев пораженных тканей на всей площади, это также уменьшит лечебный эффект за счет невозможности стимулировать основные биохимические реакции на всей площади пораженных тканей.
Чем обширнее пораженный участок, тем больший диапазон разброса собственных "характеристических частот" в каждой клетке. Поэтому при воздействии одиночным источником излучения существенно снижается вероятность быстрого возбуждения каждой клетки за счет биологически корректной добавки терагерцового излучения, поскольку снижается вероятность быстрого попадания в резонанс с характеристическими частотами клеток на всей пораженной площади. В кризисном случае, когда требуется достичь не только эффективного заживления, но и нельзя растягивать процесс заживления на существенно долее долгий период времени, воздействуют терагерцовым излучением, в качестве несущей которого выступает излучение инфракрасного диапазона длин волн, из множества источников излучения.
При этом все источники излучения должны быть настроены таким образом, чтобы суммарный средний световой поток всех источников излучения не превышал бы допустимую величину, определяемую количеством биологически корректной добавки энергии пораженным тканям. Для достижения требуемого взрывного эффекта заживления необходимо как быстро стимулировать биохимические реакции организма, так и быстрый вывод из зоны поражения разрушенных мембран пораженных клеток за счет ускоренного кровотока. В особенности вышесказанное относится к экстренному случаю, когда жизни больного угрожает опасность и требуется существенно ускорить перенос энергии по всему организму. В этом случае, без одновременного переноса энергии из множества источников возбуждения, требуемого взрывного эффекта заживления не достичь. Существует еще не до конца изученный механизм накопления и переноса энергии клетками. Однако известно, что при одновременном воздействии несколькими источниками излучения возникает солитонный эффект транспорта белков, который ответственен за эффект заживления. Постоянная величина биологической скорости передачи энергии от клетки к клетке и механизм ее передачи не позволяют добиться быстрого заживления только с помощью одного источника излучения.
Таким образом, техническим результатом является увеличение эффективности заживления пораженных биотканей путем облучения в терагерцовом диапазоне путем достижения на большой площади множества источников возбуждения клеток во всем диапазоне характеристических частот клеточных мембран, а также нелинейный эффект интенсификации регенеративных воздействий.
Заявленный технический результат достигается с помощью следующего устройства. Панель для лечения и регенерации тканей состоит из n излучателей в виде кремниевых светодиодов с терагерцовым излучением в диапазоне от 0,02 до 8 ТГц, в качестве несущей которого выступает инфракрасное излучение от 1 до 56 мкм, максимальный суммарный средний поток световой мощности которых рассчитывают исходя из медицинских показаний. Причем размеры панели определены исходя из требуемой площади облучения, обеспечивающей при одновременном включении светодиодов нелинейный эффект интенсификации регенеративных воздействий, а количество размещенных на ней светодиодов рассчитано в зависимости от величины угловой апертуры излучателей. В частности, количество излучателей рассчитывают при суммарном среднем потоке световой мощности не более 300 мВт/м2. Размеры активной зоны панели составляют исходя из площади пораженного участка, а также мощности и апертуры одиночного источника излучения. Панель выполнена из нескольких частей, объединяющих источники излучения в блоки с равномерным шагом между ними. Кроме того, светодиоды могут включаться как блоками, так и в определенном порядке, что может быть обусловлено, например, труднодоступным для облучения участком тела.
Максимальное число излучателей рассчитывают исходя из медицинских показаний, размеры панели определены исходя из требуемой площади облучения, количество размещенных на ней светодиодов рассчитывают в зависимости от размеров и глубины поражения тканей. При одновременном включении светодиодов нелинейный эффект интенсификации регенеративных воздействий обеспечивает как антишоковое влияние, так и эффективное заживление на больших площадях пораженных тканей без существенного увеличения времени заживления.
В частном случае, например, количество излучателей составляет 108, размеры панели составляют по ширине и длине, например, 0,6×1,8 м2, а шаг между светодиодами - 10 см.
При этом при клинических испытаниях использовали излучатели мощностью 0,3 Вт/м2.
Суммарный средний поток световой мощности составлял 300 мВт/м2.
На чертежах изображены:
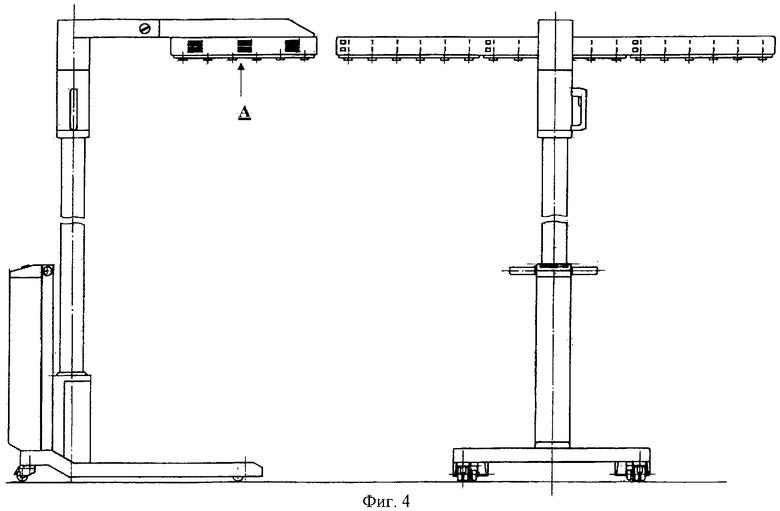
на фиг.4 - панель, закрепленная на штативе, позволяющем регулировать высоту над облучаемой поверхностью, вид сбоку и вид сзади;
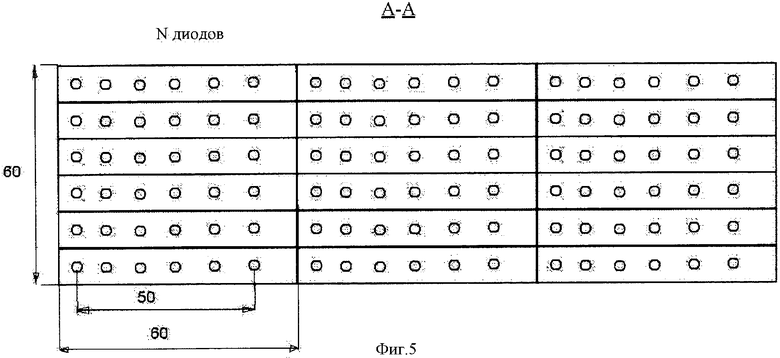
на фиг.5 - вид снизу на панель, состоящую из трех блоков излучателей, объединенных по 36 светодиодов в каждом блоке.
Устройство работает следующим образом.
На панели размещаются светодиоды с заданными характеристиками излучения. В случае ожогов большой площади размеры излучающей части панели определяются размерами и положением пораженных участков. Например, включают все три блока излучателей или выборочно по всем трем блокам панели. Вторым фактором, который определяет количество и распределение включенных источников излучения на панели, является время распространения и время перехода возбуждения от источника излучения до клеток всего организма. В зависимости от высоты облучения и геометрии поверхности подбирают суммарный средний поток световой мощности от всех включенных источников излучения, который не должен превышать максимально допустимый световой поток исходя из биологических показаний. Кроме того, для достижения нелинейного эффекта интенсификации регенеративных воздействий подбирают необходимую плотность излучения на 1 см2 поверхности тканей.
Поскольку биологическая скорость накапливания и передачи энергии от клетки к клетке не может быть больше чем при облучении одиночным источником облучения, необходимо стимулирование основных биохимических реакций сразу в нескольких местах. Тогда существенно повышается вероятность попадания терагерцового излучения в резонанс с характеристическими частотами клеток, а также достигается взрывной эффект стимулирования этих реакций. Так при кризисных ситуациях, угрожающих жизни больного от болевого шока, такое воздействие может обеспечить заживление обширных площадей пораженных тканей за 10 сеансов, т.е. не дольше, чем при небольших по площади поражениях. Благодаря этому уменьшается риск для жизни больного.
Поскольку площадь облучения от одного источника излучения известна, в зависимости от высоты расположения источника излучения, рассчитывают угловую апертуру, суммарный средний поток световой мощности и геометрию включения светодиодов.
Клинические испытания показали.
Пример 3. Пациентка с диагнозом множественные ожоги 1-ой и 2-ой степени нижней части живота и обеих ног в возрасте 39 лет. Облучению электромагнитным излучением с частотой 0,025 ТГц подвергалась вся нижняя часть тела. В качестве несущей использовалось инфракрасное излучение с длиной волны 1-56 мкм. Облучение проводилось по одному сеансу в день, длительностью 22,5 мин, в течение 10 дней. До начала лечения реографические показатели составляли РИ=0,05; ПТН=21; ИПР=90. После проведения лечения реографические показатели составляли РИ=0,10; ПТН=16; ИПР=78.
Пример 4. Пациент с диагнозом множественные ожоги 2-ой степени спины и правой ноги в возрасте 43 лет. Облучению электромагнитным излучением с частотой 1,2 ТГц подвергались все пораженные области одновременно. В качестве несущей использовалось инфракрасное излучение с длиной волны 1-56 мкм. Облучение проводилось по одному сеансу в день, длительностью 22,5 мин, в течение 10 дней. До начала лечения реографические показатели составляли РИ=0,03; ПТН=22; ИПР=89. После проведения лечения реографические показатели составляли РИ=0,07; ПТН=17; ИПР=79.
Таким образом, наблюдение за больными с обширными площадями поражения показало, что при облучении сразу несколькими источниками излучения, суммарный средний поток световой мощности которых был такой же, что и суммарный средний поток световой мощности одиночного источника излучения, приводил к заживлению за такое же время, что и заживление небольшого пораженного участка тканей при облучении одиночным источником излучения. Этот эффект объясняется увеличением эффективности заживления пораженных тканей путем облучения в терагерцовом диапазоне множества источников возбуждения клеток во всем диапазоне характеристических частот частей клеток и нелинейный эффект интенсификации регенеративных воздействий.
Излучатель для лечения и регенерации тканей.
Изобретение относится к полупроводниковым приборам, предназначенным для излучения света, а именно к светодиодам, содержащим р-n-переход в качестве основного источника излучения. Может быть использовано в медицинской технике для реализации способа стимулирования основных биохимических реакций организма для лечения и регенерации тканей.
Известно изобретение «Устройство для микроволновой терапии», патент RU 2134597, опубл. 20.08.1999, МПК A61N 5/00 A61N 5/02, содержащее генератор излучения, усилитель тока, размещенные в металлическом стакане с крышкой, в качестве диэлектрической перегородки, выполняющего роль экрана, при этом генератор излучения выполнен с частотой 2,5+0,1 ГГц, а цифровой генератор шума - в диапазоне частот 0,2-3,0 Гц. Устройство содержит аналог микрорезонатора, позволяет использовать как низкую частоту излучения, так и высокочастотное излучение. Однако предложена сложная конструкция, не использующая квантоворазмерные гетероструктуры.
Известно изобретение «Сине-зеленый лазерный диод», патент RU №2127478, опубл. 03.10.1999, МПК H01S 3/19, содержащий множество слоев полупроводника II-VI групп, образующих р-n-переход, при этом, например, на полупроводниковой подложке n-типа проводимости последовательно выполнены слои: буфферный слой n-типа, нижний контактный слой n-типа, слой нижней оболочки n-типа, первый световодный слой n-типа, активный слой с квантовой ямой, второй световодный слой р-типа, слой верхней оболочки р-типа и верхний контактный слой р-типа. Техническим результатом изобретения является создание лазерного диода, излучающего свет в области спектра в интервале длин волн 430-590 нм. Однако не достигается выхода высококачественного излучения, отсутствует инфракрасная несущая.
Известно изобретение «Полупроводниковый усилитель света», патент RU №2062543, опубл. 20.06.1996, МПК H01S 3/18, выполненный на основе гетероструктуры с квантово0размерными слоями разной толщины, размещенными между парами электродов для подачи напряжения смещения, гетероструктура выполнена в виде набора чередующихся или группированных произвольным образом квантоворазмерных слоев разной толщины. Однако отсутствует высокочастотная составляющая излучения.
Известно изобретение «Полупроводниковый электролюминесцентный источник света», патент RU №2233013, опубл. 20.07.2004, МПК H01L 33/00, включающий полупроводниковый кристалл со сформированным в нем р-n-переходом, генерирующий световой поток при приложении прямого смещения, содержит объемные или квантоворазмерные гетероструктуры и/или гетероструктуры с квантовыми ямами, квантовыми нитями, квантовыми точками. Излучатель обеспечивает излучение в сине-фиолетовой области спектра при повышенной светоотдаче. Однако не обеспечивает получение всего спектра частот излучения от низкочастотных до высокочастотных.
Известно изобретение «Полупроводниковый электролюминесцентный источник света», заявка RU №2002105900, опубл. 20.11.2003, МПК H01L 33/00, включающий полупроводниковый кристалл со сформированным в нем р-n-переходом, генерирующий световой поток при приложении прямого смещения, и люминесцентную область, частично поглощающую излучение кристалла и преобразующую его в излучение с большей доминирующей длиной волны. Кристалл содержит объемные или квантоворазмерные гетероструктуры с активной областью, заключенной между широкозонными эмиттерами, и/или гетероструктуры с квантовыми ямами, квантовыми нитями, квантовыми точками. В изобретении используют полимерную матрицу для обеспечения излучения в сине-фиолетовой области спектра при повышенной светоотдаче. Однако имеет слишком сложную технологию изготовления. Однако данное средство не является средством того же назначения, что и заявляемое изобретение.
Наиболее близким к предлагаемому техническому решению является изобретение «Устройство для электромагнитной терапии», патент RU 2209097, опубл. 27.07.2003 г., содержащее источник питания, включающее некогерентный инфракрасный излучатель с длиной волны 1-56 мкм, однако излучатель не обеспечивает резонанса или совпадения с характеристическими частотами по всему диапазону колебательных процессов внутри клетки, что может привести к осложнениям.
Необходимо получить терагерцовое излучение в диапазоне от 0,02 до 8 ТГц, в качестве несущей которого выступает инфракрасное излучение от 1 до 56 мкм.
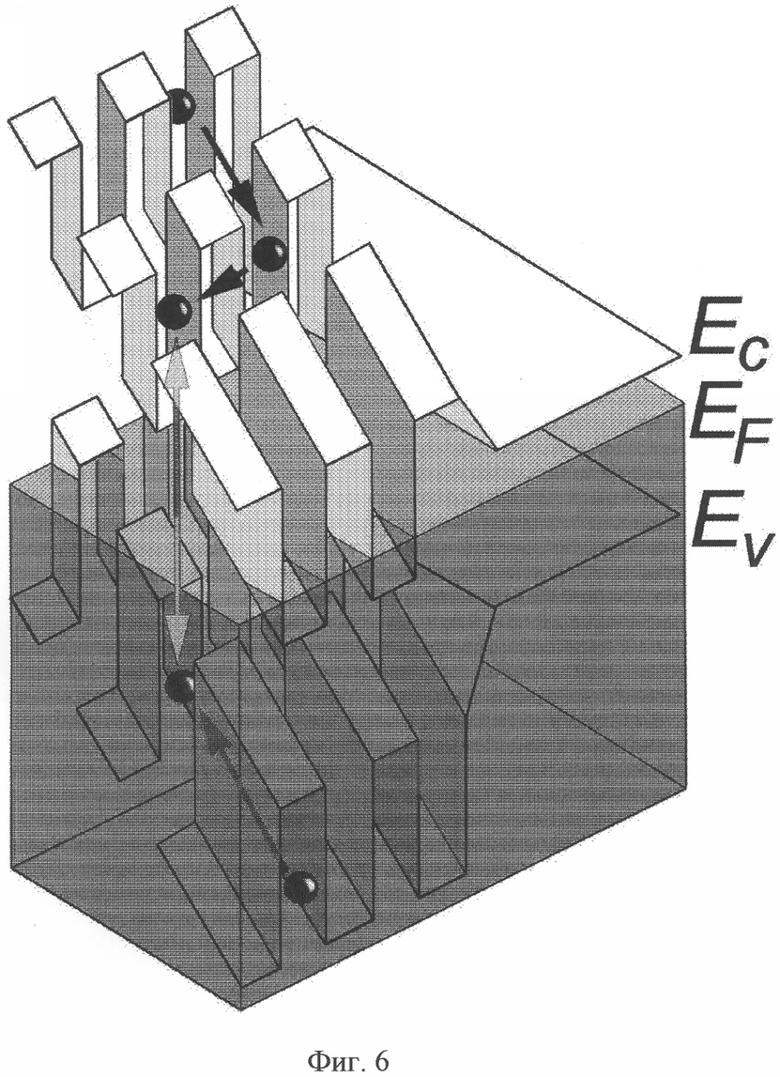
Поставленная задача решается с помощью планарных кремниевых структур, которые представляют собой каскад продольных самоупорядоченных кремниевых квантовых ям (СКЯ) р-типа проводимости, сформированных между δ-барьерами, которые являются двумерными сегнетоэлектриками (фиг.6).
Для достижения технического результата предложен излучатель для лечения и регенерации тканей, содержащий источник терагерцового излучения, в виде полупроводникового кремниевого светодиода, генерирующего посредством излучающих матриц планарных кремниевых структур инфракрасное излучение, являющееся несущей терагерцового излучения.
Причем основой излучающей матрицы выступают кремниевые квантовые ямы р-типа, самоупорядоченные внутри сверхмелких диффузионных профилей бора, полученных на поверхности пластин монокристаллического кремния (100) n-типа проводимости, которые обеспечивают влияние размерного квантования и электрон- электронного взаимодействия на характеристики транспорта одиночных носителей тока. Пластины выбирают, например, толщиной 350 мкм с различной концентрацией мелких доноров фосфора. Излучающим элементом выступает квантоворазмерный р-n-переход, представляющий собой каскад продольных кремниевых СКЯ р-типа проводимости, через который проходит модулированная квантовая проволока, при этом квантоворазмерный р-n-переход находится внутри самоупорядоченного кремниевого микрорезонатора. Частота ТГц-ого излучения обеспечена за счет подбора геометрии топографического изображения поверхности сверхмелких диффузионных профилей бора в кремнии, достигаемая с учетом флуктуации поверхностного деформационного потенциала, которые приводят к формированию самоупорядоченных кремниевых микрорезонаторов с распределенной обратной связью в плоскости самоупорядоченных кремниевых квантовых ям (СКЯ). Геометрические размеры р-области выбирают, например, по формуле Вульфа Брэгга, которая определяет их соответствие с диапазоном частот терагерцового излучения, а глубина модуляции обеспечена за счет величины напряжения, приложенного как вдоль, так и перпендикулярно плоскости диффузионного профиля (фиг.7). Например, модулированная квантовая проволока получена длиной 10 нм и формируется в месте пересечения самоупорядоченных квантовых ям.
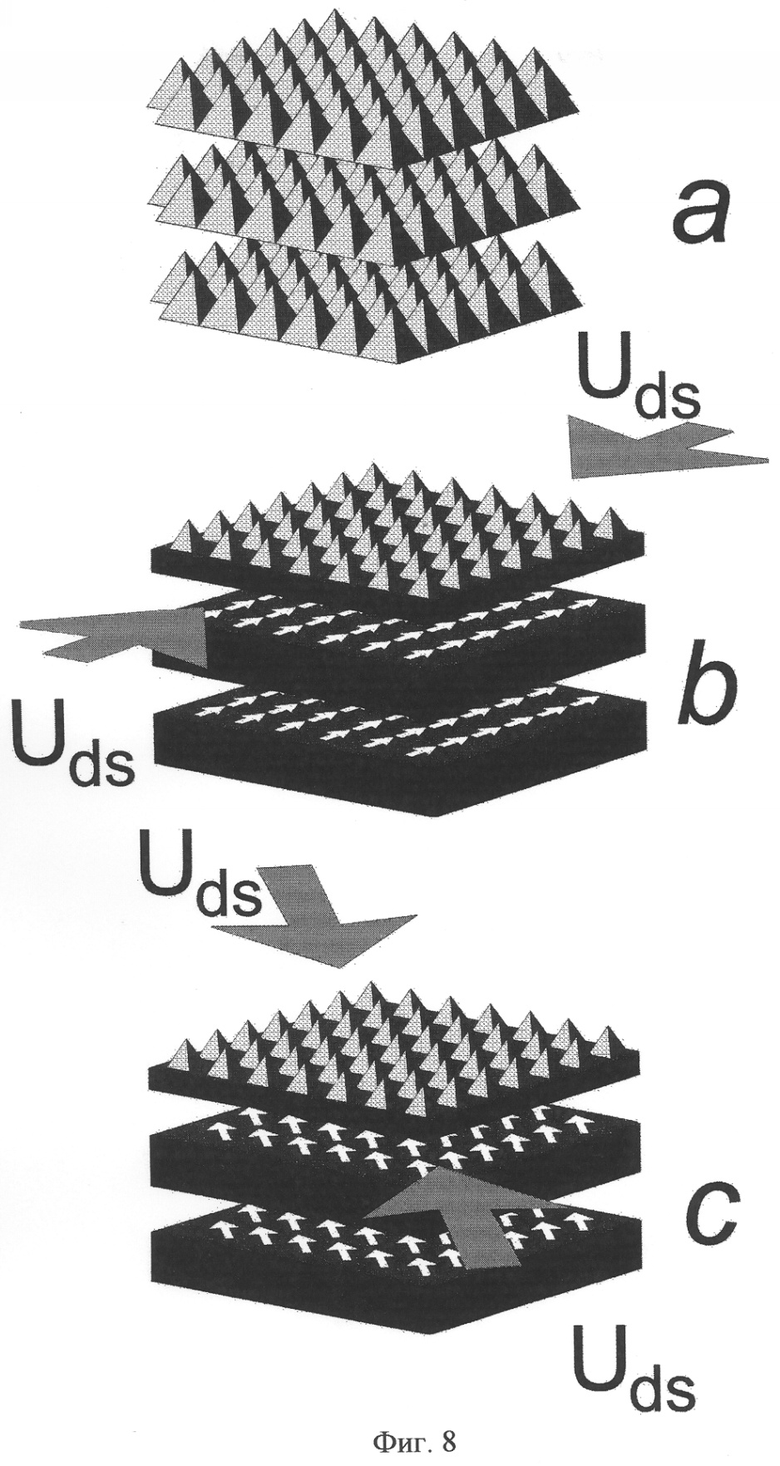
Данные светоизлучающие структуры основаны на сверхмелких р+-диффузионных профилях глубиной, например, 20 нм, которые были получены на поверхности Si(100) n-типа с помощью неравновесной диффузии бора в условиях генерации избыточных потоков собственных дефектов (фиг.8).
Кремниевые излучающие матрицы представляют собой последовательность квантоворазмерных р-n-переходов, полученных в рамках планарной технологии на поверхности пластины монокристаллического кремния. Типы кремниевых излучающих матриц - это дисплейные матрицы видимого и инфракрасного диапазона длин волн. Они состоят из основы, излучающего элемента, самоупорядоченных кремниевых микрорезонаторов.
Основой являются кремниевые квантовые ямы р-типа, самоупорядоченные внутри сверхмелких диффузионных профилей бора, полученных на поверхности пластин монокристаллического кремния (100) n-типа проводимости, которые обеспечивают влияние размерного квантования и электрон- электронного взаимодействия на характеристики транспорта одиночных носителей тока. При этом наличие самоупорядоченных кремниевых квантовых ям внутри сверхмелких диффузионных профилей, локализованных между сильнолегированными δ-барьерами, контролируют путем регистрации угловых зависимостей проводимости и циклотронного резонанса (ЦР) электронов и дырок. Например, при вращении магнитного поля в плоскости, перпендикулярной плоскости диффузионного профиля бора на поверхности кремния (100).
Сильнолегированные δ-барьеры, между которыми сформирована самоупорядоченная квантовая яма (СКЯ), состоят из тригональных примесных диполей B+-В- в кремниевой матрице и демонстрируют свойства как сегнетоэлектриков, металлов, так и сверхпроводников. При этом для получения дисплейных матриц видимого и инфракрасного диапазонов длин волн используют δ-барьеры с сегнетоэлектрическими свойствами. При этом δ-барьеры формируют, например, посредством обменного взаимодействия через мелкие доноры фосфора, располагающиеся вблизи плоскости сверхмелкого диффузионного профиля бора в кремнии (100) n-типа.
Модулированной квантовой проволокой [001] является квазиодномерная структура, полученная вследствие пересечения двух СКЯ. Например, ее получают длиной 5 мкм, с помощью методики расщепленного затвора в плоскости кремниевой квантовой ямы (см. N/T/Bagraev, A/D/Bouravleuv, W/ Gehlhoff, L.E.Klyachkin and A.M.Malyarenko: White light emission from nanostructures embedded in ultra-shallow silicon p-n junction, Proc., of the 26th International Conference on the Physics of Semiconductors (ICPS - 26), Edinburgh.U.K., Physics of Semiconductors 2002, ed. By A.R.Long and J.H.Davies, Inst. of Psysics, Conference series. No 171, G3.3, 2002).
В качестве излучающего элемента используют квантоворазмерный p-n-переход, представляющий собой каскад продольных кремниевых СКЯ р-типа проводимости, через который проходит модулированная квантовая проволока. При этом квантоворазмерный р-n-переход находится внутри самоупорядоченного кремниевого микрорезонатора.
В качестве квантовой точки используют нуль-мерные системы (заряженные или пустые), которые могут быть получены при полном ограничении движения носителей тока как в квантовых проволоках и ямах, так и в объемных кристаллах. Они могут быть получены электростатически, с помощью нанесенных металлических микроконтактов и вследствие ограничения движения носителей тока в квантовых ямах, а также в процессе получения наноструктур (в нашем случае). При этом режим кулоновской блокады характеризуется возникновением периодических кулоновских пиков, которые являются результатом одноэлектронной перезарядки квантовой точки. Кулоновское поле в квантовых точках может обладать произвольной симметрией и быть непрерывным с точки зрения элементарного заряда. Заполнение соответствующих оболочек квантовых точек зависит, в первую очередь, от таких факторов, как электрон-электронное взаимодействие и спин электрона.
В качестве самоупорядоченного кремниевого микрорезонатора используют кремниевые микрорезонаторы с распределенной обратной связью в плоскости самоупорядоченных кремниевых квантовых ям (СКЯ) для усиления излучения, которое обусловлено межзонными и внутризонными переходами между подуровнями размерного квантования. Например, микрорезонаторы могут быть сформированы при введении микродефектов в плоскость СКЯ. Их геометрия задается топографическим изображением поверхности сверхмелких диффузионных профилей бора в кремнии и варьируется вследствие флуктуации поверхностного деформационного потенциала за счет фрактального механизма формирования самоупорядоченных нуль-мерных систем. Получение самоупорядоченных микродефектов, встроенных в систему кремниевых квантовых ям, делает возможным создание микрорезонаторов с распределенной обратной связью, характеристики которых идентифицируются с помощью спектральных зависимостей коэффициентов отражения и пропускания в видимом и инфракрасном диапазонах длин волн. Самоупорядоченные микрорезонаторы существенно снижают коэффициент отражения света в коротковолновой области спектра излучения, которое возникает вследствие прямых межзонных переходов в продольных СКЯ (d˜2 нм), сформированных в плоскости сверхмелкого р+-диффузионного профиля. Микрорезонаторы, самоорганизующиеся между самоупорядоченными микродефектами средних размеров, наиболее сильно снижает R(λ) в коротковолновой области спектра (200÷330 нм), в то время как присутствие более крупных микродефектов способствует эффективному отражению света в более длинноволновой области (λ>330 нм). Спектральная зависимость излучения и его усиление и размеры микрорезонатора взаимосвязаны в рамках соотношения Вульфа-Брэгга: Х=λ/2n, где Х - размер микрорезонатора, λ - длина волны, n - коэффициент преломления света в кремнии.
Таким образом, кремниевая излучающая матрица - это последовательность излучающих элементов, каждый из которых находится внутри кремниевого микрорезонатора.
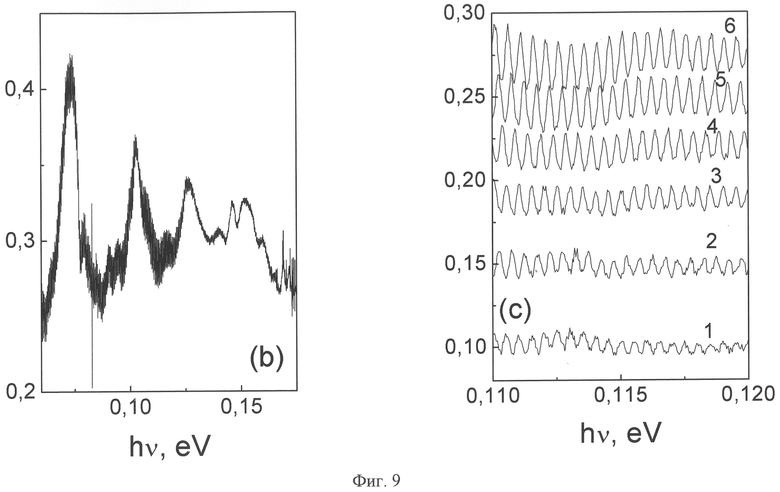
Высокочастотную модуляцию инфракрасного (ИК) излучения получают в виде излучения, индуцированного внутризонными дырочными переходами в самоупорядоченной квантовой яме (СКЯ) р-типа, полученной на поверхности Si(100) n-типа в условиях неравновесной диффузии бора (фиг.9). Спектральная зависимость электролюминесценции вследствие излучательных переходов между подуровнями тяжелых и легких дырок проявляет терагерцовую модуляцию. Спектры электролюминесценции СКЯ с высокой подвижностью дырок, возникающие вследствие излучательных переходов между подуровнями тяжелых и легких дырок, демонстрируют терагерцовую и гигагерцовую модуляцию, обусловленную излучением тригональных дипольных центров бора, В+-В-, которые составляют основу δ-барьеров, ограничивающих квантовую яму. Глубина модуляции увеличивается при введении в плоскость СКЯ микрорезонаторов в соответствии с соотношением Вульфа-Брэгга: X=λ/2n, где Х - размер микрорезонатора, λ - длина волны, n - коэффициент преломления света в кремнии. Модуляции, генерируемые дипольными центрами бора в гигагерцовом и терагерцовом диапазоне от 0,02 до 8 ТГц, позволяют использовать в качестве брэгговского отражателя границу р+-области.
Таким образом, одиночная квантовая яма на поверхности монокристаллического кремния является мощным генератором терагерцового и гигагерцового излучения, источником которого являются ее границы, тогда как в качестве его несущей выступает инфракрасное излучение, индуцированное внутризонными дырочными переходами. Этим достигается технический результат заявленного изобретения.
На чертежах пояснены зависимости частотных спектров излучения при предложенной структуре светодиода.
На фиг.6 изображена планарная кремниевая структура, представляющая каскад продольных самоупорядоченных квантовых ям р-типа проводимости, сформированных между δ-барьерами, на поверхности кремния n-типа проводимости.
На фиг.7 изображена схема получения СКЯ на поверхности кремния (100) n-типа в условиях инжекции собственных междоузельных атомов кремния (белые кружки) и вакансий (черные кружки) в процессе предварительного окисления (а, b) и последующей диффузии бора (с):
а - избыточные потоки собственных междоузельных атомов кремния и вакансий, которые генерируются в процессе предварительного окисления поверхности кремния (100) и кристаллографически, ориентированны соответственно вдоль осей [111] и [100].
b - схема продольных СКЯ, которые возникают между слоями микродефектов, формирующихся на стадии предварительного окисления поверхности кремния (100) из собственных междоузельных атомов кремния и вакансий.
с - схема продольных СКЯ после последующей пассивации микродефектов в условиях кратковременной диффузии бора по вакансионному механизму (темные области) в рамках планарной кремниевой технологии.
Размеры области р-типа проводимости (продольные размеры диффузионного профиля) определяют частоту терагерцового излучения в соответствии с формулой Вульфа-Брэгга.
На фиг.8 показано трехмерное изображение продольных СКЯ, сформированных между слоями микродефектов (а), которые трансформируются в нейтральные δ-барьеры после пассивации в условиях кратковременной диффузии бора по вакансионному механизму ((b), (с)). Белые стрелки показывают направление упорядочения примесных диполей бора внутри δ-барьеров в условиях напряжения исток-сток, приложенного вдоль кристаллографических осей [001] (b) и [011] (с).
На фиг.9 показаны спектральные интервалы, демонстрирующие терагерцовую (b) и гигагерцовую (с) модуляцию инфракрасного излучения СКЯ (для регистрации при Т=300 К использовался ИК-Фурье спектрометр IFS-115). Плотность тока, А/см2: 1 - 50; 2 - 62.5; 3 - 75; 4 - 87.5; 5 - 100; 6 - 112.5.
Таким образом, достигается терагерцовое излучение в диапазоне от 0,02 до 8 ТГц, в качестве несущей которого выступает инфракрасное излучение от 1 до 56 мкм.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ НЕКОГЕРЕНТНЫМ ИЗЛУЧЕНИЕМ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ ТКАНЕЙ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1996 |
|
RU2193424C2 |
| Широкополосный излучатель инфракрасного и терагерцевого диапазонов длин волн | 2020 |
|
RU2739541C1 |
| Способ восстановления механических повреждений роговицы глаза в эксперименте на кроликах | 2022 |
|
RU2809828C1 |
| ФОТОЧУВСТВИТЕЛЬНАЯ СТРУКТУРА И СЕЛЕКТИВНОЕ ФОТОПРИЕМНОЕ УСТРОЙСТВО НА ЕЕ ОСНОВЕ | 2012 |
|
RU2510101C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЭЛЕКТРОМАГНИТНОГО ИЗЛУЧЕНИЯ ГИГА- И ТЕРАГЕРЦОВОГО ДИАПАЗОНА ЧАСТОТ | 2013 |
|
RU2546052C1 |
| Детектор электромагнитного излучения | 2023 |
|
RU2816104C1 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ ИШЕМИЧЕСКИМ ИНСУЛЬТОМ В РАННЕМ ПЕРИОДЕ ЗАБОЛЕВАНИЯ | 2020 |
|
RU2742746C1 |
| ЧАСТОТНО-ПЕРЕСТРАИВАЕМЫЙ ИСТОЧНИК КОГЕРЕНТНОГО ИЗЛУЧЕНИЯ ДАЛЬНЕГО ИНФРАКРАСНОГО И ТЕРАГЕРЦОВОГО ДИАПАЗОНА НА ПОЛУПРОВОДНИКОВОЙ НАНОГЕТЕРОСТРУКТУРЕ | 2011 |
|
RU2478243C1 |
| СПОСОБ ЛЕЧЕНИЯ ПАРОДОНТИТА | 2005 |
|
RU2286815C2 |
| Способ усиления мощности радиочастотно-модулированного терагерцового излучения 30-периодной слабосвязанной полупроводниковой сверхрешетки GaAs/AlGaAs | 2014 |
|
RU2617179C2 |

Изобретение относится к медицине и может быть применено при лечении болезней, при которых имеют место нарушения энергетического обмена в клетках. Способ стимулирования биохимических реакций организма для лечения и регенерации тканей заключается в облучении участков кожи терагерцовым излучением в диапазоне от 0,02 до 8 ТГц, в качестве несущей которого выступает инфракрасное излучение от 1 до 56 мкм. Панель для лечения и регенерации тканей включает n излучателей в виде кремниевых светодиодов, при этом суммарный средний поток световой мощности излучателей составляет не более 300 мВт/м2. Излучатель для лечения и регенерации тканей содержит источник терагерцового излучения в виде полупроводникового кремниевого светодиода, генерирующего посредством излучающих матриц планарных кремниевых структур инфракрасное излучение, при этом основой излучающей матрицы выступают кремниевые квантовые ямы р-типа, самоупорядоченные внутри сверхмелких диффузионных профилей бора, полученных на поверхности пластин монокристаллического кремния (100) n-типа проводимости, а излучающим элементом выступает квантоворазмерный р-n-переход, представляющий собой каскад продольных кремниевых самоупорядоченных квантовых ям р-типа, через который проходит модулированная квантовая проволока. Квантоворазмерный р-n-переход находится внутри самоупорядоченного кремниевого микрорезонатора, а частота терагерцового излучения обеспечена за счет подбора геометрии топографического изображения поверхности сверхмелких диффузионных профилей бора в кремнии с учетом флуктуации поверхностного деформационного потенциала, которые приводят к формированию самоупорядоченных кремниевых микрорезонаторов с распределенной обратной связью в плоскости самоупорядоченных квантовых ям. Глубина модуляции обеспечена за счет величины напряжения, приложенного как вдоль, так и перпендикулярно плоскости диффузионного профиля. Использование изобретения позволяет увеличить эффективность заживления пораженных биотканей. 3 н. и 3 з.п. ф-лы, 12 ил.
| СПОСОБ ВОЛНОВОЙ ТЕРАПИИ | 2000 |
|
RU2229906C2 |
| СПОСОБ ЛЕЧЕНИЯ НЕКОГЕРЕНТНЫМ ИЗЛУЧЕНИЕМ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ ТКАНЕЙ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1996 |
|
RU2193424C2 |
| RU 93026037 A, 20.11.1995 | |||
| УСТРОЙСТВО ДЛЯ ЭЛЕКТРОМАГНИТНОЙ ТЕРАПИИ | 2002 |
|
RU2209097C1 |
| US 2004108468 A, 10.06.2004 | |||
| SMYE SW et al | |||
| The interaction between Terahertz radiation and biological tissue | |||
| Phys Med Biol, 2001 Sep; 46(9): R101-12 | |||
| ZHAO G et al | |||
| A terahertz system using semi-large emitters: noise and performance characteristics | |||
| Phys Med Biol., 2002 Nov 7; 47(21); 3699-704. | |||
Авторы
Даты
2008-01-20—Публикация
2005-07-20—Подача