Изобретение относится к медицине и может быть использовано в различных областях восстановительной хирургии для изготовления биологических трансплантатов с высокими биопластическими качествами.
Известен способ заготовки биологических тканей в гельсодержащей стерилизующей среде, состоящей из консервирующего раствора, например №9 ЦОЛИПК, геля (1% агар или 9% желатин) и антисептиков: неомицина, полимиксина, пипольфена или формалина [1, 2].
К недостаткам способа следует отнести сложность состава и приготовления консерванта, а также недостаточную надежность антисептического комплекса по отношению к грибкам и плесени. Использованные в среде антибиотики и пипольфен к настоящему времени утратили свое значение, их выпуск в стране практически прекращен. Замена антисептического комплекса 0,5% раствором формалина также оказалась не совсем удачной, поскольку формалин в такой концентрации слишком сильно фиксирует биологические препараты, снижая их полезные качества.
Более приемлемым для практики оказалось применение в составе геля более слабых, 0,1% и 0,25% концентраций формалина [3]. Однако данный способ, он же прототип, обеспечивая достаточно надежный консервирующий эффект, не всегда гарантировал стерильность заготавливаемых трансплантатов, что потребовало разработки комбинированного использования формалина с другими антисептиками, усиливающими его бактерицидные свойства. Из агентов-усилителей наиболее эффективной оказалась комбинация 0,25% формалина с 0,05% канамицином. Правда, и здесь формалин не утратил своих нежелательных фиксирующих свойств, что подтверждалось в эксперименте на животных, у которых по сравнению с контролем удлинялись сроки остеоиндуктивного ответа на пересадку деминерализованного костного матрикса.
Техническим исходом изобретения в отличие от прототипа является исключение из среды формалина и канамицина и включение в нее меда и сульфосалициловой кислоты, при следующем соотношении использованных компонентов (г): желатин - 5,0; агар - 0,5; мед - 10,0; сульфосалициловая кислота - 0,7; вода дистиллированная - 90,0.
1) В таблицах показаны:
Таблица 1 - результаты стерилизации биотрансплантатов растворами сульфосалициловой кислоты, где «+» это рост микрофлоры, «-» отсутствие роста.
Таблица 2 - результаты эктопической пересадки крысам деминерализованных костных трансплантатов через 3 месяца после операции, где положительный результат - полное замещение трансплантатов новообразованной костной тканью, а отрицательный - отсутствие замещения.
Таблица 3 - результаты ортотопической пересадки кроликам деминерализованных костных трансплантатов через 2 месяца после операции, где положительный результат - полное замещение дефекта лучевой кости новообразованной костной тканью, а отрицательный - отсутствие или частичное (неполное) замещение.
2) На фигурах изображены:
Фиг.1 - костный трансплантат, консервированный в предлагаемой гельсодержащей среде.
Фиг.2 - сухожильный трансплантат, консервированный в предлагаемой гельсодержащей среде.
Фиг.3 - рентгенограмма области эктопической внутримышечной пересадки стерилизованного трансплантата. Видна слабая тень трансплантата. Срок 2 недели.
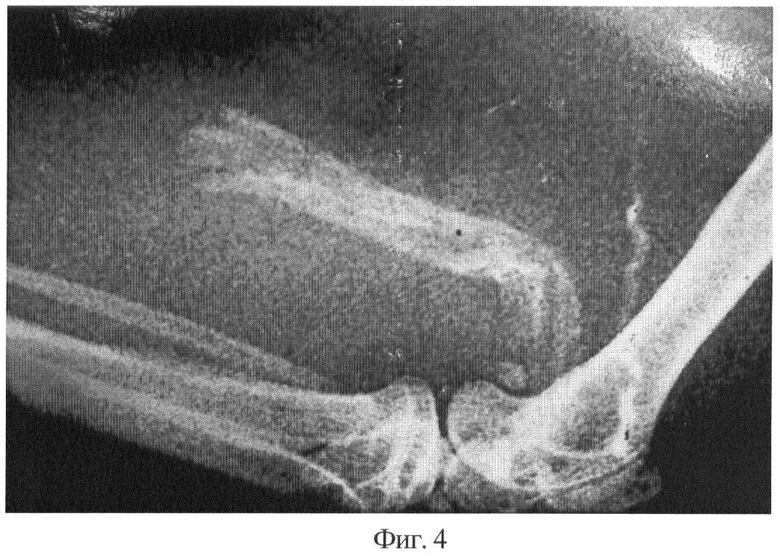
Фиг.4 - рентгенограмма области эктопической внутримышечной пересадки стерилизованного трансплантата. На его месте виден новообразованный компактный костный регенерат с четкими контурами. Срок 3 месяца.
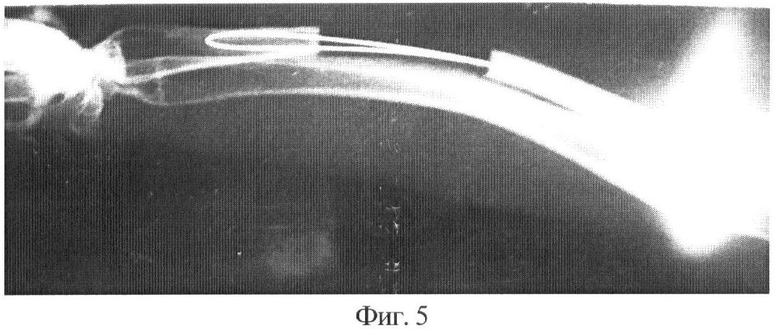
Фиг.5 - дефект лучевой кости кролика через 2 недели после ортотопической пересадки фрагмента деминерализованной кости. Трансплантат не виден, он рентгенонегативен.
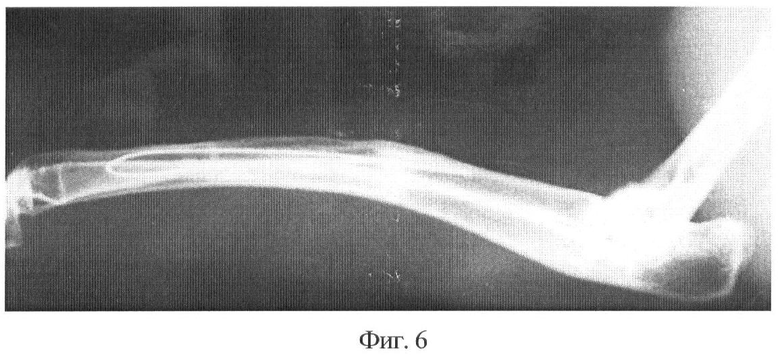
Фиг.6 - полное замещение дефекта лучевой кости кролика через 3 месяца после применения деминерализованного трансплантата, заготовленного предлагаемым способом. Рентгенограмма.
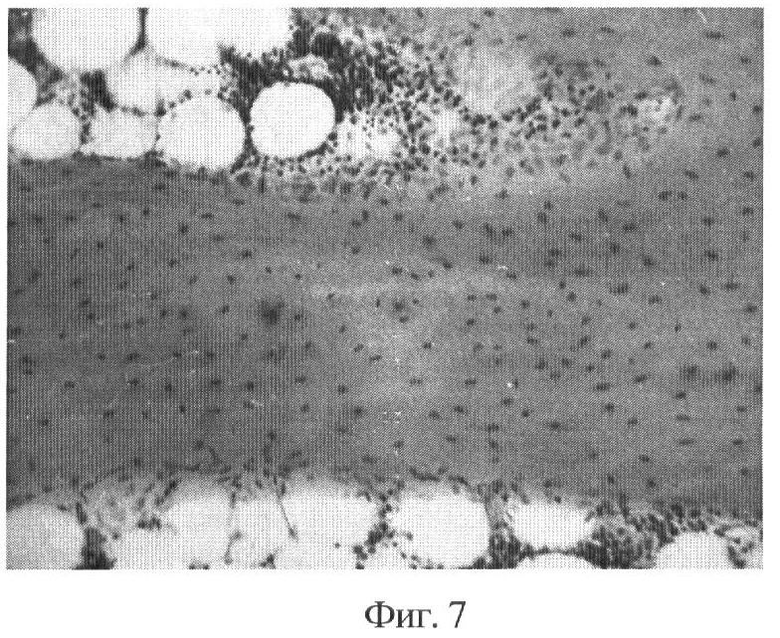
Фиг.7 - новообразованная костная ткань, сформировавшаяся на месте дефекта лучевой кости кролика после применения деминерализованного трансплантата, заготовленного предлагаемым способом. Микрофото. Срок 3 месяца. Гематоксилин и эозин, х80.
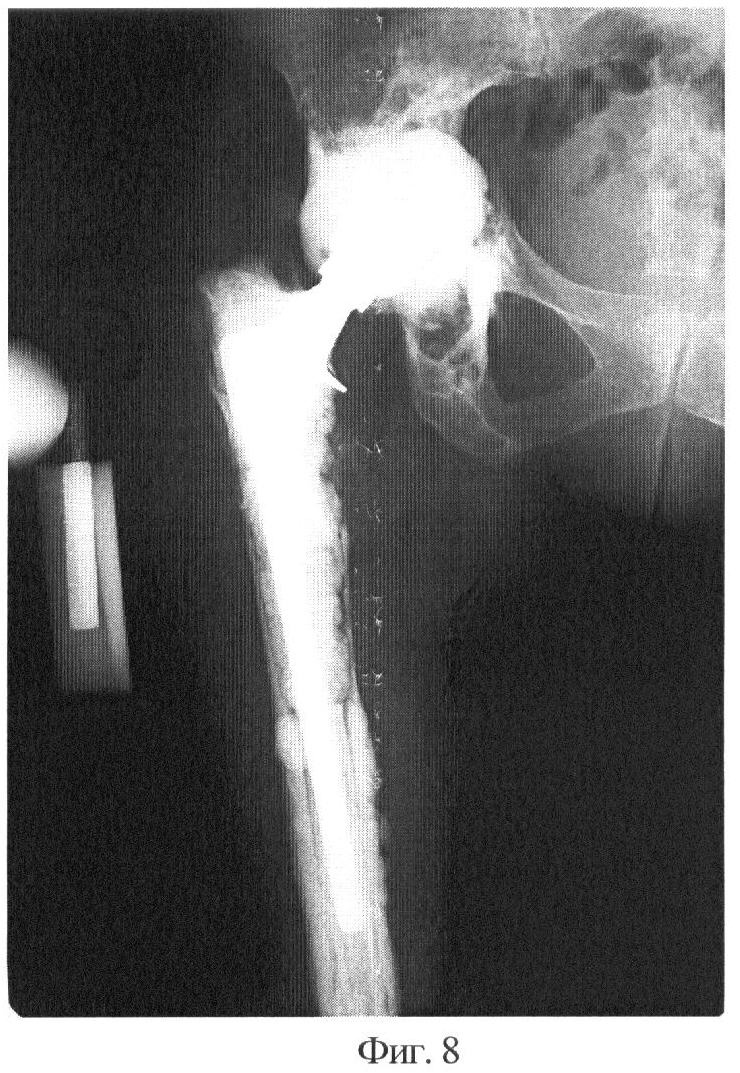
Фиг.8 - тотальное ревизионное эндопротезирование тазобедренного сустава с использованием костного цемента. Клинически и рентгенологически нестабильность бедренного и вертлужного компонентов эндопротеза. Рентгенограмма.
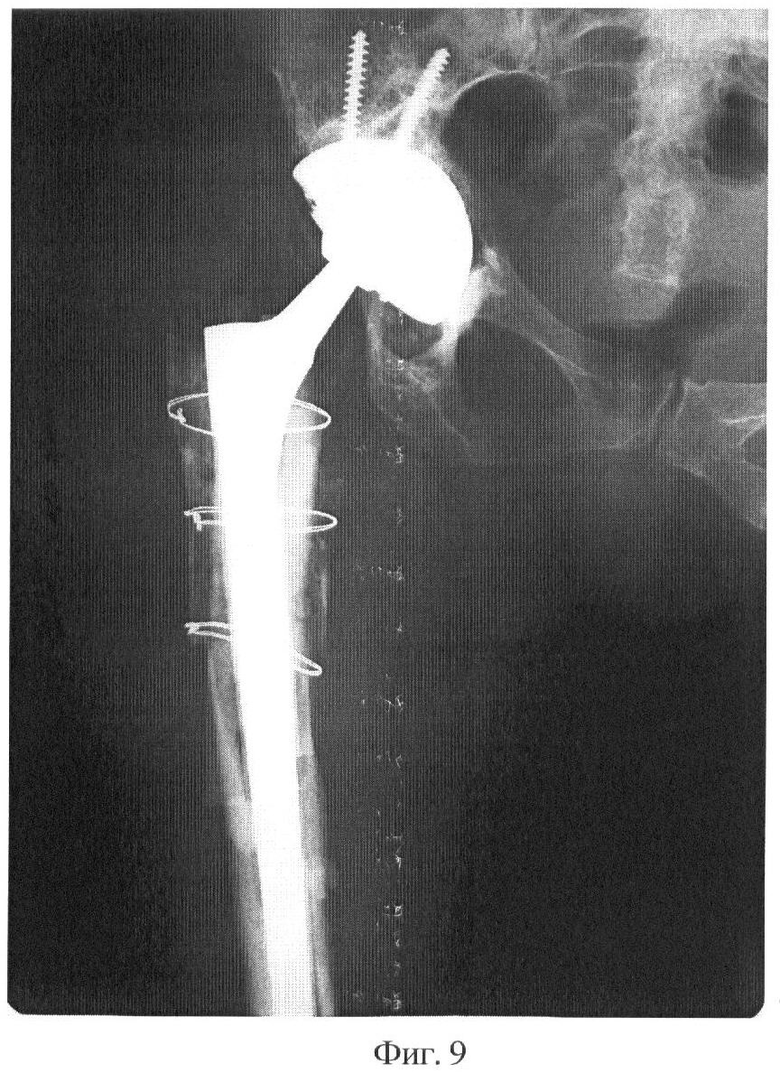
Фиг.9 - рентгенограмма, 4 месяца после операции замены эндопротеза. Восстановление проксимального отдела бедра и дефекта таза с помощью аллогенных костных трансплантатов.
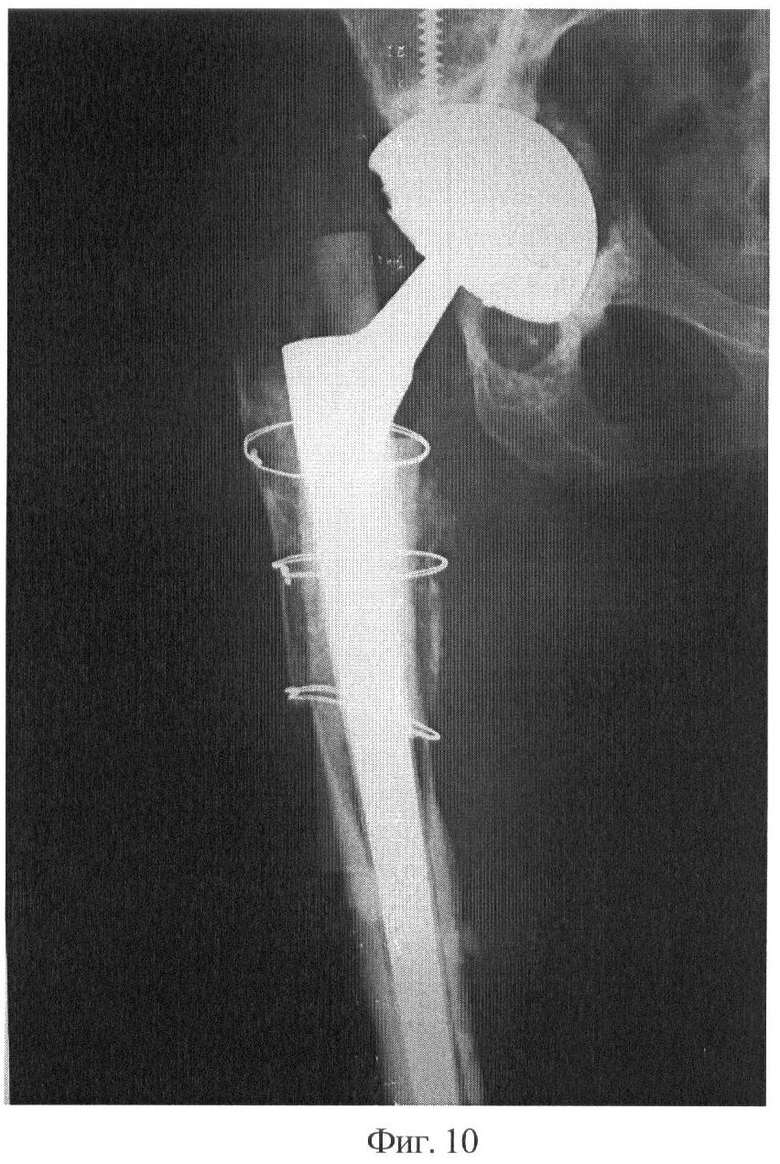
Фиг.10 - рентгенограмма, 1 год и 2 месяца после реэндопротезирования. Пациентка ходит с опорой на палочку. Имплантированные аллогенные трансплантаты частично перестроились и обеспечивают надежную фиксацию бедренного и вертлужного компонентов эндопротеза.
Способ осуществляется следующим образом: в термостойкую тару вносят 90 мл дистиллированной воды, 5,0 г желатина и 0,5 г агара. Тару ставят на водяную баню и подогревают до тех пор, пока ее содержимое не расплавится и не закипит. При этом необходимо тщательно следить, чтобы расплавленный агар или желатин не подгорели. Затем в жидкий гель добавляют 10 г меда (любого, но лучше не засахаренного) и 0,7 г сульфосалициловой кислоты. Полученный раствор перемешивают и остужают до температуры в пределах 40°С. В таком виде консервирующая среда готова для заливки биологических трансплантатов. Для этого последние размещают в соответствующую стеклянную, полиэтиленовую или пластмассовую тару и заливают до края таким образом, чтобы исключить проникновение воздуха. От каждого заготавливаемого препарата для бактериологического исследования отсекают небольшие фрагменты, которые заливают той же средой, что и остальные трансплантаты. Когда их много, то для бакконтроля на стерильность выборочно берут 2-3 трансплантата из 10. Хранят заготовленные ткани для пересадки в холодильниках с температурным режимом +2…+7°С. Замораживать их не рекомендуется. Оптимальный срок хранения 6-9 месяцев. Транспортировка биологических трансплантатов в предлагаемой среде возможна любым видом транспорта при комнатной температуре.
Следовательно, в отличие от прототипа предлагаемый способ исключает из процесса заготовки биологических трансплантатов формалин и повышает их биопластические и остеоиндуктивные (при заготовке костной ткани) качества. В отличие от прототипа способ не пролонгирует сроки индукционного остеогенеза, что свидетельствует о его менее фиксирующем влиянии на белковые структуры заготавливаемых трансплантатов. Кроме того, при совместном, а не раздельном применении желатина и агара удалось уменьшить их расход и повысить плотность консервирующей среды.
Для подтверждения вышеизложенного приводим следующие примеры:
1. Стерилизующая активность способа.
Исследование проведено по стандартной методике, для чего кусочки кожи (тест-объекты), взятые посмертно у трупов-доноров в нестерильной обстановке, или хвостовые фрагменты крыс (материал, наиболее инфицированный в естественных условиях) помещали в стеклянную тару и заливали предлагаемой средой, содержание сульфосалициловой кислоты в которой составляло 0,25%-0,5%-0,7%. Тару с тест-объектами герметично опечатывали и переносили на хранение в холодильник с температурным режимом +5°С. На 1, 2, 3, 5, 7 сутки в боксе с соблюдением правил асептики тест-объекты извлекали из среды, помещали в стерильные пробирки или чашки Петри с питательной средой и направляли на исследование в бактериологическую лабораторию, где они выдерживались в термостате при +37°С на протяжении 7 суток. В общем итоге была изучена микрофлора 450 тест-объектов, распределенных в зависимости от концентрации сульфосалициловой кислоты на три группы. О степени антимикробной активности судили по задержке или отсутствию роста микрофлоры. До стерилизации было установлено, что исследуемый материал оказался контаминированным смешанной микрофлорой, в которой преобладали: стафилококк - 93,5%; грамотрицательная споровая палочка - 73,1%; плеснь - 69,2%; кишечная палочка - 62,3%; стрептококк - 19,6%; протей - 17,7%; синегнойная палочка - 10,8%. Дрожжевые грибки встречались в 1,1% исследований, анаэробная палочка в 0,4%.
Как видно из таблицы, 0,25% р-р сульфосалициловой кислоты обладает слабой антимикробной активностью и для стерилизации биологических тканей непригоден. Лучшие результаты были получены после стерилизации тест-объектов 0,5% и 0,7% растворами кислоты на 3 и 5 сутки консервации биопрепаратов при 4°С.
Эксперимент, таким образом, показал несомненную пригодность 0,5%-0,7% концентраций сульфосалициловой кислоты для заготовки биотрансплантатов, предназначенных для клинического использования.
2. Изучение остеоиндуктивной активности костных трансплантатов, стерилизованных и консервированных предлагаемым способом.
Эксперимент проведен на 75 беспородных крысах и 44 кроликах. Крысам производили эктопические пересадки в мышечную ткань бедра, кроликам - ортотопические - в дефект лучевой кости. Костную ткань деминерализовали в 0,6 н. растворе соляной кислоты и после ее отмывки консервировали предлагаемым в заявке способом. Сроки консервации трансплантатов не превышали одного месяца при +5°С. В контрольной серии опытов деминерализованные костные трансплантаты консервировали в гельсодержащей среде, содержащей формалин (0,25%) и антибиотик канамицин (0,05 г на 100 мл). Оперированных животных забивали на 15; 30; 60 и 90 сутки в соответствии с правилами, изложенными в приказе МЗ СССР №755 от 12.08. 77 года. Взятые у них препараты изучали макроскопически, рентгенологически и гистологически с окраской гематоксилин-эозином и пикрофуксином.
Результаты экспериментов, как это видно из таблиц, подтвердили преимущества предлагаемого способа консервации биологических тканей, который существенно (на 10% при эктопической и 16,7% при ортотопической пересадке) улучшил результаты трансплантации деминерализованной костной ткани. Послеоперационная эволюция ортотопических трансплантатов, консервированных предлагаемым способом, рентгенологически сводилась к следующему. У крыс через 2 недели после операции в области пересадки стерилизованных трансплантатов рентгенологическая тень последних не определялась, поскольку они были лишены минеральных компонентов в процессе деминерализации. Через 2 месяца на рентгенограммах в зоне вмешательства обнаруживался новообразованный костный регенерат компактного типа, по очертаниям сходный с пересаженным фрагментом кости.
При ортотопической пересадке у кроликов через 2 недели в зоне дефекта лучевой кости появлялись первые признаки костеобразования в виде облаковидных включений по ходу трансплантата и более выраженные у его концов. Спустя месяц участки вкраплений местами сливались между собой, формируя четкие признаки костного регенерата, повторяющего контуры трансплантата. Через два месяца отмечалось практически полное замещение последнего новообразованной костной тканью. На рентгенограммах трехмесячного срока в области бывшего дефекта обнаруживалась новая кость, имевшая органотипические черты с хорошо развитыми кортикальными пластинками и сформированным костно-мозговым каналом.
На гистологических препаратах к этому сроку на месте пересадки обнаруживалась достаточно зрелая компактная кость, содержащая в своем канале фибро-ретикулярную ткань и миелоидно-жировой костный мозг.
Клинический пример: пациентка К., 57 лет поступила по поводу нестабильности эндопротеза тазобедренного сустава. Выполнено ревизионное эндопротезирование с использованием аллогенных костных трансплантатов, стерилизованных предлагаемым способом. Представлены: дооперационная рентгенограмма, послеоперационные рентгенограммы через 4 месяца и 1 год и 2 месяца.
СПИСОК ЛИТЕРАТУРЫ
1. Применение гельсодержащих сред для консервации и транспортировки тканевых трансплантатов. Методические рекомендации, Новосибирск, 1973, 9 с.
2. Применение гельсодержащих стерилизующих сред для консервации и транспортировки тканевых трансплантатов. Вестник хирургии, 1972, 2, стр.115-118.
3. Аллотрансплантация формалинизированной костной ткани в травматологии и ортопедии. СПб., 2001, стр.55-145.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ СТЕРИЛИЗАЦИИ БИОЛОГИЧЕСКИХ ТКАНЕЙ ДЛЯ ТРАНСПЛАНТАЦИИ | 2007 |
|
RU2362589C1 |
| КОМБИНИРОВАННЫЙ СПОСОБ СТЕРИЛИЗАЦИИ КОСТНЫХ ТРАНСПЛАНТАТОВ | 2007 |
|
RU2356224C1 |
| СПОСОБ КАМЕРНОЙ СТЕРИЛИЗАЦИИ БИОЛОГИЧЕСКИХ ТРАНСПЛАНТАТОВ НИЗКОТЕМПЕРАТУРНОЙ ПЛАЗМОЙ ПЕРОКСИДА ВОДОРОДА | 2006 |
|
RU2317109C1 |
| СПОСОБ КИСЛОТНОЙ ДЕМИНЕРАЛИЗАЦИИ КОСТНОЙ ТКАНИ ДЛЯ ТРАНСПЛАНТАЦИИ | 2007 |
|
RU2356582C1 |
| ЖИДКАЯ СРЕДА ДЛЯ НИЗКОТЕМПЕРАТУРНОЙ КОНСЕРВАЦИИ БИОЛОГИЧЕСКИХ ТРАНСПЛАНТАТОВ | 2001 |
|
RU2235462C2 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ТРАВМАТИЧЕСКИХ ПОВРЕЖДЕНИЙ КОСТЕЙ | 2000 |
|
RU2180534C2 |
| Способ определения жизнеспособности консервированной хрящевой ткани | 1977 |
|
SU700083A1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ АЛЛОТРАНСПЛАНТАТА ВЕРТЛУЖНОЙ ВПАДИНЫ | 2007 |
|
RU2377959C2 |
| Способ консервации костной ткани | 1984 |
|
SU1790942A1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ КОСТНОГО АЛЛОТРАНСПЛАНТАТА | 1999 |
|
RU2147800C1 |

Изобретение относится к медицине и может быть применимо для консервации биологических трансплантатов. Производят консервацию трансплантатов в гельсодержащей стерилизующей среде, имеющей следующее соотношение компонентов (г.): желатин - 5,0, агар - 0,5, мед - 10,0, сульфосалициловая кислота - 0,7, вода дистиллированная - 90,0. Способ позволяет увеличить качество стерилизации. 10 ил., 3 табл.
Способ консервации биологических трансплантатов в гельсодержащей стерилизующей среде, состоящей из желатинового и агарового геля, отличающийся тем, что в состав среды входят мед и сульфосалициловая кислота при следующем соотношении компонентов, г:
| Способ деминерализации и консервации костных трансплантатов | 1988 |
|
SU1586714A1 |
| Способ приготовления биологического имплантата | 1981 |
|
SU1082362A1 |
| КОНСЕРВИРУЮЩИЙ РАСТВОР "Б-2" ДЛЯ ТРАНСПЛАНТАТОВ | 1997 |
|
RU2140152C1 |
| WO 03022047 A1, 20.03.2003 | |||
| БОЛТРУКЕВИЧ С.И | |||
| и др | |||
| Деминерализованный костный матрикс в реконструктивно-восстановительной хирургии опорно-двигательной системы | |||
| Методические рекомендации | |||
| - Гродно, 2001, с.10-11 | |||
| IONKOV A | |||
| et al | |||
| Importance of conservation media for | |||
Авторы
Даты
2009-10-20—Публикация
2007-12-21—Подача