Изобретение относится к области фармации и касается новых фармацевтических композиций для пероральной доставки 3,3′-дииндолилметана (DIM) и способов лечения заболеваний с их помощью.
3,3′-дииндолилметан (DIM), его аналоги и производные обладают широким спектром биологических активностей, что позволяет рассматривать его как весьма перспективное фармакологически активное соединение. 3,3′-дииндолилметан (DIM) является основным олигомерным продуктом индол-3-карбинола (I3C), для которого показана выраженная избирательная активность в отношении трансформированных клеток различного происхождения (Aggarwal В.В., Ichikawa P. (2005) Molecular targets and anticancer potential of indole-3-carbinol and its derivatives. Cell Cycle, 4 (9), 1201-1215). Как показали фармакокинетические исследования, под воздействием кислой среды желудка принятый перорально I3C почти мгновенно превращается в DIM (Arneson D.W., Hurwitz A., McMahon L.M., Robaugh D. (1999) Presence of 3,3′-diindolylmethane in human plasma after oral administration of indole-3-carbinol (abstr.) Proc. Am. Assoc. Cancer Res, 40, 2833); Поэтому многие авторы, исследующие противоопухолевую активность I3C, склоняются к мысли, что большинство клинических эффектов, наблюдаемых при его приеме, на самом деле обусловлены димерной формой индол-3-карбинола-DIM.
Экспериментально доказано, что практически все множественные противоопухолевые механизмы, индуцируемые I3C in vitro и in vivo, характерны и для DIM (Chang X., Tou J.C., Hong C. et al. (2005) 3,3′-Diindolylmethane inhibits angiogenesis and the growth of transplantable human breast carcinoma in athymic mice. Carcinogenesis, 264 (4), 771-778; Firestone G.L., Bjeldanes L.F. (2003) Indole-3-Carbinol and 3,3′-Diindolylmethane anti-proliferative signaling pathways control cell cycle gene transcription in human breast cancer cells by regulating promoter-Sp1 transcription factor interactions. J. Nutr., 133, 2448S-2455S; Ge X., Yannai S., Rennert G. et al. (1996) 3,3′-Diindolylmethane induces apoptosis in human cancer cells. Biochem. Biophys. Res. Commun., 228, 153-158; Hong C., Kim H.A., Firestone G.L. et al. (2002) 3,3′-Diindolylmethane (DIM) induces a cell cycle arrest in human breast cancer cells that is accompanied by Sp-1-mediated activation of p21 WAF1/CIP1 expression. Carcinogenesis, 23, 1297-1305; Leibelt D.A., Hedstrom O.R., Fisher K.A. (2003) Evaluation of chronic dietary exposure to indole-3-carbinol and absorption enhanced 3,3′-diindolylmethane in Sprague-Dawley rats. Toxicol. Sci., 74, 10-21; Li Y., Li X., Sarkar F.H. (2003) Gene expression profiles of I3C-and DIM-treated PC3 human prostate cancer cells determined by cDNA microarray analysis. J. Nutr., 133, 1011-1019; Nachshon-Kedmi M., Yannai S., Haj A., Fares F.A. (2003) Indole-3-carbinol and 3,3′-diindolylmethane induce apoptosis in human prostate cancer cells. Food Chem. Toxicol., 41, 745-752). Данный вывод справедлив и в отношении рака простаты. Так же, как и I3C, DIM in vitro и in vivo останавливает рост опухолевых простатических клеток (Li Y., Li X., Sarkar F.H. (2003) Gene expression profiles of I3C- and DIM-treated PC3 human prostate cancer cells determined by cDNA microarray analysis. J. Nutr., 133, 1011-1019; Nachshon-Kedmi M., Fares F.A., Yannai S. (2004) Therapeutic activity of 3,3′-diindolylmetane on prostate cancer in an in vivo model. Prostate, 61 (2), 153-160) и индуцирует их апоптоз (Li Y., Li X., Sarkar F.H. (2003) Gene expression profiles of I3C- and DIM-treated PC3 human prostate cancer cells determined by cDNA microarray analysis. J. Nutr., 133, 1011-1019; Nachshon-Kedmi M., Yannai S., Fares F.A. (2004) Induction of apoptosis in human prostate cancer cell line, PC3, by 3,3′-diindolylmethane through the mitochondrial pathway, Br. J. Cancer, 91, 1358-1363), при этом так же, как и I3C, реализует свою активность на субмолекулярном уровне, регулируя экспрессию генов, ответственных за процессы пролиферации, дифференцировки и выживаемости (Li Y., Li X., Sarkar F.H. (2003) Gene expression profiles of I3C- and DIM-treated PC3 human prostate cancer cells determined by cDNA microarray analysis. J. Nutr., 133, 1011-1019) и ингибируя множественные сигнальные пути, ведущие к клеточной гиперпролиферации.
На гормон-чувствительных клетках предстательной железы (культура LNCaP) показана способность DIM конкурентно связываться с андрогеновыми рецепторами, подавляя, таким образом, транслокацию их в ядро с последующей активацией генной транскрипции, а также экспрессию промотора гена, кодирующего простата-специфический антиген PSA. Белок PSA (специфическая протеаза простаты) является классическим маркером рака предстательной железы, продуцирующимся и секретирующимся в избыточном количестве опухолевыми простатическими клетками. В той же работе в результате проведенных структурных исследований было установлено, что по молекулярной геометрии DIM чрезвычайно похож на известный синтетический антиандроген Касодекс (Le Н.Т., Schaldach C.M., Bjeldanes L.F. (2003) Plant-derived 3,3′-diindolylmethane is a strong androgen antagonist in human prostate cancer cells, J. Biol. Chem., 278, 21136-21145), который, однако, в отличие от DIM способствует транслокации андрогеновых рецепторов в ядро (Masiello D., Cheng S., Bubley G.J. et al. (2002) Bicalutamide functions as an androgen receptor antagonist by assembly of a transcriptionally inactive receptor, J. Biol. Chem., Ill, 26321-26326).
Чрезвычайно важным моментом представляется недавно обнаруженная способность DIM проявлять антиангиогенную активность. Патологический рост сосудов практически всегда сопровождает гипер- и неопластические процессы. Известно, что без формирования сети капиллярных сосудов, снабжающих вновь образованную опухоль, достигшую в диаметре 1-2 мм, кислородом и питательными веществами, абсолютно невозможен ее дальнейший рост. Показано, что в условиях in vitro микромолярные концентрации DIM эффективно подавляют пролиферацию и миграцию эндотелиальных клеток, а также их способность образовывать сосуды. In vivo введенный подкожно экспериментальным животным DIM (5 мг/кг, ежедневно) на 74% подавлял патологический неоангиогенез (Chang X., Tou J.C., Hong C. et al. (2005) 3,3′-Diindolylmethane inhibits angiogenesis and the growth of transplantable human breast carcinoma in athymic mice. Carcinogenesis, 264 (4), 771-778; McCarty M.F., Block K.I. (2005) Multifocal angiostatic therapy: an update, Integrative Cancer Therapies, 4 (4), 301-314).
Важнейшей молекулярной мишенью, на блокирование активности которой направлено действие разрабатываемых и внедряемых в клиническую практику современных таргетных препаратов (препаратов направленного действия), является ядерный фактор транскрипции NF-κB. Доказано, что данный фактор опосредует воспалительный ответ, а также играет важную роль в регуляции пролиферативной (антиапоптотической), ангиогенной, миграционной и инвазивной клеточных активностей, осуществляя заключительный этап сигнальных каскадов, индуцируемых ростовыми факторами и цитокинами. При этом ключевым моментом является транслокация активного фактора в ядро и активация транскрипции генов, ответственных за эти процессы. Установлено, что в условиях in vitro DIM (Rahman K.M., Ali S., Aboukameel A. et al. (2007) Inactivation of NF-kappaB by 3,3′-diindolylmethane contributes to increased apoptosis induced by chemotherapeutic agent in breast cancer cells. Mol. Cancer Ther., 6(10), 2757-2765; Rahman K.M., Sarkar F.H. (2005) Inhibition of nuclear translocation of Nuclear Factor-κВ contributes to 3,3′-diindolylmethane-induced apoptosis in breast cancer cells. Cancer Res., 65, 364-371), а также его метаболический предшественник I3C эффективно подавляют ядерную транслокацию и активность фактора NF-κВ. Это означает, что помимо антипролиферативного и антиангиогенного действия препарат, произведенный на основе DIM, способен подавлять местные воспалительные реакции, которые нередко сопровождают гипер- и неопластические процессы в гормон-зависимых органах и тканях.
В недавно проведенных плацебо-контролируемых клинических исследованиях более детальное исследование больных с регрессией цервикальных дисплазий позволило установить прямую связь между позитивной динамикой течения заболевания и эффективностью превращения I3C в DIM (Sepkovic D.W., Bradlow H.L., Bell M. (2001) Quantitative determination of 3,3′-Diindolylmethane in the urine of individuals receiving indole-3-carbinol. Natr. Cancer, 41, 57-63). Высокая концентрация последнего определялась в моче пациенток во время приема препарата.
В одном из последних экспериментальных исследований была показана способность DIM вызывать апоптоз цервикальных ВПЧ-инфицированных кератиноцитов человека в условиях in vitro. При этом на одной из трех исследованных клеточных линий цервикального рака DIM демонстрировал в несколько раз большую эффективность, чем I3C. Величина LD50 составляла 50-60 мкМ для DIM и 200 мкМ для I3C, соответственно, но так же, как и его метаболический предшественник (I3C), DIM не вызывал апоптотических изменений в нормальных (нетрансформированных) кератиноцитах (Chen D.Z., Qi M., Auborn K., Carter T.H. (2001) Indole-3-Carbinol and Diindollylmethane induce apoptosis of human cervical cancer cells and in murine HPV16-transgenic preneoplastic cervical epithelium. J. Nutrit., 131, 3294-3302).
В заключение необходимо упомянуть еще об одном недавно описанном важнейшем свойстве DIM - его иммуномодулирующей активности. Было показано, что в условиях in vitro в опухолевых клетках DIM стимулирует IFNγ-зависимые сигнальные каскады посредством активации экспрессии рецепторов IFNγ, а также других IFN-респонсивных регуляторных белков.
Пероральный способ дозирования препаратов на основе DIM является наиболее предпочтительным, поскольку он содержит целый ряд преимуществ перед другими способами дозирования, таких как наибольший комфорт для пациента, возможность гибких режимов лечения, а также эффективность стоимости лечения. Однако биологическая доступность DIM при пероральном дозировании сильно ограничена из-за его очень низкой растворимости и низкой эффективности абсорбции в тонком кишечнике. DIM обычно демонстрирует низкую растворимость в физиологических жидкостях и имеет очень ограниченную способность проникать через барьерные мембраны. Более того, хорошо известна способность этого соединения связываться с белками плазмы крови, а также участвовать в различных неспецифических взаимодействиях в кровотоке, что существенно снижает эффективность его доставки к очагу заболевания.
В качестве одного из способов решения вышеуказанных проблем недавно были предложены несколько фармацевтических композиций на основе пегилированного витамина E (TPGS) (Anderton M.J., Manson M.M. et al. (2004) Phsiological modeling of formulated and crystalline Diindolylmethane pharmacokinetics following oral administration in mice. Drug metabolism and Disposition, 32 (6), 632-638), известного своей способностью увеличивать водную растворимость различных соединений (Constantinides Р.Р., Tustian A., Kessler D.R. (2004) Tocol emulsions for drug solubilization and parenteral delivery, Adv. Drug Deliv. Rev., 56, 1243-1255) и усиливать их биологическую доступность при пероральном введении (Wu SHW., Hopkins W.K. (1999) Characteristics of d-α-tocopheryl PEG 1000 succinate for applications as an absorption enhancer in drug delivery systems, Pharm. Technol, 23, 52-68). Однако использование композиций на основе TPGS позволило добиться только очень небольшого (не более чем в 1.5-2 раза) увеличения биологической доступности DIM, его аналогов и производных (Zeligs et al. US patent 6.416.793. Formulation and use of controlled-release indole alkaloids), что не позволяет в полной мере использовать терапевтический потенциал этих соединений.
Таким образом, задачей настоящего изобретения является решение проблемы улучшенной доставки DIM.
Задача решается новыми фармацевтическими композициями для пероральной доставки DIM на основе блок-сополимеров оксиэтилена и оксипропилена.
Блок-сополимеры оксиэтилена и оксипропилена также известны под названием «Плюроник» или «Полоксамер».
Гидрофобно-гидрофильные свойства Плюроников и их способность солюбилизировать водонерастворимые соединения определяются размерами и соотношением полиоксиэтиленового (гидрофильного) и полиоксипропиленового (гидрофобного) блоков. Следующая таблица (Таблица 1) суммирует структурные свойства различных Плюроников.
Несмотря на то, что указанные блок-сополимеры широко используются в фармацевтических и косметических композициях в том числе и для увеличения растворимости гидрофобных водонерастворимых соединений (Foster B., Cosgrove T., Hammouda B. (2009) Pluronic triblock copolymer systems and their interactions with ibuprofen, Langmuir, 25 (12), 6760-6766) требуется индивидуальное решение об их использовании для каждого конкретного лекарства.
В настоящее время известно более пятидесяти АТФ-зависимых транспортеров, которые в той или иной степени могут влиять на биологическую доступность лекарств (Oostendorp R.L., Beijnen J.H., Schellens J.H. (2009) The biological and clinical role of drug transporters at the intestinal barrier, Cancer Treat Rev, 35(2), 137-147). Более того, генетический полиморфизм этих транспортеров также вносит значительный вклад в вариабельность биодоступности различных лекарств (Nakamura T., Yamamori M., Sakaeda T. (2008) Pharmacogenetics of intestinal absorption, Curr Drug Deliv, 5(3), 153-169). Точные механизмы взаимодействия разных поверхностно-активых полимеров с различными транспортерами и их комбинациями, ограничивающими биодоступность разных лекарств, в настоящее время не установлены, и композиция, оказавшая положительный эффект на биодоступность одного активного вещества, может оказаться неэффективной для другого и наоборот.
Что касается использования блок-сополимеров оксиэтилена и оксипропилена для усиления оральной биодоступности соединений, то ее связывают с модулированием активности Р-гликопротеина, и соответственно они предлагаются в составе композиций, где активные вещества являются субстратами Р-гликопротеина (Kabanov et al. US patent 6.277.410. Copolymer compositions for oral delivery) и некоторых форм MRP (Miller D.W., Batrakova E.V., Kabanov A.V. (1999) Inhibition of multidrug resistance-associated protein (MRP) functional activity with pluronic block copolymers, Pharm Res, 16(3), 396-401). Подобные свойства были также продемонстрированы для других полимерных поверхностно активных соединений. В частности, в дополнение к высокой солюбилизируещей активности в отношении водонерастворимых соединений была описана способность Solutol H15 модулировать активность Р-гликопротеина (Coon J.S., Knudson W., Clodfelter K. et al. (1991) Solutol HS 15, Nontoxic Polyoxyethylene Esters of 12-Hydroxystearic Acid, Reverses Multidrug Resistance, Cancer Res, 51, 897-902), что потенциально открывает возможность его применения в качестве усилителя абсорбции пероральных лекарственных форм. Аналогичные свойства были также описаны для Chremophor EL, Tween 80, вышеупомянутого TPGS и других им подобных соединений (Seelig A., Gerebtzoff G. (2006) Enhancement of drug absorption by noncharged detergents through membrane and P-glycoprotein binding, Expert Opinion on Drug Metabolism and Toxicology, 2 (5), 733-752).
Прямой эксперимент, описание которого приводится ниже (пример 8), показал, что DIM не вызывает усиления захвата родамина 123 клетками, экспрессирующими Р-гликопротеин, что указывает на то, что DIM не является субстратом этого транспортера. Это хорошо согласуется с результатами упомянутой выше попытки применить высокоактивный модулятор Р-гликопротеина TPGS для увеличения биодоступности DIM, не приведшей к существенному улучшению этого параметра. Вместе с тем использование ряда поверхностно-активных полимеров, описываемых настоящим изобретением, привело к значительному повышению оральной биодоступности лекарства.
Анализ растворимости DIM в Плюрониках с различным содержанием гидрофобных и гидрофильных блоков показал, что полимеры, содержащие 50 мас.% и более гидрофильного блока, обладают более высокой солюбилизирующей способностью, чем полимеры, содержащие менее 50 мас.% гидрофильного блока. При этом известно, что у ряда Плюроников молекулярная масса гидрофобного элемента постоянная, а содержание оксиэтиленовых групп изменяется.
Неожиданно оказалось, что биодоступность DIM зависит также и от молекулярной массы гидрофильного блока. Более высокую биодоступность обеспечивают блок-сополимеры оксиэтилена и оксипропилена, в которых содержание гидрофобного блока составляет менее 50 мас.%, а молекулярная масса гидрофильного блока составляет 2250 Да и более. Наиболее эффективным оказался Плюроник F127, позволяющий получить стабильные водные дисперсии, содержащие более 3 мг/мл DIM. Пероральное введение такой композиции DIM крысам позволило значительно (более чем в 5 раз) повысить его биологическую доступность. Соотношение выбранного блок-сополимера и активного компонента может варьировать в зависимости от желательной длительности высвобождения и составляет в среднем 10:1-2:1. Наиболее оптимальное соотношение Плюроника F127 и DIM оказалось 6:1.
Также неожиданно Плюроник L10 (содержание гидрофильного блока около 40% и общая молекулярная масса около 3200), который оказывал малый эффект на водную растворимость DIM и его биологическую доступность при пероральном введении крысам, оказался способным значительно усиливать эффект Плюроника F127, что привело к увеличению биодоступности формуляции DIM более чем в 15 раз по сравнению с контролем. Оптимальное соотношение Плюроника F127 и Плюроника L10 оказалось 8:1-1:1. Также неожиданно, что другие Плюроники с содержанием гидрофильного блока менее 50%, например Плюроник Р85 и Плюроник L61, подобного эффекта не оказали.
Композиции согласно изобретению могут быть получены, например, путем совместного или раздельного растворения компонентов в подходящих растворителях, таких как вода, спиртовые или водно-спиртовые растворы, последующего смешения полученных растворов в необходимых пропорциях.
Полученные растворы необязательно могут быть высушены для получения твердой лекарственной формы. Высушивание производят любым технологически подходящим методом или их комбинацией, включая, но не ограничиваясь такими методами, как упаривание на роторном испарителе или спидваке, лиофильная сушка, сушка в потоке.
Готовые лекарственные формы могут быть получены путем таблетирования высушенных композиций с использованием необходимых эксципиентов, например, стеарата натрия, лактозы, производных целлюлозы и др.
Готовые лекарственные формы могут быть получены путем упаковки высушенных композиций в капсулы, например, желатиновые капсулы с твердой оболочкой.
Настоящее изобретение также относится к методам лечения заболеваний с помощью фармацевтических композиций, содержащих эффективное количество DIM, описанных в этом изобретении.
Учитывая вышеупомянутые молекулярные мишени действия DIM, а именно, позитивное влияние на метаболизм эстрогенов, восстановление процессов апоптоза, антипролиферативную, противоопухолевую и антиангиогенную активность, описанные составы предлагаются для лечения таких пролиферативных заболеваний, как миома матки, аденомиоз, гиперпластические заболевания предстательной железы. Также продемонстрирована высокая клиническая эффективность DIM с повышенной биодоступностью при лечении инфекционных заболеваний урогенитального тракта, вызванных такими внутриклеточными инфекционными агентами, как Chlamydia trahomatis. Вероятней всего эти эффекты обусловлены индукцией программируемой клеточной гибели эпителиальных клеток, инфицированных Chlamydia trahomatis.
Эффективное количество дииндолилметана, необходимое для лечения и профилактики, может варьироваться в зависимости от вида и тяжести заболевания, возраста и состояния пациента и может быть определено в каждом конкретном случае лечащим врачом. При этом используемые дозы находятся в пределах от 2 до 2000 мг в сутки.
Изобретение иллюстрируется следующими примерами:
Пример 1
Определение растворимости DIM в водных дисперсиях различных Плюроников
Приготовление раствора Плюроника
В стеклянную емкость вносим 400 мг Плюроника, 9.7 мл обезвоженного этилового спирта и 0.3 мл дистиллированной воды Полученную смесь тщательно перемешиваем на магнитной мешалке до получения прозрачного раствора.
Приготовление раствора DIM
В стеклянную емкость вносим 10 мг DIM, добавляем 1.0 мл обезвоженного этилового спирта. Тщательно перемешиваем на магнитной мешалке до получения прозрачного раствора
Приготовление молекулярных дисперсий, содержащих Плюроник и DIM
В пробирку объемом 2 мл внести 0.5 мл раствора Плюроника (20 мг) и 0.2 мл раствора DIM. Полученный раствор обработать ультразвуком в течение 10 мин и перемешать в течение 1 часа. Этанол из полученной смеси удалить на роторном испарителе или «спидваке» и продолжить выпаривание под вакуумом в течение ночи. В результате проведенных манипуляций полученную смесь растворяют в 1.5 мл дистиллированной воды фильтруют и определяют концентрацию DIM в полученном растворе, используя спектрометрический метод. Результаты, приведенные в следующей таблице (Таблица 2), свидетельствуют, что наиболее высокую растворимость DIM удается получить при использовании Плюроника F127.
Пример 2
Приготовление молекулярных суспензий, содержащих Плюроник F127 и DIM
Приготовление раствора Плюроника F127
В стеклянную емкость вносим 400 мг Плюроника F127 и 9.7 мл обезвоженного этилового спирта, и 0.3 мл дистиллированной воды. Полученную смесь тщательно перемешиваем на магнитной мешалке до получения прозрачного раствора
Приготовление раствора DIM
В стеклянную емкость вносим 10 мг DIM, добавляем 1.0 мл обезвоженного этилового спирта. Тщательно перемешиваем на магнитной мешалке до получения прозрачного раствора.
Приготовление молекулярных суспензий, содержащих Плюроник F127 и DIM
В пробирку объемом 2 мл внести 0.5 мл раствора Плюроника F127 (20 мг) и 0.2 мл раствора DIM. Полученный раствор обработать ультразвуком в течение 10 мин. И перемешать в течение 1 часа. Этанол из полученной смеси удалить на роторном испарителе или «спидваке» и продолжить выпаривание под вакуумом в течение ночи. В результате проведенных манипуляций получается воскообразная масса, которую следует растворить в дистиллированной воде до конечной концентрации DIM 3 мг в мл.
Пример 3
Приготовление молекулярных суспензий, содержащих Плюроник F127, Плюроник L10 и DIM
Приготовление раствора Плюроника L10
В стеклянную емкость вносим 250 мг Плюроника L10 и 10 мл обезвоженного этилового спирта. Полученную смесь тщательно перемешиваем на магнитной мешалке.
Приготовление раствора Плюроника F127
В стеклянную емкость вносим 400 мг Плюроника F127 и 9.7 мл обезвоженного этилового спирта, и 0.3 мл дистиллированной воды Полученную смесь тщательно перемешиваем на магнитной мешалке до получения прозрачного раствора.
Приготовление раствора DIM
В стеклянную емкость вносим 10 мг DIM, добавляем 1.0 мл обезвоженного этилового спирта. Тщательно перемешиваем на магнитной мешалке до получения прозрачного раствора.
Приготовление молекулярных суспензий, содержащих Плюроник F127, Плюроник L10 и DIM
В пробирку объемом 2 мл внести 0.5 мл раствора Плюроника F127 (20 мг), 0.2 мл раствора DIM и 0.1 мл Плюроника L10. Полученный раствор обработать ультразвуком в течение 10 мин. И перемешать в течение 1 часа. Этанол из полученной смеси удалить на роторном испарителе или «спидваке» и продолжить выпаривание под вакуумом в течение ночи. В результате проведенных манипуляций получается воскообразная масса, которую следует растворить в дистиллированной воде до конечной концентрации DIM 3 мг в мл.
Пример 4
Приготовление водорастворимой композиции DIM методом лиофилизации
1 мл дистиллированной воды добавить к одному из растворов DIM с Плюрониками, описанными в примерах 1 и 2. Смесь перемешать на мешалке до получения прозрачного раствора. Раствор стабилен в течение 15 часов. Полученный раствор замораживается и помещается в лиофильную сушку. В результате лиофилизации из замороженного состояния получается белый бесцветный порошок.
Пример 5
Получение композиции DIM методом распылительной сушки
В 20 литровый стеклянный контейнер загрузить 200 г Плюроника F127, 300 мл дистиллированной воды, 10 литров этанола. Смесь перемешивать до полного растворения Плюроника и получения прозрачного раствора. К полученному раствору добавить 25 г Плюроника L10 и 20 г DIM. Полученную смесь перемешивать до получения прозрачного раствора и отфильтровать. Полученный раствор высушивается на распылительной сушке при температуре 40°C.
Пример 6
Получение композиции прямым растворением DIM в расплавленных Плюрониках
Плюроники F98, F127 или их сочетание в оптимальной пропорции (F98 и F127, примерно, 1:4) смешиваются и расплавляются (темп. 60°С), после чего DIM в кристаллическом виде вносится в расплавленную массу при интенсивном перемешивании. После растворения DIM раствор быстро охлаждается до +5°C. Образуется твердая масса, которая размалывается до порошкообразного состояния.
Пример 7
Исследование растворимости составов, содержащих DIM
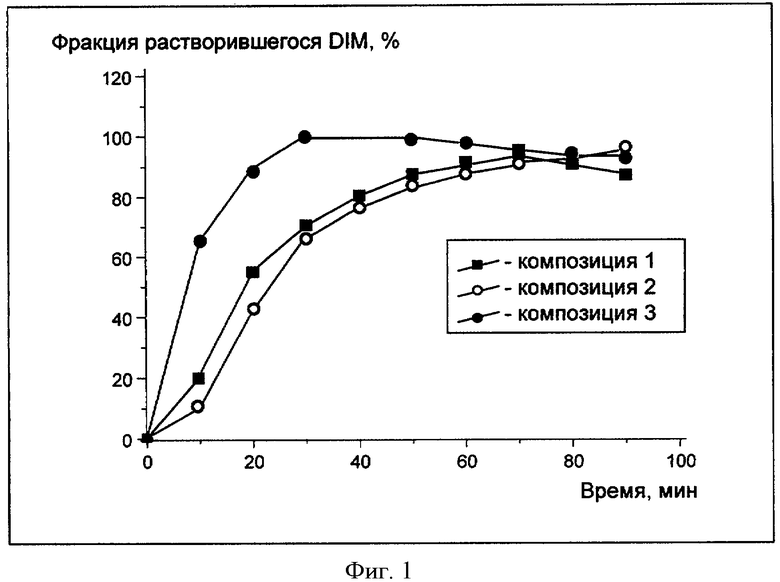
Исследовалась растворимость в воде композиций DIM, полученных в примерах 2-3. Для этих целей к каждой из полученных композиций (навески содержали по 6 мг DIM) добавляли 2 мл 0,9% водного раствора хлорида натрия и помещали в горизонтальный шейкер, вращающийся со скоростью 200 оборотов в мин. Образцы по 0.2 мл периодически отбирались для определения концентрации DIM по изменению оптической плотности. На чертеже представлены результаты экспериментов (Фигура 1).
Пример 8
Исследование ингибирующей активности DIM в отношении мембранного P-гликопротеина
В качестве модели для проведения экспериментов изучалось поглощение Родамина (Rhodamine 123 (R123) клетками MESSA/DX, экспрессирующими мембранный Р-гликопротеина (P-gp). P-gp негативные клетки MESSA/DX использовали в качестве контроля. Клетки помещали в 96-луночную плату в концентрации 40000 клеток на лунку. После 24 часов инкубации к клеткам добавляли R123 в концентрации 3 мкм. И инкубировали 1 час при 37°C в присутствии различных концентраций DIM и верапамила - известного ингибитора P-gp. После инкубации раствор удалялся, а клетки 3-кратно отмывались охлажденным фосфатным буфером. После этого в клеточных образцах измерялась флюоресценция Родамина. Все эксперименты выполнялись троекратно. Как и ожидалось, клетки MESSA/DX, экспрессирующие мембранный Р-гликопротеина (P-gp), слабо поглощают Родамин по сравнению P-gp негативные клетки MESSА. Верапамил - известный ингибитор P-gp в доза-зависимой манере повышает накопление R123 в клетках MESSA/DX, но не влияет на его накопление в клетках MESSA. DIM в концентрации 500 мкм не влияет на накопление R123 ни в одной из клеточных линий, что однозначно свидетельствует о том, что DIM не является субстратом P-gp.
Пример 9
Фармакокинетика DIM у экспериментальных животных, получающих композиции DIM
Для исследования использовали композиции DIM, полученные в примерах 2-4. Результаты суммированы в таблице, приведенной в конце этого примера. Композиции давали животным перорально в виде водных дисперсий с конечной концентрацией DIM 3 мг в мл. Кристаллический DIM давали в виде суспензии 15 мг DIM в 5 мл 0.5% метилцеллюлозы в дистиллированной воде.
В эксперименте использовали самок крыс породы Female Spraque-Dawley весом 250-350 г. Все исследования проводились в полном соответствии с правилами GLP. Формуляции DIM назначались животным в дозировке 60 мг на кг веса. После получения препаратов в различные интервалы времени (15, 30, 45 мин и 1, 2, 4, 6 и 24 часа) у животных собирали образцы крови. Сразу после забора образцы крови центрифугировали, а отделенную плазму замораживали и хранили при -80°C.
Изофлуран (Bimeta-MTC, Animal Health Inc. Cambridge, ON, Canada). Забор крови производился из яремной вены в пробирки с гепарином, которые немедленно помещали в лед на 5-10 минут. Затем кровь подвергали центрифугированию для ее отделения от плазмы. Образцы с плазмой замораживали и хранили при -80°C.
Экстракция и анализ образца
Образцы с плазмой размораживали, центрифугировали, аликвоты по 100 мкл расфасовывали по пластиковым пробиркам. Далее образцы дважды экстрагировались с помощью 750 мкл метил-трет-бутилового эфира в течение 2 мин перемешивания при 180°C. Образцы центрифугировали при 10000 в течение 10 минут. Супернатанты отделяли и переносили в стеклянные пробирки. Органическая фаза испарялась с помощью азота при 50°C до полного высушивания. Высушенные образцы хранили при температуре -80°C. Исследуемые образцы разводили в 15 мкл ацетонитрила и 85 мкл подвижной фазы. Далее аликвоты в объеме 20 мкл анализировали с помощью метода HPLC.
Проведение HPLC:
C18 обратно-фазовые колонки 50×4,6 мм, Symmetry/shield 3,5 мкм (сорбент, зернение в мкм), 30°C, скорость потока 1,5 мл/мин, объем инъекции 20 мкл, при 280 нм.
Подвижная фаза: линейный градиент буфера B от 0 до 100%, буфер A: 5% ацетонитрил, 0,1 трифторуксусная кислота, буфер B: 90% ацетонитрил, 0,1% трифторуксусная кислота, в течение 10 минут.
Концентрацию DIM рассчитывали с помощью калибровочной кривой, исходя из площади пика (AUP). Площадь под кривыми рассчитывали (AUC), используя формулу трапеций (используется для вычисления определенных интегралов).
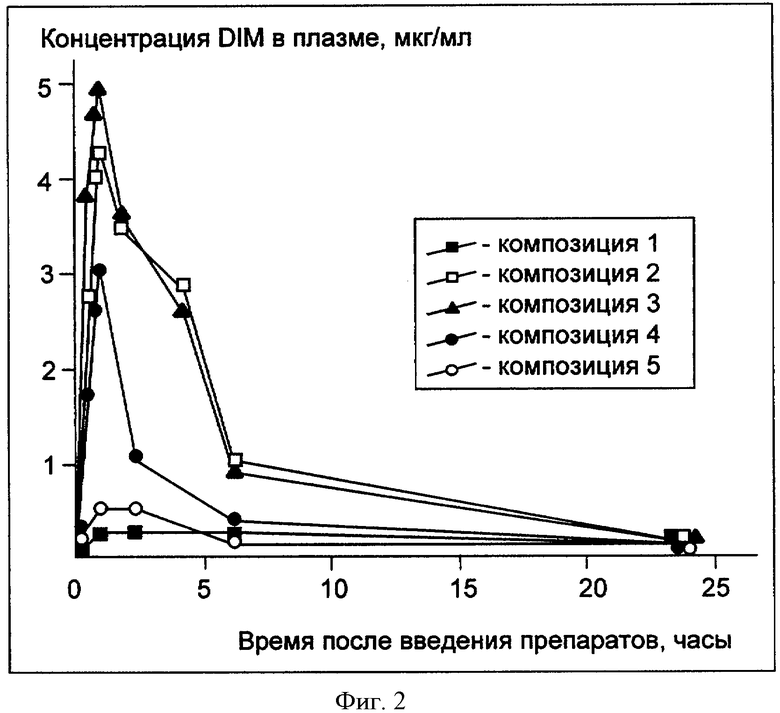
Значение Cmax и AUC для контроля и исследуемых композиций представлена в следующей таблице (Таблица 3).
па
Графическая презентация данных показана на следующем чертеже - фармакокинетика DIM в плазме крыс, получивших вышеуказанные композиции (см. Фигура 2).
Пример 10
Изучение клинической эффективности фармацевтической композиции DIM, полученной по Примеру 2.
Цель исследования
Оценить клиническую эффективность, морфологические эффекты и безопасность фармацевтической композиции с DIM в новой композиции (содержащей в одной капсуле 50 мг Дииндолилметана) в сравнении с фармацевтической композицией, содержащей кристаллический DIM (содержащей в одной капсуле 50 мг кристаллического Дииндолилметана).
Задачи исследования
- Оценить влияние препаратов на динамику симптомов нарушения функции нижних мочевых путей (СНМП) и качество жизни больных аденомой предстательной железы АПЖ;
- Оценить влияние препаратов на основные уродинамические показатели: максимальную скорость потока мочи (Qmax) и объем остаточной мочи (Vres);
- Оценить влияние препаратов на динамику PSA;
- Оценить влияние препаратов на объем предстательной железы;
- Оценить характер морфологических эффектов препаратов на ткань предстательной железы в сравнении с плацебо;
- Оценить безопасность препаратов на основании анализа частоты нежелательных явлений, побочных эффектов и динамики основных биохимических параметров сыворотки крови.
Для проведения испытаний были предъявлены:
Фармацевтическая композиция с DIM согласно изобретению (группа I) - 2 капсулы/2 раза в день.
Фармацевтическая композиция с кристаллическим DIM (группа II) - 2 капсулы/2 раза в день.
Для оценки клинической эффективности, морфологических эффектов и безопасности препаратов обследовано и пролечено 34 пациента с аденомой предстательной железы (АПЖ) и интраэпителиальной неоплазией простаты (ПИН). Группа I (18 пациентов) принимала предложенную фармацевтическую композицию с DIM по 2 капсулы 2 раза в день, группа II (16 пациентов) принимала фармацевтическую композицию с кристаллическим DIM по 2 капсулы 2 раза в день.
Больные были отобраны на лечение по следующим критериям
- амбулаторные и стационарные больные с симптоматической и морфологически подтвержденной АПЖ и ПИН;
- возраст старше 50 лет;
- пациенты, давшие письменное согласие и соблюдающие указания врача, относительно назначенной терапии;
- выраженность симптомов по шкале I-PSS более 7 баллов;
- Qmax более 5 и менее 15 мл/с;
- Остаточной мочи не более 200 мл;
- Объем простаты более 25 куб. см;
- PSA-до 10 нг/мл.
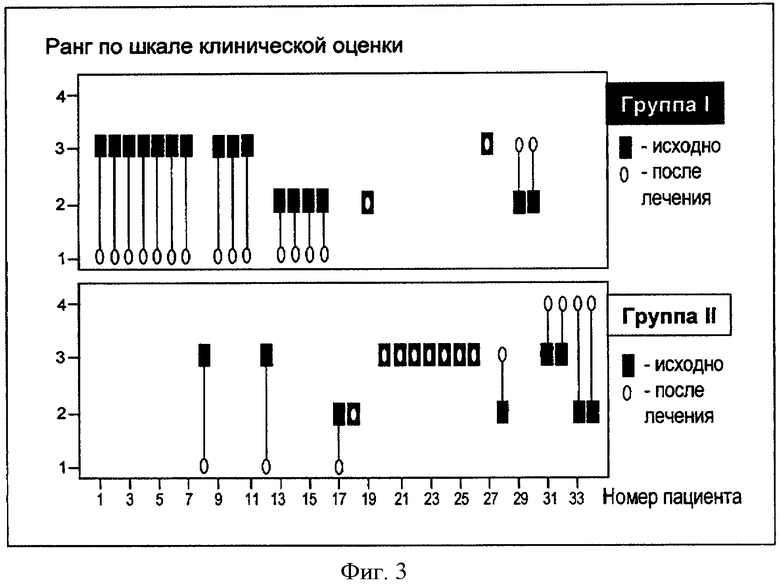
Оценка влияния препарата на клиническое состояние
В исходной временной точке (VI) в обеих группах было зафиксировано 2 морфологических характеристики: L-PIN и H-PIN. В результате воздействия препарата состояние пациента ухудшалось, оставалось неизменным или наблюдалось улучшение. Всего возможно 7 вариантов клинического ответа в интервале времени между V1 и V2. В данном случае представляется возможным отнести оценку клинического изменения (между V1 и V2) к порядковой шкале. Наибольшей чувствительностью для сравнения клинического изменения в исследуемых группах обладает критерий Манн-Уитни:
Изменения данных морфологического исследования по всем пациентам представлены на чертеже (см. Фигура 3), который показывает изменение морфологической характеристики в группах I и II в ходе исследования.
На основании полученного двустороннего уровня значимости по результатам воздействия терапии группы I (принимали фармацевтическую композицию с DIM согласно изобретению) и II (принимали фармацевтическую композицию с кристаллическим DIM) значимо различались (p=0.002)
Сравнение частоты малигнизации
Отдельно изучалось различие частоты малигнизации в исследуемых группах. В основной группе (фармацевтическая композиция с DIM в новой формуляции, 18 пациентов) случаев малигнизации не отмечено. В контрольной группе (фармацевтическая композиция с кристаллическим DIM, 16 пациентов) зафиксированы 4 случая развития рака предстательной железы. Принимая во внимание вероятную ошибку аппроксимации хи-квадрат, для анализа частот признаков использовался точный критерий Фишера.
Вывод: Исследуемые группы различаются по частоте малигнизации, различия статистически значимы (p=0,039).
Оценка влияния заявленной фармацевтической композиции с DIM на иммуногистохимические показатели
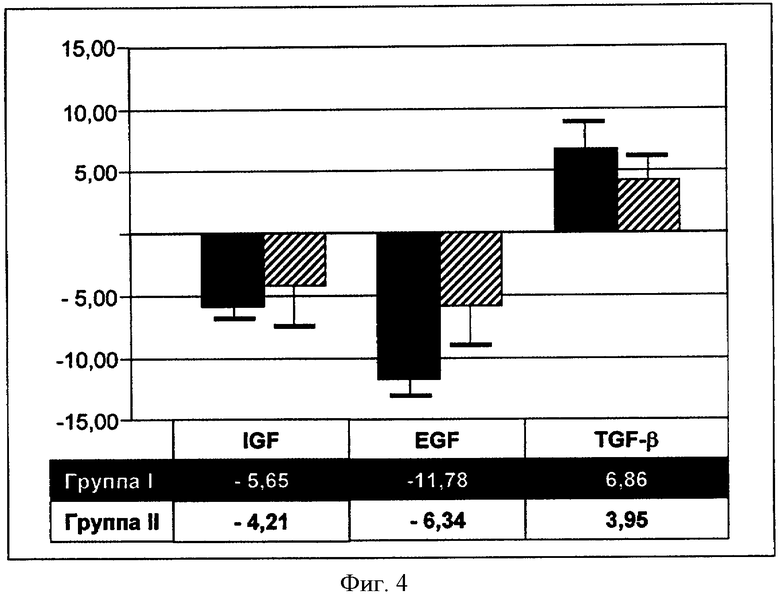
Иммуногистохимический анализ проводился у двух групп пациентов, насчитывающих по четыре человека из группы принимавших фармацевтическую композицию с DIM в новой форме (группа I) и фармацевтическую композицию с кристаллическим DIM (группа II), соответственно. Оценивались такие показатели, как факторы роста IGF и EGF, регулирующий фактор TGF-β, до и после назначения исследуемых препаратов. При статистически однородных исходных значениях IGF, EGF и TGF-β отмечались следующие изменения уровня исследуемых параметров при последующем измерении:
Отмечается статистически достоверное снижение факторов роста IGF (р=0.004) и EGF (р=0.002), а также повышение уровня TGF-β (р=0.047), в группе пациентов, принимавших фармацевтическую композицию с DIM в новой формуляции. В контрольной группе достоверной динамики не отмечено. Более наглядно полученные данные отображены на нижеприведенном чертеже (см. Фигуру 4).
Вывод
Полученные данные достоверного снижения факторов роста IGF и EGF, повышения уровня TGF-β в группе принимающих заявленную фармацевтическую композицию с DIM говорят о влиянии действующих веществ препарата на основные сигнальные механизмы патологической клеточной пролиферации, а также на индукцию апоптоза трансформированных клеток.
В ходе лечения побочных эффектов и нежелательных явлений не зарегистрировано.
Фармацевтическая композиция с DIM в новой формуляции обладает антипролиферативной активностью у больных с аденомой предстательной железы и простатической интроэпителиальной неоплазией.
Фармацевтическая композиция с DIM в новой формуляции является безопасным средством в лечении АПЖ и ПИН в виду отсутствия побочных эффектов и нежелательных явлений в ходе лечения.
Изобретение поясняется следующими графическими материалами:
Фигура 1 - определение концентрации DIM по изменению оптической плотности:
Композиция 1 - DIM (контроль)
Композиция 2 - Плюроник F127 и DIM,
Композиция 3 - Плюроник F127, Плюроник L10 и DIM,
Фигура 2 - фармакокинетика DIM в плазме крыс, получивших следующие композиции:
Композиция 1 - DIM (контроль),
Композиция 2 - Плюроник F127, Плюроник L10 и DIM,
Композиция 3 - лиофильно высушенный раствор Плюроник F127, Плюроник L10 и DIM,
Композиция 4 - Плюроник F127 и DIM,
Композиция 5 - Плюроник L10 и DIM,
Фигура 3 - данные морфологического исследования по пациентам с аденомой предстательной железы (АПЖ) и интраэпителиальной неоплазией простаты (ПИН) до и после лечения:
Группа I - (18 пациентов) принимали фармацевтическую композицию с DIM согласно изобретению.
Группа II - (16 пациентов) принимали фармацевтическую композицию с кристаллическим DIM.
Фигура 4 - данные иммуногистохимического анализа исследовались такие показатели, как факторы роста IGF и EGF, регулирующий фактор TGF-β до и после назначения препаратов:
Группа I - (4 пациента) принимали заявленную фармацевтическую композицию с DIM,
Группа II - (4 пациента) принимали фармацевтическую композицию с кристаллическим DIM.
Изобретение относится к области медицины, а именно к химико-фармацевтической промышленности, а именно к блок-сополимерным фармацевтическим композициям, содержащим 3,3′-дииндолилметан (DIM). Изобретение также относится к методам лечения различных заболеваний с помощью указанных композиций. Композиции улучшают абсорбцию активного соединения в кровоток при его пероральной доставке. 2 н. и 4 з.п. ф-лы, 4 ил., 3 табл.
1. Фармацевтическая композиция для перорального введения, содержащая 3,3′-дииндолилметан в качестве активного компонента и целевую добавку, отличающаяся тем, что содержит в качестве целевой добавки блок-сополимер оксиэтилена и оксипропилена, в котором содержание гидрофобного блока составляет менее 50 мас.%, а молекулярная масса гидрофильного блока составляет 2250 Да и более, при соотношении выбранного блок-сополимера и активного компонента 10:1-2:1.
2. Фармацевтическая композиция по п.1, отличающаяся тем, что содержит в качестве блок-сополимера оксиэтилена и оксипропилена Плюроник F127.
3. Фармацевтическая композиция по п.2, отличающаяся тем, что содержит дополнительно Плюроник L10.
4. Фармацевтическая композиция по п.1, отличающаяся тем, что содержит дополнительно фармацевтически приемлемый носитель.
5. Фармацевтическая композиция по п.4, отличающаяся тем, что представляет собой таблетку, лиофилизированный порошок, суспензию или капсулу.
6. Применение фармацевтической композиции по п.1 для получения антипролиферативного, противоопухолевого, антиангиогенного, иммуномодулирующего, противовоспалительного, влияющего на индукцию апоптоза лекарственного средства.
| ТВЕРДАЯ ЛЕКАРСТВЕННАЯ ФОРМА ДИИНДОЛИЛМЕТАНА ДЛЯ ЛЕЧЕНИЯ НЕОПЛАСТИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2006 |
|
RU2318509C2 |
| US 6277410 B1, 21.08.2001 | |||
| US 6416793 В1, 09.07.2002. | |||
Авторы
Даты
2011-01-20—Публикация
2009-09-18—Подача