Родственные заявки
Данная заявка имеет приоритет предварительной заявки на патент США №60/807545, поданной 17 июля 2006 года, раскрытие сущности которой включено здесь во всей ее полноте.
Область изобретения
Настоящее изобретение относится к соединениям и фармацевтическим композициям, которые являются селективными антагонистами аденозинового А2А рецептора (AR). Эти соединения полезны в качестве фармацевтических агентов.
Предшествующий уровень техники
Оказалось, что селективные антагонисты аденозиновых A2A рецепторов являются эффективными для лечения болезни Паркинсона (БП) как на животных моделях, так и при испытании на людях (см. Hauser et al., Neurology 2003, 61, 297-303). Первыми относительно селективными антагонистами A2AAR были 8-стирилксантины, например KW-6002, который имеет низкое наномолярное сродство к A2AAR и >100-кратную селективность в отношении A2AAR по сравнению с A1AR. KW-6002 проходил клинические испытания в 2002 году в качестве агента для лечения БП (см. Bara-Jimenez et al., Neurology 2003, 61, 293-296). SCH58261, пиразоло[4,3-е]-1,2,4-триазоло[1,5-c]пиримидин, представлял собой прототип ряда производных второго поколения, которые также имеют низкое наномолярное сродство и хорошую селективность в отношении A2AAR in vitro (см. Zocchi et al., Br. J. Pharmacol. 1996, 117, 1381-1386). Третий класс антагонистов, который появился, 1,2,4-триазоло[4,5-е]-1,3,5-триазины, был представлен ZM241385, который активен в отношении A2AAR в субнаномолярном диапазоне, но имеет некоторую перекрестную реактивность (см. Keddie et al., Eur. J. Pharmacol. 1996, 301, 107-113).
Эти потенциальные антагонисты A2A являются важными инструментами исследования, весьма облегчающими фармакологические исследования функции A2AAR in vitro, а также in vivo, и значительно улучшающими наше понимание нейробиологии A2AAR. Однако каждый из этих антагонистов имеет существенные недостатки. KW-6002 является светочувствительным и подвергается фотоизомеризации из активного Е-изомера в 800 раз менее активный Z-изомер. SCH58261 имеет чрезвычайно низкую растворимость, и даже его производные второго поколения имеют минимальную биодоступность. ZM241385 не только является умеренно селективным, но также имеет плохую биодоступность. Другие азотсодержащие гетероциклы, такие как 1,2,4-триазоло[4,3-а]хиноксалин-1-оны и оксазоло[4,5-d]пиримидины от ICl, также являются неселективными, а их биодоступность неизвестна (см. Colotta et al., Arch. Pharm. (Weinheim) 1999, 332, 39-41).
Хотя доступны подтип-селективные зонды к аденозиновым рецепторам для А1, A2A, A2B и А3 AR, имеется мало селективных антагонистов с подходящими свойствами in vitro и in vivo. Поэтому существует постоянная потребность в соединениях, которые являются селективными антагонистами A2A рецепторов.
Описание изобретения
Согласно настоящему изобретению предложены соединения, которые действуют в качестве антагонистов аденозиновых A2A рецепторов, и их стереоизомеры и фармацевтически приемлемые соли.
Согласно изобретению также предложены фармацевтические композиции, содержащие соединение по настоящему изобретению или его стереоизомер или фармацевтически приемлемую соль в комбинации с фармацевтически приемлемым носителем.
Кроме того, согласно изобретению предложен терапевтический способ лечения патологического состояния или симптома у млекопитающего, такого как человек, при котором активность, например повышенная активность, аденозиновых A2A рецепторов вовлечена в один или более чем один симптом патологии, и для облегчения указанных симптомов требуется антагонистическое действие (то есть блокирование) в отношении их активности. Таким образом, согласно настоящему изобретению предложен способ лечения заболевания, включающий введение терапевтически эффективного количества по меньшей мере одного соединения по настоящему изобретению или его стереоизомера или фармацевтически приемлемой соли, где заболевание выбрано из двигательных расстройств, рака, расстройств, связанных с привыканием (например, к курению, алкоголю, лекарствам).
Согласно изобретению предложено соединение по настоящему изобретению для применения в лекарственной терапии.
Согласно изобретению также предложено применение соединения по настоящему изобретению для изготовления лекарственного средства.
Другие задачи, признаки и преимущества настоящего изобретения станут очевидными из следующего подробного описания. Однако следует понимать, что подробное описание и конкретные примеры при указании аспектов изобретения даны только в качестве иллюстрации, так как различные изменения и модификации в пределах сущности и объема изобретения станут очевидными для специалистов в данной области техники из этого подробного описания.
Наилучшие варианты осуществления изобретения
Авторами изобретения обнаружено, что соединения по настоящему изобретению могут быть полезны для лечения заболеваний, ассоциированных с неблагоприятной активацией или активностью A2A рецепторов.
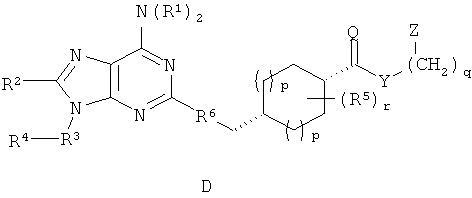
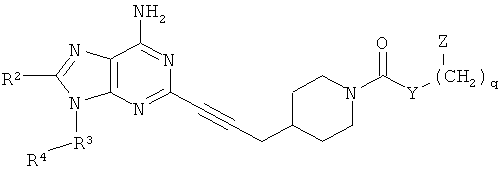
В одном аспекте согласно настоящему изобретению предложены новые соединения формулы Ia или Ib или их стереоизомеры или фармацевтически приемлемые соли:
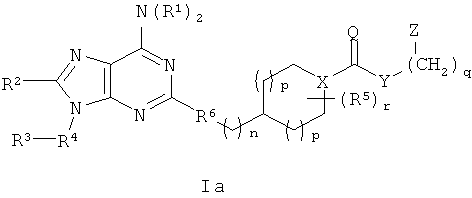
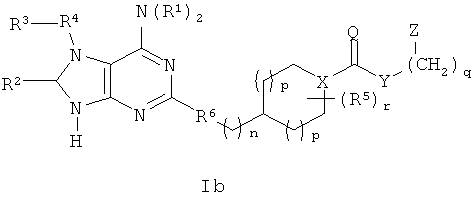
где
(СН2)-фрагменты (СН2)n и (СН2)q независимо замещены 0-2 группами, выбранными из ОН, =O, C1-4алкила, С3-6циклоалкила и бензила;
Q представляет собой О или S;
Х представляет собой СН или N;
Y выбран из группы, состоящей из О, NY1, OCH2CH2OCH2, OCH2CH2OCH2CH2OCH2, OCH2CH2OCH2CH2OCH2CH2OCH2, NY1CH2CH2OCH2, NY1CH2CH2OCH2CH2OCH2 и NY1CH2CH2OCH2CH2OCH2CH2OCH2;
альтернативно, Y отсутствует;
Y1 выбран из группы, состоящей из Н, C1-4алкила, бензила, С3-6циклоалкила и (С3-6циклоалкил)C1-4алкилена;
Z выбран из группы, состоящей из арила и гетероарила, где Z присоединен через атом углерода и замещен 1-4 группами Z1;
Z1 независимо выбран из группы, состоящей из F, Cl, Br, I, C1-6алкила, C2-6алкенила, C2-6алкинила, -(СН2)aORa, -(СН2)aNRaRa,
-(СН2)aNHOH, -(СН2)aNRaNRaRa, -(СН2)aNO2, -(СН2)aCN, -(СН2)aCO2Ra, -(СН2)aC(O)Ra, -(СН2)aOC(O)Ra, -(СН2)aCONRaRa, CF3 и OCF3;
Rа независимо выбран из группы, состоящей из Н, C1-6алкила, C2-6алкенила, C2-6алкинила, C3-8циклоалкила, (C3-8циклоалкил)C1-8алкилена, арила, (арил)C1-8алкилена, гетероарила и (гетероарил)C1-8алкилена, где алкил и циклоалкил возможно прерваны 1-2 гетероатомами, выбранными из группы, состоящей из -O-,
-S(O)0-2- и -NRc-;
R1 независимо выбран из группы, состоящей из Н, C1-8алкила, C3-8циклоалкила, (C3-8циклоалкил)C1-8алкилена, арила, (арил)C1-8алкилена, гетероарила, (гетероарил)C1-8алкилена, (арил)(арил)-C1-8алкилена, (гетероарил)(гетероарил)-C1-8алкилена и (арил)(гетероарил)C1-8алкилена, где алкил и циклоалкил возможно могут быть прерваны 1-2 гетероатомами, выбранными из группы, состоящей из
-O-, -S(O)0-2- и -NRc-, и группы R1 замещены 0-4 группами, независимо выбранными из группы, состоящей из F, Cl, Br, I, C1-6алкила, C2-6алкенила, C2-6алкинила, -(СН2)aORa, -(СН2)aNRaRa, -(СН2)aNHOH, -(СН2)aNRaNRaRa, -(СН2)aNO2, -(СН2)aCN, -(СН2)aCO2Ra, -(СН2)aC(O)Ra, -(СН2)aOC(O)Ra, -(СН2)aCONRaRa, CF3 и OCF3;
R2 выбран из группы, состоящей из Н, C1-6алкила, ORa, N(Ra)2, C3-8циклоалкила, арила, гетероцикла и гетероарила, где алкил, циклоалкил, арил, гетероцикл и гетероарил возможно замещены 1-2 группами, независимо выбранными из группы, состоящей из F, Cl, I, Br, CH3, CF3 и CH3O;
R3 отсутствует или представляет собой C1-4алкилен, где алкиленовая группа возможно прервана 1-2 гетероатомами, выбранными из группы, состоящей из
-O-, -S(O)0-2- и -NH-;
R3 замещен 0-2 группами, выбранными из группы, состоящей из F, Cl, Br, I, -ORd, -SRd, -N(Rd)2, C3-6циклоалкила, (C3-6циклоалкил)C1-4алкилена, арила, (арил)C1-4алкилена, гетероарила и (гетероарил)C1-4алкилена, где алкил и циклоалкил возможно прерваны 1-2 гетероатомами, выбранными из группы, состоящей из
-O-, -S(O)0-2- и -NRc-;
R4 выбран из группы, состоящей из C1-8алкила, C2-8алкенила, С2-8алкинила, C3-12цикпоалкила, (С3-12циклоалкил)C1-8алкилена, арила, (арил)C1-8алкилена, гетероарила, (гетероарил)C1-8алкилена, CF3, -CO2Rb, RbC(O)-, (Rb)2NC(O)-, RbOC(S)-, RbC(S)- и RbS(=O)-, где алкил и циклоалкил возможно прерваны 1-2 гетероатомами, выбранными из группы, состоящей из -O-, -S(O)0-2- и -NH-, и алкил, алкенил, алкинил, циклоалкил, арил и гетероарил замещены 0-4 группами, независимо выбранными из группы, состоящей из F, Cl, Br, I, C1-6алкила, C2-6алкенила, C2-6алкинила, -(CH2)aORa, -(CH2)aNRaRa, -(СН2)aNHOH, -(СН2)aNRaNRaRa, -(СН2)aNO2, -(СН2)aCN, -(СН2)aCO2Ra, -(СН2)aC(O)Ra, -(СН2)aOC(O)Ra, -(СН2)aCONRaRa, CF3, OCF3 и -OS(O2)Ra;
альтернативно, когда R3 присутствует, R4 дополнительно выбран из группы, состоящей из Н, F, Cl, Br, I, N(Rb)2, ORb, SRb, -CN, NO2, CF3O, RbC(O)O-, -OCO2Rb, (Rb)2NC(O)O-, RbOC(O)NRb-, RbC(O)NRb -, (Rb)2NC(O)NRb- и (Rb)2NC(S)NRb-;
при условии, что когда R2 представляет собой Н, и R3 отсутствует, тогда R4 отличен от  ,
,
где
(а) "*" является точкой присоединения;
(б) RZ представляет собой -CH2OR, -CO2R, -OC(O)R, -CH2OC(O)R, -CH2SR, -C(S)OR, -CH2OC(S)R, -CH2NRR, -C(S)NRR и -C(O)NRR; и
(в) R представляет собой Н или заместитель;
Rb независимо выбран из группы, состоящей из Н, C1-6алкила, C2-6алкенила, C2-6алкинила, C3-8циклоалкила, (C3-8циклоалкил)C1-8алкилена, арила, (арил)C1-8алкилена, гетероарила и (гетероарил)C1-8алкилена, где алкил и циклоалкил возможно прерваны 1-2 гетероатомами, выбранными из группы, состоящей из -O-, -S(O)0-2- и -NH-, и где алкил, циклоалкил, арил и гетероарил замещены 0-4 заместителями, выбранными из группы, состоящей из F, Cl, Br, I, C1-6алкила, C2-6алкенила, C2-6алкинила, -(СН2)aORa, -(СН2)aNRaRa, -(СН2)aNHOH, -(CH2)aNRaNRaRa,
-(СН2)aNO2, -(СН2)aCN, -(СН2)aCO2Ra, -(СН2)aC(O)Ra, -(СН2)aOC(O)Ra,
-(CH2)aCONRaRa, CF3 и OCF3;
Rc независимо выбран из группы, состоящей из Н, C1-6алкила и бензила;
Rd независимо выбран из группы, состоящей из Н, C1-6алкила, C3-6циклоалкила, (C3-6циклоалкил)C1-4алкилена, фенила и бензила;
R5 независимо выбран из группы, состоящей из Н, F, Cl, Br, I, -ORc, -N(Rc)2, C1-6алкила, C3-циклоалкила, арила и (арил)C1-4алкилена, где алкил и циклоалкил возможно прерваны 1-2 гетероатомами, выбранными из группы, состоящей из
-O-, -S(O)0-2- и -NRb-;
R6 выбран из группы, состоящей из CH2CH2, СН=СН и С≡С;
а независимо выбран из группы, состоящей из 0, 1 и 2;
n независимо выбран из группы, состоящей из 0, 1 и 2;
р независимо выбран из группы, состоящей из 0, 1 и 2;
q независимо выбран из группы, состоящей из 0, 1 и 2; и
r независимо выбран из группы, состоящей из 0, 1 и 2.
В другом аспекте, когда R2 представляет собой Н, R5 представляет собой С≡С, и Y представляет собой О или NY1, тогда по меньшей мере один Z1 отличен от -CN, ORa и NRaNRa, где Ra представляет собой Н или C1-6алкил.
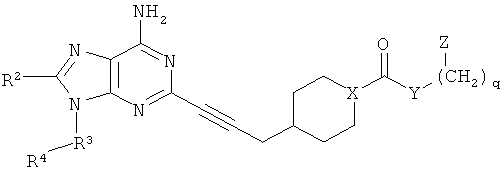
В другом аспекте согласно настоящему изобретению предложены новые соединения формулы IIa или IIIa:
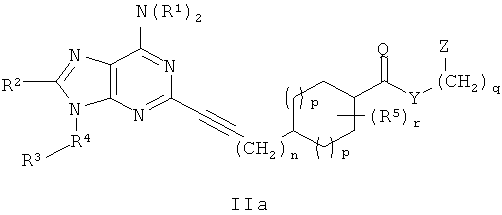
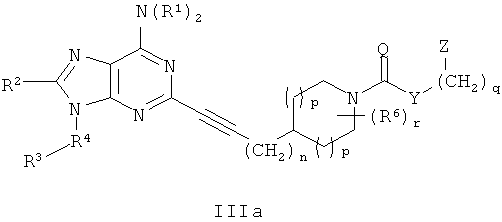
Y выбран из группы, состоящей из О, NY1, OCH2CH2OCH2 и NY1CH2CH2OCH2;
альтернативно, Y отсутствует;
Y1 выбран из группы, состоящей из Н и CH3;
Z выбран из группы, состоящей из 5-6-членного гетероарила и фенила, где Z присоединен через атом углерода и замещен 1-4 группами Z1;
Z1 независимо выбран из группы, состоящей из F, Cl, C1-4алкила, C2-4алкенила, C2-4алкинила, -(СН2)aORa, -(CH2)aNRaRa, -(СН2)aNHOH, -CH2)aNRaNRaRa, -(СН2)aNO2, -(СН2)aCN, -(CH2)aCO2Ra, -(СН2)aC(O)Ra, -(CH2)aOC(O)Ra, -(CH2)aCONRaRa, CF3 и OCF3;
Ra независимо выбран из группы, состоящей из Н, C1-4алкила, C2-4алкенила, C2-4алкинила, C3-6циклоалкила, (C3-6циклоалкил)C1-2алкилена, арила, (арил)C1-2алкилена, гетероарила и (гетероарил)C1-2алкилена, где алкил и циклоалкил возможно прерваны 1-2 гетероатомами, выбранными из группы, состоящей из -O-, -S(O)0-2- и -NRc-;
R1 независимо выбран из группы, состоящей из Н, C1-4алкила, C3-6циклоалкила, (C3-6циклоалкил)C1-4алкилена, арила, (арил)C1-4алкилена, гетероарила, (гетероарил)C1-4алкилена, (арил)(арил)-C1-4алкилена, (гетероарил)(гетероарил)-C1-4алкилена и (арил)(гетероарил)C1-2алкилена, где алкил и циклоалкил возможно прерваны 1-2 гетероатомами, выбранными из группы, состоящей из -O-, -S(O)0-2- и -NRc-, и арильные и гетероарильные кольца замещены 0-2 группами, независимо выбранными из группы, состоящей из F, Cl, C1-4алкила, C2-4алкенила, C2-4алкинила, -(СН2)aORа, -(СН2)aNRaRa, -(СН2)aNHOH, -(CH2)aNRaNRaRa, -(СН2)aNO2, -(СН2)aCN, -(СН2)aCO2Ra, -(СН2)aC(O)Ra, -(СН2)aOC(O)Ra, -(СН2)aCONRaRa, CF3 и OCF3;
R2 выбран из группы, состоящей из Н, C1-4алкила, ORa, N(Ra)2, C3-6циклоалкила, арила, гетероцикла и гетероарила, где алкил, циклоалкил, арил, гетероцикл и гетероарил замещены 0-2 группами, независимо выбранными из группы, состоящей из F, Cl, CH3, CF3 и CH3O;
R4 выбран из группы, состоящей из C1-4алкила, C2-4алкенила, C2-4алкинила, C3-6циклоалкила, (C3-6циклоалкил)C1-2алкилена, арила, (арил)C1-2алкилена, гетероарила, (гетероарил)C1-2алкилена, CF3, -CO2Rb, Rb(O)-, (Rb)NC(O)-, RbOC(S)-, RbC(S)- и RbS(=O)-, где алкил и циклоалкил возможно прерваны 1-2 гетероатомами, выбранными из группы, состоящей из -O-, -S(O)0-2-и -NH-, и алкил, алкенил, алкинил, циклоалкил, арил и гетероарил замещены 0-3 группами, независимо выбранными из группы, состоящей из F, Cl, C1-4алкила, C2-4алкенила, C2-4алкинила, -(CH2)aORa, -(CH2)aNRaRa, -(СН2)aNHOH, -(CH2)aNRaNRaRa, -(СН2)aNO2, -(СН2)aCN, -(CH2)aCO2Ra, -(CH2)aCO2Ra, -(СН2)aOC(O)Ra, -(СН2)aCONRaRa, CF3, OCF3 и -OS(O2)Rа;
альтернативно, когда есть по меньшей мере один R3, R4 дополнительно может быть выбран из группы, состоящей из Н, F, Cl, N(Rb)2, ORb, SRb, -CN, NO2, CF3O, RbC(O)O-, -OCO2Rb, (Rb)2NC(O)O-, RbOC(O)NRb-, RbC(O)NRb-, (Rb)2NC(O)NRb- и (Rb)2NC(S)NRb-;
при условии, что когда R2 представляет собой Н, и R3 отсутствует, тогда R4 отличен от  , где
, где
(а) "*" является точкой присоединения;
(б) Rz представляет собой -CH2OR, -CO2R, -OC(O)R, -СН2ОС(O)R, -CH2SR, -C(S)OR, -CH2OC(S)R, -CH2NRR, -C(S)NRR и -C(O)NRR; и
(в) R представляет собой Н или заместитель;
Rb независимо выбран из группы, состоящей из Н, C1-4алкила, C2-4алкенила, C2-4алкинила, C3-6циклоалкила, (C3-6циклоалкил)C1-2алкилена, арила, (арил)C1-2алкилена, гетероарила и (гетероарил)C1-2алкилена, где алкил и циклоалкил возможно прерваны 1-2 гетероатомами, выбранными из группы, состоящей из -O-, -S(O)0-2- и -NH-, и где алкил, циклоалкил, арил и гетероарил замещены 0-2 заместителями, выбранными из группы, состоящей из F, Cl, C1-4-далкила, C2-4алкенила, C2-4алкинила, -(СН2)aORa, -(CH2)aNRaRa, -(СН2)aNHOH, -(CH2)aNRaNRaRa, -(СН2)aNO2, -(СН2)aCN, -(СН2)aCO2Ra, -(CH2)aC(O)Ra, -(СН2)aOC(O)Ra, -(CH2)aCONRaRa, CF3 и OCF3;
R3 отсутствует или представляет собой C1-4алкилен, где алкиленовая группа возможно прервана гетероатомом, выбранным из группы, состоящей из -O-, -S(O)0-2- и -NH-;
R3 замещен 0-1 группой, выбранной из группы, состоящей из F, Cl, -ORd, -SRd, -N(Rd)2, C3-6циклоалкила, (C3-6циклоалкил)C1-2алкилена, арила, (арил)C1-2алкилена, гетероарила и (гетероарил)C1-2алкилена, где алкил и циклоалкил возможно прерваны 1-2 гетероатомами, выбранными из группы, состоящей из -O-, -S(O)0-2- и -NRc-;
Rc независимо выбран из группы, состоящей из Н и C1-4алкила;
Rd независимо выбран из группы, состоящей из Н, Cl-4алкила, (C3-6циклоалкил)C1-2алкилена и бензила;
R5 независимо выбран из группы, состоящей из Н, F, Cl, -ORc, -N(Rc)2, C1-4алкила, C3-6циклоалкила, арила и (арил)C1-2алкилена, где алкил и циклоалкил возможно прерваны 1 гетероатомом, выбранным из группы, состоящей из -O-, -S(O)0-2- и -NRb;
а независимо выбран из группы, состоящей из 0 и 1;
n независимо выбран из группы, состоящей из 0 и 1;
р независимо выбран из группы, состоящей из 0 и 1;
q независимо выбран из группы, состоящей из 0 и 1; и
r независимо выбран из группы, состоящей из 0 и 1.
В другом аспекте согласно настоящему изобретению предложены новые соединения, где:
Y выбран из группы, состоящей из О и OCH2CH2OCH2;
альтернативно, Y отсутствует;
Z выбран из группы, состоящей из фенила, пиридила и пиримидила, где Z присоединен через атом углерода и замещен 1-3 группами Z1;
Z1 независимо выбран из группы, состоящей из F, Cl, C1-4алкила, C2-4алкенила, C2-4алкинила, ORа, NHOH, NRaNRaRa, NO2, CO2Ra, C(O)Ra, OC(O)Ra, CONRaRa, CF3 и OCF3;
R1 независимо выбран из группы, состоящей из Н, C1-4алкила, (циклопропил)СН2-, бензила, пиридил-СН2-, (фенил)(фенил)-C1-4алкилена, (пиридил)(пиридил)-C1-4алкилена и (фенил)(пиридил)C1-4алкилена, где арильные и гетероарильные кольца замещены 0-2 группами, независимо выбранными из группы, состоящей из F, Cl, CH3, ОН, OCH3, NH2, NHCH3, N(CH3)2, NHOH, NHNH2, NO2, CN, CO2CH3, С(O)CH3, CONH2, C(O)NHCH3, С(O)N(CH3)2, CF3 и OCF3;
R2 выбран из группы, состоящей из Н, ORа, N(Ra)2, фенила и 5-6-членного гетероарила, где арил и гетероарил замещены 0-2 группами, независимо выбранными из группы, состоящей из F, Cl, CH3, CF3 и CH3O;
R3 отсутствует или представляет собой C1-2алкилен,
R4 выбран из группы, состоящей из C2-4алкенила, C2-4алкинила, циклопропила, циклобутила, циклопентила, циклогексила, фенила, нафтила, гетероарила, где циклоалкилы возможно прерваны гетероатомом, выбранным из группы, состоящей из -O-, -S(O)0-2- и -NH-, и алкенил, алкинил, циклоалкил, арил и гетероарил замещены 0-2 группами, независимо выбранными из группы, состоящей из F, Cl, CH3, ОН, OCH3, NH2, NHCH3, N(CH3)2, NHOH, NHNH2, NO2, CN, CO2CH3, С(O)CH3, CONH2, C(O)NHCH3, C(O)N(CH3)2, CF3 и OCF3;
R5 независимо выбран из группы, состоящей из Н и CH3;
n равен 1;
р равен 1;
q независимо выбран из группы, состоящей из 0 и 1; и
r независимо выбран из группы, состоящей из 0 и 1.
В другом аспекте согласно настоящему изобретению предложены новые соединения, где:
Z выбран из группы, состоящей из фенила, пиридила и пиримидила, где Z присоединен через атом углерода и замещен 1 группой Z1; и
Z1 независимо выбран из группы, состоящей из F, Cl, CH3, CH2CH3, ОН, OCH3, NH2, NHCH3, N(CH3)2, NHOH, NHNH2, NO2, CN, CO2CH3, С(O)CH3, CONH2, С(O)NHCH3, С(O)N(CH3)2, CF3 и OCF3.
В другом аспекте согласно настоящему изобретению предложены новые соединения, где соединение является соединением формулы IIa.
В другом аспекте согласно настоящему изобретению предложены новые соединения, где р равен 1.
В другом аспекте согласно настоящему изобретению предложены новые соединения, где r равен 0.
В другом аспекте согласно настоящему изобретению предложены новые соединения, где Y представляет собой О.
В другом аспекте согласно настоящему изобретению предложены новые соединения, где соединение является соединением формулы IIb:
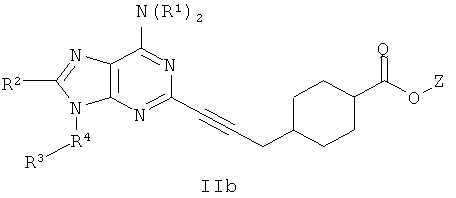
В другом аспекте согласно настоящему изобретению предложены новые соединения, где соединение является соединением формулы IIIa.
В другом аспекте согласно настоящему изобретению предложены новые соединения, где р равен 1.
В другом аспекте согласно настоящему изобретению предложены новые соединения, где r равен 0.
В другом аспекте согласно настоящему изобретению предложены новые соединения, где Y представляет собой О.
В другом аспекте согласно настоящему изобретению предложены новые соединения, где соединение является соединением формулы IIIb:

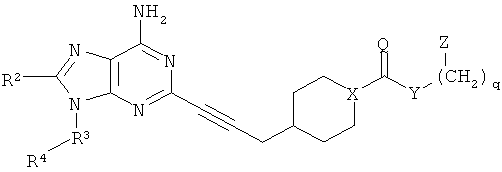
В другом аспекте согласно настоящему изобретению предложены новые соединения, выбранные из:
2-бензилокси-этилового эфира 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты;
2-бензилокси-этилового эфира 4-[3-(6-амино-9-циклопентил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты;
3-трифторметил-фенилового эфира 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты;
3-трифторметил-фенилового эфира 4-[3-(6-амино-9-циклопентил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты;
2-фтор-фенилового эфира 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты;
4-нитро-фенилового эфира 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты;
4-метоксикарбонил-фенилового эфира 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты;
4-хлор-фенилового эфира 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты;
4-метокси-фенилового эфира 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты;
4-метил-фенилового эфира 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты;
4-нитро-бензилового эфира 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты;
2-хлор-фенилового эфира 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты;
2-метокси-фенилового эфира 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты;
2-{3-[1-((3,4-диметил)феноксикарбаноил)пиперидин-4-ил]пропин-1-ил}-9-пропаргиладенина;
2-{3-[1-((3,4-дифтор)феноксикарбаноил)пиперидин-4-ил]пропин-1-ил}-9-пропаргиладенина и
2-{3-[1-((3,4-дихлор)феноксикарбаноил)пиперидин-4-ил]пропин-1-ил}-9-пропаргиладенина.
В другом аспекте изобретения предложена фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по настоящему изобретению и фармацевтически приемлемый носитель.
В другом аспекте изобретения предложен терапевтический способ лечения патологического состояния или симптома у млекопитающего, в которые вовлечена активность аденозиновых A2A рецепторов, и требуется антагонистическое действие в отношении их активности, включающий: введение млекопитающему терапевтически эффективного количества соединения по настоящему изобретению.
В другом аспекте изобретения предложен способ лечения заболевания, включающий: введение терапевтически эффективного количества по меньшей мере одного соединения по настоящему изобретению или его стереоизомера или фармацевтически приемлемой соли, где заболевание выбрано из двигательных расстройств, рака, расстройств, связанных с привыканием (например, к курению, алкоголю, лекарствам).
В другом аспекте изобретения двигательное расстройство выбрано из: болезни Хантингтона, каталепсии, болезни Паркинсона, нарколепсии, прогрессирующего супрануклеарного паралича, множественной системной атрофии, кортикобазальной дегенерации, болезни Вильсона, болезни Халлервордена-Шпатца, прогрессирующей паллидумальной атрофии, ДОФА-чувствительной дистонии-паркинсонизма и мышечной спастичности.
В другом аспекте изобретения предложен терапевтический способ предупреждения или лечения патологического состояния или симптома у млекопитающего, в которые вовлечена активность аденозиновых A2A рецепторов, и требуется антагонистическое действие в отношении активности рецепторов, включающий введение млекопитающему эффективного количества соединения по настоящему изобретению.
В другом аспекте изобретения предложено соединение по настоящему изобретению для применения в лекарственной терапии.
В другом аспекте предложено применение соединения по изобретению для изготовления лекарственного средства, полезного для лечения заболевания у млекопитающего.
Любой аспект или признак настоящего изобретения, характеризующийся как предпочтительный или не характеризующийся как предпочтительный, может быть объединен с любым другим аспектом или признаком изобретения, независимого от того характеризуется ли такой другой признак как предпочтительный или не характеризуется как предпочтительный.
Когда R4-R3- представляет собой Н, тогда имидазольное кольцо соединений по настоящему изобретению может существовать в таутомерных формах или в виде таутомеров (например, алкинильный заместитель может находиться в положении 7 или 9). Специалисту в данной области техники будет понятно, что эти таутомеры включены в объем настоящего изобретения. Называя или ссылаясь на какое-либо соединение, например, также имеют в виду его соответствующий таутомер.
Определения
Примеры, представленные в этой заявке, являются неисключительными, если не оговорено особо. Они включают перечисленные группы, но не ограничены ими.
Если не оговорено особо, упоминание какого-либо признака в единственном числе подразумевает «по меньшей мере один» или «один или более чем один» при использовании в этой заявке, включая формулу изобретения.
Примеры молекулярной массы соединений по настоящему изобретению могут включать: (а) менее чем примерно 500, 550, 600, 650, 700, 750, 800, 850, 900, 950 или 1000 грамм на моль; (б) менее чем примерно 950 грамм на моль; (в) менее чем примерно 850 грамм на моль; и (г) менее чем примерно 750 грамм на моль.
Термин «замещенный» означает, что любой один или более чем один атом водорода в обозначенной группе (или на атоме) замещен выборкой из указанной группы, при условии, что не превышена нормальная валентность обозначенного атома, и что это замещение приводит к стабильному соединению. Когда заместитель представляет собой кето (то есть =O), тогда на атоме замещены 2 водорода. Кето заместители не присутствуют в ароматических группировках. Если допускается более одного заместителя (например, 0-4), тогда каждое число в диапазоне включено отдельно. Например, (а) 0-4 включает 0, 1, 2, 3 и 4, и (б) 0-2 включает 0, 1 и 2.
«Стабильное» означает, что соединение подходит для фармацевтического применения.
Настоящее изобретение охватывает стабильное соединение и тем самым избегает, если не оговорено особо, следующих типов связей:
гетероатом-галоген, N-S, O-S, O-O и S-S.
Настоящее изобретение включает все изотопы атомов, встречающихся в настоящих соединениях. Изотопы включают те атомы, которые имеют одинаковое атомное число, но разные массовые числа. Изотопы водорода включают тритий и дейтерий. Изотопы углерода включают С-13 и С-14.
«Алкил» включает как разветвленные, так и неразветвленные насыщенные алифатические углеводородные группы, имеющие конкретное число атомов углерода. C1-6алкил, например, включает C1, C2, C3, C4, C5 и C6 алкильные группы. Примеры алкила включают метил, этил, н-пропил, изопропил, н-бутил, втop-бутил, трет-бутил, н-пентил и втop-пентил. Когда алкил прерван группой NH, эта группа NH может быть замещена, если заместитель определен как алкильная группа.
«Алкенил» включает конкретное число атомов углерода либо в неразветвленной, либо в разветвленной конфигурации с одной или более чем одной ненасыщенной углерод-углеродной связью, которая может находиться в любой стабильной точке в цепи, например, этенил и пропенил. C2-6алкенил включает C2, C3, C4, C5 и C6 алкенильные группы.
«Алкинил» включает конкретное число атомов углерода либо в неразветвленной, либо в разветвленной конфигурации с одной или более чем одной тройной углерод-углеродной связью, которая может находиться в любой стабильной точке в цепи, например, этинил и пропинил. C2-6алкинил включает C2, C3, C4, C5 и C6 алкинильные группы.
«Галогено» или «галоген» относится к фторо, хлоро, бромо и иодо.
«Циклоалкил» включает конкретное число атомов углерода в насыщенном кольце, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. C3-8циклоалкил включает C3, C4, C5, C6, C7 и C8 циклоалкильные группы. циклоалкил также включает бициклоалкил и трициклоалкил, оба из которых включают конденсированные и мостиковые кольца (например, норборнан и адамантан). Циклоалкильная группа может также быть ненасыщенной, хотя и не ароматической (например, 1-2 двойных связи). Примеры ненасыщенного циклоалкила включают циклопентенил и циклогексенил. Когда циклоалкил прерван группой NH, эта группа NH может быть замещена, если заместитель определен как алкильная группа.
«Арил» относится к любому стабильному 6-, 7-, 8-, 9-, 10-, 11-, 12- или 13-членному моноциклическому, бициклическому или трициклическому кольцу, где по меньшей мере одно кольцо, если присутствует более одного, является ароматическим. Примеры арила включают флуоренил, фенил, нафтил, инданил и тетрагидронафтил.
«Гетероцикл» относится к любому стабильному кольцу, имеющему конкретное число атомов, или 3-, 4-, 5-, 6-, 7-, 8-, 9-, 10-, 11- или 12-членному моноциклическому, бициклическому или трициклическому кольцу, которое является насыщенным или частично ненасыщенным (то есть неароматическим), которое состоит из атомов углерода и 1, 2, 3 или 4 гетероатомов, независимо выбранных из группы, состоящей из N, О и S. В качестве примера, если гетероцикл является 5-6-членным, тогда он состоит из атомов углерода и 1-2 гетероатомов, независимо выбранных из группы, состоящей из N, О и S. Если гетероцикл является бициклическим или три циклическим, тогда по меньшей мере одно из двух или трех колец должно содержать гетероатом, хотя оба или все три, каждое, могут содержать один или более чем один гетероатом. N-группа может представлять собой N, NH или N-заместитель, в зависимости от выбранного кольца, и если заместители перечислены. Гетероатомы азота и серы возможно могут быть окислены (например, S, S(O), S(O)2 и N-O). Гетероцикл может быть присоединен к своей боковой группе по любому гетероатому или атому углерода, что приводит к стабильной структуре. Гетероциклы, описанные здесь, могут быть замещены по атому углерода или азота, если получающееся соединение будет стабильно. Типично, когда общее число атомов S и О в гетероцикле превышает 1, тогда эти гетероатомы не являются смежными друг с другом. Примеры гетероциклов включают гетероциклы, где общее число атомов S и О в гетероцикле составляет 0-1. Примеры гетероциклов включают декагидрохинолинил, дигидрофуран, имидазолидинил, имидазолинил, морфолинил, пиперидинил, пирролидинил и тетрагидрофуранил. Также включены соединения с конденсированными кольцами и спиросоединения, содержащие, например, вышеуказанные гетероциклы.
«Гетероарил» относится к любому стабильному 5-, 6-, 7-, 8-, 9-, 10-, 11- или 12-членному моноциклическому, бициклическому или трициклическому гетероциклическому кольцу, которое является ароматическим, и которое состоит из атомов углерода и 1, 2, 3, 4, 5 или 6 гетероатомов, независимо выбранных из группы, состоящей из N, О и S. Если гетероарильная группа является бициклической или трициклической, тогда по меньшей мере одно из двух или трех колец должно содержать гетероатом, хотя оба или все три, каждое, могут содержать один или более чем один гетероатом. Если гетероарильная группа является бициклической или трициклической, тогда по меньшей мере одно из колец должно быть ароматическим. N-группа может представлять собой N, NH или N-заместитель, в зависимости от выбранного кольца, и если заместители перечислены. Гетероатомы азота и серы возможно могут быть окислены (например, S, S(O), S(O)2 и N-O). Гетероарильное кольцо может быть присоединено к своей боковой группе по любому гетероатому или атому углерода, что приводит к стабильной структуре. Гетероарильные кольца, описанные здесь, могут быть замещены по атому углерода или азота, если получающееся соединение будет стабильно.
Примеры гетероарила включают акридинил, азоцинил, бензимидазолил, бензофуранил, бензотиофуранил, бензотиофенил, бензоксазолил, бензоксазолинил, бензтиазолил, бензтриазолил, бензтетразолил, бензизоксазолил, бензизотиазолил, бензимидазолинил, карбазолил, 4аН-карбазолил, карболинил, хроманил, хроменил, циннолинил, декагидрохинолинил, 2H,6H-1,5,2-дитиазинил, дигидрофуро[2,3-b]тетрагидрофуран, фуранил, фуразанил, имидазолил, 1H-индазолил, индоленил, индолинил, индолизинил, индолил, 3Н-индолил, изатиноил, изобензофуранил, изохроманил, изоиндазолил, изоиндолинил, изоиндолил, изохинолинил, изотиазолил, изоксазолил, нафтиридинил, оксадиазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, оксазолидинил, оксазолил, оксиндолил, пиримидинил, фенантридинил, фенантролинил, феназинил, фенотиазинил, феноксатинил, феноксазинил, фталазинил, птеридинил, пиранил, пиразинил, пиразолил, пиридазинил, пиридооксазол, пиридоимидазол, пиридотиазол, пиридинил, пиридил, пиримидинил, 2Н-пирролил, пирролил, хиназолинил, хинолинил, 4Н-хинолизинил, хиноксалинил, хинуклидинил, тетразолил, 6Н-1,5,2-тиадиазинил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, тиантренил, тиазолил, тиенил, тиенотиазолил, тиенооксазолил, тиеноимидазолил, тиофенил, триазинил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,5-триазолил, 1,3,4-триазолил и ксантенил.
«Млекопитающее» и «пациент» охватывают теплокровных млекопитающих, которым обычно оказывают медицинскую помощь (например, люди и домашние животные). Примеры млекопитающих включают (а) кошку, собаку, лошадь, корову и человека и (б) человека.
«Проведение лечения» или «лечение» охватывает лечение болезненного состояния у млекопитающего и включает: (а) предупреждение возникновения болезненного состояния у млекопитающего, в частности, когда такое млекопитающее предрасположено к болезненному состоянию, но оно еще не диагностировано; (б) подавление болезненного состояния, например, прекращение его развития; и/или (в) облегчение болезненного состояния, например, вызывание регрессии болезненного состояния до тех пор, пока не будет достигнут желаемый результат. Проведение лечения также включает уменьшение интенсивности симптома заболевания (например, облегчение боли или дискомфорта), при котором подобное уменьшение может или не может непосредственно влиять на заболевание (например причину, передачу, проявление и так далее).
«Фармацевтически приемлемые соли» относятся к производным раскрытых соединений, где исходное соединение модифицировано посредством получения его кислой или основной соли. Примеры фармацевтически приемлемых солей включают соли неорганических или органических кислот основных остатков, таких как амины; щелочные или органические соли кислотных остатков, таких как карбоновые кислоты, и тому подобное, но не ограничены ими. Фармацевтически приемлемые соли включают обычные нетоксичные соли или четвертичные аммониевые соли исходного соединения, образованные, например, из нетоксичных неорганических или органических кислот. Например, такие обычные нетоксичные соли включают соли, образованные из неорганических и органических кислот, выбранных из 1,2-этандисульфоновой, 2-ацетоксибензойной, 2-гидроксиэтансульфоновой, уксусной, аскорбиновой, бензолсульфоновой, бензойной, бикарбоновой, карбоновой, лимонной, эдетовой, этандисульфоновой, этансульфоновой, фумаровой, глюкогептоновой, глюконовой, глутаминовой, гликолевой, гликолиларсаниловой, гексилрезорциновой, гидрабаминовой, бромистоводородной, соляной, иодистоводородной, гидроксималеиновой, гидроксинафтойной, изэтионовой, молочной, лактобионовой, лаурилсульфоновой, малеиновой, яблочной, миндальной, метансульфоновой, напсиловой, азотной, щавелевой, памовой, пантотеновой, фенилуксусной, фосфорной, полигалактуроновой, пропионовой, салициловой, стеариновой, субуксусной, янтарной, сульфаминовой, сульфаниловой, серной, дубильной, винной и толуолсульфоновой кислот.
Фармацевтически приемлемые соли по настоящему изобретению могут быть синтезированы из исходного соединения, которое содержит основную или кислотную группировку, посредством обычных химических способов. Как правило, такие соли могут быть получены путем осуществления взаимодействия свободнокислотных или основных форм этих соединений со стехиометрическим количеством соответствующего основания или кислоты в воде или в органическом растворителе или в их смеси; как правило, желательны неводные среды подобные эфиру, этилацетату, этанолу, изопропанолу или ацетонитрилу. Перечни подходящих солей имеются в Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing Company, Easton, PA, 1990, p 1445, раскрытие сущности которой включено здесь в виде ссылки.
«Терапевтически эффективное количество» включает количество соединения по настоящему изобретению, которое является эффективным при введении отдельно или в комбинации для лечения показания, перечисленного здесь. «Терапевтически эффективное количество» также включает количество комбинации заявленных соединений, которое является эффективным для лечения требуемого показания. Комбинация соединений может быть синергической комбинацией. Синергизм, как описано, например, Chou and Talalay, Adv. Enzyme Regul. 1984, 22:27-55, возникает, когда эффект соединений при введении в комбинации больше, чем аддитивный эффект соединений при введении отдельно в виде единственных агентов. Обычно синергический эффект наиболее ярко демонстрируется при субоптимальных концентрациях соединений. Синергизм может проявляться в пониженной цитотоксичности, повышенном эффекте или каком-либо другом положительном эффекте комбинации по сравнению с отдельными компонентами.
Соединения по настоящему изобретению могут иметь один или более чем один асимметрический центр и могут существовать и быть выделены в оптически активных и рацемических формах. Некоторые соединения могут проявлять полиморфизм. Настоящее изобретение охватывает любую рацемическую, оптически активную, полиморфную или стереоизомерную форму или смеси этих форм соединения по изобретению, которые обладают полезными свойствами, описанными здесь; в данной области техники хорошо известно, как получить оптически активные формы (например, посредством разделения рацемической формы способами перекристаллизации, посредством синтеза из оптически активных исходных веществ, посредством хирального синтеза или посредством хроматографического разделения с использованием хиральной стационарной фазы) и как определить терапевтическую активность при использовании стандартных тестов, описанных здесь, или при использовании других подобных тестов, которые хорошо известны в данной области техники.
Примеры стереоизомеров по настоящему изобретению включают соединения формул A-F (а также таутомерные формы, которые не показаны).
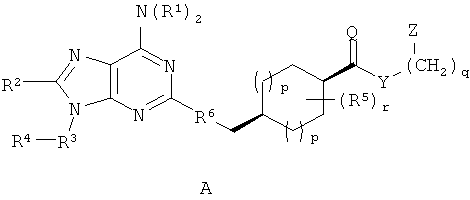
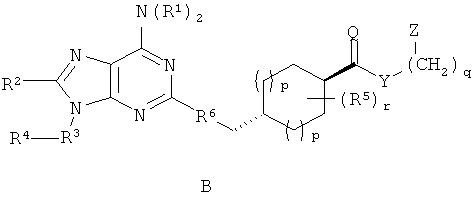
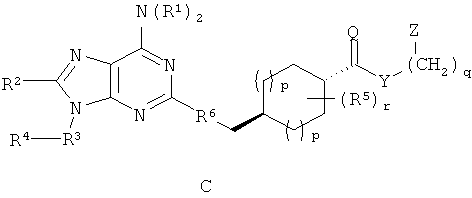


Специфические значения, перечисленные для радикалов, заместителей и диапазонов, даны только для иллюстрации; они не исключают других определенных значений или других значений в пределах определенных диапазонов для радикалов и заместителей.
Дозировка и изготовление лекарственных средств
Соединения по настоящему изобретению могут быть приготовлены в виде фармацевтических композиций и введены млекопитающему-хозяину, такому как пациент-человек, в разнообразных формах, предназначенных для выбранного пути введения, например перорального или парентерального, посредством внутривенного, внутримышечного, местного, ингаляционного или подкожного путей введения. Характерные фармацевтические композиции раскрыты в "Remington: The Science and Practice of Pharmacy", A. Gennaro, ed., 20th edition, Lippincott, Williams & Wilkins, Philadelphia, PA.
Настоящие соединения можно вводить системно, например перорально, в комбинации с фармацевтически приемлемым носителем, таким как инертный разбавитель или усвояемый, пригодный к употреблению в пищу носитель. Они могут быть заключены в желатиновые капсулы с твердой или мягкой оболочкой, могут быть спрессованы в таблетки или могут быть введены непосредственно в пищевой рацион пациента. Для перорального терапевтического введения активное соединение может быть объединено с одним или более чем одним носителем и использовано в форме таблеток для приема внутрь, трансбуккальных таблеток, пастилок, капсул, эликсиров, суспензий, сиропов, облаток и тому подобного. Такие композиции и препараты должны содержать по меньшей мере 0,1% активного соединения. Процентное содержание композиций и препаратов может изменяться и может удобным образом составлять от примерно 2 до примерно 60% от массы данной стандартной лекарственной формы. Количество активного соединения в таких терапевтически полезных композициях является таким, чтобы был достигнут эффективный уровень дозы.
Таблетки, пастилки, пилюли, капсулы и тому подобное могут также содержать следующее: связующие вещества, такие как трагакантовая камедь, аравийская камедь, кукурузный крахмал или желатин; носители, такие как дикальцийфосфат; разрыхлитель, такой как кукурузный крахмал, картофельный крахмал, альгиновая кислота и тому подобное; смазывающее вещество, такое как стеарат магния; и подсластитель, такой как сахароза, фруктоза, лактоза или аспартам или ароматизатор, такой как перечная мята, масло гаультерии или вишневый ароматизатор могут быть добавлены. Когда стандартная лекарственная форма представляет собой капсулу, она может содержать, кроме веществ вышеприведенного типа, жидкий носитель, такой как растительное масло или полиэтиленгликоль. Другие различные вещества могут присутствовать в качестве оболочек или для иной модификации физической формы твердой стандартной лекарственной формы. Например, таблетки, пилюли или капсулы могут быть покрыты желатином, воском, шеллаком или сахаром и тому подобным. Сироп или эликсир может содержать активное соединение, сахарозу или фруктозу в качестве подсластителя, метил- и пропилпарабены в качестве консервантов, краситель и ароматизатор, такой как вишневая или апельсиновая отдушка. Следует понимать, что любое вещество, применяемое в изготовлении любой стандартной лекарственной формы, должно быть фармацевтически приемлемым и по существу нетоксичным в используемых количествах. Кроме того, активное соединение может быть включено в препараты и устройства длительного высвобождения.
Активное соединение может быть также введено внутривенно или внутрибрюшинно посредством инфузии или инъекции. Растворы активного соединения или его солей могут быть приготовлены в воде, возможно смешанной с нетоксичным поверхностно-активным веществом. Дисперсии могут быть также приготовлены в глицерине, жидких полиэтиленгликолях, триацетине и их смесях и в маслах. При нормальных условиях хранения и применения эти препараты содержат консервант для предотвращения роста микроорганизмов.
Фармацевтические лекарственные формы, подходящие для инъекции или инфузии, могут включать стерильные водные растворы или дисперсии или стерильные порошки, содержащие активный ингредиент, которые предназначены для экстемпорального приготовления стерильных инъекционных или инфузионных растворов или дисперсий, возможно инкапсулированных в липосомы. Во всех случаях конечная лекарственная форма должна быть стерильной, текучей и стабильной в условиях производства и хранения. Жидкая основа или носитель могут представлять собой растворитель или жидкую дисперсионную среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль, жидкие полиэтиленгликоли и тому подобное), растительные масла, нетоксичные сложные эфиры глицерина и их подходящие смеси. Подходящую текучесть можно поддерживать, например, посредством образования липосом, посредством поддержания требуемого размера частиц в случае дисперсий или посредством применения поверхностно-активных веществ. Предупреждения деятельности микроорганизмов можно достичь с помощью различных антибактериальных и противогрибковых агентов, например парабенов, хлорбутанола, фенола, сорбиновой кислоты, тимеросала и тому подобных. Во многих случаях может быть желательно включать агенты, придающие изотоничность, например сахара, буферные растворы или хлорид натрия. Пролонгированной абсорбции инъекционных композиций можно достичь посредством использования в композициях агентов, замедляющих абсорбцию, например моностеарата алюминия и желатина.
Стерильные инъекционные растворы готовят посредством введения активного соединения в требуемом количестве в соответствующий растворитель с некоторыми другими ингредиентами, перечисленными выше, в случае необходимости, с последующей стерилизацией посредством фильтрации. В случае стерильных порошков для приготовления стерильных инъекционных растворов желательные способы приготовления включают технологии вакуумной сушки и лиофилизации, которые дают порошок активного ингредиента плюс любой дополнительный желаемый ингредиент, присутствующий в предварительно стерилизованных посредством фильтрации растворах.
Для местного введения настоящие соединения могут быть использованы в чистой форме, то есть в тех случаях, когда они представляют собой жидкости. Однако в большинстве случаев будет желательно наносить их на кожу в виде композиций или препаратов в комбинации с дерматологически приемлемым носителем, который может представлять собой твердое вещество или жидкость.
Полезные твердые носители включают тонко измельченные твердые вещества, такие как тальк, глина, микрокристаллическая целлюлоза, диоксид кремния, оксид алюминия и тому подобное. Полезные жидкие носители включают воду, спирты или гликоли или водно-спиртовые/гликолевые смеси, в которых настоящие соединения могут быть растворены или диспергированы в эффективных уровнях дозировки, возможно с помощью нетоксичных поверхностно-активных веществ. Адъюванты, такие как ароматизирующие вещества и дополнительные антимикробные агенты, могут быть добавлены для оптимизации свойств для данного применения. Полученные жидкие композиции могут быть нанесены с гигроскопических прокладок, используемых для импрегнированных бинтов и других повязок, или нанесены распылением на поврежденный участок при использовании помповых или аэрозольных распылителей.
Загустители, такие как синтетические полимеры, жирные кислоты, соли и сложные эфиры жирных кислот, жирные спирты, модифицированные целлюлозы или модифицированные минеральные вещества, также могут быть использованы с жидкими носителями для образования легко распределяющихся паст, гелей, мазей, мыл и тому подобного для применения непосредственно на кожу потребителя.
Примеры полезных дерматологических композиций, которые могут быть использованы для доставки соединений по настоящему изобретению в кожу, известны в данной области техники; например, см. Jacquet et al. (патент США №4608392), Geria (патент США №4992478), Smith et al. (патент США №4559157) и Wortzman (патент США №4820508). Полезные дозировки соединений по настоящему изобретению могут быть определены посредством сравнения их активности in vitro и активности in vivo в экспериментальных моделях на животных. Способы экстраполяции эффективных дозировок с мышей и других животных на людей известны в данной области техники; например, см. патент США №4938949.
Как правило, концентрация соединения(й) по настоящему изобретению в жидкой композиции, такой как лосьон, будет составлять (а) примерно 0,1-25 мас.% и (б) примерно 0,5-10 мас.%. Концентрация в полутвердой или твердой композиции, такой как гель или порошок, будет составлять (а) примерно 0,1-5 мас.% и (б) примерно 0,5-2,5 мас.%.
Количество соединения или его активной соли или производного, требуемое для применения в лечении будет изменяться не только в соответствии с конкретным выбранным соединением или солью, но также в соответствии с путем введения, природой состояния, которое подвергают лечению, и возрастом и состоянием пациента и будет оставаться в конечном итоге на усмотрение лечащего врача или клинициста. Однако обычно подходящая доза будет находиться в пределах (а) примерно 1,0-100 мг/кг массы тела в сутки, (б) примерно 10-75 мг/кг массы тела в сутки и (в) примерно 5-20 мг/кг массы тела в сутки.
Соединение удобно вводить в стандартной лекарственной форме, например таблетках, каплетах и так далее, содержащих (а) примерно 4-400 мг, (б) примерно 10-200 мг и (в) примерно 20-100 мг активного ингредиента на стандартную лекарственную форму.
В идеале активный ингредиент следует вводить так, чтобы достичь максимальных концентраций активного соединения в плазме (а) примерно 0,02-20 мкМ, (б) примерно 0,1-10 мкМ и (в) примерно 0,5-5 мкМ. Этих концентраций можно достичь, например, посредством внутривенной инъекции 0,005-0,5% раствора активного ингредиента или перорального введения в виде болюса, содержащего примерно 4-400 мг активного ингредиента.
Соединения по изобретению также могут быть введены посредством ингаляции из ингалятора, инсуффлятора, распылителя или упаковки под давлением или других средств доставки распыляемого аэрозоля. Упаковки под давлением могут содержать подходящий пропеллент, такой как диоксид углерода или другой подходящий газ. В случае аэрозоля под давлением единица дозировки может быть определена путем предложения клапана для доставки отмеренного количества. Ингаляторы, инсуффляторы, распылители подробно описаны в фармацевтических справочниках, таких как Remington's Pharmaceutical Sciences Volumes 16 (1980) or 18 (1990) (Mack Publishing Co.).
Желаемая доза может быть удобно представлена в виде однократной дозы или в виде разделенных доз, вводимых через соответствующие интервалы, например, в виде двух, трех, четырех или более суб-доз в сутки. Сами суб-дозы могут быть дополнительно разделены, например, на ряд прерывистых введений со свободными промежутками, таких как многократные ингаляции из инсуффлятора, или посредством внесения некоторого количества капель в глаз.
Все патенты, заявки на патенты, книги и литература, цитируемые в описании, включены, таким образом, в виде ссылки во всей своей полноте. В случае любых несоответствий настоящее раскрытие сущности изобретения, включая любые определения в нем, будет иметь приоритетное значение.
Изобретение описано со ссылкой на различные конкретные и подробные аспекты и методики. Однако следует понимать, что многие изменения и модификации могут быть сделаны, оставаясь в пределах сущности и объема изобретения. Настоящее изобретение, полностью описанное таким образом, будет легче понять с помощью следующих примеров, которые представлены в качестве иллюстрации и не предназначены для ограничения настоящего изобретения.
Примеры
Фармакология
Способность соединений по изобретению действовать в качестве антагониста аденозиновых A2A рецепторов может быть определена с использованием фармакологических моделей, которые хорошо известны в данной области техники (например, см. публикацию заявки на патент Соединенных Штатов №2005/0282831).
Подразумевают, что соединения по настоящему изобретению являются антагонистами аденозиновых A2A рецепторов. Считают, что соединения по настоящему изобретению являются антагонистами аденозиновых A2A рецепторов, если они имеют величину IC50 менее или равную 1 мкМ. Было протестировано и показано, что типичные соединения являются активными, так как их величины IC50, как установили, находятся в пределах ≤1 мкМ. Дополнительные примеры желательных уровней активности антагонистов аденозиновых A2A рецепторов, полезных в настоящем изобретении, включают (а) величину IC50 0,1 мкМ или ниже, (б) величину IC50 0,01 мкМ или ниже, (в) величину IC50 0,001 мкМ или ниже и (г) величину IC50 0,0001 мкМ или ниже.
Также может быть полезным, что соединения по настоящему изобретению являются селективными к A2A рецепторам по сравнению с другими аденозиновыми рецепторами А1, A2B и А3. 3-кратная селективность к A2A по сравнению с A1 будет составлять, например, 100 нМ к А2А и 300 нМ к A1 (300/100=3). Примеры селективности к A2A по сравнению с A1 включают (а) по меньшей мере 3-кратную к А2А; (б) по меньшей мере 4-кратную к A2A; (в) по меньшей мере 5-кратную к A2A; (г) по меньшей мере 10-кратную к A2A; (д) по меньшей мере 20-кратную к A2A и (е) по меньшей мере 100-кратную к А2А. Примеры селективности к A2A по сравнению с A2В включают (а) по меньшей мере 3-кратную к A2A; (б) по меньшей мере 4-кратную к A2A; (в) по меньшей мере 5-кратную к A2A; (г) по меньшей мере 10-кратную к A2A; (д) по меньшей мере 20-кратную к A2A и (е) по меньшей мере 100-кратную к A2A. Примеры селективности к А2A по сравнению с А3 включают (а) по меньшей мере 3-кратную к А2A; (б) по меньшей мере 4-кратную к A2A; (в) по меньшей мере 5-кратную к А2А; (г) по меньшей мере 10-кратную к А2А; (д) по меньшей мере 20-кратную к А2A и (е) по меньшей мере 100-кратную к A2A.
Примеры по настоящему изобретению показаны ниже в таблице А.


Синтез и характеристика
Спектроскопию протонного ядерного магнитного резонанса проводили на спектрометре Varian-300 МГц и спектры снимали в растворе при использовании либо CD3OD, CDCl3, либо ДМСО-d6 (дейтерированный диметилсульфоксид) в качестве растворителя. Если не указано иначе, химические сдвиги выражены в виде млн-1 в сторону слабого поля от CD3OD (3.30 млн-1), CDCl3 (7.26 млн-1) или ДМСО-d6 (2.5 млн-1). Масс-спектрометрию с ионизацией электрораспылением проводили на масс-спектрометре LCQ ThermoFinnigan.
Типичный способ NS-аминозамещения: 2-иодаденозин

Суспензию 6-хлор-2-иод-9-(2',3',5'-O-триацетилфуранозил)-9Н-пурина (14,70 г; 0,02729 моль) в МеОН (300 мл) охлаждали на ледяной бане. Затем барботировали газообразный аммиак через смесь до тех пор, пока она не становилась насыщенной. Реакционный сосуд герметизировали и нагревали при 40°С в течение 18 часов и при 60°С в течение 5 суток. Смесь охлаждали на льду и газообразный аммиак барботировали через раствор, а смесь оставляли для нагревания до комнатной температуры. Растворитель затем удаляли при пониженном давлении и неочищенный продукт перекристаллизовывали из воды, содержащей 3-4 капли ледяной уксусной кислоты. Полученный осадок фильтровали и промывали водой и эфиром с получением белого твердого вещества: выход 7,167 г; 67%.
Типичный способ С2-сочетания: 2-{3-[1-((2-хлор)феноксикарбаноил)-пиперидин-4-ил]пропин-1-ил}аденозин
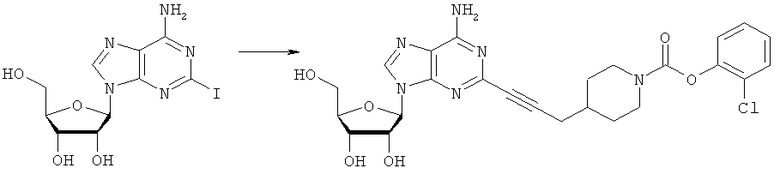
К раствору 2-иодаденозина (0,602 г; 1,531 ммоль) в свежедегазированном ДМФА (диметилформамид) (20 мл) добавляли дегазированный триэтиламин (1,20 мл; 8,54 ммоль), Pd(PPh3)4 (85 мг; 0,074 ммоль), CuI (каталитическое количество) и 2-хлорфенил-4-(проп-2-инил)пиперидин-1-карбоксилат (0,588 г; 2,117 ммоль). Смесь перемешивали при комнатной температуре в атмосфере инертного газа в течение 20 часов. Добавляли кремний-связанный Pd(II) поглотитель Si-тиол (400 мг) и Pd(0) поглотитель Si-TAAcOH (619 мг) и продолжали перемешивание в течение еще 72 часов. Суспензию фильтровали через целит и полученный раствор упаривали досуха. Неочищенный продукт очищали посредством колоночной хроматографии, элюируя градиентом ДХМ (дихлорметан)/МеОН (0-4%) с получением чистого продукта в виде белого твердого вещества: выход 0,733 г; 88%.
Типичный способ отщепления рибозы: 2-хлорфениловый эфир 4-[3-(6-амино-9Н-пурин-2-ил)проп-2-инил]пиперидин-1-карбоновой кислоты
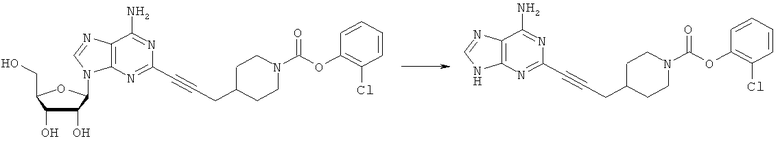
Раствор 2-{3-[1-((2-хлор)феноксикарбаноил)пиперидин-4-ил]пропин-1-ил}аденозина (0,720 г; 1,326 ммоль) в метаноле (25 мл) и 1,0 М HCl (2,50 мл) перемешивали при 90°С в аппарате под давлением в течение 22 часов. рН доводили до 5 с использованием 1,0 М NaOH и метанол удаляли при пониженном давлении. После охлаждения полученный осадок фильтровали и промывали водой с получением чистого продукта в виде белого твердого вещества: выход 1,481 г; 88%.
Типичный способ N9-алкилирования с использованием соответствующего алкилгалогенида или алкилтозилата
Соответствующий 9-незамещенный аденин (0,099 ммоль) растворяли в ДМФА (10 мл). Добавляли безводный карбонат калия (38 мг; 0,275 ммоль) и соответствующий алкилгалогенид (0,121 ммоль) или алкилтозилат и смесь перемешивали при 25-100°С в течение 17-71 часов. Реакционную смесь присоединяли к диоксиду кремния и очищали посредством колоночной хроматографии, элюируя градиентом ДХМ/МеОН (0-6%) с получением чистого продукта.
Пример 1: фениловый эфир 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты
Применение типичного способа N9-алкилирования вышеуказанного фенилового эфира 4-[3-(6-амино-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты (42 мг) дало указанное в заголовке соединение в виде белого твердого вещества: выход 16 мг, 35%. 1H ЯМР (CD3OD) δ 8.21 (s, 1H), 7.39-7.32, 7.22-7.16, 7.10-7.06 (3×m, 5H), 5.03 (d, 2H, J=2,6 Гц), 4.41-4.12 (m, 2H), 3.07, 2.93 (2×m, 2H), 2.98 (t, 1H, J=2,6 Гц), 2.49 (d, 2H, J=6,2 Гц), 2.02-1.81, 1.53-1.33 (2×m, 5H). 13С ЯМР (CD3OD) δ 157.1, 155.5, 152.9, 150.5, 147.9, 142.6, 130.3, 126.4, 122.9, 119.3, 86.3, 82.5, 77.6, 75.9, 45.7, 45.4, 36.5, 33.9, 32.6, 32.3, 26.5. LRMS ESI (M+H+) 415,2.
Пример 2: фениловый эфир 4-[3-(6-амино-9-циклопентил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты
Применение типичного способа N9-алкилирования вышеуказанного фенилового эфира 4-[3-(6-амино-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты (47 мг) дало указанное в заголовке соединение в виде белого твердого вещества: выход 30 мг, 53%. 1H ЯМР (CD3OD) δ 8.20 (s, 1H), 7.39-7.32, 7.23-7.16, 7.11-7.06 (3×m, 5H), 4.90 (m, 1H), 4.42-4.14 (m, 2H), 3.08, 2.93 (2×m, 2H), 2.49 (d, 2H, J=6,3 Гц), 2.32-1.18, 2.07-1.73, 1.55-1.32 (3×m, 13Н). 13С ЯМР (CD3OD) δ 157.0, 155.5, 152.9, 150.9, 147.5, 141.2, 130.3, 126.4, 122.9, 119.7, 85.9, 82.7, 57.5, 45.7, 45.5, 36.6, 33.6, 32.6, 32.4, 26.5, 24.8. LRMS ESI (M+H+) 445,2.
Пример 3: 2-бензилокси-этиловый эфир 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты
Применение типичного способа N9-алкилирования вышеуказанного 2-бензилокси-этилового эфира 4-[3-(6-амино-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты (25 мг) дало указанное в заголовке соединение в виде белого твердого вещества: выход 20 мг, 74%. 1H ЯМР (CD3OD) δ 8.20 (s, 1Н), 7.32-7.20 (m, 5Н), 5.01 (d, 2H, J=2,6 Гц), 4.53 (s, 2H), 4.27-4.09 (m, 4H), 3.67 (t, 2H, J=4,7 Гц), 2.98 (t, 1Н, J=2,6 Гц), 2.91-2.73 (m, 2H), 2.42 (d, 2H, J=6,3 Гц), 2.91-1.73, 1.37-1.20 (2×m, 5Н). 13С ЯМР (CD3OD) δ 157.0 (×2), 150.4, 147.9, 142.5, 139.5, 129.4, 128.8, 128.7, 119.3, 86.3, 82.5, 77.6, 75.9, 74.0, 69.5, 65.8, 45.1, 36.6, 33.9, 32.5, 26.5. LRMS ESI (M+H+) 473,2.
Пример 4: 2-бензилокси-этиловый эфир 4-[3-(6-амино-9-циклопентил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты
Применение типичного способа N9-алкилирования вышеуказанного 2-бензилокси-этилового эфира 4-[3-(6-амино-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты (21 мг) дало указанное в заголовке соединение в виде белого твердого вещества: выход 10 мг, 41%. 1H ЯМР (CD3OD) δ 8.19 (s, 1Н), 7.33-7.20 (m, 5Н), 4.88 (m, 1Н), 4.53 (s, 2H), 4.29-4.10 (m, 4H), 3.67 (t, 2H, J=4,7 Гц), 2.83 (m, 2H), 2.42 (d, 2H, J=6,0 Гц), 2.30-2.16, 2.05-1.70, 1.38-1.21 (3×m, 13H). 13С ЯМР (CD3OD) δ 157.0 (×2), 150.9, 147.5, 141.4, 139.5, 129.4, 128.8, 128.7, 119.7, 85.9, 82.7, 74.0, 69.5, 65.8, 57.5, 45.1, 36.6, 33.6, 32.5, 26.5, 24.8. LRMS ESI (M+H+) 503,4.
Пример 5: 3-трифторметил-фениловый эфир 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты
Применение типичного способа N9-алкилирования вышеуказанного 3-трифторметил-фенилового эфира 4-[3-(6-амино-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты (48 мг) дало указанное в заголовке соединение в виде белого твердого вещества: выход 34 мг, 65%. 1H ЯМР (CD3OD) δ 8.21 (s, 1Н), 7.60-7.35 (m, 4H), 5.03 (d, 2H, J=2,6 Гц), 4.40-4.29, 4.25-4.14 (2×m, 2H), 3.08, 2.93 (2×m, 2H), 2.98 (t, 1Н, J=2,6 Гц), 2.48 (d, 2H, J=6,5 Гц), 2.01-1.80, 1.54-1.33 (2×m, 5H). 13С ЯМР (CD3OD) δ 157.1, 154.7, 153.2, 150.5, 147.9, 142.6, 132.7 (q), 131.3, 126.8, 123.4, 123.1, 120.1, 119.3, 86.2, 82.6, 77.6, 75.9, 45.8, 45.5, 36.5, 33.9, 32.6, 32.3, 26.5. LRMS ESI (M+H+) 483,3.
Пример 6: 3-трифторметил-фениловый эфир 4-[3-(6-амино-9-циклопентил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты
Применение типичного способа N9-алкилирования вышеуказанного 3-трифторметил-фенилового эфира 4-[3-(6-амино-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты (38 мг) дало указанное в заголовке соединение в виде белого твердого вещества: выход 16 мг, 37%. 1H ЯМР (CD3OD) δ 8.20 (s, 1H), 7.61-7.35 (m, 4H), 4.89 (m, 1H), 4.35, 4.20 (2×m, 2H), 3.09, 2.94 (2×m, 2H), 2.48 (d, 2H, J=6,3 Гц), 2.32-2.17, 2.06-1.72, 1.55-1.34 (3×m, 13Н). 13С ЯМР (CD3OD) δ 157.0, 154.7, 153.2, 150.9, 147.4, 141.4, 132.7 (q), 131.3, 126.8, 123.4, 123.1, 120.1, 119.7, 85.9, 82.7, 57.5, 45.8, 45.5, 36.5, 33.6, 32.3, 26.5, 24.8. LRMS ESI (M+H+) 513,4.
Пример 7: 2-фтор-фениловый эфир 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты
Применение типичного способа N9-алкирования вышеуказанного 4-фтор-фенилового эфира 4-[3-(6-амино-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты (77 мг) дало указанное в заголовке соединение в виде белого твердого вещества: выход 50 мг, 59%. 1H ЯМР (CD3OD) δ 8.21 (s, 1H), 7.10 (s, 2H), 7.07 (d, 2H, J=1,6 Гц), 5.03 (d, 2H, J=2,6 Гц), 4.32, 4.19 (2×m, 2H), 3.06, 2.91 (2×m, 2H), 2.98 (t, 1H, J=2,6 Гц), 2.48 (d, 2H, J=6,3 Гц), 2.00-1.80, 1.52-1.31 (2×m, 5H). 13С ЯМР (CD3OD) δ 163.1, 159.9, 157.1, 155.4, 150.5, 148.9 (d), 147.9, 142.6, 124.6, 124.4, 119.3, 116.9, 116.6, 86.2, 82.6, 77.6, 75.9, 45.7, 45.4, 36.5, 33.9, 32.6, 32.3, 26.5. LRMS ESI (M+H+) 433,2.
Пример 8: 4-нитро-фениловый эфир 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты
Применение типичного способа N9-алкилирования вышеуказанного 4-нитро-фенилового эфира 4-[3-(6-амино-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты (64 мг) дало указанное в заголовке соединение в виде белого твердого вещества: выход 29 мг, 42%. 1H ЯМР (CDCl3) δ 8.23 (d, 2H), 8.08 (s, 1H), 7.29 (d, 2H), 6.44 (br s, 2H), 4.98 (d, 2H), 4.29 (m, 2H), 3.03, 2.89 (2×m, 2H), 2.55 (t, 1H), 2.52 (d, 2H), 2.05-1.85, 1.51-1.32 (2×m, 5H). 13С ЯМР (CDCl3) δ 156.4, 154.6, 152.2, 149.5, 145.3, 144.8, 140.7, 125.0, 122.2, 118.7, 86.5, 80.8, 77.2, 75.5, 44.8, 44.4, 35.1, 33.3, 31.7, 31.3, 26.1. LRMS ESI (M+H+) 460,2.
Пример 9: 4-метоксикарбонил-фениловый эфир 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты
Применение типичного способа N9-алкилирования вышеуказанного 4-метоксикарбонил-фенилового эфира 4-[3-(6-амино-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты (57 мг) дало указанное в заголовке соединение в виде белого твердого вещества: выход 34 мг, 55%. 1H ЯМР (CDCl3) δ 8.06 (s, 1Н), 8.02 (d, 2Н, J=8,7 Гц), 7.17 (d, 2Н, J=8,8 Гц), 6.36 (br s, 2H), 4.97 (d, 2Н, J=2,6), 4.29 (m, 2Н), 3.89 (s, 3H), 2.99, 2.86 (2×m, 2Н), 2.54 (t, 1Н, J=2,6 Гц), 2.48 (d, 2Н, J=6,5 Гц), 2.02-1.82, 1.49-1.30 (2×m, 5H). 13C ЯМР (CDCl3) δ 166.4, 155.2, 154.9, 152.8, 149.5, 145.8, 140.5, 130.9, 126.9, 121.5, 118.7, 86.1, 81.1, 75.6, 75.4, 52.0, 44.6, 44.3, 35.2, 33.2, 31.7, 31.4, 26.2. LRMS ESI (M+H+) 473,2.
Пример 10: 4-хлор-фениловый эфир 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты
Применение типичного способа N9-алкилирования вышеуказанного 4-хлор-фенилового эфира 4-[3-(6-амино-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты (41 мг) дало указанное в заголовке соединение в виде белого твердого вещества; выход 30 мг, 67%. 1H ЯМР (CD3OD) δ 8.21 (s, 1Н), 7.34 (d, 2Н, J=8,9 Гц), 7.09 (d, 2Н, J=8,9 Гц), 5.02 (d, 2Н, J=2,6 Гц), 4.31, 4.18 (2×m, 2Н), 3.06, 2.91 (2×m, 2Н), 2.98 (t, 1Н, J=2,6 Гц), 2.47 (d, 2H, J=6,3 Гц), 2.00-1.79, 1.51-1.31 (2×m, 5H). 13С ЯМР (CD3OD) δ 157.1, 155.0, 151.6, 150.4, 147.9, 142.6, 131.7, 130.3, 124.5, 119.3, 86.2, 82.5, 77.6, 75.9, 45.7, 45.4, 36.5, 33.9, 32.6, 32.3, 26.5. LRMS ESI (M+H+) 449,1.
Пример 11: 4-метокси-фениловый эфир 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты
Применение типичного способа N9-алкилирования вышеуказанного 4-метокси-фенилового эфира 4-[3-(6-амино-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты (39 мг) дало указанное в заголовке соединение в виде белого твердого вещества: выход 32 мг, 75%. 1H ЯМР (CD3OD) δ 8.21 (s, 1Н), 6.98 (d, 2H, J=9,1 Гц), 6.87 (d, 2H, J=9,1 Гц), 5.02 (d, 2H, J=2,5 Гц), 4.32, 4.18 (2×m, 2H), 3.76 (s, 3H), 3.04, 2.89 (2×m, 2H), 2.99 (t, 1Н, J=2,6 Гц), 2.47 (d, 2H, J=6,3 Гц), 2.00-1.79, 1.51-1.30 (2×m, 5H). 13С ЯМР (CD3OD) 5 158.6, 157.1, 155.9, 150.4, 147.9, 146.3, 142.5, 123.6, 119.3, 115.3, 86.3, 82.5, 77.6, 75.9, 56.1, 45.6, 45.4, 36.5, 33.9, 32.6, 32.3, 26.5. LRMS ESI (M+H+) 445,2.
Пример 12: 4-метил-фениловый эфир 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты
Применение типичного способа N9-алкилирования вышеуказанного 4-метил-фенилового эфира 4-[3-(6-амино-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты (38 мг) дало указанное в заголовке соединение в виде белого твердого вещества: выход 27 мг, 65%. 1H ЯМР (CD3OD) δ 8.21 (s, 1H), 7.14 (d, 2H, J=8,5 Гц), 6.94 (d, 2H, J=8,4 Гц), 5.02 (d, 2H, J=2,6 Гц), 4.33, 4.19 (2×m, 2H), 3.05, 2.90 (2×m, 2H), 2.98 (t, 1H, J=2,6 Гц), 2.47 (d, 2H, J=6,3 Гц), 2.00-1.79, 1.51-1.32 (2×m, 5H). 13С ЯМР (CD3OD) δ 157.1, 155.7, 150.6, 150.4, 147.9, 142.5, 136.2, 130.7, 122.6, 119.3, 86.3, 82.5, 77.6, 75.9, 45.6, 45.4, 36.5, 33.9, 32.6, 32.3, 26.5, 20.8. LRMS ESI (M+H+) 429,2.
Пример 13: 4-нитро-бензиловый эфир 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты
Применение типичного способа N9-алкилирования вышеуказанного 4-нитро-бензилового эфира 4-[3-(6-амино-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты (43 мг) дало указанное в заголовке соединение в виде белого твердого вещества: выход 37 мг, 79%. 1H ЯМР (CD3OD) δ 8.24 (d, 2H, J=8,8 Гц), 8.21 (s, 1H), 7.59 (d, 2H, J=8,9 Гц), 5.24 (s, 2H), 5.02 (d, 2H, J=2,5 Гц), 4.22 (m, 2H), 2.98 (t, 1H, J=2,6 Гц), 2.91 (m, 2H), 2.46 (d, 2H, J=6,2 Гц), 1.96-1.78, 1.43-1.26 (2×m, 5H). 13С ЯМР (ДМСО) δ 155.7, 154.0, 149.1, 146.9, 145.8, 144.9, 140.8, 128.0, 123.5, 117.9, 83.4, 82.4, 78.2, 75.9, 64.9, 43.4, 34.5, 32.2, 30.9, 24.8. LRMS ESI (M+H+) 474,2.
Пример 14: 2-хлор-фениловый эфир 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты
Применение типичного способа N9-алкилирования вышеуказанного 2-хлор-фенилового эфира 4-[3-(6-амино-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты (68 мг) дало указанное в заголовке соединение в виде белого твердого вещества: выход 46 мг, 62%. 1H ЯМР (CD3OD) δ 8.21 (s, 1H), 7.41-7.46, 7.34-7.27, 7.24-7.17 (3×m, 4H), 5.03 (d, 2H, J=2,5 Гц), 4.38, 4.18 (2×m, 2H), 3.11, 2.94 (2×m, 2H), 2.98 (t, 1H, J=2,6 Гц), 2.48 (d, 2H, J=6,4 Гц), 2.03-1.82, 1.59-1.32 (2×m, 5H). 13С ЯМР (CD3OD) δ 157.1, 154.3, 150.4, 148.9, 147.9, 142.5, 131.1, 129,0, 128.4, 128.0, 125.4, 119.3, 86.2, 82.6, 77.6, 75.9, 46.0, 45.6, 36.5, 33.9, 32.6, 32.4, 26.5. LRMS ESI (MH+H+) 449,2.
Пример 15: 2-метокси-фениловый эфир 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты
Применение типичного способа N9-алкилирования вышеуказанного 2-метокси-фенилового эфира 4-[3-(6-амино-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты (63 мг) дало указанное в заголовке соединение в виде белого твердого вещества: выход 49 мг, 71%. 1H ЯМР (CD3OD) δ 8.20 (s, 1Н), 7.20-7.12, 7.05-6.98, 6.93-6.85 (3×m, 4H), 5.02 (d, 2H, J=2,6 Гц), 4.34, 4.16 (2×m, 2H), 3.78 (s, 3H), 3.05, 2.90 (2×m, 2H), 2.99 (t, 1H, J=2,6 Гц), 2.48 (d, 2H, J=6,0 Гц), 1.98-1.80, 1.56-1.30 (2×m, 5H). 13С ЯМР (CD3OD) δ 157.1, 155.5, 153.1, 150.4, 147.9, 142.5, 141.9, 127.6, 124.1, 121.7, 119.3, 113.6, 86.3, 82.6, 77.6, 75.9, 56.4, 46.0, 45.5, 36.6, 33.9, 32.6, 32.4, 26.6. LRMS ESI (M+H+) 445,2.
Пример 16: 2-{3-[1-((3,4-диметил)феноксикарбаноил)пиперидин-4-ил]пропин-1-ил}-9-пропаргиладенин
Применение типичного способа N9-алкилирования вышеуказанного 2-{3-[1-((3,4-диметил)феноксикарбаноил)пиперидин-4-ил]пропин-1-ил}аденина (33 мг) дало указанное в заголовке соединение в виде белого твердого вещества: выход 23 мг, 64%. 1H ЯМР (CD3OD) δ 8.21 (s, 1H), 7.08 (d, 1H, J=8,2 Гц), 6.84 (d, 1H, J=2,3 Гц), 6.78 (dd, 1H, J=8,2 Гц, J=2,5 Гц), 5.02 (d, 2H, J=2,6 Гц), 4.42-4.12 (m, 2H), 3.13-2.84 (m, 3H), 2.48 (d, 2H, J=6,5 Гц), 2.23 (s, 3H), 2.22 (s, 3H), 2.02-1.81, 1.52-1.32 (2×m, 5H). 13С ЯМР (CD3OD) δ 157.1, 155.8, 150.8, 150.5, 147.9, 142.5, 138.8, 134.7, 131.1, 123.7, 119.9, 119.3, 86.3, 82.6, 77.2, 75.9, 45.5 (×2), 36.5, 33.9, 32.5 (×2), 26.5,19.8, 19.1. LRMS ESI (М+Н+) 443,2.
Пример 17: 2-{3-[1-((3,4-дифтор)феноксикарбаноил)пиперидин-4-ил]пропин-1-ил}-9-пропаргиладенин
Применение типичного способа N9-алкилирования вышеуказанного 2-{3-[1-((3,4-дифтор)феноксикарбаноил)пиперидин-4-ил]пропин-1-ил}аденина (32 мг) дало указанное в заголовке соединение в виде белого твердого вещества: выход 15 мг, 43%. 1Н ЯМР (CD3OD) δ 8.22 (s, 1H), 7.25 (m, 1H), 7.13 (m, 1H), 6.93 (m, 1H), 5.03 (d, 2H, J=2,5 Гц), 4.30, 4.18 (2×m, 2H), 3.06, 2.92 (2×m, 2H), 2.99 (t, 1H, J=2,6 Гц), 2.48 (d, 2H, J=6,3 Гц), 2.00-1.80, 1.53-1.31 (2×m, 5H). Имеется 13С, но фтор расщепляется на множество пиков. LRMS ESI (M+H+) 451,2.
Пример 18: 2-{3-[1-((3,4-дихлор)феноксикарбаноил)пиперидин-4-ил]пропин-1-ил}-9-пропаргиладенин
Применение типичного способа N9-алкилирования вышеуказанного 2-{3-[1-((3,4-дихлор)феноксикарбаноил)пиперидин-4-ил]пропин-1-ил}-9-пропаргиладенина (37 мг) дало указанное в заголовке соединение в виде белого твердого вещества: выход 11 мг, 28%. 1H ЯМР (CD3OD) δ 8.22 (s, 1H), 7.50 (d, 1H, J=8,8 Гц), 7.36 (d, 1H, J=2,6 Гц), 7.08 (dd, 1H, J=2,6 Гц, J=8,8 Гц), 5.03 (d, 2H, J=2,6 Гц), 4.31, 4.19 (2×m, 2H), 3.07, 2.93 (2×m, 2H), 2.99 (t, 1H, J=2,6 Гц), 2.48 (d, 2H, J=6,2 Гц), 2.00-1.81, 1.54-1.33 (2×m, 5H). LRMS ESI (M+H+) 483,1.
Типичные соединения по настоящему изобретению показаны ниже в Таблице 1. Эти соединения и их стереоизомеры и фармацевтически приемлемые соли включены в настоящее изобретение.
Возможны многочисленные модификации и варианты настоящего изобретения с учетом вышеизложенных методик. Поэтому, следует понимать, что в объеме прилагаемой формулы изобретение может быть осуществлено на практике иначе, чем конкретно описано здесь.
| название | год | авторы | номер документа |
|---|---|---|---|
| N-9-ЗАМЕЩЕННЫЕ ПУРИНОВЫЕ СОЕДИНЕНИЯ, КОМПОЗИЦИИ И СПОСОБЫ ПРИМЕНЕНИЯ | 2010 |
|
RU2607635C2 |
| ГИДРОКСИМЕТИЛЦИКЛОГЕКСИЛАМИНЫ | 2009 |
|
RU2514192C2 |
| 1,3-ДИЗАМЕЩЕННЫЕ 4-МЕТИЛ-1Н-ПИРРОЛ-2-КАРБОКСАМИДЫ И ИХ ПРИМЕНЕНИЕ ДЛЯ ИЗГОТОВЛЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2007 |
|
RU2463294C2 |
| ЗАМЕЩЕННЫЕ НИКОТИНАМИДЫ В КАЧЕСТВЕ КСNQ2-3 МОДУЛЯТОРОВ | 2010 |
|
RU2529904C2 |
| ИНГИБИТОРЫ ПРОЛИЛГИДРОКСИЛАЗЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2007 |
|
RU2429226C9 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ 1-ОКСА-2,8-ДИАЗАСПИРО[4.5]ДЕЦ-2-ЕНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ЛЕКАРСТВЕННОЕ СРЕДСТВО, ОБЛАДАЮЩЕЕ АНАЛЬГЕТИЧЕСКИМ ДЕЙСТВИЕМ | 2002 |
|
RU2296128C2 |
| АНТИБАКТЕРИАЛЬНЫЕ АГЕНТЫ | 2000 |
|
RU2269525C2 |
| НОВЫЕ СОЕДИНЕНИЯ | 2001 |
|
RU2261245C2 |
| ПРОИЗВОДНЫЕ СПИРО(5.5)УНДЕКАНА | 2009 |
|
RU2515895C2 |
| АЗОТСОДЕРЖАЩИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ В ФАРМАЦЕВТИЧЕСКИХ ПРЕПАРАТАХ | 2013 |
|
RU2701156C2 |
Изобретение относится к новым соединениям, выбранным из Таблицы 1, Таблицы А и соединений, перечисленных в п.3 формулы изобретения. Соединения являются селективными антагонистами аденозиновых рецепторов А2A, и пригодны для изготовления лекарственного средства, полезного для лечения заболеваний, для которых требуется антагонистическое действие в отношении активности указанных рецепторов. Такими заболеваниями могут быть, например, рак, заболевания, связанные с двигательными расстройствами, расстройствами, связанными к привыканию к курению, алкоголю, лекарствам. Соединение, выбранное из соединения указанного в Таблице 1 или в Таблице А соответствуют общим формулам:
 или
или 
В таблице 1 соединения выбираются из соединений, где У соответствует NH или О; R2 выбирается из Н, 2-фторфенила, фуран-2-ила; группа R4-R3- выбирается из группы=-СН2-, тетрагидрофуран-3-ила, циклопентила, группа -(CH2)qZ выбирается из фенила, замещенного СН3,СF3, Сl. В соединениях, выбранных из Таблицы А, R выбирается из возможно замещенного фенила, -CH2CH2OBn, где Вn означает бензил; Х означает О; R9 выбирается из пропаргила и циклопентила. 5 н. и 1 з.п. ф-лы, 2 табл., 18 пр.
1. Соединение согласно Таблице 1:
2. Соединение, выбранное из:
2-бензилокси-этилового эфира 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты;
2-бензилокси-этилового эфира 4-[3-(6-амино-9-циклопентил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты;
3-трифторметил-фенилового эфира 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты;
3-трифторметил-фенилового эфира 4-[3-(6-амино-9-циклопентил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты;
2-фтор-фенилового эфира 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты;
4-нитро-фенилового эфира 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты;
4-метоксикарбонил-фенилового эфира 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты;
4-хлор-фенилового эфира 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты;
4-метокси-фенилового эфира 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты;
4-метил-фенилового эфира 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты;
4-нитро-бензилового эфира 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты;
2-хлор-фенилового эфира 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты;
2-метокси-фенилового эфира 4-[3-(6-амино-9-проп-2-инил-9Н-пурин-2-ил)-проп-2-инил]-пиперидин-1-карбоновой кислоты;
2-{3-[1-((3,4-диметил)феноксикарбонил)пиперидин-4-ил]пропин-1-ил}-9-пропаргиладенина;
2-{3-[1-((3,4-дифтор)феноксикарбонил)пиперидин-4-ил]пропин-1-ил}-9-пропаргиладенина; и 2-{3-[1-((3,4-дихлор)феноксикарбонил)пиперидин-4-ил]пропин-1-ил}-9-пропаргиладенина.
3. Соединение, выбранное из соединения из Таблицы А:


4. Фармацевтическая композиция, обладающая селективной антагонистической активностью в отношении рецептора А2А, содержащая терапевтически эффективное количество соединения по любому из пп.1-3 и фармацевтически приемлемый носитель.
5. Соединение по любому из пп.1-3 в качестве селективного антагониста рецепторов A2a для изготовления лекарственного средства.
6. Применение соединения по одному из пп.1-3 для изготовления лекарственного средства, полезного для лечения заболеваний, для которых требуется антагонистическое действие в отношении активности аденозиновых рецепторов А2A.
| US 6232297 B1, 15.05.2001 | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| RU 2007134899 A, 27.04.2009. | |||
Авторы
Даты
2012-11-20—Публикация
2007-07-17—Подача