Область техники, к которой относится изобретение
Данное изобретение относится к способу лечения или профилактики системного воспаления.
Уровень техники
Воспалительная ответная реакция представляет собой попытку организма восстановить и поддержать гомеостаз после инвазии инфекционного агента, введения антигена или физического, химического или травматического повреждения. Локализованное воспаление происходит в специфическом месте и может характеризоваться различными симптомами, включая покраснение, опухоль, выделение тепла и боль.
В то время как воспалительная ответная реакция рассматривается как здоровая реакция на повреждение, иммунная система может проявлять нежелательный физиологический ответ, если не осуществлять ее соответствующее регулирование. В этой ситуации обычно нормально функционирующая защитная иммунная система организма вызывает повреждение своих собственных тканей вследствие действия на здоровую ткань как на инфицированную или аномальную. Или же, если есть повреждение, воспалительная ответная реакция может быть несоизмеряемой с угрозой, вызывающей повреждение. Когда это возникает, воспалительная ответная реакция может вызвать гораздо более сильное повреждение организма, чем вызывает сам агент.
Было установлено, что воспалительная ответная реакция частично состоит из увеличенной экспрессии как провоспалительных цитокинов, так и противовоспалительных цитокинов. Цитокины имеют низкий молекулярный вес и являются биологически активными белками, вовлеченными в процесс координации иммунологических и воспалительных ответов и коммуникации между специфическими популяциями иммунных клеток. Ряд видов клеток продуцирует цитокины во время воспалительных реакций, включая нейтрофилы, моноциты и лимфоциты.
Существует много механизмов, по которым цитокины, образовавшиеся в воспалительных сайтах, влияют на воспалительную ответную реакцию. Если, однако, провоспалительная ответная реакция не уравновешивается успешно противовоспалительными цитокинами, может возникнуть неконтролируемое системное воспаление.
В противоположность локализованному воспалению системное воспаление распространено по всему организму. Этот тип воспаления может включать локализованное воспаление в специфических сайтах, но может также быть связно с общими симптомами, "похожими на грипп", включая жар, озноб, усталость или потерю энергии, головную боль, потерю аппетита и ригидность мышц. Системное воспаление может привести к разрушению белков, катаболизму и гиперметаболизму. Как следствие этого, структура и функция основных органов, таких как мышцы, сердце, иммунная система и печень, могут быть ослаблены и могут привести к повреждению многих органов и к смерти. Jeschke, et al., Insulin Attenuates the Systemic Inflammatory Response to Thermal Trauma, Mol. Med. 8 (8): 443-450 (2002). Хотя был достигнут огромный успех в понимании механизмов системного воспаления, показатель смертности из-за такого повреждения остается неприемлемо высоким.
Очень часто вопрос о том, является ли цитокиновый ответ провоспалительным или противовоспалительным, зависит от баланса индивидуальных микроорганизмов, которые образуют колонии в кишечной полости в любое данное время. Хорошо известно, что поверхность слизистой оболочки кишечного тракта содержит колонии чрезвычайно большой, сложной и динамической коллекции микроорганизмов. Состав кишечной микрофлоры меняется при прохождении вдоль пищеварительного тракта, как и в различных местах обитания микроорганизмов, таких как слой эпителиальной слизистой оболочки, глубокий слой слизистой оболочки крипты и поверхность эпителиальных клеток слизистой оболочки. Специфическая колонизация зависит от внешних и внутренних факторов, включая доступные в просветах молекулы, качество слизистой оболочки и взаимодействие организма - хозяина с микробами и микробов друг с другом. Murch, S.H., Toll of Allergy Reduced by Probiotics, Lancet, 357: 1057-1059 (2001).
Эти микроорганизмы, которые образуют кишечную микрофлору, активно участвуют в иммунной ответной реакции. Они реагируют с эпителием в условиях взаимных благоприятных отношений для обоих партнеров (симбиоз) или в условиях, благоприятных для одного партнера и не вредных для другого партнера (комменсализм). Hooper, et al., How Host-Microbial Interactions Shape the Nutrient Environment of the Mammalian Intestine, Аnnu. Rev. Nutr. 22: 283-307 (2002). В действительности, появляются значительные доказательства, которые показывают сильное взаимодействие или "взаимное влияние" между кишечной микрофлорой и различными популяциями клеток слизистой оболочки кишечника. Bourlioux, et al., The Intestine and its Microflora are Partners for the Protection of the Host: Report on the Danone Symposium "The Intelligent Intestine", held in Paris, June 14, 2002, Am. J. Clin. Nutr. 78: 675 (2003); Hooper, L.V. & Gordon, J.I., Commensal Host-Bacterial Relationships in the Gut, Sci. 292: 1115 (2001); Haller, et al., Non-Pathogenic Bacteria Elicit a Differential Cytokine Response by Intestinal Epithelial Cell/Leucocyte Co-Cultures, GUT 47: 79 (2000); Walker, W.A., Role of Nutrients and Bacterial Colonization in the Development of Intestinal Host Defense, J. Pediatr. Gastroenterol. Nutr. 30: S2 (2000). Кроме того, было показано, что микрофлора в кишечнике вызывает специфичные иммунные ответные реакции как на локальном, так и на системном уровне у взрослых. Isolauri, E., et al., Probiotics: Effects on Immunity, A, J. Clin. Nutr. 73: 444S-50S (2001).
Известно, что кишечная микрофлора у детей гораздо менее развита, чем у взрослых. В то время как микрофлора у взрослого человека состоит из более чем 1013 микроорганизмов и почти 500 видов, при этом некоторые из них бывают вредными и некоторые являются полезными, микрофлора у ребенка содержит только часть этих микроорганизмов как в абсолютном выражении, так и в отношении разнообразия видов микроорганизмов. Дети рождаются со стерильным кишечником и приобретают кишечную флору из родовых путей, из первоначальной среды и из того, что они усваивают. Ввиду того, что популяция кишечной микрофлоры очень нестабильная в ранней неонатальной жизни, часто кишечнику ребенка трудно поддерживать хрупкий баланс между вредными и полезными бактериями, что снижает способность иммунной системы функционировать нормально.
Особенно трудно поддерживать этот баланс младенцам, которых кормят молочной смесью вследствие разницы между видами бактерий в кишечнике детей, получающих молочные смеси, и детей, вскармливаемых грудным молоком. Стул у младенцев, вскармливаемых грудью, в основном содержит Bifidobacterium со Streptococcus и Lactobacillus в качестве менее распространенных компонентов. В противоположность этому микрофлора младенцев, получающих молочные смеси, является более разнообразной и содержит Bifidobacterium и Bacteroides, а также более патогенные виды, представляющие собой Staphilococcus, Escherichia coli и Clostridia. Различные виды Bifidobacterium в стуле вскармливаемых грудью детей и детей, получающих молочные смеси, также отличаются. Разнообразие факторов было предложено считать причиной различной флоры в кале детей, вскармливаемых грудью, и детей, получающих молочные смеси, включая более низкое содержание и различный состав белков в грудном молоке людей, более низкое содержание фосфора в грудном молоке у людей, большое разнообразие олигосахаридов в этом молоке и различные гуморальные и клеточные медиаторы иммунологической функции в грудном молоке. Agostoni, et al., Probiotic Bacteria in Dietetic Products for Infants: A Commentary by the ESPGHAN Committee on Nutrition, J. Pediatr. Gastro. Nutr. 38: 365-374 (Apr. 2004).
Вследствие того, что микрофлора у младенцев, которых кормят грудными смесями, является такой нестабильной и кишечная микрофлора в значительной степени участвует в стимуляции кишечного иммунитета, дети, получающие молочные смеси, более подвержены воспалительным заболеваниям. Многие из основных болезней, которые поражают детей, включая хроническую болезнь легких, околожелудочковую лейкомаляцию, неонатальный менингит, неонатальный гепатит, сепсис и некротизирующий энтероколит, являются воспалительными по природе. В зависимости от конкретного заболевания сопутствующее воспаление может возникнуть в конкретном органе, таком как легкие, мозг, печень или кишечник, или же воспаление может быть системным по природе.
Например, хроническая болезнь легких приводит к возникновению воспаления в тканях в легких, в то время как неонатальный менингит включает воспаление выстилок в мозгу и в спинном мозге. Околожелудочковая лейкомаляция вызывается воспалительным повреждением околожелудочковой области в развивающемся мозге. Некротизирующий энтероколит вызывает воспаление в кишечнике, которое может привести к разрушению части или всего кишечника, а неонатальный гепатит включает воспаление печени, которое возникает в раннем грудном возрасте. Сепсис, который известен также как системный воспалительный ответный синдром, представляет собой очень серьезное заболевание, вызванное очень сильной инфекцией в токе крови, вызванной бактериями, продуцирующими токсины. При этой болезни патогены в потоке крови вызывают воспалительную ответную реакцию во всем организме.
У недоношенных и смертельно больных детей также с трудом развивается кишечный иммунитет и часто возникает системное воспаление. Недоношенные или смертельно больные дети часто сразу же помещаются в стерильные инкубаторы, где на них не действуют популяции бактерий, воздействию которых обычно подвергаются здоровые, доношенные дети. Это может замедлить природный процесс колонизации или повредить ему. Эти дети также часто подвергаются лечению антибиотиками с широким спектром действия, которые убивают комменсальные бактерии, пытающиеся образовать колонии в кишечном тракте ребенка. Кроме того, этих детей часто кормят детскими молочными смесями, а не материнским молоком. Каждый из этих факторов может вызвать неправильное развитие кишечной микрофлоры ребенка, тем самым вызывая или ускоряя системное воспаление, опасное для жизни.
В последние годы было предложено введение пробиотических бактерий в пищу детей, получающих молочные смеси, с целью облегчения колонизации кишечника полезными микроорганизмами. Пробиотические бактерии представляют собой живые микроорганизмы, которые оказывают благоприятное воздействие на здоровье организма хозяина. Fuller, R. Probiotics in Man and Animals, J. Appl. Bacteriol. 66: 365-78 (1989).
Хотя жизнеспособные пробиотические бактерии могут быть эффективными при нормализации кишечной микрофлоры, существует очень мало опубликованных исследований, в которых оценивается их безопасность для недоношенных детей и детей после иммуносупрессивной терапии. Эти особые популяции создают преждевременный защитный барьер в кишечнике, который увеличивает риск транслокации бактерий просвета, вызывая потенциально возросший риск возникновения инфекций. Во многих случаях жизнеспособные пробиотики не рекомендуются пациентам после иммуносупрессивной терапии, пациентам после хирургического вмешательства, пациентам с дисфункцией поджелудочной железы или пациентам со стулом с прожилками крови. Сообщалось о по меньшей мере одной смерти, последовавшей после введения пробиотиков в пищу субъекту после иммуносупрессивной терапии. MacGregor G., et al. Yoghurt biotherapy: contraindicated in immunosuppressed patients? Postgrad Med J. 78: 366-367 (2002).
Таким образом, для пациентов с ослабленньм иммунитетом или для недоношенных детей было бы полезно создать нежизнеспособную добавку, которая может способствовать лечению или профилактике системного воспаления. Нежизнеспособная альтернатива живым пробиотикам может иметь дополнительные преимущества, такие как большая жизнеспособность. Живые пробиотики являются чувствительными к нагреванию, влаге и свету и в идеале их нужно охлаждать для поддержания жизнеспособности. Даже, если принять эту меру предосторожности, жизнеспособность типичного пробиотика будет довольно непродолжительной. Нежизнеспособная альтернатива живым пробиотикам устранит необходимость охлаждения и обеспечит продукт, имеющий более длительную жизнеспособность. Этот продукт будет затем распространяться в тех районах мира, где достаточное охлаждение недоступно. Нежизнеспособная альтернатива пробиотикам дополнительно обеспечит меньший риск взаимодействия с другими компонентами пищи, такими как ферментация и изменения во вкусе, структуре и свежести продукта. Соответственно, было бы полезно создать способ уменьшения или предотвращения системного воспаления у детей, которых кормят молочными смесями, включающий введение инактивированных пробиотиков.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Таким образом, данное изобретение направлено на новый способ лечения, профилактики или уменьшения системного воспаления у субъекта, при этом способ включает введение субъекту терапевтически эффективного количества инактавированной LGG.
Согласно другим вариантам данное изобретение предусматривает способ изготовления лекарственного средства для лечения, профилактики или уменьшения системного воспаления у субъекта, характеризующийся тем, что в качестве фармакологически активного вещества применяют по меньшей мере примерно 1×104-1×1010 клеточных эквивалентов на кг веса субъекта в день инактивированной Lactobacillus rhamnosus GG (LGG).
Согласно другим вариантам данное изобретение предусматривает новый способ лечения, профилактики или уменьшения воспаления дыхательных путей у субъекта, при этом способ включает введение субъекту терапевтически эффективного количества инактивированной LGG.
Согласно другим вариантам данное изобретение предусматривает способ уменьшения или предотвращения системного высвобождения одного или более провоспалительных цитокинов или хемокинов у субъекта, при этом способ включает введение субъекту терапевтически эффективного количества инактивированной LGG.
Согласно еще одному варианту данное изобретение предусматривает профилактику убиквитинирования IkВ экспрессии у субъекта, при этом способ включает введение субъекту терапевтически эффективного количества инактивированной LGG. Кроме того, данное изобретение охватывает метод уменьшения NFkB транслокации у субъекта, при этом способ включает введение субъекту терапевтически эффективного количества инактивированной LGG.
Согласно другому варианту нестоящее изобретение направлено на способ лечения, профилактики или уменьшения системного или респираторного воспаления у субъекта, при этом способ включает введение субъекту терапевтически эффективного количества инактивированной LGG в комбинации с по меньшей мере одной LCPUFA и/или по меньшей мере одним жизнеспособным пробиотиком. По конкретным вариантам LCPUFA может представлять собой докозагексановую кислоту (DHA) или арахидоновую кислоту (ARA).
Среди нескольких преимуществ, достигаемых при осуществлении данного изобретения, можно назвать то, что оно уменьшает или предотвращает системное воспаление. Изобретение может уменьшить воспаление в печени, плазме крови, в легких и в кишечнике. Кроме того, данное изобретение снижает или предотвращает высвобождение различных провоспалительных цитокинов и хемокинов, включая интерлейкин-1β (IL-1β), IL-8, CINC-1 и онкоген, связанный с ростом (GRO/KC). Так как данное изобретение можно использовать для улучшения состояния, связанного с воспалением, оно может также предотвращать начало причиняющих вред инфекций или болезней.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Для более полного понимания данного изобретения ниже приведено описание со ссылкой на прилагаемые чертежи.
На Фиг.1 показано влияние живой и инактивированной LGG на цитокин-индуцируемое продуцирование нейтрофильного хемоаттрактанта-1 (CINC-1), пептида, в печени, изученное методом фермент-связанного иммуносорбентного анализа (ELISA). Инактивированная LGG обозначена как "LGG, прошедшая тепловую обработку".
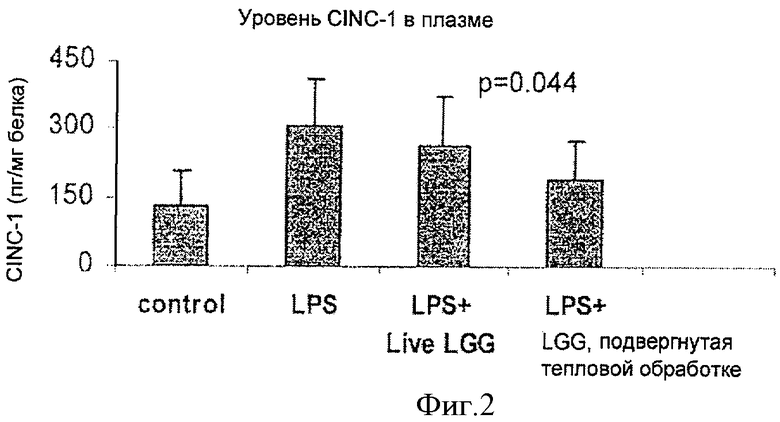
На Фиг.2 показано влияние живой и инактивированной LGG на цитокин-индуцируемое продуцирование нейтрофильного хемоаттрактанта-1 (CINC-1), пептида, в плазме крови, изученное методом фермент-связанного иммуносорбентного анализа (ELISA). Инактивированная LGG обозначена как "LGG, прошедшая тепловую обработку".
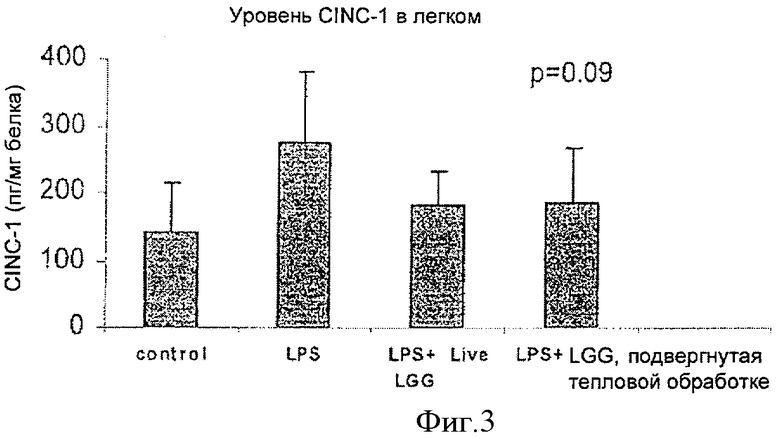
На Фиг.3 показано влияние живой и инактивированной LGG на цитокин-индуцируемое продуцирование нейтрофильного хемоаттрактанта-1 (CINC-1), пептида, в легких, изученное методом фермент-связанного иммуносорбентного анализа (ELISA). Инактивированная LGG обозначена как "LGG, прошедшая тепловую обработку".
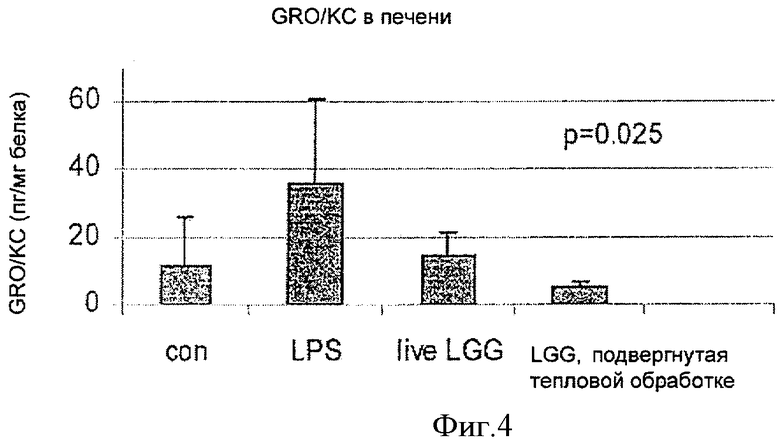
На Фиг.4 показано влияние живой и инактивированной LGG на продуцирование связанного с ростом онкогена (GRO/KC) в печени, изученное методом мультиплексного анализа профиля цитокинов. Инактивированная LGG обозначена как "LGG, прошедшая тепловую обработку".
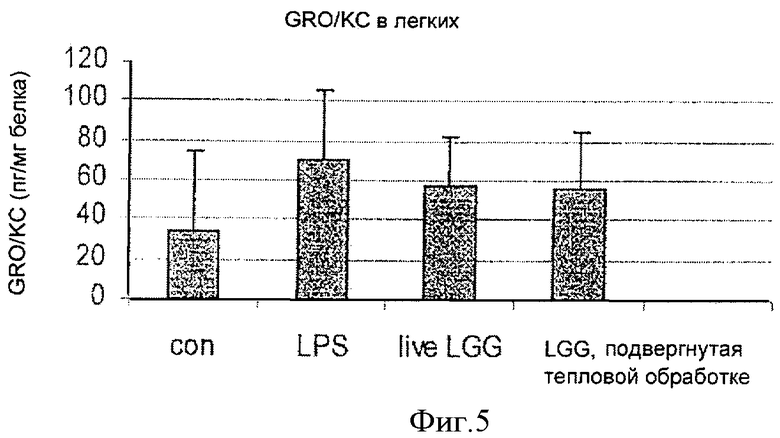
На Фиг.5 показано влияние живой и инактивированной LGG на продуцирование связанного с ростом онкогена (GRO/KC) в легких, изученное методом мультиплексного анализа профиля цитокинов. Инактивированная LGG обозначена как "LGG, прошедшая тепловую обработку".
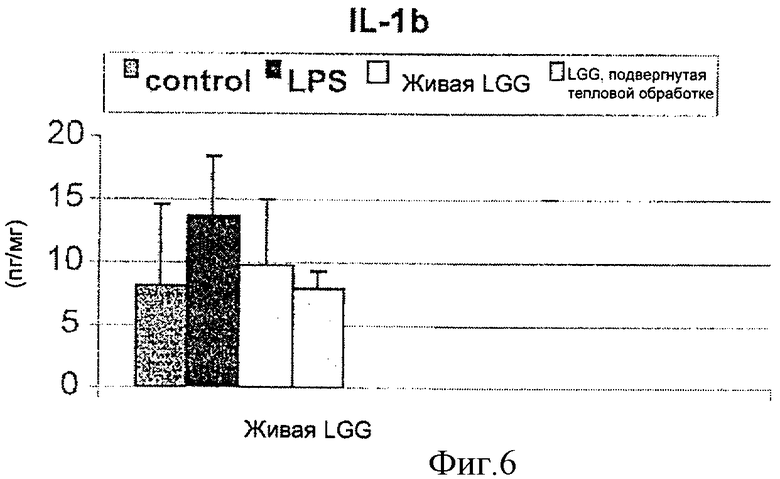
На Фиг.6 показано влияние живой и инактивированной LGG на уровень IL-1β в печени, изученное методом мультиплексного анализа цитокинового профиля. Инактивированная LGG обозначена как "LGG, прошедшая тепловую обработку".
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ
Далее варианты данного изобретения будут описаны более подробно с приведением одного или более примеров. Каждый пример служит для объяснения изобретения, но не ограничивает его. В действительности, специалистам очевидно, что, не выходя за рамки изобретения и его объем, можно осуществить различные его модификации и вариации. Например, признаки, проиллюстрированные или описанные как часть одного варианта, могут быть использованы в другом варианте, что приводит к получению еще одного варианта.
Таким образом, подразумевается, что данное изобретение охватывает такие модификации и вариации, которые входят в объем изобретения, определенный прилагаемыми формулой изобретения, и их эквивалентами. Другие цели, признаки и аспекты данного изобретения описаны в заявке или очевидны из следующего подробного описания. Специалисту в данной области очевидно, что данное обсуждение основано на описании только примерных вариантов изобретения и не ограничивает более широкие аспекты данного изобретения.
В данном описании применены следующие сокращения: LGG, Lactobacillus rhamnosus GG; LCPUFA, длинноцепочечная полиненасыщенная жирная кислота; LPS, липополисахарид; IL, интерлейкин; CINC-1, цитокин-индуцируемый нейтрофильный хемоаттрактант-1; GRO/KC, рост-ассоциированный онкоген; ELISA, фермент-связанный иммуносорбентный анализ; RT-PCR, обратная транскрипционная полимеразная цепная реакция; ANOVA, анализ вариантности; SD, стандартное отклонение; RMS, заменитель крысиного молока; TLRs - толл-подобные рецепторы; Nuclear Factor kappa В, NF-кВ; ЕРА, эйкозапентановая кислота; DHA, докозагексановая кислота; ARA, арахидоновая кислота.
Термин "инактивированный пробиотик" или "инактивированная LGG" означает, что метаболическая активность или репродуктивная способность пробиотика или LGG снижена или исчезла. Термин "инактивированный пробиотик" или "инактивированная LGG" означает, однако, что на клеточном уровне они сохраняют, по меньшей мере, часть их биологической гликоль-белковой и ДНК/РНК структуры. Применяемый в данной заявке термин "инактивированный" является синонимом термина "нежизнеспособный".
Термин "пробиотик" означает живой, активный или жизнеспособный микроорганизм, который оказывает благоприятное влияние на здоровье хозяина.
Термин "пребиотик" означает неусвояемый ингредиент пищи, который стимулирует рост и/или активность пробиотиков.
Применяемый в данной заявке термин "лечение" означает уменьшение интенсивности, положительную динамику или излечение болезни, расстройства или симптома болезни или состояния.
Термин "уменьшение" означает снижение степени, количества.
Термин "профилактика" ("предотвращение") означает остановку или предотвращение болезни, расстройства или симптома болезни или состояния благодаря какому-то действию.
Термин "системный" относится ко всему организму.
Термин "терапевтически эффективное количество" относится к количеству, которое приводит к улучшению или излечению болезни, расстройства или симптомов болезни или состояния.
Термин "недоношенный" означает ребенка, родившегося до истечения 37 недели беременности.
Термин "младенец" означает человека, возраст которого составляет менее примерно 1 года.
Термин "ребенок" означает человека в возрасте, составляющем от примерно 1 года до 12 лет. Согласно некоторым вариантам ребенок означает человека в возрасте от примерно 1 года до 6 лет. По другим вариантам возраст "ребенка" составляет от примерно 7 до 12 лет.
Применяемый в данной заявке термин "детская молочная смесь" означает композицию, которая удовлетворяет требованиям к питанию младенца, являясь заменителем грудного молока женщины.
В соответствии с данным изобретением предусмотрен новый способ лечения или профилактики системного воспаления. Этот способ включает введение субъекту терапевтически эффективного количества инактивированной LGG. По некоторым вариантам субъектом является младенец.
Предыдущие попытки эффективно ввести инактивированные пробиотики натолкнулись на значительные препятствия. Например, Kirjavainen P. et al., сообщили, что при сравнении с живой и инактивированной путем тепловой обработки LGG почти 40% детей, которым давали инактивированную LGG, страдали от сильной диареи. Probiotic Bacteria in the Management of Atopic Disease: Underscoring the importance of Viability, J. Ped. Gastro. 36: 223-227 (2003).
При введении плацебо или жизнеспособной LGG не наблюдались неблагоприятные реакции Id, 225. Поскольку диарея в значительной степени связана с воспалением, как показало исследование Kirjavainen, инактивированная LGG действительно может вызывать воспаление желудочно-кишечного тракта. В указанной работе отмечено, что "способ инактивации путем тепловой обработки может привести к денатурации поверхностных пептидов и экспрессии хит-шокового белка, тем самым модифицируя иммуностимуляторные свойства LGG таким образом, что инактивированная путем тепловой обработки форма будет индуцировать воспалительные ответные реакции и соответственно увеличивать проницаемость кишечника", Id, 226. В противоположность этому изобретатели создали новый способ лечения или профилактики системного воспаления путем введения инактивированной LGG.
LGG представляет собой пробиотический штамм, выделенный из здоровой кишечной флоры человека. Этот продукт описан в патенте США №5032399, Gorbach et аl., который включен в данную заявку полностью в качестве ссылки. LGG устойчива к большинству антибиотиков, стабильна в присутствии кислоты и желчи и быстро попадает в клетки слизистой оболочки в кишечном тракте человека. Она живет в течение 1-3 дней у большинства субъектов и до 7 дней у 30% субъектов. В дополнение к своей способности к колонизации LGG также благоприятно влияет на иммунные ответные реакции слизистой оболочки. LGG находится в депозитарии American Type Culture Collection под номером АТСС 53103.
Согласно данному изобретению используют LGG, которая была инактивирована. Инактивация может осуществляться любым методом, известным из уровня техники, или методом, который еще должен быть создан. Инактивацию можно проводить, например, путем тепловой обработки, лиофилизации, воздействия УФ-света, гамма-облучения, давления, химического расщепления или механического расщепления. Например, LGG может быть инактивирована путем тепловой обработки при хранении при температуре 80-100°С в течение 10 мин. LGG можно также инактивировать УФ-светом при облучении в течение 5 мин на расстоянии 5 см от лампы мощностью 30 ватт. Или же инактивированная LGG может быть инактивирована путем гамма-облучения 2 кг - Грей (kGY) с применением источника Кобальт-60 на расстоянии 20 см.
В способе по изобретению терапевтически эффективное количество инактивированной LGG означает количество, достаточное для уменьшения или профилактики системного воспаления у субъекта. Это количество может соответствовать примерно 1×104-1×1012 клеточных эквивалентов на кг веса в день. Согласно другому варианту данное изобретение предусматривает введение примерно 1×106-1×109 клеточных эквивалентов на кг веса в день. Согласно еще одному варианту данное изобретение включает введение примерно 1×108 клеточных эквивалентов на кг веса в день.
Согласно некоторым вариантам данного изобретения субъект нуждается в лечении, уменьшении или профилактике системного воспаления. Субъект может входить в группу риска, заболеть системным воспалением из-за генетической предрасположенности, питания, стиля жизни, наличия болезней, расстройств и т.п. Например, недоношенный младенец или младенец после иммуносупрессивной терапии рискует заболеть системным воспалением и может поэтому нуждаться в таком лечении, уменьшении или профилактике.
Согласно некоторым вариантам инактивированная LGG может быть введена младенцу или ребенку для профилактики, лечения или уменьшения системного воспаления. По одному из вариантов младенцу может быть менее 1 года. По другому варианту ребенку может быть от 1 до 6 лет. Согласно еще одному варианту возраст ребенка может быть от 7 до 12 лет.
Форма введения инактивированной LGG согласно способу по изобретению не является критической до тех пор, пока вводится терапевтически эффективное количество. По некоторым из вариантов инактивированную LGG вводят субъекту в виде таблеток, пилюль, капсул, каплетов, гелькапов, масляных капель или саше. По этому варианту инактивированная LGG может применяться в комбинации с другими пищевыми добавками, такими как витамины, или в сочетании с LCPUFA, такой как DHA или ARA.
По другому варианту инактивированная LGG инкапсулирована в сахар, жир или полисахарид. Согласно другому варианту инактивированная LGG добавляется к пище или напитку, которые используют для кормления. Пищевой продукт или напиток может быть искусственным детским пищевым продуктом, таким как продукт, принимаемый после приема пищи, молоко, напиток, йогурт, фруктовый сок, напиток на основе фруктов, жевательная таблетка, печенье, крекер или порошковое молоко, или же он может быть искусственным продуктом для младенцев, таким как молочная смесь.
По одному из вариантов изобретения состав для грудных детей является полным с точки зрения питательности и содержит подходящие виды и количества липида, углевода, белка, витаминов и минералов. Количество липида или жира обычно может меняться от примерно 3 до примерно 7 г/100 ккал. Количество белка обычно может колебаться от примерно 1 до примерно 5 г/100 ккал. Количество углевода обычно может составлять от примерно 8 до примерно 12 г/100 ккал. Источниками белка могут быть любые, известные из уровня техники, например, обезжиренное молоко, сывороточный белок молока, казеин, соевый белок, гидролизованный белок, аминокислоты и т.п. Источниками углеводов также могут быть известные из уровня техники, например, лактоза, глюкоза, твердые вещества кукурузного сиропа, мальтодекстрины, сахароза, крахмал, твердые вещества рисового сиропа и т.п. Источники липидов могут представлять собой известные из уровня техники источники, например, растительные масла, такие как пальмовое масло, соевое масло, пальмолеин (жидкая фракция пальмового масла), кокосовое масло, среднецепочечные триглицериды, подсолнечное масло с высоким содержанием олеиновой кислоты, сафлоровое масло с высоким содержанием олеиновой кислоты и т.п.
Обычно может быть использована коммерчески доступная смесь для новорожденных. Например, могут быть дополнены подходящим количеством инактивированной LGG Enfamil®, Enfamil® Premature Formula, Engamil® with Iron, Lactofree®, Nutramigen®, Pregestimil® и ProSobee® (доступна в Mead Johnson & Company, Evansville, IN, U.S.A.), которые можно применять в практике осуществления данного изобретения.
Согласно одному из вариантов изобретения LGG можно соединить с одним или несколькими жизнеспособными и/или инактивированными пробиотиками для лечения или профилактики системного воспаления у искусственно вскармливаемых грудных детей. По этому варианту приемлемым является любой живой или инактивированный пробиотик, известный из уровня техники, при условии, что он позволяет достичь намеченного результата. Согласно конкретному варианту жизнеспособный и/или инактивированный пробиотик выбирают из группы, состоящей из Lactobacillus и Bifidobacterium.
Если живой пробиотик вводят в комбинации с инактивированным пробиотиком, количество живого пробиотика может соответствовать примерно 1×104-1×1012 колониеобразующих единиц (КОЕ) на кг веса в день. Согласно другому варианту живые пробиотики могут содержать примерно 1×106-1×109 КОЕ на кг веса в день. Согласно еще одному варианту живые пробиотики могут содержать примерно 1×108 КОЕ на кг веса в день.
По другому варианту данного изобретения инактивированная LGG может быть соединена с одним или несколькими пребиотиками для лечения или профилактики системного воспаления у младенцев, вскармливаемых искусственной пищей. Согласно этому варианту пригоден любой пребиотик, известный из уровня техники, при условии, что он приводит к достижению желаемого результата.
Пребиотики по данному изобретению могут включать лактулозу, галакто-олигосахарид, фрукто-олигосахариды соевого масла, лактосахарозу, ксило-олигосахарид и гентио-олигосахариды.
Согласно еще одному варианту данного изобретения грудная смесь может содержать другие активные агенты, такие как длинноцепочечные полиненасыщенные жирные кислоты (LCPUFA). Подходящие LCPUFA включают, но без ограничения, α-линолевую кислоту, γ-линолевую кислоту, линолевую кислоту, линоленовую кислоту, эйкозапентановую кислоту (ЕРА), ARA и DHA. По одному из вариантов инактивированную LGG вводят в сочетании с DHA. По другому варианту инактивированную LGG вводят в сочетании с ARA. Согласно еще одному варианту инактивированную LGG вводят в сочетании с DHA и ARA. Коммерчески доступная смесь для грудных младенцев, которая содержит DHA, ARA или их сочетание, может быть дополнена инактивированной LGG и применена согласно данному изобретению. Например, Enfamil® LIPEL®, которая содержит эффективные количества DHA и ARA, является коммерчески доступной и в нее может быть добавлена инактивированная LGG, после чего ее используют согласно данному изобретению.
Согласно одному из вариантов изобретения и DHA, и ARA применяют в комбинации с инактивированной LGG для лечения системного воспаления у младенцев. По этому варианту весовое отношение ARA: DHA обычно составляет от примерно 1:3 до примерно 9:1. По одному из вариантов данного изобретения это отношение равно от примерно 1:2 до примерно 4:1. Согласно еще одному варианту это отношение составляет от примерно 2:3 до примерно 2:1. По одному конкретному варианту это отношение равно примерно 2:1. Согласно другому конкретному варианту настоящего изобретения это отношение составляет примерно 1:1,5. По другим вариантам оно составляет примерно 1:1,3. Согласно еще одному варианту это отношение равно примерно 1,5:1. По другому варианту это отношение равно 1,47:1.
Согласно некоторым вариантам изобретения содержание DHA составляет от примерно 0,0% до примерно 1,00% вес. в расчете на жирные кислоты.
Содержание DHA может составлять примерно 0,32% вес. Согласно некоторым вариантам содержание DHA может равняться примерно 0,33% вес. Согласно другому варианту содержание DHA может составлять примерно 0,64% вес. Согласно еще одному варианту содержание DHA может равняться примерно 0,67% вес. Согласно другому варианту содержание DHA может составлять примерно 0,96% вес. Согласно еще одному варианту содержание DHA может составлять примерно 1,00% вес.
Согласно изобретению количество ARA составляет от 0,0% до 0,67% в расчете на весовое содержание жирных кислот. По одному из вариантов содержание ARA равно примерно 0,67% вес. По другому варианту содержание ARA может составлять примерно 0,5% вес. Согласно еще одному варианту содержание DHA может быть равным от примерно 0,47% до 0,48% вес.
Эффективное количество DHA по одному из вариантов данного изобретения составляет обычно от примерно 3 мг на кг веса в день до примерно 150 мг на кг веса в день. По одному из вариантов изобретения это количество может равняться от примерно 6 мг на кг веса вдень до примерно 100 мг на кг веса в день. По другому варианту это количество равно от примерно 10 мг на кг веса в день до примерно 60 мг на кг веса в день. По еще одному варианту это количество может составлять от примерно 15 мг на кг веса в день до примерно 30 мг на кг веса в день.
Эффективное количество ARA согласно изобретению может равняться обычно от примерно 5 мг на кг веса в день до примерно 150 мг на кг веса в день. По одному из вариантов данного изобретения это количество может составлять от примерно 10 мг на кг веса в день до примерно 120 мг на кг веса в день. По другому варианту это количество меняется от примерно 15 мг на кг веса в день до примерно 90 мг на кг веса в день. Согласно еще одному варианту это количество меняется от примерно 20 мг на кг веса в день до примерно 60 мг на кг веса в день.
Количество DHA в смесях для грудных детей согласно изобретению обычно колеблется от примерно 5 мг/100 ккал до примерно 80 мг/100 ккал. По одному из вариантов данного изобретения количество DHA составляет от примерно 10 мг/100 ккал до примерно 50 мг/ккал; и согласно еще одному варианту оно равно от примерно 15 мг/100 ккал до примерно 20 мг/100 ккал. Согласно конкретному варианту данного изобретения количество DHA равно около 17 мг/100 ккал.
Количество ARA в смесях для грудных детей, используемых по данному изобретению, обычно меняется от примерно 10 мг/100 ккал до примерно 100 мг/100 ккал. По одному из вариантов данного изобретения количество ARA составляет от примерно 15 мг/100 ккал до примерно 70 мг/100 ккал. По другому варианту это количество может равняться от примерно 20 мг/100 ккал до примерно 40 мг/100 ккал. Согласно конкретному варианту данного изобретения количество ARA равно примерно 34 мг/100 ккал.
Смесь для грудных детей, дополненная маслами, содержащими DHA и ARA, применяемая по данному изобретению, может быть приготовлена стандартными методами, известными из уровня техники. Например, масла могут быть добавлены к смеси путем замены эквивалентного количества масла, такого как подсолнечное масло с высоким содержанием олеинового компонента, обычно содержащегося в смеси. Другим примером можно считать добавление масел, содержащих DHA и ARA, к смеси путем замены эквивалентного количества остального количества всей смеси жиров без DHA и ARA, обычно содержащейся в смеси.
Источником DHA и ARA может быть любой источник, известный из уровня техники, такой как осветительное масло, рыбий жир, масла из одноклеточных культур, липид яичного желтка, липид из мозга и т.п. DHA и ARA могут быть в природном виде, при условии, что остальная часть источника LCPUFA не приводит к значительному вредному воздействию на грудного ребенка. Альтернативно, DHA и ARA могут применяться в рафинированном виде.
По одному из вариантов изобретения источником DHA и ARA служат масла из одноклеточных культур, описанные, например, в патентах США №№5374567, 5550156 и 5397591, содержание которых включено полностью в качестве ссылок в данную заявку. Однако данное изобретение не ограничивается только такими маслами. По одному из вариантов источник LCPUFA содержит ЕРА. По другому варианту LCPUFA не содержит практически ЕРА. Например, по одному из вариантов смесь для грудных детей содержит менее примерно 16 мг ЕРА / 100 ккал; еще по одному варианту - менее примерно 5 мг ЕРА / 100 ккал. Согласно одному конкретному варианту этот источник практически не содержит ЕРА. По другому варианту он не содержит даже следов ЕРА.
Считают, что комбинация инактивированной LGG с DHA и/или ARA обеспечивает появление дополнительных или синергических эффектов в отношении противовоспалительных свойств составов, содержащих эти агенты. Не ограничиваясь какой-либо определенной теорией, можно считать, что инактивированная LGG усиливает противовоспалительные свойства, частично предотвращая убиквитинирование ингибиторного - kB (IkB). В нормальной клетке IkВ связывает ядерный фактор - kB (NFkB) в цитоплазме. Когда убиквитинирование IkB происходит, высвобождается NFkB, который попадает в ядро клетки и активирует гены, которые являются ответственными за воспалительную ответную реакцию. Полагают, что это специфическое взаимодействие и возникающее в результате изменение в экспрессии генов вовлечены в модулирование воспаления. Считается, что инактивированная LGG предотвращает убиквитинирование IkB, тем самым препятствуя высвобождению NFkB и уменьшая или предотвращая воспаление.
В противоположность этому, омега-3 жирные кислоты, такие как DHA, как полагают, способствуют противовоспалительному действию за счет изменения продуцирования медиаторов на основе жирных кислот, широко известных как эйкозаноиды. Омега-6 жирные кислоты, такие как ARA, которые содержатся в фосфолипидном пуле клеточных мембран, высвобождаются во время воспалительной ответной реакции и освобождают пул свободной ARA. Этот пул ARA затем действует на два класса ферментов, известных как липоксигеназы и циклооксигеназы, которые продуцируют специфический круг эйкозаноидов, включая 2- серии простаноидов, таких как простагландины, тромбоксаны и лейкотриены.
Эти экзозаноиды, как известно, оказывают очень сильное провоспалительное действие во многих типах клеток и органов. Известно, что пищевые продукты, богатые омега-3 жирными кислотами, такими как ЕРА и DHA, являются конкурентами омега-6 жирных кислот на нескольких стадиях процесса и поэтому являются модераторами провоспалительного действия ARA. Например омега-3 жирные кислоты модулируют удлинение омега-6 жирных кислот до ARA, введение ARA в фосфолипидный пул клеточных мембран и продуцирование провоспалительных эйкозаноидов из ARA. Следовательно, комбинация DHA и ARA обеспечивает выраженное, но дополнительное действие на ослабление воспалительной ответной реакции во многих тканях.
Кроме того, согласно некоторым вариантам изобретения живая и инактивированная LGG вводятся в комбинации друг с другом. Полагают, что комбинация живой и инактивированной LGG приводит к появлению дополнительных или синергических эффектов, относящихся к противовоспалительным свойствам составов, содержащих эти агенты. Не желая ограничиваться какой-либо теорией, можно считать, что живые пробиотики, такие как LGG, оказывают противовоспалительно действие, отчасти за счет взаимодействия со специфичными рецепторами, известными как толл-подобные рецепторы (TLRs), на поверхности специфичных иммунных клеток. Непосредственное или косвенное взаимодействие между живой LGG и этими рецепторами инициирует каскад внутриклеточной сигнальной трансдукции, который приводит к изменению экспрессии генов в этих целевых клетках. Считают, что именно это специфическое взаимодействие и получающееся в результате изменение в экспрессии генов и других клеточных эффектов вовлечены в модуляцию воспаления. Таким образом, вследствие того, что как полагают, живая и инактивированная LGG действуют по разным механизмам, можно считать, что комбинация этих компонентов обеспечивает появление дополнительного или синергического противовоспалительного действия.
Кроме того, по некоторым вариантам данного изобретения живая LGG, инактивированная LGG и по меньшей мере одна LCPUFA вводятся в комбинации. Ввиду того, что считается, что живая LGG, инактивированная LGG и LCPUFA's каждая действует по своему механизму, полагают, что комбинация этих компонентов приводит к появлению дополнительного или синергического эффекта в отношении противовоспалительного действия составов, содержащих эти агенты.
По одному из вариантов изобретения субъект представляет собой новорожденного младенца, получающего искусственное питание. Согласно другому варианту новорожденный получает искусственное питание с момента рождения. По другому варианту новорожденный вскармливается грудью с момента рождения до возраста, составляющего менее одного года, и затем получает искусственное питание, когда в пищу вводят инактивированную LGG.
Согласно конкретному варианту данного изобретения способ включает лечение или профилактику системного воспаления у недоношенного ребенка, получающего искусственное питание. Согласно этому способ инактивированную LGG вводят недоношенному ребенку в виде молочной смеси или в другом подходящем виде. Кроме того, если желательно, инактивированную LGG можно вводить недоношенному ребенку в комбинации с DHA, ARA и/или одним или несколькими живыми пробиотиками с целью получения возможно синергического противовоспалительного эффекта.
Согласно способу по данному изобретению инактивированная LGG уменьшает или предотвращает системное высвобождение одного или более провоспалительных цитокинов или хемокинов. Применяемые по изобретению "провоспалительные" цитокины или хемокины включают такие агенты, которые, как известно, участвуют в ап - регуляции воспалительных реакций. Примеры включают, но без ограничения, TNF-α, IL-1β, IL-6, IL-8, IL-18 и GRO/КС.
Хемокины представляют собой группу цитокинов, которые обеспечивают миграцию лейкоцитов из крови в ткани в месте воспаления. При образовании хемокинов в большом количестве они могут приводить к повреждению здоровой ткани. Рост-связанный онкоген (GRO/КС) является хемокином, который направляет иммунные клетки в район воспаления. Он является человеческим дубликатом крысиного цитокин-индуцированного нейтрофильного хемоаттрактанта (CINC - 1) и функционально относится к семейству интерлейкина-8.
Согласно еще одному варианту изобретения инактивированная LGG, как было показано, ингибирует транслокацию ядерного фактора - kB (NFkB). NFkB представляет собой первичный фактор транскрипции, обнаруженный во всех видах клеток, который, как считается, играет важную роль в начале воспаления. В большинстве клеток NF-kB находится в виде латентного, неактивного ингибиторного комплекса, связанного с kB, в цитоплазме. Когда клетка получает любой из множества внеклеточных сигналов, например, от цитокинов, бактериальных антигенов или свободных радикалов, NF-kB быстро входит в ядро и активирует гены, которые являются ответственными за воспалительную ответную реакцию. Было показано, что ингибирование NFkB в начале воспаления приводит к уменьшению воспалительной ответной реакции. Lawrence, et al., Possible New Role for NFkB in the Resolution of Inflammation, Nature Med. 7:1291 (2001). Таким образом, ингибирование NFkB путем добавления инактивированной LGG согласно данному изобретению способствует уменьшению или предотвращению системного воспаления.
Как будет видно из примеров, инактивированная LGG уменьшает системное воспаление у грудных детей, которым дают искусственную пищу. Содержание CINC-1 и различных цитокинов у грудных искусственно вскармливаемых детей было снижено до уровня, похожего на содержание их в материнском молоке крыс с добавлением LGG.
Как также будет видно из примеров, было показано, что инактивированная LGG значительно уменьшает образование IL-8, уменьшает транслокацию NF-kB и повышает образование IkB в эпителии кишечного тракта. Изобретатели неожиданно обнаружили, что инактивированная LGG дополнительно предотвращает убиквитинирование IkB, в то время как живая LGG не обладает этим действием.
Следующие ниже примеры описывают различные варианты данного изображения. Другие варианты в объеме данного изобретения будут очевидны специалистам в данной области из рассмотрения описания или при осуществлении описанного в данной заявке изобретения. Данное описание вместе с примерами следует рассматривать только как приводимое в качестве примера, объем этого изобретения определяется формулой изобретения, следующей за примерами. В примерах все проценты даны как весовые, если не указано иное.
Пример 1
Этот пример иллюстрирует влияние инактивированной LGG на системное воспаление у новорожденных крысят, получающих искусственное питание.
Материалы и способы
В двух отдельных опытах детеныши крыс Sprague-Dawley (Taconic, Gennantown, NY) произвольно разделили на четыре группы по пять крыс в группе: контрольная группа (нет LPS или LGG в пище), группа, получавшая LPS, группа, получавшая LPS плюс живая LGG, и группа, получавшая LPS плюс инактивированную LGG. Детеныши крыс того же возраста, вскармливаемые матерью, использовались в качестве контрольных животных. Кормление через гастростомические трубки с применением "pup-in-the-cup" модели ("один детеныш на кормушку") начинали на 7-й день жизни детенышей крыс. Питающие гастростомические трубки изготавливали из полиэтиленовых трубок (секции по 24 см), которые вводили в желудок крысят. Введение гастростомических трубок осуществляли под анестезией изофураном. Шприцы-насосы с таймерами были соединены с питающими трубками, кормление крысят проводили в течение первых 20 мин каждый час со скоростью, зависящей от веса.
Во время 2-дневного периода акклиматизации детенышей крыс кормили заменителем крысиного молока (RMS) при помощи гастростомических трубок. По окончании периода акклиматизации детенышам в одной из групп, получавших RMS, вводили добавку, равную 1×108 клеточных эквивалентов на кг веса в день инактивированной LGG. LGG была инактивирована путем тепловой обработки, убивающей бактерии. Детенышам второй группы давали живую LGG в количестве 1×108 КОЕ на г веса в день. Крысятам в третьей группе добавляли в корм RMS без LGG любого вида. Такое кормление всех крысят продолжали в течение 6 дней. Все животные с гастростомическими трубками получали одинаковое количество жиров и углеводов и белок в количестве, требующемся для нормального роста. Крысята того же возраста, вскармливаемые матерью, использовались как контрольные животные.
Липополисахарид (LPS) из Escherichia coli 0127: В8 (LPS; Sigma, St. Louis, МО) растворяли в воде с концентрацией 2 мг/мл при встряхивании. Крысятам, вскармливаемьм через гастростомические трубки, давали от 0,25 до 0,5 мг/кг/день LPS через гастростомическую трубку, начиная через 2 дня после начала искусственного вскармливания. Детенышам крыс давали LPS в течение 6 дней. Эта доза была определена в ходе пилотных исследований, она приводила к временной дрожи, пилоэрекции и небольшому увеличению веса, но не была связана со значительным увеличением смертности в течение 6 дней.
В конце 6-дневного периода детенышей крыс умерщвляли сверхдозой натриевой соли пентобарбитала. Удаляли тонкую кишку и разделяли ее на три части: подвздошную кишку, тощую кишку и 12-перстную кишку, хранили их при температуре -80°С для проведения ферментного анализа и ELISA или фиксировали в 10% нейтральном буферированном растворе формалина для анализа морфологии кишечника. Легкие, печень и плазму хранили при температуре -80°C для проведения ферментного анализа и ELISA.
Для анализа изменения веса применяли программу Sigmastat для обработки статистических данных, ELISA применяли для определения CINC-1, а также результатов мультиплексного анализа цитокинов / хемокинов. Все данные были средними±стандартное отклонение (SD). Односторонний анализ вариантности между группами (ANOVA) применяли для определения наличия значительной разницы среди всех групп животных. В тех случаях, когда согласно ANOVA уровень значимость р был <0,05, применяли метод Holm - Sidak для попарного сравнения результатов.
Результаты и обсуждение
Рост
Этот пример иллюстрирует влияние LGG на рост детенышей крыс после кормления при помощи гастростомических трубок. Детенышей крыс взвешивали ежедневно после кормления и сравнивали с животными, вскармливаемыми матерью. Последние росли гораздо быстрее, чем детеныши, которым давали LPS при помощи гастростомических трубок. Добавление к пище живой или инактивированной LGG и LPS не приводило к увеличению веса крыс.
CINC-1
Живая и инактивированная LGG приводили к снижению уровня CINC-1. Уровень CINC-1 определяли методом иммунометрического анализа TiterZyme Enzyme с применением набора для определения рост-ассоциированного онкогена/CINC-1 (Assay Design, Ann Arbor, MI). Образцы тканей выделяли из клеточных экстрактов целых тканей в печени, кишечника, плазме и легких. Определяли абсорбцию при длине волны 450 нм и рассчитывали концентрацию, применяя уравнение, выведенное из стандартной линейной кривой.
Как показано на Фиг.1-3, результаты ELISA свидетельствовали, что LPS приводил к повышению уровней CINC-1 в печени, легких и плазме. Как живая, так и инактивированная LGG снижала LPS-индуцированное образование CINC-1 в печени (Фиг.1) и в плазме (Фиг.2) (р<0,05), наблюдалась также тенденция к изменению (р=0,09) в легких (Фиг.3).
Фиг.1 показывает, что добавка живой LGG приводила к снижению уровня CINC-1 в печени примерно на 50% по сравнению с группой, получавшей LPS. Однако инактивированная LGG понижала уровень CINC-1 в печени примерно на 75% по сравнению с этим показателем у животных, получавших LPS. Таким образом, инактивированная LGG проявляет значительно большее действие, понижая уровень CINC-1 в печени, по сравнению с живой LGG, что свидетельствует о более сильном противовоспалительном действии.
Точно так же Фиг.2 иллюстрирует более низкий уровень CINC-1 в плазме у животных в группе, получавшей инактивированную LGG, по сравнению с животными, которым давали живую LGG. В легких и живая, и инактивированная LGG понижали уровень CINC-1 в одинаковой степени (Фиг.3).
GRO/KC
Как показано на Фиг.4 и 5, данные мультиплексного анализа цитокинового профиля свидетельствовали о похожем уменьшении уровня GRO/KC в печени и в легких. Инактивированная LGG снижала уровень GRO/KC в большей степени, чем живая LGG в печени, что свидетельствовало о более сильном противовоспалительном действии (Фиг.4). И живая, и инактивированная LGG снижали уровень GRO/KC в легких в одинаковой степени (Фиг.5).
Уменьшенное содержание CINC-1 и GRO/KC, наблюдаемое в легких в данном опыте, показало, что противовоспалительное действие инактивированной LGG распространяется на периферические органы. Таким образом, противовоспалительное действие инактивированной LGG в действительности является системным по природе.
В печени при введении добавки инактивированной LGG уровень CINC-1 снижался до величины, которая была ниже, чем этот показатель у крысят, вскармливаемых материнским молоком. В легких и в плазме инактивированная LGG приводила к снижению уровня CINC-1 до величины, близкой к этому показателю у крысят, вскармливаемых материнским молоком. Эти результаты показывают, что инактивированная LGG обладает способностью снижать системное воспаление у крысят, получавших искусственную смесь, до уровня, похожего на соответствующую величину у детенышей крыс, вскармливаемых материнским молоком, а в некоторых случаях этот показатель был ниже.
Цитокины и хемокины
Живая и инактивированная LGG также снижали уровень цитокинов и хемокинов. Наборы для мультиплексного анализа были куплены в LINCO Research Inc. (St. Charles, МО, USA). Профиль цитокинов/хемокинов анализировали при помощи набора, который включал: гранулоцит-маккрофаговый колониестимулирующий фактор (GMCSF), интерферон-гамма (IFN-γ), интерлейкин-1α (IL-1α), IL-1β, IL-2, EL-4, IL-5, IL-6, IL-8, IL-10, IL-12p70, IL-18, моноцитарный хемоаттрактантный протеин-1 (МСР-1), GRO/KC (крысиный CINC-1) и TNF-α. Мультиплексный анализ проводили в соответствии с инструкциями производителя. Получали стандартные кривые для каждого цитокина / хемокина с применением стандартных концентраций от производителей. Необработанные данные (средняя интенсивность флуоресценции) анализировалась при помощи программы MasterPlex Quantitation Software (MiraiBio, Inc., Alameda, CA, USA) для получения величин концентрации.
Как видно из Фиг.6, уровень IL-1β в печени был значительно выше у животных, получавших LPS через гастростонические трубки, чем у контрольных животных. И живая, и инактивированная LGG значительно снижали вызванное введением LPS повышение содержания IL-1β. В действительнбости, инактивированная LGG уменьшала уровень IL-1β в большей степени, чем живая LGG. Инактивированная LGG понижала экспрессию IL-1β до уровня, величина которого была похожа на величину соответствующего показателя у контрольных животных. Таким образом, эта часть опыта также иллюстрирует системное противовоспалительное действие инактивированной LGG.
В заключение можно указать, что эти результаты свидетельствуют о том, что добавка инактивированной LGG снижает системное воспаление. Кроме того, эти результаты показывают, что инактивированная LGG уменьшает системное воспаление у новорожденных, получающих искусственное питание, до величины, похожей на этот показатель у новорожденных, получающих материнское молоко. Это иллюстрируется результатами, описанными в данной заявке, путем сравнения животных, получавших инактивированную LGG, и животных, питавшихся исключительно материнским молоком. В нескольких случаях введение инактивированной LGG приводит к воспалительной ответной реакции, которая очень похожа на реакцию у животных в группе, получавшей материнское молоко.
Пример 2
Этот пример также показывает влияние инактивированной LGG на воспаление у новорожденных детенышей крыс, получавших искусственное питание.
Кишечные эпителиальные клетки предварительно обрабатывали живой или УФ-инактивированной LGG в концентрации 1×108 КОЕ/ L и затем стимулировали флагеллином (500 мг/мл). Образование IL-8 анализировали методом ELISA. Степень экспрессии IkB и убиквитинированного IkВ (UbQ - IkB) определяли методом вестерн-блоттинга и методом иммуноосаждения. Локализацию NFkB оценивали методом иммунофлуоресцентного окрашивания.
Во время опыта флагеллин индуцировал значительное увеличение продуцирования IL-8 в клетках (р<0,05). Клетки, предварительно обработанные или живой LGG, или ЕА-инактивированной LGG и затем стимулированные флагеллином, показали, что произошло значительное (р<0,05) изменение содержания IL-8, NFkB-ядерной транслокации, IkB и UbQ-IkB. Результаты приведены в Таблице 1. Стрелки, направленные вверх, показывают увеличение параметра, в то время как стрелки, направленные вниз, показывают уменьшение параметра.
Как показывает Таблица 1, флагеллин индуцировал значительное увеличение образования IL-8 в эпителиальных клетках кишечника (р<0,05). Продуцирование IL- 8 в значительной степени подавлялось в присутствии как живой, так и инактивированной LGG. Кроме того, клетки, стимулированные флагеллином, характеризовались NFkB-ядерной транслокацией, что предотвращалось путем добавления как живой, так и инактивированной LGG. Флагеллин снижал образование IkB, но этот эффект становился обратным при предварительной обработке клеток как живой, так и инактивированной LGG (p<0,05). Флагеллин и живая LGG увеличивали уровень UbQ - IkB (p<0,05), в то время как инактивированная LGG снижала уровень UbQ - IkB. Этот пример показывает, что и живая, и инактивированная LGG являются эффективными при уменьшении образования IL-8, провоспалительного цитокина, и тем самым оказывают противовоспалительное действие. Поскольку флагеллин и живая LGG увеличивали образование UbQ - IkB, а инактивированная LGG снижала образование UbQ - IkB, инактивированная LGG, по всей вероятности, действует по механизму, который предотвращает убиквитинирование IkB, в то время как живая LGG, по всей видимости, не оказывает такого воздействия. Таким образом, этот пример также показывает, что живая и инактивированная LGG, по-видимому, действуют по разным механизмам и могут характеризоваться синергическим эффектом при совместном введении.
Данное изобретение, как было показано, приводит к уменьшению воспаления в печени, плазме и в легких. Так как данное изобретение может быть использовано для ослабления воспаления, оно может также предотвращать возникновение опасных инфекций или болезней.
Все ссылки, цитировавшиеся в данной заявке, включая без ограничения все сообщения, публикации, патенты, заявки на патент, презентации, тексты, рукописи, брошюры, книги, Интернет-сообщения, статьи в журналах, периодические издания и т.п., включены полностью в качестве ссылок в данную заявку. Обсуждение этих ссылок предназначено только для обобщения утверждений их автором и не сделано ни одного заявления, что какая-либо ссылка относится к предшествующему уровню техники. Заявители сохраняют за собой право подвергнуть сомнению точность и уместность процитированных ссылок.
Эти и другие модификации и изменения данного изобретения могут быть осуществлены специалистом в данной области, не выходя за рамки и объем данного изобретения, охарактеризованного в прилагаемой формуле изобретения. Кроме того, следует иметь в виду, что аспекты различных вариантов данного изобретения могут быть изменены как полностью, так и частично. Далее, специалистам очевидно, что изложенное выше описание может быть только примером и не ограничивает данное изобретение, описанное в формуле изобретения. Следовательно, смысл и объем настоящего изобретения, описанные в формуле изобретения, не должны ограничиваться описанием предпочтительных вариантов, содержащихся в нем.

Настоящая группа изобретений относится к медицине, а именно к терапии и педиатрии, и касается лечения или предотвращения системного воспаления. Для этого используют пищевую композицию или диету, включающую пищевую композицию, содержащую инактивированную Lactobacillus rhamnosus GG в количестве, эффективном для обеспечения 1×104-1×1010 клеточных эквивалентов инактивированной Lactobacillus rhamnosus GG на кг веса в день. Введение такой композиции обеспечивает эффективное снижение уровня провоспалительных цитокинов в организме. 2 н. и 10 з.п. ф-лы, 2 пр., 1 табл., 6 ил.
1. Пищевая композиция, содержащая инактивированную Lactobacillus rhamnosus GG в количестве, эффективном для обеспечения 1·104-1·1010 клеточных эквивалентов инактивированной Lactobacillus rhamnosus GG на кг веса в день.
2. Композиция по п.1, отличающаяся тем, что количество инактивированной Lactobacillus rhamnosus GG эффективно для обеспечения 1·106-1·109 клеточных эквивалентов на кг веса в день.
3. Композиция по п.1, которая дополнительно содержит по меньшей мере один другой инактивированный пробиотик.
4. Композиция по п.1, которая дополнительно содержит по меньшей мере один жизнеспособный пробиотик.
5. Композиция по п.4, в которой жизнеспособный пробиотик представляет собой жизнеспособную Lactobacillus rhamnosus GG.
6. Композиция по п.1, которая дополнительно содержит по меньшей мере один пребиотик.
7. Композиция по п.1, которая дополнительно содержит по меньшей мере одну длинноцепочечную полиненасыщенную жирную кислоту.
8. Композиция по п.7, в которой длинноцепочечная полиненасыщенная жирная кислота выбрана из группы, состоящей из DHA, ARA или их комбинаций.
9. Композиция по п.8, представляющая собой детскую молочную смесь.
10. Диета для предотвращения или уменьшения системного воспаления у субъекта, включающая кормление субъекта пищевой композицией, содержащей Lactobacillus rhamnosus GG в количестве, эффективном для обеспечения 1·104-1·1010 клеточных эквивалентов инактивированной Lactobacillus rhamnosus GG на кг веса в день.
11. Диета по п.10, при которой содержание инактивированной Lactobacillus rhamnosus GG достаточно для обеспечения 1·106-1·109 клеточных эквивалентов на кг веса в день.
12. Диета по п.10, при которой субъект представляет собой младенца или ребенка.
| WO 2006113033, 26.10.2006 | |||
| WO 2006113034, 26.10.2006 | |||
| US 2006233752 А1, 19.10.2006 | |||
| US 2006233762 A1, 19.10.2006 | |||
| PESSIT | |||
| et al | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
Авторы
Даты
2012-12-10—Публикация
2008-02-22—Подача