Изобретение относится к области химии, биологии и молекулярной медицины и может быть использовано для получения наноразмерных систем доставки нуклеозидтрифосфатов в эукариотические клетки с целью создания эффективных лекарственных препаратов.
В последние годы возрастает интерес к наноразмерным системам доставки лекарственных средств в клетки, что связано с преимуществами этих систем по сравнению с существующими методами. В качестве наночастиц используются полимеры (полимерные наночастицы, мицеллы, дендримеры) и органометаллические соединения (наночастицы, нанотрубки) (Cho К. et al., Clin. Cancer Res. 2008, v.14, р.1310-1316).
Из уровня техники известны источники, в которых представлены результаты изучения наночастиц диоксида кремния (SiO2) для увеличения эффективности действия терапевтических агентов в раковых клетках, решения проблем растворимости и стабильности некоторых лекарств, а также адресной доставки лекарств и их последующего контролируемого высвобождения (Slowing I.I. et al. Adv. Drug Deliv. Rev. 2008. v.60. p.1278-1288; Manzano M. et al. Expert Opin. Drug Deliv. 2009. v.6, p.1383-1400; Vivero-Escoto J.L. et al. Small 2010, v.6, p.1952-1967).
Известно, что наночастицы SiO2 размером 20-77 нм хорошо проникают в цитоплазму клеток, а также способны проникать в ядра клеток (Chen M., von Mikecz A. Exp. Cell Res. 2005, v.305, p.51-62; Neumeyer A. et al. Nanomedicine. 2011, v.7, p.410-419).
Наночастицы диоксида кремния можно подвергнуть различным модификациям, придавая им различные свойства. Например, введение функциональных групп позволяет легко присоединять к частицам белки или нуклеиновые кислоты, а также низкомолекулярные лекарственные препараты. Показано, что модифицированные наночастицы также эффективно проникают в клетки (Мао Z. et al. Colloids and Surfaces В: Biointerfaces, 2010, v.75, 4p.32-440; Zhu S.G. et al. Biotechnol. Appl. Biochem. 2004, v.39, p.179-187).
В качестве противовирусных, противораковых и в меньшей степени противогрибковых препаратов достаточно широко используются аналоги нуклеозидов (N). Активной формой, воздействующей на вирус, являются не сами по себе аналоги нуклеозидов, а их фосфорилированные формы - 5'-трифосфаты (pppN), которые являются основными субстратами для ДНК и РНК полимераз (Galmarini С.М. et al. Lancet. Oncol. 2002, v.3(7), p.415-424). Таким образом, аналоги нуклеозидов должны пройти в клетке стадии фосфорилирования, превращаясь последовательно в соответствующие нуклезидмоно-, ди- и трифосфаты, что приводит к необходимости использования больших доз препаратов. Кроме того, фосфорилирование аналогов нуклеозидов клеточными ферментами до соответствующих 5'-трифосфатов осуществляется труднее, чем природных; что требует создания еще более высокой концентрации нуклеозидного субстрата. Использование высоких доз препаратов приводит к расстройству функций печени, поджелудочной железы и к другим проблемам.
Решением проблемы токсичности могло бы быть использование в качестве антивирусных препаратов не аналогов нуклеозидов (N), а их фосфорилированных форм - трифосфатов. Однако нуклеозидтрифорфаты (pppN) не проникают в клетки, поэтому создание антивирусных препаратов на основе pppN, способных проникать в клетки, является актуальной и практически значимой проблемой.
Известен способ получения наноразмерной системы доставки pppN, включающий электростатическое присоединение pppN к наночастицам магнетита Fe3O4 и последующее включение образованных комплексов в липосомы (Saiyed Z.M. et al.. Int. J. Nanomed. 2010, v.7, p.157-166). Известный способ заключается в следующем. Предварительно получают наночастицы магнетита путем соосаждения ионов двух- и трехвалентного железа в щелочной среде при повышенной температуре. На полученные наночастицы магнетита (~40 нм) нековалентно иммобилизуют pppN за счет электростатических взаимодействий с максимальной емкостью по pppN ~80 нмол/мг. Отдельно получают липосомы, смешивая фосфатидилхолин и холестерин в хлороформе и упаривая смесь до образования сухой липидной пленки, которая регидратируется в 0.9% растворе NaCl, содержащем заранее приготовленные частицы с иммобилизованным pppN, что приводит к инкапсулированию наночастиц в липосомы.
Недостатком известного способа является трудоемкость приготовления липосом и нестабильность последних при хранении. Кроме того, липосомные комплексы в некоторых случаях вызывают воспалительные процессы (Zhang J.S. et al. Adv. Drug Deliv. Rev. 2005, v.57, p.689-698).
Известен способ получения наноразмерной системы доставки pppN в клетки путем их инкапсулирования в эритроциты (Magnani M. et al. J. Leukoc. Biol. 1997, v.62, p.133-137). Использование такой системы доставки pppN ограничено из-за трудности хранения, возможности загрязнения и недостаточной разработанности процедуры приготовления.
Известен способ получения наноразмерной системы доставки pppN в клетки в виде комплекса pppN с катионными наногелями, представляющими собой сополимер полиэтиленимина и полиэтиленгликоля (Vinogradov S.V., Expert Opin. Drug. Deliv. 2007, v.4(1), p.5-17; Vinogradov S.V., Curr. Pharm. Des. 2006, v.12, p.36). Предварительно полученный наногель диспергируют в воде при рН 10 для депротонирования аминогрупп, затем титруют его полученным раствором нуклеозидтрифосфата до рН 7.5, концентрируют в вакууме, пропускают через колонку NAP-20 и лиофилизуют.
Недостатками известного способа являются длительность и низкое качество целевого продукта, вследствие недостаточно прочной связи pppN с носителем.
Во всех упомянутых выше способах молекулы pppN связаны с носителями нековалентно, в частности, за счет ионообменных взаимодействий. Это является причиной относительно быстрой кинетики высвобождения pppN из наноконструкции, его деградации и выведения из организма и, как следствие, больших потерь лекарства. Этот недостаток может быть преодолен путем создания такой системы доставки, в которой pppN ковалентно, т.е. достаточно прочно связан с носителем.
Наиболее близким к заявляемому способу-прототипу является способ получения наноразмерной системы доставки, заключающийся в ковалентном присоединении фосфорилированной формы нуклеозида к полимерным частицам в виде наногеля, представляющего собой модифицированный холестерином поливиниловый спирт (PVA) или декстрин (DEX) (Senanayake Т.Н. et al. Bioconjug. Chem. 2011, v.22(10), p.1983-1993).
Известный способ заключается в следующем. Предварительно получают модифицированный холестирином полимер по следующей схеме: к PVA или DEX, высушенному в вакууме над оксидом фосфора (V) и растворенному в сухом диметилсульфоксиде, добавляют триэтиламин при 70°C; реакционную смесь охлаждают до 25°C, добавляют холестерилхлорформиат и перемешивают в течение ночи. Полученный модифицированный полимер (CPVA или CDEX) выделяют с выходом ~75% путем диализа против 20% спирта (3×24 ч), концентрируют в вакууме и лиофилизуют.
Затем получают фосфорилирующий реагент: 2-цианоэтил-бис(имидазолил)-фосфат (CNEtOP(O)Im2) по реакции 2-цианэтанола с P2O5 в присутствии триэтиламина, с последующим добавлением N-триметилсилилимидазола (выход ~42%).
Далее гидроксильные группы в структуре полимеров CPVA (или CDEX) фосфорилируют полученным реагентом CNEtOP(O)Im2, а затем обрабатывают неорганическим пирофосфатом (в форме тетрабутиламмониевой соли) в течение часа и получают полимер, несущий трифосфатные группы.
Проводят фосфорилирование 5'-гидроксильной группы нуклеозида (флоксуридина (FU) или тимидина (Т)) реагентом CNEtOP(O)Im2 и получают нуклеозид, несущий активированную фосфатную группу (выход ~80%). Полученное производное нуклеозида смешивают с полимером, несущим трифосфатные группы и получают целевой продукт - конъюгат полимера с нуклеозидом (FU или Т), ковалентно присоединенным через 5'-тетрафосфатный линкер. Конечный продукт очищают диализом (24 ч). Емкость полимера по нуклеозиду - 0.4-0.5 мкмоль/мг. При обработке полученного продукта ультразвуком в деионизованной воде в течение 2 ч при 4°C происходит образование наночастиц размером 30-50 нм за счет ассоциации (агрегации) холестериновых остатков в составе полимера. В целом процесс получения наноразмерной системы доставки (нанокомпозита) занимает не менее 6 суток (не считая времени на получение фосфорилирующего реагента).
Высвобождение pppN из нанокомпозитов при кислотном гидролизе при исследовании in vitro происходит очень медленно: ~1-2% в день при рН 4.0 и 7.4 (моделирующем кислотную среду в эндосомах и в крови) и ~4% в день при рН 1.0 (моделирующем кислотность в желудке).
Недостатком известного способа является длительность и недостаточное качество целевого продукта из-за низкого уровня высвобождения лекарственной формы в виде pppN (в лучшем случае 10-20% в течение длительного времени, около 30 суток). В то же время, при более быстром (12-24 ч) энзиматическом гидролизе SV-фосфодиэстеразой высвобождается не pppN (трифофсфат), а монофосфат (pN), который требует дальнейшего фосфорилирования, чтобы стать субстратом ДНК-полимераз в клетке.
Использование наночастиц SiO2 в качестве систем доставки pppN в литературе не описано.
Задачей изобретения является создание более простого способа получения наноразмерной системы доставки pppN в клетки, обладающей более высокой стабильностью и являющейся в целом аналогом pppN и субстратом ДНК-полимераз, т.е. активной лекарственной формой.
Техническим результатом является сокращение длительности способа и повышение качества целевого продукта.
Поставленная задача достигается заявляемым способом, заключающимся в следующем.
Предварительно получают азидомодифицированные наночастицы диоксида кремния (SiO2). Для этого 2-20 мг исходных коммерческих аминосодержащих наночастиц (SiO2~NH2) размером до 24 нм суспендируют с помощью ультразвука (УЗ) в 0.2-2 мл смеси вода/диметилформамид, взятых в соотношении 1:1, и обрабатывают избытком N-гидроксисукцинимидного эфира алифатической азидокислоты (NSIm-CO-(CH2)n-N3, n=5-10) при перемешивании в течение 1 ч при комнатной температуре. Полученные азидомодифицированные наночастицы (SiO2-NH-CO-(CH2)n-N3) отделяют центрифугированием, промывают ацетоном и серным эфиром и высушивают на воздухе. Замена аминогрупп на линкер с азидогруппами происходит с выходом 85%. Процедура занимает 2 часа.
Затем получают модифицированный pppN, несущий на γ-фосфате линкер с алкино-группой. С этой целью pppN в виде трибутиламмониевой соли активируют по известной методике (Babkina G.N. et al. Bioorg. Khim. 1975, v.1, p.611) с помощью пары трифенилфосфин/дитиодипиридин в течение 30 мин, затем образующееся активное производное инкубируют с линкером - 3-пропинилоксипропиламином (CH≡C-CH2-O-(CH2)3-NH2), несущим на одном конце аминогруппу, а на другом - алкиногруппу в течение 2 ч при комнатной температуре и перемешивании. Полученный продукт СН≡С-СН2-O-(СН2)3-NH-pppN выделяют ионообменной хроматографией. Выход ~50%. Процедура занимает 1-2 дня.
Далее проводят ковалентное присоединение CH≡C-CH2-O-(CH2)n-NH-pppN, несущего алкиногруппу, к азидосодержащим наночастицам, для чего к 1-10 мг азидомодифицированных наночастиц добавляют 0.09-0.9 мл 10 мМ раствора CH≡C-CH2-O-(CH2)3-NH-pppN и стандартные дополнительные реагенты для проведения данной реакции, включающие 0.1-1 мл воды, 50 мМ раствор сульфата меди в воде (0.01-0.1 мл), 1 М ацетат триэтиламмония, рН 7 (0.01-0.1 мл) и 0.1 М аскорбат натрия (0.01-0.1 мл) и оставляют при перемешивании на 1-4 ч. Полученный нанокомпозит SiO2~pppN выделяют центрифугированием. Частицы высушивают на воздухе и получают 0.8-9 мг целевого нанокомпозита (80-90%). В целом процесс получения наноразмерной системы доставки (нанокомпозита) занимает не более 3 суток. Емкость полученных наночастиц SiO2~pppN по нуклеозиду составляет 0.2-0.3 мкмоль/мг.
Заявляемый способ в 2 раза сокращает время приготовления нанокомпозита, при этом обеспечивает практически такую же высокую прочность связывания pppN с частицами и емкость нанокомпозита по pppN как и известный способ (прототип).
Определяющими отличиями предлагаемого способа от прототипа, являются:
1. В качестве наночастиц используют коммерческие SiO2~NH2-наночастицы размером до 24 нм, что позволяет повысить стабильность целевого продукта, поскольку SiO2~NH2-наночастицы хорошо охарактеризованы и стабильны при хранении в широком диапазоне условий (в прототипе наночастицы являются ассоциатами полимерных цепей за счет взаимодействия холестериновых остатков и могут быть неустойчивыми при различных условиях (рН, температура, солевой состав).
2. Коммерческие SiO2~NH2-наночастицы обрабатывают избытком N-гидроксисукцинимидного эфира алифатической азидокислоты, что позволяет получить азидомодифицированные наночастицы (SiO2~N3), готовые для последующего присоединения модифицированного производного pppN.
3. Для получения модифицированного производного pppN последний активируют смесью трифенилфосфин/дитиодипиридин с последующим инкубированием образующегося активного производного с линкером - 3-пропинилоксипропиламином и получают модифицированный алкиносодержащий нуклеозидтрифосфат, пригодный для присоединения к азидомодифицированным наночастицам (SiO2~N3), что в итоге приводит к повышению качества целевого продукта.
4. К 1-10 мг полученных азидомодифицированных наночастиц добавляют 0.09-0.9 мл 10 мМ раствора алкиносодержащего производного нуклеозидтрифосфата и дополнительные реагенты, необходимые для проведения данной реакции, смесь перемешивают в течение 2-4 ч и получают нанокомпозит (SiO2~pppN), который в целом является субстратом для ДНК-полимераз и в котором именно нуклеозидтрифосфат является действующим компонентом.
В прототипе фосфорилированную форму нуклеозида присоединяют к носителю (наночастицам гидрогеля) посредством тетрафосфатного линкера, и биологически активным агентом является высвобождающийся из нанокомпозита нуклеозидмонофосфат (pN), требующий дальнейшего фосфорилирования до pppN).
Изобретение иллюстрируется следующими примерами конкретного выполнения.
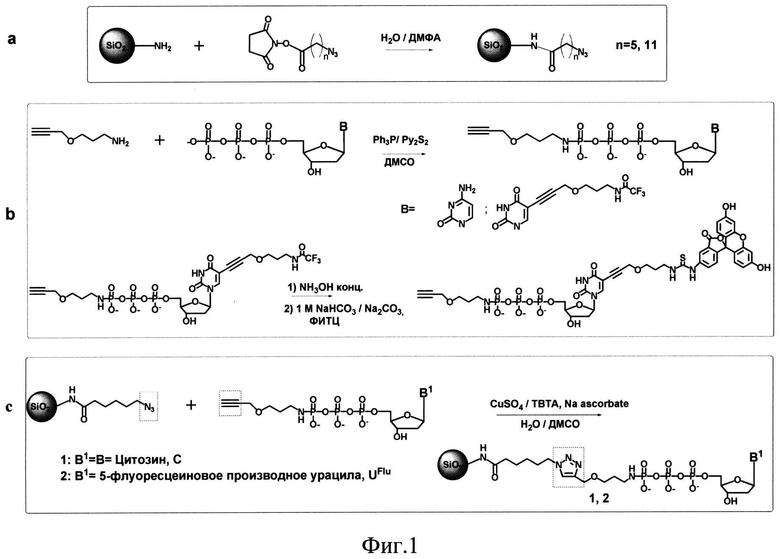
Пример 1. Получение азидомодифицированных наночастиц SiO2-NH-CO-(CH2)5-N3 (Фиг.1а).
SiO2~NH2-наночастицы (SkySpring Nanomaterials, Inc., USA) размером до 24 нм (20 мг, 10 мкмоль NH2-групп) суспендируют с помощью ультразвука (УЗ) в 2 мл смеси вода/диметилформамид (1:1), добавляют N-гидроксисукцинимидный эфир 6-азидогексановой кислоты (NSIm-CO-(СН2)5-N3, ООО «Нанотех-С», Новосибирск, Россия) (3.8 мг, 15 мкмоль, 1.5 экв). После перемешивания в течение 1 ч при комнатной температуре, реакционную смесь центрифугируют (7000 об/мин, 5 мин), супернатант удаляют, а частицы промывают ацетоном (3×0.1 мл), серным эфиром (1×0.1 мл) и сушат на воздухе 30 мин. Получают 19 мг модифицированных наночастиц SiO2-NH-CO-(CH2)5-N3 (90%). Замена аминогрупп на линкер с азидогруппами происходит с выходом 85% (количество непрореагировавших аминогрупп определяется титрованием пикриновой кислотой и составило не более 15%). Наличие азидогрупп в модифицированных наночастицах подтверждается ИК-спектроскопией (наличие в спектре пика на 2100 см-1).
Пример 2. Получение азидомодифицированных наночастиц SiO2-NH-СО-(СН2)10-N3 (Фиг.1а).
Способ осуществляли аналогично примеру 1, за исключением того, что к частицам (2 мг, 1 мкмоль аминогрупп) добавляют N-гидроксисукцинимидный эфир 11-азидоундекановой кислоты (NSIm-CO-(CH2)10-N3, ООО «Нанотех-С», Новосибирск, Россия) (3.25 мг, 10 мкмоль, 10 экв). Получают 2 мг модифицированных наночастиц SiO2-NH-CO-(CH2)10-N3 (90%).
Пример 3. Получение алкиномодифицированного нуклеозидтрифосфата, CH≡C-CH2-O-(CH2)3-NH-pppC (Фиг.1b, В=С (цитозин)). (В качестве нуклеозидных фрагментов используются 2'-дезоксинуклеозиды; префикс d в обозначении нуклеозидов опущен).
К раствору 2'-дезоксицитидин трифосфата рррС (трибутиламмониевая соль, 240 мг, 0.2 ммоль) в сухом диметилсульфоксиде (ДМСО, 3 мл) добавляют 2,2'-дитиодипиридин (245 мг, 1 ммоль) и трифенилфосфин (260 мг, 1 ммол) в сухом ДМСО (0,15 мл для каждого реагента). Реакционную смесь перемешивают в течение 30 мин, добавляют 3-пропинилоксипропиламин (СН≡С-СН2-O-(СН2)3-NH2, ООО «Нанотех-С», Новосибирск, Россия) (220 мг, 2 ммоль, 10 экв) и инкубируют еще 2 ч при комнатной температуре и перемешивании. Полученное гамма-амидное производное СН≡С-СН2-О-(CH2)3-NH-рррС очищают ионообменной хроматографией на колонке с DEAE Sephadex A-25. Элюцию проводят в линейном градиенте 0→1 М NH4HCO3 в 20% водном этаноле. Фракции, содержащие продукт, объединяют и упаривают. осле дополнительного упаривания с водным этанолом целевой продукт осаждают 4% раствором перхлората натрия в ацетоне. Выход продукта 62 мг (0.104 ммоля, 52%). Структура продукта подтверждена с помощью 1Н- и 31Р-ЯМР-спектроскопии и МАСС-спектрометрии.
Пример 4. Получение алкиномодифицированного нуклеозидтрифосфата, CH≡C-CH2-O-(CH2)3-NH-pppUFlu (Фиг.1b, В=UFlu (урацил, несущий флуоресцентно-меченный линкер в положении 5)).
Вначале получают алкиномодифицированное производное СН≡С-CH2-О-(CH2)3-NH-pppUL-TFA, (Фиг.1b, В=UL-TFA, урацил, несущий защищенный аминолинкер в положении 5), как описано в примере 3, за исключением того, что вместо рррС используют pppUL-TFA (5-(3-трифторацетамидо пропокси проп-1-инил)-2'-дезоксиуридин-5'-трифосфат, ООО «Нанотех-С», Новосибирск, Россия) и загрузка всех компонентов уменьшена в 4 раза (pppUL-TFA - 0.05 ммоль, 2,2'-дитиодипиридин - 0.25 ммоль, трифенилфосфин - 0.25 ммоль, CH≡C-CH2-O-(CH2)3-NH2 - 0.5 ммоль). Трифторацетильную защитную группу с аминолинкера в 5 положении уридина удаляют концентрированным аммиаком в течение 18 ч, и продукт CH≡C-CH2-O-(CH2)3-NH-pppUL-NH 2 осаждают 4% раствором перхлората натрия в ацетоне. Выход 22 мг (0.032 ммоля, 64%). Структура продукта подтверждена с помощью 1Н- и 31Р-ЯМР-спектроскопии и МАСС-спектрометрии.
Полученный продукт CH≡C-CH2-O-(CH2)3-NH-pppUL-NH (10 мг, 0.014 ммоль) растворяют в 1 М карбонат-бикарбонатном буфере, рН 9.0 (0.8 мл), добавляют раствор флуоресцеинизотиоцианата (55 мг, 0.14 ммоль) в смеси ДМСО/ДМФА (1:1, 0.4 мл). Реакционную смесь перемешивают 2 ч, продукт осаждают добавлением 4% перхлората натрия в ацетоне (14 мл). Целевой продукт CH≡C-CH2-O-(CH2)3-NH-pppUFlu очищают обращенно-фазовой хроматографией (Polygoprep С 18) в градиенте 0→10% этанола в воде и осаждают добавлением 4% перхлората натрия в ацетоне. Выход 10.3 мг (0.09 ммоль, 70%). Структура продукта подтверждена с помощью 1Н- и 31Р-ЯМР-спектроскопии и МАСС-спектрометрии.
Пример 5. Получение SiO2~pppC (Фиг.1с).
Азидомодифицированные наночастицы SiO2~NH-CO-(CH2)5-N3 (10 мг, 4.5 мкмоль азидогрупп), полученные, как в примере 1, суспендируют в 300 мкл воды с помощью ультразвука, затем добавляют 900 мкл 10 мМ водного раствора модифицированного нуклеозидтрифосфата СН≡С-СН2-О-(СН2)3-NH-рррС, полученного,как в примере 3 (9.5 мкмоль, 2 экв по отношению к азидогруппам), 50 мМ раствор сульфата меди(II) в воде (100 мкл), 1М ТЭААс буфер (рН 7, 50 мкл) и 0.1 М свежеприготовленный раствор аскорбата натрия в воде (160 мкл). Реакционную смесь дегазируют 2 мин аргоном и перемешивают при комнатной температуре в течение 4 ч. Полученный целевой нанокомпозит (SiO2~pppC) отделяют центрифугированием и последовательно промывают физиологическим раствором NaCl (1,5 мл), 10% ЭДТА, водой (2×1,5 мл), ацетоном (1,5 мл) и серным эфиром (1,5 мл). Частицы высушивают на воздухе и получают 9 мг целевого нанокомпозита (90% выход). Емкость нанокомпозита по нуклеозидтрифосфату, определенная по количеству присоединенного pppN, составляет 0.32 мкмол/мг.
Образующийся в нанокомпозите фрагмент в виде триазольного кольца сам по себе обладает различными биологическими функциями, в частности антибактериальными, антигистаминными и противовирусными свойствами (Alagarsamy V. et al., Chem. Biol. Drug Des. 2007, v.70, p.158; Aufort M. et al., Bioorg. Med.Chem. Lett. 2008, v.18, p.1195), что придает целевому продукту дополнительные положительные свойства.
Пример 6. Получение SiO2~pppUFlu (Фиг.1с).
Способ осуществляют аналогично примеру 5, за исключением того, что вместо производного дезоксицитидинтрифосфата СН≡С-СН2-O-(СН2)3-NH-pppC используют производное флуоресцентно-меченного уридинтрифосфата CH≡C-CH2-O-(CH2)3-NH-pppUFlu, полученного как описано в примере 4, при этом загрузки компонентов реакции уменьшены в 10 раз (SiO2~NH-CO-(CH2)5-N3 - 1 мг, сульфат меди(II) - 10 мкл, ТЭААс буфер - 5 мкл, аскорбат натрия - 16 мкл, CH≡C-CH2-O-(CH2)3-NH-pppUFlu - 90 мкл) и реакцию проводят в течение 2 ч. Оптическую плотность измеряют на 280 нм (ε280=14400). Выход составил 50%, емкость нанокомпозита по нуклеозидтрифосфату составила 0.23 мкмоль/мг.
Пример 7. Оценка способности нанокомпозитов SiO2~pppN проникать в клетки.
В эксперименте используют клетки MDCK, Hoechst 33343, Cell Mask Plasma Membrane Stain, клеточную среду IMDM, эмбриональную телячью сыворотку (ЭТС), антибиотики, PBS (Invitrogen, США). Для экспериментов клетки рассеивают в необходимой концентрации на 8-луночные камеры (Chamber Slide, Nunc. Inc.) и культивируют в среде IMDM, содержащей 10% ЭТС и антибиотики (пенициллин и стрептомицин, по 100 ед/мл) до достижения 70% монослоя, после этого заменяют культуральную среду на среду (200 мкл) без сыворотки и антибиотика. К клеткам добавляют растворы pppUFlu, CH≡C-CH2-O-(CH2)n-NH-pppUFlu, смесь pppUFlu с исходными SiO2~NH2-наночастицами и суспензию нанокомпозита SiO2~pppUFlu, полученного как описано в примере 6, разбавленные буферной смесью до нужной концентрации 0.1 мг/мл по наночастицам и ~30 нмол/мл по pppUFlu (конечная концентрация в клеточной среде - ~0.01 мг/мл по наночастицам и ~3 нмол/мл по pppUFlu). После 24 ч инкубации клетки отмывают PBS, фиксируют 3.7% формалином (10 мин) и окрашивают Hoechst 33343 и Cell Mask Plasma Membrane Stain в течение 10 мин. Полученные образцы анализируют с помощью конфокального лазерного сканирующего микроскопа LSM 510 UV Meta Microscope (Carl Zeiss, Inc., Германия) (Центр коллективного пользования ИЦИГ СО РАН).
На Фиг.2 представлено изображение клеток после инкубации с исследуемым образцом SiO2~pppUFlu (в черно-белом изображении нанокомпозиты проявляются в виде белых точек). Видно, что флуоресцентная метка более-менее равномерно распределена внутри клетки. В контрольных экспериментах показано, что pppUFlu, не будучи в составе нанокомпозита, не проникает в клетки.
Пример 8. Оценка цитотоксичности наночастиц и полученных нанокомпозитов.
Для оценки цитотоксичности нанокомпозитов применяют метод окраски мертвых клеток с помощью красителя трипанового синего (Altaian S. et al., Biotechnol. Prog. 1993, v.3, p.671-674). В экспериментах используют клетки линии MDCK. Клетки высевают с посадочной концентрацией 100000 кл/мл в питательной среде RPMI-1640, содержащей 10% сыворотки крови плодов коровы, L-глутамин и антибиотики, по 100 мкл/лунку 96-луночного планшета. Через 2 суток после образования сплошного монослоя клетки используют в экспериментах, для чего их предварительно трижды промывают питательной средой, не содержащей сыворотку, в объеме 200 мкл/лунку.
Затем клетки инкубируют с исходными наночастицами SiO2~NH2 и нанокомпозитом SiO2~pppC, полученным, как описано в примере 5, в концентрации от 100 до 1000 мкг/мл при 37°C, 5% СО2 и 100% влажности в течение 48 ч. Контролем служат необработанные клетки. После инкубации клетки промывают свежей культуральной средой и затем удаляют с планшетов смесью, содержащей 0,25% трипсин и 0,2% ЕДТА (1:1) и окрашивают 0,025% трипановым синим. Число живых и мертвых клеток считают под микроскопом Leica DM 2500. Все эксперименты повторены 3 раза. Результаты представлены на фиг.3, где темные столбцы относятся к наночастицам SiO2~NH2, светлые столбцы - к нанокомпозитам SiO2~pppC. Из фиг.3 видно, что выживаемость клеток примерно одинакова для всех исследуемых образцов, причем образцы обладают низкой токсичностью: даже при высокой концентрации 1 мг/мл выживают 80% клеток.
Пример 9. Субстратные свойства нанокомпозита SiO2~pppC.
Предварительно готовят модельную систему для проверки субстратных свойств нанокомпозита. Смесь 4 мкл 10-4 М праймера (16-мерного олигодезоксинуклеотида), 4 мкл 10-4 М матрицы (30-мерного олигодезоксинуклеотида) 8 мкл буфера, содержащего 500 мМ Трис-HCl, рН 7.6, 100 мМ MgCl2, и 50 мМ дитиотреитола (DTT) (Сибэнзим, Россия) и 64 мкл воды выдерживают при 95°C в течение 5 мин и охлаждают до комнатной температуры в течение 30 мин. Полученный дуплекс используют в качестве модельной системы для проверки субстратных свойств нанокомпозита SiO2~pppC в реакции элонгации с ДНК-полимеразой
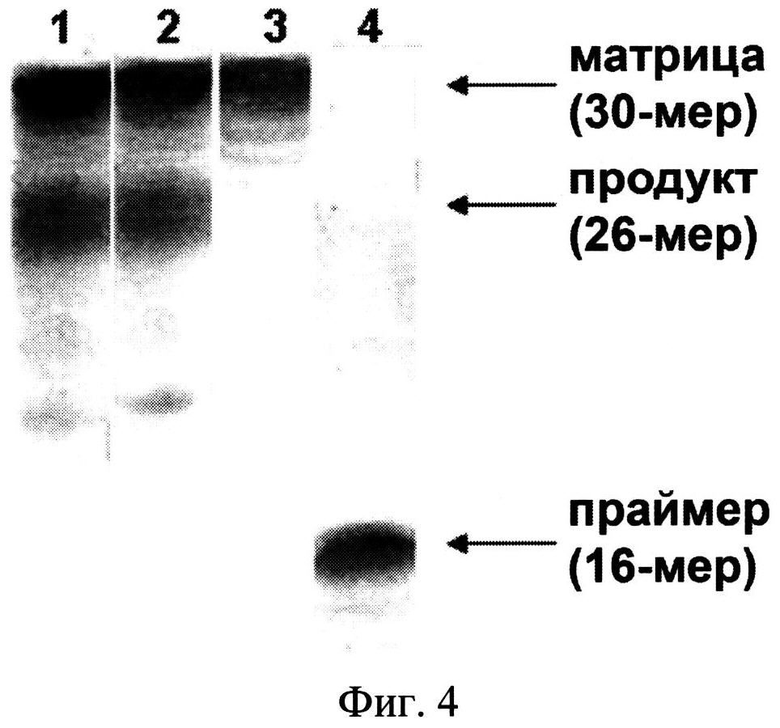
Реакцию элонгации проводят в 20 мкл смеси, содержащей 4 мкл дуплекса, 2 мкл выше приведенного буфера, 1·10-3 единиц активности ДНК-полимеразы I из Е. coli (фрагмент Кленова, Сибэнзим, Россия) и по 2 мкл каждого из 4-х дезоксинуклеозидтрифосфатов (4 природных pppN) (смесь 1), или 3 природных pppN (кроме рррС) и SiO2~pppC (смесь 2). Конечная концентрация в каждой реакционной смеси: 4·10-6 М для матрицы, 1·10-6 М для праймепа, 1·10-5 М для pppN; 0.07 мг/мл для SiO2~pppC (1·10-5 М для рррС в составе нанокомпозита). Реакцию проводят при 37°C в течение 1 ч. В реакционные смеси добавляют 30 мкл 3 М LiClO4, и реакционную смесь 2 центрифугируют для отделения от SiO2-наночастиц. Компоненты обеих реакционных смесей осаждают ацетоном (500 мкл), центрифугируют, промывают ацетоном, высушивают, растворяют в 10 мкл воды и подвергают электрофорезу в 20% полиакриламидном геле (ПААГ) в течение 1-2 ч при напряжении 1000 В. После электрофореза гель окрашивают красителем Stains All (Sigma, США), сушат в приборе FB GD 45 Gel dryer (Fisher Scientific, США) и сканируют на сканере HP ScanJet 3800 (США).
Результаты представлены на фиг.4, где: дорожки 1 и 2 - продукты реакции в смеси 1 и 2 соответственно; дорожки 3 и 4 - исходные матрица и праймер соответственно. Из фиг.4 видно, что реакция элонгации в обеих реакционных смесях приводит к образованию ожидаемого продукта (26-мерного олигонуклеотида, дор. 1 и 2), что свидетельствует о том, что SiO2~pppC является полноценным субстратом ДНК-полимеразы I из Е. Coli.
Повторение реакции элонгации через 6 месяцев показало, что субстратные свойства нанокомпозита SiO2~pppC сохраняются без изменений.
Использование предлагаемого способа позволит существенно сократить его длительность и обеспечить получение стабильной и эффективной системы доставки нуклеозидтрифосфатов в клетки млекопитающих.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ НАНОРАЗМЕРНОЙ СИСТЕМЫ ДОСТАВКИ ТРИФОСФАТА АЗИДОТИМИДИНА В КЛЕТКИ МЛЕКОПИТАЮЩИХ | 2014 |
|
RU2563171C1 |
| Способ получения системы доставки фрагментов нуклеиновых кислот в клетки млекопитающих | 2016 |
|
RU2646113C1 |
| СПОСОБ ПОЛУЧЕНИЯ НАНОРАЗМЕРНОЙ СИСТЕМЫ ДОСТАВКИ ФРАГМЕНТОВ НУКЛЕИНОВЫХ КИСЛОТ И ИХ АНАЛОГОВ В КЛЕТКИ МЛЕКОПИТАЮЩИХ | 2012 |
|
RU2499045C1 |
| НАНОКОМПОЗИТ С АКТИВНЫМ ЛИГАНДОМ, СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ И СПОСОБ АДРЕСНОЙ ИНАКТИВАЦИИ ВИРУСА ГРИППА ВНУТРИ КЛЕТКИ | 2012 |
|
RU2496878C1 |
| НАНОКОМПОЗИТЫ ДИОКСИДА ТИТАНА ДЛЯ ИНАКТИВАЦИИ ВИРУСНОГО ГЕНОМА ВНУТРИ КЛЕТОК, СПОСОБ ИХ ПОЛУЧЕНИЯ | 2008 |
|
RU2444571C2 |
| СПОСОБ ПОЛУЧЕНИЯ НАНОРАЗМЕРНОЙ СИСТЕМЫ ДОСТАВКИ АНТИБИОТИКОВ РЯДА БЛЕОМИЦИНА В КЛЕТКИ МЛЕКОПИТАЮЩИХ | 2011 |
|
RU2458705C1 |
| СОЕДИНЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ВИРУСНЫХ ИНФЕКЦИЙ | 2007 |
|
RU2466729C2 |
| СОЕДИНЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ВИРУСНЫХ ИНФЕКЦИЙ | 2007 |
|
RU2525392C2 |
| МОДИФИЦИРОВАННЫЕ 2- И 3-НУКЛЕОЗИДЫ И ИХ ПРИМЕНЕНИЕ ДЛЯ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА, ОБЛАДАЮЩЕГО ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ВИРУСА ГЕПАТИТА С | 2003 |
|
RU2437892C2 |
| ПРОЛЕКАРСТВА МОДИФИЦИРОВАННЫХ 2'- И 3'-НУКЛЕОЗИДОВ ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИЙ FLAVIVIRIDAE | 2003 |
|
RU2366661C2 |


Изобретение относится к области химии, биологии и молекулярной медицины, а именно к способу получения наноразмерной системы доставки нуклеозидтрифосфатов. Способ включает модификацию носителя, в качестве которого используют аминосодержащие наночастицы диоксида кремния размером до 24 нм, путем обработки последних N-гидроксисукцинимидным эфиром алифатической азидокислоты, далее получение модифицированного нуклеозидтрифосфата (pppN) путем обработки последнего смесью трифенилфосфин/дитиодипиридин с последующим инкубированием образующегося активного производного pppN с 3-пропинилоксипропиламином и последующую иммобилизацию модифицированного pppN на полученных азидомодифицированных наночастицах в течение 2-4 ч. Изобретение обеспечивает сокращение длительности способа и повышение качества целевого продукта. 2 з.п. ф-лы, 4 ил., 9 пр.
1. Способ получения наноразмерной системы доставки нуклеозидтрифосфатов в клетки млекопитающих, включающий модификацию носителя с последующей иммобилизацией фосфорилированной формы нуклеозида на полученный носитель, отличающийся тем, что в качестве фосфорилированной формы нуклеозида используют нуклеозидтрифосфат, а в качестве носителя используют аминосодержащие наночастицы диоксида кремния размером до 24 нм, которые обрабатывают избытком N-гидроксисукцинимидного эфира алифатической азидокислоты для получения азидомодифицированных наночастиц, далее получают алкиносодержащий нуклеозидтрифосфат путем предварительной активации нуклеозидтрифосфата смесью трифенилфосфин/дитиодипиридин с последующим инкубированием образующегося активного производного с 3-пропинилоксипропиламином, затем к 1-10 мг полученных азидомодифицированных наночастиц добавляют 0.09-0.9 мл 10 мМ раствора алкиносодержащего нуклеозидтрифосфата и стандартные дополнительные реагенты, необходимые для проведения данной реакции, включающие 0.1-1 мл воды, 0.01-0.1 мл 50 мМ раствора сульфата меди в воде, 0.01-0.1 мл 1 М ацетата триэтиламмония, рН 7 и 0.01-0.1 мл 0.1 М аскорбата натрия, смесь перемешивают в течение 2-4 ч с последующим отделением целевого продукта.
2. Способ по п.1, отличающийся тем, что в качестве N-гидроксисукцинимидного эфира алифатической азидокислоты используют N-гидроксисукцинимидный эфир азидогексановой кислоты в количестве 3.8 мг или N-гидроксисукцинимидный эфир азидоундекановой кислоты в количестве 3.25 мг.
3. Способ по п.1, отличающийся тем, что все реакции с участием SiO2-наночастиц проводят при перемешивании и продукты выделяют центрифугированием.
| THULANI H | |||
| SENANAYAKE «Novel anticancer polymeric conjugates of activated nucleoside analogs» Bioconjug Chem | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| ЛЕВИНА А.С | |||
| «Нанобиокомпозиты на основе наночастиц диоксида кремния, содержащие нуклеозид трифосфаты» Тезисы II Международной научно-практической конференции | |||
Авторы
Даты
2014-09-10—Публикация
2013-03-26—Подача