ОБЛАСТЬ ТЕХНИКИ
Настоящая заявка относится к системе ингаляции сухих порошков, содержащей ингаляторы сухого порошка, картриджи и фармацевтические композиции для доставки лекарства в дыхательные пути и малый круг кровообращения для лечения заболевания или расстройства.
УРОВЕНЬ ТЕХНИКИ
Системы доставки лекарств для лечения заболеваний, которые вводят активные ингредиенты в систему кровообращения, многочисленны и содержат системы для перорального, трансдермального, ингаляционного, подкожного и внутривенного введения. Ингаляционно доставляемые лекарства, обычно, доставляют с использованием избыточного давления относительно атмосферного давления, в воздухе с газами-вытеснителями. Данные системы доставки лекарств доставляют лекарства в форме распыленных или испаренных аэрозолей. В последнее время, доставку лекарств в легочную ткань стали обеспечивать ингаляторами сухих порошков. Ингаляторы сухих порошков могут приводиться в действие вдохом или энергией дыхания и могут доставлять лекарства посредством превращения частиц лекарств в носителе в респирабельный сухой порошок, который вовлекается в воздушный поток и вдыхается пациентом. Лекарства, доставляемые с использованием ингалятора сухого порошка, более не ограничены лечением только заболевания легких, но могут также всасываться в большой круг кровообращения и, поэтому, могут применяться для лечения многих заболеваний, в том числе, но без ограничения, диабета и ожирения.
Ингаляторы сухих порошков, применяемые для доставки лекарственных средств в легкие, содержат систему доз порошкового препарата, обычно, либо в виде нерасфасованного лекарственного средства, либо в виде разделенных по количеству на индивидуальные дозы, вложенные в ячейки с унифицированными дозами, типа капсул из жесткого желатина или блистерных упаковок. Контейнеры с нерасфасованным лекарственным средством снабжены дозирующей системой, приводимой в действие пациентом, для выделения одной дозы из порошка непосредственно перед ингаляцией. Для воспроизводимости дозировки требуется, чтобы препарат был однородным, и чтобы дозу можно было доставлять пациенту с единообразными и воспроизводимыми результатами. Поэтому, теоретически, система дозировки должна производить полный выпуск всего препарата, фактически, во время ингаляционной манипуляции, когда пациент принимает свою дозу. Однако, полный выпуск обычно не требуется, если можно обеспечить воспроизводимое дозирование. Реологические свойства порошкового препарата и долговременная физическая и механическая стабильность в связи с этим более критичны для контейнеров с нерасфасованным лекарственным средством, чем для одиночных ячеек с унифицированными дозами. Надежную влагозащиту можно проще обеспечить для ячеек с унифицированными дозами, например, блистеров. Однако, материалы, применяемые для изготовления блистеров, пропускают воздух в ячейку с лекарством, и, следовательно, препараты могут терять жизнеспособность при длительном хранении. Кроме того, ингаляторы сухих порошков, которые используют блистеры для ингаляционной доставки лекарственного средства, могут допускать доставку непостоянных доз в легкие вследствие изменчивости архитектуры воздушных каналов, являющейся следствием прокалывания пленок или отрыва пленок блистеров.
Ингаляторы сухих порошков, известные в данной области техники, могут формировать частицы лекарств или подходящие ингаляционные струи во время ингаляционной манипуляции посредством деагломерации порошкового препарата внутри картриджа или капсулы. Количество респирабельного порошка, испускаемого из мундштука ингалятора во время ингаляции, во многом, зависит, например, от сил взаимодействия между макрочастицами в порошковом препарате и эффективности разделения ингалятором упомянутых частиц до состояния, в котором они пригодны для ингаляции. Доставка лекарств через малый круг кровообращения обеспечивает многочисленные преимущества, которые могут содержать быстрое попадание в артериальное кровообращение, исключение распада лекарств вследствие обменных процессов в печени, удобство применения, т.е. отсутствие дискомфорта введения другими путями введения.
Серийные образцы ингаляторов сухих порошков, разработанные для легочного введения, до сих пор пользовались ограниченным признанием из-за недостаточной полезности и/или стоимости производства. Некоторые из заметных постоянных проблем с известными ингаляторами содержат недостаточную конструктивную прочность устройства, непостоянство дозировки, неудобство оборудования, неудовлетворительную деагломерацию, проблемы с доставкой ввиду отказа от применения газов-вытеснителей и/или несоответствия пациенту. Поэтому, авторы настоящего изобретения обнаружили необходимость разработки и изготовления ингалятора со стабильными характеристиками доставки порошка, удобного для использования без дискомфорта и с отдельными конфигурациями ингалятора, которые обеспечивают более точное соответствие пациенту,
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящей заявке приведены описания, в основном, систем ингаляции сухих порошков для легочной доставки, при этом, системы содержат ингаляторы сухих порошков и контейнеры, содержащие картриджи для ингаляторов сухих порошков, для быстрой и эффективной доставки сухих порошковых препаратов в дыхательные пути. Сухие порошковые препараты систем ингаляции содержат активные средства для лечения, по меньшей мере, одного заболевания, в том числе, локальных или системных заболеваний или расстройств, в том числе, но без ограничения, диабет, ожирение, боли, головные боли, например, мигрени, расстройства центральной или периферической нервной системы, иммунные расстройства и т.п., а также для доставки препарата вакцины. Ингаляторы сухих порошков могут быть приводимыми в действие энергией дыхания, компактными, многократно используемыми или одноразовыми системами, которые могут иметь различные формы и размеры и содержать систему путей воздушных каналов для эффективной и быстрой доставки сухих порошковых лекарственных средств. В одном варианте осуществления, ингалятор может быть, многократно используемым или одноразовым ингалятором унифицированной дозы, который можно применять с картриджем или без него. Под применением без картриджа авторы настоящего изобретения подразумевают системы, в которых обеспечены подобные картриджам конструкции, которые выполнены неразъемно с ингалятором, и ингалятор предназначен для однократного использования и является одноразовым. В качестве альтернативы, в некоторых вариантах осуществления, системы содержат картридж, который обеспечивают отдельно и устанавливают в ингалятор для использования, например, пользователем. В данном варианте осуществления, ингалятор может быть многократно используемым ингалятором, и новый картридж устанавливают в ингалятор при каждом использовании. В другом варианте осуществления, ингалятор может быть многодозовым ингалятором, одноразовым или многократно используемым, который можно применять с картриджами с одной унифицированной дозой, устанавливаемыми в ингалятор, или подобными картриджам конструкциями, встроенными в ингалятор или конструктивно сформированными в виде части ингалятора.
В дополнительных вариантах осуществления, система ингаляции сухих порошков содержит устройство для ингаляции или ингалятор сухого порошка с картриджем или без него и фармацевтический препарат, содержащий активный ингредиент для легочной доставки. В некоторых вариантах осуществления, доставка порошка осуществляется глубоко в легкие, в том числе, в область альвеол, и, в некоторых данных вариантах осуществления, активные средства всасываются в малый круг кровообращения для системной доставки. Система может также содержать ингалятор сухого порошка с картриджем унифицированной дозы или без него и препарат, доставляющий лекарство, содержащий, например, дикетопиперазин и активный ингредиент, например, так называемые, малые молекулы, пептиды, полипептиды и белки, в том числе, инсулин и глюкагоноподобный пептид-1.
В одном варианте осуществления, ингалятор сухого порошка содержит корпус, подвижный элемент и мундштук, при этом, подвижный элемент сформирован с рабочей возможностью перемещения контейнера из положения удерживания порошка в положение дозирования. В данном и других вариантах осуществления, подвижный элемент может быть ползуном, кассетой или подвижным держателем, который можно перемещать различными механизмами.
В другом варианте осуществления, ингалятор сухого порошка содержит корпус и мундштук, конструктивно сформированные с возможностью обеспечения открытого положения и закрытого положения, и механизм, сформированный с рабочей возможностью вмещения, удерживания и реконфигурации картриджа из положения удерживания в положение распыления, дозирования или доставки дозы, при перемещении ингалятора из открытого положения в закрытое положение. В модификациях данного варианта осуществления, механизм может также реконфигурировать картридж, установленный в ингалятор, из положения дозирования в промежуточное положение после использования, когда ингалятор открыт для извлечения использованного картриджа, с указанием, тем самым, пользователю, что картридж израсходован. В одном варианте осуществления, механизм может реконфигурировать картридж в конфигурацию для ликвидации или удаления в отходы после использования. В данных вариантах осуществления, корпус конструктивно сформирован с возможностью подвижного присоединения к мундштуку различными механизмами, в том числе, шарниром. Механизм, сформированный с возможностью вмещения и реконфигурации картриджа, установленного в держатель, из положения удерживания в положение дозирования, может быть выполнен с возможностью ручного или автоматического приведения в действие, при перемещении компонентов ингалятора, например, закрыванием устройства из открытой конфигурации. В одном варианте осуществления, механизм для реконфигурации картриджа содержит кассету или ползун, закрепленную к мундштуку и закрепленную с возможностью перемещения к корпусу. В другом варианте осуществления, механизм установлен в ингалятор или приспособлен для ингалятора и содержит зубчатый механизм, неразъемно установленный в, например, шарнир устройства ингалятора. В еще одном варианте осуществления, механизм, сформированный с рабочей возможностью вмещения и реконфигурации картриджа из положения удерживания в положение дозирования, содержит кулачок, который может реконфигурировать картридж при повороте, например, корпуса или мундштука.
В альтернативном варианте осуществления, ингалятор сухого порошка может быть выполнен в виде однократно используемого одноразового ингалятора унифицируемой дозы, который может быть снабжен контейнером, сформированным с возможностью вмещения порошкового лекарственного средства, и контейнер является перемещаемым пользователем из конфигурации удерживания в конфигурацию дозирования, при этом, ингалятор может иметь первую и вторую конфигурации, из которых первая конфигурация является конфигурацией удерживания, и вторая конфигурация является конфигурацией дозирования или распыления. В данном варианте осуществления, ингалятор может быть снабжен или не снабжен механизмом для реконфигурации контейнера с порошком. В соответствии с аспектами последнего упомянутого варианта осуществления, контейнер допускает реконфигурацию непосредственно пользователем. В соответствии с некоторыми аспектами данного варианта осуществления, ингалятор и контейнер могут быть изготовлены в виде двухкомпонентной сборной системы ингаляции, в которой порошковое лекарственное средство закладывают в контейнер перед сборкой устройства в конфигурации удерживания. В данном варианте осуществления, контейнер является закрепляемым к остову ингалятора и перемещаемым из конфигурации удерживания в конфигурацию дозирования, например, сдвигом относительно верхнего участка ингалятора, содержащего мундштук.
В еще одном варианте осуществления, ингалятор содержит установочное место для контейнера, сформированное с возможностью вмещения контейнера, и мундштук, содержащий, по меньшей мере, два впускных отверстия и, по меньшей мере, одно выходное отверстие; при этом, одно впускное отверстие из, по меньшей мере, двух впускных отверстий сообщается по текучей среде с местом для контейнера, и одно из, по меньшей мере, двух впускных отверстий сообщается по текучей среде с, по меньшей мере, одним выходным отверстием по пути движения потока, сформированному с возможностью обхода места для контейнера.
В одном варианте осуществления, ингалятор имеет противоположные концы, например, проксимальный конец для контакта с губами или ртом пользователя и дистальный конец, и содержит мундштук и контейнер с лекарственным средством; при этом, мундштук имеет верхнюю поверхность и подошвенную или нижнюю поверхность. Нижняя поверхность мундштука имеет первый участок, сформированный относительно плоским для поддерживания контейнера в герметичной конфигурации или конфигурации удерживания, и второй участок, прилегающий к первому участку, который приподнят относительно первого участка. В данном варианте осуществления, контейнер является перемещаемым из конфигурации удерживания в конфигурацию дозирования и наоборот, и, в конфигурации дозирования, второй приподнятый участок нижней поверхности мундштука и контейнера формируют или ограничивают путь воздуховпускного отверстия, чтобы допускать поступление атмосферного воздуха во внутренний объем контейнера или открывать внутреннее пространство контейнера для атмосферного воздуха. В одном варианте осуществления, мундштук может содержать множество отверстий, например, впускное отверстие, выпускное отверстие и, по меньшей мере, одно отверстие для сообщения с контейнером с лекарственным средством в положении распыления или дозирования и может быть сформирован с возможностью содержания неразъемно закрепленных панелей, продолжающихся со сторон нижней поверхности ингалятора и содержащими фланцы, выступающие к центру мундштука ингалятора, которые служат направляющими и опорой для контейнера на мундштуке таким образом, что контейнер может перемещаться по направляющим из положения удерживания в положение распыления или дозирования и обратно в положение удерживания, при необходимости. В одном варианте осуществления, контейнер с лекарственным средством сформирован с полочными выступами или крылышками, продолжающимися от его верхнего края для совмещения с фланцами на панелях мундштука. В одном варианте осуществления, контейнер с лекарственным средством может быть перемещаемым вручную пользователем из положения удерживания в положение дозирования и, после дозирования, обратно в положение удерживания или посредством ползуна, кассеты, или подвижного держателя.
В другом варианте осуществления, однократно используемый одноразовый ингалятор унифицируемой дозы может быть конструктивно изготовлен с возможностью содержания ползуна, встроенного в мундштук и сформированного для работы с мундштуком. В данном варианте осуществления, перегородка на ползуне может примыкать или опираться к/на участку(ок) контейнера с лекарственным средством, чтобы перемещать контейнер по направляющим панелей мундштука из положения удерживания в положение распыления или дозирования. В данном варианте осуществления, ползуном можно манипулировать вручную для перемещения контейнера по направляющим мундштука.
В одном варианте осуществления, ингалятор сухого порошка содержит, по меньшей мере, одно воздуховпускное отверстие и, по меньшей мере, одно воздуховыпускное отверстие. Когда ингалятор закрыт, по меньшей мере, одно воздуховпускное отверстие может допускать поступление потока в ингалятор и, по меньшей мере, одно воздуховпускное отверстие позволяет потоку поступать в камеру картриджа или внутреннее пространство картриджа или контейнера, приготовленного для ингаляции. В одном варианте осуществления, ингалятор содержит отверстие, конструктивно сформированное с возможностью сообщения с местом размещения картриджа и с впускным отверстием картриджа, когда контейнер картриджа находится в положении дозирования. Поток, поступающий во внутреннее пространство картриджа, может выходить из картриджа через выходное(ые) или распыляющее(ие) отверстие или отверстия; или поток, поступающий в контейнер ингалятора, может выходить через, по меньшей мере, одно из распыляющих отверстий. В данном варианте осуществления, впускное(ые) отверстие или отверстия картриджа конструктивно сформировано(ы) таким образом, что воздушный поток, поступающий во внутреннее пространство картриджа, полностью или частично направляется в выходное(ые) или распыляющее(ие) отверстие или отверстия.
Контейнер с лекарственным средством конструктивно сформирован с возможностью обеспечения двух противоположных, сравнительно криволинейных сторон, которые могут направлять воздушный поток. В данном варианте осуществления, поток, поступающий в воздуховпускное отверстие во время ингаляции, может циркулировать во внутреннем пространстве контейнера вокруг оси, относительно перпендикулярной к оси распыляющих отверстий, и, тем самым, поток может поднимать, приводить в беспорядочное движение и эффективно псевдоожижать порошковое лекарственное средство, содержащееся в картридже. В данном и других вариантах осуществления, псевдоожиженный порошок в воздушном канале может быть дополнительно деагломерирован на более мелкодисперсные частицы порошка посредством изменения направления или скорости, т.е. ускорения или замедления частиц на пути движения потока. В некоторых вариантах осуществления, изменение ускорения или замедления можно обеспечить изменением угла и геометрии, например, распыляющего(их) отверстия или отверстий, канала мундштука и/или мест из сопряжения. В ингаляторах, представленных в настоящей заявке, механизм псевдоожижения и ускорения частиц по мере их прохода через ингалятор представлен способами, посредством которых осуществляется деагломерация и доставка сухого порошкового препарата.
В отдельных вариантах осуществления, способ деагломерации и распыления сухого порошкового препарата содержит, по меньшей мере, один такой этап, как приведение в беспорядочное движение в основной области контейнера, начинаемое и усиливаемое потоком, поступающим в контейнер; быстрое ускорение порошка в потоке через распыляющие отверстия, выходящие из контейнера; дополнительное ускорение порошка, вызываемое изменением направления или скорости, когда порошок выходит из распыляющего отверстия; расщепление частиц порошка, захваченных в градиент потока, при этом, поток сверху частицы быстрее, чем поток снизу частицы; замедление потока вследствие расширения площади поперечного сечения в воздушном канале мундштука; расширение воздуха, захваченного внутри частицы, вследствие перемещения частицы из области более высокого давления в область сниженного давления или столкновений между частицами и стенками воздушного канала в любой точке на путях движения потока.
В другом варианте осуществления, ингалятор сухого порошка содержит мундштук; ползун, кассету или подвижный держатель; корпус, шарнир и зубчатый механизм, сформированный с возможностью осуществления перемещения ползуна или кассеты; при этом, мундштук и корпус соединены с возможностью перемещения на шарнире.
Подвижные держатели для применения с ингалятором сухого порошка могут быть изготовлены с возможностью содержания любого сухого порошкового лекарственного средства для ингаляции. В одном варианте осуществления, картридж конструктивно сформирован с возможностью адаптации к конкретному ингалятору сухого порошка и может быть выполнен с любыми размерами и в любой форме, в зависимости от размера и формы ингалятора, с которым планируется применение, например, если ингалятор содержит механизм, который обеспечивает возможность поступательного перемещения или вращательного перемещения. В одном варианте осуществления, картридж может быть сформирован с крепежным механизмом, например, имеющим скошенную кромку на верхней части картриджа, соответствующую ответной скошенной кромке в ингаляторе, чтобы картридж был закреплен во время использования. В одном варианте осуществления, картридж содержит контейнер и крышку или покрывающую деталь, при этом, контейнер может быть выполнен согласующимся с поверхностью крышки и может быть подвижным относительно крышки, или крышка может быть подвижной на контейнере и может приобретать различные конфигурации, зависящие от его положения, например, конфигурацию удерживания, конфигурацию дозирования, или использованную конфигурацию. В альтернативном варианте, крышка может быть съемной.
Примерный вариант осуществления может содержать камеру для вмещения лекарственного средства, сформированную с, по меньшей мере, одним впускным отверстием для пропускания потока в камеру; по меньшей мере, одним распыляющим отверстием для обеспечения выхода потока из камеры; при этом, впускное отверстие сформировано с возможностью направления, по меньшей мере, части потока к распыляющему отверстию или на частицы, достигающие распыляющего отверстия в камере под действием градиента давления. Распыляющее(ие) отверстие или отверстия и газоприемное отверстие, каждое по отдельности, могут иметь, например, продолговатую, прямоугольную, круглую, треугольную, квадратную и овальную форму и могут находиться в непосредственной близости одно от другого. Во время ингаляции, картридж, подходящий для ингалятора, в положении дозирования позволяет воздушному потоку поступать в камеру и перемешиваться с порошком для псевдоожижения лекарственного средства. Псевдоожиженное лекарственное средство движется внутри камеры таким образом, лекарственное средство постепенно выходит из камеры через распыляющее отверстие, при этом, псевдоожиженное лекарственное средство, выходящее из распыляющего отверстия, расщепляется за счет боковых сдвигов и разбавляется вспомогательным потоком, исходящим не изнутри камеры. В одном варианте осуществления, поток воздуха во внутреннем объеме циркулярно вращается так, чтобы поднимать порошковое лекарственное средство в контейнере или камере и вызывать рециркуляцию увлекаемых частиц порошка или порошковую массу во внутреннем объеме контейнера и, тем самым, вызывать беспорядочное движение потока перед выходом частиц из распыляющих отверстий контейнера или, по меньшей мере, одного из выпускных отверстий или воздуховыпускных или распыляющих отверстий ингалятора, и, при этом, рециркулирующий поток может создавать беспорядочный или невихревой поток воздуха во внутреннем объеме и, тем самым, выполняет деагломерацию лекарственного средства. В одном варианте осуществления, ось вращения, в основном, перпендикулярна направлению силы тяжести. В другом варианте осуществления, ось вращения, в основном, параллельна направлению силы тяжести. Вспомогательный поток, исходящий не изнутри камеры, выполняет дополнительную деагломерацию лекарственного средства. В данном варианте осуществления, дифференциальное давление создается вдохом пользователя. Картридж для ингалятора сухого порошка, содержащий: камеру, сформированную для вмещения лекарственного средства; по меньшей мере, одно впускное отверстие для пропускания потока в камеру и, по меньшей мере, одно распыляющее отверстие для обеспечения выхода потока из камеры; при этом, по меньшей мере, одно впускное отверстие сформировано с возможностью направления, по меньшей мере, части потока, поступающего через, по меньшей мере, одно впускное отверстие, к, по меньшей мере, одному распыляющему отверстию в камере под действием дифференциального давления.
Картридж с унифицированной дозой для ингалятора, содержащий: по существу, плоскую верхнюю часть картриджа, имеющую стреловидную конфигурацию, содержащую, по меньшей мере, одно впускное отверстие, по меньшей мере, одно распыляющее отверстие и две боковые панели, продолжающиеся вниз, при этом, каждая из двух панелей содержит направляющую; и контейнер, входящий в зацепление, с возможностью перемещения, с направляющими боковых панелей верхней части картриджа и содержащий камеру, выполненную по сравнительно чашеобразной форме с двумя сравнительно плоскими и параллельными сторонами и сравнительно скругленным дном, и внутренней поверхностью, ограничивающей внутренний объем; причем, контейнер допускает изменение конфигурации для установки в положение удерживания и положение дозирования относительно верхней части картриджа; причем, во время использования с ингалятором в процессе ингаляции, поток, поступающий во внутренний объем, расходится, когда входит во внутренний объем, на часть потока, выходящую через, по меньшей мере, одно распыляющее отверстие, и часть потока, вращающуюся внутри внутреннего объема и поднимающую порошок во внутреннем объеме перед выходом через распыляющие отверстия.
В одном варианте осуществления предлагается система ингаляции для легочной доставки лекарств, при этом, упомянутая система содержит: ингалятор сухого порошка, содержащий корпус и мундштук, содержащий впускное и выпускное отверстия, воздушный канал между впускным и выпускным отверстиями и отверстие, конструктивно сформированное с возможностью вмещения картриджа; механизм установки картриджа, например, ползун; картридж, сформированный с возможностью согласования с ингалятором сухого порошка и содержащий сухое порошковое лекарственное средство для ингаляции; причем, картридж содержит контейнер и крышку, содержащую, по меньшей мере, одно впускное отверстие или, по меньшей мере, одно дозирующее отверстие; причем, система ингаляции сухих порошков, во время использования, характеризуется предварительно заданным распределением баланса воздушного потока через картридж в отношении к общему потоку, доставляемому в пациента.
В вариантах осуществления, представленных в настоящей заявке, система ингалятора сухого порошка содержит предварительно заданное распределение баланса массовых потоков в ингаляторе. Например, балансовый поток приблизительно 20%-70% от суммарного потока, выходящего из ингалятора в пациента, доставляется распыляющими отверстиями или пропускается через картридж, а приблизительно 30%-80% формируются другими каналами ингалятора. Кроме того, обходной поток или поток, не входящий и не выходящий из картриджа, может снова объединяться с потоком, выходящим из распыляющего отверстия картриджа, внутри ингалятора для разбавления, ускорения и, в конечном итоге, деагломерации псевдоожиженного порошка перед выходом из мундштука.
В вариантах осуществления, представленных в настоящей заявке, предлагается ингалятор сухого порошка со сравнительно жесткими воздушными каналами или системой трубопроводов и высокими уровнями сопротивления потоку, чтобы обеспечивать максимальную деагломерацию порошкового лекарственного средства и облегчать его доставку. Системы ингаляции, представленные в настоящей заявке, содержат каналы, которые оказывают сопротивление потоку во время использования и, тем самым, сохраняют небольшие объемные скорости потока, которые сводят к минимуму высокие инерционные силы, действующие на частицы порошка, выпускаемые из ингалятора, что предотвращает осаждение в горле или задержку частиц порошка в верхних дыхательных путях и, тем самым, максимально увеличивает осаждение частиц порошка в легких. Соответственно, настоящие системы ингаляции обеспечивают эффективный и стабильный выпуск порошкового лекарственного средства из ингаляторов после многократного использования, так как ингаляторы снабжены воздушными каналами с геометрическими формами, которые остаются постоянными и не могут изменяться. В некоторых вариантах осуществления, сухое порошковое лекарственное средство стабильно дозируется из ингалятора за менее чем приблизительно 3 секунды, или, как правило, менее чем одну секунду. В некоторых вариантах осуществления, система ингалятора может иметь высокое значение сопротивления от приблизительно 0,065 до приблизительно 0,200 (√кПа)/литр в минуту. Поэтому, в системах ингаляции максимальные перепады давления при ингаляции 2-20 кПа создают, в результате, максимальные объемные скорости потока, приблизительно 7-70 литров в минуту. Приведенные объемные скорости потока обеспечивают, в результате, дозирование более чем 75% содержимого картриджа при массовом наполнении 1-30 мг порошка или более. В некоторых вариантах осуществления, приведенные рабочие характеристики достигаются конечными пользователями за одну ингаляционную манипуляцию, с обеспечением процентного дозирования картриджа выше чем 90%. В некоторых вариантах осуществления, система ингалятора и картриджа сконфигурирована с возможностью обеспечения одной дозы посредством выпуска порошка из ингалятора в виде непрерывного потока порошка, доставляемого в пациента.
В одном варианте осуществления предлагается способ эффективной деагломерации сухого порошкового препарата в ингаляторе сухого порошка во время ингаляции. Способ может содержать этапы обеспечения ингалятора сухого порошка, содержащего контейнер, содержащий воздуховпускное отверстие, распыляющие отверстия, сообщающиеся с воздушным каналом мундштука, и содержащий препарат для пациента, нуждающегося в препарате; создания воздушного потока в ингаляторе при вдохе пациента таким образом, что от приблизительно 20% до приблизительно 70% воздушного потока, поступающего в ингалятор, поступает в контейнер и выходит из него; предоставления воздушному потоку возможности входа во впускное отверстие контейнера, циркуляции и приведения в беспорядочное движение препарата по оси, перпендикулярной распыляющим отверстиям, чтобы псевдоожижать препарат для получения псевдоожиженного препарата; ускорения дозированных количеств псевдоожиженного препарата через распыляющие отверстия и в воздушном канале, и замедления воздушного потока, содержащего псевдоожиженный препарат в воздушном канале мундштука ингалятора перед достижением пациента. В некоторых конкретных вариантах осуществления, во время доставки дозы, через картридж проходит 20%-60% от суммарного потока через ингалятор.
В другом варианте осуществления предлагается способ деагломерации и дозирования сухого порошкового препарата для ингаляции, при этом, упомянутый способ содержит следующие этапы: создают воздушный поток в ингаляторе сухого порошка, содержащем мундштук и контейнер, содержащий, по меньшей мере, одно впускное отверстие и, по меньшей мере, одно распыляющее отверстие, и содержащий сухой порошковый препарат; причем, контейнер формирует воздушный проход между, по меньшей мере, одним впускным отверстием и, по меньшей мере, одним распыляющим отверстием, и впускное отверстие направляет часть воздушного потока, поступающего в контейнер, к, по меньшей мере, одному распыляющему отверстию; предоставляют воздушному потоку возможность приводить в беспорядочное движение порошок внутри контейнера по оси, по существу, перпендикулярной, по меньшей мере, одному распыляющему отверстию, чтобы поднимать и перемешивать сухое порошковое лекарственное средство в контейнере для формирования смеси лекарственного средства в воздушном потоке; и ускоряют воздушный поток, выходящий из контейнера через, по меньшей мере, одно распыляющее отверстие. В одном варианте осуществления, мундштук ингалятора сформирован с возможностью обеспечения постепенно расширяющегося поперечного сечения для замедления потока и сведения к минимуму осаждения порошка внутри ингалятора, и достижения максимальной доставки порошка пациенту. В одном варианте осуществления, например, площадь поперечного сечения области ингалятора для захвата ртом может составлять от приблизительно 0,05 см2 до приблизительно 0,25 см2 на приблизительной длине около 3 см. Приведенные размеры зависят от типа порошка, используемого с ингалятором и размеров самого ингалятора.
В одном варианте осуществления предлагается картридж для ингалятора сухого порошка, содержащий: верхнюю часть картриджа и контейнер, ограничивающие внутренний объем; при этом, верхняя часть картриджа имеет нижнюю поверхность, которая продолжается над контейнером; нижняя поверхность сформирована с возможностью зацепления с контейнером и содержит участок для ограничения внутреннего объема и участок для открывания внутреннего объема в атмосферный воздух.
В альтернативном варианте осуществления предлагается способ доставки частиц посредством устройства для доставки сухого порошка, при этом способ содержит следующие этапы: вставляют в устройство для доставки картридж для удерживания и дозирования частиц, содержащий камеру, вмещающую частицы, распыляющее отверстие и газоприемное отверстие; причем, камера, распыляющее отверстие и газоприемное отверстие ориентированы таким образом, что, когда всасываемый газ поступает в газоприемное отверстие, частицы деагломерируются в, по меньшей мере, одном вышеописанном режиме деагломерации для разделения частиц, и частицы, вместе с частью всасываемого газа, дозируются через распыляющее отверстие; одновременно принудительно втягивают газ через канал доставки, сообщающийся с распыляющим отверстием, и, тем самым, вынуждают всасываемый газ поступать в газоприемное отверстие, деагломерировать частицы и дозировать частицы вместе частью всасываемого газа через распыляющее отверстие; и доставляют частицы через канал доставки устройства, например, в мундштуке ингалятора. В варианте осуществления, представленном в настоящей заявке, для осуществления деагломерации порошка, ингалятор сухого порошка может быть конструктивно сформирован и снабжен, по меньшей мере, одной зоной деагломерации порошка, при этом, зоны деагломерации во время ингаляционной манипуляции могут способствовать приведению в беспорядочное движение порошка воздушным потоком, поступающим в ингалятором, ускорению воздушным потоком, содержащим порошок, замедлению потока, содержащего порошок, расщеплению частиц порошка, расширению воздуха, захваченного в частицы порошка и/или их комбинациям.
В другом варианте осуществления, система ингаляции содержит ингалятор сухого порошка, приводимый в действие энергией дыхания, картридж, вмещающий лекарственное средство, при этом, лекарственное средство может содержать, например, лекарственный препарат для легочной доставки, например, композицию, содержащую дикетопиперазин и активное средство. В некоторых вариантах осуществления активное средство содержит белки и пептиды, например, инсулин, глюкагоноподобный пептид-1, оксинтомодулин, пептид YY, экзендин, паратироидный гормон, их аналоги, малые молекулы, вакцины и т.п. Систему ингаляции можно использовать, например, в способах лечения состояний, требующих локализованной или системной доставки лекарственного средства, например, в способах лечения диабета, преддиабетных состояний, инфекции дыхательных путей, остеопороза, легочного заболевания, болей, в том числе, головных болей, в том числе, мигрени, ожирения, расстройства и заболевания центральной или периферической нервной системы и профилактического применения, например, вакцинации. В одном варианте осуществления, система ингаляции содержит набор, содержащий, по меньшей мере, один из каждого из компонентов системы ингаляции для лечения заболевания или расстройства.
В одном варианте осуществления предлагается способ эффективной доставки препарата в кровоток пациента, содержащий систему ингаляции, содержащую ингалятор, содержащий картридж, вмещающий препарат, содержащий дикетопиперазин, при этом, система ингаляции доставляет струю порошка, содержащую микрочастицы дикетопиперазина, имеющую объемный медианный геометрический диаметр (VMGD) в диапазоне от приблизительно 2,5 мкм до 10 мкм. В примерном варианте осуществления, значение VMGD микрочастиц может изменяться в диапазоне от приблизительно 2 мкм до 8 мкм. В примерном варианте осуществления, значение VMGD частиц порошка может быть в диапазоне от 4 мкм до приблизительно 7 мкм во время одной ингаляции препарата с массовым наполнением в диапазоне 3,5 мг-10 мг порошка. В данном и других вариантах осуществления, система ингаляции доставляет более чем 90% сухого порошкового препарата из картриджа.
В другом варианте осуществления предлагается ингалятор сухого порошка, содержащий: a) мундштук, сформированный с возможностью доставки сухого порошка в пациента методом пероральной ингаляции; b) корпус контейнера, и c) жесткие воздушные каналы, продолжающиеся между корпусом контейнера и мундштуком и сформированные с возможностью сообщения с атмосферным воздухом; при этом, ингалятор сухого порошка сконфигурирован с возможностью испускания более чем 75% сухого порошка в виде частиц порошка из контейнера, ориентированного в корпусе контейнера за одну ингаляцию, и испускаемые частицы порошка имеют объемный медианный геометрический диаметр (VMGD) меньше чем приблизительно 5 микрометров, когда пользователь вдыхает через мундштук с созданием максимального давления при вдохе приблизительно 2 кПа в течение двух секунд и площади под кривой (AUC) в течение 1 секунды для кривой зависимости давления от времени, по меньшей мере, приблизительно 1,0, 1,1 или 1,2 кПа×сек. В другом варианте осуществления, значение AUC в течение 1 секунды для кривой зависимости давления от времени составляет от приблизительно 1,0 и приблизительно 15 кПа×сек.
В некоторый вариантах осуществления предлагается способ доставки дозы сухого порошкового лекарственного средства с использованием ингалятора сухого порошка с высоким сопротивлением, при этом, упомянутый способ содержит этапы обеспечения ингалятора сухого порошка с высоким сопротивлением, содержащего дозу сухого порошкового лекарственного средства и ингаляции из ингалятора с усилием (или напряжением), достаточным для достижения максимального давления при вдохе, по меньшей мере, 2 кПа в течение 2 секунд; и создания площади под кривой в течение первой секунды (AUC0-1sec) для кривой зависимости давления от времени, по меньшей мере, приблизительно 1,0, 1,1 или 1,2 кПа×секунду; при этом, более чем 75% дозы сухого порошка выпускается или выбрасывается из ингалятора в виде частиц порошка. В некоторых вариантах осуществления, значение VMGD испускаемых частиц меньше чем приблизительно 5 микрометров.
В другом варианте осуществления, способ доставки достаточно деагломерированной дозы сухого порошкового лекарственного средства с использованием ингалятора сухого порошка с высоким сопротивлением содержит этапы обеспечения ингалятора сухого порошка с высоким сопротивлением, содержащего дозу сухого порошкового лекарственного средства; ингаляции из ингалятора с усилием, достаточным для достижения максимального давления при вдохе, по меньшей мере, 2 кПа в течение 2 секунд; и создания площади под кривой в течение первой секунды (AUC0-1sec) для кривой зависимости давления от времени, по меньшей мере, приблизительно 1,0, 1,1 или 1,2 кПа×секунду; при этом, значение VMGD (×50) испускаемого порошка меньше чем приблизительно 5 мкм. В альтернативном варианте осуществления, сухой порошок состоит из микрочастиц с медианным размером частиц, и значение VMGD (×50) испускаемых частиц не более 1,33-кратного медианного размера частиц, когда ингалятор используют оптимальным способом, например, при давлении приблизительно 6 кПа.
В другом варианте осуществления предлагается применение ингалятора сухого порошка с высоким сопротивлением для доставки сухого порошка, при этом, ингалятор сухого порошка имеет значение сопротивления воздушному потоку от приблизительно 0,065 (√кПа)/литр в минуту до приблизительно 0,200 (√кПа)/литр в минуту и содержит дозу сухого порошка, причем, прилагают достаточное усилие для достижения максимального давления при вдохе, по меньшей мере, 2 кПа в течение 2 секунд; и, причем, создают площадь под кривой в первую секунду (AUC0-1sec) для кривой зависимости давления при вдохе от времени, по меньшей мере, приблизительно 1,0, 1,1 или 1,2 кПа×секунду; и, причем, более чем 75% дозы сухого порошка выпускается или выбрасывается из ингалятора в виде частиц порошка.
В некоторых вариантах осуществления, системы ингаляции, представленные в настоящей заявке, применяют для лечения пациентов, нуждающихся в лечении заболевания или расстройства, упомянутого в настоящей заявке, с использованием описанного лекарственного средства.
В еще одном варианте осуществления предлагается ингалятор сухого порошка с высоким сопротивлением для использования с целью доставки сухого порошкового лекарственного средства в пациента, отличающийся тем, что обеспечивается ингалятор сухого порошка, имеющий значение сопротивления воздушному потоку в диапазоне от приблизительно 0,065 (√кПа)/литр в минуту до приблизительно 0,200 (√кПа)/литр в минуту и содержащий дозу сухого порошкового лекарственного средства, при этом, во время использования, прилагают достаточное усилие для достижения максимального давления при вдохе, по меньшей мере, 2 кПа в течение 2 секунд; и создают площадь под кривой в первую секунду (AUC0-1sec) для кривой зависимости давления при вдохе от времени, по меньшей мере, приблизительно 1,0, 1,1 или 1,2 кПа×секунду; и, причем, более чем 75% дозы сухого порошка выпускается или выбрасывается из ингалятора в виде частиц порошка.
В другом варианте осуществления предлагается система ингаляции, содержащая ингалятор, картридж, вмещающий сухой порошковый препарат для доставки в большой круг кровообращения, содержащий микрочастицы дикетопиперазина; при этом, микрочастицы дикетопиперазина обеспечивают концентрацию (нагрузку) дикетопиперазина в плазме с AUC0-2hr (площадью под кривой в течение первых двух часов) в диапазоне 1,300 нг×мин/мл - 3,200 нг×мин/мл на один мг дикетопиперазина, испускаемого в течение одной ингаляции. В другом примерном варианте осуществления предлагается система ингаляции, содержащая ингалятор, картридж, вмещающий сухой порошковый препарат для доставки в большой круг кровообращения, содержащий микрочастицы дикетопиперазина; при этом, микрочастицы дикетопиперазина обеспечивают концентрацию (нагрузку) дикетопиперазина в плазме с AUC0-∞ (общей площадью под кривой) больше чем 2,300 нг×мин/мл на один мг порошка, испускаемого в течение одной ингаляции. С точки зрения данных вариантов осуществления, соединение DKP (дикетопиперазин) является соединением FDKP (фумарил дикетопиперазин (бис-3,6-(N-фумарил-4-аминобутил)-2,5-дикетопиперазином). В данном и других вариантах осуществления, микрочастицы дикетопиперазина не вызывают ослабления функции легких, оцениваемой по тестам функции легких и измеряемой объемом форсированного выдоха за одну секунду (FEV1). В некоторых вариантах осуществления, измеренная нагрузка плазмы пациента соединением FDKP может быть выше чем 2,500 нг×мин/мл на один мг порошка соединения FDKP, испускаемого в течение одной ингаляции. В альтернативных вариантах осуществления, измеренная нагрузка плазмы в форме AUC соединения FDKP для пациента может быть больше чем 3,000 нг×мин/мл на один мг порошка соединения FDKP, испускаемого в течение одной ингаляции. В еще одном варианте осуществления, измеренная нагрузка плазмы пациента соединением FDKP в форме AUC0-∞ может быть меньше или приблизительно равной 5,500 нг×мин/мл на один мг соединения FDKP, испускаемого в течение одной ингаляции, для сухой порошковой композиции, содержащей соединение FDKP. В некоторых вариантах осуществления, упомянутый уровень нагрузки представляет индивидуальную нагрузку. В альтернативном варианте осуществления, упомянутый уровень нагрузки представляет среднюю нагрузку. В качестве альтернативы, количества активного средства, в том числе, содержания и нагрузки, могут быть выражены в единицах активности или массы.
В данных и других вариантах осуществления, микрочастицы могут дополнительно содержать активный ингредиент. В отдельных вариантах осуществления, активный ингредиент является инсулином. В другом примерном варианте осуществления предлагается система ингаляции, содержащая ингалятор, картридж, вмещающий сухой порошковый препарат для доставки в большой круг кровообращения, содержащий микрочастицы дикетопиперазина, содержащие инсулин; при этом, микрочастицы дикетопиперазина обеспечивают концентрацию (нагрузку) инсулина в плазме с AUC0-2hr больше чем 160 мкЕд.×мин/мл на единицу инсулина в порошковом препарате, испускаемом в течение одной ингаляции. В соответствии с одним аспектом данного варианта осуществления, система ингаляции сформирована с возможностью доставки инсулина и обеспечения в плазме его уровня или нагрузки, при котором(ой) измеренное значение AUC0-2hr для инсулина изменяется в диапазоне от приблизительно 100 до 1,000 мкЕд.×мин/мл на единицу инсулина в порошковом препарате, испускаемом в течение одной ингаляции. В некоторых вариантах осуществления, упомянутый уровень нагрузки представляет индивидуальную нагрузку. В альтернативных вариантах осуществления, упомянутый уровень нагрузки представляет среднюю нагрузку.
В другом примерном варианте осуществления предлагается система ингаляции, содержащая ингалятор, картридж, вмещающий сухой порошковый препарат для доставки в большой круг кровообращения, содержащий микрочастицы дикетопиперазина, содержащие инсулин; при этом, микрочастицы дикетопиперазина обеспечивают концентрацию (нагрузку) инсулина в плазме с AUC0-4hr (площадью под кривой в течение первых 4 часов) больше чем 100 мкЕд.×мин/мл на одну Ед. заложенного инсулина, испускаемого в течение одной ингаляции. В соответствии с аспектом данного варианта осуществления, система ингаляции сформирована с возможностью доставки в пациента препарата инсулина и фумарил дикетопиперазина, который обеспечивает нагрузку плазмы инсулином, характеризуемую измеренным значением AUC0-4hr в диапазоне 100-250 мкЕд.×мин/мл на единицу заложенной дозы инсулина, испускаемой в течение одной ингаляции. В соответствии с аспектами данных вариантов осуществления, значения AUC0-4hr могут быть больше чем 110, 125, 150 или 175 мкЕд.×мин/мл на одну Ед. заложенного инсулина, испускаемого в течение одной ингаляции. В данном и других вариантах осуществления, концентрация инсулина в препарате содержит от приблизительно 10 до приблизительно 20% (по массе) препарата.
В еще одном примерном варианте осуществления предлагается система ингаляции, содержащая ингалятор, картридж, вмещающий сухой порошковый препарат для доставки в большой круг кровообращения, содержащий микрочастицы дикетопиперазина, содержащие инсулин; при этом, микрочастицы дикетопиперазина обеспечивают концентрацию инсулина в плазме с Cmax выше 10 мкЕд./мл на мг порошка, испускаемого в течение одной ингаляции, в течение 30 минут после введения. В соответствии с аспектом настоящего варианта осуществления, введенный инсулиновый препарат создает концентрацию Cmax в диапазоне от приблизительно 10 до 20 мкЕд./мл на мг порошка, испускаемого в течение одной ингаляции, и в течение 30 минут после введения. В соответствии с дополнительными аспектами настоящего варианта осуществления, концентрация Cmax инсулина может быть получена в течение 25, 20 или 15 минут после введения. В разновидностях данного варианта осуществления получения концентрации Cmax, концентрация Cmax, получаемая после пульмональной ингаляции препарата, выше чем 3 мкЕд/мл на одну Ед. инсулина, заложенного в картридж, или в диапазоне 3-6 или 4-6 мкЕд./мл на одну Ед. инсулина в дозе в картридже.
В другом варианте осуществления предлагается система ингаляции, содержащая: ингалятор сухого порошка; и сухой порошковый препарат, содержащий множество частиц порошка дикетопиперазина, при этом, система ингаляция сконфигурирована с возможностью доставки дикетопиперазина в малый круг кровообращения пациента, и в плазме пациента можно измерить дикетопиперазин, создающий среднюю нагрузку или AUC0-∞ больше чем 2,300 нг×мин/мл на мг содержания дикетопиперазина в сухом порошком препарате, введенном в течение одной ингаляции. В одном варианте осуществления, система ингаляции дополнительно содержит картридж, сформированный с возможностью согласования с ингалятором сухого порошка, приводимым в действие энергией дыхания. В данном и других вариантах осуществления, дикетопиперазин в препарате является бис-3,6-(N-фумарил-4-минобутил)-2,5-дикетопиперазином (FDKP).
В вариантах осуществления, в которых в препарате применяют соединение FDKP, система может доставлять соединение FDKP в большой круг кровообращения за Tmax меньше чем 1 час. В некоторых вариантах осуществления, Tmax для соединения FDKP может быть меньше чем 15 или 30 минут после введения соединения FDKP в течение одной ингаляции. В данном и других вариантах осуществления, значение AUC измеряют за время от 0 до 2 часов, от 0 до 4 часов или от 0 до ∞.
В другом варианте осуществления предлагается система ингаляции, содержащая: ингалятор сухого порошка, приводимый в действие энергией дыхания, и сухой порошковой препарат, содержащий множество частиц дикетопиперазина; при этом, система ингаляции сформирована с рабочей возможностью испускания порошковой струи, содержащей микрочастицы дикетопиперазина с объемным медианным геометрическим диаметром в диапазоне 2 мкм - 8 мкм и геометрическим стандартным отклонением менее чем 4 мкм.
В еще одном варианте осуществления предлагается система ингаляции для легочной доставки лекарства, при этом, упомянутая система содержит: ингалятор сухого порошка, приводимый в действие энергией дыхания, и сухой порошковой препарат, содержащий множество частиц дикетопиперазина; при этом, система ингаляции сформирована с рабочей возможностью испускания более чем 90% частиц порошка, которые растворяются и всасываются в кровь за менее чем 30 минут или менее чем 25 минут и создают максимальную концентрацию дикетопиперазина после одной ингаляции сухого порошкового препарата. В некоторых вариантах осуществления, система испускает более чем 95% частиц порошка в течение одной ингаляции, при этом, упомянутые частицы всасываются в систему кровообращения.
В одном варианте осуществления предлагается система, содержащая: ингалятор сухого порошка; и сухой порошковый препарат, содержащий множество частиц сухого порошка, содержащих инсулин; при этом, система ингаляции сформирована с возможностью доставки инсулина в малый круг кровообращения пациента, и инсулин можно измерять в плазме пациента в виде нагрузки со средним значением AUC0-2hr больше чем 160 мкЕд.×мин/мл на Ед. инсулина, испускаемого в сухом порошковом препарате, вводимом в течение одной ингаляции.
В одном варианте осуществления системы ингаляции, сухой порошковый препарат вводят в пациента методом пероральной ингаляции, и препарат содержит частицы порошка инсулина, которые могут доставлять инсулин в большой круг кровообращения пациента, при этом, значение Cmax для инсулина измеряют в течение менее чем 30 минут после введения в пациента в течение одной ингаляции.
В одном варианте осуществления предлагается система ингаляции, содержащая: ингалятор сухого порошка, приводимый в действие энергией дыхания, и порошковый препарат, содержащий множество частиц дикетопиперазина; при этом, система ингаляции сформирована с рабочей возможностью испускания порошковой струи, содержащей микрочастицы дикетопиперазина с объемным медианным геометрическим диаметром в диапазоне 2 мкм - 8 мкм и геометрическим стандартным отклонением менее чем 4 мкм.
В еще одном варианте осуществления предлагается система ингаляции для легочной доставки лекарства, содержащая: ингалятор сухого порошка, приводимый в действие энергией дыхания, и порошковый препарат, содержащий множество частиц дикетопиперазина; при этом, система ингаляции сформирована с рабочей возможностью испускания частиц порошка, которые всасываются в кровь для создания максимальной концентрации лекарства в течение не более чем 30, 25, 20 или 15 минут.
В одном варианте осуществления предлагается ингалятор сухого порошка, содержащий мундштук, сформированный с возможностью доставки сухого порошка в пациента методом пероральной ингаляции, контейнер, сформированный с возможностью вмещения сухого порошка, и воздушные каналы, продолжающиеся между контейнером и мундштуком и сформированные с возможностью сообщения с атмосферным воздухом, при этом, ингалятор сухого порошка сформирован с возможностью испускания более чем 75% сухого порошка в виде частиц порошка в течение одной ингаляции, и испускаемые частицы порошка имеют объемный медианный геометрический диаметр менее чем 5 микрометров, когда пользователь делает ингаляцию через мундштук для создания максимального давления при вдохе приблизительно 2 кПа в течение двух секунд, и значения AUC0-1sec для кривой зависимости давления при вдохе от времени, по меньшей мере, приблизительно 1,0, 1,1 или 1,2 кПа×сек; причем, более чем 75% дозы сухого порошка выпускается или выбрасывается из ингалятора в виде частиц порошка.
В еще одном варианте осуществления предлагается способ доставки дозы сухого порошкового лекарственного средства в пациента с использованием ингалятора сухого порошка с высоким сопротивлением, при этом, упомянутый способ содержит этапы обеспечения ингалятора сухого порошка, имеющего значение сопротивления воздушному потоку в диапазоне от приблизительно 0,065 (√кПа)/литр в минуту до приблизительно 0,200 (√кПа)/литр в минуту и содержащего дозу сухого порошкового лекарственного средства; ингаляции из ингалятора с достаточным усилием для достижения максимального давления при вдохе, по меньшей мере, 2 кПа в течение 2 секунд; и обеспечения значения AUC0-1sec для кривой зависимости давления при вдохе от времени, по меньшей мере, приблизительно 1,0, 1,1 или 1,2 кПа×сек; причем, больше чем 75% дозы сухого порошка выпускается или выбрасывается из ингалятора в виде частиц порошка.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 - примерный вариант осуществления ингалятора, используемого в системе ингаляции, с изометрическим изображением ингалятора в закрытой конфигурации.
Фиг. 2, 3, 4, 5 и 6 - виды сбоку, сверху, снизу и проксимальный и дистальный виды соответственно ингалятора, показанного на фиг. 1.
Фиг. 7 - вид в перспективе варианта осуществления системы ингаляции, содержащей ингалятор, показанный на фиг. 1, в открытой конфигурации, с изображением соответствующего картриджа и крышки мундштука.
Фиг. 8 - изометрическое изображение ингалятора, показанного на фиг. 6, в открытой конфигурации, с картриджем, установленным в держателе, в сечении по средней продольной оси, при этом, картридж установлен в держателе картриджа и в конфигурации удерживания, причем, ингалятор в закрытой конфигурации с картриджем в конфигурации дозирования представлен на фиг. 9.
Фиг. 10 - вид в перспективе альтернативного варианта осуществления системы ингаляции сухих порошков, при этом, ингалятор показан в открытой конфигурации, с изображением типа и ориентации соответствующего картриджа, который может быть установлен в ингалятор.
Фиг. 11 - изометрическое изображение ингалятора сухого порошка, изображенного на фиг.10, в открытой конфигурации.
Фиг. 12 - вид в перспективе варианта осуществления ингалятора, показанного на фиг. 10, с пространственным разделением деталей и с изображением составляющих частей ингалятора.
Фиг. 13 - вид в перспективе ингалятора, показанного на фиг. 10, в открытой конфигурации и с изображением картриджа, установленного в ингалятор.
Фиг. 14 - сечение по средней продольной оси ингалятора, показанного на фиг. 12, с изображением контейнера картриджа в конфигурации удерживания и в контакте с ползуном и с изображением зубчатого механизма в контакте с ползуном.
Фиг. 15 - вид в перспективе ингалятора, показанного на фиг. 10, в закрытой конфигурации и с картриджем в держателе.
Фиг. 16 - сечение по средней продольной оси ингалятора, показанного на фиг. 15, с изображением контейнера картриджа в конфигурации дозирования и пути воздушного потока, образованного через контейнер.
Фиг. 17 - вид в перспективе варианта осуществления картриджа для применения с ингалятором, показанным на фиг. 1, с изображением картриджа к конфигурации удерживания.
Фиг. 18 - вид сверху варианта осуществления картриджа, показанного на фиг. 17, с изображением составляющих конструктивных элементов верхней поверхности картриджа.
Фиг. 19 - вид снизу варианта осуществления картриджа, показанного на фиг. 17, с изображением составляющих конструктивных элементов нижней поверхности картриджа.
Фиг. 20 - вид в перспективе варианта осуществления картриджа, показанного на фиг. 17, в сечении по средней продольной оси и в конфигурации удерживания.
Фиг. 21 - вид в перспективе варианта осуществления картриджа, показанного на фиг. 17, в сечении по средней продольной оси и в конфигурации дозирования.
Фиг. 22 - вид в перспективе альтернативного варианта осуществления картриджа в конфигурации удерживания.
Фиг. 23-27 - изображения варианта осуществления картриджа, показанного на фиг. 22, на видах сверху, снизу, с проксимального направления, дистального направления и сбоку соответственно.
Фиг. 28 - вид в перспективе варианта осуществления картриджа, показанного на фиг. 22, в конфигурации дозирования.
Фиг. 29 и 30 - сечения по продольной оси варианта осуществления картриджа, показанного на фиг. 22 и 28 соответственно.
Фиг. 31 - схематическое представление движения потока, указанное стрелками, в зоне удерживания порошка ингалятора сухого порошка.
Фиг. 32 - схематическое представление варианта осуществления ингалятора сухого порошка, с изображением указанных стрелками путей потока и направления потока через ингалятор.
Фиг. 33 - график результатов измерений зависимости между потоком и давлением на основании принципа Бернулли для примерного варианта осуществления отношения сопротивления к потоку ингалятора.
Фиг. 34 - график распределения размеров частиц, полученный лазерным дифракционным устройством, с использованием ингалятора и картриджа, вмещающего сухой порошковый препарат для ингаляции, содержащий частицы инсулина и фумарил-дикетопиперазина.
Фиг. 35 - графические представления данных, полученных путем усреднения всех тестов, выполненных для примерной системы ингаляции (DPI 2) и MEDTONE® (MTC), отражающие интегральную функцию распределения геометрических размеров частиц для частиц, испускаемых ингаляционными системами, при различном порошковом содержимом картриджей.
Фиг. 36 - графики данных, полученных с помощью системы контроля ингаляции для ингаляций, выполненных пациентом с использованием примерной системы ингаляции в отсутствие (кривая A) и с (кривая B) порошкового препарата.
Фиг. 37 - график концентрации соединения FDKP в плазме с образцами, отобранными из того же пациента, как на фиг. 36 в течение 6 часов после ингаляции сухого порошкового препарата, содержащего микрочастицы соединения FDKP.
Фиг. 38 - график концентраций инсулина в зависимости от времени по дозовым группам.
Фиг. 39 - график концентраций соединения FDKP в зависимости от времени по дозовым группам.
Фиг. 40 - график колебаний концентраций глюкозы для исследуемого пациента.
Фиг. 41 - график примерного профиля ингаляции настоящего устройства во время использования, с представлением максимального давления при вдохе в течение двух секунд.
Фиг. 42 - график критериев качества работы примерных ингаляторов для настоящих ингаляторов.
ПОДРОБНОЕ ОПИСАНИЕ
Настоящее описание относится, в общем, к ингаляторам сухих порошков, картриджам для ингаляторов сухих порошков и системам ингаляции для доставки, по меньшей мере, одного фармацевтического лекарственного средства в пациента посредством пульмональной ингаляции. В одном варианте осуществления, система ингаляции содержит ингалятор сухого порошка, приводимый в действие вдохом, и картридж, вмещающий фармацевтический препарат, содержащий фармацевтически активное вещество или активный ингредиент и фармацевтически допустимый носитель. Ингалятор сухого порошка обеспечивается в разных формах и размерах и может быть многократно используемым или однократно используемым, удобным для применения, недорогим в производстве и допускает производство в больших объемах, по технологии с простыми рабочими операциями, с использованием пластиков или других приемлемых материалов. В дополнение к комплектным системам, ингаляторы, наполненные картриджи и пустые картриджи составляют дополнительные варианты осуществления, представленные в настоящей заявке. Настоящая система ингаляции может быть выполнена с возможностью использования с сухим порошком любого типа. В одном варианте осуществления, сухой порошок является относительно когезионным порошком, который нуждается в приведении в состояние оптимальной деагломерации. В одном варианте осуществления, система ингаляции обеспечивает многократно используемый миниатюрный ингалятор, приводимый в действие дыханием, в сочетании с одноразовыми картриджами, содержащими предварительно дозированные дозы сухого порошкового препарата.
Предлагаются также способы эффективной и единообразной доставки фармацевтического препарата в большой круг кровообращения.
В контексте настоящего описания, термин «однодозовый ингалятор» относится к ингалятору, который выполнен с возможностью вмещения единственного контейнера с сухим порошковым препаратом и доставляет единственную дозу сухого порошкового препарата посредством ингаляции из контейнера в пользователя. Следует понимать, что в некоторых случаях потребуется несколько унифицированных доз для снабжения пользователя назначенной дозой.
В контексте настоящего описания, термин «многодозовый ингалятор» относится к ингалятору, содержащему множество контейнеров, при этом, каждый контейнер содержит предварительно дозированную дозу сухого порошкового лекарственного средства, и ингалятор доставляет одну дозу порошкового лекарственного средства посредством ингаляции в любой момент времени.
В контексте настоящего описания, «контейнер» является камерой, сформированной с возможностью вмещения или удерживания сухого порошкового препарата, камерой, наполненной порошком, и может быть конструкцией с крышкой или без крышки. Данный контейнер может быть обеспечен отдельно от ингалятора или может быть конструктивно встроенным в ингалятор (например, неразъемным). Кроме того, контейнер может быть наполнен сухим порошком. Картридж также может содержать контейнер.
В контексте настоящего описания, термин «порошковая масса» относится к агломерации частиц порошка или агломерату, имеющему нерегулярные геометрические размеры, например, ширину, диаметр и длину.
В контексте настоящего описания, термин «микрочастица» относится к частице с диаметром от приблизительно 0,5 до приблизительно 1000 мкм, независимо от точной внешней или внутренней структуры. Однако, для легочной доставки обычно требуются микрочастицы, которые меньше чем 10 мкм, в частности, частицы со средними размерами частиц меньше чем приблизительно 5,8 мкм в диаметре.
В контексте настоящего описания, термин «жесткий воздушный канал» относится к воздушному каналу, который связан с путем движения воздуха через систему ингаляции, который не изменяет геометрически или остается постоянным, например, в многократно используемом ингаляторе, воздушные каналы остаются одними и теми же после многократного использования. Жесткий воздушный канал может быть связан с мундштуком, контейнером, корпусом ингалятора, контейнером, корпусом контейнера и т.п.
В контексте настоящего описания, термин «разовая доза» относится к предварительно дозированному сухому порошковому препарату для ингаляции. В альтернативном варианте, унифицированная доза может быть одним контейнером, содержащим несколько доз препарата, которые могут быть доставлены посредством ингаляции в виде дозированных унифицированных количеств, Картридж/контейнер унифицированной дозы вмещает одну дозу. В альтернативном варианте, данный картридж/контейнер может содержать несколько ячеек, доступных по отдельности, каждая из которых вмещает унифицированную дозу.
В контексте настоящего описания, выражение «приблизительно» служит для указания, что значение содержит среднеквадратичное отклонение погрешности для устройства или способа, используемого для определения значения.
Настоящие устройства могут быть изготовлены рядом способов, однако, в одном варианте осуществления, ингаляторы и картриджи выполнены, например, методами литьевого прессования, термоформования, с использованием пластиковых материалов различных типов, в том числе, полипропилена, циклоолефинового сополимера, нейлона, сложных полиэфиров, например, полиэтиленов и других совместимых полимеров и т.п. В некоторых вариантах осуществления, ингалятор сухого порошка может быть собран с использованием метода нисходящей сборки отдельных составляющих частей. В некоторых вариантах осуществления, ингаляторы обеспечивают компактными размерами, например, от приблизительно 1 дюйма (25,4 мм) до приблизительно 5 дюймов (125 мм) в размере, при этом, ширина и высота обычно меньше длины устройства. В некоторых вариантах осуществления ингалятор обеспечен в различных формах, содержащих, при сравнительно прямоугольных остовах, цилиндрические, овальные, трубчатые, квадратные, продолговатые и круглые формы.
В вариантах осуществления, описанных и приведенных для примера в настоящей заявке, в системе ингаляции, содержащей ингалятор, картридж или контейнер и сухой порошковый препарат, ингаляторы сформированы с картриджем для эффективного псевдоожижения, деагломерации или аэролизации сухого порошкового препарата с использованием, по меньшей мере, одного пути в виде относительно жесткого проточного канала, для обеспечения поступления газа, например воздуха, в ингалятор. Например, ингалятор снабжен первым путем для поступления воздуха/газа в картридж, вмещающий сухой порошок, и выхода из данного картриджа, и вторым путем движения воздуха, который может соединяться с первым путем движения воздушного потока, выходящего из картриджа. Проточные каналы могут иметь, например, различные формы и размеры, зависящие от конфигурации ингалятора. Примеры ингаляторов и картриджей, которые можно использовать в настоящей системе ингаляции, описаны, например, в патентных заявках США №№ 12/484125 (US 2009/0308390), 12/484129 (US 2009/0308391), 12/484137 (US 2009/0308392) и 12/717884 (US 2010/0197565), которые в полном объеме включены в настоящую заявку путем отсылки, так как все упомянутые заявки относятся к системам ингаляции.
В вариантах осуществления, приведенных для примера в настоящей заявке, каждый ингалятор можно использовать с подходящим картриджем. Однако, система ингаляции может работать эффективнее, когда ингалятор и картридж конструктивно выполнены с возможностью взаимного соответствия. Например, установочное место картриджа в ингаляторе может быть конструктивно выполнено с возможностью вмещения только конкретного картриджа, и, поэтому, конфигурации отверстий картриджа и ингалятора конструктивно согласуются или совпадают между собой, например, в качестве шпоночных соединительных мест или поверхностей, которые могут служить параметром безопасности для пользователей. Примеры соответствующих ингалятора и картриджа приведены далее в настоящем описании в виде ингалятора 302, который можно использовать с картриджем 170, ингалятора 900, который можно использовать с картриджем 150. Упомянутые ингаляторы и картриджи описаны в патентных заявках США №№ 12/484125; 12/484129 и 12/484137, которые в полном объеме включены в настоящую заявку путем отсылки, так как все упомянутые заявки относятся к ингаляторам и картриджам и, где уместно, к принципам дополнительных или альтернативных деталей, признаков и/или техническим основам.
Примерный вариант осуществления ингалятора сухих порошков представлен на фиг. 1-9. В данном варианте осуществления, ингалятор сухих порошков имеет две конфигурации, т.е. закрытую конфигурацию, изображенную на фиг. 1-6 и 9, и открытую конфигурацию, изображенную на фиг. 7 и 8. Ингалятор 302 сухого порошка в открытой конфигурации допускает установку или извлечение картриджа, содержащего лекарственное средство для ингаляции. На фиг. 1-6 изображен ингалятор 302 в закрытой конфигурации на видах с разных направлений и имеющий сравнительно прямоугольный остов, содержащий корпус 320 и мундштук 330 сверху остова и продолжающийся наружу от остова. Участок мундштука 330 сужается к концу для контакта с пользователем и содержит отверстие 335. Ингалятор 302 содержит также зубчатый механизм 363 и ползун. Ингалятор 302 может быть изготовлен с использованием, например, четырех частей методом нисходящей сборки. Мундштук 330 дополнительно содержит воздушный канал 340, сформированный с возможностью прохождения вдоль продольной оси ингалятора, и содержит участок 312 для захвата ртом, воздуховпускное отверстие 310 и воздуховыпускное отверстие 335, сформированное с возможностью обеспечения его поверхности под углом или со скосом относительно продольной оси воздушного канала, и впускное отверстие 355 картриджа, которое сообщается по текучей среде с корпусом 320 и/или картриджем, установленным в корпус 320, для предоставления воздушному потоку возможности входа в воздушный канал 340 из корпуса или из картриджа, установленного в ингалятор во время использования. На фиг. 1 показан ингалятор 302 в изометрии в закрытом положении, имеющий остов 305 уже, чем ингалятор 300, сформированный корпусом 320 и участком 308 крышки мундштука 330, который продолжается над корпусом 320 и сцепляется с ним посредством фиксирующего механизма 313, например, выступа. На фиг. 2-6 представлены виды сбоку, сверху, снизу и проксимальный и дистальный виды соответственно ингалятора, изображенного на фиг. 1. Как показано на фигурах, ингалятор 302 содержит мундштук 330, содержащий секцию 312 для захвата ртом, протяженный участок, сформированный в виде крышки 308, которая может закрепляться к корпусу 320, по меньшей мере, в одном месте, как показано на фиг. 7. Мундштук 330 может поворачиваться в открытое положение из проксимального положения от рук пользователя в угловом направлении, благодаря шарнирному механизму 363. В данном варианте осуществления, ингалятор 302 сформирован также с возможностью обеспечения зубчатого механизма 363, как показано на фиг. 8, встроенного в шарнирное соединение для открывания ингалятора или мундштука 330 по отношению к корпусу 320.
Зубчатый механизм или зубчатая рейка 319, которая является частью ползуна 317, и ведущая зубчатка 363 сформированы с мундштуком в виде составной части шарнирного механизма для зацепления с корпусом 320, при этом, корпус также может быть сформирован с возможностью вмещения ползуна 317. В данном варианте осуществления ползун 317 сформирован в виде отдельной части и содержит участок, сформированный в виде зубчатой рейки, которая зацепляется с зубчатым колесом, сформированным на шарнирном механизме. Шарнирный механизм 363 допускает перемещение мундштука 330 в угловом направлении в открытую конфигурацию или конфигурацию для вставки картриджа и в закрытую конфигурацию или положение ингалятора 302. Зубчатый механизм 363 в ингаляторах 300, 302 может приводить в действие ползун, чтобы обеспечивать одновременное перемещение ползуна 317 внутри корпуса 320, когда ингалятором манипулируют для открывания или закрывания посредством перемещения мундштука 330, при этом, ползун 317 сформирован в одно целое с зубчатой рейкой 319 в виде составной части зубчатого механизма 363. При использовании с картриджем, зубчатый механизм 363 ингалятора может реконфигурировать картридж посредством перемещения ползуна 317 во время закрывания ингалятора, из конфигурации удерживания картриджа после того, как картридж устанавливают в корпус ингалятора или на установочное место, в конфигурацию дозирования, когда ингалятор закрыт. Перемещение мундштука 330 в открытую конфигурацию ингалятора после ингаляции с картриджем 170 или в конфигурацию для отправки в отходы после того, как пациент выполнил дозирование сухого порошкового препарата. В варианте осуществления, представленном в настоящем описании, шарнирный и зубчатый механизмы обеспечены на дистальном конце ингалятора, однако, можно обеспечить другие конфигурации, в которых ингалятор открывается и закрывается для вставки или извлечения картриджа, например, конфигурацию типа грейферного захвата.
Как показано на фиг. 1 и во время использования, воздушный поток втекает в ингалятор через воздуховпускное отверстие 310 и, одновременно, в воздушный канал 340, который проходит картридж 170 через воздуховпускное отверстие 355. В одном варианте осуществления, внутренний объем воздушного канала 340 мундштука 330, продолжающегося от впускного отверстия 355 до выпускного отверстия 335, имеет большее значение, чем приблизительно 0,2 см3. В другом примерном варианте осуществления, внутренний объем равен приблизительно 0,3 см3, или приблизительно 0,3 см3, или приблизительно 0,4 см3, или приблизительно 0,5 см3. В другом примерном варианте осуществления, упомянутый внутренний объем мундштука, превышающий 0,2 см3, является внутренним объемом мундштука 330. В примерном варианте осуществления, внутренний объем мундштука имеет значение 0,2-6,5 см3. Порошок, содержащийся в контейнере 175 картриджа, псевдоожижается или увлекается в воздушный поток, поступающий в картридж, при размельчении порошкового содержимого. Затем псевдоожиженный порошок постепенно выходит через распыляющее отверстие 173, 127 и в воздушный канал 340 мундштука и дополнительно деагломерируется и разбавляется воздушным потоком, поступающим в воздуховпускное отверстие 310, перед выходом из выпускного отверстия 335.
В одном варианте осуществления, корпус 320 содержит, по меньшей мере, одну составляющую часть, например, верхний участок 316 и нижний участок 318. Верхний и нижний участки сформированы с возможностью согласования между собой с формированием герметичного уплотнения и, тем самым, камеры, которая вмещает ползун 317 и шарнирный и/или зубчатый механизмы. Корпус 320 сформирован также с возможностью содержания, по меньшей мере, одного отверстия 309, чтобы пропускать воздушный поток внутрь корпуса, фиксирующего механизма 313, например, выступов или пружинных запорных колец для зацепления и закрепления участка 308 крышки мундштука в закрытом положении ингалятора 302. Корпус 320 сформирован также с возможностью содержания держателя картриджа или установочного места 315 для картриджа, которое сформировано с возможностью соответствия типу картриджа, подлежащего использованию с ингалятором. В данном варианте осуществления, место размещения картриджа или держатель является отверстием в верхнем участке корпуса 320, при этом, данное отверстие допускает также расположение нижнего участка картриджа или контейнера на ползуне 317 после того, как картридж устанавливают в ингалятор 302. Корпус может дополнительно содержать места 304, 307 захвата, сформированные с возможностью облегчения, для пользователя ингалятора, прочного или надежного захвата для открывания ингалятора с целью вставки или извлечения картриджа. Корпус 320 может дополнительно содержать фланцы, сформированные с возможностью ограничения воздушного канала или прохода, например, два параллельных фланца 303, которые также сформированы с возможностью направления воздушного потока в воздуховпускное отверстие 310 ингалятора и в воздуховпускное отверстие картриджа воздушного канала картриджа, расположенного в ингаляторе. Фланцы 310 сформированы также с возможностью предотвращения загораживания пользователем впускного отверстия 310 ингалятора 302.
На фиг. 7 представлено изометрическое изображение ингалятора, показанного на фиг. 1, в открытой конфигурации с крышкой мундштука, например, колпачком 342, и картриджем 170, который сформирован с возможностью согласования с установочным местом картриджа и обеспечения установки картриджа в держатель 315 картриджа для использования. В одном варианте осуществления, реконфигурация картриджа из положения удерживания, обеспечиваемого после изготовления, может быть выполнена после того, как картридж установлен в держатель 315 картриджа, который сформирован внутри корпуса 320 с возможностью такого согласования с ингалятором, чтобы картридж был правильно ориентирован в ингаляторе и мог быть вставлен или установлен только единственным образом или в единственной ориентации. Например, картридж 170 может быть сформирован с фиксирующим механизмом 301, который соответствует фиксирующему механизму, сформированному в корпусе ингалятора, например, установочное место ингалятора или держатель могут содержать скошенную кромку 301, которая будет соответствовать скошенной кромке 180 на картридже, например, картридже 170, подлежащем установке в ингалятор. В данном варианте осуществления, скошенные кромки формируют фиксирующий механизм, который препятствует выпадению картриджа из держателя 315 во время перемещения ползуна 317.
В одном специальном варианте осуществления, изображенном на фиг. 8 и 9, крышка картриджа сформирована со скошенной кромкой, чтобы картридж оставался закрепленным в установочном месте корпуса во время использования, при этом, установочное место содержит согласующиеся скошенные кромки. На фиг. 8 и 9 изображен также механизм 319 зубчатой рейки, сформированный с ползуном 317 для осуществления скользящего перемещения контейнера 175 картриджа в картридже 170 под верхом картриджа, чтобы выставить контейнер под нижней поверхностью верха картриджа, сформированной с возможностью содержания распыляющего(их) отверстия(ий) в закрытой конфигурации ингалятора или положении распыления или дозирования, или конфигурации картриджа, в которой ингалятор 302 готов к дозированию в пользователя. В конфигурации дозирования, воздуховпускное отверстие формируется краем верха картриджа и закраиной контейнера, так как нижняя поверхность верха картриджа приподнята относительно нижней поверхности контейнера. В данной конфигурации, воздушный канал через картридж устанавливается воздуховпускным отверстием, внутренним объемом картриджа, который открыт для атмосферного воздуха, и отверстиями в верхе картриджа или распыляющим отверстием в верхе картриджа, при этом, воздушный канал сообщается по текучей среде с воздушным каналом 340 мундштука.
Ингалятор 302 может дополнительно содержать колпачок 342 мундштука для защиты участка мундштука для захвата ртом. На фиг. 8 изображен ингалятор, показанный на фиг. 1, в сечении по средней продольной оси, при этом, картридж установлен в держателе картриджа и в открытой конфигурации, и на фиг. 9 изображена закрытая конфигурация, являющаяся конфигурацией распыления или дозирования картриджа.
На фиг. 8 показано положение картриджа 350, установленного в держателе или установочном месте 315, и показано относительное расположение внутренних составляющих частей ингалятора 302 и картриджа 170, в том числе, бобышку 326 с распыляющими отверстиями 327; зубчатый механизм 360, 363 и защелки 380, которые помогают удерживать устройство в закрытой конфигурации.
На фиг. 10-16 представлен еще один вариант осуществления ингалятора сухого порошка системы ингаляции. На фиг. 10 изображен ингалятор 900 в открытой конфигурации, который конструктивно сформирован подобно ингалятору 302, показанному на фиг. 1-9. Ингалятор 900 содержит мундштук 930 и подузел 920 корпуса, которые шарнирно соединены между собой таким образом, что мундштук 930 поворачивается относительно подузла 920 корпуса. Мундштук 930 дополнительно содержит неразъемно сформированные боковые панели 932, более широкие, чем корпус 920, которые входят в зацепление с выступами 905 корпуса для приведения ингалятора 900 в замкнутую конфигурацию. Мундштук 930 дополнительно содержит воздуховпускное отверстие 910, воздуховыпускное отверстие 935; воздушный канал 940, продолжающийся от воздуховпускного отверстия 910 к воздуховыпускному отверстию 935 для контакта с губами или ртом пользователя, и отверстие 955 в подошвенной или нижней поверхности, которое сообщается с воздушным каналом 940 ингалятора. На фиг. 12 представлен вид в перспективе ингалятора 900 с пространственным разделением деталей, где показаны составляющие части ингалятора, в том числе, мундштук 930 и подузел 920 корпуса. Как показано на фиг. 12, мундштук сформирован в виде одного компонента и дополнительно содержит стержень, цилиндр или трубку 911, сформированную с зубьями или зубчаткой 913 для такого шарнирного сочленения с корпусом 920, чтобы перемещение мундштука 930 относительно корпуса 920 в угловом направлении обеспечивало закрывание устройства. В корпусе может быть обеспечен воздушный канал 912, который может направлять воздушный поток к воздуховпускному отверстию 910 мундштука. Воздушный канал 912 сформирован так, что, во время использования, палец пользователя, помещенный сверху канала, не сможет ограничить или перегородить воздушный поток в воздушный канал 940.
На фиг. 12 изображен подузел 920 корпуса, содержащий две части, изготовленных для создания камеры и содержащих верхний участок с посадочным или установочным местом 908 для картриджа и прорезь 918, которая сформирована с возможностью ограничения воздуховпускного отверстия, когда ингалятор находится в закрытой конфигурации. На фиг. 12 изображен корпус 920 в виде камеры, дополнительно содержащий две составляющих части для облегчения изготовления, однако, число применяемых частей может быть меньше или больше. Нижний участок, формирующий корпус, не содержит отверстий и содержит лоток 922, и соединен с верхним участком или крышкой 925 для формирования камеры или корпуса 920. Лоток 922 сформирован с прорезями 914, сформированными вблизи дистального конца лотка, которые вмещают стержень, цилиндр или трубку 911 для формирования шарнирного сочленения с мундштуком 930. Лоток 922 вмещает также ползун 917. Ползун 917 сформирован с возможностью перемещения в лотке 922 и содержит место 921 для вмещения картриджа и консольный конструктивный элемент, содержащий отверстия 915 для зацепления с зубьями или зубчаткой 913 мундштука 930 таким образом, чтобы, при закрывании устройства для использования, перемещение мундштука 930 относительно корпуса 920 перемещало ползун в проксимальном направлении, что приводит к упору ползуна в контейнер картриджа, расположенный в держателе ингалятора или установочном месте 908, и может сместить контейнер из положения удерживания в положение дозирования. В данном варианте осуществления, картридж, расположенный в держателе 908 картриджа, содержит воздуховпускное отверстие в конфигурации дозирования, обращенное к проксимальному концу ингалятора или пользователю. Крышка 925 корпуса сформирована так, что может надежно закрепляться к лотку 922 благодаря наличию, например, выступов 926, продолжающихся от нижнего края в качестве крепежного механизма. Ингалятор 900 представлен на фиг. 12 в открытой конфигурации, с изображением положения и ориентации картриджа 150, который подлежит установке в установочное место ингалятора, в конфигурации удерживания. На фиг. 13 ингалятор 900 дополнительно изображен в открытой конфигурации, с картриджем 150, расположенным в держателе картриджа в положении удерживания. На фиг. 14 представлено сечение по средней продольной оси ингалятора, показанного на фиг. 13, с изображением положения зубчатки 913 относительно ползуна 917 в конфигурации удерживания контейнера 151 картриджа, который упирается в ползун 917. В данном варианте осуществления, контейнер 151 перемещается относительно верха 156 картриджа. При закрывании ингалятора 900 (фиг. 15), и по мере того, как мундштук 930 перемещается для прихода в закрытую конфигурацию, ползун 917 толкает контейнер 151, пока не достигается конфигурация дозирования, и отверстие 955 в мундштуке не продвинется над бобышкой 126 картриджа так, что распыляющие отверстия 127 становятся сообщающимися с каналом 940 мундштука, и создается путь движения воздушного потока для дозирования через воздуховпускную прорезь 918, воздуховпускное отверстие 919 картриджа и распыляющие отверстия 127 в воздушном канале 940. Как показано на фиг.16, мундштук 930 и, поэтому, воздушный канал 940 имеют сравнительно сужающуюся конфигурацию в виде песочных часов от, приблизительно середины к дистальному концу. В данном варианте осуществления, ползун 917 сформирован так, что, когда ингалятор открывают после использования, ползун не может реконфигурировать картридж в конфигурацию удерживания. В некоторых модификациях данного варианта осуществления, картридж можно или желательно реконфигурировать в зависимости от используемого порошкового лекарственного средства.
В вариантах осуществления, представленных в настоящей заявке, отверстия ингалятора, например, 355, 955 могут быть снабжены уплотнением, например, сминаемыми буртиками, согласующимися поверхностями, прокладками и уплотнительными кольцами для предотвращения утечки воздушного потока в системы, чтобы воздушный поток проходил только через картридж. В другом варианте осуществления, для осуществления уплотнения, уплотнение можно обеспечить в картридже. Ингаляторы снабжены также, по меньшей мере, одной зоной деагломерации, которая сформирована с возможностью сведения к минимуму накопления порошка или отложений. Зоны деагломерации обеспечены, например, в картридже, в том числе, в контейнере и распыляющих отверстиях, и в, по меньшей мере, одном месте в воздушном канале мундштука.
Варианты осуществления картриджа для применения с ингаляторами описаны выше, например, картриджи 150, 170, изображенные соответственно на фиг. 10, 13, 14, 16-21 и на фиг. 7-9, 22-30. Настоящие картриджи сформированы с возможностью формирования камеры, имеющей, по меньшей мере, две конфигурации и вмещающей сухое порошковое лекарственное в положении хранения, герметичной упаковки или удерживания. В данном и других вариантах осуществления, картридж может быть реконфигурирован внутри ингалятора из положения удерживания порошка в положение ингаляции или дозирования.
В некоторых вариантах осуществления, картридж содержит крышку или верхнюю часть и контейнер, содержащий, по меньшей мере, одно отверстие, конфигурацию удерживания и конфигурацию дозирования, внешнюю поверхность, внутреннюю поверхность, ограничивающую внутренний объем; и конфигурация удерживания ограничивает сообщение с внутренним объемом, и конфигурация распыления формирует воздушный проход через внутренний объем, чтобы допускать поступление воздушного потока во внутренний объем и выход из него предварительно заданным образом. Например, контейнер картриджа может быть сформирован так, чтобы воздушный поток, входящий в воздуховпускное отверстие картриджа, направлялся через воздуховыпускные отверстия картриджа во внутреннем объеме для дозирования лекарственного средства, выходящего из картриджа, таким образом, чтобы регулировать скорость выпуска порошка; и, при этом, воздушный поток в картридже может совершать беспорядочное движение, по существу, перпендикулярно направлению выходного воздушного потока, смешивать и псевдоожижать порошок во внутреннем объеме до выхода через распыляющие отверстия,
В одном варианте осуществления, картридж может быть кодирован, по меньшей мере, одним признаком, в том числе, этикеткой, гравировкой, цветом, матовыми узорами, фланцами, ребрами и т.п. Например, если выбран цвет, то во время изготовления картриджа можно внедрять цветные пигменты различных типов, которые совместимы с пластиками и фармацевтическими препаратами, или которые являются фармацевтически допустимыми. В данном и других вариантах осуществления, цвет может обозначать конкретный активный ингредиент или величину дозы, например, зеленая крышка может означать 6 единиц препарата FDKP и инсулина. Фармацевтически допустимыми цветами могут быть зеленый, синий, зеленовато-голубой, оранжево-красный, фиолетовый, желтый, оранжевый и т.п.
На фиг. 17 дополнительно изображен картридж 150, содержащий верхнюю часть или крышку 156 и контейнер 151, ограничивающие внутреннее пространство или внутренний объем. На фиг. 18 дополнительно изображен пример верхней части 156 картриджа, имеющей противоположные концы и содержащей участок 154 углубления и бобышку 126 на противоположных концах продольной оси X и сравнительно прямоугольный набор панелей 152 по сторонам и на продольной оси X, которые сформированы неразъемно и закреплены своими концами к верхней части 156. Край 158 верхней части 156 картриджа продолжается вниз и является слитным с панелями 152. Панели 152 продолжаются вниз с каждой стороны верхней части 156 вдоль продольной оси X и отделены от участка бобышки 126 и участка 154 углубления продольным пространством или пазом 157. На фиг. 17-21 показано также, что каждая панель 152 дополнительно содержит фланец 153, конструктивно сформированный с возможностью зацепления с выступами или полками 166 контейнера 151, создания опоры для контейнера 151 и допуска перемещения контейнера 151 из положения удерживания под участком 154 углубления в положение дозирования под участком бобышки 126. Панели 152 конструктивно сформированы со стопором 132 на каждом конце, чтобы не допускать перемещения контейнера 151 за их конец, где они соединяются с краем 158. В данном варианте осуществления, контейнер 151 или крышку 156 можно перемещать, например, посредством поступательного сдвига по верхней части 156, или верхняя часть 156 может быть подвижной относительно контейнера 151. В одном варианте осуществления, контейнер 151 может быть перемещаемой сдвигом по фланцам 153 на крышке 156, когда крышка или верхняя часть 156 является неподвижной, или крышка 156 может быть перемещаемой сдвигом по неподвижному контейнеру 151, в зависимости от конфигурации ингалятора. Край 158 вблизи бобышки 126 содержит участок углубления, который формирует часть периметра впускного отверстия 119 в конфигурации дозирования картриджа.
На фиг. 19, картридж 150 представлен на виде снизу, показывающем взаимное расположение конструктивных элементов в конфигурации удерживания, например, контейнера 151, распыляющих отверстий 127, панелей 152, фланцев 153 и зоны под бобышкой 126 или нижней поверхностью 168, которая является сравнительно полой или углубленной. На фиг. 20 представлено поперечное сечение по средней продольной оси X картриджа 150 в конфигурации удерживания и изображен контейнер 151 в плотном контакте с крышкой 156 на участке 154 углубления и с опорой на фланцы 153. Нижняя поверхность бобышки 126 является полой и может наблюдаться в сравнительно более высоком положении, чем верхний край контейнера 151. На фиг. 21 изображен картридж 150 в конфигурации дозирования, в которой верхний край контейнера 151 и панель 158 под участком бобышки 126 формируют впускное отверстие 119, которое допускает вход потока во внутреннее пространство контейнера 151.
В другом варианте осуществления, на фиг. 22-30 показан поступательно перемещаемый картридж 170, который является альтернативным вариантом осуществления картриджа 150 и может применяться, например, с ингалятором 302, изображенным на фиг. 1-9. На фиг. 22 изображен картридж 170, содержащий камеру, содержащую верхнюю часть или крышку 172 и контейнер 175, ограничивающий внутреннее пространство, при этом, картридж показан в конфигурации удерживания. В данной конфигурации картриджа, верхняя часть 172 картриджа сформирована с возможностью формирования уплотнения с контейнером 175, и контейнер или крышка являются перемещаемыми друг относительно друга. Картридж 170 допускает изменение конфигурации из положения удерживания (фиг. 22 и 29) в положение дозирования (фиг. 24-28 и 30) и в положение для отправления в отходы (не показанное), например, в середине картриджа, для указания, что картридж использован. На фиг. 22 показаны также различные характерные элементы картриджа 170, при этом, верхняя часть 172 содержит боковые панели 171, сформированные с возможностью частичного перекрытия внешней поверхности контейнера. Каждая боковая панель 171 содержит фланец 177 на ее нижней кромке, который формирует направляющую для опоры полочных конструкций контейнера 175, которая допускает перемещение контейнера 175 вдоль нижнего края верхней части 172. Верхняя часть 172 картриджа дополнительно содержит внешнюю, сравнительно плоскую поверхность на одном конце, сравнительно прямоугольную бобышку 174, содержащую отверстие или распыляющее отверстие 173, и вогнутый или углубленный участок, сформированный внутри с возможностью удерживания содержимого контейнера 175 в состоянии герметичного уплотнения. В одном варианте осуществления, распыляющее отверстие может быть сформировано с различными размерами, например, ширина и длина отверстия могут составлять от приблизительно 0,025 см до приблизительно 0,25 см по ширине и от приблизительно 0,125 см до приблизительно 0,65 см в длину на его входе внутри картриджа. В одном варианте осуществления, вход распыляющего отверстия имеет размеры приблизительно 0,06 см в ширину на 0,3 см в длину. В некоторых вариантах осуществления, верхняя часть 172 картриджа может содержать различные формы, которые могут содержать захватывающие поверхности, например, лапки 176, 179 и другие конфигурации, чтобы правильно ориентировать картридж для надлежащего размещения в держателе, и крепежный механизм, например, закругленную или скошенную кромку 180 для надежного согласования с соответствующим ингалятором. Фланцы, внешняя геометрия бобышки, лапки и различные другие формы могут составлять шпоночные соединительные поверхности, которые могут указывать, облегчать и/или вынуждать надлежащее размещение картриджа в ингаляторе. Кроме того, упомянутые конструкции могут различаться между разными системами сбора пары ингалятор-картридж, чтобы соответствовать конкретному лекарственному средству или конкретной дозировке, обеспечиваемым картриджем с конкретным ингалятором. Таким образом, картридж, предназначенный для ингалятора, соответствующего первому лекарственному средству или первой дозировке, может быть заблокирован от установки в сходный ингалятор, соответствующий второму лекарственному средству или второй дозировке, или работы с данным ингалятором.
На фиг. 23 показана, на виде сверху, примерная общая форма верхней части 172 картриджа с бобышкой 174, распыляющим отверстием 173, участком 178 углубления и лапками 176 и 179. На фиг. 24, на виде снизу картриджа 170 изображен контейнер 175 в положении дозирования, опирающийся своими полочными выступами 182 на каждый фланец 177 от верхней части 172. На фиг. 25 изображен картридж 170 в конфигурации дозирования, дополнительно содержащий воздуховпускное отверстие 181, сформированное прорезью на верхней части 172 картриджа и верхнем краю контейнера 175. В данной конфигурации, воздуховпускное отверстие 181 сообщается с внутренним пространством картриджа и формирует воздушный канал с распыляющим отверстием 173. Воздуховпускное отверстие 181 картриджа сформировано с возможностью направления воздушного потока, входящего во внутреннее пространство картриджа во время использования, в распыляющее отверстие 173. На фиг. 26 представлено изображение картриджа 170 с противоположной стороны в конфигурации дозирования или вид сзади конфигурации, показанной на фиг. 25.
На фиг. 27 картридж 150 представлен на виде сбоку, показывающем взаимное расположение конструктивных элементов в конфигурации дозирования, например, контейнера 175, бобышки 174, боковых панелей 172 и лапки 176. На фиг. 28 картридж 170 изображен в конфигурации дозирования для использования и содержит контейнер 175 и верхнюю часть 172, содержащую сравнительно прямоугольное воздуховпускное отверстие 181 и сравнительно прямоугольное распыляющее отверстие 173, проходящее сквозь бобышку 174, которая расположена относительно по центру на верхней поверхности верхней части 172 картриджа. Бобышка 174 сформирована с возможностью входа в отверстие в стенке мундштука ингалятора. На фиг. 29 и 30, приведены сечения по средней продольной оси X картриджа 170 в конфигурации удерживания и конфигурации дозирования соответственно, при этом, контейнер 175 показан в контакте с нижней поверхностью крышки 172 участка 178 углубления и опирается на фланцы 177, которые формируют направляющие скольжения для сдвига контейнера из одного положения в другое положение. Как показано на фиг. 29, в конфигурации удерживания, контейнер 175 формирует уплотнение с нижней поверхностью верхней части 172 картриджа на участке 178 углубления. На фиг. 30 картридж 170 изображен в конфигурации дозирования, в которой контейнер находится на противоположном конце от участка 181 углубления, и контейнер 175 и верхняя часть картриджа формируют воздуховпускное отверстие 181, которое допускает вход атмосферного воздуха в картридж 170, а также формирование воздушного канала с распыляющим отверстием 173 и внутренним пространством контейнера 175. В данном варианте осуществления, нижняя поверхность верхней части картриджа, под которой обеспечивается положение дозирования, является сравнительно плоской, и внутренняя поверхность контейнера 175 сформирована несколько U-образной. Бобышка 174 сформирована немного выступающей над верхней поверхностью верхней части 172 картриджа.
В других вариантах осуществления картриджа, картридж может быть выполнен с возможностью согласования с ингаляторами сухих порошков, которые пригодны для использования с ингалятором с поворотным механизмом для перемещения ингалятора или картриджа из конфигурации удерживания в конфигурацию дозирования, при этом, верхняя часть картриджа является перемещаемой относительно контейнера, или для перемещения контейнера относительно верхней части во время обеспечения совмещения распыляющих отверстий с контейнером в положение дозирования, или для перемещения либо контейнера, либо верхней части в конфигурацию удерживания.
В вариантах осуществления, представленных в настоящей заявке, картриджи могут быть сформированы с возможностью доставки одной унифицированной, предварительно дозированной дозы сухого порошкового лекарственного средства в различных количествах, зависящих от используемого сухого порошкового препарата. Примерные картриджи, например, картридж 150, 170 могут быть конструктивно сформированы с возможностью содержания дозы, например, от 0,1 мг до приблизительно 50 мг сухого порошкового препарата. Таким образом, размер и форма контейнера могут изменяться в зависимости от размера ингалятора и количества или массы порошкового лекарственного средства, подлежащего доставке. Например, контейнер может иметь сравнительно цилиндрическую форму с двумя противоположными боковыми сторонами, сравнительно плоскими и имеющими между собой приблизительное расстояние от приблизительно 0,4 см до приблизительно 2,0 см. Чтобы оптимизировать рабочие характеристики ингалятора, высота внутреннего пространства картриджа по оси Y может изменяться в зависимости от количества порошка, которое предполагается вместить в камеру. Например, для количества 5 мг-15 мг порошка может требоваться оптимальная высота от приблизительно 0,6 см до приблизительно 1,2 см.
В одном варианте осуществления обеспечен картридж с лекарственным средством для ингалятора сухого порошка, при этом, упомянутый картридж содержит: камеру, сформированную с возможностью вмещения лекарственного препарата; по меньшей мере, одно впускное отверстие для пропуска потока в камеру и, по меньшей мере, одно распыляющее отверстие для выпуска потока из камеры; причем, по меньшей мере, одно впускное отверстие сформировано с возможностью направления, по меньшей мере, части потока, входящего в, по меньшей мере, одно впускное отверстие, к, по меньшей мере, одному распыляющему отверстию в камере в ответ на дифференциальное давление. В одном варианте осуществления, картридж ингалятора сформирован из пластика на основе полиэтилена высокой плотности. Картридж содержит контейнер, который имеет внутреннюю поверхность, ограничивающую внутренний объем и содержащую нижнюю и боковые стенки, прилегающие друг к другу и содержащие, по меньшей мере, одно отверстие. Контейнер имеет чашеобразную конструкцию и содержит одно отверстие с закраиной, и данное отверстие сформировано верхней частью картриджа и низом контейнера, которые допускают изменение конфигурации, устанавливающей границы, по меньшей мере, впускного отверстия и, по меньшей мере, одного распыляющего отверстия. Верхняя часть картриджа и низ контейнера допускают изменение конфигурации в положение удерживания и положение распыления или дозирования.
В вариантах осуществления, представленных в настоящей заявке, ингалятор сухого порошка и картридж формируют систему ингаляции, которая может быть конструктивно сформирована с возможностью осуществления настраиваемого или модульного сопротивления воздушному потоку, так как система может быть исполнена с изменением площади поперечного сечения в любом сечении ее воздушных каналов. В одном варианте осуществления, система ингалятора сухого порошка может иметь значение сопротивления воздушному потоку от приблизительно 0,065 до приблизительно 0,200 (√кПа)/литр в минуту. В другом варианте осуществления можно воспользоваться обратным клапаном для предотвращения воздушного потока через ингалятор, пока перепад давления не достигнет требуемого значения, например, 4 кПа, при котором требуемое сопротивление достигает значения в вышеприведенном диапазоне.
В вариантах осуществления, представленных в настоящей заявке, система ингалятора сухого порошка сформирована с возможностью обеспечения предварительно заданного распределения баланса объемных скоростей потоков во время использования, за счет наличия первого пути движения потока через картридж и второго пути движения потока через, например, воздушный канал мундштука. На фиг. 31 и фиг. 32 схематически показаны воздушные каналы, образованные конструктивными конфигурациями картриджа и ингалятора, которые управляют балансом распределения потоков. На фиг. 31 показано общее направление потока внутри картриджа в положении распыления или дозирования ингалятора сухого порошка, как показано стрелками. На фиг. 32 показано перемещение потока в варианте осуществления ингалятора сухого порошка, с изображением показанных стрелками путей движения потока в ингаляторе в положении дозирования.
Баланс массовых потоков внутри ингалятора составляет приблизительно 20%-70% для объема, проходящего по пути движения потока в картридже, и приблизительно 30%-90% через начальный участок канала мундштука. В данном варианте осуществления, распределение воздушного потока через картридж перемешивает лекарственное средство посредством беспорядочного движения для псевдоожижения или аэрозолизации сухого порошкового лекарственного средства в контейнере картриджа. Затем, воздушный поток, псевдоожижающий порошок внутри контейнера, поднимает порошок и постепенно дает частицам порошка выходить из контейнера картриджа через распыляющие отверстия, затем, расщепляться под действием воздушного потока, входящего в канал мундштука, сходится с воздушным потоком, содержащим лекарственное средство, исходящим из контейнера картриджа. Предварительно заданный или дозированный воздушный поток, выходящий из картриджа, сходится с обходным воздушным потоком, входящим в воздушный канал мундштука, для дополнительного разбавления и дегломерации порошкового лекарственного средства перед выходом из выходного отверстия мундштука и поступления в пациента.
В еще одном варианте осуществления обеспечена система ингаляции для доставки сухого порошкового препарата в пациента, при этом, упомянутая система содержит ингалятор, содержащий установочное место для контейнера, сформированное с возможностью вмещения контейнера, и мундштук, содержащий, по меньшей мере, два впускных отверстия и, по меньшей мере, одно выходное отверстие; причем, одно впускное отверстие из, по меньшей мере, двух впускных отверстий сообщается по текучей среде с местом для контейнера, и одно из, по меньшей мере, двух впускных отверстий сообщается по текучей среде с, по меньшей мере, одним выходным отверстием по пути движения потока, сформированному с возможностью обхода места для контейнера, чтобы доставлять сухой порошковый препарат в пациента; причем, проточный канал, сформированный с возможностью обхода места для контейнера, доставляет 30%-90% суммарного потока, проходящего через ингалятор во время ингаляции.
В другом варианте осуществления также обеспечена система ингаляции для доставки сухого порошкового препарата в пациента, при этом, упомянутая система содержит ингалятор сухого порошка, содержащий область контейнера и контейнер; причем, упомянутые ингалятор сухого порошка и контейнер, в сочетании, сформированы с жесткими проточными каналами в конфигурации дозирования и множеством конструктивных областей, которые обеспечивают механизмы для деагломерации порошка в системе ингаляции во время использования; причем, по меньшей мере, один из множества механизмов для деагломерации представляет собой отверстие для вытеснения агломератов по размеру в области контейнера, имеющей наименьший размер 0,5 мм-3 мм. Термин «жесткие проточные каналы» означает воздушные каналы системы ингаляции, которые не изменяют своей геометрии после многократного использования, т.е. каналы остаются одними и теми же или постоянными и не переменными от использования к использованию, в противоположность системам, которые действуют с прокалывающими механизмами для применения с капсулами и блистерами, которые могут демонстрировать изменчивость конфигурации каналов от капсулы к капсуле или блистера к блистеру.
В альтернативном варианте осуществления обеспечена система ингаляции для доставки сухого порошкового препарата пациенту, при этом, упомянутая система содержит ингалятор сухого порошка, содержащий мундштук и контейнер; причем, упомянутые ингалятор сухого порошка и контейнер, в сочетании, сформированы с возможностью обеспечения жестких проточных каналов в конфигурации дозирования и множества конструктивных областей, которые обеспечивают механизм деагломерации порошка системы ингаляции во время использования; причем, по меньшей мере, один из множества механизмов деагломерации представляет собой воздушный канал, сформированный в мундштуке, который направляет поток к выходному отверстию, сообщающемуся по текучей среде с контейнером. В отдельных вариантах осуществления, система ингаляции содержит контейнер, дополнительно содержащий механизмы для деагломерации когезионного порошка, который содержит чашеобразную конструкцию, сформированную с возможностью направления потока, входящего в контейнер, во вращательное движение, рециркуляцию во внутреннем объеме чашеобразной конструкции и подъема порошкового лекарственного средства для увлечения порошковых агломератов в потоке, пока порошковые массы не станут достаточно малыми перед выходом из контейнера. В данном варианте осуществления, чашеобразная конструкция имеет, по меньшей мере, один радиус, сформированный для предотвращения застаивания потока.
В вариантах осуществления, представленных в настоящей заявке, картридж конструктивно сформирован с впускным отверстием в непосредственной близости от распыляющего отверстия по горизонтальной и вертикальной оси. Например, близкое расстояние между впускным отверстием и распыляющими отверстиями может изменяться от непосредственной близости к воздуховпускному отверстию до приблизительно в пределах одной ширины картриджа, хотя данное взаимное расположение может изменяться в зависимости от объемной скорости потока, физических и химических свойств порошка. Вследствие данного близкого расстояния, поток из впускного отверстия пересекает проход до распыляющих отверстий внутри картриджа, с созданием конфигурации потока, которая препятствует выходу псевдоожиженного порожка или порошка, увлеченного в воздушном потоке, из картриджа. Таким образом, во время ингаляционной манипуляции, поток, входящий в контейнер картриджа, может вызывать беспорядочное движение сухого порошкового препарата в контейнере картриджа, и псевдоожиженный порошок, достигающий выхода или распыляющих отверстий картриджа, может задерживаться потоком, поступающим во впускное отверстие картриджа, и, тем самым, возможно ограничение выхода потока, образованного внутри картриджа, из контейнера картриджа. Вследствие различий инерции, плотности, скорости, взаимодействия зарядов, положения потока, только некоторые частицы могут пролетать по пути, необходимому для выхода из распыляющих отверстий. Частицы, которые не проходят через выходное отверстие, должны продолжать беспорядочное движение, пока частицы не приобретут надлежащую массу, заряд, скорость или положение. Фактически, данный механизм может дозировать количество лекарственного средства, истекающего из картриджа, и может способствовать деагломерации порошка. Для дополнительной поддержки дозирования выходящего псевдоожиженного порошка, можно изменять размер и число распыляющих отверстий. В одном варианте осуществления используют распыляющие отверстия, имеющие круглую форму, каждое 0,10 см в диаметре, и расположенные вблизи впускного отверстия приблизительно от положения на средней осевой линии контейнера до положения на расстоянии приблизительно 0,2 см от осевой линии в сторону воздуховпускного отверстия. Другие варианты осуществления, например, могут содержать распыляющие отверстия различных форм, в том числе, прямоугольной формы, при этом, площадь поперечного сечения, по меньшей мере, одного распыляющего отверстия изменяется от 0,05 см2 до приблизительно 0,25 см2. В некоторых вариантах осуществления, размеры распыляющих отверстий могут изменяться от приблизительно 0,05 см до приблизительно 0,25 см в диаметре. Другие формы и площади поперечного сечения можно использовать при условии, если данные формы имеют площадь поперечного сечения со значениями, сходными со значениями, приведенными в настоящей заявке. В качестве альтернативы, для более когезионных порошков можно обеспечить большую площадь поперечного сечения распыляющего отверстия. В некоторых вариантах осуществления, площадь поперечного сечения дозирующего отверстия можно увеличить в зависимости от размера агломератов относительно минимального размера просвета отверстия или отверстий таким образом, чтобы отношение длины к ширине отверстия оставалась большой. В одном варианте осуществления, впускное отверстие имеет размер в ширину больше ширины распыляющего отверстия или отверстий. В вариантах осуществления, в которых впускное отверстие является прямоугольным, воздуховпускное отверстие имеет ширину в пределах от приблизительно 0,2 см до приблизительно максимальной ширины картриджа. В одном варианте осуществления, высота составляет приблизительно 0,15 см, и ширина составляет приблизительно 0,40 см. В альтернативных вариантах осуществления, контейнер может иметь высоту от приблизительно 0,05 см до приблизительно 0,40 см. В отдельных вариантах осуществления, контейнер может иметь ширину от приблизительно 0,4 см до приблизительно 1,2 см и высоту от приблизительно 0,6 см до приблизительно 1,2 см. В одном варианте осуществления, контейнер содержит, по меньшей мере, одно распыляющее отверстие, и каждое из отверстий может иметь диаметр от 0,012 см до приблизительно 0,25 см.
В отдельных системах ингаляции обеспечен картридж для ингалятора сухого порошка, содержащий верхнюю часть картриджа и контейнер, при этом, верхняя часть картриджа сформирована относительно плоской и содержащей, по меньшей мере, одно отверстие и, по меньшей мере, один фланец, содержащий направляющие, сформированные с возможностью зацепления с контейнером; причем, контейнер имеет внутреннюю поверхность, ограничивающую внутренний объем, и закреплен с возможностью перемещения на направляющих на, по меньшей мере, одном фланце на верхней части картриджа, и допускает изменение конфигурации для перевода в положение удерживания и положение распыления или дозирования посредством перемещения по направляющим, по меньшей мере, одного фланца.
В другом варианте осуществления, система ингаляции содержит камеру, содержащую, по меньшей мере, одно входное отверстие, сформированное для вытеснения порошковой массы сухой порошковой композиции, имеющей наименьший размер больше чем 0,5 мм и меньше чем 3 мм. В одном варианте осуществления, картридж для ингалятора сухого порошка, содержащего камеру, содержит, по меньшей мере, две жесткие части; при этом, картридж содержит, по меньшей мере, одно впускное отверстие и, по меньшей мере, одно распыляющее отверстие, причем, по меньшей мере, впускное отверстие имеет суммарную площадь поперечного сечения, которая больше, чем суммарная площадь поперечного сечения распыляющих отверстий, причем, суммарная площадь поперечного сечения, по меньшей мере, одного распыляющего отверстия имеет значение в диапазоне от 0,05 см2 до приблизительно 0,25 см2.
В одном варианте осуществления, способ деагломерации и распыления сухого порошкового препарата для ингаляции содержит следующие этапы: формируют воздушный поток в ингаляторе сухого порошка, содержащем мундштук и контейнер, содержащий, по меньшей мере, одно впускное отверстие и, по меньшей мере, одно распыляющее отверстие и содержащий сухой порошковый препарат; причем, контейнер формирует воздушный канал между, по меньшей мере, одним впускным отверстием и, по меньшей мере, одним распыляющим отверстием, и впускное отверстие направляет часть воздушного потока, поступающего в контейнер, к, по меньшей мере, одному распыляющему отверстию; предоставляют воздушному потоку возможность приводить в беспорядочное движение порошок внутри контейнера, чтобы поднимать и перемешивать сухое порошковое лекарственное средство в контейнере для формирования смеси лекарственного средства в воздушном потоке; и ускоряют воздушный поток, выходящий из контейнера через, по меньшей мере, одно распыляющее отверстие. В данном варианте осуществления, порошковое лекарственное средство, которое проходит через распыляющие отверстия может сразу же ускоряться благодаря уменьшению площади поперечного сечения выходных отверстий в сравнении с впускным отверстием. Данное изменение скорости может дополнительно деагломерировать псевдоожиженное и аэрозолированное порошковое лекарственное средство во время ингаляции. Кроме того, из-за инерции частиц или групп частиц в псевдоожиженном лекарственном средстве, скорость частиц, выходящих из распыляющих отверстий, не является одинаковой. Воздушный поток, движущийся с большей скоростью в канале мундштука, создает касательное или сдвиговое усилие на каждой частице или группе частиц медленнее движущегося псевдоожиженного порошка, выходящего из выходного(ых) или распыляющего(их) отверстия или отверстий, что может дополнительно деагломерировать лекарственное средство.
Порошковое лекарственное средство, которое проходит через выходное(ые) или распыляющее(ие) отверстие или отверстия сразу же ускоряется благодаря уменьшению площади поперечного сечения выходных или распыляющих отверстий относительно контейнера, которые выполнены с возможностью обеспечения меньшей площади поперечного сечения, чем воздуховпускное отверстие контейнера. Данное изменение скорости может дополнительно деагломерировать псевдоожиженное порошковое лекарственное средство. Кроме того, из-за инерции частиц или групп частиц в псевдоожиженном лекарственном средстве, скорость частиц, выходящих из распыляющих отверстий, и скорость потока, проходящего через распыляющие отверстия, не является одинаковой.
В вариантах осуществления, представленных в настоящей заявке, порошок, выходящий из распыляющих отверстий, может дополнительно ускоряться, например, за счет сообщаемого изменения направления и/или скорости псевдоожиженного лекарственного средства. Направленное изменение движения псевдоожиженного порошка, выходящего из распыляющего отверстия и поступающего в канал мундштука, может происходить под углом от приблизительно 0° до приблизительно 180°, например приблизительно 90°, к оси распыляющего отверстия. Изменение скорости и направления потока может дополнительно деагломерировать псевдоожиженный порошок на протяжении воздушных каналов. Изменение направления может обеспечиваться посредством изменений геометрической конфигурации воздушного канала и/или посредством создания помехи воздушному потоку, выходящему из распыляющих отверстий, вспомогательным воздушным потоком, поступающим во впускное отверстие мундштука. Псевдоожиженный порошок в канале мундштука расширяется и теряет скорость, когда поступает в участок для захвата ртом перед выходом, вследствие увеличения площади поперечного сечения в канале. Газ, захваченный внутри агломератов, также расширяется и может способствовать разделению отдельных частиц. Данный эффект является дополнительным механизмом деагломерации в вариантах осуществления, представленных в настоящей заявке. Воздушный поток, содержащий лекарственное средство, может поступать в ротовую полость пациента и эффективно доставляться, например, в малый круг кровообращения.
Каждый из механизмов деагломерации, представленных в настоящей заявке, и часть системы ингаляции представляет многоступенчатый способ, который максимально усиливает деагломерацию порошка. Максимальную деагломерацию и доставку порошка можно обеспечить оптимизацией эффекта каждого отдельного механизма, в том числе, по меньшей мере, одного ускоряющего/замедляющего канала, силы касательного сопротивления или расширения газа, захваченного в агломератах, взаимодействий свойств порошка со свойствами компонентов ингалятора, свойствами материалов, которые являются существенными характеристиками системы настоящего ингалятора. В вариантах осуществления, представленных в настоящей заявке, ингаляторы снабжены сравнительно жесткими воздушными каналами или системой трубопроводов для максимального усиления деагломерации порошкового лекарственного средства, так что, во время многократного использования происходит стабильный выпуск порошкового лекарственного средства из ингалятора. Поскольку настоящие ингаляторы снабжены каналами, которые являются жесткими или остаются однообразными и не могут изменяться, то исключаются изменения архитектуры воздушных каналов, происходящие вследствие прокалывания пленок или отрыва пленок, связанные с известными ингаляторами, использующими блистерные упаковки.
В одном варианте осуществления обеспечен способ деагломерации порошкового препарата в системе ингаляции сухих порошков, при этом, упомянутый способ содержит следующие этапы: обеспечивают сухой порошковый препарат в контейнере, имеющем внутренний объем, для ингалятора сухого порошка; обеспечивают поступление потока в контейнер, который сформирован с возможностью направления потока для подъема, увлечения и циркуляции сухого порошкового препарата, пока порошковый препарат не будет содержать порошковые массы, достаточно малые для прохода через, по меньшей мере, одно распыляющее отверстие в мундштук. В данном варианте осуществления, способ может дополнительно содержать этап ускорения порошковых масс, увлеченных в потоке, выходящем из, по меньшей мере, одного распыляющего отверстия и поступающем в мундштук.
В вариантах осуществления, представленных в настоящей заявке, порошковое лекарственное средство стабильно дозируется из ингалятора за время меньше чем приблизительно 2 секунды. Настоящая система ингалятора имеет высокое значение сопротивления от приблизительно 0,065 до приблизительно 0,20 (√кПа)/литр в минуту. Поэтому, в системе ингаляции, содержащей картридж, максимальные перепады давления при ингаляции 2-20 кПа создают, в результате, максимальные объемные скорости потока через систему 7-70 л/мин. В некоторых вариантах осуществления, дифференциальное давление для системы ингалятора и картриджа может быть ниже 2 кПа. Приведенные объемные скорости потока обеспечивают, в результате, дозирование более чем 75% содержимого картриджа, при массовом наполнении 1-30 мг порошка или более. В некоторых вариантах осуществления, приведенные рабочие характеристики достигаются конечными пользователями за одну ингаляционную манипуляцию, с обеспечением процентного дозирования картриджа выше чем 90%. В других вариантах осуществления, приведенные рабочие характеристики достигаются конечными пользователями за одну ингаляционную манипуляцию, с обеспечением процентного дозирования картриджа, приблизительно равного 100%. В некоторых вариантах осуществления, система ингалятора и картриджа сконфигурирована с возможностью обеспечения одной дозы посредством выпуска порошка из ингалятора в виде непрерывного потока порошка, доставляемого в пациента. В некоторых вариантах осуществления, система ингаляции может быть сформирована для доставки порошка во время использования за, по меньшей мере, один импульс выпуска порошка, в зависимости от размеров частиц. В одном варианте осуществления обеспечена система ингаляции для доставки сухого порошкового препарата в легкие пациента, при этом, упомянутая система содержит ингалятор сухого порошка, сформированный с возможностью содержания проточных каналов со значением суммарного сопротивления потоку в конфигурации дозирования в диапазоне от приблизительно 0,065 до приблизительно 0,200 (√кПа)/литр в минуту. В данном и других вариантах осуществления, суммарное сопротивление потоку системы ингаляции является относительно постоянным в диапазоне дифференциальных давлений 0,5 кПа-7 кПа.
Конструктивная компоновка системы ингаляции позволяет механизму деагломерации формировать более чем 50% респирабельных фракций и частицы менее чем 5,8 мкм. Ингаляторы могут выпускать более чем 85% порошкового лекарственного средства, содержащегося в контейнере, в течение ингаляционной манипуляции. В общем, ингаляторы, изображенные на фиг. 15, могут выпускать более чем 90% содержимого картриджа или контейнера за менее чем 3 секунды при дифференциальных давлениях 2-5 кПа, при массовом наполнении в диапазоне до 30 мг.
В другом варианте осуществления, настоящие системы имеют нижний предел рабочей характеристики. Данный предел рабочей характеристики назначен с учетом ингаляции сухого порошка, описанного в настоящей заявке, когда обеспечивается медианное распределение отдельных частиц по размерам. Можно сформировать график зависимости PIP (максимального давления при вдохе) от AUC, на котором существует треугольная зона, в которой значения PIP физически невозможно обеспечить для устройства, при данных значениях AUC. Однако, приемлемую зону можно сформировать по горизонтальной и вертикальной линиям, представляющим проходной критерий. Системы ингаляции, представленные в настоящей заявке, имеют нижний предел для приемлемой рабочей характеристики PIP приблизительно 2 кПа и AUC, по меньшей мере, приблизительно 1,0, 1,1 или 1,2 кПа×сек.
В других вариантах осуществления существуют нижний предел и верхний предел для AUC. Например, AUC может изменяться в диапазоне от приблизительно 1,0 до приблизительно 15 кПа×сек, от приблизительно 1,0 до приблизительно 10 кПа×сек, от приблизительно 1,1 до приблизительно 15 кПа×сек, от приблизительно 1,2 до приблизительно 10 кПа×сек, от приблизительно 1,2 до приблизительно 15 кПа×сек или от приблизительно 1,2 до приблизительно 10 кПа×сек.
В другом варианте осуществления, удовлетворительно деагломерированные дозы сухого порошкового лекарственного средства, с использованием ингалятора сухого порошка с высоким сопротивлением, получают посредством обеспечения ингалятора сухого порошка с высоким сопротивлением, содержащего дозу сухого порошкового лекарственного средства; вдыхания через ингалятор с достаточным усилием для достижения максимального давления при вдохе, по меньшей мере, 2 кПа в течение 2 секунд; и создания площади под кривой в первую секунду (AUC0-1sec) для кривой зависимости давления при вдохе от времени, по меньшей мере, приблизительно 1,0, 1,1 или 1,2 кПа×секунду; при этом, значение VMGD (×50) испускаемого порошка меньше чем приблизительно 5 мкм. В некоторых вариантах осуществления, пациент развивает максимальное давление при вдохе не менее чем 2 кПа и не более чем 15 или 20 кПа через (2) секунды (PIP2seconds). В другом варианте осуществления, сухое порошковое лекарственное средство содержит микрочастицы с медианным размером частиц, VMGD (×50), испускаемого порошка меньше не более 1,33-кратного медианного размера частиц, когда ингалятор используют оптимальным способом. В данном и другом вариантах осуществления, оптимальное использование ингалятора пациентом является такое использование, когда пациент развивает максимальное давление при вдохе приблизительно 6 кПа через (2) секунды (PIP2seconds). Оптимальным использованием можно также считать достижение объемной скорости приблизительно 28,3 л в минуту. Аналогичным оптимальным использованием может быть использование, отражающее условия стандартных испытаний для испытаний на аэродинамический размер частиц, установленные, например, в Фармакопее США (USP)<601>.
В некоторых вариантах осуществления, вдох через ингалятор сухого порошка с высоким сопротивлением, содержащий дозу сухого порошкового лекарственного средства, выполняется пациентом с усилием (или напряжением), достаточным для достижения максимального давления при вдохе, по меньшей мере, 2 кПа в течение 2 секунд; и с созданием площади под кривой в первую секунду (AUC0-1sec) для кривой зависимости давления при вдохе от времени, по меньшей мере, приблизительно 1,0, 1,1 или 1,2 кПа×секунду; при этом, более чем 75% дозы сухого порошка выпускается или выбрасывается из ингалятора в виде частиц порошка. В некоторых вариантах осуществления, значение VMGD испускаемых частиц меньше чем приблизительно 5 микрометров.
Дозы сухого порошкового лекарственного средства, удовлетворительно деагломерированные с использованием ингалятора сухого порошка с высоким сопротивлением, можно получать посредством обеспечения ингалятора сухого порошка с высоким сопротивлением, содержащего дозу сухого порошкового лекарственного средства; вдыхания через ингалятор с достаточным усилием для достижения максимального давления при вдохе, по меньшей мере, 2 кПа в течение 2 секунд; и создания площади под кривой в первую секунду (AUC0-1sec) для кривой зависимости давления при вдохе от времени, по меньшей мере, приблизительно 1,0, 1,1 или 1,2 кПа×секунду; при этом, значение VMGD (×50) испускаемого порошка меньше чем приблизительно 5 мкм. В другом варианте осуществления, сухое порошковое лекарственное средство содержит микрочастицы с медианным размером частиц, VMGD (×50), испускаемого порошка не более 1,33-кратного медианного размера частиц, когда ингалятор используют оптимальным способом.
Хотя настоящее описание относится, главным образом, к ингаляторам, приводимым в действие вдохом, в некоторых вариантах осуществления, ингалятор может быть снабжен источником для формирования дифференциального давления, необходимого для деагломерации и доставки сухого порошкового препарата. Например, ингалятор может быть адаптирован к источнику движущего газа, например, источнику энергии, накопленной сжатым газом, например, из баллона с азотом, который может быть обеспечен на воздуховпускных отверстиях. Чтобы пациент мог производить вдох с удобной скоростью, можно обеспечить промежуточную деталь для улавливания струи.
В вариантах осуществления, представленных в настоящей заявке, ингалятор может быть обеспечен в виде многократно используемого ингалятора или ингалятора одноразового использования. В альтернативных вариантах осуществления, аналогичный принцип деагломерации можно применить к многодозовым ингаляторам, при этом, ингалятор может содержать множество, например, конструкций типа картриджей в одной кассете, и, при необходимости, можно задавать одну дозу. В модификациях данного варианта осуществления, многодозовый ингалятор может быть сформирован с возможностью обеспечения достаточного числа доз, например, для запаса лекарственного средства на день, неделю или месяц. В многодозовых вариантах осуществления, представленных в настоящей заявке, оптимизируется удобство для конечного пользователя. Например, в прандиальных режимах, дозирование во время завтрака, обеда и ужина обеспечивается системой, сформированной с возможностью обеспечения дозирования в течение 7-дневного курса одним устройством. Дополнительное удобство конечного пользователя обеспечивается системой, сформированной с индикаторным механизмом, который указывает день и дозирование, например, день 3 (D3), обеденное время (L).
В одном варианте осуществления, сухое порошковое лекарственное средство может содержать, например, дикетопиперазин и фармацевтически активный ингредиент. В данном варианте осуществления, фармацевтически активный ингредиент или активное средство может быть любого типа, в зависимости от заболевания или состояния, которое должно лечиться. В другом варианте осуществления дикетопиперазин может содержать, например, симметричные молекулы и асимметричные дикетопиперазины, находящие применение при формировании частиц, микрочастиц, и т.п., которые можно применять в качестве систем-носителей для доставки активных средств к заданным локализациям в организме. Термин «активное средство» упоминается в настоящей заявке как терапевтическое средство или молекула, например, белковая или пептидная, или биологическая молекула, подлежащая инкапсуляции, связыванию, присоединению, комплексированию или захвату внутрь дикетопиперазинового препарата, или адсорбции на нем. С дикетопиперазином можно объединять любую форму активного средства. Система доставки лекарств можно применять для доставки биологически активных средств, имеющих терапевтическую, профилактическую или диагностическую активность.
Один класс средств для доставки лекарств, которые применяли для получения микрочастиц, которые устраняют проблемы в области фармацевтики, например, нестабильность и/или плохое всасывание лекарств, представляет собой 2,5-дикетопиперазины. 2,5-Дикетопиперазины представлены соединением с нижеприведенной общей формулой 1, где атомы E1 и E2 в позициях 1 и 4 являются либо O или N для создания замещенных аналогов дикетоморфолина и дикетодиоксана соответственно, и, по меньшей мере, одна из боковых цепей R1 и R2, расположенных в позициях 3 и 6 соответственно, содержит карбоновокислотную (карбоксильную) группу. Соединения, соответствующие формуле 1, содержат, без ограничения, дикетопиперазины, дикетоморфолины и дикетодиоксаны и их замещенные аналоги.
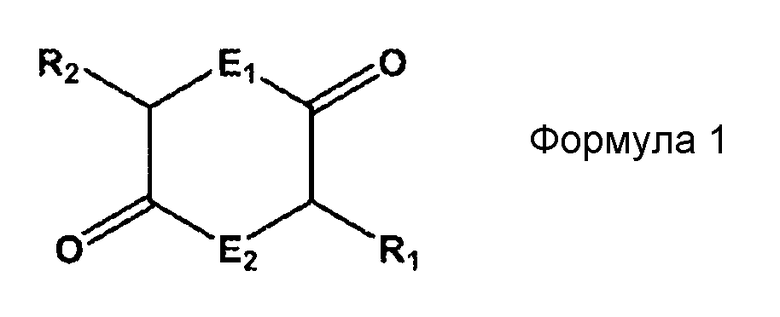
В контексте настоящего описания, «дикетопиперазин» или «DKP» содержит дикетопиперазины и фармацевтически допустимые соли, их дериваты, аналоги и модификации, охватываемые областью определения общей формулы 1.
Упомянутые 2,5 дикетопиперазины, как показано, пригодны для доставки лекарств, в частности, лекарств, содержащих кислотные группы R1 и R2 (смотри например, патенты США №№ 5,352,461, «Self Assembling Diketopiperazine Drug Delivery System»; 5503852, «Method For Making Self-Assembling Diketopiperazine Drug Delivery System»; 6071497 «Microparticles For Lung Delivery Comprising Diketopiperazine»; и 6331318 «Carbon-Substituted Diketopiperazine Drug Delivery System», каждый из которых включен в настоящую заявку путем отсылки, в полном объеме информации, которую содержит патент в отношении дикетопиперазинов и доставки лекарств при посредстве дикетопиперазина. Дикетопиперазины можно формировать в виде микрочастиц, адсорбирующих лекарство. Данная комбинация лекарства и дикетопиперазина может придавать повышенные характеристики стабильности и/или всасывания лекарства. Упомянутые микрочастицы можно вводить различными способами введения. В виде сухих порошков упомянутые микрочастицы можно доставлять ингаляцией в конкретные области дыхательной системы, в том числе, легкие.
Фумарил дикетопиперазин (бис-3,6-(N-фумарил-4-аминобутил)-2,5-дикетопиперазин; FDKP) является одним из предпочтительных дикетопиперазинов для респираторных применений:
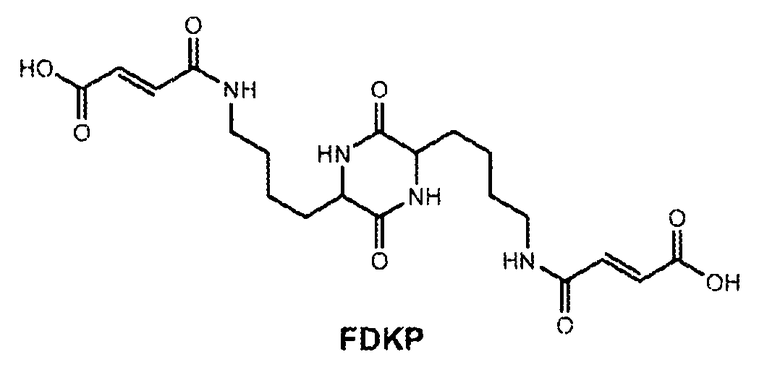
Соединение FDKP обеспечивает полезную матрицу микрочастиц, поскольку данное соединение является слаборастворимым в кислоте, но легко растворяется при нейтральных или основных уровнях pH. Данные свойства позволяют соединению FDKP кристаллизоваться в кислотных условиях, и кристаллы осуществляют самосборку с образованием частиц. Частицы легко растворяются в физиологических условиях, когда уровень pH является нейтральным. В одном варианте осуществления, микрочастицы, описанные в настоящей заявке, являются микрочастицами соединения FDKP, нагруженными активным средством, например, инсулин.
Соединение FDKP является хиральной молекулой, имеющей транс- и цис-изомеры относительно расположения заместителей на замещенных атомах углерода дикетопиперазинового кольца. Как изложено в опубликованной заявке на патент США № 2010/0317574, «Diketopiperazine microparticles with defined isomer contents», более надежные аэродинамические характеристики и стабильность морфологии частиц можно получать путем ограничения содержания изомера до приблизительно 45-65% транс-изомера. Соотношение изомеров может регулировать при синтезе и рекристаллизации молекулы. Влияние основания способствует эпимеризации кольца, приводящей к рацемизации, например, во время удаления защитных групп с конечных карбоксильных групп. Однако увеличение содержания метанола в растворителе на данном этапе приводит к увеличению содержания транс-изомера. Транс-изомер является менее растворимым чем цис-изомеры, и регулировку температуры и композиции растворителя во время рекристаллизации можно применять для увеличения или уменьшения содержания транс-изомера на данном этапе.
Микрочастицы, имеющие диаметр от приблизительно 0,5 до приблизительно 10 микрометров, могут достигать легких, с уверенным проходом через большинство естественных барьеров. Диаметр менее чем приблизительно 10 микрометров необходим для прохождения изгиба гортани, и диаметр не менее чем приблизительно 0,5 микрометров необходим для предотвращения выдыхания частиц. Микрочастицы дикетопиперазина с удельной поверхностью (SSA) от приблизительно 35 до приблизительно 67 м2/г имеют характеристики, полезные для доставки лекарств в легкие, например, повышенные аэродинамические характеристики и улучшенное всасывание лекарств.
Как поясняется в публикации PCT № WO2010144789, «Diketopiperazine microparticles with defined specific surface areas», распределение размеров и форма кристаллов соединения FDKP зависят от баланса между образованием центров кристаллизации новых кристаллов и ростом существующих кристаллов. Оба явления сильно зависят от концентраций и перенасыщения в растворе. Характеристический размер кристалла соединения FDKP является показателем относительных скоростей образования центров кристаллизации и роста. Когда преобладает образование центров кристаллизации, образуется много кристаллов, но они являются относительно мелкими, поскольку все данные кристаллы конкурируют за соединение FDKP в растворе. Когда преобладает рост, то имеется меньше конкурирующих кристаллов, и характеристический размер кристаллов больше.
Кристаллизация сильно зависит от перенасыщения, которое, в свою очередь, сильно зависит от концентрации компонентов в потоках исходных материалов. Более высокое перенасыщение соответствует образованию множества мелких кристаллов; пониженное перенасыщение дает меньшее количество кристаллов большего размера. В переводе на перенасыщение: 1) увеличение концентрации соединения FDKP повышает перенасыщение; 2) повышение концентрации аммиака сдвигает систему к более высоким уровням pH, повышает равновесную растворимость и снижает перенасыщение; и 3) повышение концентрации уксусной кислоты повышает перенасыщение посредством сдвига конечной точки к меньшим уровням pH, при которых равновесная растворимость ниже. Снижение концентраций упомянутых компонентов оказывает противоположное действие.
Температура влияет на образование микрочастиц соединения FDKP посредством влияния на растворимость соединения FDKP и на кинетику образования центров кристаллизации и роста кристаллов соединения FDKP. При низких температурах образуются мелкие кристаллы с большой удельной поверхностью. Суспензии данных частиц характеризуются высокой вязкостью, указывающей на сильное притяжение между частицами. Диапазон температур от приблизительно 12°C до приблизительно 26°C обеспечивает частицы с приемлемыми (или лучшими) аэродинамическими характеристиками для различных систем ингаляторов, в том числе, системы ингаляторов, предложенные в настоящей заявке.
Упомянутые настоящие устройства и системы полезны при легочной доставке порошков с широким набором характеристик. Варианты осуществления настоящего изобретения содержат системы, содержащие ингалятор, неразъемный или устанавливаемый картридж с унифицированной дозой, и порошок с заданной(ыми) характеристикой(ами), и обеспечивающие улучшенный или оптимальный диапазон рабочих характеристик. Например, устройства составляют эффективный механизм деагломерации и, следовательно, могут эффективно доставлять когезионные порошки. Данное решение отличается от метода, используемого множеством других специалистов, которые пробовали разрабатывать системы ингаляции сухих порошков на основе частиц с оптимизированными подвижностью и потоком (смотри, например, патенты США №№ 5997848 и 7399528, заявку на патент США № 2006/0260777; и публикацию Ferrari et al. AAPS PharmSciTech 2004; 5(4) Article 60). Таким образом, варианты осуществления содержат системы плюс когезионный порошок.
Когезионную способность порошка может оценивать в зависимости от его подвижности или соотносить с оценками формы и нерегулярности, например, неровности. Как изложено в Фармакопее США USP 29, 2006, раздел 1174, в области фармации обычно используют четыре метода для оценки подвижности порошков: угол откоса; индекс сжимаемости (Карра) и отношение Хауснера; поток через диафрагму и способы сдвиговых ячеек. Для последних двух методов не разработано общих шкал из-за различий в методологии. Метод потока через диафрагму можно применять для измерения объемной скорости потока или, в качестве альтернативы, для определения критического диаметра, который допускает протекание. Соответствующими переменными параметрами являются форма и диаметр проходного отверстия диафрагмы, диаметр и высота слоя порошка и материал, из которого изготовлено устройство. Устройства сдвиговых ячеек содержат цилиндрические, кольцевые и планарные разновидности и обеспечивают высокую степень регулирования эксперимента. Для любого из данных двух способов решающее значение имеет характеристика оборудования и методологии, но, несмотря на отсутствие общих шкал, данные способы успешно применяют для обеспечения качественных и относительных характеристик подвижности порошка.
Угол откоса определяют как угол, принимаемый конусообразной грудой материала относительно горизонтального основания, на который насыпан данный материал. Отношение Хауснера отношением неустановившегося объема к утрамбованному объему (то есть, объему после того, как трамбование больше не изменяет объем), или, в качестве альтернативы, утрамбованную плотность, деленную на объемную плотность. Индекс сжимаемости (CI) можно вычислять из отношения Хауснера (HR) по формуле
Cl=100×(1-(1/HR))
Несмотря на некоторый разброс экспериментальных способов, для угла откоса, индекса сжимаемости и отношения Хауснера опубликованы обычно принятые шкалы характеристик сыпучести (Carr, RL, Chem. Eng. 1965, 72: 163-168).
Код Ассоциации производителей конвейерного оборудования (CEMA) обеспечивает несколько отличную характерику угла откоса.
Порошки с характеристикой сыпучести в соответствии с вышеприведенной таблицей, которая является очень высокой или высокой, можно охарактеризовать с точки зрения когезионной способности как некогезионные или минимально когезионные, и порошки с меньшей сыпучестью можно охарактеризовать как когезионные, и дополнительно разделять их на умеренно когезионные (соответствующие средней или удовлетворительной характеристике сыпучести) и высококогезионные (соответствующие любой степени низкой характеристики сыпучести). При оценке угла откоса с помощью шкалы CEMA, порошки с углом откоса ≥30° можно считать когезионными, а порошки, у которых данный угол ≥40°, можно считать высококогезионными. Порошки в каждом из этих диапазонов или их комбинаций составляют аспекты отдельных вариантов осуществления настоящего изобретения.
Когезионную способность можно также соотносить с неровностью, являющейся показателем нерегулярности поверхности частиц. Неровность является отношением фактической удельной поверхности частицы к удельной поверхности эквивалентной сферы:
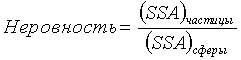
Способы прямого измерения неровности, например, воздушная пермеаметрия, также известны в технике. Неровность не менее 2 ставили в соответствие с повышенной когезионной способностью. Следует учитывать, что размер частиц также влияет на сыпучесть так, что более крупные частицы (например, с размером порядка 100 микрометров) могут иметь приемлемую сыпучесть, несмотря на несколько увеличенную неровность. Однако, в случае частиц, пригодных для доставки в глубину легкого, например, частиц с преимущественным диаметром частиц 1-3 микрометров, даже умеренно повышенная неровность, составляющая 2-6, может оказаться когезионной. Высококогезионные порошки могут иметь неровности ≥ 10 (смотри нижеприведенный пример A).
Многие из нижеприведенных примеров предусматривают использование сухих порошков, содержащих соединение FDKP. Составляющие микрочастицы представляют собой полученные самосборкой агрегаты кристаллических пластинок. Порошки, состоящие из частиц с пластинчатыми поверхностями, как известно, обладают, в общем, низкой сыпучестью, то есть, данные порошки являются когезионными. В действительности, гладкие сферические частицы обладают, как правило, наиболее высокой сыпучестью, при этом, сыпучесть, как правило, снижается, когда частицы становятся продолговатыми, имеют острые края, становятся по существу двухмерными и приобретают нерегулярную форму, имеют нерегулярные, взаимно зацепляющиеся формы или являются волокнистыми. Хотя ограничения нежелательны, однако, авторы настоящей заявки подразумевают, что кристаллические пластинки микрочастиц соединения FDKP могут располагаться чередующимися слоями и взаимно зацепляться, что повышает когезионную способность (свойство, обратное сыпучести) рассыпных порошков, содержащих упомянутые частицы, и дополнительно затрудняет агломерацию порошка в сравнении с менее когезионными порошками. Кроме того, факторы, влияющие на структуру частиц, могут влиять на аэродинамические характеристики. Как показали наблюдения, когда удельная поверхность частиц превышает некоторое пороговое значение, аэродинамические характеристики частиц, измеряемые в виде респирабельной фракции, обычно, ухудшаются. Кроме того, соединение FDKP содержит два хиральных атома углерода в пиперазиновом кольце, и поэтому боковые группы N-фумарил-4-аминобутила могут быть в цис- или транс-конфигурациях по отношению к плоскости кольца. Как показали наблюдения, когда отношение транс-/цис- в соединении FDKP, используемого при получении микрочастиц, отклоняется от оптимального диапазона, содержащего рацемическую смесь, респирабельная фракция уменьшается, а, при больших отклонениях от предпочтительного диапазона, морфология частиц при наблюдении с помощью SEM (сканирующего электронного микроскопа) становится заметно отличающейся. Таким образом, варианты осуществления настоящего изобретения содержат системы устройства, плюс дикетопиперазиновые порошки с удельными поверхностями в предпочтительных диапазонах, и устройства, плюс порошки соединения FDKP с отношениями транс-/цис-изомеров в предпочтительных диапазонах.
Микрочастицы соединения FDKP, немодифицированные или содержащие лекарство, например, инсулин, образуют высококогезионные порошки. По данным измерений, микрочастицы соединения FDKP характеризуются отношением Хауснера 1,8, индексом сжимаемости 47% и углом откоса 40°. По данным измерений, инсулин, заложенный в микрочастицы соединения FDKP (инсулин TECHNOSPHERE®; TI; MannKind Corporation, Valencia, CA), характеризуется отношением Хауснера 1,57, индексом сжимаемости 36% и углом откоса 50°±3°. Кроме того, при испытании на критической диафрагме получена оценка, что, для образования потока под действием силы тяжести потребуется диаметр проходного отверстия диафрагмы порядка 2-3 футов (60-90 см) (в предположении высоты слоя 2,5 футов; повышение давления увеличивало размер необходимого диаметра). В подобных условиях подвижный порошок будет нуждаться в диаметре проходного отверстия диафрагмы только порядка 1-2 см (Taylor, M.K. et al. AAPS PharmSciTech t, art. 18).
Соответственно, в одном варианте осуществления, настоящая система ингаляции содержит ингалятор сухого порошка, и обеспечен контейнер для дегломерации когезионного порошка, содержащий когезионный сухой порошок с индексом Кара в диапазоне 16-50. В одном варианте осуществления, сухой порошковый препарат содержит дикетопиперазин, в том числе, соединение FDKP и пептид или белок, содержащий эндокринный гормон, например, инсулин, GLP-1, паратироидный гормон, оксинтомодулин и другие, упомянутые в настоящем описании.
Микрочастицы, имеющие диаметр от приблизительно 0,5 до приблизительно 10 микрометров могут достигать легких, с уверенным проходом через большинство естественных барьеров. Диаметр менее чем приблизительно 10 микрометров необходим для прохождения изгиба гортани, и диаметр не менее чем приблизительно 0,5 микрометров необходим для предотвращения выдыхания частиц. Варианты осуществления, представленные в настоящей заявке, показывают, что микрочастицы с SSA (удельной поверхностью) от приблизительно 35 до приблизительно 67 м2/г имеют характеристики, полезные для доставки лекарств в легкие, например, повышенные аэродинамические характеристики и улучшенное всасывание лекарств.
В настоящем описании упоминаются также микрочастицы соединения FDKP, обладающие отношением отдельных транс-изомеров от приблизительно 45 до приблизительно 65%. В данном варианте осуществления, микрочастицы обеспечивают повышенную подвижность.
В одном варианте осуществления предлагается система для доставки вдыхаемого сухого порошка, при этом, упомянутая система содержит: a) когезионный порошок, содержащий лекарственное средство, и b) ингалятор, содержащий камеру, ограничивающую внутренний объем для вмещения порошка, причем, камера содержит газовпускное отверстие и газовыпускное отверстие, причем, впускное отверстие и выпускное отверстие расположены так, что газ, втекающий во внутренний объем через впускное отверстие, направляется в виде газового потока к выпускному отверстию. В одном варианте осуществления, система пригодна для деагломерации когезионного порошка с индексом Кара 18-50. Система может быть также пригодной для доставки порошка, когда когезионный порошок имеет угол откоса 30°-55°. Когезионный порошок может характеризоваться критическим размером проходного отверстия диафрагмы ≤3,2 футов (98 см) для потока через воронку или ≤2,4 футов (73 см) для массового потока, при неровности >2. Примерные частицы когезионного порошка содержат частицы, содержащие кристаллы соединения FDKP, при этом, отношение изомеров транс/цис соединения FDKP находится в диапазоне 50%-65%.
В другом варианте осуществления, система ингаляции может содержать ингалятор, содержащий мундштук, и, при создании в ингаляторе перепада давлений ≥2 кПа, может формировать струи частиц, которые испускаются из мундштука, в которых 50% испускаемых частиц имеют значение VMGD≤10 микрометров, причем, 50% испускаемых частиц имеют значение VMGD ≤8 микрометров, или в которых 50% испускаемых частиц имеют значение VMGD ≤4 микрометров.
В еще одном варианте осуществления предлагается система доставки вдыхаемого сухого порошка, при этом, упомянутая система содержит: a) сухой порошок, содержащий частицы, состоящие из кристаллов соединения FDKP, в котором отношение изомеров транс/цис соединения FDKP находится в диапазоне 50%-65%, и лекарственное средство; и b) ингалятор, содержащий камеру, вмещающую порошок, причем, камера содержит газовпускное отверстие и газовыпускное отверстие; и корпус, в котором следует устанавливать камеру, и который определяет границы двух путей движения потока, первый путь движения потока, допускающий поступление газа в газовпускное отверстие камеры, второй путь движения потока, позволяющий газу обходить газовпускное отверстие камеры; причем, поток, обходящий газовпускное отверстие камеры, направляется в столкновение с потоком, выходящим из камеры, по существу, перпендикулярно направлению потока из газовыпускного отверстия.
В некоторых вариантах осуществления предлагается система для доставки вдыхаемого сухого порошка, при этом, система содержит: a) сухой порошок, содержащий частицы, состоящие из кристаллов соединения FDKP, в котором микрочастицы имеют значение SSA от приблизительно 35 до приблизительно 67 м2/г, что обеспечивает характеристики, выгодные для доставки лекарств в легкие, например, повышенные аэродинамические характеристики и улучшенное всасывание лекарств на один миллиграмм, и лекарственное средство; и b) ингалятор, содержащий камеру, вмещающую порошок, причем, камера содержит газовпускное отверстие и газовыпускное отверстие; и корпус, в котором следует устанавливать камеру, и который определяет границы двух путей движения потока, первый путь движения потока, допускающий поступление газа в газовпускное отверстие камеры, второй путь движения потока, позволяющий газу обходить газовпускное отверстие камеры; причем, поток, обходящий газовпускное отверстие камеры, направляется в столкновение с потоком, выходящим из камеры, по существу, перпендикулярно направлению потока из газовыпускного отверстия.
Предлагается также система для доставки вдыхаемого сухого порошка, при этом, упомянутая система содержит: a) сухой порошок, содержащий лекарственное средство, и b) ингалятор, содержащий картридж, вмещающий порошок, причем, картридж содержит газовпускное отверстие и газовыпускное отверстие, и корпус, в котором следует устанавливать картридж, и который определяет границы двух путей движения потока, первый путь движения потока, допускающий поступление газа в газовпускное отверстие картриджа, второй путь движения потока, позволяющий газу обходить газовпускное отверстие камеры, и мундштук, и, при создании в ингаляторе перепада давлений ≥2 кПа, из мундштука испускается струя частиц, в которой 50% испускаемых частиц имеют значение VMGD ≤10 микрометров, причем, поток, обходящий газовпускное отверстие картриджа, направляется в столкновение с потоком, выходящим из камеры, по существу, перпендикулярно направлению потока из газовыпускного отверстия.
Активные средства для использования в композициях и способах, представленных в настоящей заявке, могут содержать любое фармацевтическое средство. Упомянутые средства могут содержать, например, синтетические органические соединения, в том числе, вазодилататоры, молекулы вазоконстрикторов, аналоги нейротрансмиттеров, антагонисты нейротрансмиттеров, стероиды, антиноцицептивные средства, пептиды и полипептиды, полисахариды и другие сахара, липиды, молекулы неорганических соединений и нуклеиновых кислот, обладающие терапевтическим, профилактическим или диагностическим действиями. Пептиды, белки и полипептиды являются цепями аминокислот, связанных пептидными связями.
Примеры активных средств, которые могут быть доставлены в заданный орган или место в организме с использованием дикетопиперазиновых препаратов, содержат гормоны, антикоагулянты, иммуномодулирующие средства, вакцины, цитотоксичные средства, антибиотики, вазоактивные средства, нейроактивные средства, анестетики или седативные средства, стероидные молекулы, например, глюкокортикоиды, в том числе, флутиказон, будезонид, мометазон, циклезонид, флунизолид, бетаметазон и триамцинолон, деконгестанты, антивирусные средства, антисмысловые средства, антигены и антитела. В частности, данные соединения содержат инсулин, гепарин (в том числе, низкомолекулярный гепарин), кальцитонин, фельбамат, суматриптан, паратироидный гормон и их активные фрагменты, гормон роста, эритропоэтин, AZT (азотимидин), DDI (диданозин), фактор, стимулирующий образование колоний макрофагов - гранулоцитов (GM-CSF), ламотригин, фактор высвобождения хорионического гонадотропина, люлиберин, бета-галактозидаза, экзендин, вазоактивный интестинальный пептид, аргатробан, малые молекулы, в том числе, противоопухолевые и ингибиторы или аналоги клеточных рецепторов, например, нейрорецепторы, в том числе, антиноцицептивные средства; триптаны, в том числе, Суматриптана сукцинат, Альмотриптана малат, Ризатриптана бензоат, Зольмитриптан, Элетриптана гидробромид, Наратриптана гидрохлорид, β2-агонисты, например, сальбутамол, фенотерол, формотерол, тербуталин, пирбутерол, битолтерол, индакатерол и т.п., и вакцины. Антитела и их фрагменты могут содержать, без ограничения, антиген SSX-241-49 (synovial sarcoma, X breakpoint 2), анти-NY-ESO-1 (антиген, ассоциированный с раком пищевода), анти-PRAME (избирательно экспрессируемый антиген меланомы), анти-PSMA (простатоспецифический мембранный антиген), анти-Melan-A (антиген, ассоциированный с меланомой) и антитирозиназа (антиген, ассоциированный с меланомой).
В некоторых вариантах осуществления, сухой порошковый препарат для доставки фармацевтического препарата в малый круг кровообращения содержит активный ингредиент или активное средство, в том числе, пептид, белок, гормон, их аналоги или комбинации, при этом, активный ингредиент является инсулином, кальцитонином, гормоном роста, эритропоэтином, фактором, стимулирующим образование колоний макрофагов - гранулоцитов (GM-CSF), фактором высвобождения хорионического гонадотропина, люлиберин, фоллитропином (FSH), вазоактивным интестинальным пептидом, паратироидным гормоном (в том числе, гормоном околощитовидной железы (PTH) черного медведя), белком, связанным с паратироидным гормоном, глюкагоноподобным пептидом-1 (GLP-1), экзендином, оксинтомодулином, пептидом YY, интерлейкин-2-индуцируемой тирозинкиназой, тирозинкиназой Брутона (BTK), инозитол-зависимой киназой 1 (IRE1) или их аналогами, активными фрагментами, PC-DAC-модифицированными производными или O-гликозилированными формами. В отдельных вариантах осуществления, фармацевтическая композиция или сухой порошковый препарат содержит фумарил дикетопиперазин, и активный ингредиент является, по меньшей мере, каким-то одним, выбранным из инсулина, паратироидного гормона 1-34, глюкагоноподобного пептида-1 (GLP-1), оксинтомодулина, пептида YY, гепарина или их аналогов; малых молекул, в том числе, нейротрансмиттеров, производных и/или аналогов, или ингибиторов/антагонистов, антиноцицептивныв средств, например, модуляторов болевой чувствительности, лекарственных средств от головной боли, лекарств от мигрени, в том числе, вазоактивных средств, например, триптанов, и вакцин и их адьювантов; молекул иммунодепрессантов и противоопухолевых лекарств.
В одном варианте осуществления предлагается также способ самостоятельного введения сухого порошкового препарата в легкие пациента с помощью системы ингаляции сухих порошков, при этом, упомянутый способ содержит следующие этапы: получают ингалятор сухих порошков в закрытом положении, и содержащий мундштук; получают картридж, содержащий предварительно дозированную дозу сухого порошкового препарата в конфигурации удерживания; открывают ингалятор сухого порошка для установки картриджа; закрывают ингалятор для осуществления перемещения картриджа в положение дозирования; захватывают мундштук ртом и делают однократный глубокий вдох для доставки сухого порошкового препарата.
В одном варианте осуществления предлагается также способ доставки активного ингредиента, при этом, упомянутый способ содержит следующие этапы: a) обеспечивают ингалятор сухого порошка, содержащий картридж с сухим порошковым препаратом, содержащим дикетопиперазин и активное средство; и b) доставляют активный ингредиент или активное средство в пациента согласно требований лечения. Система ингаляции сухих порошков может доставлять сухой порошковый препарат, например, соединение FDKP с инсулином, содержащий более чем 50% респирабельной фракции с размерами частиц менее чем 5,8 мкм.
В еще одном дополнительном варианте осуществления предлагается способ лечения ожирения, гипергликемии, резистентности к инсулину и/или диабету. Способ содержит введение вдыхаемой сухой порошковой композиции или препарата, содержащей(щего) дикетопиперазин, имеющий формулу 2,5-дикето-3,6-ди(4-X-аминобутил)пиперазин, где X выбрано из группы, состоящей из сукцинила, глутарила, малеила и фумарила. В данном варианте осуществления, сухая порошковая композиция может содержать соль дикетопиперазина. В еще одном варианте осуществления настоящего изобретения предлагается сухая порошковая композиция, при этом, дикетопиперазин представляет собой 2,5-дикето-3,6-ди(4-фумарил-аминобутил)пиперазин, с присутствием или без фармацевтически допустимого носителя или наполнителя.
В одном варианте осуществления, система ингаляции для доставки сухого порошкового препарата в легкие пациента содержит ингалятор сухого порошка, сформированный с возможностью содержания проточных каналов с значением суммарного сопротивления потоку в конфигурации дозирования в диапазоне от 0,065 до приблизительно 0,200 (√кПа)/литр в минуту.
В одном варианте осуществления предлагается набор для ингаляции сухих порошков, содержащий вышеописанный ингалятор сухого порошка и, по меньшей мере, картридж с лекарственным средством, содержащий сухой порошковый препарат для лечения расстройства или заболевания, например, заболевание дыхательных путей, диабета и ожирения. В данном варианте осуществления, набор может содержать материалы с инструкциями для применения.
Улучшенные возможности опорожнения картриджа и деагломерации в ингаляционных системах, предложенных в настоящей заявке, способствуют повышению степени биологической доступности сухого порошкового препарата. В отдельных вариантах осуществления, сухие порошки являются дикетопиперазин-содержащие порошки. Под биологической доступностью в настоящем случае понимают нагрузку либо активным ингредиентом (например, инсулином), либо дикетопиперазином (в вариантах осуществления, относящихся к дикетопиперазиновым порошкам), получаемую в результате доставки в большой круг кровообращения пациента и, обычно оцениваемую по графику AUC зависимости концентрации от времени. Характеристики системы можно определить посредством нормирования упомянутых измерений относительно дозировки. Дозировка, используемая при нормировании нагрузки, может быть основана на заложенной или испускаемой дозе и может выражаться в унифицированной массе порошка. В качестве альтернативы, нагрузку можно нормировать относительно картриджа с конкретной заложенной массой. Каждый способ нагрузки можно дополнительно настраивать с учетом конкретного содержания дикетопиперазина или активного ингредиента конкретного препарата, то есть, нагрузку можно нормировать относительно количества активного средства или количества дикетопиперазина в заложенной или испускаемой дозе. На наблюдаемую нагрузку могут влиять переменные параметры, имеющие отношение к пациенту, например, объем текучей среды, поэтому, в различных вариантах осуществления, биологическая доступность системы будет выражена в диапазоне или в пределах.
В одном варианте осуществления, порошковый препарат может содержать микрочастицы соединения FDKP и инсулин в качестве активного средства для лечения диабета, при этом, содержание инсулина препарата может быть не менее чем 3 Ед./мг, 4 Ед./мг, 6 Ед./мг порошка. Количество инсулина или доза, подлежащая введению, может изменяться в зависимости от потребности пациента. Например, в одном варианте осуществления, одна доза для одной ингаляции может содержать до приблизительно 60 Ед. инсулина для лечения гипергликемии при диабете.
При определении физиологического действия инсулина, важным фактором является фармакокинетический профиль инсулина. При одинаковых нагрузках инсулином, введение инсулинового препарата, который обеспечивает фармакокинетический профиль, отличающееся быстро достигаемым пиком, является более эффективным при подавлении прандиальных колебаний глюкозы и высвобождения глюкозы из печени, чем введение инсулина, приводящее к медленному подъему до Cmax и отличающееся протяженным плато. Таким образом, системы ингаляции, предложенные в настоящей заявке, также обеспечивают, в результате, более эффективную доставку инсулина, при которой уровни Cmax могут быть достигнуты с использованием меньших доз инсулина в сравнении с известными системами. Другими словами, данные системы ингаляции обеспечивают нормированные Cmax более высоких доз.
ПРИМЕР 1
Измерение сопротивления и распределения потока в системе ингалятор сухого порошка - картридж
Несколько конструкций ингаляторов сухого порошка исследовали для измерения их сопротивления потоку, которое является важной характеристикой, зависящей, в частности, от геометрических параметров путей движения потоков в ингаляторах. Ингаляторы, обладающие высоким сопротивлением, требуют большего перепада давлений для получения такой же объемной скорости потока, как в ингаляторах с меньшим сопротивлением. Вкратце, для измерения сопротивления каждой системы ингалятора и картриджа, в ингаляторе создают различные объемные скорости потока, и измеряют полученные в ингаляторе давления. Упомянутые измерения можно выполнять с использованием вакуумного насоса, присоединяемого к мундштуку ингалятора, для создания перепада давлений и контроллера потока и измерителя давления для изменения потока и регистрации полученного давления. В соответствии с принципом Бернулли, когда строят график зависимости квадратного корня перепада давления от объемной скорости потока, сопротивление ингалятора представляет собой крутизну линейного участка кривой. В ходе данных экспериментов, сопротивление системы ингаляции, содержащей ингалятор сухого порошка и картридж, предложенной в настоящей заявке, измеряли в конфигурации дозирования с использованием устройства для измерения сопротивления. Конфигурация дозирования формирует путь движения воздуха через воздушные каналы ингалятора и через картридж в ингаляторе.
Поскольку разные конструкции ингаляторов характеризуются разными значениями сопротивления из-за небольших изменений геометрии их путей движения воздуха, то было выполнено несколько экспериментов для определения идеального интервала для настроек давления, предназначенных для использования с конкретной конструкцией. С учетом принципа Бернулли, устанавливающего линейную зависимость между квадратным корнем из давления и объемной скоростью потока, интервалы для оценки линейности для трех используемых ингаляторов предварительно задавали после множества испытаний, чтобы соответствующие настройки можно было использовать вместе с другими партиями ингаляторов такой же конструкции. Примерный график для ингалятора можно увидеть на фиг. 33 для системы ингаляции, изображенной на фиг. 7. График, изображенный на фиг. 33, показывает, что сопротивление системы ингаляции, изображенной на фиг. 7, можно измерять с высокой корреляцией с принципом Бернулли, при объемных скоростях потока в диапазоне от приблизительно 10 до 25 л/мин. График показывает также, что найденное сопротивление примерной системы ингаляции составляет 0,093 √кПа/л/мин. На фиг. 33 показано, что между потоком и давлением существует связь. Поэтому, когда крутизна линии графика зависимости квадратного корня из давления от потока уменьшается, т.е. системы ингаляции характеризуются меньшим сопротивлением, изменение потока при данном изменении давления становится больше. Соответственно, системы ингаляции с более высоким сопротивлением будут характеризоваться меньшим разбросом скоростей потока при данных изменений давления, обеспечиваемых пациентом с помощью системы, приводимой в действие энергией дыхания.
Данные в таблице 1 показывают результаты набора экспериментов с использованием систем ингаляции, показанных на фиг. 10 (DPI 1) и фиг. 7 (DPI 2). Для ингалятора 1 сухого порошка (DPI 1) использовали конструкцию картриджа 150, показанного на фиг. 17-21, и в ингаляторе DPI 2 использовали конструкцию картриджа 170, показанного на фиг. 22-30. Соответственно, в DPI 1 использовали картридж 1, и в DPI 2 использовали картридж 2.
В таблице 1 показано, что сопротивление испытанной системы ингаляции составляет 0,0874 и 0,0894 √кПа/л/мин соответственно с ингаляторами DPI 1 и DPI 2. Приведенные данные показывают, что сопротивление системы ингаляции потоку, частично, определяется геометрией или конфигурацией воздушных каналов в картридже.
ПРИМЕР 2
Измерения распределения размеров частиц с использованием системы ингалятора с инсулиновым препаратом
Измерения распределения размеров частиц лазерным дифракционным устройством (Helos Laser Diffraction system, Sympatec Inc.) с адаптером (по заявке на патент США № 12/727,179 компании MannKind Corp, описание которой включено в настоящую заявку путем отсылки, в части, касающейся принципов соответствующего предмета изобретения) выполняли для препарата с различными количествами в миллиграммах (мг) частиц инсулина и фумарил-дикетопиперазина, обеспеченных в системе картридж-ингалятор, описанной в настоящей заявке (ингалятор, изображенный на фиг. 1-9, с картриджем 170, изображенным на фиг. 22-30). Устройство присоединяют на одном конце к трубке, которая выполнена для согласования с измерителем расхода (TSI, Inc. модель 4043) и клапаном для регулировки давления или потока от источника сжатого воздуха. После включения лазерной системы и подготовки лазерного пучка к измерению струи, пневматический клапан приводят в действие, чтобы обеспечить возможность выпуска порошка из ингалятора. Лазерная система автоматически измеряет струю, покидающую устройство ингалятора, на основе предварительно заданных условий измерения. Система дифракции лазерного излучения приводится в действие программным обеспечением, встроенным в устройство, и работает под управлением компьютерной программы. Измерения выполняли с образцами, содержащими разные количества порошка, и из разных партий порошка. Измерения выполняли при следующих условиях:
Условия включения начала лазерных измерений: когда ≥0,6% интенсивности лазера детектируется в конкретном канале детектора;
Условия выключения лазерных измерений: когда ≤0,4% интенсивности лазера детектируется в конкретном канале детектора;
Расстояние между источником вакуума и камерой ингалятора составляет приблизительно 9,525 см.
Несколько испытаний выполнили с использованием разных количеств порошков или заложенных масс в картриджах. Картриджи использовали только один раз. Чтобы определять высвобождаемые порошковые массы, массу картриджа определяли до и после выпуска порошка из ингалятора. Измерения в устройстве производили при разных перепадах давлений и повторяли несколько раз, как показано в нижеприведенной таблице 2. После измерения порошковой струи, данные анализировали и отображали графически. В таблице 2 представлены экспериментально полученные данные, где CE означает опорожнение картриджа (выпущенный порошок) и Q3 (50%) означает геометрический диаметр 50-го процентиля интегральной функции распределения размеров частиц порошка в образце, и q3(5,8 мкм) обозначает процентную долю распределения размеров частиц с геометрическим диаметром, меньшим чем 5,8 мкм.
(5,8 мкм)
Данные в таблице 2 показали, что из системы ингаляции испускалось 92,9%-98,4% суммарной заложенной массы порошка. Кроме того, данные показывают, что, независимо от заложенной массы, 50% частиц, испускаемых из системы ингаляции имеет геометрический диаметр меньше чем 4,7 мкм, при измерении в различные моменты времени и с различными испытанными перепадами давления. Кроме того, 60%-70% испускаемых частиц имело геометрический диаметр менее чем 5,8 мкм.
На фиг. 34 представлены данные, полученные в ходе другого эксперимента, в котором использовали 10 мг заложенной порошковой массы. График показывает, что распределение частиц порошка в образце, содержащем частицы препарата, содержащего инсулин и фумарил-дикетопиперазин, приводило к тому, что 78,35% измеренных частиц имело размер частиц ≤5,8 мкм. Лазерное измерение обнаружило 37,67% оптическую концентрацию в течение 0,484 секунд измерения в вышеприведенных условиях измерения. Данные показывают, что система ингаляции эффективно деагломерирует препарат инсулина и соединения FDKP до небольших размеров в соответствующем диапазоне невысоких ингаляционных возможностей пользователя, т.е. создаваемых им перепадов давления. Предполагается, что упомянутые небольшие геометрические размеры для данного когезионного препарата (Индекс Кара =36%) должны обеспечивать его респирабельность.
ПРИМЕР 3
Измерение выпуска порошка из картриджа в качестве показателя эффективности системы ингаляции
Эксперименты выполняли с использованием системы ингаляции, предложенной в настоящей заявке, с использованием нескольких прототипов ингаляторов, изображенных на фиг. 1-9, с прототипами картриджа 170, изображенного фиг. 22-30. С каждым ингалятором использовали несколько картриджей. Каждый картридж взвешивали на электронных весах перед заполнением. Картриджи заполняли предварительно заданной массой порошка, снова взвешивали, и каждый заполненный картридж помещали в ингалятор и испытывали на эффективность опорожнения порошкового препарата, т.е. партий порошка инсулина TECHNOSPHERE® (инсулина и соединения FDKP; как правило, 3 Ед.-4 Ед. инсулина/мг порошка, приблизительно 10-15 масс% инсулина). Для определения характеристик стабильности рабочих характеристик применяли несколько перепадов давлений. Таблица 3 представляет результаты данного испытания с использованием 35 измерений высвобождения из картриджа на каждый ингалятор. В данных в таблице 3 все испытания выполняли с использованием одной и той же партии порошка инсулина клинического качества с соединением FDKP. Результаты показывают, что соответствующие перепады давления, создаваемые пользователем, находящиеся в диапазоне 2-5 кПа, обеспечивают высокоэффективное опорожнение порошка из картриджа.
ПРИМЕР 4
Измерение прогнозируемого осаждения с использованием каскадного импактора Андерсена
Эксперименты выполняли с использованием каскадного импактора Андерсена для сбора осаждений порошка на ступенчатых пластинах в течение моделируемой доставки дозы, с применением объемных скоростей потока 28,3 л/мин. Данная объемная скорость потока создавала перепад давлений в системе ингаляции (DPI (ингалятор сухого порошка) плюс картридж) приблизительно 6 кПа. Осаждения на ступенчатых пластинах анализировали гравиметрически с использованием фильтров и электронных весов. Измеренные на веса заложенные массы когезионного порошка, при заложенной массе 10 мг, 6,6 мг и 3,1 мг, оценивали с точки зрения рабочих характеристик системы ингаляции. Каждое динамическое испытание выполняли с пятью картриджами. Накопленную порошковую массу, собранную на ступенях 2-F, измеряли в соответствии с аэродинамическими размерами частиц менее чем 5,8 мкм. Отношение собранной порошковой массы к заложенному содержимому картриджа определяли и приводили в виде процентного содержания респирабельной фракции (RF) в измеренной заложенной массе. Данные представлены в таблице 4.
Данные показывают, что с несколькими партиями порошка обеспечивалось содержание респирабельной фракции в диапазоне 50%-70%. Данный диапазон представляет нормированную рабочую характеристику системы ингаляции.
Измерения рабочих характеристик системы ингалятора повторяли 35 раз с другим картриджем. Заложенную массу (мг) и время выпуска (в секундах) измеряли для каждой использованной системы ингалятора и картриджа. Кроме того, измеряли также процентное содержание респирабельной фракции, т.е. частиц, пригодных для легочной доставки, в порошке. Результаты представлены в нижеприведенной таблице 4. В данной таблице, % отношение RF/закладка равно процентному содержанию в порошке частиц, имеющих размер (≤5,8 мкм), которые будут проходить в легкие; CE означает опорожнение картриджа или доставляемый порошок; RF означает респирабельную фракцию. В таблице 4, испытания №№ 1-10 выполняли с использованием второй партии порошка инсулина клинического качества с соединением FDKP, но при испытаниях порошка №№ 11-17 использовали такой же порошок, как при испытаниях, проводимых и представленных в таблице 3.
доставка
Вышеприведенные данные показывают, что настоящая система ингаляции, содержащая ингалятор сухого порошка и картридж, вмещающий когезионный порошок, т.е. инсулин TECHNOSPHERE® (частицы соединения FDKP, содержащие инсулин), может выпускать, фактически, почти все порошковое содержимое, так как, при переменных заложенных массах и перепадах давления, обеспечивалась стабильная и высокая степень опорожнения больше чем 85% и, в большинстве случаев, больше чем 95% от суммарного порошкового содержимого картриджа. Измерения методом соударений каскада Андерсена показали, что больше чем 50% частиц находятся в респирабельном диапазоне, в котором частицы меньше чем 5,8 мкм, и составляют 53,5%-73% от суммарного испускаемого порошка.
ПРИМЕР 5
Неровность инсулина TECHNOSPHERE (TI)
Неровность является отношением фактической удельной поверхности частицы к удельной поверхности эквивалентной сферы. Удельная поверхность сферы равна:
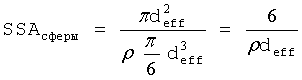
где deff=1,2 мкм равен взвешенному по поверхности диаметру частиц TI по результатам лазерных дифракционных измерений с использованием системы Sympatec/RODOS.
Поэтому, средняя сфера с такой же плотностью, как матрица частицы TI (1,4 г/см3) будет иметь значение SSA
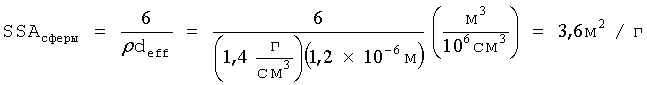
Таким образом, для частиц TI с удельной поверхностью (SSA) приблизительно 40 м2/г
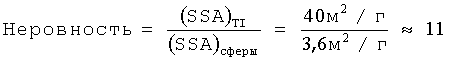
Для частиц со сходными размерами с удельной поверхностью 50 или 60 м2/г, неровность будет составлять приблизительно 14 и 16 соответственно.
ПРИМЕР 6
Анализ геометрических размеров частиц испускаемых препаратов путем определения характеристик объемного медианного геометрического диаметра (VMGD)
Лазерная дифракция на сухих порошковых препаратах, испускаемых из ингаляторов сухих порошков, представляет собой общий метод, применяемый для описания уровня деагломерации, которой подвергают порошок. Методология указывает показатель геометрического размера, вместо аэродинамического размера, который определяют с использованием стандартных промышленных методологий соударения. Обычно, геометрический размер испускаемого порошка содержит объемное распределение, характеризуемое медианным размером частиц (VMGD). Следует отметить, что геометрические размеры испускаемых частиц распознаются с более высоким разрешением в сравнении с аэродинамическими размерами, обеспечиваемыми способами соударения. Меньшие размеры являются предпочтительными и приводят к более высокой вероятности доставки отдельных частиц в дыхательные пути. Таким образом, различия деагломерации в ингаляторе и конечных рабочих характеристик можно легче различать с помощью дифракции. В ходе данных экспериментов, ингалятор, упомянутый в примере 3, и известный ингалятор испытывали с использованием лазерной дифракции при давлениях, подобных фактическим дыхательным возможностям пациента, для определения эффективности деагломерации порошковых препаратов в системе ингаляции. В частности, препараты содержали когезионные порошки дикетопиперазина с наличием или без заложенного активного ингредиента инсулина. Данные порошковые препараты обладали характеристическими удельными поверхностями, отношениями изобмеров и индексами Карра. В таблице 5 представлены значения VMGD и эффективность опорожнения контейнера во время испытания. Порошки соединения FDKP обладают индексом Кара около 50, и порошок TI имеет индекс Кара около 40.
Данные, приведенные в таблице 5, показывают совершенствование деагломерации порошка системой ингалятора, представленной в настоящей заявке, в сравнении с известной системой ингалятора. Препараты дикетопиперазина с удельными поверхностями в диапазоне 14-56 м2/г показали эффективности опорожнения, превышающие 85%, и значение VMGD меньше чем 7 микрометров. Аналогично, препараты, обладающие отношением транс-изомеров в диапазоне 45-66%, показали повышенные рабочие характеристики в сравнении с известным устройством. И, наконец, как оказалось, рабочие характеристики системы ингалятора с препаратами, отличающимися индексами Карра 40-50, также повышаются в сравнении с известным устройством. Во всех случаях упоминавшиеся значения VMGD были меньше 7 микрометров.
ПРИМЕР 7
Повышение рабочих характеристик in vitro, реализованное в системе доставки сухих порошков следующего поколения
Препараты TECHNOSPHERE® эффективно доставляли в пациентов с помощью системы доставки MEDTONE® (MTDS, Mann Kind Corporation, Valencia, CA). Данная система содержит сухие порошковые препараты, предварительно дозированные в однократно используемые картриджи, вставленные в многократно используемый ингалятор MEDTONE® с высоким сопротивлением, приводимый в действие энергией дыхания. В качестве альтернативы системе MTDS была разработана усовершенствованная система доставки (ингалятор DPI 2, описанный в примере 1). Рабочие характеристики порошков in vitro для данных систем сравнивали с различными рабочими параметрами ингалятора. Для DPI 2 использовали однократный выпуск на один картридж в сравнении с двумя выпусками на один картридж в системе MEDTONE®.
В данных экспериментах применяли измерение размеров частиц методом лазерной дифракции и вышеописанную количественную оценку испускаемой массы. С новой герметичной камерой ингалятора применяли лазерный дифракционный прибор (Sympatec HELOS) для облегчения анализа порошковых струй. Картриджи MTDS опорожняли дважды для одного определения, а ингалятор DPI 2 опорожняли один раз. Системы ингаляции применяли с максимальными давлениями 4 кПа, чтобы оценить процентные показатели опорожнения порошка и объемный медианный геометрический диаметр (VMGD) с препаратами TECHNOSPHERE® (ингаляционный порошок соединения FDKP) и инсулина TECHNOSPHERE® (ингаляционный порошок FDKP-инсулина).
Результаты экспериментов приведены в таблице 6 и на фиг. 35. В общих словах, для ингалятора DPI 2, процентные показатели опорожнения порошка составляли 97,8% (FDKP-инсулин, с заложенной массой 3,5 мг; n=20), 96,8% (FDKP-инсулин, с заложенной массой 6,7 мг; n=20) и 92,6% (ингаляционный порошок соединения FDKP, с заложенной массой 10,0 мг; n=15); значения VMGD (в микрометрах) составляли 4,37, 3,69 и 6,84 соответственно. Для картриджей MTDS, процентные показатели опорожнения порошка составляли 89,9% (FDKP-инсулин, с заложенной массой 5,0 мг; n=30), 91,7% (FDKP-инсулин, с заложенной массой 10,0 мг; n=30) и 89,4% (ингаляционный порошок соединения FDKP, с заложенной массой 10,0 мг; n=30); значения VMGD (в микрометрах) составляли 10,56, 11,23 и 21,21 соответственно.
На фиг. 35 графически представлены данные, полученные посредством усреднения всех испытаний, выполненных для каждой системы ингаляции. Как показано на фиг. 35, Интегральная функция распределения частиц по размерам, при использовании MEDTONE®, с ингалятором DPI 2 меньше, чем с ингалятором MEDTONE®. При сравнении с ингалятором MEDTONE®, система ингаляции DPI 2 производит больший процент мелких частиц. Данный результат является свидетельством улучшенного механизма деагломерации, обеспеченного в системе DPI 2. Приведенные данные поддерживают клиническое использование системы DPI 2 в качестве конкурентного и усовершенствованного альтернативного решения для доставки ингаляционных порошковых препаратов с соединением FDKP. При использовании ингалятора DPI 2 повышался процентный показатель опорожнения, что дает пользователям значительное преимущество однократного выпуска на один картридж в сравнении с двумя выпусками, при использовании ингалятора MTDS. Уменьшение медианного геометрического размера частиц предполагает улучшенную деагломерацию порошка в ингаляторе DPI 2. Ниже приведена оценка клинических последствий данной улучшенной деагломерации.
(3,5 мг FDKP с инсулином)
(6,7 мг FDKP с инсулином)
(10 мг FDKP)
(5 мг FDKP с инсулином)
(10 мг FDKP с инсулином)
(10 мг FDKP)
ПРИМЕР 8
Повышение биологической доступности соединения FDKP при использовании примерного варианта осуществления системы ингаляции
Для оценки безопасности и допустимости различных массовых закладок ингаляционного порошка TECHNOSPHERE® (ингаляционный порошок соединения FDKP), доставляемого ингалятором DPI 1, упомянутом в вышеописанном примере 1, выполняли измерения с использованием системы ингаляции, т.е. ингалятора и картриджа, вмещающего различные заложенные массы сухого ингаляционного порошка, модифицированного CQLQ (опросника качества жизни при хроническом кашле), VAS (визуальной аналоговой шкалы) и максимальных потоков системы ингаляции. Для сравнения использовали систему ингалятора MEDTONE®. Эксперименты также выполняли для сбора данных с используемыми системами, чтобы оценить влияние изменения ингаляционных усилий и времени ингаляции на фармакинетику (PK) соединения FDKP, вдыхаемого в качестве ингаляционного порошка соединения FDKP через ингалятор DPI 1,
В начале исследования, пациентов контролировали и инструктировали выполнять тренировочные «короткие» и «длинные» ингаляции с использованием системы ингаляции, совмещенной с устройством измерения давления, предложенным в заявке на патент США № 12/488469, которое может регистрировать наличие дозы, испускаемой устройством во время использования. Пациента инструктировали поддерживать, во время ингаляционной манипуляции, номинальное дифференциальное давление 4-6 кПа, в сочетании с короткой ингаляцией продолжительностью 3-4 секунды или длинной ингаляции продолжительностью 6-7 секунд. Для проведения «напряженной» ингаляции, пациент обеспечивал номинальное время ингаляции приблизительно 6,5 секунд и максимальное давление 7 кПа. И, наоборот, для проведения «легкой» ингаляции, пациент обеспечивал номинальное время ингаляции приблизительно 6,5 секунд и максимальное давление 5 кПа. В соединении с устройством контроля ингаляции, выполняли гравиметрическую оценку порошковой массы, выпускаемой из картриджа. Данный подход позволял связывать ингаляционную манипуляцию во время дозирования, массу, выпускаемую из картриджа, и данные определения фармакокинетического профиля для каждого пациента.
Исследование было открытым перекрестным исследованием из 2 частей, проводимым на здоровых добровольных испытуемых. В части 1 трехфакторного, 3-периодного перекрестного исследования, 10 и 15 мг ингаляционного порошка соединения FDKP вдыхали через ингалятор DPI 1, и 10 мг вдыхали через ингалятор MEDTONE®. Десяти испытуемым вводили дозу ингаляционного порошка соединения FDKP, и выполняли измерения безопасности и допустимости (с использованием CQLQ, VAS и максимальных потоков). Для оценки фармакокинетики соединения FDPK, у испытуемых брали пробы крови перед дозированием и через 5, 10, 15, 25, 30, 60, 120, 240 и 360 минут после дозирования при каждой процедуре.
В части 2, после определения допустимости ингаляционного порошка соединения FDKP в части 1, в части 2 использовали 10 мг. Часть 2 исследования выполняли как состоящее из 2 частей, 2-факторное перекрестное исследование для оценки влияния объемной скорости потока (15 в сравнении с 30 л/мин) и времени ингаляции (3 в сравнении с 6 секундами). Для каждого проверяемого параметра (т.е. объемной скорости потока и времени ингаляции), десять испытуемых перекрестно переводили на каждый параметр, при общем числе 20 испытуемых для всех параметров. Фармакокинетику соединения FDPK оценивали для каждой процедуры по пробам крови, отобранным у испытуемых. Измерения пульмональных параметров (FEV1) выполняли до и после ингаляции ингаляционного порошка соединения FDKP. Результаты данных экспериментов показаны в таблице 7 и на фиг. 36 и 37.
Репрезентативные данные результатов экспериментов представлены в нижеприведенной таблице 7, в которой приведены среднее значение AUC0-6hr (в первые 6 часов) для соединения FDKP, измеренное для испытуемых, а также средняя Cmax (максимальная концентрация).
1, 10 мг (n=10)
На фиг. 36 изображен пример профиля для испытуемого, при использовании ингалятора DPI 1 с 10-мг дозой соединения FDKP, полученного контрольным измерительным устройством и отражающего тренировочную ингаляцию без порошка длительностью приблизительно 4 секунд и дозирующую ингаляцию длительностью приблизительно 1 секунду, с дозой порошка соединения FDKP. На фиг. 36 показано также, что гравиметрически измеренная масса, выпускаемая из картриджа, составляла 10,47 мг, что приводило к системной нагрузке испытуемого соединением FDKP, выражаемое значением AUC, равным 31,433 нг×мин/мл. Нормированное значение AUC/мг доставляемого порошка соединения FDKP составляло 3,003 нг×мин/мл на мг. На фиг. 37 представлена концентрация соединения FDKP в плазме крови, контролируемая в течение 6 часов, где показана концентрация Cmax приблизительно 270 нг/мл через приблизительно 10 мин.
Система ингаляции с ингалятором DPI 1, вмещающим 10 мг порошка соединения FDKP, доставляла почти двукратное количество соединения FDKP в кровь в сравнении ингалятором MEDTONE®, вмещающим 10 мг. Система ингаляции с ингалятором DPI 1, вмещающим, в среднем, 15 мг порошка ингаляционного порошка соединения FDKP, не доставляла дозу, пропорциональную по нагрузке, в сравнении с системой с ингалятором DPI 1, вмещающим 10 мг порошка, из-за того, что несколько отдельных испытуемых не получали достаточную нагрузку порошком, что наблюдалось как значительно более высокое стандартное отклонение. Разброс данных в части 1 экспериментов может быть обусловлен тем, что некоторые испытуемые не использовали ингаляторы в надлежащем положении во время дозирования,
Данные, полученные для дозы 10 мг с ингалятором DPI 1 при более длительной, короткой, более интенсивной или свободной ингаляции, в сравнении с системой ингалятора MEDTONE®, приведены в таблице 8. Проведенное исследование состояло из трех частей, как показано в таблице 8. Таблица 8 содержит доставку соединения FDKP в малый круг кровообращения, измеренную в форме среднего значения AUC0-∞ значений соединения FDKP, полученных во время экспериментов. Данные являются примерными данными эффективности и рабочих характеристик системы ингаляции с ингалятором DPI 1, в сравнении с системой ингалятора MEDTONE®, и показывают, что DPI 1 эффективно доставлял соединение FDKP в большой круг кровообращения приблизительно на 30% эффективнее, чем ингалятор MEDTONE®, при этом, значения для DPI 1 были в диапазоне значений AUC0-∞ 2375-5277 нг×мин/мл на мг соединения FDKP, испускаемого в препарате, для ингалятора MEDTONE® значения AUC0-∞ были в диапазоне 1465-2403 нг×мин/мл на мг соединения FDKP, испускаемого в препарате, после двух ингаляций.
Соединение FDKP, доставленное посредством DPI 1 и MT (MEDTONE) в 3 части исследования
Доставка 10 мг соединения FDKP устройством DPI 1 оказывается эффективнее, так как доставка соединения FDKP, измеряемая по значению AUC для уровня FDKP в плазме, почти, в 2 раза превосходит доставку ингалятором MEDTONE®. Доставка FDKP не зависит от времени ингаляции и усилия ингаляции. Данные показывают, что ингалятор DPI 1 обеспечивает повышенную биологическую доступность и эффективность в сравнении с ингалятором MEDTONE®, по оценкам на основании значения AUC для FDKP и влиянию изменения параметров ингаляции на значения AUC для FDKP. Концентрация Cmax для FDKP в ходе данного исследования была выше чем приблизительно 100 нг/мл с ингалятором DPI 1 (одна ингаляция) и имела меньшее значение при использовании ингалятора MEDTONE® (две ингаляции), т.е. 96±30 нг/мл.
ПРИМЕР 9
Повышение биологической доступности соединения FDKP и инсулина при использовании примерной системы ингаляции
Настоящее исследование предназначалось для оценки относительной биологической доступности различных заложенных масс ингаляционного порошка инсулина TECHNOSPHERE® (FDKP-инсулин), доставляемого системой доставки методом пульмональной ингаляции (ингалятором DPI 2) в сравнении с ингалятором MEDTONE®, при определении по фармакокинетике (PK) инсулина и соединения FDKP.
Выполнено открытое перекрестное исследование фармакокинетики (PK) (инсулина и соединения FDKP) на здоровых добровольных испытуемых. Поправки на C-пептид применяли для определения относительных количеств инсулина, доставляемого ингаляцией, в сравнении с инсулином эндогенного происхождения. Двадцать четыре испытуемых (по 12 в ветви) принимали дозу 6,7 мг и 7,3 мг ингаляционного порошка FDKP-инсулина (20 Ед. и 22 Ед. инсулина соответственно и приблизительно 10 масс.% инсулина), с использованием ингалятора DPI 2, и 10 мг ингаляционного порошка FDKP-инсулина (30 Ед. инсулина), с использованием ингалятора MEDTONE®. Затем, 12 испытуемым давали 20 Ед. посредством ингалятора DPI 2 или 30 Ед. посредством ингалятора MEDTONE®, в 3-факторной перекрестной ветви исследования. Пробы крови от испытуемых брали перед дозированием и через 7, 15, 30, 60, 120, 240 и 360 минут после дозирования, чтобы оценить фармакинетику соединения FDPK при каждой процедуре.
Данные показывают, что 20 Ед. или 22 Ед. инсулина, при использовании ингалятора DPI 2, обеспечивали нагрузки инсулином и соединением FDKP, аналогичные нагрузкам от 30 Ед. инсулина, введенного ингалятором MEDTONE®. Для инсулина, результаты нагрузок плазмы (AUC0-2hr) составляли 3407±1460 мкЕд.×мин/мл против 4,154±1,682 мкЕд.×мин/мл для 20 Ед. с ингалятором DPI 2 и 30 Ед. с ингалятором MEDTONE® соответственно и 4,661±2,218 мкЕд.×мин/мл против 3,957±1,519 мкЕд.×мин/мл с ингалятором DPI 2, вмещающим 22 Ед., и ингалятором MEDTONE®, вмещающим 30 Ед. соответственно. В 3-факторной перекрестной ветви, инсулиновые нагрузки плазмы составляли 4,091+1,189 мкЕд.×мин/мл и 3,763±1,652 мкЕд.×мин/мл для ингаляторов DPI 2 и MEDTONE® соответственно.
Результаты 3-факторного исследования показывали также снижение Tmax для инсулина с 20,8+18,7 минут с ингалятором MEDTONE® до 14,8±8,94 минут с ингалятором DPI 2 (20 Ед.) и до 13,6±4,3 минут с использованием системы DPI 2 (22 Ед.). Во время 3-факторного перекрестного исследования, при котором 6,7 мг соединения FDKP-инсулина доставляли ингалятором DPI 2 в сравнении с 10,0 мг порошка соединения FDKP-инсулина, доставляемого ингалятором MEDTONE®, нагрузки плазмы соединением FDKP (AUC0-2hr), нормированные для доставленной массы, составляли 2,059 нг×мин/мл/мг (среднее значение для доз 16 испытуемых) для ингалятора DPI 2, в сравнении с 1,324 нг×мин/мл/мг для ингалятора MEDTONE® (среднее значение для доз 17 испытуемых). В данном примерном варианте осуществления, исследования биологической доступности проводили с приблизительно 10% содержанием инсулина в порошковом препарате. Соответственно, более высокие показатели биологической доступности (не нормированные по порошковому содержимому) могут быть получены обеспечением более высокой концентрации инсулина, и аналогичные результаты могут быть обеспечены с другими активными ингредиентами. Аналогично, препараты с более высоким содержанием активного ингредиента будут характеризоваться меньшими показателями биологической доступности соединения FDKP (не нормированными по порошковому содержимому).
В общих словах, по результатам измерения инсулиновых нагрузок плазмы, ингалятор DPI 2 эффективнее производил доставку инсулина, чем ингалятор MEDTONE®, система ингалятора DPI 2 с 20 Ед. инсулина обеспечивала такие же инсулиновые нагрузки, как ингалятор MEDTONE® с 30 Ед. инсулина.
Дополнительные результаты вышеприведенных экспериментов представлены в нижеприведенных таблицах. Исследование, описанное в вышеприведенном примере, проводили в виде двух дополнительных частей. Во второй части настоящего исследования, испытуемым давали дозу 10 Ед. инсулина в сухом порошковом препарате соединения FDKP, с использованием ингалятора DPI 2, или 15 Ед. инсулина в соединении FDKP, с использованием системы ингаляции MEDTONE®, в 3-й части настоящего исследования, испытуемым давали дозу 20 Ед. инсулина в препарате соединения FDKP, с использованием ингалятора DPI 2, или 30 Ед. с использованием ингалятора MEDTONE®, 3-факторным перекрестным способом. Концентрацию инсулина в крови измеряли, и результаты анализировали и оценивали.
Нагрузки плазмы инсулином и соединением FDKP (AUC0-2hr), достигнутые с испытуемыми с использованием ингалятора DPI 2 с 20 Ед., сходны с нагрузками, полученными с испытуемыми с использованием ингалятора MEDTONE®. Данные представлены в таблице 9. Представленные значения получены от всех дозовых групп, которые использовали ингалятор DPI 2 с 20 Ед. инсулина, из частей I и III, а значения для ингалятора MEDTONE® с 30 Ед. инсулина получали из частей I, la и III. Меньшие, чем ожидалось, инсулиновые нагрузки плазмы в значениях AUC для ингалятора DPI 2 с 22 Ед., вероятнее всего, объясняются недостаточным числом моментов времени во время фазы окончательного выведения инсулина. Как выяснилось, некоторые из более поздних моментов времени не вносили вклад в вычисление AUC и, с поправкой, сдвигались вверх во временной последовательности, что обеспечивало более точные результаты для AUClast (площадь под концом кривой). Данное изменение моментов времени для фармакинетики инсулина по окончании введения для группы введения 22 Ед. инсулина ингалятором DPI 2 повышало последующие временные профили концентрации. Меньшие дозы 10 Ед. С ингалятором DPI 2 и 15 Ед. с ингалятором MEDTONE® также имели сходное действие, и концентрации инсулина для всех отдельных испытуемых представлены на графике на фиг. 38. Как нагрузка соединением FDKP при введении 20 Ед. ингалятором DPI 2 и 30 Ед. ингалятором MEDTONE®, так и нагрузка соединением FDKP при введении 10 Ед. ингалятором DPI 2 и 15 Ед. ингалятором MEDTONE® соответствуют критериям биоэквивалентности. Между нагрузкой соединением FDKP и нагрузкой инсулином имеет место хорошая корреляция. Концентрации соединения FDKP для всех испытуемых графически представлены по дозовым группам на фиг. 39.
Данные в таблице 9 представляют рабочие характеристики системы ингалятора, описанные в настоящей заявке и показывают, что среднее значение AUC0-∞ в плазме, измеренное для испытуемых во время эксперимента, изменялось в диапазоне 1,879-3,383 нг×мин/мл на мг соединения FDKP, испускаемого ингалятором MEDTONE® за две ингаляции, и в диапазоне 2,773-5124 нг×мин/мл на мг соединения FDKP, испускаемого ингалятором DPI 2 в препарате после одной ингаляции. Данные показывают также, что среднее значение AUC0-∞ для соединения FDKP на мг испускаемой массы соединения FDKP в препарате для всех испытуемых было больше 3,500 или 3,568 нг×мин/мл.
Среднее значение AUC инсулина в плазме в данном исследовании изменялось для ингалятора DPI 2 в диапазоне от приблизительно 96 до 315 мкЕд.×мин/мл на Ед. инсулина в порошковом препарате, введенном за одну ингаляцию, при этом, среднее значение инсулина изменялось в диапазоне 168-216 мкЕд.×мин/мл на Ед. инсулина в порошковом препарате, введенном за одну ингаляцию. Значения AUC (AUC0-∞) для ингалятора MEDTONE изменялось в диапазоне от приблизительно 76 до приблизительно 239 мкЕд.×мин/мл на Ед. инсулина в порошковом препарате, введенном за две ингаляции. Ранее замечено, что первая ингаляция посредством системы ингалятора MEDTONE® обеспечивает менее чем половину всего инсулина, испускаемого за две ингаляции, на один обычно используемый картридж (данные не показаны), и такие же характеристики аналогичным образом обеспечиваются для соединения FDKP, при его применении в качестве средства доставки в препарате.
Постпрандиальные колебания концентраций глюкозы оценивали для каждого испытуемого во время опытного приема пищи, применяемого для установления соотношение между инсулином и C-пептидом, а также во время провокационных приемов пищи после введения инсулина ингалятором DPI 2 или ингалятором MEDTONE®. Колебания глюкозы при каждом отдельном сравнении между ингаляторами DPI 2 или MEDTONE® представлены на фиг. 40. Дозы, использованные во время исследования, не титровали для отдельного испытуемого, и, поэтому, величина реакции изменяется между отдельными испытуемыми, но, в общем, для каждого отдельного испытуемого наблюдались сравнимые колебания глюкозы между процедурами с двумя ингаляторами.
Фармакокинетические параметры соединения FDKP и инсулина при использовании сухого порошкового препарата соединение FDKP-инсулин
(0-2hr) для инсулина
Биологическую доступность ингаляторов оценивали также в сравнении с биологической доступностью фумарил дикетопиперазина или FDKP, вводимого внутривенной инъекцией ударной дозы с использованием меченного радиоизотопом соединения FDKP и измеряемого в виде значения AUC0-∞. Результаты данного исследования показали, что, по расчетам, биологическая доступность для системы MEDTONE® составляет приблизительно 26% и 32% для 10 мг и 20 мг соответственно доставленного порошка соединения FDKP. Полученная биологическая доступность, измеренная с использованием ингалятора DPI 1 путем анализа на модели доставки 10 мг соединения FDKP, составляла 57%, при сравнении с введением 10 мг соединения FDKP посредством внутривенной инъекцией ударной дозы. Для оценки рабочих характеристик системы ингалятора или эффективности доставляемого порошка, измеренных как значение AUC0-∞ для соединения FDKP с использованием ингалятора DPI 2 и однократной ингаляции порошка, применили анализ на модели для данных, полученных с использованием препарата соединения FDKP-инсулина. Ингалятор DPI 2 доставлял 64% соединения FDKP из 6,7 мг суммарной закладки в большой круг кровообращения, в сравнении с 46% при использовании ингалятора MEDTONE® с двумя ингаляциями. Для данного препарата соединения FDKP-инсулина, содержание соединения FDKP составляло около 6 мг.
ПРИМЕР 10
Фармакокинетические параметры, основанные на значениях и средних геометрический значениях концентрации инсулина, скорректированных на C-пептид
В ветви исследования, выполняемого, как поясняется в примере 9, 46 здоровых нормальных добровольных испытуемых исследовали с использованием протокола фазы 1 открытого рандомизированного перекрестного исследования. Исследования выполняли для оценки биоэквивалента препарата соединения FDKP-инсулина, введенного с использованием ингаляторов DPI 2, которые требовали одной ингаляции для доставки дозы, содержащейся в картридже, в сравнении с ингалятором MEDTONE®, который требует двух ингаляций на картридж для доставки дозы. Кроме того, выполнили эксперименты для оценки того, будет ли доза ингаляционного порошка соединения FDKP-инсулина из двух картриджей, вмещающих 10-Ед. дозы, обеспечивать в испытуемом концентрацию инсулина, биологически эквивалентную концентрации от 20-Ед. дозы инсулина из одного картриджа, доставляемой с использованием ингаляторов DPI 2, и препарата соединения FDKP-инсулин, вводимого методом пероральной ингаляции. Испытуемые принимали соединение FDKP-инсулин методом пероральной ингаляции с использованием ингалятора DPI 2 или MEDTONE®. Испытуемые принимали одну 20-Ед. дозу инсулина, две 10-Ед. дозы инсулина с использованием ингаляторов DPI 2 или 30 Ед. инсулина с использованием ингалятора MEDTONE®. У каждого подвергнутого процедуре испытуемого брали пробы крови в различные моменты времени в продолжении 2 часов. Пробы анализировали для измерения концентрации инсулина. Фармакокинетические параметры для исследования основывались на значениях концентрации, скорректированные на C-пептид. Результаты, полученные в процессе исследования, показаны в нижеприведенной таблице 10.
0,981-1,145
0,992-1,180
0,886-1,035
0,852-1,014
Данные показывают, что использование 20 Ед. инсулина, вводимого методом пероральной ингаляции испытуемым с использованием препарата соединения FDKP-инсулина системой доставки DPI 2, статистически дает результат, биологически эквивалентный введению 30 Ед. того же препарата с использованием ингалятора MEDTONE®. Данные показывают также, что введение двух 10-Ед. доз препарата соединения FDKP-инсулина методом пероральной ингаляции ингалятором DPI 2 создает в большом круге кровообращения инсулиновую нагрузку, аналогичную ситуации с одной 20-Ед. дозой инсулина из препарата соединения FDKP-инсулина, введенной с использованием ингалятора того же типа или DPI 2. Поэтому, две 10-Ед. дозы инсулина из препарата соединения FDKP-инсулина обеспечивают концентрацию инсулина в большом круге кровообращения, биологически эквивалентную одной 20-Ед. дозе соединения FDKP-инсулина, при введении системой ингалятора DPI 2 методом пульмональной ингаляции. Данные биологической доступности также показывают, что использование ингалятора DPI 2 для дозирования в пациентов, по меньшей мере, например, препарата инсулина/соединения FDKP, который дозируют посредством данной системы ингаляции, обеспечивает дозирование, которое характеризуется очевидной линейностью и пропорциональностью в, по меньшей мере, испытанных диапазонах инсулина, или диапазоне 10 Ед.-30 Ед.
Результаты показывают также, что система доставки DPI 2 является приблизительно на 33% эффективнее при доставке одной и той же дозы препарата. Поэтому, ингалятор DPI 2 обеспечивает одинаковые нагрузки инсулиновой дозой, при уменьшении дозы на 33%, в сравнении с ингалятором MEDTONE®.
ПРИМЕР 11
Определение характеристик профилей ингаляции с использованием системы показателей, основанной на рабочих характеристиках in vitro ингалятора
Система ингаляции, описанная в настоящей заявке, состоит из ингалятора сухого порошка (DPI 2) с картриджем. Ингалятор DPI 2 применяли с устройством BLUHALE™, предложенным в заявке на патент США № 12/488469 (US 2009/0314292, описание которой включено в настоящую заявку путем отсылки, в отношении всех принципов, касающихся ингаляционной манипуляции и связанных с ней усилий и их измерений), которое измеряет дифференциальное давление в ингаляторе в течение периода времени в течение и после ингаляционной манипуляции. На фиг. 41 графически представлен примерный профиль для ингалятора DPI 2, при этом, перепад давлений в ингаляторе измеряли в течение 5-секундного периода во время и после ингаляции. Максимальное давление при вдохе через 2 сек, или PIP (2), означает наивысшую точку на кривой или максимальное давление, достигаемое в течение первых двух секунд после начала ингаляции. На фиг. 41 показано, что PIP (2) для ингалятора DPI 2 составляло приблизительно 5 кПа, и площадь под кривой в течение 1 секунды, или AUC (1) составляла 3,7 кПа×сек.
ПРИМЕР 12
Испытание пороговых рабочих характеристик ингалятора на основании испытаний для определения значений диаметров частиц
Для данных экспериментов использовали ингаляторы типа DPI 2. В отдельные ингаляторы вставляли картридж, вмещающий сухой порошковый препарат, содержащий микрочастицы, содержащие инсулин и соединение FDKP для испытания рабочих характеристик устройств. Ингаляторы ранее использовали для получения профилей, представленных в вышеприведенном примере 11. После получения профилей ингаляции с помощью устройства BLUHALE™, ингаляторы применяли с имитатором ингаляции, описанным в патентной заявке № PCT/US2010/055323, описание которой включено в настоящую заявку путем отсылки, в отношении всех принципов, касающихся ингаляционной манипуляции и связанных с ней усилий и их измерений, для воспроизведения примерной ингаляции, выполняемой пользователем. Затем, профили ингаляции, использующие имитатор, применяли для выпуска порошка из двух ингаляторов в лазерное дифракционное устройство, описанное в вышеприведенном примере 2, для измерения распределения частиц по размерам. Лазерное дифракционное устройство измеряет объемный медианный геометрический диаметр (VMGD). Значения считались приемлемыми, если 50% испускаемых частиц имели диаметр меньше чем 4,88 мкм, который был выбран на основании 33% увеличения среднего размера частиц для оптимально используемого ингалятора DPI 2. В лазерное дифракционное устройство устанавливали два ингалятора с дозами порошка, и получали высвобождения или испускания порошка с различными профилями ингаляции, т.е. различными значениями PIP (2) и AUC (1). Испытание повторяли 5 раз для каждого ингалятора, для, в общем, десяти измерений, и данные анализировали и представляли графически. На фиг. 42 показан результат экспериментов в виде графика PIP (2) в зависимости от AUC (1) для двух ингаляторов, при этом, каждая точка на графике представляет среднее значение по 10 высвобождениям. Опорожнение картриджа (или количество высвобожденного сухого порошка) было больше чем 87% во время всех высвобождений. Область ингаляции, ограниченная треугольником на графике, представляет зону графика, в которой физически невозможно получить значения PIP (2) для устройства, при данных значениях AUC (1). Ингаляционные манипуляции, которые, как предполагалось, обладали проходными критериями на основании вышеприведенных характеристик и находились сверху и справа от линий проходных критериев Gen 2 на фиг. 42, обеспечивали приемлемые рабочие характеристики. Данные на фиг. 42 показывают, что нижний предел для приемлемых рабочих характеристик настоящих устройством находится при PIP (2) приблизительно 2 кПа и AUC (1), по меньшей мере, приблизительно 1,2 кПа×сек. Однако, во время других экспериментов, приемлемые рабочие характеристики были продемонстрированы также при AUC (1), по меньшей мере, приблизительно 1,0 или, по меньшей мере, приблизительно 1,1 кПа×сек.
Предыдущие описания являются наглядными вариантами осуществления. Специалистам в данной области следует понимать, что устройства, методы и способы, описанные в настоящей заявке, поясняют репрезентативные варианты осуществления, которые хорошо функционируют при применении настоящего описания. Однако специалисты в данной области должны понимать в свете настоящего описания, что в конкретные варианты осуществления, которые предложены, можно вносить множество изменений и, по-прежнему, получать сходный или подобный результат, без выхода за пределы существа и объема настоящего изобретения.
Если не указано иначе, то все числа, выражающие количества ингредиентов, свойства, например, молекулярную массу, условия реакции и так далее, используемые в описании и формуле изобретения, следует понимать как изменяющиеся во всех случаях применения термина «приблизительно». Соответственно, если не указано обратного, численные параметры, приведенные в описании и в прилагаемой формуле изобретения, являются приближенными значениями, которые могут изменяться в зависимости от желаемых свойств, которые должны быть получены по настоящему изобретению. И, наконец, и не в качестве попытки ограничить применение теории эквивалентов объемом притязаний формулы изобретения, каждый численный параметр следует рассматриваться, по меньшей мере, в свете числа сообщаемых значащих цифр и с применением обычных методов округления. Несмотря на то, что численные диапазоны и параметры, приводимые в расширенном объеме настоящего изобретения, представляют собой приближенные значения, численные значения, приведенные в конкретных примерах, сообщаются как можно точнее. Однако любое численное значение, по существу, содержит некоторые погрешности, с необходимостью возникающие из стандартного отклонения, обнаруживаемого при их соответствующих экспериментальных измерениях.
Признаки единственного числа в виде неопределенных и определенного артиклей и аналогичных ссылок, используемых в контексте описания настоящего изобретения (в частности, в контексте нижеследующей формулы изобретения), подлежат истолкованию в смысле содержания как единственного, так и множественного числа, если в настоящей заявке не указано иначе или прямо не противоречит контексту. Упоминание диапазонов значений в настоящей заявке предназначено только для сокращенного способа индивидуального упоминания каждого отдельного значения, попадающего в этот диапазон. Если в настоящем документе не указано иначе, каждое такое индивидуальное значение включено в настоящее описании, как если бы оно отдельно упоминалось в настоящем описании. Все способы, описанные в настоящей заявке, можно выполнять в любом подходящем порядке, если в настоящей заявке не указано иное, или, в ином случае, прямо не противоречит контексту. Использование любого и всех примеров или пояснительных выражений стиля (типа, например), приведенных в настоящем описании, предназначено только для улучшения пояснения настоящего изобретения и не налагает ограничения на объем настоящего изобретения, заявляемый иным образом. Никакие выражения в описании не подлежат интерпретации как указывающие на любой незаявленный элемент, существенный для применения настоящего изобретения.
Использование термина «или» в формуле изобретения служит для обозначения «и/или», если явно не указана ссылка только на альтернативные варианты, или если альтернативные варианты не являются взаимно исключающими, хотя описание поддерживает определение, которое относится только к альтернативным вариантам и «и/или».
Группы альтернативных элементов или вариантов осуществления настоящего изобретения, описанные в настоящей заявке, нельзя интерпретировать как ограничение. Каждый элемент группы может упоминаться и быть заявлен по отдельности или в любом сочетании с другими элементами группы или другими элементами, упомянутыми в настоящем описании. Предполагается, что, по меньшей мере, один элемент группы может быть включен в группу или исключен из нее по причинам удобства и/или патентоспособности. Когда происходит любое подобное включение или исключение, предполагается, что описание в настоящей заявке должно содержать видоизмененную группу, с соответствием, тем самым, письменному описанию всех групп Маркуша, используемых в прилагаемой формуле изобретения.
В настоящей заявке представлены описания предпочтительных вариантов осуществления настоящего изобретения, в том числе, наилучший способ осуществления настоящего изобретения, известный авторам. Разумеется, специалистам в данной области техники, после прочтения вышеприведенного описания, будут очевидны разновидности данных предпочтительных вариантов осуществления. Авторы настоящего изобретения предполагают, что специалисты в данной области должны использовать упомянутые разновидности соответствующим образом, и авторы настоящего изобретения предполагают, что настоящее изобретение будут применять иначе, чем конкретно описано в настоящей заявке. Соответственно, настоящее изобретение содержит все модификации и эквиваленты предмета изобретения, изложенного в формуле изобретения, прилагаемой к настоящему описанию, как допускает применимое законодательство. Более того, любое сочетание вышеописанных элементов во всех возможных видоизменениях содержится в настоящем изобретении, если не указано иное в настоящей заявке, или иначе прямо не противоречит контексту.
Конкретные варианты осуществления, предложенные в настоящей заявке, могут быть дополнительно ограничены в формуле изобретения с использованием формулировок «состоящий из» или «состоящий, по существу, из». При использовании в формуле изобретения, либо в поданной форме, либо в добавленный измененной форме, переходный термин «состоящий из» исключает любой элемент, этап или ингредиент, не указанный в формуле изобретения. Переходный термин «состоящий, по существу, из» ограничивает объем притязаний пункта формулы изобретения указанными материалами или этапами и материалами или этапами, которые существенно не влияют на основную и новую характеристику(и). Варианты осуществления настоящего изобретения, заявленные данным образом, по существу или явно описаны и разрешены в настоящем описании.
Кроме того, по всему настоящему описанию приведены многочисленные ссылки на патенты и печатные публикации. Каждая из вышеупомянутых ссылок и печатных публикаций по отдельности включены в настоящую заявку в полном объеме путем отсылки.
Кроме того, следует понимать, что варианты осуществления настоящего изобретения, предложенные в настоящей заявке, поясняют принципы настоящего изобретения. Другие модификации, которые применимы, не выходят за пределы объема настоящего изобретения. Таким образом, например, но без ограничения, в соответствии с принципами настоящей заявки можно использовать альтернативные конфигурации настоящего изобретения. Соответственно, настоящее изобретение не ограничено точно как описано и показано.
| название | год | авторы | номер документа |
|---|---|---|---|
| СИСТЕМЫ И СПОСОБЫ ДОСТАВКИ СУХИХ ПОРОШКОВЫХ ЛЕКАРСТВ | 2011 |
|
RU2571331C1 |
| СИСТЕМЫ И СПОСОБЫ ДОСТАВКИ СУХИХ ПОРОШКОВЫХ ЛЕКАРСТВ | 2013 |
|
RU2650035C2 |
| ИНГАЛЯТОР ДЛЯ СУХОГО ПОРОШКА И СИСТЕМА ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2016 |
|
RU2731107C2 |
| УСОВЕРШЕНСТВОВАННАЯ СИСТЕМА ДОСТАВКИ СУХОГО ПОРОШКООБРАЗНОГО ЛЕКАРСТВЕННОГО СРЕДСТВА | 2010 |
|
RU2487731C2 |
| ИНГАЛЯТОР ДЛЯ СУХОГО ПОРОШКА И СИСТЕМА ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2009 |
|
RU2468832C2 |
| ИНГАЛЯТОР ДЛЯ СУХОГО ПОРОШКА И СИСТЕМА ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2009 |
|
RU2608439C2 |
| МИКРОЧАСТИЦЫ ДИКЕТОПИПЕРАЗИНА С ОПРЕДЕЛЕННЫМ СОДЕРЖАНИЕМ ИЗОМЕРОВ | 2010 |
|
RU2490026C1 |
| ИНГАЛЯЦИОННАЯ СИСТЕМА ДЛЯ СУХОГО ПОРОШКА | 2009 |
|
RU2491103C2 |
| МИКРОЧАСТИЦЫ ДИКЕТОПИПЕРАЗИНА С ОПРЕДЕЛЕННЫМИ УДЕЛЬНЫМИ ПЛОЩАДЯМИ ПОВЕРХНОСТИ | 2010 |
|
RU2509555C2 |
| СПОСОБ ПРЕДОТВРАЩЕНИЯ ПОБОЧНЫХ ЭФФЕКТОВ GLP-1 | 2008 |
|
RU2474415C2 |
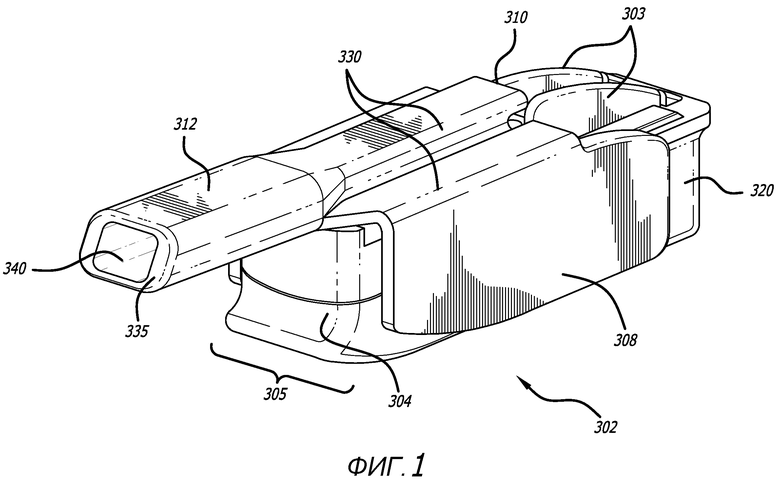
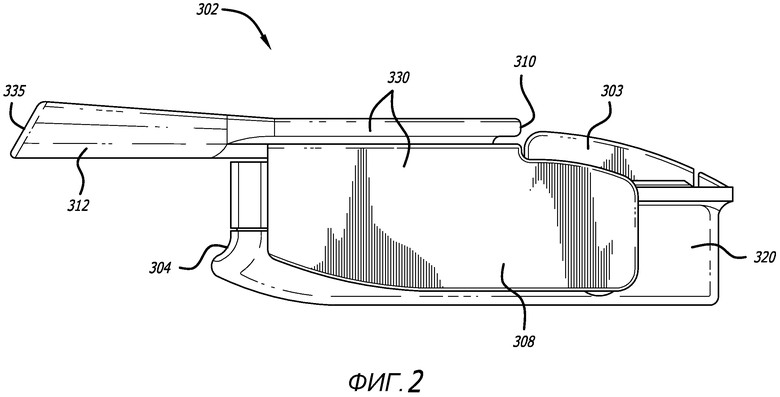
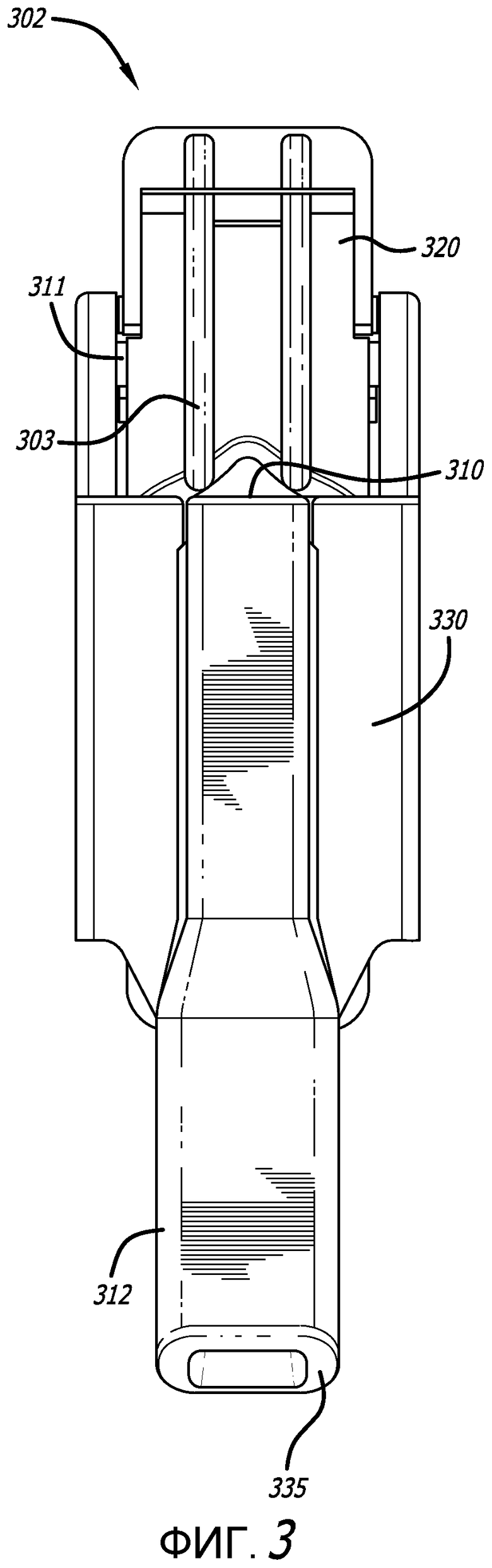
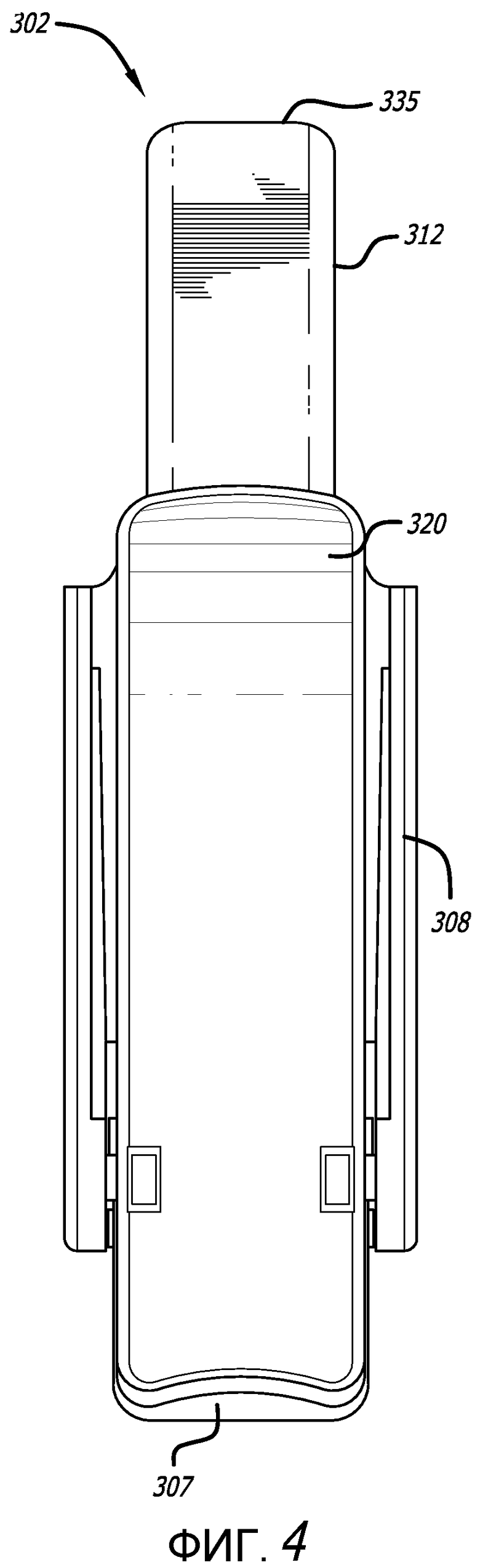
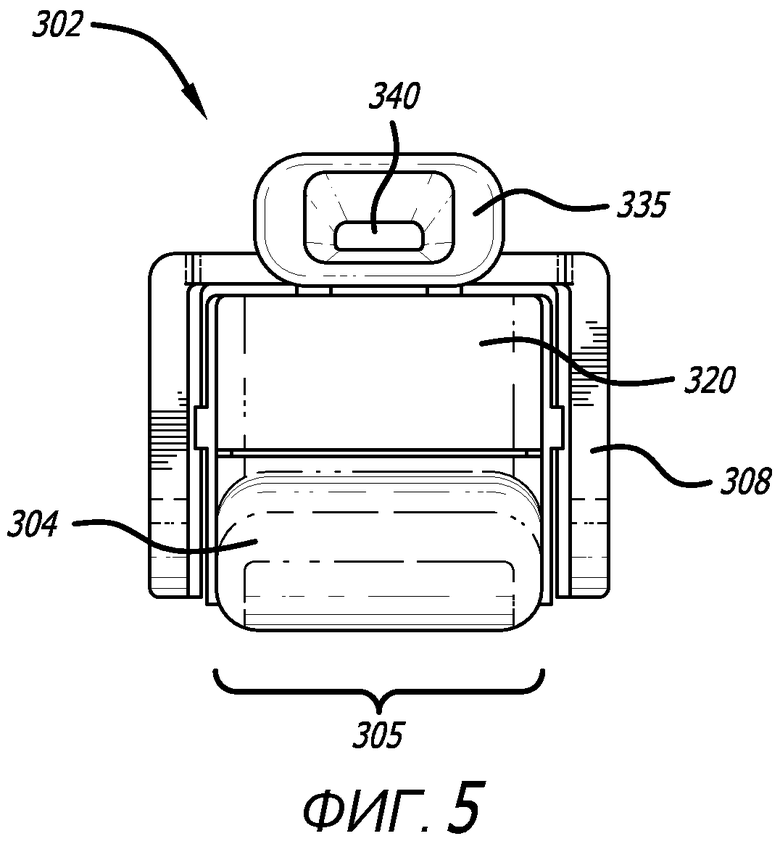
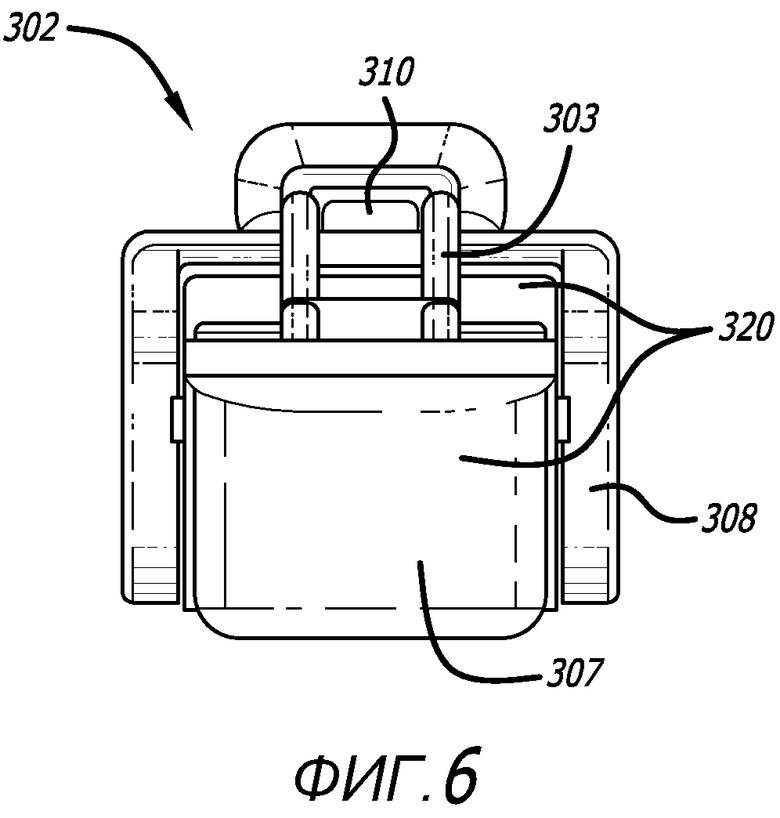
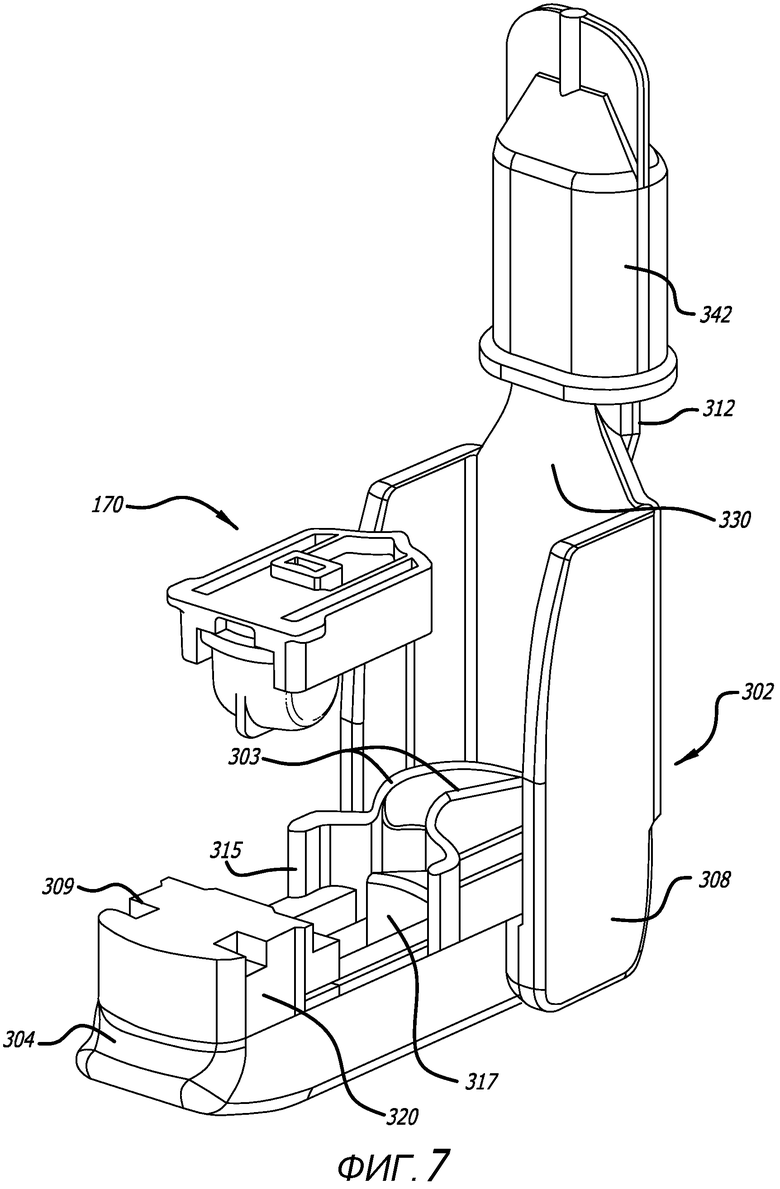
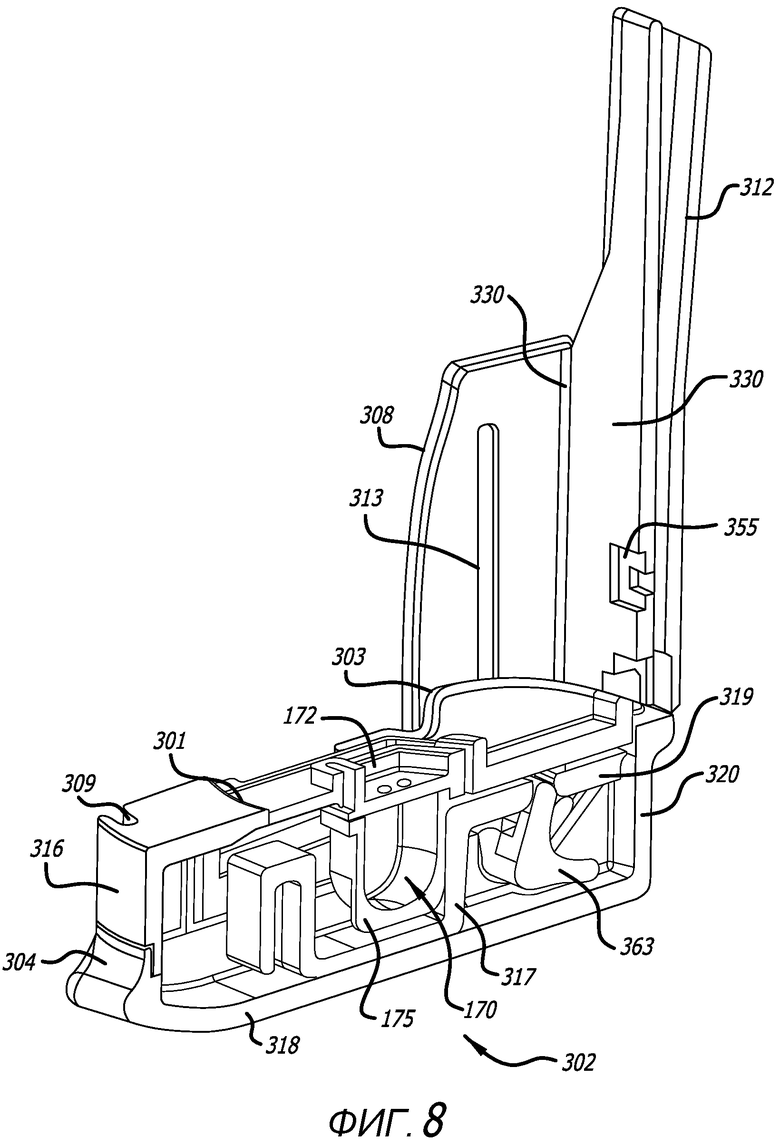
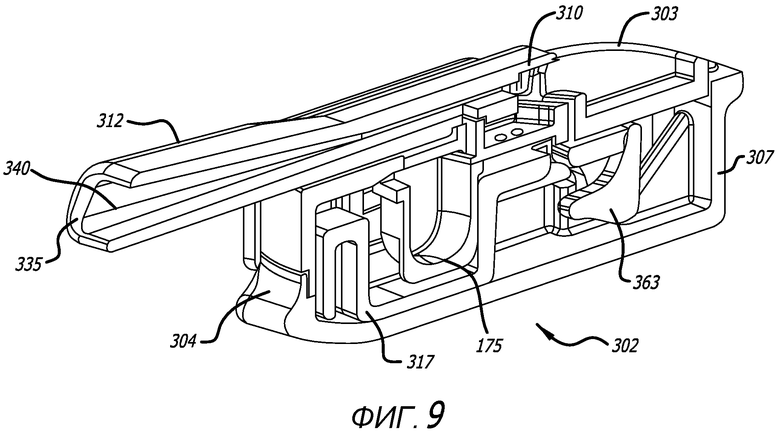
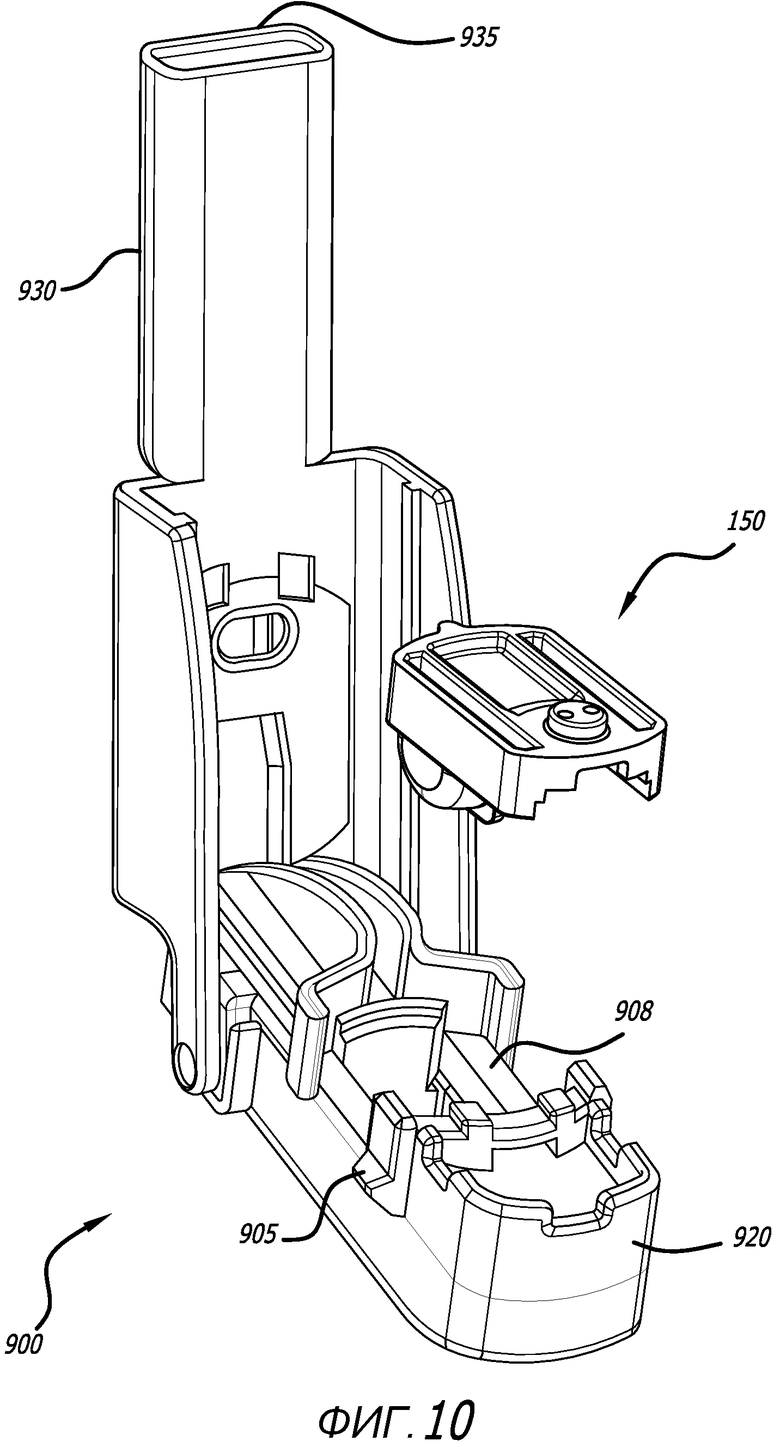
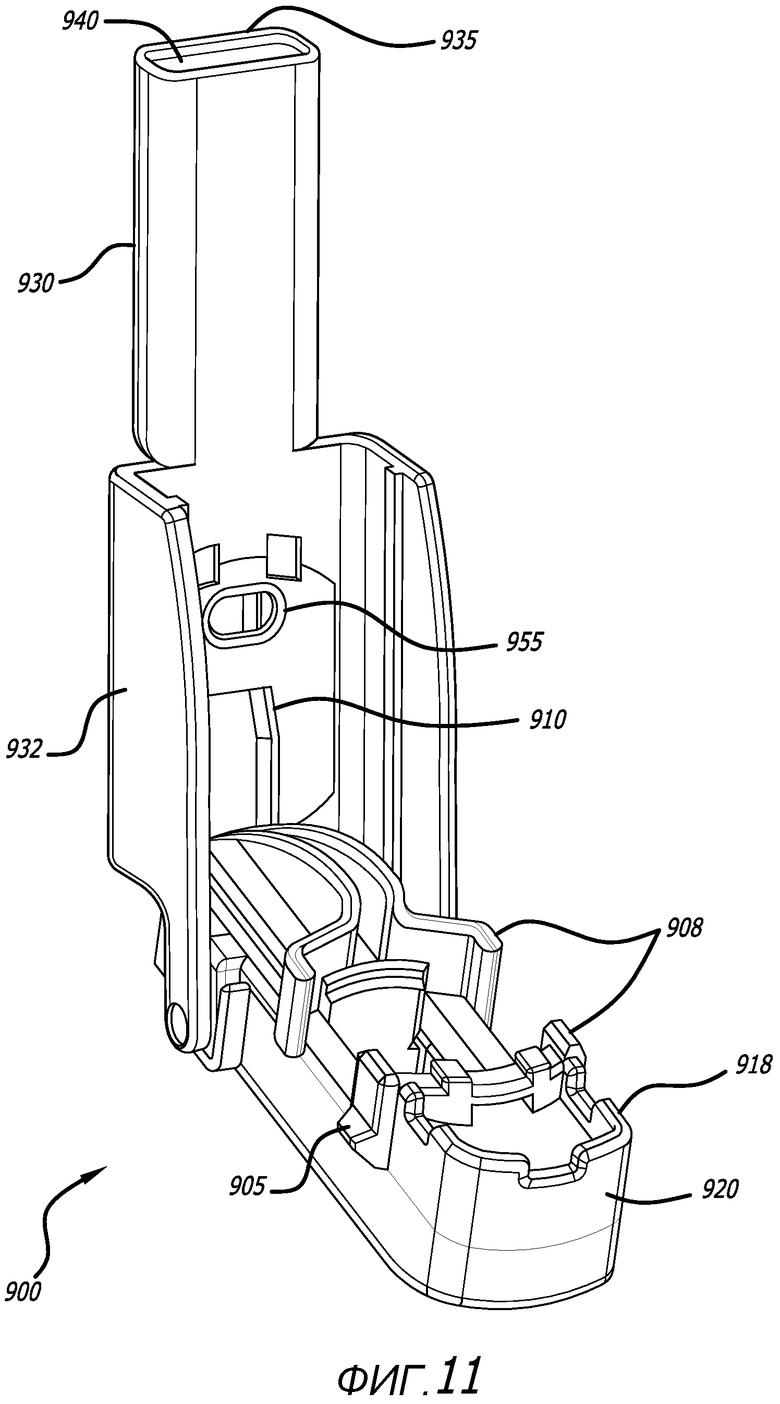
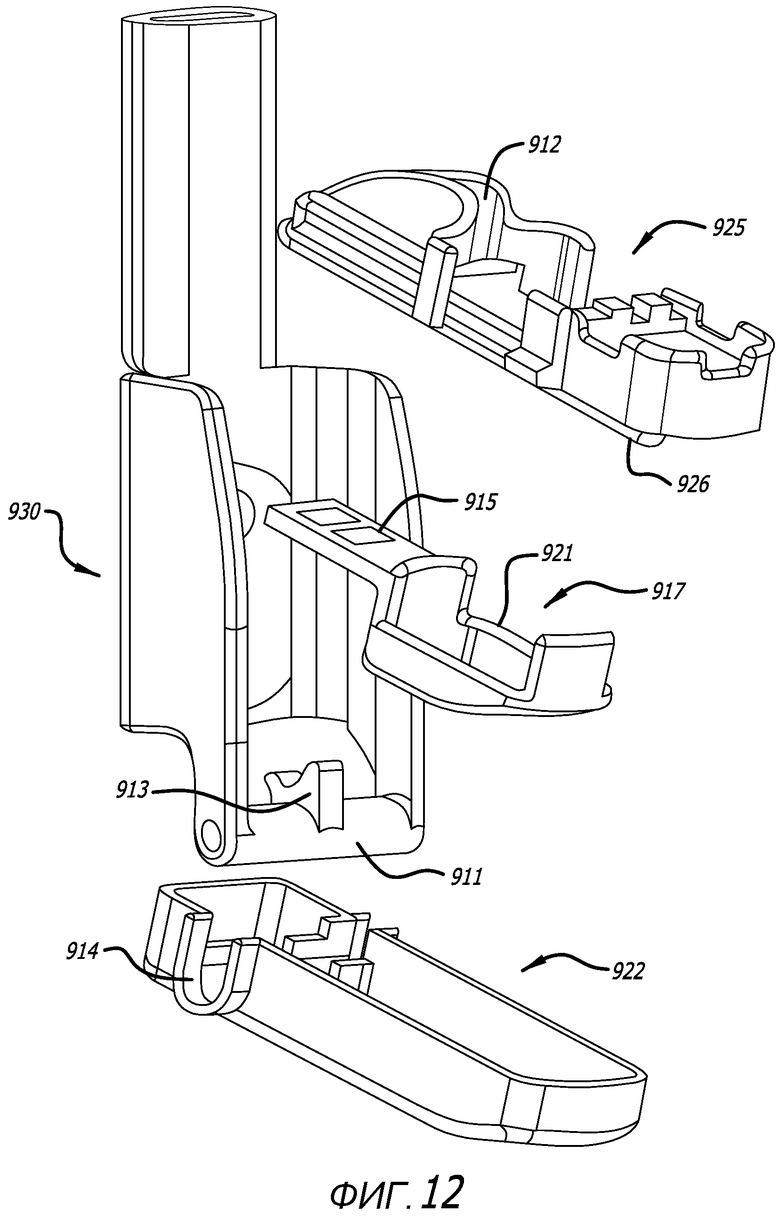
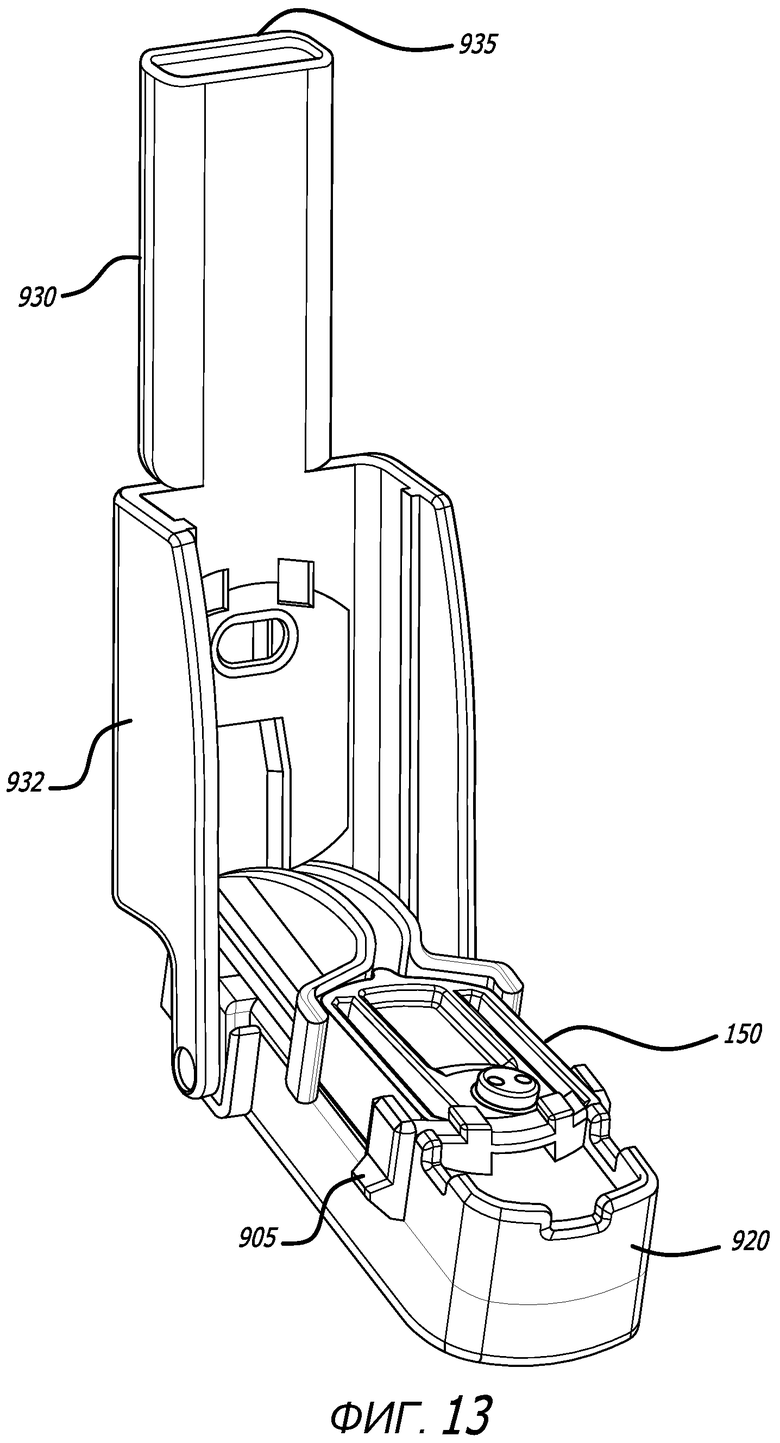
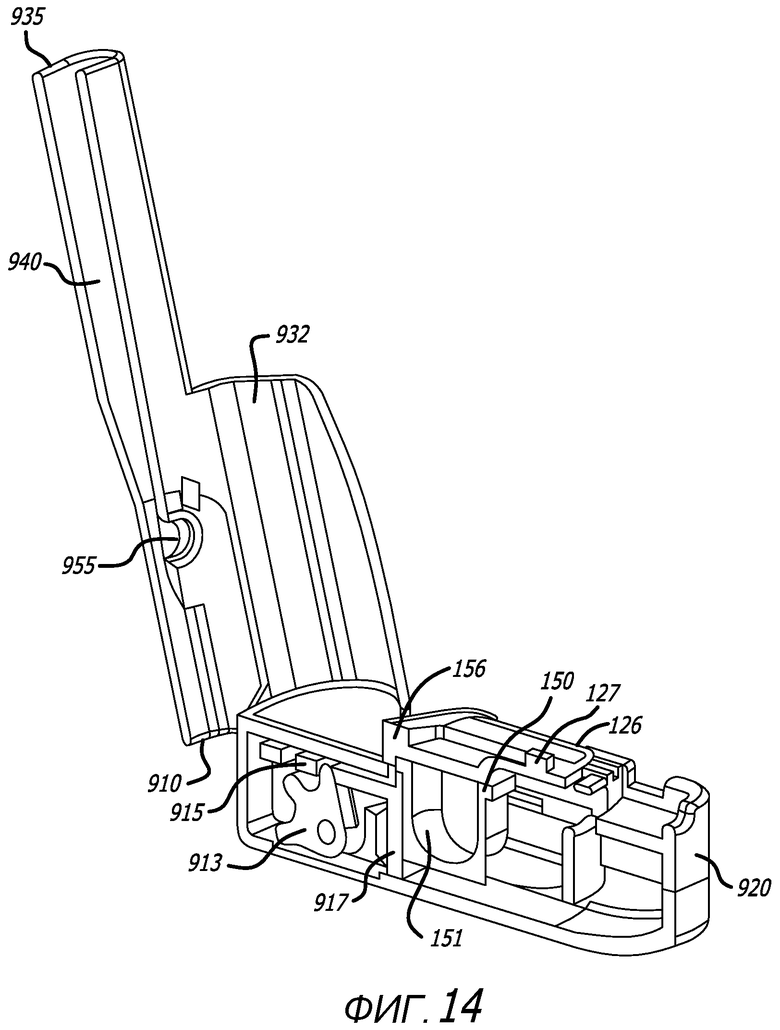
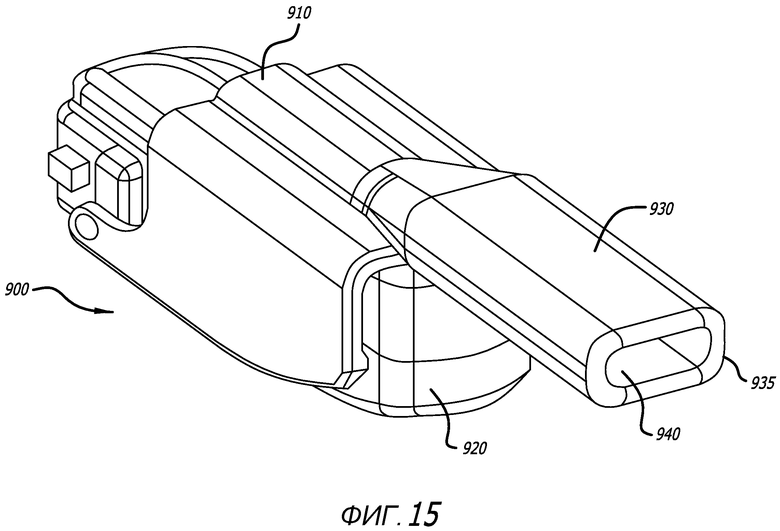
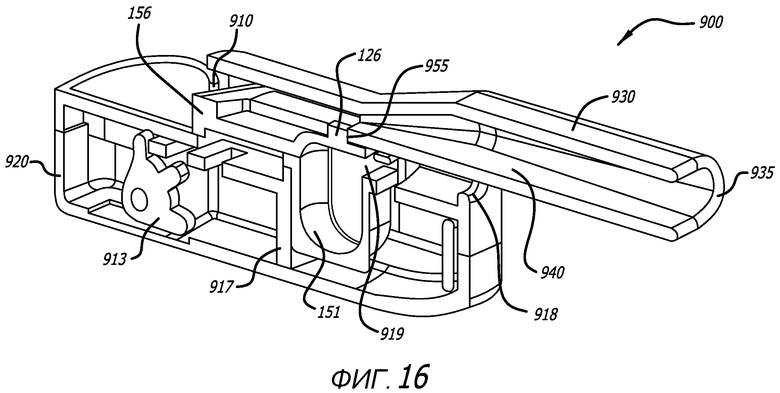
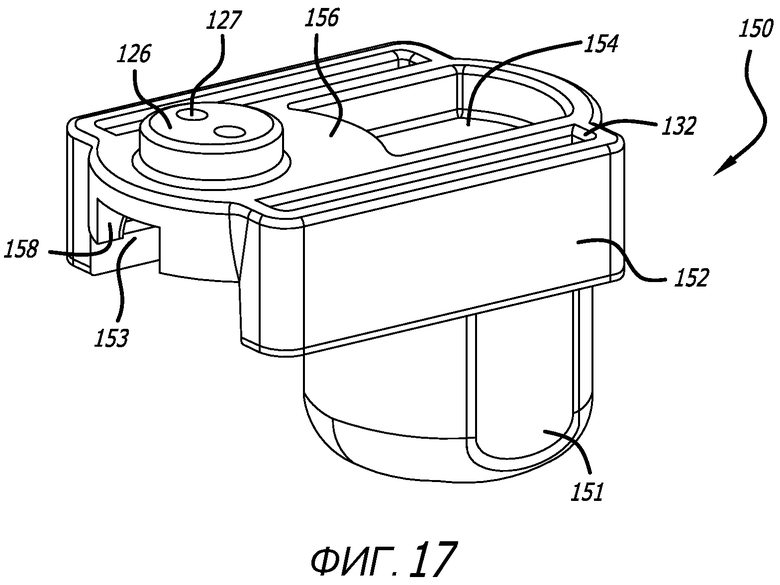
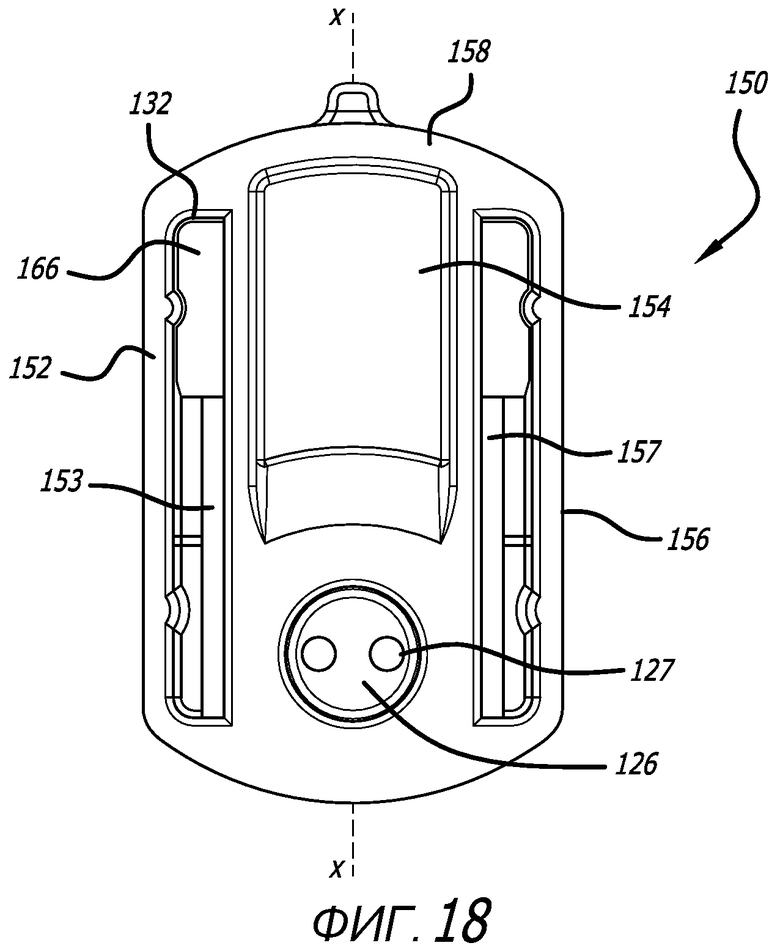
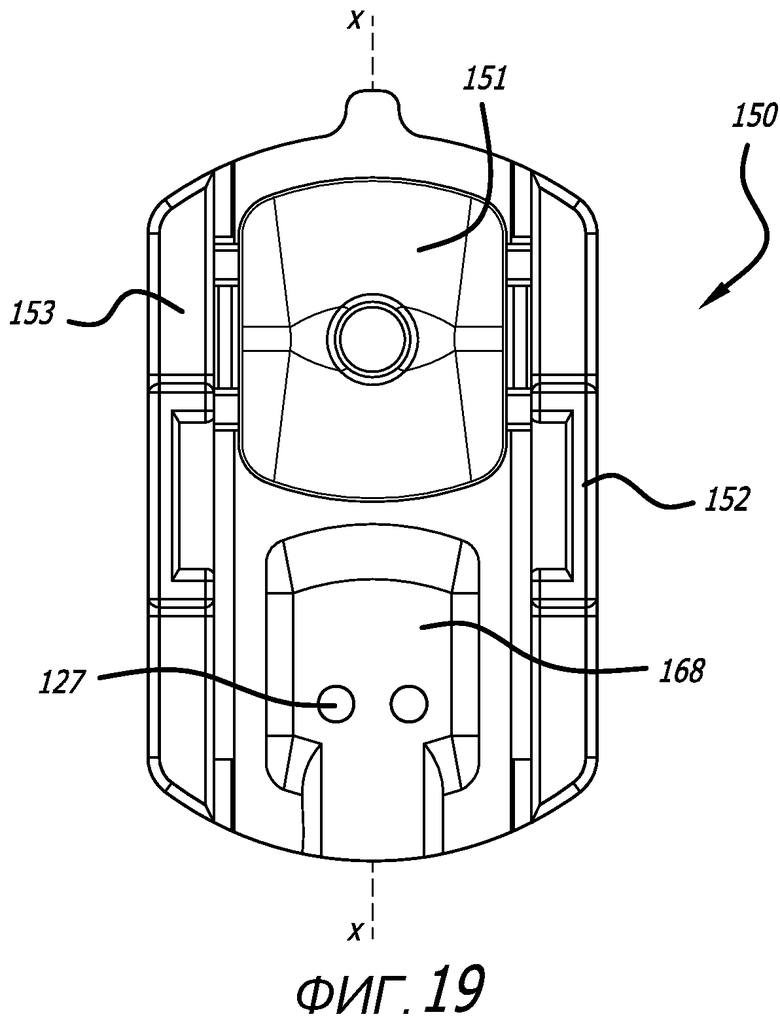
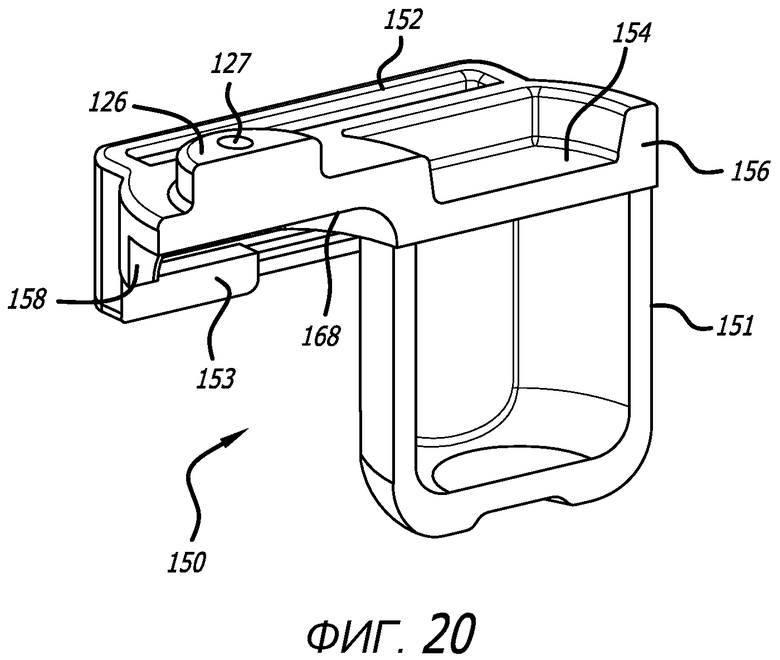
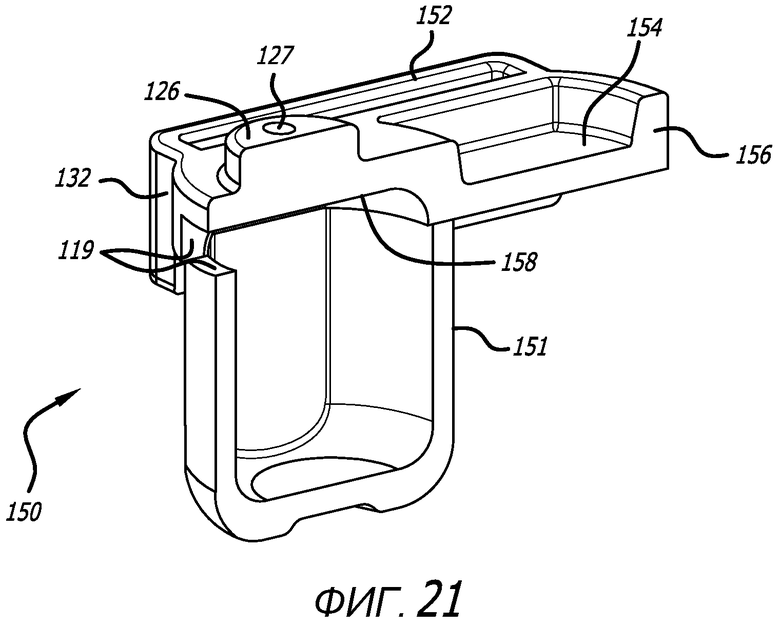
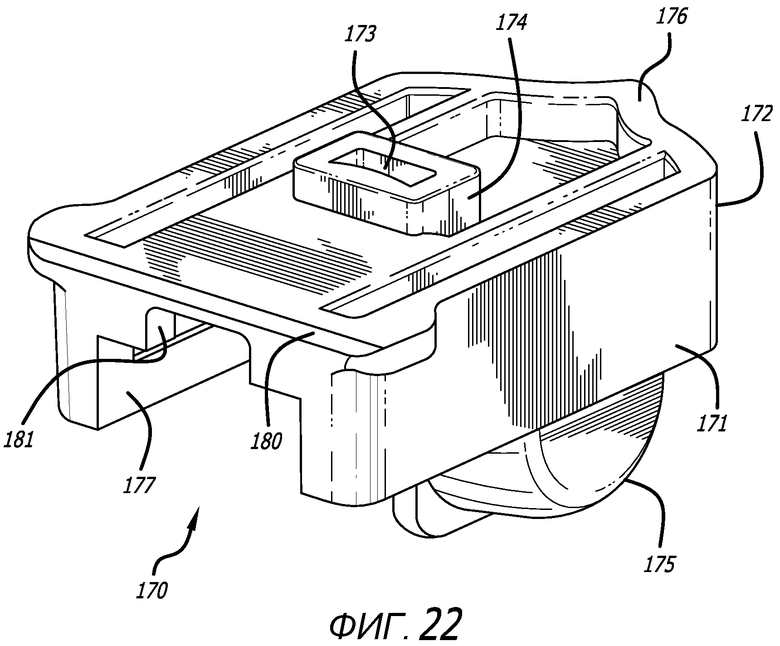
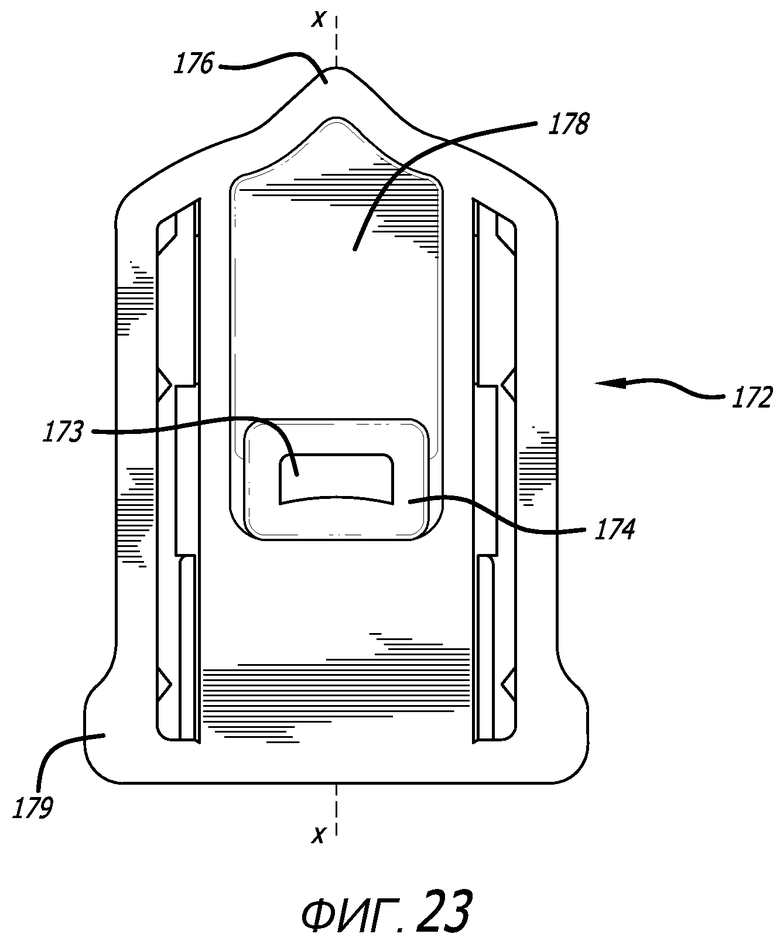
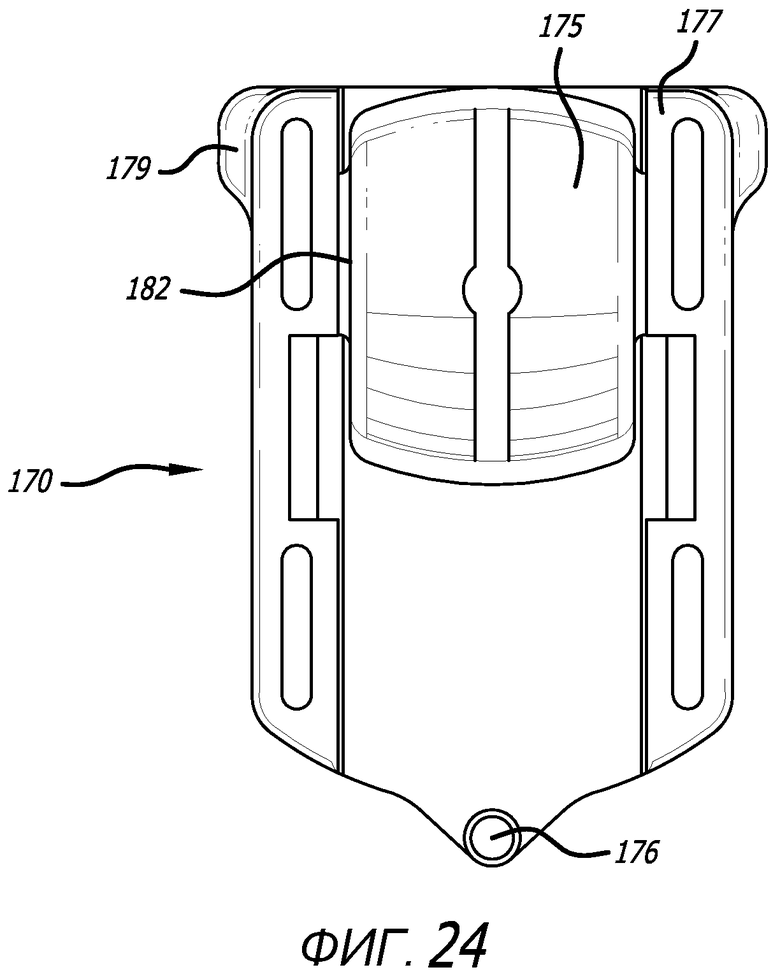
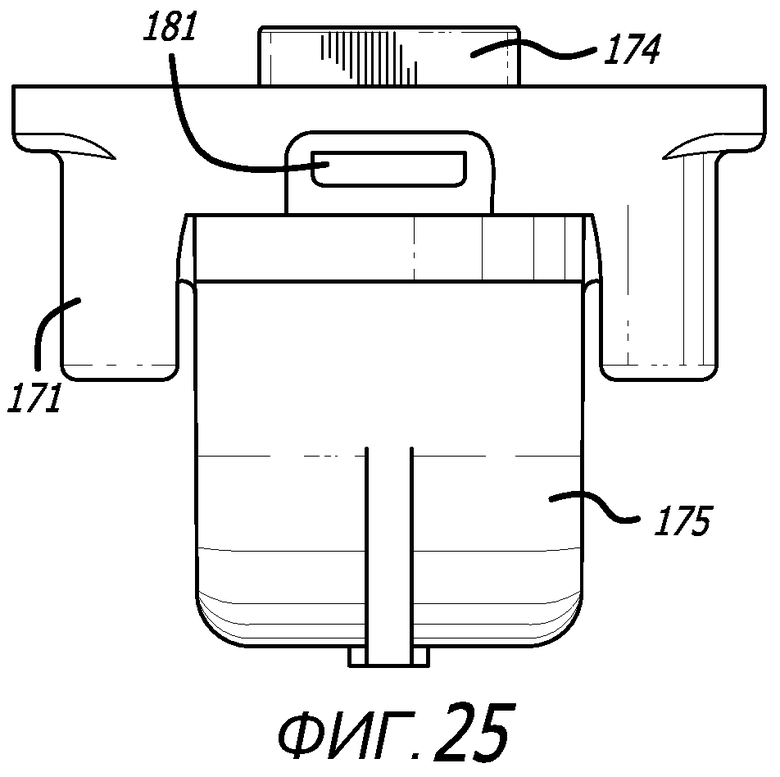
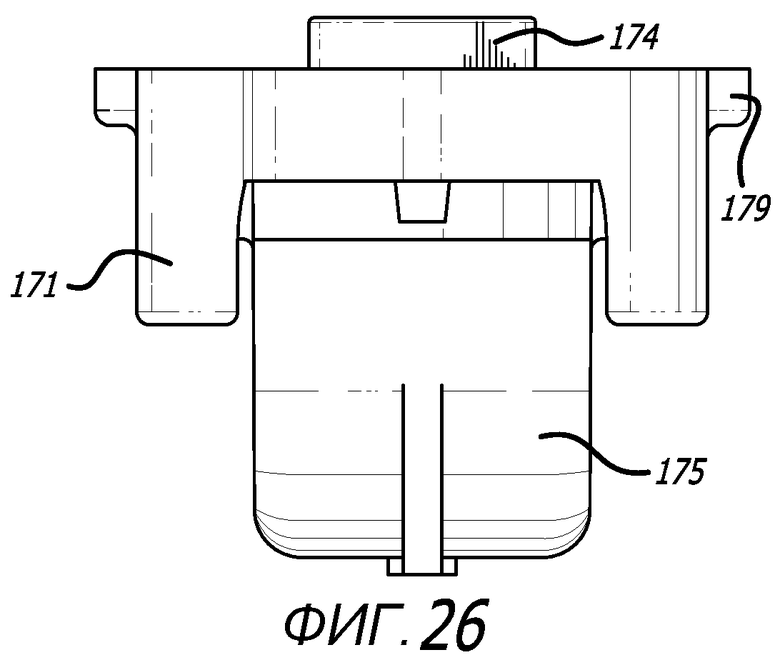
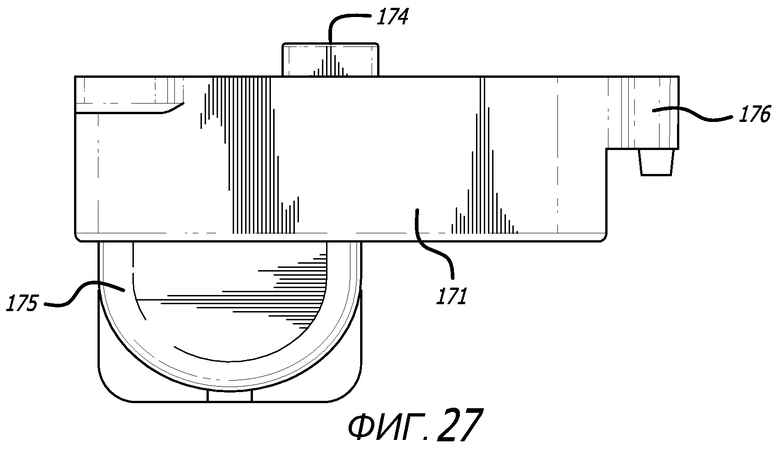
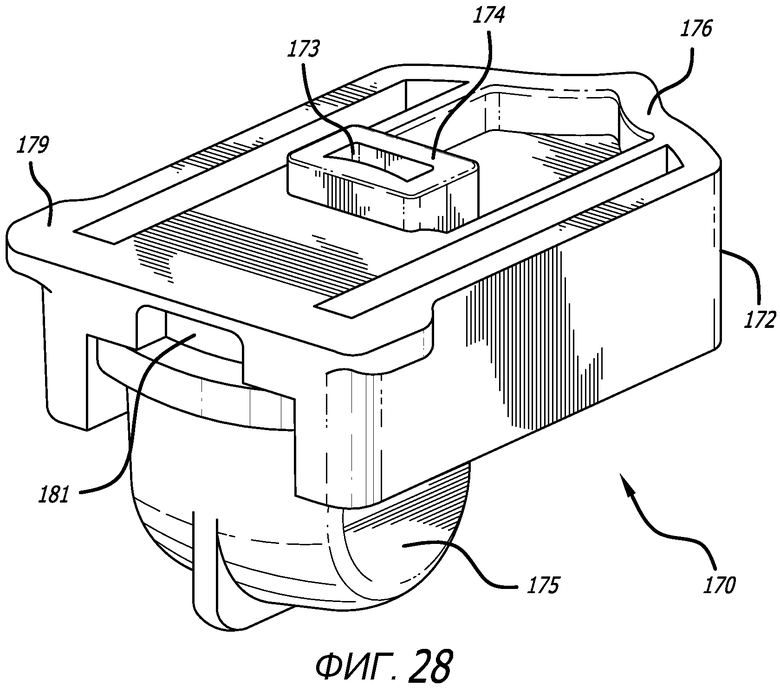
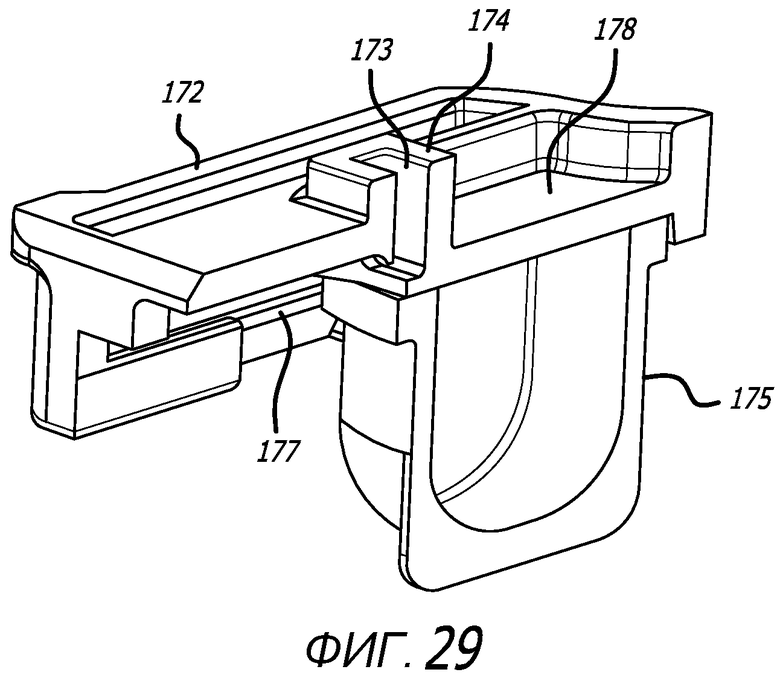

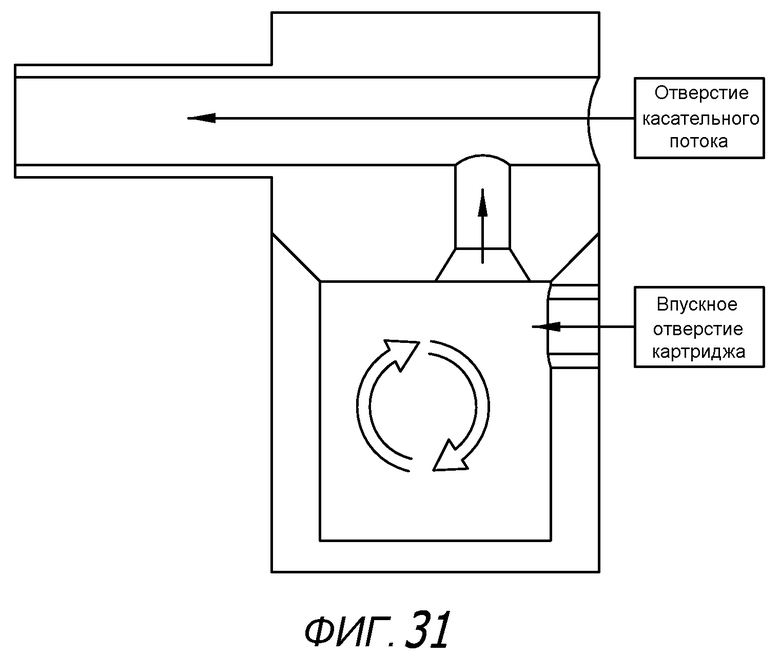
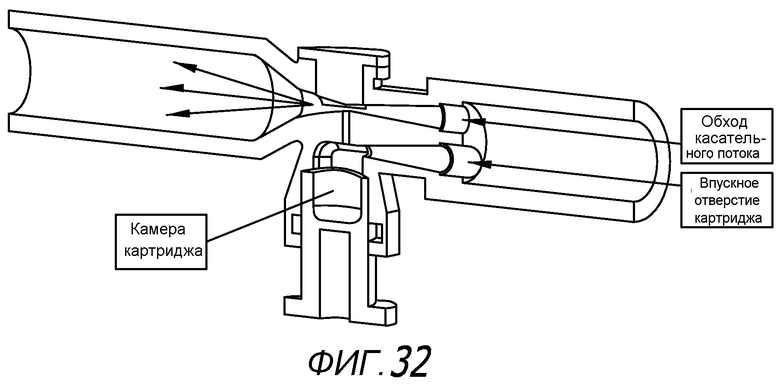
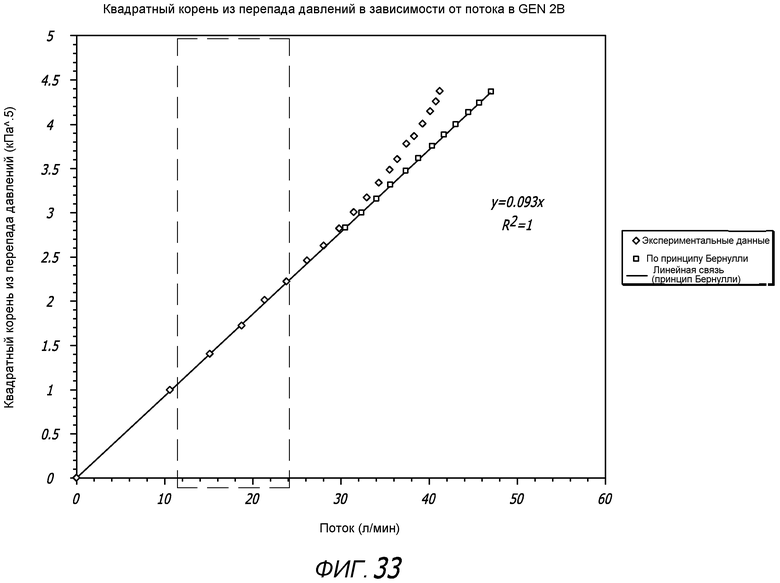
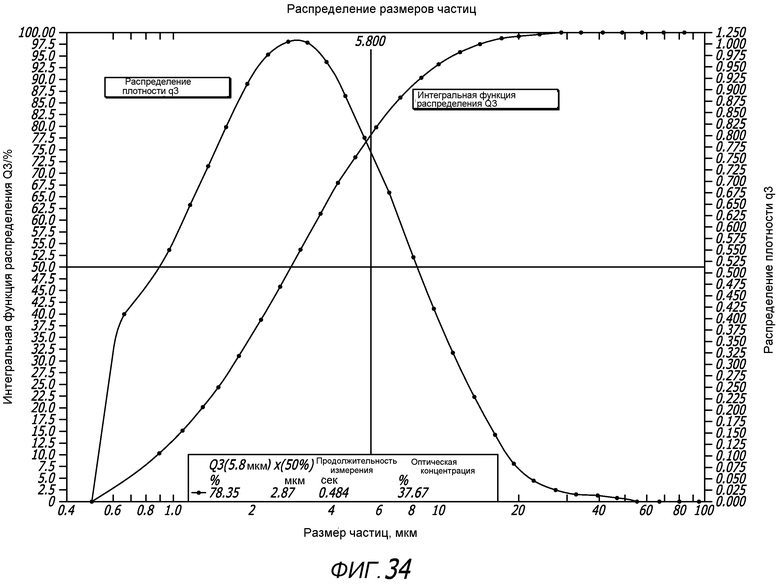
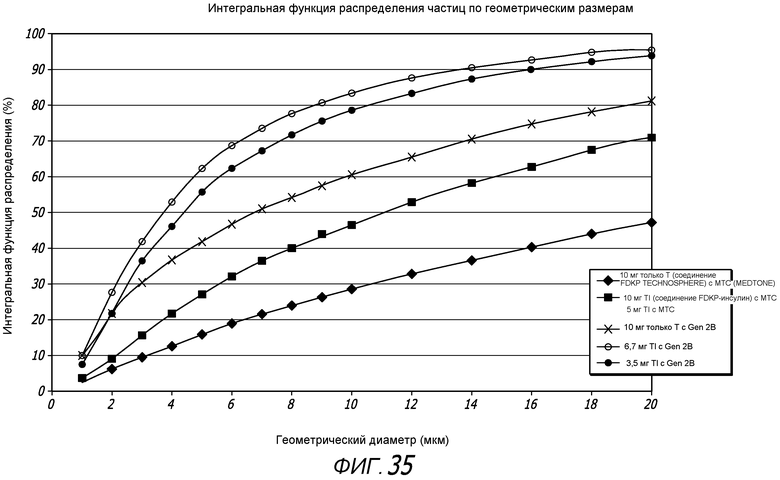
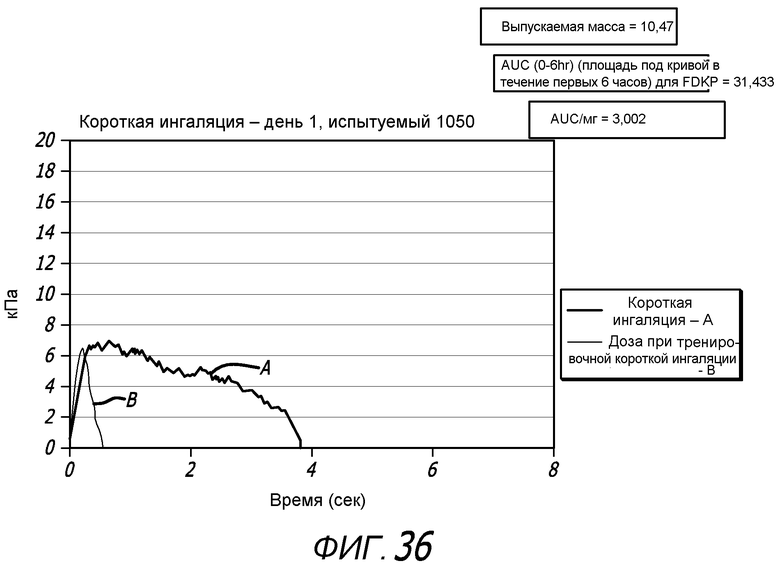
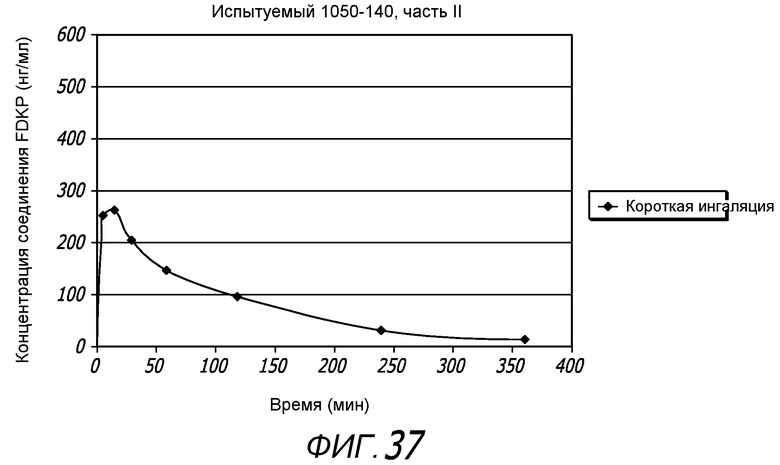

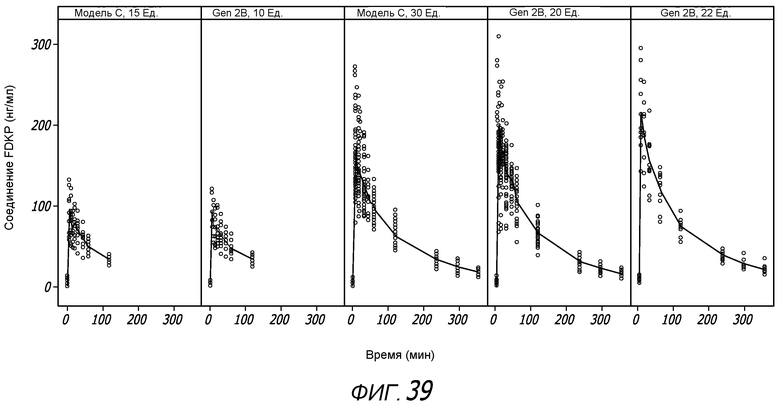
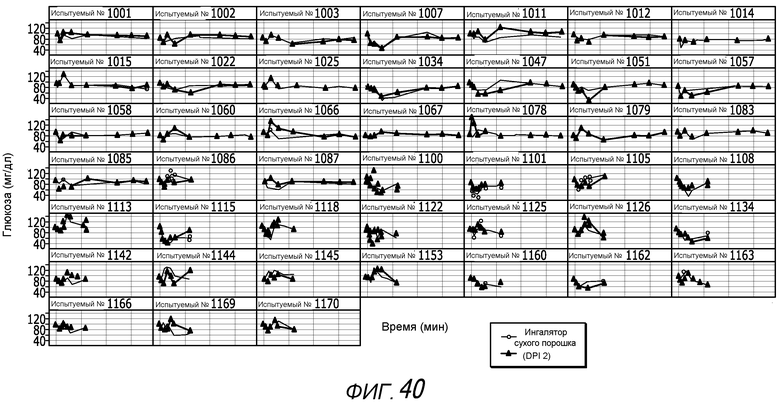
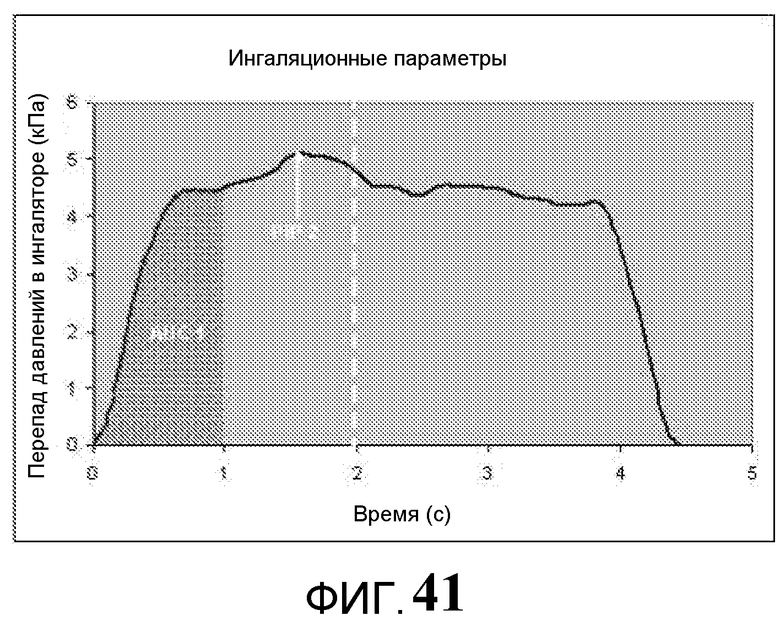
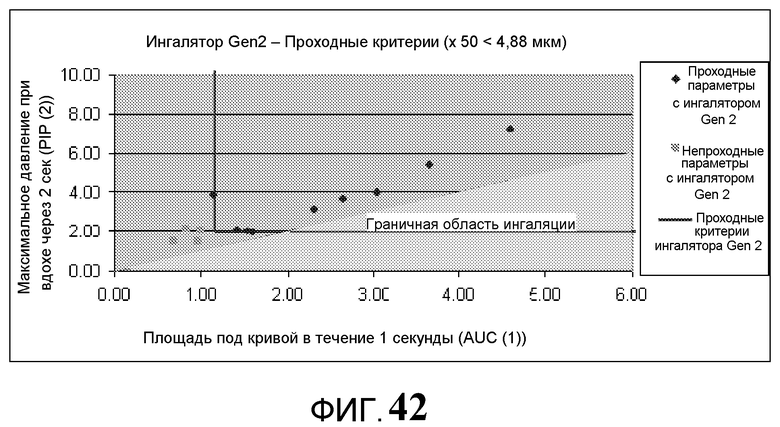
Изобретение относится к медицинской технике. Ингалятор сухого порошка содержит 1-30 мг препарата сухого порошка, содержащего множество частиц порошка дикетопиперозина или его фармацевтически допустимые соли; и приводимый в действие вдохом ингалятор сухого порошка, имеющий сопротивление воздушному потоку 0,065-0,200 (√кПа)/литр в минуту и снабженный мундштуком, контейнером, выполненным с возможностью удерживания порошка и относительно жесткими воздушными каналами, и выполненный с возможностью доставки частиц в малый легочный круг кровообращения пациента в течение одной ингаляции. Раскрыта сухая порошковая композиция для применения в лечении пациентов, страдающих от диабета. Технический результат состоит в повышении стабильности характеристик доставки порошка, удобства использования и устранения дискомфорта пациента. 2 н. и 13 з.п. ф-лы, 42 ил., 12 табл.
1. Ингалятор сухого порошка, содержащий:
1-30 мг препарата сухого порошка, содержащего множество частиц порошка дикетопиперозина или его фармацевтически допустимые соли; и
приводимый в действие вдохом ингалятор сухого порошка, имеющий сопротивление воздушному потоку 0,065-0,200 (√кПа)/литр в минуту и снабженный мундштуком, контейнером, выполненным с возможностью удерживания порошка и относительно жесткими воздушными каналами, и выполненный с возможностью доставки частиц в малый легочный круг кровообращения пациента в течение одной ингаляции, причем указанный ингалятор имеет зоны для осуществления многоступенчатой деагломерации порошка с помощью механизмов, выбранных из вовлечения частиц в воздушный поток, размельчения частиц, размера распыляющего отверстия для частиц, выходящих из контейнера, ускорения, замедления, изменения направления потока, расщепления частиц, захваченных в градиент потока, расширения воздуха, захваченного внутри частиц,
участки ингалятора, образующие первый путь потока для 20-70% объема воздуха через ингалятор, причем указанный путь продолжается от впускного отверстия через указанный контейнер к мундштуку, и воздух, входящий в камеру, вовлекающий частицы в поток;
участки ингалятора, образующие второй путь потока для 30-80% объема воздуха через ингалятор, причем указанный второй путь потока обходит указанное впускное отверстие в указанной камере и сходится с первым путем, когда указанный первый путь выходит из камеры; причем
первый путь потока изменяет направление там, где сходится со вторым путем, причем псевдоожиженные частицы, выходящие из камеры, расщепляются при контакте с потоком во втором пути потока, при этом указанный ингалятор выполнен с рабочей возможностью обеспечения перепада давления по меньшей мере 2 кПа через него в течение 2 секунд; так что
площадь, создаваемая под кривой в первую секунду (AUC0-1sec) для кривой зависимости давления при вдохе от времени, составляет по меньшей мере около 1,0 кПа×секунду; и
выпуска или выброса более чем 75% препарата сухого порошка в виде частиц порошка, имеющих объемный медианный геометрический диаметр меньше 5 микрометров, и не более 1,33-кратного медианного размера частиц, когда перепад давления в ингаляторе составляет 6 кПа.
2. Ингалятор по п.1, в котором дикетопиперазин имеет формулу 2,5-дикето-3,6-бис(N-X-аминобутил)пиперазин, где X выбран из группы, состоящей из фумарила, сукцинила, малеила и глутарила.
3. Ингалятор по п.1, в котором дикетопиперазин представляет собой:

4. Ингалятор по п.3, в котором отношение изомеров транс/цис соединения FDKP находится в диапазоне 50%-65%.
5. Ингалятор по любому из предшествующих пунктов, в котором сухой порошковый препарат содержит активный ингредиент.
6. Ингалятор по п.5, в котором активный ингредиент представляет собой белок, пептид, полипептид или их фрагменты.
7. Ингалятор по п.5, в котором активный ингредиент содержит инсулин.
8. Ингалятор по п.5, в котором активный ингредиент содержит глюкагон, глюкагоноподобный пептид-1, паратироидный гормон, окситоцин, оксинтомодулин, пептид YY, экзендин, их аналоги или фрагменты.
9. Ингалятор по п.5, в котором активный ингредиент содержит любой из:
a) лекарство или активное средство;
b) эндокринный гормон;
c) полипептид или его фрагменты, малую органическую молекулу или молекулу нуклеиновой кислоты;
d) вазодилататоры, вазоконстрикторы, агонисты нейротрансмиттеров, антагонисты нейротрансмиттеров или стероиды.
10. Ингалятор по п.1, в котором один вдох создает площадь под кривой (AUC) для кривой зависимости давления от времени в течение 1 секунды по меньшей мере около 1,2 кПа×сек.
11. Сухая порошковая композиция для применения в лечении пациентов, страдающих от диабета, для подавления прандиальных колебаний глюкозы и высвобождения глюкозы из печени, причем указанная композиция содержит частицы инсулина и дикетопиперазина или их фармацевтически допустимые соли, и
предназначенная для введения в приводимый в действие вдохом ингалятор сухого порошка, имеющий сопротивление воздушному потоку 0,065-0,200 (√кПа)/литр в минуту и выполненный с возможностью доставки частиц в малый легочный круг кровообращения пациента в течение одной ингаляции, причем указанный ингалятор выполнен с возможностью осуществления многоступенчатой деагломерации порошка с помощью механизмов, выбранных из вовлечения частиц в воздушный поток, размельчения частиц, размера распыляющего отверстия для частиц, выходящих из контейнера, ускорения, замедления, изменения направления потока, расщепления частиц, захваченных в градиент потока, расширения воздуха, захваченного внутри частиц,
для обеспечения перепада давления по меньшей мере 2 кПа через него в течение 2 секунд; так что
площадь, создаваемая под кривой зависимости давления при вдохе от времени в первую секунду (AUCO-lsec), составляет по меньшей мере около 1,0 кПа×секунду; и
выпуска или выброса более чем 75% препарата сухого порошка в виде частиц порошка, имеющих объемный медианный геометрический диаметр (VMGD) меньше 5 микрометров, и не более 1,33-кратного медианного размера частиц, когда перепад давления в ингаляторе составляет 6 кПа.
12. Композиция по п.11, выполненная с возможностью введения для обеспечения концентрации инсулина Cmax менее чем за 30 минут после одной ингаляции.
13. Композиция по п.11 или 12, в которой дикетопиперазин имеет формулу 2,5-дикето-3,6-бис(N-X-аминобутил)пиперазин, где X выбран из группы, состоящей из фумарила, сукцинила, малеила и глутарила.
14. Композиция по п.11 или 12, в которой дикетопиперазин представляет собой:
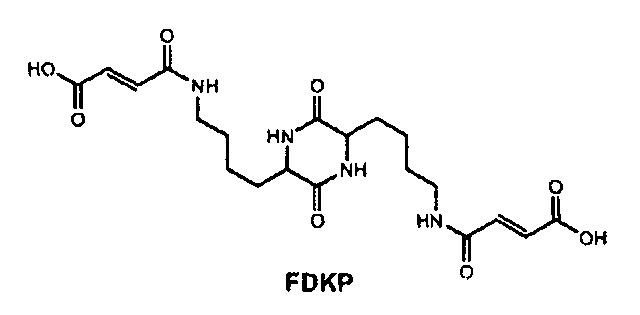
15. Композиция по п.14, в которой отношение изомеров транс/цис соединения FDKP находится в диапазоне 50%-65%.
| US 2009308390 A1, 17.12.2009 | |||
| US 7305986 B1, 11.12.2007 | |||
| Устройство для отделения газа при бурении дегазационных скважин | 1982 |
|
SU1082971A1 |
| ИНГАЛЯТОР ДЛЯ ДОЗИРОВАННОГО ВВЕДЕНИЯ ЛЕКАРСТВЕННОГО ПОРОШКА ПРИ ЕСТЕСТВЕННОМ ВДОХЕ | 1992 |
|
RU2077893C1 |
Авторы
Даты
2014-10-20—Публикация
2011-06-21—Подача