Настоящее изобретение относится к питательной композиции, более конкретно к питательной композиции для младенцев, которая может способствовать снижению риска развития ожирения в более старшем возрасте.
Материнское молоко рекомендовано для всех младенцев. Однако в некоторых случаях грудное вскармливание бывает недостаточным, или безуспешным, или нецелесообразным по медицинским причинам, или же мать отказывается от кормления грудью вообще или в течение периода более нескольких недель. Для таких случаев разработаны смеси для питания младенцев.
За последние 30 лет распространенность ожирения и избыточного веса у взрослых, детей и подростков в Соединенных Штатах и в мировом масштабе сильно возросла и продолжает увеличиваться. По всему миру от детского ожирения и избыточного веса в настоящее время страдают 18 миллионов детей в возрасте до 5 лет. Почти 30% детей и подростков в США и 10-30% детей в Европе имеют избыточный вес или страдают ожирением.
Все чаще и чаще признается, что первые 6 месяцев жизни представляют один из самых важных постнатальных периодов в отношении развития жировой массы у человека и, следовательно, могут являться критическим периодом в отношении закладывания предпосылок для появления избыточной жировой массы в более старшем возрасте. Более того, данные по эпидемиологии человека и результаты исследований на животных свидетельствуют, что увеличенная масса тела при рождении или в грудном возрасте связана с риском развития таких заболеваний, как метаболический синдром, диабет типа 2 и проблемы с сердечно-сосудистой системой в более старшем возрасте.
Korotkova и др. исследовали влияние соотношения содержания линолевой кислоты (LA) к α-линоленовой кислоте (ALA) в материнской диете на уровни сывороточного лептина у их подсосных детенышей и нашли, что в случаях скармливания маткам диеты, богатой ALA (соотношение LA/ALA 0,42), у их подсосных детенышей происходило снижение уровней сывороточного лептина по сравнению с подсосными детенышами, матери которых получали диету, содержащую как LA, так и ALA (соотношение LA/ALA 9,0). Средние уровни сывороточного лептина у третьей группы детенышей, матерям которых скармливалась диета, обогащенная LA (отношение LA/ALA 216), находились между уровнями в двух других группах, но отличались от них незначительно. Авторы занялись изучением уровней сывороточного лептина у детенышей, поскольку в ряде более ранних исследований уже было предположено, что уровни циркулирующего во время перинатального периода лептина могут иметь важное значение для нормального развития и состояния здоровья. Основываясь на своих обнаружениях, они пришли к предположению того, что в отношении роста жировой ткани более важным могут быть не количества в материнской диете LA или ALA per se, а баланс между содержанием LA и ALA (Korotkova и др., "Leptin levels in rat offspring are modified by the ratio oflinoleic to a-linolenic acid in the maternal diet" Journal of Lipid Research, том 43, 2002, страницы 1743 -1749).
В WO2008/054192 заявляется, что общая масса жировой ткани младенца не является хорошим прогностическим фактором для определения риска заболевания в более старшем возрасте и что в этом качестве скорее следует принимать во внимание накопление в раннем грудном возрасте висцеральной жировой массы. Было показано, что количество висцеральных адипоцитов определяется прежде всего в младенчестве, и авторы изобретения WO2008/054192 полагают, что было бы полезно обладать возможностью контроля висцерального адипогенеза в течение этого периода. Предлагаемое в WO2008/054192 решение состоит в том, чтобы снижать количества скармливаемой младенцам LA таким образом, чтобы соотношение LA/ALA составляло 2-6, обеспечивая в то же самое время, чтобы содержание LA составляло бы менее 14,5 масс.% от общего количества жирных кислот.
Однако этот подход может иметь практические ограничения в том, что касается питания человеческих младенцев, в связи с тем, что и LA, и ALA являются незаменимыми жирными кислотами, то есть жирными кислотами, которые не могут синтезироваться организмом.
Поэтому очевидно наличие потребности в альтернативных подходах к питанию, направленных на снижение накопления жировой массы на протяжении детского возраста и уменьшение тем самым риска развития ожирения в более старшем возрасте, а также риска развития заболеваний, связанных с таким ожирением.
Сущность изобретения
Авторы настоящего изобретения неожиданно обнаружили, что кормление на протяжении грудного возраста композицией, относительно богатой α-линоленовой кислотой, ослабляет накопление общей жировой массы в более старшем возрасте.
Соответственно, настоящее изобретение обеспечивает питательную композицию, содержащую источник белков, источник липидов и источник углеводов, в которой источник липидов включает по меньшей мере 16 масс.% линолевой кислоты и по меньшей мере 2 масс.% α-линоленовой кислоты от общего содержания жирных кислот, причем эти количества таковы, что соотношение линолевой кислоты к α-линоленовой кислоте находится в диапазоне от 1 до 10.
Изобретение также распространяется на применение линолевой кислоты и α-линоленовой кислоты в производстве питательной композиции, предназначенной для введения младенцу в первые шесть месяцев жизни младенца с тем, чтобы снизить риск развития ожирения в более старшем возрасте. При этом данная композиция включает по меньшей мере 16 масс.% линолевой кислоты и по меньшей мере 2 масс.% α-линоленовой кислоты от общего содержания в композиции жирных кислот, и в таких количествах, что соотношение содержания линолевой кислоты к α-линоленовой кислоте находится в диапазоне от 1 до 10.
Изобретение, кроме того, распространяется на способ снижения риска того, что у младенца в более старшем возрасте разовьется ожирение, включающий кормление младенца в течение шести месяцев его жизни питательной композицией, содержащей источник белков, источник липидов и источник углеводов, при этом источник липидов включает по меньшей мере 16 масс.% линолевой кислоты и по меньшей мере 2 масс.% α-линоленовой кислоты от общего содержания жирных кислот, причем эти количества таковы, что соотношение линолевой кислоты к α-линоленовой кислоте находится в диапазоне от 1 до 10.
Не претендуя на теоретическую глубину, авторы настоящего изобретения, исходя из своих экспериментальных наблюдений, полагают, что кормление на протяжении грудного возраста диетой, богатой α-линоленовой кислотой, может некоторым образом ослабить любое из двух или оба вместе из адипогенеза и увеличения размеров адипоцитов, и что эти благоприятные эффекты могут сохраняться в будущем, снижая таким образом риск развития ожирения в более старшем возрасте. Кроме того, ожирение, как известно, связано с увеличенным риском таких состояний, как резистентность к инсулину и отсутствие толерантности к глюкозе, которые могут приводить к развитию диабета 2 типа.
Краткое описание чертежей
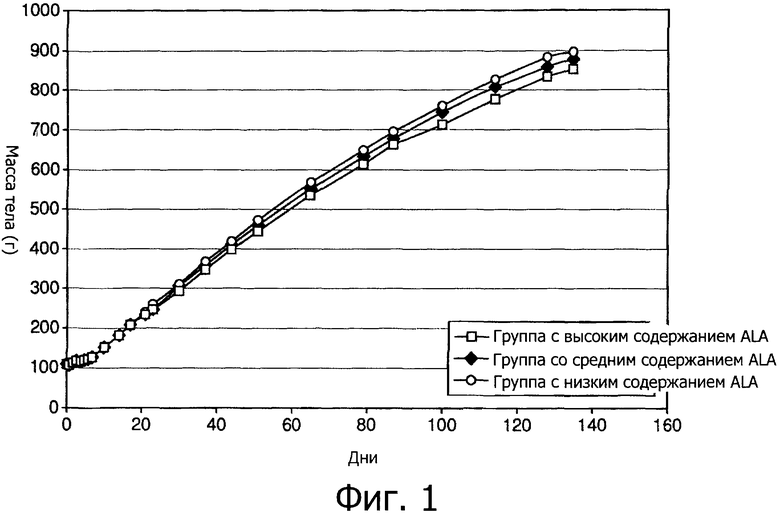
Фигура 1 показывает постепенное изменение массы тела трех групп детенышей морской свинки, получавших на протяжении первых 136 дней жизни различные диеты.
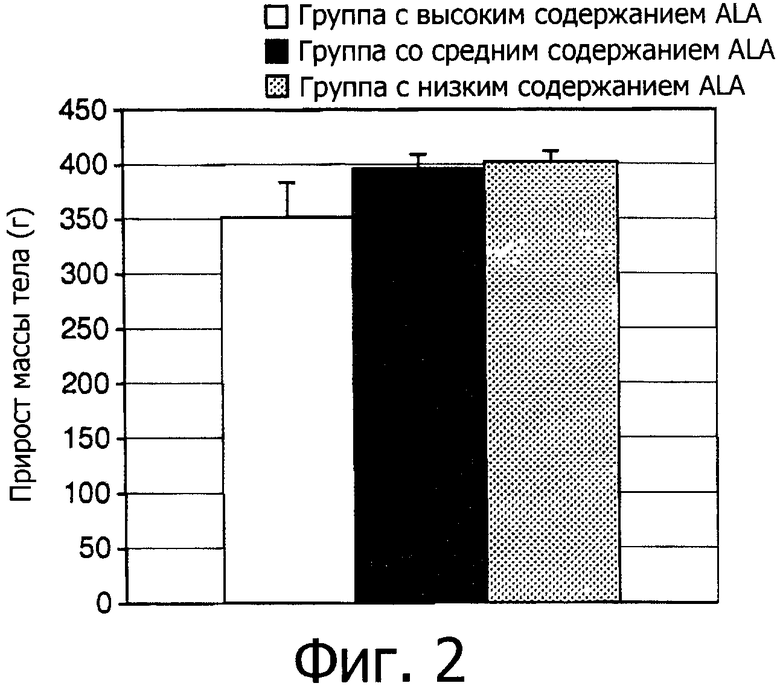
Фигура 2 показывает усредненные показатели прибавления в массе тела детенышей в трех группах между 21 днем и 79 днем.
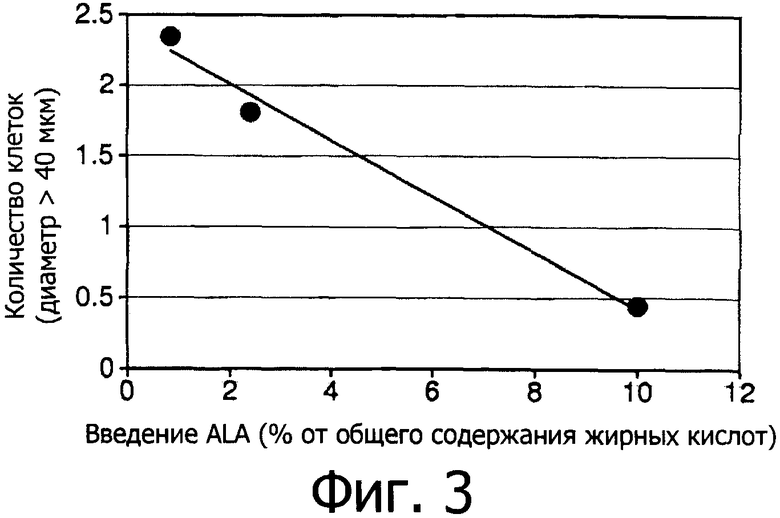
Фигура 3 показывает количество крупных адипоцитов, представленное в виде графической зависимости от потребления ALA.
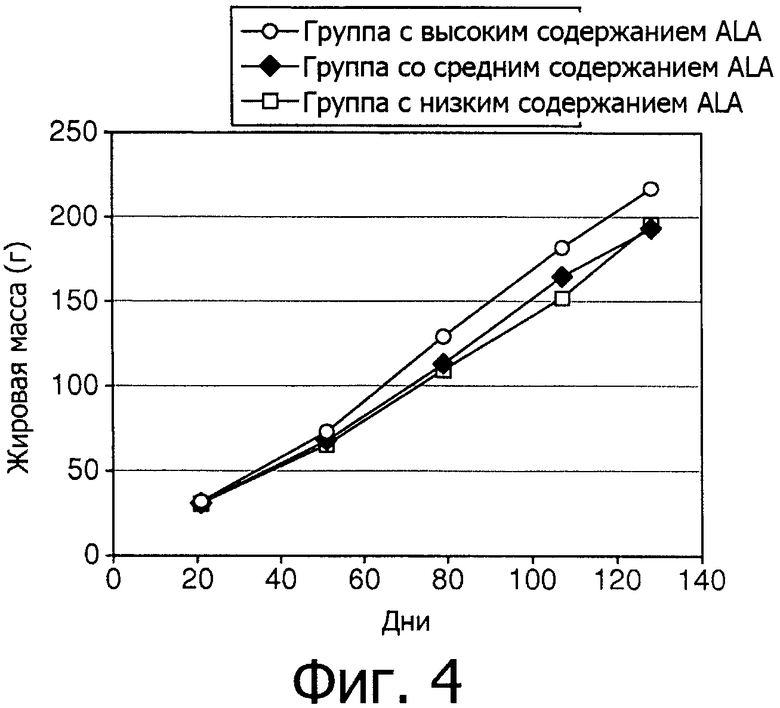
Фигура 4 показывает выраженные в граммах постепенные изменения жировой массы в трех группах с 21 дня по 128 день.
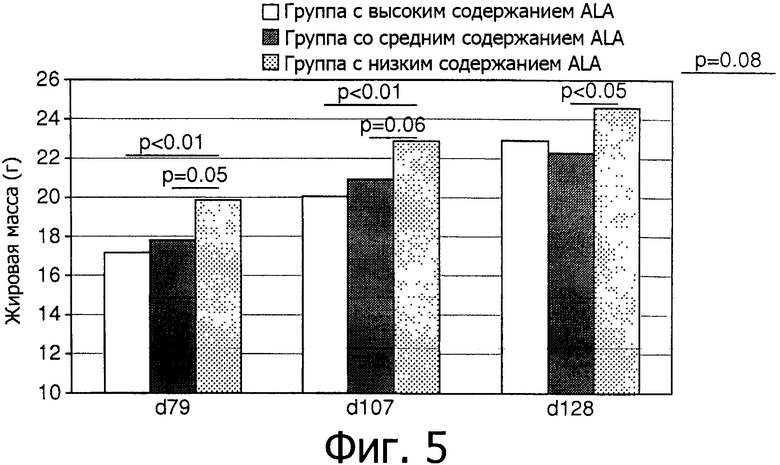
Фигура 5 показывает выраженные в процентах от общей массы тела постепенные изменения жировой массы в трех группах в 79 день, 107 день и 128 день.
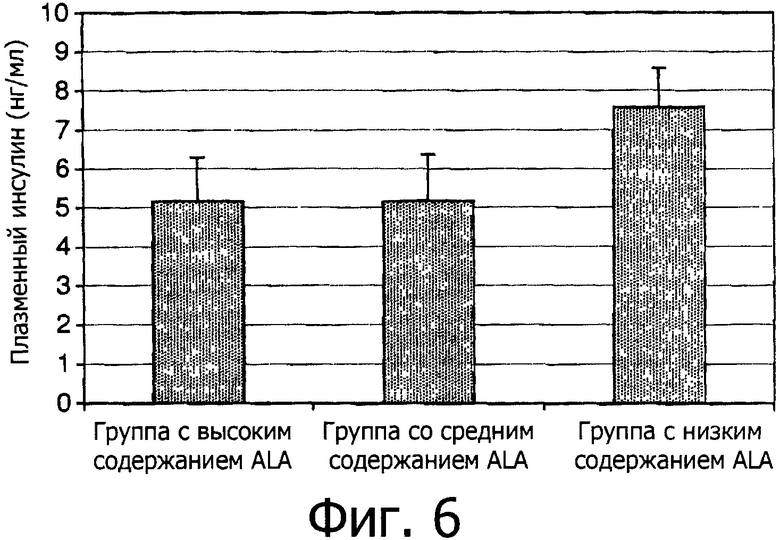
Фигура 6 показывает средние плазменные уровни инсулина трех групп в 136 день.
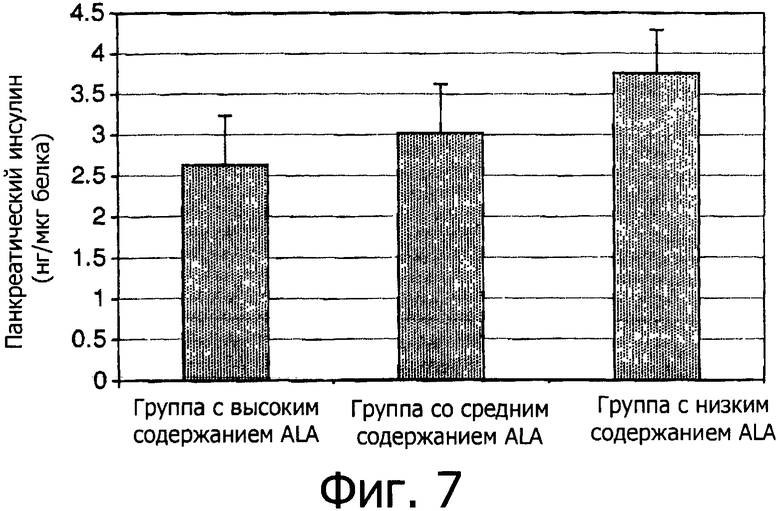
Фигура 7 показывает уровни содержания панкреатического инсулина в трех группа в 136 день.
Раскрытие изобретения
В данном описании следующие выражения имеют значения, соответствующие представленным ниже.
«ALA» означает α-линоленовую кислоту (С18:3n-3).
«Младенец» означает ребенка младше 12 месяцев и соответственно должен истолковываться и термин «младенчество». Для целей настоящего документа термин «младенец» включает молодых детенышей животных, таких как молодые домашние животные, молодые собаки, молодые лошади или молодые кошки.
«LA» означает линолевую кислоту (С18:2n-6).
«В более старшем возрасте» применительно к младенцу означает любой момент на протяжении жизни после завершения периода младенчества. Одним примером такого момента может быть возраст «жирового рикошета», который у человеческих младенцев обычно происходит в возрасте между пятью и шестью годами.
Все процентные содержания и соотношения, если не указывается иного, представлены массовыми процентами.
Питательная композиция согласно настоящему изобретению содержит по меньшей мере 16% LA и по меньшей мере 2% ALA. Предпочтительно содержание LA находится в диапазоне от 18 до 30% от общего содержания жирных кислот, более предпочтительно от 18 до 25%. Предпочтительно содержание ALA находится в диапазоне от 2 до 12% от общего содержания жирных кислот, более предпочтительно от 6 до 11%. Величина соотношения LA:ALA предпочтительно находится в диапазоне от 2 до 6.
Предпочтительно питательная композиция настоящего изобретения имеет содержание белка менее 1,85 г/100 ккал. Подробная структура источника белка для настоящего изобретения в качестве критической не рассматривается при условии, что удовлетворяются минимальные требования по содержанию незаменимых аминокислот и обеспечивается удовлетворительный рост. Так, могут использоваться источники белка, основанные на белках коровьего молока, такие как сыворотка, казеин и их смеси, а также источники белка, основанные на сое. Однако предпочтительными являются смеси сывороточных белков и белков казеина. Величина соотношения казеина и сыворотки может лежать в диапазоне от 70:30 до 30:70, но предпочтительно 30:70.
Белок(-и) в источнике белка может быть интактным или частично гидролизованным, или же может использоваться смесь интактных и гидролизованных белков. Источник белка может быть, кроме того, дополнен свободными аминокислотами, если это оказывается необходимым для удовлетворения минимальных требований по содержанию незаменимых аминокислот. Эти требования опубликованы, например, в Директиве ЕС 2006/141/ЕС.
Как отмечалось выше, предпочтительным источником белка является смесь казеина и сывороточных белков. Сывороточный белок может являться изолятом сывороточного белка, кислой сывороткой, сладкой сывороткой или сладкой сывороткой, из которой был извлечен казеин-гликомакропептид (модифицированная сладкая сыворотка). Однако предпочтительно сывороточный белок является модифицированной сладкой сывороткой. Сладкая сыворотка является легко доступным побочным продуктом изготовления сыров и часто используется в производстве питательных композиций, основанных на коровьем молоке. Однако сладкая сыворотка включает компонент, именуемый казеин-гликомакропептидом (CGMP), который имеет нежелательно высокое содержание треонина и недостаточное - триптофана. Удаление CGMP из сладкой сыворотки приводит к белку с более близким к женскому молоку содержанием треонина. Способ удаления CGMP из сладкой сыворотки описан в ЕР 880902.
Если в качестве сывороточного белка применяется модифицированная сладкая сыворотка в смеси из 70% сыворотки и 30% казеина, источник белка может быть дополнен свободным гистидином в количестве 0,1-0,3% от общего содержания белка.
Питательная композиция настоящего изобретения содержит источник углеводов. Предпочтительным источником углеводов является лактоза, хотя также могут добавляться и другие углеводы, такие как сахароза, мальтодекстрин и крахмал. Предпочтительно содержание углеводов в питательной композиции составляет 9-14 г/100 ккал.
Питательная композиция настоящего изобретения содержит источник липидов. В дополнение к LA и ALA источник липидов может включать любой липид или жир, который является подходящим для применения в питательных композициях, предназначенных для питания младенцев. Предпочтительные источники жиров включают кокосовое масло, низкоэруковое рапсовое масло (маслоканолы), лецитин сои, пальмовый олеин и подсолнечное масло. Источник липидов может также включать небольшие количества предварительно обработанных длинноцепочечных полиненасыщенных жирных кислот: арахидоновой кислоты (С20:4n-6) и докозагексаеновой кислоты (С22:6n-3). Подходящим источником докозагексаеновой кислоты является рыбий жир, альтернативным вариантом подходящих источников как арахидоновой кислоты, так и докозагексаеновой кислоты являются масла, получаемые из одноклеточных микроорганизмов. В целом содержание липидов может составлять 4,4-6 г/100 ккал. Соотношение содержания арахидоновой кислоты и докозагексаеновой кислоты в источнике липидов предпочтительно составляет между 2:1 и 1:1.
Питательная композиция может также содержать в существенных количествах все витамины и минеральные вещества, которые рассматриваются в качестве незаменимых в повседневном пищевом рационе. По некоторым витаминам и минеральным веществам были установлены минимальные требования. Примеры минеральных веществ, витаминов и других питательных веществ, возможно присутствующих в данной питательной композиции, включают витамин А, витамин В1, витамин В2, витамин В6, витамин В12, витамин Е, витамин К, витамин С, витамин D, фолиевую кислоту, инозитол, никотиновую кислоту, биотин, пантотеновую кислоту, холин, кальций, фосфор, йод, железо, магний, медь, цинк, марганец, хлор, калий, натрий, селен, хром, молибден, таурин и L-карнитин. Минеральные вещества обычно добавляются в виде солей.
В случае необходимости питательная композиция может содержать эмульгаторы и стабилизаторы, такие как лецитин сои, моно- и диглицеридные эфиры лимонной кислоты и т.п. Это, в частности, имеет место, когда композиция представляется в жидкой форме.
Питательная композиция может содержать и другие способные оказывать благоприятное воздействие материалы, такие как пробиотические бактерии, волокна, лактоферрин, нуклеотиды, нуклеозиды и другие подобные в количествах, обычных для питательных композиций, предназначенных для питания младенцев.
Питательная композиция может быть приготовлена любым подходящим способом. Например, питательная композиция может готовиться смешиванием в соответствующих пропорциях источника белка, источника углеводов и источника липидов. В случае их применения на данном этапе могут быть внесены эмульгаторы. На данном этапе могут также добавляться витамины и минеральные вещества, но обычно они прибавляются позднее в целях избежания теплового разложения. Любые липофильные витамины, эмульгаторы и т.п. могут быть перед смешиванием растворены в источнике жиров. Затем для получения жидкой смеси может примешиваться вода, предпочтительно вода, подвергнутая обработке обратным осмосомт
Жидкая смесь может быть затем подвергнута термической обработке для снижения бактериальной нагрузки. Например, жидкая смесь может быть быстро нагрета до температуры в диапазоне от около 80°С до около 110°С в течение от около 5 секунд до около 5 минут. Это может быть осуществлено нагнетанием пара или с помощью теплообменника, например пластинчатого теплообменника.
Затем жидкая смесь может быть охлаждена до температуры от около 60°С до около 85°С, например, мгновенным охлаждением. После чего жидкая смесь может быть гомогенизирована, например, в два этапа: при давлении от около 7 МПа до около 40 МПа на первом этапе и от около 2 МПа до около 14 МПа на втором этапе. Далее гомогенизированная смесь может быть дополнительно охлаждена, после чего могут добавляться какие-либо чувствительные к нагреванию компоненты, такие как витамины и минеральные вещества. На данном этапе удобно стандартизуются величина рН и содержание сухих веществ в гомогенизированной смеси.
Если желательно получение порошкообразной композиции, гомогенизированная смесь поступает в подходящее сушильное устройство, такое как распылительная сушилка или установка для сублимационной сушки, и преобразуется в порошок. Порошок должен иметь влажность менее чем около 5 масс.%.
Если желательно получение жидкой композиции, гомогенизированная смесь разливается в подходящие контейнеры, предпочтительно в асептических условиях. Однако жидкая композиция может также стерилизоваться в контейнере. Подходящее устройство для осуществления наполнения подобного рода доступно в продаже. Жидкая композиция может быть в форме готовой к вскармливанию композиции, имеющей содержание сухих веществ от около 10 до около 14 масс.%, или же может быть представлена в виде концентрата с обычным содержанием сухих веществ от около 20 до около 26 масс.%.
Далее изобретение иллюстрируется на основании нижеследующих примеров.
Пример 1
Ниже представлен пример питательной композиции согласно изобретению.
Питательная композиция согласно изобретению может скармливаться младенцу в качестве единственного источника питания от момента рождения и до возраста четырех-шести месяцев, а впоследствии - как часть смешанной диеты в ходе приучения к твердой пище до полного отлучения ребенка от груди в возрасте около 12 месяцев.
Пример 2
В этом примере исследовалось действие кормовых рационов, содержащих различные количества LA и ALA, на новорожденных детенышей морской свинки в отношении развития у детенышей общей жировой массы в период после прекращения получения грудного вскармливания. Детеныши морской свинки считаются хорошим модельным животным для изучения прогнозов развития жировой массы у человеческих младенцев, поскольку, как и новорожденные человеческие младенцы, детеныши морской свинки рождаются со значительным количеством туловищного жира, в то время новорожденные крысиные детеныши являются очень худыми.
План исследования
Новорожденные самцы морских свинок были разделены на три группы по 20 животных в каждой группе. Каждая группа в течение 21 дня получала диету для подсосных/отлучаемых от грудного вскармливания детенышей, в которой 44% энергии обеспечивалось жиром. Различные диеты были изокалорийными и отличались только содержанием ALA. Диета с высоким содержанием ALA имела 10% ALA по отношению к общему количеству жирных кислот, диета со средним содержанием ALA содержала 2,4% ALA по отношению к общему количеству жирных кислот и диета с низким содержанием ALA имела 0,85% ALA по отношению к общему количеству жирных кислот. Уровни содержания LA сохранялись между диетами относительно постоянными, такими, чтобы величины соотношений LA: ALA составляли около 2, 10 и 30 соответственно. Более подробные сведения о композициях жирных кислот этих трех диет представлены в Таблице 1.
В конце подсосного периода/отлучения от грудного вскармливания (21 день) и до 136 дня все группы получали диету с умеренно высоким содержанием жира (35% энергии из жира), содержащую 2% ALA и 26% LA. Масса тела и жировая масса регистрировались в 21, 51, 79, 107, 128 и 136 дни, а в 21 день и 136 день фиксировались данные по клеточности ретроперитонеальной жировой ткани, составу жирных кислот в плазме и инсулину.
Результаты
Как и ожидалось, в конце подсосного периода/отлучения от грудного вскармливания (21 день) концентрации ALA в фосфолипидной (Таблица 2) и триглицеридной (Таблица 3) фракциях плазмы в группе 10% ALA оказались более высокими, чем в других группах.
Различные символы отображают статистическую значимость при Р<0,05;
ND - не поддающийся обнаружению.
Из Фигуры 1 видно, что средняя масса тела между тремя группами в течение эксперимента значительно не различалась. Однако Фигура 2 показывает, что между 21 днем и 78 днем в группе с высоким содержанием ALA проявилась тенденция к меньшему набору массы тела, чем в других группах.
В конце подсосного периода/отлучения от грудного вскармливания (21 день) общая жировая масса, измеренная методом ЯМР, между группами не различалась. Тем не менее, в среднем диаметр адипоцитных клеток из ретроперитонеальной жировой ткани в группе с высоким содержанием ALA показал тенденцию к меньшим размерам, чем в других группах (Таблица 4).
Группа с высоким содержанием ALA имела меньшее количество адипоцитов в диапазоне больших диаметров (от 30 до 50 мкм) (Таблица 5).
Интересно, что наблюдалась зависимость «доза-эффект» между количеством крупных адипоцитов (>40 мкм) и процентным содержанием ALA в диете. Как видно из Фигуры 3, чем выше было введение ALA, тем меньше оказалось количество крупных адипоцитов.
Как ни удивительно, из Фигур 4 и 5 видно, что группа с низким содержанием ALA имела более высокие показатели жировой массы как в граммах, так и в процентах, чем группа с высоким содержанием ALA, на 79 день (р<0,01), 107 день (р<0,01) и 128 день (Р=0,08).
Плазменные уровни инсулина на 21 день между группами не различались. Однако, как показано на Фигуре 6, в конце эксперимента группа с низким содержанием ALA показала около 1,5-кратное превосходство в концентрациях плазменного инсулина по сравнению с двумя другими группами. Фигура 7 показывает, что подобные результаты наблюдались и в отношении содержания панкреатического инсулина. Группа с низким содержанием ALA показала около 1,4-кратное увеличение содержания панкреатического инсулина по сравнению с группой с высоким содержанием ALA (р=0,08).
Этот пример ясно демонстрирует, что кормление в период младенчества диетой, богатой ALA, играет важную роль в создании предпосылок или закладывании такой «программы» для жировой ткани, которые позволяют снизить ее склонность к чрезмерному развитию в более старшем возрасте. В частности, результаты показывают, что низкое введение ALA с высоким соотношением LA:ALA в период грудного вскармливания/отлучения от груди ведут к возрастанию риска ожирения и склонности к гиперинсулинемии в более старшем возрасте.
Пример 3
В этом примере с помощью метода D2O исследовалось действие кормовых рационов, содержащих различные количества LA и ALA, на новорожденных детенышей морской свинки в отношении скорости пролиферации клеток жировой ткани (АТ-клетки) и de novo липогенеза (DNL). Изучались группа с высоким содержанием ALA и группа с низким содержанием ALA из Примера 2. По десять детенышей в каждой группе получали D2O в течение 5 дней перед умерщвлением в 21 день. Другие 10 детенышей получали D2O в течение 5 дней перед умерщвлением в 136 день. Дейтеризованная вода вводилась интраперитонеально (стерилизованный 0,9% NaCl, 99% D2O по 35 мг/г массы тела) утром первого дня. После этого в течение остальных 5 дней детеныши пили дейтеризованную воду (8% обогащение дейтерием) ad libitum. Затем они умерщвлялись обескровливанием под анестезией изофлураном. Из аорты отбиралась кровь в гепаринизированные виалы (минимум 200 мкл). Отбирались ретроперитонеальные, эпидидимальные и подкожные жировые ткани и печень, а также костный мозг из задней конечности и сохранялись при - 80°С до анализа.
Аналитическая методика была подробно описана ранее (Neese RA, Siler SQ, Cesar D, Antelo F, Lee D, Misell L, Patel K, Tehrani S, Shah P, Hellerstein MK, "Advances in the stable isotope mass spectrometric measurement of DNA synthesis and cell proliferation " Analy Biochem 2001; 298: 189-195). Вкратце, из жировых тканей (около 50 мг) извлекались геномная ДНК АТ-клеток и триглицериды (TG). Обогащение дейтерием ДНК и пальмитата из TG определялось масс-спектрометрией в соединении с газовой хроматографией (GC/MS, Hewlett-Packard, Пало-Альто, Калифорния).
Применение внесения D2O для подсчета репликаций ДНК (пролиферация клеток) и DNL основывается на взаимозависимости предшественник-продукт (Hellerstein MK, Neese R7 "Mass isotopomer-data analysis: a-technique-for measuring-biosynthesis and-turnover of polymers" Am J Physiol 1992; 263: E988-E1001). При этом способе количественным определением доли содержания присутствующих меченых нитей ДНК выполняется подсчет делений клеток, происходивших в течение периода введения меченых атомов. Парциальная пролиферативная активность клеток жировой ткани (FSRcell в % новых клеток/5дней) рассчитывалась как величина ЕМ1 (избыточное изотопное обогащение) в ДНК жировой ткани, деленная (подвергнутая нормализации) на ЕМ1 в ДНК костного мозга. Обогащение костного мозга использовалось для аппроксимации величины максимально достижимого для каждого животного обогащения ДНК.
DNL или «парциальная интенсивность синтеза пальмитата» (FSRpalmitate в % нового пальмитата/5 дней) в TG вычислялась по вхождению меченого дейтерия из воды в TG-пальмитат с помощью анализа изотопно-массового распределения (MIDA). Настоящая величина максимально достижимого обогащения пальмитата дейтерием была рассчитана на основе измеренных показателей обогащения организма водой (подробно вычисления представлены в Hellerstein МК and Neese RA "Mass isotopomer distribution analysis at eight years: theoretical, analytic, and experimental considerations" Am J Physiol 1999; 276: E1146-E1170).
Результаты
Данные по массе жировой ткани и печени сведены в Таблице 6.
Различные символы отображают статистическую значимость при Р<0,05.
* В день 136 для соотношения «высокое/низкое содержание ALA» Р=0,020.
Данные по воздействию применяемых в раннем возрасте диет на парциальную интенсивность синтеза (FSR или парциальную пролиферативную активность) клеток в жировом депо сведены в Таблице 7. АТ-клетки включают клетки любых типов, такие как адипоциты и стромально-васкулярные клетки (предадипоциты, энтероциты, макрофаги и т.д.), всей жировой ткани.
Различные символы отображают статистическую значимость при Р<0,05.
* В день 136 для соотношения «высокое/низкое содержание ALA» Р=0,021.
Эти результаты показывают более высокую (удвоенную) скорость пролиферации клеток в подкожной жировой ткани на день 136 (Р=0,021) и более высокую пролиферацию клеток (но незначительно) в ретроперитонеальной ткани, а также не изменившуюся пролиферацию клеток в эпидидимальных жировых тканях группы с низким содержанием ALA по сравнению с группой с высоким содержанием ALA. Так как подкожная жировая ткань является главным жировым депо всего организма взрослых морских свинок, возрастание пролиферации клеток в этой жировой ткани может объяснить увеличение жировой массы, наблюдаемое после введения ALA в низких количествах (результаты, полученные в Примере 2). Результаты автоматически предполагают, что увеличение жировой массы тела в группе с низким содержанием ALA включает увеличение скорости пролиферации клеток жировой ткани (гиперплазия) у морских свинок в более старшем взрослом возрасте.
Введение ALA в низких количествах не вызывало изменений в de novo липогенезе (DNL) в жировых отложениях, но в группе с низким содержанием ALA на 21 день наблюдался более высокий по сравнению с группой высокого содержания ALA печеночный DNL (Р<0,001) (Таблица 8).
Различные символы отображают статистическую значимость при Р<0,001.
Этот пример 3 показывает, что введение низких количеств ALA в периоды грудного вскармливания/отлучения от груди по состоянию на 21 день увеличивает интенсивность печеночного DNL у морских свинок и увеличивает скорость пролиферации клеток в подкожной жировой ткани у взрослых морских свинок.
| название | год | авторы | номер документа |
|---|---|---|---|
| СНИЖЕНИЕ РИСКА ОЖИРЕНИЯ | 2010 |
|
RU2559646C2 |
| ЭФФЕКТЫ МЕТАБОЛИЧЕСКОГО ИМПРИНТИНГА СПЕЦИАЛЬНО РАЗРАБОТАННОГО ЛИПИДНОГО КОМПОНЕНТА | 2012 |
|
RU2586930C2 |
| ЛИПИДНАЯ СМЕСЬ ДЛЯ ДЕТСКОГО ПИТАНИЯ | 2008 |
|
RU2488283C2 |
| ПИТАТЕЛЬНЫЕ КОМПОЗИЦИИ ДЛЯ МЛАДЕНЦЕВ, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ПРЕДУПРЕЖДЕНИЯ ОЖИРЕНИЯ | 2006 |
|
RU2444210C2 |
| ЛИПИДНАЯ СМЕСЬ ДЛЯ ДЕТСКОГО ПИТАНИЯ | 2008 |
|
RU2611808C2 |
| ЭФФЕКТЫ МЕТАБОЛИЧЕСКОГО ИМПРИНТИНГА СТРУКТУРИРОВАННЫХ ЛИПИДОВ | 2010 |
|
RU2558853C2 |
| ЛИНОЛЕВАЯ КИСЛОТА ИЛИ АЛЬФА-ЛИНОЛЕНОВАЯ КИСЛОТА ДЛЯ ПРИМЕНЕНИЯ С ЦЕЛЬЮ УМЕНЬШЕНИЯ КОГНИТИВНЫХ НАРУШЕНИЙ/СНИЖЕНИЯ НЕЙРОГЕНЕЗА, ИНДУЦИРОВАННЫХ СТРЕССОМ В РАННЕМ ПЕРИОДЕ ЖИЗНИ | 2017 |
|
RU2741495C2 |
| ПИЩЕВЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ЛИПИДНЫЕ ГЛОБУЛЫ С ПОКРЫТИЕМ | 2009 |
|
RU2496343C2 |
| СНИЖЕНИЕ ЖИРОВОЙ МАССЫ ТЕЛА У ГРУДНОГО РЕБЕНКА | 2009 |
|
RU2540541C2 |
| МОДУЛИРОВАНИЕ ПОСТПРАНДИАЛЬНОГО ПОГЛОЩЕНИЯ ЖИРОВ | 2011 |
|
RU2552940C2 |
Изобретение относится к питательной композиции для младенцев. Питательная композиция для введения младенцам в первые шесть месяцев жизни младенца содержит источник белков, источник углеводов и источник липидов, в которой источник липидов включает по меньшей мере 16 масс. % линолевой кислоты и от 6 до 11 масс. % α-линоленовой кислоты от общего содержания жирных кислот. Причем эти количества таковы, что соотношение содержания линолевой кислоты к содержанию α-линоленовой кислоты находится в диапазоне от 1 до 10. Изобретение позволяет снизить риск развития ожирения у ребенка в более старшем возрасте. 2 н. и 5 з. п. ф-лы, 7 ил., 8 табл., 3 пр.
1. Питательная композиция для введения младенцам в первые шесть месяцев жизни младенца, чтобы снизить риск развития ожирения в более старшем возрасте, содержащая источник белков, источник липидов и источник углеводов, в которой источник липидов включает по меньшей мере 16 масс. % линолевой кислоты и от 6 до 11 масс. % α-линоленовой кислоты от общего содержания жирных кислот, причем эти количества таковы, что соотношение содержания линолевой кислоты к содержанию α-линоленовой кислоты находится в диапазоне от 1 до 10.
2. Питательная композиция по п.1, в которой содержание линолевой кислоты находится в диапазоне от 18 до 25% от общего содержания жирных кислот.
3. Питательная композиция по п.1 или 2, в которой соотношение содержания линолевой кислоты к содержанию α-линоленовой кислоты предпочтительно находится в диапазоне от 2 до 6.
4. Применение линолевой кислоты и α-линоленовой кислоты в производстве питательной композиции по любому из пп.1-3, предназначенной для введения младенцам в первые шесть месяцев жизни младенца, чтобы снизить риск развития ожирения в более старшем возрасте.
5. Применение по п.4, где указанный младенец является молодым детенышем домашнего животного, такого как собака или кошка.
6. Применение по п.4, где указанное снижение риска развития ожирения в более старшем возрасте отличается статистически значимым уменьшением жировой массы по сравнению с контрольной популяцией, не получавшей указанной композиции.
7. Применение по п.4, где указанное снижение риска развития ожирения в более старшем возрасте отличается таким снижением риска, которое является очевидным в возрасте «жирового рикошета», например, у человеческих младенцев после достижения возраста 5 лет.
| MASSIERA FLORENCE ET AL: “;Arachidonic acid and prostacyclin signaling promote adipose tissue development: A human health concern?”;, JOURNAL OF LIPID RESEARCH, vol | |||
| Приспособление для плетения проволочного каркаса для железобетонных пустотелых камней | 1920 |
|
SU44A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| АН УССР I I/ '' ^-^'^''0-!^t-^^AEC.;. 12ЯЙЬ^ПУ;.,. , | 0 |
|
SU178530A1 |
| WO2007004878 A2, 11.01.2007 | |||
| EP 1932437 A1, 18.06.2008 | |||
| . | |||
Авторы
Даты
2015-02-10—Публикация
2009-12-16—Подача