Изобретение относится к области медицины, а именно к экспериментальной хирургии, патофизиологии, гастроэнтерологии, и может быть использовано для получения модели язвенного колита у мелких лабораторных животных.
Получение модели язвенного колита представляет интерес не только для экспериментальной медицины, но и для практического здравоохранения, поскольку в настоящее время отмечается рост воспалительных заболеваний кишечника (Ooi CJ, Fock KM, Makharia GK, Goh KL, Ling KL, Hilmi I, Lim WC, Kelvin T, Gibson PR, Gearry RB, et al.: The Asia-Pacific consensus on ulcerative colitis. J Gastroenterol Hepatol 2010, 25(3):453 - 468).
Известен способ моделирования тотального ишемического некроза толстой кишки у экспериментальных животных путем перевязки краниальных или каудальных брыжеечных артерий, вен и их ответвлений (Шалимов С.А., Радзиховский А.П., Кейсевич Л.В. Руководство по экспериментальной хирургии. - М., 1989. - с. 207).
Первые признаки инфаркта кишечника появляются через 10-15 минут после лигирования сосудов, а полностью развиваются в течение шести часов. При лигировании артерии, непосредственно отходящей от основного ствола, летальный исход наступает не позднее 24-30 часов после операции. Одновременная перевязка брыжеечных артерии и вены также ведет к гибели животного через 4-5 часов.
К недостаткам данного способа следует отнести:
- отсутствие образования язвенных дефектов и васкулитов в кишечной стенке вследствие одномоментного протекания ишемического некроза.
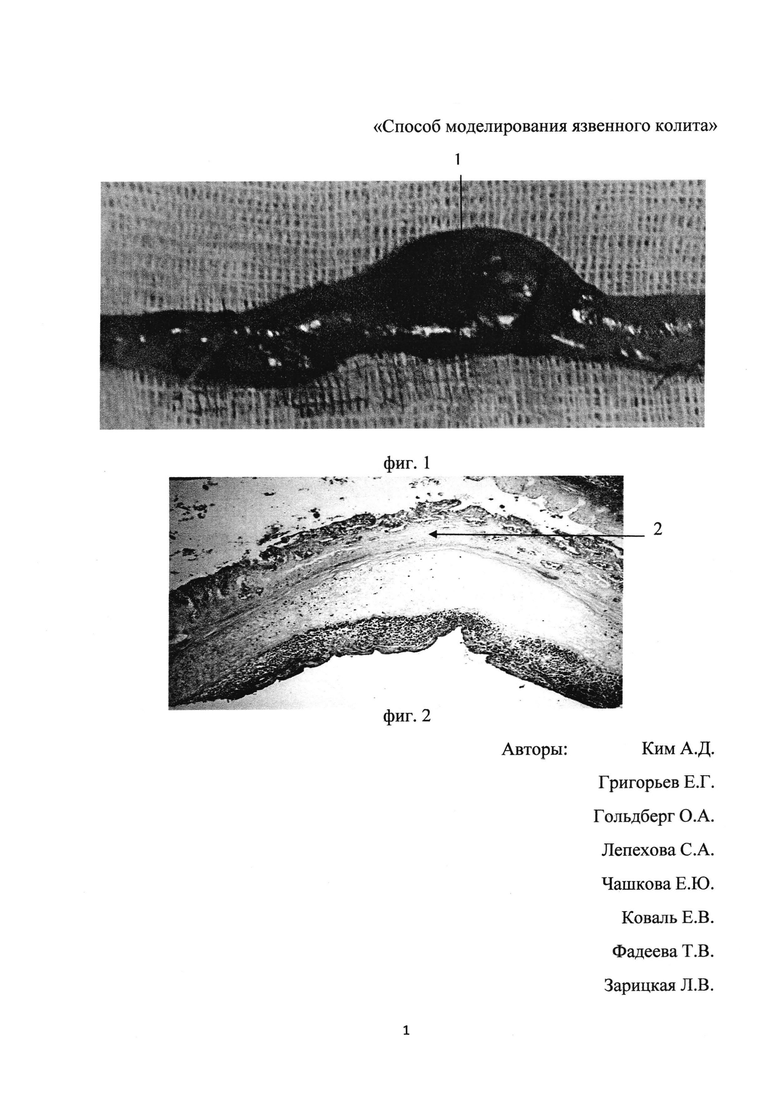
Проведенный авторами предлагаемого технического решения эксперимент по получению модели по вышеописанному способу на крысах линии «Wistar», показал, что при перевязке сосудов макроскопически был выявлен некроз кишки (фиг. 1, где 1 - участок гангрены тостой кишки); при гистологическом исследовании - некроз кишечной стенки без формирования язвенных дефектов (фиг. 2, где 2 - участок некроза кишечной стенки).
- получаемая модель не позволяет изучать изменения в стенке толстой кишки в динамике исследования, т.к. смоделированная патология заканчивается либо смертью экспериментального животного из-за большого участка некроза кишки, либо выздоровлением без признаков хронического воспаления в зоне ишемии;
- сложность стандартизации модели по полу, возрасту и весу используемых лабораторных животных - собак, в том числе из-за особенностей кровоснабжения кишечника у этих животных;
- отсутствует стандарт оперативного вмешательства, не указаны размеры участка перевязки сосудов.
Наиболее близким по технической сущности к предлагаемому является способ моделирования язвенного колита, заключающийся в том, что экспериментальному животному в слепую кишку внутрипросветно одновременно вводят 45-50%-ный спиртовой раствор пикрилсульфоновой кислоты в дозе 0,8-1,0 мл/кг, 1-1,5%-ный водный раствор метиленового синего в дозе 1,5-2,0 мл/кг и индерал в дозе 0,5-1,0 мг/кг (Пат. RU 2316055, МПК G09B 23/28. Способ моделирования неспецифического язвенного колита / Лычкова А.Э.: заявитель и патентообладатель Лычкова А.Э. - №2006112133/14; заявл. 13.04.2006; опубл. 27.01.2008).
Известный способ реализовывали на крысах породы Вистар весом 250-270 г в условиях хирургической стадии нембуталового наркоза (40-60 мг/кг). Регистрировали электромоторную активность (ЭМА) слепой и подвздошной кишки с помощью биполярных поверхностных электродов площадью контактной поверхности 1,5-2 мм. Регистрацию проводили с помощью многоканального полиграфа Nishon-Konden. Фоновая ЭМА слепой кишки характеризовалась медленноволновой активностью с частотой 10,7±1,9 в мин и амплитудой 0,24±0,04 мВ. Фоновая ЭМА слепой кишки характеризовалась достаточно интенсивной электрической и механической составляющей. Фоновая ЭМА подвздошной кишки характеризовалась высокочастотными (20,8±3,2 в мин) и среднеамплитудными (0,52±0,07 мВ) медленными волнами, т.е. фоновая моторная активность подвздошной кишки была достаточно интенсивна.
Затем экспериментальному животному в слепую кишку внутрипросветно одновременно вводили 45-50% спиртовой раствор пикрилсульфоновой кислоты в дозе 0,8-1,0 мл/кг, 1-1,5% водный раствор метиленового синего в дозе 1,5-2,0 мл/кг и индерал в дозе 0,5-1,0 мг/кг.
Моделирование неспецифического язвенного колита сопровождалось угнетением ЭМА слепой кишки (частота медленных волн составила 7,6±1,2 в мин, амплитуда - 0,27±0,05 мВ) и угнетением ЭМА подвздошной кишки (частота уменьшилась до 18,1±1,2 в мин (12,5%), амплитуда - до 0,34±0,03 мВ (на 34,6%, p<0,05).
Морфологическое исследование биоптатов слепой кишки на 10-й день моделирования показало соответствие клинико-морфологических характеристик неспецифическому язвенному колиту - язвенно-воспалительный процесс в слепой кишке.
К недостаткам известного способа моделирования следует отнести то, что он не обеспечивает возможности получения модели с типичной клиникой проявлений язвенного колита, т.к.:
1) отсутствуют язвенные поражения слизистой и подслизистой толстой кишки;
2) отсутствует наличие аутоиммунного компонента в виде васкулита, характерного для пациентов, страдающих воспалительными заболеваниями кишечника;
3) отсутствует нарушение кровоснабжения в стенке толстой кишки, т.к. у пациентов помимо язвенных дефектов в толстой кишке также отмечается нарушение кровоснабжения в ее стенке;
4) по известному способу невозможно получить прогрессирование язвенного дефекта с пенетрацией в брыжейку с участками эпителизации по краям язвенного дефекта, характерного для такого заболевания;
5) получаемое повреждение является неконтролируемым тяжелым химическим ожогом слизистой оболочки как толстой, так и тонкой кишки;
6) слепая кишка не является местом манифестации заболевания, т.к. в клинике заболевание начинается с нисходящего отдела толстой кишки.
Следовательно, получаемые изменения в толстой кишке подопытных животных в способе-прототипе не соответствуют изменениям в толстой кишке пациентов, страдающих воспалительными заболеваниями кишечника.
Задачей заявляемого технического решения является разработка способа моделирования язвенного колита, приближенного к его клиническому течению.
Техническим результатом предлагаемого способа является обеспечение возможности получения модели язвенного колита с характеристиками его клинического течения.
Технический результат достигается тем, что самцам крыс линии «Wistar» выполняют ишемизацию стенки толстой кишки, для этого на уровне нисходящего отдела толстой кишки, на протяжении 3 см от основания мочевого пузыря, пристеночно выделяют, перевязывают и пересекают с сопровождающими венами прямые ветви левой артерии толстой кишки и краниальной прямокишечной артерии.
Отличительным приемом предлагаемого способа также является и то, что после ишемизации стенки толстой кишки в течение семи послеоперационных суток экспериментальным животным обеспечивают свободный доступ к пище и к 1% водному раствору декстрана сульфата натрия.
Сопоставительный анализ заявляемого технического решения с ближайшим аналогом позволяет сделать вывод о соответствии заявляемого технического решения критерию изобретения «новизна».
Перевязка пристеночных сосудов на протяжении 3 см от основания мочевого пузыря вызывает ишемию стенки толстой кишки, что приводит к нарушению ее барьерной функции и создает условия развития язвенного поражения слизистого и подслизистого слоев толстой кишки. Нарушение кровоснабжения стенки толстой кишки позволило получить модель язвенного колита с характерным клиническим проявлением данного заболевания.
Авторами предлагаемого способа моделирования установлено, что оральное введение 1% водного раствора ДСН в течение семи послеоперационных суток приводит к формированию васкулитов, поддерживает воспаление и препятствует заживлению кишечной стенки со стороны слизистой на фоне ишемии, т.е. является необходимым и достаточным для развития язвенного поражения стенки толстой кишки. Гистологическая картина и характеристика развивающегося воспалительного процесса в стенке толстой кишки соответствует язвенному колиту у пациентов с ВЗК, следовательно, заявляемый способ обеспечивает возможность получения модели язвенного поражения толстой кишки на экспериментальном животном. Изложенное позволяет сделать вывод о соответствии заявляемого технического решения критерию «изобретательский уровень».
Способ, составляющий заявляемое изобретение, предназначен для использования в экспериментальной хирургии и патофизиологии. Возможность его осуществления подтверждена описанными в заявке приемами и средствами, следовательно, предлагаемое решение соответствует критерию изобретения «промышленная применимость».
Заявляемый способ осуществляют следующим образом. Экспериментальному животному - самцу крысы линии «Wistar», на уровне нисходящего отдела толстой кишки, на протяжении 3 см от основания мочевого пузыря, пристеночно выделяют, перевязывают и пересекают с сопровождающими венами прямые ветви левой артерии толстой кишки и краниальной прямокишечной артерии. Затем в течение семи послеоперационных суток перорально вводят 1%-ный водный раствор декстрана сульфата натрия.
Наличие язвенных дефектов и васкулитов на гистологических срезах сердца устанавливают методом световой микроскопии.
Сущность предложенного способа моделирования язвенного колита толстой кишки поясняется фиг. 4-7.
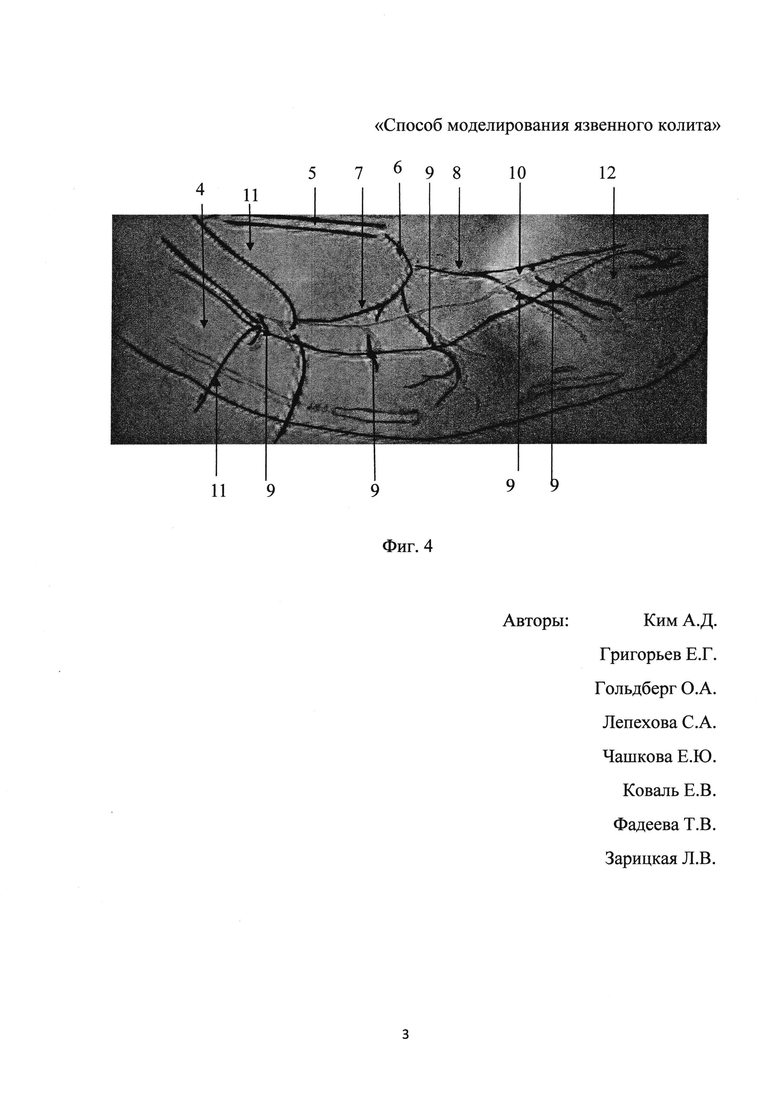
Так, на фиг. 4 приведена схема перевязки сосудов, кровоснабжающих стенку толстой кишки, где 4 - нисходящая часть толстой кишки; 5 - аорта; 6 - нижняя брыжеечная артерия; 7 - левая артерия толстой кишки; 8 - краниальная прямокишечная артерия; 9 - прямые пристеночные ветви артерий; 10 - сопровождающая вена; 11 - нить шовного материала, 12 - проксимальный отдел прямой кишки.
На фиг. 6-7 представлены фотографии гистологических препаратов срезов толстой кишки, окрашенных гематоксилин-эозином (ув. × 100), где 13 - язвенный дефект (фиг. 5, 6); 14 - васкулит в стенке язвенного дефекта (фиг. 6); 15 - язвенный дефект с пенетрацией в брыжейку 16 (фиг. 7); 17 - участок эпителизации по краю язвенного дефекта 15 (фиг. 7).
Предлагаемый способ поясняется примером конкретного выполнения.
Исследования проведены на 30-ти самцах крыс линии «Вистар» возрастом более 6 месяцев, массой тела 280-350 г. Животные содержались в условиях вивария при свободном доступе к воде и пище, соответственно нормативам ГОСТа «Содержание экспериментальных животных в питомниках НИИ» (виварий I категории, вет. удостоверение №0015220 от 25 марта 2009 г., служба ветеринарии Иркутской области).
Эксперименты на животных выполнены в соответствии с правилами гуманного обращения с животными, которые регламентированы «Правилами проведения работ с использованием экспериментальных животных», утвержденных Приказом МЗ СССР №742 от 13.11.84 г. «Об утверждении правил проведения работ с использованием экспериментальных животных» и №48 от 23.01.85 г. «О контроле за проведением работ с использованием экспериментальных животных», а также основывались на положениях Хельсинской Декларации Всемирной Медицинской Ассоциации от 1964 г., дополненной в 1975, 1983 и 1989 гг. Работа проведена с разрешения комиссии по медицинской этике.
Под общим обезболиванием выполняли нижне-срединную лапаротомию, в операционную рану выводили петли тонкого кишечника, слепую кишку и червеобразный отросток с отведением в левую сторону. Половые железы и мочевой пузырь отводили книзу с укрытием стерильным перевязочным материалом, обильно смоченным 0,9% раствором NaCl.
После доступа и освобождения нисходящей части толстой кишки 4 выделяли аорту 5, нижнюю брыжеечную артерию 6, ее главные ветви: левую артерию толстой кишки 7 и краниальную прямокишечную артерию 8. Далее выделяли прямые пристеночные ветви 9 данных артерий с сопровождающими венами 10 на протяжении 3 см нисходящего отдела толстой кишки 4 и проксимальной части прямой кишки 12 от основания мочевого пузыря. Нитью (пролен 6,0) 11 с применением микрохирургической техники проводили лигирование всех прямых ветвей 9 на протяжении 3 см с последующим их пересечением. Нить 11 проводили в безсосудистых областях, продольно оси толстой кишки, с захватом прямой артерии, вены, лимфатических сосудов, нервов в один узловой шов. Один шов накладывали вблизи кишечной стенки, без захвата последней, второй в 2-3 мм от кишечной стенки, после чего сосудисто-нервный пучок пересекали. Левую артерию толстой кишки 7 нитью 11 перевязывали проксимально, краниальную прямокишечную артерию 8 с сопровождающей веной 10 - дистально от участка ишемизации, с последующим пересечением. Восходящую часть толстой кишки, половые железы, мочевой пузырь, слепую кишку, петли тонкого кишечника укладывали в брюшную полость, после чего проводили послойное ушивание раны.
В последующем животных содержали в боксах по 6 особей. Подопытные животные имели свободный доступ к пище и водному раствору декстрана сульфата натрия в течение семи суток с момента операции. 1% раствор декстрана сульфата натрия готовили ежедневно.
За время проведения эксперимента летальных исходов не было.
У животных, выведенных из эксперимента на седьмые сутки после операции, при гистологическом исследовании выявлено развитие язвенного дефекта 13 слизистой толстой кишки и острых язв с эпителизацией 17, сопровождающееся продуктивным воспалением кишечной стенки, отеком подслизистого слоя (фиг. 5-7). Кроме этого выявлен васкулит 14 (фиг. 6) в стенке язвенного дефекта слизистой 13 с плазматическим пропитыванием (фибриноидный некроз) стенок сосудов с утолщением интимы, в том числе и в микроциркуляторном русле.
На 10-е сутки выявлено: прогрессия язвенного дефекта 15 с пенетрацией в брыжейку 16 с участками эпителизации по краям язвенного дефекта 17 (фиг. 7).
Выявленные изменения были документированы у всех подопытных животных.
Авторами также было проведено исследование качественного и количественного состава пристеночной микрофлоры по всем срокам выведения животных из эксперимента и в норме.
Установлено, что в норме 95% пристеночной микрофлоры нисходящей части толстой кишки представлено Lactobacillus spp.(1·109), Bacteroides ssp. (1·108) и Peptococcus spp.(6·108). Превалирующую половину из оставшихся 5% занимают Enterococcus faecalis (1,1·108), меньше грамм + палочка (1·105), Bifidobacterium spp.(1·107) и E.coli (1,35·106).
На седьмые сутки, вследствие ишемизации и последующего приема 1%-ного водного раствора ДСНа, выявлено снижение количественного содержания лактобацил в 1000 раз (1·106), бифидобактерий в 10 раз (до 28%), количество бактероидов (1·105) и кишечной палочки (6·103) ниже нормы.
Так же на седьмые сутки отмечено появление веллионел (до 28%) (1·106), в частности, Veillonella parvula, присутствие которых связывают с воспалением толстой кишки. На 10-е сутки эксперимента их содержание составило 2·105.
По общему анализу крови на седьмые сутки выявлен лейкоцитоз (7,55·109), достоверное повышение сегментоядерных лейкоцитов (p=0,008), и моноцитов (p=0,04), снижение показателя лифоцитов (p=0,002), что подтверждает воспалительный процесс.
Показатель эритроцитов составил 5,215·1012 при норме 6,4·1012, т.е. достоверно/снизился (p=0,01), что указывает на кровопотерю вследствие язвенного поражения слизистой толстой кишки.
Авторами зарегистрировано угнетение иммунологических тестов I уровня к 10-м суткам исследования - снижается показатель теста НСТсп (p=0,01) 0%, против 2% в норме; НСТинд. (p=0,003) 1%, против 4% в норме, что отражает хронизацию воспалительного процесса и угнетение клеточного иммунитета.
Таким образом, предлагаемый способ позволяет к седьмым суткам эксперимента получить модель язвенного колита у самцов крыс линии «Wistar», которая характеризуется формированием глубоких эрозий слизистой и острых язв с эпителизацией, сопровождающихся продуктивным воспалением кишечной стенки, отеком подслизистого слоя, васкулитом, с утолщением интимы, в том числе и в микроциркуляторном русле. На 10-е сутки эксперимента выявлена прогрессия язвенного дефекта с пенетрацией в брыжейку с участками эпителизации по краям язвенного дефекта.
Заявляемый способ обеспечивает возможность получения модели язвенного колита, приближенного к клинике. Воспроизводимость модели составляет не менее 90%.
Использование предложенной модели обеспечивает возможность изучения механизмов формирования язвенного колита, методов диагностики, профилактики и лечения.
| название | год | авторы | номер документа |
|---|---|---|---|
| Средство для профилактики и лечения язвенного колита | 2017 |
|
RU2649119C1 |
| СПОСОБ ВНУТРИБРЮШИННОГО ПРИМЕНЕНИЯ МЕДИЦИНСКОГО ОЗОНА ДЛЯ ЛЕЧЕНИЯ ЯЗВЕННОГО КОЛИТА | 2021 |
|
RU2782488C1 |
| СПОСОБ ОРТОТОПИЧЕСКОЙ ЦИСТОПЛАСТИКИ | 2012 |
|
RU2514530C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ДИВЕРТИКУЛЕЗА ТОЛСТОЙ КИШКИ | 1992 |
|
RU2087943C1 |
| Способ диагностики псевдомембранозного колита тяжелого течения у больных, перенесших коронавирусную инфекцию | 2022 |
|
RU2786752C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ПЕРИТОНИТА | 2019 |
|
RU2716482C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ СПАЕЧНОГО ПРОЦЕССА В БРЮШНОЙ ПОЛОСТИ | 2016 |
|
RU2632538C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ НЕСПЕЦИФИЧЕСКОГО ЯЗВЕННОГО КОЛИТА | 2006 |
|
RU2316055C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ТОЛСТОКИШЕЧНОЙ ОБСТРУКЦИИ | 2022 |
|
RU2798407C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ АНАЛЬНОЙ ТРЕЩИНЫ | 2005 |
|
RU2300813C1 |



Изобретение относится к медицине, а именно к экспериментальной хирургии и патофизиологии, и касается моделирования язвенного колита. Самцам крыс линии «Wistar выполняют ишемизацию стенки толстой кишки. Для этого на уровне нисходящего отдела толстой кишки, на протяжении 3 см от основания мочевого пузыря, пристеночно выделяют, перевязывают и пересекают с сопровождающими венами прямые ветви левой артерии толстой кишки и краниальной прямокишечной артерии. После этого в течение семи послеоперационных суток обеспечивают свободный доступ к пище и к 1%-ному водному раствору декстрана сульфата натрия. Способ позволяет получить модель язвенного колита толстой кишки, приближенную к клиническому течению заболевания, воспроизводимость модели при этом составляет 90%. 7 ил.
Способ моделирования язвенного колита, отличающийся тем, что самцам крыс линии «Wistar выполняют ишемизацию стенки толстой кишки, для этого на уровне нисходящего отдела толстой кишки, на протяжении 3 см от основания мочевого пузыря, пристеночно выделяют, перевязывают и пересекают с сопровождающими венами прямые ветви левой артерии толстой кишки и краниальной прямокишечной артерии, после чего в течение семи послеоперационных суток обеспечивают свободный доступ к пище и к 1%-ному водному раствору декстрана сульфата натрия.
| СПОСОБ МОДЕЛИРОВАНИЯ НЕСПЕЦИФИЧЕСКОГО ЯЗВЕННОГО КОЛИТА | 2006 |
|
RU2316055C1 |
| КОСМЕТОЛОГИЧЕСКОЕ И/ИЛИ ДЕРМАТОЛОГИЧЕСКОЕ СРЕДСТВО, СТИМУЛИРУЮЩЕЕ МИКРОЦИРКУЛЯЦИЮ В ТКАНЯХ КОЖИ | 2007 |
|
RU2371170C2 |
| JP 2010029078 A, 12.02.2010 | |||
| CN 104046592 A, 17.09.2014 | |||
| ЛИСЯНАЯ Т | |||
| А | |||
| Экспериментальное обоснование применения пиримиданта и спленина на модели неспецифического язвенного колита | |||
| Гастроэнтерология | |||
| Циркуль-угломер | 1920 |
|
SU1991A1 |
| Способ крашения тканей | 1922 |
|
SU62A1 |
| ELSHEIKH W | |||
| et al | |||
| Dextran sulfate sodium induces pan-gastroenteritis in | |||
Авторы
Даты
2016-12-10—Публикация
2015-07-06—Подача