Изобретение относится к фармакологии и медицине и может быть использовано для получения фармацевтической композиции, используемой для лечения онкологических заболеваний на основе лекарственного вещества таксанового ряда, содержащегося в полимерной матрице. Композиция выполнена в виде лиофилизата, предназначенного для парентерального введения, и обеспечивает длительное действие.
Одним из методов лечения онкологических заболеваний является применение химиотерапевтических препаратов. Наиболее распространенные - противоопухолевые агенты растительного происхождения группы таксанов (таксоидов), в частности, такой препарат, как таксол. Таксол широко применяют в комплексе с другими противоопухолевыми, гормональными и антигормональными агентами при метастатическом раке молочной железы, немелкоклеточном раке легкого, метастатическом раке яичников, плоскоклеточном раке головы и шеи, гормонорезистентном раке предстательной железы и метастатическом раке желудка. Особенно высокая эффективность препарата отмечена при метастатическом поражении печени, лимфатических узлов и легких [1-5].
Механизм действия - нарушение митоза из-за повреждения сети микротрубочек в опухолевых клетках. Биомишень - мономеры бета-тубулина. Препарат препятствует деполимеризации микротрубочек. Такие стабилизированные микротрубочки не позволяют формироваться веретену деления, что приводит к ингибированию митоза и гибели клетки [1, 2].
Однако использование таксола сопряжено с многочисленными и сильными побочными эффектами (обратимая нейтропения, аллергические реакции, развитие периферических отеков и др.), представляющими в ряде случаев опасность для жизни пациентов. Кроме того, препарат противопоказан больным с нарушениями функции печени, беременным и кормящим женщинам [1, 2].
Решением указанных выше проблем может являться создание инновационных форм доставки этого противоопухолевого агента в клетки-мишени. При этом важно, чтобы такие формы обеспечивали также длительное, постепенное высвобождение лекарственного вещества, что позволило бы уменьшить кратность приема, снизить вводимую дозу и создать более комфортные условия для пациентов, вынужденных регулярно и длительно применять этот препарат.
Предлагаемая разработка представляет собой препарат на основе биодеградируемого полилактидгликолида (50/50), отвечающий всем вышеперечисленным требованиям, а также способ его получения.
Аналоги предложенной фармацевтической композиции и способу ее получения представлены в патентах [6, 7], в которых предложены способы получения субмикронных частиц при соотношении полимер/препарат 1:1.
Недостатками этих способов и получаемой фармацевтической композиции является относительно низкое соотношении полимер/препарат, что снижает эффективность его применения.
Известна фармацевтическая композиция для перорального введения млекопитающему [RU 2236226, С2, A61K 31/337, A61K 47/44, A61K 9/08, A61K 9/10, A61K 9/48, А61Р 35/00, 20.09.2004], включающая таксан или производное таксана в качестве активного ингредиента, несущее средство, включающее по меньшей мере 30% по массе носителя для таксана, причем, указанный носитель имеет значение HLB по меньшей мере приблизительно 10, и несущее средство дополнительно включает приблизительно 0-70% по массе сорастворителя, который снижает вязкость несущего средства.
Недостатком препарата является относительно низкая эффективность применения.
Наиболее близким к предложенному является препарат на основе лецитина, содержащий в качестве активного ингредиента плохо растворимое в воде соединение с противоопухолевой активностью из класса таксанов, предназначенная для парентерального введения человеку с целью терапии опухолевых заболеваний [RU 2370261, С2, A61K 31/337, A61K 47/20, A61K 47/34, A61K 9/107, А61Р 35/00, 20.10.2009], содержащая названный выше активный ингредиент в интервале концентраций от 1 до 30 мг в 1 мл эмульсии, эффективное количество антиоксиданта, по крайней мере, один стабилизатор эмульсии, по крайней мере, один сорастворитель активного ингредиента и, по крайней мере, один стабилизатор активного ингредиента в эмульсии, при этом, в качестве стабилизатора активного ингредиента эмульсия содержит сополимер лактида и гликолида, в качестве сорастворителя активного ингредиента эмульсия содержит диметилсульфоксид в количестве от 0,01 до 3 об. %, при содержании частиц эмульсии с размером менее 100 нм не менее 80%.
Особенностью препарата является содержание в нем в качестве таксана или паклитаксела, или доцетаксела, в качестве антиоксиданта аскорбиновую кислоту, убихинон, токоферол или бензиловый спирт, в качестве стабилизатора эмульсии жирорастворимые или водорастворимые блок-сополимеры этиленоксида и пропиленоксида.
В этом техническом решении предложен также способ его получения, характеризующийся тем, что раздельно готовят водную и масляную фазы, при этом, водную фазу готовят путем эмульгирования в воде лецитина, добавления стабилизаторов эмульсии, масляную фазу готовят путем добавления раствора активного ингредиента в диметилсульфоксиде, и сополимера лактида и гликолида к раствору лецитина в масле и с последующим добавлением стабилизатора эмульсии, смешивают водную и масляную фазы эмульсии с последующими, в случае необходимости, стерильной фильтрацией полученной эмульсии, замораживанием и лиофильной сушкой в стерильных условиях.
Под активным ингредиентом используют соединение класса таксанов, в частности, доцетаксел или паклитаксел.
Недостатком этого наиболее близкого технического решения является необходимость использования большого избытка модификатора поверхности в процессе синтеза, что снижает содержание получаемого лекарственного вещества и уменьшает эффективность его применения. Это сужает область применения способа и эффективность лечения.
Задачей, которая решается в предложенном изобретении, является разработка фармацевтической композиции и способа ее получения с целью повышения эффективности ее применения.
Требуемый технический результат заключается в получении препарата, обладающего повышенной эффективностью применения.
Относительно способа поставленная задача решается, а требуемый технический результат достигается тем, что, в способе получения фармацевтической композиции для химиотерапии онкологических заболеваний растворяют навески таксола и полилактидгликолида с концевой карбоксильной группой в метиленхлориде и интенсивно перемешивают, полученный раствор добавляют к водному раствору бычьего альбумина при интенсивном перемешивании, после чего его гомогенизируют, удаляют органический растворитель, фильтруют, добавляют глюкозу, замораживают и лиофильно высушивают.
Относительно фармацевтической композиции для химиотерапии онкологических заболеваний поставленная задача решается, а требуемый технический результат достигается тем, что, фармацевтическая композиция представляющая собой полимерные субмикронные частицы и предназначенная для парентерального введения, содержит таксол, полилактидгликолид, бычий альбумин и глюкозу в следующем соотношении % мас.:
В качестве иллюстраций представлены:
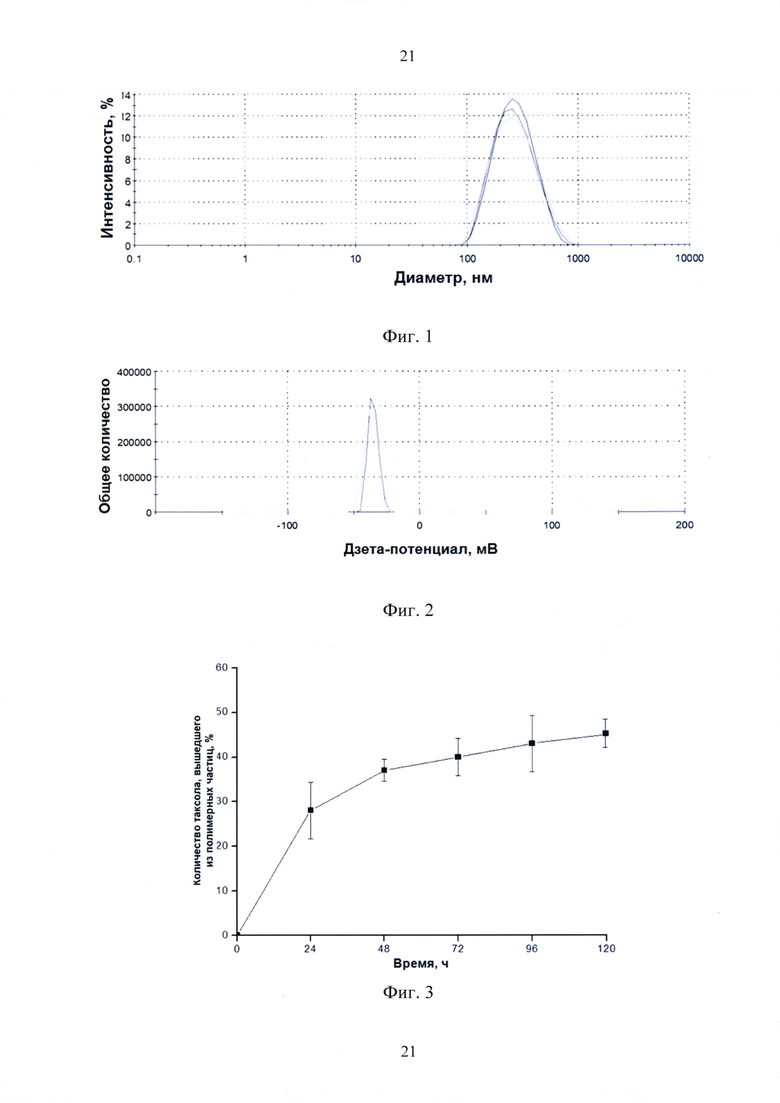
фиг. 1 - распределение размеров полимерных частиц таксола по интенсивности светорассеяния (3 повторных измерения);
фиг. 2 - распределение дзета-потенциала полимерных частиц таксола (2 повторных измерения);
фиг. 3 - профиль высвобождения таксола из полимерной матрицы при рН 7.4 и 37°С;
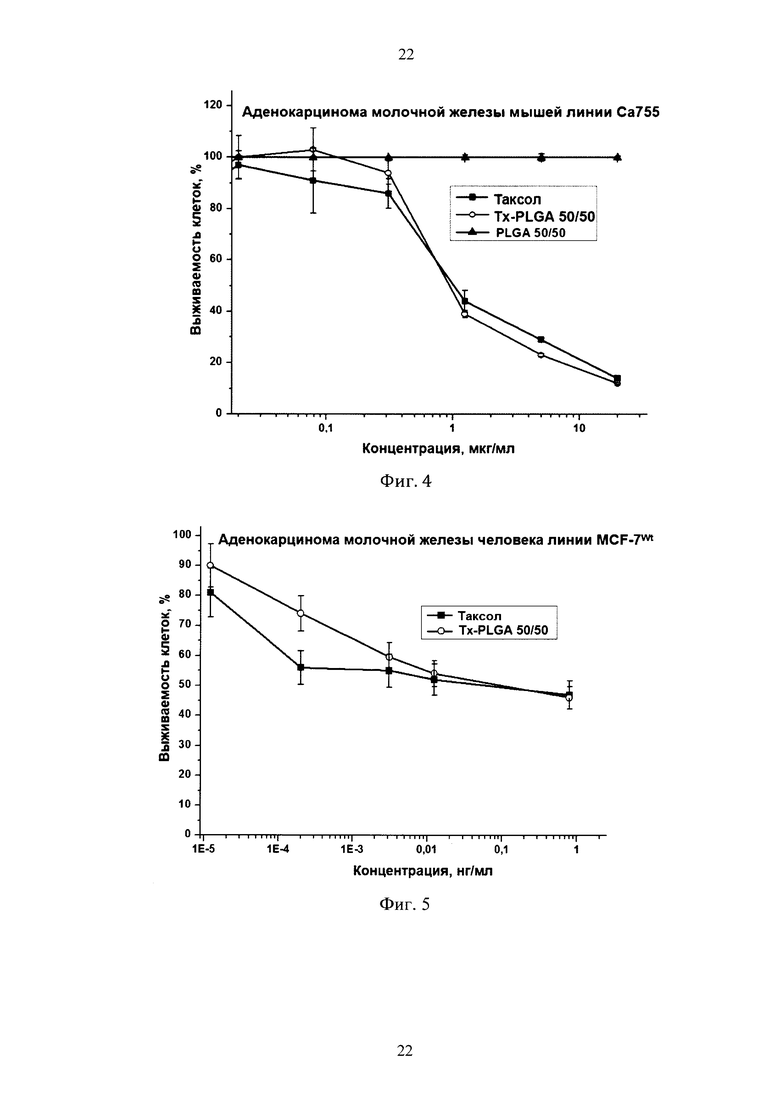
фиг. 4 - выживаемость клеток аденокарциномы молочной железы мышей линии Са755 после 96 ч инкубации с лекарственной субстанцией таксола, полимерной формой таксола (Tx-PLGA 50/50) и полимерной формы, не содержащей таксола (PLGA 50/50);
фиг. 5 - выживаемость клеток аденокарциномы молочной железы человека линии MCF-7Wt после 72 ч инкубации с лекарственной субстанцией таксола и полимерной формой таксола (Tx-PLGA 50/50);
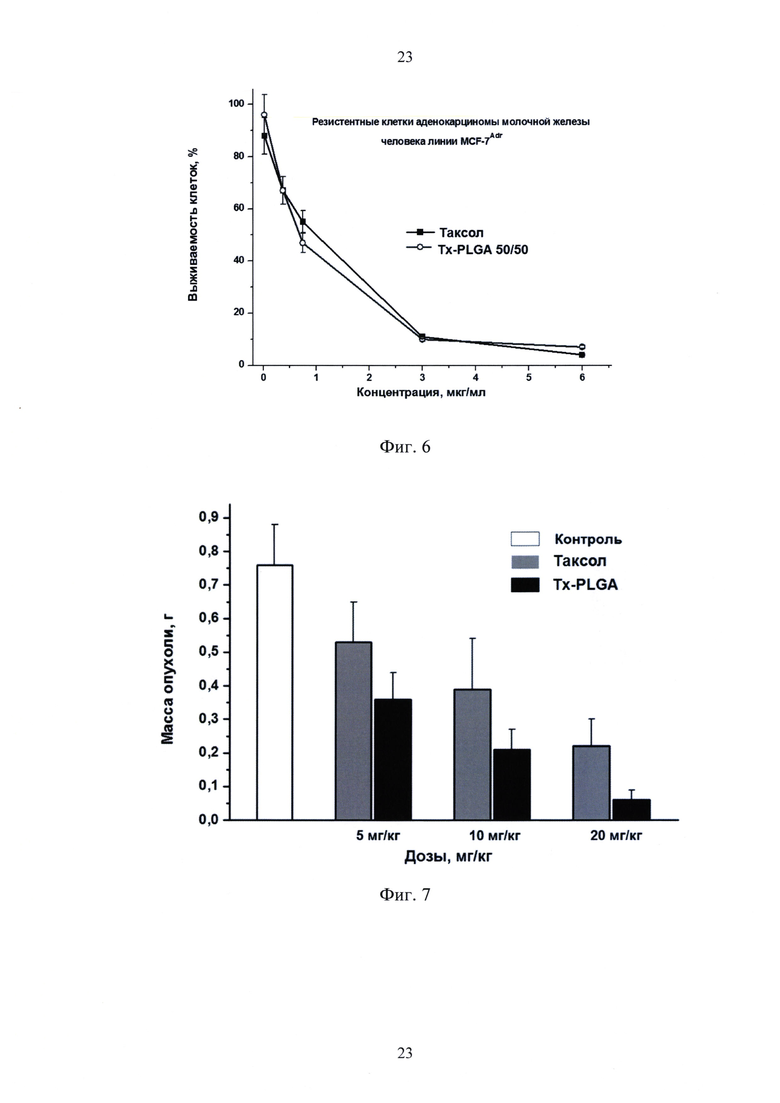
фиг. 6 - выживаемость резистентных клеток аденокарциномы молочной железы человека линии MCF-7Adr после 96 ч инкубации с лекарственной субстанцией таксола и полимерной формой таксола (Tx-PLGA 50/50);
фиг. 7 - зависимость размера опухолей у мышей от дозы лекарственной субстанции таксола и ее полимерной формы (Tx-PLGA) на 9-е сут после прививки аденокарциномы молочной железы линии Са755;
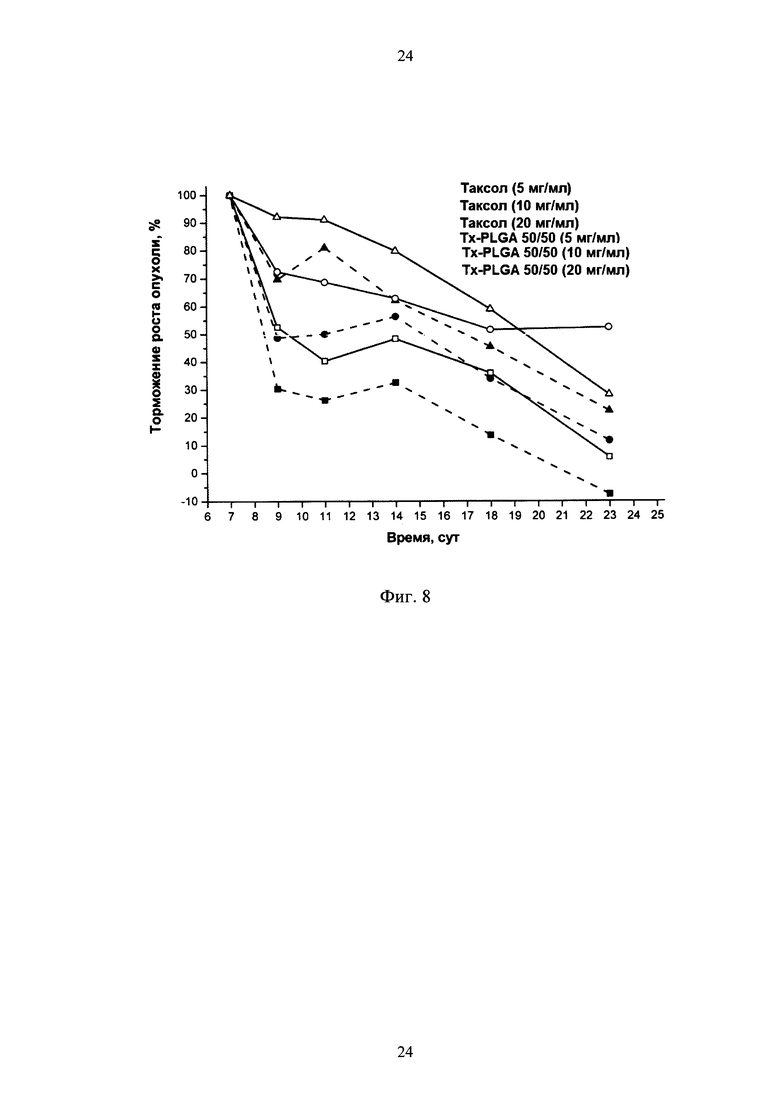
фиг. 8 - изменение степени торможения роста опухоли аденокарциномы молочной железы линии Са755 в динамике после однократного введения животным лекарственной субстанции таксола и его полимерной формы (Tx-PLGA 50/50) в дозах 5, 10 и 20 мг/кг, 50% - критически значимый уровень торможения роста опухоли (ТРО).
Предлагаемое изобретение иллюстрируется следующими примерами.
Пример 1. Получение фармацевтической композиции методом одинарного эмульгирования.
Навески таксола и полилактидгликолида с концевой карбоксильной группой растворяли в метиленхлориде и перемешивали на магнитной мешалке в течение 15 мин. Затем полученный раствор добавляли к водному раствору бычьего альбумина, перемешивали полученную смесь на магнитной мешалке в течение 30 мин и после этого подвергали ее эмульгированию с помощью гомогенизатора погружного типа. Далее проводили удаление органического растворителя на роторном испарителе. Полученную эмульсию фильтровали через стеклянный пористый фильтр. В фильтрате растворяли навеску криопротектора (глюкозы) и замораживали его в с жидком азоте, после чего лиофильно высушивали.
Препарат представлял собой полимерные частицы субмикронного размера.
Пример 2. Определение размера и дзета-потенциала частиц.
Размер частиц определяли методом динамического светорассеяния, а дзета-потенциал - электрофоретическим методом. Из испытуемого образца приготавливали суспензию с концентрацией 1 мг/мл. После чего проводили измерения с помощью анализатора Zetasizer Nano ZS ZEN 3600 (Malvern Instruments, Великобритания) с использованием стандартизованного протокола исследования (SOP).
Среднее значение диаметра частиц составило 200÷350 нм. Дзета-потенциал составил -27÷-10 мВ (Фиг. 1 и 2).
Пример 3. Определение содержания действующего вещества и степени его включения (сорбции) в полимерную матрицу.
Эксперименты по изучению содержания таксола и степени включения (сорбции) проводились на основе хроматографических способов, описанных в работах Не X., Ma J. и Musumeci Т. [16-18].
Для проведения ВЭЖХ использовали жидкостной хроматограф Agilent 1290 series, с МС-детектором с тройным квадруполем (6400), США. Была использована колонка с обращенной фазой Agilent Zorbax SB-C18, 100×2,1 мм, 3,5 мкм. Хроматографию проводили в изократическом режиме. Подвижная фаза Элюент А: ацетонитрил =97%, Элюент В: 10 мМ водный раствор формиата аммония =3. Скорость потока 0,8 мл/мин. Объем вводимой пробы - 2 мкл. Время регистрации хроматограммы составляет 1,5 мин. Детекцию проводили в электроспрее при позитивной ионизации(SIR(Е+)), характеристический ион m/z 835,7. Время удерживания пика таксола составило около 0,5 минут. Перед проведением анализов полимерной формы осуществляли построение калибровочной кривой зависимости площади пиков от концентрации действующего вещества. Для этого готовили стандартные растворы лекарственной субстанции и испытуемого раствора с использованием мерной посуды и дозаторов. Все рабочие растворы перед опытами подвергались центрифугированию на центрифуге Biofuge A (Heraeus Sepatech, ФРГ) при 13 тыс. об/мин в течение 15 мин или фильтрации через мембранные фильтры 0.22 мкм для удаления возможных механических примесей.
Приготовление стандартного раствора таксола (20 мкг/мл).
Около 5 мг стандартного образца (точная навеска) помещали в мерную колбу объемом 25 мл, растворяли в 2 мл ДМСО, доводили до метки ацетонитрилом, тщательно перемешивали. 2,5 мл полученного раствора помещали в пробирку на 25 мл, доводили до метки ацетонитрилом, тщательно перемешивали. 2 мл полученного стандартного раствора центрифугировали в течение 10 мин при 14000 об/мин, отбирали 1 мл раствора, переносили в виалу для хроматографа.
Приготовление испытуемого раствора
Около 5 мг испытуемой субстанции (точная навеска) помещали в мерную колбу объемом 25 мл, растворяли в 2 мл ДМСО, доводили до метки ацетонитрилом, тщательно перемешивали. 2 мл полученного стандартного раствора центрифугировали в течение 10 мин при 14000 об/мин, отбирали 1 мл раствора, переносили в виалу для хроматографа.
Приготовление элюента В подвижной фазы: 10 мМ водного раствора формиата аммония.
В мерную колбу вместимостью 1 литр помещали 6,3 г формиата аммония, растворяли в 500 мл воды Milli-Q, полученной с помощью системы водоподготовки Millipore (Milli-Q Advantage А10, Франция). Доводили объем тем же растворителем до метки и перемешивают.
Оценка результатов.
Хроматографировали растворитель, стандартный раствор (не менее 4 раз), испытуемый раствор (не менее 4 раз). Хроматографическая система считается пригодной, если RSD площади пика стандартного и испытуемого растворов ≤2. Содержание таксола в препарате в процентах (X) вычисляли по формуле:
X=(P×S1×a0)/(S0×a1×10),
где S1 - площадь пика таксола на хроматограмме испытуемого раствора (среднее значение); S0 - площадь пика таксола на хроматограмме стандартного раствора (среднее значение); a1 - навеска испытуемой субстанции в граммах; а0 - навеска стандартного образца таксола в граммах; Р - содержание основного вещества в стандартном образце таксола в процентах.
Пример 4. Изучение стабильности полимерной формы таксола при хранении.
Изучение стабильности полимерной формы таксола при хранении проводили в термостате при 5.0°С без доступа света. Оценка стабильности препарата осуществлялась по таким критериям, как отсутствие (или наличие) дополнительных примесных пиков, выявленных методом ВЭЖХ; цветности препарата; его ресуспендируемости в воде, а также по среднему значению диаметра частиц.
Для проведения данного исследования, брали 75 пластиковых пробирок типа эппендорф (вместимость 1.3 мл). В каждую пробирку помещали по 10.0 мг полимерной формы таксола. Для контроля готовили 20 пробирок, содержащих по 1.0 мг субстанции таксола. Пробирки с препаратами помещали в термостатируемую камеру, соединенную с термостатом (ThermoHaake K20, ФРГ) и инкубировали их при 5.0°С. Пробы отбирались один раз в неделю: 3 параллельные пробы с полимерной формой таксола и одна проба с лекарственной субстанцией. Пробы полимерного таксола оценивались по показателям, указанным выше. Определение размера частиц осуществлялось 1 раз в мес. Пробы с субстанцией таксола оценивались по результатам ВЭЖХ и цветности (визуально).
Цветности лекарственной субстанции таксола (белый) и его полимерной формы (белая) визуально не менялись. ВЭЖХ растворов исследуемых образцов не отличались от хроматограмм образцов, полученных до начала эксперимента. Образцы полимерной формы таксола хорошо ресуспендировались при встряхивании в течение 2 мин, наличие агломератов и осадка не наблюдалось.
Размеры частиц образцов полимерной формы таксола, полученные в процессе их хранения приведены в таблице 1.
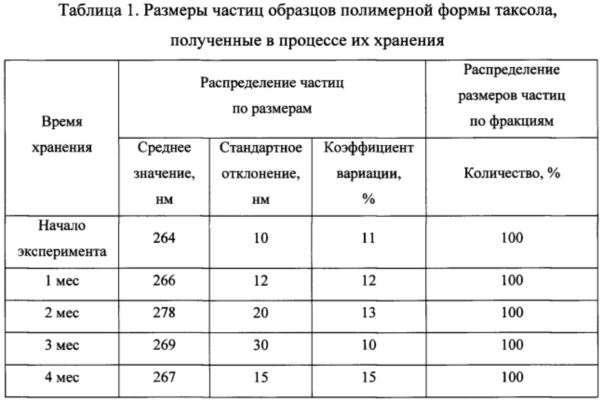

Таким образом, регулярный анализ образцов субстанции и полимерной формы таксола, проведенный указанными методами, за время хранения в течение 6 месяцев не выявил заметных изменений показателей качества изучаемого препарата.
Пример 5. Изучение кинетики высвобождения (релиза) таксола из полимерной матрицы в модельном эксперименте.
Для проведения эксперимента по изучению высвобождения таксола осуществляли взвешивание 5.0 мг полимерной формы таксола во флаконе с завинчивающейся пробкой, после чего добавляли 10.0 мл фосфатно-солевого буферного раствора (PBS) с рН 7.4. Флакон помещали на водяную баню (37°С) и перемешивали на магнитной мешалке. Через определенные интервалы времени содержимое флакона центрифугировали при 16 тыс. об/мин. и 4°С в течение 15 мин на центрифуге Beckman J2-21 (Beckman Instruments, США). Осадок ресуспендировали в 10.0 мл свежего PBS и помещали обратно в водяную баню для продолжения опыта. От супернатанта отбирали 9.0 мл, добавляли 1.0 мл метанола для преципитации следовых количеств полимера, центрифугировали в течение 15 мин при 16 тыс.об/мин и анализировали методом ВЭЖХ (Фиг. 3). Из приведенных на фиг.3 данных на 5-е сутки было отмечено высвобождение всего 45% действующего вещества, что свидетельствовало о достаточно низкой скорости его выхода из полимерной матрицы и служило косвенным подтверждением наличия у полимерной формы длительного действия.
Пример 6. Изучение активности полимерной формы таксола in vitro.
Исследование проводилось на линиях опухолевых клеток: аденокарциноме молочной железы мыши линии Са755 и аденокарциноме молочной железы человека линии MCF-7Wt. Клетки перевиваемых линий культивировали в среде DMEM, содержащей 10% сыворотки плодов крупного рогатого скота и 50 мкг/мл гентамицина в пластиковых культуральных флаконах (Corning-Costar) в СО2-инкубаторе при 37°С в увлажненной атмосфере, содержащей 5% CO2. Клетки рассевали 2 раза в неделю с помощью раствора Версена.
Определение противоопухолевой активности субстанции таксола и полимерных частиц проводили с помощью МТТ-теста по методу Mosmann [19]. Клетки высевали в 96-луночные платы по 5÷7 тысяч клеток в лунку за сутки до внесения препаратов. К клеткам однократно добавляли исследуемые препараты в различных дозах и инкубировали в стандартных условиях для культивирования в течение 72 или 96 ч. Инкубацию до 96 ч продлевали в тех случаях, когда гибель клеток через 72 ч не достигала 50%. Жизнеспособность клеток после инкубации с противоопухолевыми препаратами определяли с помощью МТТ-теста. Для этого за 4 ч до окончания инкубации в каждую лунку добавляли по 50.0 мкл раствора МТТ - бромида 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия в концентрации 1.0 мг/мл в среде для культивирования клеток. После развития окраски среду удаляли, выпавшие кристаллы формазана растворяли в 100.0 мкл ДМСО и измеряли интенсивность окраски по поглощению при 540 нм с помощью планшетного спектрофотометра Labsystem (Финляндия). Выживаемость клеток оценивали в процентах от необработанного контроля и по кривым выживаемости клеток рассчитывали значение IC50-концентрацию препарата, при которой наблюдается гибель 50% клеток (Фиг. 4, 5 и 6).
В отношении опухолевых клеток различных линий (Са755, MCF-7Wt, MCF-7Adr, KB, НТ-29, SKOV3, SCVLB, HeLa и др.) цитотоксическая активность полимерной формы таксола была идентична или выше, чем у лекарственной субстанции. Эти данные указывали на сохранение или увеличение эффективности таксола при его включении в состав полимерных частиц.
Пример 7. Исследование противоопухолевой активности полимерной формы таксола in vivo.
В экспериментах использовали мышей-самок линии C57B1/6 с массой тела 18÷20 г разведения питомника «Столбовая». Противоопухолевую активность полимерной формы таксола и лекарственной субстанции изучали на модели перевиваемой опухоли - аденокарциноме молочной железы мышей линии Са755. Для индукции опухолей мышам вводили клеточную суспензию подкожно, в область подлопаточного пространства в количестве 106 клеток. Методом случайной выборки были сформированы 7 групп животных, каждая группа состояла из 10 мышей. Лечение было начато через 48 ч после инокуляции опухоли. Исследуемые препараты вводили однократно внутривенно (в латеральную хвостовую вену) в 0.4 мл физиологического раствора. Контрольным животным вводили физиологический раствор в том же объеме.
Противоопухолевая активность исследуемых препаратов оценивалась путем сопоставления изучения кинетики роста опухолей, а также сравнения продолжительности жизни в группах леченных и контрольных животных. Полученные результаты показали, что полимерная форма таксола и субстанция оказывают сильное ингибирующее воздействие на рост опухоли. Эффективность действия полимерной формы препарата значительно превышала активность субстанции, взятой в эквивалентной дозе, в отличие от опытов in vitro. После введения полимерной формы таксола, как и субстанции, уже через 7÷8 дней начинало проявляться ингибирующее действие веществ на рост опухоли (Фиг. 7). Препараты проявляли четко выраженную дозозависимую противоопухолевую активность - с увеличением действующей дозы препарата уменьшался размер опухолей. При этом ингибирующее влияние полимерной формы было более выраженным. Также важно отметить, что действие полимерного препарата в дозе 10 мг/кг было эквивалентно действию субстанции в дозе в 2 раза большей, т.е. 20 мг/кг.
Разница в эффективности торможения роста опухоли полимерной формы таксола и субстанции увеличивалась к 12 сут после их введения животным (Фиг. 8) и сохранялось на протяжении всего срока эксперимента для всех доз. При этом, значимый эффект действия (ТРО>50%) полимерного препарата при введении в дозе 10 мг/кг наблюдался в течение 23 сут, а субстанции, введенной в той же дозе, лишь до 15 сут, а в дозе 20 мг/кг - только до 17 сут. Полученные данные о торможении роста опухоли подтверждают эффективность применяемых препаратов и наличие у них четко выраженного дозозависимого характера, как для субстанции таксола, так и для его полимерной формы.
В таблице 2 представлены результаты средней продолжительность жизни животных (СПЖ), а также значения увеличения средней продолжительности жизни (УСПЖ) животных с привитой опухолью после их лечения полимерной формой таксола и субстанцией.
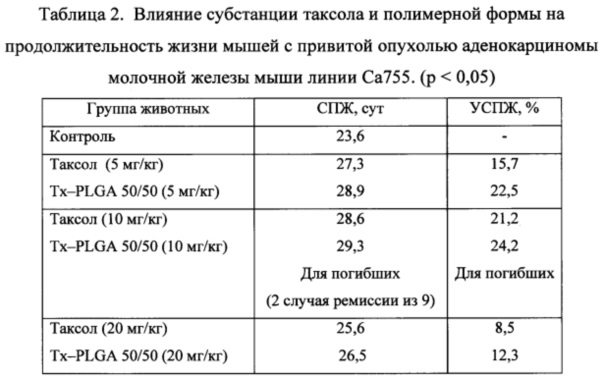
Полученные данные свидетельствуют об увеличении средней продолжительности жизни при использовании полимерного препарата, по сравнению с субстанцией таксола для всех доз. Следует особенно отметить положительные результаты, полученные при лечении мышей с привитой опухолью полимерной формой таксола для дозы 10 мг/кг. При однократном введении препарата наблюдалось ремиссия у 2-х из 9-ти животных в данной группе (~22%). Животные оставались живы даже после 2-х мес наблюдения после прививки опухоли. Применение полимерного препарата в дозе 20 мг/кг не способствовало увеличению выживаемости животных, что, по-видимому, связано с его токсическим действием. Эти данные коррелируют с результатами опытов по изучению роста опухоли.
Пример 8. Определение острой токсичности таксола и его полимерной формы.
Для эксперимента были использованы мыши-самцы линии BALB/c с массой тела 18÷22 г разведения питомника лабораторных животных «Столбовая». Животных распределяли по группам методом случайной выборки, используя в качестве критерия массу тела, так, чтобы индивидуальная масса животных не отличалась более чем на 10% от средней массы животных одного пола. Было сформировано 11 групп, в каждой - по 6 мышей.
Сравнительное изучение острого токсического действия лекарственной субстанции таксола и его полимерной формы провели в 4-х дозах. Препараты таксола и контроль вводили однократно внутрибрюшинно в предпаховую область в объеме 1.0 мл. Контроль составил 3 группы: 1-й группе вводили растворяющую основу (водный раствор Твина-80 и этанола); 2-й - водную суспензию полимерных частиц, не содержащих таксол; 3-й - стерильную воду для инъекций.
За состоянием животных осуществляли контроль на протяжении первых суток тотально и последующие 14 сут с момента введения - дважды в течение дня утром и вечером. Все погибшие и умерщвленные эвтаназией животные подвергались некропсии (вскрытию).
Данное исследование показало, что острая токсичность полимерной формы была в 2.3 раза ниже, чем у лекарственной субстанции.
Клиническая картина интоксикации показала сходные токсические эффекты у животных, получавших лекарственную субстанцию таксола и полимерную форму. В течение первых суток отмечались дозозависимая иммобилизация, угнетенное состояние, в токсических дозах развивалась адинамия, апноэ. В последующий период наблюдений у выживших животных общее состояние и поведение во всех экспериментальных группах нормализовалось в течение 4÷7 суток и соответствовало обычному состоянию и поведению животных контрольных групп.
Животные, получавшие препараты в смертельных дозах, демонстрировали резкое выраженную адинамию, апноэ. Отмечался цианоз «носогубного» треугольника, ушей и лап. Смерть обычно наступала в течение 30÷40 минут после введения субстанции, в течение 1÷3-x сут после введения полимерной формы, преимущественно от остановки дыхания. При некропсии погибших животных наблюдалось венозное полнокровие внутренних органов. Макроскопические изменения других исследуемых органов отсутствовали. Данные вскрытия выживших животных в конце эксперимента (через 14 дней после введения препаратов) и макроскопическое исследование показали отсутствие как внешних отклонений, так и патологий внутренних органов и слизистых оболочек.
Таким образом, по совокупности всех полученных результатов испытаний полимерной формы таксола можно заключить, что полученный препарат обладает более высокой противоопухолевой активностью, а также выраженным длительным действием, что позволило увеличить продолжительность жизни животных и подтверждает достижение требуемого технического результата, заключающегося в получении препарата, обладающего повышенной эффективностью применения.
Источники информации
1. Борисова Т.А. // Материалы IV Российского национального конгресса «Человек и лекарство», М., 1997, С. 34-38.
2. Бычков М.Б., Возный Э.К., Гарин A.M., Горбунова В.А. и др. Новые цитостатики в лечении злокачественных опухолей // «Новое в терапии злокачественных опухолей», М., 1998, 128 с.
3. Горбунова В.А., Орел Н.Ф., Борисова Т.А. и др. Возможности использования таксотера при различных солидных опухолях // «Онкология», 5(1), 2003, С. 36-42.
4. Карякин О.Б., Алексеев Б.Я., Матвеев В.Б. и др. Российский опыт применения Таксотера в терапии метастатического гормонорефрактерного рака предстательной железы: результаты описательного исследования TANDEM // «Онкоурология», 4, 2010, С. 61-64.
5. Ковтун В.А., Гаевой К.В., Севидов В.В. Длительная инфузия доцетаксела (таксотера) в полихимиотерапии 2-й линии у больных с прогрессирующими солидными опухолями // «Онкология», Т. 8, №3, 2006, С. 285-286.
6. Tapas De, Neil P. Desai, Andrew Yang et al. Compositions and methods for preparation of poorly water soluble drugs with increased stability // Пат. WO 2007027941 A2; опубл. 08.03.2007 г.
7. Tapas De, Neil P. Desai, Andrew Yang et al. Compositions and methods for preparation of poorly water soluble drugs with increased stability // Пат. US 2007/0082838 A1; опубл. 12.04.2007 г.
8. Клячко Н.Л., Угланова С.В., Абрикосова Ю.Е. и др. Стабильная эмульсия для парентерального введения плохо растворимых в воде соединений, обладающих противоопухолевой активностью, и способ ее получения // RU 2370261, С2, A61K 31/337, A61K 47/20, A61K 47/34, A61K 9/107, А61Р 35/00, 20.10.2009.
9. Pradhan R, Poudel В.К., Ramasamy Т. Docetaxel-loaded poly lactic acid-co-glycolic acid nanoparticles: formulation, physicochemical characterization and cytotoxicity studies // J. Nanosci Nanotechnol. 2013 Aug; 13(8):5948-56).
10. Sanna V., Roggio A.M., Posadino A.M. et al. Novel docetaxel-loaded nanoparticles based on poly(lactide-co-caprolactone) and poly(lactide-co-glycolide-co-caprolactone) for prostate cancer treatment: formulation, characterization, and cytotoxicity studies // Nanoscale Research Letters 2011, 6:260.
11. Musumeci Т., Ventura C.A., Giannone I. et al. PLA/PLGA nanoparticles for sustained release of docetaxel // Int. J. Pharm. 2006. V. 325 (1-2). P. 172-179.
12. Kevin S. Chu, Warefta Hasan, Sumit Rawal et al. Plasma, tumor and tissue pharmacokinetics of Docetaxel delivered via nanoparticles of different sizes and shapes in mice bearing SKOV-3 human ovarian carcinoma xenograft // Nanomedicine: Nanotechnology, Biology and Medicine, Volume 9, Issue 5, July 2013, Pages 686-693.
13. Immordino M.L. et al. Preparation, characterization, cytotoxicity and pharmacokinetics of liposomes containing docetaxel // J. Control. Release 2003. V. 91 (3). P. 417-429.
14. Yousefi A. et al. Preparation and In Vitro Evaluation of a Pegylated Nano-Liposomal Formulation Containing Docetaxel // Sci. Pharm. 2009. V. 77 (2). P. 453-464.
15. 10. Zhai G. et al. Preparation, characterization and pharmacokinetics of folate receptor-targeted liposomes for docetaxel delivery // (J. Nanosci. Nanotechnol. 2009. V. 9 (3). P. 2155-2161.
16. He X., Ma J., Mercado A.E. et al. Cytotoxicity of Paclitaxel in Biodegradable Self-Assembled Core-Shell Poly(Lactide-Co-Glycolide Ethylene Oxide Fumarate) Nanoparticles // Pharm. Res. (2008). V. 25 (7). P. 1552-1561.
17. Musumeci Т., Ventura C.A., Giannone I. et al. PLA/PLGA nanoparticles for sustained release of docetaxel // Int. J. Pharm. (2006). V. 325 (1-2). P. 172-179.
18. Руководство по экспертизе лекарственных средств / Под. ред. проф. А.Н. Миронова. Том I. - М.: Гриф и К, 2013. 328 с.
19. Mossman Т. Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays // J. Immunol. Meth. 1983. V. 65 (1-2). P. 55-63.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛИМЕРОСОДЕРЖАЩЕЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ОСНОВЕ ПРОТИВООПУХОЛЕВОГО ПРЕПАРАТА ЭТОПОЗИДА | 2015 |
|
RU2595859C1 |
| ПРОТИВООПУХОЛЕВОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ НА ОСНОВЕ ПРОТИВООПУХОЛЕВОГО ПРЕПАРАТА, ИНГИБИТОРА СИНТЕЗА ЭСТРОГЕНОВ - АНАСТРОЗОЛА | 2013 |
|
RU2548722C1 |
| Средство для использования в фотон-захватной терапии злокачественных солидных новообразований | 2015 |
|
RU2611379C1 |
| ВЫСОКОЭФФЕКТИВНЫЙ СПОСОБ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОЙ ФОРМЫ АДРЕСНОГО ДЕЙСТВИЯ ДЛЯ ТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 2019 |
|
RU2727924C1 |
| Фосфолипидная композиция доксорубицина для лечения больных раком молочной железы | 2019 |
|
RU2714137C1 |
| ПРОТИВООПУХОЛЕВОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ОСНОВЕ НИКЛОЗАМИДА | 2016 |
|
RU2617049C1 |
| Лекарственное средство пролонгированного действия на основе анастрозола | 2017 |
|
RU2659689C1 |
| Композиция для лечения болезни Паркинсона | 2017 |
|
RU2697411C2 |
| ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 2014 |
|
RU2545734C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИМЕРНЫХ ПРОТИВООПУХОЛЕВЫХ ЧАСТИЦ В ПРОТОЧНОМ МИКРОРЕАКТОРЕ И ЛИОФИЛИЗАТА НА ИХ ОСНОВЕ | 2018 |
|
RU2681933C1 |
Изобретение относится к медицине и фармацевтической промышленности и представляет собой способ получения противоопухолевой композиции для химиотерапии онкологических заболеваний и противоопухолевую фармацевтическую композицию для химиотерапии онкологических заболеваний, содержащую таксол, полилактидгликолид, бычий альбумин и глюкозу, причем компоненты в композиции находятся в определенном соотношении в мас.%. Изобретение обеспечивает длительное, постепенное высвобождение таксола, уменьшение кратности приема и снижение вводимой дозы. 2 н.п. ф-лы, 8 пр., 2 табл., 8 ил.
1. Способ получения противоопухолевой фармацевтической композиции для химиотерапии онкологических заболеваний, заключающийся в том, что растворяют навески таксола и полилактидгликолида с концевой карбоксильной группой в метиленхлориде и интенсивно перемешивают, полученный раствор добавляют к водному раствору бычьего альбумина при интенсивном перемешивании, после чего его гомогенизируют, удаляют органический растворитель, фильтруют, добавляют глюкозу, замораживают и лиофильно высушивают.
2. Противоопухолевая фармацевтическая композиция для химиотерапии онкологических заболеваний, полученная по способу п. 1, представляющая собой полимерные субмикронные частицы и предназначенная для парентерального введения, содержащая таксол, полилактидгликолид, бычий альбумин и глюкозу в следующем соотношении, мас.%:
| СТАБИЛЬНАЯ ЭМУЛЬСИЯ ДЛЯ ПАРЕНТЕРАЛЬНОГО ВВЕДЕНИЯ ПЛОХО РАСТВОРИМЫХ В ВОДЕ СОЕДИНЕНИЙ, ОБЛАДАЮЩИХ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2007 |
|
RU2370261C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ПОЛУЧЕНИЯ СЛАБОРАСТВОРИМЫХ В ВОДЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ С УВЕЛИЧЕННОЙ СТАБИЛЬНОСТЬЮ | 2006 |
|
RU2451510C2 |
| US 0008202540 В1, 19.06.2012 | |||
| CN 101366696 B, 11.04.2012 | |||
| CN 103110581 В, 22.07.2015. | |||
Авторы
Даты
2017-04-25—Публикация
2016-05-12—Подача