Изобретение относится к биополимерам и может применяться в медицине (хирургии) для профилактики соединительно-тканных сращений, возникающих после полостных операций и воспалительных процессов в полостях тела.
Преимущественная область использования изобретения - абдоминальная хирургия, гинекология.
Известен способ изготовления биодеградируемых мембран для предотвращения образования спаек после кардиохирургических операций, в котором описана мембрана на основе сополимера полигидроксибутирата / гидроксивалерата (ПГБВ) и поли(D,L-лактида). Мембрану изготавливают методом электростатического формирования (электроспининга), в процессе которого в структуру волокон включают биологически активные вещества из группы фибринолитических препаратов или препаратов из группы антикоагулянтов прямого действия. Мембраны обладают биосовместимыми свойствами, сроком биодеградации, не превышающим 60 суток, и позволяют эффективно предупреждать образование спаек в эксперименте (см. Патент РФ 2525181).
Недостатком этого барьерного материала является необходимость введения дополнительных компонентов для проявления противоспаечной активности, а также слишком большой срок присутствия в организме инородного тела. Для предотвращения спайкообразования достаточным является срок от 5 до 10 суток [1]. К тому же в процессе биодеградации материала могут образоваться токсичные продукты, оказывающие негативное воздействие на организм.
Известны измельченные полимерные гидрогели для исключения образования спаек и способы их получения (см. Патент РФ 2207882). Описываются молекулярно - сшитые гели, содержащие разнообразные биологические и небиологические полимеры, например протеины, полисахариды и синтетические полимеры. Применение в живом теле (in vivo) таких гелей является полезным для предупреждения образования послеоперационных спинальных и других спаек ткани, для заполнения дефектов ткани, полостей тела, хирургических дефектов и др.
Недостатком указанных гидрогелей является то, что для их получения используют токсичные сшивающие агенты: альдегиды, эпоксиды, сукцинимиды, карбодиимиды, малеинимиды, азиды, карбонаты, изоцианаты, дивинилсульфон, спирты, амины, имидаты, ангидриды, галоиды, силаны, диазоацетат, азиридины и т.п. Упомянутые реагенты сильно токсичны, их использование сопровождается образованием побочных продуктов, полное удаление их избытка из реакционной массы практически невозможно.
Известно изобретение, описывающее хирургические барьеры с ингибирующими образование спаек свойствами (см. Патент РФ 2480246), которые включают в себя обращенное к ране полимерное покрытие, содержащее энтеросолюбильный полимер; и, по меньшей мере, один гибкий носитель, где упомянутый, по меньшей мере, один гибкий носитель имеет, по меньшей мере, одну внешнюю поверхность, причем упомянутое полимерное покрытие наносится на упомянутый, по меньшей мере, один гибкий носитель так, чтобы существенно покрыть упомянутую, по меньшей мере, одну внешнюю поверхность носителя.
Недостатком хирургических барьеров является то, что они состоят из различных производных целлюлозы, получение которых химической модификацией является время затратным и дорогостоящим процессом.
Известно изобретение - биоматериал для предотвращения послеоперационных спаек, включающий производные гиалуроновой кислоты (варианты) и способ предотвращения послеоперационных спаек ткани (см. Патент РФ 2177332), может быть использовано в области хирургии, в особенности, для использования при предотвращении послеоперационных спаек в хирургии. Данное изобретение касается новых биопрепаратов, неотъемлемой составной частью которых являются этерифицированные производные гиалуроновой кислоты или перекрестно связанные производные гиалуроновой кислоты.
Недостаток изобретения заключается в том, что для получения производных гиалуроновой кислоты необходимо использование токсичных органических растворителей, которые могут оказывать негативное влияние на биосовместимость полученных барьерных материалов.
Известен способ профилактики спаек и их рецидива (см. Патент РФ 2331367), основанный на разобщении поврежденных серозных оболочек и их мезотелизации введением в раневую область 5% геля пектина. Способ позволяет предотвратить склеивание поверхностей на срок их мезотелизации. Недостатком данного способа является применение раствора пектина, не обладающего ранозаживляющей активностью.
Известна мультислойная противоспаечная барьерная мембрана (см. Патент Республики Корея KR 20100013837), которая предотвращает спайкообразование, обеспечивая защиту и отделение раневых поверхностей от тканей и органов. Мульти-мембранная структура состоит из адгезионного к ткани слоя, содержащего коллаген, желатин, эластин, хитин или хитозан, и смазочного слоя, содержащего альгиновую кислоту, пектин, каррагинан, геллановую камедь, карбоксиметилцеллюлозу, гиалуроновую кислоту или полисахарид декстран. Адгезионный слой сшивается со смазочным слоем с помощью глутарового альдегида, формалина, N-(3-диметиламидопропил)-N'-этилкарбодиимида или N-гидроксисульфо-сукцинимида натриевой соли.
Существенным недостатком данного изобретения является использование для получения мультислойной структуры токсичных сшивающих реагентов.
Ближайшим аналогом является способ получения геля на основе пектина из надземной части кипрея узколистного (см. Патент РФ 2510275). Заявленный способ включает растворение предварительно выделенного пектина из надземной части кипрея узколистного в воде с последующим охлаждением и нанесением его на замороженный раствор хитозана и последующее формирование геля. Способ позволяет получить разлагаемый биоматериал, обладающий антимикробной активностью в отношении клеток Escherichia coli и Staphylococcus aureus.
Недостатком данного способа является использование для получения геля пектина из надземной части кипрея узколистного, не обладающего противоспаечной активностью, а также хитозана с неизвестной молекулярной массой и степенью дезацетилирования.
Задача, решаемая настоящим изобретением, заключается в получении хирургического барьерного материала на основе биосовместимых, биодеградируемых полисахаридов - пектина яблочного или пектина яблочного и хитозана без применения токсичных сшивающих реагентов для использования с целью предотвращения послеоперационных спаек в брюшной полости.
Хирургические барьерные материалы согласно изобретению включают полисахариды пектин яблочный или пектин яблочный и хитозан.
Технический результат достигается за счет того, что при применении хирургического барьерного материала, полученного путем замораживания и последующего оттаивания исходных растворов пектина яблочного или пектина яблочного и хитозана (со степенью дезацетилирования 38-100% и молекулярной массой 25-230 кДа) с хлоридом кальция, согласно предложенному способу, предотвращается образование послеоперационных спаек в брюшной полости.
Для получения хирургического барьерного материала растворяют хлорид кальция или хитозан и хлорид кальция в 0,25% водном растворе уксусной кислоты при перемешивании. Полученный раствор заливают в форму и замораживают при температуре -18±1°C в течение 1 ч. Пектин яблочный растворяют в дистиллированной воде при перемешивании. Затем раствор пектина яблочного наслаивают на замороженный раствор хлорида кальция или хитозана и хлорида кальция, при этом массовое соотношение пектина и хитозана в составе хирургического барьерного материала составляет 3:1. Хирургический барьерный материал формируется при медленном оттаивании раствора хлорида кальция или хитозана и хлорида кальция при температуре 15°C-22°C в течение 4-6 ч. Сформировавшийся хирургический барьерный материал лиофильно высушивают и затем стерилизуют УФ-облучением в течение 0,5 ч с каждой стороны. Полученный хирургический барьерный материал имеет форму лиофильно высушенного криогеля.
Спайки - это тонкие фибриновые тяжи, пленки и сращения, возникающие между соседними органами. Причины спайкообразования чрезвычайно разнообразны. Среди них можно выделить механические и физические повреждения серозных покровов кишечника, попадание инородного материала в брюшную полость, ишемию органов брюшной полости вследствие нарушения кровотока, инфекционное воспаление брюшины, а также внутрибрюшинное кровотечение [2].
Все перечисленные факторы присутствуют при выполнении хирургических операций, поэтому на первом месте среди непосредственных причин развития спаечного процесса стоит само оперативное вмешательство. Внутрибрюшинные спайки возникают более чем у 90% больных, перенесших ранее полостные операции [3]. В большинстве случаев они обусловлены травмой, у 22,5% пациентов - инородными телами, шовный материал - 19%; тальк - 6%, в комбинации - 3%. Другими причинами являются воспалительные заболевания внутри брюшной полости и врожденные аномалии [4].
Спаечный процесс может стать причиной кишечной непроходимости, тазовых болей, последующего бесплодия и внематочной беременности у женщин [5]. Профилактика образования спаек и воспалительных заболеваний органов брюшной полости является актуальной проблемой абдоминальной хирургии.
Патофизиологический механизм все еще остается неясным, но доказан общий центральный путь, в котором важную роль играет перитонеальный фибринолиз.
Внутрибрюшные спайки формируются при плотном соприкосновении поврежденных участков брюшины. Повреждение брюшины инициирует высвобождение стромальными тучными клетками гистамина и кининов, которые повышают сосудистую проницаемость. Образуется экссудат, содержащий фибрин, который откладывается между поврежденными серозными поверхностями. Эти пленчатые фибринозные спайки нестабильны и деградируют под действием протеаз фибринолитической системы в течение 72 ч. Процесс заживления характеризуется комбинацией фиброза и мезотелиальной регенерации. Если фибринолитическая активность низкая и не происходит быстрого удаления фибрина путем абсорбции либо фибринолиза, то в него мигрируют фибробласты, мезотелиальные и эндотелиальные клетки, накапливается коллаген, прорастают кровеносные сосуды и к концу 1 недели формируются прочные фибринозные спайки. Таким образом, плотное прилегание поврежденных серозных поверхностей и нарушение баланса между образованием фибринозных отложений и фибринолизом являются ключевым моментом в образовании спаек [6].
Существуют различные методы предотвращения спайкообразования, но все они основываются на нескольких подходах, которые включают в себя стимуляцию фибринолиза, уменьшение первичного воспалительного процесса, механическое разделение поверхностей, покрытых фибрином, ингибирование свертывающей системы крови, подавление пролиферации фибробластов [2].
На основании этих подходов в последние годы активно разрабатываются и внедряются в клиническую практику различные средства профилактики спайкообразования в брюшной полости. Их можно разделить на фармацевтические средства (стероидные и нестероидные противовоспалительные агенты, антикоагулянты, протеолитические агенты) и барьерные материалы (полимерные растворы, твердые листы, гидрогели).
Большинство фармацевтических препаратов оказались не достаточно эффективными при применении их в качестве противоспаечных средств [4, 7]. Неэффективность применения фармацевтических препаратов может быть связана с быстрым выведением их из брюшной полости, так как чаще всего они применяются в виде растворов.
Современная тенденция в вопросе профилактики послеоперационного спаечного процесса - применение средств, ограничивающих раневую поверхность от окружающих тканей на срок, достаточный для восстановления мезотелия.
Наиболее перспективным методом профилактики образования послеоперационных спаек считается применение барьерных методов из биодеградируемых материалов. Имеющиеся барьерные материалы являются твердыми, гелевыми или жидкими средствами. Многие из них разжижаются в организме через какое-то время. Биосовместимые, абсорбируемые гелевые барьеры безопасны и эффективны, кроме того их легко применять и быстро приспособить к поврежденным тканям без фиксации. Использование барьеров отличается от других методов тем, что они сами по себе не влияют на процесс заживления, а разделяют противоположные поверхности во время заживления. Барьерные средства помещаются внутрь брюшины во время или в конце операции. В настоящее время одобрены для клинического использования барьерные материалы на основе окисленной регенерированной целлюлозы («Interceed») и на основе растянутого политетрафторэтилена (е-ПТФЭ) - «Gore-Тех» (см. Патент US №4478665 и Патент US №4482516) или полиэтилена, или полипропилена.
Следует отметить, что оба вышеуказанных материала связаны с важными противопоказаниями. Использование барьерных мембран из е-ПТФЭ, или полиэтилена, или полипропилена включает имплантацию синтетического материала, который является чужеродным для организма человека и не способен к биодеградации, и который требует повторной хирургической операции для удаления барьерной мембраны.
В преклинических и клинических моделях сетки на основе окисленной регенерированной целлюлозы были признаны эффективными для предотвращения образования спаек, но только в том случае, если их наложению предшествовал полный гемостаз.
В данном изобретении основой получаемых хирургических барьерных материалов служит низко метилэтерифицированный пектин яблочный, который способен к гелеобразованию в присутствии двухвалентных ионов Са2+. В процессе получения хирургических барьерных материалов пектин яблочный наслаивается на поверхность замороженного раствора хитозана с хлоридом кальция. При медленном оттаивании раствора хитозана с хлоридом кальция формируется полиэлектролитный комплекс между противоположно заряженными макромолекулами пектина яблочного и хитозана. Происходит электростатическое взаимодействие между аминогруппами хитозана (NH3+) и карбоксильными группами пектина яблочного (СОO-). Ионы кальция диффундируют в слой пектина яблочного и связывают оставшиеся свободные карбоксильные группы, которые присутствуют в избытке, так как пектин яблочный является основным компонентом хирургических барьерных материалов. Таким образом, хирургический барьерный материал сформирован при ионном взаимодействии противоположно заряженных полисахаридов и дополнительно сшит ионами Са2+, без применения токсичных сшивающих реагентов, использование которых, сопровождается образованием побочных продуктов, полное удаление их избытка из реакционной массы практически невозможно.
Пектин яблочный - натуральный анионный полисахарид, основной компонент клеточной стенки растений. Главную углеводную цепь пектина составляют 1,4 - связанные остатки α - D - галактуроновой кислоты, которые могут быть частично замещены остатками метилового эфира (до 70%). В зависимости от степени метилэтерифицирования (СМ) пектины подразделяют на высоко метилэтерифицированные, у которых СМ>50%, и низко метилэтерифицированные со СМ<50%. Как правило, высоко метилэтерифицированные пектины образуют гели в присутствии растворимых сухих веществ, таких как сахара, в то время как низко метилэтерифицированные пектины способны к гелеобразованию в присутствии двухвалентных катионов, таких как Са2+ [8]. Пектины сами по себе состоят из молекул, обладающих противовоспалительной активностью, поэтому материалы на их основе подавляют воспаление без введения в состав каких-либо дополнительных фармакологических средств [9].
Для придания хирургическим барьерным материалам большей адгезивности, прочности, ранозаживляющей и антиоксидантной активности в состав противоспаечного средства включен хитозан - катионный полисахарид, дезацетилированное производное природного полисахарида хитина, который является основным компонентом наружных покровов членистоногих, некоторых грибов. Хитозан состоит из остатков D-глюкозаминовых и N-ацетил-D-глюкозаминовых звеньев, соединенных β-1,4-гликозидными связями. Одним из важнейших свойств полимера является его степень дезацетилирования (СД), которая определяет, является ли биополимер хитином или хитозаном. При СД>40% биополимер является хитозаном. СД оказывает влияние на физические, химические и биологические свойства хитозана [10]. Для получения образцов хитозана, отличающихся по СД можно использовать методы реацетилирования [11] и дезацетилирования [12]. Не менее важной характеристикой полимера является молекулярная масса (ММ). ММ оказывает влияние на скорость биодеградации, адгезивность, антиоксидантные свойства полимера. На основе высокомолекулярного хитозана можно получить образцы с меньшей ММ методами химической, физической, ферментативной деполимеризации [13]. Таким образом, варьируя ММ и СД хитозана, можно получать материал с характеристиками, необходимыми для конкретной цели. Хитозан также способствует ранозаживлению и восстановлению мезотелиальных клеток [14].
Кроме того, пектины и хитозаны обладают антиоксидантной активностью [15, 16]. Так как воспаление и окислительный стресс опосредуют образование спаек, пектин - хитозановые барьерные материалы будут обладать противоспаечной эффективностью.
Хирургические барьерные материалы имеют явные преимущества перед жидкой формой противоспаечных средств, так жидкие материалы слишком быстро элиминируются. Тем не менее, гелевые барьерные материалы, используемые на сегодняшний день, не показывают достаточной эффективности для предотвращения брюшных спаек у людей, потому что их действие ограничивается функцией физического барьера.
В данном случае, в изобретении описываются хирургические барьерные материалы на основе биосовместимых, биодеградируемых полисахаридов с коротким временем существования in vivo, сочетающие функцию физического барьера и собственную биологическую активность. Хирургические барьерные материалы выполняют барьерную функцию до тех пор, пока не произойдет заживление, для того, чтобы устранить проблемы, создаваемые не биодеградируемыми материалами (инфекция, кальцификация имплантатов, образование рубца и необходимость повторных операций для удаления биоматериала и т.д.). При этом компоненты хирургических барьерных материалов имеют противовоспалительную, антиоксидантную, ранозаживляющую активность сами по себе, без добавления фармакологических субстанций.
Таким образом, возможный механизм предотвращения спайкообразования хирургическими барьерными материалами полисахаридов пектина яблочного или пектина яблочного и хитозана (со степенью дезацетилирования 38-100% и молекулярной массой 25-230 кДа) с хлоридом кальция заключается в сочетании функции физического барьера и биоактивности компонентов биоматериала.
Конкретные формы настоящего изобретения будут далее описаны более подробно с использованием примеров.
Пример 1. Получение хирургического барьерного материала на основе пектина яблочного
Для получения хирургического барьерного материала растворяют 13,32 мг безводного хлорида кальция в 1 мл 0,25% водного раствора уксусной кислоты при перемешивании. Раствор хлорида кальция объемом 1 мл заливают в форму и замораживают при температуре -18±1°C в течение 1 ч. Пектин яблочный массой 20 мг растворяют в 2 мл дистиллированной воды при перемешивании. Затем раствор пектина яблочного наслаивают на замороженный раствор хлорида кальция в объемном соотношении 2:1. Хирургический барьерный материал формируется при медленном оттаивании раствора хлорида кальция при температуре 15°C-25°C в течение 4-6 ч. Сформировавшийся хирургический барьерный материал лиофильно высушивают и затем стерилизуют УФ-облучением в течение 0,5 ч с каждой стороны.
Пример 2. Получение хирургического барьерного материала на основе пектина яблочного и высокомолекулярного хитозана
Для получения хирургического барьерного материала растворяют 6,67 мг хитозана с ММ 200 кДа и СД 95% (Хит200/95) в 1 мл 0,25% раствора уксусной кислоты при перемешивании. Затем к раствору хитозана добавляют 13,32 г безводного хлорида кальция и перемешивают до полного растворения. Раствор хитозана с хлоридом кальция объемом 1 мл заливают в форму и замораживают при температуре -18°C в течение 1 ч. Пектин яблочный массой 20 мг растворяют в 2 мл дистиллированной воды при перемешивании. Затем раствор яблочного пектина наслаивают на замороженный раствор хитозана с хлоридом кальция в объемном соотношении 2:1, при этом массовое соотношение пектина и хитозана в составе хирургического барьерного материала составляет 3:1. Хирургический барьерный материал формируется при медленном оттаивании раствора хлорида кальция при температуре 15°C-25°C в течение 4-6 ч. Сформировавшийся хирургический барьерный материал лиофильно высушивают и затем стерилизуют УФ-облучением в течение 0,5 ч с каждой стороны.
Пример 3. Получение хирургического барьерного материала на основе пектина яблочного и деполимеризованного хитозана
Аналогично примеру 2, но добавляют хитозан с ММ 25 кДа и СД 98% (Хит25/98).
Пример 4. Получение хирургического барьерного материала на основе пектина яблочного и реацетилированного хитозана
Аналогично примеру 2, но добавляют хитозан с ММ 230 кДа и СД 38% (Хит230/38).
Пример 5. Получение хирургического барьерного материала на основе пектина яблочного и дезацетилированного хитозана
Аналогично примеру 2, но добавляют хитозан с ММ 150 кДа и СД 98% (Хит150/98).
Результаты исследования физико-механических характеристик хирургического барьерного материала.
Для исследования механической прочности образцы хирургического барьерного материала размером 15 × 15 мм, толщиной 1 мм фиксировали на платформе текстурного анализатора ТА. XTplus (Stable Micro Systems, Великобритания). Оценивали прочность хирургического барьерного материала на прокол. Для этого использовали цилиндрический зонд р/2 диаметром 2 мм. Все измерения проводили при комнатной температуре, скорость тестирования 0,5 мм/с. На кривой зависимости напряжения - деформации фиксировали силу давления зонда (Fmax), при которой происходил прокол хирургического барьерного материала. Предел прочности рассчитывали с использованием программного обеспечения Exponent Software (версия V6.1.5.0).
Данные по механической прочности хирургического барьерного материала на основе пектина яблочного и хитозана представлены в таблице 1. Прочность пектин-хитозановых хирургических барьерных материалов на основе пектина яблочного зависит от типа хитозана, использованного для приготовления. Хитозаны с высокой СД увеличивают прочность хирургического барьерного материала из яблочного пектина в 3-5 раз. При этом максимальной прочностью (513 кПа) обладает хирургический барьерный материал на основе яблочного пектина и низкомолекулярного хитозана с высокой СД Хит25/98. Высокомолекулярный хитозан с низкой СД Хит230/38 не влияет на прочность хирургического барьерного материала из пектина яблочного, которая составляет около 147 кПа.
Для оценки модуля упругости образцы хирургических барьерных материалов размером 15×15 мм, толщиной 1 мм, предварительно выдержанные в дистиллированной воде в течение 3 мин, фиксировались на платформе текстурного анализатора ТА. XTplus (Stable Micro Systems, Великобритания). Фиксировалась сила давления цилиндрического зонда p/2 диаметром 2 мм на поверхность хирургического барьерного материала при комнатной температуре, скорость тестирования 0,5 мм/с. Модуль упругости был рассчитан при 10% деформации в соответствии со следующим уравнением [17]:

где Е - модуль упругости, F - приложенная сила, А - площадь поперечного сечения тестируемого образца, l - начальная высота образца, Δl - изменение высоты под воздействием приложенной силы. Для каждого типа хирургического барьерного материала пять образцов были проанализированы. Средний модуль упругости был определен.
В результате проведенных сравнительных исследований доказано, что эластичность образцов хирургических барьерных материалов, изготовленных из пектина яблочного и хитозана близка к эластичности мягких тканей человека, которая составляет 10-75 кПа, на которых адгезируется хирургический барьерный материал во время операции, следовательно, разработанные материалы являются биомеханически совместимыми [18].
Для оценки адгезивных свойств пектин-хитозановых хирургических барьерных материалов определяли силу адгезии образцов к серозной оболочке брюшной стенки лабораторных крыс. Измерение силы адгезии проводили каждой из сторон хирургического барьерного материала с помощью текстурного анализатора ТА. XTplus (Stable Micro Systems, Великобритания). Образец размером 5×5 мм фиксировали с помощью двустороннего скотча на цилиндрическом зонде p/0,5R диаметром 12,7 мм. Адгезию оценивали по силе отрыва зонда от ткани после 60 с прижатия с нагрузкой 0,1 Н [19]. Силу адгезии рассчитывали с использованием программного обеспечения Exponent Software (версия V6.1.5.0).
Показано, что адгезия хирургического барьерного материала к биологическим тканям увеличивается при внесении хитозана с высокой ММ и СД. Включение в состав хирургического барьерного материала хитозана Хит150/98 увеличивает адгезию сторон хирургического барьерного материала к серозной оболочке брюшной стенки на 68%. Хитозан Хит200/98 увеличивает адгезивность хирургического барьерного материала из яблочного пектина на 27%. Установлено, что обе стороны хирургического барьерного материала (пектиновый слой и хитозановый слой) имеют сопоставимую адгезивность. Результаты, полученные при исследовании, представлены в таблице 1.
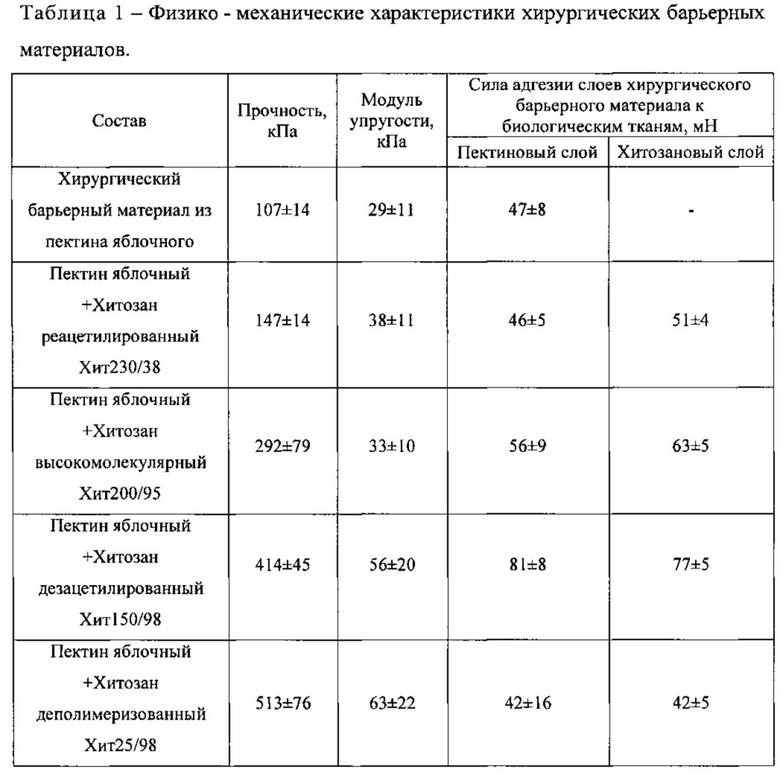
Таким образом, включение хитозана в состав хирургического барьерного материала способствует усилению адгезии биоматериалов к серозной оболочке брюшной стенки лабораторных крыс, а также увеличению их прочности.
Применение хирургических барьерных материалов для предотвращения послеоперационных спаек в брюшной полости
Эффективность разработанных хирургических барьерных материалов оценивали в условиях развития спаечного процесса у лабораторных животных. Спаечную болезнь моделировали у крыс - самок линии Wistar, весом 180-200 г. Для степени тяжести образования спаек при использовании изготовленных хирургических барьерных материалов провели исследование на моделях образования спаек между слепой кишкой и боковой стенкой брюшной полости крыс продолжительностью 7 суток при использовании хирургических барьерных материалов в сравнении с контролями. Определение общей эффективности каждого испытуемого хирургического барьерного материала основывалось на сравнении с контролем в отношении обширности образования спаек и степени тяжести образующихся спаек.
Испытуемый хирургический барьерный материал признавали успешным, если по результатам испытания он имел лучшие показатели по сравнению с отрицательным контролем, в качестве которого в данном исследовании использовался стандартный шовный материал.
Хирургические процедуры.
Вдоль срединной линии передней стенки брюшной полости делали разрез длиной приблизительно 3 см. Слепую кишку извлекали на поверхность и растирали участок ее поверхности площадью 1×1 см до получения точечных кровотечений. Мышечный слой участка размером 1×1 см на прилежащей к слепой кишке боковой стенке брюшной полости растирали до получения точечных кровотечений, используя стерильный зубной бур. Поврежденная слепая кишка была помещена обратно в брюшную полость вблизи поврежденной стенки брюшной полости. Опытным животным между поврежденными поверхностями прокладывали смоченный в стерильном физиологическом растворе в течение 3 мин хирургический барьерный материал размером 1,5×1,5 см. Контрольная группа крыс не получала обработки их раневых поверхностей перед закрытием брюшной полости. После завершения процедуры, брюшная полость была закрыта с 3-0 шелковыми швами, а кожа была закрыта с 4-0 шелковыми швами.
Через 7 суток после операции животных подвергали эвтаназии с использованием передозировки газа СО2. Брюшную полость вскрывали с U-образный разрезом и проводили слепую оценку степени тяжести адгезии по шкале спайкообразования [20].
Шкала оценки спайкообразования в эксперименте in vivo:
0 баллов - спайки отсутствуют;
1 балл - тонкая пленочная спайка;
2 балла - несколько тонких спаек;
3 балла - утолщенная спайка с точечным прикреплением;
4 балла - утолщенная спайка с плоским прикреплением;
5 баллов - очень толстые кровоснабжаемые спайки.
Результаты испытания приведены в таблице 2.
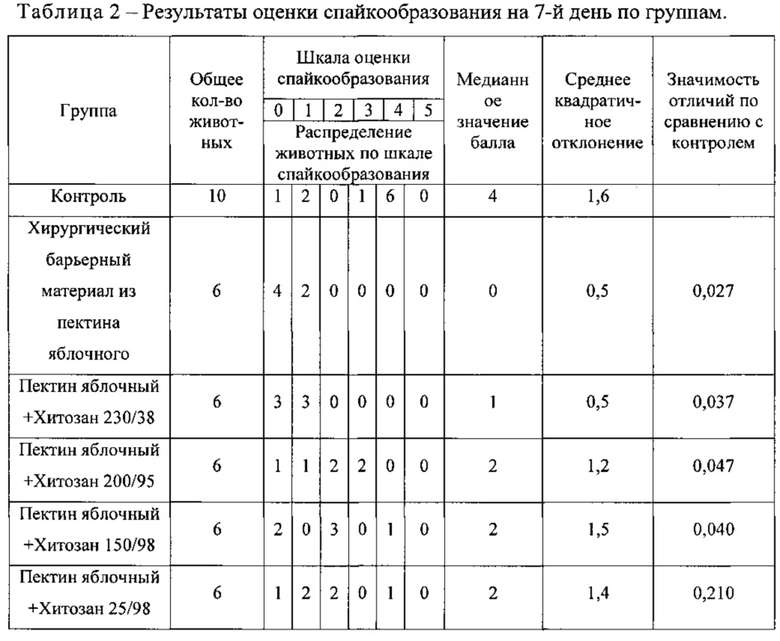
В ходе исследования противоспаечной активности обнаружено, что спайкообразование достигает уровня 4 баллов из 5 у контрольных животных. У животных, на раневые поверхности которых были помещены хирургические барьерные материалы на основе яблочного пектина, спайкообразование значительно снижается по сравнению с контрольной группой. Медианное значение по шкале оценки спайкообразования составляет 0±0,5 баллов (табл. 2). При добавлении хитозана Хит150/98, Хит200/95, Хит230/38 в состав хирургического барьерного материала на основе пектина яблочного также происходит снижение спайкообразования. Группы имели достоверно меньший балл спайкообразования по сравнению с контролем. Как показано в таблице 2, при обработке раневых поверхностей хирургическим барьерным материалом с хитозаном Хит150/98 и Хит200/95 происходит снижение спайкообразования по сравнению с контролем до 2 баллов по шкале (присутствует несколько тонких спаек). В случае использования хирургического барьерного материала с хитозаном Хит230/38 спайкообразование снижается до 1±0,5 балла (одна тонкая пленочная спайка). Значимых различий не наблюдается между хирургическим барьерным материалом с хитозаном Хит25/98 и контрольной группой. У большинства крыс при использовании хирургического барьерного материала на основе пектина яблочного не образовывались спайки, и дефекты почти полностью восстанавливались в течение 7 суток, что свидетельствует об эффективности разработанного хирургического барьерного материала для предотвращения спайкообразования. Во время вскрытия, остатков хирургического барьерного материала не было обнаружено на обработанных участках (раневых поверхностях брюшной стенки и/или поверхностях слепой кишки) или в брюшной полости, что свидетельствует о биодеградации барьерного материала. Таким образом, наибольший противоспаечный эффект в модели травматического повреждения боковой брюшной стенки у крыс наблюдается при использовании хирургического барьерного материала на основе пектина яблочного (0±0,5 балла), а также при добавлении в состав барьерного материала реацетилированного хитозана с низкой СД 230/38 (1±0,5 балла).
Результаты определения времени биодеградации хирургических барьерных материалов in vivo.
Было определено время биодеградации образцов хирургического барьерного материала в условиях моделирования спаечного процесса на самках крыс линии Wistar. 15 самок крыс линии Wistar были случайным образом разделены на 5 групп по 3 животных в группе. На 5 группах животных исследовалось время биодеградации образцов хирургического барьерного материала на основе яблочного пектина. Одно животное из каждой группы выводилось из эксперимента через 4 и 24 ч. Через определенные промежутки времени брюшную полость вскрывали, наличие криогелей в брюшной полости оценивали визуально.
Типичная картина биодеградации хирургического барьерного материала на основе яблочного пектина представлена на фигуре 1. В ходе определения времени биодеградации было выявлено, что через 4 ч нахождения в брюшной полости все хирургические барьерные материалы на основе пектина яблочного теряют форму и разрушаются при извлечении из брюшной полости. Полная биодеградация хирургического барьерного материала наступает через 24 ч инкубации.
Список литературы
1. Brochhausen С. et al. Intraperitoneal adhesions-An ongoing challenge between biomedical engineering and the life sciences // J. Biomed. Mater. Res. - Part A. 2011. Vol. 98 A, №1, P. 143-156.
2. Kamel R.M. Prevention of postoperative peritoneal adhesions // Eur. J. Obstet. Gynecol. Reprod. Biol. Elsevier Ireland Ltd, 2010. Vol. 150, №2. P. 111-118.
3. Ward B.C., Panitch A. Abdominal adhesions: Current and novel therapies // J. Surg. Res. Elsevier Ltd, 2011. Vol. 165, №1. P. 91-111.
4. Ляхова A.B. Пути профилактики послеоперационного спайкообразования брюшной полости // Вестник экспериментальной и клинической хирургии. 2010. Vol. 3, №1, P. 72-81.
5. Trew G. Postoperative adhesions and their prevention // Rev. Gynaecol. Perinat. Pract. 2006. Vol. 6, №1-2. P. 47-56.
6. Schnriger B. et al. Prevention of postoperative peritoneal adhesions: A review of the literature // Am. J. Surg. Elsevier Inc., 2011. Vol. 201, №1. P. 111-121.
7. Мазитова М.И. Место противоспаечных барьеров в оперативной гинекологии // Казанский медицинский журнал. 2007. Vol. 88, №2. Р. 184-186.
8. Löfgren C., Hermansson А.-М. Synergistic rheological behaviour of mixed HM/LM pectin gels // Food Hydrocoll. 2007. Vol. 21, №3. P. 480-486.
9. Popov S. V. et al. Injectable hydrogel from plum pectin as a barrier for prevention of postoperative adhesion // J. Bioact. Compat. Polym. 2016. P. 1-17.
10. Tan S.C. et al. The degree of deacetylation of chitosan: Advocating the first derivative UV-spectrophotometry method of determination // Talanta. 1998. Vol. 45. P. 713-719.
11. Ilyina A.V., Varlamov V.P. Effect of physicochemical parameters on the formation of chitosan-based gels // Appl. Biochem. Microbiol. 2004. Vol. 40, №6. P. 599-602.
12. Lim S.-H., Hudson S.M. Synthesis and antimicrobial activity of a water-soluble chitosan derivative with a fiber-reactive group // Carbohydr. Res. 2004. Vol. 339, №2. P. 313-319.
13. Aranaz I. et al. Functional Characterization of Chitin and Chitosan // Curr. Chem. Biol. 2009. Vol. 3. P. 203-230.
14. Patrulea V. et al. Chitosan as a starting material for wound healing applications // Eur. J. Pharm. Biopharm. Elsevier B.V., 2015. Vol. 97. P. 417-126.
15. Younes I., Rinaudo M. Chitin and Chitosan Preparation from Marine Sources. Structure, Properties and Applications // Mar. Drugs. 2015. Vol. 13. P. 1133-1174.
16. Popov S. V et al. Pectic polysaccharides of the fresh plum Prunus domestica L. isolated with a simulated gastric fluid and their anti-inflammatory and antioxidant activities. // Food Chem. Elsevier Ltd, 2014. Vol. 143. P. 106-113.
17. Elowsson L. et al. Porous protein-based scaffolds prepared through freezing as potential scaffolds for tissue engineering // J. Mater. Sci. Mater. Med. 2012. Vol. 23, №10. P. 2489-2498.
18. Oakes P.W. et al. Neutrophil morphology and migration are affected by substrate elasticity // Blood. 2009. Vol. 114, №7. P. 1387-1395.
19. Wattanakorn N. et al. Pectin-Based Bioadhesive Delivery of Carbenoxolone Sodium for Aphthous Ulcers in Oral Cavity // AAPS PharmSciTech. 2010. Vol. 11, №2. P. 743-751.
20. Lauder C.I.W., Strickland A., Maddern G.J. Use of a Modified Chitosan-Dextran Gel to Prevent Peritoneal Adhesions in a Rat Model // J. Surg. Res. Elsevier Inc, 2011. Vol. 171. P. 877-882.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ СПАЙКООБРАЗОВАНИЯ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ И СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ СПАЕЧНОГО ПРОЦЕССА | 2016 |
|
RU2624228C1 |
| СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ СПАЕЧНОГО ПРОЦЕССА | 2012 |
|
RU2582975C2 |
| Способ моделирования послеоперационного спаечного процесса брюшины в эксперименте | 2018 |
|
RU2677194C1 |
| СПОСОБ ПРОФИЛАКТИКИ ПОСЛЕОПЕРАЦИОННОГО СПАЕЧНОГО ПРОЦЕССА ОРГАНОВ МАЛОГО ТАЗА | 2020 |
|
RU2745965C1 |
| КОМПОЗИЦИЯ ДЛЯ ИЗОЛИРОВАНИЯ КИШЕЧНОГО АНАСТАМОЗА И ПРЕДОТВРАЩЕНИЯ ПОСЛЕОПЕРАЦИОННОГО СПАЕЧНОГО ПРОЦЕССА | 2022 |
|
RU2796007C1 |
| СПОСОБ ПРОФИЛАКТИКИ РЕЦИДИВА СПАЕЧНОЙ БОЛЕЗНИ У БОЛЬНЫХ С ТРУБНО-ПЕРИТОНЕАЛЬНОЙ ФОРМОЙ БЕСПЛОДИЯ | 2010 |
|
RU2445028C2 |
| Способ получения противоспаечного пленочного материала на основе карбоксиметилцеллюлозы | 2016 |
|
RU2629841C1 |
| Способ получения противоспаечного пленочного материала на основе производных целлюлозы | 2016 |
|
RU2634577C1 |
| СПОСОБ ПРОФИЛАКТИКИ ОБРАЗОВАНИЯ СПАЕК И ИХ РЕЦИДИВА | 2007 |
|
RU2331367C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ СПАЕЧНОГО ПРОЦЕССА В БРЮШНОЙ ПОЛОСТИ | 2016 |
|
RU2632538C1 |

Изобретение относится к биополимерам, в частности, к способу получения хирургического барьерного материала на основе полисахаридов. Для получения барьерного материала используют пектин яблочный и хитозан, предпочтительно, хитозан со степенью дезацетилирования 38-100% и молекулярной массой 25-230 кДа. Согласно способу пектин яблочный растворяют в воде, хлорид кальция или хитозан с добавлением хлорида кальция растворяют в 0,25% водном растворе уксусной кислоты, полученный раствор замораживают при минус 18±1оС, затем наслаивают на него раствор пектина яблочного. Массовое соотношение пектина и хитозана составляет 3:1. Медленно оттаивают замороженный раствор в течение 4-6 ч при температуре 15-22оС. Сформировавшийся хирургический барьерный материал лиофильно высушивают и затем стерилизуют УФ-облучением. Хирургический барьерный материал в форме криогеля обладает биосовместимыми свойствами, сроком биодеградации, не превышающим 24 ч, и позволяет эффективно предупреждать образование спаек в эксперименте. 1 з.п. ф-лы, 1 ил., 2 табл., 5 пр.
1. Способ получения хирургического барьерного материала на основе полисахаридов, включающий растворение пектина в воде с последующим нанесением на предварительно замороженный при минус 18±1°C раствор хлорида кальция или хитозана с добавлением хлорида кальция, отличающийся тем, что пектин используют яблочный, а хлорид кальция или хитозан и хлорид кальция растворяют в 0,25% водном растворе уксусной кислоты, полученный раствор замораживают, затем наслаивают раствор пектина яблочного на замороженный раствор хлорида кальция или хитозана и хлорида кальция, при этом массовое соотношение пектина и хитозана в составе хирургического барьерного материала составляет 3:1, формирование хирургического барьерного материала проходит при медленном оттаивании замороженного раствора в течение 4-6 ч при температуре 15°C-22°C, после чего сформировавшийся хирургический барьерный материал лиофильно высушивают и затем стерилизуют УФ-облучением.
2. Способ по п. 1, отличающийся тем, что используют хитозан со степенью дезацетилирования 38-100% и молекулярной массой 25-230 кДа.
| М.В.Коновалова и др., Деградация in vitro пектин-хитозановых криогелей, Известия Уфимского Научного Центра РАН, 2016, N3(1), стр.42-45 | |||
| М.В.Коновалова и др., Криогели на основе пектина и хитозана как противоспаечные барьерные материалы, Материалы VIII Московского Международного Конгресса "Биотехнология: состояние и перспективы развития", 17-20 марта 2015, часть 1, стр.219-220 | |||
| СПОСОБ ПОЛУЧЕНИЯ ГЕЛЯ НА ОСНОВЕ ПЕКТИНА ИЗ НАДЗЕМНОЙ ЧАСТИ КИПРЕЯ УЗКОЛИСТНОГО | 2012 |
|
RU2510275C1 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИСЕПТИЧЕСКОЙ ПЛЕНКИ | 2007 |
|
RU2342955C1 |
| СПОСОБ ПРОФИЛАКТИКИ ОБРАЗОВАНИЯ СПАЕК И ИХ РЕЦИДИВА | 2007 |
|
RU2331367C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ БИОДЕГРАДИРУЕМЫХ МЕМБРАН ДЛЯ ПРЕДОТВРАЩЕНИЯ ОБРАЗОВАНИЯ СПАЕК ПОСЛЕ КАРДИОХИРУРГИЧЕСКИХ ОПЕРАЦИЙ | 2013 |
|
RU2525181C1 |
| БИОРАЗЛАГАЕМАЯ ПЛЕНКА НА ОСНОВЕ ПЕКТИНА И ХИТОЗАНА | 2010 |
|
RU2458077C1 |
Авторы
Даты
2017-08-09—Публикация
2016-08-12—Подача