Настоящее изобретение относится к применению комбинации эйкозапентаеновой кислоты (ЕРА), докозапентаеновой кислоты (DPA) и докозагексаеновой кислоты (DHA) и соответственно ЕРА, DPA и/или DHA и белка, углевода, липида, аминокислоты, жирной кислоты, пищевых волокон, витамина, минеральных веществ, микроэлементов, бета-каротиноида, флавоноида, нуклеотида, L-карнитина, холина, инозитола, таурина, креатина и/или коэнзима с химиопрепаратом в лечении опухолевых заболеваний. Изобретение далее относится к способу лечения опухолевого заболевания, который включает введение ЕРА, DPA и/или DHA или ЕРА, DPA и/или DHA и белка, углевода, липида, аминокислоты, жирной кислоты, пищевых волокон, витамина, минеральных веществ, микроэлементов, бета-каротиноида, флавоноида, нуклеотида, L-карнитина, холина, инозитола, таурина, креатина и/или коэнзима. Изобретение далее относится к композиции, содержащей ЕРА или DPA или состоящей из ЕРА или DP А, предпочтительно применяемой для лечения опухолевого заболевания, которая, в частности, усиливает эффект противоопухолевого лечения, например, усиливает эффект химиопрепарата и/или лучевой терапии.
Уровень техники
Улучшение результатов лечения опухолевых заболеваний все еще актуально, так как в обозримом будущем количество онкологических больных возрастет, особенно вследствие старения населения. Даже несмотря на значительное увеличение выживаемости за прошедшие несколько десятилетий, в частности, детей и больных юного возраста, имеется существенная необходимость в повышении эффективности лечения онкологических больных. Вообще говоря, существует четыре стандартных способа лечения рака: хирургический, химиотерапия, лучевая терапия и иммунотерапия/биологическая терапия.
Химиотерапия в наиболее упрощенном понимании этого термина означает лечение заболевания, в том числе онкологического, то есть злокачественной или доброкачественной опухоли, с помощью химических веществ. Все химиотерапевтические вещества вызывают более или менее выраженные побочные эффекты, которые ухудшают общее состояние больного, что иногда затрудняет его лечение. Необходимость в уменьшении степени тяжести побочных эффектов для повышения эффективности химиотерапевтических веществ в лечении онкологического заболевания вызывает значительный интерес. Для достижения этой цели можно, например, повысить чувствительность опухолевых клеток к химиотерапевтическим веществам или повысить степень поглощения химического вещества опухолевыми клетками.
Заявка JP 2005213229 относится к противоопухолевым веществам, содержащим DPA в комбинации с иммунотерапевтическими веществами, такими, как вещества, индуцирующие продукцию ИЛ-12 (интерлейкин-12).
Публикация WO 97/39749 А2 относится к способу предупреждения и лечения кахексии и анорексии путем применения питательной композиции, включающей жирные кислоты, такие, как ЕРА, DPA и DHA. Эта композиция может также улучшить транспорт химиотерапевтического вещества в целевую опухолевую клетку.
В публикации WO 2010/033424 А2 описана иммунонутритивная композиция, содержащая, помимо прочих, эссенциальные жирные кислоты, такие, как ЕРА и DHA, которые можно вводить вместе с химиотерапевтическим веществом.
Тем не менее, ни в одном из этих документов не описаны специфические концентрации ЕРА, DPA и/или DHA, которые высокоэффективны в предупреждении и/или лечении опухолевого заболевания.
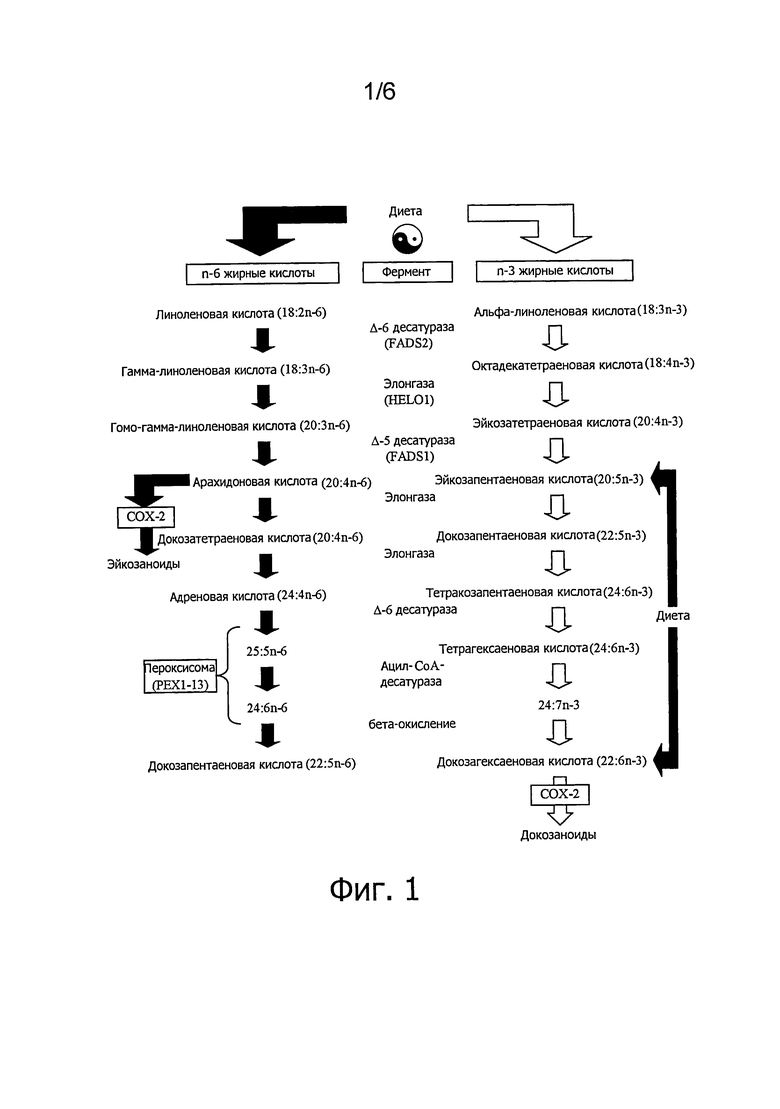
N-3 полиненасыщенные жирные кислоты играют важную роль в питании, так как в организме человека эти n-3 жирные кислоты не синтезируются. Имеется потребность в образовании n-3 жирных кислот с длинной углеродной цепью, таких, как ЕРА (С20:5) и DHA (С22:6) из n-3 жирных кислот с короткой цепью из 18 атомов углерода путем элонгации. Другая n-3 полиненасыщенная жирная кислота является DPA (С22:5) представляет собой продленный метаболит ЕРА и является промежуточным продуктом между ЕРА и DHA. Источниками DPA являются, например, DPA как свободная жирная кислота или как присутствующая в фосфолипидах или в триглицероле или диацилглицероле, причем в этом примере липиды могут образовываться синтетически. Другими примерами источников DPA является тяжелый керосин, масло, извлекаемое из морских водорослей, лососевое масло, акулье масло. В качестве альтернативы DPA превращают в тяжелый керосин или масло, получаемое из водорослей, путем ферментативного обогащения. N-З полиненасыщенным жирным кислотам приписывают многие целебные свойства, в том числе благоприятное влияние на сердечно-сосудистую систему, течение воспалительного процесса, нейродистрофических процессов и рака.
В связи со значительной вариабельностью механизма действия химиотерапевтических веществ, а также значительной вариабельностью поведения клеток различных типов опухолей, лечение онкологических заболеваний отличается высокой степенью специфичности. Настоящее изобретение относится к неожиданной комбинации ЕРА, DPA и/или DHA и химиотерапевтического вещества и соответственно химиотерапевтическому веществу, в котором концентрация активных соединений, то есть ЕРА, DPA и/или DHA и их комбинация с химиотерапевтическим веществом, высокоэффективна в применении для предупреждения и/или лечения онкологического заболевания.
Более того, авторы настоящего изобретения неожиданно обнаружили, что если химиотерапевтическое вещество комбинируют с ЕРА или DPA и/или белком в высокой концентрации и/или лейцином, то химиотерапевтическое вещество проявляет большую токсичность в отношении опухолевых клеток и в то же время меньшую токсичность в отношении здоровых, неопухолевых клеток.
Сущность изобретения
Настоящее изобретение относится к комбинации эйкозапентаеновой кислоты (ЕРА), докозапентаеновой кислоты (DPА) и/или докозагексаеновой кислоты, в которой концентрация ЕРА составляет от 1 до 1000 мг/100 мл, предпочтительно от 1 до 700 мг/100 мл, концентрация DPA составляет более 50 мг/100 мл, от 50 до 1000 мг/100 мл, предпочтительно от 65 до 800 мг/100 мл, более предпочтительно от 80 до 500 мг/100 мл и/или концентрация DHA составляет от 1 до 500 мг/100 мл, предпочтительно от 1 до 300 мг/100 мл, и химиотерапевтическому веществу и/или лучевой терапии.
В другом варианте осуществления настоящее изобретение относится к комбинации ЕРА, DPА и/или DHA, в которой концентрация ЕРА составляет от 1 до 1000 мг/100 мл, предпочтительно от 1 до 700 мг/100 мл, концентрация DPA составляет более 50 мг/100 мл, предпочтительно от 50 до 1000 мг/100 мл, предпочтительно от 65 до 800 мг/100 мл, более предпочтительно от 80 до 500 мг/100 мл, и/или концентрация DHA составляет от 1 до 500 мг/100 мл, предпочтительно от 1 до 300 мг/100 мл, и белка, углевода, липида (жира), аминокислоты, жирной кислоты, пищевых волокон, витамина, минерального вещества, микроэлемента, бета-каротиноида, флавоноида, нуклеотида, L-карнитина, холина, инозитола, таурина, креатина и/или коэнзима и химиотерапевтического вещества и/или лучевой терапии.
Химиотерапевтическое вещество является алкилирующим препаратом, антиметаболитом, антимитотическим цитостатиком, ингибитором топоизомеразы, противоопухолевым антибиотиком или любым другим цитостатиком, преимущественно цисплатином и/или доксорубицином.
В другом варианте осуществления изобретения для лечения онкологического заболевания, предпочтительно аденокарциномы, используется комбинация ЕРА, DPA и/или DHA или ЕРА, DPA и/или DHA и белка, углевода, липида (жир), аминокислоты, жирной кислоты, пищевых волокон, витамина, минерального вещества, микроэлемента, бета-каротиноида, флавоноида, нуклеотида, L-карнитина, холина, инозитола, таурина, креатина и/или коэнзима.
При альтернативном варианте осуществления изобретения предлагается способ лечения онкологического заболевания, включающий введение ЕРА, DPA и/или DHA или нутритивной композиции, содержащей ЕРА, DPA и/или DHA и белок, углевод, липид (жир), аминокислоту, жирную кислоту, пищевые волокна, витамин, минеральное вещество, микроэлемент, бета-каротиноид, флавоноид, нуклеотид, L-карнитин, холин, инозитол, таурин, креатин и/или коэнзим в комбинации с химиотерапевтическим веществом, предпочтительно цисплатином и/или доксорубицином, и/или лучевой терапией.
В еще одном варианте осуществления изобретение относится к композиции, содержащей или состоящей из DPA в концентрации >50 мг/100 мл, в частности от 50 до 1000 мг/100 мл, предпочтительно от 65 до 800 мг/100 мл, более предпочтительно от 80 до 500 мг/100 мл, или ЕРА в концентрации от 1 до 3000 мг/100 мл, от 1 до 1000 мг/100 мл, более предпочтительно от 1 до 700/100 мл, в которой ЕРА является депо DPA, и ЕРА метаболизируется в организме в DPA. Композиция предпочтительно используется для профилактики и/или лечения онкологического заболевания.
В другом варианте осуществления изобретение относится к нутритивной композиции, содержащей ЕРА, DPA и/или DHA и белок, углевод, липид, аминокислоту и/или жирную кислоту, в которой концентрация белка предпочтительно составляет более 10 энергетических процентов или более 15 энергетических процентов или более 20 энергетических процентов, а концентрация лейцина - более 5 мас.%, более 10 мас.%, более 15 мас.% или более 17 мас.% общего содержания белка.
Фигуры
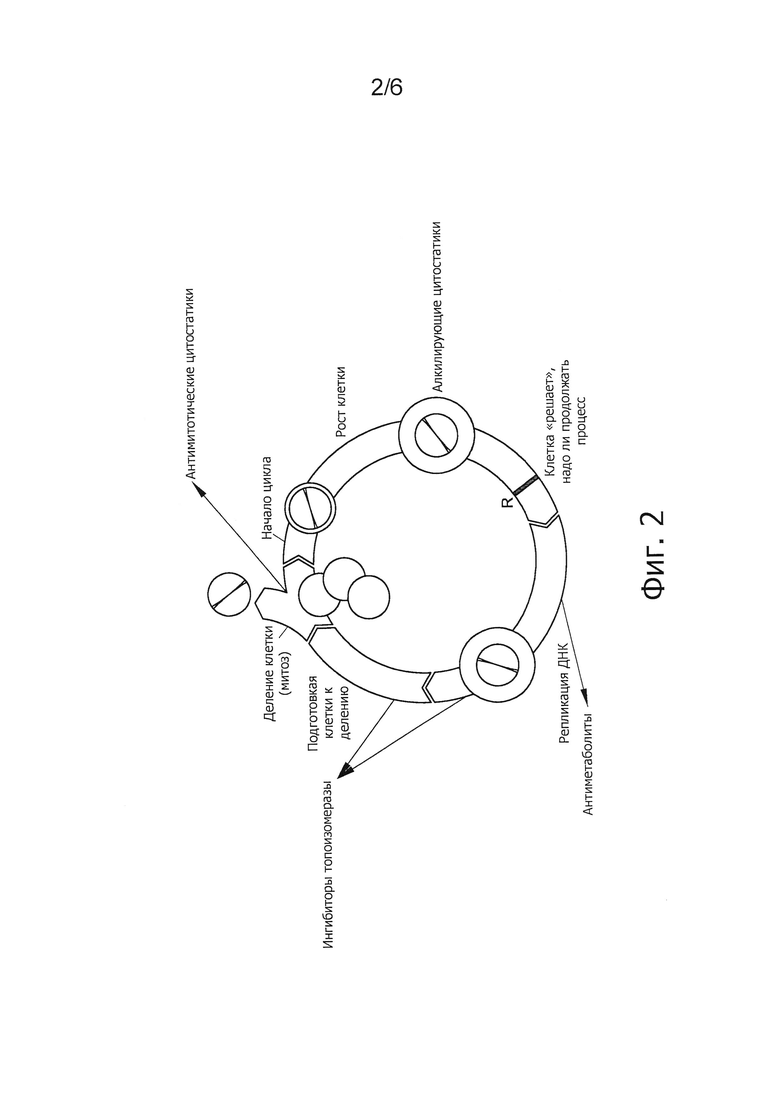
На следующих фигурах приводятся конкретные варианты осуществления изобретения, но настоящее изобретение не ограничивается приведенными вариантами. Фиг.1. Элонгация полиненасыщенных жирных кислот. Фиг.2. Категории химиотерапевтических веществ.
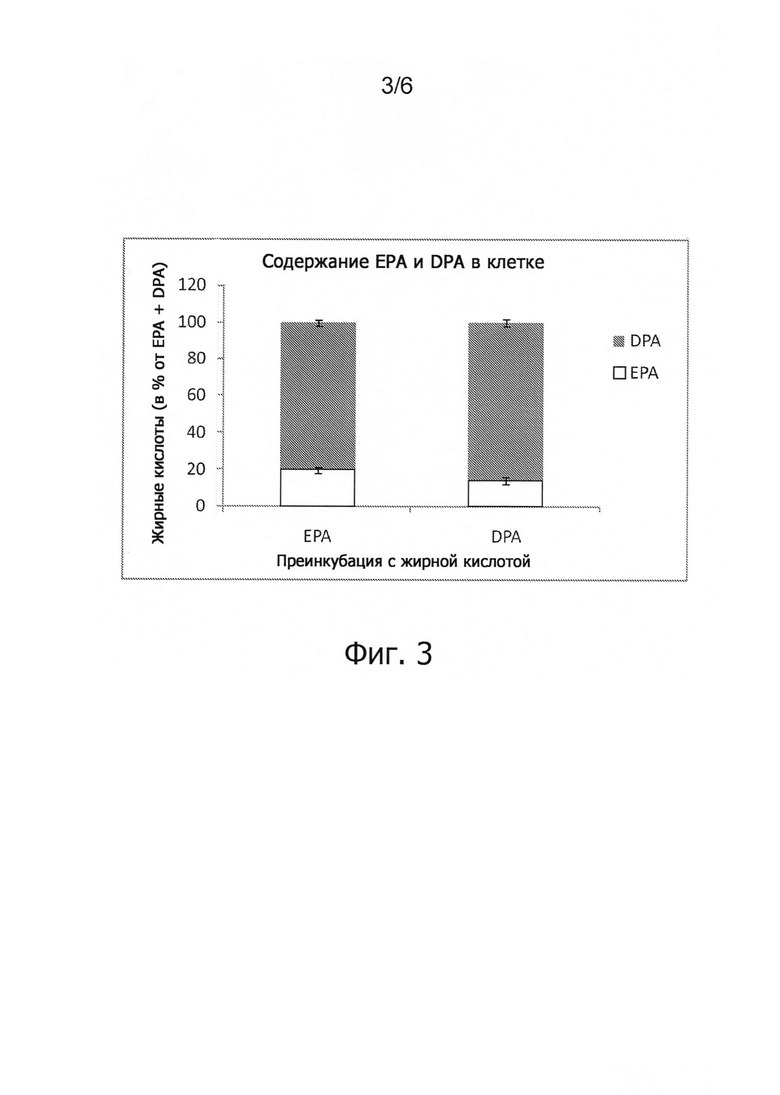
Фиг.3. После преинкубации клеток С26 с ЕРА или DPA в течение 4 дней соотношение ЕРА и DPA остается тем же. Значения представляют собой средние ± средняя квадратичная ошибка, n=4.
Фиг.4. Метаболическая активность клеток С26 через 4 дня преинкубации с ЕРА, DHA или DPA (50 мкмоль) и 24-часовой инкубации с цисплатином (фиг.4А) или доксорубицином (фиг.4В). Значения представлены средними ± средняя квадратичная ошибка, n=4.
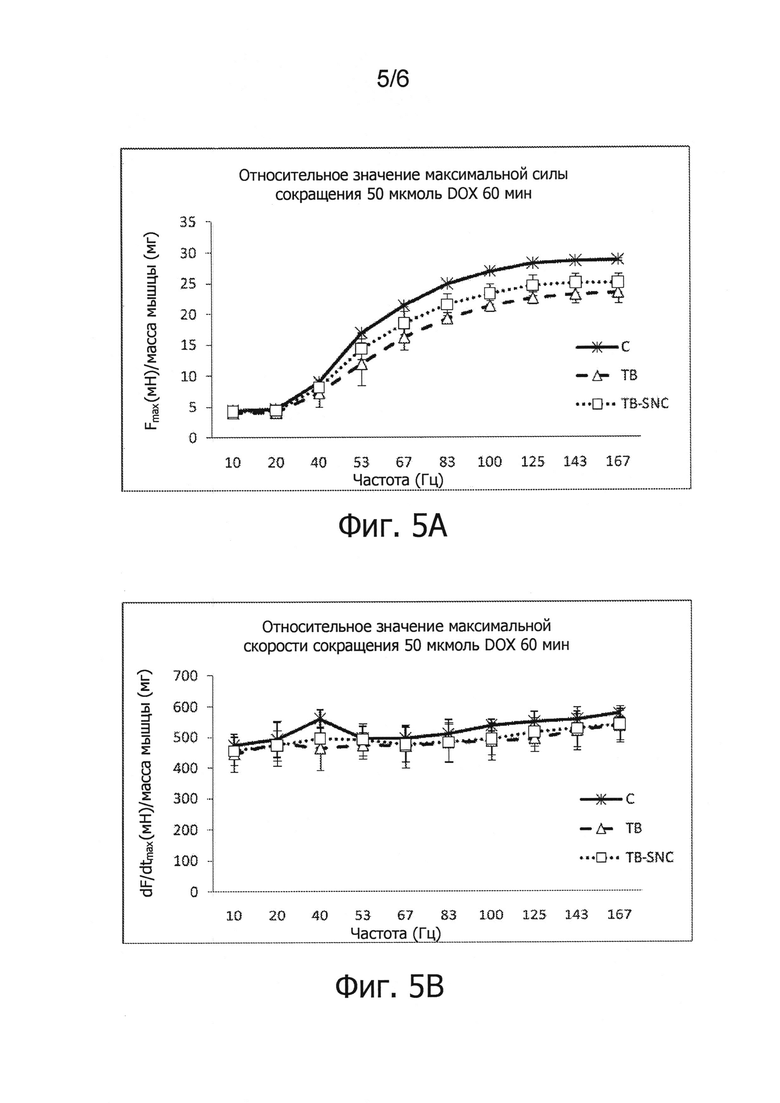
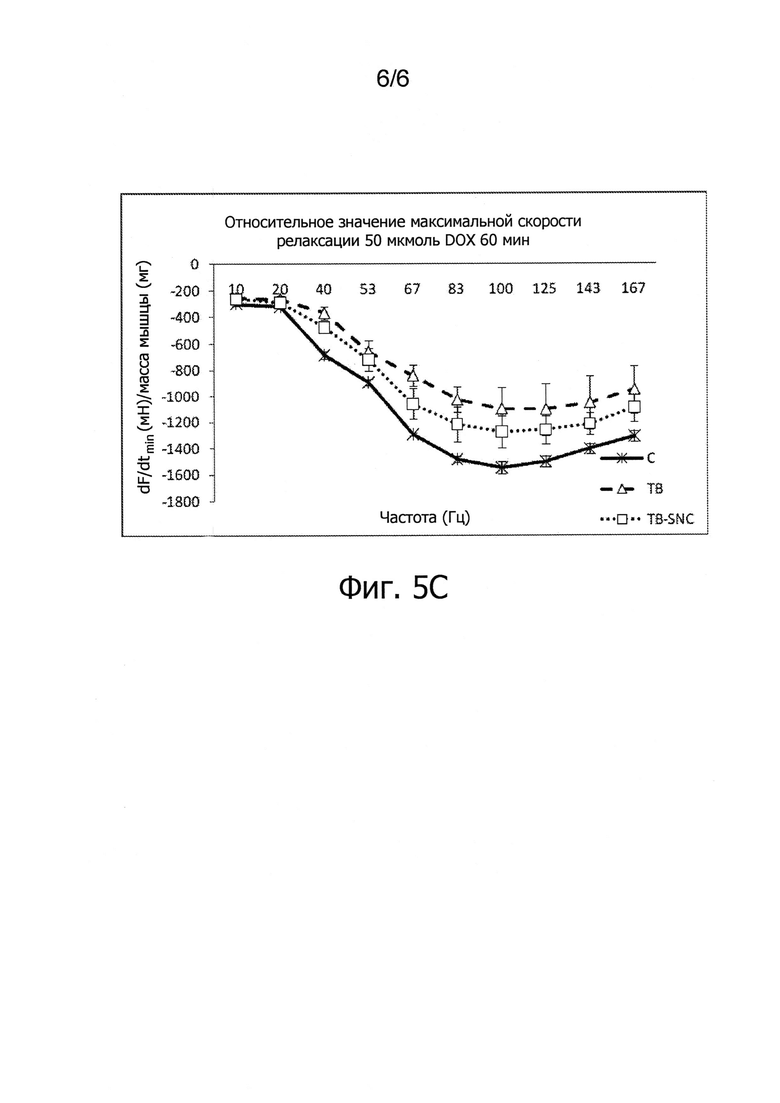
Фиг.5. Функция скелетной мышцы, описываемая кривой зависимости силы от частоты (ex-vivo), у мыши, пораженной опухолью, после приема специфической нутритивной комбинации. С - мышь, получающая контрольную диету В, ТВ - мышь, пораженная опухолью и получающая контрольную диету, TB-SNC - мышь, пораженная опухолью, получающая специфическую нутритивную комбинацию. Данные представлены средней ± средняя квадратическая ошибка.
Фиг.5A. Кривые зависимости максимальной силы сокращения длинного разгибателя пальцев на единицу массы его массы от частоты стимуляции у мыши, получающей различную пищу в течение 20 дней после инокуляции опухолевых клеток.
Фиг.5B. Кривые зависимости максимальной скорости сокращения длинного разгибателя пальцев на единицу его массы от частоты стимуляции у мыши, получающей различные диеты в течение 20 дней после инокуляции опухолевых клеток.
Фиг.5C. Кривые зависимости максимальной скорости релаксации длинного разгибателя пальцев на единицу его массы от частоты стимуляции у мыши, получающей различные диеты в течение 20 дней после инокуляции опухолевых клеток.
Подробное описание изобретения
Настоящее изобретение относится к комбинации эйкозапентаеновой кислоты (ЕРА), докозапентаеновой кислоты и/или докозагексаеновой кислоты и химиотерапевтического вещества или ЕРА, DPA и/или DHA и белка, углевода, липида (жира), аминокислоты, жирной кислоты, пищевых волокон, витамина, минерального вещества, микроэлемента, бета-каротиноида, флавоноида, нуклеотида, L-карнитина, холина, инозитола, таурина, креатина и/или коэнзима и химиотерапевтического вещества. Благоприятный эффект n-3 полиненасыщенных жирных кислот, таких, как ЕРА и DHA, например, как части рыбьего жира, например, лососевого или акульего, на состояние здоровья млекопитающих и, в частности, человека, обсуждается часто. Поскольку DPA является промежуточным продуктом между ЕРА и DHA и почти недоступна в чистом виде и образует лишь незначительную часть, например, рыбьего жира, действие DPA менее изучено. В настоящем изобретении показано, что комбинация этих n-3 полиненасыщенных жирных кислот, в частности, DP А, и химиотерапевтического вещества значительно повышает цитотоксический эффект химиотерапевтического вещества, который можно определить по метаболической активности клетки. Таким образом, ЕРА, DPA и/или DHA повышают чувствительность клеток к химиотерапевтическому веществу, в котором DPA является наиболее эффективной n-3 полиненасыщенной жирной кислотой.
Кроме того, химиотерапевтическое вещество оказывает значительно более выраженное токсическое действие на опухолевые клетки, чем на здоровые, неопухолевые, клетки, когда нутритивная или фармацевтическая композиция содержит ЕРА и/или DPA и высокую концентрацию белка и/или лейцина.
Эйкозапентаеновая кислота метаболизируется в DPA (см. фиг.2), и в этом смысле оказывает двоякое действие на клетки. Одно из них состоит в прямой сенсибилизации опухолевых клеток, другое - в эффекте «депонирования», который основывается на метаболизации ЕРА в DPA, отличающуюся высокой эффективностью (см. пример 1 и фиг.3). Выбор и комбинация ЕРА, DPA и/или DHA, их концентрация, а также отбор химиотерапевтического вещества обеспечивают высокоспецифическую комбинацию, которая приводит к очень избирательному и эффективному применению в лечении онкологического заболевания.
Онкологическое заболевание в настоящем изобретении является любой доброкачественной или злокачественной опухолью. Доброкачественная опухоль не метастазирует, а название «доброкачественная» означает, что опухоль не вызывает тяжелой симптоматики и не прогрессирует. И действительно, многие виды доброкачественных опухолей безвредны для здоровья человека. Некоторые опухоли, определяемые как «доброкачественные», могут, тем не менее, негативно сказываться на здоровье человека. Примерами могут служить опухоли, которые вызывают «масс-эффект» (компрессию жизненно важных органов, таких, как кровеносные сосуды) или опухоли эндокринной ткани, которые продуцируют избыток определенных гормонов. Примерами таких опухолей могут служить аденома щитовидной железы, аденомы коры надпочечников, аденомы гипофиза. Доброкачественные опухоли в типичных случаях окружены наружной поверхностью (фиброзной оболочкой), которая не дает им проявить признаки злокачественного роста. Тем не менее, многие типы доброкачественных опухолей могут подвергнуться злокачественной трансформации и некоторые типы этих опухолей, например, тератома, особенно склонны к малигнизации.
Злокачественная опухоль, в отличие от доброкачественной, отличается неограниченным ростом. Она способна прорастать в соседние ткани и распространяться на отдаленные ткани, то есть метастазировать. В настоящем изобретении «злокачественная опухоль» является синонимом рака.
Комбинации веществ по изобретению используются для лечения онкологических заболеваний, например, рака поджелудочной железы, меланомы, опухолей мозга, рака мочевого пузыря, рака молочной железы, рака яичника, рака предстательной железы, рака толстой кишки, рака желудка, рака эндометрия, саркомы, лейкоза и других онкологических заболеваний системы крови, бластомы, глиомы, мезотелиомы, нейробластомы, рака почки, рака печени, рака легкого, предпочтительно аденокарциномы. Способ лечения онкологического заболевания предназначен также предпочтительно для лечения других типов рака, в частности, аденокарциномы.
Аденокарцинома - это рак, исходящий из железистой эпителиальной ткани. Эпителиальная ткань включает поверхностные слои кожи, железы и различные другие ткани, которые выстилают полости и органы. Эпителий является производным эктодермы, эндодермы или мезодермы. Клетки аденокарциномы, обладающие свойством выделять секрет, необязательно являются частью железы. Такая форма рака встречается, например, у млекопитающих, в частности, у человека, собаки, кошки, лошади и др.
Комбинации по изобретению содержат или состоят из ЕРА, DPA и/или DHA или ЕРА, DPA и/или DHA и белка, углевода, жира, аминокислоты, жирной кислоты, пищевых волокон, витамина, минерального вещества, микроэлемента, бета-каротиноида, флавоноида, нуклеотида, L-карнитина, холина, инозитола, таурина, креатина и/или коэнзима и химиотерапевтического вещества. Существует несколько типов химиотерапевтических веществ, которые отличаются по механизму действия, например, повреждения и элиминации опухолевой клетки, и которые будут представлены далее. На фиг.2 перечислены различные механизмы действия химиотерапевтических веществ.
Один из типов химиотерапевтических веществ - алкилирующие вещества, которые действуют на все фазы клеточного цикла. Алкилирующие цитостатики можно разделить на три группы в зависимости от механизма действия, однако всех их объединяет свойство связываться своей алкильной группой с ДНК (с атомами O2, N2, Р и S). Алкилирование приводит к нарушению функции ДНК и клеточной смерти. Примерами алкилирующих веществ являются цисплатин, оксалиплатин, циклофосфамид, ифосфамид, трофосфамид, мелфалан, хлорамбуцил, бусульфан, треосульфан, кармустин, ломустин, нимустин, стрептозоцин, прокарбазин, дакарбазин, темозоломид и тиотепа.
К другим типам химиотерапевтических веществ относятся антиметаболиты, которые нарушают образование биомолекул в клетке и проявляют активность в основном в фазе S клеточного цикла. Антиметаболиты сходны по своей структуре с метаболитами, но не могут быть использованы клеткой, то есть не метаболизируются в организме. Таким образом, антиметаболиты напоминают естественные метаболиты и вовлекаются в клетке в те же процессы, что и естественные метаболиты. Антиметаболиты блокируют жизненно важные функции клетки, клетка утрачивает способность расти и погибает. 5-фторурацил, метотрексат, азацитидин, капецитабин, доксифлуридин, цитарабин, гемцитабин, 6-тиогуанин, пентостатин, азатиоприн, 6-меркаптопурин, флударабин и кладрибин являются примерами антиметаболитов.
Антимитотические цитостатики представляют следующий тип химиотерапетических веществ, которые действуют на фазу М клеточного цикла. Микротубулы, которым принадлежит ключевая роль в фазе М, являются главной мишенью антимитотических цитостатиков. Антимитотические цитостатики блокируют микротубулы и тем самым клеточный цикл. Примерами антимитотических цитостатиков являются винорелбин, винкристин, винбластин и виндезин.
Ингибиторы топоизомеразы - следующий тип химиотерапевтических веществ. ДНК-топоизомеразы ответственны за топологическое состояние ДНК в клетке и катализируют трехстадийный процесс, который включает: 1) расщепление одной или обеих цепочек ДНК в зависимости от типа топоизомеразы (топоизомераза I расщепляет одну цепочку, топоизомераза II - две); 2) проведение сегмента ДНК через образовавшуюся брешь; 3) запечатывание бреши ДНК. Ингибитор топоизомераз блокирует этап лигирования в клеточном цикле, вызывая разрывы одной или двух цепочек ДНК, и нарушает целостность генома. Внесение этих разрывов в дальнейшем приводит к апоптозу и клеточной смерти. Примерами ингибиторов топоизомераз являются доксорубицин, камптотецин, топотекан, иринотекан, этопозид и тенипозид.
Следующим типом химиотерапевтических веществ являются противоопухолевые антибиотики, которые создаются в основном из натуральных продуктов, например, синтезируются почвенными грибами Streptomyces. Препараты этого типа действуют на многие фазы клеточного цикла и считаются циклоспецифическими. Примерами противоопухолевых антибиотиков являются тамоксифен, 5-фтор-5'-деоксиуридин, блеомицин, актиномицин D и митомицин.
Остальные цитостатики представляют собой альтернативную группу химиотерапевтических веществ, которые имеют совершенно иной механизм действия. L-аспарагиназа, например, представляет собой фермент, разрушающий L-аспарагин и специфически действующий на лейкозные клетки, которые утрачивают способность самим продуцировать L-аспарагин.
Гидроксикарбамид, например, ингибирует фермент рибонуклеотидредуктазу и таким образом синтез ДНК. Это вещество особенно эффективно действует на лейкозные клетки. Митотан, например, нарушает метаболизм опухолевой клетки, в частности, клеток почки, аматоксин ингибирует РНК-полимеразу. В результате нарушается транскрипция РНК и последовательность синтеза белков. Алтретамин ингибирует синтез ДНК и РНК в клеточном ядре.
Химиотерапевтические вещества, действующие наподобие лучевой терапии, применяются в лечении злокачественных и доброкачественных опухолей. Поэтому настоящее изобретение относится к альтернативному варианту осуществления, в котором предлагается комбинация ЕРА, DPA и/или DHA или ЕРА, DPA и/или DHA и белка, углевода, липида (жир), аминокислоты, жирной кислоты, пищевых волокон, витамина, минерального вещества, микроэлемента, бета-каротиноида, флавоноида, нуклеотида, L-карнитина, холина, инозитола, таурина, креатина и/или коэнзима и лучевой терапии.
Помимо ЕРА, DPA и/или DHA комбинация по изобретению содержит в предпочтительном варианте осуществления белок, например, животный белок, такой, как белок молочной сыворотки или казеин, или растительный белок, такой, как соевый белок или белок пшеницы, углевод, например, сахара, такие, как глюкоза, фруктоза, галактоза, лактоза, мальтоза, сукроза или трегалоза, полисахариды, такие, как крахмал, или органические кислоты, жир, например, насыщенный, мононенасыщенный, полиненасыщенный, или холестерин, аминокислоту, например, L-форму аланина, аргинина, аспарагиновой кислоты, аспарагина, цистеина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, пролина, серина, треонина, триптофана, тирозина или валина и/или жирной кислоты предпочтительно масляной кислоты, капроновой кислоты, каприловой кислоты, каприновой кислоты, лауриновой кислоты, миристиновой кислоты, пальмитиновой кислоты, соли пальмитиновой кислоты, пальмитолеиновой кислоты, стеариновой кислоты, олеиновой кислоты, линолевой кислоты, альфа-линоленовой кислоты, гамма-линоленовой кислоты, арахиновой кислоты, эйкозаеновой кислоты, дигомо гамма-линоленовой кислоты, арахидоновой кислоты, бегеновой кислоты, эруковой кислоты, лигноцериновой кислоты, нервоновой кислоты. Нутритивная композиция может содержать пищевые волокна, например, растворимые или нерастворимые, витамин, например, витамин A, D3, Е, K, В6, B12, C, тиамин, рибофлавин, ниацин, пантотеновую кислоту, фолиевую кислоту или биотин, минеральное вещество, например, натрий, калий, хлорид, фосфор, магний, железо, цинк, медь, марганец, фторид, молибден, селен, хром, йод, микроэлемент, бета-каротиноид, например альфа-, бета- или гамма-каротины, ликопин, лютеин, или зеаксантин, флавоноид, например гесперидин или кверцетин, нуклеотид, например, цитидин-5'-монофосфат, уридин-5'-монофосфат, аденозин-5'-монофосфат, гуанозин-5'-монофосфат или инозин-5'-монофосфат, L-карнитин, холин, инозитол, таурин, креатин и/или коэнзим, например, коэнзим Q10.
В предпочтительном варианте осуществления изобретения фармацевтическая или нутритивная композиция по изобретению содержит или состоит из ЕРА, DPA и/или DHA или ЕРА, DPA и/или DHA и белка, углевода, липида (жир), аминокислоты и/или жирной кислоты.
В предпочтительном варианте осуществления изобретения комбинация, предпочтительно нутритивная или фармацевтическая композиция, содержит ЕРА, DPA и/или DHA, белок молочной сыворотки, казеин или азот, глюкозу, галактозу, лактозу, мальтозу, сукрозу и трегалозу, органическую кислоту, растительный и животный жир, предпочтительно молоко, масляную кислоту, капроновую кислоту, каприловую кислоту, каприновую кислоту, лауриновую кислота, миристиновую кислоту, пальмитиновую кислоту, соль пальмитиновой кислоты, пальмитолеиновую кислоту, стеариновую кислоту, олеиновую кислоту, линолевую кислоту, альфа-линоленовую кислоту, арахиновую кислоту, эйкозеновую кислоту, арахидоновую кислоту, бегеновую кислоту и эруковую кислоту, растворимые пищевые волокна, натрий, калий, хлорид, фосфор, магний, железо, цинк, медь, марганец, фторид, молибден, селен, хром и йод, витамин A, D3, Е, K, B6, B12, C, тиамин, рибофлаавин, ниацин, пантотеновую кислоту, фолиевую кислоту и биотин, альфа-, бета- или гамма-каротины, ликопин, лютеин, зеаксантин, L-карнитин, холин и таурин, L-форму аланина, аргинин, аспарагиновую кислоту, аспарагин, цист(е)ин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серии, треонин, триптофан, тирозин и валин и возможно воду.
В другом предпочтительном варианте осуществления изобретения комбинация, предпочтительно нутритивная или фармацевтическая, содержит одно или более химиотерапевтическое вещество, такое, как цисплатин, оксалиплатин, циклофосфамид, ифосфамид, трофосфамид, мелфалан, хлорамбуцил, эстрамустин, бусульфан, треосульфан, кармустин, ломустин, нимустин, стрептозоцин, прокарбазин, дакарбазин, темозоломид, тиотепа, 5-фторурацил, метотрексат, азацитидин, капецитабин, доксифлуридин, цитарабин, гемцитабин, 6-тиогуанин, пентостатин, азатиоприн, 6-меркаптопурин, флударабин, кладрибин, винорелбин, винкристин, винбластин, виндезин, доксорубицин, камптотецин, топотекан, иринотекан, этопозид, тенипозид, тамоксифен, 5-фтор-5'-деоксиуридин, блеомицин, актиномицин D, митомицин, L-аспарагиназа, гидроксикарбамид, митотан, аматоксин и/или алтретамин, предпочтительно цисплатин и/или доксорубицин. Комбинация химиотерапевтического вещества содержит, например, 5-фторурацил, оксалиплатин и фолиевую кислоту (Folfox 4).
В предпочтительном варианте изобретения химиотерапевтическое вещество вводят в течение 1 ч, 3 ч, 6 ч, 8 ч, 10 ч, 12 ч, 1 дня, 2 дней, 3 дней, 4 дней, 5 дней, 6 дней или 7 дней предпочтительно до или после введения ЕРА, DPA и/или DHA или ЕРА, DPA и/или DHA и белка, углевода, липида (жира), аминокислоты, жирной кислоты, пищевых волокон, витамина, минерального вещества, микроэлемента, бета-каротиноида, флавоноида, нуклеотида, L-карнитина, холина, инозитола, таурина, креатина и/или коэнзима, более предпочтительно вводить их параллельно.
Комбинация ЕРА, DPA и/или DHA или ЕРА, DPA и/или DHA и белка, углевода, липида (жира), аминокислоты, жирной кислоты, пищевых волокон, витамина, минерального вещества, микроэлемента, бета-каротиноида, флавоноида, нуклеотида, L-карнитина, холина, инозитола, таурина, креатина и/или коэнзима и одного или более химиотерапевтического вещества, содержит ЕРА в концентрации от 1 до 3000 мг/100 мл, от 1 до 1000 мг/100 мл, предпочтительно от 1 до 700 мг/100 мл, DPA в концентрации от 1 или 50 до 1000 мг/10 мл, предпочтительно от 1 или 50 до 500 мг/100 мл, более предпочтительно 3, 30 или 50 до 300 мг/100 мл, как вариант более 50 мг/100 мл, например, от 50 до 100 мг/100 мл, предпочтительно от 65 до 800 мг/100 мл, более предпочтительно от 80 до 500 и/или DHA в концентрации от 1 до 500 мг/100 мл, предпочтительно от 1 до 300 мг/100 мл. 100 мл относится к объему ЕРА, DPA и/или DHA или ЕРА, DPA и/или DHA и белка, углевода, липида (жира), аминокислоты, жирной кислоты, пищевых волокон, витамина, минерального вещества, микроэлемента, бета-каротиноида, флавоноида, нуклеотида, L-карнитина, холина, инозитола. таурина, креатина и/или коэнзима не считая химиотерапевтического вещества.
ЕРА, DPA и/или DHA или ЕРА, DPA и/или DHA и белок, углевод, липид (жир), аминокислота, жирная кислота, пищевые волокна, витамин, минеральное вещество, микроэлемент, бета-каротиноид, флавоноид, нуклеотид, L-карнитин, холин, инозитол, таурин, креатин и/или коэнзим вводят в опухолевую клетку до, параллельно или после введения химиотерапевтического вещества и/или лучевой терапии.
В одном варианте осуществления изобретения ЕРА, DPA и/или DHA или ЕРА, DPA и/или DHA и белок, углевод, липид (жир), аминокислоту, жирную кислоту, пищевые волокна, витамин, минеральное вещество, микроэлемент, бета-каротиноид, флавоноид, нуклеотид, L-карнитин, холин, инозитол, таурин, креатин и/или коэнзим вводят в течение 1 ч, 2 ч, 3 ч, 4 ч, 5 ч, 6 ч, 7 ч, 8 ч, 9 ч, 10 ч, 11 ч, 12 ч или 1 день, 2 дня, 3 дня, 4 дня, 5 дней, 6 дней, или 7 дней в опухолевую клетку до или после введения химиотерапевтического вещества и/или лучевой терапии.
В другом варианте осуществления изобретения ЕРА, DPA и/или DHA или ЕРА, DPA и/или DHA и белок, углевод, липид (жир), аминокислоту, жирную кислоту, пищевые волокна, витамин, минеральное вещество, микроэлемент, бета-картиноид, флавоноид, нуклеотид, L-карнитин, холин, инозитол, таурин, креатин и/или коэнзим вводят от 1 до 3 раз в день от 1 до 3 раз в неделю или от 1 до 3 раз в месяц.
ЕРА, DPA и/или DHA или ЕРА, DPA и/или DHA и белок, углевод, липид (жир), аминокислоту, жирную кислоту, пищевые волокна, витамин, минеральное вещество, микроэлемент, бета-каротиноид, флавоноид, нуклеотид, L-карнитин, холин, инозитол, таурин, креатин и/или коэнзим вводят в форме порошка, таблетки, капсулы или жидкости. Предпочтительно фармацевтическую или нутритивную композицию назначают в жидкой форме.
Комбинацию ЕРА, DPA и/или DHA или ЕРА, DPA и/или DHA и белка, углевода, липида (жир), аминокислоты, жирной кислоты, пищевых волокон, витамина, минерального вещества, микроэлемента, бета-каротиноида, флавоноида, нуклеотида, L-карнитина, холина, инозитола, таурина, креатина и/или коэнзима и одно или более химиотерапевтическое вещество и/или лучевую терапию применяют в лечении онкологического заболевания и как вариант для использования в способе лечения онкологического заболевания или для использования in vitro. В частности, ЕРА, DPA и/или DHA или ЕРА, DPA и/или DHA и белок, углевод, жир, аминокислота, жирная кислота, пищевые волокна, витамин, минеральное вещество, микроэлемент, бета-каротиноид, флавоноид, нуклеотид, L-карнитин, холин, инозитол, таурин, креатин, и/или коэнзим усиливают эффект химиотерапевтического вещества и/или лучевой терапии.
В другом варианте осуществления изобретение относится к композиции, содержащей или состоящей из DPA в концентрации от 1 или 50 до 1000 мг/10 мл, предпочтительно от 1 или 50 до 500 мг/100 мл, более предпочтительно от 3, 30 или 50 до 300 мг/100 мл и как вариант более 50 мг/100 мл, например, 50-100 мг/100 мл, предпочтительно от 65 до 800 мг/100 мл, более предпочтительно от 80 до 500 мг/100 мл или ЕРА в концентрации от 1 до 3000 мг/100 мл, предпочтительно от 1 до 1000 мг/100 мл, более предпочтительно от 100 до 700 мг/100 мл, в которой ЕРА является депо для DP А и ЕРА в организме метаболизируется в DPA. Композиция предпочтительно применяется для профилактики и/или лечения онкологического заболевания.
Изобретение далее содержит способ профилактики и/или лечения онкологического заболевания, включающий введение DPA в количестве от 1 или 50 до 1000 мг/100 мл, предпочтительно от 1 или 50 до 500 мг/100 мл, более предпочтительно 3,30 или 50 до 300 мг/100 мл, в другом варианте более 50 мг/100 мл, например, 50-100 мг/100 мл, предпочтительно от 65 до 800 мг/100 мл, более предпочтительно от 80 до 500 мг/100 мл или ЕРА в количестве от 1 до 3000 мг/100 мл, предпочтительно от 1 до 1000 мг/100 мл, более предпочтительно от 100 до 700 мг/100 мл, в котором ЕРА служит депо для DPA и превращается в организме в DPA.
В следующем варианте осуществления изобретение относится к комбинации или нутритивной композиции, содержащей ЕРА, DPA и/или DHA и белок, углевод, липид (жир), аминокислоту и/или жирную кислоту, в которой содержание белка составляет предпочтительно >10 энергетических процентов, например от 10 до 100 энергетических процентов, от 10 до 80 энергетических процентов, от 10 до 50 энергетических процентов или от 10 до 30 энергетических процентов или >15 энергетических процентов, например, от 15 до 100 энергетических процентов, от 15 до 80 энергетических процентов, от 15 до 50 энергетических процентов или от 15 до 30 энергетических процентов, или >20 энергетических процентов, например, от 20 до 100 энергетических процентов, от 20 до 80 энергетических процентов, от 20 до 50 энергетических процентов или от 20 до 30 энергетических процентов и содержание лейцина составляет более 5 мас.%, более 10 мас.%, более 15 мас.% или более 17 мас.% общего содержания белка, предпочтительно от 5 до 10 мас.%, от 5 до 80 мас.%, от 5 до 50 мас.%, от 5 до 30 мас.%, от 10 до 100 мас.%, от 10 до 80 мас.%, от 10 до 50 мас.%, от 10 до 30 мас.%, от 15 до 100 мас.%, от 15 до 80 мас.%, от 15 до 50 мас.%, от 15 до 30 мас.% или от 17 до 100 мас.%, от 17 до 80 мас.%, от 17 до 50 мас.% или от 17 до 30 мас.% общего содержания белка. Предпочтительно белок содержит по меньшей мере 15 мас.%, предпочтительно по меньшей мере 25 мас.% белка молочной сыворотки от общего содержания белка.
Как вариант осуществления изобретения комбинация или нутритивная композиция по изобретению содержит липид, содержание которого больше 10 мас.% суммы ЕРА и DPA и содержание DPA более 5 мас.%, предпочтительно более 10%, более предпочтительно более 20 мас.% общего содержания ЕРА и DPA.
В другом варианте осуществления изобретения липид содержит жирную кислоту или жирную кислоту выбирают из группы, состоящей из масляной кислоты, капроновой кислоты, каприловой кислоты, каприновой кислоты, лауриновой кислоты, миристиновой кислоты, пальмитиновой кислоты, пальмитолеиновой кислоты, стеариновой кислоты, олеиновой кислоты, линолевой кислоты, альфа-линоленовой кислоты, гамма-линоленовой кислоты, арахидоновой кислоты, бегеновой кислоты, эруковой кислоты, лигноцериновой кислоты и нервоновой кислоты.
Следующая комбинация признаков считается частью настоящей заявки.
1. Комбинация, включающая эйкозапентаеновую кислоту (ЕРА) или докозапентаеновую кислоту (DPA), в которой содержание ЕРА составляет от 1 до 1000 мг/100 мл, предпочтительно от 1 до 700 мг/100 мл, содержание DPA составляет более 50 мг/100 мл, а химиотерапевтическое вещество выбирают из группы, состоящей из алкилирующего препарата, антиметаболита, антимитотического цитостатика, ингибитора топоизомеразы, противоопухолевого антибиотика и других цитостатиков и/или лучевой терапии.
2. Комбинация в соответствии с пунктом 1, в которой содержание DPA составляет от 50 до 1000 мг/100 мл, предпочтительно от 65 до 800 мг/100 мл, более предпочтительно от 80 до 500 мг/100 мл.
3. Комбинация в соответствии с пунктом 1 или 2, содержащая также белок, углевод, липид, аминокислоту, предпочтительно лейцин и/или жирную кислоту.
4. Комбинация в соответствии с пунктом 3, в которой содержание липида составляет более 10 мас.% суммарного содержания ЕРА и DPA и содержание DPA составляет более 5 мас.%, предпочтительно более чем 10 мас.%, более предпочтительно более 20 мас.% общего количества (ЕРА+DPA)
5. Комбинация в соответствии с пунктом 3 или 4, в которой липида содержит жирную кислоту или ее выбирают из группы, состоящей из масляной кислоты, капроновой кислоты, каприловой кислоты, лауриновой кислоты, миристиновой кислоты, пальмитиновой кислоты, соли пальмитиновой кислоты, пальмитолеиновой кислоты, стеариновой кислоты, олеиновой кислоты, линолевой кислоты, альфа-линоленовой кислоты, гамма-линоленовой кислоты, арахиновой кислоты, эйкозеновой кислоты, дигомо-гамма-линоленовой кислоты, арахидоновой кислоты, бегеновой кислоты, эруковой кислоты, лигноцериновой кислоты и нервоновой кислоты.
6. Комбинация в соответствии с любым из пунктов 3-5, в которой содержание белка выше 10 энергетических процентов или выше 15 энергетических процентов, или выше 20 энергетических процентов, а содержание лейцина выше 5 мас.% или выше 10 мас.% или выше 15 мас.% или выше 17 мас.% общего содержания белка.
7. Комбинация в соответствии с пунктами 3-6, в которой белок содержит по меньшей мере один белок из источника белка, выбранного из группы, состоящей из казеина, казеината, сои и пшеницы.
8. Комбинация в соответствии с любым из пунктов 3-7, в которой белок содержит по меньшей мере 15 мас.%, предпочтительно по меньшей мере 25 мас.% белка молочной сыворотки от общего содержания белка.
9. Комбинация в соответствии с любым из пунктов 1-8, содержащая пищевые волокна, витамин, минеральное вещество, микроэлемент, бета-каротиноид, флавоноид, нуклеотид, L-карнитин, холин, инозитол, таурин, креатин и/или коэнзим.
10. Комбинация в соответствии с любым из пунктов 1-9, в которой алкилирующее лекарство выбирают из группы, состоящей из цисплатина, оксалиплатина, циклофосфамида, ифосфамида, трофосфамида, мелфалана, хлорамбуцила, эстрамустина, бусульфана, треосульфана, кармустина, ломустина, нимустина, стрептозоцина, прокарбазина, дакарбазина, темозоломида и тиотепы; антиметаболиты выбирают из группы, состоящей из 5-фторурацила, метотрексата, азацитидина, капецитабина, доксифлуридина, цитарабина, гемцитабина, 6-тиогуанина, пентостатина, азатиоприна, 6-меркаптопурина, флударабина и кладрибина; антимитотический цитостатик выбирают из группы, состоящей из винорелбина, винкристина, винбластина и виндезина; ингибитор топоизомеразы выбирают из группы, состоящей из доксорубицина, камптотецина, топотекана, иринотекана, этопозида и тенипозида; противоопухолевый антибиотик выбирают из группы, состоящей из тамоксифена, 5-фтор-5'-деоксиуридина, блеомицина, актиномицина D и митомицина и/или цитостатик выбирают из группы, состоящей из L-аспарагиназы, гидроксикарбамида, митотана, аматоксина и алтретамина.
11. Комбинация в соответствии с любым из пунктов 1-10, в которой ЕРА или DPA или ЕРА или DPA и белок, углевод, жир, аминокислота, жирная кислота, пищевые волокна, витамин, минеральное вещество, микроэлемент, бета-каротиноид, флавоноид, нуклеотид, L-карнитин, холин, инозитол, таурин, креатин и/или коэнзим являются фармацевтической или нутритивной композицией.
12. Комбинация в соответствии с любым из пунктов 1-11 для применения в лечении онкологических заболеваний.
13. Комбинация в соответствии с пунктом 12, в которой онкологическое заболевание является доброкачественной или злокачественной опухолью.
14. Комбинация в соответствии с пунктами 12 и 13, в которой онкологическое заболевание выбирают из группы, состоящей из рака поджелудочной железы, меланомы, опухоли головного мозга, рака мочевого пузыря, рака молочной железы, рака яичника, рака предстательной железы, рака толстой кишки, рака желудка, рака эндометрия, саркомы, онкологических заболеваний системы крови, лейкоза, бластомы, глиомы, мезотелиомы, невробластомы, рака почки, рака печени, рака легкого.
15. Комбинация в соответствии с любым из пунктов 11-14, в которой ЕРА или DPA или ЕРА или DPA и белок, углевод, жир, аминокислоту, жирную кислоту, пищевые волокна, витамин, минеральное вещество, микроэлемент, бета-каротиноид, флавоноид, нуклеотид, L-карнитин, холин, инозитол, таурин, креатин и/или коэнзим вводят до введения химиотерапевтического вещества, параллельно с химиотерапевтическим веществом или после введения химиотерапевтического вещества и/или лучевой терапии.
16. Комбинация в соответствии с любым из пунктов 11-15, в которой ЕРА или DPA или ЕРА или DPA и белок, углевод, жир, аминокислоту, жирную кислоту, пищевые волокна, витамин, минеральное вещество, микроэлемент, бета-каротиноид, флавоноид, нуклеотид, L-карнитин, холин, инозитол, таурин, креатин и/или коэнзим вводят через 1-7 дней, предпочтительно 1-5 дней, более предпочтительно 1-3 дня до и/или после введения химиотерапевтического вещества.
17. Комбинация в соответствии с любым из пунктов 11-16, в которой ЕРА или DPA или ЕРА или DPA и белок, углевод, жир, аминокислоту, жирную кислоту, пищевые волокна, витамин, минеральное вещество, микроэлемент, бета-каротиноид, флавоноид, нуклеотид, L-карнитин, холин, инозитол, таурин, креатин и/или коэнзим вводят один раз в день, один раз в неделю или один раз в месяц.
18. Комбинация в соответствии с любым из пунктов 11-17, в которой ЕРА или DPA или ЕРА или DPA и белок, углевод, жир, аминокислоту, жирную кислоту, пищевые волокна, витамин, минеральное вещество, микроэлемент, бета-каротиноид, флавоноид, нуклеотид, L-карнитин, холин, инозитол, таурин, креатин и/или коэнзим вводят в форме порошка, таблетки, капсулы или жидкости.
19. Способ лечения онкологического заболевания, содержащий ЕРА или DPA или ЕРА или DPA и белок, углевод, жир, аминокислоту и/или жирную кислоту, в которой ЕРА вводят в количестве от 1 до 1000 мг/100 мл, предпочтительно от 1 до 700 мг/100 мл, DPA вводят в количестве более 50 мг/100 мл в комбинации с химиотерапевтическим веществом, выбираемым из группы, состоящей из алкилирующего вещества, антиметаболита, антимитотического цитостатика, ингибитора изомеразы, противоопухолевого антибиотика и любого другого цитостатика и/или лучевой терапии.
20. Способ в соответствии с пунктом 19, в котором DPA вводят в количестве от 50 до 1000 мг/100 мл, предпочтительно от 65 до 800 мг/100 мл, более предпочтительно от 80 до 500 мг/100 мл.
21. Способ в соответствии с пунктами 19 или 20, в котором алкилирующее вещество выбирают из группы, состоящей из цисплатина, оксалиплатина. циклофосфамида, ифосфамида, трофосфамида, мелфалана, хлорамбуцила, эстрамустина, бусульфана, треосульфана, кармустина, ломустина, нимустина, стрептозоцина, прокарбазина, дакарбазина, темозоломида и тиотепы; антиметаболиты выбирают из группы, состоящей из 5-фторурацила, метотрексата, азацитидина, капецитабина, доксифлуридина, цитарабина, гемцитабина, 6-тиогуанина, пентостатина, азатиоприна, 6-меркаптопурина, флударабина и кладрибина; антимитотический цитостатик выбирают из группы, состоящей из винорелбина, винкристина, винбластина и виндезина; ингибитор топоизомеразы выбирают из группы, состоящей из доксорубицина, камптотецина, топотекана, иринотекана, этопозида и тенипозида; противоопухолевый антибиотик выбирают из группы, состоящей из тамоксифена, 5-фтор-5'-деоксиуридина, блеомицина, актиномицина D и митомицина; и/или цитостатик выбирают из группы, состоящей из L-аспарагиназы, гидроксикарбамида, митотана, аматоксина и алтретамина.
22. Способ в соответствии с любым из пунктов 19-21, в котором субъектом является млекопитающее, предпочтительно человек.
23. Способ в соответствии с любым из пунктов 19-22, в котором онкологическое заболевание выбирают из группы, состоящей из рака поджелудочной железы, меланомы, опухоли головного мозга, рака мочевого пузыря, рака молочной железы, рака яичника, рака предстательной железы, рака толстой кишки, рака желудка, рака эндометрия, саркомы, онкологических заболеваний системы крови, лейкоза, бластомы, глиомы, мезотелиомы, невробластомы, рака почки, рака печени, рака легкого.
24. Способ в соответствии с пунктами 19-23, в котором ЕРА или DPA или ЕРА или DPA и белок, углевод, жир, аминокислоту, жирную кислоту, пищевые волокна, витамин, минеральное вещество, микроэлемент, бета-каротиноид, флавоноид, нуклеотид, L-карнитин, холин, инозитол, таурин, креатин и/или коэнзим вводят в форме порошка, таблетки, капсулы или в жидком виде.
25. Нутритивная композиция, содержащая или состоящая из DPA в количестве более 50 мг/100 мл.
26. Композиция в соответствии с пунктом 25, содержащая или состоящая из DPA в количестве от 50 до 1000 мг/100 мл, предпочтительно от 65 до 800 мг/100 мл, более предпочтительно от 80 до 500 мг/100 мл.
27. Композиция, содержащая или состоящая из ЕРА в количестве от 1 до 3000 мг/100 мл, предпочтительно от 1 до 1000 мг/100 мл, более предпочтительно от 1 до 700 мг/100 мл, в которой ЕРА является депо для DPA и ЕРА в организме метаболизируется в DPA.
28. Композиция в соответствии с любым из пунктов 25-27, содержащая белок, углевод, жир, аминокислоту, жирную кислоту, пищевые волокна, витамин, минеральное вещество, микроэлемент, бета-каротиноид, флавоноид, нуклеотид, L-карнитин, холин, инозитол, таурин, креатин и/или коэнзим.
29. Композиция в соответствии с любым из пунктов 25 или 28, предназначенная для профилактики и/или лечения онкологического заболевания.
30. Композиция в соответствии с любым из пунктов 25-29, в которой композиция представлена в виде порошка, таблетки, капсулы или в жидком виде.
31. Композиция в соответствии с пунктом 30, в которой композицию представлена в виде порошка для приготовления раствора путем добавления жидкости.
32. Способ профилактики и лечения онкологического заболевания путем введения DPA в количестве более 50 мг/100 мл.
33. Способ в соответствии с пунктом 32, при котором DPA вводят в количестве от 50 до 1000 мг/100 мл, предпочтительно от 65 до 80 мг/100 мл, более предпочтительно от 80 до 500 мг/100 мл.
34. Способ профилактики и лечения онкологического заболевания, при котором ЕРА вводят в количестве от 1 до 3000 мг/100 мл, предпочтительно от 1 до 1000 мг/100 мл, более предпочтительно от 1 до 700 мг/100 мл, и при котором ЕРА является депо для DPA и в организме метаболизируется в DPA.
Настоящее изобретение более подробно иллюстрируется на следующих примерах, причем изобретение не ограничено приведенными примерами.
Пример 1
Определение общего содержания жирных кислот
Клетки мышиной аденокарциномы С25 обычно культивируют дважды в неделю и культуру клеток изучают под бинокулярным микроскопом для определения конфлюэнтности. Культуральную среду удаляют путем вакуумного отсасывания и клетки промывают один раз в 10 мл фосфатно-буферного раствора. Фосфатно-буферный раствор удаляют и во флакон с культурой добавляют 2 мл трипсин-ЭДТА. После непродолжительного выдерживания в инкубаторе вновь с помощью бинокулярного микроскопа проверяют дезагрегацию клеток. Клетки ресуспендируют в 8 мл культуральной среды. В зависимости от степени конфлуентности клеточной культуры клетки пересевают в новый флакон в соотношении 1:3 или 1:5 и добавляют в него 25 мл свежей культуральной среды.
Для определения общего содержания жирных кислот фосфолипидов мышиные клетки С26 культивировали в 6-луночных планшетах. После 4-дневной инкубации с 50 мкмоль ЕРА, DPA или DHA, клетки отмывали предварительно нагретым фосфатно-буферным раствором и подвергали трипсинизации. После дезагрегации клетки ресуспендировали в 1 мл культуральной среды и переносили в 15-миллилитровые пробирки. Клетки центрифугировали в течение 5 мин при 1500 об/мин, надосадочную жидкость сливали и клетки лизировали, добавляя 500 мкл холодной стерильной деминерализованной воды и интенсивно перемешивали. Содержание жирных кислот фосфолипидов определяли с помощью газовой хроматографии.
Образцы маточного раствора и культуральной среды также подвергали анализу для определения степени чистоты добавленных жирных кислот. В контрольных клетках содержание олеиновой кислоты было очень высоким (С18:1 n-9), после преинкубации с n-3 жирными кислотами значительная часть олеиновой кислоты была замещена добавленной n-3 жирной кислотой. Преинкубация с ЕРА привела к небольшому увеличению содержания ЕРА фосфолипидов (8,1%) в клетках, но очень значительному увеличению содержания DPA фосфолипидов (32,6%). С другой стороны, преинкубация с DPA также привела к увеличению содержания ЕРА фосфолипидов (6,6%), сопоставимому с преинкубацией с ЕРА и аналогичному увеличению содержания DPA фосфолипидов (40,8%). Эти данные говорят о том, что не имеет значения, с каким веществом выполнялась преинкубация: с ЕРА или DPA - обе жирные кислоты приводили к одному и тому же паттерну инкорпорации жирных кислот (см. фиг.3). Этот феномен объясняется внутриклеточным процессом элонгации, в результате которого ЕРА превращается в DPA, однако происходит и обратное превращение DPA в ЕРА. Возможно, что имеется оптимальное соотношение между ЕРА и DPA в клетках. Преинкубация клеток с DHA приводила к увеличению содержания DHA фосфолипидов (28%) в клетках.
Пример 2
Метаболическая активность ЕРА, DHA или DPA
Перед инкубацией, связанной с химиотерапией, клетки С26 преинкубировали в течение 4 дней с ЕРА и DHA или DP А в конечной концентрации 50 мкмоль. Во избежание прямого взаимодействия между жирными кислотами и химиотерапевтическим веществом среду, содержащую жирные кислоты, перед добавлением химиотерапевтического вещества удаляли. Клетки инкубировали в течение 24 ч с химиопрепаратом цисплатином и доксорубицином и после инкубации измеряли метаболическую активность. На фиг.4 показаны результаты определения метаболической активности клеток при воздействии на них химиотерапевтическим веществом, которые были преинкубированы с ЕРА, DHA или DPA. Добавление ЕРА или DPA привело к значительному снижению метаболической активности после лечения цисплатином (p<0,0001), а также после лечения доксорубицином (p<0,0001). При добавлении DHA достоверного изменения метаболической активности по сравнению с контрольными клетками не произошло.
Пример 3
Функция скелетных мышц
Самцы мышей линии CD2F1(BALB/с×DBA/2, Harlan/Charles River the Netherlands) на 5-6-й неделе жизни были помещены для проживания в отдельные клетки с контролируемыми климатическими условиями (12:12 цикл дня и ночи и постоянная комнатная температура 21±1°C). После акклиматизации в течение одной недели мыши были разделены на группы, не отличающиеся по массе тела: 1) контрольную группу, получавшую обычное питание (С), 2) группу животных, пораженных опухолью, но получавших обычное питание (ТВ), и 3) группу животных, пораженных опухолью, но получавших специальную нутритивную комбинацию (TB-SNC), как было отмечено ранее, содержавшую много белка, лейцина и рыбьего жира в качестве активных ингредиентов и, кроме того, в пищу добавляли специальную олигосахаридную смесь (1). Все процедуры эксперимента были одобрены Этическим комитетом (DEC consult, Bilthoven, The Netherlands) и соответствовали требованиям гуманного обращения с лабораторными животными.
Сократительная способность длинного разгибателя пальцев самцов мышей CD2F1 7-9-недельного возраста изучена в условиях ex vivo, как описано ранее. Мышцы инкубировали (60 мин) с доксорубицином (DOX) в концентрации 50 мкмоль. Оценка токсичности для не пораженной опухолью мышцы в условиях ex vivo была дана ранее (1, 3). Результаты исследования приведены на фиг.5A-5C.
Список литературы
1. van Norren, K., et al., Dietary supplementation with a specific combination of high protein, leucine, and fish oil improves muscle function and daily activity in tumour-bearing cachectic mice. Br J Cancer., 2009. 100(5): p.713-22.
2. Gorselink, M., et al., Mass-dependent decline of skeletal muscle function in cancer cachexia. Muscle Nerve., 2006. 33(5): p.691-3.
3. van Norren, K., et al., Direct effects of doxorubicin on skeletal muscle contribute to fatigue. Br J Cancer., 2009. 100(2): p.311-4. Epub 2009 Jan 13.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПИТАТЕЛЬНАЯ КОМПОЗИЦИЯ ДЛЯ УЛУЧШЕНИЯ ИММУННОЙ СИСТЕМЫ МЛЕКОПИТАЮЩИХ | 2009 |
|
RU2525429C2 |
| СПОСОБ ЛЕЧЕНИЯ НЕЙРОТРАВМЫ | 2012 |
|
RU2622999C2 |
| ПИТАТЕЛЬНАЯ КОМПОЗИЦИЯ ДЛЯ УЛУЧШЕНИЯ МЫШЕЧНОЙ ФУНКЦИИ И СУТОЧНОЙ АКТИВНОСТИ | 2009 |
|
RU2506825C2 |
| ПРИМЕНЕНИЕ ПИТАТЕЛЬНОЙ КОМПОЗИЦИИ ДЛЯ УЛУЧШЕНИЯ МЫШЕЧНОЙ ФУНКЦИИ И СУТОЧНОЙ АКТИВНОСТИ | 2009 |
|
RU2636162C2 |
| СПОСОБ ЛЕЧЕНИЯ НЕЙРОТРАВМЫ | 2012 |
|
RU2749191C2 |
| СПОСОБ УЛУЧШЕНИЯ УПРАВЛЯЮЩИХ ФУНКЦИЙ | 2012 |
|
RU2637089C2 |
| ДОЛГОВРЕМЕННОЕ ПИТАНИЕ ДЛЯ ПРЕСТАРЕЛЫХ | 2007 |
|
RU2406411C1 |
| НЕМЕДИЦИНСКОЕ УВЕЛИЧЕНИЕ ИЛИ ПОДДЕРЖАНИЕ МАССЫ ТЕЛА МЛЕКОПИТАЮЩЕГО | 2011 |
|
RU2647461C2 |
| КОМБИНАЦИЯ КОМПОНЕНТОВ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ НЕМОЩНОСТИ | 2011 |
|
RU2646830C2 |
| ПИТАНИЕ, СОДЕРЖАЩЕЕ СМЕСЬ ЖИРОВ | 2005 |
|
RU2402927C2 |

Группа изобретений относится к фармакологии и медицине. Предложено применение композиции, включающей эйкозапентаеновую кислоту в количестве от 1 до 3000 мг/100 мл и/или докозапентаеновую кислоту в количестве более 50 мг/100 мл, которая имеет содержание белка больше чем 10 en% и содержание лейцина больше чем 5 масс. % от общего содержания белка, для усиления эффективности химиотерапевтического агента при лечении онкологического заболевания за счет того, что химиотерапевтический агент демонстрирует большую токсичность в отношении опухолевых клеток и параллельно меньшую токсичность в отношении здоровых неопухолевых клеток, где химиотерапевтический агент выбирают из группы, состоящей из алкилирующего агента и ингибитора топоизомеразы и соответствующий способ усиления эффективности химиотерапевтического агента при лечении онкологического заболевания. Технический результат состоит в снижение метаболической активности клеток аденокарциномы после лечения цисплатином или доксорубицином под действием эйкозапентаеновой или докозапентаеновую кислот и в повышении сократительной активности мышцы пораженных опухолью мышей под действием доксорубицина, когда мышей кормили заявленной композицией. 2 н. и 37 з.п. ф-лы, 5 ил., 3 пр.
1. Применение композиции, включающей эйкозапентаеновую кислоту в количестве от 1 до 3000 мг/100 мл и/или докозапентаеновую кислоту в количестве более 50 мг/100 мл, которая имеет содержание белка больше чем 10 en% и содержание лейцина больше чем 5 масс. % от общего содержания белка, для усиления эффективности химиотерапевтического агента при лечении онкологического заболевания за счет того, что химиотерапевтический агент демонстрирует большую токсичность в отношении опухолевых клеток и параллельно меньшую токсичность в отношении здоровых неопухолевых клеток, где химиотерапевтический агент выбирают из группы, состоящей из алкилирующего агента и ингибитора топоизомеразы.
2. Применение по п. 1, где докозапентаеновую кислоту вводят субъекту в количестве более 100 мг/сут.
3. Применение по п. 1, где докозапентаеновую кислоту вводят субъекту в количестве от 200 до 4000 мг/сут.
4. Применение по п. 3, где докозапентаеновую кислоту вводят субъекту в количестве от 250 до 3200 мг/сут.
5. Применение по п. 1, где дополнительно добавленный липид, присутствует в композиции в количестве более 10 масс. % суммы эйкозапентаеновой кислоты и докозапентаеновой кислоты и содержание докозапентаеновой кислоты составляет более 5 масс. %, от общего количества эйкозапентаеновой кислоты и докозапентаеновой кислоты.
6. Применение по п. 5, где содержание докозапентаеновой кислоты составляет от более чем 10 масс. % от общего количества докозопентаеновой кислоты и докозапентаеновой кислоты.
7. Применение по п. 5, где дополнительный липид или дополнительную жирную кислоту выбирают из группы, состоящей из масляной кислоты, капроновой кислоты, каприловой кислоты, каприновой кислоты, лауриновой кислоты, миристиновой кислоты, пальмитиновой кислоты, соли пальмитиновой кислоты, пальмитолеиновой кислоты, стеариновой кислоты, олеиновой кислоты, линолевой кислоты, альфа-линоленовой кислоты, гамма-линоленовой кислоты, арахиновой кислоты, эйкозеновой кислоты, дигомо-гамма-линоленовой кислоты, арахидоновой кислоты, гебеновой кислоты, эруковой кислоты, лигноцериновой кислоты и нервоновой кислоты.
8. Применение по п. 5, где содержание белка композиции составляет более 15 энергетических, а содержание лейцина - более чем 10 масс. % общего содержания белка.
9. Применение по п. 5, где белок содержит по меньшей мере один белок, выбираемый из группы, состоящей из казеина, соли казеина, сои и пшеницы.
10. Применение по п. 5, где белок содержит по меньшей мере 15 масс. % белка молочной сыворотки от общего содержания белка.
11. Применение по п. 2, где композиция дополнительно содержит пищевые волокна, витамин, минеральное вещество, микроэлемент, бета-каротиноид, флавоноид, нуклеотид, L-карнитин, холин, инозитол, таурин, креатин и/или коэнзим.
12. Применение по п. 2, где алкилирующий агент выбирают из группы, состоящей из цисплатина, оксалиплатина, циклофосфамида, ифосфамида, трофосфамида, мелфалана, хлорамбуцила, эстрамустина, бусульфана, треосульфана, кармустина, ломустина, нимустина, стрептозоцина, прокарбазина, дакарбазина, темозоломида и тиотепы, и ингибитор топоизомеразы выбирают из группы, состоящей из доксорубицина, камптотецина, топотекана, иринотекана, этопозида и тенипозида.
13. Применение по п. 2, где упомянутая композиция является нутритивной.
14. Применение по п. 4, где онкологическое заболевание является доброкачественной или злокачественной опухолью.
15. Применение по п. 4, где онкологическое заболевание выбирают из группы, состоящей из рака поджелудочной железы, меланомы, опухоли головного мозга, рака мочевого пузыря, рака молочной железы, рака яичника, рака предстательной железы, рака толстой кишки, рака желудка, рака эндометрия, саркомы, онкологического заболевания системы крови, лейкоза, бластомы, глиомы, мезотелиомы, невробластомы, рака почки, рака печени, рака легкого.
16. Применение по п. 4, где композицию вводят до введения химиотерапевтического агента.
17. Применение по п. 4, где композицию вводят за более чем одну неделю до введения химиотерапевтического агента ежедневно.
18. Применение по п. 4, где композицию вводят за 1-3 дня, за 2-5 дней, за 3-7 дней до введения химиотерапевтического агента и либо после или между введениями химиотерапевтического агента.
19. Применение по п. 4, где композицию вводят в форме порошка, таблетки, капсулы или в жидкой форме.
20. Способ усиления эффективности химиотерапевтического агента при лечении онкологического заболевания за счет того, что химиотерапевтический агент демонстрирует большую токсичность в отношении опухолевых клеток и параллельно меньшую токсичность в отношении здоровых неопухолевых клеток, включающий введение композиции, содержащей эйкозапентаеновую кислоту в количестве от 1 до 3000 мг/100 мл и/или докозапентаеновую кислоту в количестве более 50 мг/100 мл и имеющей содержание белка больше чем 10 en% и содержание лейцина больше чем 5 масс. % от общей массы белка, где указанное химиотерапевтический агент выбирают из группы, состоящей из алкилирующего агента и ингибитора топоизомеразы.
21. Способ по п. 20, где алкилирующий агент выбирают из группы, состоящей из цисплатина, оксалиплатина, циклофосфамида, ифосфамида, трофосфамида, мелфалана, хлорамбуцила, эстрамустина, бусульфана, треосульфана, кармустина, ломустина, нимустина, стрептозоцина, прокарбазина, дакарбазина, темозоломида и тиотепы, и ингибитор топоизомеразы выбирают из группы, состоящей из доксорубицина, камптотецина, топотекана, иринотекана, этопозида и тенипозида.
22. Способ по п. 20, где субъектом является млекопитающее, предпочтительно человек.
23. Способ по п. 20, где онкологическое заболевание выбирают из группы, состоящей из рака поджелудочной железы, меланомы, опухоли головного мозга, рака мочевого пузыря, рака молочной железы, рака яичника, рака предстательной железы, рака толстой кишки, рака желудка, рака эндометрия, саркомы, онкологических заболеваний системы крови, лейкоза, бластомы, глиомы, мезотелиомы, невробластомы, рака почки, рака печени, рака легкого.
24. Способ по любому из пп. 20-23, где эйкозапентаеновая кислота является депо докозапентаеновой кислоты и эйкозапентаеновая кислота метаболизируется в организме в докозапентаеновую кислоту.
25. Применение по п. 1, где онкологическое заболевание является доброкачественной или злокачественной опухолью.
26. Применение по п. 1, где онкологическое заболевание выбирают из группы, состоящей из рака поджелудочной железы, меланомы, опухоли головного мозга, рака мочевого пузыря, рака молочной железы, рака яичника, рака предстательной железы, рака толстой кишки, рака желудка, рака эндометрия, саркомы, онкологического заболевания системы крови, лейкоза, бластомы, глиомы, мезотелиомы, невробластомы, рака почки, рака печени, рака легкого.
27. Применение по п. 1, где эйкозапентаеновую кислоту и/или докозапентаеновую кислоту вводят до введения химиотерапевтического агента.
28. Применение по п. 1, где эйкозапентаеновую кислоту и/или докозапентаеновую кислоту вводят за 1-3 дня, или 2-5 дней, или 3-7 дней до введения химиотерапевтического агента ежедневно.
29. Применение по п. 1, где эйкозапентаеновую кислоту и/или докозапентаеновую кислоту вводят за 1-3 дня, или за 2-5 дней, или 3-7 дней до введения химиотерапевтического агента и либо после или между введениями химиотерапевтического агента.
30. Применение по п. 1, где эйкозапентаеновую кислоту и/или докозапентаеновую кислоту вводят в форме порошка, таблетки, капсулы или в жидкой форме.
31. Применение по п. 1, где онкологическое заболевание является доброкачественной или злокачественной опухолью.
32. Применение по п. 1, где химиотерапевтический агент представляет собой алкилирующий агент.
33. Применение по п. 32, где алкилирующий агент представляет собой цисплатин.
34. Применение по п. 1, где химиотерапевтический агент представляет собой ингибитор топоизомеразы.
35. Применение по п. 32, где ингибитор топоизомеразы представляет собой доксорубицин.
36. Способ по п. 29, где химиотерапевтический агент представляет собой алкилирующий агент.
37. Способ по п. 36, где алкилирующий агент представляет собой цисплатин.
38. Способ по п. 36, где химиотерапевтический агент представляет собой ингибитор топоизомеразы.
39. Способ по п. 38, где ингибитор топоизомеразы представляет собой доксорубицин.
| Колосоуборка | 1923 |
|
SU2009A1 |
| WYNTER MP et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| Ю.Б.БЕЛОУСОВ и др | |||
| Клиническая фармакология и фармакотерапия М., "Универсум паблишинг", 1997, с.36 глава Биодоступность лекарственных средств, с.37 1-я колонка 2-й абзац | |||
| JP 2005213229 A, 11.08.2005. | |||
Авторы
Даты
2017-12-04—Публикация
2012-04-16—Подача