Настоящее изобретение относится к применению хондроитина в качестве трансдермального носителя и системы с замедленным высвобождением активных ингредиентов в фармацевтических и космецевтических композициях.
Определения
Зачастую термин «хондроитин» необоснованно используют для обозначения хондроитинсульфата; поэтому для ясности эти два термина «хондроитин» и «хондроитинсульфат» далее будут использоваться отдельно. Термин «хондроитин» означает несульфатированный полисахарид и его соли, тогда как термин «хондроитинсульфат» означает разнообразно сульфатированный полисахарид и его соли.
Предшествующий уровень техники
Хондроитин, метаболический предшественник хондроитинсульфата, представляет собой природный линейный полисахарид, образованный чередующимися остатками N-ацетил-D-галактозамина β-1:4 и D-глюкуроната β-1:3. У позвоночных хондроитин сульфатирован региоселективно по гидроксилам в положении 4 или 6 N-ацетил-О-галактозамина и, в некоторых случаях, по гидроксилам в положении 2 или 3 глюкуроновой кислоты (Sugahara et al., J. Biol. Chem., 1996, 271: 26745-54). Молекулярная масса (MW) хондроитина и степень и сайты сульфатирования зависят от вида, возраста и типа ткани (Kuettner et al., Eds., in Articular cartilage and osteoarthritis, NY, Raven Press, 1992; Volpi Ed., in Chondroitin sulfate: structure, role and pharmacological activity, S. Diego, California Academic Press - Elsevier Inc, 2006).
Поскольку хондроитин представляет собой промежуточное соединение метаболизма у позвоночных (Sugumaran and Silbert, J. Biol. Chem. 1990, Oct 25, 265(30): 18284-8), его невозможно выделить в значительных количествах из животных источников. Способы получения хондроитина из микроорганизмов или посредством ферментативного синтеза были разработаны только в последнее время.
Получение хондроитина с использованием сконструированного штамма Е. coli К4, описанного в WO 2010136435, представляет особый интерес; указанный штамм продуцирует полисахарид K4, производное хондроитина, которое содержит остатки β-фруктофуранозы в положении C3 глюкуроновой кислоты. Эти остатки можно легко удалить с использованием регулируемого кислотного гидролиза вследствие низкой стабильности гликозидной связи, посредством которой фруктоза связана с цепью хондроитина. С использованием этого микроорганизма и комплексной стратегии, основанной на оптимизации трехстадийного способа ферментации (периодический режим → периодическая подпитка → в режиме микрофильтрации), получают выходы хондроитина больше 8 г/л. Высокие выходы продукта, простота способа дальнейшей очистки, низкая себестоимость способа в целом и слабое воздействие на окружающую среду делают способ, описанный в WO 2010136435, превосходящим все описанные ранее стратегии ферментации (Rodriguez et al., Eur. J. Biochem., 1988, 177: 117-124; Manzoni et al., Biotechnology Letters, 1996, 18: 383-386; WO 01/02597 A1; US 6288044; US 6777398; US 2005266460; WO 0180810; EP 1282684; EP 1832662; US 20030104601; US 20050164984; US 20070015249; US 20030109693; EP 1950308; WO 2007145197; WO 2007069693; WO 2007058252; WO 2007058252; WO 2007023867; US 7273729; JP 2004024208; US 20060052335; US 20060057697; US 7232676 и US 20070059805).
He так давно в US 2011244520 A1 был описан ряд сконструированных микроорганизмов, которые продуцируют хондроитин в концентрациях, сравнимых с таковыми из WO 2010136435.
Что касается ферментативного синтеза хондроитина, то в US 2005266460, WO 0180810, EР 1282684, EР 1832662, US 20030104601 и US 20050164984 описано применение хондроитинсинтетазы из Pasteurella multocida, фермента, который катализирует синтез хондроитина из соответствующих уридин-дифосфо-сахаров (UDP sugars). В US 20070015249 и US 20030109693 описано получение хондроитинсинтетазы из Е. coli K4 и ее применение для получения хондроитина in vitro.
В ЕР 1950308, WO 2007145197, WO 2007069693, WO 2007058252, WO 2007058252 и WO 2007023867 описаны способы синтеза хондроитина и производных in vitro, где используют хондроитинсинтетазу из Е. coli К4 и его мутантов, которые имеют только одну из двух трансферазных активностей.
В US 7273729, JP 2004024208, US 20060052335, US 20060057697 и US 7232676 описано применение хондроитинсинтетазы человека, фермента, который катализирует синтез хондроитина из соответствующих UDP-сахаров. В этих документах описаны: структура хондроитинсинтетазы человека; экспрессирующий вектор, который содержит соответствующую ферменту последовательность; экспрессия указанного вектора в эукариотических клетках и способ синтеза полисахаридной цепи хондроитина.
В US 20070059805 раскрыты: структура хондроитинсинтетазы человека; экспрессирующий вектор, содержащий соответствующую ферменту последовательность; экспрессия указанного вектора в эукариотических клетках и способ синтеза полисахаридной цепи хондроитина.
Во всех процитированных выше документах хондроитин рассматривается как промежуточное соединение для синтеза хондроитинсульфата. В некоторых из них упоминается о возможности использования хондроитина в композициях, состав которых приведен только в общих чертах, как в случае US 20110244520 (пункт 63 формулы изобретения) и WO 0180810 (пункт 73 формулы изобретения); в этом последнем документе на страницах 4-5 хондроитин определяют как полимер, который является "грубо говоря, более инертным, чем аналогичная молекула гиалуроновой кислоты (НА)".
Гиалуроновая кислота является единственным гликозаминогликаном, который был предложен для применения в качестве носителя активных ингредиентов. Имеется очень много научной и патентной литературы по этому вопросу, где документально подтверждена, хотя и не всегда последовательно, способность гиалуроновой кислоты проникать через кожу и стенки слизистых оболочек, при этом учитываются некоторые критические факторы, относящиеся к молекулярной массе.
Чрескожный транспорт диклофенака с помощью гиалуроновой кислоты был тщательно изучен in vivo и в клинических испытаниях (Brown et al., 2002, in Hyaluronan: Biomedical, Medical and Clinical Aspects, eds. J. Kennedy, G.O. Phillips, P. A. Williams and V. Hascall, 249-256. Cambridge: Woodhead Publishers; Brown et al., 1995, in Hyaluronan in Drug Delivery, ed. D.A. Willoughby, 48-52. London: Royal Society of Medicine Press; Brown et al., 1995, in Hyaluronan in Drug Delivery, ed. D.A. Willoughby, 53-71, London: Royal Society of Medicine Press; Brown et al., 1995, Int. J. Tissue Reactions - Exp. Clin. Aspects, 17: 133-140; Brown and Moore, 1996, in Hyaluronan in Drug Delivery, ed. D. A. Willoughby, 121-131. London: Royal Society of Medicine Press; McEwan and Smith, 1997, Aust. J. Derm. 38: 187-189; Naziretal., 20011 Pharm. Sci. 3 (suppl.): 1429).
В целом эти исследования продемонстрировали, что в условиях in vitro гиалуроновая кислота значительно улучшает всасывание диклофенака в кожу человека, хотя он и остается локализованным в эпидермисе (McEwan and Smith, 1997, Aust. J. Derm., 38: 187-189; Wolf et al., 2001, Int. J. Dermatol., 40: 709-713; Brown et al., 1995, in Hyaluronan in Drug Delivery, ed. D.A. Willoughby, 53-71, London: Royal Society of Medicine Press; Brown et al., 1995, in Hyaluronan in Drug Delivery, ed. D.A. Willoughby, 48-52. London: Royal Society of Medicine Press; Lin and Maibach, 1996, in Hyaluronan in Drug Delivery, ed. D. Willoughby, 167-174. London: R.S. M. Press.; Brown, et al., 1999, J. Invest. Dermatol., 113: 740-746).
Сообщается об аналогичном поведении гиалуроновой кислоты с локализацией лекарственного средства в эпидермисе в отношении других активных ингредиентов, таких как ибупрофен (Brown et al. in Hyaluronan: Biomedical, Medical and Clinical Aspects, eds. J. Kennedy, G.O. Phillips, P.A. Williams and V. Hascall, 249-256. Cambridge: Woodhead Publishers; Brown and Martin, 2001, Int. J. Pharm., 225: 113-121), клиндамицина фосфат (Amr, 2000, Proc. Millen. Cong. Pharma. Sci., A80) и циклоспорин (Brown and Moore, 1996, in Hyaluronan in Drug Delivery, ed. D.A. Willoughby, 121-131. London: Royal Society of Medicine Press; Nazir et al., 2001, Pharm. Sci. 3 (suppl.): 1429).
Исходя из этих научных обоснований в US 5639738 и US5792753 заявлена комбинация гиалуроновой кислоты с молекулярной массой от 150 до 750 кДа и нестероидных противовоспалительных лекарственных средств (NSAID) для лечения актинического кератоза, а в US 5852002 заявлена комбинация гиалуроновой кислоты с молекулярной массой от 150 до 750 кДа с антибиотиками, антибактериальными средствами, антимикробными средствами и их комбинациями для лечения инфекций.
Сравнительные исследования, основанные на применении диффузионной ячейки Франца, в которой используется кожа человека, демонстрируют, что только гиалуроновая кислота способна переносить диклофенак и ибупрофен в кожу, в то время как другие гликозаминогликаны типа хондроитинсульфата и гепарина этого действия не осуществляют (Brown et al., 2001, International J. of Pharmaceutics, 225, 113-121).
Гель на основе гиалуроновой кислоты и диклофенака Solaraze® получил разрешение регулирующих органов к применению в США, Канаде и Европе для лечения актинического кератоза.
Описание изобретения
Неожиданно было обнаружено, что в отличие от данных, опубликованных для хондроитинсульфата, хондроитин с молекулярной массой от 5 до 100 кДа, будучи нанесенным на кожу в подходящих композициях, проходит через роговой слой, проникает в эпидермис и попадает в организм с кровотоком.
Таким образом, данное изобретение относится к применению хондроитина в качестве трансдермального носителя и системы с замедленным высвобождением активных ингредиентов из фармацевтических и космецевтических композиций.
Другая цель изобретения относится к нековалентным комплексам несульфатированного хондроитина с активными ингредиентами, которые всасываются через кожу и слизистые оболочки. Указанные комплексы действуют как системы с замедленным высвобождением активного ингредиента.
Примерами активных ингредиентов, пригодных для использования согласно изобретению, являются стероидные и нестероидные противовоспалительные лекарственные средства, противоопухолевые средства, противовирусные средства, антимикробные средства, диуретики, контрацептивы, анальгетики, бронходилататоры, моноклональные антитела, иммуносупрессоры, вазоконстрикторы или вазодилататоры, антиоксиданты, успокаивающие средства, увлажняющие агенты, дренажные агенты, биостимуляторы, акцепторы радикалов, агенты для лечения морщин, соединения для роста волос и биологически активные пептиды, используемые по отдельности или в комбинации друг с другом.
В общем случае нековалентные комплексы хондроитина с активными ингредиентами получают путем добавления активного ингредиента к водным или водноорганическим растворам хондроитина. Чтобы получить данный комплекс в твердой форме, растворитель удаляют выпариванием под вакуумом или с использованием сублимационной сушки. Молярные соотношения между активным ингредиентом и мономерной единицей хондроитина могут варьировать в очень широких пределах: например от 0,05 до 1 моль активного ингредиента на одну мономерную единицу в зависимости от рекомендуемых доз рассматриваемых активных ингредиентов.
Соответственно, на основе полученных таким образом комплексов изготавливают подходящие композиции с использованием традиционных методов и эксципиентов, в частности для местного, назального, ректального или вагинального введения. Указанные композиции, которые представляют собой другой объект изобретения, также возможно могут содержать другие ингредиенты. Композиции по изобретению могут иметь форму растворов, эмульсий, гелей, кремов, спреев, суппозиториев, глазных капель, масок, накладок, повязок или липких пластырей.
Композиции по изобретению также могут быть изготовлены непосредственно из раствора такого комплекса путем добавления эмульгаторов, стабилизаторов, поверхностно-активных веществ, консервантов и отдушек в зависимости от типа изготовляемого продукта (кремов, гелей, эмульсий типа вода в масле (W/O) или масло в воде (O/W), молочка, масок и т.д.).
Чрескожное всасывание хондроитина оценивали, используя меченный тритием хондроитин, полученный посредством биосинтеза, и бестимусных мышей Charles River. Данное исследование демонстрирует, что хондроитин при местном введении, независимо от его молекулярной массы, эффективно всасывается через кожу и затем распределяется кровотоком по всему организму. Через 1 ч после нанесения примерно 50% нанесенной дозы локализуется в коже и только незначительная часть распределяется в организме. После более длительных периодов времени кожное всасывание усиливается далее, равно как и процесс системного распределения через кровоток. Через 20 ч примерно 25% введенного радиоактивного вещества экскретировалось с мочой.
Кроме того, было обнаружено, что хондроитин действует как система с замедленным высвобождением активных ингредиентов. Действительно, его структурные особенности делают возможным взаимодействие с молекулами низкой молекулярной массы посредством сил притяжения разного рода, которые могут действовать по отдельности или синергически, таких как дополняющие ионные взаимодействия, гидрофобные и гидрофильные взаимодействия и водородные мостики. Указанные взаимодействия в водных растворах нарушаются, однако образуются снова и снова благодаря наличию, на приемлемом расстоянии, новых возможностей для взаимодействия с другими сайтами на одной и той же полимерной цепи. Такое поведение по сути снижает подвижность связанного соединения, которое в течение долгого времени остается захваченным в «тиски» сил притяжения, создаваемых полимерной цепью. Очевидно, что нековалентный комплекс со временем постепенно распадается в открытой системе, при этом кинетика распада зависит от степени разведения и присутствия других химических веществ.
Исследование методом равновесного диализа, при котором раствор данного комплекса заключен в диализную трубку с отсечением по молекулярной массе 2 кДа, с 20-кратным объемом воды с внешней стороны, демонстрирует, что в этой экспериментальной системе комплексы диклофенак-хондроитин различной стехиометрии действуют как системы регулируемого высвобождения активного ингредиента, достигая равновесия при диализе за время, превышающее 10 ч, и этот процесс замедляется по мере уменьшения соотношения диклофенак-хондроитин в комплексе. В системе, где присутствует только диклофенак, равновесие при диализе достигается уже через 2 ч.
Вследствие этого, способность хондроитина одновременно проходить через роговой слой кожи и поверхность слизистых оболочек, объединенная со способностью к образованию нековалентных комплексов, делает этот полисахарид превосходным носителем для различных видов активных ингредиентов в организмах людей.
Исследования in vitro, выполненные на коже человека в диффузионной ячейке Франца, демонстрируют влияние носителя и механизм высвобождения хондроитина, когда он образует нековалентные комплексы с разными активными ингредиентами, такими как диклофенак и кеторолак. Те же данные получают в исследованиях на бестимусных мышах, включающих местное нанесение указанных комплексов.
Следующие далее примеры описывают изобретение более подробно.
ПРИМЕР 1. Получение [3H]хондроитина разной молекулярной массы
[3H]Хондроитин получали биосинтезом, используя, как описано в WO 2010136435, сконструированный штамм Е. coli K4, продуцирующий полисахарид K4, производное хондроитина, которое по положению C3 глюкуроновой кислоты имеет остатки β-фруктофуранозы, которые отщепляются количественно мягким гидролизом в присутствии уксусной кислоты. Чтобы ввести радиоактивную метку в хондроитин, в культуральную среду добавляют [3H]галактозу. [3H]Хондроитин, очищенный, как описано в WO 2010136435, имеет молекулярную массу 62 кДа. Для применения в последующем исследовании его разбавляли немеченым хондроитином той же молекулярной массы, получая продукт с удельной радиоактивностью 1,5×107 (распадов/мин)/мг. Чтобы получить хондроитин с молекулярной массой 35 и 10 кДа, [3H]хондроитин с MW 62 кДа и удельной радиоактивностью 1,5×107 (распадов/мин)/мг подвергали регулируемому кислотному гидролизу в гетерогенной фазе. Согласно стандартной методике 100 мг [3H]хондроитина суспендировали в 1 мл этанола (93%-ного, об./об.), содержащего 33 мкл HCl, и инкубировали при перемешивании в устройстве Vortemp при 55°C и 900 об./мин. Гидролиз проводили в течение 40 мин для получения MW 35 кДа и 90 мин для получения MW 10 кДа. При достижении желаемой MW реакцию останавливали на льду, проводя нейтрализацию с использованием 21 мкл 50%-ного (мас./об.) NaOH, затем оставляли перемешиваться в течение 30 мин и центрифугировали при 5000 об./мин в течение 15 мин. Супернатант удаляли и выпавший в осадок остаток промывали 1 мл этанола (93%-ного, об./об.). Процедуру промывки повторяли второй раз, используя безводный этанол. Осадок после центрифугирования сушили в течение 16 ч в сушильной печи при 40°C под вакуумом. Анализ молекулярной массы хондроитина выполняли, используя систему для эксклюзионной хроматографии, оборудованную многоэлементным детектором, состоящим из четырех параллельно соединенных устройств - вискозиметра, рефрактометра, детектора рассеяния света под прямым углом (RALS) и детектора малоуглового рассеяния света (LALS), запатентованную американской корпорацией Viscotek (www.viscotek.com). Сигнал, измеренный с помощью LALS, пропорционален молекулярной массе и концентрации, а сигнал, измеренный с помощью вискозиметрического детектора, пропорционален концентрации образца и характеристической вязкости, в то время как с помощью рефрактометра измеряют концентрацию. С использованием прибора Viscotek не только определяют молекулярную массу, но также можно оценивать степень гетерогенности молекулярной массы в популяции присутствующих молекул, описываемой коэффициентом полидисперсности Mw/Mn, автоматически рассчитываемым с использованием прибора Viscotek и определяемым в виде соотношения между средней молекулярной массой (Mw=∑imiMi/∑imi, где mi представляет собой массу полимера с молекулярной массой Mi, a ∑imi представляет собой общую массу полимера, при этом указанное выражение, исходя из того, что mi=niMi, также может быть представлено в виде 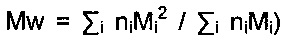 и средневзвешенной молекулярной массой (Mn=∑iniMi/∑1ni, где niMi представляет собой массу полимера с молекулярной массой Mi, a ∑ini представляет собой общее число молей присутствующего полимера). Значение полидисперсности в образцах [3H]хондроитина с разными молекулярными массами (62, 35 и 10) не превышало 1,2.
и средневзвешенной молекулярной массой (Mn=∑iniMi/∑1ni, где niMi представляет собой массу полимера с молекулярной массой Mi, a ∑ini представляет собой общее число молей присутствующего полимера). Значение полидисперсности в образцах [3H]хондроитина с разными молекулярными массами (62, 35 и 10) не превышало 1,2.
Для тестирования специфичности сайта мечения образец [3H]хондроитина подвергали гидролизу в присутствии сильной кислоты в водном растворе при 100°C, чтобы привести к разрыву всех гликозидных связей. Образец подвергнутой гидролизу смеси анализировали посредством HPLC. Для количественного определения GIcA, GalNAc и GalNH использовали аналитическую колонку Carbopac РА1, 4×250 мм, оснащенную предколонкой Carbopac РА1, 4×50 мм (Dionex Sri, San Donato Milanese, Italy), работая при скорости потока 1 мл/мин. Стандарты и образцы анализировали методом градиентного разделения, используя следующие элюенты: элюент А - 150 мМ NaOH, элюент В - 150 мМ NaOH+1 М Na-ацетат. Использовали следующий градиент (время в мин, % элюента А, % элюента В): Т0, А90, В10; Т20, А80, В20; Т30, А50, В50; Т35, А90, В10; Т40, А100, В0. Детектирование осуществляли, используя импульсный амперометрический детектор (электрод сравнения AgCl) с отслеживанием формы сигнала, обусловленной углеводами (Waveform Carbohydrates). Подвергнутая гидролизу смесь разделялась на три пика, соответствующие временам удерживания глюкуроновой кислоты, галактозамина и следовых количеств N-ацетил-D-галактозамина. Элюаты в пиках собирали и снимали показания на предмет радиоактивности, используя сцинтилляционную жидкость. 75% радиоактивности были ассоциированы с пиками галактозамина и N-ацетил-D-галактозамина.
Для выполнения следующего исследования на животной модели готовили три геля на основе [3H]хондроитина, каждый из которых содержал 100 мг полиэтиленгликоля, 1 мг бензилового спирта, 879 мг воды и 20 мг [3H]хондроитина (3×108 распадов/мин) на один грамм, с MW 62, 35 и 10 кДа, соответственно.
ПРИМЕР 2. Местное всасывание хондроитина разной молекулярной массы
В качестве экспериментальной модели для оценки чрескожного всасывания хондроитина использовали 60 бестимусных мышей Charles River обоих полов в возрасте 5 месяцев. Животных рандомизировали на 12 групп по 5 животных в каждой, как изложено в плане исследования в Таблице 1, обрабатывали 50 мг геля на основе [3H]хондроитина с разными MW, полученного так, как описано в примере 1. В ходе исследования животных содержали в индивидуальных клетках с неограниченным доступом к корму и воде.
Животных подвергали эвтаназии через 1, 5, 10 и 20 ч после нанесения, как изложено в плане исследования в Таблице 1. Сразу же после эвтаназии площадь под нанесенным гелем тщательно промывали до тех пор, пока в промывной воде не оставалось никаких детектируемых следовых количеств радиоактивности, чтобы отличить внесенную радиоактивность от радиоактивности, абсорбированной кожей. Из подвергнутых эвтаназии животных извлекали обработанные участки кожи, печень и кровь и образцы взвешивали и замораживали сразу же после извлечения. Мочу животных извлекали из клеток посредством промывания.
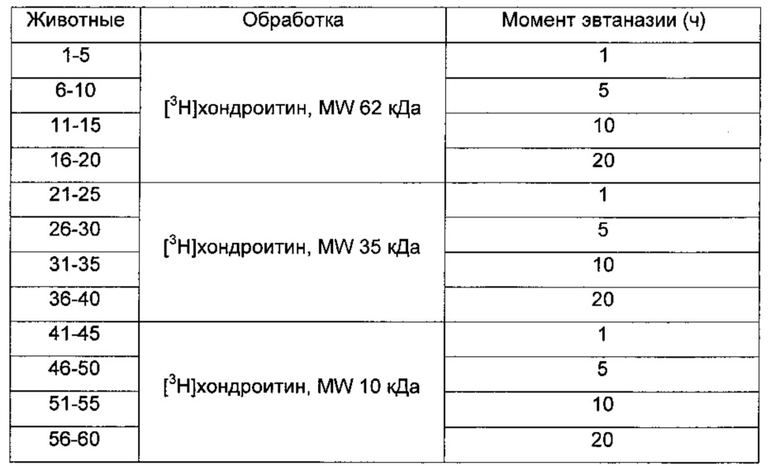
Таблица 1. План исследования: 60 бестимусных мышей Charles River обоих полов в возрасте 5 месяцев рандомизировали на 12 групп по 5 животных. На спине каждого животного помечали участок примерно 5-6 см2 в положении, недоступном для лизания или расчесывания самими животными. По 50 мг геля [3H]хондроитина с MW 62 кДа наносили шпателем животным с номерами 1-20, MW 35 кДа животным с номерами 21-40 и MW 10 кДа животным с номерами 41-60.
Образцы кожи, печени и крови (150-200 мг) солюбилизировали в Soluene® в течение 24 ч при температуре окружающей среды. Радиоактивность измеряли в солюбилизированных образцах и моче методом сцинтилляций в жидкой фазе. Экспериментальные данные приведены в Таблицах 2-4.

Таблица 2. Распределение радиоактивности у бестимусных мышей, обработанных местно гелем [3H]хондроитина (3×108 распадов/мин) с MW 62 кДа. Каждое число представляет собой среднее значение для 5 животных.

Таблица 3. Распределение радиоактивности у бестимусных мышей, обработанных местно гелем [3H]хондроитина (3×108 распадов/мин) с MW 35 кДа. Каждое число представляет собой среднее значение для 5 животных.
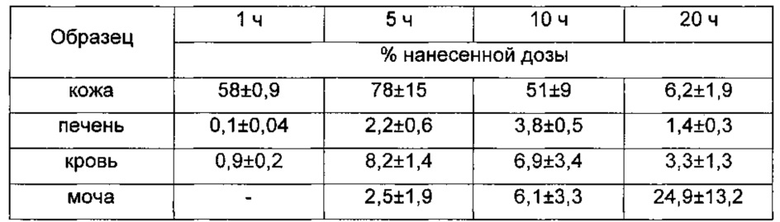
Таблица 4. Распределение радиоактивности у бестимусных мышей, обработанных местно гелем [3Н]хондроитина (3×108 распадов/мин) с MW 10 кДа. Каждое число представляет собой среднее значение для 5 животных.
Данные демонстрируют, что хондроитин при местном введении, независимо от его молекулярной массы, эффективно всасывается через кожу и затем распределяется кровотоком по всему организму. Через 1 ч после нанесения примерно 50% нанесенной дозы локализуется в коже и только незначительная часть распределяется в организме. После более длительных периодов времени кожное всасывание усиливается далее, равно как и процесс системного распределения через кровоток. Через 20 ч примерно 25% введенного радиоактивного вещества экскретировалось с мочой.
ПРИМЕР 3. Получение нековалентных комплексов диклофенак-хондроитин различных стехиометрических составов
Получение комплекса хондроитина с 2-(2-[2,6-дихлорфениламино]-фенил)этановой кислотой, также называемой диклофенаком.
Комплексы диклофенак-хондроитин получали с молярными соотношениями 0,630, 0,315 и 0,063 между диклофенаком и мономерной единицей хондроитина.
Получение комплекса диклофенак-хондроитин с молярным соотношением 0,630 - 5 г диклофенака натрия растворяли при 50°C при энергичном перемешивании в 100 мл 10%-ного (мас./об.) водного раствора хондроитина натрия с MW 62 кДа.
Получение комплекса диклофенак-хондроитин с молярным соотношением 0,315 - 2,5 г диклофенака натрия растворяли при 50°C при энергичном перемешивании в 100 мл 10%-ного (мас./об.) водного раствора хондроитина натрия с MW 35 кДа.
Получение комплекса диклофенак-хондроитин с молярным соотношением 0,063 - 0,5 г диклофенака натрия растворяли при 50°C при энергичном перемешивании в 100 мл 10%-ного (мас./об.) водного раствора хондроитина натрия с MW 10 кДа.
Твердые формы указанных комплексов получали путем удаления растворителя под вакуумом при 50°C или альтернативно с использованием сублимационной сушки растворов. Такие твердые комплексы быстро солюбилизируются в воде.
ПРИМЕР 4. Исследования in vitro постепенного высвобождения диклофенака из нековалентных комплексов диклофенак-хондроитин различной стехиометрии
Чтобы определить механизм дифференциального высвобождения диклофенака из нековалентных комплексов с хондроитином различной стехиометрии, было проведено исследование методом равновесного диализа, при котором раствор данного комплекса заключают в диализную трубку с отсечением по молекулярной массе 2 кДа и используют 20-кратный объем воды с внешней стороны. Систему поддерживали при непрерывном перемешивании при 25°C и снимали показания для поглощения во времени при 275 нм, когда диклофенак показывает максимальное поглощение. Таким образом, как только диклофенаку удается пересечь диализную мембрану, ввиду значительной разницы в объеме между диализуемым раствором и диализной средой, увеличение поглощения (оптической плотности, OD) при 275 нм можно отнести к количеству диклофенака, высвободившегося из комплекса с хондроитином. В Таблице 5 показаны данные этого исследования.
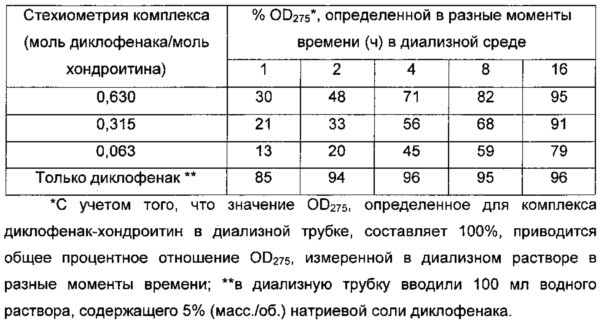
Таблица 5. Исследование методом равновесного диализа, при котором 100 мл водного раствора комплекса помещали в диализную трубку с отсечением по молекулярной массе 2 кДа, при этом объем воды с внешней стороны составлял 2 л. Систему поддерживали при непрерывном перемешивании при 25°C и снимали показания для поглощения во времени при 275 нм, когда диклофенак показывает максимальное поглощение.
Данное исследование демонстрирует, что в такой экспериментальной системе комплексы диклофенак-хондроитин различной стехиометрии проявляют себя как системы с регулируемым высвобождением активного ингредиента, достигая равновесия при диализе за время, превышающее 10 ч, и этот процесс удлиняется по мере уменьшения соотношения диклофенак-хондроитин в комплексе. В системе, где присутствует только диклофенак, равновесие при диализе достигается уже через 2 ч.
ПРИМЕР 5. Исследования чрескожного всасывания in vitro нековалентных комплексов диклофенак-хондроитин
Данное исследование проводили, используя диффузионную ячейку Франца, в которой применяется образец кожи человека, полученный после пластической хирургической операции по поводу уменьшения размера груди у здоровой женщины в возрасте 45 лет. Образец кожи замораживали до -20°C сразу же после удаления и хранили при этой температуре до момента использования. Перед помещением в диффузионные ячейки Франца замороженную кожу очищали от подкожного жира, чтобы использовать только роговой слой, эпидермис и дерму, и нарезали на кусочки размером, подходящим для размещения в диффузионной ячейке Франца, при этом роговой слой был направлен вверх. Перед началом исследования ячейку выдерживали при 30°C в течение 10 ч, непрерывно перемешивая рецепторный раствор, содержащий 10 мл HBSS (сбалансированный солевой раствор Хенкса). Поверхность, на которую наносили композицию, составляла примерно 3 см2. Перед внесением геля в ячейки рецепторный раствор заменяли, принимая меры, чтобы удалить все пузырьки воздуха между кожей и раствором. На поверхность кожи наносили по 10 мг следующих гелей: а) гель диклофенака (на один грамм геля: 100 мг полиэтиленгликоля, 1 мг бензилового спирта, 200 мг диклофенака натрия и достаточное количество воды до 1 г, растворенных при 50°C при энергичном перемешивании); б) гель комплекса диклофенак-хондроитин (0,630 моль диклофенака/моль дисахаридных единиц хондроитина; на один грамм геля: 100 мг полиэтиленгликоля, 1 мг бензилового спирта, 200 мг хондроитина с MW 35 кДа, 100 мг диклофенака натрия и достаточное количество воды до 1 г, растворенных при 50°C при энергичном перемешивании); в) гель комплекса диклофенак-хондроитин (0,630 моль диклофенака/моль дисахаридных единиц хондроитинсульфата; на один грамм геля: 100 мг полиэтиленгликоля, 1 мг бензилового спирта, 279,6 мг хондроитина с MW 35,4 кДа, 100 мг диклофенака натрия и достаточное количество воды до 1 г, растворенных при 50°C при энергичном перемешивании).
В указанные моменты времени рецепторную фазу извлекали и поверхность кожи тщательно промывали для удаления всего неабсорбированного геля. Кожу извлекали, гомогенизировали и проводили расщепление в течение 10 ч в условиях перемешивания при 30°C с коллагеназой (5200 л/г кожи) в 10 мМ фосфатном буфере, pH 7,4. В конце инкубации добавляли 0,4 объема этанола и смесь центрифугировали при 10000 об./мин в течение 20 мин. В этих условиях почти весь диклофенак, присутствующий в ткани, экстрагируется в раствор. Количество диклофенака, присутствующего в растворе после промывки кожи (неабсорбированная часть), в ферментативном переваре ткани (часть, абсорбированная кожей) и в рецепторной жидкости (часть, которая прошла через структуру кожи) определяли количественно посредством HPLC. Данные анализы проводили на HPLC-системе модели 746 от Waters (США), оборудованной колонкой μ-bondapack С18 (150×4,6 миллиметра). Раствор ацетонитрила, деионизованной воды и ортофосфорной кислоты (45:54,5:0,5 по об.) использовали в качестве подвижной фазы с конечным pH 3,5, работая при скорости потока 1 мл/мин. Мониторинг элюата проводили при 276 нм. Количественное определение проводили, измеряя соотношения между площадью пика диклофенака и площадью пика внутреннего стандарта, представляющего собой раствор напроксена с известной концентрацией.
В Таблице 6 показаны результаты исследования.

Таблица 6. Изучение всасывания диклофенака кожей человека с использованием диффузионной ячейки Франца.
Как будет видно из анализа данных, приведенных в Таблице 6, всасывание диклофенака в присутствии хондроитина значительно усиливается по сравнению с всасыванием, наблюдаемым в отсутствие этого полисахарида или в присутствии хондроитинсульфата.
ПРИМЕР 6. Исследования чрескожного всасывания in vivo комплексов хондроитин-диклофенак
В качестве экспериментальной модели для оценки чрескожного всасывания комплекса диклофенак-хондроитин использовали 45 бестимусных мышей Charles River обоих полов в возрасте 5 месяцев. Животных рандомизировали на 9 групп по 5 животных в каждой, как изложено в плане исследования в Таблице 7, обрабатывали тремя гелями по 50 мг: а) гелем диклофенака; б) гелем комплекса диклофенак-хондроитин; и в) гелем комплекса диклофенак-хондроитинсульфат, приготовленными, как изложено в примере 5. В ходе исследования животных содержали в индивидуальных клетках с неограниченным доступом к корму и воде.
Таблица 7. План исследования: 45 бестимусных мышей Charles River обоих полов в возрасте 5 месяцев рандомизировали на 9 групп по 5 животных. На спине каждого животного помечали участок примерно 5-6 см2 в положении, недоступном для лизания или расчесывания самими животными. На указанный участок наносили шпателем по 50 мг геля диклофенака животным с номерами 1-15, по 50 мг геля комплекса диклофенак-хондроитин животным с номерами 16-30 и по 50 мг геля комплекса диклофенак хондроитинсульфат животным с номерами 31-45.
Животных подвергали эвтаназии через 1, 5 и 10 ч после нанесения, как изложено в плане исследования в Таблице 7. Сразу же после эвтаназии площадь под нанесенным гелем тщательно промывали, чтобы отличить внесенную радиоактивность от радиоактивности, абсорбированной кожей. Из подвергнутых эвтаназии животных извлекали обработанные участки кожи, печень и кровь и образцы взвешивали и замораживали сразу же после извлечения. Мочу животных извлекали из клеток посредством промывания. Образцы кожи и печени солюбилизировали с использованием обработки ферментом коллагеназой, и количество присутствующего диклофенака определяли посредством HPLC, как изложено в примере 5. Содержание диклофенака в сыворотке крови и в моче определяли аналогично посредством HPLC.
Экспериментальные данные приведены в Таблицах 8-10.
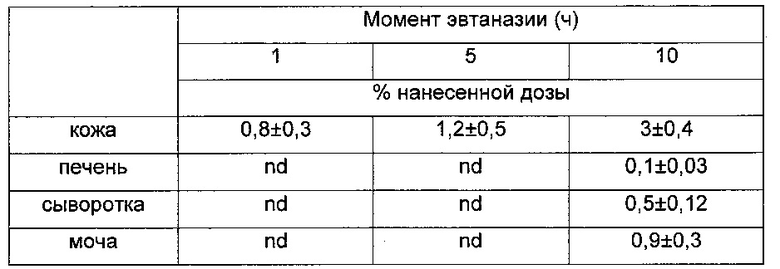
Таблица 8. Распределение радиоактивности у бестимусных мышей, обработанных местно гелем диклофенака. Каждое число представляет собой среднее значение для 5 животных.

Таблица 9. Распределение радиоактивности у бестимусных мышей, обработанных местно гелем комплекса диклофенак-хондроитин. Каждое число представляет собой среднее значение для 5 животных.
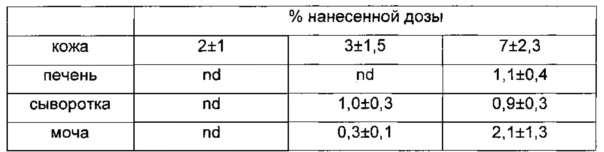
Таблица 10. Распределение радиоактивности у бестимусных мышей, обработанных местно гелем комплекс диклофенак-хондроитинсульфат. Каждое число представляет собой среднее значение для 5 животных.
Данные, приведенные в Таблицах 8-10, демонстрируют, что хондроитин, а не хондроитинсульфат, действует в качестве эффективного трансдермального носителя диклофенака, который, как обнаружено, не только локализован в коже, но также распределяется системно. Чрескожное всасывание диклофенака самого по себе оказывается существенно более слабым, чем то, которое наблюдается в случае нековалентного комплекса с хондроитином.
ПРИМЕР 7. Исследования чрескожного всасывания in vitro нековалентных комплексов кеторолак-хондроитин
(±)-5-Бензоил-2,3-дигидро-1Н-пирролизин-1-карбоновая кислота или трометаминная соль кеторолака, более известная под торговым названием торадол, представляет собой NSAID, широко используемое в качестве противовоспалительного средства, несмотря на серьезные побочные эффекты, связанные с его долгосрочным применением. Изучение местного всасывания этого активного ингредиента в виде нековалентного комплекса с хондроитином проводили в соответствии с методикой, описанной в примере 5, используя диффузионную ячейку Франца, в которой применяется образец кожи человека, полученный после пластической хирургической операции по поводу уменьшения размера груди у здоровой женщины в возрасте 33 лет. На поверхность кожи наносили по 10 мг следующих гелей: а) гель трометаминной соли кеторолака (на один грамм геля: 100 мг полиэтиленгликоля, 1 мг бензилового спирта, 200 мг трометаминной соли кеторолака и достаточное количество воды до 1 г; растворенных при 50°C при энергичном перемешивании); б) гель комплекса трометаминная соль кеторолака-хондроитин (0,535 моль трометаминной соли кеторолака/один моль дисахаридных единиц хондроитина; на один грамм геля: 100 мг полиэтиленгликоля, 1 мг бензилового спирта, 200 мг хондроитина с MW 62 кДа, 100 мг трометаминной соли кеторолака и достаточное количество воды до 1 г; растворенных при 50°C при энергичном перемешивании).
Методики обработки образцов были аналогичны приведенным в примере 5. Количество кеторолака, присутствующего в растворе после промывки кожи (неабсорбированная часть), в ферментативном переваре ткани (часть, абсорбированная кожей) и в рецепторной жидкости (часть, которая прошла через структуру кожи) определяли количественно посредством HPLC. Тесты проводили на HPLC-системе модели 746 от Waters (США), оборудованной колонкой μ-bondapack С18 (150×4,6 миллиметра). Раствор ацетонитрила, деионизованной воды и ортофосфорной кислоты (45:54,5:0,5 по об.) использовали в качестве подвижной фазы с конечным pH 3,5, работая при скорости потока 1 мл/мин. Мониторинг элюата проводили при 280 нм. Количественное определение проводили, измеряя соотношения между площадью пика кеторолака и площадью пика внутреннего стандарта, представляющего собой раствор напроксена с известной концентрацией.
В Таблице 11 показаны результаты исследования.
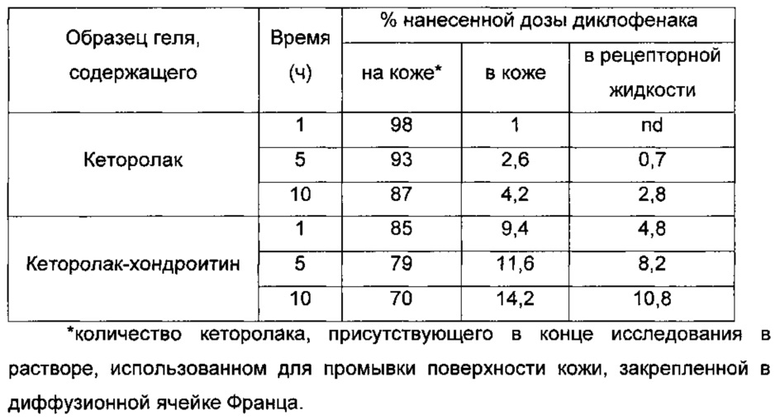
Таблица 11. Изучение всасывания кеторолака кожей человека с использованием диффузионной ячейки Франца.
Как будет видно из анализа данных, приведенных в Таблице 11, всасывание кеторолака в присутствии хондроитина значительно усиливается по сравнению с всасыванием, наблюдаемым в отсутствие этого полисахарида.
| название | год | авторы | номер документа |
|---|---|---|---|
| ХОНДРОИТИН ДЛЯ ПРИМЕНЕНИЯ В МЕДИЦИНЕ | 2013 |
|
RU2642964C2 |
| РАНЕВОЕ ПОКРЫТИЕ НА ОСНОВЕ КОЛЛАГЕН-ХИТОЗАНОВОГО КОМПЛЕКСА | 2003 |
|
RU2254145C1 |
| СПОСОБ СШИВАНИЯ ПОЛИСАХАРИДОВ ПРИ ПОМОЩИ ФОТОУДАЛЯЕМЫХ ЗАЩИТНЫХ ГРУПП | 2016 |
|
RU2713295C2 |
| АБСОРБИРУЮЩИЕ ПОВЯЗКИ С БОЛЕУТОЛЯЮЩЕЙ АКТИВНОСТЬЮ | 2012 |
|
RU2581914C2 |
| СПОСОБ ПРОФИЛАКТИКИ ЯЗВООБРАЗОВАНИЯ НА СЛИЗИСТОЙ ОБОЛОЧКЕ ЖЕЛУДКА | 2021 |
|
RU2759575C1 |
| СРЕДСТВА ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ СУСТАВОВ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2521973C1 |
| КОМПОЗИЦИЯ ДЛЯ ИНСТИЛЛЯЦИИ МОЧЕВОГО ПУЗЫРЯ С УВЕЛИЧЕННОЙ СТАБИЛЬНОСТЬЮ ПРИ ХРАНЕНИИ, СОДЕРЖАЩАЯ СУЛЬФАТ ХОНДРОИТИНА (4,5 мг/мл), ГИАЛУРОНОВУЮ КИСЛОТУ (16 мг/мл) И ФОСФАТНЫЙ БУФЕР (pH 6,1-7,9), ДЛЯ ЛЕЧЕНИЯ ЦИСТИТА | 2018 |
|
RU2742277C1 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ПОЛИСАХАРИДНУЮ МАТРИЦУ ДЛЯ КОНТРОЛИРУЕМОГО ВЫСВОБОЖДЕНИЯ АКТИВНЫХ ИНГРЕДИЕНТОВ | 2017 |
|
RU2748261C2 |
| ПРОИЗВОДНЫЕ СУЛЬФАТИРОВАННЫХ ПОЛИСАХАРИДОВ, ИХ СПОСОБ ПОЛУЧЕНИЯ, МОДИФИКАЦИЯ И ПРИМЕНЕНИЕ | 2016 |
|
RU2708327C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНЕЙ СУСТАВОВ | 2004 |
|
RU2260432C1 |
Изобретение относится к фармацевтической промышленности и представляет собой композицию для трансдермальной доставки, содержащую нековалентные комплексы между несульфатированным хондроитином, имеющим молекулярную массу от 5 до 100 кДа, определенную эксклюзионной хроматографией, и активными ингредиентами, выбранными из диклофенака или его солей и кеторолака или его солей. Изобретение обеспечивает прохождение через роговой слой кожи, проникновение в эпидермис, через слизистую оболочку, а также замедленное высвобождение активных компонентов. 2 н. и 2 з.п. ф-лы, 11 табл., 7 пр.
1. Композиции для трансдермальной доставки, содержащие нековалентные комплексы между несульфатированным хондроитином, имеющим молекулярную массу от 5 до 100 кДа, определенную эксклюзионной хроматографией, и активными ингредиентами, выбранными из диклофенака или его солей и кеторолака или его солей.
2. Композиции по п. 1 для местного, назального, ректального и вагинального введения.
3. Композиции по п. 1 или 2 в форме растворов, эмульсий, геля, кремов, спреев, суппозиториев, глазных капель, масок, накладок, повязок и пластырей.
4. Нековалентные комплексы несульфатированного хондроитина, имеющего молекулярную массу от 5 до 100 кДа, определенную эксклюзионной хроматографией, и диклофенака или его солей и кеторолака или его солей для трансдермальной доставки и в качестве систем с замедленным высвобождением.
| US 2003104601 A1, 05.06.2003 | |||
| US 20110244520 A1, 06.10.2011 | |||
| КОМПЛЕКС, СОДЕРЖАЩИЙ ИНГИБИРУЮЩИЙ ОСТЕОКЛАСТОГЕНЕЗ ФАКТОР (OCIF) И ПОЛИСАХАРИД | 2002 |
|
RU2232594C2 |
| Харкевич Д.А | |||
| Фармакология: учебник | |||
| М.: ГЭОТАР-Медиа, 2006 | |||
| ЦУГАЛЬТНЫЙ ВИСЯЧИЙ ЗАМОК | 1923 |
|
SU736A1 |
| - С | |||
| Приспособление для соединения пучка кисти с трубкою или втулкою, служащей для прикрепления ручки | 1915 |
|
SU66A1 |
| Венгеровский А.И | |||
| "Фармакологическая несовместимость", Бюллетень сибирской медицины, 3, 2003, найдено в Интернет на сайте: http://old.ssmu.ru/bull/03/3/1684.pdf. | |||
Авторы
Даты
2018-01-25—Публикация
2013-07-25—Подача