Перекрестная ссылка на родственные заявки
[1] Данная заявка испрашивает приоритет на дату подачи предварительной заявки США №61/661105, поданной 18 июня 2012 года, и предварительной заявки США №61/725693, поданной 13 ноября 2012 года. В целях любой заявки США, в которой может испрашиваться приоритет предварительной заявки США №61/661105 и предварительной заявки США №61/725693, содержание ранее поданных заявок включены в данное описание посредством ссылки во всей своей полноте.
Область техники, к которой относится изобретение
[2] Изобретение относится к пробиотическим микроорганизмам и композициям, содержащим метаболиты, продуцируемые пробиотическими микроорганизмами. Эти композиции пригодны для лечения связанных с глютеном расстройств, например, целиакии.
Предпосылки создания изобретения
[3] Глютеновые и родственные глютену полипептиды обнаружены во многих зерновых культурах, включая пшеницу, рожь и ячмень. Для людей со связанными с глютеном расстройствами, такими как целиакия и чувствительность к глютену, употребление содержащих глютен продуктов может иметь серьезные и длительные последствия для здоровья. Целиакия является аутоиммунным заболеванием тонкого кишечника, которое вызывается потреблением глютена у генетически предрасположенных людей. Некоторые фрагменты глютена («глиадины») стимулируют иммунный ответ, который постоянно поражает тонкий кишечник и препятствует поглощению питательных веществ. Целиакия может проявляться широким спектром симптомов. Наиболее распространенные из них - хронический понос, вздутие живота, потеря веса и задержка в развитии (у детей). Целиакия может быть также связана с железодефицитной анемией, остеопорозом, небольшим ростом, артритом, бесплодием, периферической нейропатией и печеночной недостаточностью. Пациенты с целиакией также подвергаются повышенному риску в отношении определенных видов рака, таких как небольшие карциномы кишечника и неходжкинская лимфома. Частота заболевания целиакией среди популяций людей европейского происхождения, по оценкам, составляет от 0,5 до 1,5%. Заболеваемость растет как в США, так и в Европе, а также в Азии, в частности в связи с внедрением прозападных режимов питания. Целиакия обычно диагностируется в младенчестве или в детстве, хотя число диагнозов, сделанных в зрелом возрасте, также растет. В настоящее время способов лечения целиакии нет, стандартными способами лечения является соблюдение безглютеновой диеты на протяжении всей жизни.
[4] Чувствительность к глютену не так хорошо изучена, как целиакия. Она проявляется во многом такими же симптомами, но не включает повреждение тонкой кишки. Диагноз, как правило, ставится по критериям исключения и улучшения симптомов после назначения пациенту безглютеновой диеты.
[5] Соблюдение безглютеновой диеты требует строгого исключения продуктов из пшеницы, ржи и ячменя. Это может оказаться сложной задачей, определяемой отсутствием достаточной информации о содержании глютена в пищевых продуктах на этикетках; вероятностью загрязнения во время обработки и приготовления пищи, особенно это касается пищи, приготовленной вне дома; материальными затратами на безглютеновые продукты, а также силой воли, которая требуется для строгого соблюдения диеты. На соблюдение диеты также могут влиять доступ к просвещению и консультациям, поддержка семьи и социальная поддержка, а также психологические факторы. Кроме того, строгое соблюдение безглютеновой диеты может привести к дефициту питательных микроэлементов. Такой дефицит, особенно витаминов В (витамин В6, витамин В12 и фолиевая кислота) и некоторых микроэлементов, например, железа, цинка и меди, может привести к потенциально существенным проблемам со здоровьем, особенно у детей. Существует постоянная потребность в терапевтических агентах для лечения связанных с глютеном расстройств.
Сущность изобретения
[6] Настоящее изобретение относится к композициям, содержащим один или несколько метаболитов, продуцируемых Lactobacillusparacasei СВА L74, инвентарный номер LMG Р-24778 в Международном депозитарии. Метаболиты могут снижать токсичность пептидов глиадина у субъекта, имеющего связанное с глютеном расстройство. Метаболиты, которые в основном устойчивы к температуре выше стандартных физиологических значений температуры, уменьшают клеточное проникновение пептидов глиадина. Пептид глиадина может изменяться и может включать пептиды, которые охватывают один или несколько эпитопов, распознаваемых Т-клетками, например, Р57-68, и пептиды, которые распознаются природной иммунной системой, например, Р31-43. Иллюстративные пептиды включают пептиды α-глиадина, например, пептиды, имеющие аминокислотную последовательность, выбранную из группы, состоящей из LGQQQPFPPQQPY (SEQ ID NO: 1); QLQPFPQPQLPY (SEQ ID NO: 2); LGQQQPFPPQQPYPQPQPF (SEQ ID NO: 3); и LQLQPFPQPQLPYPQPQLPYPQPQLPYPQPQPF (SEQ ID NO: 4). В некоторых вариантах осуществления метаболиты частично или в основном не содержат клетки Lactobacillus paracasei СВА L74, инвентарный номер LMG Р-24778 в Международном депозитарии. Композиции могут также включать физиологически приемлемый носитель, например, пищевой продукт или фармацевтический носитель.
[7] Предложены также способы лечения субъекта, имеющего связанное с глютеном расстройство, способ включает идентификацию субъекта, нуждающегося в лечении, и введение эффективного количества композиции, содержащей метаболит, продуцируемый Lactobacillus paracasei СВА L74, инвентарный номер LMG Р-24778 в Международном депозитарии, отличающийся тем, что метаболит снижает токсичность пептидов глиадина. Способы и композиции пригодны для использования в лечении любого связанного с глютеном расстройства, в том числе целиакии, включая различные подтипы, например, классическая целиакия, атипичная целиакия, скрытая целиакия и тихая целиакия, дерматит герпетиформный, глютеновая атаксия и чувствительность к глютену. Способы и композиции могут применяться одновременно со стандартными способами лечения связанных с глютеном расстройств, например, диетические способы лечения.
Краткое описание чертежей
[8] Эти и другие признаки и преимущества настоящего изобретения более полно раскрыты, или представлены наглядно, в нижеследующем подробном описании предпочтительного варианта осуществления изобретения, который следует рассматривать совместно с прилагаемыми чертежами, на которых одинаковые номера относятся к одинаковым частям:
[9] Фиг. 1 - анализ влияния Lactobacillus paracasei, штамм СВА L74 на проникновение P31-43liss в клетки СаСо2.
[10] Фиг. 2 - график, иллюстрирующий результаты анализа влияния различных концентраций Lactobacillus paracasei, штамм СВА L74 на проникновение P31-43liss в клетки СаСо2.
[11] Фиг. 3 - график, иллюстрирующий результаты анализа влияния различных концентраций Lactobacillus paracasei, штамм СВА L74 на проникновение 57-68liss в клетки СаСо2.
[12] Фиг. 4 - анализ влияния Lactobacillus paracasei, ДНК штамма СВА L74 на проникновение P31-43liss в клетки СаСо2.
[13] Фиг. 5а - график, иллюстрирующий результаты анализов влияния Lactobacillus paracasei, супернатант штамма СВА L74 на проникновение Р31-43liss в клетки СаСо2. Фиг. 5b - анализ влияния Lactobacillus paracasei, супернатант штамма СВА L74 на проникновение P31-43liss в клетки СаСо2.
[14] Фиг. 6а - график, иллюстрирующий результаты анализа влияния Lactobacillus paracasei, супернатант штамма СВА L74 на проникновение P57-68liss в клетки СаСо2. Фиг. 6b - анализ влияния Lactobacillus paracasei, супернатант штамма СВА L74 на проникновение P57-68liss в клетки СаСо2.
[15] Фиг. 7а - график, иллюстрирующий результаты анализа влияния тепловой обработки Lactobacillus paracasei, супернатанта штамма СВА L74 на проникновение P31-43liss в клетки СаСо2. Фиг. 7b - анализ влияния тепловой обработки Lactobacillus paracasei, супернатант штамма СВА L74 на проникновение Р31-43liss в клетки СаСо2.
[16] Фиг. 8 - анализ влияния Lactobacillus paracasei, супернатант штамма СВА L74 от ферментированного риса на проникновение P31-43liss в клетки СаСо2.
[17] Фиг. 9 - график, иллюстрирующий результаты анализа влияния Lactobacillus paracasei, супернатант штамма СВА L74 от ферментированного риса и ферментированного овса на проникновение P31-43liss в клетки СаСо2.
[18] Фиг. 10 - график, иллюстрирующий результаты анализа влияния Lactobacillus paracasei, супернатант штамма СВА L74 от ферментированного риса и ферментированного овса на проникновение декстран-Texas Red в клетки СаСо2.
[19] Фиг. 11 - график, иллюстрирующий результаты анализа влияния Lactobacillus paracasei, супернатант штамма СВА L74 на проникновение Alexa Fluor®-коньюгированного EGF [ЭФР] в клетки СаСо2.
[20] Фиг. 12 - анализ влияния Lactobacillus paracasei, супернатант штамма СВА L74 на проникновение Alexa Fluor®-коньюгированного EGF в клетки СаСо2.
[21] Фиг. 13а, 13b, 13с и 13d - анализ влияния Lactobacillus paracasei, штамма СВА L74 на проникновение P31-431iSS в клетки СаСо2. На Фиг. 13а показаны необработанные контрольные клетки. На Фиг. 13b показаны клетки СаСо2, обработанные с помощью 104 КОЕ/мл L.paracasei СВА L74. На Фиг. 13с показаны клетки СаСо2, обработанные с помощью 106 КОЕ/мл L.paracasei СВА L74. На Фиг. 13d показаны клетки СаСо2, обработанные с помощью 108 КОЕ/мл L.paracasei СВА L74.
[22] Фиг. 14 - график, иллюстрирующий результаты анализа влияния различных концентраций Lactobacillus paracasei, штамм СВА L74 на проникновение P31-43liss в клетки СаСо2.
[23] Фиг. 15а, 15b, 15с, 15d - анализ влияния Lactobacillus paracasei, штамм СВА L74 на проникновение P57-68liss в клетки СаСо2. На Фиг. 15а показаны необработанные контрольные клетки. На Фиг. 15b показаны клетки СаСо2, обработанные с помощью 104 КОЕ/мл L.paracasei СВА L74. На Фиг. 15с показаны клетки СаСо2, обработанные с помощью 106 КОЕ/мл L.paracasei СВА L74. На Фиг. 15d показаны клетки СаСо2, обработанные с помощью 108 КОЕ/мл I. paracasei СВА L74.
[24] Фиг. 16 - график, иллюстрирующий результаты анализа влияния различных концентраций Lactobacillus paracasei, штамм СВА L74 на проникновение P57-68liss в клетки СаСо2.
[25] Фиг. 17 - график, иллюстрирующий результаты анализа влияния 108 КОЕ/мл Lactobacillus paracasei, штамм СВА L74 на проникновение P31-43liss и P57-68liss в клетки СаСо2.
[26] Фиг. 18а, 18b и 18с - анализ влияния Lactobacillus paracasei, супернатант штамма СВА L74 на проникновение P31-43liss в клетки СаСо2. На Фиг. 18а показаны необработанные контрольные клетки. На Фиг. 18b показаны клетки СаСо2, обработанные с помощью 108 КОЕ/мл L.paracasei СВА L74. На Фиг. 18с показаны клетки СаСо2, обработанные супернатантом, собранным от 108 КОЕ/мл L.paracasei СВА L74.
[27] Фиг. 19 - график, иллюстрирующий результаты анализа влияния L.paracasei, клетки штамма СВА L74 и L.paracasei, супернатант штамма СВА L74 на проникновение P31-43liss в клетки СаСо2.
[28] Фиг. 20а, 20b и 20с - анализ влияния L.paracasei, супернатант штамма СВА L74 на проникновение P57-68liss в клетки СаСо2. На Фиг. 20а показаны необработанные контрольные клетки. На Фиг. 20b показаны клетки СаСо2, обработанные с помощью 108 КОЕ/мл L.paracasei СВА L74. На Фиг. 20с показаны клетки СаСо2, обработанные супернатантом, собранным от 108 КОЕ/мл L.paracasei СВА L74.
[29] Фиг. 21 - график, иллюстрирующий результаты анализа влияния L.paracasei, клетки штамма СВА L74, и L.paracasei, супернатант штамма СВА L74 на проникновение P57-68liss в клетки СаСо2.
[30] Фиг. 22а и 22b - анализ влияния L.paracasei, супернатант штамма СВА L74 на проникновение EGF-Alexa 488 в клетки СаСо2. На Фиг. 20а показаны необработанные контрольные клетки. На Фиг. 20b показаны клетки СаСо2, обработанные супернатантом, собранным от эквивалента 108 КОЕ/мл L.paracasei СВА L74.
[31] Фиг. 23 - график, иллюстрирующий результаты анализа влияния L.paracasei, супернатант штамма СВА L74 на проникновение EGF-Alexa 488 в клетки Сасо2.
[32] Фиг. 24а, 24b и 24с - анализ влияния удаления L.paracasei, супернатант штамма СВА L74 на проникновение P31-43liss в клетки Сасо2. На Фиг. 20а показаны необработанные контрольные клетки. На Фиг. 20b показаны клетки Сасо2, обработанные супернатантом L.paracasei СВА L74. На Фиг. 20с показаны клетки Сасо2, обработанные супернатантом L.paracasei СВА L74, который был удален.
[33] Фиг. 25 - график, иллюстрирующий результаты анализа влияния обработки, а затем удаления L.paracasei, супернатант штамма СВА L74 на проникновение P31-43liss в клетки СаСо2.
[34] Фиг. 26а, 26b, 26с, 26d - анализ влияния тепловой обработки L.paracasei, супернатант штамма СВА L74 на проникновение P31-43llss в клетки Сасо2. На Фиг. 26а показаны необработанные контрольные клетки. На Фиг. 26b показаны клетки Сасо2, обработанные супернатантом L.paracasei СВА L74. На Фиг. 26с показаны клетки Сасо2, обработанные супернатантом L.paracasei СВА L74, который подвергался кипячению. На Фиг. 26d показаны клетки Сасо2, обработанные супернатантом L.paracasei СВА L74, который нагревали при 80°С.
[35] Фиг. 27 - график, иллюстрирующий результаты анализа влияния тепловой обработки L.paracasei, супернатант штамма СВА L74 на проникновение P31-43liss в клетки СаСо2.
Подробное описание предпочтительного варианта осуществления
[36] Данное описание предпочтительных вариантов осуществления следует читать в сочетании с прилагаемыми рисунками, которые должны рассматриваться как часть полного письменного описания настоящего изобретения. Представленные рисунки не обязательно изображены в определенном масштабе, а некоторые признаки изобретения могут быть показаны в увеличенном масштабе или в несколько схематичном виде в интересах ясности и краткости. В описании относительные термины, такие как «горизонтальный», «вертикальный», «вверх», «вниз», «сверху» и «снизу», а также их производные (например, «горизонтально», «внизу», «вверху» и т.д.) следует толковать как относящиеся к ориентации, как затем описано или как показано на рассматриваемом чертеже. Эти относительные термины приняты для удобства описания и обычно не предназначены для указания конкретной ориентации. Термины, включающие «внутрь» по сравнению с «наружу», «продольный» по сравнению с «поперечный» и т.п., следует понимать по отношению друг к другу или по отношению к продольной оси, или оси или центра вращения, по обстоятельствам. Термины, касающиеся прикреплений, связи и т.п., такие как «связаны» и «взаимосвязаны», относятся к отношениям, когда соединение структур друг к другу либо прямое, либо непрямое, через промежуточные структуры, а также к подвижным или жестким присоединениям или связям, если специально не указано иное. Понятие «функционально связаны» означает такое прикрепление, связь или соединение, которое позволяет соответствующим структурам работать по назначению в силу такой связи. Если показана только одна машина, термин «машина» также следует принимать, как включающий любую группу машин, которые по отдельности или совместно выполняют набор (или несколько наборов) инструкций по осуществлению одного или нескольких методик, описанных здесь. В формуле изобретения пункты, совмещающие средство-плюс-функция, если используются, предназначены для охвата конструкций, описанных, предложенных или представленных очевидными согласно письменному описанию или рисункам для выполнения указанной функции, в том числе не только структурные эквиваленты, но и эквивалентные структуры.
[37] Настоящее изобретение основано, частично, на открытии авторов изобретения, что культуры пробиотического микроорганизма Lactobacillus paracasei, штамм СВА L74, могут уменьшать проникновение некоторых компонентов глютена в интестинальные клетки человека. Более конкретно, авторами изобретения установлено, что выделенные супернатанты L.paracasei СВА L74 и культуральные супернатанты от L.paracasei СВА L74 уменьшили проникновение пептидов α-глиадина в культивируемые человеческие интестинальные эпителиальные клетки. Кроме того, уменьшение проникновения пептида также наблюдалось и в отношении продуктов, которые были ферментированы с помощью L.paracasei СВА L74. Действие на проникновение пептида наблюдалось даже тогда, когда культуральные супернатанты подвергались тепловой обработке. Соответственно, данное изобретение относится к композициям, которые могут ослабить токсическое воздействие пептидов глиадина. Композиции могут включать Lactobacillus paracasei, клетки штамма СВА L74, метаболиты, продуцируемые Lactobacillus paracasei, штамм СВА L74, или комбинацию Lactobacillus paracasei, клетки штамма СВА L74, и метаболитов, продуцируемых Lactobacillus paracasei, штамм СВА L74.
[38] Lactobacillus paracasei, штамм СВА L74, был выделен авторами и сдан на хранение согласно условиям Будапештского Договора о международном признании хранения микроорганизмов для целей процедуры выдачи патента [the Budapest Treaty on the International Recognition of the Deposit of Micro-organisms for the Purposes of Patent Procedure] 9 сентября 2008 года в Бельгийской координированной коллекции микроорганизмов (ВССМ) Лаборатории микробиологии [Laboratorium voor Microbiologie] (LMG), Гент, Бельгия. Международным депозитарным органом [International Depositary Authority] присвоен инвентарный номер LMG Р-24778. Для удобства чтения далее по тексту фраза «инвентарный номер LMG Р-24778» не будет повторяться. Следует понимать, что, когда авторы делают ссылку на L.paracasei, штамм СВА L74, они ссылаются на депонированный штамм под инвентарным номером LMG Р-24778.
[39] Несмотря на то что авторы полагают, что они понимают определенные события, которые происходят при введении композиций, содержащих или составленных путем ферментации с помощью L.paracasei СВА L74, композиции по настоящему изобретению не ограничиваются теми из них, которые работают за счет воздействия на любой конкретный клеточный механизм. Рабочая гипотеза авторов состоит в том, что композиции, содержащие L.paracasei СВА L74, супернатант от культур или ферментатов L.paracasei СВА L74, а также метаболиты, продуцируемые L.paracasei СВА L74, могут обеспечить повышенный барьер для транслокации глютеновых и родственных глютену полипептидов через кишечную слизистую оболочку и, таким образом, смягчить действие глютеновых и родственных глютену полипептидов у лиц, имеющих связанное с глютеном расстройство, например, целиакию или чувствительность к глютену. Авторами настоящего изобретения установлено, что L.paracasei СВА L74, супернатант, снизил поглощение клетками молекул, которые проникают в клетки по различным эндоцитозным путям, напр., фагоцитоз, макропиноцитоз, клатрин-опосредованный эндоцитоз (также известный как рецептор-опосредованный эндоцитоз) и кавеолы. Например, L.paracasei СВА L74, супернатант, уменьшил клеточное проникновение как декстрана, который, как известно, проникает в клетки через макропиноцитоз, так и эпидермального фактора роста (EGF), который проникает в клетку через рецептор-опосредованный эндоцитоз. Положительного действия композиций, описанных здесь, можно получить, например, от метаболитов, продуцируемых во время ферментации, например, органических кислот, таких как молочная кислота, масляная кислота или уксусная кислота. Альтернативно или в дополнение, воздействие на клеточный ответ на глютеновые и родственные глютену полипептиды могут оказывать фрагменты бактериальной клеточной стенки и другие субклеточные бактериальные компоненты, такие как белки, углеводы, фрагменты нуклеиновой кислоты и липиды.
[40] Соответственно, в настоящем изобретении предлагаются композиции и способы, которые могут использоваться для защиты клеток от потенциально токсичного действия глютеновых и родственных глютену пептидов. Композиции могут включать среды, в которых были выращены L.paracasei СВА L74, или пищевые продукты, например, молочные продукты или зерновые продукты, которые были ферментированы с помощью L.paracasei СВА L74. В некоторых вариантах осуществления, среды или пищевые продукты могут обрабатываться, напр., физико-химическими способами, такими как центрифугирование, с целю удаления всех или в основном всех клеток L.paracasei СВА L74, которые были культивированы в этих средах или пищевом продукте. В некоторых вариантах осуществления композиции могут включать выделенные L.paracasei СВА L74 и физиологический носитель. Носитель может быть пищевым продуктом, но изобретение не ограничивается этим, и в некоторых вариантах осуществления носителем может быть фармакологический носитель.
[41] Кроме того, предлагаются способы изготовления и применения композиций. Способы в соответствии с изобретением включают способы получения композиций, содержащих L.paracasei СВА L74, способы ферментации пищевых продуктов с помощью L.paracasei СВА L74 и способы введения композиций субъекту, имеющему связанное с глютеном расстройство. Способы могут применяться на людях или в ветеринарии. Независимо от субъекта (человек или субъект кроме человека) любой из настоящих способов может включать стадию идентификации субъекта. Например, способы могут включать этап определения, нуждается ли субъект в лечении.
Композиции
L.paracasei СВА LI4
[42] Композиции в соответствии с изобретением могут включать пробиотический микроорганизм L.paracasei СВА L74. Всемирная организация здравоохранения определила пробиотики как: «Живые микроорганизмы, которые при введении в адекватных количествах приносят пользу здоровью хозяина». В некоторых вариантах осуществления, L.paracasei СВА L74 может подвергаться обработкам, которые делают его нереплицируемым, например, воздействие тепла, γ-облучение или УФ-облучение. Нереплицируемой L.paracasei СВА L74 может быть мертвая клетка или живая клетка, которую сделали неспособной к клеточному делению. Нереплицируемой L.paracasei СВА СВА L74 может быть интактная клетка или клетка, которая претерпела частичный или полный лизис. В некоторых вариантах осуществления нереплицируемые клетки могут включать смесь интактных и лизированных клеток.
[43] В некоторых вариантах осуществления, композиции могут включать ферментаты L.paracasei СВА L74, из которых удалены все или в основном все клетки L.paracasei СВА L74. Способы выделения клеток из питательных сред хорошо известны в данной области и могут быть основаны на физических способах, например, центрифугирование для получения дебриса и культурального супернатанта, фильтрация, ультрафильтрация, тангенциальная поточная фильтрация, фильтрация нормального потока или обратный осмос. Альтернативно или в дополнение, способ выделения может быть на основе лиганда и включать, например, антитело, которое специфически связывается с L.paracasei СВА L74. Антитело может быть соединено с твердой подложкой, например, магнитным шариком.
[44] Композиции включают один или несколько метаболитов L.paracasei СВА L74, т.е. любое вещество, продуцируемое L.paracasei СВА L74. Метаболит может быть закодирован одним или несколькими генами или он может генерироваться ферментативной активностью одного или нескольких генных продуктов. Метаболиты включают, например, малые молекулы, например, аминокислоты, нуклеозиды, нуклеотиды, а также более крупные полимерные структуры, такие как полипептиды, углеводы, нуклеиновые кислоты, протеогликаны и липиды. Метаболит может быть первичным метаболитом, например, метаболит, непосредственно участвующий в функии нормальной клетки, или вторичным метаболитом, например, метаболитом, который, как правило, не требуется для основных клеточных функций. Метаболит может также включать любой метаболический интермедиат, генерируемый в процессе синтеза первичного или вторичного метаболита. Интермедиаты могут включать, но не ограничиваются этим, интермедиаты пути Эмбдена-Мейергофа, пентозофосфатного (пентоза-Р) пути, пути Энтнер-Дудорова, цитратного цикла и аминокислотного биосинтеза.
[45] Иллюстративные первичные метаболиты включают, без ограничения, спирты, напр., этанол, метанол, бутанол; аминокислоты, напр., лизин, аргинин, орнитин, гистидин, цитруллин, изолейцин, аланин, валин, лейцин, глицин, треонин, серии, пролин, фенилаланин, тирозин, триптофан, цистеин, цистин, метионин, глутаминовая кислота, аспарагиновая кислота, глутамин и аспарагин; нуклеотиды, напр., 5' гуаниловая кислота; антиоксиданты, напр., изоаскорбиновая кислота; органические кислоты, напр., уксусная кислота, молочная кислота, лимонная кислота, муравьиная кислота; витамины, напр., витамин В12; сахара, жирные кислоты, напр., короткоцепочечные жирные кислоты; полиамины; пептиды, напр., бактериоцины, такие как лантибиотик, напр., низин, или нелантибиотик, напр., энтероцин, плантарицин W, плантарицин S.
[46] Метаболит может также быть вторичным метаболитом. Вторичными метаболитами обычно являются такие метаболиты, которые не требуются для фундаментальных клеточных функций. Вторичные метаболиты могут широко варьироваться; иллюстративные вторичные метаболиты включают антибиотики, гормоны, флавониды, терпеноиды, алкалоиды, фенилпропаноиды, производные фенила, производные гексанола, кумарины, стильбены, циангидрины, глюкозинолаты, стерины и сапонины.
[47] Лактобактерии обычно продуцируют следующие метаболиты в процессе ферментации молочных продуктов: молочная кислота/лактат, ацетат, этанол, формиат, ацетальдегид, α-ацетолактат, ацетоин, диацетил и 2,3 бутиленгликоль (бутандиол) в процессе ферментации молочных продуктов. Ферментацией может быть любой процесс, в котором микроб вызывает расщепление или способствует расщеплению сложного органического вещества на более простые вещества.
[48] Метаболит L.paracasei СВА L74 может содержаться в средах, ферментатах или культуральных супернатантах. В некоторых вариантах осуществления метаболит может быть частично или в основном выделен из сред, ферментатов или культуральных супернатантов. Таким образом, функциональный метаболит, т.е. метаболит, который уменьшает клеточное проникновение пептида глиадина, может включать или исключать любой из описанных выше метаболитов. Способы выделения метаболитов будут варьироваться в зависимости от структуры и химического состава конкретного метаболита. Частично или в основном выделенный метаболит сохраняет функциональную активность, то есть способность уменьшать проникновение в клетку глиадина пептидов, сред, ферментатов или культуральных супернатантов. Таким образом, если супернатант культуры L.paracasei СВА L74 может уменьшать проникновение пептида глиадина в клетки, можно предполагать, что частично или в основном выделенный метаболит из культурального супернатанта L.paracasei СВА L74 также будет уменьшать проникновение пептида глиадина в клетки. Для выделения и характеризации метаболитов L.paracasei СВА L74 могут использоваться с тандартные известные способы. Иллюстративные способы включают, например, анализы устойчивости, напр., устойчивости к нагреву, рН и/или ферментативная активность; хроматографический анализ, напр., эксклюзионная хроматография, высокоэффективная жидкостная хроматография (ВЭЖХ), газовая хроматография, тонкослойная хроматография, ионообменная хроматография, аффинная хроматография, хроматография с обращенной фазой; масс-спектрометрия. В некоторых вариантах осуществления метаболит устойчив к нагреванию, то есть он сохраняет свою функциональную активность, т.е. способность предотвращать проникновение в клетку пептидов глиадина после воздействия температур за пределами нормального физиологического диапазона, напр., 50°С, 60°С, 70°С, 80°С, 90°С или 100°С.
Глютеновые и родственные глютену полипептиды
[49] Независимо от конкретной формы описанные здесь композиции уменьшают клеточное поглощение глютеновых и родственных глютену полипептидов. Глютеновые и родственные глютену полипептиды являются основными запасными белками диетических хлебных злаков. Глютен содержится в пшенице. Близкородственные белки, гордеины и секалины, содержатся в ячмене и ржи, соответственно. Описано несколько сотен генов, кодирующих глютеновые и родственные глютену белки. Дополнительно к своим питательным свойствам глютен играет ключевую роль в определении уникального хлебопекарного качества пшеницы за счет придания водопоглощающей способности, склеиваемости, вязкости и эластичности тесту. Глютен фактически представляет собой комплекс из двух полипептидных фракций, которые классифицированы на основании их растворимости в водных спиртах: растворимые глиадины и нерастворимые глютенины. Обе фракции состоят из многочисленных родственных белковых компонентов, характеризующихся высоким содержанием глутамина и пролина.
[50] Глиадины представляют собой мономерные белки с молекулярной массой (MW) примерно 28000-55000 и изоэлектрической точкой примерно рН=3,0-4,0. Существуют четыре класса полипептидов глиадина: α-глиадина, β-глиадина, γ-глиадина и ω-глиадина. Иллюстративные аминокислотные последовательности для α-глиадина можно найти в Генном Банке [GenBank] в Gl: 7209265 (тритикум аестивум 290 аминокислот, SEQ ID NO: 7); Gl: 7209263 (тритикум аестивум 269 аминокислот, SEQ ID NO: 8); Gl: 376341626 (тритикум аестивум 210 аминокислот, SEQ ID NO: 9); Gl: 282721198 тритикум аестивум, 313 аминокислот, SEQ ID NO: 10).
[51] Глютенин является более крупным мультимерным белком в диапазоне молекулярной массы от примерно 100000 до более чем 10000000 со средней молекулярной массой около 3000000. Изоэлектрические точки для глютенина находятся в диапазоне от примерно 6,5 до 7,0. После уменьшения дисульфидных связей получаемые в результате субъединицы глютенина демонстрируют растворимость в водных спиртов аналогичную глиадинам. Исходя из первичной структуры, субъединицы глютенина разделены на высокомолекулярные (HMW) субъединицы (MW=67000-88000) и низкомолекулярные (LMW) субъединицы (MW=32000-35000). Глиадины, глютенины, гордеины и секалины имеют высокое содержание пролина и глутамина. Высокое содержание пролина делает эти белки устойчивыми к полному протеолитическому расщеплению энзимами желудка, поджелудочной железы и щеточной каймы в кишечнике человека, поскольку у этих энзимов недостаточная активность пролил эндопептидазы. Это может привести к накоплению относительно больших пептидных фрагментов (порядка 50 аминокислот в длину) с высоким содержанием пролина и глутамина в тонком кишечнике.
[52] Специфические аминокислотные последовательности для глиадина могут варьироваться, но все они содержат Т-клеточные эпитопы, которые запускают иммунные ответы, участвующие в патогенезе целиакии. Именно эти глютеновые специфические ответы Т-клеток в тонком кишечнике играют важную роль в создании воспалительной реакции, что, в конечном счете приводит к характерной атрофии кишечных ворсинок и гиперплазии крипт. Специфические нативные пептиды глютена могут связываться с HLA-DQ2/8, типы HLA, наиболее сильно связанные с целиакией. Такое связывание HLA индуцирует CD4 Т-клеточные ответы собственной пластинки, которые в свою очередь приводят к повреждению слизистой оболочки тонкого кишечника. Повреждение тканей инициирует секрецию раноисцеляющей трансглутаминазы тканевого энзима (tTG). Однако, tTG также дезамидирует пептиды глюкена. Дезамидирование преобразует нейтральные остатки глутамина в отрицательно заряженные остатки глутаминовой кислоты. Эти дезамидированные пептиды значительно повысили аффинность связывания для HLA-DQ2/8 по отношению к пептидам, которые не были деамидированы. Этот процесс приводит к повышенной антигенной презентации глиадина. Связывание дезамидированных пептидов дополнительно активирует глютен-специфические клетки CD4+ Т-хелпер 1 (Th1) в собственной пластинке, которая в свою очередь увеличивает интраэпителиальный лимфоцитоз, гиперплазию крипт, продуцирование цитокинов, ведущие к атрофии ворсинок, а также расширение В-клеток, которые продуцируют антитела к глиадину и tTG.
[53] В α- и γ-глиадинах, а также в глютенинах были идентифицированы мотивы множественных Т-клеточных эпитопов. Большинство из них показали повышенное узнавание Т-клеток после дезамидирования. Кроме того, пациенты с целиакией, как правило, чувствительны к нескольким пептидам глютена. Хотя взаимодействие DQ2/8 представляет наиболее значимую ассоциацию с целиакией, определенную до настоящего времени, неиммуногенные пептиды глютена могут также влиять на врожденную иммунную систему.
[54] Пептиды глиадина Р31-43 и Р31-49, как правило, не распознаются Т-клетками. Эти пептиды индуцируют врожденный иммунный ответ в чревной слизистой оболочке. Пептид Р31-43 задерживает созревание эндоцитозных пузырьков и, следовательно, уменьшает деградацию рецептора эпидермального фактора роста (EGFR) и продлевает активацию EGFR. Было продемонстрировано, что продленная активация EGFR вызывает повышенную пролиферацию клеток и модификации актина как в энтероцитах чревных крипт, так и в культивируемых клеточных линиях. После проникновения в кишечные энтероциты или в интестинальную линию клеток человека, СаСо2, Р31-43 взаимодействует с ранними эндоцитозными пузырьками, снижает их подвижность и задерживает их созревание до поздних эндосом.
[55] В ходе развития целиакии участвуют различные пептиды глютена. Есть две группы биологически активных пептидов, производных от α-глиадина. Группа серин-содержащих пептидов, по-видимому, является практически цитотоксической, тогда как тирозин-содержащая группа обладает способностью запускать иммунологические реакции у больных целиакией. Активность серин-содержащих пептидов связана с наличием PSQQ и QQQP мотивов. Тирозин-содержащие пептиды, напр., QQPY и/или QPYP, ассоциированы с иммунологической активностью.
[56] Пептиды глиадина могут значительно различаться по последовательностям. Полипептид, который имеет последовательность, которая идентична части последовательности глиадина и которая функционирует (напр., для одной или нескольких из описанных здесь целей), является пептидом глиадина. Непроцессированный глиадин содержит последовательность пептида глиадина и один или несколько из описанных здесь пептидов могут находиться частично или полностью в пределах последовательности глиадина. Пептид, который имеет последовательность, отличающуюся в определенной ограниченной степени от последовательности, которая встречается в природном глиадине и которая сохраняет способность функционировать (например, сохраняет достаточную активность, чтобы передавать токсичность пептида глиадина), является биологически активным вариантом пептида глиадина. Авторы намерены использовать термины «глиадин» для обозначения непроцессированных белков природного глиадина и термины «полипептид» и «пептид» в отношении их фрагментов (т.е. фрагментов глиадина) и их биологически активных вариантов. Поскольку полипептиды или пептиды могут иметь последовательность, которая идентична последовательности, встречающейся в глиадине, полипептиды или пептиды являются производными фрагментов глиадина.
[57] Хотя последовательности имеющихся полипептидов могут варьироваться, полезные полипептиды могут включать фрагменты SEQ ID NO: 7-10. Полипептиды могут включать или состоять из аминокислотной последовательности глиадина, которая естественным образом экспрессируется в растительной клетке. Биологически активный вариант может включать, например, аминокислотную последовательность, которая отличается от фрагмента глиадина дикого типа из-за содержания одного или нескольких консервативных аминокислотных замещений. В некоторых вариантах осуществления по меньшей мере 50% аминокислотных остатков варианта идентичны остаткам в соответствующем фрагменте глиадина дикого типа. Биологически активные варианты могут также включать аминокислотные последовательности, которые отличаются от фрагмента глиадина дикого типа благодаря неконсервативным аминокислотным замещениям, добавлениям и/или делециям.
[58] Авторы ссылаются на некоторые аминокислотные последовательности как «полипептиды», чтобы сообщить, что они являются линейными полимерами аминокислотных остатков, и чтобы можно было отличать их от непроцессированных белков. Следует иметь в виду, что полипептиды могут, следовательно, включать только фрагмент глиадина (или его биологически активный вариант), но в такой же мере могут включать дополнительные остатки. Полипептиды в соответствии с изобретением могут изменяться по длине. Например, полипептиды могут быть длиной 8-40 (например, 12, 14, 18, 18, или 20) аминокислот или длиннее (например, вплоть до примерно 40 остатков).
[59] Полипептиды, которые являются биологически активными вариантами глиадина, можно охарактеризовать с точки зрения степени, в какой их последовательность аналогична или идентична соответствующему фрагменту глиадина. Например, последовательность биологически активного варианта может быть по меньшей мере или примерно на 60% идентичной соответствующим остаткам в глиадине дикого типа. Например, биологически активный вариант полипептида глиадина может иметь аминокислотную последовательность по меньшей мере или примерно с 60% идентичностью последовательности (например, по меньшей мере или примерно 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98% или 99% идентичностью последовательности) глиадину (например, аминокислотной последовательности, представленной SEQ ID NO: 7-10, или другому полипептиду, как описано здесь (напр., полипептид, представленный, например, SEQ ID NO: 1-6) или его гомологу или ортологу).
[60] Биологически активный вариант полипептида глиадина будет сохранять достаточную биологическую активность, чтобы передавать токсичность субъекту, имеющему связанное с глютеном расстройство. Биологическую активность можно определять способами, известными обычному специалисту в данной области техники, они включают без ограничения анализы клеточного поглощения, анализы экспрессии генов или животные модели in vivo. Биологически активные варианты можно идентифицировать, например, путем сравнения относительной активности вариантного полипептида с относительной активностью активного фрагмента пептида глиадина. Анализы могут включать неродственный контрольный полипептид (напр., можно было бы включать в любой заданный анализ пептид, который имеет такое же содержание аминокислот, расположенных случайным образом, а также контрольную группу только с носителем). Некоторые биологически активные варианты могут даже обладать даже большей биологической активностью, чем родственный природный фрагмент или непроцессированный глиадин. Более конкретно, биологически активный вариант может иметь по меньшей мере или примерно 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 98% или более биологической активности полипептида нативной формы.
[61] Иллюстративные пептиды α-глиадина, которые играют некоторую роль в целиакии, включают Р31-43, LGQQQPFPPQQPY, (SEQ ID NO.: 1); Р31-49 LGQQQPFPPQQPYPQPQPF (SEQ ID NO: 3); P44-55; PQQPFPSQLP (SEQ ID NO.: 5; P57-68 QLQPFPQPQLPY (SEQ ID NO.: 2); P56-88, LQLQPFPQPQLPYPQPQLPYPQPQLPYPQPQPF (SEQ ID NO: 4) и P63-76 QPQLPYPQPQLPYP (SEQ ID NO.: 6).
Пищевые продукты
[62] Композиции в соответствии с изобретением могут включать физиологически приемлемый носитель. Физиологический носитель может быть пищевым продуктом или фармацевтическим носителем. Авторы используют термины «физиологически приемлемый» (или «фармакологически приемлемый») в отношении молекулярных частиц и композиций, которые не вызывают побочную, аллергическую или иную неблагоприятную реакцию при введении животному или человеку, по обстоятельствам. Таким образом, композиции в соответствии с настоящим изобретением включают пищевые продукты, ферментированные пробиотическим микроорганизмом, L.paracasei СВА L74. Пищевой продукт может включать клетки L.paracasei СВА L74, либо живые, либо нереплицируемые. В некоторых вариантах осуществления пищевой продукт может обрабатываться для удаления всех или в основном всех клеток L.paracasei СВА L74. Использовать можно любой пищевой продукт, поддающийся ферментации с помощью L.paracasei СВА L74. Пищевым продуктом может быть молочный продукт, например, молоко или продукт на молоке. Иллюстративными источниками молока включают, без ограничения, крупный рогатый скот, овец, коз, яков, буйволов, лошадей, ослов, оленей и верблюдов. Независимо от источника, молоко или молочные продукты могут быть в любой форме, пригодной для ферментации с помощью L.paracasei СВА L74. Например, молоко может быть цельным молоком или молоком, которое было обработано с целью удаления некоторого количества или всего молочного жира, напр., 2% молоко, 1% молоко или обезжиренное молоко. Альтернативно или в дополнение, молоко может быть предварительно подвергнуто пастеризации и/или гомогенизации, сушке и восстановлению или сгущению. Также могут использоваться фракции молочных продуктов, включая казеин, белок молочной сыворотки или лактозу. В некоторых вариантах осуществления молочный продукт может составлять от примерно 1% до примерно 30% восстановленного сухого обезжиренного молока, например, примерно 2%, примерно 5%, примерно 7%, примерно 9%, примерно 10%, примерно 12%, примерно 15%, примерно 20%, примерно 25%, примерно 30% восстановленного сухого обезжиренного молока. Перед ферментацией молочный продукт может соединяться с одним или несколькими из следующего: а) углевод (напр., дисахарид, такой как декстроза или крахмал; b) липид; с) витамин и d) минерал. Например, обезжиренное сухое молоко может соединяться с декстрозой примерно до 2%, напр., примерно до 0,25%, примерно до 0,50%, 0,75%, 1,0%, 1,5%, или примерно до 2,0%.
[63] Пищевой продукт может представлять собой зерновой продукт, например, рис, овес, кукуруза, сорго или просо. В некоторых вариантах осуществления зерновым продуктом может быть пшеница, ячмень, рожь или тритикале. Зерновой продукт может быть в виде цельного зерна или может быть измельчен до состояния муки. Пищевой продукт может представлять собой один вид зерновых или смесь двух или более видов зерновых, напр., овсяная мука плюс рисовая мука. Зерновые продукты могут быть класса и типа, пригодных для потребления человеком или могут быть продуктами, пригодными для потребления домашними животными. Как правило, зерновой продукт перед ферментацией подвергается гидратации. Концентрация злаков может варьироваться, но применимые диапазоны включают от примерно 5% до примерно 50% вес/объем, например, примерно 8% вес/объем, примерно 10% вес/объем, примерно 12% вес/объем, примерно 15% вес/объем, примерно 18% вес/объем, примерно 20% вес/объем, примерно 22% вес/объем, примерно 25% вес/объем, примерно 30% вес/объем, примерно 35% вес/объем, примерно 40% вес/объем, примерно 45% вес/объем или примерно 50% вес/объем. Иллюстративные концентрации включают 15% вес/объем риса или смесь из 18,5% вес/объем овсяной муки плюс 5% вес/объем солодовой ячменной муки. Значение рН гидратированных зерновых можно регулировать с помощью любой кислоты, пригодной для потребления. Кислота может быть, например, органической кислотой. Пригодные органические кислоты включают уксусную кислоту, лимонную кислоту, молочную кислоту, адипиновую кислоту, яблочную кислоту и винную кислоту. Можно использовать любую комбинацию двух или более кислот. В некоторых вариантах осуществления с помощью лимонной кислоты значение рН можно отрегулировать до примерно 4,0.
[64] Пищевой продукт также может представлять собой растительный или фруктовый продукт, например, сок, пюре, концентрат, паста, соус, рассол или кетчуп. Иллюстративные овощи и фрукты включают, без ограничения, кабачки, напр., цукини, желтый сквош, зимний сквош, тыква; картофель, спаржа, брокколи, брюссельская капуста, фасоль, напр., зеленые бобы, восковая фасоль, лимская фасоль, конские бобы, соевые бобы, капуста, морковь, цветная капуста, огурцы, кольраби, лук-порей, зеленый лук, репчатый лук, сахарный горох, английский горох, перец, репа, брюква, помидоры, яблоки, груши, персики, сливы, клубника, малина, ежевика, черника, брусника, бойзенова ягода, крыжовник, виноград, смородина, апельсины, лимоны, грейпфруты, бананы, манго, киви и карамбола.
[65] Пищевой продукт может также представлять собой «молоко», полученное из орехов или бобовых, например, соевое молоко или миндальное молоко.
[66] Кроме того, предусматриваются пищевые продукты, содержащие белки животного происхождения, например, мясо, например, сосиски, сушеное мясо, сушеная рыба и продукты из сушеной рыбы.
[67] Независимо от типа используемого пищевого продукта, продукт соединяется с L.paracasei СВА L74 и инкубируется при температуре и в течение времени, достаточных для осуществления ферментации. Может использоваться любой стандартный способ ферментации, известный в данной области. Конкретные условия ферментации будут варьироваться в зависимости от многих факторов, включая, например, тип пищевого продукта, концентрацию пищевого продукта, используемый инструментарий, объем образца, начальную концентрацию инокулума L.paracasei СВА L74, наличие, если имеется, ко-инокулума, органолептические свойства ферментированного пищевого продукта и предполагаемое использование ферментированного пищевого продукта.
[68] И инструментарий, и субстрат (т.е. пищевой продукт, подлежащий ферментации) подвергают стерилизации перед инокуляцией L.paracasei СВА L74, чтобы снизить уровень жизнеспособных бактерий и/или грибков, и/или инфекционных вирусов, или удалить их. Инструментарий можно стерилизовать, применяя стандартные способы, или в соответствии с инструкциями изготовителя. Выбор конкретного способа стерилизации субстрата будет зависеть отчасти от устойчивости субстрата к способу стерилизации. Например, субстрат может стерилизоваться паром и под давлением, напр., автоклавированием, повторяющимися циклами нагрева и охлаждения (например, тиндализацией), воздействием высоких давлениях (напр., паскализацией), ультрафильтрацией или излучением (например, воздействием гамма-, х-лучами, электронным пучком и/или ультра-фиолетом (длина волны 10 нм - 320 нм, напр., 50 нм - 320 нм, 100 нм - 320 нм, 150 нм - 320 нм, 180 нм - 320 нм или 200 нм - 300 нм). Аликвоты субстрата могут быть удалены после обработки и высева на подходящие среды для подтверждения отсутствия бактериальных и/или грибковых загрязняющих веществ. Если субстрат стерилизован путем воздействия высоких температур, его необходимо охладить по меньшей мере до 37°С перед инокуляцией L.paracasei СВА L74.
[69] Субстрат может быть инокулирован с L.paracasei СВА L74 в соответствии со стандартными способами, например, из свежей жидкой культуры или лиофилизированной культуры, которая была ресуспендирована в водной среде в течение короткого периода времени перед посевом. Как правило, L.paracasei СВА L74 добавляют в концентрации от примерно 0,5×106 до 1×106 КОЕ/мл субстрата, напр., примерно 1×106 КОЕ/мл, примерно 2×106 КОЕ/мл, примерно 5×106 КОЕ/мл, 7×106 КОЕ/мл, 8×106 КОЕ/мл. Культуру необходимо перемешать в достаточной мере до получения относительно равномерного распределения бактерий и субстрата, но не слишком сильно, так как L.paracasei СВА L74 - это анаэробная бактерия. Например, пять литров культуры можно перемешивать при скорости примерно 150 об/мин. Температура ферментации обычно составляет 37°С. Различные параметры, например рН, парциальное давление О2, скорость мешалки, температура, перемешивание газом, уровень пены и концентрация субстрата можно контролировать во время ферментации и соответствующим образом регулировать. Рост L.paracasei СВА L74 можно контролировать с помощью стандартных микробиологических способов. Ферментация выполняется до тех пор, пока концентрация L.paracasei СВА L74 не достигнет значения в интервале от примерно 108/мл до примерно 109/мл. В зависимости от субстрата и других условий такая концентрация может быть достигнута примерно через 10-30 часов после инокуляции, напр., примерно через 12 часов, примерно через 15 часов, примерно через 18 часов, примерно через 24 часов, примерно через 30 часов.
[70] Контроль качества образцов субстрата можно выполнять до, во время и после ферментации, используя стандартные микробиологические способы. Иллюстративные способы включают, но не ограничиваются этим, рост на агаре Рогоза для L.paracasei СВА L74, рост на агаре чашечного подсчета (РСА) для всех аэробов, рост на агаре McConkay для колиформных бактерий, рост на усиленном клостридийном агаре (RCM) для клостридий. Дополнительно к определению количества колоний можно наблюдать морфологию колоний и сравнивать с контрольными образцами.
[71] В некоторых вариантах осуществления вместе с L.paracasei СВА L74 можно добавлять ко-инокулум для содействия инициированию ферментации. Пригодные ко-инокулумы для ферментации молочных продуктов включают, например, без ограничения, Streptococcus thermophilus, Lactobacillus paracasei, Lactobacillus salivarious, Lactobacillus rhamnosus, Lactobacillus casei, Lactobacillus lactis, Lactobacillus delbrueckii, подвиды Bulgaricus, Lactobacillus acidophilus, Lactobacillus brevis или Leuconostoc mesenteroides. В общем, концентрация ко-инокулума будет ниже, чем L.paracasei СВА L74, например, примерно 1×104/мл ×105/мл. Конечная концентрация S. thermophilus может варьироваться от примерно 0,5×108/мл до примерно 2,5×108/мл.
[72] После того как будет достигнута соответствующая концентрация L.paracasei СВА L74, ферментированные пищевые продукты могут подвергаться дополнительной обработке для использования. В некоторых вариантах осуществления ферментированный пищевой продукт может подвергаться фракционированию для удаления всех или в основном всех клеток L.paracasei СВА L74. В некоторых вариантах осуществления значение рН ферментированного пищевого продукта можно регулировать, например, от примерно 3,0 до почти нейтральности, напр., 6,5, путем добавления NaOH или КОН. В некоторых вариантах осуществления ферментированный пищевой продукт может подвергаться сушке. Сушить ферментированный пищевой продукт можно любым способом, известным в данной области техники, который сохраняет иммуномодулирующие свойства ферментированного пищевого продукта Иллюстративные способы сушки включают сушку распылением, сублимационную сушку, например, лиофилизация или барабанная сушка. Конечное содержание воды в ферментированном пищевом продукте может варьироваться, но может быть в пределах от прииерно 1% до прииерно 10% или более. В некоторых вариантах осуществления в процессе сушки L.paracasei СВА L74 может стать нереплицируемым.
[73] Высушенные ферментированные пищевые продукты могут гидратироваться перед применением. В зависимости от количества жидкости, используемой при гидратации, ферментированные продукты могут содержать эквивалент примерно 102, примерно 103, примерно 104, примерно 105, примерно 106, примерно 107, примерно 108, примерно 109, примерно 1010, примерно 1011 и примерно 1012 КОЕ/мл бактерий L.paracasei СВА L74. Высушенные L.paracasei СВА L74 не образуют колоний, значит, следует понимать, что это количество вычислено на основании количества живых бактерий, которые присутствовали в ферментированных пищевых продуктах до стадии сушки. В некоторых вариантах осуществления ферментированные пищевые продукты могут включать эквивалент от примерно 107 до примерно 1012 КОЕ/г, напр., примерно 5×107 КОЕ/ г, примерно 1×108 КОЕ/г, примерно 1×108 КОЕ/г, примерно 1×109 КОЕ/г, примерно 5×109 КОЕ/г, примерно 1×1010 КОЕ/г, примерно 5×1010 КОЕ/г, примерно 1×1011 КОЕ/г, примерно 5×1011 КОЕ/г сухой массы.
[74] Перед введением два или более ферментированных пищевых продукта, приготовленных по способам в соответствии с изобретением, можно объединять. Например, ферментированные молочные продукты можно объединять с ферментированными зерновыми продуктами. Альтернативно, ферментированный пищевой продукт можно объединять с другими пищевыми продуктами, например, неферментированными пищевыми продуктами или пищевыми продуктами, ферментированными с использованием других бактериальных штаммов. Может быть использована любая комбинация, при условии что воздействие на пептиды глиадина ферментированного продукта сохраняется. Иллюстративные пищевые продукты включают, без ограничения, молочные продукты, напр., молоко, йогурт, творог, сыр и сырные продукты, кисломолочные продукты, продукты на основе кисломолочных продуктов, ферментированные продукты на молочной основе, порошки на основе молока, детские смеси, протертые продукты детского питания на основе молока, мороженое, холодный десерт, пудинги, супы, соусы, пюре или приправы, пищевые формулы для пожилых людей; крупяные продукты, напр., детская питательная смесь, протертые продукты детского питания на зерновой основе, овсяные хлопья, крахмал, манная крупа, полента, макаронные изделия, печенье, крекеры, энергетические батончики; растительные продукты, напр., пюре, продукты детского питания на овощной основе, маринованные овощи, включая огурцы, капусту, морковь, фасоль, сладкий перец или приправы; фруктовые продукты, напр., протертые продукты детского питания на фруктовой основе, томатные продукты, пюре, соусы, пасты, кетчупы, фруктовые пюре; или продукты на белковой основе, напр., бобовые, сосиски, хот-доги или протертое мясо. В некоторых вариантах осуществления ферментированный пищевой продукт может быть объединен с консервами для домашних животных или кормами для животных. Фармацевтические композиции
[75] Композиции, описанные здесь, могут соединяться с фармацевтически приемлемым носителем. Термин «фармацевтически приемлемый носитель» в данном контексте включает любые и все растворители, дисперсионные среды, покрытия, антибактериальные, изотонические и задерживающие всасывание агенты, буферы, наполнители, связующие вещества, смазывающие вещества, гели, поверхностно-активные вещества и т.п., которые могут быть использованы в качестве сред для фармацевтически приемлемого вещества.
[76] Таким образом, изобретение также включает фармацевтические композиции, содержащие в качестве активного ингредиента L.paracasei СВА L74 или один или несколько метаболитов, продуцируемых L.paracasei СВА L74, описанных здесь, в комбинации с одним или несколькими фармацевтически приемлемыми носителями. В некоторых вариантах осуществления L.paracasei СВА L74 может подвергаться стерилизации с использованием обычных методов стерилизации до или после соединения с фармацевтически приемлемым носителем. При изготовлении композиций в соответствии с изобретением L.paracasei СВА L74 или один или несколько метаболитов, продуцируемых L.paracasei СВА L74, обычно смешивают с наполнителем, разбавляют наполнителем или заключают в такой носитель в виде, например, капсулы, таблетки, саше, бумаги, или другого контейнера. Когда наполнитель выполняет функцию разбавителя, это может быть твердый, полутвердый или жидкий материал (напр., физиологический раствор), который действует как среда-наполнитель, носитель или среда для активного ингредиента. Таким образом, композиции могут быть в форме таблеток, пилюль, порошков, лепешек, саше, крахмальных облаток, эликсиров, суспензий, эмульсий, растворов, сиропов, аэрозолей (как твердое вещество или в жидкой среде), мазей, мягких и твердых желатиновых капсул, суппозиториев, стерильных растворов для инъекций и стерильных упакованных порошков. Как известно в данной области техники, тип разбавителя может варьироваться в зависимости от предполагаемого способа введения. Получаемые в результате композиции могут включать дополнительные агенты, такие как консерванты. Наполнитель или носитель выбирают на основании режима и способа введения. Пригодные фармацевтические носители, а также фармацевтические необходимые составляющие для использования в фармацевтических составах описаны в Remington's Pharmaceutical Sciences [Фармацевтические науки Ремингтона] (Е.W. Martin), известный текст для ссылок в данной области, и в USP/NF (United States Pharmacopeia and the National Formulary) [Фармакопея и Национальный формуляр США]. Некоторые примеры пригодных наполнителей включают лактозу, декстрозу, сахарозу, сорбит, маннит, крахмалы, аравийскую камедь, фосфат кальция, альгинаты, трагакант, желатин, силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, воду, сироп и метилцеллюлозу. Составы могут дополнительно включать: смазьтающие агенты, такие как тальк, стеарат магния и минеральное масло; смачивающие агенты; эмульгирующие и суспендирующие агенты; консерванты, такие как метил- и пропилгидрокси-бензоаты; подсластители; а также вкусовые добавки. Фармацевтические композиции могут быть составлены таким образом, чтобы обеспечивалось быстрое, замедленное или отсроченное высвобождение активного ингредиента после введения пациенту с помощью процедур, известных в данной области.
[77] Фармацевтически приемлемые композиции для применения в представленных способах, включая те, в которых L.paracasei СВА L74 или один или несколько метаболитов, продуцируемых L.paracasei СВА L74, заключены в коллоид для пероральной доставки, можно получать по стандартым методикам. L.paracasei СВА L74 или один или несколько метаболитов, продуцируемых L.paracasei СВА L74, можно высушивать и прессовать путем перемалывания или измельчения в порошок и вставлять в капсулу для перорального приема. В некоторых вариантах осуществления L.paracasei СВА L74 или один или несколько метаболитов, продуцируемых L.paracasei СВА L74, можно соединять с одним или несколькими наполнителями, например, разрыхлителем, заполнителем, глидантом или консервантом. Пригодные капсулы включают капсулы с твердой оболочкой или капсулы с мягкой оболочкой. Для формирования капсулы можно использовать любой коллоид на основе липидов или на основе полимеров. Иллюстративные полимеры, используемые для коллоидных препаратов, включают желатин, полисахариды растений или их производные, такие как каррагинаны, и модифицированные формы крахмала и целлюлозы, напр., гипромеллоза. При желании, в раствор гелеобразующего агента могут быть добавлены другие ингредиенты, например пластификаторы, такие как глицерин и/или сорбит для уменьшения твердости капсулы, красители, консерванты, разрыхлители, смазывающие вещества и обработка поверхности капсулы. В некоторых вариантах осуществления капсула не содержит желатин. В других вариантах осуществления капсула не содержит растительные полисахариды или их производные.
[78] Независимо от их первоначального источника или способа получения, L.paracasei СВА L74 или один или несколько метаболитов, продуцируемых L.paracasei СВА L74, можно получать составы в соответствии с их применением. Такие композиции можно приготовить хорошо известным в фармацевтической области способом и можно вводить разными путями в зависимости от того, требуется местное или системное лечение, а также от области, подлежащей лечению. Введение может быть пероральным или местным (включая офтальмологическое и в слизистые оболочки, включая интраназальную, вагинальную и ректальную доставку). В некоторых вариантах осуществления введение может быть пульмональным (напр., путем ингаляции или инсуффляции порошков или аэрозолей, в том числе с помощью распылителя; интратрахеально, интраназально, трансдермально и эпидермально) или офтальмологическим. Способы офтальмологической доставки могут включать местное введение (глазные капли), субконъюнктивальную, периокулярную инъекцию или инъекцию в стекловидное тело или введение баллонного катетера или офтальмологических вставок, которые помещаются хирургическим путем в конъюнктивальный мешок. Парентеральное введение включает внутривенную, внутриартериальную, подкожную, внутрибрюшинную или внутримышечную инъекцию или вливание; или внутричерепное, напр., интратекальное или интравентрикулярное введение. Парентеральное введение может быть в виде разовой болюсной дозы или может быть, например, выполнено с помощью насоса непрерывной перфузии. Фармацевтические композиции и составы для местного введения могут включать трансдермальные пластыри, мази, лосьоны, кремы, гели, капли, суппозитории, спреи, жидкости, порошки и т.п. Необходимыми или желательными могут быть обычные фармацевтические носители, водные, порошковые или масляные основы, загустители и т.п.
[79] Композиции могут быть приготовлены в виде стандартной дозы, каждая доза содержит, например, от примерно 0,005 мг до примерно 2000 мг L.paracasei СВА L74 или одного или нескольких метаболитов, продуцируемых L.paracasei СВА L74, на каждую суточную дозу. В некоторых вариантах осуществления композиции могут содержать эквивалент примерно 102, примерно 103, примерно 104, примерно 105, примерно 106, примерно 107, примерно 108, примерно 109, примерно 1010, примерно 1011 и примерно 1012 КОЕ/мл L.paracasei СВА L74. Термин «стандартные дозы» относится к физически дискретным единицам, пригодным в качестве единичных дозировок для человека и других млекопитающих, причем каждая единица содержит заданное количество активного материала, рассчитанного на получение желаемого терапевтического эффекта, в сочетании с пригодным фармацевтическим наполнителем. Для приготовления твердых композиций, например таблеток, основной активный ингредиент смешивают с фармацевтическим наполнителем с образованием твердой композиции до придания ей лекарственной формы, содержащей однородную смесь соединения в соответствии с настоящим изобретением. Если рассматривать эти предварительные композиции как однородные, активный ингредиент обычно равномерно распределяется по всей композиции, так что композицию можно легко разделить на одинаково эффективные стандартные дозы, такие как таблетки, пилюли и капсулы. Такой твердый предварительный состав затем разделяется на стандартные дозы описанного выше типа, содержащие от, например, 0,005 мг до примерно 1000 мг L.paracasei СВА L74 или одного или нескольких метаболитов, продуцируемых L.paracasei СВА L74, в соответствии с настоящим изобретением.
[80] Композиции могут быть составлены в виде стандартной дозы, причем каждая доза содержит, например, от примерно 0,1 мг до примерно 50 мг, от примерно 0,1 мг до примерно 40 мг, от примерно 0,1 мг до примерно 20 мг, от примерно 0,1 мг до примерно 10 мг, от примерно 0,2 мг до примерно 20 мг, от примерно 0,3 мг до примерно 15 мг, от примерно 0,4 мг до примерно 10 мг, от примерно 0,5 мг до примерно 1 мг; от примерно 0,5 мг до примерно 100 мг, от примерно 0,5 мг до примерно 50 мг, от примерно 0,5 мг до примерно 30 мг„ от примерно 0,5 мг до примерно 20 мг, от примерно 0,5 мг до примерно 10 мг, от примерно 0,5 мг до примерно 5 мг; от примерно 1 мг до от примерно 50 мг, от примерно 1 мг до примерно 30 мг„ от примерно 1 мг до примерно 20 мг, от примерно 1 мг до примерно 10 мг, от примерно 1 мг до примерно 5 мг; от примерно 5 мг до примерно 50 мг, от примерно 5 мг до примерно 20 мг, от примерно 5 мг до примерно 10 мг; от примерно 10 мг до примерно 100 мг, от примерно 20 мг до примерно 200 мг, от примерно 30 мг до примерно 150 мг, от примерно 40 мг до примерно 100 мг, от примерно 50 мг до примерно 100 мг активного ингредиента.
[81] В некоторых вариантах осуществления таблетки или пилюли в соответствии с настоящим изобретением могут иметь покрытие или иным образом составлены для получения лекарственной формы, обеспечивающей пролонгированное действие. Например, таблетка или пилюля может содержать внутренний дозированный и наружный дозированный компонент, причем последний в виде оболочки поверх первого. Два компонента могут быть разделены энтеросолюбильным слоем, который предназначен для защиты от разрушения в желудке и чтобы внутренний компонент поступал неповрежденным в двенадцатиперстную кишку или чтобы обеспечивалось его отсроченное высвобождение. Для таких энтеросолюбильных слоев или покрытий могут использоваться различные материалы, включающие многие полимерные кислоты и смеси полимерных кислот с такими материалами, как шеллак, цетиловый спирт и ацетат целлюлозы.
[82] Жидкие формы, в которые композиции по настоящему изобретению могут быть включены для введения перорально или путем инъекции, включают водные растворы, надлежащим образом ароматизированные сиропы, водные или масляные суспензии и ароматизированные эмульсии с пищевыми маслами, такими как хлопковое масло, кунжутное масло, кокосовое масло или арахисовое масло, а также эликсиры и подобные фармацевтические носители.
[83] Пропорция или концентрация композиций в соответствии с изобретением в фармацевтической композиции может варьироваться в зависимости от ряда факторов, включающих дозировку, химические характеристики (напр., гидрофобность), и от способа введения. Например, L.paracasei СВА L74 или один или несколько метаболитов, продуцируемых L.paracasei СВА L74, в соответствии с изобретением могут изготавливаться в виде капсулы, содержащей от примерно 0,005 мг до примерно 1000 мг для перорального введения.
Способы применения
Связанные с глютеном растройства
[84] Композиции, предлагаемые в настоящем изобретении, в целом и в отдельности пригодны для лечения связанных с глютеном расстройств. Субъекты, на которых такое лечение оказывает благоприятное воздействие, включают тех, кто испытывает или имеет повышенный риск токсичных эффектов при приеме внутрь глютеновых и родственных глютену полипептидов. Такие токсические эффекты могут охватывать широкий спектр симптомов, включая, но не ограничиваясь этим, воспаление, аутоиммунные реакции, желудочно-кишечные симптомы, такие как диарея, стеаторея, вздутие живота, потеря веса, анемия, остеопороз, артрит, бесплодие, периферическая невропатия, печеночная недостаточность и депрессия. Токсичность пептидов глиадина может обусловливаться цитотоксическими или иммунологическими механизмами или комбинацией цитотоксических и иммунологических механизмов. Симптом токсичности пептидов глиадина может включать воспаление, аутоиммунные реакции, желудочно-кишечные симптомы, такие как диарея, стеаторея, вздутие живота, потеря веса, анемия, остеопороз, артрит, бесплодие, периферическая невропатия, печеночная недостаточность и депрессия. Связанные с глютеном расстройства включают целиакию, в том числе различные подтипы, напр., классическую целиакию, атипичную целиакию, скрытую целиакию и молчащую целиакию, дерматит герпетиформный, глютеновую атаксию и чувствительность к глютену
[85] Подтипы целиакии включают классическую целиакию, атипичную целиакию, скрытую целиакию и молчащую целиакию. Классическими симптомами, ассоциированными с целиакией, являются диарея, вздутие живота и задержка в развитии. Эти симптомы чаще всего наблюдаются у детей в возрасте от 6 до 24 месяцев. Атипичная целиакия характеризуется умеренными желудочно-кишечными симптомами. Это связано с внекишечными проявлениями, такими как железодефицитная анемия, остеопороз, небольшой рост, артрит, бесплодие, периферическая невропатия, гипертрансаминаземия и, в некоторых случаях, печеночная недостаточность на момент постановки диагноза. Скрытая целиакия относится к пациентам, у которых присутствуют HLA-DQ2 и/или HLA-DQ8, с или без положительной серологии, и у которых до этого времени не развилась атрофия ворсинок, но может быть умеренное воспаление или иммунная активация. Пациенты в этой субпопуляции могут быть асимптоматичными или могут иметь внекишечные проявления. Молчащая целиакия характеризуется положительной серологией и атрофией ворсинок у в других отношениях асимптоматичного пациента. После проведения безглютеновой диеты некоторые бессимптомные пациенты замечают улучшение различных физических и психологических аспектов жизни, таких, как повышение аппетита, снижение усталости или сокращение числа поведенческих отклонений. Независимо от подтипа, многие случаи целиакии протекают нераспознанными, что подвергает пациентов риску долгосрочных осложнений, например, бесплодия и злокачественных опухолей, например, лимфомы и рака кишечника.
[86] Проявление целиакии может варьироваться в широких пределах. Целиакия обычно проявляется у детей в виде задержки в развитии, ассоциированной с классическими симптомами мальабсорбции: преимущественно потеря веса, стеаторея и ряд дефицитов, хотя могут присутствовать другие внекишечные симптомы, например, задержка в развитии осевого скелета и задержка менструаций у девочек.
[87] Распространенность целиакии возрастает в условиях риска, таких, как семейный анамнез целиакии, аутоиммунные заболевания, дефицит иммуноглобулина А, некоторые генетические синдромы (синдром Дауна, синдром Тернера и синдромы Уильяма) и особенно диабет 1 типа и тиреоидит.
[88] Важную роль в целиакии играет генетическая предрасположенность. Целиакия прочно связана со специфическими генами человеческого лейкоцитарного антигена класса II (HLA), HLA-DQ2 и HLA-DQ8, расположенными на хромосоме 6р21. Большинство пациентов с целиакией (примерно 95%) экспрессируют гены, кодирующие белок HLA-DQ2 главного комплекса гистосовместимости (МНС) класса II. Остальные пациенты, как правило, HLA-DQS-положительны. HLA-DQ2 гаплотип является общим и присутствует примерно у 30% жителей Кавказа, что предполагает, что присутствие HLA-DQ2 и/или HLA-DQ8 является необходимым для развития болезни, но не достаточно само по себе, поскольку его эффект оцененного риска составляет только 36% - 53%. Гены non-HLA также содействуют предрасположенности к целиакии.
[89] Диагностика целиакии обычно опирается на ряд критериев, включая: 1) проявление с симптомами типичной целиакии; 2) положительность серологических тестов, в том числе, например, высокий титр IgA антител к tTG (анти-tTG), высокий титр антител к дезамидированым пептидам α-глиадина; 3) генотипы HLA-DQ2 и/или HLA-DQ8; 4) энтеропатия целиакии, обнаруженная на биопсии тонкого кишечника; и 5) реакция на безглютеновую диету. Широкий диапазон проявления целиакии побудило некоторых врачей к принятию количественного подхода, определяемого как «четыре из пяти правил». То есть диагноз целиакии подтверждается, если выполняются по меньшей мере четыре из пяти критериев.
[90] Герпетиформный дерматит - это кожное проявление целиакии в виде пузырчатой сыпи и патогномоничных отложений IgA в коже. Преобладающими симптомами являются сильный зуд и жжение. Сыпь имеет характерное симметричное распределение. Локти и верхняя часть предплечий поражаются более чем у 90% пациентов. Другими обычно вовлеченными местами являются ягодицы, колени, плечи, крестец, лицо, голова, шея и туловище. Атрофия ворсинок брюшного типа в верхней слизистой оболочке тонкой кишки обнаруживается у 65% - 75% пациентов с герпетиформным дерматитом. Даже у пациентов с явно нормальной биопсией трудно уловимые изменения в слизистой оболочке, такие как увеличение количества интраэпителиальных лимфоцитов, указывают на чувствительность к глютену. Пациенты с герпетиформным дерматитом могут демонстрировать такой же набор проявлений, ассоциированных расстройств и осложнений, как и больные целиакией (аутоиммунные заболевания, железодефицитная анемия, остеопороз и злокачественные опухоли). Пациентов с герпетиформным дерматитом, как правило, держат на безглютеновой диете, потому что сыпь герпетиформного дерматита чувствительна к глютену.
[91] Глютеновая атаксия была определена как иная идиопатическая спорадическая атаксия с положительными серологическими маркерами по чувствительности к глютену. Подобно целиакии, она является аутоиммунным заболеванием, характеризующимся повреждением мозжечка, приводящем к атаксии. Пациенты с глютеновой атаксией, как правило, имеют высокий титр антиглиадиновых антител. У пациентов с глютеновой атаксией отложение антител трансглутаминазы с широким разбросом было обнаружено вокруг сосудов головного мозга. Глютеновая атаксия обычно проявляется простой мозжечковой атаксией или, реже, атаксией в сочетании с миоклонусом, небным тремором или глазным миоклонусом. Глютеновая атаксия, как правило, имеет постепенное развитие в среднем возрасте после 53 лет. У многих пациентов проявление э нтеропатии обнаруживается на биопсии кишечника. Пациентов, положительных к анти-глиадиновым антителам или анти-tTG антителам при отсутствии альтернативной причины для атаксии, как правило, держат на строгой безглютеновой диете при регулярном последующем врачебным наблюдении.
[92] Чувствительность к глютену, также известная как нецелиакийная чувствительность к глютену или непереносимость глютена, как правило, характеризуется как функциональное, морфологическое и иммунологическое расстройство, при полном отсутствии всех признаков целиакии, но, тем не менее, реагирующее на исключение глютена. Чувствительность к глютену отличается от целиакии и не сопровождается анти-tTG аутоантителами или другими аутоиммунными сочетанными заболеваниями. Тонкий кишечник у пациентов с чувствительностью к глютену, как правило, в норме. Симптомы чувствительности к глютену могут напоминать симптомы, ассоциированные с целиакией, но с преобладанием внекишечных симптомов, таких как поведенческие изменения, боли в костях или в суставах, мышечные судороги, онемение ног, потеря веса и хроническая усталость. Не существует лабораторных биомаркеров, специфичных в отношении чувствительности к глютену. Обычно диагностика основывается на критериях исключения; элиминационная диета в отношении глютенсодержащих продуктов с последующей открытой пищевой провокацией (т.н. тест «open challenge») чаще всего используется для оценки, улучшается ли здоровье при исключении или уменьшении глютена из рациона пациента или нет.
Способы лечения
[93] Лечение субъекта считается эффективным, когда наступает клинически благоприятный результат. Это может означать, например, полное прекращение симптомов, ассоциированных со связанным с глютеном расстройством, уменьшение тяжести симптомов, ассоциированных со связанным с глютеном расстройством, или замедление прогрессирования симптомов, ассоциированных со связанным с глютеном расстройством. Эти способы могут также включать стадии а) идентификации субъекта (например, пациент и, более конкретно, пациент-человек), у которого имеется связанное с глютеном расстройство; и b) предоставление субъекту композиции, содержащей L.paracasei СВА L74 или один или несколько метаболитов L.paracasei СВА L74, описанных здесь, например, любой ферментированный пищевой продукт или композиция, содержащая L.paracasei СВА L74, в физиологически приемлемом носителе. Количество такой композиции, предоставленной субъекту, которое приводит к полному прекращению симптомов, ассоциированных со связанным с глютеном расстройством, уменьшению тяжести симптомов, ассоциированных со связанным с глютеном расстройством, или замедлению прогрессирования симптомов, ассоциированных со связанным с глютеном расстройством, считается терапевтически эффективным количеством. Данные способы также могут включать стадию мониторинга для оптимизации дозирования и планирования, а также прогнозирования исхода.
[94] Способы, описанные здесь, могут применяться к широкому кругу видов, напр., люди, не являющихся человеком приматы (напр., обезьяны), лошади, свиньи, коровы или другие домашние животные, собаки, кошки или другие млекопитающие, содержащиеся как домашние животные, крысы, мыши или другие лабораторные животные. Композиции, описанные здесь, могут быть полезны в терапевтических композициях и схемах или для изготовления лекарственного средства для применения в лечении состояний, описанных здесь (напр., связанные с глютеном расстройства.)
[95] Композиции, описанные здесь, могут назначаться для перорального приема в рамках обычного ежедневного рациона пациента. Пищевые композиции можно вводить в виде дополнительного питания как детям, так и взрослым. После приготовления в виде фармацевтических препаратов, композиции можно вводить в любую часть тела хозяина для последующей доставки в клетки-мишени. Композиция может быть доставлена, без ограничения, в мозг, спинномозговую жидкость, суставы, слизистую оболочку носа, кровь, легкие, кишечник, мышечные ткани, кожу или в брюшную полость млекопитающего. С точки зрения маршрутов доставки композицию можно вводить путем внутривенной, внутричерепной, внутрибрюшинной, внутримышечной, подкожной, внутримышечной, ректальной, интравагинальной, интратекальной, внутритрахиальной, внутрикожной или чрескожной инъекции, путем перорального или назального введения или путем постепенной перфузии в течение длительного периода времени. В другом примере, аэрозольный препарат композиции может быть предоставлен хозяину путем ингаляции.
[96] Независимо от того, приготовлены композиции в виде продуктов питания или в виде лекарственных средств, требуемая дозировка будет зависеть от пути введения, природы состава, характера состояния субъекта, напр., недоразвитие иммунной системы или желудочно-кишечное нарушение, размера, веса, площади поверхности, возраста и пола субъекта, других вводимых лекарств, а также решения лечащих врачей. Приемлемые дозы находятся в интервале от 0,01-1000 мг/кг. Некоторые типичные диапазоны доз составляют от примерно 1 μг/кг до примерно 1 г/кг массы тела в день. В некоторых вариантах осуществления доза составляет от примерно 0,01 мг/кг до около 100 мг/кг веса тела в день. В некоторых вариантах осуществления доза может быть, например, 1 мг/кг, 2 мг/кг, 5 мг/кг, 10 мг/кг, 20 мг/кг, 50 мг/кг или 100 мг/кг. Дозировка может зависеть от таких переменных, как тип и степень прогрессирования заболевания или расстройства, общего состояния здоровья конкретного пациента, относительной биологической эффективности выбранного соединения, состава наполнителя и пути введения.
[97] Эффективные дозы могут быть экстраполированы из кривых доза-ответ, полученных из тест-систем in vitro или животной модели. Например, может быть полезным исследование воздействия на проникновение в клетку пептидов глиадина в клеточных анализах. Композиции также можно исследовать на воздействие на иммунный ответ, продуцирование цитокинов и Т-клеточные ответы.
[98] Следует предполагать широкие вариации необходимых доз, принимая во внимание спектр симптомов, ассоциированных со связанными с глютеном расстройствами, различные клеточные мишени и разную эффективность различных путей введения. Вариации этих уровней дозировки можно корректировать, используя стандартные эмпирические процедуры для оптимизации, как это хорошо известно в данной области техники. Введение может быть одноразовым или многоразовым (например, 2- или 3-, 4-, 6-, 8-, 10-, 20-, 50-, 100-, 150-, или более раз). Инкапсуляция соединений в подходящем носителе для доставки (напр., полимерные микрочастицы или имплантируемые устройства) может повысить эффективность доставки.
[99] Продолжительность лечения любой композиции, представленной здесь, может занимать любой период времени от максимально короткого один день и на протяжении продолжительности жизни хозяина (напр., в течение многих лет). Например, композицию можно вводить один раз в неделю (в течение, например, 4 недель до многих месяцев или лет); один раз в месяц (например, от трех до двенадцати месяцев или в течение многих лет); или один раз в год в течение периода 5 лет, десять лет или больше. Следует также отметить, что частота лечения может быть переменной. Например, предлагаемые композиции можно вводить один раз (или два раза, три раза, и т.д.) ежедневно, еженедельно, ежемесячно или ежегодно.
[100] Любой способ, известный в данной области, может быть использован для определения, индуцируется или нет конкретный ответ. Для определения, индуцируется или нет конкретный ответ, могут использоваться клинические методы, которые могут оценить степень конкретного состояния заболевания. Например, мониторинг субъекта может осуществляться в отношении облегчения симптомов, напр., избавление от диареи, боли в животе, спазмов, вздутия живота, и способность переносить провокационную пробу глютена. Альтернативно или в дополнение могут использоваться сывороточные маркеры, методы визуализации, напр., ультразвук, рентгенограмма и эндоскопические методы.
[101] Композиции можно также вводить в сочетании с другими терапевтическими методиками. Эти терапевтические методики будут варьироваться в зависимости от конкретного расстройства, но могут включать, например, диетические средства, такие как безглютеновая диета. В некоторых вариантах осуществления диетические средства могут включать введение продуктов из пшеницы из штаммов, которые были разработаны с помощью селекционного разведения или рекомбинантных технологий для экспрессии форм глиадина, которые уменьшили количество токсичных Т-клеточных эпитопов. В некоторых вариантах осуществления диетическое средство может включать введение пребиотика, т.е. вещества, которое стимулирует рост или активность одного или нескольких видов кишечной флоры, полезных для здоровья хозяина. Примеры пребиотиков включают транс-галактоолигосахарид, инулин, фруктоолигосахариду и лактулозу.
[102] Другие терапевтические методики включают введение терапевтического агента. Терапевтический агент может представлять собой фермент, например эндопептидазу (также упоминается как глютеназа), который разрушает глютен, нацеливаясь на пролин-богатые пептиды, которые иначе противостоят природным протеазам организма и содержат высоко иммуногенные пептиды. Иллюстративные эндопептидазы включают пролилэндопептидазы и ALV003, комбинацию цистеин эндопротеазы, полученной из прорастающих семян ячменя, и пролил эндопептидазы из сфингомонаса капсулированного [Sphingomonas capsulate].
[103] Другие терапевтические агенты включают ингибиторы повышенной кишечной проницаемости, типичной для целиакии, например, AT-1001 (ларазотид) октапептидный ингибитор парацеллюлярной проницаемости, который ингибирует глиадин-индуцированную цитоскелетную реаранжировку интестинальных эпителиальных клеток, разборку плотного контакта и пиковое приращение F-актина. Другие терапевтические агенты включают ингибиторы tTG, модуляторы иммуной системы и терапию десенсибилизации с вакцинами на основе пептидов (Newax2).
[104] При одновременном введении двух или более терапевтических агентов не требуется, чтобы агенты вводились в одно и то же время или по одному и тому же пути, поскольку существует частичное совпадение периода времени, в течение которого агенты оказывают свое терапевтическое действие. Одновременное или последовательное введение предполагается как введение в разные дни или недели.
Изделия
Композиции, описанные здесь, также можно собирать в наборы вместе с инструкцией по применению. Например, наборы могут включать дозированные количества композиции, включающей один или несколько пищевых продуктов, ферментированных L.paracasei СВА L74. Инструкции по применению могут предоставляться на любых подходящих носителях. Например, они могут быть напечатаны на бумажном вкладыше на одном или нескольких языках или поставляться в звуковом или визуальном варианте (напр., на компакт-диске). Материалы для упаковки могут включать упаковочные материалы, например, флаконы, пакеты, контейнеры. В некоторых вариантах осуществления наборы могут включать дозированные количества композиции, содержащей L.paracasei СВА L74, в физиологически приемлемом носителе вместе с упаковочными материалами и инструкциями по применению в любом формате или в форматах, описанных выше. В некоторых вариантах осуществления наборы могут включать дозированные количества композиции, содержащей один или несколько метаболитов L.paracasei СВА L74. В некоторых вариантах осуществления композиции могут исключать клетки L.paracasei СВА L74, т.е. метаболиты могут быть частично или в основном отделены от клеток L.paracasei СВА L74. Компоненты в наборе могут быть пригодны для немедленного применения. Тем не менее, изобретение охватывает наборы, которые включают концентрированные составы и/или материалы, требующие разбавления перед применением.
Примеры
Пример 1: Материалы и способы
[105] Пептиды: α-глиадин Р31-Р43 (SEQ ID NO.: 1)и Р57-68 (SEQ ID NO.: 2) были синтезированы in vitro и связаны с флуорохромом, лиссамином, фирма Inbios, Неаполь, Италия. Хроматографические анализы показали, что пептиды имели чистоту 99%.
[106] Анализ на проникновение пептида Сасо2: Культуры клеток Сасо2, линия клеток эпителиальной раковой опухоли толстой кишки человека, инкубировали с мечеными пептидами в течение 15 минут. Меченые пептиды удалили путем многократной промывки и клетки исследовали под конфокальным микроскопом. Морфологический анализ показал, что после 15 минут инкубации меченые пептиды попадали в клетки и локализовались в эндоцитозных пузырьках, которые появились в виде маленьких цветных пятен. Количественный анализ проводили с использованием специализированного программного пакета, который оценил интенсивность флуоресценции множественных микроскопических полей.
[107] Культура клеток Сасо2: Клетки Сасо-2 были выращены в модифицированной по способу Дульбекко среде Игла (DMEM) (GIBCO, Сан-Джулиано-Миланезе, Италия), 10% фетальной бычьей сыворотке (FBS) (GIBCO, Сан-Джулиано-Миланезе, Италия) и 1 мМ глутамина (GIBCO, Сан-Джулиано-Миланезе, Италия), в инкубаторе при температуре 37°С при концентрации СО2 5%.
[108] Культура L.paracasei СВА L74: L.paracasei СВА L74 (инвентарный номер LMG Р-24778 в Международном депозитарии) была выделена, как описано в заявке WO 2012/177556, которая включена в данном документе по ссылке в полном объеме. Клетки выращивали в 50 мл среды DMEM с добавлением FBS и Glu в течение ночи при 37°С при 160 колебаний в минуту. Бактериальную концентрацию измеряли спектрофотометрически в спектрофотометре Бекман DU-7 при длине волны 600 нм. Показание оптической плотности (OD) использовали для расчета концентрации бактерий следующим образом: OD2=1,5×109 КОЕ/мл. Различные бактериальные концентрации, используемые для экспериментов, были получены разбавлением бактериальной культуры в свежей среде без антибиотика. Для экспериментов с использованием только супернатанта, бактериальную культуру центрифугировали при 3000 об/мин в течение 10 минут при комнатной температуре. Супернатант извлекли и профильтровали через фильтр с размером пор 0,2 микрон.
[109] Пептиды глиадина и EGF-Alexa-488: Синтетические пептиды (Inbios, чистота 95%, анализ MALDI-Toff, как и предполагалось) были получены фильтрацией Ultrasart-D20 (Sartorius AG, Геттинген, Германия). Пептид Р31-43 имел аминокислотную последовательность: LGQQQPFPPQQPY (SEQ ID NO.: 1). Пептид Р57-68 имел аминокислотную последовательность: QLQPFPQPQLPY (SEQ ID NO.: 1). Пептиды были конъюгированы лиссамином, красным флуорохромом, возбужденным HeNel лазером (543 нм) с эмиссией в диапазоне сверхвысоких частот 610 нм. EGF-Alexa-488 получен от Molecular Probes, Сан-Джулиано-Миланезе, Италия.
[110] Флуоресцентный анализ: Авторами выполнена проверка действия L.paracasei СВА L74 на проникновение пептидов глиадина или EGF-Alexa в клетки Сасо-2. Клетки Сасо2 выраптивали на стерильных покровных стеклах, переносили в 24-луночные планшеты и обрабатывали различными концентрациями L.paracasei СВА L74, в диапазоне от 104 до 108 КОЕ/мл. Для экспериментов, в которых использовали не содержащий клетки супернатант, клетки Сасо2 обрабатывали с помощью L.paracasei СВА L74, супернатант собрали от культур L.paracasei СВА L74, которые достигли плотности 108 КОЕ/мл. Супернатант использовали свежий или после воздействия тепла. В некоторых экспериментах супернатант нагревали при 80°С в течение 15 минут. В других экспериментах супернатант кипятили в течение 5 минут. Клетки Сасо2 обрабатывали различными бактериальными препаратами в атмосфере 5% СО2 при 37°С в течение 30 минут, а затем инкубировали с пептидами глиадина Р31-43-лиссамин (liss) или P57-68liss или с EGF-Alexa-488. Концентрации пептидов были следующие: P31-43liss и P57-68liss при 20 микрограмм/мл: немеченые пептиды использовали при концентрации 50 микрограмм/мл; EGF-Alexa-488 при концентрации 10 микрограмм/мл. После добавления пептидов клетки инкубировали в атмосфере 5% CO2 при 37°С в течение 30 минут. Затем среду удаляли путем трех промывок в среде PBS IX (Gibco). Покровные стекла фиксировали в течение короткого периода (5 минут) параформальдегидом 3% (Sigma-Aldrich) при комнатной температуре, а затем устанавливали и обследовали с помощью конфокального микроскопа (LSM 510 Zeiss). Изображения были получены и проанализированы с помощью программного обеспечения AIS Zeiss для оценки интенсивности флуоресценции исследуемого микроскопического поля. Увеличение микрофотографий было одинаковым для всех показанных чертежах (63х объектив). Меченые пептиды и EGF-Alexa оказались в эндоцитозных пузырьках, которые появляются в виде маленьких точек, окрашенных в красный цвет (пептиды) или в зеленый цвет (EGF).
[111] Статистический анализ: Статистический анализ и графики были получены от GraphPad Prism. Были рассчитаны средние и стандартные отклонения. Они оценивались по тесту Стьюдента. Результаты со значениями р<0,05 считались значимыми.
Пример 2: Влияние живых L.paracasei СВА L74 на проникновение пептида α-глиадина
[112] Живые L.paracasei СВА L74 уменьшили проникновение как Р31-43, так и Р57-68 в клетки СаСо2. На Фиг. 1 показаны конфокальные флюоресцентные изображения. Контрольные клетки (левые секции), которые инкубировали с меченым лиссамином Р31-43 в отсутствие L.paracasei СВА L74, показали разные профили флуоресценции, которые соответствовали Р31-43, содержащего эндоцитотические пузырьки (белые стрелки). В отличие от этого, флуоресценция была снижена в клетках, которые были инкубированы меченым лиссамином Р31-43 в присутствии L.paracasei СВА L74 (правые секции).
[113] Количественный анализ показал, что действие L.paracasei СВА L74 на проникновение Р31-43 зависело от дозы и было статистически значимым. На Фиг. 2 показаны результаты пяти независимых экспериментов на дублирующих образцах. Интенсивность флуоресценции рассчитали для 30 случайных полей в каждом образце. Как показано на Фиг. 2, обработка клеток СаСо2 с помощью 104, 106 и 108 L.paracasei СВА L74 привела к статистически значимому, дозозависимому уменьшению проникновения Р31-43.
[114] Аналогичное действие наблюдалось в отношении пептида Р57-68. Эксперимент, показанный на Фиг. 3, проводили точно так же, как и эксперимент на Фиг. 2, за исключением того, что вместо Р31-43 был использован Р57-68. Как показано на Фиг. 3, обработка клеток СаСо2 с помощью 104, 106 и 108 L.paracasei СВА L74 привела к статистически значимому, дозозависимому уменьшению проникновения Р57-68.
Пример 3: Действие выделенной ДНК L.paracasei СВА L74 на проникновение пептида α-глиадина
[115] ДНК из L.paracasei СВА L74 была извлечена и очищена с помощью стандартных способов. Как показано на Фиг. 4, обработка клеток СаСо2 с помощью Р31-43 в присутствии количества ДНК L.paracasei СВА L74, эквивалентного 108 клеткам, не блокировала проникновение пептида.
Пример 4: Действие супернатанта культуры L.paracasei СВА L74 на проникновение пептида α-глиадина
[116] Супернатант культуры L.paracasei СВА L74 собрали центрифугированием и культуральный супернатант профильтровали для удаления живых бактерий и клеточного дебриса. Супернатант от эквивалента 108 клеток нанесли на клетки СаСо2 в присутствии пептида Р31-43. Контрольные клетки CaCO2 обработали с помощью 108 живых клеток L.paracasei СВА L74. На Фиг. 5 приведены результаты четырех независимых экспериментов на дублирующих образцах. Интенсивность флуоресценции рассчитали для 30 случайных полей в каждом образце.
[117] Как показано на гистограмме на Фиг. 5а, обработка клеток СаСо2 живыми клетками L.paracasei СВА L74 снова привела к статистически существенному уменьшению проникновения пептида Р31-43. Обработка клеток СаСо2 супернатантом культуры L.paracasei СВА L74 привела к уменьшению такой же величины. Конфокальные изображения для данного эксперимента показаны на Фиг. 5b. Эти изображения наглядно демонстрируют, что супернатант культуры L.paracasei СВА L74 уменьшил проникновение пептида Р31-43.
[118] Результаты аналогичного эксперимента, в котором вместо Р31-43 был использован Р57-68, представлены на Фиг. 6. Обработка клеток СаСо2 живыми клетками L.paracasei СВА L74 снова привела к статистически значимому снижению проникновения пептида Р57-68 (Фиг. 6а). Обработка клеток СаСо2 супернатантом культуры L.paracasei СВА L74 привела к уменьшению такой же величины. Конфокальные изображения для данного эксперимента представлены на Фиг. 6b. Эти изображения наглядно показывают, что супернатант культуры L.paracasei СВА L74 уменьшил проникновение пептида Р57-68.
Пример 5: Действие термообработанного супернатанта культуры L.paracasei СВА L74 на проникновение пептида α-глиадина
[119] Супернатант культуры L.paracasei СВА L74 собирали в соответствии со способом из Примера 4 и затем нагревали в течение 30 минут либо при 37°, либо при 80°С в течение 30 минут. Нагретые супернатанты затем охладили и нанесли на клетки Сасо2 в присутствии Р31-43. На Фиг. 7 представлены результаты пяти независимых экспериментов на дублирующих образцах для контрольных клеток, не обработанных супернатантом, пяти независимых экспериментов на дублирующих образцах для контрольных клеток, обработанных неподогретым супернатантом («37°С») и двух независимых экспериментов на дублирующих образцах для клеток, прошедших обработку нагретым супернатантом («80°С»). Интенсивность флуоресценции рассчитали для 30 случайных полей в каждом образце. Как показано на Фиг. 7, нагретый до 80°С супернатант сохранил способность неподогретого супернатанта по блокировке проникновения пептида Р31-43 в клетки СаСо2. Конфокальные изображения для этого эксперимента показаны в правой секции Фиг. 7. Эти изображения наглядно демонстрируют, что термообработанный супернатант культуры L.paracasei СВА L74 уменьшил проникновение пептида Р31-43 в такой же степени, как и супернатант культуры L.paracasei СВА L74 без тепловой обработки. Взятые вместе, эти данные свидетельствуют о том, что действие супернатанта культуры L.paracasei СВА L74 не было результатом ферментативной активности.
Пример 6: Действие риса и овса, ферментированных L.paracasei СВА L74, на проникновение пептида α-глиадина
[120] Приготовили рис, ферментированный L.paracasei СВА L74.
Ферментированный рис, супернатант от ферментированного риса или термообработанный супернатант от ферментированного риса нанесли на клетки СаСо2 в присутствии пептида Р31-43 и проникновение пептида контролировали в соответствии со способом из Примера 2. Как показано на Фиг. 8, все три варианта - ферментированный рис, супернатант от ферментированного риса или термообработанный супернатант от ферментированного риса, уменьшили проникновение пептида по сравнению с необработанными клетками СаСо2. Как показано на Фиг. 9, уменьшение проникновения пептида Р31-43 в присутствии ферментированного риса было статистически значимым (правые столбцы). Аналогичное, статистически значимое действие наблюдалось в присутствии ферментированного овса (левые столбцы).
Пример 7: Действие риса и овса, ферментированных L.paracasei СВА L74, на проникновение декстран-техасского красного [Texas Red] в клетки СаСо2
[121] Приготовили ферментированные L.paracasei СВА L74 рис и овес. Как показано на Фиг. 10, инкубация клеток СаСо2 либо с ферментированным рисом, либо с ферментированным овсом приводила к статистически значимому уменьшению проникновения в клетки декстран- техасского красного по отношению к клеткам, которые были обработаны неферментированным рисом или овсом соответственно. Поскольку декстран, как правило, поглощается клетками через макропиноцитоз, эти данные свидетельствуют о том, что метаболиты L.paracasei СВА L74 могут блокировать макропиноцитозный путь.
Пример 8: Действие супернатанта культуры L.paracasei СВА L74 на проникновение эпидермального фактора роста (EGF) в клетки Сасо2
[122] Супернатант культуры L.paracasei СВА L74 собирали в соответствии со способом из Примера 4 и наносили на клетки Сасо2 в присутствии Alexa Fluor®-конъюгированного EGF (Invitrogen). Как показано на гистограмме на Фиг. 11, обработка клеток СаСо2 супернатантом культуры L.paracasei СВА L74 привела к статистически значимому уменьшению проникновения EGF в клетки. Конфокальные изображения по этому эксперименту представлены на Фиг. 12. Поскольку поглощение EGF требует связывания со специфическим рецептором, напр., с рецептором EGF, эти данные свидетельствуют о том, что метаболиты L.paracasei СВА L74 могут блокировать клатрин-опосредованный эндоцитозный путь.
Пример 9: Зависимое от концентрации действие L.paracasei СВА L74 на прникновение Р31-43 и Р57-68 в клетки Сасо2
[123] Клетки Сасо2 обработали с увеличением концентраций L.paracasei СВА L74 и затем инкубировали с пептидами глиадина P31-43liss или P57-68liss, как описано в Примере 1. Эндоцитозные пузырьки, которые содержали меченый Р31-43 или меченый Р57-68, появились в виде красных пятен с цитозольным распределением после 30 минут воздействия. Обработка клетками L.paracasei СВА L74 привела к дозозависимому уменьшению проникновения как Р31-43, так и Р57-68 в клетки Сасо-2. Как показано на Фиг. 13b, 13с и 13d, в отношении Р31-43, обработка с помощью 104, 106 и 108 КОЕ/мл L.paracasei СВА L74 соответственно привела к уменьшению интенсивности флуоресценции по сравнению с интенсивностью флуоресценции в необработанных контрольных клетках (Фиг. 13а). Белые стрелки обозначают пузырьки, содержащие P31-43liss. Эти результаты представлены количественно на Фиг. 14. Интенсивность флуоресценции рассчитали для 30 случайных полей для каждого образца. Данные на Фиг. 14 представляют пять независимых экспериментов. На гистограмме на Фиг. 14 сравнивается интенсивность флуоресценции для необработанных контрольных клеток («UN») с интенсивностью флуоресценции клеток, которые подвергались воздействию Р31-43liss в присутствии 104, 106 или 108 КОЕ/мл клеток L.paracasei СВА L74. Обработка L.paracasei СВА L74 привела к статистически значимому уменьшению интенсивности флуоресценции на 50%, 70% и 75%, соответственно, для 104, 106 или 108 КОЕ/мл клеток L.paracasei СВА L74 (***=р<0,001).
[124] Как показано на Фиг. 15b, 15с и 15d для P57-68liss, обработка с помощью 104, 106 и 108 КОЕ/мл L.paracasei СВА L74, соответственно, привела к уменьшению интенсивности флуоресценции по сравнению с интенсивностью флуоресценции в необработанных контрольных клетках (Фиг. 15а). Белые стрелки обозначают пузырьки, содержащие P57-68liss. Эти результаты представлены количественно на Фиг. 16. Интенсивность флуоресценции рассчитали для 30 случайных полей для каждого образца. Данные на Фиг. 16 представляют пять независимых экспериментов. На гистограмме на Фиг. 16 сравнивается интенсивность флуоресценции в отношении необработанных контрольных клеток («UN») с интенсивностью флуоресценции клеток, которые подвергались воздействию P57-68liss в присутствии 104, 106 или 108 КОЕ/мл клеток L.paracasei СВА L74. Обработка клетками L.paracasei СВА L74 привела к статистически значимому уменьшению интенсивности флуоресценции на 25%, 25% и 50% соответственно, для 104, 106 или 10 КОЕ/мл клеток L.paracasei СВА L74. Как показано на Фиг. 15b, 15c и 15d, для Р57-68, обработка с помощью 104, 106 и 108 КОЕ/мл L.paracasei СВА L74 привела к уменьшению интенсивности флуоресценции на 25%, 25% и 50%, соответственно, по сравнению с необработанными контрольными клетками (***=р<0,001).
[125] Как показано на Фиг. 17, обработка с помощью 108 КОЕ/мл L.paracasei СВА L74 уменьшила интенсивность флуоресценции на 75% в отношении Р31-43 и на 50% в отношении Р57-68. Эти данные свидетельствуют о том, что L.paracasei СВА L74 может быть более эффективным в уменьшении проникновения Р41-43, чем в уменьшении проникновения Р57-68, возможно, отражая различные эндоцитозные пути.
Пример 10: Зависимое от концентрации действие супернатанта L.paracasei СВА 174 на проникновение Р31-43 и Р57-68 в клетки Сасо2
[126] Клетки Сасо2 обработали супернатантом L.paracasei СВА L74 или ДНК L.paracasei СВА L74, как описано в Примере 1. Клетки Сасо2 инкубировали в течение 30 минут в супернатанте или ДНК из эквивалента 108 КОЕ/мл. Как показано на Фиг. 18b и 18с, обработка либо клетками L.paracasei СВА L74, либо супернатантом L.paracasei СВА L74, соответственно, привела к уменьшению интенсивности флуоресценции в клетках, подвергнутых воздействию Р31-43liss, по сравнению с тем, что наблюдается в необработанных контрольных клетках (Фиг. 18а). Эти результаты представлены количественно на Фиг. 19. Интенсивность флуоресценции рассчитали для 30 случайных полей для каждого образца. Данные на Фиг. 19 представляют пять независимых экспериментов. На гистограмме на Фиг. 19 сравнивается интенсивность флуоресценции для необработанных контрольных клеток («UN») с интенсивностью флуоресценции клеток, подвергнутых воздействию P31-43-liss в присутствии 108 КОЕ/мл клеток L.paracasei СВА L74 («LP 108») или супернатанта L.paracasei СВА L74 от культуры 108 КОЕ/мл L.paracasei СВА L74 («Sup LP 108»). Как показано на Фиг. 19, супернатант L.paracasei СВА L74 значительно уменьшил проникновение Р31-43 в клетки СаСо2, рассчитанное как снижение интенсивности флуоресценции, примерно на 25% по сравнению с необработанными контрольными клетками (***=р 0,001).
[127] Как показано на Фиг. 20b и 20с, обработка либо клетками L.paracasei СВА L74, либо супернатантом L.paracasei СВА L74, соответственно, привела к снижению интенсивности флуоресценции в клетках, подвергнутых воздействию P57-68liss, по сравнению с тем, что наблюдается в необработанных контрольных клетках (Фиг. 20а). Эти результаты представлены количественно на Фиг. 21. На гистограмме на Фиг. 21 сравнивается интенсивность флуоресценции для необработанных контрольных клеток («UN») с интенсивностью флуоресценции клеток, подвергнутых воздействию P57-681iss в присутствии 108 КОЕ/мл клеток L.paracasei СВА L74 («LP 108») или супернатанта L.paracasei СВА L74 («Sup LP 108») от культуры 108 КОЕ/мл L.paracasei СВА L74. Как показано на Фиг. 21, супернатант L.paracasei СВА L74 значительно уменьшил проникновение Р31-43 в клетки СаСо2, рассчитанное как снижение интенсивности флуоресценции, примерно на 40% по сравнению с необработанными контрольными клетками (***=р<0,001).
[128] В отличие от этого, обработка очищенной ДНК из L.paracasei СВА L74 не оказала никакого влияния на проникновение Р31-43 или Р57-68 в клетки СаСо2. Взятые вместе, эти данные свидетельствуют о том, что метаболит, отвечающий за уменьшение проникновения пептида, может секретироваться в бактериальный культуральный супернатант.
Пример 11: Влияние супернатанта L.paracasei СВА L74 на проникновение EGF-Alexa 488 в клетки Сасо2
[129] Клетки Сасо2 обработали супернатантом L.paracasei СВА L74 от культуры 108 КОЕ/мл L.paracasei СВА L74 с последующей инкубацией с EGF-Alexa 488 в течение 30 минут, как описано в Примере 1. Как показано на Фиг. 22b, обработка супернатантом L.paracasei СВА L74 привела к снижению интенсивности флуоресценции в клетках, подвергнутых воздействию EGF-Alexa 488, по сравнению с тем, что наблюдается в необработанных контрольных клетках (Фиг. 22а). Эти результаты представлены количественно на Фиг. 23. Интенсивность флуоресценции рассчитали для 30 случайных полей для каждого образца. Данные на Фиг. 23 представляют пять независимых экспериментов. На гистограмме на Фиг. 23 сравнивается интенсивность флуоресценции для необработанных контрольных клеток («UN») с интенсивностью флуоресценции клеток, подвергнутых воздействию EGF-Alexa 488 в присутствии супернатанта L.paracasei СВА L74 («Sup LP 108»). Как показано на Фиг. 23, супернатант L.paracasei СВА L74 значительно уменьшил проникновение EGF-Alexa 488 в клетки СаСо2, рассчитанное как снижение интенсивности флуоресценции, примерно на 50% по сравнению с необработанными контрольными клетками. Оказалось, что проникновение EGF-Alexa 488 блокируется на клеточной мембране (***=р<0,001).
Пример 12: Действие супернатанта L.paracasei СВА L74 на проникновение Р31-43 в клетки Сасо2 после удаления супернатанта
[130] Клетки Сасо2 инкубировали с супернатантом L.paracasei СВА L74 от культуры 108 КОЕ/мл L.paracasei СВА L74 в течение 30 минут, как описано в Примере 1. Супернатант L.paracasei СВА L74 затем удалили и заменили DMEM. Добавили P31-43liss, контроль проникновения пептида осуществляли, как описано в Примере 1. Как показано на Фиг. 24с, проникновение Р31-43-liss значительно уменьшилось по сравнению с необработанными контрольными клетками (Фиг. 24а) даже после удаления супернатанта L.paracasei СВА L74 и замены средой DMEM. На Фиг. 24b показана клетка Сасо2, которая была обработана супернатантом L.paracasei СВА L74, который не был удален. На гистограмме на Фиг. 25 сравнивается интенсивность флуоресценции для необработанных контрольных клеток («UN»); клеток, подвергнутых воздействию Р31-43-liss в присутствии супернатанта L.paracasei СВА L74 («Sup LP 108») и клеток, подвергнутых воздействию Р31-43-liss с последующим удалением супернатанта L.paracasei СВА L74 («МЕМ») (***=р<0,001).
Пример 13: Действие термообработанного супернатанта L.paracasei СВА L74 на проникновение Р31-43 в клетки Сасо2
[131] Клетки Сасо2 инкубировали с супернатантом L.paracasei СВА L74 (из культуры 108 КОЕ/мл L.paracasei СВА L74), которые подвергались тепловой обработке кипячением в течение 5 минут или путем инкубации при 80°С в течение 15 минут. Проникновение Р31-43-liss проанализировали, как описано в Примере 1. Как показано на Фиг. 26d, проникновение Р31-43-liss уменьшилось по сравнению с необработанными контрольными клетками (Фиг. 24а) даже после нагрева супернатанта L.paracasei СВА L74 до 80°С. Наоборот, проникновение Р31-43-liss уменьшалось незначительно (Фиг. 26с) по сравнению с необработанными контрольными клетками (Фиг. 24а), когда супернатант L.paracasei СВА L74 нагревали при 95°С - 100°С. На Фиг. 26b показаны клетки Сасо2, которые были обработаны супернатантом L.paracasei СВА L74, который не подвергали тепловой обработке. На гистограмме на Фиг. 27 сравнивается интенсивность флуоресценции для необработанных контрольных клеток («UN»); клеток, подвергнутых воздействию P31-43-liss в присутствии супернатанта L.paracasei СВА L74 («Sup LP 108»), не подвергавшемся тепловой обработке; клеток, подвергнутых воздействию P31-43-liss в присутствии супернатанта L.paracasei СВА L74, который подвергли кипячению («95° - 100°»); и клеток, подвергнутых воздействию P31-43-liss в присутствии супернатанта L.paracasei СВА L74, который нагревали при 80°С («70° - 80°»). Взятые вместе, эти данные свидетельствуют о том, что биологический эффектор в супернатанте L.paracasei СВА L74 не мог быть ферментом, поскольку ферментативная активность, как правило, разрушается под действием температуры 80°С (***=р<0,001).


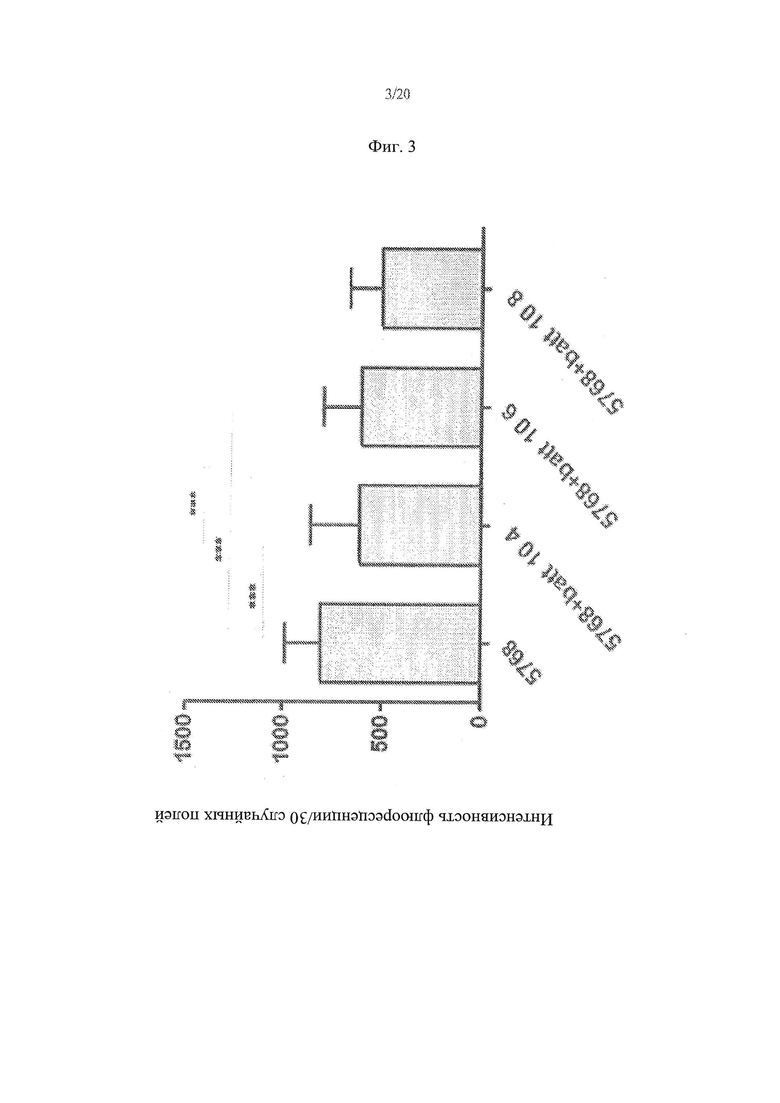

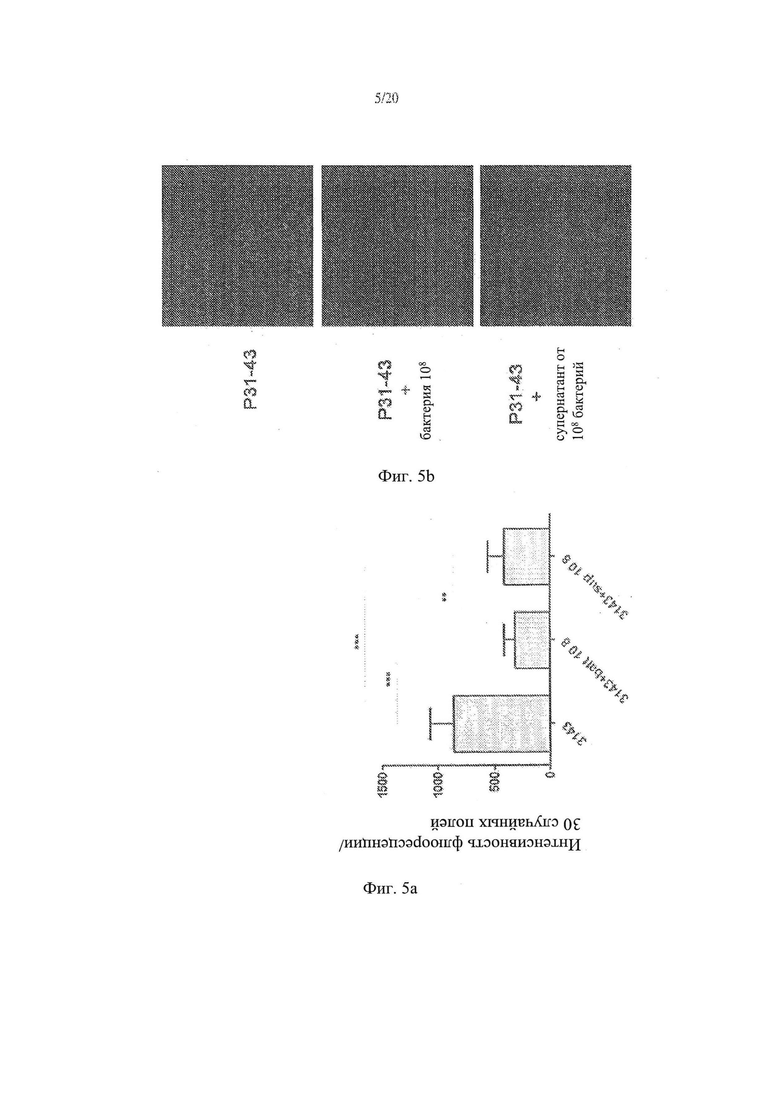

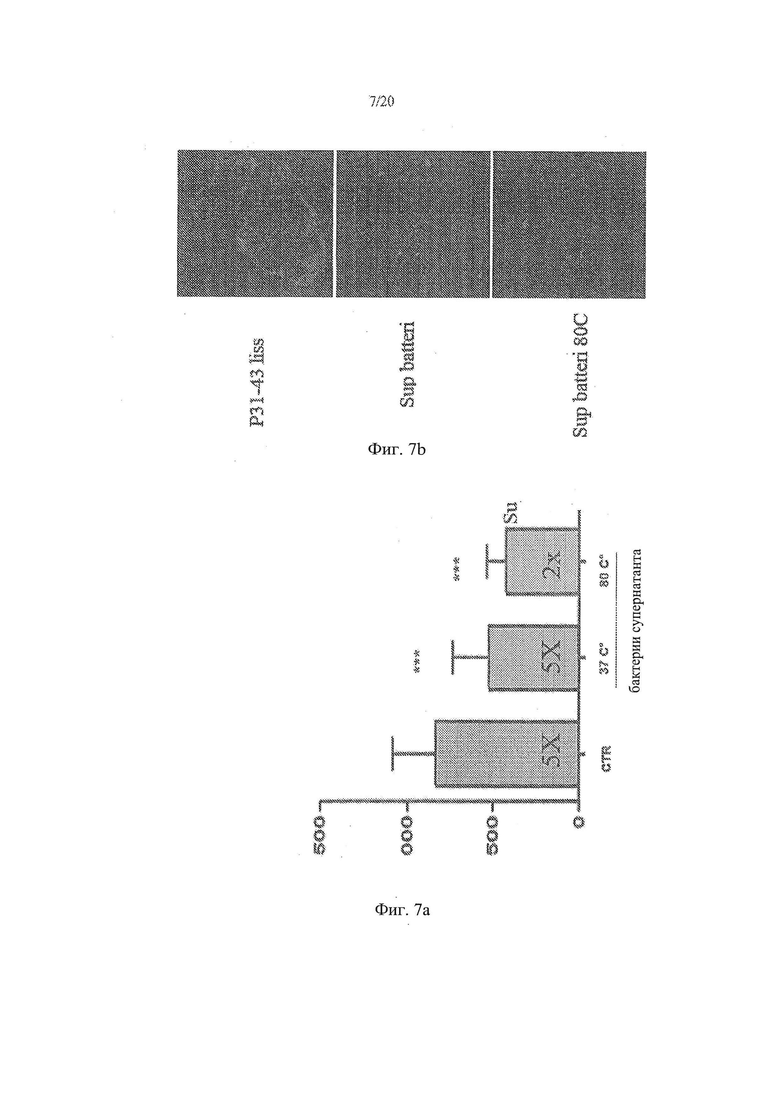



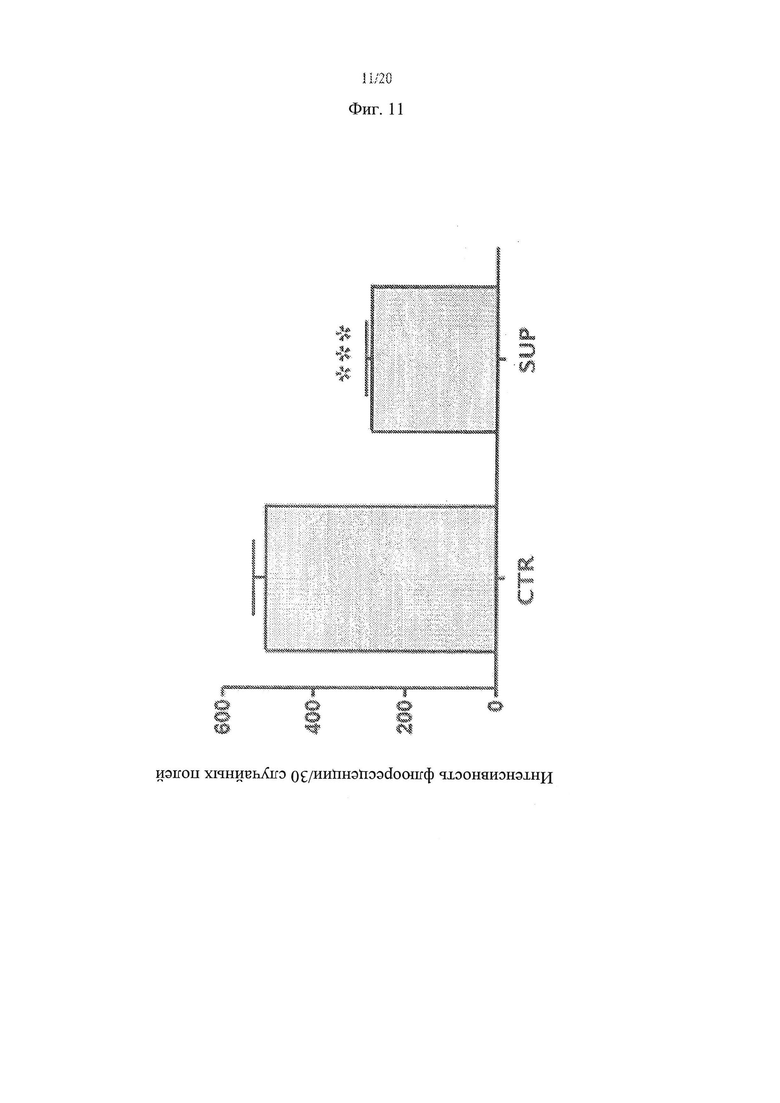

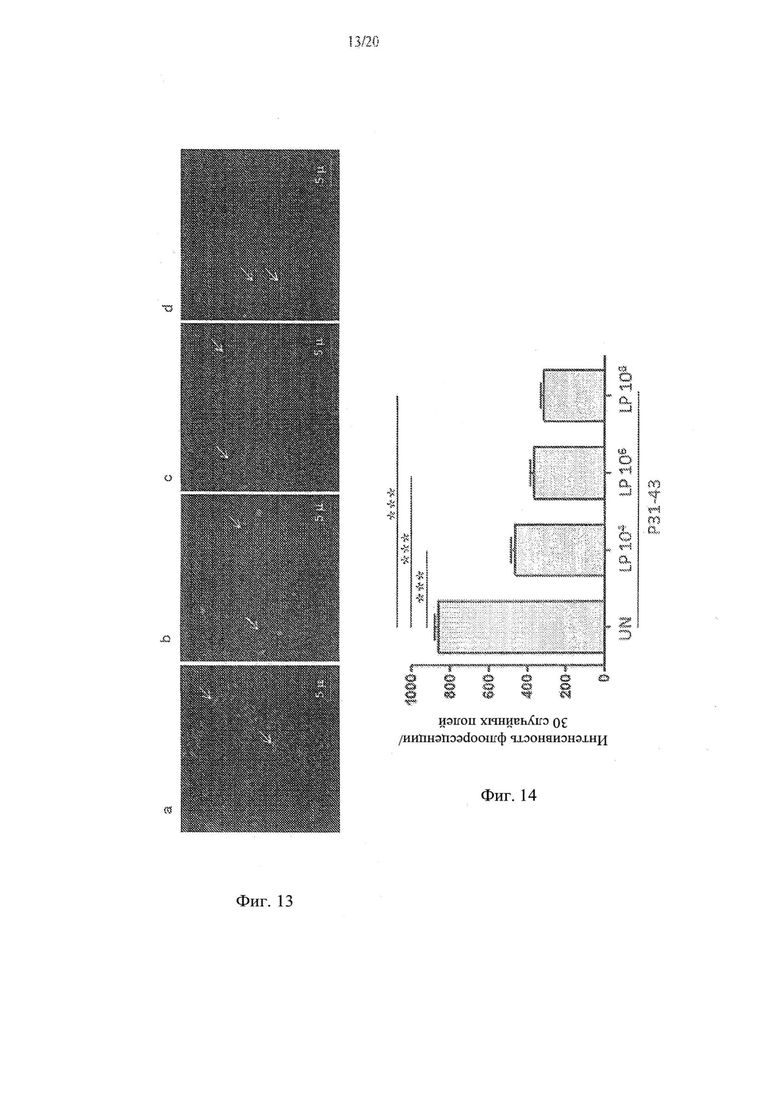
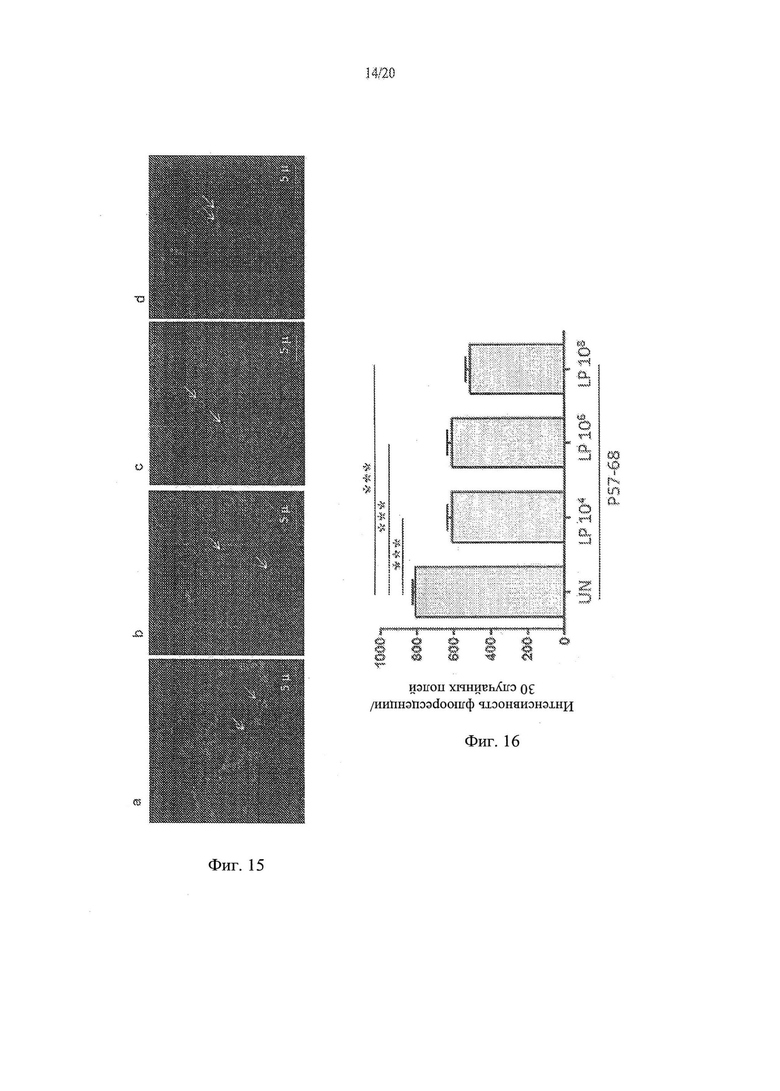
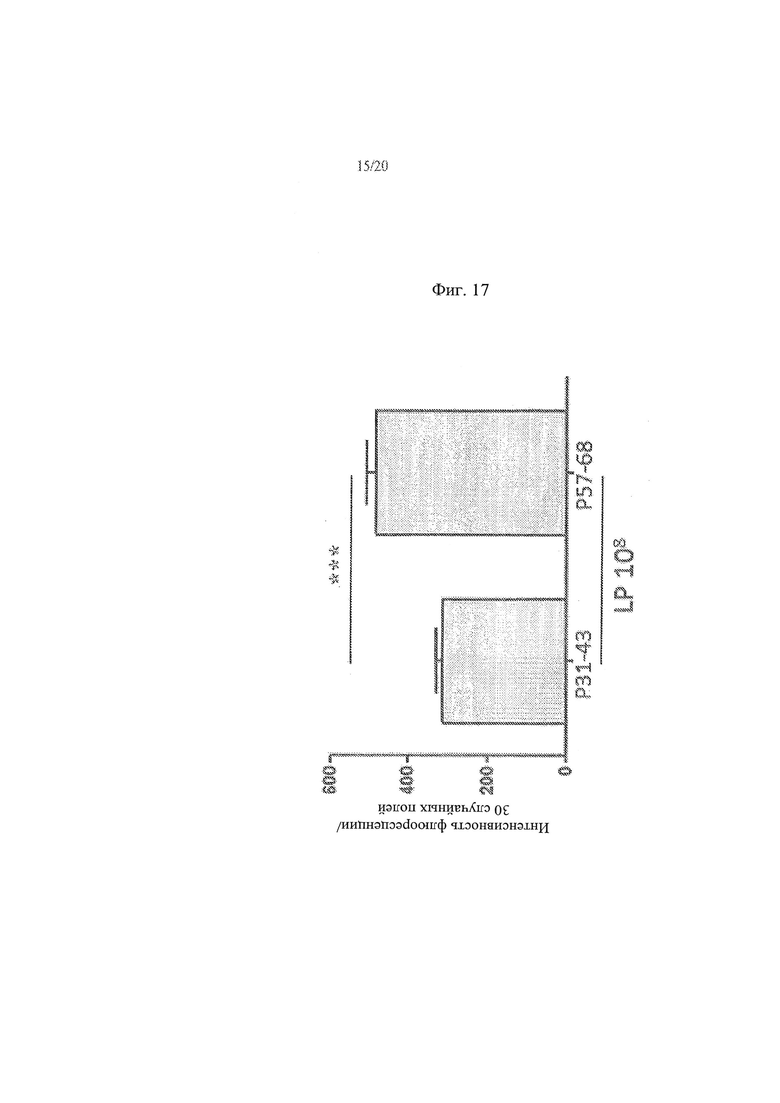
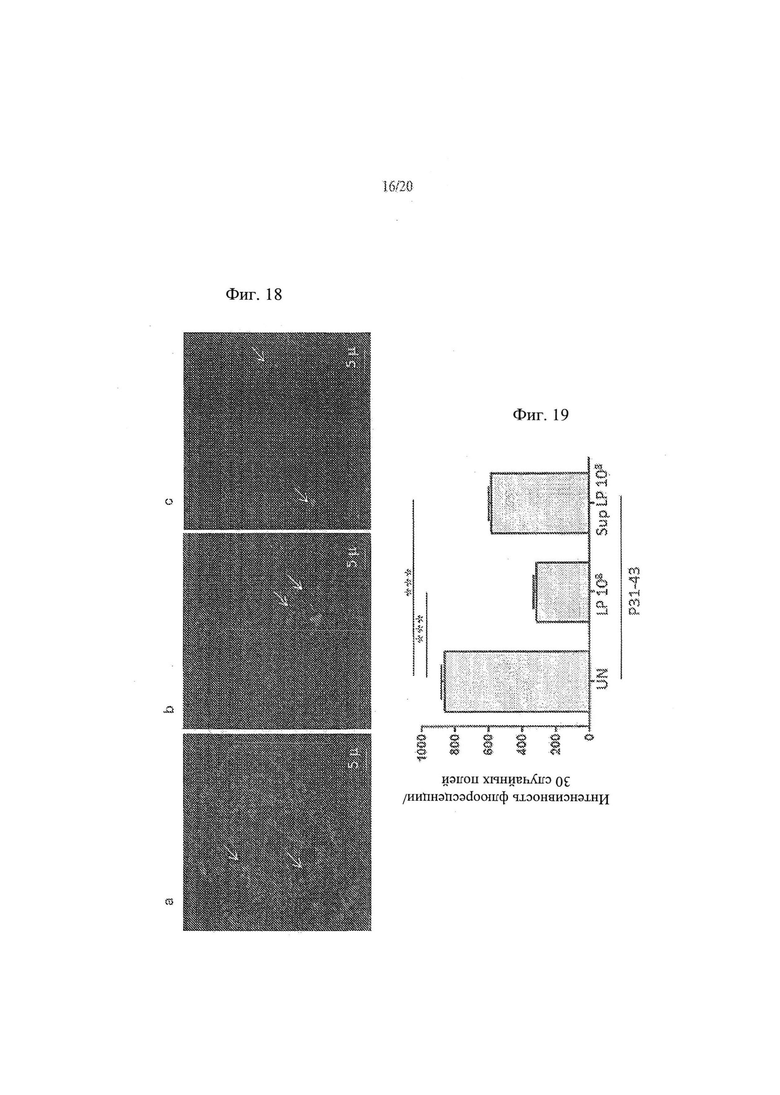
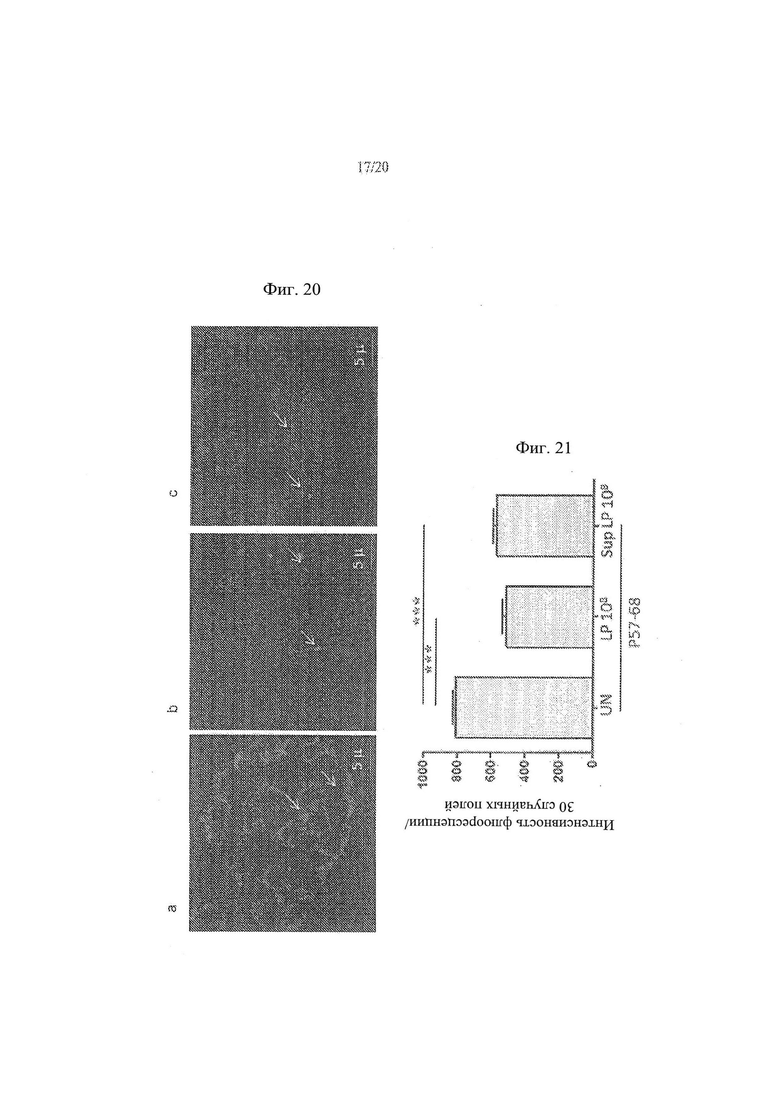
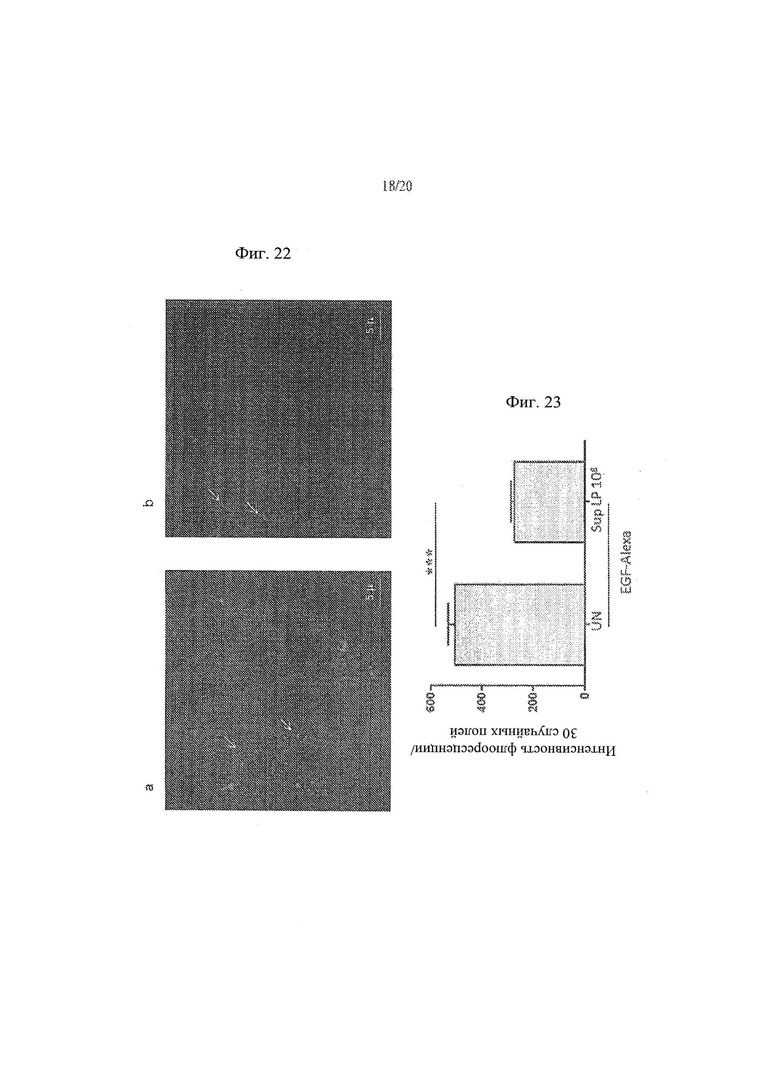
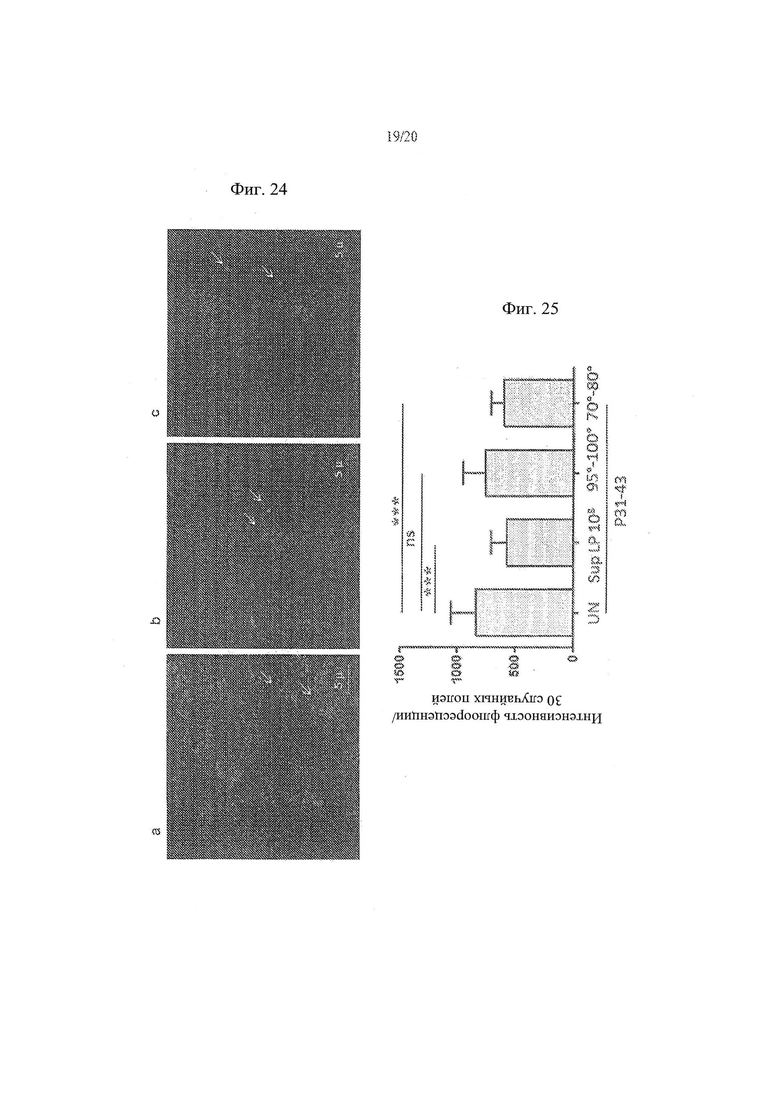
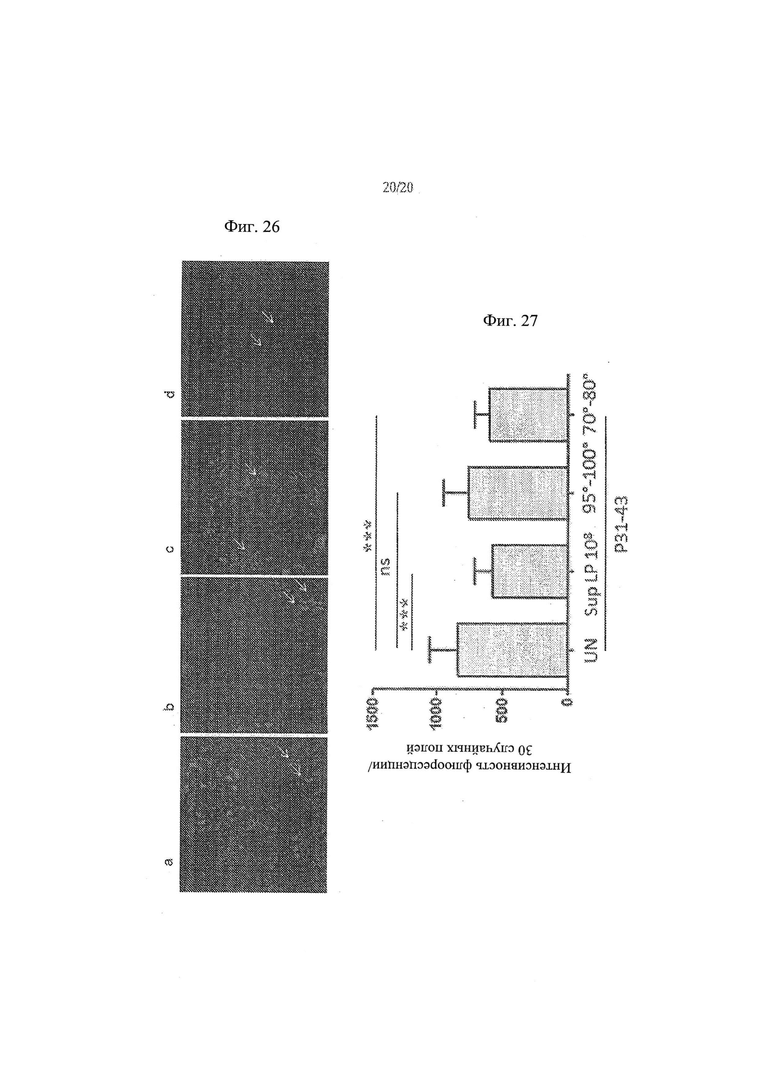
Группа изобретений относится к медицине и касается композиции для уменьшения симптомов токсичности пептида глиадина у субъекта, имеющего связанное с глютеном расстройство, содержащей пробиотический микроорганизм Lactobacillus paracasei СВА L74, номер международного депонирования LMG Р-24778, и/или супернатант культуры, продуцируемый ферментирующими Lactobacillus paracasei СВА L74, номер международного депонирования LMG Р-24778, в комбинации с одним или более физиологически приемлемым носителем. Группа изобретений также касается способа лечения субъекта, имеющего связанное с глютеном расстройство, включающего введение эффективного количества указанной композиции; набора для уменьшения симптомов токсичности пептида глиадина у субъекта, имеющего связанное с глютеном расстройство, содержащего дозированное количество указанной композиции. Группа изобретений обеспечивает уменьшение проникновения пептидов глиадина в клетки слизистой оболочки кишечника у субъекта. 4 н. и 27 з.п. ф-лы, 27 ил., 13 пр.
1. Композиция для уменьшения симптомов токсичности пептида глиадина у субъекта, имеющего связанное с глютеном расстройство, содержащая пробиотический микроорганизм Lactobacillus paracasei СВА L74, номер международного депонирования LMG Р-24778, и/или супернатант культуры, продуцируемый ферментирующими Lactobacillus paracasei СВА L74, номер международного депонирования LMG Р-24778, в комбинации с одним или более физиологически приемлемым носителем, где пробиотический микроорганизм и/или супернатант культуры уменьшает симптом токсичности пептида глиадина у субъекта, имеющего связанное с глютеном расстройство, за счет обеспечения повышенного барьера для транслокации пептида глиадина через слизистую оболочку кишечника у субъекта.
2. Композиция по п. 1, где супернатант культуры является термостабильным.
3. Композиция по п. 1, где супернатант культуры в основном не содержит клетки Lactobacillus paracasei СВА L74, номер международного депонирования LMG Р-24778.
4. Композиция по п. 1, где пептид глиадина представляет собой пептид α-глиадин.
5. Композиция по п. 4, где пептид α-глиадин имеет аминокислотную последовательность, выбранную из группы, состоящей из LGQQQPFPPQQPY (SEQ ID NO: 1); QLQPFPQPQLPY (SEQ ID NO: 2); LGQQQPFPPQQPYPQPQPF (SEQ ID NO: 3); и LQLQPFPQPQLPYPQPQLPYPQPQLPYPQPQPF (SEQ ID NO: 4).
6. Композиция по п. 1, где связанное с глютеном расстройство представляет собой целиакию или чувствительность к глютену.
7. Композиция по п. 1, где физиологически приемлемым носителем является пищевой продукт или фармацевтический носитель.
8. Композиция по п. 1, где в случае, если композиция содержит клетки пробиотического микроорганизма Lactobacillus paracasei СВА L74, номер международного депонирования LMG Р-24778, указанные клетки являются нереплицирующимися.
9. Способ лечения субъекта, имеющего связанное с глютеном расстройство, содержащий:
a) идентификацию субъекта, нуждающегося в лечении;
b) введение эффективного количества композиции, содержащей пробиотический микроорганизм Lactobacillus paracasei СВА L74, номер международного депонирования LMG Р-24778, и/или супернатант культуры, продуцируемый ферментирующими Lactobacillus paracasei СВА L74, номер международного депонирования LMG Р-24778, в комбинации с одним или более физиологически приемлемым носителем, где пробиотический микроорганизм и/или супернатант культуры уменьшает симптом токсичности пептида глиадина за счет обеспечения повышенного барьера для транслокации пептида глиадина через слизистую оболочку кишечника у субъекта.
10. Способ по п. 9, где супернатант культуры является термостабильным.
11. Способ по п. 9, где супернатант культуры в основном не содержит клетки Lactobacillus paracasei СВА L74, номер международного депонирования LMG Р-24778.
12. Способ по п. 9, где пептид глиадин представляет собой пептид α-глиадин.
13. Способ по п. 12, где пептид α-глиадин имеет аминокислотную последовательность, выбранную из группы, состоящей из LGQQQPFPPQQPY (SEQ ID NO: 1); QLQPFPQPQLPY (SEQ ID NO: 2); LGQQQPFPPQQPYPQPQPF (SEQ ID NO: 3); и LQLQPFPQPQLPYPQPQLPYPQPQLPYPQPQPF (SEQ ID NO: 4).
14. Способ по п. 9, где связанное с глютеном расстройство представляет собой целиакию или чувствительность к глютену.
15. Способ по п. 9, где симптом токсичности пептида глиадина включает воспаление, аутоиммунную реакцию, желудочно-кишечный симптом, потерю веса, анемию, остеопороз, артрит, бесплодие, периферическую невропатию или печеночную недостаточность.
16. Способ по п. 9, где возраст субъекта не более 21 года.
17. Способ по п. 9, где способ дополнительно содержит стадию применения второго вида лечения в отношении связанного с глютеном расстройства.
18. Способ по п. 17, где вторым видом лечения является диетотерапия или лекарственная терапия.
19. Способ по п. 18, где диетотерапия представляет собой безглютеновую диету.
20. Способ по п. 9, где в случае, если композиция содержит клетки пробиотического микроорганизма Lactobacillus paracasei СВА L74, номер международного депонирования LMG Р-24778, указанные клетки являются нереплицирующимися.
21. Применение пробиотического микроорганизма Lactobacillus paracasei СВА L74, номер международного депонирования LMG Р-24778, и/или супернатанта культуры, продуцируемого ферментирующими Lactobacillus paracasei СВА L74, номер международного депонирования LMG Р-24778, в комбинации с одним или более физиологически приемлемым носителем для приготовления композиции для уменьшения симптома токсичности пептида глиадина у субъекта, имеющего связанное с глютеном расстройство, где пробиотический микроорганизм и/или супернатант культуры уменьшает симптом токсичности пептида глиадина за счет обеспечения повышенного барьера для транслокации пептида глиадина через слизистую оболочку кишечника у субъекта.
22. Применение по п. 21, где супернатант культуры является термостабильным.
23. Применение по п. 21, где супернатант культуры в основном не содержат клетки Lactobacillus paracasei СВА L74, номер международного депонирования LMG Р-24778.
24. Применение по п. 21, где пептид глиадин представляет собой пептид α-глиадин.
25. Применение по п. 24, где пептид α-глиадин имеет аминокислотную последовательность, выбранную из группы, состоящей из LGQQQPFPPQQPY (SEQ ID NO: 1); QLQPFPQPQLPY (SEQ ID NO: 2); LGQQQPFPPQQPYPQPQPF (SEQ ID NO: 3); и LQLQPFPQPQLPYPQPQLPYPQPQLPYPQPQPF (SEQ ID NO: 4).
26. Применение по п. 21, где физиологически приемлемый носитель представляет собой пищевой продукт или фармацевтический носитель.
27. Применение по п. 21, где симптом токсичности пептида глиадина включает воспаление, аутоиммунную реакцию, желудочно-кишечный симптом, потерю веса, анемию, остеопороз, артрит, бесплодие, периферическую невропатию или печеночную недостаточность.
28. Применение по п. 21, где в случае, если композиция содержит клетки пробиотического микроорганизма Lactobacillus paracasei СВА L74, номер международного депонирования LMG Р-24778, указанные клетки являются нереплицирующимися.
29. Набор для уменьшения симптомов токсичности пептида глиадина у субъекта, имеющего связанное с глютеном расстройство, содержащий дозированное количество композиции, содержащей пробиотический микроорганизм Lactobacillus paracasei СВА L74, номер международного депонирования LMG Р-24778, и/или супернатант культуры, продуцируемый ферментирующими Lactobacillus paracasei СВА L74, номер международного депонирования LMG Р-24778, в комбинации с одним или более физиологически приемлемым носителем, где пробиотический организм и/или супернатант культуры уменьшает симптом токсичности пептида глиадина у субъекта, имеющего связанное с глютеном расстройство, за счет обеспечения повышенного барьера для транслокации пептида глиадина через слизистую оболочку кишечника у субъекта, и одну или несколько позиций, выбранных из группы, состоящей из упаковочного материала, листовки-вкладыша с инструкциями по применению, стерильной жидкости, шприца и стерильного контейнера.
30. Набор по п. 29, где физиологически приемлемый носитель представляет собой пищевой продукт или фармацевтический носитель.
31. Набор по п. 29, где в случае, если композиция содержит клетки пробиотического микроорганизма Lactobacillus paracasei СВА L74, номер международного депонирования LMG Р-24778, указанные клетки являются нереплицирующимися.
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| D ARIENZO R., et al., Modulation of the immune response by probiotic strains in a mouse model of gluten sensitivity.Cytokine | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| DI CAGNO R., et al., Use of selected sourdough strains of Lactobacillus for removing gluten and enhancing the nutritional properties of gluten-free bread.J Food Prot | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| RIZZELLO CG., et al., Highly efficient gluten degradation by lactobacilli and fungal proteases during food processing: new perspectives for celiac disease.Appl Environ Microbiol | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
Авторы
Даты
2018-05-22—Публикация
2013-06-18—Подача