Область, к которой относится изобретение
Изобретение относится к молекулярной биологии, биотехнологии, генной инженерии и медицине и может быть использовано для коррекции патологических состояний клеток различных органов и тканей, а также собственно органов и тканей человека, связанных с уменьшением уровня экспрессии гена ANG и/или уменьшением количества и/или активности белка ангиогенина, в частности, в терапевтических целях.
Предшествующий уровень.
Ангиогенез - это процесс образования новых кровеносных сосудов в уже существующей сосудистой системе. Он играет важную роль в развитии и нормальном росте тканей, заживлении ран, репродуктивном цикле у женщин (развитие плаценты и желтого тела, овуляции), и вовлечен в патогенез различных заболеваний.
Процесс неоангиогенеза является необходимым для длительной адаптации тканей в условиях повреждения. При этом происходит частичное поступление факторов роста в кровь, что имеет диагностическое значение. Факторы роста, как правило, продуцируются неспециализированными клетками, находящимися во всех тканях, и обладают эндокринным, паракринным и аутокринным действием.
Одним из факторов ангиогенеза является белок ангиогенин, который принадлежит к суперсемейству Рибонуклеаз А. Он обладает и специфическим биологическим действием, и ферментативной РНКазной активностью, в отличие от других факторов ангиогенеза. Ангиогенин является гомологом бычьей панкреатической рибонуклеазы А (РНКазы А). Биологическая активность ангиогенина зависит от РНКазной активности, которая при этом у него в 104-106 ниже, чем у РНКазы A (Biochemistry 2002, 41, р. 1343). Мутации критических для ферментативной активности ангиогенина аминокислот приводят к потере ангиогенной активности.
Эндогенный ангиогенин необходим для пролиферации клеток, индуцируемой другими белками, как, например, фактор роста эндотелия сосудов (VEGF). Как и в случае с VEGF, экспрессия ангиогенина может индуцироваться состоянием гипоксии. Белок, кодируемый геном ANG, является мощным медиатором образования новых кровеносных сосудов. Зрелый пептид обладает противомикробной активностью против некоторых бактерий и грибов, в том числе S. pneumoniae, и C. Albicans. Ангиогенин - один из ключевых белков, вовлеченных в процесс ангиогенеза в нормальных и опухолевых тканях. Ангиогенин взаимодействует с актином на поверхности эндотелиальных клеток, и путем эндоцитоза транспортируется в клеточное ядро, что в дальнейшем приводит к стимуляции процессов клеточной миграции, инвазии и пролиферации. Ангиогенин также способен связывать фоллистатин. Его активность in vivo регулируется взаимодействием с RNH1 (ribonuclease/angiogenin inhibitor 1).
Ангиогенин продуцируется различными типами клеток и присутствует в нормальной человеческой плазме, способствует миграции эндотелиальных клеток, связывается с ними, опосредует клеточное сцепление, способствует формированию трубчатых структур и может влиять на созревание сосудов, индуцируя пролиферацию гладкомышечных клеток и фибробластов. Преимущественно он экспрессируется в печени, а также детектируется в нейронах спинного мозга. Высокий уровень экспрессии ANG был обнаружен во внеклеточном матриксе и интерстициальной ткани, также ангиогенин был локализован в спинном мозге, эндотелиальных клетках, например, в сосудистом эндотелии, что свидетельствует о его роли в ангиогенезе. Известно также, что ANG экспрессируют такие клетки, как клетки сосудистого эндотелия, гладкомышечные клетки, фибробласты, цилиндрический эпителий толстой кишки, лимфоциты и клетки первичной аденокарциномы, а также селективные линии клеток опухоли человека.
У ангиогенина была открыта нейротрофическая функция (Greenway M.J. et al., ANG mutations segregate with familial and 'sporadic' amyotrophic lateral sclerosis, Nat. Genet., 2006; №38, c. 411-413 - Мутации в гене ангиогенина выделяют при семейной и "спорадической" формах бокового амиотрофического склероза - БАС), а также - у фактора роста эндотелия сосудов (Lambrechts D. et al., Nat. Genet., 2003, Ns 34, c. 383-394 - Фактор роста эндотелия сосудов является модификатором бокового амиотрофического склероза (БАС) у мыши и человека и защищает мотонейроны от ишемической смерти.), что позволяет рассматривать нейротрофические факторы в числе наиболее перспективных соединений для лечения БАС. Важность ангиогенина при патогенезе БАС подтверждена в экспериментах на мышах линии B6SJL- 3 Tg(SOD1*G93A)dI1Gur/J с мутацией G93A в гене СОД1 (Gurney М.Е. et al., Science, 1994, №264, С. 1772). Было показано увеличение продолжительности жизни при введении им рекомбинантного ангиогенина.
В заявке на патент США N2008/0045456 показаны фармацевтические композиции на основе ангиогенина человека, в том числе рекомбинантного происхождения (полученного в E.coli), и методы их использования для терапии нейродегенеративных заболеваний, в частности БАС, позволяющие снизить проявления нейродегенеративных процессов у подопытных мышей и удлинить продолжительность их жизни. При такой терапии необходимо ежедневно вводить рекомбинантный ангиогенин.
Известны ряд лекарственных препаратов (гели «Ангиофарм», «Cosmo-Genium», «Ангиосиб», «Фармаген») содержащие рекомбинантный человеческий ангиогенин, на который получен патенты RU 2512527, RU 2221043. Согласно данным исследований препараты обладают высокими репаративными свойствами за счет ускоренной реконструкции локальной капиллярной сети и образования грануляционной ткани, снижают отечные и воспалительные явления, повышают местный иммунитет в зоне повреждения, снижают вероятность образования келоидных рубцов. Однако подобная терапия за счет местного применения может быть недостаточно эффективной и не учитывает индивидуальных характеристик пациента.
В заявке WO 2009146178 А1 описан способ терапевтического лечения нейродегенеративного расстройства у субъекта, включающий введение субъекту терапевтически эффективного количества композиции, содержащей выделенный полипептид ангиогенина; способ позволяет изолированному ангиогенину проходить через один или оба барьера - гематоэнцефалического барьера и барьера крови спинного мозга; при этом уменьшая один или более симптомов нейродегенеративного нарушения у субъекта.
Недостатком данного подхода является высокая стоимость получения чистого рекомбинантного белка, частое его введение (что увеличивает стоимость терапии и повышает риск побочных явлений) и сложность внутриклеточной доставки препарата. Кроме того, внесение модификаций в аминокислотную последовательность природного белка может привести к образованию структур, являющихся антигенными детерминантами.
За прототип авторами было принято техническое решение по заявке WO 2013122502 А1, в которой описана фармацевтическая композиция и способ терапии нейродегенеративных заболеваний, в частности бокового амиотрофического склероза (БАС). Композиция содержит нереплицирующиеся наночастицы, включающие ген ангиогенина человека и ген фактора роста эндотелия сосудов человека, клонированных в две экспрессирующих кассеты одной нереплицирующейся наночастицы на основе генома аденовируса человека 5-го серотипа, при этом композиция дополнительно содержит формулирующий буфер. Способ терапии бокового амиотрофического склероза заключается во введении человеку терапевтически эффективной дозы фармацевтической композиции, содержащей нереплицирующиеся наночастицы, включающие ген ангиогенина человека и ген фактора роста эндотелия сосудов человека, клонированных в две экспрессирующих кассеты одной нереплицирующейся наночастицы на основе генома аденовируса человека 5-го серотипа, при этом композиция дополнительно содержит формулирующий буфер.
Недостатком данного подхода является то, что при создании генно-терапевтического средства в этом изобретении использован аденоассоциированный вирус, который может интегрироваться в хромосому клетки-хозяина, а также - не учитываются индивидуальные характеристики пациента, в связи с которыми может понадобиться группа вариаций для данного средства.
Раскрытие изобретения
Задачей данного изобретения является создание высокоэффективного средства для лечения состояний человеческого организма, связанных с уменьшением уровня экспрессии гена ANG и/или уменьшением количества и/или активности белка ангиогенина, на основе генно-терапевтических субстанций с геном ANG, представляющих собой группу генно-терапевтических субстанций, при использовании которых с учетом индивидуальных особенностей пациента, происходит повышение уровня экспрессии гена ANG и/или повышение количества и/или активности белка ангиогенина, в клетках органов и тканей и/или органах и тканях организма
Указанная задача решается за счет того, что создано средство для лечения состояний человеческого организма, связанных с уменьшением уровня экспрессии гена ANG и/или уменьшением количества и/или активности белка ангиогенина на основе генно-терапевтических субстанций с кДНК гена ANG, представляющее собой, по крайней мере, одну генно-терапевтическую субстанцию, выбранную из группы генно-терапевтических субстанций, каждая из которых представляет генетическую конструкцию на основе векторной плазмиды, включающей кДНК гена ANG, с кодирующей последовательностью белка ангиогенина, с делециями 5' и 3'-нетранслируемых областей, а именно, полученной на основе участка нативной немодифицированной кДНК гена ANG SEQ ID No: 1, или модифицированной кДНК гена ANG, при этом в качестве модифицированной кДНК гена ANG используют SEQ ID No: 2, или SEQ ID No: 3, или SEQ ID No: 4, или SEQ ID No: 5, или SEQ ID No: 6, или SEQ ID No: 7, или сочетание этих генетических конструкций, каждая из которых содержит также регуляторные элементы, обеспечивающие высокий уровень экспрессии гена ANG в эукариотических клетках, в частности в клетках органов и тканей человека, и способную увеличить количество и/или активность белка ангиогенина в клетках органов и тканей и/или органах и тканях человека, в частности в спинном мозге, кровеносных сосудах, сердце, кишечнике, желудке, печени, желчном пузыре, легких, органах выделительной и половой систем (мочевом пузыре, мочеточниках, матке, яичниках), гладких и скелетных мышцах, интерстициальной, эндотелиальной, эпителиальной, нервной, мышечной тканях, плацентарной ткани, в дерме (коже), гепатоцитах, нейронах, клетках сосудистого эндотелия, мышечных клетках, фибробластах, клетках эпителия, лимфоцитах в сочетании с транспортной молекулой или без нее при введении этих генно-терапевтических субстанций в органы и ткани человека. При этом каждая генетическая конструкция с модифицированной кДНК гена ANG содержит последовательность нуклеотидов, включающую в себя белок-кодирующую область кДНК гена ANG, которая несет модификации, не затрагивающие структуру белка ангиогенина, а именно: нуклеотидные замены, не приводящие к аминокислотным заменам или обрыву аминокислотной цепи, или комбинации вышеперечисленных модификаций и, не влияющие на кодируемую этой последовательностью аминокислотную последовательность. В качестве транспортной молекулы используют липосомы, или дендримеры 5-го и выше поколений, или амфифильные блоксополимеры.
Способ получения средства для лечения состояний человеческого организма, связанных с уменьшением уровня экспрессии гена ANG и/или уменьшением количества и/или активности белка ангиогенина, заключается в получении каждой генно-терапевтической субстанции из группы созданных генно-терапевтических субстанций, при этом получают кДНК гена ANG, затем помещают кДНК в векторную плазмиду, способную обеспечить высокий уровень экспрессии этой кДНК в клетках различных органов и тканей человека, наращивают и выделяют необходимое количество генетической конструкции, затем комбинируют генетическую конструкцию с транспортной молекулой для трансфекции полученной генно-терапевтической субстанцией клеток органов и тканей и/или введения полученной генно-терапевтической субстанции в органы и ткани человека, при этом используют кДНК гена ANG с кодирующей последовательностью белка ангиогенина, с делециями 5' и 3'-нетранслируемых областей, а именно, полученной на основе участка нативной немодифицированной кДНК гена ANG SEQ ID No: 1, или модифицированной кДНК гена ANG, при этом в качестве модифицированной кДНК гена ANG используют, или SEQ ID No: 2, или SEQ ID No: 3, или SEQ ID No: 4, или SEQ ID No: 5, или SEQ ID No: 6, или SEQ ID No: 7, или сочетание этих генетических конструкций.
Способ использования средства для лечения состояний человеческого организма, связанных с уменьшением уровня экспрессии гена ANG и/или уменьшением количества и/или активности белка ангиогенина, заключается в трансфекции генно-терапевтической субстанцией, выбранной из группы созданных генно-терапевтических субстанций, клеток органов и тканей пациента и/или во введении в органы и ткани пациента аутологичных клеток пациента, трансфицированных генно-терапевтической субстанцией, выбранной из группы созданных генно-терапевтических субстанций, и/или во введении в органы и ткани пациента генно-терапевтической субстанции или нескольких субстанций, выбранной/ выбранных из группы созданных генно-терапевтических субстанций, или сочетанием обозначенных способов.
Перечень фигур
На фиг. 1
Представлена нуклеотидная последовательность немодифицированной кДНК гена ANG длиной 444 н.п. SEQ ID No: 1, которая имеет высокую гомологию с приводимой в базе данных GenBank под номером NM_001145 и кодирует белок ангиогенин (GenBank NP_001136.1.)
На фиг. 2
Представлена нуклеотидная последовательность модифицированной кДНК гена ANG, SEQ ID No: 2, которая содержит 1 нуклеотидную замену G→C в позиции 663, не приводящую к изменениям в аминокислотной последовательности белка ангиогенина.
На фиг. 3
Представлена нуклеотидная последовательность модифицированной кДНК гена ANG, SEQ ID No: 3, которая содержит 2 нуклеотидные замены: 1 нуклеотидную замену G→C в позиции 663, и одну нуклеотидную замену A→G в позиции 921, не приводящие к изменениям в аминокислотной последовательности белка ангиогенина.
На фиг. 4
Представлена нуклеотидная последовательность модифицированной кДНК гена ANG, SEQ ID No: 4, которая содержит 4 нуклеотидные замены: 1 нуклеотидную замену G→С в позиции 663, 2 нуклеотидных замены A→G в позициях 879, 921; 1 нуклеотидную замену А→С в позиции 885, не приводящие к изменениям в аминокислотной последовательности белка ангиогенина.
На фиг. 5
Представлена нуклеотидная последовательность модифицированной кДНК гена ANG, SEQ ID NO: 5, которая содержит 6 нуклеотидных замен: 2 нуклеотидных замены G→C в позиции 663, 966; 3 нуклеотидных замены A→G в позициях 879, 921, 957; 1 нуклеотидную замену А→С в позиции 885, не приводящие к изменениям в аминокислотной последовательности белка ангиогенина.
На фиг. 6
Представлена нуклеотидная последовательность модифицированной кДНК гена ANG, SEQ ID NO: 6, которая содержит 8 нуклеотидных замен: 2 нуклеотидных замены G→C в позицииях 663, 966; 4 нуклеотидных замены A→G в позициях 879, 921, 957, 1005; 1 нуклеотидную замену А→С в позиции 885, 1 нуклеотидную замену Т→С в позиции 1003; не приводящие к изменениям в аминокислотной последовательности белка ангиогенина.
На фиг. 7
Представлена укороченная нуклеотидная последовательность модифицированной кДНК гена ANG, SEQ ID No: 7, которая содержит 10 нуклеотидных замен: 2 нуклеотидных замены G→C в позиции 663, 966; 4 нуклеотидных замены A→G в позициях 879, 921, 957, 1005; 1 нуклеотидную замену А→С в позиции 885, 1 нуклеотидную замену Т→С в позиции 1003; и 2 нуклеотидных замены T→G в позициях 1035 и 1038, не приводящие к изменениям в аминокислотной последовательности белка ангиогенина.
На фиг. 8
С целью последующего корректного определения генно-терапевтического эффекта после трансфекции фибробластов генно-терапевтической субстанцией с кДНК гена ANG проводили анализ эндогенной экспрессии гена ANG в культуре первичных фибробластов. На фигуре представлены графики накопления продуктов полимеразной цепной реакции (ПЦР), соответствующих:
1 - кДНК гена ANG, фибробласты со сниженной экспрессией гена ANG,
2 - кДНК гена ANG, фибробласты с нормальной экспрессией гена ANG,
3 - кДНК гена В2М, фибробласты со сниженной экспрессией гена ANG,
4 - кДНК гена В2М, фибробласты с нормальной экспрессией гена ANG.
В качестве референтного гена использовали ген В2М (Бета-2-микроглобулин) приведенного в базе данных GenBank под номером NM 004048.2.
На фиг. 9
С целью подтверждения увеличения экспрессии гена ANG в клеточной культуре фибробластов со сниженной экспрессией гена ANG при трансфекции данных клеток генно-терапевтической субстанцией с кДНК гена ANG с генетической конструкцией pCMV6-ANG SEQ ID No: 1 представлены графики накопления ПЦР-продуктов, соответствующих:
1 - кДНК гена ANG в фибробластах с нормальной экспрессией гена ANG,
2 - кДНК гена ANG в фибробластах со сниженной экспрессией гена ANG до трансфекции ГТС с кДНК гена ANG,
3 - кДНК гена ANG в фибробластах со сниженной экспрессией гена ANG после трансфекции ГТС с кДНК гена ANG,
4 - кДНК гена ANG в фибробластах со сниженной экспрессией гена ANG после трансфекции вектором без кДНК гена ANG,
5 - кДНК гена В2М в фибробластах с нормальной экспрессией гена ANG,
6 - кДНК гена В2М в фибробластах со сниженной экспрессией гена ANG до трансфекции ГТС с кДНК гена ANG,
7 - кДНК гена В2М в фибробластах со сниженной экспрессией гена ANG после трансфекции ГТС с кДНК гена ANG,
8 - кДНК гена В2М в фибробластах со сниженной экспрессией гена ANG после трансфекции вектором без кДНК гена ANG.
Из графиков следует, что в случае трансфекции вектором без вставки кДНК гена ANG уровень кДНК гена ANG в фибробластах не изменился, а в случае трансфекции вектором с кДНК гена ANG - уровень кДНК фибробластов со сниженной экспрессией гена ANG многократно увеличился (до уровня выше, чем уровень кДНК гена ANG в нормальных фибробластах).
На фиг. 10
С целью подтверждения увеличения количества белка ангиогенина, в клеточной культуре фибробластов с нормальной экспрессией гена ANG при трансфекции данных клеток генно-терапевтической субстанцией содержащей кДНК гена ANG представлен график изменения количества белка ангиогенина, нетрансфицированных фибробластов (культура А), трансфицированных вектором pCDNA 3.1 (+) не содержащим кДНК гена ANG (культура В) и трансфицированных генно-терапевтической субстанцией с генетической конструкцией pCDNA 3.1-ANG SEQ ID No: 1 (культура С). Из графика следует, что при трансфекции фибробластов генно-терапевтической субстанцией с кДНК гена ANG происходит увеличение количества белка ангиогенина, в клеточном лизате.
На фиг. 11
С целью подтверждения увеличения количества белка ангиогенина, в коже человека при введении в кожу клеточной культуры фибробластов, трансфицированной генно-терапевтической субстанцией, представлен анализ изменения количества белка ангиогенина, в коже пациентов. При этом пациентам вводили три варианта культуры аутологичных фибробластов - нетрансфицированные (А), трансфицированные вектором pCMV6-XL5 (Б) и трансфицированные генно-терапевтической субстанцией с генетической конструкцией pCMV6-ANG SEQ ID No: 7 (С) - в кожу предплечья. Также анализировали количество белка ангиогенина, в интактной коже. Показано повышение количества белка ангиогенина, в коже пациента в области введения фибробластов, трансфицированных генно-терапевтической субстанцией кДНК гена ANG (С).
На фиг. 12
С целью подтверждения увеличения количества белка ангиогенина до различного индивидуального уровня в клеточных культурах фибробластов пациентов при трансфекции данных клеток генно-терапевтическими субстанциями с участком нативной немодифицированной кДНК гена ANG и модифицированных кДНК гена ANG, представлен анализ изменения количества белка ангиогенина в культурах фибробластов кожи человека в зависимости от наличия и типа модификаций в кДНК гена ANG, используемой для трансфекции фибробластов.
Культуры фибробластов 26 пациентов делили на 8 частей каждую с (А) по (Н); первые части (А) клеточных культур пациентов трансфицировали генно-терапевтической субстанцией pCMV6-ANG SEQ ID No: 1, части (В) трансфицировали генно-терапевтической субстанцией pCMV6-ANG SEQ ID No: 2, части (С) трансфицировали генно-терапевтической субстанцией pCMV6-ANG SEQ ID No: 3, части (D) трансфицировали генно-терапевтической субстанцией pCMV6-ANG SEQ ID No:4, части (E) трансфицировали генно-терапевтической субстанцией рСМV6-ANG SEQ ID No: 5, части (F) трансфицировали генно-терапевтической субстанцией pCMV6-ANG SEQ ID No: 6, части (G) трансфицировали генно-терапевтической субстанцией pCMV6-ANG SEQ ID No:7, части (H) трансфицировали векторной плазмидой, не содержащей кДНК гена ANG.
По итогам анализа уровня количества белка ангиогенина, выбрали показатели, касательно каждой части клеточной культуры от каждого пациента, продемонстрировавшие максимальное количество белка ангиогенина, и объединили их в семь групп, исходя из следующего критерия:
В группе 1 максимальное количество белка ангиогенина, наблюдалась при трансфекции pCMV6-ANG SEQ ID No: 1,
в группе 2 максимальное количество белка ангиогенина, наблюдалась при трансфекции pCMV6-ANG SEQ ID No: 2,
в группе 3 максимальное количество белка ангиогенина, наблюдалась при трансфекции рСМV6-ANG SEQ ID No: 3,
в группе 4 максимальное количество белка ангиогенина, наблюдалась при трансфекции pCMV6-ANG SEQ ID No: 4,
в группе 5 максимальное количество белка ангиогенина, наблюдалась при трансфекции pCMV6-ANG SEQ ID No: 5,
в группе 6 максимальное количество белка ангиогенина, наблюдалась при трансфекции рСМV6-ANG SEQ ID No:6,
в группе 7 максимальное количество белка ангиогенина, наблюдалась при трансфекции pCMV6-ANG SEQ ID No: 7.
Ни в одной из клеточных культур не наблюдалось того, что максимальное количество белка ангиогенина присутствует при трансфекции вектором без вставки кДНК гена ANG.
На фигуре 12 для каждой группы клеточных культур приведены диаграммы показателей (усредненных в рамках группы, в случае, если в группу входит более одной клеточной культуры) применительно ко всем, участвующим в эксперименте генно-терапевтическим субстанциям, после трансфекции этих клеточных культур генно-терапевтическими субстанциями, содержащими модифицированные и нативную кДНК гена ANG.
Из фигуры следует, что достижение максимального количества белка ангиогенина, в культурах фибробластов кожи различных пациентов при их трансфекции генно-терапевтическими субстанциями, связано с индивидуальными особенностями пациентов и зависит от наличия и типа модификаций в кДНК гена ANG, входящих в генно-терапевтические субстанции.
Каждая генно-терапевтическая субстанция из группы генно-терапевтических субстанций является эффективной в некоторой значительной группе пациентов. Следовательно, для выбора наиболее эффективной генно-терапевтической субстанции из группы генно-терапевтических субстанций для терапевтических целей необходимо предварительное персонализированное исследование пациента.
Обозначения:
 части клеточных культур, трансфицированных ГТС ANG SEQ ID No: 1 (А)
части клеточных культур, трансфицированных ГТС ANG SEQ ID No: 1 (А)
 части клеточных культур, трансфицированных ГТС ANG SEQ ID No: 2 (В)
части клеточных культур, трансфицированных ГТС ANG SEQ ID No: 2 (В)
 части клеточных культур, трансфицированных ГТС ANG SEQ ID No: 3 (С)
части клеточных культур, трансфицированных ГТС ANG SEQ ID No: 3 (С)
 части клеточных культур, трансфицированных ГТС ANG SEQ ID No: 4 (D)
части клеточных культур, трансфицированных ГТС ANG SEQ ID No: 4 (D)
 части клеточных культур, трансфицированных ГТС ANG SEQ ID No: 5 (Е)
части клеточных культур, трансфицированных ГТС ANG SEQ ID No: 5 (Е)
 части клеточных культур, трансфицированных ГТС ANG SEQ ID No: 6 (F)
части клеточных культур, трансфицированных ГТС ANG SEQ ID No: 6 (F)
 части клеточных культур, трансфицированных ГТС ANG SEQ ID No: 7 (G)
части клеточных культур, трансфицированных ГТС ANG SEQ ID No: 7 (G)
 части клеточных культур, трансфицированных плацебо (Н)
части клеточных культур, трансфицированных плацебо (Н)
На фиг. 13
С целью одтверждения увеличения экспрессии гена ANG в клеточной культуре эпителиальных клеток глаза человека при трансфекции данных клеток генно-терапевтической субстанцией с кДНК гена ANG в генетической конструкции pCMV6-Kan/Neo ANG SEQ ID No: 2 приведены графики накопления ПЦР-продуктов, соответствующих:
1 - кДНК гена ANG, эпителий роговицы до трансфекции
2 - кДНК гена ANG, эпителий роговицы после трансфекции
3 - кДНК гена В2М, эпителий роговицы до трансфекции
4 - кДНК гена В2М, эпителий роговицы после трансфекции
Ген В2М использовали в качестве референтного.
Из фигуры следует, что в результате трансфекции уровень специфической кДНК гена ANG в культуре клеток эпителия роговицы человека многократно вырос.
На фиг. 14
С целью подтверждения увеличения экспрессии гена ANG в клеточной культуре эпителия слизистой оболочки полости рта при трансфекции данных клеток генно-терапевтической субстанцией с кДНК гена ANG приведены графики накопления ПЦР-продуктов, соответствующих:
1 - кДНК гена ANG, до трансфекции
2 - кДНК гена ANG, после трансфекции
3 - кДНК гена В2М, до трансфекции
4 - кДНК гена В2М, после трансфекции
Ген В2М использовали в качестве референтного.
Из фигуры следует, что в результате трансфекции уровень специфической кДНК гена ANG вырос многократно.
На фиг. 15
С целью подтверждения увеличения количества белка ангиогенина, в коже человека при введении в кожу генно-терапевтической субстанции представлен анализ изменения количества белка ангиогенина в коже. При этом пациенту вводили генно-терапевтическую субстанцию, содержащую векторную плазмиду с кДНК гена ANG pCMV6-ANG SEQ ID No: 4 (В) и параллельно вводили плацебо, представляющее собой комбинацию векторной плазмиды pCMV-XL5 не содержащей кДНК гена ANG с транспортной молекулой (А) - в кожу предплечья. Показано увеличение количества белка ангиогенина, в биоптате кожи пациента 1В, которому вводились генно-терапевтическая субстанция, содержащая генетическую конструкцию с кДНК гена ANG, что говорит об эффективности генно-терапевтической субстанции.
Обозначения:
 пациент 1А
пациент 1А
 пациент 1В
пациент 1В
 пациент 1В до введения ГТС
пациент 1В до введения ГТС
На фиг. 16
С целью подтверждения увеличения количества белка ангиогенина в слизистой оболочке полости рта человека при введении в слизистую оболочку полости рта генно-терапевтической субстанции представлен анализ изменения количества белка ангиогенина, в слизистой оболочке полости рта. При этом пациенту вводили генно-терапевтическую субстанцию, содержащую векторную плазмиду с кДНК гена ANG pCDNA 3.1 ANG SEQ ID No: 5 (В) и параллельно вводили плацебо pCDNA 3.1(+), представляющее собой комбинацию векторной плазмиды не содержащей кДНК гена ANG с транспортной молекулой (А) - в слизистую оболочку полости рта.
Показано увеличение количества белка ангиогенина, в лизате биоптата слизистой оболочки полости рта пациента 1В, которому вводились генно-терапевтическая субстанция, содержащая генетическую конструкцию с кДНК гена ANG, что говорит об эффективности генно-терапевтической субстанции.
Обозначения:
 пациент 1А
пациент 1А
 пациент 1В
пациент 1В
 пациент 1В до введения ГТС
пациент 1В до введения ГТС
На фиг. 17
С целью подтверждения увеличения количества белка ангиогенина, в мышечной ткани человека при введении в мышечную ткань генно-терапевтической субстанции представлен анализ изменения количества белка ангиогенина в мышечной ткани. При этом пациенту вводили генно-терапевтическую субстанцию, содержащую векторную плазмиду с кДНК гена ANG - pCMV6-Kan/Neo ANG SEQ ID No: 6 (В) и параллельно вводили плацебо pCMV6-Kan/Neo, представляющее собой комбинацию векторной плазмиды не содержащей кДНК гена ANG с транспортной молекулой (А) - в мышечную ткань в зоне предплечья. Показано увеличение количества белка ангиогенина, в биоптате мышечной ткани пациента 1В, которому вводились генно-терапевтическая субстанция, содержащая генетическую конструкцию с кДНК гена ANG, что говорит об эффективности генно-терапевтической субстанции.
Обозначения:
 пациент 1А
пациент 1А
 пациент 1В
пациент 1В
 пациент 1В до введения ГТС
пациент 1В до введения ГТС
На фиг. 18
С целью подтверждения увеличения количества белка ангиогенина до различного индивидуального уровня при введении в кожу пациентов генно-терапевтических субстанций с модифицированными кДНК гена ANG и участком нативной немодифицированной кДНК гена ANG анализировали уровень количества белка ангиогенина в коже человека в зависимости от наличия и типа модификаций в кДНК гена ANG.
Каждому из 31-го пациента, которые были отобраны в случайном порядке, вводили в кожу предплечья 7 генно-терапевтических субстанций pCMV6- SEQ ID No: 1, pCMV6- SEQ ID No: 2, pCMV6- SEQ ID No: 3, pCMV6- SEQ ID No: 4, pCMV6- SEQ ID No: 5, pCMV6- SEQ ID No: 6, pCMV6- SEQ ID No: 7, и плацебо pCMV6- XL5.
По итогам анализа уровня количества белка ангиогенина, в биоптатах выбрали показатели, касательно каждого биоптата от каждого пациента, продемонстрировавшие максимальные уровни количества белка ангиогенина, и объединили их в семь групп, исходя из следующего критерия:
В группе 1 максимальная активность белка ангиогенина, наблюдалась при введении pCMV6-ANG SEQ ID No: 1,
в группе 2 максимальная активность белка ангиогенина, наблюдалась при введении pCMV6-ANG SEQ ID No: 2,
в группе 3 максимальная активность белка ангиогенина, наблюдалась при введении pCMV6-ANG SEQ ID No: 3,
в группе 4 максимальная активность белка ангиогенина, наблюдалась при введении pCMV6-ANG SEQ ID No: 4,
в группе 5 максимальная активность белка ангиогенина, наблюдалась при введении рСМV6-ANG SEQ ID No: 5,
в группе 6 максимальная активность белка ангиогенина, наблюдалась при введении pCMV6-ANG SEQ ID No: 6,
в группе 7 максимальная активность белка ангиогенина, наблюдалась при введении pCMV6-ANG SEQ ID No: 7.
Ни в одном из биоптатов не наблюдалось того, что максимальное количество белка ангиогенина, присутствует в случае введения плацебо.
На фигуре 18 для каждой группы биоптатов приведены диаграммы показателей (усредненных в рамках группы, в случае, если в группу входит более одного биоптата) применительно ко всем, участвующим в эксперименте генно-терапевтическим субстанциям, после введения пациентам этих генно-терапевтических субстанций, содержащих модифицированные кДНК гена ANG и участок нативной немодифицированной кДНК гена ANG.
Из данного примера следует, что достижение максимального количества белка ангиогенина, в биоптатах кожи различных пациентов при введении им в кожу генно-терапевтических субстанций, связано с индивидуальными особенностями пациентов и зависит от наличия и типа модификаций в кДНК гена ANG, входящих в генно-терапевтические субстанции.
Каждая генно-терапевтическая субстанция из группы генно-терапевтических субстанций является эффективной в некоторой значительной группе пациентов. Следовательно, для выбора наиболее эффективной генно-терапевтической субстанции из группы генно-терапевтических субстанций для терапевтических целей, необходимо предварительное персонализированное исследование пациента.
Обозначения:
 биоптаты пациентов после введения ГТС ANG SEQ ID No: 1 (А)
биоптаты пациентов после введения ГТС ANG SEQ ID No: 1 (А)
 биоптаты пациентов после введения ГТС ANG SEQ ID No: 2 (В)
биоптаты пациентов после введения ГТС ANG SEQ ID No: 2 (В)
 биоптаты пациентов после введения ГТС ANG SEQ ID No: 3 (С)
биоптаты пациентов после введения ГТС ANG SEQ ID No: 3 (С)
 биоптаты пациентов после введения ГТС ANG SEQ ID No: 4 (D)
биоптаты пациентов после введения ГТС ANG SEQ ID No: 4 (D)
 биоптаты пациентов после введения ГТС ANG SEQ ID No: 5 (Е)
биоптаты пациентов после введения ГТС ANG SEQ ID No: 5 (Е)
 биоптаты пациентов после введения ГТС ANG SEQ ID No: 6 (F)
биоптаты пациентов после введения ГТС ANG SEQ ID No: 6 (F)
 биоптаты пациентов после введения ГТС ANG SEQ ID No: 7 (G)
биоптаты пациентов после введения ГТС ANG SEQ ID No: 7 (G)
 биоптаты пациентов после введения плацебо (Н)
биоптаты пациентов после введения плацебо (Н)
На фиг. 19
С целью определения наиболее эффективной применительно к конкретному пациенту генно-терапевтической субстанции анализировали количество белка ангиогенина, в клеточных лизатах фибробластов этого пациента, трансфицированных разными генетическими конструкциями, содержащими участок нативной немодифицированной кДНК гена ANG или модифицированные кДНК гена ANG.
По итогам анализа количества белка ангиогенина, в культуре фибробластов пациента выделили вариант генно-терапевтической субстанции, при трансфекции которой выявляется максимальная концентрация белка ангиогенина. В данном эксперименте максимальная концентрация белка ангиогенина в лизате наблюдается при трансфекции генно-терапевтической субстанцией на базе pCMV6 ANG SEQ ID No: 1, содержащей участок нативной немодифицированной кДНК гена ANG, что показано на фигуре 19.
Таким образом, выбрана наиболее эффективная применительно к данному пациенту генно-терапевтическая субстанция для последующей трансфекции клеток пациента в рамках терапевтической процедуры.
Обозначения:
1 - клеточный лизат после трансфекции ГТС ANG SEQ ID No: 1 (А)
2 - клеточный лизат после трансфекции ГТС ANG SEQ ID No: 2 (В)
3 - клеточный лизат после трансфекции ГТС ANG SEQ ID No: 3 (С)
4 - клеточный лизат после трансфекции ГТС ANG SEQ ID No: 4 (D)
5 - клеточный лизат после трансфекции ГТС ANG SEQ ID No: 5 (Е)
6 - клеточный лизат после трансфекции ГТС ANG SEQ ID No: 6 (F)
7 - клеточный лизат после трансфекции ГТС ANG SEQ ID No: 7 (G)
8 - клеточный лизат после трансфекции плацебо (Н)
На фиг. 20
С целью определения наиболее эффективной применительно к конкретному пациенту генно-терапевтической субстанции анализировали количество белка ангиогенина в лизатах биоптатов кожи этого пациента, после введения ему генно-терапевтических субстанций, содержащих участок нативной немодифицированной кДНК гена ANG или участки модифицированных кДНК гена ANG.
По итогам анализа количества белка ангиогенина, в лизате биоптатов кожи пациента выделили вариант генно-терапевтической субстанции, при трансфекции которой выявляется максимальная концентрация белка ангиогенина. В данном эксперименте максимальная концентрация белка ангиогенина отмечена при введении генно-терапевтической субстанции на базе pCMV6 ANG SEQ ID No: 7, содержащей модифицированную кДНК гена, что показано на фигуре 20.
Таким образом, выбрана наиболее эффективная применительно к данному пациенту генно-терапевтическая субстанция для ее последующего введения пациенту в рамках терапевтической процедуры.
Обозначения:
1 - лизат биоптата после введения ГТС ANG SEQ ID No: 1 (А)
2 - лизат биоптата после введения ГТС ANG SEQ ID No: 2 (В)
3 - лизат биоптата после введения ГТС ANG SEQ ID No: 3 (С)
4 - лизат биоптата после введения ГТС ANG SEQ ID No: 4 (D)
5 - лизат биоптата после введения ГТС ANG SEQ ID No: 5 (Е)
6 - лизат биоптата после введения ГТС ANG SEQ ID No: 6 (F)
7 - лизат биоптата после введения ГТС ANG SEQ ID No: 7 (G)
8 - лизат биоптата после введения плацебо (Н)
Реализация изобретения.
При снижении экспрессии генов, кодирующих белки ангиогенеза, например, гена ANG, происходит снижение количества белка ангиогенина или снижение его активности в организме, что приводит к патологическим состояниям.
Так у гомозиготных мышей, нокаутных по гену ANG, наблюдали аномальную реакцию на испуг (http://www.mouse phenotype.org/data/genes/MGI:88022).
Преимущества использования генетической конструкции с геном ANG для коррекции экспрессии гена ANG и количества и/или активности белка ангиогенина в клетках органов и тканей человека, по сравнению с использованием фармацевтической композиции на основе нереплицирующихся наночастиц, одна из которых включает ген ангиогенина человека, решение по заявке WO 2013122502 А1 (прототип) следующие:
1) легче обеспечить более высокий и стабильный количественный уровень и активность целевого белка в клетках при одновременной минимизации вероятности встраивания элементов генетической конструкции в геном пациента,
2) обеспечивается транспортировка генно-терапевтической субстанции в больший спектр клеток органов и тканей человека, а также более эффективная внутриклеточная транспортировка генно-терапевтической субстанции при одновременной минимизации вероятности встраивания элементов генетической конструкции в геном пациента,
3) учитываются индивидуальные характеристики пациента.
Таким образом, для создания группы генно-терапевтических субстанций по данному изобретению был выбран ген ANG, а не белок ангиогенин, кодируемый этим геном.
Для получения группы генно-терапевтических субстанций осуществляют следующие действия:
1. Получение участка нативной кДНК гена ANG, содержащей белок-кодирующую область гена ANG, клонирование его в промежуточную плазмиду,
2. Переклонирование участка нативной кДНК гена ANG в экспрессионные векторные плазмиды под контроль эукариотических регуляторных элементов для эффективной экспрессии этой кДНК в клетках органов и тканей человека таким образом, что полученные генетические конструкции содержат кодирующую нуклеотидную последовательность кДНК белка ангиогенина с делециями 5'- нетранслируемых 3'-нетранслируемых областей, которая является участком нативной немодифицированной кДНК гена ANG и которая используются для дальнейших модификаций.
3. Внесение модификаций в последовательность нуклеотидов участка нативной кДНК гена ANG, клонированной в векторных плазмидах, с целью создания группы кДНК гена ANG, обеспечивающих достаточный для борьбы с патологическими проявлениями уровень трансляции белка ангиогенина.
4. Трансформация каждой из полученных генетических конструкций бактериальных клеток E.coli, анализ трансформированных клонов на предмет наличия, ориентации и копийности вставки кДНК и наращивание отобранных клонов для получения необходимого для дальнейшей работы количества вариантов плазмидной ДНК.
5. Выделение группы генетических конструкций, содержащих модифицированные кДНК гена ANG или участок нативной немодифицированной кДНК гена ANG для создания на их базе группы генно-терапевтических субстанций.
6. Создание группы генно-терапевтических субстанций, каждая из которых представляет генетическую конструкцию на основе векторной плазмиды, включающей кДНК гена ANG, с кодирующей последовательностью белка ангиогенина, с делециями 5' и 3'-нетранслируемых областей, а именно, полученной на основе участка нативной немодифицированной кДНК гена ANG SEQ ID No: 1, или модифицированной кДНК гена ANG, при этом в качестве модифицированной кДНК гена ANG используют SEQ ID No: 2, или SEQ ID No: 3, или SEQ ID No: 4, или SEQ ID No: 5, или SEQ ID No: 6, или SEQ ID No: 7, или сочетание этих генетических конструкций, каждая из которых содержит также регуляторные элементы, обеспечивающие высокий уровень экспрессии гена ANG в эукариотических клетках, или комбинацию такой конструкции с транспортной молекулой для эффективной трансфекции различных типов клеток органов и тканей и/или введения в органы и ткани человека.
Для доказательства эффективности созданных генно-терапевтических субстанций, приводящих к увеличению экспрессии гена ANG, проводят следующие исследования:
A) Выращивание культур различных типов клеток из биоптатов различных органов и тканей человека, например, фибробластов кожи человека, или клеток эпителия слизистой оболочки полости рта, или клеток эпителия роговицы глаза.
B) Выделение РНК из культуры клеток, например, фибробластов кожи человека, или клеток эпителия слизистой оболочки полости рта, или клеток эпителия роговицы глаза и анализ экспрессии гена ANG из генома этих клеток.
C) Трансфекция культуры клеток, например, фибробластов кожи человека, или клеток эпителия слизистой оболочки полости рта, или клеток эпителия роговицы глаза генно-терапевтическими субстанциями содержащими участок нативной немодифицированной кДНК гена ANG или модифицированные кДНК гена ANG и параллельная трансфекция культуры этих же клеток векторной плазмидой, не содержащей кДНК гена ANG в различных комбинациях.
D) Сравнительный анализ изменения уровня мРНК гена ANG и/или изменения количества белка ангиогенина, после трансфекции в различных комбинациях клеток, например, фибробластов кожи человека, или клеток эпителия слизистой оболочки полости рта, или клеток эпителия роговицы глаза генно-терапевтическими субстанциями содержащими участок нативной немодифицированной кДНК гена ANG и/или модифицированные кДНК гена ANG и параллельной трансфекции культуры этих же клеток векторной плазмидой, не содержащей кДНК гена ANG. Данный анализ проводят, в частности, перед предполагаемой терапией с целью определения наиболее эффективной для пациента генно-терапевтической субстанции.
E) Введение пациентам в органы и ткани культуры клеток трансфицированных генно-терапевтической субстанцией с кДНК гена ANG, например, введение, в кожу человека, аутологичных фибробластов, трансфицированных генно-терапевтической субстанцией с кДНК гена ANG и параллельное введение пациентам в органы и ткани, например, в кожу, культур этих же клеток нетрансфицированных и трансфицированных вектором без вставки кДНК гена ANG и/или введение пациентам в органы и ткани генно-терапевтических субстанций, например, введение в кожу человека генно-терапевтических субстанций, содержащих участок нативной немодифицированной кДНК гена ANG или модифицированные кДНК ANG, а также плацебо в различных комбинация.
F) Сравнительный анализ количества белка ангиогенина, в органах и тканях человека, в частности в коже человека, после введения клеток нетрансфицированных и трансфицированных генно-терапевтическими субстанциями, содержащими кДНК гена ANG и векторными плазмидами, не содержащими кДНК гена ANG или генно-терапевтических субстанций, содержащих участок нативной немодифицированной кДНК гена ANG или модифицированные кДНК гена ANG, а также плацебо.
G) Введение пациентам в органы и ткани, например, в слизистую оболочку полости рта или мышечную ткань, генно-терапевтических субстанций, содержащих участок нативной немодифицированной кДНК гена ANG или модифицированные кДНК гена ANG, а также плацебо.
H) Сравнительный анализ количества белка ангиогенина, в органах и тканях человека, в частности в слизистой оболочке полости рта, или мышечной ткани человека, после введения генно-терапевтических субстанций, содержащих участок нативной немодифицированной кДНК гена ANG или модифицированные кДНК гена ANG а также плацебо.
I) Введение пациентам в органы и ткани, например, введение в кожу пациента генно-терапевтических субстанций, содержащих участок нативной немодифицированной кДНК гена ANG или модифицированные кДНК гена ANG.
J) Сравнительный анализ количества белка ангиогенина, в органах и тканях пациента, в частности в коже, после введения генно-терапевтических субстанций, содержащих участок нативной немодифицированной кДНК гена ANG или модифицированные кДНК гена ANG. Данный анализ проводят, в частности, перед предполагаемой терапией с целью выбора наиболее эффективной для пациента генно-терапевтической субстанции из группы генно-терапевтических субстанций.
Пример 1.
Получение и клонирование нативной немодифицированной кДНК гена ANG.
Немодифицированная кДНК гена ANG представляет собой последовательность нуклеотидов, которая имеет высокую гомологию с нуклеотидной последовательностью гена и мРНК ANG, приведенной в базе данных GenBank под номером NM_001145; нуклеотиды с 601 по 1044 транслируются в аминокислотную последовательность белка ангиогенина, соответствующую приведенной в GenBank под номером NP_ NP_001136.1.
Суммарную РНК получают из клеток человеческой крови с помощью набора PAXGeneBlood RNA Kit (Qiagen, Germany) и используют для получения суммарной кДНК путем обратной транскрипции с помощью обратной транскриптазы RevertAid (ThermoScientific, USA) и случайных 9-нуклеотидных праймеров по методике производителя обратной транскриптазы. Затем, используя суммарную кДНК в качестве матрицы и специфичные, предварительно кинированные праймеры, комплементарные нуклеотидам 84-103 5' TGGACGCTCAGCCAGGGGTA 3' (ANG-F1) и 1081-1060 5' GGACAGCAGAGCCAGCACTTGA 3' (ANG-R1) из последовательности мРНК ANG (NM_001145), получают участок нативной немодифицированной кДНК гена ANG, содержащий кодирующую последовательность белка ангиогенина, и частичные делеции 5' и 3'-нетранслируемых областей. Полимеразную цепную реакцию (ПЦР) проводят с помощью ДНК-полимеразы Phusion (ThermoScientific, USA), дающей продукты с тупыми концами, на амплификаторе Master CyclerGradient (Eppendorf, USA) в 50 мкл. реакционной смеси, содержащей 0,5 мкл суммарной кДНК первой цепи, по 0,1 мкМ каждого праймера ANG F1 и ANG R1, 250 мкМ каждого дезоксинуклеозидтрифосфата (дАТФ, дЦТФ, дТТФ и дГТФ), 100 мМ трис-HCl (рН 8,85 при 20°С), 50 мМ сульфата аммония, 250 мМ хлористого калия, 0,01% Твин-20 и 5 ед. Pfu ДНК-пол имеразы (PhusionThermoScientific, USA) при следующих условиях: первоначальная денатурация при +98°С в течение 30 сек., 35 циклов, включающих денатурацию при +98°С в течение 10 сек., отжиг праймеров при +65°С в течение 30 сек. и элонгацию при +68°С течение 2 минут.
Продукт амплификации выделяют из агарозного геля с помощью набора QIAquickGelExtractionKit (Qiagen, Germany)
Амплифицированный фрагмент кДНК длиной 998 н.п, несущий участок нативной немодифицированной кДНК гена ANG, клонируют в плазмидном векторе pUC19 (NEB, USA, кат номер N3041S). ДНК векторной плазмиды pUC19 (NEB, USA, кат номер N3041S) гидролизуют рестриктазой, дающей тупые концы, например, SmaI (NEB, USA) и обрабатывают щелочной фосфатазой. Амплифицированный фрагмент кДНК и линеаризованную плазмиду pUC19 лигируют с помощью ДНК-лигазы фага Т4 400000 ед./мл. (NEB, USA, кат номер M0202S) из расчета 1 мкл фермента на 1 мкг ДНК. Лигирование проводят в объеме 20 мкл в присутствии 2 мМ АТФ, 50 мМ трис -HCl, pH 7,6, 10 мМ MgCl2, 10 мМ DTT в течение 10 ч при +16°C.
Полученной смесью трансформируют компетентные клетки Е.coliTop10 (http://molbiol.ru/protocol/03_04.html), которые высевают на чашки Петри с L-агаром, содержащих 100 мкг/мл ампициллина и по 40 мкл на чашку растворов 100 мМ ИПТГ и 2% X-gal. Отдельные колонии анализируют на наличие вставки с помощью ПЦР с праймерами ANG--F1 и ANG--R1 и подтверждают секвенированием по методу Сэнгера.
Пример 2.
Получение генетических конструкций с участком немодифицированной кДНК гена ANG
Для экспрессии участка немодифицированной кДНК гена ANG в клетках органов и тканей человека вариант кДНК гена ANG по Примеру 1 помещают в векторную плазмиду, при выборе которой используют следующие критерии выбора:
1) плазмида должна обязательно реплицироваться в E.coli, желательно с высокой копийностью;
2) в плазмиде должен быть бактериальный фактор селекции (например, ген устойчивости к антибиотику, либо другой фактор селекции не содержащий генов резистентности к антибиотикам);
3) в плазмиде должно быть наличие эукариотических регуляторных элементов - обязательных промотора и терминатора (сигнала полиаденилирования), например, энхансер и интронный(е) элемент(ы);
4) в плазмиде должно быть наличие удобного полилинкера для клонирования. Примером такой плазмиды может быть pCMV6-XL5, pCMV6-Kan/Neo (OriGene, USA) или pCDNA 3.1 (+) (ThermoFisherScientific, USA), либо плазмидные векторы вирусного происхождения - например, аденовирус человека 5-го серотипа.
5) Плазмида может содержать нуклеотидные последовательности с регуляторными элементами для репликации в клетках млекопитающих, например, такие как SV40 ori из вируса обезьян SV40 или ori P/EBNA-1 из вируса Эпштейн-Барра человека.
6) Плазмида также может содержать дополнительные регуляторные элементы, усиливающие трансляцию белка, например, участки связывания с транскрипционным фактором NFkB, обеспечивающим активный транспорт плазмидной ДНК в клеточное ядро для более эффективной транскрипции целевого гена.
При клонировании кДНК гена ANG в pCDNA 3.1 (+) кодирующая нуклеотидная последовательность помещается под контроль промотора цитомегаловируса человека CMV, эффективного в эукариотических клетках, и сигнала полиаденилирования гена бычьего гормона роста. Также данная плазмида обладает бактериальным фактором селекции - геном устойчивости к ампициллину, и эукариотическим фактором селекции - геном устойчивости к неомицину.
При клонировании кДНК гена ANG в pCMV6-XL5, pCMV6-Kan/Neo кодирующая нуклеотидная последовательность помещается под контроль промотора цитомегаловируса человека CMV, эффективного в эукариотических клетках, и сигнала полиаденилирования гена гормона роста человека. Также данная плазмида обладает бактериальным фактором селекции - геном устойчивости к ампициллину.
Векторную плазмиду pUC19-ANG с нативной немодифицированной последовательностью кДНК гена ANG используют в качестве матрицы для амплификации со следующими парами праймеров:
1 пара для ориентации Hind III - ANG - Eco RI
ANG F2 GGAAGCTTGCCACCATGGTGATGGGCCTGGG
ANG R2 GGGAATTCTTACGGACGACGGAAAA
2 пара для ориентации RI - ANG - Hind III
ANG F3 GGGAATTCGCCACCATGGTGATGGGCCTGGG
ANG R3 GGAAGCTTTTACGGACGACGGAAAA
Амплификацию проводят при условиях, приведенных в Примере 1. Далее продукты амплификации переосаждают этиловым спиртом, осадки промывают 70% этанолом и растворяют в 1× ТЕ буфере, после чего подвергают рестрикции с эндонуклеазами EcoRI и HindIII.
Продукты рестрикции разделяют с помощью электрофореза в геле 1% агарозы, окрашивают раствором бромистого этидия и фрагменты ДНК, соответствующие гену-вставке HindIII-5'NTR-кДНК ANG-3'NTR-EcoRI, либо EcoRI-5'NTR-кДНК ANG-3'NTR-HindIII и линеаризованной плазмиде pCMV6-XL5 и pCMV6-Kan/Neo и pCDNA 3.1(+), вырезают, выделяют из геля с помощью набора для выделения из геля QIAquickGelExtractionKit (Qiagen, Germany) и смешивают. Полученную смесь рестрикционных фрагментов лигируют с помощью ДНК-лигазы фага Т4. Лигирование проводят в течение 10-15 мин при комнатной температуре, а затем - при 12°С в течение 10 ч. Лигированную ДНК используют для трансформации клеток Е. coli по стандартной методике с использованием хлористого кальция. Трансформированные клетки отбирают на агаризованной среде LB с ампициллином (100 мкг/мл). Плазмидную ДНК из ампициллин-устойчивых колоний выделяют с помощью набора для выделения плазмид QiagenSpinMiniprepKit (Qiagen, Germany), анализируют с помощью гидролиза рестриктазами EcoRI и HindiII и отбирают генетическую (ие) конструкцию (ии) с помощью секвенирования ДНК по методу Сэнгера.
Бактерии, содержащие полученные генетические конструкции на базе векторов pCMV6-XL5, pCMV6-Kan/Neo и pCDNA 3.1(+), выращивают на жидкой среде LB с ампициллином, лизируют и выделяют плазмидную ДНК для трансфекции специальным набором для выделения плазмид QiagenMaxiKit (Qiagen, Germany) для получения соответствующих генно-терапевтических субстанций.
Таким образом, получают экспрессионые генетические конструкции на базе векторов pCMV6-XL5, pCMV6-Kan/Neo и pCDNA 3.1(+), содержащие нуклеотидную последовательность длиной 444 н.п., полученную за счет делеции 5'-нетранслируемых и 3'-нетранслируемых областей, с первичной структурой, приведенной на фиг. 1 Seq ID No 1.
Пример 3.
Модификации кДНК гена ANG в генетических конструкциях для получения на их основе генно-терапевтических субстанций.
Модификации проводят таким образом, чтобы не затрагивать первичную структуру белка ангиогенина, а именно, нуклеотидные замены, не приводящие к аминокислотным заменам или обрыву аминокислотной цепи, и, соответственно, не влияющие на кодируемую этой последовательностью аминокислотную последовательность.
В частности для получения модифицированных кДНК гена ANG с целью повышения эффективности транскрипции и трансляции белка ангиогенина, в клетках тканей и органов человека в участок нативной последовательности кДНК гена ANG, используя принцип оптимизации кодонов, вносят модификации путем замены минорных кодонов на синонимичные мажорные таким образом, чтобы замены не привели к изменениям в аминокислотной последовательности белка или обрыву аминокислотной цепи при трансляции, не ухудшили процессы транскрипции и трансляции.
Все модификации осуществляют в несколько этапов методом ПЦР мутагенеза набором QuikChANGe II XL kit или QuikChANGe Multi Site-Directed Mutagenesis Kit (AgilentTechnologies, USA,) согласно рекомендациям производителя.
http://www.agilent.com/cs/library/usermanuals/Public/200513.
К плазмидной ДНК, полученной по Примеру 2, в количестве 10-50 нг добавляют 50-100 нг праймера, содержащего необходимую замену, инсерцию или делецию длиной 19-45 н.п. и проводят ПЦР в буфере QuikChANGe Multi reaction buffer (AgilentTechnologies, USA) со смесью ферментов QuikChANGe Multi mix (AgilentTechnologies, USA) при следующих условиях: 95°C, 1 мин; далее от 30 до 35 циклов: 95°С 1 минута, 55°С 1 минута, 65°С 2 минуты/1000 н.п. После проведения ПЦР к амплификационной смеси добавляют 1-2 мкл рестриктазы Dpn I и инкубируют 1-2 часа при 37°С. Полученной смесью трансформируют компетентные клетки E.coli Тор10 (http://molbiol.ru/protocol/03_04.html). которые высевают на чашки с L-агаром, содержащих 100 мкг/мл ампициллина. Трансформированнные колонии анализируют на содержание мутаций секвенированием плазмидной ДНК по методу Сэнгера.
Для получения модифицированной кДНК ANG SEQ ID No 2 проводят последовательный ПЦР-мутагенез на плазмидах pCMV6-XL5-ANG Seq ID No1, pCMV6-Kan/Neo-ANG Seq ID No 1 и pCDNA 3.1(+)- ANG Seq ID No 1 с праймерами, комплементарными участкам нативной кДНК ANG, приведенной в GenBank под номером NM_001145:
1. ANG 651-680 F:
5' TCTGACCCCACCCACCCTGGCTCAGGATAA 3',
Комплементарный нуклеотидам 651-680, с заменой G→C в позиции 663;
Модифицированная таким образом нуклеотидная последовательность кДНК ANG SEQ ID No: 2 содержит 1 нуклеотидную замену G→C в позиции 663, не приводящую к изменениям в аминокислотной последовательности белка, кодируемого последовательностью гена ANG и имеет первичную структуру, приведенную на фиг. 2:
Для получения модифицированной кДНК ANG SEQ ID No 3 проводят последовательный ПЦР-мутагенез на плазмидах pCMV6-XL5-ANG Seq ID No 1, pCMV6-Kan/Neo-ANG Seq ID No 1 и pCDNA 3.1(+)- ANG Seq ID No 1 с праймерами, комплементарными участкам нативной кДНК ANG, приведенной в GenBank под номером NM_001145:
1. ANG 651-680 F:
5' TCTGACCCCACCCACCCTGGCTCAGGATAA 3',
Комплементарный нуклеотидам 600-633, с заменой G→C в позиции 615;
2. ANG 910-929F:
5' ACTTGCAAGCTGCATGGAGG 3',
Комплементарный нуклеотидам 910-929, с заменой A→G в позиции 921;
Модифицированная таким образом нуклеотидная последовательность кДНК ANG SEQ ID No: 3 содержит 1 нуклеотидную замену G→C в позиции 663, и одну нуклеотидную замену A→G в позиции 921; не приводящие к изменениям в аминокислотной последовательности белка ангиогенина, и имеет первичную структуру, приведенную на фиг. 3.
Для получения модифицированной кДНК ANG SEQ ID No 4 проводят последовательный ПЦР-мутагенез на плазмидах pCMV6-XL5-ANG Seq ID No 1, pCMV6-Kan/Neo-ANG Seq ID No 1 и pCDNA 3.1(+)- ANG Seq ID No 1 с праймерами, комплементарными участкам нативной кДНК ANG, приведенной в GenBank под номером NM_001145:
1. ANG 651-680 F:
5' TCTGACCCCACCCACCCTGGCTCAGGATAA 3',
Комплементарный нуклеотидам 600-633, с заменой G→C в позиции 615;
2. ANG 910-929F:
5' ACTTGCAAGCTGCATGGAGG 3',
Комплементарный нуклеотидам 910-929, с заменой A→G в позиции 921;
3. ANG 866-891F:
5' ACAGAGAAAACCTGAGAATCAGCAAG 3',
Комплементарный нуклеотидам 866-891, с заменой A→G в позиции 879 и заменой А→С в позиции 885;
Модифицированная таким образом нуклеотидная последовательность кДНК ANG SEQ ID No: 4 содержит 1 нуклеотидную замену G→C в позиции 663, 2 нуклеотидных замены A→G в позициях 879, 921; 1 нуклеотидную замену А→С в позиции 885, не приводящие к изменениям в аминокислотной последовательности белка ангиогенина, и имеет первичную структуру, приведенную на фиг. 4.
Для получения модифицированной кДНК ANG SEQ ID No 5 проводят последовательный ПЦР-мутагенез на плазмидах pCMV6-XL5-ANG Seq ID No 1, pCMV6-Kan/Neo-ANG Seq ID No 1 и pCDNA 3.1(+)- ANG Seq ID No 1 с праймерами, комплементарными участкам нативной кДНК ANG, приведенной в GenBank под номером NM_001145:
1. ANG 651-680 F:
5' TCTGACCCCACCCACCCTGGCTCAGGATAA 3',
Комплементарный нуклеотидам 600-633, с заменой G→C в позиции 615;
2. ANG 910-929F:
5' ACTTGCAAGCTGCATGGAGG 3',
Комплементарный нуклеотидам 910-929, с заменой A→G в позиции 921;
3. ANG 866-891F:
5' ACAGAGAAAACCTGAGAATCAGCAAG 3',
Комплементарный нуклеотидам 866-891, с заменой A→G в позиции 879 и заменой А→С в позиции 885;
4. ANG 938-977F:
5' GGCCTCCATGCCAGTACCGGGCCACAGCCGGGTTCAGAAA 3',
Комплементарный нуклеотидам 938-977, с заменой A→G в позиции 957 и заменой G→C в позиции 966;
Модифицированная таким образом нуклеотидная последовательность кДНК ANG SEQ ID No: 5 содержит 2 нуклеотидных замены G→C в позиции 663, 966; 3 нуклеотидных замены A→G в позициях 879, 921, 957; 1 нуклеотидную замену А→С в позиции 885, не приводящие к изменениям в аминокислотной последовательности белка ангиогенина, и имеет первичную структуру, приведенную на фиг. 5.
Для получения модифицированной кДНК ANG SEQ ID No 6 проводят последовательный ПЦР-мутагенез на плазмидах pCMV6-XL5-ANG Seq ID No 1, pCMV6-Kan/Neo-ANG Seq ID No 1 и pCDNA 3.1(+)- ANG Seq ID No 1 с праймерами, комплементарными участкам нативной кДНК ANG, приведенной в GenBank под номером NM_001145:
1. ANG 651-680 F:
5' TCTGACCCCACCCACCCTGGCTCAGGATAA 3',
Комплементарный нуклеотидам 600-633, с заменой G→C в позиции 615;
2. ANG 910-929F:
5' ACTTGCAAGCTGCATGGAGG 3',
Комплементарный нуклеотидам 910-929, с заменой A→G в позиции 921;
3. ANG 866-891F:
5' ACAGAGAAAACCTGAGААТСAGСAAG 3',
Комплементарный нуклеотидам 866-891, с заменой A→G в позиции 879 и заменой А→С в позиции 885;
4. ANG 938-977F:
5' GGCCTCCATGCCAGTACCGGGCCACAGCCGGGTTCAGAAA 3',
Комплементарный нуклеотидам 938-977, с заменой A→G в позиции 957 и заменой G→C в позиции 966;
5. ANG 994-1023F:
5' GAAAATGGCCTGCCTGTCCACTTGGATCAG 3',
Комплементарный нуклеотидам 994-1023, с заменой A→G в позиции 1005 и заменой Т→С в позиции 1003;
Модифицированная таким образом нуклеотидная последовательность кДНК ANG SEQ ID No: 6 содержит 2 нуклеотидных замены G→C в позицииях 663, 966; 4 нуклеотидные замены A→G в позициях 879, 921, 957, 1005; 1 нуклеотидную замену А→С в позиции 885, 1 нуклеотидную замену Т→С в позиции 1003; не приводящие к изменениям в аминокислотной последовательности белка ангиогенина, и имеет первичную структуру, приведенную на фиг. 6.
Для получения модифицированной кДНК ANG SEQ ID No 7 проводят последовательный ПЦР-мутагенез на плазмидах pCMV6-XL5-ANG Seq ID No 1, pCMV6-Kan/Neo-ANG Seq ID No 1 и pCDNA 3.1(+)- ANG Seq ID No 1 с праймерами, комплементарными участкам нативной кДНК ANG, приведенной в GenBank под номером NM_001145:
1. ANG 651-680 F:
5' TCTGACCCCACCCACCCTGGCTCAGGATAA 3',
Комплементарный нуклеотидам 600-633, с заменой G→C в позиции 615;
2. ANG 910-929F:
5' ACTTGCAAGCTGCATGGAGG 3',
Комплементарный нуклеотидам 910-929, с заменой A→G в позиции 921;
3. ANG 866-891F:
5' ACAGAGAAAACCTGAGAATCAGCAAG 3',
Комплементарный нуклеотидам 866-891, с заменой A→G в позиции 879 и заменой А→С в позиции 885;
4. ANG 938-977F:
5' GGCCTCCATGCCAGTACCGGGCCACAGCCGGGTTCAGAAA 3',
Комплементарный нуклеотидам 938-977, с заменой A→G в позиции 957 и заменой G→C в позиции 966;
5. ANG 994-1023F:
5' GAAAATGGCCTGCCTGTCCACTTGGATCAG 3',
Комплементарный нуклеотидам 994-1023, с заменой A→G в позиции 1005 и заменой Т→С в позиции 1003;
6. ANG 1024-1044F:
5' TCAATTTTCCGGCGGCCGTAA 3',
Комплементарный нуклеотидам 1024-1044, с заменами T→G в позициях 1035, 1038;
Модифицированная таким образом нуклеотидная последовательность кДНК ANG SEQ ID No: 7 содержит 2 нуклеотидных замены G→C в позиции 663, 966; 4 нуклеотидных замены A→G в позициях 879, 921, 957, 1005; 1 нуклеотидную замену А→С в позиции 885, 1 нуклеотидную замену Т→С в позиции 1003; и 2 нуклеотидные замены T→G в позициях 1035 и 1038; не приводящие к изменениям в аминокислотной последовательности белка ангиогенина, и имеет первичную структуру, приведенную на фиг. 7.
Таким образом, получают экспрессионные векторы на базе плазмид pCMV6-XL5, pCMV6-Kan/Neo и pCDNA 3.1(+), в которых клонированы участок нативной немодифицированной кДНК гена ANG (SEQ ID No: 1) и модифицированные нуклеотидные последовательности кДНК гена ANG (SEQ ID No: 2, 3, 4, 5, 6, 7), кодирующие белок ангиогенина.
Бактерии, содержащие полученные генетические конструкции на базе векторов pCMV6-XL5, pCMV6-Kan/Neo и pCDNA 3.1(+), выращивают на жидкой среде LB с ампициллином, лизируют и выделяют плазмидную ДНК для трансфекции специальным набором для выделения плазмид QiagenMaxiKit для получения соответствующих генно-терапевтических субстанций.
Полученные экспрессионные векторы используют для получения на их основе генно-терапевтических субстанций, которые в дальнейшем применяют для трансфекции эукариотических клеток органов и тканей и/или введения в органы и ткани человека. В качестве контрольных плазмид используют исходный вектор pCMV6-XL5, (pCMV6-Kan/Neo) или pCDNA 3.1 (+) без вставки кДНК гена ANG.
Пример 4.
Наращивание генетической конструкции в бактериальной культуре.
Для получения препаративных количеств векторной плазмиды, содержащей один из вариантов кДНК гена ANG, полученными конструкциями по примеру 3 трансформируют бактериальные клетки E.coli (Маниатис Т., и др. Молекулярное клонирование. М., Мир, 1984) и выращивают полученные клоны бактерий, содержащие конструкцию, в присутствии бактериального фактора селекции - устойчивости к ампициллину.
Лигазную смесь по примеру 3 используют для трансформации компетентных клеток E.coli штамма XLblue. Предварительный отбор клонов, содержащих вставку кДНК гена ANG в правильной ориентации и единичной копии, осуществляют путем гидролиза плазмидной ДНК рестриктазами EcoRI и HindiII и анализа продуктов рестрикции путем электрофореза в 1.2% агарозном геле. Отобранные клоны используют для препаративного наращивания плазмидной ДНК с целью дальнейшей трансфекции в культуры фибробластов (клеток эпителия слизистой оболочки полости рта, или клеток эпителия роговицы глаза и др.).
Для получения препаративных количеств генетических экспрессионных конструкций по Примеру 3 выращивали 20 мл ночной культуры E.coli в LB-среде с 150 мкг/мл ампициллина. Этой культурой инокулировали 500 мл LB-среды с 100 мкг/мл ампициллина, рост осуществляли в шейкере-инкубаторе в течение 16 часов при 37°С и 200 об/мин. Выделение плазмидной ДНК проводили с помощью набора EndoFreePlasmidMaxiKit (Qiagen, Germany). Выход составил 350 мкг ДНК.
Пример 5.
Культивирование эукариотических клеток, например, фибробластов для последующих трансфекции генно-терапевтической субстанцией и анализа экспрессии гена ANG.
Для последующей трансфекции генно-терапевтической субстанцией содержащей один из вариантов кДНК гена ANG по примеру 3, выращивают первичные культуры фибробластов человека из биоптатов кожи пациентов.
Используя устройство для взятия биопсии кожи Epitheasy 3.5 (MedaxSRL) берут образец биоптата кожи из зоны, защищенной от действия ультрафиолета, например, за ушной раковиной или с боковой внутренней поверхности в зоне локтевого сустава, размером около 3 мм, массой - до 20 мг. Кожу пациента предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Выращивание первичной культуры клеток осуществляют на чашках Петри при 37°С в атмосфере, содержащей 5% СO2 в среде DMЕМ с 10% фетальной телячьей сывороткой и ампициллином 100 Ед/мл. Трипсинизацию и пересев производят каждые 5 дней, для трипсинизации клетки промывали раствором PBS и инкубировали 30 минут при 37°С в растворе, содержащем 0.05% трипсина и 1 мМ ЭДТА. Для нейтрализации трипсина к клеткам добавляли 5 мл культуральной среды и центрифугировали суспензию при 600 об/мин 5 минут. Рост культуры фибробластов после 4-5 пассажей осуществляли в культуральных флаконах емкостью 75 мл в среде, содержащей 10 г/л DMEM, 3.7 г/л Na2CO3, 2.4 г/л HEPES, 10% фетальной сыворотки и 100 Ед/мл ампициллина. Смену культуральной среды осуществляли каждые 2 дня. Общая продолжительность роста культуры не превышала 25-30 дней. Из культуры клеток отбирали аликвоту, содержащую 106 клеток.
Часть культуры фибробластов, предназначенную для выделения РНК с последующим анализом транскрипции гена ANG, центрифугировали при 1000 об/мин 20 минут и дважды отмывали в буферном растворе PBS центрифугированием при 600 об/мин в течение 5 минут. Затем клетки ресуспендировали в 1.5 мл стабилизирующего реагента RNAlater и хранили при 4°С в течение 10 дней для последующего выделения РНК.
Выделение РНК проводили с помощью набора RNeasyMiniKit. (Qiagen, Germany). Выделенную РНК анализировали спектрофотометрически, измеряя соотношение оптической плотности при 260 и 280 нм, а также с помощью капиллярного электрофореза на приборе QIAxcel (Qiagen, Germany), используя картридж RNA Qiality Control. Для дальнейшей работы использовали только те образцы, для которых общее количество выделенной РНК было не менее 50 мкг РНК, соотношение D260 : D280 - не менее 1,8, а соотношение полос 28S : 18S на капиллярном электрофорезе - не ниже 1:1.
Синтез суммарной кДНК первой цепи проводили, используя обратную транскриптазу RevertAid (Thermo Scientific, USA), согласно рекомендациям изготовителя. 1-2 мкг суммарной РНК использовали в качестве матрицы для синтеза первой цепи кДНК. В реакционную смесь для проведения обратной транскрипции вносили 100-200 ед. обратной транскриптазы и 10 пМ случайного 9-нуклеотидного праймера.
Пример 6.
Анализ эндогенной экспрессии гена ANG в культуре первичных фибробластов.
Анализ экспрессии гена ANG из генома фибробластов проводят с целью последующего корректного определения генно-терапевтического эффекта после трансфекции этих клеток генетическими конструкциями с кДНК гена ANG.
Для анализа используют клеточные линии фибробластов кожи, фибробласты с низкой экспрессией гена ANG и фибробласты с нормальной экспрессией гена ANG, из которых выделяют РНК по стандартной методике (Маниатис Т. и др. Молекулярное клонирование. М., Мир, 1984).
Выделенную РНК анализируют методом ПЦР в режиме реального времени (SYBR GreenRealTimePCR). Для амплификации кДНК (265-338 н.п.), специфичной для гена ANG, используют прямой праймер ANG FA1 5' CACAGAGAAAACCTAAGAATAAGCAA 3'
и обратный праймер ANG-RA1 5' CAGGGGGAACCTCCATGT 3'
Длина продукта амплификации -74 нуклеотид. В качестве референтного гена используют ген бета-2-микроглобулина В2М, уровень экспрессии которого в фибробластах сопоставим с таковым в норме для гена ANG.
ПЦР-амплификацию проводят с помощью набора реагентов SYBR GreenQuantitect RT-PCR Kit (Qiagen, USA) или другого набора для ПЦР в режиме реального времени в 20 мкл амплификационной смеси, содержащей: 25 мкл QuantiTect SYBR Green RT-PCR MasterMix, 2,5 mM хлорида магния, по 0,5 мкМ каждого прймера, 5 мкл суммарной РНК. Реакцию осуществляют на амплификаторе CFX96 (Bio-Rad, USA) при следующих условиях: 1 цикл обратной транскрипции при 50°С 30 минут, денатурация 98°С - 15 мин., затем 40 циклов, включающих денатурацию 94°С - 15 сек., отжиг праймеров 59°С - 30 сек. и элонгацию 72°С - 30 сек.
В качестве положительного контроля используют концентрацию ампликонов, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов ANG и В2М. В качестве отрицательного контроля используют деионизированную воду (кривые накопления ПЦР продуктов отрицательного и положительных контролей для упрощения визуализации на фигуре 8 не показаны). Количество ПЦР продуктов - кДНК генов ANG и В2М, полученных в результате амплификации, оценивают в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1.
По итогам анализа экспрессии гена ANG в разных культурах фибробластов (с низкой экспрессией гена ANG и с нормальной экспрессией гена ANG) были отобраны клоны от пациентов одного возраста и одного типа старения, в которых количество ПЦР-продукта, соответствующего кДНК гена ANG, была в 10-20 раз ниже таковой кДНК гена В2М. Кривые накопления специфических ПЦР-продуктов приведены на фигуре 8.
Пример 7.
Трансфекция клеточной культуры фибробластов со сниженной экспрессией гена ANG генно-терапевтической субстанцией с целью подтверждения увеличения экспрессии гена ANG в культуре данных клеток.
Для оценки эффективности генно-терапевтической субстанции, содержащей немодифицированную кДНК гена ANG по примеру 3, этой генно-терапевтической субстанцией трансфицируют первичную культуру фибробластов человека со сниженной экспрессией гена ANG, отобранную по примеру 6.
Данную культуру фибробластов выращивают в культуральных флаконах (25 см2) до момента, когда клетки покрывают 50-70% поверхности флакона. Полученные клетки трансфицируют генно-терапевтической субстанцией на основе pCMV6-ANG SEQ ID No: 1 в присутствии транспортной молекулы (например, дендримера) и вектором pCMV6-XL5 в качестве контроля.
6-луночный планшет с DMEM-средой с 10% фетальной телячьей сывороткой (1.6 мл в лунке) засевали фибробластами из расчета 1-4×105 клеток на лунку. Инкубировали клетки в течение 18 часов при 37°С и в атмосфере, содержащей 5% CO2. Затем 2 мкг плазмидной ДНК растворяли в среде DMEM без сыворотки с буфером Трис-HCl 20 мМ с 1 мМ ЭДТА, pH 7-8 (минимальная концентрация ДНК - 0.1 мкг/мкл). Конечный объем смеси составлял 100 мкл.
В качестве транспортной молекулы использовали раствор дендримера SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия).
Приготовление комплекса ДНК-дендример проводили по методике производителя (QIAGEN, SuperFect Transfection Reagent Handbook, 2002) с некоторыми изменениями: к 15 мкл раствора дендримера (с концентрацией 3 мкг/мкл) добавляли 5 мкл (с концентрацией 0,5 мкг/мкл) раствора плазмидной ДНК и тщательно перемешивали. Затем инкубировали смесь ДНК с дендримером в течение 5-10 минут при температуре 15-25°С.
Из лунок планшета с клеточной культурой осторожно отбирали среду (не нарушая клеточного слоя) и промывали клетки 3 мл буфера PBS. К раствору, содержащему комплексы ДНК-дендример, добавляли 600 мкл среды DMEM с фетальной сывороткой и переносили эту смесь в лунки планшета с клетками. Клетки инкубировали с комплексами 2-3 часа при 37°С и в атмосфере, содержащей 5% СO2. Затем осторожно удаляли среду и промывали клеточный слой 3 мл буфера PBS. Затем добавляли культуральную среду и инкубировали 24-48 часов при 37°С и в атмосфере, содержащей 5% СO2, после чего оценивали уровень кДНК гена ANG и контрольной кДНК гена В2М с помощью амплификации в режиме реального времени как описано в примере 6. Результаты анализа приведены на фигуре 9.
Из графиков следует, что в случае трансфекции вектором без вставки кДНК гена ANG уровень кДНК гена ANG в фибробластах не изменился, а в случае трансфекции вектором с кДНК гена ANG - уровень кДНК фибробластов со сниженной экспрессией гена ANG многократно увеличился (до уровня выше, чем уровень кДНК гена ANG в нормальных фибробластах).
Показано, что в клетках трансфицированных генно-терапевтической субстанцией на основе pCMV6-ANG SEQ ID No: 1 наблюдается усиление экспрессии целевого гена ANG.
Пример 8.
Трансфекция клеточной культуры фибробластов с нормальной экспрессией гена ANG генно-терапевтической субстанцией с кДНК гена ANG с целью подтверждения увеличения экспрессии гена ANG в культуре данных клеток.
Белок ангиогенин обладает ферментной и биологической активностью, которые взаимосвязаны между собой. Поскольку РНК-азная его активность достаточно низкая, ее изучение имеет прерывистый характер (Biochemistry 2002, 41, 1343), а отсутствие коммерческих стандартизованных методик затрудняет проведение исследований активности ангиогенина у пациентов с патологическими состояниями, связанными с гипофункцией этого белка, обеспечивающих стабильный воспроизводимый результат.
Известно, что биологическая активность белка ангиогенина связана с механизмом индукции ангиогенеза путем взаимодействия белков-рецепторов (например, α-актина) клеток-мишеней эндотелия с определенной дозой ангиогенина. Также в определенных концентрациях ангиогенином осуществляется стимуляция фибринолиза, опосредованного эндотелиальными клетками, и клеточноассоциированной протеолитической активности, которые являются составными частями ангиогенеза (http://medbiol.ru/medbiol/angiogenin/00009e6f.htm).
На основе вышесказанного, при проведении экспериментов приняли степень корреляции между эффективностью экспрессии и количеством белка ангиогенина как достаточно-высокую, а использование стандартизованной чувствительной методики количественного определения ангиогенина в клетках и биологических жидкостях - приемлемым для получения достоверно-значимых данных об эффективности исследуемых генно-терапевтических субстанций.
Для оценки изменения уровня экспрессии гена ANG, использовали культуру фибробластов кожи человека по Примеру 5, в качестве транспортной молекулы - дендримеры SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия), в качестве контроля - водный раствор дендримеров без плазмидной ДНК (А), векторную плазмиду pCDNA 3.1(+), не содержащую кДНК гена ANG (В), в качестве трансфицируемых агентов - генно-терапевтическую субстанцию на основе векторной плазмиды pCDNA 3.1(+), содержащую кДНК гена ANG - pCDNA 3.1 ANG EQ ID No: 1(C), Приготовление комплекса ДНК-дендример и трансфекцию фибробластов проводили согласно Примеру 7.
После трансфекции к 0,5 мл культуральной жидкости приливали 0,1 мл 1N HCl, тщательно перемешивали и инкубировали 10 минут при комнатной температуре. Затем нейтрализовывали смесь, добавляя 0,1 мл 1.2N NaOH/0.5M HEPES (рН 7-7,6) и тщательно перемешивали.
Данную смесь использовали для количественного определения целевого белка. Количественное определение продукта кДНК гена ANG проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор ANG Human ELISA Kit (Abcam, США) согласно методике производителя http://www.abcam.com/ps/products/99/ab99970/documents/ab99970_Angiogenin%20(ANG)%20Human%20ELISA_Kit%20v3%20(website).pdf Оптическая плотность образцов измерялась при длине волны 450 нм при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness TechNology Inc., США) и пропорциональна концентрации белка ANG в пробе. Численное значение концентрации определяется с помощью калибровочной кривой, построенной по калибраторам с известной концентрацией белка ANG, входящим в состав набора. Разница между значениями оптической плотности (ОП) калибраторов поставленных в трех повторностях не превышала 10%.
Статистическую обработку полученных результатов, осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/).
Таким образом, показано, что транфекция фибробластов полученной генно-терапевтической субстанцией, несущей кДНК гена ANG, приводит к увеличению экспрессии гена ANG в клетках фибробластов. Результаты показаны на фигуре 10.
Пример 9.
Введение в кожу человека клеточной культуры фибробластов, трансфицированной генно-терапевтической субстанцией с кДНК гена ANG с целью подтверждения увеличения после этого уровня экспрессии гена ANG в биоптате кожи человека.
С целью анализа изменения уровня экспрессии гена ANG в тканях человека, пациентам в кожу предплечья вводили три варианта культуры аутологичных фибробластов - нетрансфицированных (А), трансфицированных вектором без вставки, например, pCMV6-XL5 (В) и трансфицированных генно-терапевтической субстанцией на основе pCMV6- ANG SEQ ID No: 7(C) в комбинации с транспортными молекулами - липосомами TRANSFAST ТМ Transfection Reagent (PROMEGA, USA),
Приготовление суспензии липосом проводили по методике производителя (Promega, TransFast Transfection Reagent, Instruction for Use of Product, E2431) с некоторыми изменениями: к 0,4 мг порошка липосом добавляли 0,4 мл стерильной воды степени очистки Nuclease-Free. Суспензию хорошо перемешивали взбалтыванием. Полученный полупродукт суспензии липосом выдерживали в течение 18 часов при температуре - 20°С, затем оттаивали при комнатной температуре, ресуспендировали встряхиванием или на настольном миксере типа «ВОРТЕКС».
Для приготовления комплекса ДНК-липосомы к 400 мкл раствора липосом (с концентрацией 1 мг/мл) добавляли 400 мкл раствора плазмидной ДНК (с концентрацией 150 мкг/мл) и тщательно перемешивали. Затем инкубировали смесь ДНК с липосомами в течение 5-10 минут при температуре 15-25°С и использовали далее в качестве генно-терапевтической субстанции.
Для последующей трансфекции клеток генно-терапевтической субстанцией выращивали первичные культуры фибробластов человека из биоптатов кожи пациентов по примеру 5.
Для трансфекции из лунок планшета с клеточной культурой осторожно отбирали среду (не нарушая клеточного слоя) и промывали клетки 3 мл буфера PBS. К раствору, содержащему комплексы ДНК-липосимы, добавляли 600 мкл среды DMEM с фетальной сывороткой и переносили эту смесь в лунки планшета с клетками. Клетки инкубировали с комплексами 2-3 часа при 37°С и в атмосфере, содержащей 5% СO2. Затем осторожно удаляли среду и промывали клеточный слой 3 мл буфера PBS. Затем добавляли культуральную среду и инкубировали 24-48 часов при 37°С в атмосфере, содержащей 5% СO2.
Часть клеточной культуры центрифугировали при 700 об/мин, дважды отмывали клетки физиологическим раствором, ресуспендировали в физиологическом растворе из расчета 1 млн клеток в 200 мкл и использовали для введения пациенту. Введение осуществляли тоннельным методом иглой 30G на глубину 3 мм. Очаги введения культур фибробластов располагались на расстоянии 3-5 см друг от друга.
Оценку белка ангиогенина проводили в лизатах биоптатов кожи пациента методом твердофазного иммуноферментного анализа (ИФА ELISA), используя набор ANG Human ELISA Kit (Abcam, США), как описано в Примере 8.
Биопсийные образцы брали на 3 сутки после введения суспензии фибробластов. Взятие биопсии осуществляли из участков введения суспензии фибробластов, а также из интактной кожи, используя устройство для взятия биопсии кожи Epitheasy 3.5 (MedaxSRL). Кожу пациента предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Размер биопсийного образца был около 3 мм, масса - до 20 мг. Образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl рН 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторид, и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 минут при 14000 об/мин. Отбирали супернатант и использовали его для количественного определения целевого белка.
Как видно из фигуры 11, в коже пациента в области введения фибробластов, трансфицированных генно-терапевтической субстанцией на основе pCMV6-ANG SEQ ID No: 7 (зона С), произошло увеличение количества белка ангиогенина, что может свидетельствовать об усилении экспрессии гена ANG. Тогда как при введении контрольных культур фибробластов (нетрансфицированных (зона А) и трансфицированных вектором без вставки кДНК гена ANG pCMV6-XL5 (зона В)) количество белка ангиогенина, в коже не изменялась.
Таким образом, показана эффективность генно-терапевтической субстанции при введении в кожу человека клеточной культуры фибробластов, трансфицированных полученной генно-терапевтической субстанцией, несущей модифицированную кДНК гена ANG, что приводит к повышению уровня экспрессии гена ANG в коже в зоне введения.
Пример 10.
Трансфекция культур фибробластов из биоптатов группы различных пациентов генно-терапевтическими субстанциями, содержащими модифицированные кДНК гена ANG и участок нативной немодифицированной кДНК гена ANG.
С целью подтверждения индивидуального характера увеличения экспрессии гена ANG до различного уровня при трансфекции клеточных культур фибробластов пациентов генно-терапевтическими субстанциями с модифицированными кДНК гена ANG и участком нативной кДНК гена ANG анализировали количественный уровень белка ангиогенина в клеточных лизатах фибробластов, трансфицированных разными генно-терапевтическими субстанциями по примеру 3, содержащими модифицированные кДНК гена ANG и участок нативной немодифицированной кДНК гена ANG в группе пациентов в зависимости от наличия и типа модификаций в кДНК гена ANG.
Последовательности участка нативной немодифицированной кДНК гена ANG приведена на фигуре 1, SEQ ID No: 1., последовательности модифицированных кДНК гена ANG приведены на фигурах 2-7 (SEQ ID No: 2, SEQ ID No: 3, SEQ ID No: 4, SEQ ID No: 5, SEQ ID No: 6, SEQ ID No: 7).
Вырастили культуры фибробластов из однотипных биоптатов кожи, отобранных из зоны внутренней боковой поверхности в зоне локтевого сустава 26 пациентов, выбранных случайным образом по примеру 5, отобрали аликвоты и оценили уровень белка ангиогенина, в клеточных лизатах. Клеточный осадок, соответствующий 2×106 клеток, промывали фосфатным буфером и ресуспендировали во льду в лизирующем буфере, содержащем 25 мМ ХЕПЕС pH 7.9, 100 мM NaCl, 1 мМ ЭДТА, 1% Тритон Х-100, 10% глицерин и 1 мМ фенилметилсульфонилфторид. Лизат центрифугировали 5 минут при 14000 об/мин, концентрацию белка в супернатанте определяли методом Брэдфорда ([Bradford М.М. (1976) Anal. Biochem. 72: 248-254.]).
Затем каждую из 18-ти культур фибробластов разделили на 8 частей. Одну часть, обозначенную (А), трансфицировали по примеру 7 генно-терапевтической субстанцией на базе вектора pCMV6- SEQ ID No: 1, содержащей немодифицированную кДНК гена ANG (SEQ ID No: 1.) по примеру 2 в сочетании с транспортной молекулой - дендримером по примеру 7.
Вторую часть, обозначенную (В), трансфицировали по примеру 7 генно-терапевтической субстанцией на базе вектора pCMV6- SEQ ID No: 2, содержащей модифицированную кДНК гена ANG (SEQ ID No: 2.) по примеру 3 в сочетании с транспортной молекулой - дендримером по примеру 7.
3-ю часть, обозначенную (С), трансфицировали по примеру 7 генно-терапевтической субстанцией на базе вектора pCMV6- SEQ ID No: 3, содержащей модифицированную кДНК гена ANG (SEQ ID No: 3.) по примеру 3 в сочетании с транспортной молекулой -дендримером по примеру 7.
4-ю часть, обозначенную (D), трансфицировали по примеру 7 генно-терапевтической субстанцией на базе вектора pCMV6- SEQ ID No:4, содержащей модифицированную кДНК гена ANG (SEQ ID No: 4.) по примеру 3 в сочетании с транспортной молекулой - дендримером по примеру 7.
5-ю часть, обозначенную (Е), трансфицировали по примеру 7 генно-терапевтической субстанцией на базе вектора pCMV6- SEQ ID No: 5, содержащей модифицированную кДНК гена ANG (SEQ ID No: 5.) по примеру 3 в сочетании с транспортной молекулой - дендримером по примеру 7.
6-ю часть, обозначенную (F), трансфицировали по примеру 7 генно-терапевтической субстанцией на базе вектора pCMV6- SEQ ID No: 6, содержащей модифицированную кДНК гена ANG (SEQ ID No: 6.) по примеру 3 в сочетании с транспортной молекулой - дендримером по примеру 7.
7-ю часть, обозначенную (G), трансфицировали по примеру 7 генно-терапевтической субстанцией на базе вектора pCMV6- SEQ ID No: 7, содержащей вариант модифицированную кДНК гена ANG (SEQ ID No: 7.) по примеру 3 в сочетании с транспортной молекулой - дендримером по примеру 7.
8-ю часть, обозначенную (Н), трансфицировали по примеру 7 векторной плазмидой pCMV6-XL5, не содержащей кДНК гена ANG по примеру 3 в сочетании с транспортной молекулой - дендримером по примеру 7.
Оценку белка ангиогенина проводили в лизатах биоптатов кожи пациента методом твердофазного иммуноферментного анализа (ИФА ELISA), используя набор ANG Human ELISA Kit (Abcam, США), как описано в Примере 8.
По итогам определения количества белка ангиогенина выбрали показатели, касательно каждой части клеточной культуры от каждого пациента, продемонстрировавшие максимальные уровни экспрессии и объединили их в семь групп, исходя из следующего критерия:
В группе 1 максимальное количество белка ангиогенина, наблюдалось при трансфекции немодифицированной кДНК гена ANG SEQ ID No: 1. В эту группу вошло 5 культур из 26.
В группе 2 максимальное количество белка ангиогенина, наблюдалось при трансфекции модифицированной кДНК гена ANG SEQ ID No: 2. В эту группу вошло 2 культуры из 26.
В группе 3 максимальное количество белка ангиогенина, наблюдалось при трансфекции модифицированной кДНК гена ANG SEQ ID No: 3. В эту группу вошло 5 культур из 26.
В группе 4 максимальное количество белка ангиогенина, наблюдалось при трансфекции модифицированной кДНК гена ANG SEQ ID No: 4. В эту группу вошло 3 культуры из 26.
В группе 5 максимальное количество белка ангиогенина, наблюдалось при трансфекции модифицированной кДНК гена ANG SEQ ID No: 5. В эту группу вошло 2 культуры из 26.
В группе 6 максимальное количество белка ангиогенина, наблюдалось при трансфекции модифицированной кДНК гена ANG SEQ ID No: 6. В эту группу вошло 4 культуры из 26.
В группе 7 максимальное количество белка ангиогенина, наблюдалось при трансфекции модифицированной кДНК гена ANG SEQ ID No: 7. В эту группу вошло 5 культур из 26.
Ни в одной из клеточных культур, трансфицированных генно-терапевтической субстанцией с векторной плазмидой, не содержащей кДНК гена ANG не было обнаружено максимальное количество белка ангиогенина, в отличие от клеточных культур, трансфицированных генно-терапевтическими субстанциями с генетическими конструкциями, содержащими кДНК гена ANG.
На фигуре 12 для каждой группы клеточных культур приведены диаграммы показателей концентраций белка ангиогенина, (усредненных в рамках группы, в случае, если в группу входит более одной клеточной культуры) применительно ко всем, участвующим в эксперименте генно-терапевтическим субстанциям, после трансфекции этих клеточных культур генно-терапевтическими субстанциями, содержащими модифицированные и участок нативной кДНК гена ANG.
Из данного примера следует, что достижение максимального уровня экспрессии гена ANG в культурах фибробластов кожи различных пациентов при их трансфекции генно-терапевтическими субстанциями, связано с индивидуальными особенностями пациентов и зависит от наличия и типа модификаций в кДНК гена ANG, входящих в генно-терапевтические субстанции.
Каждая генно-терапевтическая субстанция из группы генно-терапевтических субстанций является эффективной в некоторой значительной группе пациентов. Следовательно, для выбора наиболее эффективной генно-терапевтической субстанции из группы генно-терапевтических субстанций для терапевтических целей необходимо предварительное персонализированное исследование биоптатов пациента, либо клеток, выращенных из этих биоптатов на предмет максимальной эффективности терапевтического воздействия, созданных генно-терапевтических субстанций в рамках группы генно-терапевтических субстанций.
Пример 11.
Введение в клеточную культуру эпителиальных клеток глаза человека генно-терапевтической субстанции с кДНК гена ANG с целью подтверждения при этом увеличения экспрессии гена ANG.
Биопсийный материал из области лимба в виде круга диаметром 1-1.5 мм помещали в чашку Петри в сбалансированный солевой раствор Хэнкса, добавляли диспазу (20 мкл 25 ед/мл) и гентамицин и инкубировали 24 часа при +4. Затем отделяли эпителиальный слой от стромы и нарезали обе ткани кусочками 1-2 мм3.
Суспензию эпителиальных клеток получали путем инкубирования кусочков тканей в растворе Трипсин-ЭДТА в течение 15 минут при +37°С. Трипсинизацию останавливали добавлением соевого ингибитора трипсина в PBS. Клеточные суспензии отмывали центрифугированием при 700 об/мин и ресуспендировали в бессывороточной среде DMEM с гентамицином. Клетки растили в 25 см2 флаконах с 5 мл среды при 37°С и в атмосфере, содержащей 5% СO2. Через 24 часа среду с не прикрепившимися клетками удаляли и добавляли 5 мл свежей среды. Пересев производили каждые 7 дней в соотношении 1:2 - 1:3.
Трансфекцию этой клеточной культуры проводили генно-терапевтической субстанцией на основе плазмиды pCMV6-Kan/Neo ANG SEQ ID No: 2, используя в качестве транспортной молекулы РАМАМ-дендримеры (Weihai CY Dendrimer Technology). В качестве контроля использовали плазмиду pCMV6-Kan/Neo без кДНК гена ANG.
Каждые 24 часа из каждой культуры отбирали аликвоту по 500 мкл суспензии с целью выделения РНК и анализа уровня специфической кДНК. Выделение РНК проводили с помощью набора RNeasyMiniKit (Qiagen, Germany). Образцы РНК были сгруппированы в 3 группы по 8 образцов с близкой концентрацией и объединены. Анализ уровня специфической кДНК гена ANG проводили с помощью амплификации в режиме реального времени по методике и с праймерами по примеру 6, используя набор реагентов iTaqUniversalSYBRGreenSupermix (Bio-Rad, USA), амплификатор CFX96 (Bio-RadUSA) и программное обеспечение Bio-RadCFXManager 2.1. Максимальное увеличение экспрессии (транскрипции) гена ANG наблюдали на 3 сутки.
На фигуре 13 приведены кривые накопления специфического продукта амплификации, соответствующего кДНК гена ANG в эпителиальных клетках роговицы.
Показано, что, в клеточной культуре эпителиальных клеток глаза человека, трансфицированной генно-терапевтической субстанцией с кДНК гена ANG, произошло увеличение экспрессии гена ANG при использовании генно-терапевтической субстанции с кДНК гена ANG.
Пример 12.
Трансфекция клеточной культуры эпителия слизистой оболочки полости рта генно-терапевтической субстанцией с целью подтверждения при этом увеличения экспрессии гена ANG в данной культуре клеток.
С целью выяснения эффективности генно-терапевтической субстанции, содержащей кДНК гена ANG, в различных типах клеток, а также с целью оценки влияния транспортной молекулы на успешность трансфекции этой субстанцией - трансфицировали эпителий слизистой оболочки полости рта человека, используя в качестве транспортной молекулы амфифильные блок-сополимеры.
Биоптаты слизистой оболочки полости рта массой 40 мг измельчали на фрагменты до 10 мм3. Выращивание первичной культуры клеток осуществляют на чашках Петри при 37оС в атмосфере, содержащей 5% СO2 в среде DMEM с 10% фетальной телячьей сывороткой и ампициллином 100 Ед/мл. Трипсинизацию и пересев производят каждые 5 дней, для трипсинизации клетки промывали раствором PBS и инкубировали 30 минут при 37оС в растворе, содержащем 0.05% трипсина и 1 мМ ЭДТА. Для нейтрализации трипсина к клеткам добавляли 5 мл культуральной среды и центрифугировали суспензию при 600 об/мин 5 минут. Рост культуры клеток эпителия после 4-5 пассажей осуществляли в культуральных флаконах емкостью 75 мл в среде, содержащей 10 г/л DMEM, 3.7 г/л Na2CO3, 2.4 г/л HEPES, 10% фетальной сыворотки и 100 Ед/мл ампициллина. Смену культуральной среды осуществляли каждые 2 дня. Общая продолжительность роста культуры не превышала 25-30 дней. Из культуры клеток отбирали аликвоту, содержащую 105 клеток.
Для трансфекции клеток генно-терапевтической субстанцией содержащей кДНК гена ANG использовали амфифильные блок-сополимеры. Применяли методику по (IntJPharm, 2012, 427, 80-87) или в (Macromol. Biosci. 2011, 11, 652-661), с некоторыми изменениями. Блок-сополимер синтезировали из смеси линейного полиэтиленимина (ПЭИ) (Polyscience Inc., США) и бифункционального полиэтиленгликоля (ПЭГ) N-гидроксисукцинимидил-75-N-(3-малеимидопропионил)-амидо-4,7,10,13,16,19,22,25,28,31,34,37,40,43,46,49,52,55,58,61,64,67,70,73-тетракосаоксапента-гептаконтаноата (MAL-dPEG™-NHS ester, Quanta BioDesign, Ltd., США) в боратном буфере. Полиплекс готовили за 1 час до введения в клетки, смешивая раствор блок-сополимера с ДНК генетической конструкции pCMV6-Kan/Neo ANG SEQ ID No:3 с модифицированной кДНК гена ANG SEQ ID No: 3. Смесь для трансфекции добавляли к суспензии клеток в 1 мл культуральной среды DMEM с 10% фетальной сывороткой и ампициллином.
Так как для трансфекции использовали конструкцию, содержащую фактор селекции (устойчивость к генетицину), то клетки после трансфекции выращивали в 25 см3 флаконах с 5 мл среды с генетицином в течение 12 дней, меняя среду каждые 4 дня. Каждые 24 часа из каждой культуры отбирали аликвоту по 500 мкл суспензии с целью выделения РНК и анализа уровня специфической кДНК. Выделение РНК производили с помощью набора RNeasyMiniKit (Qiagen, Germany). Образцы РНК были сгруппированы в 3 группы по 8 образцов с близкой концентрацией и объединены. Анализ уровня специфической кДНК гена ANG проводили с помощью амплификации в режиме реального времени по методике и с праймерами по примеру 6, используя набор реагентов iTaqUniversalSYBRGreenSupermix (Bio-Rad, USA), амплификатор CFX96 (Bio-Rad, USA) и программное обеспечение Bio-RadCFXManager 2.1. Максимальное увеличение транскрипции ANG наблюдали на 4 сутки. На фигуре 14 приведены кривые накопления специфического продукта амплификации, соответствующего кДНК гена ANG.
Показано, что в клетках эпителия слизистой оболочки полости рта, трансфицированных генно-терапевтической субстанцией на основе pCMV6-Kan/Neo ANG SEQ ID No: 3, используя в качестве транспортной молекулы амфифильные блок-сополимеры, наблюдается увеличение экспрессии целевого гена ANG.
Пример 13.
Введение в кожу человека генно-терапевтической субстанции с кДНК гена ANG с целью подтверждения при этом увеличения уровня экспрессии целевого гена ANG в коже человека.
С целью анализа увеличения уровня экспрессии целевого гена ANG пациентам вводили генно-терапевтическую субстанцию, содержащую генетическую конструкцию с кДНК гена ANG (В) и параллельно вводили плацебо, представляющее собой комбинацию векторной плазмиды не содержащей кДНК гена ANG с транспортной молекулой (А) - в кожу предплечья.
В качестве транспортной молекулы использовали порошок липосом TRANSFAST ТМ Transfection Reagent (PROMEGA, USA) по примеру 9. Далее генетическую конструкцию pCMV6 ANG SEQ ID No: 4, которая содержит модифицированную кДНК гена ANG (SEQ ID No: 4) и плазмиду pCMV6-XL5, используемую в качестве плацебо - которая не содержит кДНК гена ANG, каждую из которых растворяли в стерильной воде степени очистки Nuclease-Free. Для получения генно-терапевтических субстанций готовили комплексы ДНК-липосомы по примеру 9.
Полученные генно-терапевтическую субстанцию и плацебо использовали для введения пациенту. Введение осуществляли тоннельным методом иглой 30G на глубину 3 мм. Объем вводимого раствора генно-терапевтической субстанции и плацебо - около 0,3 мл для каждого. Очаги введения генно-терапевтической субстанции и плацебо располагались на расстоянии 3-5 см друг от друга.
Количественную оценку белка ангиогенина проводили в лизатах биоптатов кожи пациента методом твердофазного иммуноферментного анализа (ИФА ELISA), используя набор ANG Human ELISA Kit (Abcam, США), как описано в Примере 8.
Биопсийные образцы брали на 3 сутки после введения генно-терапевтической субстанции. Взятие биопсии осуществляли из участков кожи в зоне введения генно-терапевтической субстанции и плацебо, а также из интактной кожи, используя устройство для взятия биопсии Epitheasy 3.5 (Medax SRL) далее, как описано в примере 9.
Показано, что в коже пациента в области введения генно-терапевтической субстанции с кДНК гена ANG, произошло увеличение количества белка ангиогенина, тогда как при введении плацебо, количество белка ангиогенина в коже не изменялась, что говорит об увеличении экспрессии гена ANG при использовании генно-терапевтической субстанции с кДНК гена ANG. Результаты отражены на фигуре 15.
Пример 14.
Введение в слизистую оболочку полости рта человека генно-терапевтической субстанции с кДНК гена ANG с целью подтверждения при этом увеличения уровня экспрессии целевого гена ANG в слизистой оболочке рта человека человека.
С целью анализа уровня экспрессии целевого гена ANG пациентам вводили генно-терапевтическую субстанцию, содержащую генетическую конструкцию с кДНК гена ANG (В) и параллельно вводили плацебо, представляющее собой комбинацию векторной плазмиды не содержащей кДНК гена ANG с транспортной молекулой (А) - в слизистую оболочку полости рта.
В качестве транспортной молекулы использовали порошок липосом TRANSFAST ТМ Transfection Reagent (PROMEGA, USA) по примеру 9. Далее генетическую конструкцию pCDNA 3.1 ANG SEQ ID No: 5, которая содержит модифицированную кДНК гена ANG (SEQ ID No: 5), и плазмиду pCDNA 3.1(+), используемую в качестве плацебо, которая не содержит кДНК гена ANG, каждую из которых растворяли в стерильной воде степени очистки Nuclease-Free. Для получения генно-терапевтических субстанций готовили комплексы ДНК-липосомы по примеру 9.
Полученные генно-терапевтическую субстанцию и плацебо использовали для введения пациенту. Введение осуществляли тоннельным методом иглой 30G на глубину 1-2. Объем вводимого раствора генно-терапевтической субстанции и плацебо - около 0,3 мл для каждого. Очаги введения генно-терапевтической субстанции и плацебо располагались на расстоянии 2-4 см друг от друга.
Количественную оценку белка ангиогенина проводили в лизатах биоптатов слизистой оболочки полости рта пациента методом твердофазного иммуноферментного анализа (ИФА ELISA), используя набор ANG Human ELISA Kit (Abcam, США), как описано в Примере 8.
Биопсийные образцы брали на 3 сутки после введения генно-терапевтической субстанции. Взятие биопсии осуществляли из участков слизистой оболочки полости рта в зоне введения генно-терапевтической субстанции, а также из интактных участков и в зоне введения плацебо, используя устройство для взятия биопсии Epitheasy 3.5 (Medax SRL), далее по примеру 9.
Показано, что слизистой оболочке полости рта пациента в области введения генно-терапевтической субстанции с кДНК гена ANG, произошло увеличение белка ангиогенина, тогда как при введении плацебо количество белка ангиогенина в слизистой оболочке рта не изменялось, что подтверждает увеличение экспрессии гена ANG при использовании генно-терапевтической субстанции с кДНК гена ANG. Результаты отражены на фигуре 16.
Пример 15.
Введение в мышечную ткань человека генно-терапевтической субстанции с кДНК гена ANG с целью подтверждения при этом увеличения уровня экспрессии целевого гена ANG в мышечной ткани человека.
С целью анализа уровня экспрессии целевого гена ANG пациентам вводили генно-терапевтическую субстанцию, содержащую векторную плазмиду с кДНК гена ANG (В) и параллельно вводили плацебо, представляющее собой комбинацию векторной плазмиды не содержащей кДНК гена ANG с транспортной молекулой (А) - в мышечную ткань в зоне предплечья.
В качестве транспортной молекулы использовали порошок липосом TRANSFAST ТМ Transfection Reagent (PROMEGA, USA) по примеру 9. Далее генетическую конструкцию pCMV6-Kan/Neo ANG SEQ ID No: 6, которая содержит модифицированную кДНК гена ANG (SEQ ID No: 6), и плазмиду pCMV6-Kan/Neo, используемую в качестве плацебо, которая не содержит кДНК гена ANG, каждую из которых растворяли в стерильной воде степени очистки Nuclease-Free.
Для получения генно-терапевтических субстанций готовили комплексы ДНК-липосомы по примеру 9.
Полученные генно-терапевтическую субстанцию и плацебо использовали для введения пациенту. Введение осуществляли тоннельным методом иглой 30G на глубину 15-20 мм. Объем вводимого раствора генно-терапевтической субстанции и плацебо - около 0,5 мл для каждого. Очаги введения генно-терапевтической субстанции и плацебо располагались на расстоянии 5-7 см друг от друга
Количественную оценку белка ангиогенина проводили в лизатах биоптатов мышечной ткани пациента методом твердофазного иммуноферментного анализа (ИФА ELISA), используя набор ANG Human ELISA Kit (Abcam, США), как описано в Примере 8.
Биопсийные образцы брали на 3 сутки после введения генно-терапевтической субстанции. Взятие биопсии осуществляли из участков мышечной ткани в зоне введения генно-терапевтической субстанции, а также из интактных участков мышцы и в зоне введения плацебо, используя автоматическое устройство для взятия биопсии MAGNUM (компания BARD, USA), далее по примеру 9.
Показано, что, в мышечной ткани пациента в области введения генно-терапевтической субстанции с кДНК гена ANG, произошло увеличение белка ангиогенина, тогда как при введении плацебо количество белка ангиогенина в мышечной ткани не изменялась, что подтверждает увеличение экспрессии гена ANG при использовании генно-терапевтической субстанции с кДНК гена ANG. Результаты отражены на фигуре 17
Пример 16.
Введение группе различных пациентов генно-терапевтических субстанций содержащих модифицированные кДНК гена ANG и участок нативной немодифицированной кДНК гена ANG.
С целью подтверждения индивидуального характера увеличения уровня экспрессии целевого гена ANG до различного уровня при введении в кожу пациентов генно-терапевтических субстанций с модифицированными и немодифицированной кДНК гена ANG анализировали количественный уровень белка ангиогенина, в лизате биоптатов кожи группы пациентов в зависимости от наличия и типа модификаций в кДНК гена ANG.
Последовательность участка нативной немодифицированной кДНК гена ANG приведена на фигуре 1, SEQ ANG ID No: 1, последовательности модифицированных кДНК гена ANG приведены на фигурах 2-7 (SEQ ANG ID No: 2, SEQ ANG ID No: 3, SEQ ANG ID No: 4, SEQ ANG ID No: 5, SEQ ANG ID No: 6, SEQ ANG ID No: 7).
При этом генетические конструкции, одна из которых содержит участок нативной немодифицированной кДНК гена ANG (SEQ ID No: 1), вторая генетическая конструкция содержит участок модифицированной кДНК гена ANG (SEQ ID No: 2), третья генетическая конструкция содержит модифицированную кДНК гена ANG (SEQ ID No: 3), четвертая генетическая конструкция содержит модифицированную кДНК гена ANG (SEQ ID No: 4), пятая генетическая конструкция содержит модифицированную кДНК гена ANG (SEQ ID No: 5), шестая генетическая конструкция содержит модифицированную кДНК гена ANG (SEQ ID No: 6), седьмая генетическая конструкция содержит модифицированную кДНК гена ANG (SEQ ID No: 7), восьмая генетическая конструкция (плацебо), представляет собой вектор pCMV6 XL5, растворяли в стерильной воде степени очистки Nuclease-Free. Для получения генно-терапевтических субстанций готовили комплексы ДНК в сочетании с транспортными молекулами - липосомами по примеру 9.
Полученные семь вариантов генно-терапевтических субстанций и плацебо использовали для введения в кожу пациентам. Введение осуществляли тоннельным методом иглой 30G на глубину 3 мм. Объем вводимого раствора каждой генно-терапевтической субстанции составлял около 0,3 мл. Очаги введения генно-терапевтических субстанций и плацебо располагались на расстоянии 3-5 см друг от друга.
Каждому из 31-го пациента, которые были отобраны в случайном порядке, вводили 7 генно-терапевтических субстанций и плацебо в кожу предплечья.
Биопсийные образцы брали через 72 часа после введения генно-терапевтических субстанций. Взятие биопсии осуществляли из участков введения генно-терапевтических субстанций, плацебо, а также из интактной кожи, используя устройство для взятия биопсии кожи Epitheasy 3.5 (Medax SRL). Кожу пациента предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Размер каждого биопсийного образца был около 3 мм, масса - до 20 мг. Образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl pH 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторид и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 минут при 14000 об/мин. Отбирали супернатант и использовали его для количественного определения целевого белка.
А - биоптат, полученный после введения генно-терапевтической субстанции на базе pCMV6- SEQ ID No: 1, содержащий немодифицированную кДНК гена ANG (SEQ ID No: 1.) по примеру 2 в сочетании с транспортными молекулами - липосомами по примеру 9. В - биоптат, полученный после введения генно-терапевтической субстанции на базе pCMV6- SEQ ID No: 2, содержащий модифицированную кДНК гена ANG (SEQ ID No: 2.) по примеру 3 в сочетании с транспортными молекулами - липосомами по примеру 9. С - биоптат, полученный после введения генно-терапевтической субстанции на базе pCMV6- SEQ ID No: 3, содержащий модифицированную кДНК гена ANG (SEQ ID No: 3.) по примеру 3 в сочетании с транспортными молекулами - липосомами по примеру 9.
D - биоптат, полученный после введения генно-терапевтической субстанции на базе pCMV6- SEQ ID No: 4, содержащий модифицированную кДНК гена ANG (SEQ ID No: 4.) по примеру 3 в сочетании с транспортными молекулами - липосомами по примеру 9.
Е - биоптат, полученный после введения генно-терапевтической субстанции на базе pCMV6- SEQ ID No: 5, содержащий модифицированную кДНК гена ANG (SEQ ID No: 5) по примеру 3 в сочетании с транспортными молекулами - липосомами по примеру 9.
F - биоптат, полученный после введения генно-терапевтической субстанции на базе pCMV6- SEQ ID No: 6, содержащий модифицированную кДНК гена ANG (SEQ ID No: 6) по примеру 3 в сочетании с транспортными молекулами - липосомами по примеру 9.
G - биоптат, полученный после введения генно-терапевтической субстанции на базе pCMV6- SEQ ID No: 7, содержащий модифицированную кДНК гена ANG (SEQ ID No: 7.) по примеру 3 в сочетании с транспортными молекулами - липосомами по примеру 9.
Н - биоптат, полученный после введения векторной плазмиды pCMV6-XL5, не содержащей кДНК гена ANG по примеру 3 в сочетании с транспортными молекулами - липосомами по примеру 9.
Количественную оценку белка ангиогенина проводили в девяти биоптатах кожи от каждого пациента (от А до Н и в биоптате интактной кожи) через 72 часа после введения генно-терапевтических субстанций методом твердофазного иммуноферментного анализа (ИФА ELISA), используя набор ANG Human ELISA Kit (Abcam, США), как описано в Примере 8.
По итогам анализа количественного уровня белка ангиогенина, выбрали показатели, касательно каждого биоптата от каждого пациента, продемонстрировавшие максимальные уровни белка ангиогенина и объединили их в семь групп, исходя из следующего критерия:
В группе 1 максимальное количество белка ангиогенина, наблюдалось при введении немодифицированной кДНК гена ANG SEQ ID No: 1. В эту группу вошло 7 биоптатов из 31.
В группе 2 максимальное количество белка ангиогенина, наблюдалось при введении модифицированной кДНК гена ANG SEQ ID No: 2. В эту группу вошло 2 биоптата из 31.
В группе 3 максимальное количество белка ангиогенина, наблюдалось при введении модифицированной кДНК гена ANG SEQ ID No: 3. В эту группу вошло 5 биоптатов из 31.
В группе 4 максимальное количество белка ангиогенина, наблюдалось при введении модифицированной кДНК гена ANG SEQ ID No: 4. В эту группу вошло 4 биоптата из 31.
В группе 5 максимальное количество белка ангиогенина, наблюдалось при введении модифицированной кДНК гена ANG SEQ ID No: 5. В эту группу вошло 3 биоптата из 31.
В группе 6 максимальное количество белка ангиогенина, наблюдалось при введении модифицированной кДНК гена ANG SEQ ID No: 6. В эту группу вошло 4 биоптата из 31.
В группе 7 максимальное количество белка ангиогенина, наблюдалось при введении модифицированной кДНК гена ANG SEQ ID No: 7. В эту группу вошло 6 биоптатов из 31.
Ни в одном из биоптатов, в которые были введены генно-терапевтические субстанции плацебо - векторной плазмидой, не содержащей кДНК гена ANG, не было обнаружено максимальное количество белка ангиогенина, в отличие от биоптатов, в которые были введены генно-терапевтические субстанции с генетическими конструкциями, содержащими кДНК гена ANG.
На фигуре 18 для каждой группы биоптатов приведены диаграммы показателей концентрации белка (усредненных в рамках группы, в случае, если в группу входит более одного биоптата) применительно ко всем, участвующим в эксперименте генно-терапевтическим субстанциям, после введения пациентам этих генно-терапевтических субстанций, содержащих
модифицированные и участок нативной кДНК гена ANG.
Из данного примера следует, что достижение максимального уровня белка ангиогенина в биоптатах кожи различных пациентов при введении им в кожу генно-терапевтических субстанций, связано с индивидуальными особенностями пациентов и зависит от наличия и типа модификаций в кДНК гена ANG, входящих в генно-терапевтические субстанции.
Каждая генно-терапевтическая субстанция из группы генно-терапевтических субстанций является эффективной в некоторой значительной группе пациентов. Следовательно, для выбора наиболее эффективной генно-терапевтической субстанции из группы генно-терапевтических субстанций для терапевтических целей необходимо предварительное персонализированное исследование биоптатов пациента, либо клеток, выращенных из этих биоптатов на предмет максимальной эффективности терапевтического воздействия, созданных генно-терапевтических субстанций в рамках группы генно-терапевтических субстанций.
Пример 17.
Трансфекция клеточной линии фибробластов пациента разными генно-терапевтическими субстанциями, содержащими модифицированные кДНК гена ANG и участок нативной немодифицированной кДНК гена ANG с целью персонализированного выбора из группы генно-терапевтических субстанций наиболее эффективной генно-терапевтической субстанции применительно к данному пациенту для последующей трансфекции этой субстанцией клеток пациента в рамках терапевтической процедуры.
С целью определения наиболее эффективной применительно к конкретному пациенту генно-терапевтической субстанции анализировали количество белка ангиогенина, в клеточных лизатах фибробластов этого пациента, трансфицированных разными генно-терапевтическими субстанциями, содержащими участок нативной немодифицированной кДНК гена ANG и/или модифицированные кДНК гена ANG.
Последовательность участка нативной немодифицированной кДНК гена ANG приведена на фигуре 1, SEQ ANG ID No: 1, последовательности модифицированных кДНК гена ANG приведены на фигурах 2-7 (SEQ ANG ID No: 2, SEQ ANG ID No: 3, SEQ ANG ID No: 4, SEQ ANG ID No: 5, SEQ ANG ID No: 6, SEQ ANG ID No: 7).
Культуры фибробластов из биоптата пациента вырастили по примеру 5, отобрали аликвоты и провели клеточный лизис: клеточный осадок, соответствующий 2×106 клеток, промывали фосфатным буфером и ресуспендировали во льду в лизирующем буфере, содержащем 25 мМ ХЕПЕС pH 7.9, 100 мМ NaCl, 1 мМ ЭДТА, 1% Тритон Х-100, 10% глицерин и 1 мМ фенилметилсульфонилфторид. Лизат центрифугировали 5 минут при 14000 об/мин.
Затем культуру фибробластов пациента разделили на 8 частей. Первую часть, обозначенную (А), трансфицировали по примеру 7 генно-терапевтической субстанцией на базе вектора pCMV6- SEQ ID No: 1, содержащей участок нативной немодифицированной кДНК гена ANG (SEQ ID No: 1.) по примеру 3 в сочетании с транспортными молекулами - липосомами по примеру 9.
Вторую часть, обозначенную (В), трансфицировали по примеру 7 генно-терапевтической субстанцией на базе вектора pCMV6- SEQ ID No: 2, содержащей участок модифицированной кДНК гена ANG (SEQ ID No: 2.) по примеру 3 в сочетании с транспортными молекулами - липосомами по примеру 9.
Третью часть, обозначенную (С), трансфицировали по примеру 7 генно-терапевтической субстанцией на базе вектора pCMV6- SEQ ID No: 3, содержащей модифицированную кДНК гена ANG (SEQ ID No: 3.) по примеру 3 в сочетании с транспортными молекулами - липосомами по примеру 9.
Четвертую часть, обозначенную (D), трансфицировали по примеру 7 генно-терапевтической субстанцией на базе вектора pCMV6- SEQ ID No: 4, содержащей модифицированную кДНК гена ANG (SEQ ID No: 4.) по примеру 3 в сочетании с транспортными молекулами - липосомами по примеру 9.
Пятую часть, обозначенную (Е), трансфицировали по примеру 7 генно-терапевтической субстанцией на базе вектора pCMV6- SEQ ID No: 5, содержащей модифицированную кДНК гена ANG (SEQ ID No: 5.) по примеру 3 в сочетании с транспортными молекулами - липосомами по примеру 9.
Шестую часть, обозначенную (F), трансфицировали по примеру 7 генно-терапевтической субстанцией на базе вектора pCMV6- SEQ ID No: 6, содержащей модифицированную кДНК гена ANG (SEQ ID No: 6.) по примеру 3 в сочетании с транспортными молекулами - липосомами по примеру 9.
Седьмую часть, обозначенную (G), трансфицировали по примеру 7 генно-терапевтической субстанцией на базе вектора pCMV6- SEQ ID No: 7, содержащей модифицированную кДНК гена ANG (SEQ ID No: 7.) по примеру 3 в сочетании с транспортными молекулами - липосомами по примеру 9.
Восьмую часть, обозначенную (Н), трансфицировали по примеру 7 векторной плазмидой pCMV6-XL5, не содержащей кДНК гена ANG по примеру 3 в сочетании с транспортными молекулами - липосомами по примеру 9.
Определение количества белка ангиогенина, в клеточных лизатах фибробластов пациента проводили через 72 часа после трансфекции методом твердофазного иммуноферментного анализа (ИФА ELISA), используя набор ANG Human ELISA Kit (Abcam, США), как описано в Примере 8.
По итогам определения белка ангиогенина, в культуре фибробластов пациента выделили вариант генно-терапевтической субстанции, при трансфекции которой наблюдается максимальное количество белка ангиогенина, в лизате клеточной культуры и соответственно наблюдается максимальная экспрессия гена ANG. В данном эксперименте максимальное количество белка ангиогенина, в лизате отмечено при трансфекции генно-терапевтической субстанцией на базе pCMV6 ANG SEQ ID No: 1, содержащей немодифицированную кДНК гена ANG, что показано на фигуре 19.
Таким образом, выбрана наиболее эффективная применительно к данному пациенту генно-терапевтическая субстанция для последующей трансфекции клеток пациента в рамках терапевтической процедуры.
Пример 18.
Введение в кожу пациента различных генно-терапевтических субстанций, содержащих модифицированные кДНК гена ANG и участок нативной немодифицированной кДНК гена ANG с целью выбора из группы генно-терапевтических субстанций наиболее эффективной генно-терапевтической субстанции применительно к данному пациенту для последующего введения этой субстанции пациенту в рамках терапевтической процедуры.
С целью определения наиболее эффективной применительно к конкретному пациенту генно-терапевтической субстанции анализировали количество белка ангиогенина, в лизатах биоптатов кожи этого пациента, после введения ему в кожу генно-терапевтических субстанций, содержащих модифицированные кДНК гена ANG и/или участок нативной кДНК гена ANG.
Последовательность участка нативной немодифицированной кДНК гена ANG приведена на фигуре 1, SEQ ANG ID No: 1, последовательности модифицированных кДНК гена ANG приведены на фигурах 2-7 (SEQ ANG ID No: 2, SEQ ANG ID No: 3, SEQ ANG ID No: 4, SEQ ANG ID No: 5, SEQ ANG ID No: 6, SEQ ANG ID No: 7).
Пациенту вводили 7 генно-терапевтических субстанций и плацебо в кожу предплечья.
Первая генно-терапевтическая субстанция (А) на базе pCMV6- SEQ ID No: 1, содержащая участок нативной немодифицированной кДНК гена ANG (SEQ ID No: 1.) по примеру 3 в сочетании с транспортной молекулой - дендримером по примеру 7.
Вторая генно-терапевтическая субстанция(В) на базе pCMV6-SEQ ID No: 2, содержащая модифицированную кДНК гена ANG (SEQ ID No:2.) по примеру 3 в сочетании с транспортной молекулой - дендримером по примеру 7.
Третья генно-терапевтическая субстанция (С) на базе pCMV6-SEQ ID No: 3, содержащая модифицированную кДНК гена ANG (SEQ ID No: 3.) по примеру 3 в сочетании с транспортной молекулой - дендримером по примеру 7.
Четвертая генно-терапевтическая субстанция (D) на базе pCMV6- SEQ ID No: 4, содержащая модифицированную кДНК гена ANG (SEQ ID No: 4.) по примеру 3 в сочетании с транспортной молекулой - дендримером по примеру 7.
Пятая генно-терапевтическая субстанция (Е) на базе pCMV6-SEQ ID No: 5, содержащая модифицированную кДНК гена ANG (SEQ ID No: 5.) по примеру 3 в сочетании с транспортной молекулой -дендримером по примеру 7.
Шестая генно-терапевтическая субстанция (F) на базе pCMV6- SEQ ID No: 6, содержащая модифицированную кДНК гена ANG (SEQ ID No: 6.) по примеру 3 в сочетании с транспортной молекулой - дендримером по примеру 7.
Седьмая генно-терапевтическая субстанция (G) на базе pCMV6- SEQ ID No: 7, содержащая модифицированную кДНК гена ANG (SEQ ID No: 7.) по примеру 3 в сочетании с транспортной молекулой - дендримером по примеру 7.
Восьмая векторная плазмида pCMV6-XL5, не содержащая кДНК гена ANG по примеру 3 в сочетании с транспортной молекулой - дендримером по примеру 7.
При этом генетические конструкции, одна из которых содержит участок нативной немодифицированной кДНК гена ANG (SEQ ID No: 1), вторая генетическая конструкция содержит модифицированную кДНК гена ANG (SEQ ID No: 2), третья генетическая конструкция содержит модифицированную кДНК гена ANG (SEQ ID No: 3), четвертая генетическая конструкция содержит модифицированную кДНК гена ANG (SEQ ID No: 4), пятая генетическая конструкция содержит модифицированную кДНК гена ANG (SEQ ID No: 5), шестая генетическая конструкция содержит модифицированную кДНК гена ANG (SEQ ID No: 6), седьмая генетическая конструкция содержит модифицированную кДНК гена ANG (SEQ ID No: 7), восьмая плазмида (плацебо), представляет собой вектор pCMV6 XL5, растворяли в стерильной воде степени очистки Nuclease-Free. Для получения генно-терапевтических субстанций готовили комплексы ДНК-дендример по примеру 7.
Полученные семь вариантов генно-терапевтических субстанций и плацебо использовали для введения пациенту. Введение осуществляли тоннельным методом иглой 30G на глубину 3 мм в кожу предплечья пациентов. Объем вводимого раствора каждой генно-терапевтической субстанции составлял около 0,3 мл. Очаги введения генно-терапевтических субстанций и плацебо располагались на расстоянии 3-5 см друг от друга.
Биопсийные образцы брали через 72 часа после введения генно-терапевтических субстанций. Взятие биопсии осуществляли из участков введения генно-терапевтических субстанций, плацебо, а также из интактной кожи используя устройство для взятия биопсии кожи Epitheasy 3.5 (Medax SRL). Кожу пациента предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Размер каждого биопсийного образца был около 3 мм, масса - до 20 мг. Образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl pH 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторид и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 минут при 14000 об/мин. Отбирали супернатант и использовали его для количественного определения целевого белка.
Определение количества белка ангиогенина проводили в девяти биоптатах кожи пациента через 72 часа после введения генно-терапевтических субстанций методом твердофазного иммуноферментного анализа (ИФА ELISA), используя набор ANG Human ELISA Kit (Abcam, США), как описано в Примере 8.
По итогам определения количества белка ангиогенина, в лизате биоптатов кожи пациента выделили вариант генно-терапевтической субстанции, при введении которой в кожу наблюдается максимальное количество белка ангиогенина, в лизате биоптата кожи и соответственно наблюдается максимальная экспрессия гена ANG. В данном эксперименте максимальное количество целевого белка в лизате биоптата кожи отмечено при введении генно-терапевтической субстанции на базе pCMV6 ANG SEQ ID No: 7, содержащей модифицированную кДНК гена ANG, что показано на фигуре 20
Таким образом, выбрана наиболее эффективная применительно к данному пациенту генно-терапевтическая субстанция для ее последующего введения пациенту в рамках терапевтической процедуры.
Создано средство для лечения состояний человеческого организма, связанных с уменьшением экспрессии гена ANG и/или уменьшением количества белка ангиогенина, состоящее из одной или нескольких генно-терапевтических субстанций из группы генно-терапевтических субстанций для коррекции патологических состояний клеток органов и тканей и/или органов и тканей человека, возникших вследствие недостаточной экспрессии гена ANG, способ его получения и использования.
Созданное средство для лечения состояний человеческого организма, связанных с уменьшением экспрессии гена ANG и/или уменьшением количества белка ангиогенина, состоящее из одной или нескольких генно-терапевтических субстанций из группы генно-терапевтических субстанций с использованием одной из модифицированных кДНК гена ANG или участка нативной немодифицированной кДНК гена ANG позволяет на практике использовать входящие в группу генно-терапевтические субстанции для повышения до необходимого уровня белка ангиогенина, в различных клетках органов и тканей и/или органах и тканях человека путем увеличения экспрессии гена ANG.
В результате проведения предварительных исследований биоптата пациента, либо клеток, выращенных из этих биоптатов, определяют, какой вариант генно-терапевтической субстанции из созданной группы генно-терапевтических субстанций необходимо выбрать для данного пациента для того, чтобы повысить количество белка ангиогенина, в клетках этих органов и тканей и/или органах и тканях до необходимого уровня применительно к конкретному пациенту. В тех случаях, когда использование генно-терапевтической субстанции с участком нативной немодифицированной кДНК гена ANG не приводит к желаемому изменению уровня белка ангиогенина, в клетках органов и тканей и/или органах и тканях, необходимо применять субстанцию на основе модифицированной кДНК гена ANG, приводящей к более эффективной экспрессии гена ANG.
При использовании заявленной генно-терапевтической субстанции не происходит встраивания экзогенного генетического материала в геном клетки.
Группа генно-терапевтических субстанций обеспечивает высокий уровень экспрессии гена ANG, повышая количество белка ангиогенина, в клетках органов и тканей и/или органах и тканях человека в частности, в гепатоцитах, нейронах, клетках сосудистого эндотелия, мышечных клетках, фибробластах, клетках эпителия, лимфоцитах, в сочетании с транспортной молекулой или без нее при трансфекции этими генно-терапевтическими субстанциями клеток органов и тканей человека и/или в органах и тканях человека в частности, в спинном мозге, кровеносных сосудах, сердце, кишечнике, желудке, печени, желчном пузыре, легких, органах выделительной и половой систем (мочевом пузыре, мочеточниках, матке, яичниках), гладких и скелетных мышцах, интерстициальной, эндотелиальной, эпителиальной, нервной, мышечной тканях, плацентарной ткани, в дерме (коже) в сочетании с транспортной молекулой или без нее при введении этих генно-терапевтических субстанций в органы и ткани человека.
Таким образом, приведенные примеры подтверждают выполнение поставленной задачи, а именно, создание высокоэффективного средства для лечения состояний человеческого организма, связанных с уменьшением уровня экспрессии гена ANG и/или уменьшением количества белка ангиогенина, на основе генно-терапевтических субстанций с геном ANG, представляющего собой группу генно-терапевтических субстанций, при использовании которых с учетом индивидуальных особенностей пациента, происходит повышение уровня экспрессии гена ANG и/или повышение количества белка ангиогенина, в клетках органов и тканей и/или органах и тканях организма.
Кроме этого при введении генетических конструкций в отличие от введения непосредственно белка, снижается требуемая частота их введения в связи с пролонгированным действием, а также облегчается внутриклеточная доставка.
Повышение эффективности коррекции количественного уровня белка ангиогенина, в клетках органов и тканей человека достигают за счет того, что при недостаточном количестве этого белка вследствие дефекта гена ANG используют не белок, а генетическую конструкцию с кДНК гена ANG, кодирующую этот белок.
Промышленная применимость.
Все приведенные примеры по созданию и использованию созданной группы генно-терапевтических субстанций подтверждают ее промышленную применимость.
Перечень сокращений
ДНК - дезоксирибонуклеиновая кислота
кДНК - комплементарная дезоксирибонуклеиновая кислота
РНК - рибонуклеиновая кислота
мРНК - матричная рибонуклеиновая кислота
ПЦР - полимеразная цепная реакция
мл - миллилитр, мкл - микролитр
л - литр
мкг - микрограмм
мг - миллиграмм
г - грамм
мкМ - микромоль
мМ - миллимоль
об/мин - обороты в минуту
нм - нанометр
см - сантиметр
мВт - милливатт
о.е.ф. - относительная единица флуоресценции
ГТС - генно-терапевтическая субстанция.







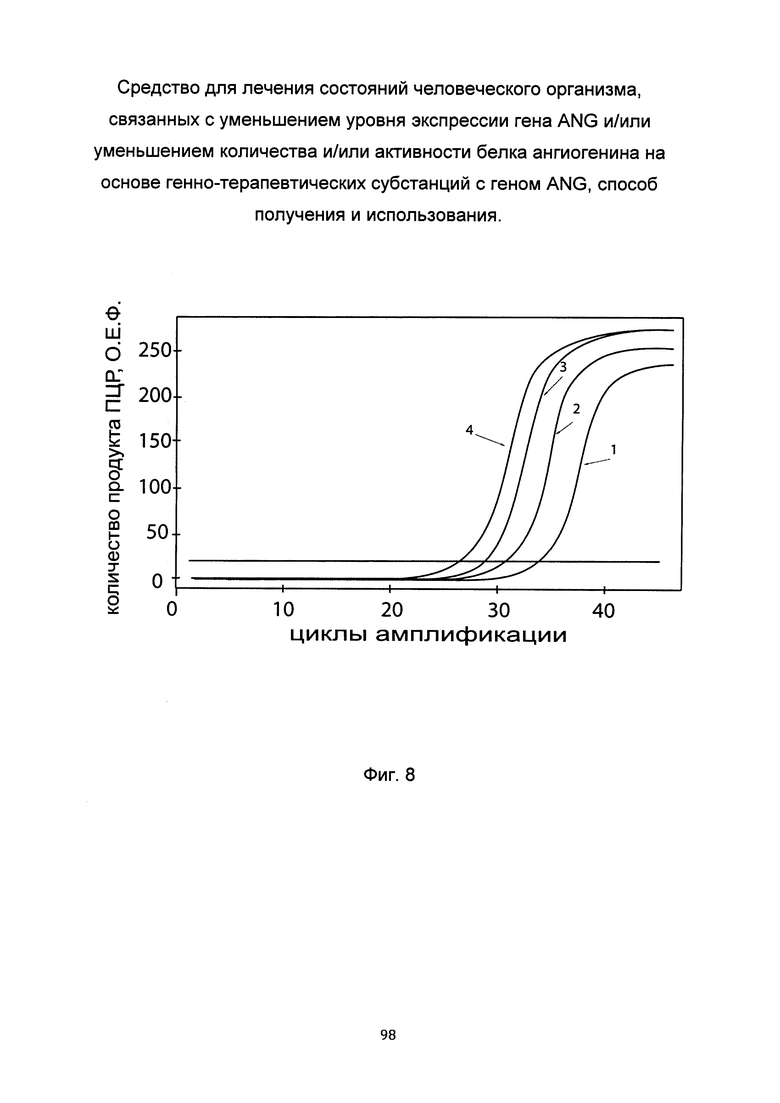
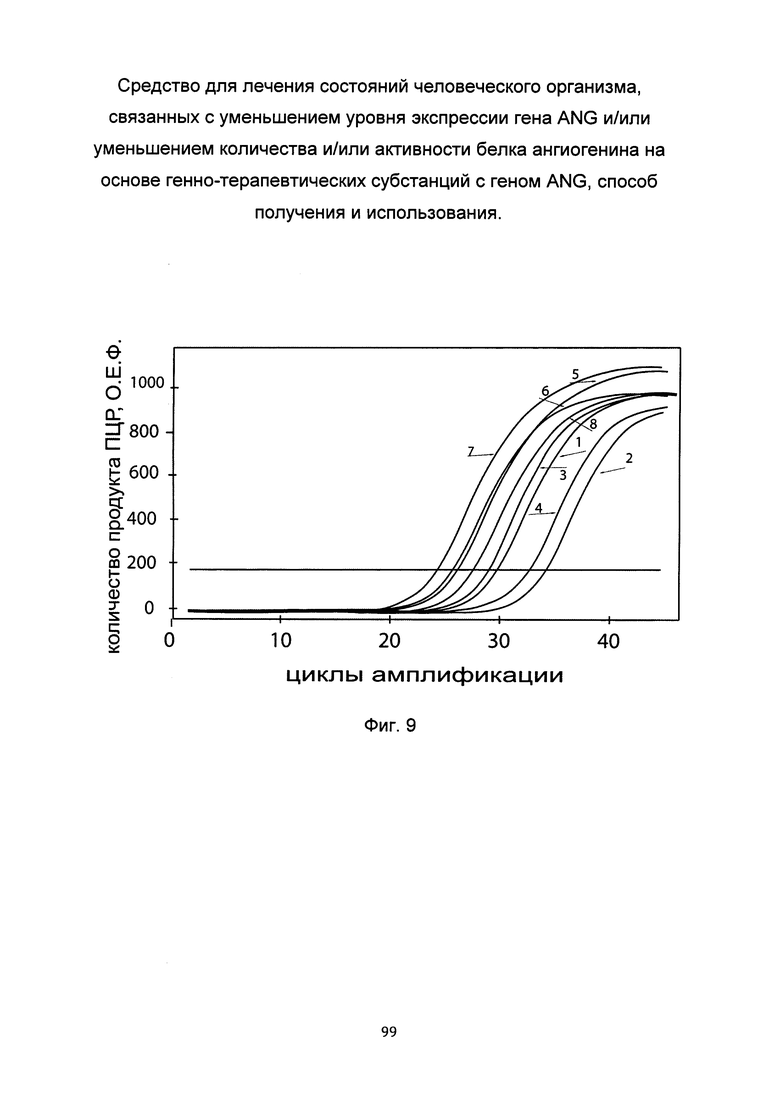
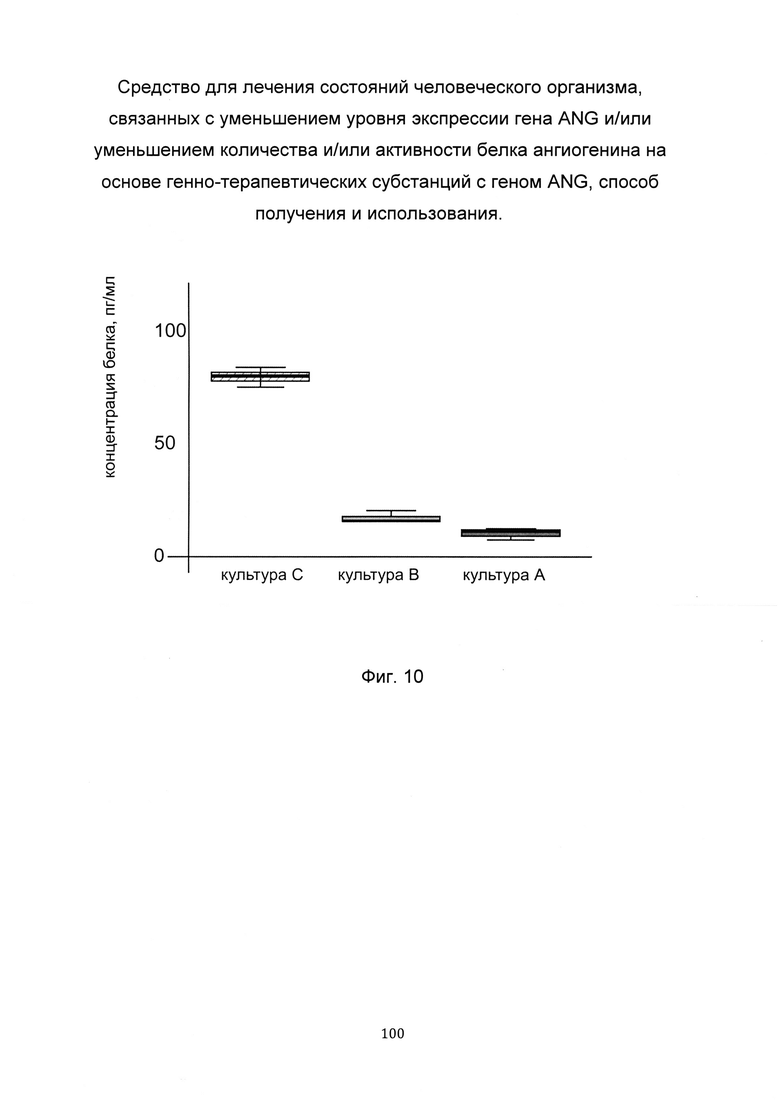
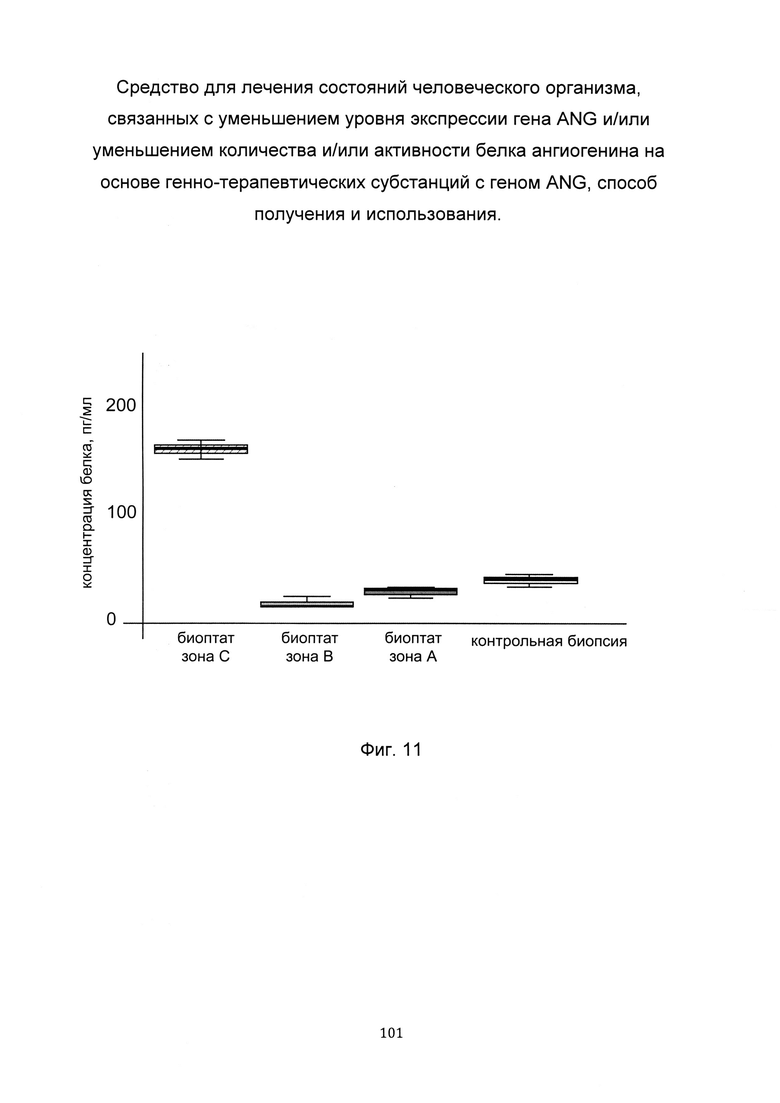
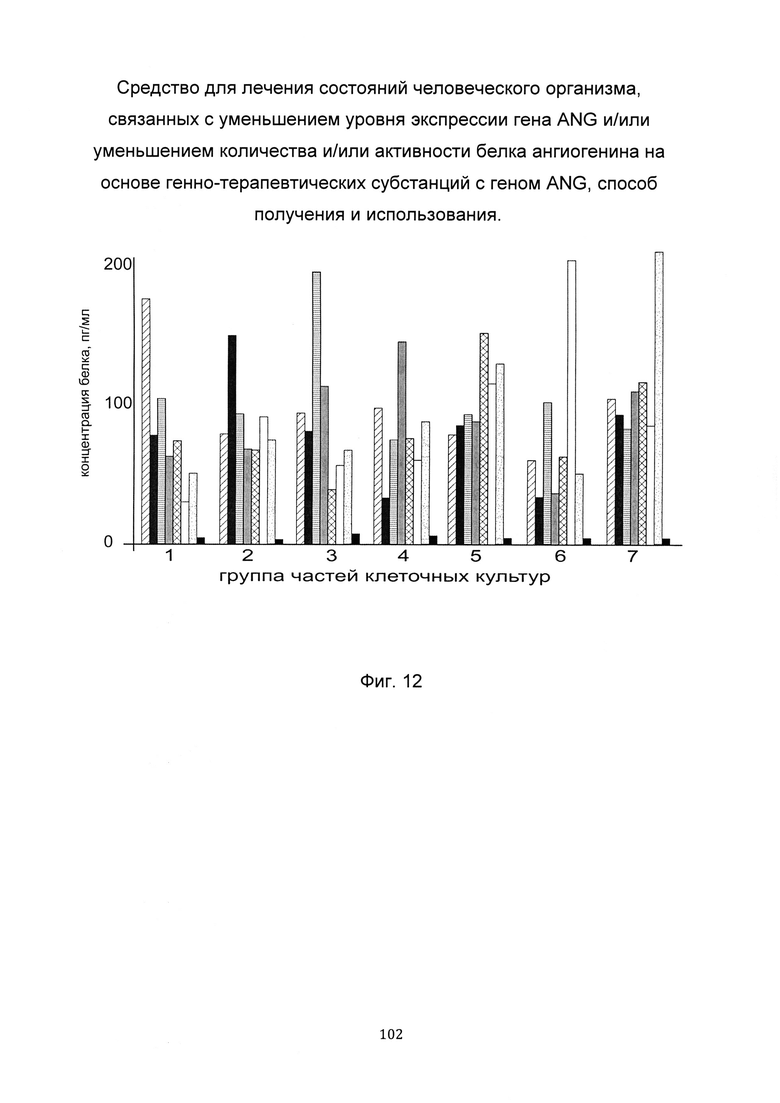
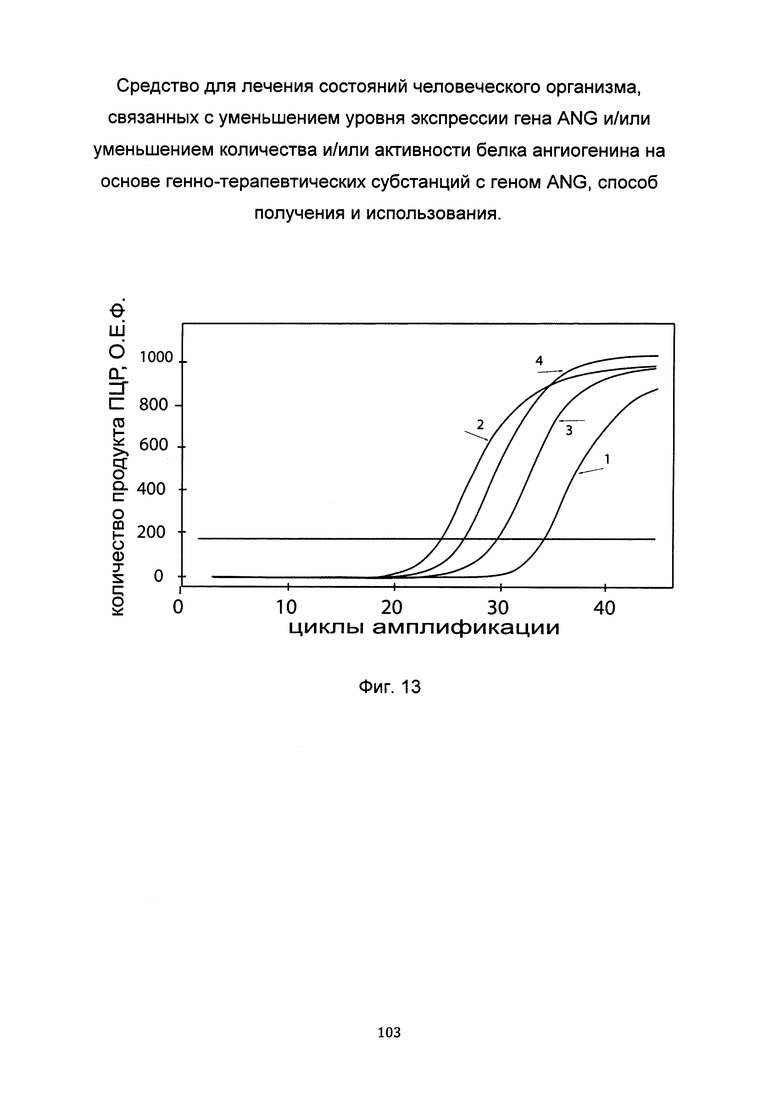
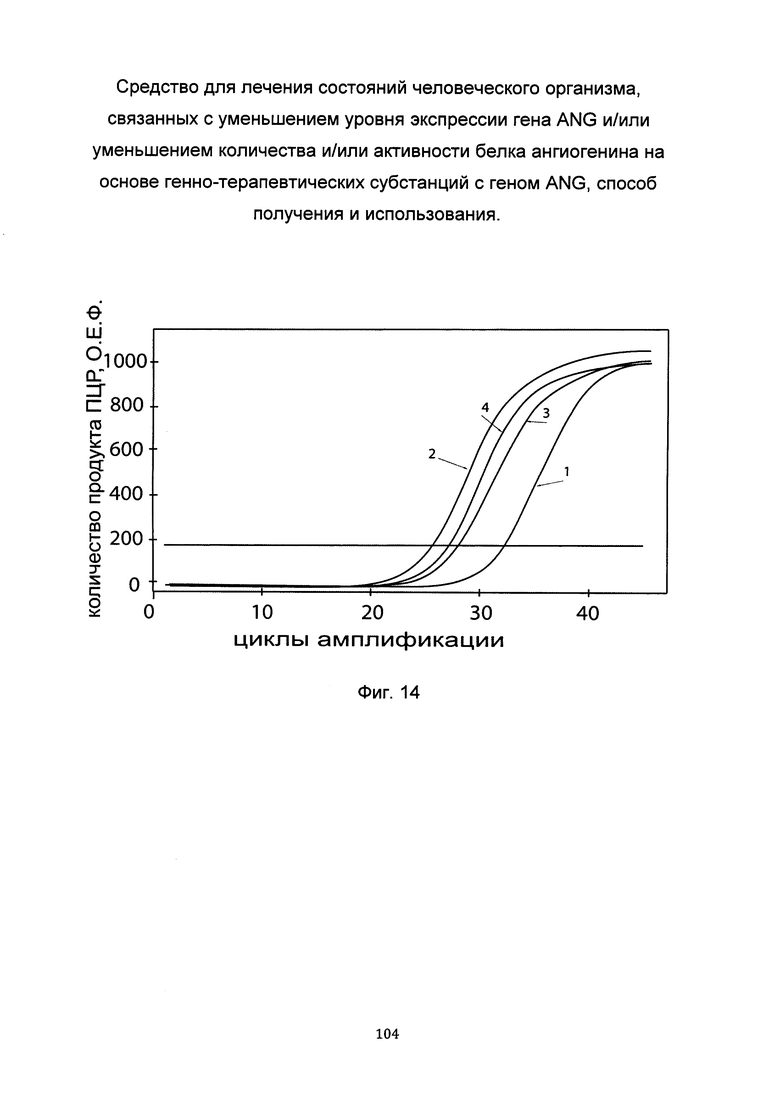
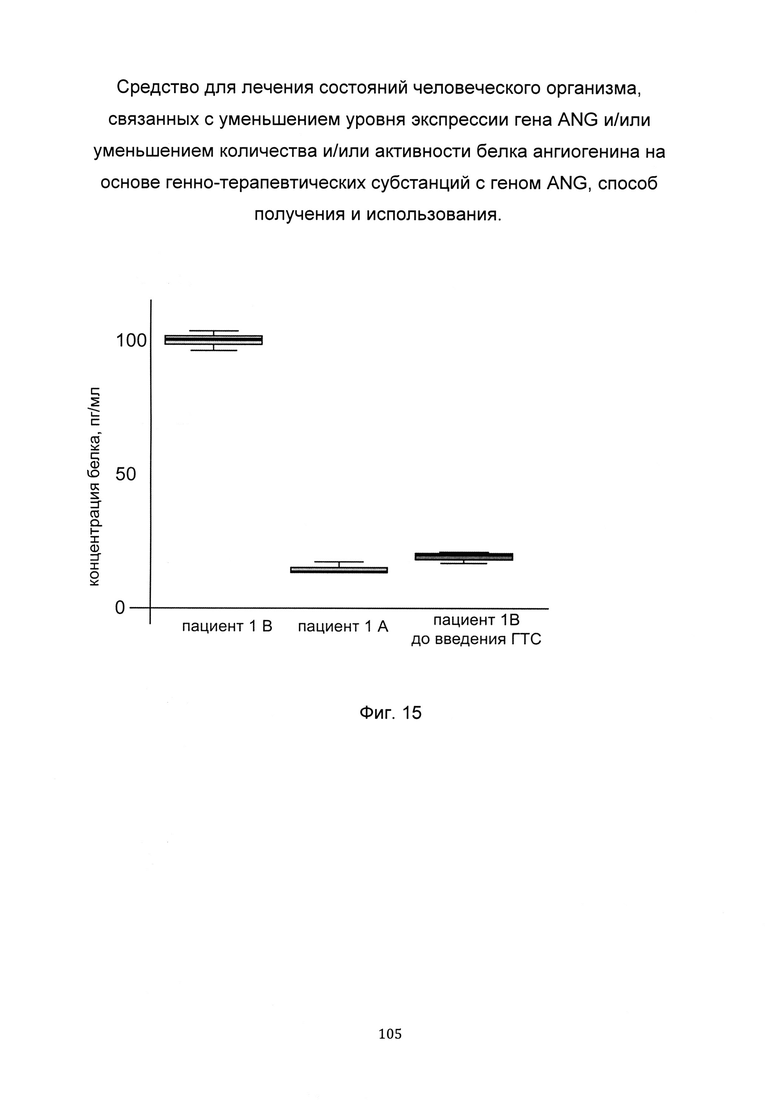
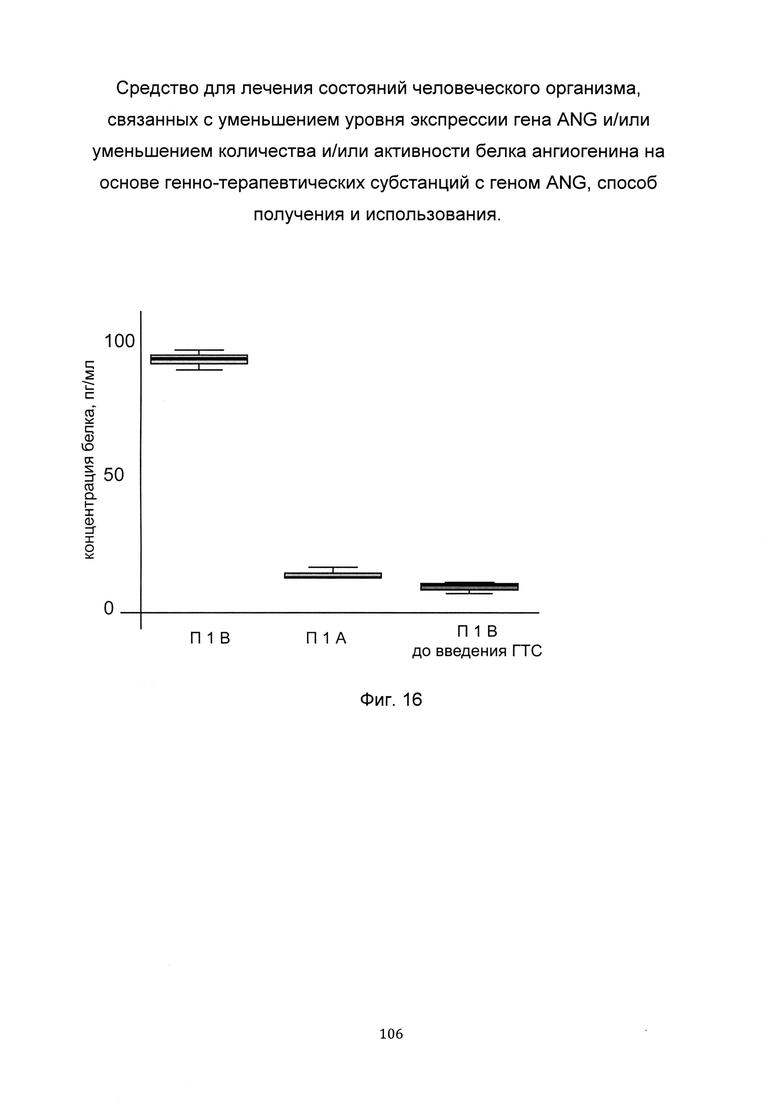
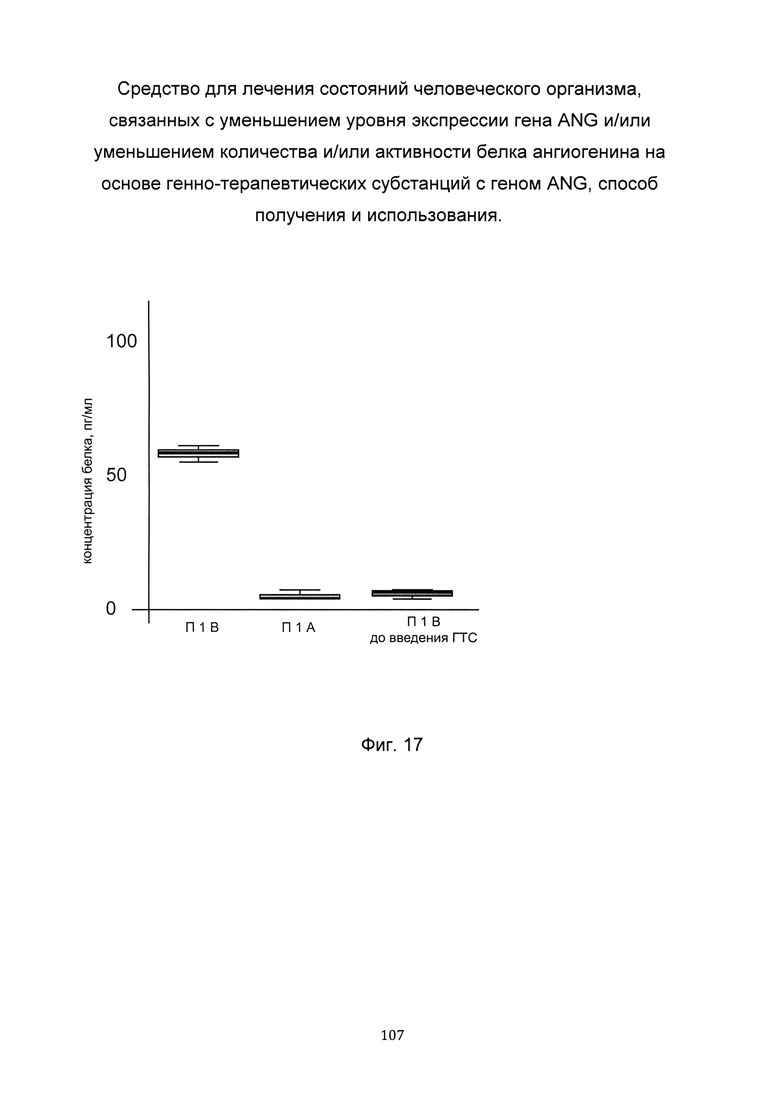
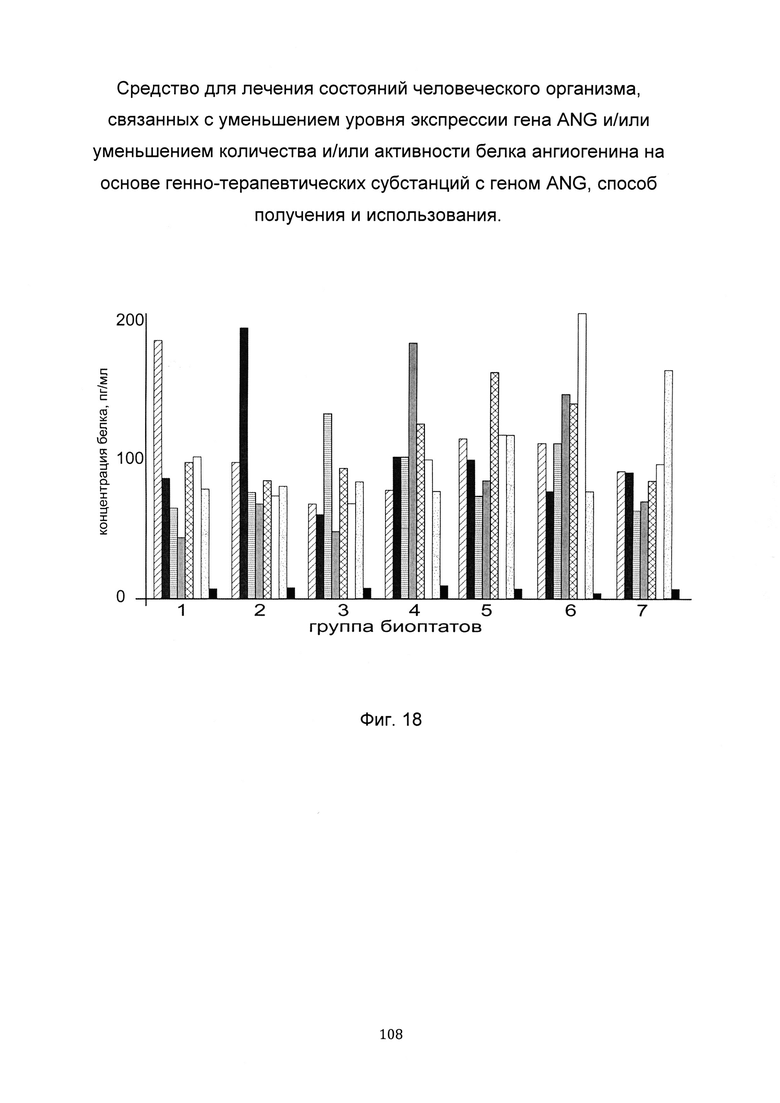
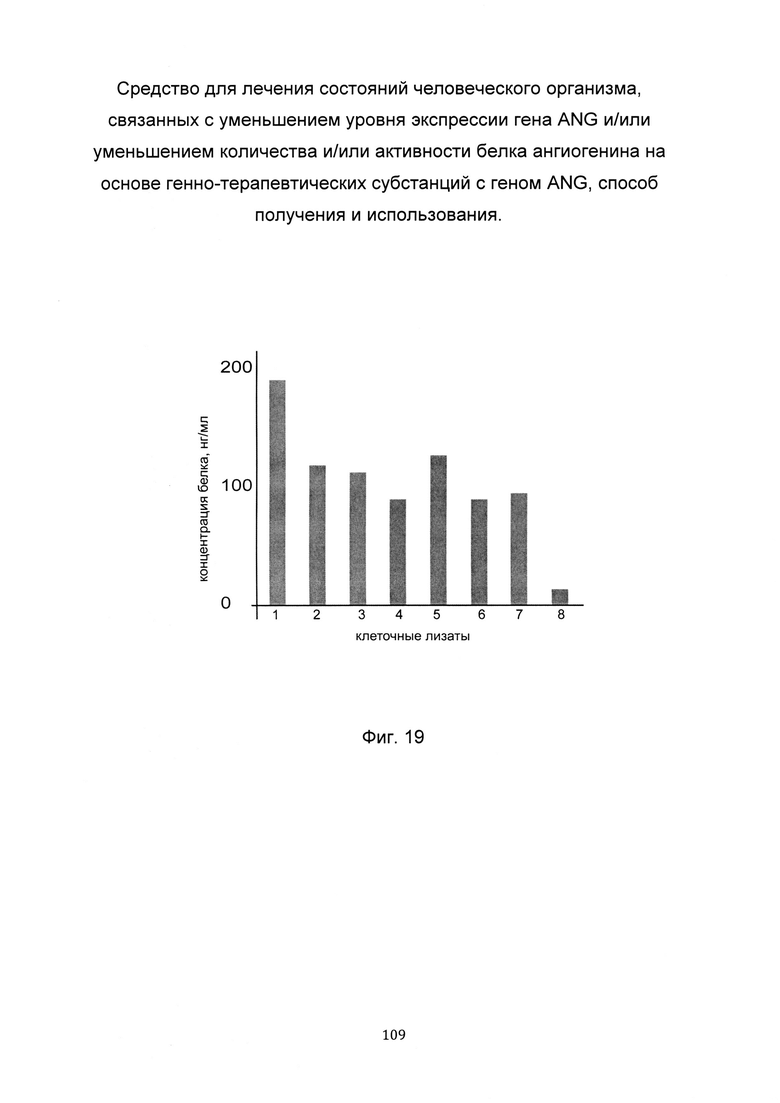
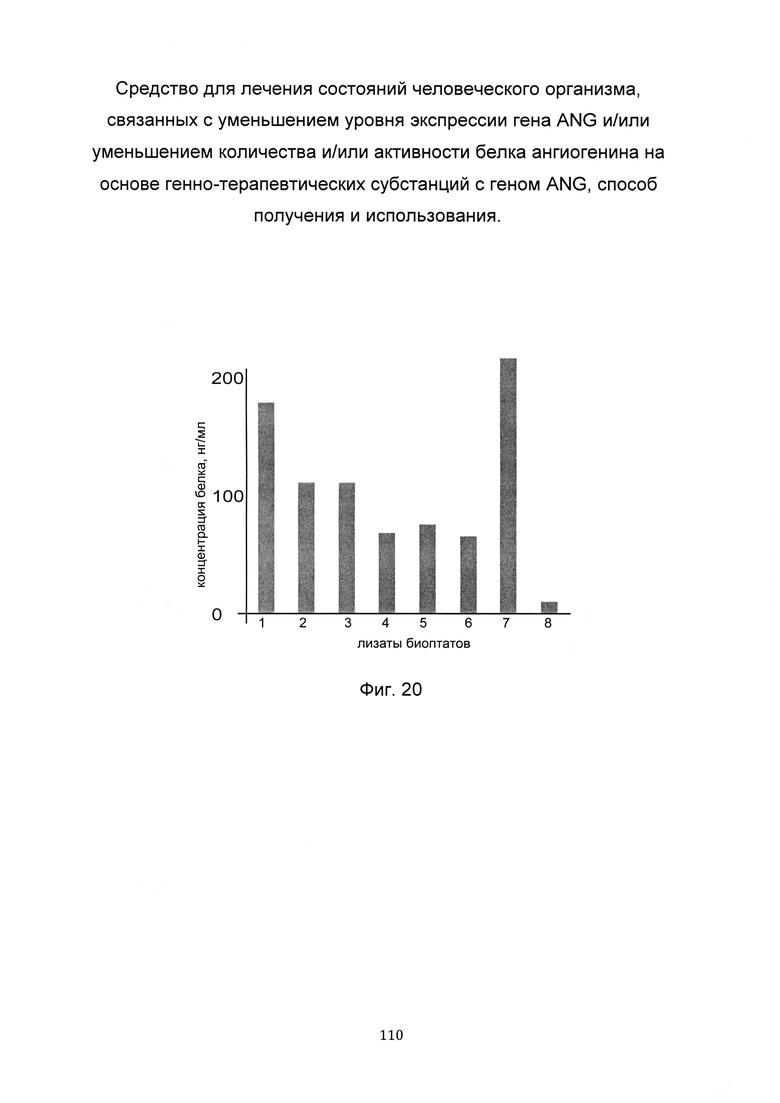
Изобретение относится к области биохимии, в частности к средству для лечения состояний человеческого организма, связанных с уменьшением уровня экспрессии гена ANG и/или уменьшением количества и/или активности белка ангиогенина на основе генно-терапевтической субстанции с геном ANG, представляющей собой генетическую конструкцию на основе векторной плазмиды, включающей кДНК гена ANG, с кодирующей последовательностью белка ангиогенина, с делециями 5' и 3'-нетранслируемых областей, и регуляторными элементами, обеспечивающими повышение экспрессии гена ANG в эукариотических клетках и в клетках органов и тканей человека, выбранных из фибробластов, эпителиальных клеток роговицы глаза, кожи, слизистой оболочки полости рта или мышечной ткани, в сочетании с транспортной молекулой или без нее при введении этого средства в органы и ткани человека. Изобретение также относится к способу получения вышеуказанного средства и способу его использования. Изобретение обеспечивает высокоэффективное лечение состояний человеческого организма, связанных с уменьшением уровня экспрессии гена ANG и/или уменьшением количества и/или активности белка ангиогенина. 3 н. и 2 з.п. ф-лы, 20 ил., 18 пр.
1. Средство для лечения состояний человеческого организма, связанных с уменьшением уровня экспрессии гена ANG и/или уменьшением количества и/или активности белка ангиогенина, на основе генно-терапевтических субстанций с геном ANG, представляющее собой, по крайней мере, одну генно-терапевтическую субстанцию, выбранную из группы генно-терапевтических субстанций, каждая из которых представляет генетическую конструкцию на основе векторной плазмиды, включающей кДНК гена ANG, с кодирующей последовательностью белка ангиогенина, с делециями 5' и 3'-нетранслируемых областей, а именно, полученной на основе участка нативной немодифицированной кДНК гена ANG SEQ ID No:1, или модифицированной кДНК гена ANG, при этом в качестве модифицированной кДНК гена ANG используют SEQ ID No:2, или SEQ ID No:3, или SEQ ID No:4, или SEQ ID No:5, или SEQ ID No:6, или SEQ ID No:7, или сочетание этих генетических конструкций, каждая из которых содержит также регуляторные элементы, обеспечивающие повышение экспрессии гена ANG в эукариотических клетках, в клетках органов и тканей человека, где клетки органов и тканей выбраны из фибробластов, эпителиальных клеток роговицы глаза, органы и ткани выбраны из кожи, слизистой оболочки полости рта или мышечной ткани, в сочетании с транспортной молекулой или без нее при введении этого средства в органы и ткани человека.
2. Средство по п. 1, отличающееся тем, что генетическая конструкция с модифицированной кДНК гена ANG содержит последовательность нуклеотидов, включающую в себя белок-кодирующую область кДНК гена ANG, которая несет модификации, не затрагивающие структуру белка ангиогенина, а именно: нуклеотидные замены, не приводящие к аминокислотным заменам или обрыву аминокислотной цепи, или комбинации вышеперечисленных модификаций и не влияющие на кодируемую этой последовательностью аминокислотную последовательность.
3. Средство по п. 1, отличающееся тем, что в качестве транспортной молекулы используют липосомы, или дендримеры 5-го и выше поколений, или амфифильные блоксополимеры.
4. Способ получения средства для лечения состояний человеческого организма, связанных с уменьшением уровня экспрессии гена ANG и/или уменьшением количества и/или активности белка ангиогенина по п. 1, заключающийся в получении каждой генно-терапевтической субстанции из группы генно-терапевтических субстанций, при этом получают кДНК гена ANG, затем помещают кДНК и регуляторные элементы в векторную плазмиду, способную обеспечить высокий уровень экспрессии этой кДНК в клетках различных органов и тканей человека, наращивают и выделяют необходимое количество субстанции, затем комбинируют субстанцию с транспортной молекулой для трансфекции полученным средством клеток органов и тканей и/или введения полученного средства в органы и ткани человека, при этом используют кДНК гена ANG с кодирующей последовательностью белка ангиогенина, с делециями 5' и 3'-нетранслируемых областей, а именно, полученной на основе участка нативной немодифицированной кДНК гена ANG SEQ ID No:1, или модифицированной кДНК гена ANG, при этом в качестве модифицированной кДНК гена ANG используют, или SEQ ID No:2, или SEQ ID No:3, или SEQ ID No:4, или SEQ ID No:5, или SEQ ID No:6, или SEQ ID No:7, или используют сочетание этих субстанций.
5. Способ использования средства по п. 1 для лечения состояний человеческого организма, связанных с уменьшением уровня экспрессии гена ANG и/или уменьшением количества и/или активности белка ангиогенина, заключающийся в трансфекции средством для лечения по п. 1 клеток органов и тканей пациента и/или во введении в органы и ткани пациента аутологичных клеток пациента, трансфицированных средством для лечения по п. 1 и/или во введении в органы и ткани пациента средства для лечения по п. 1.
| US 20170071972 A1, 16.03.2017 | |||
| KURACHI K., et al., Expression of Human Angiogenin in Cultured Baby Hamster Kidney Cells, BIOCHEMISTRY, 1988, Vol.27, No.17, pp.6558-6562 | |||
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ТЕРАПИИ НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ, В ЧАСТНОСТИ БОКОВОГО АМИОТРОФИЧЕСКОГО СКЛЕРОЗА | 2012 |
|
RU2491097C1 |
Авторы
Даты
2018-09-04—Публикация
2017-03-17—Подача