Изобретение относится к ветеринарии и предназначено для оценки биологической полноценности инкубационного яйца, риска снижения выводимости и сохранности цыплят.
Птицеводство является одной из ключевых отраслей сельского хозяйства, которое вносит весомый вклад не только в экономику страны, но и обеспечивает ее продовольственную безопасность. Доброкачественное пищевое яйцо содержит все необходимые для человека питательные и биологически активные вещества в сбалансированной и легко усвояемой форме. Яйценоскость птицы определяется генетическим потенциалом, физиологическим состоянием организма и условиями внешней среды. При этом степень проявления наследуемого уровня продуктивности и продолжительность продуктивной жизни кур-несушек зависит от полноценности эмбриогенеза, роста и развития ремонтного молодняка, поэтому ключевым фактором, определяющим яйценоскость кур, а, следовательно, и эффективность птицеводства, является качество инкубационного яйца. Птица, переболевшая в эмбриональный период, хуже растет и развивается, часто не в состоянии проявить в дальнейшем хорошую мясную и яичную продуктивность [Прокудина Н.А., Артеменко А.Б., Огурцова Н.С. Методы биологического контроля в инкубации / Под общ. ред. Ю.А. Рябоконя. - Борки, 2006. - 107 с.], поэтому производство инкубационного яйца строго регламентируется нормативными документами. Так, в настоящее время действует ОСТ 10321-2003 [Яйца куриные. Инкубационные. Технические условия: ОСТ 10 321-2003. Введ. 01.04.2003. - Сергиев Пасад, 2003. - 20 с.], определяющий технические требования, методы контроля, правила приемки, упаковки, хранения и транстпортировки яиц куриных, предназначенных для инкубации с целью получения суточного молодняка. В данном отраслевом стандарте отмечено, что для инкубации используют яйца, полученные в соответствии с ОСТ 46-184-85 от несушек, содержащихся в хозяйствах благополучных по инфекционным заболеваниям [Производство яиц куриных инкубационных. Технологические процессы содержания кур родительского стада. Основные параметры: ОСТ 46 184-85. Введ. с 01.12.1985. - Загорск, 1985. - 6 с.]. В отраслевом стандарте регламентируется такие параметры как внешний вид, масса и плотность яйца, а также содержание в нем витаминов, толщины скорлупы, индекса и кислотного числа желтка.
Однако данные отраслевые стандарты не учитывают многие физико-химические показатели яиц, определяющие эмбриональное развитие и жизнеспособность цыплят. Так, И.Н. Яковлева акцентирует внимание на влиянии на эмбриогенез и качество цыплят степени контаминации яиц [Яковлева Е.Г. Зависимость показателей качества выращивания цыплят от микробной контаминации, физических свойств и биохимического состава инкубационных яиц // Современные проблемы науки и образования. - 2015, 2-2. - С. 855.], а Н.С. Акимова - на роли возраста кур-несушек, от которых их получили [Акимова Н.С. Инкубационные качества яиц кур кросса «Хайсекс белый» в зависимости от возраста несушек // Сб. науч. тр. /Всерос. н.-и. и технол. ин-т птицеводства - Сергиев Посад, 2002. - Т. 77. - С. 98-102].
Таким образом, отраслевые стандарты определяют базовые параметры отбора яиц для инкубации, но для повышения полноценности эмбриогенеза и жизнеспособности цыплят необходим более расширенный алгоритм оценки инкубационных яиц.
Ю.А. Глебова предлагает способ прогнозирования выводимости яиц и вывода цыплят яичных кур на основании расчета индекса ранней естественной резистентности по более 15 показателям [Глебова, Ю. А. Прогнозирование репродукции у яичных кур / Ю.А. Глебова // Актуальные проблемы ветеринарного акушерства и репродукции конференции животных: материалы международной научно-практической конференции, посвященной 75-летию со дня рождения и 50-летию научно-практической деятельности доктора ветеринарных наук, профессора Г.Ф. Медведева, - Горки: БГСХА, 2013. - С. 317-321].
Однако необходимость определения большого количества показателей снижает практическую приемлемость данного способа.
Известен способ «Visible light/near infrared spectroscopy-based fowl egg hatching capability determination method» [Visible light/near infrared spectroscopy-based fowl egg hatching capability determination method: пат. №105973816 A CN, F16B 13/10_/ T. Xiuying, Q. Wuchang, P. Yankun, L. Yongyu. - опублик. 28.09.2016.], авторы которого предлагают оценивать инкубационные качества яиц с помощью видимого света / ближней инфракрасной спектроскопии. Метод включает предварительную обработку спектральных данных яичного яйца, построение математической модели для определения возможности выведения методом качественного анализа и определение модели с наивысшей точностью определения в качестве оптимальной модели для прогнозирования выводимости цыплят.
Данный метод перспективен для разработки программного обеспечения инкубации, но в представленном варианте он требует специальной подготовки специалистов и дорогостоящего оборудования, что ограничивает его применение.
Известен способ ранней оценки яичных кур при селекции [RU № 2507739 C1, А01К 67/02, опубл. 27.02.2014 г. Бюл. №6], в котором эмбрионы дополнительно оценивают по интенсивности эмбрионального развития в период инкубации путем определения на 18-19 час инкубации диаметра зародыша и определения на 63-64 час инкубации диаметра сосудистого поля желточного мешка. При этом отбирают эмбрионы, у которых диаметр сосудистого поля желточного мешка не менее 20 мм, а разница между диаметрами сосудистого поля и зародыша находится в диапазоне 10-15 мм, что позволяет повысить выводимость яиц, сохранность цыплят до 16-недельного возраста, яйценоскость кур за 45 недель жизни, а также ускорить наступление половой зрелости кур на 4,0-5,0 дней.
Несмотря на высокую информативность данного способа, он основан на констатации уже произошедшего изменения эмбриогенеза, что указывает на высокую вероятность снижения жизнеспособности цыплят, но не дает возможности устранения данного риска.
М.В. Орлов предлагает оценивать куриные эмбрионы по времени появления бластодиска путем овоскопирования в первые часы после начала инкубации [Орлов М.В. Биологический контроль в инкубации. М., Россельхозиздат, 1966. - 164 с.]. Данный способ основан на том, что зародыши, в которых бластодиск виден раньше, и дальше развивались более интенсивно, а выводимость таких яиц была выше.
Несмотря на простоту способа, он требует изъятия яиц из инкубатора, что снижаете его практическую приемлемость, а также в нем не учитываются риски, обусловленные нарушением биохимического статуса яйца, проявляющиеся на поздних стадиях эмбриогенеза.
Имеется «Способ определения оплодотворенности яиц птицы» [RU № 2161404 C1, А01K 45/00, G01N 33/08, опубл. 10.01.2001 г. Бюл. №1], в котором рекомендуется просвечивание яйца направленным лучом света и оценку развития зародышевого диска в желтке яйца, отличающийся тем, что жизнедеятельность зародышевого диска яйца определяют по колебаниям объема его воздушной камеры.
Однако данный способ является диагностическим, но не прогностическим, т.к., позволяет выявить нарушения эмбриогенеза, но не информировать о риске их возникновения.
Многие авторы обращают внимание на зависимость инкубационных качеств яйца от его биохимического состава. Так, Ю.А. Александров [Александров Ю.А. Биохимические показатели яиц кур-несушек разных кроссов и их влияние на инкубационные качества и пищевую ценность // Вестник Марийского государственного университета. Серия "Сельскохозяйственные науки. Экономические науки". - 2015, №2, С. 5-7.] акцентирует внимание на роль содержания в яйце селена и йода, Al-Murrani W.K - аминокислот [Аl-Murrani W.K. Effect of injecting amino acids into the egg on embryonic and subsequent growth in the domestic fowl // Brit. Poultry Sc. - 1982. - Vol. 23. - P. 171-174.], a E.J. Robel - биотина [Robel E.J. Increasing hatchability with biotin // Intern. Hatchery Practice. 1990. - Vol. 4, N 2. - P. 47-53.].
Анализ опубликованных источников информации и результатов собственных исследований показал сравнительно низкую информативность прогноза выводимости и качества приплода, основанного на оценке концентрации в яйце веществ, уровень которых зависит от их содержания в рационе кур-несушек, по причине высокой вариабельности зависимости от внешних факторов.
Более информативны метаболиты, являющиеся продуктами физиологических и патофизиологических реакций. Многие авторы отмечают достоверное влияние на развитие эмбриона эмбриогенеза молочной кислоты [Kucera P., Raddatz Е., Baroffio A. Oxygen and glucose uptake in the early chick embryo // In: Respiration and metabolism of embryonic vertebrates / Ed. R.S. Seymour. - Dordrecht, the Netherlands, 1984. - P. 299-309], гормонов [Al-Murrani W.K. Effect of injecting amino acids into the egg on embryonic and subsequent growth in the domestic fowl // Brit. Poultry Sc. - 1982. - Vol. 23. - P. 171-174.], продуктов метаболизма азота [Титов В.Ю. Специфическая роль оксида азота (NO) в эмбриональном миогенезе птиц / В.Ю. Титов, Г.В. Кондратов, А.В. Иванова // Бюллетень экспериментальной биологии и медицины. - 2014, 10 (158). - С. 512-516.] и липидов [Комаров А.А. Окисление и гидролиз липидов. / Комаров А.А., Васильев А.В., Титова Е.Г. // Птицеводство. - 2007. - №7. - С. 36-36.].
Однако изменение уровня метаболитов данной группы относится к категории полифакторых феноменов, проявляющихся интегральным биохимическим сбоем. Большинство из этих показателей имеют сравнительно высокую диагностическую, но низкую прогностическую информативность, т.к. каждая биологическая система в ответ на патогенетические процессы активирует специфические саногенетические реакции с соответствующей корректировкой гомеорезиса.
Таким образом, очевидна актуальность разработки способа прогнозирования выводимости и сохранности цыплят, не имеющего указанные недостатки, при одновременном повышении его практической приемлемости и прогностической информативности, в основе которого должно быть изучение метаболических предикторов, выбор которых основан на закономерностях эмбриогенеза и эмбриопатии.
Известен способ идентификации фенотипически невыраженных форм сельскохозяйственной птицы [RU № 22404577 C1, А01К 67/02, опубл. 27.11. 2010 г., Бюл. №33], который позволяет прогнозировать мясную продуктивность птицы на основании определения суммарного содержания нитро- и нитрозосоединений в аллантоисе эмбриона на заключительной стадии предплодного периода. Причем этот показатель у быстрорастущих превосходит таковой у медленнорастущих в 4 и более раз.
Однако данный способ предназначен для оценки фенотипа цыплят, но не качества инкубационных яиц, помимо этого, в основе данного способа лежит определение метаболитов азота, что позволяет оценить физиологические механизмы регуляции эмбриогенеза, но не отражает риски эмбриопатии, поэтому способ не может быть применен для прогнозирования выводимости и жизноспособности цыплят.
Таким образом, в уровне техники не выявлены аналоги, позволяющие прогнозировать выводимость и сохранность цыплят.
Изобретение решает задачу разработки способа прогнозирования выводимости и сохранности цыплят.
Для решения поставленной задачи предложен способ прогнозирования выводимости и сохранности цыплят, включающий отбор яиц методом случайной выборки от кур одной группы риска, определение содержания малонового диальдегида и стабильных метаболитов в желтке и белке и констатацию низкой полноценности яйца, наличие риска снижения выводимости и сохранности цыплят в случае содержания малонового диальдегида в желтке не менее 36,0 нМ, стабильных метаболитов окиси азота в желтке менее 3,0 мМ NOx/грамм белка и содержании в белке менее 1,0 мМ NOx/грамм белка. Расчет численности выборки, достаточной для достоверности результата, проводят по формуле n=t2/K2, где n - объем выборки в планируемом исследовании; t - число сигм, соответствующее показателю вероятности, достаточной в планируемом исследовании; K - допустимая неточность в данном эксперименте, выраженная в сигмах.
Теоретической основой изобретения является то, что окись азота (NO) является одной из важнейших биологических сигнальных молекул, принимающая активное участие во многих физиологических процессах, в том числе и эмбриогенезе, где продукты метаболизма азота участвуют в регуляции дифференциации тканей [Титов В.Ю. Физиологическое значение окиси азота в эмбриогенезе птицы и использование ее доноров для коррекции развития эмбриона / В.Ю. Титов, Н.С. Акимова, Э.З. Винникова // Материалы конференции РАСХН - РФФИ «Ориентированные фундаментальные исследования и их реализация в АПК России». - 2009. - С. 150-153]. Поэтому можно предположить, что низкое содержание окиси азота может стать причиной нарушения развития эмбриона в яйце. Период полураспада NO в биологических системах очень короткий (миллисекунды), поэтому в клинической практике определяют концентрацию суммы его стабильных метаболитов. Оксид азота является активным элементом патогенеза многих заболеваний [Сосунов А.А. Оксид азота как межклеточный посредник / Сосунов А.А. // Соросовский образовательный журнал. - 2000. - т. 6. - №12. - С. 27-30], поэтому накопление его метаболитов может быть причиной или следствием патологического процесса. Для дифференциации физиологической и патофизиологической активации синтеза NO необходимо выявление маркеров патологии. При этом, учитывая, что оксид азота обладает выраженными антиоксидантными свойствами, т.к. является донором электронов в восстановительных реакциях, целесообразно изучение перекисного окисления липидов (ПОЛ), которое может выступать как в качестве вторичного мессенджера, участвуя в трансмембранной передаче сигналов и формирования внутриклеточной среды, так и причиной большинства метаболических патологий. Наиболее стабильным продуктом ПОЛ является молоновый диальдегид, который синтезируется за счет процессов, которые включают в себя арахидоновую кислоту и другие полиненасыщенных жирные кислоты [Владимиров Ю.А. Свободные радикалы в живых системах / Ю.А. Владимиров, О.А. Азизова, А.И. Деев с соавт. // Итоги науки и техники, 2000. - Т. 29. - С. 151-167.]. Увеличение ее содержания указывает на нарушение баланса антиоксидантно-прооксидантных процессов с доминированием реакций липопероксидации и окисления кислорода по одноэлектронному пути, в процессе которого образуется большинство сверхактивных свободных радикалов - нарушающих нормальное протекание всех биосинтетических процессов в яйце.
Таким образом, окись азота активно участвует во многих физиологических процессах и снижение уровня продуктов биотрансформации азота может стать причиной нарушения развития эмбриона, поэтому необходимо контролировать нижний их уровень. Учитывая, что метаболиты азота являются трансмиттерами многих патологических процессов и взаимосвязь между метаболизмом азота и пероксидацией липидов, для оценки риска свободнорадикального окисления белков следует контролировать верхний уровень продуктов перекисного окисления липидов. Поэтому, можно предположить, что определение концентрации в белке яйца суммы стабильных метаболитов окиси азота, позволит прогнозировать течение процесса эмбриогенеза, а оценка уровня молонового диальдегида в желтке - риск эмбриопатии, что в результате даст основание для прогноза выводимости и сохранности цыплят.
Способ позволяет прогнозировать риски в период инкубации и первых дней жизни цыплят, с целью улучшения выводимости яиц и качества выведенного молодняка, что повышает полноценность проявления генетического потенциала птицы, способствует более эффективному использованию яйцеместа в инкубаторах и производственные помещения, предназначенные для содержания племенной птицы, что способствует сокращению затрат на инкубацию, выращивание племенного молодняка и росту эффективности птицеводства.
Способ осуществляют следующим образом. Проводят клиническое обследование кур и полный зоотехнический анализ корма, который получает птица. На основании обследования выделяют три группы кур: 1-я группа - клинически здоровые; 2-я группа - с легким течением висцеральной формы мочекислого диатеза; 3-я группа - куры, которые в течение 25 суток перед контрольной яйцекладкой получали рацион с повышенным перекисным числом (0,53% Йода). В течение 5-ти дней получают яйцо, а затем из каждой группы методом случайных выборок отбирают яйца для более детального анализа. Затем определяют содержание малонового диальдегида, стабильных метаболитов в желтке и белке по общепринятым методикам [Методическое положение по изучению процессов свободнорадикального окисления и системы антиоксидантной защиты организма. - Воронеж, 2010 - 72 с.] и [Способ определения малонового диальдегида в биологическом материале: SU № 1469460 A1, G01N 33/48 / A.M. Дупин, А.А. Болдырев. - опубл. 30.03.1989 г.]. Общее содержание малонового диальдегида в желтке яйца менее 35,0 нМ, стабильных метаболитов окиси азота (NO2-+NO3-=NOx) в желтке более 3,0 мМ NOx/г. белка и в белке - более 1,0 мМ NOx/г. белка указывает на сравнительно высокую биологическую полноценность инкубационного яйца, что дает основание для прогнозирования выводимости цыплят на уровне не ниже 85%, а их сохранности в течение первой недели жизни - не менее 98,0%. О низкой полноценности яйца, наличии риска снижения выводимости и сохранности цыплят свидетельствует увеличение содержания малонового диальдегида в желтке до 36,0 нМ и более, стабильных метаболитов окиси азота в желтке менее 3,0 мМ NOx/г. белка и в белке менее 1,0 мкМ NOx/г. белка.
Пример конкретного выполнения изобретения.
В условиях экспериментально-биологической лаборатории ГНУ ВНИВИПФиТ Россельхозакадемии были проведены исследования на курах и петухах родительского стада кросса Хайсекс Браун. Содержание птицы, кормление и ветеринарно-санитарные мероприятия были организованы в соответствии с «Руководством по работе с птицей кросса Хайсекс Браун» [Руководство по работе с птицей кросса Хайсекс Браун / Под ред. А.К. Грачева. - Кашино: «Лазурь», 2007. - 82 с.]. В период воспроизводства от кур в возрасте 158-165 суток было отобрано 230 яиц соответствующих требованиям ОСТ 10321-2003, которые были разделены на три группы: №1 (n=90) были получены от клинически здоровых родителей; №2 (n=70) от кур с легким течением висцеральной формы мочекислого диатеза, на что указывали: слабовыраженное безболезненное утолщение суставов без изменения их функций, содержание мочевой кислоты в сыворотке через 6,5 часов после кормления - 0,48±0,011 мМ/л (норма 0,15-0,30 мМ/л). В группу №3 (n=70) были отобраны яйца от клинически здоровых кур, которые в течение 25 суток перед контрольной яйцекладкой получали рацион с повышенным перекисным числом (0,53% Йода). По 10 яиц из каждой группы были подвергнуты более детальному анализу, в частности в желтке определяли содержание малонового диальдегида с помощью тиобарбитуровой кислоты [SU № 1469460 A1, G01N 33/48, опубл. 30.03.1989 г. Бюл. №12], а в белке и желтке, после предварительного их гомогенезирования, оценивали концентрацию стабильных метаболитов окиси азота с использованием реактива Грисса [Методическое положение по изучению процессов свободнорадикального окисления и системы антиоксидантной защиты организма. - Воронеж, 2010 - 72 с.]. В таблице 1 приведены физико-химические показатели яиц, полученных от кур различных групп риска.
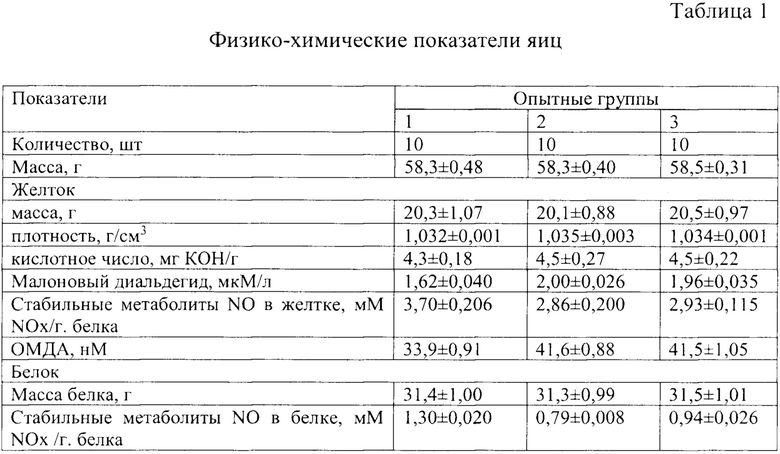
Примечание: ОМДА - общее содержание МДА в желтке, рассчитывается по формуле СМДА=МЖ * ПЖ * МДА, где ОМДА - общее содержание МДА в желтке (нМ), МЖ - масса желтка (г), ПЖ - плотность желтка (г/см3), МДА - содержание МДА в желтке (мкМ/л).
Срок хранения яиц до инкубации составлял от 3 до 10 суток. Перед закладкой в инкубатор яйца охлаждали в течение 5 часов до 19,0-20,5°С. Время выхода инкубатора на рабочий режим (20,0°С, относительная влажность 56,5-58,0%) составило 3,5 часа. Показатели выводимости и сохранности цыплят представлены в таблице 2. Сортировку и оценку развития цыплят проводили на смотровом столе, установленном в помещении, где поддерживалась температура 25,0-27,0°С и скорость движения воздуха не более 0,4 м/с. Живых с нормальным уровнем развития цыплят в течение первой недели жизни содержали в деревянных коробах в расчете 32 см2/гол, пол которых застилали бумагой. Они размещались в помещении, где температура воздуха поддерживалась в диапазоне 31,0-32,0°С, относительная влажность 68-72%, скорость движение воздуха 0,15 м/с, освещенность 45,0 лк, продолжительность светового дня 22,5 часа. Температура питьевой воды 30,0-31,0°С, кратность кормления - 6. Результаты приведены в таблице 2.

Полученные результаты показали, что инкубационное яйцо, соответствующее ОСТ 10321-2003, в котором общее содержание малонового диальдегида в желтке яйца менее 35,0 нМ, стабильных метаболитов окиси азота (NO2- + NO3- = NOx) в желтке более 3,0 мМ NOx/г. белка и в белке более 1,0 мМ NOx/г. белка, обеспечило выводимость на 9,2-15,9%, а сохранность цыплят в первую неделю жизни на 6,6-16,0% выше, чем яйцо, которое также соответствовало отраслевому стандарту, но содержало малонового диальдегида в желтке более 36,0 нМ, стабильных метаболитов окиси азота в желтке менее 3,0 мкМ NOx/г. белка, в белке менее 1,0 мкМ NOx/г. белка.
Изобретение является промышленно применимым, так как может быть использовано в птицеводстве, в частности для прогнозирования вывода и сохранности цыплят их яиц, полученных от кур различных групп риска.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОВЫШЕНИЯ ОПЛОДОТВОРЕННОСТИ ЯИЦ И ВЫВОДИМОСТИ ЦЫПЛЯТ | 2012 |
|
RU2523287C1 |
| СПОСОБ ПОВЫШЕНИЯ И СИНХРОНИЗАЦИИ ВЫВОДА ЦЫПЛЯТ ПОСРЕДСТВОМ ПРОФИЛАКТИКИ ОКСИДАТИВНОГО СТРЕССА У ЭМБРИОНОВ КУР | 2014 |
|
RU2567898C2 |
| СПОСОБ СТИМУЛЯЦИИ РОСТА И РАЗВИТИЯ ЭМБРИОНОВ ЯИЧНЫХ КУР ПУТЕМ ЙОДИРОВАННОГО ТРАНСОВАРИАЛЬНОГО ПИТАНИЯ | 2013 |
|
RU2573313C2 |
| Способ продления репродуктивного периода кур родительского стада | 2019 |
|
RU2729386C1 |
| СПОСОБ ПОВЫШЕНИЯ ИНКУБАЦИОННОГО КАЧЕСТВА ЯИЦ ПРИ ДЛИТЕЛЬНОМ ИХ ХРАНЕНИИ | 2016 |
|
RU2619255C1 |
| СПОСОБ НИВЕЛИРОВАНИЯ ГИПОКСИИ У ЭМБРИОНОВ КУР | 2020 |
|
RU2751848C1 |
| СПОСОБ ФИЗИОЛОГИЧЕСКОЙ АКСЕЛЕРАЦИИ ЭМБРИОНОВ КУР | 2011 |
|
RU2486751C1 |
| СПОСОБ ПОВЫШЕНИЯ ПРОДУКТИВНОСТИ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ПТИЦ | 2011 |
|
RU2501292C2 |
| СПОСОБ ПОДБОРА ЭМБРИОНОВ КУР ДЛЯ СВЕТОЛАЗЕРНОЙ ОБРАБОТКИ | 1998 |
|
RU2159541C2 |
| СПОСОБ РЕАНИМАЦИИ ЭМБРИОНОВ ПЕРЕПЕЛОВ И СТИМУЛЯЦИИ ИХ НЕСПЕЦИФИЧЕСКОЙ РЕЗИСТЕНТНОСТИ | 2020 |
|
RU2759674C1 |
Изобретение относится к ветеринарии и предназначено для оценки биологической полноценности инкубационного яйца, риска снижения выводимости и сохранности цыплят. Способ прогнозирования выводимости и сохранности цыплят включает отбор яиц методом случайной выборки от кур одной группы риска, определение содержания малонового диальдегида и стабильных метаболитов в желтке и белке и констатацию низкой полноценности яйца. При этом о наличии риска снижения выводимости и сохранности цыплят свидетельствует содержание малонового диальдегида в желтке не менее 36,0 нМ, стабильных метаболитов окиси азота в желтке менее 3,0 мМ NOx / грамм белка и содержание в белке менее 1,0 мМ NOx /грамм белка. Способ повышает информативность оценки качества инкубационного яйца, позволяет прогнозировать риски в период инкубации и первых дней жизни цыплят, что обеспечивает улучшение выводимости яиц и качества выведенного молодняка. 1 з.п. ф-лы, 1 пр., 2 табл.
1. Способ прогнозирования выводимости и сохранности цыплят, включающий отбор яиц методом случайной выборки от кур одной группы риска, определение содержания малонового диальдегида и стабильных метаболитов в желтке и белке и констатацию низкой полноценности яйца, наличие риска снижения выводимости и сохранности цыплят в случае содержания малонового диальдегида в желтке не менее 36,0 нМ, стабильных метаболитов окиси азота в желтке менее 3,0 мМ NOx/грамм белка и содержании в белке менее 1,0 мМ NOx/грамм белка.
2. Способ по п. 1, отличающийся тем, что расчет численности выборки, достаточной для достоверности результата, проводят по формуле
n=t2/K2,
где n - объем выборки в планируемом исследовании;
t - число сигм, соответствующее показателю вероятности, достаточной в планируемом исследовании;
K - допустимая неточность в данном эксперименте, выраженная в сигмах.
| Способ раннего прогнозирования яичной продуктивности кур | 2016 |
|
RU2617302C1 |
| СПОСОБ РАННЕЙ ОЦЕНКИ ЯИЧНЫХ КУР ПРИ СЕЛЕКЦИИ | 2012 |
|
RU2507739C1 |
| WO 2010101679 A1, 10.09.2010 | |||
| СПОСОБ ПОВЫШЕНИЯ ОПЛОДОТВОРЕННОСТИ ЯИЦ И ВЫВОДИМОСТИ ЦЫПЛЯТ | 2012 |
|
RU2523287C1 |
Авторы
Даты
2019-03-28—Публикация
2017-10-13—Подача