Область техники
Данное изобретение относится к области терапевтического применения лекарственных средств при медицинских состояниях, связанных с диабетом. Более конкретно, данное изобретение относится к новым ацилированным производным аналогов инсулина человека. Данное изобретение также относится к фармацевтическим композициям, содержащим такие дериватизованные аналоги инсулина, а также относится к применению таких производных для лечения или профилактики медицинских состояний, связанных с диабетом.
Уровень техники
Терапия инсулином для лечения сахарного диабета использовалась в течение десятилетий. Терапия инсулином, как правило, включает введение нескольких инъекций инсулина каждый день. Такая терапия, как правило, включает введение базальной инъекции длительного действия один раз или два раза в день, а также инъекции быстродействующего инсулина во время приема пищи (т.е. прандиальное применение). Одним из ключевых улучшений в инсулинотерапии явилось введение быстродействующих аналогов инсулина. Тем не менее, даже с быстродействующими аналогами инсулина пиковые уровни инсулина, как правило, имеют место не ранее 50-70 минут после инъекции.
Поэтому инъекции инсулина не копируют естественный профиль инсулина "время - действие". В частности, естественный всплеск высвобождения инсулина первой фазы у человека без диабета приводит к тому, что уровень инсулина в крови повышается в течение нескольких минут после поступления глюкозы в кровь из еды. Напротив, введенный инсулин поступает в кровь медленно, при этом пиковые уровни инсулина имеют место через 80-100 минут после инъекции обычного человеческого инсулина.
Поскольку быстродействующие аналоги инсулина не позволяют адекватно имитировать высвобождение инсулина первой фазы, пациенты с сахарным диабетом, использующие инсулиновую терапию, продолжают иметь неадекватный уровень инсулина, присутствующий в момент начала приема пищи, а между приемами пищи присутствует слишком много инсулина. Это отставание в доставке инсулина может привести к гипергликемии в ранние сроки после начала еды.
Инсулин обладает свойствами самоассоциации, и его концентрация представляет собой важный фактор самоассоциации. При высоких концентрациях, особенно в фармацевтических составах, инсулин будет самоассоциироваться в димер, гексамер, додекамер и кристалл. Тем не менее, физиологически активной формой инсулина является мономер, который связывается с рецептором инсулина и вызывает биологическую реакцию.
Быстрота действия инсулина зависит от того, как быстро инсулин абсорбируется из подкожной клетчатки. Когда обычный человеческий инсулин вводят подкожно, состав в основном состоит из гексамеров, содержащих два иона цинка. Благодаря своим размерам гексамерный инсулин имеет более низкую скорость диффузии и, следовательно, скорость абсорбции становится ниже, чем у молекул меньшего размера.
В гексамере находятся два атома цинка, которые стабилизируют молекулу в отношении химической и физической деградации. После инъекции в подкожной клетчатке развивается управляемое концентрацией динамическое равновесие, в результате чего гексамеры диссоциируют до димеров, а затем до мономеров. Исторически сложилось так, что этим составам обычного человеческого инсулина требуется примерно 120 минут, чтобы достичь максимального уровня концентрации в плазме. Препараты "цинк - инсулин", которые абсорбируются быстрее, чем обычный человеческий инсулин, были коммерциализированы, например, инсулин аспарт и инсулин лизпро.
Бесцинковые составы инсулина сделали бы более быстрой подкожную абсорбцию, но для инсулинов в целом химическая и физическая стабильность бесцинковых составов является проблемой.
Для различных применений были предложены различные производные инсулина.
WO 1998 042749 описывает кристаллы бесцинкового инсулина для введения в легкие.
US 6960561 описывает препараты инсулина без цинка и с низким уровнем цинка, обладающие улучшенной стабильностью.
WO 2007/096431 описывает некоторые производные человеческого инсулина, в том числе аналоги, помимо прочего, содержащие в позиции А22 ацилированный остаток лизина, содержащие в позиции В29 остаток аргинина, а также являющиеся производными desB30, которые растворимы при физиологических значениях рН и имеют продолжительный профиль действия и предназначены для применения в качестве инсулинов длительного действия.
WO 2009/022013 описывает некоторые ацилированные аналоги инсулина, в том числе аналоги, помимо прочего, содержащие в позиции А22 ацилированный остаток лизина, содержащие в позиции В29 остаток аргинина, а также являющиеся desB30, обладающие более высокими аффинностями связывания с инсулиновым рецептором и предназначенные для применения в качестве инсулинов длительного действия.
WO 2009/112583 описывает некоторые аналоги инсулина, в том числе аналоги, содержащие в позиции А22 остаток лизина, содержащие в позиции В29 остаток аргинина, а также являющиеся производными desB30, демонстрирующие улучшенную стабильность к протеазе.
WO 2011/161124 описывает некоторые ацилированные аналоги инсулина, содержащие дополнительные дисульфидные связи для улучшения стабильности, в том числе аналоги, помимо прочего, содержащие в позиции А22 остаток лизина, содержащие в позиции В29 остаток аргинина, а также являющиеся desB30.
WO 2012/171994 описывает определенное производное инсулина, содержащее два или более двух заместителей, в том числе аналоги, помимо прочего, содержащие в позиции А22 ацилированный остаток лизина, содержащие в позиции В29 аргинин, а также являющиеся производными desB30, для пролонгированной активности in vivo.
WO 2013 063572 описывает ультраконцентрированные составы инсулина быстрого действия, возможно, лишенные цинка.
Кроме того, ацилирование пептидов и белков альбуминсвязывающими группировками было использовано для пролонгирования действия пептидов и белков.
Тем не менее, о производных инсулина согласно данному изобретению не сообщалось, и их применение в качестве производных инсулина быстрого действия для прандиального применения никогда не было предложено.
Цели данного изобретения
Целью данного изобретения является создание аналогов инсулина, которые имеют прандиальный профиль после подкожного введения.
Другой целью данного изобретения является создание аналогов инсулина, которые химически стабильны в составе.
Третьей целью данного изобретения является создание аналогов инсулина, которые химически стабильны в составе без добавленного цинка.
Четвертой целью данного изобретения является создание аналогов инсулина, которые физически стабильны в составе.
Пятой целью данного изобретения является создание аналогов инсулина, которые физически стабильны в составе без добавленного цинка.
Шестой целью данного изобретения является создание аналогов инсулина, которые химически и физически стабильны в составе.
Седьмой целью данного изобретения является создание аналогов инсулина, которые химически и физически стабильны в составе без добавленного цинка.
Восьмой целью данного изобретения является создание аналогов инсулина, которые гепатопредпочтительны по сравнению с имеющимися в настоящее время на рынке прандиальными инсулинами после подкожного введения.
Девятой целью данного изобретения является создание аналогов инсулина, которые гепатоселективны по сравнению с имеющимися в настоящее время на рынке прандиальными инсулинами после подкожного введения.
Десятой целью данного изобретения является создание аналогов инсулина, которые менее склонны вызывать гипогликемию по сравнению с имеющимися в настоящее время на рынке прандиальными инсулинами после прандиального подкожного введения.
Одиннадцатой целью данного изобретения является создание аналогов инсулина, которые менее склонны вызывать увеличение веса по сравнению с имеющимися в настоящее время на рынке прандиальными инсулинами после прандиального подкожного введения.
Двенадцатой целью данного изобретения является создание аналогов инсулина, которые менее склонны вызывать гипогликемию и увеличение веса по сравнению с имеющимися в настоящее время на рынке прандиальными инсулинами после прандиального подкожного введения.
Другие цели данного изобретения относятся к комбинациям одной или более чем одной из указанных выше целей и, в частности, к предоставлению инсулина аналогов, которые демонстрируют прандиальный профиль после подкожного введения, при этом будучи химически стабильными в составах и, в частности, в составах без добавленного цинка.
Сущность изобретения
Мы обнаружили, что A22K-ацилированные производные инсулина согласно данному изобретению имеют значительно улучшенные свойства по сравнению с аналогичными производными инсулина предшествующего уровня техники. В частности, мы обнаружили, что производные инсулина согласно данному изобретению в составах, не содержащих добавленных ионов цинка, и по сравнению с аналогичными производными предшествующего уровня техники ассоциированы с меньшим размером молекулярных агрегатов. Более мелкие молекулы, как известно, диффундируют быстрее, чем более крупные молекулы, и, следовательно, можно ожидать более быстрой абсорбции. Размер этих молекулярных агрегатов можно измерить, например, как описано в данном документе, путем малоуглового рассеяния рентгеновских лучей (SAXS) и путем выполнения серии разведений с SEC-HPLC (эксклюзионной высокоэффективной жидкостной хроматографией), как описано в разделе "Примеры".
Мы также обнаружили, что производные инсулина согласно данному изобретению по сравнению с аналогичными производными инсулина предшествующего уровня техники в составах, не содержащих добавленных ионов цинка, быстрее абсорбируются после подкожного введения свиньям, демонстрируя тем самым потенциальную клиническую пользу в качестве инсулинов для прандиального применения. Мы обнаружили, что производные инсулина согласно данному изобретению по сравнению с аналогичными производными инсулина предшествующего уровня техники в составах, не содержащих добавленных ионов цинка, ассоциированы с меньшим "хвостохранилищем" после подкожного введения свиньям. Под "меньшим хвостохранилищем" подразумевается, что подкожное депо введенного инсулина абсорбируется быстрее, чем у подобных аналогов известного уровня техники, так что среднее времени удержания (от англ. mean residence time - MRT) после подкожного введения является более коротким для производных инсулина согласно данному изобретению по сравнению с аналогичными ацилированными производными предшествующего уровня техники.
Бесцинковые составы делают возможной более быструю подкожную абсорбцию, но для инсулинов в целом химическая и физическая стабильность бесцинковых составов является проблемой, и до сих пор такая возможность была показана только для инсулина глулизина (Apidra®; B3K, В29Е человеческий инсулин) и только в присутствии поверхностно-активных веществ при разливании в ампулы.
Теперь мы обнаружили, что подгруппа A22K-ацилированных производных инсулина согласно данному изобретению с заменами в позиции В3 неожиданно и беспрецедентно является химически и физически стабильной в составах без добавления ионов цинка и без добавления поверхностно-активных веществ.
Преимущество применения ацилированных производных инсулина в качестве прандиальной инсулинотерапии заключается в достижении более высоких концентраций инсулина в плазме по сравнению с концентрациями, достигнутыми при лечении неацилированными прандиальными инсулинами, такими как инсулин аспарт, инсулин лизпро или инсулин глулизин.
A22K-ацилированные производные инсулина согласно данному изобретению после подкожного введения имеют профиль "время - действие" прандиального типа.
Было показано, что A22K-ацилированные производные инсулина с альбуминсвязывающими группировками на основе тетрадекандиовой кислоты, пентадекандиовой кислоты или гексадекандиовой кислоты согласно данному изобретению имеют очень высокую аффинность связывания с инсулиновым рецептором, которая уменьшается в присутствии 1,5% человеческого сывороточного альбумина (HSA).
A22K-ацилированные производные инсулина согласно данному изобретению не имеют сниженной растворимости при физиологических концентрациях солей.
Соответственно, в своем первом аспекте данное изобретение относится к новым производным инсулина, которые являются ацилированными производными аналогов человеческого инсулина, где указанные аналоги представляют собой [A22K, desB27, B29R, desB30] относительно инсулина человека; и где указанные аналоги дериватизованы путем ацилирования эпсилон-аминогруппы остатка лизина в позиции А22 группой формулы II
[Ацил]-[Линкер]-,
где линкерная группа представляет собой аминокислотную цепь, состоящую из от 1 до 10 аминокислотных остатков, выбранных среди -gGlu- и -OEG-; где gGlu представляет собой остаток гамма-глутаминовой кислоты; OEG представляет собой остаток 8-амино-3,6-диоксаоктановой кислоты (т.е. группу формулы -NH-(CH2)2-O-(CH2)2-O-CH2-СО-); где указанные аминокислотные остатки могут присутствовать в любом порядке; и где указанная аминокислотная цепь содержит по меньшей мере один остаток gGlu; и
где ацил-группа представляет собой остаток α,ω-дикарбоновой кислоты, выбранной среди 1,14-тетрадекандновой кислоты; 1,15-пентадекандиовой кислоты; и 1,16-гексадекандиовой кислоты;
где указанный ацилированный аналог может дополнительно содержать замены А14Е и/или В3Е или B3Q.
В другом первом аспекте данное изобретение относится к фармацевтическим композициям, содержащим производное инсулина согласно данному изобретению и один или более чем один фармацевтически приемлемый эксципиент.
В другом своем аспекте данное изобретение относится к применению производного инсулина согласно данному изобретению в качестве лекарственного средства.
В еще одном аспекте данное изобретение относится к способам лечения, профилактики или облегчения заболеваний, нарушений или состояний, связанных с сахарным диабетом, сахарным диабетом 1 типа, сахарным диабетом 2 типа, нарушенной толерантностью к глюкозе, гипергликемией, дислипидемией, ожирением, метаболическим синдромом (метаболическим синдромом X, синдромом резистентности к инсулину), гипертонией, когнитивными расстройствами, атеросклерозом, инфарктом миокарда, инсультом, сердечно-сосудистыми заболеваниями, ишемической болезнью сердца, синдромом воспаленного кишечника, диспепсией или язвами желудка, где указанные способы включают введение субъекту, нуждающемуся в этом, терапевтически эффективного количества производного инсулина согласно данному изобретению.
Другие цели данного изобретения будут очевидны специалистам в данной области из следующего далее подробного описания и примеров.
Подробное описание изобретения
Производные инсулина
В своем первом аспекте данное изобретение относится к новым производным инсулина, которые являются ацилированными аналогами человеческого инсулина.
Производное инсулина согласно данному изобретению, в частности, можно охарактеризовать как ацилированный аналог человеческого инсулина, который представляет собой [A22K, desB27, B29R, desB30] по отношению к человеческому инсулину;
и который дериватизован путем ацилирования эпсилон-аминогруппы остатка лизина в позиции А22 группой формулы II
[Ацил]-[линкер],
где линкерная группа представляет собой аминокислотную цепь, состоящую из от 1 до 10 аминокислотных остатков, выбранных из -gGlu- и -OEG-; где gGlu представляет собой остаток гамма-глутаминовой кислоты; OEG представляет собой остаток 8-амино-3,6-диоксаоктановой кислоты (т.е. группу формулы -NH-(CH2)2-O-(CH2)2-O-CH2-СО-); где указанные аминокислотные остатки могут присутствовать в любом порядке; и где указанная аминокислотная цепь содержит по меньшей мере один остаток gGlu; и
где ацил-группа представляет собой остаток α,ω-дикарбоновой кислоты, выбранной среди 1,14-тетрадекандиовой кислоты; 1,15-пентадекандиовой кислоты; и 1,16-гексадекандиовой кислоты.
Производное инсулина согласно данному изобретению может дополнительно включать замены А14Е и/или В3Е или B3Q.
В одном воплощении аналог человеческого инсулина представляет собой [А14Е, A22K, В3Е, desB27, B29R, desB30]; [А14Е, A22K, desB27, B29R, desB30]; [A22K, В3Е, desB27, B29R, desB30]; [A22K, B3Q, desB27, B29R, desB30]; или [A22K, desB27, B29R, desB30] по отношению к человеческому инсулину; и указанный аналог инсулина ацилирован на эпсилон-аминогруппе остатка лизина в позиции А22.
В другом воплощении аналог человеческого инсулина представляет собой [A22K, desB27, B29R, desB30] по отношению к инсулину человека; и указанный аналог инсулина ацилирован на эпсилон-аминогруппе остатка лизина в позиции А22.
В третьем воплощении аналог человеческого инсулина представляет собой [A22K, В3Е, desB27, B29R, desB30] по отношению к инсулину человека; и указанный аналог инсулина ацилирован на эпсилон-аминогруппе остатка лизина в позиции А22.
В четвертом воплощении аналог человеческого инсулина представляет собой [A22K, B3Q, desB27, B29R, desB30] по отношению к инсулину человека; и указанный аналог инсулина ацилирован на эпсилон-аминогруппе остатка лизина в позиции А22.
В пятом воплощении аналог человеческого инсулина представляет собой [А14Е, A22K, desB27, B29R, desB30] по отношению к инсулину человека; и указанный аналог инсулина ацилирован на эпсилон-аминогруппе остатка лизина в позиции А22.
В шестом воплощении аналог человеческого инсулина представляет собой [А14Е, A22K, В3Е, desB27, B29R, desB30] по отношению к инсулину человека; и указанный аналог инсулина ацилирован на эпсилон-аминогруппе остатка лизина в позиции А22.
Как было описано выше, аналог инсулина дериватизован путем ацилирования эпсилон-аминогруппы остатка лизина в позиции А22 группой формулы II, описанной выше, т.е. заместителем, содержащим ацил-группу, связанную со связывающей группой.
В контексте данного изобретения связывающая группа в соответствии с формулой II представляет собой аминокислотную цепь, содержащую от 1 до 10 аминокислотных остатков, выбранных среди -gGlu- и -OEG-.
В одном воплощении связывающая группа в соответствии с формулой II представляет собой аминокислотную цепь, содержащую от 1 до 7 аминокислотных остатков, выбранных среди -gGlu- и -OEG, содержащую от 1 до 4 остатков -gGlu- и от 0 до 3 остатков -OEG-.
В другом воплощении изобретения связывающая группа в соответствии с формулой II выбрана среди -gGlu-; -2xgGlu-; -3xgGlu-; -4xgGlu-; -gGlu-2xOEG-; -gGlu-3x(OEG-gGlu)-; -4xgGlu-2xOEG-; -2xOEG-; и -2xOEG-gGlu-.
В третьем воплощении связывающая группа в соответствии с формулой II представляет собой -gGlu-.
В четвертом воплощении связывающая группа в соответствии с формулой II представляет собой -2xgGlu-.
В пятом воплощении связывающая группа в соответствии с формулой II представляет собой -3xgGlu-.
В шестом воплощении связывающая группа в соответствии с формулой II представляет собой -4xgGlu-.
В седьмом воплощении связывающая группа в соответствии с формулой II представляет собой -gGlu-2xOEG-.
В восьмом воплощении связывающая группа в соответствии с формулой II представляет собой -gGlu-3x (OEG-gGlu)-.
В девятом воплощении связывающая группа в соответствии с формулой II представляет собой -4xgGlu-2xOEG-.
В десятом воплощении связывающая группа в соответствии с формулой II представляет собой -2xOEG-.
В одиннадцатом воплощении связывающая группа в соответствии с формулой II представляет собой -2xOEG-gGlu-.
В контексте данного изобретения ацильная группа в соответствии с формулой II получена из 1,14-тетрадекандиовой кислоты; пентадекандиовой-1,15 кислоты; или 1,16-гексадекандиовой кислоты.
В одном воплощении ацильная группа в соответствии с формулой II получена из 1,14-тетрадекандиовой кислоты (т.е. 1,14-тетрадекандиоил).
В другом воплощении изобретения ацильная группа в соответствии с формулой II получена из 1,15-пентадекандиовой кислоты (т.е. 1,15-пентадекандиоил).
В третьем воплощении ацильная группа в соответствии с формулой II получена из 1,16-гексадекандиовой кислоты (т.е. 1,16-гексадекандиоил).
В еще одном воплощении группа формулы II, описанная выше, представляет собой тетрадекандиоил-gGlu-; тетрадекандиоил-2xgGlu-; тетрадекандиоил-3xgGlu-; тетрадекандиоил-4xgGlu-; тетрадекандиоил-gGlu-2xOEG-; тетрадекандиоил-4xgGlu-2xOEG-; тетрадекандиоил-2xOEG-; пентадекандиоил-4xgGlu; гексадекандиоил-4xgGlu-; гексадекандиоил-gGlu-2xOEG-; или гексадекандиоил-3х (gGlu-OEG)-gGlu-.
В другом воплощении группа формулы II представляет собой тетрадекандиоил-gGlu-.
В третьем воплощении группа формулы II представляет собой тетрадекандиоил-2xgGlu-.
В четвертом воплощении группа формулы II представляет собой тетрадекандиоил-3xgGlu-.
В пятом воплощении группа формулы II представляет собой тетрадекандиоил-4xgGlu-.
В шестом воплощении группа формулы II представляет собой тетрадекандиоил-gGlu-2xOEG-.
В седьмом воплощении группа формулы II представляет собой тетрадекандиоил-2xOEG-.
В восьмом воплощении группа формулы II представляет собой тетрадекандиоил-4xgGlu-2xOEG.
В девятом воплощении группа формулы II представляет собой пентадекандиоил-4xgGlu.
В десятом воплощении группа формулы II представляет собой гексадекандиоил-4xgGlu-.
В одиннадцатом воплощении группа формулы II представляет собой гексадекандиоил-gGlu-2xOEG-.
В двенадцатом воплощении группа формулы II представляет собой гексадекандиоил-3х(gGlu-OEG)-gGlu-.
Производное инсулина согласно данному изобретению, в частности, может быть выбрано из группы, включающей
A22K(N(eps)-тетрадекандиоил-4xgGlu), desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-4xgGlu), В3Е, desB27, B29R, desB30 человеческий инсулин;
А14Е, A22K(N(eps)-тетрадекандиоил-4xgGlu), desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-4xgGlu), В3Е, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-gGlu-2xOEG), В3Е, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-3х(gGlu-OEG)-gGlu), В3Е, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-4xgGlu), B3Q, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-gGlu-2xOEG), B3Q, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-3x(gGlu-OEG)-gGlu), B3Q, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-2xgGlu), desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-4xgGlu), desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-gGlu-2xOEG), desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-3x(gGlu-OEG)-gGlu), desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-gGlu), desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-gGlu-2xOEG), В3Е, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-gGlu-2xOEG), B3Q, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-2xOEG), desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-4xgGlu), B3Q, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-пентадекандиоил-4xgGlu), В3Е, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-4xgGlu-2xOEG), desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-4xgGlu-2xOEG), В3Е, desB27, B29R, desB30 человеческий инсулин;
А14Е, A22K(N(eps)-тетрадекандиоил-gGlu-2xOEG), В3Е, desB27, B29R, desB30 человеческий инсулин;
А14Е, A22K(N(eps)-тетрадекандиоил-4xgGlu), В3Е, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-2xgGlu), В3Е, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-gGlu), В3Е, desB27, B29R, desB30 человеческий инсулин; и
A22K(N(eps)-тетрадекандиоил-3xgGlu), В3Е, desB27, B29R, desB30 человеческий инсулин.
Предпочтительные признаки соединения согласно данному изобретению
Данное изобретение может быть дополнительно охарактеризовано со ссылкой на один или более чем один из следующих признаков:
1. Ацилированный аналог человеческого инсулина, который представляет собой [A22K, desB27, B29R, desB30]; и который, возможно, замещен А14Е и/или В3Е или B3Q; и который ацилирован на эпсилон-аминогруппе остатка лизина в позиции А22.
2. Ацилированный аналог человеческого инсулина согласно положению 1, который представляет собой [A22K, desB27, B29R, desB30] относительно человеческого инсулина; и который замещен В3Е или B3Q; и который ацилирован на эпсилон-аминогруппе остатка лизина в позиции А22.
3. Ацилированный аналог человеческого инсулина согласно положению 1, который представляет собой [A22K, В3Е, desB27, B29R, desB30] относительно человеческого инсулина; и который ацилирован на эпсилон-аминогруппе остатка лизина в позиции А22.
4. Ацилированный аналог человеческого инсулина согласно положению 1, который представляет собой [A22K, B3Q, desB27, B29R, desB30] относительно человеческого инсулина; и который ацилирован на эпсилон-аминогруппе остатка лизина в позиции А22.
5. Ацилированный аналог человеческого инсулина согласно положению 1, который представляет собой [А14Е, A22K, desB27, B29R, desB30] относительно человеческого инсулина; и который ацилирован на эпсилон-аминогруппе остатка лизина в позиции А22.
6. Ацилированный аналог человеческого инсулина согласно положению 1, который представляет собой [А14Е, A22K, desB27, B29R, desB30] относительно человеческого инсулина; и который замещен В3Е или B3Q; и который ацилирован на эпсилон-аминогруппе остатка лизина в позиции А22.
7. Ацилированный аналог человеческого инсулина согласно положению 1, который представляет собой [А14Е, A22K, В3Е, desB27, B29R, desB30] относительно человеческого инсулина; и который ацилирован на эпсилон-аминогруппе остатка лизина в позиции А22.
8. Ацилированный аналог человеческого инсулина согласно положению 1, который представляет собой [A22K, desB27, B29R, desB30] относительно человеческого инсулина; и который дериватизован путем ацилирования эпсилон-аминогруппы остатка лизина в позиции А22 группой формулы II
[Ацил]-[Линкер]-,
где линкерная группа представляет собой аминокислотную цепь, содержащую от 1 до 10 аминокислотных остатков, выбранных среди -gGlu- и -OEG-; где
gGlu представляет собой остаток гамма-глутаминовой кислоты; и
OEG представляет собой остаток 8-амино-3,6-диоксаоктановой кислоты (т.е. группу формулы -NH-(CH2)2-O-(CH2)2-O-CH2-CO-);
где указанные аминокислотные остатки могут находиться в любом порядке; и где указанная аминокислотная цепь содержит по меньшей мере один остаток gGlu;
где ацильная группа представляет собой остаток α,ω-дикарбоновой кислоты, выбранной среди
1,14-тетрадекандиовой кислоты;
1,15-пентадекандиовой кислоты; и
1,16-гексадекандиовой кислоты;
где указанный ацилированный аналог может дополнительно содержать замены А14Е и/или В3Е или B3Q.
9. Ацилированный аналог человеческого инсулина согласно положению 7, где ацильная группа представляет собой двукислотную группу, полученную из 1,14-тетрадекандиовой кислоты; 1,15-пентадекандиовой кислоты; или 1,16-гексадекандиовой кислоты.
10. Ацилированный аналог человеческого инсулина согласно положению 7, где ацильная группа представляет собой двукислотную группу, полученную из 1,14-тетрадекандиовой кислоты или 1,16-гексадекандиовой кислоты.
11. Ацилированный аналог человеческого инсулина согласно положению 7, где ацильная группа представляет собой двукислотную группу, полученную из 1,14-тетрадекандиовой кислоты.
12. Ацилированный аналог человеческого инсулина согласно положению 7, где ацильная группа представляет собой двукислотную группу, полученную из 1,16-гексадекандиовой кислоты.
13. Ацилированный аналог человеческого инсулина согласно положению 7, где ацильная группа представляет собой двукислотную группу, полученную из 1,15-пентадекандиовой кислоты.
14. Ацилированный аналог человеческого инсулина согласно положению 7, где связывающая группа содержит 1-10 остатков gGlu.
15. Ацилированный аналог человеческого инсулина согласно положению 7, где связывающая группа содержит 1-8 остатков gGlu.
16. Ацилированный аналог человеческого инсулина согласно положению 7, где связывающая группа содержит 1-6 остатков gGlu.
17. Ацилированный аналог человеческого инсулина согласно положению 7, где связывающая группа содержит 1-4 остатка gGlu.
18. Ацилированный аналог человеческого инсулина согласно положению 7, где связывающая группа содержит 1-3 остатка gGlu.
19. Ацилированный аналог человеческого инсулина согласно положению 7, где связывающая группа содержит 1-2 остатка gGlu.
20. Ацилированный аналог человеческого инсулина согласно положению 7, где связывающая группа содержит один остаток gGlu.
21. Ацилированный аналог человеческого инсулина согласно положению 7, где связывающая группа содержит два остатка gGlu.
22. Ацилированный аналог человеческого инсулина согласно положению 7, где связывающая группа содержит три остатка gGlu.
23. Ацилированный аналог человеческого инсулина согласно положению 7, где связывающая группа содержит четыре остатка gGlu.
24. Ацилированный аналог человеческого инсулина согласно положению 7, где связывающая группа содержит 1-6 остатков OEG.
25. Ацилированный аналог человеческого инсулина согласно положению 7, где связывающая группа содержит 1-4 остатка OEG.
26. Ацилированный аналог человеческого инсулина согласно положению 7, где связывающая группа содержит 1-3 остатка OEG.
27. Ацилированный аналог человеческого инсулина согласно положению 7, где связывающая группа содержит один остаток OEG.
28. Ацилированный аналог человеческого инсулина согласно положению 7, где связывающая группа содержит два остатка OEG.
29. Ацилированный аналог человеческого инсулина согласно положению 7, где связывающая группа содержит три остатка OEG.
30. Ацилированный аналог человеческого инсулина согласно положению 7, где связывающая группа не содержит остатков OEG.
31. Ацилированный аналог человеческого инсулина согласно положению 7, где связывающая группа выбрана среди -gGlu-; -2xgGlu-; -3xgGlu-; -gGlu-3x(OEG-Glu)-; -4xgGlu-; -2xOEG-; -4xgGlu-2xOEG-; -2xOEG-gGlu-; и -gGlu-2xOEG-.
32. Ацилированный аналог человеческого инсулина согласно положению 7, где связывающая группа выбрана среди -gGlu; -gGlu-3x(OEG-gGlu)-; и -gGlu-2xOEG-.
33. Ацилированный аналог человеческого инсулина согласно положению 7, где связывающая группа выбрана среди -gGlu-; -2xgGlu-; и -4xgGlu-.
34. Ацилированный аналог человеческого инсулина согласно положению 7, где группа формулы II [Ацил]-[Линкер]- представляет собой тетрадекандиоил-gGlu-; тетрадекандиоил-2xgGlu-; тетрадекандиоил-3xgGlu-; тетрадекандиоил-4xgGlu-; тетрадекандиоил-gGlu-2xOEG-; тетрадекандиоил-2xOEG-; тетрадекандиоил-4xgGlu-2xOEG-; гексадекандиоил-4xgGlu-; гексадекандиоил-gGlu-2xOEG-; или гексадекандиоил-3x(gGlu-OEG)-gGlu-.
35. Ацилированный аналог человеческого инсулина согласно положению 7, где группа формулы II [Ацил]-[Линкер]- представляет собой тетрадекандиоил-gGlu-; тетрадекандиоил-2xgGlu-; тетрадекандиоил-4xgGlu-; тетрадекандиоил-gGlu-2xOEG-; или тетрадекандиоил-2xOEG-; гексадекандиоил-4xgGlu-; гексадекандиоил-gGlu-2xOEG-; или гексадекандиоил-3х(gGlu-OEG)-gGlu-.
Определения
Номенклатура
В данном документе инсулины называют в соответствии со следующими принципами:
Термин "аналог" часто используется для белка или пептида инсулина, о котором идет речь, до того, как он подвергается дальнейшей химической модификации (дериватизации) и, в частности, ацилированию. Продукт, полученный путем такой химической модификации (дериватизации), как правило, называют "производным" или "ацилированным аналогом". Тем не менее, в контексте данной заявки термин "аналог" обозначает аналоги человеческого инсулина, а также (ацилированные) производные таких аналогов инсулина человека.
Названия приведены в виде аналогов, производных и модификаций (ацилирований) по отношению к инсулину человека. Для ацильной группировки (т.е. [ацил]-[линкер]-группы формулы II) в некоторых случаях присвоение названия осуществляется в соответствии с номенклатурой IUPAC, а в других случаях присвоение названия осуществляется в соответствии с пептидной номенклатурой.
В качестве примера, ацильная группировка со следующей структурой (Соед. 1):
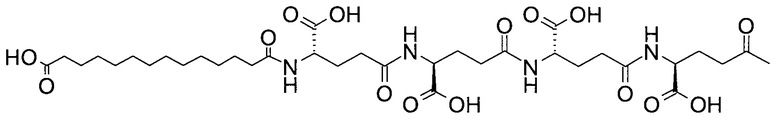
может быть названа "тетрадекандиоил-4xgGlu", "тетрадекандиоил-4хγGlu" или "1,14-тетрадекандиоил-4xgGlu" и т.п., где γGlu (и gGlu) является коротким написанием аминокислоты гамма-глутаминовой кислоты в L-конфигурации, а "4х" означает, что следующий далее остаток повторяется 4 раза.
Аналогично, ацильная группировка со следующей структурой (Соед. 2):

может быть названа, например, "гексадекандиоил-(gGlu-OEG)3-gGlu)", "гексадекандиоил-(gGlu-OEG)3-gGlu)", "гексадекандиоил-3х(gGlu-OEG)-gGlu)", "1,16-гексадекандиоил-(gGlu-OEG)3-gGlu)", "1,16-гексадекандиоил-(gGlu-OEG)3-gGlu)", "1,16-гексадекандиоил-3х(gGlu-OEG)-gGlu)", "гексадекандиоил-(γGlu-OEG)3-γGlu)", "гексадекандиоил-(γGlu-OEG)3-γGlu)" или "гексадекандиоил-3х(γGlu-OEG)-γGlu)";
где группировка со следующей структурой (Соед. 3):
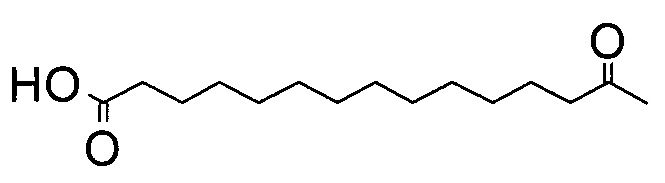
может быть названа, например, как тетрадекандиоил, 1,14-тетрадекандиоил или (короткое написание) С14-двухосновной кислотой. Аналогичное написание применимо для остатков с 15 и 16 атомами углерода, пентадекандиоил, С15-двухосновная кислота и гексадекандиоил, С16-двухосновная кислота, соответственно.
γGlu (и gGlu) является коротким написанием для аминокислоты гамма-глутаминовой кислоты в L-конфигурации.
OEG является коротким написанием для аминокислотного остатка 8-амино-3,6-диокса-октановой кислоты, NH2(СН2)2O(СН2)2ОСН2СО2Н.
"2х" и "3х" означает, что следующий далее остаток повторяется 2 и 3 раза, соответственно.
Например, производное инсулина из примера 1 называют "A22K(N(eps)-тетрадекандиоил-4xgGlu), desB27, B29R, desB30 человеческий инсулин", чтобы указать, что А-цепь, которая содержит 21 аминокислотный остаток человеческого инсулина, был удлинен на 1 аминокислоту (позиция А22) лизином (K), далее модифицирован путем ацилирования на эпсилон-азоте в остатке лизина А22, обозначаемом Nε (или N(eps)), группировкой тетрадекандиоил-4xgGlu, аминокислота в позиции В27, Т в человеческом инсулине, была удалена, аминокислота в позиции В29, K в человеческом инсулине, была замещена аргинином, аминокислота R в позиции В30, треонин, Т, в человеческом инсулине, была удалена. Звездочками в формулах ниже показано, что остаток, о котором идет речь, отличается (т.е. замещен) по сравнению с человеческим инсулином.
В данной заявке приводятся как формулы, так и названия предпочтительных инсулинов согласно данному изобретению.
Кроме того, инсулины согласно данному изобретению также называют в соответствии с номенклатурой IUPAC (OpenEye, стиль IUPAC). Согласно этой номенклатуре производному инсулина из примера 1 присваивается следующее название: N{альфа}([ArgB29],des-ThrB27,ThrB30-инсулин(человеческий)-(А)-пептидил)-N{эпсилон}[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-(13-карбокси-три-деканоил-амино)-бутаноил]-амино]-бутаноил]-амино]бутаноил]амино]бутаноил]Lys, (В)-пептид.
Следует отметить, что формулы можно записать с остатком лизина (который модифицирован путем ацилирования), при этом либо изобразить с расширенным остатком лизина (как показано, например, в примере 23), либо изобразить с сокращенным остатком лизина (как показано, например, в примере 1). Во всех случаях ацильная группа присоединена к эпсилон-азоту остатка лизина.
Для полноты картины можно упомянуть, что удаление остатка в позиции В27 (desB27) приводит к (формальному) перемещению остальных аминокислотных остатков по направлению к N-концу на один остаток. Следовательно, такой аналог может быть также назван В27Р, B28R, desB29-30, так как остаток в позиции В28 представляет собой пролин, а остаток в позиции В29 представляет собой аргинин (см., например, соединение из примера 1). Это объясняется тем, что при удалении В27 следующая аминокислота в последовательности сдвигается и, таким образом, аминокислота в позиции В28 (пролин) сдвигается в позицию В27.
Физическая стабильность
Термин "физическая стабильность" препарата инсулина, используемый в данном документе, относится к склонности белка формировать биологически неактивные и/или нерастворимые агрегаты белка в результате воздействия на белок термо-механической нагрузки и/или в результате взаимодействия с дестабилизирующими внутренними или внешними поверхностями, например гидрофобными внутренними и внешними поверхностями. Физическую стабильность водных белковых препаратов оценивают путем визуального осмотра и/или измерения мутности после экспонирования препарата в соответствующих контейнерах (например, в картриджах или флаконах) в условиях механической/физической нагрузки (например, встряхивания) при различных температурах в течение различных периодов времени. Визуальный осмотр препаратов выполняют в резком сфокусированном свете на темном фоне. Препарат классифицируют как физически нестабильный в связи с белковой агрегацией, если он демонстрирует визуальную мутность в дневном свете. Альтернативно, мутность препарата может быть оценена простыми способами измерения мутности, хорошо известными специалистам. Физическая стабильность водных белковых препаратов также может быть оценена с помощью спектроскопического агента или зонда конформационного состояния белка. Зондом предпочтительно является небольшая молекула, которая предпочтительно связывается с ненативным конформером белка. Одним из примеров низкомолекулярного спектроскопического зонда белковой структуры является тиофлавин Т. Тиофлавин Т представляет собой флуоресцентную метку, которая широко используется для обнаружения амилоидных фибрилл. В присутствии фибрилл и, возможно, также и других белковых конфигураций тиофлавин Т дает новый максимум возбуждения примерно при 450 нм и усиливает эмиссию примерно при 482 нм, когда связывается с белковыми фибриллами. Несвязанный тиофлавин Т по существу не флуоресцирует при этих длинах волн.
Химическая стабильность
Термин "химическая стабильность" белкового препарата, используемый в данном документе, относится к изменениям в ковалентной структуре белка, ведущим к формированию продуктов химической деградации с потенциальной потерей биологической активности и/или потенциальным увеличением иммуногенных свойств по сравнению с нативной структурой белка. В зависимости от типа и природы нативного белка и среды, в которой он находится, могут формироваться различные продукты химической деградации. Во время хранения и применения белкового препарата часто наблюдается увеличение количества продуктов химической деградации. Большинство белков подвержено дезамидированию, процессу, в котором амидная группа боковой цепи в остатках глутамина или аспарагина гидролизуется с формированием свободной карбоновой кислоты, либо остаток аспарагина формирует производное изоАsр. Другие пути деградации включают формирование высокомолекулярных продуктов, в которых две или более двух белковых молекул ковалентно связаны друг с другом путем трансамидирования и/или дисульфидного взаимодействия, что ведет к формированию ковалентно связанных димерных, олигомерных и полимерных продуктов деградации (Stability of Protein Pharmaceuticals, Ahern. T.J. & Manning M.C., Plenum Press, New York 1992). Окисление (например, остатков метионина) может быть упомянуто в качестве еще одного варианта химической деградации. Химическая стабильность белкового препарата может быть оценена путем измерения количества продуктов химической деградации в различные временные точки после воздействия различных условий окружающей среды (формирование продуктов деградации часто может быть ускорено, например, повышением температуры). Количество каждого отдельного продукта деградации часто определяют путем разделения продуктов деградации в зависимости от размера, гидрофобности и/или заряда молекулы с использованием различных хроматографических методик (например, SEC-HPLC и/или RP-HPLC). Поскольку HMWP-продукты являются потенциально иммуногенными и не являются биологически активными, выгодны низкие уровни HMWP.
Способы синтеза
Производные инсулина согласно данному изобретению могут быть получены с помощью обычных способов получения инсулина, аналогов инсулина и производных инсулина и, в частности, с помощью способов, описанных в примерах.
В одном воплощении производное инсулина согласно данному изобретению получают путем ацилирования эпсилон-аминогруппы остатка лизина в позиции А22 группой формулы II, которая представляет собой тетрадекандиоил-4xgGlu.
В другом воплощении производное инсулина согласно данному изобретению получают путем ацилирования эпсилон-аминогруппы остатка лизина в позиции А22 при высоких значениях рН и, в частности, при рН в диапазоне от 9,5 до 13, группой формулы II, которая представляет собой тетрадекандиоил-4xgGlu.
Более конкретно, производное инсулина согласно данному изобретению получают путем ацилирования эпсилон-аминогруппы остатка лизина в позиции А22 соединением (S)-2-((S)-4-карбокси-4-{(S)-4-карбокси-4-[(S)-4-карбокси-4-(13-карбокси-тридеканоиламино)-бутириламино]-бутирил-амино}-бутириламино)-пентадекадиовой кислоты 5-(2,5-диоксо-пирролидин-1-ил)эфиром (альтернативно обозначенным как тетрадекандиоил-4xgGlu-OSu) (Соед. 4).
В другом воплощении производное инсулина согласно данному изобретению получают путем ацилирования эпсилон-аминогруппы остатка лизина в позиции А22 соединением 14-[[(1S)-1-карбокси-4-[2-[2-[2-[2-[2-[2-(2,5-диоксопирролидин-1-ил)окси-2-оксоэтил]этокси]-этил-амино]-2-оксоэтил]этокси]этиламин]-4-оксобутил]амино]-14-оксотетра-декадиовой кислотой (альтернативно обозначенной как тетрадекандиоил-gGlu-2xOEG-OSu) (Соед. 5).
Предпочтительные признаки синтеза соединений согласно данному изобретению
Данное изобретение может быть дополнительно охарактеризовано со ссылкой на один или более чем один из следующих признаков:
1. Соединение (S)-2-((S)-4-карбокси-4-{(S)-4-карбокси-4-[(S)-4-карбокси-4-(13-карбокси-тридеканоиламино)-бутириламино]-бутириламино}-бутириламино)-пентандиовой кислоты 5-(2,5-диоксо-пирролидин-1-ил)эфир (альтернативно обозначенное как тетрадекандиоил-4xgGlu-OSu) (Соед. 4) для применения в процессе ацилирования в качестве промежуточного продукта в синтезе производного инсулина согласно изобретению.
2. Соединение 14-[[(1S)-1-карбокси-4-[2-[2-[2-[2-[2-[2-(2,5-диоксопирролидин-1-ил)окси-2-оксоэтокси]этокси]этиламино]-2-оксоэтокси]этокси]этиламино]-4-оксобутил]амино]-14-оксотетрадекановая кислота (альтернативно обозначенное как тетрадекандиоил-gGlu-2xOEG-OSu) (Соед. 5) для применения в процессе ацилирования в качестве промежуточного продукта в синтезе производного инсулина согласно изобретению.
3. Соединение согласно любому из положений 1-2 для применения в качестве промежуточного соединения в синтезе производного инсулина, где указанное производное инсулина представляет собой ацилированный аналог человеческого инсулина, который содержит мутацию A22K относительно человеческого инсулина, и в этой позиции соединение согласно любому из положений 1-2 ацилировано.
4. Соединение согласно любому из положений 1-2 для применения в качестве промежуточного соединения в синтезе производного инсулина, где указанное производное инсулина представляет собой ацилированный аналог человеческого инсулина, который представляет собой [A22K, desB27, B29R, desB30] относительно человеческого инсулина и который ацилирован в позиции A22K соединением согласно любому из положений 1-2.
5. Соединение согласно любому из положений 1-2 для применения в качестве промежуточного соединения в синтезе производного инсулина, где указанное производное инсулина представляет собой ацилированный аналог человеческого инсулина, который представляет собой [A22K, desB27, B29R, desB30] относительно человеческого инсулина, который может дополнительно содержать замены А14Е, и/или В3Е или B3Q и который ацилирован в позиции A22K соединением согласно любому из положений 1-2.
6. Соединение согласно положению 1 для применения в качестве промежуточного соединения в синтезе
A22K(N(eps)-тетрадекандиоил-4xgGlu), desB27, B29R, desB30 человеческого инсулина;
A22K(N(eps)-тетрадекандиоил-4xgGlu), В3Е, desB27, B29R, desB30 человеческого инсулина;
А14Е, A22K(N(eps)-тетрадекандиоил-4xgGlu), desB27, B29R, desB30 человеческого инсулина;
A22K(N(eps)-тетрадекандиоил-4xgGlu), B3Q, desB27, B29R, desB30 человеческого инсулина;
A22K(N(eps)-тетрадекандиоил-4xgGlu-2xOEG), desB27, B29R, desB30 человеческого инсулина;
A22K(N(eps)-тетрадекандиоил-4xgGlu-2xOEG), В3Е, desB27, B29R, desB30 человеческого инсулина; или
А14Е, A22K(N(eps)-тетрадекандиоил-4xgGlu), В3Е, desB27, B29R, desB30 человеческого инсулина.
Биологическая активность
В другом аспекте данное изобретение относится к новым производным инсулина для применения в качестве лекарственных средств или для применения в производстве лекарственных средств или фармацевтических композиций.
Было обнаружено, что производные инсулина согласно данному изобретению являются короткими и быстродействующими производными инсулина, которые, как считается, хорошо подходят для прандиального применения.
Все производные инсулина согласно данному изобретению обладают аффинностью к рецептору инсулина, адекватной для активации рецептора инсулина, чтобы получить необходимую гликемическую реакцию, т.е. они могут снижать уровень глюкозы в крови у животных и людей.
Было обнаружено, что производные инсулина согласно данному изобретению имеют сбалансированное соотношение аффинности к инсулиновому рецептору (IR) и аффинности к рецептору инсулиноподобного фактора роста 1 (IGF-1R) (IR/IGF-1R).
В одном из аспектов A22K-ацилированный инсулин согласно данному изобретению имеет соотношение IR/IGF-1R выше 0,3; выше 0,4; выше 0,5; выше 0,6; выше 0,7; выше 0,8; выше 0,9; выше 1; выше 1,5; или выше 2.
В другом аспекте A22K-ацилированный аналог инсулина представляет собой соединение согласно данному изобретению, в котором ацильная группа формулы II получена из 1,14-тетрадекандиовой кислоты, где указанный ацилированный аналог инсулина имеет среднее время удержания (MRT) менее 250 мин; менее 200 минут; менее 175 минут; менее 150 минут; менее 125 минут после подкожного введения свиньям (примерно) 600 мкМ состава ацилированного аналога инсулина согласно изобретению, содержащего 1,6% (вес/объем, примерно) глицерина и 30 мМ фенол/м-крезол, рН 7,4.
В другом воплощении A22K-ацилированный аналог инсулина представляет собой соединение согласно изобретению, в котором ацильная группа формулы II получена из 1,16-гексадекандиовой кислоты, где указанный ацилированный аналог инсулина имеет среднее время удержания (MRT) менее 700 мин; менее 600 минут; менее 500 минут; менее 400 минут; менее 300 минут после подкожного введения свиньям (примерно) 600 мкМ состава ацилированного аналога инсулина согласно изобретению, содержащего 1,6% (вес/объем, примерно) глицерина и 30 мМ фенол/м-крезол, рН 7,4.
В другом аспекте данное изобретение относится к медицинскому применению ацилированного аналога инсулина согласно изобретению и, в частности, к применению таких производных инсулина для лечения, профилактики или облегчения заболеваний, нарушений или состояний, связанных с сахарным диабетом, сахарным диабетом 1 типа, сахарным диабетом 2 типа, нарушенной толерантностью к глюкозе, гипергликемией, дислипидемией, ожирением, метаболическим синдромом (метаболическим синдромом X, синдромом резистентности к инсулину), гипертонией, когнитивными расстройствами, атеросклерозом, инфарктом миокарда, инсультом, сердечно-сосудистыми заболеваниями, ишемической болезнью сердца, синдромом воспаленного кишечника, диспепсией или язвами желудка, где указанный способ включает введение субъекту, нуждающемуся в этом, терапевтически эффективного количества производного инсулина согласно данному изобретению.
В другом воплощении данное изобретение относится к применению таких производных инсулина для лечения, профилактики или облегчения заболеваний, нарушений или состояний, связанных с сахарным диабетом, сахарным диабетом 1 типа, сахарным диабетом 2 типа или нарушенной толерантностью к глюкозе, где указанный способ включает введение субъекту, нуждающемуся в этом, терапевтически эффективного количества производного инсулина согласно данному изобретению.
В третьем воплощении данное изобретение относится к применению таких производных инсулина для лечения, профилактики или облегчения заболеваний, нарушений или состояний, связанных с сахарным диабетом и, в частности, с сахарным диабетом 1 типа или сахарным диабетом 2 типа.
Фармацевтические композиции
Данное изобретение относится к ацилированных аналогам инсулина, которые можно использовать в качестве лекарственных средств.
Таким образом, в другом аспекте данное изобретение относится к новым фармацевтическим композициям, содержащим терапевтически эффективное количество производного инсулина согласно данному изобретению.
Фармацевтическая композиция согласно данному изобретению, возможно, содержит один или более чем один из фармацевтически приемлемых носителей и/или разбавителей.
Фармацевтическая композиция согласно данному изобретению может также содержать другие эксципиенты, обычно используемые в фармацевтических композициях, например, консерванты, хелатирующие агенты, модифицирующие тоничность агенты, усилители абсорбции, стабилизаторы, антиоксиданты, полимеры, поверхностно-активные вещества, ионы металлов, маслянистые носители и белки (например, человеческий сывороточный альбумин, желатин или белки).
В одном воплощении данного изобретения фармацевтическая композиция согласно данному изобретению является водным препаратом, т.е. препаратом, содержащим воду. Такой препарат, как правило, является раствором или суспензией. В другом воплощении данного изобретения фармацевтическая композиция является водным раствором.
Термин "водный препарат" определяется как препарат, содержащий по меньшей мере 50% w/w (по массе) воды. Кроме того, термин "водный раствор" определяется как раствор, содержащий по меньшей мере 50% w/w воды, а термин "водная суспензия" определяется как суспензия, содержащая по меньшей мере 50% w/w воды. Водные суспензии могут содержать активные соединения в смеси с эксципиентами, подходящими для изготовления водных суспензий.
В одном воплощении данного изобретения инсулиновый препарат содержит водный раствор производного инсулина согласно данному изобретению, в котором указанное соединение инсулина присутствует в концентрации от примерно 0,1 мМ до примерно 20,0 мМ; более конкретно от примерно 0,2 мМ до примерно 4,0 мМ; от примерно 0,3 мМ до примерно 2,5 мМ; от примерно 0,5 мМ до примерно 2,5 мМ; от примерно 0,6 мМ до примерно 2,0 мМ; или от примерно 0,6 мМ до примерно 1,2 мМ.
В другом воплощении данного изобретения инсулиновый препарат содержит водный раствор производного инсулина согласно данному изобретению, в котором указанное соединение инсулина присутствует в концентрации примерно 0,1 мМ, примерно 0,3 мМ, примерно 0,4 мМ, примерно 0,6 мМ, примерно 0,9 мМ, примерно 1,2 мМ, примерно 1,5 мМ или примерно 1,8 мМ.
Фармацевтическая композиция согласно данному изобретению может также содержать буферную систему. Буфер может быть выбран из группы, включающей, но не ограничиваясь ими, ацетат натрия, карбонат натрия, дигидрофосфат натрия, гидрофосфат динатрия, фосфат натрия и трис(гидроксиметил)-аминометан, бицин, трицин, яблочную кислоту, глицилглицин, этилендиамин, янтарную кислоту, малеиновую кислоту, фумаровую кислоту, винную кислоту, аспарагиновую кислоту или их смеси. Каждый из этих конкретных буферов составляет альтернативное воплощение данного изобретения.
В одном воплощении указанный буфер представляет собой фосфатный буфер. В еще одном воплощении концентрация указанного фосфатного буфера находится в диапазоне от примерно 0,1 мМ до 20 мМ. В еще одном воплощении концентрация указанного фосфатного буфера находится в диапазоне от 0,1 мМ до примерно 10 мМ, или от примерно 0,1 мМ до примерно 8 мМ, от примерно 1 мМ до примерно 8 мМ, или от примерно 2 мМ до примерно 8 мМ, или от 6 до 8 мМ.
Значение рН инъекционной фармацевтической композиции согласно данному изобретению находится в диапазоне от 3 до 8,5. Предпочтительно, чтобы инъекционная фармацевтическая композиция согласно данному изобретению имела рН в диапазоне от примерно 6,8 до примерно 7,8.
В одном воплощении значение рН находится в диапазоне от примерно 7,0 до примерно 7,8, или от 7,2 до 7,6.
Препараты инсулина согласно данному изобретению также могут включать агент, модифицирующий тоничность. Агент, модифицирующий тоничность, может быть выбран из группы, состоящей из солей (например, хлорид натрия), Сахаров или сахарных спиртов, аминокислот (например, L-глицина, L-гистидина, аргинина, лизина, изолейцина, аспарагиновой кислоты, триптофана, треонина), алдитола (например, глицерола (глицерина), 1,2-пропандиола (пропиленгликоля), 1,3-пропандиола, 1,3-бутандиола), полиэтиленгликоля (например ПЭГ 400) или их смесей. Могут быть использованы любые сахара, такие как моно-, ди- или полисахариды, или водорастворимые гликаны, включая, например, фруктозу, глюкозу, маннозу, сорбозу, ксилозу, мальтозу, лактозу, сахарозу, трегалозу, декстран, пуллулан, декстрин, циклодекстрин, растворимый крахмал, гидроксиэтилкрахмал и натрий-карбоксиметилцеллюлозу. В одном воплощении сахарной добавкой является сахароза. Сахарные спирты включают, например, маннит, сорбит, инозит, галактитол, дульцитол, ксилитол и арабитол. В одном воплощении сахароспиртовой добавкой является маннит. Сахара или сахарные спирты, упомянутые выше, могут быть использованы по отдельности или в комбинации. Каждый из этих конкретных агентов, модифицирующих тоничность, или их смесей представляет собой альтернативное воплощение данного изобретения.
В одном воплощении данного изобретения глицерин и/или маннит и/или хлорид натрия может присутствовать в количестве, соответствующем концентрации от 0 до 250 мМ, от 0 до 200 мМ или от 0 до 100 мМ.
Препараты инсулина согласно данному изобретению могут дополнительно включать фармацевтически приемлемый консервант. Консервант может присутствовать в количестве, достаточном для получения консервирующего действия. Количество консерванта в фармацевтической композиции согласно данному изобретению может быть определено, например, из литературы в данной области и/или по известному количеству консерванта, например, в коммерческих продуктах. Каждый из этих конкретных консервантов или их смесей представляет собой альтернативное воплощение данного изобретения. Применение консерванта в фармацевтических препаратах описано, например, в Remington: The Science and Practice of Pharmacy, 19th edition, 1995.
В одном воплощении инъекционная фармацевтическая композиция содержит по меньшей мере одно фенольное соединение в качестве консерванта.
В другом воплощении фенольное соединение для применения в соответствии с данным изобретением может присутствовать в количестве до примерно 6 мг/мл конечной инъекционной фармацевтической композиции, в частности, до примерно 4 мг/мл конечной инъекционной фармацевтической композиции.
В другом воплощении фенольное соединение для применения в соответствии с данным изобретением может присутствовать в количестве до применения 4,0 мг/мл конечной инъекционной фармацевтической композиции; в частности, от примерно 0,5 мг/мл до примерно 4,0 мг/мл; или от примерно 0,6 мг/мл до примерно 4,0 мг/мл.
В другом воплощении изобретения консервант представляет собой фенол.
В другом воплощении инъекционная фармацевтическая композиция содержит смесь фенола и м-крезола в качестве консерванта.
В другом воплощении инъекционная фармацевтическая композиция содержит примерно 16 мМ фенол (1,5 мг/мл) и примерно 16 мМ м-крезол (1,72 мг/мл).
Фармацевтическая композиция согласно данному изобретению может также содержать хелатирующий агент. Применение хелатирующего агента в фармацевтических препаратах хорошо известно специалистам в данной области. Для удобства дана ссылка на Remington: The Science and Practice of Pharmacy, 19th edition, 1995.
Фармацевтическая композиция согласно данному изобретению может также содержать усилитесь абсорбции. Группа усилителей абсорбции может включать, но не ограничиваясь ими, никотиновые соединения. Термин "никотиновое соединение" включает никотинамид, никотиновую кислоту, ниацин, ниацинамид и витамин В3 и/или их соли и/или любую их комбинацию.
В одном воплощении никотиновое соединение представляет собой никотинамид и/или никотиновую кислоту и/или ее соль. В другом воплощении никотиновое соединение представляет собой никотинамид. Никотиновое соединение для применения в соответствии с данным изобретением может, в частности, представлять собой N-метилникотинамид, N,N-диэтилникотинамид, N-этилникотинамид, N,N-диметилникотинамид, N-пропилникотинамид или N-бутилникотинамид.
В другом воплощении никотиновое соединение присутствует в количестве от примерно 5 мМ до примерно 200 мМ; в частности, в количестве от примерно 20 мМ до примерно 200 мМ; в количестве от примерно 100 мМ до примерно 170 мМ; или в количестве от примерно 130 мМ до примерно 170 мМ, например, примерно 130 мМ, примерно 140 мМ, примерно 150 мМ, примерно 160 мМ или примерно 170 мМ.
Фармацевтическая композиция согласно данному изобретению может дополнительно содержать стабилизатор. Термин "стабилизатор", используемый в данном документе, относится к химическим веществам, добавленным в фармацевтические препараты, содержащие полипептиды, с целью стабилизации пептида, т.е. чтобы увеличить срок годности при хранении и/или время использования таких препаратов. Для удобства дана ссылка на Remington: The Science and Practice of Pharmacy, 19th edition, 1995.
Фармацевтическая композиция согласно данному изобретению может дополнительно содержать некоторое количество аминокислотного основания, достаточное для уменьшения формирования агрегатов полипептидом или белком при хранении композиции. Термин "аминокислотное основание" относится к аминокислоте или комбинации аминокислот, где любая аминокислота присутствует либо в форме свободного основания, либо в форме его соли. Аминокислоты, в частности, могут представлять собой аргинин, лизин, аспарагиновую кислоту, глутаминовую кислоту, аминогуанидин, орнитин или N-моноэтил-L-аргинин, этионин или бутионин, или S-метил-L-цистеин. В одном воплощении данного изобретения аминокислотное основание может присутствовать в количестве, соответствующем концентрации от 1 до 100 мМ; от 1 до 50 мМ; или от 1 до 30 мМ.
В одном воплощении фармацевтическая композиция согласно данному изобретению может дополнительно включать поверхностно-активное вещество. Термин "поверхностно-активное вещество", используемый в данном описании, относится к любой молекуле или иону, состоящему из водорастворимой (гидрофильной) части, головки, и жирорастворимого (липофильного) сегмента. Поверхностно-активные вещества предпочтительно накапливаются на границах раздела, при этом гидрофильная часть ориентирована по направлению к воде (гидрофильной фазе), а липофильная часть ориентирована по направлению к масляной или гидрофобной фазе (т.е. стеклу, воздуху, маслу и т.д.). Концентрация, при которой поверхностно-активные вещества начинают образовывать мицеллы, называется критической концентрацией мицелл, или CMC (critical micelle concentration). Кроме того, поверхностно-активные вещества снижают поверхностное натяжение жидкости. Поверхностно-активные вещества также известны как амфипатические соединения. Применение поверхностно-активного вещества в фармацевтических препаратах хорошо известно специалистам в данной области. Для удобства дана ссылка на Remington: The Science and Practice of Pharmacy, 19th edition, 1995.
Данное изобретение также относится к способу получения таких препаратов инсулина. Препараты инсулина согласно данному изобретению могут быть получены с использованием любого из множества известных способов. Например, препараты могут быть получены путем смешивания водного раствора эксципиентов с водным раствором производного инсулина, после чего рН доводят до требуемого уровня, и смесь доводят до конечного объема водой с последующей стерилизацией путем фильтрации.
Бесцинковые фармацевтические композиции
Препараты инсулина традиционно содержат цинк, добавленный, например, в виде хлорида или ацетата для получения приемлемой стабильности фармацевтического препарата. Тем не менее, неожиданно было обнаружено, что некоторые производные инсулина согласно данному изобретению, сохраняя при этом достаточную химическую и физическую стабильность, могут быть приготовлены в виде фармацевтических композиций без добавления цинка, тем самым давая возможность более быстрого начала действия, чем сопоставимые аналоги инсулина, которые нуждаются в добавлении ионов Zn2+ для поддержания достаточной химической и физической стабильности. Бесцинковые составы быстрее всасываются из подкожной клетчатки и, таким образом, могут быть использованы для прандиального применения.
В связи с этим нужно отметить, что бесцинковые фармацевтические композиции инсулина действительно трудно получить, так как следы цинка в большей или меньшей степени могут присутствовать в эксципиентах, стандартно используемых для производства фармацевтических композиций, а также, в частности, в резиновых материалах, используемых в медицинских контейнерах.
Таким образом, в одном из аспектов данное изобретение относится к фармацевтическим композициям, содержащим производное инсулина согласно данному изобретению, приготовленное в виде состава с низким содержанием цинка, т.е. без отдельного добавления цинка к препарату. Такие фармацевтические композиции, как правило, называют "бесцинковыми композициями", хотя они на самом деле могут рассматриваться как "композиции с низким содержанием цинка".
Тем не менее, могут быть получены бесцинковые эксципиенты, которые фактически позволяют получать бесцинковые фармацевтические композиции производных инсулина согласно данному изобретению. Таким образом, в другом аспекте данное изобретение относится к бесцинковым фармацевтическим композициям, содержащим производное инсулина согласно данному изобретению и один или более чем один фармацевтически приемлемый носитель или разбавитель, совсем лишенный цинка.
Кроме того, мы обнаружили, что подгруппа A22K-ацилированных производных инсулина согласно данному изобретению, содержащих замену в позиции ВЗ, повышает как химическую, так и физическую стабильность фармацевтических композиций, приготовленных без добавления ионов цинка и без каких-либо добавленных поверхностно-активных веществ. Таким образом, в дополнительном аспекте данное изобретение относится к фармацевтической композиции с низким содержанием цинка или без цинка, как описано выше, содержащей производное инсулина согласно данному изобретению с дополнительной заменой в позиции В3 (т.е. В3Е или B3Q) и один или более чем один из фармацевтически приемлемых носителей или разбавителей, где в фармацевтическую композицию, тем не менее, не было добавлено поверхностно-активное вещество.
В одном воплощении данное изобретение относится к фармацевтической композиции, приготовленной в форме композиции с низким содержанием цинка, без добавления ионов цинка, содержащей производное инсулина, а также один или более чем один из фармацевтически приемлемых носителей или разбавителей, где производное инсулина представляет собой ацилированный аналог человеческого инсулина, где аналог представляет собой
[A22K, В3Е или B3Q, desB27, B29R, desB30] относительно человеческого инсулина;
и где аналог инсулина дериватизован путем ацилирования эпсилон-аминогруппы остатка лизина в позиции А22 группой формулы II
[Ацил]-[Линкер],
где линкерная группа представляет собой аминокислотную цепь, содержащую от 1 до 10 аминокислотных остатков, выбранных среди -gGlu- и -OEG-; где
gGlu представляет собой остаток гамма-глутаминовой кислоты;
OEG представляет собой остаток 8-амино-3,6-диоксаоктановой кислоты (т.е. группу формулы -NH-(CH2)2-O-(CH2)2-O-CH2-CO-);
где указанные аминокислотные остатки могут присутствовать в любом порядке; и
где указанная аминокислотная цепь содержит по меньшей мере один остаток gGlu; и
где ацильная группа представляет собой остаток α,ω-дикарбоновой кислоты, выбранной среди
1,14-тетрадекандиовой кислоты;
1,15-пентадекандиовой кислоты; и
1,16-гексадекандиовой кислоты;
где указанный ацилированный аналог может дополнительно содержать замену А14Е.
В другом воплощении дополнительная замена в позиции В3 представляет собой В3Е.
В третьем воплощении дополнительная замена в позиции В3 представляет собой B3Q.
В четвертом воплощении данное изобретение относится к фармацевтической композиции, приготовленной в форме композиции с низким содержанием цинка, без добавления ионов цинка, содержащей ацилированный аналог инсулина человека, выбранный среди следующих:
A22K(N(eps)-тетрадекандиоил-4xgGlu), В3Е, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-4xgGlu), В3Е, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-gGlu-2xOEG), В3Е, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-3х(gGlu-OEG)-gGlu), В3Е, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-gGlu-2xOEG), В3Е, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-пентадекандиоил-4xgGlu), В3Е, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-4xgGlu), B3Q, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-gGlu-2xOEG), B3Q, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-3х(gGlu-OEG)-gGlu), B3Q, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-gGlu-2xOEG), B3Q, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-4xgGlu), B3Q, desB27, B29R, desB30 человеческий инсулин;
A14E, A22K(N(eps)-тетрадекандиоил-4xgGlu), В3Е, desB27, B29R, desB30 человеческий инсулин;
А14Е, A22K(N(eps)-тетрадекандиоил-gGlu-2xOEG), В3Е, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-2xgGlu), В3Е, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-3xgGlu), В3Е, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-4xgGlu-2xOEG), В3Е, desB27, B29R, desB30 человеческий инсулин; и
A22K(N(eps)-тетрадекандиоил-gGlu), В3Е, desB27, B29R, desB30 человеческий инсулин.
В еще одном воплощении данное изобретение относится к фармацевтической композиции с низким содержанием цинка, описанной выше, где ионы цинка могут присутствовать в количестве, соответствующем концентрации менее 0,2 ионов Zn2+ на 6 молекул инсулина; менее 0,15 ионов Zn2+ + на 6 молекул инсулина; менее 0,12 ионов Zn2+ на 6 молекул инсулина; менее 0,1 ионов Zn2+ на 6 молекул инсулина; менее 0,09 ионов Zn2+ на 6 молекул инсулина; менее 0,08 ионов Zn2+ на 6 молекул инсулина; менее 0,07 ионов Zn2+ на 6 молекул инсулина; менее 0,06 ионов Zn2+ на 6 молекул инсулина; менее 0,05 ионов Zn2+ на 6 молекул инсулина; менее 0,04 ионов Zn2+ на 6 молекул инсулина; менее 0,03 ионов Zn2+ на 6 молекул инсулина; менее 0,02 ионов Zn2+ на 6 молекул инсулина; или менее 0,01 ионов Zn2+ на 6 молекул инсулина.
В еще одном воплощении данное изобретение относится к фармацевтической композиции с низким содержанием цинка или не содержащей цинк, как описано выше, приготовленной в форме инъекционной композиции. Фармацевтическая композиция согласно данному изобретению может быть получена с использованием традиционных способов, известных в данной области. Например, компоненты могут быть смешаны вместе в виде водных растворов, после чего рН доводят до нужного уровня, и смесь доводят до конечного объема водой с последующей стерилизацией путем фильтрации.
Парентеральное введение может быть осуществлено путем подкожной, внутримышечной, внутрибрюшинной или внутривенной инъекции с помощью шприца, возможно, с помощью шприца-ручки. Альтернативно, парентеральное введение может быть осуществлено с помощью инфузионного насоса. В качестве еще одного варианта препараты инсулина, содержащие инсулиновое соединение согласно данному изобретению, также могут быть адаптированы для чрескожного введения, например путем безигольчатой инъекции или с помощью микроигольчатого пластыря, возможно, с помощью ионтофоретического пластыря или путем чресслизистого, например трансбуккального, введения.
Препараты инсулина в соответствии с данным изобретением могут быть введены пациенту, нуждающемуся в таком лечении, через несколько участков, например через участки кожи и слизистой оболочки, через участки, которые обходят абсорбцию, например, могут быть введены в артерию, в вену, в сердце, и через участки, которые связаны с абсорбцией, например, могут быть введены в кожу, под кожу, в мышцу или в брюшную полость.
В одном воплощении инсулиновые препараты согласно данному изобретению хорошо подходят для применения в устройствах типа шприца-ручки, используемых для инсулиновой терапии в виде инъекций.
Фармацевтическая композиция согласно данному изобретению может быть использована в лечении сахарного диабета путем парентерального введения.
В другом воплощении препараты инсулина согласно данному изобретению также могут быть приготовлены для использования в различных медицинских устройствах, которые обычно используются для введения инсулина, включая непрерывную подкожную инфузионную терапию инсулином путем использования насосов, и/или для применения в базисной терапии инсулином.
Рекомендуется, чтобы дозировка инсулиновых препаратов согласно данному изобретению, которая должна быть введена пациенту, была выбрана врачом. В настоящее время предполагается, что производное инсулина согласно данному изобретению должно присутствовать в конечной фармацевтической композиции в количестве от примерно 0,1 мМ до примерно 20,0 мМ; более конкретно от примерно 0,2 мМ до примерно 4,0 мМ; от примерно 0,3 мМ до примерно 2,5 мМ; от примерно 0,5 мМ до примерно 2,5 мМ; от примерно 0,6 мМ до примерно 2,0 мМ; или от примерно 0,6 мМ до примерно 1,2 мМ.
Предпочтительные признаки фармацевтической композиции согласно данному изобретению
Данное изобретение может быть дополнительно охарактеризовано относительно одного или более чем одного из следующих признаков:
1. Фармацевтическая композиция, содержащая ацилированный аналог человеческого инсулина согласно изобретению и один или более чем один из фармацевтически приемлемых эксципиентов.
2. Фармацевтическая композиция согласно положению 1, приготовленная в виде композиции с низким содержанием цинка, без добавления ионов цинка.
3. Фармацевтическая композиция согласно положению 1, приготовленная в виде композиции с низким содержанием цинка, без добавления ионов цинка, содержащая ацилированный аналог человеческого инсулина, содержащий замену в позиции В3.
4. Фармацевтическая композиция согласно положению 1, приготовленная в виде композиции с низким содержанием цинка, без добавления ионов цинка, содержащая ацилированный аналог человеческого инсулина, содержащий замену В3Е или B3Q.
5. Фармацевтическая композиция согласно положению 1, приготовленная в виде композиции с низким содержанием цинка, без добавления ионов цинка, содержащая ацилированный аналог человеческого инсулина, содержащий замену В3Е.
6. Фармацевтическая композиция согласно положению 1, приготовленная в виде композиции с низким содержанием цинка, без добавления ионов цинка, содержащая ацилированный аналог человеческого инсулина, содержащий замену B3Q.
7. Фармацевтическая композиция согласно положению 1, приготовленная в виде композиции с низким содержанием цинка, без добавления ионов цинка, содержащая ацилированный аналог человеческого инсулина, выбранный среди следующих:
A22K(N(eps) тетрадекандиоил-4xgGlu), В3Е, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-4xgGlu), В3Е, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-gGlu-2xOEG), В3Е, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-3х(gGlu-OEG)-gGlu), В3Е, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-gGlu-2xOEG), В3Е, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-пентадекандиоил-4xgGlu), В3Е, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-4xgGlu-2xOEG), В3Е, desB27, B29R, desB30 человеческий инсулин;
А14Е, A22K(N(eps)-тетрадекандиоил-gGlu-2xOEG), В3Е, desB27, B29R, desB30 человеческий инсулин;
А14Е, A22K(N(eps)-тетрадекандиоил-4xgGlu), В3Е, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-2xgGlu), В3Е, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-gGlu), В3Е, desB27, B29R, desB30 человеческий инсулин; и
A22K(N(eps)-тетрадекандиоил-3xgGlu), В3Е, desB27, B29R, desB30 человеческий инсулин.
8. Фармацевтическая композиция согласно положению 1, приготовленная в виде композиции с низким содержанием цинка, без добавления ионов цинка, содержащая ацилированный аналог человеческого инсулина, выбранный среди следующих:
A22K(N(eps)-тетрадекандиоил-4xgGlu), B3Q, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-gGlu-2xOEG), B3Q, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-3x(gGlu-OEG)-gGlu), B3Q, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-gGlu-2xOEG), B3Q, desB27, B29R, desB30 человеческий инсулин; и
A22K(N(eps)-гексадекандиоил-4xgGlu), B3Q, desB27, B29R, desB30 человеческий инсулин.
9. Фармацевтическая композиция согласно любому из положений с 7 по 8, содержащая менее 0,2 ионов Zn2+ на 6 молекул инсулина.
10. Композиция с низким содержанием цинка согласно любому из положений с 7 по 8, в которую не было добавлено поверхностно-активное вещество.
11. Фармацевтическая композиция согласно любому из положений с 7 по 8, содержащая никотиновое соединение.
12. Фармацевтическая композиция согласно любому из положений с 7 по 8, содержащая никотиновое соединение, фенилаланин и/или его соль в общей концентрации от примерно 20 мМ до примерно 170 мМ.
13. Фармацевтическая композиция согласно любому из положений с 7 по 8, содержащая никотиновое соединение, фенилаланин и/или его соль в общей концентрации от примерно 130 мМ до примерно 170 мМ.
14. Фармацевтическая композиция согласно любому из положений с 7 по 8, содержащая фармацевтически приемлемый эксципиент, разбавитель и/или адъювант.
Способы лечения
Данное изобретение относится к лекарственным средствам для терапевтического применения. Более конкретно, изобретение относится к применению ацилированных производных аналогов инсулина человека согласно изобретению для лечения или профилактики заболеваний, связанных с диабетом.
Таким образом, в другом аспекте данное изобретение относится к способу лечения или облегчения заболевания или нарушения или состояния живого организма животного, включая человека, при этом заболевание, нарушение или состояние может быть выбрано среди заболеваний, нарушений или состояний, связанных с сахарным диабетом, сахарным диабетом 1 типа, сахарным диабетом 2 типа, нарушенной толерантностью к глюкозе, гипергликемией, дислипидемией, ожирением, метаболическим синдромом (метаболическим синдромом X, синдромом резистентности к инсулину), гипертонией, когнитивными расстройствами, атеросклерозом, инфарктом миокарда, инсультом, сердечно-сосудистыми заболеваниями, ишемической болезнью сердца, синдромом воспаленного кишечника, диспепсией или язвами желудка, где указанный способ включает этап введения субъекту, нуждающемуся в этом, терапевтически эффективного количества ацилированного аналога человеческого инсулина согласно данному изобретению.
В другом воплощении данное изобретение относится к способу лечения или облегчения заболевания или нарушения или состояния живого организма животного, включая человека, при этом заболевание, нарушение или состояние может быть выбрано среди заболеваний, нарушений или состояний, связанных с сахарным диабетом, сахарным диабетом 1 типа, сахарным диабетом 2 типа, нарушенной толерантностью к глюкозе, гипергликемией, дислипидемией, ожирением, метаболическим синдромом (метаболическим синдромом X, синдромом резистентности к инсулину), гипертонией, когнитивными расстройствами, атеросклерозом, инфарктом миокарда, инсультом, сердечно-сосудистыми заболеваниями, ишемической болезнью сердца, синдромом воспаленного кишечника, диспепсией или язвами желудка, где указанный способ включает введение субъекту, нуждающемуся в этом, терапевтически эффективного количества ацилированного аналога человеческого инсулина согласно данному изобретению.
В третьем воплощении данное изобретение относится к способу лечения или облегчения заболевания или нарушения или состояния живого организма животного, включая человека, при этом заболевание, нарушение или состояние может быть выбрано среди заболеваний, нарушений или состояний, связанных с сахарным диабетом, сахарным диабетом 1 типа, сахарным диабетом 2 типа, нарушенной толерантностью к глюкозе, гипергликемией, дислипидемией, ожирением или метаболическим синдромом (метаболическим синдромом X, синдромом резистентности к инсулину).
В четвертом воплощении данное изобретение относится к способу лечения или облегчения заболевания или нарушения или состояния живого организма животного, включая человека, при этом заболевание, нарушение или состояние может быть выбрано среди заболеваний, нарушений или состояний, связанных с сахарным диабетом, в частности, с сахарным диабетом 1 типа или сахарным диабетом 2 типа.
Краткое описание графических материалов
Данное изобретение дополнительно проиллюстрировано прилагаемыми графическими материалами, где:
Фиг. 1 показывает ФК-профиль (фармакокинетический профиль) (концентрация инсулина в зависимости от времени) производного инсулина из примера 1, приготовленного с 0 ионами цинка на 6 молекул инсулина (1 нмоль/кг), в сравнении с профилем NovoRapid®/NovoLog® (инсулин аспарт, коммерческий препарат, 3 иона цинка на 6 молекул инсулина (0,5 и 1 нмоль/кг);
Фиг. 2 показывает те же данные, что и фиг. 1, но показаны только первые 2 часа.
Фиг. 3а показывает те же данные, что и фиг. 1, но показаны только данные для инсулина из примера 1, приготовленного с 0 ионами цинка на 6 молекул инсулина (1 нмоль/кг), в сравнении с профилем NovoRapid®/NovoLog® (инсулин аспарт, коммерческий препарат, 3 иона цинка на 6 молекул инсулина (1 нмоль/кг);
Фиг. 3b показывает полученные изменения уровней глюкозы в плазме крови, возникающие из профилей инсулина на фиг. 3а;
Фиг. 4а и 4b показывают ФК-профиль (фармакокинетический профиль) (концентрация инсулина в зависимости от времени) производного инсулина из примера 2, приготовленного с 0 ионами цинка на 6 молекул инсулина (1 нмоль/кг), в сравнении с профилем NovoRapid®/NovoLog® (инсулин аспарт, коммерческий препарат, 3 иона цинка на 6 молекул инсулина (0,5 и 1 нмоль/кг), а также полученные изменения уровней глюкозы в плазме крови, соответственно;
Фиг. 5а и 5b показывают те же данные, что и фиг. 4а и 4b, но показаны данные только для инсулина из примера 2, приготовленного с 0 ионами цинка на 6 молекул инсулина (1 нмоль/кг), в сравнении с профилем NovoRapid®/NovoLog® (инсулин аспарт, коммерческий препарат, 3 иона цинка на 6 молекул инсулина (1 нмоль/кг); а также полученные изменения уровней глюкозы в плазме крови, соответственно;
Фиг. 6 и 7 показывают ФК-профиль (фармакокинетический профиль) (концентрация инсулина в зависимости от времени) производного инсулина из примера 11, приготовленного с 0 ионами цинка на 6 молекул инсулина (1 нмоль/кг), а также полученные изменения уровней глюкозы в плазме крови, соответственно;
Фиг. 8 и 9 показывают ФК-профиль (фармакокинетический профиль) (концентрация инсулина в зависимости от времени) производного инсулина из примера 44, приготовленного с 0 ионами цинка на 6 молекул инсулина (1 нмоль/кг), а также полученные изменения уровней глюкозы в плазме крови, соответственно (1 нмоль/кг);
Фиг. 10 и 11 показывают ФК-профиль (фармакокинетический профиль) (концентрация инсулина в зависимости от времени) инсулина предшествующего уровня техники, A22K(N(eps)-гексадекандиоил-gGlu-2xOEG), B29R, desB30 человеческий инсулин (WO 2009/022013, пример 45), приготовленного с 0 ионами цинка на 6 молекул инсулина (1 нмоль/кг), а также полученные изменения уровней глюкозы в плазме крови, соответственно (1 нмоль/кг);
Фиг. 12 и 13 показывают ФК-профиль (фармакокинетический профиль) (концентрация инсулина в зависимости от времени) аналога тетрадекандиовой кислоты, представляющего предшествующий уровень техники (WO 2009/022013, пример 45), приготовленного с 0 ионами цинка на 6 молекул инсулина (72 нмоль/животное), а также полученные изменения уровней глюкозы в плазме крови, соответственно;
Фиг. 14А, 14В и 14С показывают графики "флуоресценция в зависимости от времени", из которых можно оценить время задержки как пересечение линейной аппроксимации зоны задержки и зоны образования фибрилл;
Фиг. 15 показывает ФК/ФД-профиль производного инсулина из примера 2 после подкожного введения крысам с ожирением линии Zucker в отсутствие/в присутствии 170 мМ никотинамида;
Фиг. 16-17 показывают ФК/ФД-профиль производного инсулина из примера 7 после подкожного введения крысам с ожирением линии Zucker в отсутствие/в присутствии 170 мМ никотинамида;
Фиг. 18-19 показывают ФК/ФД-профиль производного инсулина из примера 7 после подкожного введения крысам с ожирением линии Zucker в отсутствие/в присутствии 170 мМ никотинамида; и
Фиг. 20-21 показывают профиль ФК/ФД-профиль производного инсулина из примера 4 после подкожного введения крысам с ожирением линии Zucker в отсутствие/в присутствии 170 мМ никотинамида.
Примеры
Данное изобретение дополнительно проиллюстрировано следующими примерами, которые не предназначены для ограничения каким-либо образом заявленного объема данного изобретения.
Экспрессия и очистка аналога инсулина
Экспрессия аналога инсулина
Аналог инсулина, т.е. двухцепочечный неацилированный аналог инсулина, для применения согласно данному изобретению получают рекомбинантно путем экспрессии последовательности ДНК, кодирующей аналог инсулина, о котором идет речь, в подходящей клетке-хозяине с помощью хорошо известных методик, например, описанных в US 6500645. Аналог инсулина экспрессируется либо непосредственно, либо в виде молекулы-предшественника, которая может иметь N-концевое удлинение на В-цепи и/или соединительный пептид (С-пептид) между В-цепью и А-цепью. Это N-концевое удлинение и С-пептид отщепляются in vitro с помощью подходящей протеазы, например, протеазы Achromobactor lyticus (ALP) или трипсина, и, следовательно, будет иметь участок расщепления рядом с позицией В1 и А1, соответственно. N-концевые удлинения и С-пептиды такого типа, который пригоден для применения согласно данному изобретению, описаны, например, в US 5395922, ЕР 765395 и WO 9828429.
Полинуклеотидная последовательность, кодирующая предшественник аналога инсулина для применения согласно данному изобретению, может быть получена синтетически с помощью известных способов, например, фосфоамидитного способа, описанного в Beaucage et al. (1981) Tetrahedron Letters 22 1859-1869, или способа, описанного в Matthes et al. (1984) EMBO Journal 3 801-805. Согласно фосфоамидитному способу олигонуклеотиды синтезируют, например, в автоматическом синтезаторе ДНК, очищают, дуплицируют и лигируют с формированием синтетической ДНК-конструкции. Предпочтительным в настоящее время способом изготовления ДНК-конструкции является полимеразная цепная реакция (ПЦР).
В рекомбинантном способе обычно используется вектор, который способен к репликации в выбранном микроорганизме или клетке-хозяине и который несет полинуклеотидную последовательность, кодирующую предшественник аналога инсулина для применения согласно данному изобретению. Рекомбинантный вектор может быть автономно реплицирующимся вектором, т.е. вектором, существующим как внехромосомный объект, репликация которого не зависит от хромосомной репликации, например плазмидой, внехромосомным элементом, мини-хромосомой или искусственной хромосомой. Вектор может содержать какие-либо средства для обеспечения саморепликации. Альтернативно, вектор может быть таким, который при введении в клетку-хозяина интегрируется в геном и реплицируется вместе с хромосомой(ами), в которую(ые) он был интегрирован. Кроме того, в геном клетки-хозяина могут быть введены один вектор или плазмида или два или более вектора или плазмиды, которые вместе содержат всю ДНК, которую нужно ввести в геном, либо может быть использован транспозон. Вектор может быть линейной или замкнутой кольцевой плазмидой и предпочтительно содержит элемент(ы), который делает возможной стабильную интеграцию вектора в геном клетки-хозяина или автономную репликацию вектора в клетке независимо от генома.
Рекомбинантный экспрессионный вектор может быть таким, который способен к репликации в дрожжах. Примерами последовательностей, которые позволяют вектору реплицироваться в дрожжах, являются гены репликации REP 1-3 и сайт начала репликации (origin of replication) дрожжевой плазмиды 2 μn.
Вектор может содержать один или более чем один селектируемый маркер, который позволяет легко отбирать трансформированные клетки. Селектируемый маркер представляет собой ген, продукт которого обеспечивает биоцидную или вирусную устойчивость, устойчивость к тяжелым металлам, прототрофа к ауксотрофам и т.п. Примерами бактериальных селектируемых маркеров являются гены dal от Bacillus subtilis или Bacillus licheniformis, или маркеры, которые наделяют устойчивостью к антибиотикам, такой как устойчивость к ампициллину, канамицину, хлорамфениколу или тетрациклину. Селектируемые маркеры для использования в клетках-хозяевах нитчатых грибов включают amdS (ацетамидазу), argB (орнитинкарбамоилтрансферазу), pyrG (оротидин-5'-фосфат-декарбоксилазу) и trpC (антранилатсинтазу). Подходящими маркерами для дрожжевых клеток-хозяев являются ADE2, HIS3, LEU2, LYS2, МЕТ3, TRP1 и URA3. Хорошо подходящим селектируемым маркером для дрожжей является ген TPI от Schizosaccharomyces pompe (Russell (1985) Gene 40:125-130).
В векторе полинуклеотидная последовательность функционально связана с подходящей промоторной последовательностью. Промотор может быть любой нуклеиновокислотной последовательностью, которая демонстрирует транскрипционную активность в выбранной клетке-хозяине, включая мутантные, усеченные и гибридные промоторы, и может быть получен из генов, кодирующих внеклеточные или внутриклеточные полипептиды, гомологичные или гетерологичные клетке-хозяину.
Примерами подходящих промоторов для управления транскрипцией в бактериальной клетке-хозяине являются промоторы, полученные из lac-оперона Е. coli, гена агаразы Streptomyces coelicolor (dagA), гена левансукразы Bacillus subtilis (sacB), гена альфа-амилазы Bacillus licheniformis (amyL), гена мальтогенной амилазы Bacillus stearothermophilus (amyM), гена альфа-амилазы Bacillus amyloliquefaciens (amyQ) и гена пенициллиназы Bacillus licheniformis (penP). Примерами подходящих промоторов для управления транскрипцией в клетке-хозяине нитчатого гриба являются промоторы, полученные из генов ТАКА-амилазы Aspergillus oryzae, аспарагиновой протеиназы Rhizomucor miehei, нейтральной альфа-амилазы Aspergillus niger и кислотоустойчивой альфа-амилазы Aspergillus niger. В дрожжевых клетках-хозяевах используют промоторы Ма1, TPI, ADH или PGK от Saccharomyces cerevisiae.
Полинуклеотидная последовательность, кодирующая пептидную цепь инсулина для применения согласно данному изобретению, также обычно функционально связана с подходящим терминатором. В дрожжах подходящим терминатором является TPI-терминатор (Alber et al. (1982) J. Mol. Appl. Genet. 1:419-434).
Специалистам в данной области хорошо известны процедуры, которые используются для объединения полинуклеотидной последовательности, кодирующей аналог инсулина для применения согласно данному изобретению, промотора и терминатора, соответственно, и для вставки их в подходящий вектор, содержащий информацию, необходимую для репликации в выбранном хозяине. Необходимо понимать, что вектор может быть построен либо путем получения вначале ДНК-конструкции, содержащей всю последовательность ДНК, кодирующую нити инсулина для применения согласно данному изобретению, а затем вставки этого фрагмента в подходящий экспрессионный вектор, либо путем последовательной вставки фрагментов ДНК, содержащих генетическую информацию об отдельных элементах (таких как сигнальный пептид и пропептид (N-концевое удлинение В-цепи), С-пептид, А- и В-цепи), и затем лигирования.
Вектор, содержащий полинуклеотидную последовательность, кодирующую аналог инсулина для применения согласно данному изобретению, вводят в клетку-хозяина так, что он поддерживается как хромосомный интегрант или как самореплицирующийся внехромосомный вектор. Термин "клетка-хозяин" охватывает любое потомство родительской клетки, которое не идентично родительской клетке из-за мутаций, которые произошли во время репликации. Клетка-хозяин может быть одноклеточным микроорганизмом, например, прокариотом, или неодноклеточным микроорганизмом, например, эукариотом. Используемыми одноклеточными клетками являются бактериальные клетки, такие как грам-положительные бактерии, в т.ч. клетка Bacillus, клетка Streptomyces, или грам-отрицательные бактерии, такие как Е. coli и Pseudomonas sp. Эукариотические клетки могут быть клетками млекопитающих, насекомых, растений или грибов.
Клетка-хозяин может быть дрожжевой клеткой. Дрожжевой организм может быть любым подходящим дрожжевым организмом, который при культивировании секретирует пептидную цепь инсулина или его предшественника в культуральную среду. Примерами подходящих дрожжевых организмов являются штаммы, выбранные среди Saccharomyces cerevisiae, Saccharomyces kluyveri, Schizosaccharomyces pombe, Sacchoromyces uvarum, Kluyveromyces lactis, Hansenula polymorpha, Pichia pastoris, Pichia метанолюа, Pichia kluyveri, Yarrowia lipolytica, Candida sp., Candida utilis, Candida cacaoi, Geotrichum sp. и Geotrichum fermentans.
Трансформация дрожжевых клеток может осуществляться, например, путем формирования протопластов, а затем трансформации известными способами. Среда, используемая для культивирования клеток, может быть любой обычной средой, подходящей для выращивания дрожжевых организмов.
Очистка аналога инсулина
Секретированный аналог инсулина или его предшественник может быть выделен из среды с помощью стандартных процедур, включая отделение дрожжевых клеток от среды путем центрифугирования, фильтрации или захвата или адсорбции аналога инсулина или его предшественника на ионообменной матрице или на обращено-фазовой адсорбционной матрице, осаждения белковых компонентов супернатанта, или путем фильтрацией с помощью соли, например, сульфата аммония, с последующей очисткой с помощью различных хроматографических процедур, например ионообменной хроматографии, аффинной хроматографии и т.д.
Очистку и расщепление пептидных цепей инсулина данного изобретения осуществляют следующим образом:
Одноцепочечный предшественник аналога инсулина, который может содержать N-концевое удлинение В-цепи и модифицированный С-пептид между В-цепью и А-цепью, очищают и концентрируют из супернатанта дрожжевой культуры путем катионного обмена (Kjeldsen et al. (1998) Prot. Expr. Pur. 14 309-316).
Одноцепочечный предшественник аналога инсулина созревает до двухцепочечной пептидной нити инсулина за счет расщепления лизин-специфической иммобилизованной ALP (Kristensen et al. (1997) J. Biol. Chem. 20 12978-12983) или трипсином, чтобы отщепить N-концевое удлинение В-цепи, если оно присутствует, и С-пептид.
Расщепление трипсином
Элюат из катионнообменного этапа хроматографии, содержащий предшественник аналога инсулина, разводят водой до концентрации этанола от 15 до 20%. Добавляют глицин в концентрации 50 мМ и рН доводят до от 9,0 до 9,5 с помощью NaOH. Трипсин добавляют в пропорции 1:300 (по массе) и расщепление проводят при 4°С. Расщепление аналитически контролируют каждые 20 минут до тех пор, пока оно не будет завершено. Расщепление прекращают путем добавления 1 М лимонной кислоты в соотношении 3:100 (по объему).
Реакцию расщепления анализируют с помощью аналитической LC на системе Waters Acquity Ultra-Performance Liquid Chromatography с использованием колонки С18, и молекулярную массу подтверждают путем MALDI-TOF MS (Bruker Daltonics Autoflex II TOF/TOF).
Двухцепочечный аналог инсулина очищают с помощью обращено-фазовой HPLC (система Waters 600) на колонке С18 с использованием градиента ацетонитрила. Нужный аналог инсулина, например, A22K, desB27, B29R, desB30 человеческий инсулин, A22K, В3Е, desB27, B29R, desB30 человеческий инсулин или A22K, B3Q, desB27, B29R, desB30 человеческий инсулин, восстанавливают путем лиофилизации.
Чистоту определяют с помощью аналитической LC на системе Waters Acquity Ultra-Performance Liquid Chromatography с использованием колонки С18, и молекулярную массу подтверждают путем MALDI-TOF MS.
Сокращения
ALP - протеаза Achromobactor lyticus
С-пептид - соединительный пептид (от англ. connecting peptide)
HPLC - высокоэффективная жидкостная хроматография (от англ. high-performance liquid chromatography)
IR - рецептор инсулина (от англ. insulin receptor)
IGF-1R - рецептор инсулиноподобного фактора роста 1 (от англ. insulin-like growth factor 1 receptor)
LC - жидкостная хроматография (от англ. liquid chromatography)
MALDI-TOF - времяпролетная масс-спектрометрия с матрично-активированной лазерной десорбцией/ионизацией (от англ. matrix-assisted laser desorption ionisation time-of-flight)
MS - масс-спектрометрия (от англ. mass spectrometry)
ПЦР - полимеразная цепная реакция
ФД - фармакодинамика (эффект снижения уровня глюкозы в крови/плазме)
PG - уровень глюкозы в плазме (от англ. plasma glucose)
ФК - фармакокинетика (профили концентраций инсулина в крови/плазме с течением времени)
tBu - трет-бутил;
DCM - дихлорметан (от англ. dichloromethane);
DIC - диизопропилкарбодиимид (от англ. diisopropylcarbodiimide);
DIPEA или DIEA - N,N-диизопропилэтиламин (от англ. N,N-diisopropylethylamine);
DMF - N,N-диметилформамид (от англ. N,N-dmethylformamide);
DMSO - диметилсульфоксид (от англ. dimethyl sulphoxide);
EtOAc - этилацетат;
Fmoc - 9-флуоренил-метокси-окси-карбонил (от англ. 9-fluorenylmethyloxycarbonyl);
γGlu (gGlu) - гамма-L-глутамил;
HCl - соляная кислота;
HOBt - 1-гидроксибензотриазол (от англ. 1-hydroxybenzotriazole);
NMP - N-метилпирролидон (от англ. N-methylpyrrolidone);
MeCN - ацетонитрил;
OEG - [2-(2-аминоэтокси)этокси]этилкарбонил;
Su - сукцинимидил-1-ил или 2,5-диоксо-пирролидин-1-ил;
OSu - сукцинимидил-1-илокси или 2,5-диоксо-пирролидин-1-илокси;
RPC - обращенно-фазовая хроматография (от англ. reverse phase chromatography);
RT - комнатная температура (от англ. room temperature);
TCTU - O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафтоборат;
TFA - трифторуксусная кислота (от англ. trifluoroacetic acid);
THF - тетрагидрофуран (от англ. tetrahydrofuran);
TNBS - 2,4,6-тринитро-бензен-сульфоновая кислота (от англ. 2,4,6-trinitro-benzene-sulfonic acid);
TRIS - трис(гидокси-метил)аминометан (от англ. tris(hydroxymethyl)aminomethane) и
TSTU - O-(N-сукцинимидил)-1,1,3,3-тетраметилурония тетрафторборат.
Общие заметки
Следующие примеры и общие процедуры относятся к промежуточным соединениям и конечным продуктам, указанным в подробном описании и в схемах синтеза. Получение соединений согласно данному изобретению подробно описано с помощью следующих примеров, но описанные химические реакции раскрыты с точки зрения их общей применимости для получения соединений данного изобретения.
Иногда реакция может быть не применима в соответствии с описанием для каждого соединения, включенного в раскрываемый объем изобретения. Специалисты в данной области легко узнают соединения, для которых это имеет место. В этих случаях реакции может быть успешно выполнены путем обычных модификаций, известных специалистам в данной области, например, путем подходящей защиты мешающих групп, путем замены на другие стандартные реагенты или путем обычного изменения условий реакции.
Альтернативно, в получении соответствующих соединений согласно данному изобретению будут применяться другие реакции, описанные в данном документе или, в противном случае, стандартные реакции. Во всех способах получения все исходные материалы известны или могут быть легко получены из известных исходных материалов. Все температуры приведены в градусах Цельсия, и, если не указано иное, все части и проценты даны по массе, когда речь идет о выходе, и все части даны по объему, когда речь идет о растворителях и элюентах.
Соединения согласно данному изобретению могут быть очищены путем использования одной или более чем одной из следующих процедур, которые являются типичными в данной области. Эти процедуры при необходимости могут быть изменены в отношении градиентов, рН, солей, концентраций, потока, колонок и т.д. В зависимости от таких факторов, как распределение примеси, растворимость инсулина, о котором идет речь, и т.д., специалист в данной области может легко узнать и произвести эти изменения.
После кислотной HPLC или обессоливания соединения выделяют путем лиофилизации чистых фракций.
После нейтральной HPLC или анионообменной хроматографии соединения обессоливают, осаждают при изоэлектрическом рН или очищают путем кислотной HPLC.
Типичные процедуры очистки:
Система RP-HPLC
Система Gilson включает: аппарат для работы с жидкими растворами модели 215, насос модели 322-Н2, и УФ-детектор модели 155 (УФ 215 нм и 280 нм).
Анионообменная и обессоливающая система:
Система  Purifier включает: насос модели Р-900, УФ-детектор модели UV-900 (УФ 214 нм, 254 нм и 280 нм), детектор рН и проводимости модели рН/С-900, коллектор фракций модели Frac-950.
Purifier включает: насос модели Р-900, УФ-детектор модели UV-900 (УФ 214 нм, 254 нм и 280 нм), детектор рН и проводимости модели рН/С-900, коллектор фракций модели Frac-950.
Кислотная RP-HPLC:
Нейтральная RP-HPLC:
Анионообменная хроматография:
Обессоливание:
Реагенты для ацилирования синтезировали либо в растворе (см. ниже), либо на твердой фазе, как описано, например, в WO 2009/115469.
Общая процедура твердофазного синтеза реагентов для ацилирования общей формулы III
[Ацил]-[Линкер]-Act,
где ацильная и линкерная группы являются такими, как описано выше, и Act является оставшейся группой активного эфира, такой как N-гидроксисукцинимид (OSu) или 1-гидроксибензотриазол, и
где карбоновые кислоты с ацильной и линкерной группировками ацильной группировки защищены в форме трет-бутиловых эфиров.
Соединения общей формулы III могут быть синтезированы на твердой подложке с помощью процедур, известных специалистам в области твердофазного синтеза белков.
Одна такая процедура содержит присоединение Fmoc-защищенной аминокислоты к полистирен-2-хлортритилхлорид-смоле. Присоединение может быть выполнено с помощью свободной N-защищенной аминокислоты в присутствии третичного амина, такого как триэтиламин или N,N-диизопропилэтиламин (см. ссылки ниже). С-конец (который присоединен к смоле) этой аминокислоты находится на конце синтетической последовательности, будучи связанным с родительскими инсулинами согласно изобретению.
После присоединения Fmoc-аминокислоты к смоле с Fmoc-группы снимают защиту, например, с помощью вторичных аминов, таких как пиперидин или диэтиламин, а затем соединяют с другой (или такой же) Fmoc-защищенной аминокислотой и снимают защиту. Синтетическая последовательность завершается соединением моно-трет-бутил-защищенных жирных (α,ω)-двухосновных кислот, таких как моно-трет-бутиловые эфиры гексадекандиовой, пентадекандиовой или тетрадекандиовой кислот.
Отщепление соединений от смолы осуществляется с помощью разбавленной кислоты, такой как 0,5-5% TFA/DCM (трифторуксусная кислота в дихлорметане), уксусная кислота (например, 10% в DCM или НОАс/трифторэтанол/DCM 1:1:8), или гексафторизопропанол в DCM (см. например, F.Z.  : Organic Synthesis on Solid Phase; Wiley-VCH 2000, ISBN 3-527-29950-5; N. Sewald & H.-D. Jakubke: Peptides: Chemistry and Biology; Wiley-VCH, 2002, ISBN 3-527-30405-3; или The Combinatorial Cheemistry Catalog, 1999, Novabiochem AG, и ссылки, приведенные в данном документе). Это подтверждает, что трет-бутиловые эфиры присутствуют в соединениях, поскольку с карбоновокислотных защитных групп защита не снята.
: Organic Synthesis on Solid Phase; Wiley-VCH 2000, ISBN 3-527-29950-5; N. Sewald & H.-D. Jakubke: Peptides: Chemistry and Biology; Wiley-VCH, 2002, ISBN 3-527-30405-3; или The Combinatorial Cheemistry Catalog, 1999, Novabiochem AG, и ссылки, приведенные в данном документе). Это подтверждает, что трет-бутиловые эфиры присутствуют в соединениях, поскольку с карбоновокислотных защитных групп защита не снята.
Наконец, С-концевую карбокси-группу (высвобожденную из смолы) активируют, например, в виде N-гидроксисукцинимидного эфира (OSu). Этот активированный эфир подвергают снятию защиты, например, с помощью чистой TFA, или используют напрямую или после очистки (кристаллизации) в качестве связывающего реагента в присоединении к родительским инсулинам согласно изобретению. Эта процедура проиллюстрирована ниже.
Пример, иллюстрирующий общую процедуру синтеза реагентов для ацилирования на твердой фазе:
Синтез тетрадекандиоил-4xgGlu-OSu (Соед. 4)
2-хлортритил-смолу 100-200 меш 1,5 ммоль/г (15,79 г, 23,69 ммоль) оставляли для набухания в сухом дихлорметане (150 мл) на 20 минут. Раствор Fmoc-Glu-OtBu (6,72 г, 15,79 ммоль) и N,N-диизопропилэтиламина (10,46 мл, 60,01 ммоль) в сухом дихлорметане (120 мл) добавляли к смоле и смесь встряхивали в течение 16 ч. Смолу фильтровали и обрабатывали раствором N,N-диизопропилэтиламина (5,5 мл, 31,59 ммоль) в смеси метанола/дихлорметана (9:1, 150 мл, 5 мин). Затем смолу промывали N,N-диметилформамидом (2 × 150 мл), дихлорметаном (2 × 150 мл) и N,N-диметилформамидом (2 × 150 мл).
Fmoc-группу удаляли путем обработки 20% пиперидином в N,N-диметилформамиде (2 × 150 мл, 1 × 5 мин, 1 × 20 мин). Смолу промывали N,N-диметилформамидом (2 × 150 мл), 2-пропанолом (2 × 150 мл), дихлорметаном (2 × 150 мл) и N,N-диметилформамидом (2 × 150 мл). Раствор Fmoc-Glu-OtBu (10,08 г, 23,69 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TCTU, 8,42 г, 23,69 ммоль) и N,N-диизопропилэтиламин (7,43 мл, 42,64 ммоль) в N,N-диметилформамиде (120 мл) добавляли к смоле и смесь встряхивали в течение 16 ч. Смолу фильтровали и обрабатывали раствором N,N-диизопропилэтиламина (5,5 мл, 31,59 ммоль) в смеси метанола/дихлорметана (9:1, 150 мл, 5 мин). Затем смолу промывали N,N-диметилформамидом (2 × 150 мл), дихлорметаном (2 × 150 мл) и N,N-диметилформамидом (2 × 150 мл).
Fmoc-группу удаляли путем обработки 20% пиперидином в N,N-диметилформамиде (2 × 150 мл, 1 × 5 мин, 1 × 20 мин). Смолу промывали N,N-диметилформамидом (2 × 150 мл), 2-пропанолом (2 × 150 мл), дихлорметаном (2 × 150 мл) и N,N-диметилформамидом (2 × 150 мл). Раствор Fmoc-Glu-OtBu (10,08 г, 23,69 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторбората (TCTU, 8,42 г, 23,69 ммоль) и N,N-диизопропилэтиламина (7,43 мл, 42,64 ммоль) в N,N-диметилформамиде (120 мл) добавляли к смоле и смесь встряхивали в течение 16 ч. Смолу фильтровали и обрабатывали раствором N,N-диизопропилэтиламина (5,5 мл, 31,59 ммоль) в смеси метанола/дихлорметана (9:1, 150 мл, 5 мин). Затем смолу промывали N,N-диметилформамидом (2 × 150 мл), дихлорметаном (2 × 150 мл) и N,N-диметилформамидом (2 × 150 мл).
Fmoc-группу удаляли путем обработки 20% пиперидином в N,N-диметилформамиде (2 × 150 мл, 1 × 5 мин, 1 × 20 мин). Смолу промывали N,N-диметилформамидом (2 × 150 мл), 2-пропанолом (2 × 150 мл), дихлорметаном (2 × 150 мл) и N,N-диметилформамидом (2 × 150 мл). Раствор Fmoc-Glu-OtBu (10,08 г, 23,69 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторбората (TCTU, 8,42 г, 23,69 ммоль) и N,N-диизопропилэтиламина (7,43 мл, 42,64 ммоль) в N,N-диметилформамиде (120 мл) добавляли к смоле и смесь встряхивали в течение 16 ч. Смолу фильтровали и обрабатывали раствором N,N-диизопропилэтиламина (5,5 мл, 31,59 ммоль) в смеси метанола/дихлорметана (9:1, 150 мл, 5 мин). Затем смолу промывали N,N-диметилформамидом (2 × 150 мл), дихлорметаном (2 × 150 мл) и N,N-диметилформамидом (2 × 150 мл).
Fmoc-группу удаляли путем обработки 20% пиперидином в N,N-диметилформамиде (2 × 150 мл, 1 × 5 мин, 1 × 20 мин). Смолу промывали N,N-диметилформамидом (2 × 150 мл), 2-пропанолом (2 × 150 мл), дихлорметаном (2 × 150 мл) и N,N-диметилформамидом (2 × 150 мл). Раствор тетрадекандиовой кислоты моно-трет-бутилового эфира (7,45 г, 23,69 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторбората (TCTU, 8,42 г, 23,69 ммоль) и N,N-диизопропилэтиламина (7,43 мл, 42,64 ммоль) в смеси N,N-диметилформамида (40 мл) и дихлорметана (80 мл) добавляли к смоле и смесь встряхивали в течение 16 ч. Смолу фильтровали и промывали дихлорметаном (2 × 150 мл), N,N-диметилформамидом (2 × 150 мл), метанолом (2 × 150 мл) и дихлорметаном (10 × 150 мл).
Продукт отщепляли от смолы путем обработки трифторэтанолом (150 мл) в течение ночи. Смолу отфильтровывали и промывали дихлорметаном (3 × 100 мл). Растворитель удаляли при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле (градиентное элюирование дихлорметаном/метанолом от 100:0 до 95:5), получая названное соединение в виде белого твердого вещества.
Продукт сушили в вакууме, получая (S)-2-((3)-4-трет-бутоксикарбонил-4-{(S)-4-трет-бутоксикарбонил-4-[(S)-4-трет-бутоксикарбонил-4-(13-трет-бутоксикарбонил-тридеканоиламино)-бутириламино]-бутириламино}-бутириламино)-пентандиовой кислоты 1-трет-бутиловый эфир.
Выход: 14,77 г (89%).
1Н NMR-спектр (300 MHz, CDCl3, δН): 7,22 (d, J=7,7 Hz, 1H); 6,97 (d, J=7,9 Hz, 1H); 6,72 (d, J=7,9 Hz, 1H); 6,41 (d, J=7,9 Hz, 1H); 4,59-4,43 (m, 4H); 2,49-2,13 (m, 16H); 2,06-1,72 (m, 4H); 1,70-1,52 (m, 4H); 1,52-1,38 (m, 45H); 1,35-1,21 (m, 16H).
Чистота по LC-MS: 100% (ELSD).
Rt по LC-MS (Sunfire 4,6 мм × 100 мм, ацетонитрил/вода от 50:50 до 100:0 + 0,1% FA): 7,39 мин.
LC-MS m/z: 1055,0 (М+Н)+.
Полученный трет-бутил-защищенный тетрадекандиоил-4xgGlu-ОН((S)-2-((S)-4-трет-бутоксикарбонил-4-{(S)-4-трет-бутоксикарбонил-4-[(S)-4-трет-бутоксикарбонил-4-(13-трет-бутоксикарбонил-тридеканоиламино)-бутириламино]-бутириламино}-бутириламино)-пентандиовой кислоты 1-трет-бутиловый эфир) растворяли в тетрагидрофуране. Добавляли DIPEA, а затем TSTU, растворенный в ацетонитриле. Реакционную смесь встряхивали в течение 3 ч, а затем выпаривали в вакууме, повторно растворяли в этилацетате, промывали 0,1М HCl (водн.), сушили над MgSO4, фильтровали и выпаривали в вакууме. LC-MS (электроспрей): m/z равно 1174,7 (M+Na+). Рассчит.: 1175,4.
Защищенное и OSu-активированное соединение растворяли в 10 мл TFA и встряхивали при комнатной температуре в течение ночи. Диэтиловый эфир добавляли и сформированный осадок отфильтровывали и сушили в вакууме в течение ночи, получая (S)-2-((S)-4-карбокси-4-{(S)-4-карбокси-4-[(S)-4-карбокси-4-(13-карбокси-тридеканоиламино)-бутириламино]-бутириламино}-бутириламино)-пентандиовой кислоты 5-(2,5-диоксо-пирролидин-1-ил)эфир (тетрадекандиоил-4xgGlu-OSu). LC-MS (электроспрей): m/z равно 872,2 (М+Н+). Рассчит.: 871,9.
Пример, иллюстрирующий общую процедуру синтеза реагентов для ацилирования на твердой фазе:
Синтез тетрадекандиоил-gGlu-2xOEG-OSu (Соед. 5)
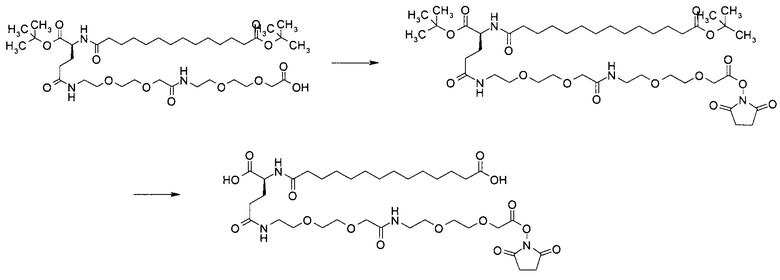
13-{(S)-1-трет-бутоксикарбонил-3-[2-(2-([2-(2-карбоксиметокси-этокси)-этилкарбамоил]-метокси)-этокси)-этилкарбамоил]-пропилкарбамоил)-тридекановая кислоты трет-бутиловый эфир
1,7 ммоль/г 2-хлортритил-смолы 100-200 меш (79,8 г, 135,6 ммоль) оставляли для набухания в сухом дихлорметане (450 мл) на 20 минут. Раствор {2-[2-(9Н-флуорен-9-илметоксикарбониламино)-этокси]-этокси}уксусной кислоты (Fmoc-OEG-ОН, 34,9 г, 90,4 ммоль) и N,N-диизопропилэтиламина (59,9 мл, 343,6 ммоль) в сухом дихлорметане (100 мл) добавляли к смоле и смесь встряхивали в течение 4 ч. Смолу фильтровали и обрабатывали раствором N,N-диизопропилэтиламина (31,5 мл, 180,8 ммоль) в смеси метанола/дихлорметана (4:1, 150 мл, 2 × 5 мин). Затем смолу промывали N,N-диметилформамидом (2 × 300 мл), дихлорметаном (2 × 300 мл) и N,N-диметилформамидом (3 × 300 мл). Fmoc-группу удаляли путем обработки 20% пиперидином в диметилформамиде (1 × 5 мин, 1 × 30 мин, 2 × 300 мл). Смолу промывали N,N-диметилформамидом (3 × 300 мл), 2-пропанолом (2 × 300 мл) и дихлорметаном (350 мл, 2 × 300 мл).
Раствор {2-[2-(9Н-флуорен-9-илметоксикарбониламино)-этокси]-этокси}-уксусной кислоты (Fmoc-OEG-OH, 52,3 г, 135,6 ммоль), 0-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторбората (TCTU, 48,2 г, 135,6 ммоль) и N,N-диизопропилэтиламина (42,5 мл, 244,1 ммоль) в N,N-диметилформамиде (250 мл) добавляли к смоле и смесь встряхивали в течение 2 ч. Поскольку нингидриновый тест все еще был положительным, смолу фильтровали и обрабатывали таким же количеством реагентов в течение еще 30 минут. Смолу фильтровали и промывали N,N-диметилформамидом (2 × 300 мл), дихлорметаном (2 × 300 мл) и N,N-диметилформамидом (3 × 300 мл). Fmoc-группу удаляли путем обработки 20% пиперидином в диметилформамиде (1 × 5 мин, 1 × 30 мин, 2 × 300 мл). Смолу промывали N,N-диметилформамидом (3 × 300 мл), 2-пропанолом (2 × 300 мл) и дихлорметаном (350 мл, 2 × 300 мл).
Раствор (S)-2-(9Н-флуорен-9-илметоксикарбониламино)-пентандиовой кислоты 1-трет-бутилового эфира (Fmoc-LGlu-OtBu, 57,7 г, 135,6 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторбората (TCTU, 48,2 г, 135,6 ммоль) и N,N-диизопропилэтиламина (42,5 мл, 244,1 ммоль) в N,N-диметилформамиде (250 мл) добавляли к смоле и смесь встряхивали в течение 1 ч. Смолу фильтровали и промывали N,N-диметилформамидом (2 × 300 мл), дихлорметаном (2 × 300 мл) и N,N-диметилформамидом (2 × 300 мл). Fmoc-группу удаляли путем обработки 20% пиперидином в диметилформамиде (1 × 5 мин, 1 × 30 мин, 2 × 300 мл). Смолу промывали N,N-диметилформамидом (3 × 300 мл), 2-пропанолом (2 × 300 мл) и дихлорметаном (350 мл, 2 × 300 мл).
Раствор тетрадекандиовой кислоты моно-трет-бутилового эфира (C14(OtBu)-ОН, 42,7 г, 135,6 ммоль), O-(6-хлор-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторбората (TCTU, 48,2 г, 135,6 ммоль) и N,N-диизопропилэтиламина (42,5 мл, 244,1 ммоль) в смеси дихлорметана/N,N-диметилформамида (4:1, 300 мл) добавляли к смоле и смесь встряхивали в течение 1,5 ч. Смолу фильтровали и промывали N,N-диметилформамидом (6 × 300 мл), дихлорметаном (4 × 300 мл), метанолом (4 × 300 мл) и дихлорметаном (7 × 600 мл). Продукт отщепляли от смолы путем обработки 2,2,2-трифторэтанолом (600 мл) в течение 18 ч. Смолу отфильтровывали и промывали дихлорметаном (4 × 300 мл), смесью дихлорметана/2-пропанола (1:1, 4 × 300 мл), 2-пропанолом (2 × 300 мл) и дихлорметаном (6 × 300 мл). Растворы объединяли; растворитель выпаривали и неочищенный продукт очищали путем колоночной хроматографии (Silicagel 60А, от 0,060 до 0,200 мм; элюент: дихлорметан/метанол 1:0-9:1).
Чистый трет-бутиловый эфир 13-{(S)-1-трет-бутоксикарбонил-3-[2-(2-{[2-(2-карбоксиметокси-этокси)-этилкарбамоил]-метокси}-этокси)-этилкарбамоил]-пропилкарбамоил}-тридекановой кислоты сушили в вакууме и получали в виде оранжевого масла.
Выход: 55,2 г (77%).
RF (SiO2, дихлорметан/метанол 9:1): 0,35.
1Н NMR-спектр (300 MHz, CDCl3, δН): 7,37 (bs, 1Н); 7,02 (bs, 1Н); 6,53 (d, J=7,9 Hz, 1H); 4,54-4,38 (m, 1H); 4,17 (s, 2H); 4,02 (s, 2H); 3,82-3,40 (m, 16H); 2,37-2,12 (m, 7H); 2,02-1,82 (m, 1H); 1,71-1,51 (m, 4H); 1,47 (s, 9H); 1,43 (s, 9H); 1,25 (bs, 16H).
Чистота по LC-MS: 100%.
Rt по LC-MS (Sunfire 4,6 мм × 100 мм, ацетонитрил/вода от 70:30 до 100:0 + 0,1% FA): 3,93 мин.
LC-MS m/z: 791,0 (М+Н)+.
13-{(S)-1-трет-бутоксикарбонил-3-[2-(2-{[2-(2-карбоксиметокси-этокси)-этилкарбамоил]-метокси}-этокси)-этилкарбамоил]-пропилкарбамоил}тридекановой кислоты трет-бутиловый эфир (тетрадекандиоил-gGlu-2xOEG-ОН, 8,89 г, 11,3 ммоль)) растворяли в 100 мл ацетонитрила и добавляли TSTU (4,07 г, 13,5 ммоль) и DIPEA (2,35 мл, 13,5 ммоль) к встряхиваемому раствору, и смесь встряхивали при комнатной температуре в течение 1 ч. Растворитель выпаривали и осадок растворяли в дихлорметане и дважды промывали 0,05 М HCl.
Органическую фазу сушили (MgSO4) и выпаривали в вакууме. Так получали 9,98 г (100%) 13-((S)-1-трет-бутоксикарбонил-3-{2-[2-({2-[2-(2,5-диоксо-пирролидин-1-илоксикарбонилметокси)-этокси]-этилкарбамоил}-метокси)-этокси]-этилкарбамоил}-пропилкарбамоил)-тридекановой кислоты трет-бутилового эфира в виде масла.
13-((S)-1-трет-бутоксикарбонил-3-{2-[2-({2-[2-(2,5-диоксо-пирролидин-1-илоксикарбонилметокси)-этокси]-этилкарбамоил}-метокси)-этокси]-этилкарбамоил}-пропилкарбамоил)-тридекановая кислоты трет-бутиловый эфир (4 г) растворяли в трифторуксусной кислоте (10 мл) и смесь встряхивали при комнатной температуре в течение 1 ч и выпаривали в вакууме. Остаток растворяли в дихлорметане (10 мл) и выпаривали в вакууме. Добавление холодного диэтилового эфира (10 мл) приводило к осаждению белого маслянистого твердого вещества. Его выделяли путем декантации и сушили в вакууме. Таким образом получали 3,4 г (колич.) 14-[[(1S)-1-карбокси-4-[2-[2-[2-[2-[2-[2-(2,5-диоксопирролидин-1-ил)окси-2-оксоэтокси]этокси]этиламино]-2-оксоэтокси]этокси]этиламино]-4-оксобутил]амино]-14-оксотетрадекановой кислоты (тетрадекандиоил-gGlu-2xOEG-OSu), которую хранили при -18°С.
LC-MS (электроспрей): m/z равно 775,33; рассчит.: 774,8.
Ацилирование и очистка производных инсулинов
Общая процедура (А) для ацилирования и очистки производных инсулинов согласно изобретению описана в примере 1, см. ниже. Эта процедура также применима к синтезу соединений из примеров с 2 по 25, см. ниже. Очистку с помощью других способов (как описано выше) также проводили для некоторых из этих производных.
Пример 1; Общая процедура (А)
A22K(N(eps)-тетрадекандиоил-4xgGlu), desB27, B29R, desB30 человеческий инсулин;
Название IUPAC (OpenEye, стиль IUPAC): N{Alpha}([ArgB29],des-ThrB27,ThrB30-инсулин(человеческий)-(А)-пептидил)-N{эпсилон}[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-(13-карбокси-тридеканоиламино)-бутаноил]-амино]-бутаноил]-амино]бутаноил]амино]бутаноил]Lys, (В)-пептид.

A22K, desB27, B29R, desB30 человеческий инсулин (2,0 г) растворяли в 40 мл 0,1 М Na2CO3 (водн.), и рН доводили до 11,2 с помощью 1 М NaOH (водн.). Тетрадекандиоил-4xgGlu-OSu (0,454 г) растворяли в 2 мл DMF и по каплям добавляли к раствору инсулина, поддерживая рН на постоянном уровне 11,2 с помощью 1 М NaOH (водн.). Реакционную смесь встряхивали при комнатной температуре в течение 30 минут, затем нейтрализовали до рН равно 7,5 с помощью 0,1 М HCl (водн.) и разводили смесью 1:1 EtOH/milliQ воды.
Полученный инсулин очищали путем аниообменной хроматографии на 74 мл колонке Poros50HQ, элюируя 25-500 мМ раствором аммония ацетата в 15 мМ Tris, 50 v/v% этанол, рН 7,5 (уксусная кислота). Обессоливание чистых фракций проводили на обращенно-фазовой колонке, элюируя градиентом ацетонитрила в воде milliQ, содержащей 0,1% трифторуксусную кислоту. Полученный чистый инсулин лиофилизировали. LC-MS (электроспрей): m/z = 1629,98 (М+4)/4. Рассчит.: 1630,65.
Реагент для ацилирования, тетрадекандиоил-4xgGlu-OSu, синтезировали, как описано выше.
Пример 2; Общая процедура (А)
A22K(N(eps)-тетрадекандиоил-4xgGlu), В3Е, desB27, B29R, desB30 человеческий инсулин:
Название IUPAC (OpenEye, стиль IUPAC): N{Alpha}([GluB3,ArgB29],des-ThrB27,ThrB30-инсулин(человеческий)-(А)-пептидил)-N{эпсилон}[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]бутаноил]амино]бутаноил]амино]бутаноил]Lys, (В)-пептид.
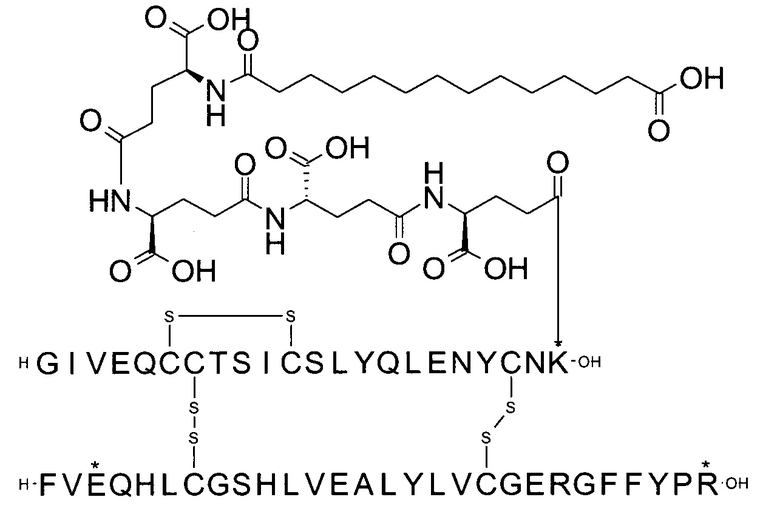
Этот аналог получали в соответствии со способом, описанным в примере 1. LC-MS (электроспрей): m/z = 1633,9 (М+4Н+). Рассчит.: 1634,4
Пример 3; Общая процедура (А)
А14Е, A22K(N(eps)-тетрадекандиоил-4xgGlu), desB27, B29R, desB30 человеческий инсулин:
Название IUPAC (OpenEye, стиль IUPAC): N{Alpha}([GluA14,ArgB29],des-ThrB27,ThrB30-инсулин(человеческий)-(А)-пептидил)-N{эпсилон}[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]бутаноил]амино]бутаноил]амино]бутаноил]Lys, (В)-пептид.

LC-MS (электроспрей): m/z = 1622,2 (М+4)/4. Рассчит.: 1622,1
Пример 4; Общая процедура (А)
A22K(N(eps)-гексадекандиоил-4xgGlu), В3Е, desB27, B29R, desB30 человеческий инсулин;
Название IUPAC (OpenEye, стиль IUPAC): N{Alpha}([GluB3,ArgB29],des-ThrB27,ThrB30-инсулин(человеческий)-(А)-пептидил)-N{эпсилон}[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-(15-карбоксипентадеканоиламино)бутаноил]амино]бутаноил]амино]бутаноил]амино]бутаноил]Lys, (B)-пептид.
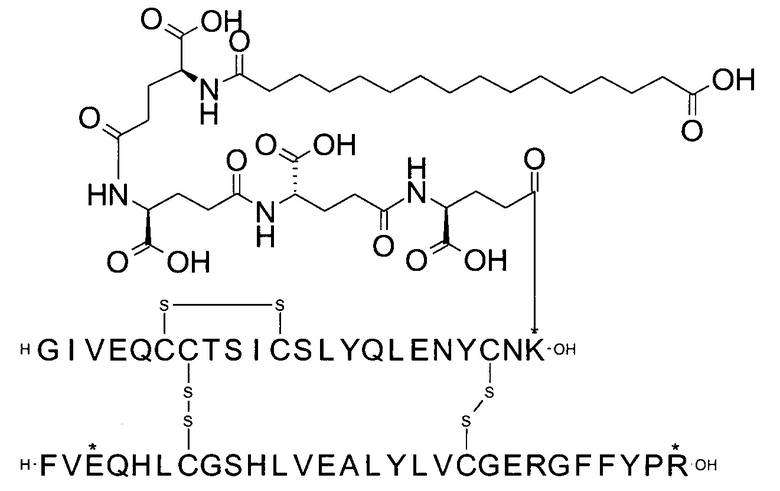
LC-MS (электроспрей): m/z = 1641,2 (M+4H+). Рассчит.: 1641,4.
Пример 5; Общая процедура (А)
A22K(N(eps)-гексадекандиоил-gGlu-2xOEG, В3Е, desB27, B29R, desB30 человеческий инсулин:
Название IUPAC (OpenEye, стиль IUPAC): N{Alpha}([GluB3,ArgB29],des-ThrB27,ThrB30-инсулин(человеческий)-(А)-пептидил)-N{эпсилон}[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(15-карбоксипентадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]Lys, (В)-пептид.
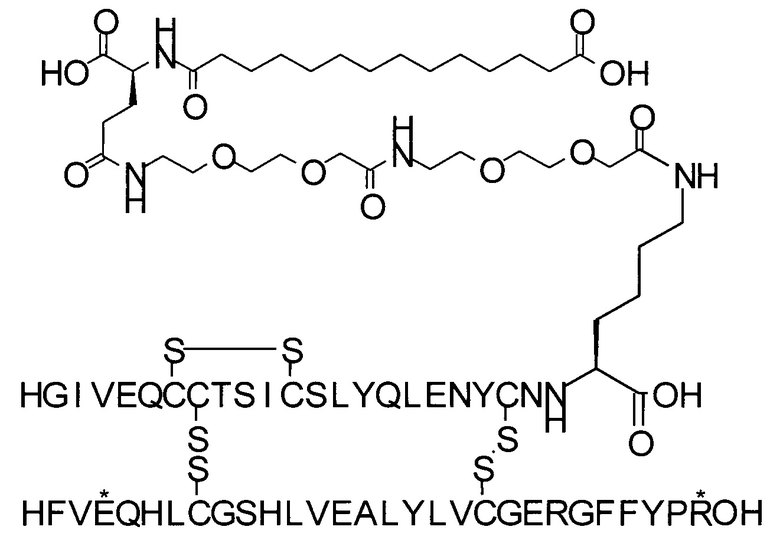
LC-MS (электроспрей): m/z = 1616,6 (М+4)/4. Рассчит.: 1617,1
Пример 6; Общая процедура (А)
A22K(N(eps)-гексадекандиоил-3х(gGlu-OEG)-gGlu), В3Е, desB27, B29R, desB30 человеческий инсулин;
Название IUPAC (OpenEye, стиль IUPAC): N{Alpha}([GluB3,ArgB29],des-ThrB27,ThrB30-инсулин(человеческий)-(А)-пептидил)-N{эпсилон}[(4S)-4-карбокси-4-[[2-[2-[2-[[(4S)-4-карбокси-4-[[2-[2-[2-[[(4S)-4-карбокси-4-[[2-[2-[2-[[(4S)-4-карбокси-4-(15-карбоксипентадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]бутаноил]амино]этокси]этокси]ацетил]амино]бутаноил]амино]этокси]этокси]ацетил]амино]бутаноил]Lys, (В)-пептид.
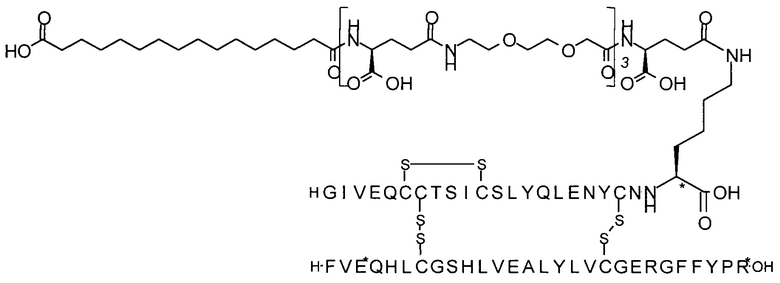
LC-MS (электроспрей): m/z = 1749,9 (М+4)/4. Рассчит.: 1750,3
Пример 7; Общая процедура (А)
A22K(N(eps)-тетрадекандиоил-4xgGlu), B3Q, desB27, B29R, desB30 человеческий инсулин;
Название IUPAC (OpenEye, стиль IUPAC): N{Alpha}([GlnB3,ArgB29],des-ThrB27,ThrB30-инсулин(человеческий)-(А)-пептидил)-N{эпсилон}[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]бутаноил]амино]бутаноил]амино]бутаноил]Lys, (В)-пептид.
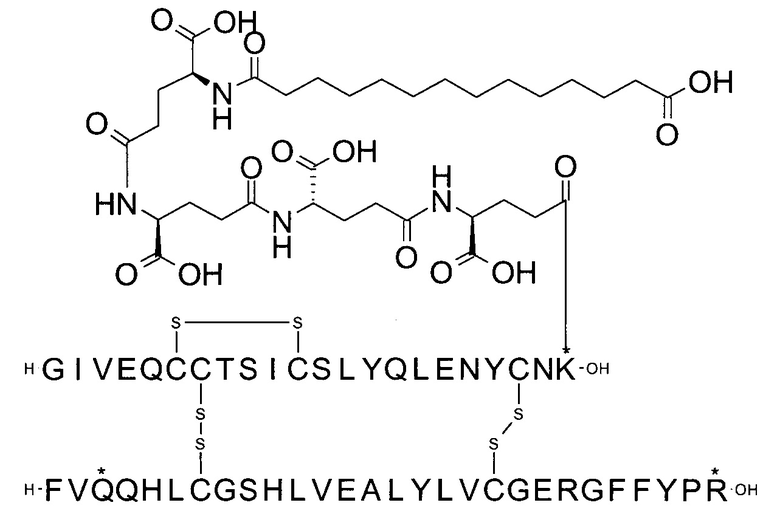
LC-MS (электроспрей): m/z = 1634,2 (M+4)/4. Рассчит.: 1633,1
Пример 8; Общая процедура (А)
A22K(N(eps)-гексадекандиоил-gGlu-2xOEG, B3Q, desB27, B29R, desB30 человеческий инсулин:
Название IUPAC (OpenEye, стиль IUPAC): N{Alpha}([GlnB3,ArgB29],des-ThrB27,ThrB30-инсулин(человеческий)-(А)-пептидил)-N{эпсилон}[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(15-карбоксипентадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]Lys, (B)-пептид.
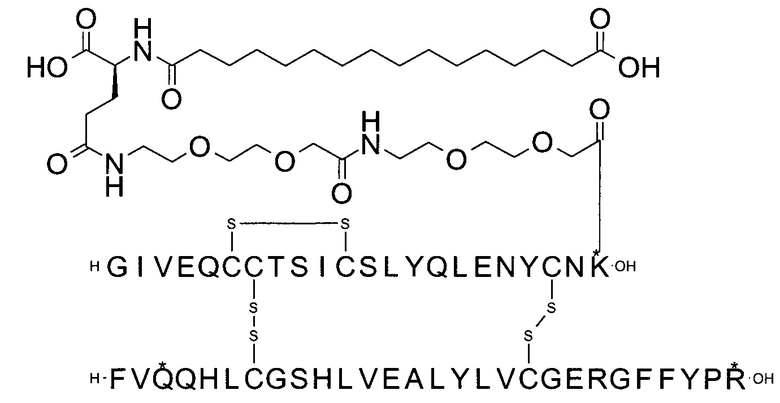
LC-MS (электроспрей): m/z = 1616,6 (М+4)/4. Рассчит.: 1615,8.
Пример 9; Общая процедура (А)
A22K(N(eps)-гексадекандиоил-3х(gGlu-OEG)-gGlu), B3Q, desB27, B29R, desB30 человеческий инсулин:
Название IUPAC (OpenEye, стиль IUPAC): N{Alpha}([GlnB3,ArgB29],des-ThrB27,ThrB30-инсулин(человеческий)-(А)-пептидил)-N{эпсилон}[(4S)-4-карбокси-4-[[2-[2-[2-[[(4S)-4-карбокси-4-[[2-[2-[2-[[(4S)-4-карбокси-4-[[2-[2-[2-[[(4S)-4-карбокси-4-(15-карбоксипентадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]бутаноил]амино]этокси]этокси]ацетил]амино]бутаноил]амино]этокси]этокси]ацетил]амино]бутаноил]Lys, (В)-пептид.

LC-MS (электроспрей): m/z = 1749,8 (М+4)/4. Рассчит.: 1748,5
Пример 10; Общая процедура (А)
A22K(N(eps)-тетрадекандиоил-2xgGlu), desB27, B29R, desB30 человеческий инсулин:
Название IUPAC (OpenEye, стиль IUPAC): N{Alpha}([ArgB29],des-ThrB27,ThrB30-инсулин(человеческий)-(А)-пептидил)-N{эпсилон}[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]бутаноил]Lys, (В)-пептид.
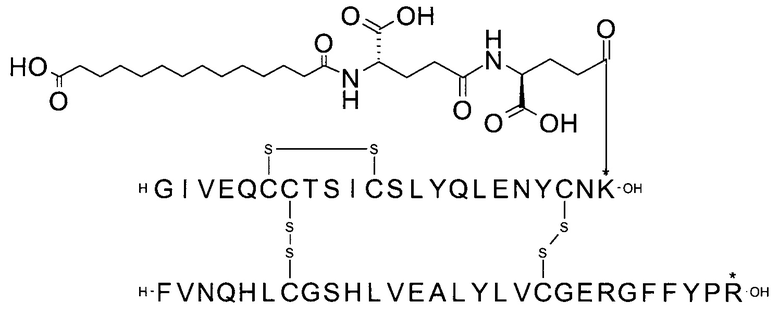
LC-MS (электроспрей): m/z = 1565,6 (М+4)/4. Рассчит.: 1566,1
Пример 11; Общая процедура (А)
A22K(N(eps)-гексадекандиоил-4xgGlu), desB27, B29R, desB30 человеческий инсулин;
Название IUPAC (OpenEye, стиль IUPAC): N{Alpha}([ArgB29],des-ThrB27,ThrB30-инсулин(человеческий)-(А)-пептидил)-N{эпсилон}[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-(15-карбоксипентадеканоиламино)бутаноил]амино]бутаноил]амино]бутаноил]амино]бутаноил]Lys, (В)-пептид.
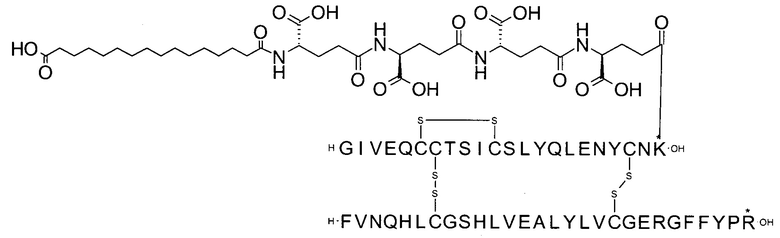
LC-MS (электроспрей): m/z = 1637,4 (М+4)/4. Рассчит.: 1636,6
Пример 12; Общая процедура (А)
A22K(N(eps)-гексадекандиоил-gGlu-2xOEG), desB27, B29R, desB30 человеческий инсулин;
Название IUPAC (OpenEye, стиль IUPAC): N{Alpha}([ArgB29],des-ThrB27,ThrB30-инсулин(человеческий)-(А)-пептидил)-N{эпсилон}[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(15-карбоксипентадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]Lys, (B)-пептид.
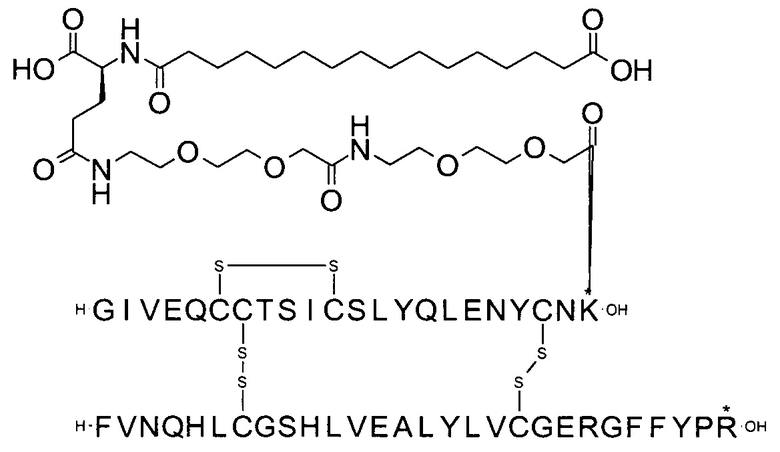
LC-MS (электроспрей): m/z = 1613,2 (М+4)/4. Рассчит.: 1613,4
Пример 13; Общая процедура (А)
A22K(N(eps)-гексадекандиоил-3x(gGlu-OEG)-gGlu), desB27, B29R, desB30 человеческий инсулин;
Название IUPAC (OpenEye, стиль IUPAC): N{Alpha}([ArgB29],des-ThrB27,ThrB30-инсулин(человеческий)-(А)-пептидил)-N{эпсилон}[(4S)-4-карбокси-4-[[2-[2-[2-[[(4S)-4-карбокси-4-[[2-[2-[2-[[(4S)-4-карбокси-4-[[2-[2-[2-[[(4S)-4-карбокси-4-(15-карбоксипентадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]-бутаноил]амино]этокси]этокси]ацетил]амино]бутаноил]амино]этокси]этокси]-ацетил]амино]бутаноил]Lys, (В)-пептид.
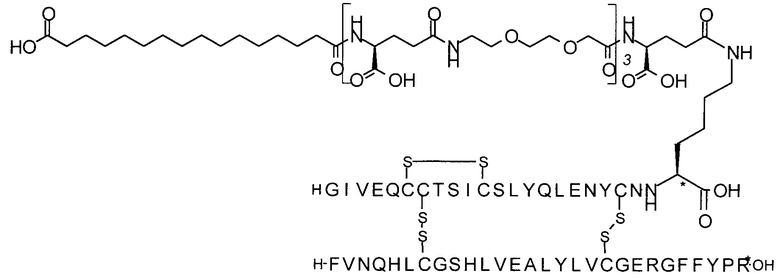
LC-MS (электроспрей): m/z = 1746,4 (М+4)/4. Рассчит.: 1746,5.
Пример 14; Общая процедура (А)
A22K(N(eps)-тетрадекандиоил-gGlu), desB27, B29R, desB30 человеческий инсулин;
Название IUPAC (OpenEye, стиль IUPAC): N{Alpha}([ArgB29],des-ThrB27,ThrB30-инсулин(человеческий)-(A)-пептидил)-N{эпсилон}[(4S)-4-карбокси-4-(13-карбокситридеканоиламино) бутаноил]Lys, (В)-пептид.
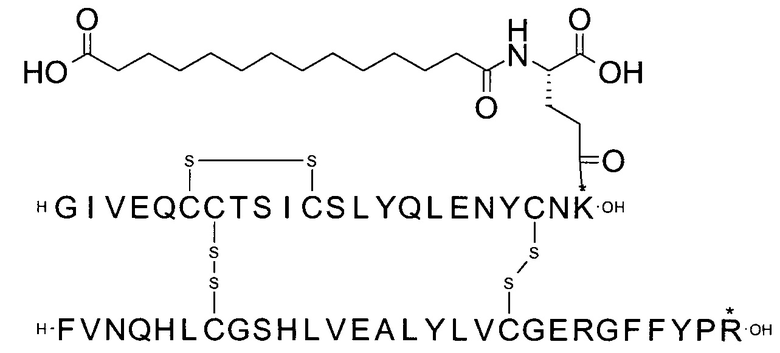
LC-MS (электроспрей): m/z = 1533,2 (М+4)/4. Рассчит.: 1533,8
Пример 15; Общая процедура (А)
A22K(N(eps)-тетрадекандиоил-gGlu-2xOEG, В3Е, desB27, B29R, desB30 человеческий инсулин;
Название IUPAC (OpenEye, стиль IUPAC): N{Alpha}([GluB3,ArgB29],des-ThrB27,ThrB30-инсулин(человеческий)-(А)-пептидил)-N{эпсилон}[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]этокси]этокси]-ацетил]амино]этокси]этокси]ацетил]Lys, (В)-пептид.
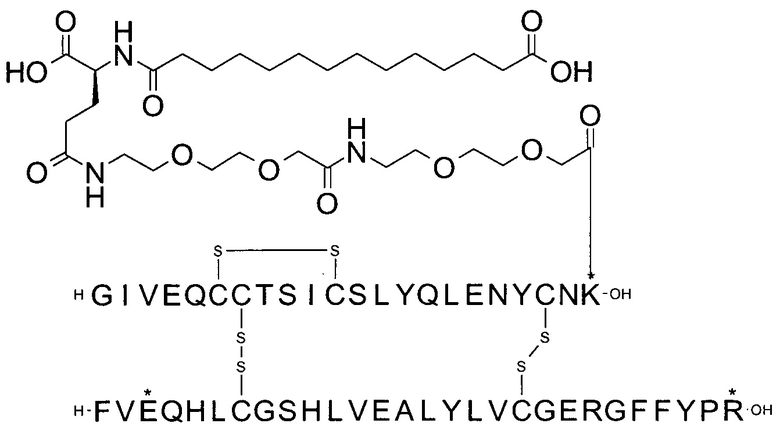
LC-MS (электроспрей): m/z = 1610,7 (М+4)/4. Рассчит.: 1610,1
Пример 16; Общая процедура (А)
A22K(N(eps)-тетрадекандиоил-gGlu-2xOEG), B3Q, desB27, B29R, desB30 человеческий инсулин;
Название IUPAC (OpenEye, стиль IUPAC): N{Alpha}([GlnB3,ArgB29],des-ThrB27,ThrB30-инсулин(человеческий)-(А)-пептидил)-N{эпсилон}[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]этокси]этокси]-ацетил]амино]этокси]этокси]ацетил]Lys, (В)-пептид.
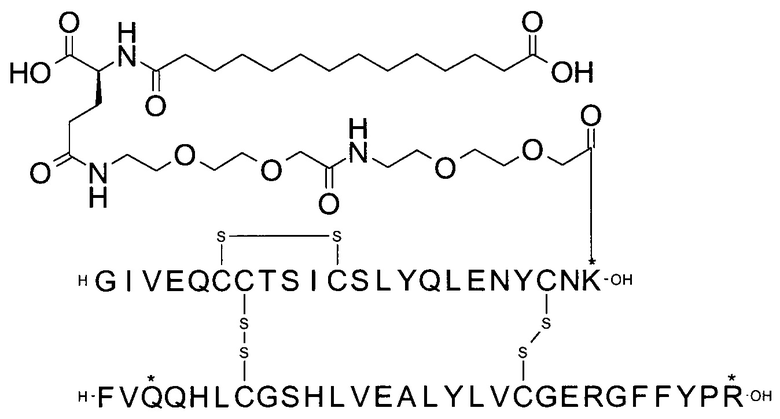
LC-MS (электроспрей): m/z = 1609,7 (М+4)/4. Рассчит.: 1609,9
Пример 17; Общая процедура (А)
A22K(N(eps)-тетрадекандиоил-2xOEG), desB27, B29R, desB30 человеческий инсулин;
Название IUPAC (OpenEye, стиль IUPAC): N{Alpha}([ArgB29],des-ThrB27,ThrB30-инсулин(человеческий)-(А)-пептидил)-N{эпсилон}[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]этокси]этокси]-ацетил]амино]этокси]этокси]ацетил]Lys, (В)-пептид.
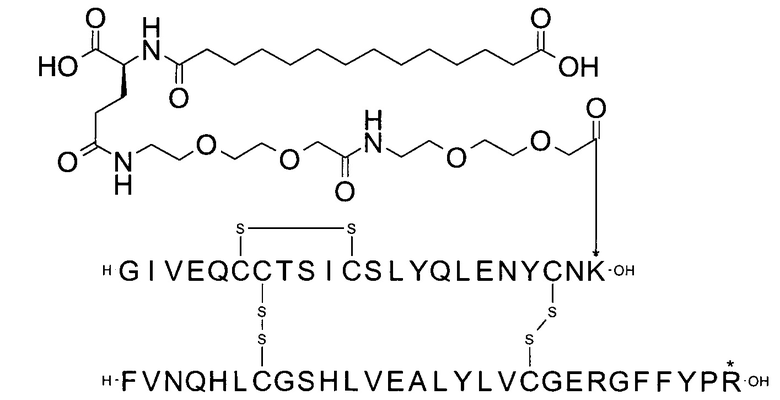
LC-MS (электроспрей): m/z = 1606,3 (М+4)/4. Рассчит.: 1606,4
Пример 18; Общая процедура (А)
A22K(N(eps)-гексадекандиоил-4xgGlu), B3Q, desB27, B29R, desB30 человеческий инсулин;
Название IUPAC (OpenEye, стиль IUPAC): N{Alpha}([GlnB3,ArgB29],des-ThrB27,ThrB30-инсулин(человеческий)-(А)-пептидил)-N{эпсилон}[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-(15-карбоксипента-деканоиламино)бутаноил]амино]бутаноил]амино]бутаноил]амино]бутаноил]Lys, (В)-пептид.
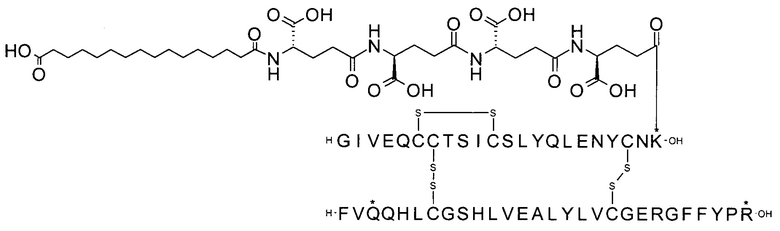
LC-MS (электроспрей): m/z = 1640,9 (М+4)/4. Рассчит.: 1641,1
Пример 19; Общая процедура (А)
A22K(N(eps)-пентадекандиоил-4xgGlu), В3Е, desB27, B29R, desB30 человеческий инсулин;
Название IUPAC (OpenEye, стиль IUPAC): N{Alpha}([GluB3,ArgB29],des-ThrB27,ThrB30-инсулин(человеческий)-(А)-пептидил)-N{эпсилон}[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-(14-карбокситетрадеканоиламино)бутаноил]амино]бутаноил]амино]бутаноил]амино]бутаноил]Lys, (В)-пептид.
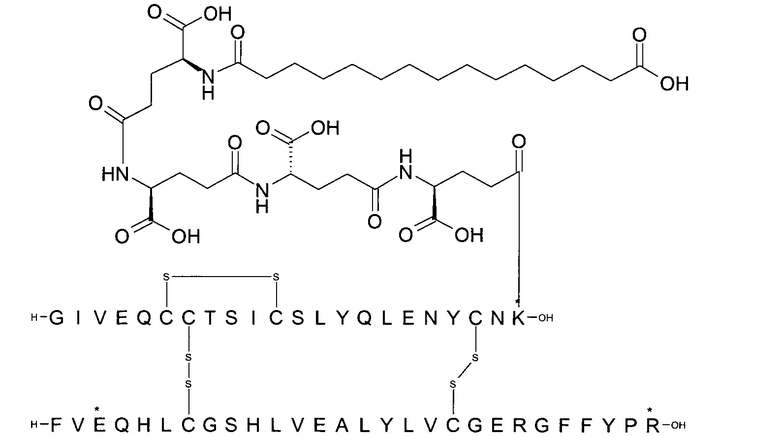
LC-MS (электроспрей): m/z = 1637,63 (М+4)/4. Рассчит.: 1636,76
Пример 20; Общая процедура (А)
A22K(N(eps)-тетрадекандиоил-4xgGlu-2xOEG, desB27, B29R, desB30 человеческий инсулин;
Название IUPAC (OpenEye, стиль IUPAC): N{Alpha}([ArgB29],des-ThrB27,ThrB30-инсулин(человеческий)-(А)-пептидил)-N{эпсилон}[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]бутаноил]амино]бутаноил]амино]-бутаноил]амино]этокси]этокси]ацетил]амино]этокси]-этокси]ацетил]Lys, (В)-пептид.
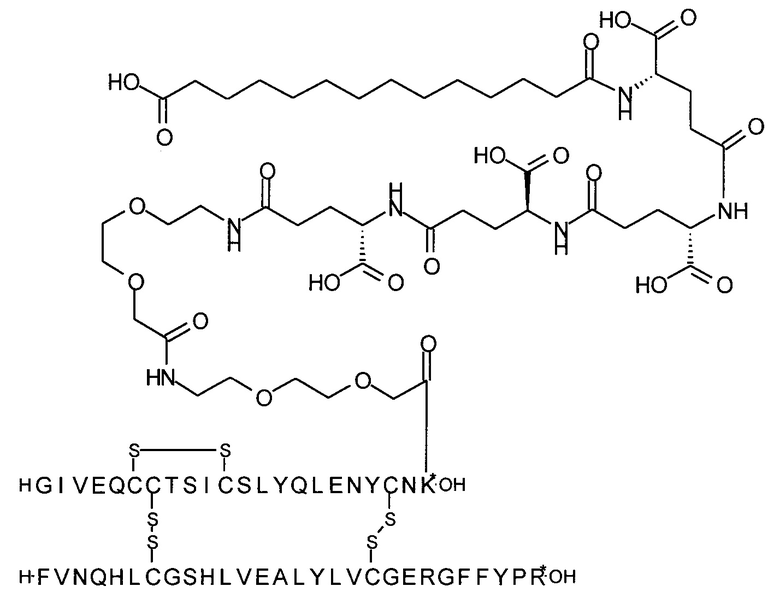
LC-MS (электроспрей): m/z = 1703,0 (M+4)/4. Рассчит.: 1703,2
Пример 21; Общая процедура (А)
A22K(N(eps)-тетрадекандиоил-4xgGlu-2xOEG, В3Е, desB27, B29R, desB30 человеческий инсулин:
Название IUPAC (OpenEye, стиль IUPAC): N{Alpha}([GluB3,ArgB29],des-ThrB27,ThrB30-инсулин(человеческий)-(А)-пептидил)-N{эпсилон}[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]бутаноил]амино]бутаноил]амино]-бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]Lys, (B)-пептид.

LC-MS (электроспрей): m/z = 1706,6 (M+4)/4. Рассчит.: 1707,0
Пример 22; Общая процедура (А)
А14Е, A22K(N(eps)-тетрадекандиоил-gGlu-2xOEG), В3Е, desB27, B29R, desB30 человеческий инсулин:
Название IUPAC (OpenEye, стиль IUPAC): N{Alpha}([GluA14,GluB3,ArgB29],des-ThrB27,ThrB30-инсулин(человеческий)-(А)-пептидил)-N{эпсилон}[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоил-амино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]Lys, (B)-пептид.
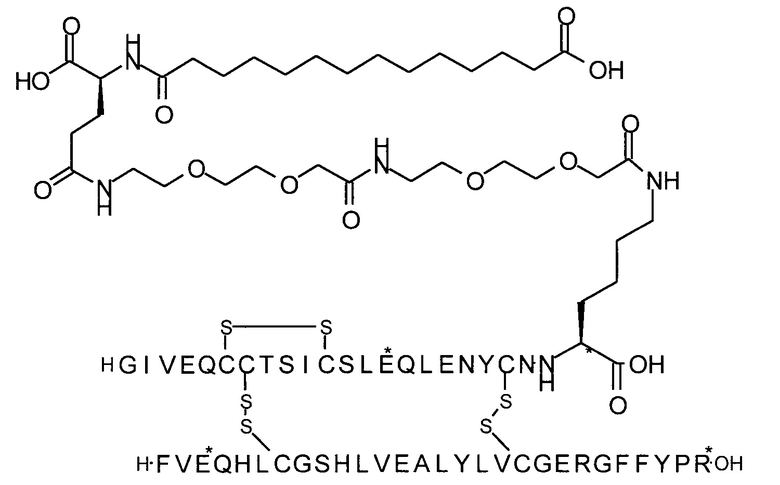
LC-MS (электроспрей): m/z = 1601,9 (M+4)/4. Рассчит.: 1601,6
Пример 23; Общая процедура (А)
А14Е, A22K(N(eps)-тетрадекандиоил-4xgGlu), В3Е, desB27, B29R, desB30 человеческий инсулин:
Название IUPAC (OpenEye, стиль IUPAC):
N{Alpha}([GluA14,GluB3,ArgB29],des-ThrB27,ThrB30-инсулин(человеческий)-(А)-пептидил)-N{эпсилон}[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]бутаноил]амино]-бутаноил]амино]бутаноил]Lys, (B)-пептид.
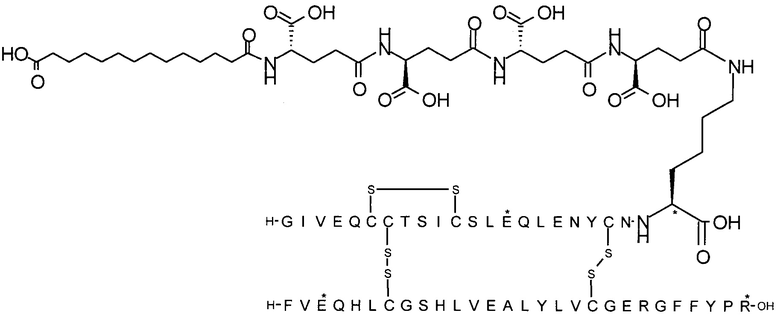
LC-MS (электроспрей): m/z = 1625,9 (М+4)/4. Рассчит.: 1625,8
Пример 24; Общая процедура (А)
A22K(N(eps)-тетрадекандиоил-2xgGlu), В3Е, desB27, B29R, desB30 человеческий инсулин:
Название IUPAC (OpenEye, стиль IUPAC): N{Alpha}([GluB3,ArgB29],des-ThrB27,ThrB30-инсулин(человеческий)-(А)-пептидил)-N{эпсилон}[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-(13-карбокситридеканоил-амино)бутаноил]амино]бутаноил]Lys, (B)-пептид.
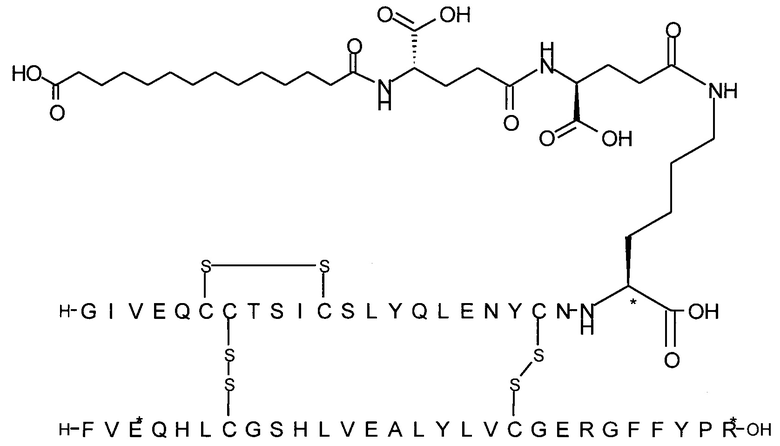
LC-MS (электроспрей): m/z = 1537,7 (M+4)/4. Рассчит.: 1537,5
Пример 25; Общая процедура (А)
A22K(N(eps)-тетрадекандиоил-gGlu), В3Е, desB27, B29R, desB30 человеческий инсулин:
Название IUPAC (OpenEye, стиль IUPAC): N{Alpha}([GluB3,ArgB29],des-ThrB27,ThrB30-инсулин(человеческий)-(А)-пептидил)-N{эпсилон}[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]Lys, (B)-пептид.
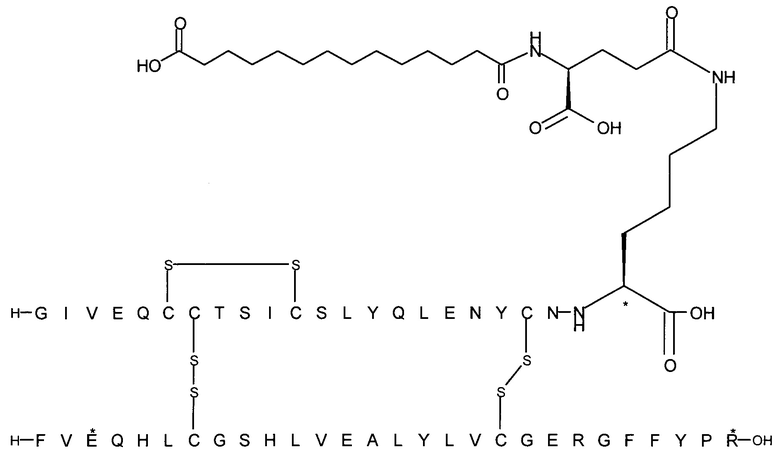
LC-MS (электроспрей): m/z = 1537,7 (М+4)/4. Рассчит.: 1537,5
Пример 26; Общая процедура (А)
A22K(N(eps)-тетрадекандиоил-3xgGlu), В3Е, desB27, B29R, desB30 человеческий инсулин;
Название IUPAC (OpenEye, стиль IUPAC): N{Alpha}([GluB3,ArgB29],des-ThrB27,ThrB30-инсулин(человеческий)-(А)-пептидил)-N{эпсилон}[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-(13-карбокси-тридеканоиламино)бутаноил]амино]бутаноил]амино]бутаноил]Lys, (В)-пептид.
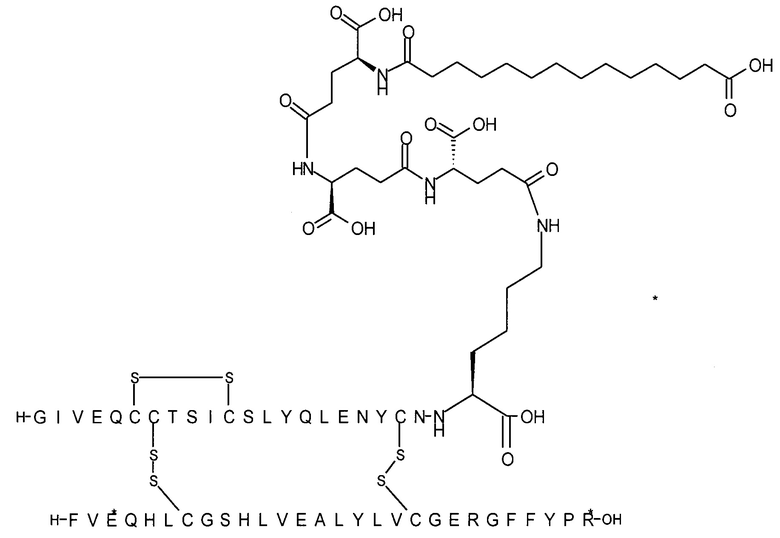
Этот аналог может быть получен в соответствии со способом, описанным в примере 1.
Пример 27; Аффинность к рецептору инсулина выбранных производных инсулина согласно данному изобретению, измеренная на солюбилизированных рецепторах
Относительную аффинность связывания аналогов инсулина согласно данному изобретению с человеческим рецептором инсулина (IR) определяли путем конкурентного связывания в анализе сцинтилляционной близости (SPA) (в соответствии с Glendorf Т et al. (2008) Biochemistry 47 4743-4751).
Вкратце, серии разведений стандарта человеческого инсулина и анализируемого аналога инсулина выполняли в 96-луночных планшетах Optiplates (Perkin-Elmer Life Sciences), а затем добавляли человеческий [125I-A14Y]-инсулин, мышиное анти-IR-антитело 83-7, солюбилизированный человеческий IR-A (полуочищенный путем хроматографии на агглютининах зародышей пшеницы из клеток почки детеныша хомяка (ВНК), сверхэкспрессирующих холорептор IR-A) и SPA-частицы (противомышиные поливинилтолуоловые SPA-частицы, GE Healthcare) в буфере для связывания, состоящем из 100 мМ HEPES (рН 7,8), 100 мМ NaCl, 10 мМ MgSO4 и 0,025% (об/об) Tween 20. Планшеты инкубировали при осторожном встряхивании в течение 22-24 ч при 22°С, центрифугировали при 2000 об/мин в течение 2 минут и подсчитывали на TopCount NXT (Perkin-Elmer Life Sciences).
Данные SPA анализировали в соответствии с четырехпараметрической логистической моделью ( А (1978) Biometrics 34 357-365), а аффинности связывания аналогов рассчитывали относительно аффинности, измеренной для стандарта человеческого инсулина в том же планшете.
А (1978) Biometrics 34 357-365), а аффинности связывания аналогов рассчитывали относительно аффинности, измеренной для стандарта человеческого инсулина в том же планшете.
Также использовали связанный анализ, в котором связывающий буфер содержит 1,5% HSA (вес/объем) (Sigma А1887) для того, чтобы имитировать более физиологические условия.
Аффинности к рецептору инсулина и другие данные in vitro выбранных аналогов инсулина согласно данному изобретению представлены в таблице 1, см. ниже.
Пример 28; аффинности к рецепторам инсулин и инсулиноподобного фактора роста 1 выбранных производных инсулина согласно данному изобретению, измеренные на связанных с мембраной рецепторах
Ассоциированный с мембраной человеческий IR и IGF-1R очищали из клеток ВНК, стабильно трансфицированных вектором pZem219B, содержащим вставку человеческого IR-A, IR-B или IGF-IR. Клетки ВНК собирали и гомогенизировали в ледяном буфере (25 мМ HEPES, рН 7,4, 25 мМ CaCl2 и 1 мМ MgCl2, 250 мг/л бацитрацина, 0,1 мМ Pefablock). Гомогенаты наносили на 41% (вес/объем) сахарозную подушку и центрифугировали в течение 75 мин при 95000 g при 4°С. Плазматические мембраны собирали, разводили 1:5 буфером (описанным выше) и снова центрифугировали в течение 45 мин при 40000 g при 4°С. Осадки ресуспендировали в минимальном объеме буфера и три раза пропускали через иглу (размер 23), а затем сохраняли при -80°С до использования.
Относительную аффинность связывания для любого из ассоциированных с мембранами человеческих IR-A, IR-B или IGF-IR определяли путем конкурентного связывания в установке SPA. IR-анализы проводили в двух повторах в 96-луночных планшетах Optiplates (Perkin-Elmer Life Sciences). Мембранный белок инкубировали при осторожном перемешивании в течение 150 минут при 25°С с 50 пМ человеческого [125I-A14Y]-инсулина в общем объеме 200 мкл буфера для анализа (50 мМ HEPES, 150 мМ NaCl, 5 мМ MgSO4, 0,01% Тритона Х-100, 0,1% (вес/объем) HSA (Sigma А1887), ингибиторы протеазы полностью без EDTA), 50 мкг PVT-микросфер, покрытых агглютинином зародышей пшеницы (WGA) - (GE Healthcare), и возрастающими концентрациями лиганда. Анализы завершали центрифугированием планшета при 2000 об/мин в течение 2 минут, и связанную радиоактивность количественно оценивали путем подсчета на TopCount NXT (Perkin-Elmer Life Sciences).
Анализы IGF-1R проводили по существу так же, как анализы связывания IR, за исключением того, что использовали ассоциированный с мембраной IGF-1R и 50 пМ человеческого [125I-Tyr31]-IGF-1. Данные SPA анализировали в соответствии с четырехпараметрической логистической моделью ( А (1978) Biometrics 34 357-365), и рассчитывали аффинности связывания анализируемых аналогов относительно аффинности, измеренной для стандарта человеческого инсулина в том же планшете.
А (1978) Biometrics 34 357-365), и рассчитывали аффинности связывания анализируемых аналогов относительно аффинности, измеренной для стандарта человеческого инсулина в том же планшете.
Данные связывания IR (изоформа А) и IGF-1R выбранных аналогов инсулина согласно данному изобретению приведены в таблице 1, см. ниже.
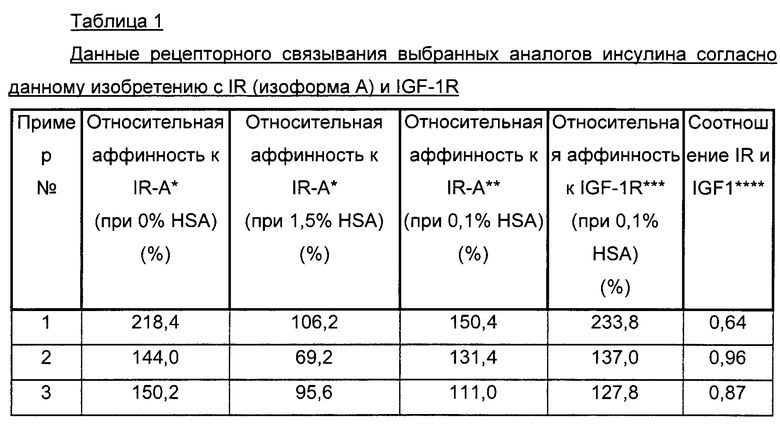
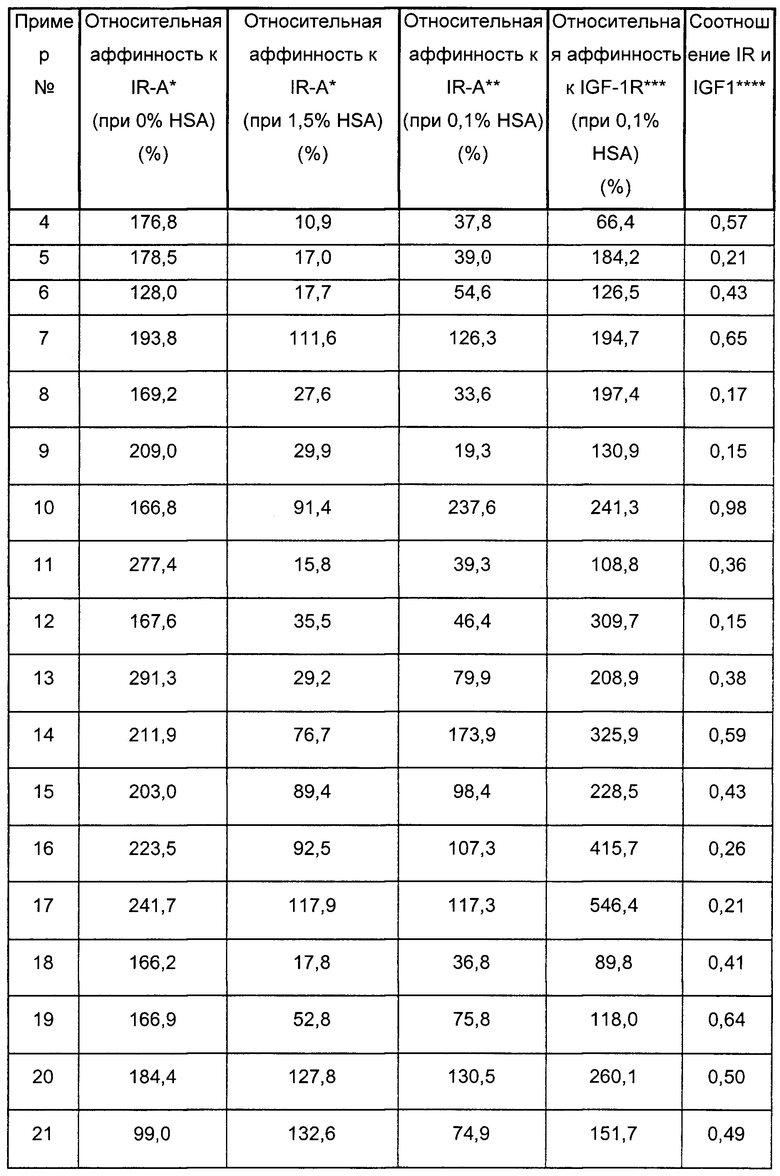
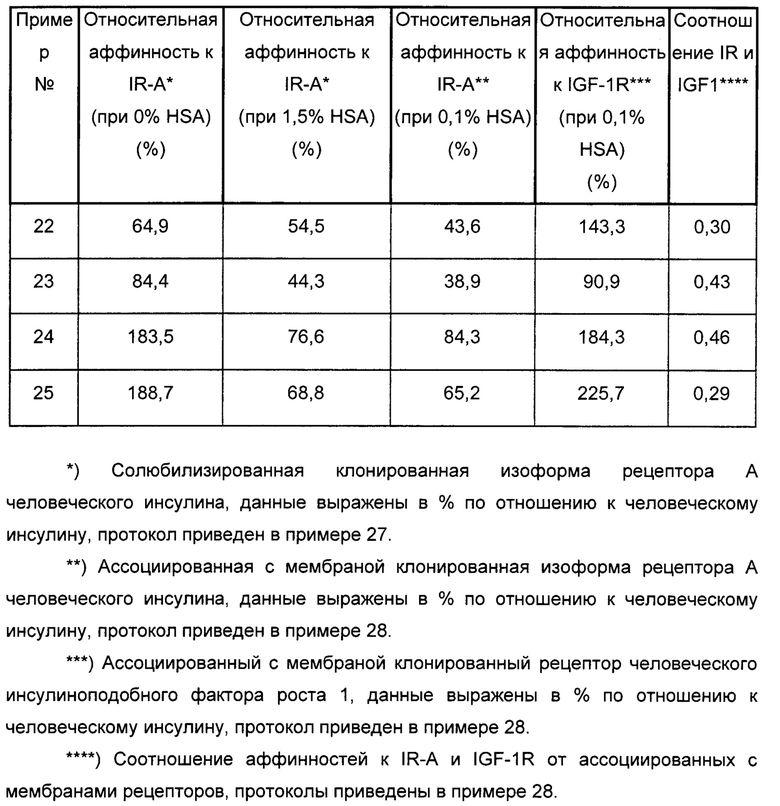
Пример 29; Равновесие "мономер-димер", проанализированное с помощью SEC-HPLC разведения
Серию разведений с SEC-HPLC (эксклюзионной HPLC) проводили для оценки равновесия "мономер-димер" бесцинкового инсулина. Вводя изменяющиеся объемы (2,5-80 мкл) 0,6 мМ анализируемого аналога инсулина на колонку Superose 12 10/300 GL и элюируя смесью 140 мМ NaCl, 10 мМ Tris, рН 7,7, со скоростью потока 0,8 мл/мин, образец разводили практически пропорционально объему введения. На основании сдвига времени удержания в зависимости от разбавления вычисляли два параметра: увеличение молекулярной массы (Mw-увеличение) и R-наклон.
R-наклон получали как наклон графика "время удержания в зависимости от логарифма объема введения", тогда как Mw-увеличение рассчитывали с помощью набора референсных образцов как увеличение кажущейся молекулярной массы между минимальным и максимальным объемом введения. Оба параметра отражают тенденцию аналога инсулина диссоциировать в ответ на разведение и, следовательно, отражают потенциал получения быстрой диссоциации мономеров при подкожном введении.
Результаты этих определений и таких же определений для аналогов инсулина предшествующего уровня техники представлены в таблицах 2-4, см. ниже.
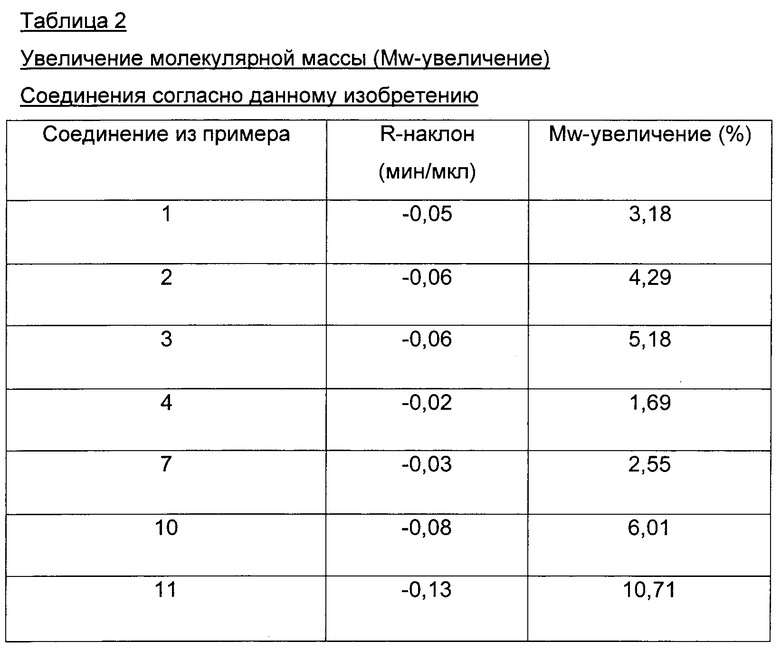

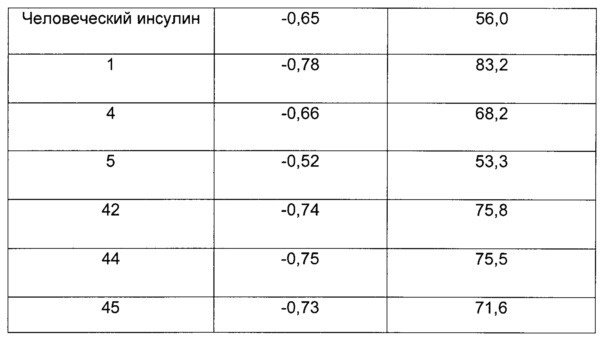
Указанные номера примеров представляют собой A22K-ацилированные аналоги без делеции остатка B27Thr (desB27), известные и описанные в предшествующем уровне техники (например, WO 2009/022013).

Указанные номера примеров представляют собой A22K-ацилированные аналоги без делеции остатка B27Thr (desB27), известные и описанные в предшествующем уровне техники (например, WO 2007/096431).
Вывод
Можно сделать вывод о том, что A22K-ацилированные инсулины согласно данному изобретению, будучи desB27-аналогами, гораздо более склонны к диссоциации в ответ на разведение и, таким образом, гораздо они более удобны для прандиального болюсного введения, чем аналогичные A22K-ацилированные аналоги (без делеции остатка B27Thr) предшествующего уровня техники. Можно также сделать вывод о том, что инсулины согласно данному изобретению в данном анализе напоминают инсулин аспарт (коммерчески доступный как NovoRapid® или NovoLog® (Novo Nordisk A/S), используемый в качестве прандиального инсулина) больше, чем человеческий инсулин (также используемый в качестве прандиального инсулина, но с более медленным профилем действия, чем инсулин аспарт), что подчеркивает улучшенные свойства производных согласно данному изобретению по сравнению с таковыми предшествующего уровня техники.
Все аналоги согласно данному изобретению имеют менее отрицательный R-наклон от -0,13 до -0,02 (таблица 2), таким образом, напоминающий инсулин аспарт (R-наклон -0,04; см. таблицу 3) гораздо больше, чем человеческий инсулин (R-наклон -0,65; см. таблицу 3). Напротив, все проанализированные подобные аналоги предшествующего уровня техники имеют R-наклон, напоминающий человеческий инсулин (от -0,52 до -0,78; таблицы 3 и 4). Следовательно, все аналоги согласно изобретению показали меньшее MW-увеличение, чем аналоги предшествующего уровня техники (до 10,7% по сравнению с 53-83%, соответственно (см. таблицы 2, 3 и 4).
Эти данные указывают на то, что соединения согласно данному изобретению являются более мономерными, чем аналогичные аналоги предшествующего уровня техники. В этом отношении соединения согласно данному изобретению напоминают инсулин аспарт, в то время как подобные аналоги предшествующего уровня техники напоминают человеческий инсулин.
Пример 30; Самоассоциация, измеренная путем малоуглового рассеяния рентгеновских лучей (SAXS, от англ. Small Angle X-ray Scattering)
Данные SAXS использовали для оценки степени самоассоциации анализируемых аналогов инсулина после подкожного введения. Данные SAXS собирали от бесцинковых составов, содержащих 0,6 мМ анализируемого аналога инсулина и 140 мМ NaCl при рН 7,4. Для каждого аналога оценивали относительные количества мономера, димера и более крупных молекул, используя тот факт, что профиль рассеяния SAXS имеет вклад интенсивности от всех отдельных компонентов в многокомпонентной смеси. Используя интенсивности (форм-факторы) от каждого из компонентов, можно оценить объемную долю вклада каждого из компонентов в смеси. Используют систему линейных уравнений с использованием алгоритма неотрицательных или неограниченных наименьших квадратов, чтобы минимизировать расхождение между экспериментальными и расчетными кривыми рассеяния. Форм-факторы вычисляются из кристаллических структур мономера, димера, гексамера и т.д. Объемные фракции выражают в процентах (%).
Среднюю молекулярную массу аппроксимируют с помощью референсного образца с известной концентрацией при условии, что отношение молекулярных масс идентично отношению рассеянной интенсивности под нулевым углом, I(0), нормированному по измеренным концентрациям.
Результаты, полученные от производных согласно изобретению и производных известного уровня техники, приведены в таблицах 5, 6 и 7 ниже.


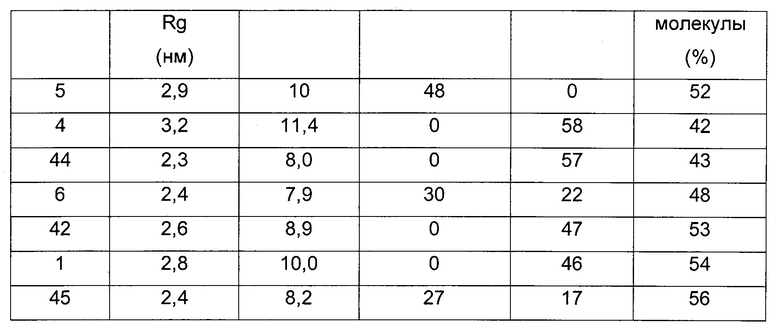
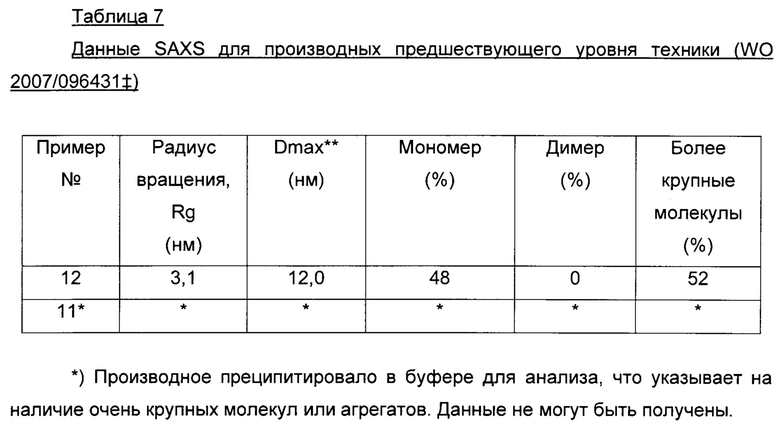
Из этих исследований можно сделать вывод о том, что производные согласно данному изобретению в условиях, имитирующих условия в подкожной клетчатке после введения, гораздо более склонны к диссоциации на мономеры, и, таким образом, могут быть абсорбированы намного быстрее после подкожного введения, чем аналоги предшествующего уровня техники. Диапазон содержания мономеров варьирует от 63 до 83% для аналогов согласно данному изобретению по сравнению с 0-48% для аналогов предшествующего уровня техники. Можно также сделать вывод о том, что для аналогов предшествующего уровня техники наибольшие наблюдаемые молекулярные частицы как крупнее по размеру (Rg и Dmax), так и найдены в больших количествах (42-62% по сравнению с 1-22% для аналогов согласно данному изобретению). Это подчеркивает полезность аналогов для прандиального применения по сравнению с аналогами предшествующего уровня техники.
Пример 31; Приготовление фармацевтических препаратов
Фармацевтические препараты согласно данному изобретению могут быть приготовлены в виде водного раствора. Водный раствор можно сделать изотоническим, например, с помощью хлорида натрия и/или глицерина. Кроме того, водная среда может содержать буферы и консерванты. Значение рН препарата доводят до требуемого значения, и оно может находиться в пределах от примерно 3 до примерно 8,5, от примерно 3 до примерно 5, или примерно 6,5, или примерно 7,4, или примерно 7,5 в зависимости от изоэлектрической точки, pI, аналога инсулина, о котором идет речь.
Приготовление бесцинковых составов инсулина
Бесцинковые аналоги инсулина растворяли в водном растворе, который в конечном составе содержал 0,6 мМ аналог инсулина, 16 мМ м-крезол, 16 мМ фенол, 7 мМ динатрия фосфат, соответствующие количества никотинамида и глицерина, и рН доводили до 7,3-7,5 (измеряли при комнатной температуре) с использованием 1 н соляной кислоты/1 н NaOH. Добавляли воду до конечного объема и стерилизовали раствор фильтрацией через фильтр с размером пор 0,2 мкм. Состав помещали в ампулы объемом 2 мл и герметизировали их с помощью обжимных крышек.
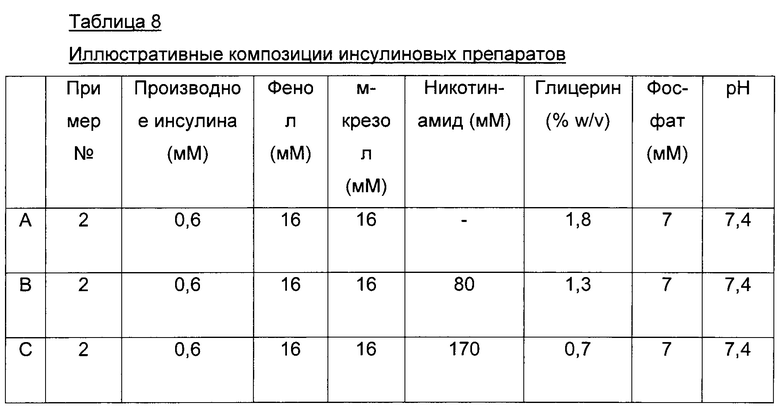
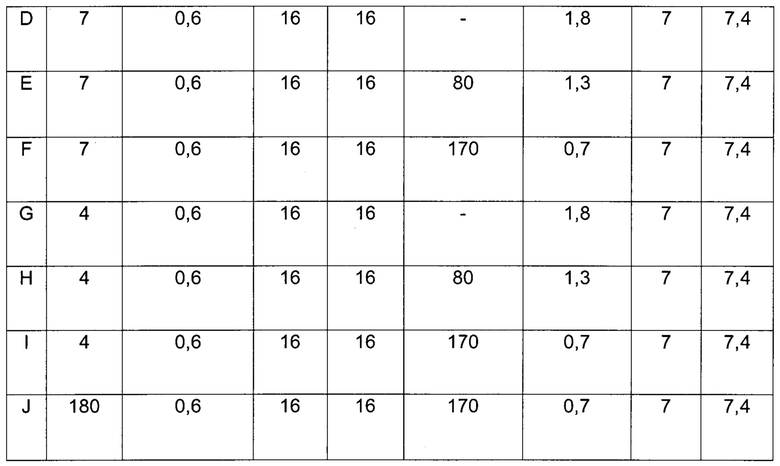
Пример 32; ThT-анализ образования фибрилл для оценки физической стабильности белковых составов
Низкая физическая стабильность пептида может привести к образованию амилоидных фибрилл, которые наблюдаются как хорошо упорядоченные нитевидные макромолекулярные структуры в образце, в конечном итоге приводящие к образованию геля. Тиофлавин Т (ThT) имеет ярко выраженный характер флуоресценции при связывании с фибриллами [Naiki et al. (1989) Anal. Biochem. 177 244-249; LeVine (1999) Methods. Enzymol. 309 274-284].
Формирование частично свернутого промежуточного продукта пептида предлагается в качестве общего механизма, инициирующего образование фибрилл. Некоторые из этих промежуточных продуктов образуют ядро, формируя матрицу, на которой могут собираться другие промежуточные продукты, и формирование фибрилл продолжается. Время задержки соответствует интервалу, в котором достраивается критическая масса ядра, а постоянная кажущаяся скорость является скоростью, с которой образуются сами фибриллы (фиг. 1).
Приготовление образцов
Перед каждым анализом готовили свежие образцы. Образцы каждой композиции смешивали с водным раствором ThT (0,1 мМ ThT) в объемном соотношении 990:10 и переносили в 96-луночный микротитровальный планшет (Packard Opti-Plate™-96, белый полистирол). Как правило, в один столбец лунок помещали четыре или восемь повторов каждого образца (соответствующих одному анализируемому условию). Планшет запечатывали с помощью Scotch 15 Pad (Qiagen).
Инкубация и измерение флуоресценции
Инкубацию при данной температуре, встряхивание и измерение флуоресцентного излучения ThT проводили во флуоресцентном планшетном ридере Fluoroskan Ascent FL или планшетном ридере Varioskan (Thermo Labsystems). Температуру доводили до 37°С. Орбитальный шейкер выставляли на 960 об/мин с амплитудой 1 мм во всех представленных данных. Измерение флуоресценции проводили, используя возбуждение через фильтр 444 нм и измерение излучения через фильтр 485 нм. Каждый прогон начинали с инкубации планшета при температуре анализа в течение 10 минут. Планшет измеряли каждые 20 минут в течение 45 часов. Между измерениями планшет встряхивали и нагревали, как описано.
Обработка данных
Графики зависимости флуоресценции от времени строили в Microsoft Excel, и время задержки оценивали как пересечение линейной аппроксимации зоны задержки и зоны образования фибрилл, как показано на фиг. 14А, 14В и 14С (иллюстрации 1А, 1В и 1С, соответственно). Увеличение времени задержки соответствует увеличению физической стабильности. Точки данных, как правило, представляют собой среднее значение от четырех или восьми образцов.
Результаты, полученные для A22K-ацилированных аналогов согласно данному изобретению и аналогичных A22K-ацилированный аналогов предшествующего уровня техники без делеции остатка B27Thr (desB27) приведены в таблице 8, см. ниже.

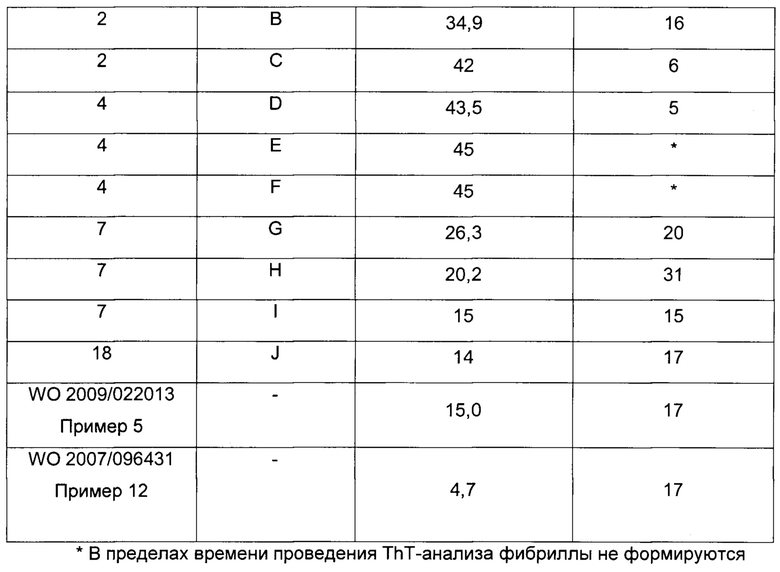
Сделан вывод о том, что A22K-ацилированные аналоги инсулина согласно данному изобретению демонстрируют улучшенную или аналогичную стабильность в отношении образования фибрилл (т.е. увеличенную физическую стабильность) в бесцинковом составе с добавленным никотинамидом и без него, аналогично аналогам предшествующего уровня техники. Это очень удивительно, так как данные SAXS и SEC-HPLC разведения показывают, что аналоги инсулина согласно данному изобретению имеют меньший размер (т.е. состоят из мономеров и димеров), что, согласно ожиданиям специалистов в данной области, должно приводить к снижению физической стабильности.
Пример 33; Анализ химической стабильности инсулина
Эксклюзионная хроматография
Используемые составы: см. пример 31
Количественную оценку высокомолекулярных белков (HMWP) и мономеров аналога инсулина проводили на колонке Waters Acquity ВЕН200 SEC (150 × 2,4 мм, №186005225) с элюентом, содержащим 55% (объем/объем) ацетонитрила, 0,05% TFA, при скорости потока 0,2 мл/мин и температуре колонки 40°С. Обнаружение проводили с помощью настраиваемого детектора абсорбции (Waters Acquity TUV) при 215 нм. Объем введения составлял 1,5 мкл как для 600 мкМ составов аналогов инсулина, так и для 600 мкМ стандарта человеческого инсулина. Препарат каждого аналога инкубировали при 5, 25 и 37°С в 2 мл ампулах. В определенные моменты времени измеряли HMWP и содержание препаратов. Результаты приведены в таблице 9, см. ниже.

Сделан вывод о том, что формирование высокомолекулярных белков (HMWP) при хранении бесцинкового состава при температуре 37°С гораздо меньше для производных инсулина согласно изобретению (формирование до 6,8% HMWP после 8-недельного хранения для инсулинов согласно изобретению из примеров 2, 4 и 7, соответственно), в то время как аналогичное производное инсулина предшествующего уровня техники приводит к формированию 29,1% HMWP. Далее сделан вывод о том, что производные инсулина согласно изобретению формируют низкие уровни HMWP в бесцинковом составе и в присутствии никотинамида при хранении при температуре 37°С.
Обращенно-фазовая хроматография (UPLC)
Определение примесей, связанных с инсулином, проводили на системе UPLC с использованием колонки Phenomenex Kinetex С18 размером 2,1 × 150 мм, размер частиц 1,7 мкм, размер пор 100 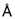 (Phenomenex часть №00F-4475-AN), со скоростью потока 0,3 мл/мин при 50°С и с УФ-детекцией при 215 нм. Элюирование проводили с подвижной фазой, включающей: А: 10% (объем/объем) ацетонитрил, 0,09 М диаммония гидрофосфат, рН 3,6, и В: 80% (объем/объем) ацетонитрил. Градиент: 0-7 минуты: линейное изменение от 15% В до 26% В, 7-34 минуты: линейное изменение до 40% В, 34-36 минуты: линейное изменение до 80% В для промывания колонки, затем возвращение к начальным условиям при 39 мин 15% В. Количество примесей определяли как площадь абсорбции, измеренную в процентах от общей площади абсорбции, определенной после элюирования консервантов. Каждый препарат аналога инкубировали при 5, 25 и 37°С в 2 мл ампулах. В определенные моменты времени в препаратах измеряли примеси, связанные с инсулином. Результаты приведены в таблице 10, см. ниже.
(Phenomenex часть №00F-4475-AN), со скоростью потока 0,3 мл/мин при 50°С и с УФ-детекцией при 215 нм. Элюирование проводили с подвижной фазой, включающей: А: 10% (объем/объем) ацетонитрил, 0,09 М диаммония гидрофосфат, рН 3,6, и В: 80% (объем/объем) ацетонитрил. Градиент: 0-7 минуты: линейное изменение от 15% В до 26% В, 7-34 минуты: линейное изменение до 40% В, 34-36 минуты: линейное изменение до 80% В для промывания колонки, затем возвращение к начальным условиям при 39 мин 15% В. Количество примесей определяли как площадь абсорбции, измеренную в процентах от общей площади абсорбции, определенной после элюирования консервантов. Каждый препарат аналога инкубировали при 5, 25 и 37°С в 2 мл ампулах. В определенные моменты времени в препаратах измеряли примеси, связанные с инсулином. Результаты приведены в таблице 10, см. ниже.
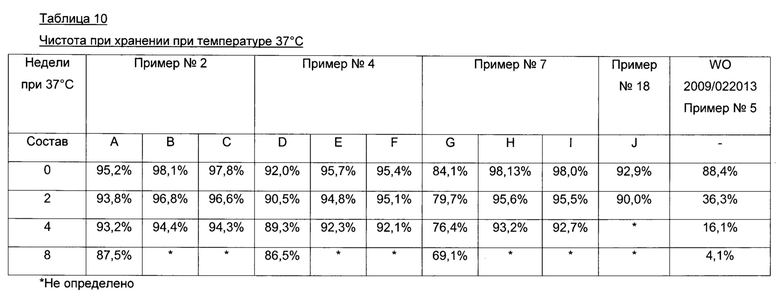
Сделан вывод о том, что производные инсулина согласно данному изобретению являются более стабильными в бесцинковом составе, чем аналогичный A22K-ацилированный аналога предшествующего уровня техники. Аналоги предшествующего уровня техники являются настолько нестабильными, что менее 5% (что соответствует потере чистоты в 84% точек) производного остаются интактными после 8 недель хранения при 37°С. Аналоги инсулина согласно данному изобретению (представленные соединениями из примеров 2, 4 и 7) имеют меньше, чем 7,7, 5,5 и 15% потерь чистоты, соответственно, через 8 недель хранения при 37°С. Также сделан вывод о том, что производные инсулина согласно изобретению являются стабильными в бесцинковом составе с добавлением никотинамида.
Пример 34; ФК/ФД-профили при подкожном введении свиньям LYD
Производные инсулина согласно данному изобретению могут быть проанализированы путем подкожного введения свиньям, например, по сравнению с инсулином аспартом (NovoRapid) в коммерческом составе или по сравнению с подобными A22K-ацилированными аналогами инсулина согласно предшествующему уровню техники в соответствии с этим протоколом. Производные могут быть проанализированы на предмет фармакокинетических и/или фармакодинамических параметров.
Используемые общие способы
Ультразвуковое исследование и маркировка области введения
Во время анестезии для постановки постоянных внутривенных катетеров свиней исследуют с помощью ультразвука и ультразвукового сканера Esaote модели "MyLabFive" и линейного зонда типа "LA435 6-18 MHz". Середину шеи между ухом и лопаткой, справа или слева (с противоположной стороны от катетера), площадью 2 × 2 см без подлежащей мышцы (что подходит для подкожной инъекции) определяют и помечают татуировкой.
График кормления
Свиньи не кормят (утром) до начала эксперимента.
Свиньи находятся в их обычных загонах в течение всего эксперимента и не получают анестезию. Свиней не кормят до 12-часового сбора крови, но оставляют свободный доступ к воде. После взятия 12-часового образца крови свиньям дают корм и яблоки.
Дозирование
Penfill устанавливают в NovoPen®4. Для каждой свиньи используют новую иглу. Стопор для иглы используется для обеспечения подкожного проникновения максимум на 5 мм ниже эпидермиса. Объем дозы (IU-объем) рассчитывают и отмечают для каждой свиньи.
Объем дозы (U) = ((вес × доза нмоль/кг)/конц нмоль/мл) × 100 Ед/мл
Свинье вводят дозу подкожно в боковую поверхность шеи справа или слева (противоположно катетеру), и иглу оставляют в подкожном слое как минимум на 10 секунд после введения, чтобы обеспечить сохранение соединения.
Лечение гипогликемии
После подкожного введения должен быть готов раствор глюкозы для внутривенного введения, чтобы предотвратить гипогликемию, т.е. от 4 до 5 шприцов (20 мл) заполняют стерильным 20% раствором глюкозы, готовым к использованию. Диагноз гипогликемии основывается на клинических симптомах и определении уровня глюкозы в крови глюкометром (Glucocard X-meter).
Лечение состоит в медленном внутривенном введении от 50 до 100 мл 20% раствора глюкозы (от 10 до 20 г глюкозы). Глюкозу дают частями в течение от 5 до 10 минут до достижения эффекта.
Взятие образцов крови
Проходимость яремных катетеров проверяют до эксперимента с помощью стерильного 0,9% NaCl без добавления 10 МЕ/мл гепарина.
До и после введения дозы образцы крови забирают через центральный венозный катетер в следующие моменты времени:
Перед введением дозы (-10, 0), через 3, 6, 9, 12, 15, 20, 30, 45, 60, 90, 120, 150, 180, 240, 300, 360, 420, 480, 540, 600 и 720 минут.
Образцы отбирают с помощью 3-ходового запорного крана. 4-5 мл крови отбирают и выбрасывают перед тем, как взять образец.
Образцы крови объемом 0,8 мл собирают в пробирки, покрытые EDTA, для анализов глюкозы и инсулина.
После каждого взятия образцов крови катетер промывают с помощью 5 мл стерильного 0,9% раствора NaCl без добавления 10 МЕ/мл гепарина.
Пробирку осторожно наклоняют минимум 10 раз, чтобы обеспечить достаточное смешивание крови с антикоагулянтом (EDTA), и через одну минуту помещают на влажный лед. Пробирки центрифугируют в течение 10 минут со скоростью 3000 об/мин при 4°С в течение 1 часа после взятия образцов. Образцы хранят на льду до пипетирования.
Необходима асептическая методика, чтобы избежать роста бактерий в катетере с повышенным риском свертывания крови.
Закрытие катетеров после эксперимента
Если забор крови не был выполнен с использованием асептической методики, то можно однократно внутривенно медленно ввести 1 мл Pentrexyl® (1 г ампициллина, растворенного в 10 мл 0,9% NaCl) на каждые 10 кг через катетер, который был использован для забора крови. После этой обработки катетер промывают с помощью 10 мл 0,9% NaCl.
Катетеры промывают с помощью 5 мл стерильного 0,9% NaCl с добавлением гепарина (10 МЕ/мл). Катетеры закрывают новым наконечником типа Луер-Лок с инъекционной латексной мембраной и вводят 1,0 мл TauroLockHep500 через мембрану для блокировки катетера.
Анализ образцов крови
Уровень глюкозы в плазме крови: 10 мкл плазмы переносят пипеткой в 500 мкл буферного раствора для измерения концентрации глюкозы в плазме в автоанализаторе BIOSEN.
Инсулин в плазме: 1 × 50 мкл плазмы переносят пипеткой в 0,65 мл пробирки Micronic® (установки ELISA/LOCI/SPA) для анализа либо путем ELISA, либо путем LC-MS.
Плазму хранят в замороженном виде при -20°С.
Пример 35; ФК/ФД-профили производного инсулина из примера 1 у свиней LYD
Согласно общей процедуре, описанной выше, следующие ФК- и ФД-профили были получены для производного инсулина из примера 1.
Используемые составы
Производное инсулина из примера 1, рН равен 7,4; 609 мкМ; 1,6% (вес/объем) глицерин; 30 мМ фенол (0 ионов Zn/гексамер).
Инсулин аспарт, коммерческий препарат, 600 мкМ; 1,6% (вес/объем) глицерин; 7 мМ фосфат; 10 мМ хлорид натрия; 300 мкМ ацетат цинка; 16 мМ фенол; 16 мМ м-крезол.
Результаты этих определений представлены в прилагаемых фиг. с 1 по 4 и в таблице 11, см. ниже.
Вывод
Сделан вывод о том, что производное инсулина из примера 1 в бесцинковом составе имеет ФК/ФД-профиль, очень похожий на профиль коммерческого препарата инсулин аспарт (NovoRapid®). Кроме того, среднее время удержания этого производного инсулина составляет 165 минут. Отсюда можно сделать вывод, что производное инсулина из примера 1 может использоваться в качестве быстродействующего (прандиального) инсулина.
Пример 27; ФК/ФД-профиль производного инсулина из примера 2 при подкожном введении свиньям LYD
Согласно общей процедуре, описанной выше, следующие ФК- и ФД-профили были получены для производного инсулина из примера 2.
Используемые составы
Производное инсулина из примера 2, рН равен 7,367; 607 мкМ; 1,6% (вес/объем) глицерин; 30 мМ фенол (0 ионов Zn/гексамер).
Инсулин аспарт, коммерческий препарат, 600 мкМ; 1,6% (вес/объем) глицерин; 7 мМ фосфат; 10 мМ хлорид натрия; 300 мкМ ацетат цинка; 16 мМ фенол; 16 мМ м-крезол.
Результаты этих определений представлены в прилагаемых фиг. с 4 по 5 и в таблице 12, см. ниже.

Вывод
Сделан вывод о том, что производное инсулина из примера 2 в бесцинковом составе имеет ФК/ФД-профиль, очень похожий на провиль инсулина аспарта. Кроме того, среднее время удержания этого производного инсулина составляет 111 минут, что незначительно отличается от NovoRapid® (инсулин аспарт). Отсюда можно сделать вывод, что производное инсулина из примера 2 может использоваться в качестве быстродействующего (прандиального) инсулина.
Пример 287; ФК/ФД-профиль производного инсулина из примера 11 при подкожном введении свиньям LYD
Согласно общей процедуре, описанной выше, следующие ФК- и ФД-профили были получены для производного инсулина из примера 11.
Используемые составы
Производное инсулина из примера 11, рН равенн 7,44; 689 мкМ; 1,6% (вес/объем) глицерин; 30 мМ фенол (0 ионов Zn/гексамер).
Результаты этих определений представлены в прилагаемых фиг. 6-7 и в таблице 13, см. ниже.
На фиг. 6 и 7 показан ФК- (фармакокинетический) профиль (концентрации инсулина стечением времени) инсулина из примера 11, приготовленного с 0 ионами цинка на 6 молекул инсулина (1 нмоль/кг), и полученные изменения в уровнях глюкозы в плазме, соответственно; 1 нмоль/кг.

Сделан вывод о том, что производное инсулина примера 11 в бесцинковом составе имеет ФК-профиль, расцениваемый как прандиальный инсулин. Кроме того, среднее время удержания этого производного инсулина составляет 334 минуты, что значительно короче, чем профиль, полученный для подобного (также) содержащего 1,16-гексадекандиовую кислоту производного инсулина предшествующего уровня техники, A22K(N(eps)-гексадекандиоил-gGlu-2xOEG), B29R, desB30 человеческого инсулина (WO 2009/022013, пример 45, (MRT равно 1287 минут), см. ниже. Можно сделать вывод о том, что производное инсулина из примера 11 может использоваться в качестве быстродействующего (прандиального) инсулина.
Пример 298; ФК/ФД-профиль производного инсулина из примера 4 при подкожном введении свиньям LYD
Согласно общей процедуре, описанной выше, следующие ФК- и ФД-профили были получены для производного инсулина из примера 4.
Используемые составы
Производное инсулина из примера 4, рН равен 7,43; 621 мкМ; 1,8% (вес/объем) глицерин; 16 мМ фенол (0 ионов Zn/гексамер), 16 мМ м-крезол, 10 мМ хлорид натрия (0 ионов Zn/гексамер).
Результаты этих определений представлены в прилагаемых фиг. с 8 по 9 и в таблице 14, см. ниже.

Сделан вывод о том, что производное инсулина из примера 4 в бесцинковом составе имеет ФК-профиль, расцениваемый как прандиальный инсулин. Кроме того, среднее время удержания этого производного инсулина составляет 160 минут, что значительно короче, чем профиль, полученный для подобного содержащего 1,16-гексадекандиовую кислоту производного инсулина предшествующего уровня техники, A22K(N(eps)-гексадекандиоил-gGlu-2xOEG), B29R, desB30 человеческого инсулина (WO 2009/022013, пример 45, (MRT равно 1287 минут), см. ниже. Можно сделать вывод о том, что производное инсулина из примера 4 может использоваться в качестве быстродействующего (прандиального) инсулина.
Пример 309; ФК/ФД-профиль производного инсулина предшествующего уровня техники при подкожном введении свиньям LYD
Согласно общей процедуре, описанной выше, следующие ФК- и ФД-профили были получены для производного инсулина предшествующего уровня техники, A22K(N(eps)-гексадекандиоил-gGlu-2xOEG), B29R, desB30 человеческого инсулина (WO 2009/022013, пример 45).
Используемые составы
Производное из WO 2009/022013, пример 45, 588 мкМ; 1,6% (вес/объем) глицерин; 30 мМ фенол; 7 мМ Tris, рН равен 7,4 (0 ионов Zn/гексамер), 1 нмоль/кг.
Результаты этих определений представлены в прилагаемых фиг. 10 и 11 ив таблице 15, см. ниже.
На фиг. 10 и 11 показан ФК- (фармакокинетический) профиль (концентрации инсулина с течением времени) инсулина предшествующего уровня техники, т.е. A22K(N(eps)-гексадекандиоил-gGlu-2xOEG), B29R, desB30 человеческого инсулина (WO 2009/022013, Пример 45), приготовленного с 0 ионами цинка на 6 молекул инсулина (1 нмоль/кг), и полученные изменения в уровнях глюкозы в плазме, соответственно (1 нмоль/кг).

Сделан вывод о том, что производное инсулина предшествующего уровня техники, WO 2009/022013, пример 45, в бесцинковом составе связано с затяжным хвостохранилищем, возможно, возникающим из-за замедленной абсорбции части подкожного депо. Концентрация данного инсулина в плазме через 24 часа (1440 минут) составляет 98 пМ. Кроме того, эффект снижения уровня глюкозы в крови распространяется по меньшей мере на 8 часов (480 минут). Среднее время удержания составляет 1287 минут, почти 1 день. Это делает данный инсулин предшествующего уровня техники не подходящим для прандиального применения.
Пример 40; ФК/ФД-профиль близкого аналога производного инсулина предшествующего уровня техники при подкожном введении свиньям LYD
Согласно общей процедуре, описанной выше, следующие ФК- и ФД-профили были получены для С14-двуосновного аналога A22K(N(eps)-тетрадекандиоил-gGlu-2xOEG), B29R, desB30 человеческого инсулина, представляющего уровень техники, описанного в WO 2009/022013 (см., в частности, A22K(N(eps)-гексадекандиоил-gGlu-2xOEG), B29R, desB30 человеческий инсулин).
Используемые составы
A22K(N(eps)-тетрадекандиоил-gGlu-2xOEG), B29R, desB30 человеческий инсулин, аналог 1,16-гексадекандиоил (С16-двуосновного) аналога из WO 2009/022013, пример 45, 588 мкМ; 1,6% (вес/объем) глицерин; 30 мМ фенол; 7 мМ Tris, рН равен 7,4 (0 ионов Zn/гексамер).
Результаты этих определений представлены на прилагаемой фиг. 9 и в таблице 16, см. ниже.
На фиг. 12 и 13 показан ФК- (фармакокинетический) профиль (концентрации инсулина с течением времени) С14-двуосновного аналога производного инсулина, представляющего уровень техники, т.е. A22K(N(eps)-гексадекандиоил-gGlu-2xOEG), B29R, desB30 человеческого инсулина (WO 2009/022013, пример 45), приготовленного с 0 ионами цинка на 6 молекул инсулина (1 нмоль/кг), и полученные изменения в уровнях глюкозы в плазме, соответственно (72 нмоль/животное).
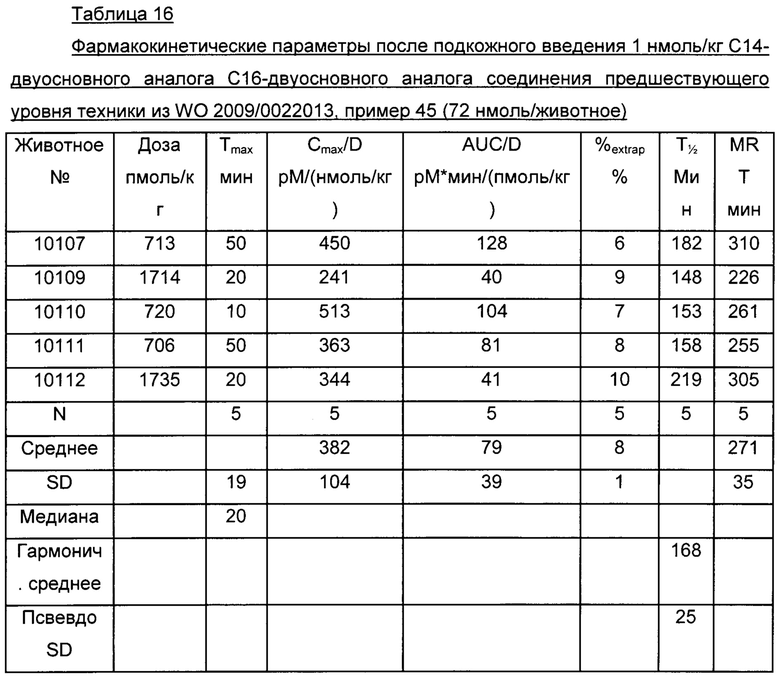
Вывод
Сделан вывод о том, что С14-двухосновная версия производного инсулина согласно известному уровню техники, из WO 2009/022013, пример 45, в бесцинковом составе связана с затяжным хвостохранилищем, возможно, возникающим из-за замедленной абсорбции части подкожного депо. Концентрация данного инсулина в плазме через 10 часов (600 минут) составляет 24 пМ. Среднее время удержания (MRT) этой С14-двухосновной кислоты - аналога составляет 271 минуту. Соответствующие результаты, полученные для С14-двухосновных кислот - аналогов из примеров 1 и 2 данного изобретения, составляют 165 и 111 минут, соответственно. Кроме того, эффект снижения уровня глюкозы в крови распространяется по меньшей мере на 11 часов (660 минут).
Это делает данный инсулин предшествующего уровня техники не подходящим для прандиального применения.
Пример 41; ФК/ФД-профиль производного инсулина из примера 2 при подкожном введении крысам с ожирением линии Zucker, сравнение профилей состава с 170 мМ никотинамидом и без никотинамида
Согласно общей процедуре, описанной выше, следующие ФК- и ФД-профили были получены для производного инсулина из примера 2.
Используемые составы
Производное инсулина из примера 2, рН равен 7,43; 621 мкМ; 1,8% (вес/объем) глицерин; 16 мМ фенол; 16 мМ м-крезол, 10 мМ хлорид натрия (0 ионов Zn/гексамер), с 170 мМ никотинамидом и без него.
Крысам вводили дозу 40 нмоль/кг.
Результаты этих определений представлены на прилагаемой фиг. 15.
Сделан вывод о том, что включение 170 мМ никотинамида в бесцинковый состав инсулина из примера 2, вводимый подкожно крысам Zucker, приводит к ФК-профилю, который является еще более быстро действующим, с более ранним Tmax. Таким образом, показано, что включение никотинамида в состав инсулина из примера 2 данного изобретения приводит к получению состава инсулина, который является еще более подходящим для прандиального применения.
Пример 42; ФК/ФД-профиль производного инсулина из примера 7 при подкожном введении крысам с ожирением линии Zucker, сравнение профилей состава с 170 мМ никотинамидом и без никотинамида
Согласно общей процедуре, описанной выше, следующие ФК- и ФД-профили были получены для производного инсулина из примера 7.
Используемые составы
Производное инсулина из примера 7, рН равен 7,39; 604 мкМ; 1,6% (вес/объем) глицерин; 16 мМ фенол; 16 мМ м-крезол, 7 мМ фосфат натрия, 10 мМ хлорид натрия (0 ионов Zn/гексамер), 170 мМ никотинамид.
Производное инсулина из примера 7, рН равен 7,39; 599 мкМ; 1,6% (вес/объем) глицерин; 16 мМ фенол; 16 мМ м-крезол, 7 мМ фосфат натрия, 10 мМ хлорид натрия (0 ионов Zn/гексамер).
Крысам вводили дозу 40 нмоль/кг.
Результаты этих определений представлены на прилагаемых фиг. 16-17.
Сделан вывод о том, что включение 170 мМ никотинамида в бесцинковый состав инсулина примера 7, вводимый подкожно крысам Zucker, приводит к ФК-профилю, который является еще более быстро действующим, с более ранним Tmax. Таким образом, показано, что включение никотинамида в состав инсулина из примера 7 данного изобретения приводит к получению состава инсулина, который является еще более подходящим для прандиального применения.
Пример 43; ФК/ФД-профиль производного инсулина из примера 16 при подкожном введении крысам с ожирением линии Zucker, сравнение профилей состава с 170 мМ никотинамидом и без никотинамида
Согласно общей процедуре, описанной выше, следующие ФК- и ФД-профили были получены для производного инсулина из примера 16.
Используемые составы
Производное инсулина из примера 16, рН равен 7,44; 599 мкМ; 1,6% (вес/объем) глицерин; 16 мМ фенол; 16 мМ м-крезол, 7 мМ фосфат натрия, 10 мМ хлорид натрия (0 ионов Zn/гексамер), 170 мМ никотинамид.
Производное инсулина из примера 16, рН равен 7,40; 581 мкМ; 1,6% (вес/объем) глицерин; 16 мМ фенол; 16 мМ м-крезол, 7 мМ фосфат натрия, 10 мМ хлорид натрия (0 ионов Zn/гексамер).
Крысам вводили дозу 40 нмоль/кг.
Результаты этих определений представлены на прилагаемых фиг. 18-19.
Сделан вывод о том, что включение 170 мМ никотинамида в бесцинковый состав инсулина из примера 16, вводимый подкожно крысам Zucker, приводит к ФК-профилю, который является еще более быстро действующим, с более ранним Tmax. Таким образом, показано, что включение никотинамида в состав инсулина из примера 16 данного изобретения приводит к получению состава инсулина, который является еще более подходящим для прандиального применения.
Пример 44; ФК/ФД-профиль производного инсулина из примера 4 при подкожном введении свиньям линии LYD, сравнение профилей состава с 170 мкМ никотинамидом и без никотинамида
Согласно общей процедуре, описанной выше, следующие ФК- и ФД-профили были получены для производного инсулина из примера 4.
Используемые составы
Производное инсулина из примера 4, рН равен 7,42; 0,604 мкМ производное инсулина; 16 мМ фенол; 16 мМ м-крезол, 2% (вес/объем) глицерин; 7 мМ фосфат (0 ионов Zn/гексамер).
Производное инсулина из примера 4, рН равен 7,43; 0,605 мкМ производное инсулина; 170 мМ никотинамид; 16 мМ фенол; 16 мМ м-крезол, 0,6% (вес/объем) глицерин; 7 мМ фосфат.
Свиньям вводили дозу 1 нмоль/кг.
Результаты этих определений представлены на прилагаемой фиг. 20.
Сделан вывод о том, что включение 170 мкМ никотинамида в бесцинковый состав инсулина примера 4, вводимый подкожно свиньям, приводит к ФК-профилю, который является еще более быстро действующим, с более ранним Tmax. Таким образом, показано, что включение никотинамида в состав инсулина из примера 4 данного изобретения приводит к получению состава инсулина, который является еще более подходящим для прандиального применения.
Пример 45; ФК/ФД-профиль производного инсулина из примера 2 при подкожном введении свиньям линии LYD, сравнение профилей состава с 170 мкМ никотинамидом и без никотинамида
Согласно общей процедуре, описанной выше, следующие ФК- и ФД-профили были получены для производного инсулина из примера 2.
Используемые составы
Производное инсулина из примера 2, рН равен 7,4; 608 мкМ; 2% (вес/объем) глицерин; 16 мМ фенол; 16 мМ м-крезол, 7 мМ натрия фосфат (0 ионов Zn/гексамер).
Производное инсулина из примера 2, рН равен 7,4; 614 мкМ; 170 мкМ никотинамид; 0,6% (вес/объем) глицерин; 16 мМ фенол; 16 мМ м-крезол, 7 мМ натрия фосфат (0 ионов Zn/гексамер).
Свиньям вводили дозу 1 нмоль/кг.
Результаты этих определений представлены на прилагаемой фиг. 21.
Сделан вывод о том, что включение 170 мкМ никотинамида в бесцинковый состав инсулина примера 2, вводимый подкожно свиньям, приводит к ФК-профилю, который является еще более быстро действующим, с более ранним Tmax. Таким образом, показано, что включение никотинамида в состав инсулина из примера 2 данного изобретения приводит к получению состава инсулина, который является еще более подходящим для прандиального применения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ИНСУЛИНА, СОДЕРЖАЩИЕ ДОПОЛНИТЕЛЬНЫЕ ДИСУЛЬФИДНЫЕ СВЯЗИ | 2011 |
|
RU2598273C2 |
| АНАЛОГИ ИНСУЛИНА С АЦИЛЬНОЙ И АЛКИЛЕНГЛИКОЛЕВОЙ ГРУППИРОВКОЙ | 2008 |
|
RU2514430C2 |
| СТАБИЛИЗИРОВАННЫЕ ПО ОТНОШЕНИЮ К ПРОТЕАЗАМ АЦИЛИРОВАННЫЕ АНАЛОГИ ИНСУЛИНА | 2009 |
|
RU2571857C2 |
| НОВОЕ ПРОИЗВОДНОЕ АНАЛОГА ИНСУЛИНА | 2014 |
|
RU2673185C2 |
| АНАЛОГИ ИНСУЛИНА, УСТОЙЧИВЫЕ К ПРОТЕАЗАМ | 2007 |
|
RU2524150C2 |
| НОВЫЕ АНАЛОГИ ГЛЮКАГОНА | 2012 |
|
RU2610175C2 |
| ДВАЖДЫ АЦИЛИРОВАННЫЕ ПРОИЗВОДНЫЕ GLP-1 | 2010 |
|
RU2559540C2 |
| АНАЛОГИ ЭФР(А) С ЗАМЕСТИТЕЛЯМИ - ЖИРНЫМИ КИСЛОТАМИ | 2017 |
|
RU2747877C2 |
| СТАБИЛЬНЫЕ СОВМЕСТНЫЕ АГОНИСТЫ РЕЦЕПТОРА ГЛЮКАГОНОПОДОБНОГО ПЕПТИДА-1/ГЛЮКАГОНА ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ | 2014 |
|
RU2683039C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИНСУЛИН | 2017 |
|
RU2832680C1 |
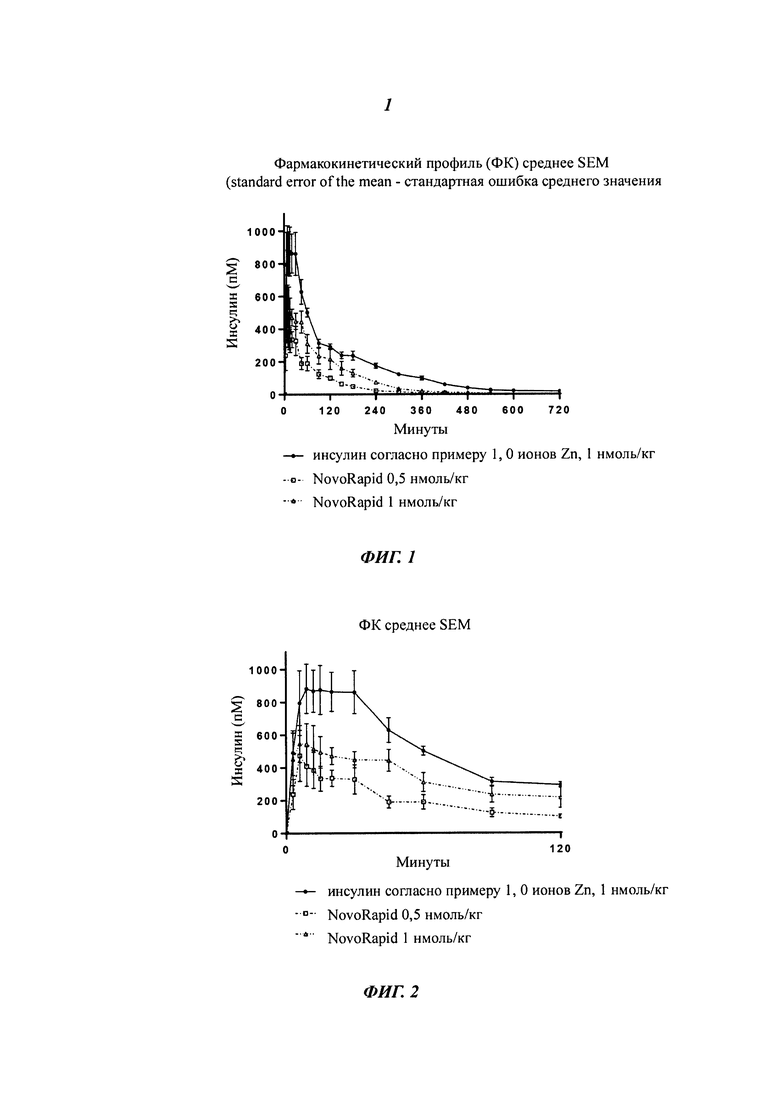
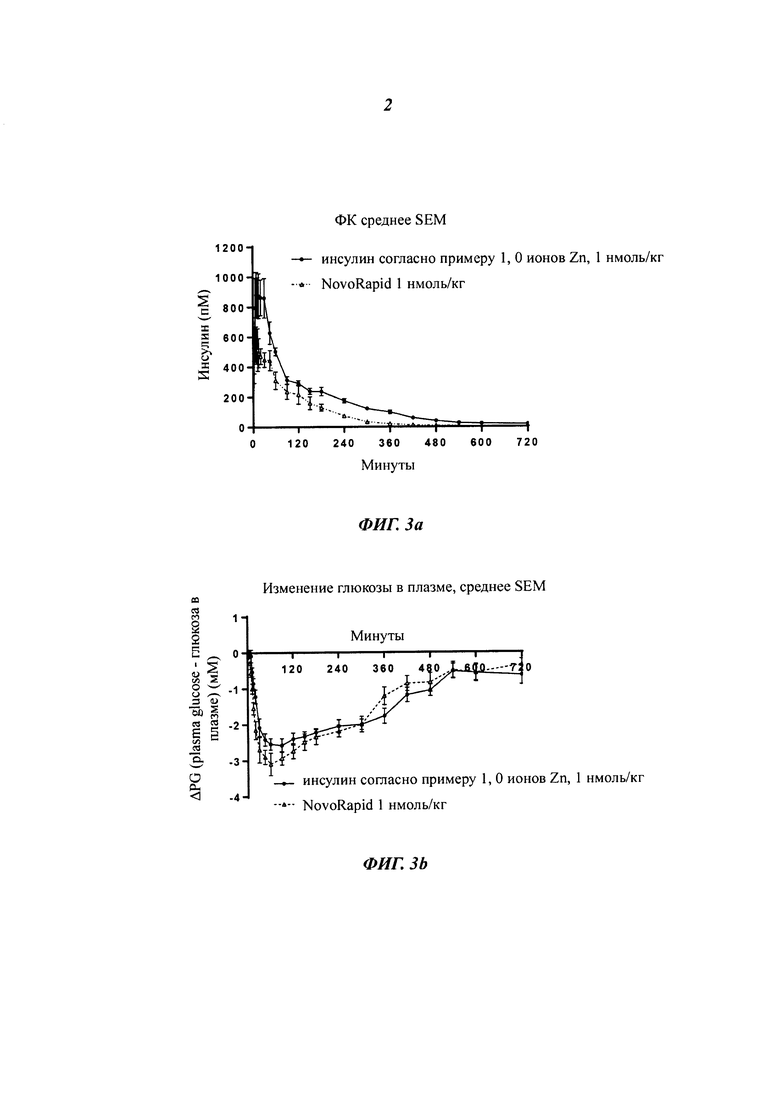

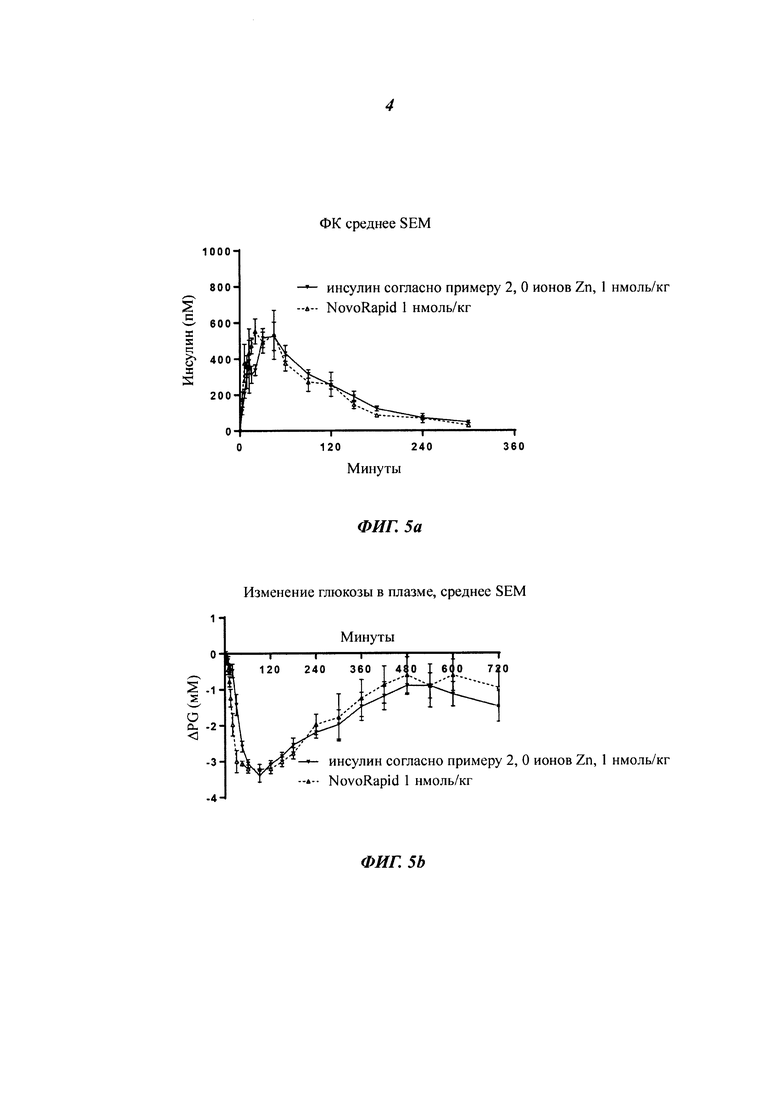
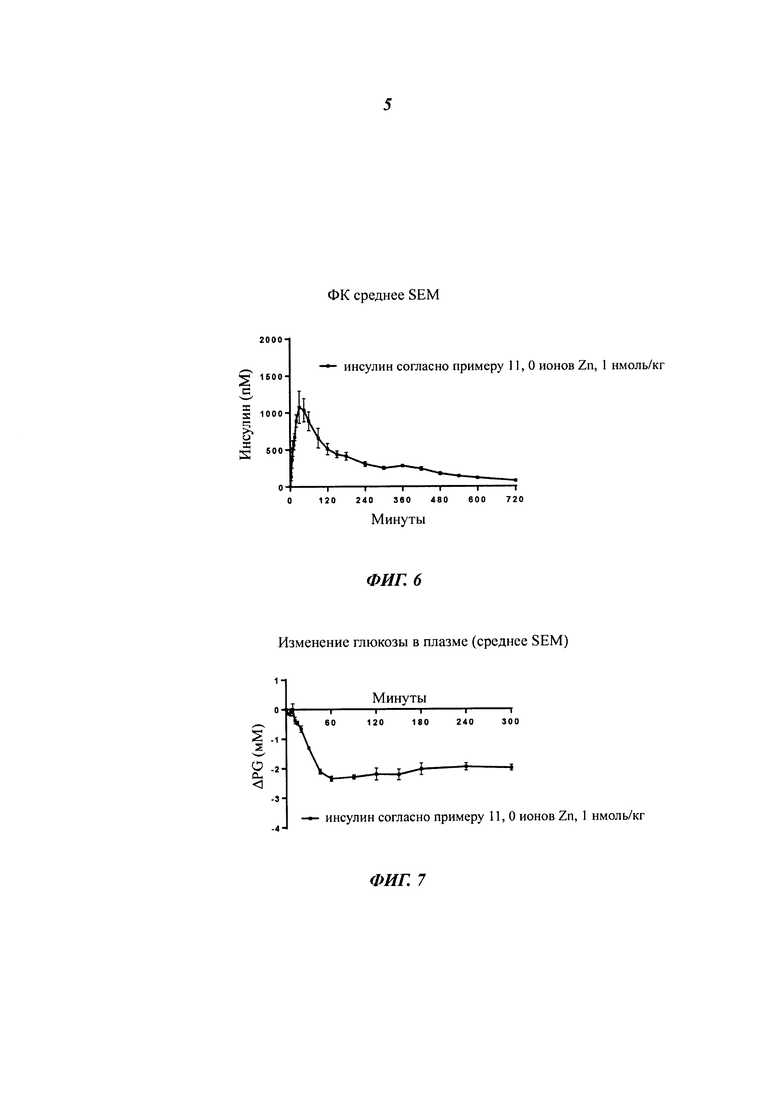

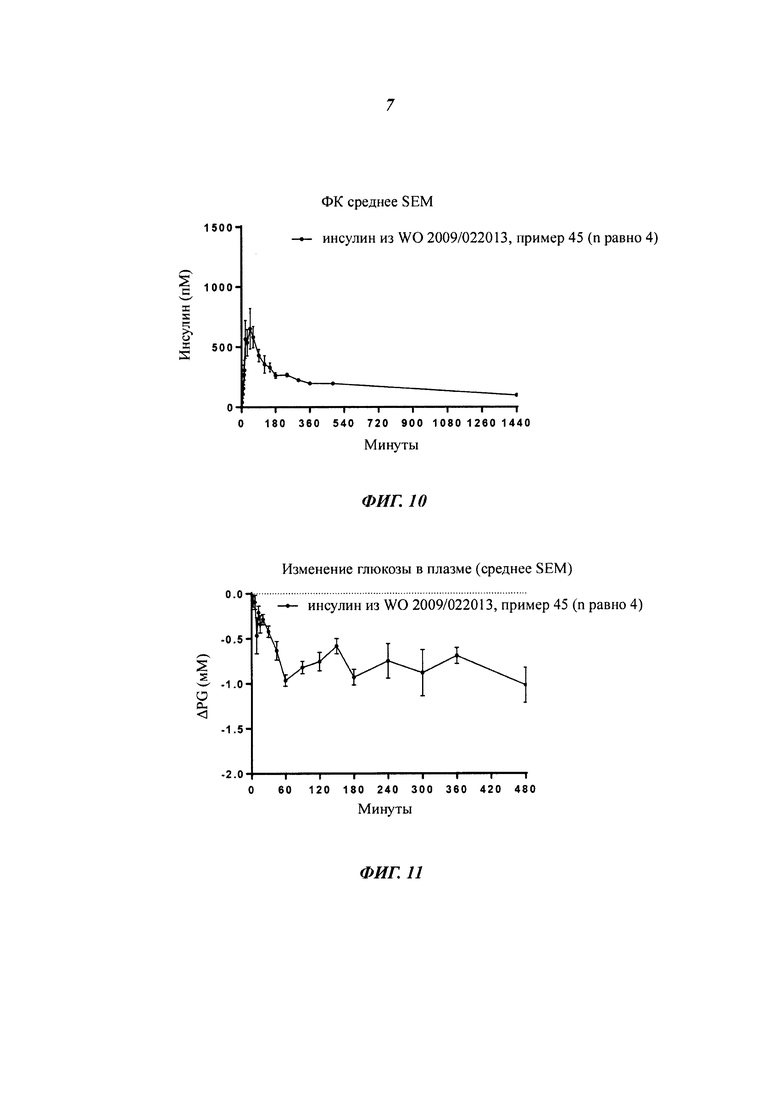
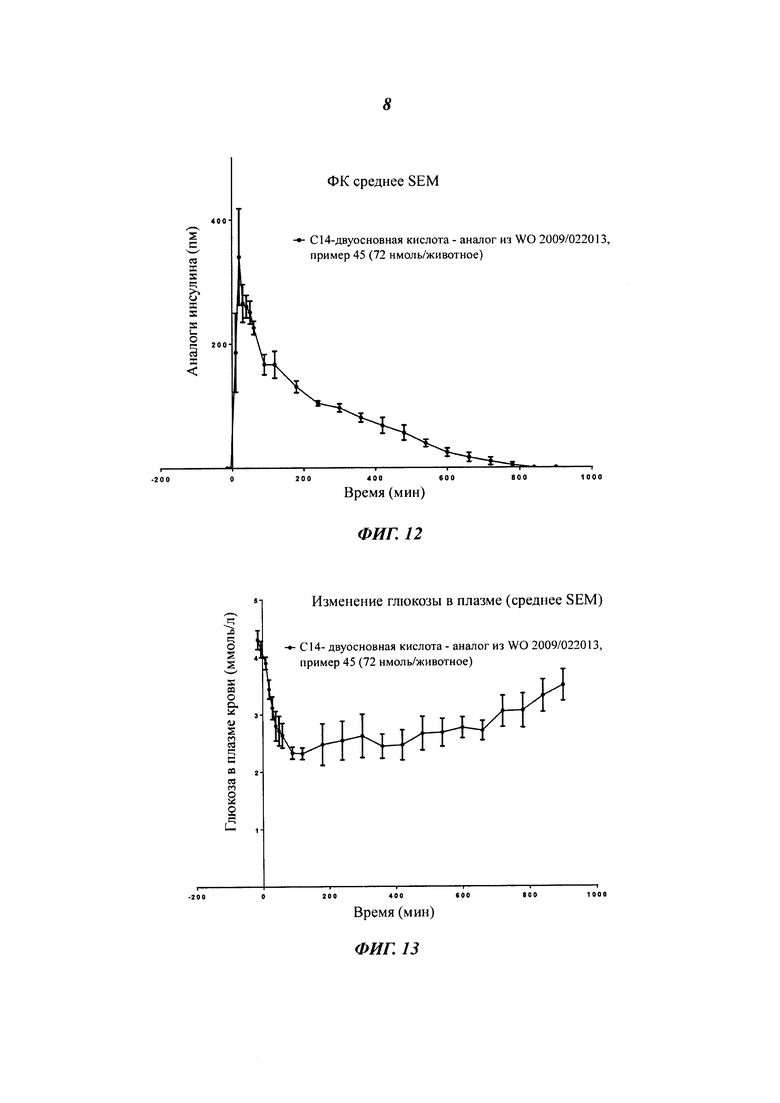
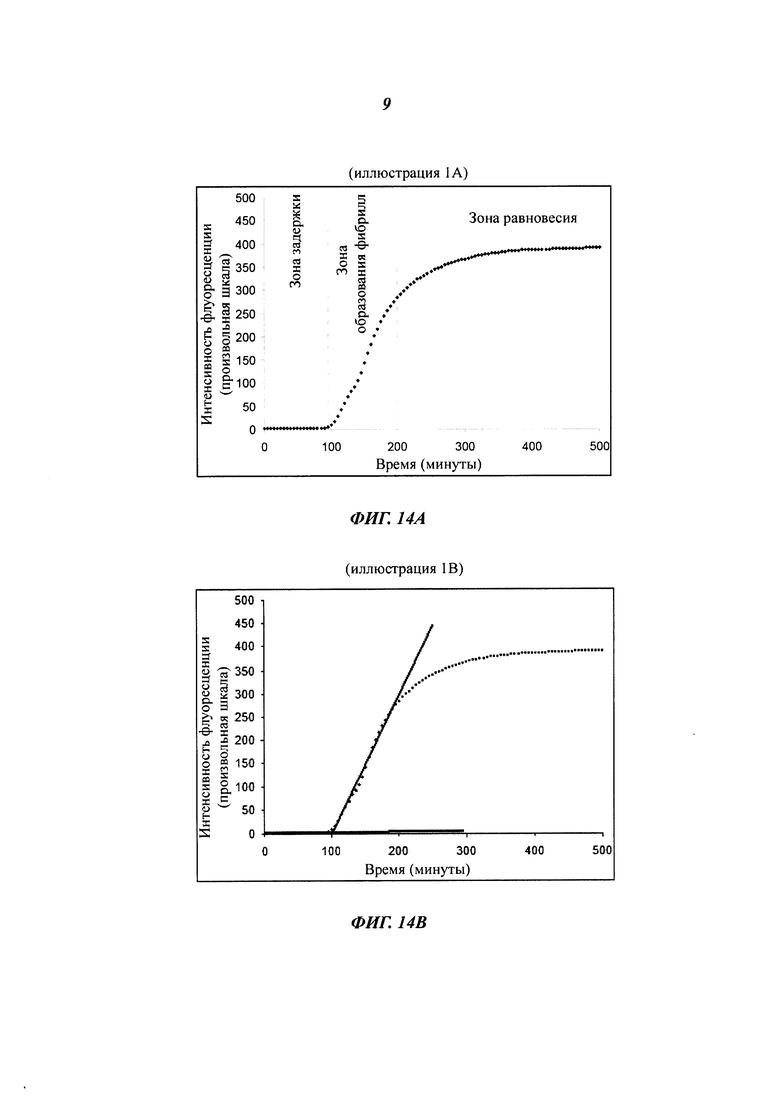
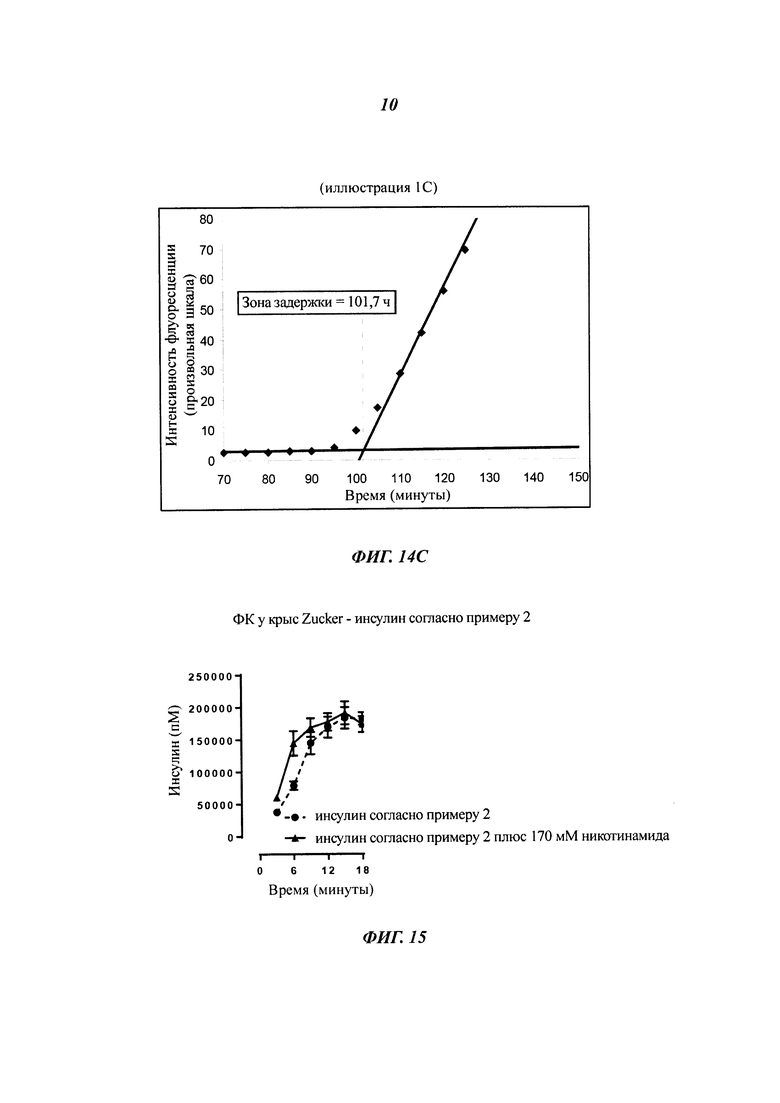
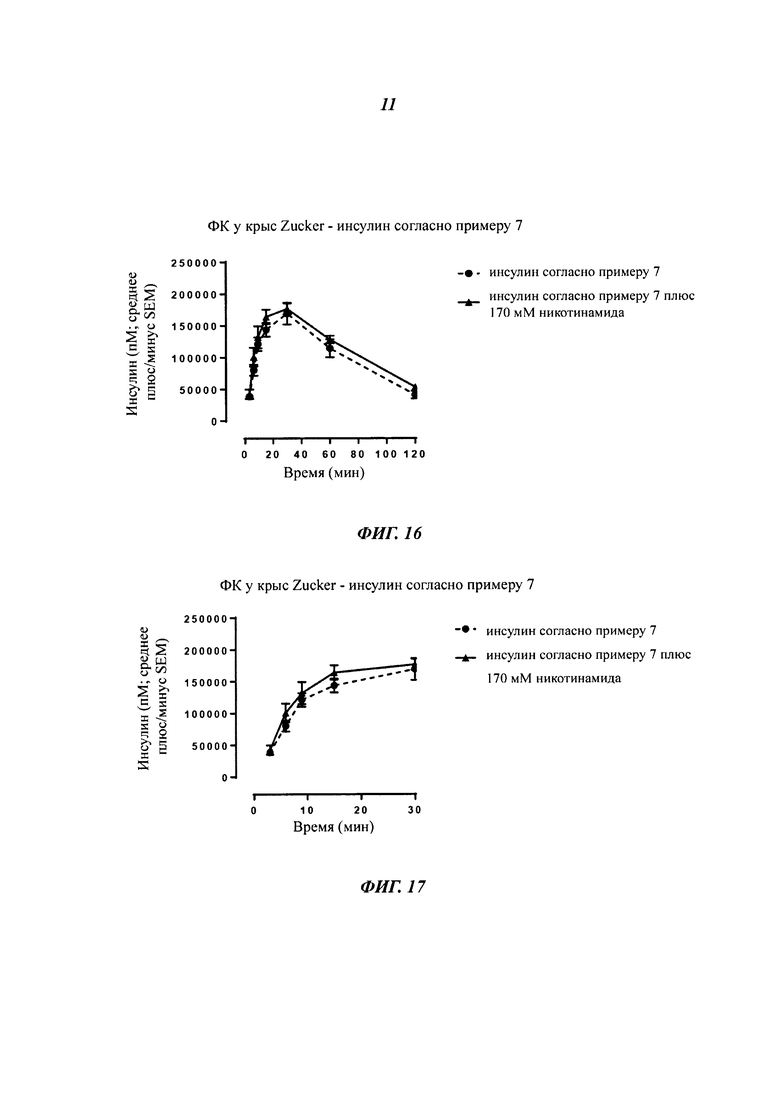
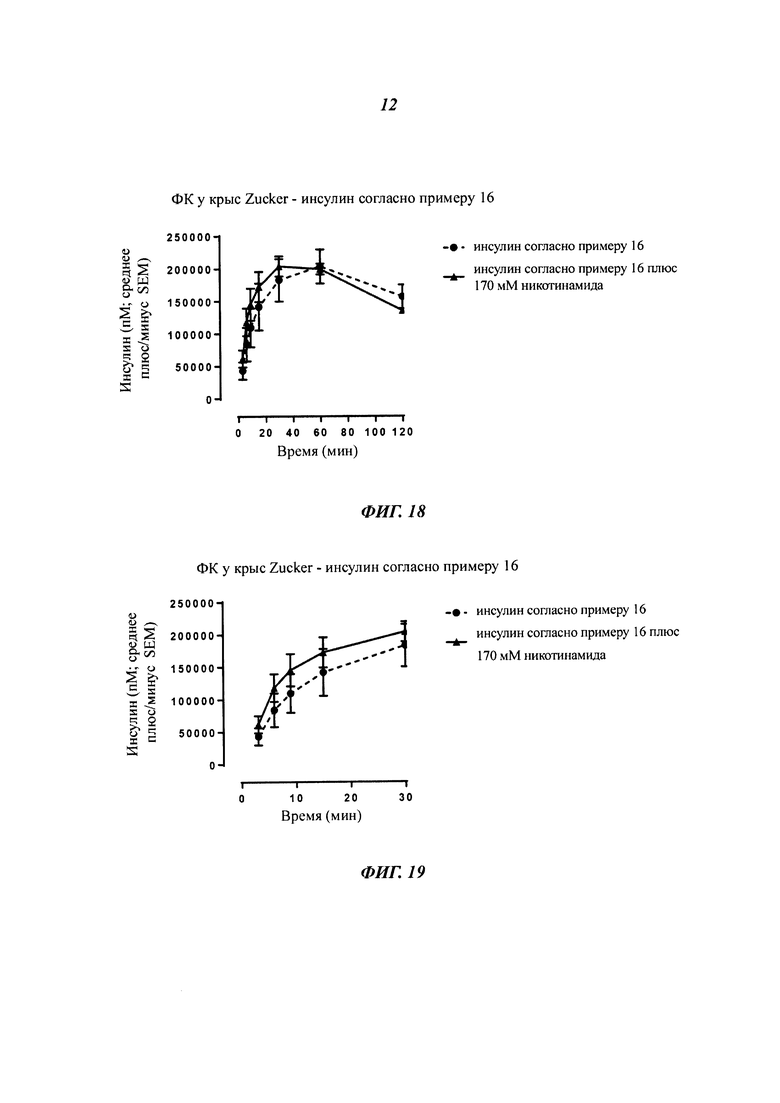
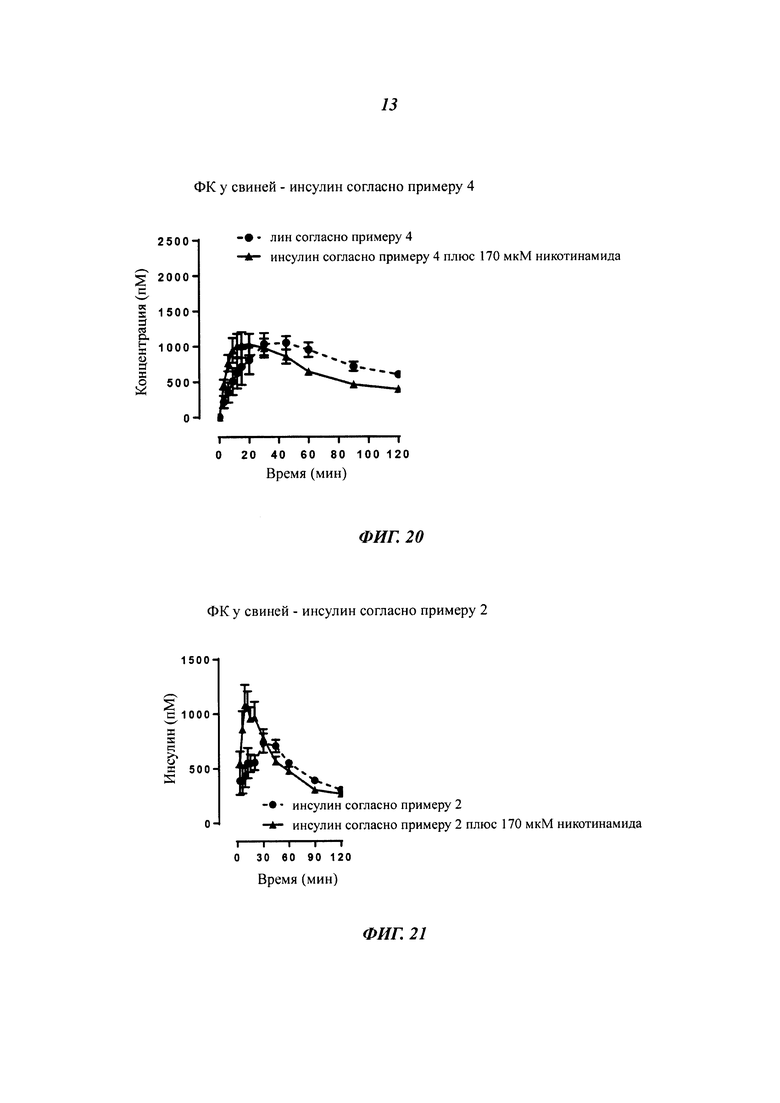
Группа изобретений относится к биотехнологии и медицине, а именно к новым ацилированным производным аналогов инсулина человека и их применению для лечения или профилактики медицинских состояний, связанных с диабетом. Предложен ацилированный аналог человеческого инсулина, представляющий собой [A22K, desB27, B29R, desB30] по отношению к человеческому инсулину, который дериватизован путем ацилирования эпсилон-аминогруппы остатка лизина в позиции А22 группой формулы II [Ацил]-[линкер]. Линкер представляет собой аминокислотную цепь, состоящую из от 1 до 10 аминокислотных остатков, выбранных среди -gGlu- и -OEG-, где gGlu представляет собой остаток гамма-глутаминовой кислоты; OEG представляет собой остаток 8-амино-3,6-диоксаоктановой кислоты. Указанные аминокислотные остатки могут присутствовать в любом порядке, и аминокислотная цепь содержит по меньшей мере один остаток gGlu. Ацил-группа представляет собой остаток α,ω-дикарбоновой кислоты, выбранной из 1,14-тетрадекандиовой кислоты, 1,15-пентадекандиовой кислоты и 1,16-гексадекандиовой кислоты. Указанный ацилированный аналог является коротко- и быстродействующим, и его применяют в фармацевтических составах без добавления цинка для прандиальной инсулинотерапии. 4 н. и 12 з.п. ф-лы, 21 ил., 16 табл., 45 пр.
1. Производное инсулина для прандиальной инсулинотерапии, которое представляет собой ацилированный аналог человеческого инсулина, где указанный аналог представляет собой
[A22K, desB27, B29R, desB30] по отношению к человеческому инсулину;
и где указанный аналог инсулина дериватизован путем ацилирования эпсилон-аминогруппы остатка лизина в позиции А22 группой формулы II
[Ацил]-[линкер],
где линкерная группа представляет собой аминокислотную цепь, состоящую из от 1 до 10 аминокислотных остатков, выбранных среди -gGlu- и -OEG-; где
gGlu представляет собой остаток гамма-глутаминовой кислоты;
OEG представляет собой остаток 8-амино-3,6-диоксаоктановой кислоты (т.е. группу формулы -NH-(CH2)2-O-(CH2)2-O-CH2-CO-);
где указанные аминокислотные остатки могут присутствовать в любом порядке; и
где указанная аминокислотная цепь содержит по меньшей мере один остаток gGlu; и
где ацил-группа представляет собой остаток α,ω-дикарбоновой кислоты, выбранной среди:
1,14-тетрадекандиовой кислоты;
1,15-пентадекандиовой кислоты; и
1,16-гексадекандиовой кислоты.
2. Производное инсулина по п. 1, где указанный аналог дополнительно включает замены А14Е, и/или B3E или B3Q.
3. Производное инсулина по п. 1, где указанный аналог представляет собой [А14Е, A22K, B3E, desB27, B29R, desB30]; [А14Е, A22K, desB27, B29R, desB30]; [A22K, B3E, desB27, B29R, desB30]; [A22K, B3Q, desB27, B29R, desB30] или [A22K, desB27, B29R, desB30] по отношению к человеческому инсулину; и где указанный аналог инсулина ацилирован на эпсилон-аминогруппе остатка лизина в позиции А22.
4. Производное инсулина по п. 1, где линкерная группа выбрана среди -gGlu-; -2xgGlu-; -3xgGlu-; -4xgGlu-; -gGlu-2xOEG-; -gGlu-3x(OEG-gGlu)-; -4xgGlu-2xOEG-; -2xOEG-; и -2xOEG-gGlu-, где «2x», «3х» и «4x» означает, что следующий далее остаток повторяется 2, 3 и 4 раза, соответственно.
5. Производное инсулина по п. 1, где ацильная группа представляет собой двукислотную группу, полученную из 1,14-тетрадекандиовой кислоты; 1,15-пентадекандиовой кислоты или 1,16-гексадекандиовой кислоты.
6. Производное инсулина по п. 1, где группа формулы II представляет собой тетрадекандиоил-gGlu-; тетрадекандиоил-2xgGlu-; тетрадекандиоил-3xgGlu-; тетрадекандиоил-4xgGlu-; тетрадекандиоил-gGlu-2хОЕG-; тетрадекандиоил-4xgGlu-2xOEG-; тетрадекандиоил-2хОЕG-; пентадекандиоил-4xgGlu; гексадекандиоил-4xgGlu-; гексадекандиоил-gGlu-2хОЕG- или гексадекандиоил-3х(gGlu-ОЕG)-gGlu-.
7. Производное инсулина по п. 1, которое представляет собой:
A22K(N(eps)-тетрадекандиоил-4xgGlu), desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-4xgGlu), B3E, desB27, B29R, desB30 человеческий инсулин;
А14Е, A22K(N(eps)-тетрадекандиоил-4xgGlu), desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-4xgGlu), B3E, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-gGlu-2xOEG), B3E, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-3х(gGlu-ОЕG)-gGlu), B3E, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-4xgGlu), B3Q, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-gGlu-2xOEG), B3Q, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-3х(gGlu-ОЕG)-gGlu), B3Q, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-2xgGlu), desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-4xgGlu), desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-gGlu-2хОЕG), desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-3x(gGlu-OEG)-gGlu), desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-gGlu), desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-gGlu-2xOEG), B3E, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-gGlu-2хОЕG), B3Q, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-2хОЕG), desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-4xgGlu), B3Q, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-пентадекандиоил-4xgGlu), B3E, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-4xgGlu-2хОЕG), desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-4xgGlu-2xOEG), B3E, desB27, B29R, desB30 человеческий инсулин;
А14Е, A22K(N(eps)-тетрадекандиоил-gGlu-2хОЕG), B3E, desB27, B29R, desB30 человеческий инсулин;
А14Е, A22K(N(eps)-тетрадекандиоил-4xgGlu), B3E, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-2xgGlu), B3E, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-gGlu), B3E, desB27, B29R, desB30 человеческий инсулин или
A22K(N(eps)-тетрадекандиоил-3xgGlu), B3E, desB27, B29R, desB30 человеческий инсулин.
8. Фармацевтическая композиция для лечения или профилактики сахарного диабета, сахарного диабета 1 типа, сахарного диабета 2 типа, нарушенной толерантности к глюкозе, гипергликемии, дислипидемии, ожирения, метаболического синдрома (метаболического синдрома X, синдрома резистентности к инсулину), гипертонии, когнитивных расстройств, атеросклероза, инфаркта миокарда, инсульта, сердечно-сосудистых заболеваний, ишемической болезни сердца, синдрома воспаленного кишечника, диспепсии или язв желудка, содержащая эффективное количество производного инсулина по любому из пп. 1-7 и один или более чем один из фармацевтически приемлемых носителей или разбавителей.
9. Фармацевтическая композиция по п. 8, приготовленная в виде композиции с низким содержанием цинка, без добавления ионов цинка.
10. Фармацевтическая композиция по п. 8, приготовленная в виде композиции с низким содержанием цинка, без добавления ионов цинка, и содержащая ацилированный аналог человеческого инсулина, выбранный среди следующих:
A22K(N(eps)-тетрадекандиоил-4xgGlu), B3E, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-4xgGlu), B3E, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-gGlu-2хОЕG), B3E, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-3х(gGlu-ОЕG)-gGlu), B3E, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-gGlu-2xOEG), B3E, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-пентадекандиоил-4xgGlu), B3E, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-4xgGlu), B3Q, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-gGlu-2xOEG), B3Q, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-3x(gGlu-OEG)-gGlu), B3Q, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-gGlu-2хОЕG), B3Q, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-гексадекандиоил-4xgGlu), B3Q, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-4xgGlu-2хОЕG), desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-4xgGlu-2хОЕG), B3E, desB27, B29R, desB30 человеческий инсулин;
А14Е, A22K(N(eps)-тетрадекандиоил-gGlu-2хОЕG), B3E, desB27, B29R, desB30 человеческий инсулин;
А14Е, A22K(N(eps)-тетрадекандиоил-4xgGlu), B3E, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-2xgGlu), B3E, desB27, B29R, desB30 человеческий инсулин;
A22K(N(eps)-тетрадекандиоил-gGlu), B3E, desB27, B29R, desB30 человеческий инсулин и
A22K(N(eps)-тетрадекандиоил-3xgGlu), B3E, desB27, B29R, desB30 человеческий инсулин.
11. Фармацевтическая композиция по п. 9, приготовленная в виде композиции с низким содержанием цинка, содержащая менее 0,2 ионов Zn2+ на 6 молекул инсулина.
12. Фармацевтическая композиция по п. 9, в которую не добавлено поверхностно-активное вещество.
13. Фармацевтическая композиция по любому из пп. 9-12, содержащая никотиновое соединение, в частности никотинамид.
14. Производное инсулина по любому из пп. 1-7 для применения в качестве лекарственного препарата для лечения или профилактики сахарного диабета, сахарного диабета 1 типа, сахарного диабета 2 типа, нарушенной толерантности к глюкозе, гипергликемии, дислипидемии, ожирения, метаболического синдрома (метаболического синдрома X, синдрома резистентности к инсулину), гипертонии, когнитивных расстройств, атеросклероза, инфаркта миокарда, инсульта, сердечно-сосудистых заболеваний, ишемической болезни сердца, синдрома воспаленного кишечника, диспепсии или язв желудка.
15. Применение производного инсулина по любому из пп. 1-7 для изготовления лекарственного препарата для лечения или профилактики сахарного диабета, сахарного диабета 1 типа, сахарного диабета 2 типа, нарушенной толерантности к глюкозе, гипергликемии, дислипидемии, ожирения, метаболического синдрома (метаболического синдрома X, синдрома резистентности к инсулину), гипертонии, когнитивных расстройств, атеросклероза, инфаркта миокарда, инсульта, сердечно-сосудистых заболеваний, ишемической болезни сердца, синдрома воспаленного кишечника, диспепсии или язв желудка, где указанные лечение или профилактика включают введение субъекту, нуждающемуся в этом, терапевтически эффективного количества производного инсулина по любому из пп. 1-7.
16. Способ лечения или профилактики заболевания, нарушения или состояния, связанного с сахарным диабетом, сахарным диабетом 1 типа, сахарным диабетом 2 типа, нарушенной толерантностью к глюкозе, гипергликемией, дислипидемией, ожирением, метаболическим синдромом (метаболическим синдромом X, синдромом резистентности к инсулину), гипертонией, когнитивными расстройствами, атеросклерозом, инфарктом миокарда, инсультом, сердечно-сосудистыми заболеваниями, ишемической болезнью сердца, синдромом воспаленного кишечника, диспепсией или язвами желудка, где указанный способ включают введение субъекту, нуждающемуся в этом, терапевтически эффективного количества производного инсулина по любому из пп. 1-7.
| US 5382574 A, 17.01.1995 | |||
| WO 2009022005, 19.02.2009 | |||
| WO 2009112583, 17.09.2009 | |||
| STEENSGAARD D | |||
| B | |||
| et al | |||
| "Ligand-Controlled Assembly of Hexamers, Dihexamers, and Linear Multihexamer Structures by the Engineered Acylated Insulin Degludec", BIOCHEMISTRY, 2013, v.52, no.2, p.295-309, DOI: http://dx.doi.org/10.1021/bi3008609. | |||
| RU 2012107487 A, 10.09.2013 | |||
| RU 2010141481 A, 27.04.2012 | |||
| WO 2011161125 A1, 29.12.2011 | |||
| RU 2009114324 A, 27.10.2010 | |||
| WO 2012171994 A1, 20.12.2012. |
Авторы
Даты
2019-04-09—Публикация
2015-02-26—Подача