Изобретение относится к медицине, а именно к кардиологии и может использоваться для прогнозирования эффективности проведения фармакологической антиаритмической терапии (ААТ) в качестве первичной профилактики фибрилляции предсердий (ФП) у больных с предсердной экстрасистолией (ПЭ).
В настоящее время известен метод скринингового тестирования противоаритмических средств для выбора наиболее эффективного антиаритмического препарата для больных с экстрасистолией (Олесин А.И., Константинова И.В., Литвиненко В.А., Шлапакова А.В. Способ выбора наиболее эффективного антиаритмического препарата для больных с экстрасистолией. Патент РФ №2641164, опубл. 16.01.18, Бюл. №2). Метод скринингового тестирования заключается в следующем: тестируемые антиаритмические средства вводят поочередно однократно, до введения каждого препарата и после начала их действия, определяемого как полпериода их полувыведения, дополнительно рассчитывают индекс экстрасистолии (ИЭ) по формуле:  , где ИЭ - индекс экстрасистолии, А - линейное отклонение (ЛО) корригированного предэктопического интервала (ПДИкор.) не менее чем в 20 ЖЭ, В - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час, причем при увеличении ИЭ по сравнению с исходными величинами определяли тестируемый антиаритмический препарат, как эффективный (Олесин А.И., Константинова И.В., Литвиненко В.А., Шлапакова А.В. Способ выбора наиболее эффективного антиаритмического препарата для больных с экстрасистолией. Патент RU №2641164, опубл. 16.01. 2018, Бюл. №2.).
, где ИЭ - индекс экстрасистолии, А - линейное отклонение (ЛО) корригированного предэктопического интервала (ПДИкор.) не менее чем в 20 ЖЭ, В - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час, причем при увеличении ИЭ по сравнению с исходными величинами определяли тестируемый антиаритмический препарат, как эффективный (Олесин А.И., Константинова И.В., Литвиненко В.А., Шлапакова А.В. Способ выбора наиболее эффективного антиаритмического препарата для больных с экстрасистолией. Патент RU №2641164, опубл. 16.01. 2018, Бюл. №2.).
Известно использование противоаритмических препаратов II класса в качестве первичной профилактики (ФП) (Олесин А.И., Литвиненко В.А., Константинова И.В., Шлапакова А.В. Возможность использования противоаритмических препаратов II класса и модулированной кинезотерапии в качестве первичной профилактики фибрилляции предсердий у больных метаболическим синдромом. Российский кардиологический журнал. 2015; 11(127):75-80).
В настоящее время определяется долгосрочный риск развития ФП, при котором риск развития этой аритмии в возрасте старше 40 лет составляет 25% в год, а также при однократном выявлении предикторов ФП таких, как выявление патологических значений дисперсии зубца Р, поздних потенциалов предсердий, дисфункции левого желудочка, дилатации предсердий, предсердной экстрасистолии, прогнозируется развитие этой аритмии в течение 5-10 и более (Диагностика и лечение фибрилляции предсердий. Национальные клинические рекомендации 5-е издание. М.: 2012, Олесин А.И., Литвиненко В.А., Аль-барбари А.В. и соавт. Оценка риска развития фибрилляция предсердий у больных метаболическим синдромом: проспективное исследование. Российский кардиологический журнал, 2014; 12 (116): 25-30., Олесин А.И., Константинова И.В., Литвиненко В.А., Аль-Барбари А.В. Способ определения риска развития фибрилляции предсердий у больных с предсердной экстрасистолией - Патент Российской Федерации №2556602, опубликован 10.07.2015 г., Бюллетень изобретений №19). При этом риске рекомендуется модификация образа жизни, коррекция ожирения, артериального давления, сахара крови и т.д. Кроме того, определяется краткосрочный риск развития ФП, в течение 2 лет и менее, определяемый в динамике наблюдения, с интервалом 1-3 месяца, при котором в качестве первичной профилактики может рекомендоваться использование фармакологической ААТ и/или других методов лечения (Олесин А.И., Литвиненко В.А., Аль-барбари А.В. и соавт. Оценка риска развития фибрилляция предсердий у больных метаболическим синдромом: проспективное исследование. Российский кардиологический журнал, 2014; 12 (116):25-30., Олесин А.И., Константинова И.В., Литвиненко В.А., Аль-Барбари А.В. Способ определения риска развития фибрилляции предсердий у больных с предсердной экстрасистолией - Патент Российской Федерации №2556602, опубликован 10.07.2015 г., Бюллетень изобретений №19).
Прогнозирование эффективности использования фармакологической ААТ в качестве первичной профилактики ФП у больных с ПЭ не проводилось.
Техническим результатом изобретения является возможность прогнозирования эффективности фармакологической ААТ в качестве первичной профилактики ФП у больных с ПЭ. Технический результат изобретения достигается тем, что до и после проведения ААТ, используемой, как минимум, в течение 7 периодов полувыведения препарата определяют индекс риска развития фибрилляции предсердий (ИРРФП) по формуле:  , где ИРРФП - риск развития ФП, FiP-P - продолжительность фильтрованной волны «Р» сигнал-усредненной ЭКГ в мс, Pd - дисперсия зубца «Р» в мс, определяемая как разница между максимальными и минимальными значениями продолжительности зубца «Р» при регистрации 12 отведений стандартной ЭКГ, ЧПИА - частотный порог индуцирования аритмии, определяемый как произведение количества стимулов при проведении ЧПЭКС на длительность стимуляции в минутах, А - продолжительность индуцированной аритмии в минутах, и при увеличении ИРРФП, полученного после проведения ААТ по сравнению с ИРРФП, полученного до этого прогнозируют проведение фармакологической ААТ в качестве первичной профилактики ФП у больных с ПЭ как эффективную.
, где ИРРФП - риск развития ФП, FiP-P - продолжительность фильтрованной волны «Р» сигнал-усредненной ЭКГ в мс, Pd - дисперсия зубца «Р» в мс, определяемая как разница между максимальными и минимальными значениями продолжительности зубца «Р» при регистрации 12 отведений стандартной ЭКГ, ЧПИА - частотный порог индуцирования аритмии, определяемый как произведение количества стимулов при проведении ЧПЭКС на длительность стимуляции в минутах, А - продолжительность индуцированной аритмии в минутах, и при увеличении ИРРФП, полученного после проведения ААТ по сравнению с ИРРФП, полученного до этого прогнозируют проведение фармакологической ААТ в качестве первичной профилактики ФП у больных с ПЭ как эффективную.
Способ осуществляется следующим образом. Пациенту проводят скрининговое тестирование противоаритмических средств для выбора наиболее эффективного антиаритмического препарата для больных с ПЭ. После выбора наиболее эффективного антиаритмического препарата до и после его применения, как минимум, в течение 7 периодов полувыведения препарата определяют индекс риска развития фибрилляции предсердий (ИРРФП) по формуле:
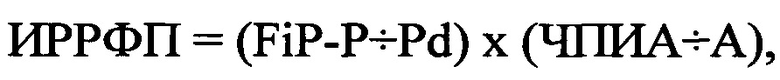
где ИРРФП - риск развития ФП, FiP-P - продолжительность фильтрованной волны «Р» сигнал-усредненной ЭКГ в мс, Pd - дисперсия зубца «Р» в мс, определяемая как разница между максимальными и минимальными значениями продолжительности зубца «Р» при регистрации 12 отведений стандартной ЭКГ, ЧПИА - частотный порог индуцирования аритмии, определяемый как произведение количества стимулов при проведении ЧПЭКС на длительность стимуляции в минутах, А - продолжительность индуцированной аритмии в минутах, и при увеличении ИРРФП, полученного после проведения ААТ по сравнению с ИРРФП, полученного до этого, прогнозируют проведение фармакологической ААТ в качестве первичной профилактики ФП у больных с ПЭ как эффективную.
Существенные отличительные признаки заявляемого способа и причинно-следственная связь между ними и достигаемым результатом:
- До и после применения наиболее эффективного антиаритмического препарата, используемого, как минимум, в течение 7 периодов полувыведения препарата определяют ИРРФП по формуле:

где ИРРФП - риск развития ФП, FiP-P - продолжительность фильтрованной волны «Р» сигнал-усредненной ЭКГ в мс, Pd - дисперсия зубца «Р» в мс, определяемая как разница между максимальными и минимальными значениями продолжительности зубца «Р» при регистрации 12 отведений стандартной ЭКГ, ЧПИА - частотный порог индуцирования аритмии, определяемый как произведение количества стимулов при проведении ЧПЭКС на длительность стимуляции в минутах, А - продолжительность индуцированной аритмии в минутах.
- При увеличении ИРРФП, полученного после проведения ААТ по сравнению с ИРРФП, полученного до этого, прогнозируют эффективность проведения фармакологической ААТ у больных с ПЭ в качестве первичной профилактики ФП.
Основой развития ФП является перегрузка кальцием кардиомиоцитов предсердий, в том числе в результате повышенного выхода кальция из саркоплазматического ретикулома, в том числе за счет активации рианодинового рецептора типа 2, который является специфической молекулярной мишенью окислительного стресса (Hove-Madsen L., Llach A., Bayes-Genis A. et al. Atrial fibrillation is associated with increased spontaneous calcium release from the sarcoplasmic reticulum in human atrial myocytes. Circulation, 2004; 110(11): 1358-1363, Santulli G., Marks A.R. Essential roles of intracellular calcium release channels in muscle, brain, metabolism, and aging. Curr Mol Pharmacol 2015; 8:206-222, Voigt N., Heijman J., Wang Q., et al. Cellular and molecular mechanisms of atrial arrhythmogenesis in patients with paroxysmal atrial fibrillation. Circulation 2014; 129:145-156, Xie W., Santulli G., Reiken S.R. et al. Mitochondrial oxidative stress promotes atrial fibrillation. Sci Rep 2015; 5:11427, Chiang D.Y., Kongchan N., Beavers D.L. et al. Loss of microRNA-106b-25 cluster promotes atrial fibrillation by enhancing ryanodine receptor type-2 expression and calcium release. Circ Arrhythm Electrophysiol 2014; 7:1214-1222). Перегрузка миокардиоцитов предсердий кальцием приводит к развитию процесса «электрического ремоделирования» миокарда предсердий. Суть этого феномена заключается в электрофизиологических изменениях в предсердиях, главным образом проявляющихся в укорочении их рефрактерности (Fynn S.P., Todd D.M., Hobbs W.J., Armstrong K.L., Garratt C.J. Role of dispersion of atrial refractoriness in the recurrence of clinical atrial fibrillation; a manifestation of atrial electrical remodeling in humans? Eur. Heart J., 2001; ..22(19):1822-1834, Antzelevitch С, Burashnikov A. Overview of Basic Mechanisms of Cardiac Arrhythmia. Card Electrophysiol Clin. 2011; 3(l):23-45). Прогрессируя, укорочение рефрактерности предсердий способствует развитию как ПЭ, так и ФП.
В настоящее время известно, что развитие ПЭ может быть обусловлено различными клеточными механизмами: наличием триггерной активности (ранеей или задержанной постдеполяризации), re-entry и т.д. (Antzelevitch С, Burashnikov A. Overview of Basic Mechanisms of Cardiac Arrhythmia. Card ElectrophysiolClin. 2011; 3(1):23-45). Например, эктопия, обусловленная задержанной постдеполяризацией, обычно связана с гиперполяризацией клеточных мембран кардиомиоцитов в пределах 60-70 mV, что косвенно отражает обратимый характер нарушения функции кардиомиоцитов, причем ее индукция может являться результатом стресса, вегетативного или электролитного дисбаланса, ишемии миокарда и т.д., а после устранения причины она, как правило, купируется (Braunwald's Heart Disease. A textbook of cardio-vascular medicine. 9th ed. Libby P. et al., Phyladelfhia, W.B. Saunders Company; 2011). Между тем, при прогрессирующей гиперполяризации мембран кардиомиоцитов, например, от -50 до -60 mV, отмечается локальное замедление распространения возбуждения с формированием в этой области однонаправленного блока проведения, приводящего к развитию re-entry. Возникновение этого механизма аритмии в большинстве случаев связано с более глубокими метаболическими нарушениями и/или в результате органического поражения кардиомиоцитов, которые, в конечном итоге, могут сформировать анатомический субстрат в предсердиях, предрасполагающий появлению ФП (Braun-wald's Heart Disease. A textbook of cardiovascular medicine. 9 th ed. Libby P. et al., Phyladelfhia, W.B. Saunders Company; 2011). Кроме того, источником ПЭ может быть эктопический очаг в миокарде предсердий или легочных венах (Braunwald's Heart Disease. A textbook of cardiovascular medicine. 9th ed. Libby P. et al., Phyladelfhia, W.B. Saunders Company; 2011). Частая, продолжительная или рецидивирующая ПЭ, обусловленная этими механизмами, может способствовать ухудшению исходно нарушенного неоднородного проведения возбуждения по предсердиям, увеличивая потенциальный риск развития ФП (Braunwald's Heart Disease. A textbook of cardiovascular medicine. 9th ed. Libby P. et al., Phyladelfhia, W.B. Saunders Company; 2011, Antzelevitch C, Burashnikov A. Overview of Basic Mechanisms of Cardiac Arrhythmia. Card Elec-trophysiol Clin. 201 l; 3(1):23-45). Между тем, при прогрессирующей гиперполяризации мембран кардиомиоцитов, например, от -50 до -60 mV, отмечается локальное замедление распространения возбуждения с формированием в этой области однонаправленного и/или частотно-зависимого блока распространения возбуждения с явлениями Венкебаха, приводящего к развитию re entry (Antzelevitch С, Burashnikov A. Overview of Basic Mechanisms of Cardiac Arrhythmia. Card Electrophysiol Clin. 2011; 3(1):23-45). Возникновение этого механизма аритмии в большинстве случаев связано с более глубокими метаболическими нарушениями и/или в результате органического поражения кардиомиоцитов (Antzelevitch С, Burashnikov A. Overview of Basic Mechanisms of Cardiac Arrhythmia. Card Electrophysiol Clin. 2011; 3(1):23-45). Ранее проведенные клинико-экспериментальные исследования показали, что выявленные показатели ЛО ПДИкор. экстрасистолии, например, ≤ 10 мс, косвенно подтверждают механизмы re-entry и/или формирование патологического эктопического очага, а большая вариабельность этого показателя - наличие триггерных механизмов (Олесин А.И., Коновалова О.А., Козий А.В. и соавт. Желудочковая экстрасистолия у больных острым коронарным синдромом без подъема сегмента ST: оценка риска развития жизнеугрожающих желудочковых аритмий (клинико-экспериментальное исследование). Российский кардиологический журнал. 2009; 1:24-31). Поэтому уже после однократного введения антиаритмического препарата при наличии триггерных механизмов уменьшается гиперполяризация мембраны кардиомиоцитов, что проявляется увеличением ПДИкор. и уменьшением частоты ПЭ, а после формирования фронта волны возбуждения, например, по механизму «re-entry», она фракционируется, разделяется на дочерние волны, каждая из которых становится независимой, что приводит к появлению на ЭКГ различных ПДИкор. преждевременных комплексов и затем, когда, в конечном итоге, вместо одностороннего блока развивается полный блок проведения, эктопия купируется или наблюдается ее урежение (Antzelevitch С, Burashnikov A. Overview of Basic Mechanisms of Cardiac Arrhythmia. Card Electrophysiol Clin. 2011; 3(1):23-45). Следует отметить, что оценка эффективности используемой ААТ в качестве первичной профилактики ФП у больных с ПЭ, проводится, как минимум, на протяжении применения, как минимум, 7 периодов полувыведения препарата для исключения ложноположительного или ложноотрицательного результата. В связи с тем, что после проведения ААТ ПЭ предсердная эктопия может купироваться или отмечаться такое ее урежение, что оценить ее эффективность в качестве первичной профилактики ФП по ранее описанному способу не представляется возможным (Олесин А.И., Константинова И.В., Литвиненко В.А., Аль-Барбари А.В. Способ определения риска развития фибрилляции предсердий у больных с предсердной экстрасистолией - Патент Российской Федерации №2556602, опубликован 10.07.2015 г., Бюллетень изобретений №19). Поэтому для прогнозирования эффективности фармакологической ААТ в качестве первичной профилактики ФП у больных с ПЭ был выбран метод оценки риска развития ФП с помощью ЧПЭКС (Олесин А.И., Просяникова О.Н. Способ определения риска развития фибрилляции предсердий - Патент Российской Федерации №2497446, опубликован 10.11.2013 г., Бюллетень изобретений №31).
Для иллюстрации заявляемого способа приводим примеры из клинической практики:
Пример 1. Больной Г., 66 лет, поступил в дневной стационар 16.05.2017 г. по направлению участкового врача по поводу частой ПЭ. Из анамнеза известно, что больной страдает гипертонической болезнью в течение последних 9-10 лет. Постоянно принимает индапамид 2,5 мг в день. В последние 3-4 недели стал отмечать появление перебоев в работе сердца. При суточном мониторировании ЭКГ, выполненном амбулаторно 10.05.2017 г., было выявлено 1537 одиночных ПЭ в среднем с частотой до 63 экстрасистол в час. При суточном мониторировании ЭКГ, выполненном 17.05.2017 г., было выявлено 1739 одиночных ПЭ в среднем с частотой до 73 экстрасистол в час. На второй день пребывания больного в стационаре больному была проведена регистрация сигнал-усредненной ЭКГ полосе частот от 40 до 250 Гц с регистрацией биполярных отведений X, Y, Z по Франку и усреднением до 400 комплексов по волне «Р» с помощью компьютерного комплекса «Поли-спектр-ВР» (фирма «Нейрософт», г. Иваново). Определялась продолжительность фильтрованной волны «Р» (FiP-P), дисперсия зубца «Р» (Pd) автоматическим методом при регистрации 12 отведений стандартной ЭКГ путем определения максимальной разницы, как минимум, в 10 комплексах P-QRST между продолжительностью максимальной и минимальной волной «Р» с последующим усреднением значений Pd. У больного Г., 66 лет FiP-P составило 136 мс, Pd - 79 мс. Затем была индуцирована ФП с помощью ЧПЭКС. Частотный порог индуцирования аритмии (ЧПИА) составил 9 имп ⋅ сек., а продолжительность ФП - 37 минут. В последующем был рассчитан ИРРФП по формуле:

где ИРРФП - риск развития ФП, FiP-P - продолжительность фильтрованной волны «Р» сигнал-усредненной ЭКГ в мс, Pd - дисперсия зубца «Р» в мс, определяемая как разница между максимальными и минимальными значениями продолжительности зубца «Р» при регистрации 12 отведений стандартной ЭКГ, ЧПИА - частотный порог индуцирования аритмии, определяемый как произведение количества стимулов при проведении ЧПЭКС на длительность стимуляции в минутах, А - продолжительность индуцированной аритмии в минутах.

ИРРФП составил 0,42 ед. Согласно способу определения риска развития фибрилляции предсердий, ИРРФП, составивший 0,42 ед, определял высокий риск развития ФП, т.е. в течение 3 месяцев после обследования (Олесин А.И., Просяникова О.Н. Способ определения риска развития фибрилляции предсердий - Патент Российской Федерации №2497446, опубликован 10.11.2013 г., Бюллетень изобретений №31).
После проведения суточного мониторирования ЭКГ, больному Г., 66 лет 18.05.2017 г. проведено скрининговое тестирование противоаритмических средств, проведенным по ранее описанному способу (Олесин А.И., Константинова И.В., Литвиненко В.А., Шлапакова А.В. Способ выбора наиболее эффективного антиаритмического препарата для больных с экстрасистолией. Патент РФ №2641164, опубл. 16.01.18, Бюл. №2.).
18.05.2017 г. больному Г., 66 лет в стационаре в 10 ч была проведена регистрация ЭКГ одновременно в 12 стандартных отведениях с помощью компьютерного комплекса «Полиспектр-ритм» (фирма «Нейрософт», г. Иваново). При регистрации ЭКГ в течение 30 минут было выявлено 35 ПЭ. Затем было рассчитано линейное отклонение (ЛО) корригированного предэктопического интервала (ПДИкор.), составившее 11 мс и индекс экстрасистолии (ИЭ) по формуле:

где ИЭ - индекс экстрасистолии, А - ЛО ПДИкор. не менее чем в 20 ПЭ, В - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час.

где ИЭ - индекс экстрасистолии, в числителе - ЛО ПДИкор., составившее 11 мс в 35 ПЖЭ, в знаменателе - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час и составившее 70 в час.
Больному сублингвально был назначен соталол в дозе 40 мг с последующей регистрацией ЭКГ одновременно в 12 стандартных отведениях с помощью компьютерного комплекса «Полиспектр-ритм» (фирма «Нейрософт», г. Иваново) через 6 часов после применения препарата, составившие полпериода полувыведения препарата. При регистрации ЭКГ после использования соталола в течение 60 минут было выявлено 22 ПЭ. Затем было рассчитано ЛО ПДИкор., составившее 38 мс и ИЭ по формуле:
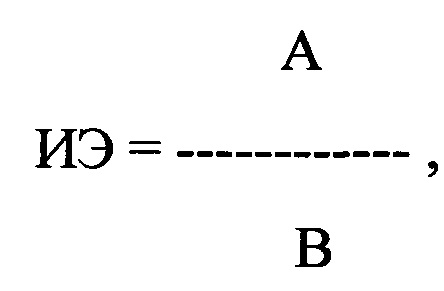
где ИЭ - индекс экстрасистолии, А - ЛО ПДИкор. не менее чем в 20 ПЖЭ, В - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час.

где ИЭ - индекс экстрасистолии, в числителе - ЛО ПДИкор., составившее 38 мс в 22 ПЭ, в знаменателе - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час и составившее 22 в час.
После применения соталола отмечалось увеличение ИЭ в 10,88 раза в сравнении с исходными данными.
Затем больному Г, 66 лет последовательно, ежедневно было проведено тестирование противоаритмических препаратов - пропранолол в дозе 40 мг, метопролол в дозе 50 мг, карведиол в дозе 50 мг, аллапинин в дозе 25 мг, дизопирамид в дозе 200 мг в сутки, внутривенно - пропафенон (пропанорм) в дозе 150 мг, амиодарон в дозе 300 мг. Результаты тестирования антиаритмических препаратов у больного Г., 66 лет представлены в таблице №1.

Примечание: * - исследования проводились через пол-периода полувыведения препарата, ΔМ% - изменения ИЭ после введения препарата в сравнении с исходными данными (в %).
Как видно из представленных данных, наибольшее увеличение ИЭ отмечалось при использовании соталола.
Больному был назначен соталол в дозе 120 мг в сутки. Период полувыведения препарата в среднем составляет 12 часов. Через 7 периодов полувыведения, составиший 3,5 суток [(7×12 часов)÷24 часа)=3, 5 суток], повторно было выполнено суточное мониторирование ЭКГ и был определен ИРРФП.
У больного Г., 66 лет при суточном мониторировании ЭКГ частота ПЭ уменьшилась до 345 в сутки, в среднем составил до 15 экстрасистол в час, FiP-P составило 136 мс, Pd - 70 мс, ЧПИА составил 22 имп ⋅ сек., а продолжительность ФП - 5 минут. В последующем был рассчитан ИРРФП по формуле:
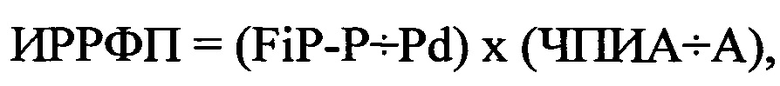
где ИРРФП - риск развития ФП, FiP-P - продолжительность фильтрованной волны «Р» сигнал-усредненной ЭКГ в мс, Pd - дисперсия зубца «Р» в мс, определяемая как разница между максимальными и минимальными значениями продолжительности зубца «Р» при регистрации 12 отведений стандартной ЭКГ, ЧПИА - частотный порог индуцирования аритмии, определяемый как произведение количества стимулов при проведении ЧПЭКС на длительность стимуляции в минутах, А - продолжительность индуцированной аритмии в минутах.
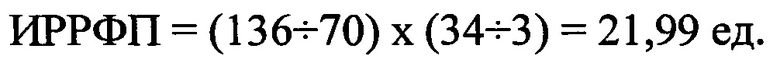
ИРРФП составил 21,99 ед. и увеличился в сравнении с исходными данными в среднем в 52 раза.
В последующем больному была продолжена терапия соталолом в дозе 120 мг в сутки. При проведении неоднократных процедур суточного мониторирования ЭКГ частота ПЭ уменьшилась и составила 5-8 экстрасистол в час. Развитие ФП не отмечалось при наблюдении в течение 3 лет.
Данный пример показывает, что при выявлении у больного с ПЭ и высоким риском развития ФП, увеличение ИРРФП через 7 периодов полувыведения после применения соталола в дозе 120 мг в сутки в сравнении с исходными данными свидетельствует об эффективности использования этого препарата для предупреждения развития (в качестве первичной профилактики) ФП.
Пример 2. Больной Н., 59 лет, поступил в дневной стационар 11.02.2017 г. по направлению участкового врача по поводу частой ПЭ. Из анамнеза известно, что больной страдает гипертонической болезнью в течение последних 8-9 лет. Постоянно принимает индапамид 2,5 мг в день, амлодипин (норваск) 10 мг в сутки. В последние 1-2 месяца стал отмечать появление перебоев в работе сердца. Лечился народными средствами, без эффекта. При суточном мониторировании ЭКГ, выполненном 12.02.2017 г., было выявлено 2433 одиночных ПЭ в среднем с частотой до 99 экстрасистол в час. На третий день пребывания больного в стационаре больному была проведена регистрация сигнал-усредненной ЭКГ полосе частот от 40 до 250 Гц с регистрацией биполярных отведений X, Y, Z по Франку и усреднением до 400 комплексов по волне «Р» с помощью компьютерного комплекса «Поли-спектр-ВР» (фирма «Нейрософт», г. Иваново). Определялись FiP-P, Pd автоматическим методом У больного Н., 59 лет FiP-P составило 135 мс, Pd - 81 мс. Затем была индуцирована ФП с помощью ЧПЭКС. ЧПИА составил 8 имп ⋅ сек., а продолжительность ФП - 33 минуты. В последующем был рассчитан ИРРФП по формуле: 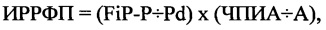
где ИРРФП - риск развития ФП, FiP-P - продолжительность фильтрованной волны «Р» сигнал-усредненной ЭКГ в мс, Pd - дисперсия зубца «Р» в мс, определяемая как разница между максимальными и минимальными значениями продолжительности зубца «Р» при регистрации 12 отведений стандартной ЭКГ, ЧПИА - частотный порог индуцирования аритмии, определяемый как произведение количества стимулов при проведении ЧПЭКС на длительность стимуляции в минутах, А - продолжительность индуцированной аритмии в минутах.
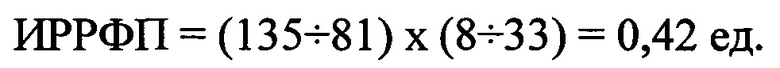
ИРРФП составил 0,40 ед. Согласно способу определения риска развития фибрилляции предсердий, ИРРФП, составивший 0,40 ед., определял высокий риск развития ФП, т.е. в течение 3 месяцев после обследования (Олесин А.И., Просяникова О.Н. Способ определения риска развития фибрилляции предсердий - Патент Российской Федерации №2497446, опубликован 10.11.2013 г., Бюллетень изобретений №31).
После проведения суточного мониторирования ЭКГ, больному Н., 59 лет 13.02.2017 г. проведено скрининговое тестирование противоаритмических средств, проведенным по ранее описанному способу (Олесин А.И., Константинова И.В., Литвиненко В.А., Шлапакова А.В. Способ выбора наиболее эффективного антиаритмического препарата для больных с экстрасистолией. Патент РФ №2641164, опубл. 16.01.18, Бюл. №2.).
13.02.2017 г. больному Н., 59 лет в стационаре в 09 ч была проведена регистрация ЭКГ одновременно в 12 стандартных отведениях с помощью компьютерного комплекса «Полиспектр-ритм» (фирма «Нейрософт», г. Иваново). При регистрации ЭКГ в течение 30 минут было выявлено 44 ПЭ. Затем было рассчитано ЛО ПДИкор., составившее 14 мс и ИЭ по формуле:

где ИЭ - индекс экстрасистолии, А - ЛО ПДИкор. не менее чем в 20 ПЭ, В - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час.
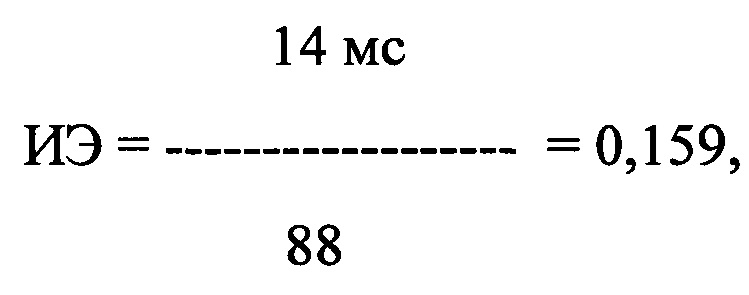
где ИЭ - индекс экстрасистолии, в числителе - ЛО ПДИкор., составившее 14 мс в 44 ПЭ, в знаменателе - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час и составившее 70 в час.
Больному сублингвально был назначен метопролол в дозе 50 мг с последующей регистрацией ЭКГ одновременно в 12 стандартных отведениях с помощью компьютерного комплекса «Полиспектр-ритм» (фирма «Нейро-софт», г. Иваново) через 6 часов после применения препарата, составившие пол-периода полувыведения препарата. При регистрации ЭКГ после использования соталола в течение 60 минут было выявлено 24 ПЭ. Затем было рассчитано ЛО ПДИкор., составившее 29 мс и ИЭ по формуле:
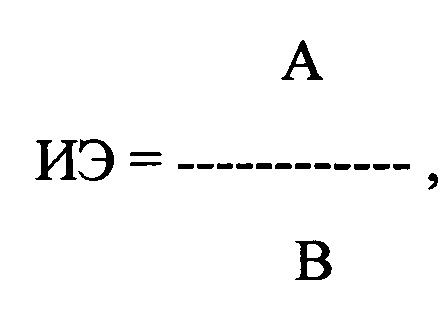
где ИЭ - индекс экстрасистолии, А - ЛО ПДИкор. не менее чем в 20 ПЖЭ, В - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час.

где ИЭ - индекс экстрасистолии, в числителе - ЛО ПДИкор., составившее 42 мс в 24 ПЭ, в знаменателе - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час и составившее 24 в час.
После применения метопролола отмечалось увеличение ИЭ в 11,01 раза в сравнении с исходными данными.
Затем больному Н., 59 лет последовательно, ежедневно было проведено тестирование противоаритмических препаратов - пропранолол в дозе 40 мг, соталол в дозе 80 мг, карведиол в дозе 50 мг, аллапинин в дозе 25 мг, дизопирамид в дозе 200 мг в сутки, внутривенно - пропафенон (пропанорм) в дозе 150 мг, амиодарон в дозе 300 мг. Результаты тестирования антиаритмических препаратов у больного Н., 59 лет представлены в таблице №2.


Примечание: * - исследования проводились через пол-периода полувыведения препарата, ΔМ% - изменения ИЭ после введения препарата в сравнении с исходными данными (в %).
Как видно из представленных данных, наибольшее увеличение ИЭ отмечалось при использовании метопролола.
Больному был назначен метопролол в дозе 100 мг в сутки. Период полувыведения препарата в среднем составляет 12 часов. Через 10 периодов полувыведения, составиший 5 суток [(10×12 часов)÷24 часа)=5 суток] было выполнено повторно суточное мониторирование ЭКГ и был определен ИР-РФП. У больного Н., 59 лет при суточном мониторировании ЭКГ частота ПЭ уменьшилась до 216 в сутки, в среднем составил до 9 экстрасистол в час, FiP-P составило 135 мс, Pd - 74 мс, ЧПИА составил 36 имп ⋅ сек., а продолжительность ФП - 10 минут. В последующем был рассчитан ИРРФП по формуле: 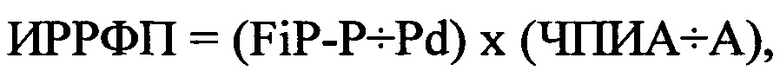 где ИРРФП - риск развития ФП, FiP-P - продолжительность фильтрованной волны «Р» сигнал-усредненной ЭКГ в мс, Pd - дисперсия зубца «Р» в мс, определяемая как разница между максимальными и минимальными значениями продолжительности зубца «Р» при регистрации 12 отведений стандартной ЭКГ, ЧПИА - частотный порог индуцирования аритмии, определяемый как произведение количества стимулов при проведении ЧПЭКС на длительность стимуляции в минутах, А - продолжительность индуцированной аритмии в минутах.
где ИРРФП - риск развития ФП, FiP-P - продолжительность фильтрованной волны «Р» сигнал-усредненной ЭКГ в мс, Pd - дисперсия зубца «Р» в мс, определяемая как разница между максимальными и минимальными значениями продолжительности зубца «Р» при регистрации 12 отведений стандартной ЭКГ, ЧПИА - частотный порог индуцирования аритмии, определяемый как произведение количества стимулов при проведении ЧПЭКС на длительность стимуляции в минутах, А - продолжительность индуцированной аритмии в минутах.

ИРРФП составил 21,99 ед. и увеличился в сравнении с исходными данными в среднем в 16 раз.
В последующем больному была продолжена терапия метопрололом в дозе 100 мг в сутки. При проведении неоднократных процедур суточного мониторирования ЭКГ частота ПЭ уменьшилась и составила 9-10 экстрасистол в час. Развитие ФП не отмечалось при наблюдении в течение 3 лет.
Данный пример показывает, что при выявлении у больного с ПЭ и высоким риском развития ФП, увеличение ИРРФП через 10 периодов полувыведения после применения метопролола в дозе 100 мг в сутки в сравнении с исходными данными свидетельствует об эффективности использования этого препарата для предупреждения развития (в качестве первичной профилактики) ФП.
Пример 3.
Больной Б., 62 года, поступил в дневной стационар 14.09.2017 г. по направлению участкового врача по поводу частой ПЭ. Из анамнеза известно, что больной страдает гипертонической болезнью в течение последних 10-12 лет. Постоянно принимает микардис-плюс в дозе 80 мг в день. В последние 2-3 недели стал отмечать появление перебоев в работе сердца. При суточном мониторировании ЭКГ, выполненном амбулаторно 10.09.2017 г., было выявлено 2547 одиночных ПЭ в среднем с частотой до 106 экстрасистол в час. При суточном мониторировании ЭКГ, выполненном 16.09.2017 г., было выявлено 2234 одиночных ПЭ в среднем с частотой до 93 экстрасистол в час. На следующий день после мониторирования ЭКГ больному в стационаре больному была проведена регистрация сигнал-усредненной ЭКГ полосе частот от 40 до 250 Гц с регистрацией биполярных отведений X, Y, Z по Франку и усреднением до 400 комплексов по волне «Р» с помощью компьютерного комплекса «Поли-спектр-ВР» (фирма «Нейрософт», г. Иваново). Определялись FiP-P, Pd автоматическим методом. У больного Б., 62 года FiP-P составило 137 мс, Pd - 75 мс. Затем была индуцирована ФП с помощью ЧПЭКС. ЧПИА составил 7 имп ⋅ сек., а продолжительность ФП - 32 минуты. В последующем был рассчитан ИРРФП по формуле:

где ИРРФП - риск развития ФП, FiP-P - продолжительность фильтрованной волны «Р» сигнал-усредненной ЭКГ в мс, Pd - дисперсия зубца «Р» в мс, определяемая как разница между максимальными и минимальными значениями продолжительности зубца «Р» при регистрации 12 отведений стандартной ЭКГ, ЧПИА - частотный порог индуцирования аритмии, определяемый как произведение количества стимулов при проведении ЧПЭКС на длительность стимуляции в минутах, А - продолжительность индуцированной аритмии в минутах.

ИРРФП составил 0,40 ед. Согласно способу определения риска развития фибрилляции предсердий, ИРРФП, составивший 0,40 ед, определял высокий риск развития ФП, т.е. в течение 3 месяцев после обследования (Олесин А.И., Просяникова О.Н. Способ определения риска развития фибрилляции предсердий - Патент Российской Федерации №2497446, опубликован 10.11.2013 г., Бюллетень изобретений №31).
После проведения суточного мониторирования ЭКГ, больному Б., 62 года 17.09.2017 г. проведено скрининговое тестирование противоаритмических средств, проведенным по ранее описанному способу (Олесин А.И., Константинова И.В., Литвиненко В.А., Шлапакова А.В. Способ выбора наиболее эффективного антиаритмического препарата для больных с экстрасистолией. Патент РФ №2641164, опубл. 16.01.18, Бюл. №2.).
17.09.2017 г. больному Н., 59 лет в стационаре в 09 ч была проведена регистрация ЭКГ одновременно в 12 стандартных отведениях с помощью компьютерного комплекса «Полиспектр-ритм» (фирма «Нейрософт», г. Иваново). При регистрации ЭКГ в течение 30 минут было выявлено 52 ПЭ. Затем было рассчитано ЛО ПДИкор., составившее 16 мс и ИЭ по формуле:

где ИЭ - индекс экстрасистолии, А - ЛО ПДИкор. не менее чем в 20 ПЭ, В - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час.

где ИЭ - индекс экстрасистолии, в числителе - ЛО ПДИкор., составившее 16 мс в 44 ПЭ, в знаменателе - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час и составившее 104 в час.
Больному сублингвально был назначен метопролол в дозе 50 мг с последующей регистрацией ЭКГ одновременно в 12 стандартных отведениях с помощью компьютерного комплекса «Полиспектр-ритм» (фирма «Нейрософт», г. Иваново) через 6 часов после применения препарата, составившие пол-периода полувыведения препарата. При регистрации ЭКГ после использования метопролола в течение 60 минут было выявлено 42 ПЭ. Затем было рассчитано ЛО ПДИкор., составившее 18 мс и ИЭ по формуле:

где ИЭ - индекс экстрасистолии, А - ЛО ПДИкор. не менее чем в 20 ПЖЭ, В - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час.
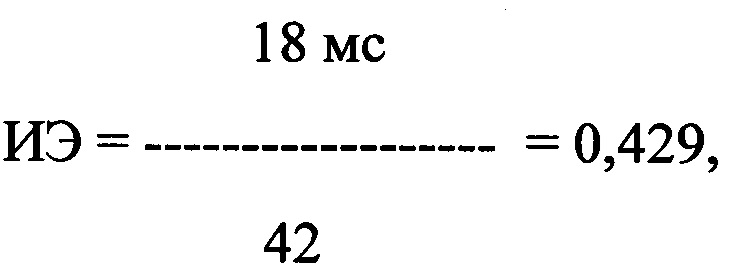
где ИЭ - индекс экстрасистолии, в числителе - ЛО ПДИкор., составившее 18 мс в 42 ПЭ, в знаменателе - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час и составившее 42 в час.
После применения метопролола отмечалось увеличение ИЭ в 11,01 раза в сравнении с исходными данными.
Затем больному Б., 62 года последовательно, ежедневно было проведено тестирование противоаритмических препаратов - пропранолол в дозе 40 мг, соталол в дозе 80 мг, карведиол в дозе 50 мг, аллапинин в дозе 25 мг, дизопирамид в дозе 200 мг в сутки, внутривенно - пропафенон (пропанорм) в дозе 150 мг, амиодарон в дозе 300 мг. Результаты тестирования антиаритмических препаратов у больного Б., 62 года представлены в таблице №3.
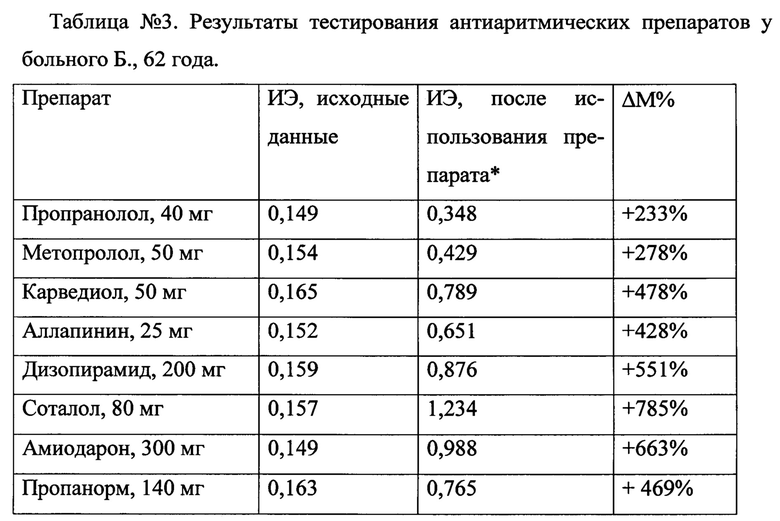
Примечание: * - исследования проводились через пол-периода полувыведения препарата, ΔМ% - изменения ИЭ после введения препарата в сравнении с исходными данными (в %).
Как видно из представленных данных, наибольшее увеличение ИЭ отмечалось при использовании соталола.
Больному был назначен соталол в дозе 160 мг в сутки. Период полувыведения препарата в среднем составляет 12 часов. Через 5 периодов полувыведения, составишие 2,5 суток [(5×12 часов)÷24 часа)=2, 5 суток] был определен ИРРФП.
У больного Б., 62 лет FiP-P составило 137 мс, Pd - 72 мс, ЧПИА составил 8 имп ⋅ сек., а продолжительность ФП - 39 минут. В последующем был рассчитан ИРРФП по формуле:
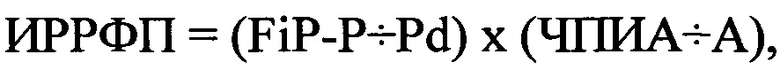
где ИРРФП - риск развития ФП, FiP-P - продолжительность фильтрованной волны «Р» сигнал-усредненной ЭКГ в мс, Pd - дисперсия зубца «Р» в мс, определяемая как разница между максимальными и минимальными значениями продолжительности зубца «Р» при регистрации 12 отведений стандартной ЭКГ, ЧПИА - частотный порог индуцирования аритмии, определяемый как произведение количества стимулов при проведении ЧПЭКС на длительность стимуляции в минутах, А - продолжительность индуцированной аритмии в минутах.
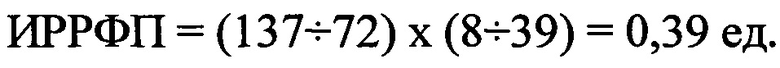
ИРРФП составил 0,39 ед. и он уменьшился в сравнении с исходными данными в среднем в 25%.
Затем повторно через 9 периодов полувыведения соталола, составившие 4,5 суток [(9×12 часов)÷24 часа)=4, 5 суток] был определен ИРРФП. У больного Б., 62 лет FiP-P составило 136 мс, Pd - 68 мс, ЧПИА составил 15 имп ⋅ сек., а продолжительность ФП - 12 минут. В последующем был рассчитан ИРРФП по формуле: 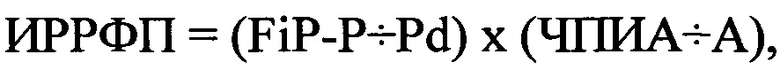 где ИРРФП - риск развития ФП, FiP-P - продолжительность фильтрованной волны «Р» сигнал-усредненной ЭКГ в мс, Pd - дисперсия зубца «Р» в мс, определяемая как разница между максимальными и минимальными значениями продолжительности зубца «Р» при регистрации 12 отведений стандартной ЭКГ, ЧПИА - частотный порог индуцирования аритмии, определяемый как произведение количества стимулов при проведении ЧПЭКС на длительность стимуляции в минутах, А - продолжительность индуцированной аритмии в минутах.
где ИРРФП - риск развития ФП, FiP-P - продолжительность фильтрованной волны «Р» сигнал-усредненной ЭКГ в мс, Pd - дисперсия зубца «Р» в мс, определяемая как разница между максимальными и минимальными значениями продолжительности зубца «Р» при регистрации 12 отведений стандартной ЭКГ, ЧПИА - частотный порог индуцирования аритмии, определяемый как произведение количества стимулов при проведении ЧПЭКС на длительность стимуляции в минутах, А - продолжительность индуцированной аритмии в минутах.

ИРРФП составил 2,5 ед. и он увеличился в сравнении с исходными данными в среднем в 6,25 раза.
В последующем больному была продолжена терапия соталолом в дозе 160 мг в сутки. При проведении неоднократных процедур суточного мониторирования ЭКГ частота ПЭ уменьшилась и составила 5-7 экстрасистол в час. Развитие ФП не отмечалось при наблюдении в течение 2 лет.
Данный пример показывает, что при выявлении у больного с ПЭ и высоким риском развития ФП, увеличение ИРРФП через 5 периодов полувыведения после применения соталола в дозе 160 мг в сутки в сравнении с исходными данными выявляются ложноотрицательные данные об эффективности этого препарата в качестве первичной профилактики ФП, в то время как определение ИРРФП через 9 периодов полувыведения соталола свидетельствует об эффективности использования этого препарата для предупреждения развития (в качестве первичной профилактики) ФП.
Наблюдалось 112 больных МС в возрасте от 58 до 75 лет (в среднем 67,7±1,9 лет). Критерием включения являлось наличие синусового ритма, выявление ПЭ, субъективно ощущающих больными, более 10 экстрасистол в час, хронической сердечной недостаточности (ХСН) I-II класса по NYHA, отсутствие регистрации ФП, в том числе, при проведении не менее 3-4 процедур 1-3 суточного мониторирования ЭКГ не реже 1 раза в 1-3 месяца, выявление высокого и среднего рисков развития этой аритмии (Олесин А.И., Просяникова О.Н. Способ определения риска развития фибрилляции предсердий - Патент Российской Федерации №2497446, опубликован 10.11.2013 г., Бюллетень изобретений №31), информированного согласия больного на проводимое обследование и лечение. В исследование не включали больных острыми коронарными синдромами, синдромом WPW, слабости синусового узла, атриовентрикулярной блокадой, имплантированным искусственным водителем ритма, желудочковой тахикардией, пороками сердца, кардиомиопатиями, дисфункцией щитовидной железы, неконтролируемой артериальной гипертензией, тяжелыми соматическими заболеваниями, которые могли повлиять на результаты исследования, а также пациенты, имеющие ФВлж < 45%, аневризму левого желудочка, ХСН III-IV класса по NYHA. У 96(85,71%) больных была выявлена гипертоническая болезнь, у 16(14,29%) - инфаркт миокарда в анамнезе, у 18(16,07%) - сахарный диабет, у 12(10,71%) - хронический бронхит.
Всем больным проводилась базисная гипотензивная терапия ингибиторами ангиотензинпревращающего фермента (эналаприл (эднит, ренитек, и т.д.), салуретиками (индапамид (арифон) и т.д., включая всех больных, перенесших инфаркт миокарда, а также коррекция содержания глюкозы и липидов крови путем использования диеты, гипогликемических и гиполипидемических препаратов, в частности, статинов.
Всем больным была проведена регистрация сигнал-усредненной ЭКГ полосе частот от 40 до 250 Гц с регистрацией биполярных отведений X, Y, Z по Франку и усреднением до 400 комплексов по волне «Р» с помощью компьютерного комплекса «Поли-спектр-ВР» (фирма «Нейрософт», г. Иваново). Определялись FiP-P, Pd автоматическим методом. До и, как минимум, через 7 периодов полувыведения наиболее эффективного препарата, опроеделенного с помощью скринингового тестирования противоаритмических средств, проведенным по ранее описанному способу (Олесин А.И., Константинова И.В., Литвиненко В.А., Шлапакова А.В. Способ выбора наиболее эффективного антиаритмического препарата для больных с экстрасистолией. Патент РФ №2641164, опубл. 16.01.18, Бюл. №2.), определялся ИРРФП по формуле:
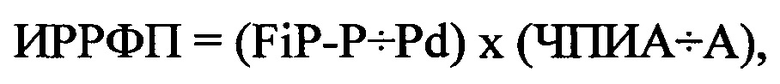
где ИРРФП - риск развития ФП, FiP-P - продолжительность фильтрованной волны «Р» сигнал-усредненной ЭКГ в мс, Pd - дисперсия зубца «Р» в мс, определяемая как разница между максимальными и минимальными значениями продолжительности зубца «Р» при регистрации 12 отведений стандартной ЭКГ, ЧПИА - частотный порог индуцирования аритмии, определяемый как произведение количества стимулов при проведении ЧПЭКС на длительность стимуляции в минутах, А - продолжительность индуцированной аритмии в минутах (Олесин А.И., Просяникова О.Н. Способ определения риска развития фибрилляции предсердий - Патент Российской Федерации №2497446, опубликован 10.11.2013 г., Бюллетень изобретений №31). При увеличении ИРРФП, полученного после проведения ААТ по сравнению с ИРРФП, полученного до этого, прогнозировали проведение фармакологической ААТ в качестве первичной профилактики ФП у больных с ПЭ как эффективную.
Точность прогнозирования (ТП) ААТ, определенной для первичной профилактики ФП, оценивалась по формуле:
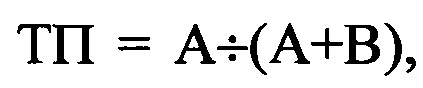 где ТП - точность прогнозирования ААТ, определенной для первичной профилактики ФП (в процентах), А - пациенты без развития ФП после включения в исследование (количество больных, умноженное на период риска развития аритмии, выраженного в месяцах), В - пациенты с фактическим развитием ФП после включения в исследование (количество больных, умноженное на период наблюдения до развития аритмии, выраженный в месяцах).
где ТП - точность прогнозирования ААТ, определенной для первичной профилактики ФП (в процентах), А - пациенты без развития ФП после включения в исследование (количество больных, умноженное на период риска развития аритмии, выраженного в месяцах), В - пациенты с фактическим развитием ФП после включения в исследование (количество больных, умноженное на период наблюдения до развития аритмии, выраженный в месяцах).
После включения в исследование больные наблюдались от 3 до 4-5 лет. Конечной точкой за этот период наблюдения явилось наличие или отсутствие развития ФП. Все исследования, включая суточное мониторирование ЭКГ, проводились не реже 1 раза в 3-4 месяца, контроль за состоянием пациентов, регистрацию ЭКГ - 1 раз в месяц. Регулярный контроль артериального давления и частоты сердечных сокращений пациенты осуществляли самостоятельно.
Статистическая обработка полученных результатов проводилась с использованием критерия "t" Стьюдента, х2, а также стандартных пакетов программ "Statistica", версия 11.0.
Согласно ранее предложенному способу (Олесин А.И., Просяникова О.Н. Способ определения риска развития фибрилляции предсердий - Патент Российской Федерации №2497446, опубликован 10.11.2013 г., Бюллетень изобретений №31), все больные в зависимости от риска развития ФП были распределены на две группы. В I группу вошло 45(40,18%) больных с высоким риском развития ФП, у которых риск развития этой аритмии в течение 3 месяцев, остальные больные составили II группу, у которых был выявлен риск развития ФП от 3 месяцев до 1 года после первого обследования. Состояние ИРРФП (в ед.) при выборе наиболее эффективной ААТ ПЭ и ТП этой терапии в качестве первичной профилактики ФП у больных I и II группы представлено в таблице 4. Как видно из таблицы, наиболее эффективными препаратами для устранения ПЭ у больных I и II группы оказались пропранолол, метопролол, соталол, пропафенон, причем ТП этой терапии в качестве первичной профилактики ФП у больных этих групп в среднем составила 93,57% и 95,27% соответственно.
Таким образом, ТП ААТ ПЭ, используемой в качестве первичной профилактики ФП, у больных с высоким и средним риском развития этой аритмии в среднем составила 93,57% и 95,27% соответственно.


Примечание: ИРРФП - индекс риска развития ФП, ТП - точность прогнозирования положительного клинического эффекта ААТ, определенной в качестве первичной профилактики ФП, А - исходные данные, Б - после применения препарата,  - в числителе препарат, используемый в I группе, в знаменателе - во II группе; * - достоверное различие показателей в сравнении с исходными данными (при р<0,001).
- в числителе препарат, используемый в I группе, в знаменателе - во II группе; * - достоверное различие показателей в сравнении с исходными данными (при р<0,001).
Таким образом, впервые разработан способ прогнозирования эффективности фармакологической ААТ в качестве первичной профилактики ФП у больных с ПЭ.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ прогнозирования развития фибрилляции предсердий у больных с предсердной экстрасистолией | 2021 |
|
RU2763978C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ПРОДОЛЖИТЕЛЬНОСТИ СОХРАНЕНИЯ ПОЛОЖИТЕЛЬНОГО ЭФФЕКТА ФАРМАКОЛОГИЧЕСКОЙ АНТИАРИТМИЧЕСКОЙ ТЕРАПИИ У БОЛЬНЫХ С ЭКСТРАСИСТОЛИЕЙ | 2020 |
|
RU2749851C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ ПРОВЕДЕНИЯ МОДУЛИРОВАННОЙ КИНЕЗОТЕРАПИИ В КАЧЕСТВЕ ПЕРВИЧНОЙ ПРОФИЛАКТИКИ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ У БОЛЬНЫХ С ПРЕДСЕРДНОЙ ЭКСТРАСИСТОЛИЕЙ | 2017 |
|
RU2667827C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ РИСКА РАЗВИТИЯ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ У БОЛЬНЫХ С ПРЕДСЕРДНОЙ ЭКСТРАСИСТОЛИЕЙ | 2014 |
|
RU2556602C1 |
| СПОСОБ ВЫБОРА НАИБОЛЕЕ ЭФФЕКТИВНОГО АНТИАРИТМИЧЕСКОГО ПРЕПАРАТА ДЛЯ БОЛЬНЫХ С ЭКСТРАСИСТОЛИЕЙ | 2017 |
|
RU2641164C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ РИСКА РАЗВИТИЯ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ | 2012 |
|
RU2497446C1 |
| СПОСОБ ВЫБОРА ЭФФЕКТИВНОГО АНТИАРИТМИЧЕСКОГО ПРЕПАРАТА ДЛЯ БОЛЬНЫХ С ЭКСТРАСИСТОЛИЕЙ | 2019 |
|
RU2707261C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ ПАРОКСИЗМОВ МЕРЦАНИЯ И ТРЕПЕТАНИЯ ПРЕДСЕРДИЙ У БОЛЬНЫХ С НАДЖЕЛУДОЧКОВОЙ ЭКСТРАСИСТОЛИЕЙ | 2006 |
|
RU2312592C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ РИСКА РАЗВИТИЯ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ У БОЛЬНЫХ С ПРЕДСЕРДНОЙ ЭКСТРАСИСТОЛИЕЙ | 2017 |
|
RU2657189C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ ПАРОКСИЗМОВ МЕРЦАНИЯ И ТРЕПЕТАНИЯ ПРЕДСЕРДИЙ У БОЛЬНЫХ С НАДЖЕЛУДОЧКОВОЙ ЭКСТРАСИСТОЛИЕЙ | 2005 |
|
RU2294137C2 |
Изобретение относится к медицине, а именно к кардиологии. Определяют индекс риска развития фибрилляции предсердий (ИРРФП) по оригинальной формуле до и после проведения антиаритмической терапии (ААТ), используемой как минимум в течение 7 периодов полувыведения препарата. При увеличении ИРРФП, полученного после проведения ААТ по сравнению с ИРРФП, полученного до этого, прогнозируют проведение фармакологической ААТ в качестве первичной профилактики ФП у больных с ПЭ как эффективную. Способ позволяет осуществить прогнозирование эффективности фармакологической ААТ в качестве первичной профилактики фибрилляции предсердий у больных с предсердной экстросистолией. 4 табл., 3 пр.
Способ прогнозирования эффективности фармакологической антиаритмической терапии (ААТ) в качестве первичной профилактики фибрилляции предсердий (ФП) у больных с предсердной экстрасистолией (ПЭ), заключающийся в том, что до и после проведения ААТ, используемой как минимум в течение 7 периодов полувыведения препарата, выполняют электрокардиографическое (ЭКГ) исследование, чреспищеводную электрокардиостимуляцию (ЧПЭКС) и определяют индекс риска развития фибрилляции предсердий (ИРРФП) по формуле
ИРРФП=(FiP-P÷Pd)×(ЧПИА÷А),
где ИРРФП - риск развития ФП, FiP-P - продолжительность фильтрованной волны «Р» сигнал-усредненной ЭКГ в мс, Pd - дисперсия зубца «Р» в мс, определяемая как разница между максимальными и минимальными значениями продолжительности зубца «Р» при регистрации 12 отведений стандартной ЭКГ, ЧПИА - частотный порог индуцирования аритмии, определяемый как произведение количества стимулов при проведении ЧПЭКС на длительность стимуляции в минутах, А - продолжительность индуцированной аритмии в минутах, и при увеличении ИРРФП, полученного после проведения ААТ по сравнению с ИРРФП, полученного до этого, прогнозируют проведение фармакологической ААТ в качестве первичной профилактики ФП у больных с ПЭ как эффективную.
| СПОСОБ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ АНТИАРИТМИЧЕСКОЙ ТЕРАПИИ | 2011 |
|
RU2492483C2 |
| СПОСОБ ВЫБОРА НАИБОЛЕЕ ЭФФЕКТИВНОГО АНТИАРИТМИЧЕСКОГО ПРЕПАРАТА ДЛЯ БОЛЬНЫХ С ЭКСТРАСИСТОЛИЕЙ | 2017 |
|
RU2641164C1 |
| ОСЛОПОВА Ю.В | |||
| Эффективность пропафенона в лечении экстрасистолии, Казанский медицинский журнал, 2010,2, с.152-158 | |||
| NICOLAY JP., Stimulation of erythrocyte cell membrane scrambling by amiodarone, Cell Physiol Biochem 2007; 20(6):1043-50, реферат. | |||
Авторы
Даты
2019-05-21—Публикация
2018-10-12—Подача