ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая заявка публикуется вместе с Перечнем последовательностей в электронном формате. Перечень последовательностей предоставлен в виде файла, озаглавленного BIOL0171WOSEQ_ST25.txt, созданного 1 августа 2014 г., размер которого составляет приблизительно 276 кбит. Информация приведенного в электронном формате перечня последовательностей в полном объеме включена в данный документ.
ОБЛАСТЬ ТЕХНИКИ
В данном документе предложены способы, соединения и композиции для снижения экспрессии мРНК и белка DMPK у животного. Также, в данном документе предложены способы, соединения и композиции, содержащие ингибитор DMPK для преимущественного снижения РНК CUGexp DMPK, снижения миотонии или снижения патологии сплайсинга у животного. Такие способы, соединения и композиции применимы, например, для лечения, предотвращения или облегчения миотонической дистрофии 1 типа (МД1) у животного.
УРОВЕНЬ ТЕХНИКИ
Миотоническая дистрофия 1 типа (МД1) является наиболее распространенной формой мышечной дистрофии среди взрослого населения и встречается, согласно оценкам, у 1 из 7500 человек (Harper PS., Myotonic Dystrophy. London: W.B. Saunders Company; 2001). МД1 является аутосомным доминантным расстройством, вызванным экспансией некодирующего повтора CTG в DMPK1. DMPK1 представляет собой ген, кодирующий цитозольную серин/треонин киназу (Brook JD, et al., Cell., 1992, 68(4): 799-808). Физиологические функции и субстраты этой киназы определены не полностью. Экспансированный повтор CTG расположен в 3' нетранслируемой области (НТО) DMPK1. Эта мутация приводит к доминированию РНК-процессу, в котором экспрессия РНК, содержащейся в экспансированном повторе CUG (CUGexp), индуцирует нарушение клеточной функции (Osborne RJ and Thornton CA., Human Molecular Genetics., 2006, 15(2): R162-R169).
Нормальный ген DMPK содержит 5-37 CTG-повторов в 3' нетранслируемой области. При миотонической дистрофии I типа это число существенно возрастает и соответствует диапазону, например, от 50 до более чем 3500 (Harper, Myotonic Dystrophy (Saunders, London, ed. 3, 2001); Annu. Rev. Neurosci. 29: 259, 2006; EMBO J. 19: 4439, 2000; Curr Opin Neurol. 20: 572, 2007).
Участок CUGexp взаимодействует с РНК-связывающими белками, включая «muscleblind-like» белок (MBNL), являющийся фактором сплайсинга, и приводит к тому, что мутантный транскрипт удерживается в ядре. Токсичность этой РНК связана с секвестрацией РНК-связывающих белков и активацией сигнальных путей. Исследования, проводимые на животных моделях, показали, что фенотипы МД1 могут быть обращены в случае снижения токсичности РНК CUGexp (Wheeler TM, et al., Science., 2009, 325(5938): 336-339; Mulders SA, et al., Proc Natl Acad Sci USA., 2009, 106(33): 13915-13920).
Наиболее поражаемой тканью при МД1 являются скелетные мышцы, но заболевание также оказывает существенное влияние на сердечные и гладкие мышцы, глазные линзы и головной мозг. Преимущественно поражаются мышцы головы, дистальные мышцы конечностей и мышцы диафрагмы. Происходит раннее нарушение мануальной ловкости, которое приводит к нескольким десятилетиям тяжелой формы инвалидности. Средний возраст умерших составляет 55 лет, а причиной обычно является дыхательная недостаточность (de Die-Smulders СЕ, et al., Brain., 1998, 121(Pt 8): 1557-1563).
Появление антисмысловых технологий как эффективного средства для модуляции экспрессии определенных генных продуктов, следовательно, может оказаться исключительно полезным в большом количестве терапевтических, диагностических и исследовательских применений для модуляции DMPK1. Было показано, что в случае мышей внутримышечная инъекция полностью модифицированных олигонуклеотидов, нацеленных на CAG-повторы, блокирует образование комплексов CUGexp-MBNLl, рассеивает ядерные очаги транскриптов CUGexp, повышает ядерно-цитоплазматический транспорт и трансляцию транскриптов CUGexp, приводит к высвобождению белков MBNL в нуклеоплазму, нормализует альтернативный сплайсинг MBNL-зависимых экзонов и устраняет миотонию у экспрессирующих CUGexp трансгенных мышей (Wheeler TM, et al., Science., 2009, 325(5938): 336-339; WO 2008/036406).
В настоящее время не существует лечения, которое могло бы модифицировать протекание МД1. Следовательно, уровень заболеваемости является значительным. Таким образом, объектом данного изобретения являются соединения, композиции и способы лечения МД1.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В данном документе предложены способы, соединения и композиции для ингибирования экспрессии DMPK и лечения, предотвращения, отложения начала или облегчения связанного с DMPK заболевания и/или его симптома. В определенных вариантах реализации изобретения раскрытые в данном документе соединения и композиции ингибируют мутантный DMPK или CUGexp DMPK.
В определенных вариантах реализации изобретения предложен способ снижения экспрессии DMPK у животного, включающий введение животному соединения, содержащего модифицированный олигонуклеотид, как дополнительно описано в данном документе, нацеленный на DMPK.
В определенных вариантах реализации изобретения предложен способ преимущественного снижения CUGexp DMPK по сравнению с DMPK дикого типа, снижения миотонии или снижения патологии сплайсинга у животного, включающий введение животному соединения, содержащего модифицированный олигонуклеотид, как дополнительно описано в данном документе, нацеленный на CUGexp DMPK. В некоторых случаях считается, что транскрипты CUGexp DMPK являются особенно чувствительными к антисмысловому нокдауну, осуществляемому при помощи ядерных рибонуклеаз (таких как РНКаза Н), вследствие своего большего времени удержания в ядре, и считается, что эта чувствительность делает возможным эффективное антисмысловое ингибирование транскриптов CUGexp DMPK в соответствующих тканях, таких как мышцы, несмотря на барьеры, связанные с биораспределением и тканевым поглощением антисмысловых олигонуклеотидов. Антисмысловые механизмы, которые не приводят к расщеплению ядерными рибонуклеазами, такие как АСО CAG-повторов, описанные, например, в Wheeler ТМ, et al., Science., 2009, 325(5938): 336-339 и WO 2008/036406, не обеспечивают такого терапевтического преимущества.
В определенных вариантах реализации изобретения предложен способ лечения животного, имеющего миотоническую дистрофию 1 типа. В определенных вариантах реализации изобретения указанный способ включает введение животному терапевтически эффективного количества соединения, содержащего модифицированный олигонуклеотид, как дополнительно описано в данном документе, нацеленный на DMPK. В определенных вариантах реализации изобретения указанный способ включает выявление животного с миотонической дистрофией 1 типа.
В определенных вариантах реализации изобретения предложен способ лечения, предотвращения, отложения начала или облегчения симптомов и последствий, связанных с развитием МД1, включая ригидность мышц, миотонию, слабость периферийных мышц, приводящую к недееспособности, слабость мышц лица и челюсти, затрудненное глотание, нависание век (птоз), слабость мышц шеи, слабость мышц рук и ног, постоянную мышечную боль, патологическую сонливость, мышечную атрофию, дисфагию, дыхательную недостаточность, нерегулярное сердцебиение, повреждение сердечной мышцы, апатию, резистентность к инсулину и катаракты. В определенных вариантах реализации изобретения предложен способ лечения, предотвращения, отложения начала или облегчения симптомов и последствий, связанных с развитием МД1 у детей, включая отставание в развитии, проблемы с обучаемостью, языковые и речевые проблемы, а также проблемы личностного развития.
В определенных вариантах реализации изобретения предложен способ введения антисмыслового олигонуклеотида для противодействия доминированию РНК путем управления расщеплением патогенных транскриптов.
В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа NM_001081560.1 (включенную в данный документ как SEQ ID №: 1). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа NT_011109.15, усеченную от нуклеотида 18540696 до 18555106 (включенную в данный документ как SEQ ID №: 2). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа NT_039413.7, усеченную от нуклеотида 16666001 до 16681000 (включенную в данный документ как SEQ ID №: 3). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа NM_032418.1 (включенную в данный документ как SEQ ID №: 4). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа AI007148.1 (включенную в данный документ как SEQ ID №: 5). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа AI304033.1 (включенную в данный документ как SEQ ID №: 6). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа ВС024150.1 (включенную в данный документ как SEQ ID №: 7). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа ВС056615.1 (включенную в данный документ как SEQ ID №: 8). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа ВС075715.1 (включенную в данный документ как SEQ ID №: 9). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа BU519245.1 (включенную в данный документ как SEQ ID №: 10). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа СВ247909.1 (включенную в данный документ как SEQ ID №: 11). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа СХ208906.1 (включенную в данный документ как SEQ ID №: 12). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа СХ732022.1 (включенную в данный документ как SEQ ID №: 13). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа S60315.1 (включенную в данный документ как SEQ ID №: 14). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа S60316.1 (включенную в данный документ как SEQ ID №: 15). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа NM_001081562.1 (включенную в данный документ как SEQ ID №: 16). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа NM_001100.3 (включенную в данный документ как SEQ ID №: 17).
В настоящем изобретении предложены следующие неограничивающие пронумерованные варианты реализации:
Вариант реализации 1. Соединение, содержащее модифицированный олигонуклеотид, состоящий из 10-30 связанных нуклеозидов и имеющий нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 8 смежных нуклеотидных оснований, комплементарных области-мишени нуклеиновой кислоты DMPK эквивалентной длины.
Вариант реализации 2. Соединение по варианту реализации 1, отличающееся тем, что по меньшей мере один нуклеозид модифицированного олигонуклеотида содержит бициклический сахар, выбранный из cEt, LNA, α-L-LNA, ENA и 2'-тио LNA.
Вариант реализации 3. Соединение по любому из вариантов реализации 1-2, отличающееся тем, что область-мишень представляет собой экзон 9 нуклеиновой кислоты DMPK.
Вариант реализации 4. Соединение по любому из вариантов реализации 1-3, отличающееся тем, что комплементарная область содержит по меньшей мере 10 смежных нуклеотидных оснований, комплементарных области-мишени транскрипта DMPK эквивалентной длины.
Вариант реализации 5. Соединение по любому из вариантов реализации 1-3, отличающееся тем, что комплементарная область содержит по меньшей мере 12 смежных нуклеотидных оснований, комплементарных области-мишени нуклеиновой кислоты DMPK эквивалентной длины.
Вариант реализации 6. Соединение по любому из вариантов реализации 1-3, отличающееся тем, что комплементарная область содержит по меньшей мере 14 смежных нуклеотидных оснований, комплементарных области-мишени нуклеиновой кислоты DMPK эквивалентной длины.
Вариант реализации 7. Соединение по любому из вариантов реализации 1-3, отличающееся тем, что комплементарная область содержит по меньшей мере 16 смежных нуклеотидных оснований, комплементарных области-мишени нуклеиновой кислоты DMPK эквивалентной длины.
Вариант реализации 8. Соединение по любому из вариантов реализации 1-7, отличающееся тем, что нуклеиновая кислота DMPK представляет собой пре-мРНК DMPK.
Вариант реализации 9. Соединение по любому из вариантов реализации 1-7, отличающееся тем, что нуклеиновая кислота DMPK представляет собой мРНК DMPK.
Вариант реализации 10. Соединение по любому из вариантов реализации 1-9, отличающееся тем, что нуклеиновая кислота DMPK имеет нуклеотидную последовательность, выбранную из SEQ ID №: 1 и SEQ ID №: 2.
Вариант реализации 11. Соединение по любому из вариантов реализации 1-10, отличающееся тем, что модифицированный олигонуклеотид имеет нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 10 смежных нуклеотидных оснований, комплементарную области-мишени эквивалентной длины из SEQ ID №: 1 или SEQ ID №: 2.
Вариант реализации 12. Соединение по любому из вариантов реализации 1-10, отличающееся тем, что модифицированный олигонуклеотид имеет нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 12 смежных нуклеотидных оснований, комплементарную области-мишени эквивалентной длины из SEQ ID №: 1 или SEQ ID №: 2.
Вариант реализации 13. Соединение по любому из вариантов реализации 1-10, отличающееся тем, что модифицированный олигонуклеотид имеет нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 14 смежных нуклеотидных оснований, комплементарную области-мишени эквивалентной длины из SEQ ID №: 1 или SEQ ID №: 2.
Вариант реализации 14. Соединение по любому из вариантов реализации 1-10, отличающееся тем, что модифицированный олигонуклеотид имеет нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 16 смежных нуклеотидных оснований, комплементарную области-мишени эквивалентной длины из SEQ ID №: 1 или SEQ ID №: 2.
Вариант реализации 15. Соединение по любому из вариантов реализации 1-14, отличающееся тем, что область-мишень расположена от нуклеотидного основания 1343 до нуклеотидного основания 1368 SEQ ID №: 1.
Вариант реализации 16. Соединение по любому из вариантов реализации 1-14, отличающееся тем, что область-мишень расположена от нуклеотидного основания 1317 до нуклеотидного основания 1366 SEQ ID №: 1.
Вариант реализации 17. Соединение по любому из вариантов реализации 1-14, отличающееся тем, что область-мишень расположена от нуклеотидного основания 2748 до нуклеотидного основания 2791 SEQ ID №: 1.
Вариант реализации 18. Соединение по любому из вариантов реализации 1-14, отличающееся тем, что область-мишень расположена от нуклеотидного основания 730 до нуклеотидного основания 748 SEQ ID №: 1.
Вариант реализации 19. Соединение по любому из вариантов реализации 1-14, отличающееся тем, что область-мишень расположена от нуклеотидного основания 10195 до нуклеотидного основания 10294 SEQ ID №: 2.
Вариант реализации 20. Соединение по любому из вариантов реализации 1-14, отличающееся тем, что область-мишень расположена от нуклеотидного основания 10195 до нуклеотидного основания 10294 SEQ ID №: 2.
Вариант реализации 21. Соединение по любому из вариантов реализации 1-14, отличающееся тем, что область-мишень расположена от нуклеотидного основания 10201 до нуклеотидного основания 10216 SEQ ID №: 2.
Вариант реализации 22. Соединение по любому из вариантов реализации 1-14, отличающееся тем, что область-мишень расположена от нуклеотидного основания 10202 до нуклеотидного основания 10218 SEQ ID №: 2.
Вариант реализации 23. Соединение по любому из вариантов реализации 1-22, отличающееся тем, что модифицированный олигонуклеотид имеет нуклеотидную последовательность, которая является по меньшей мере на 80% комплементарной области-мишени на протяжении всей длины олигонуклеотида.
Вариант реализации 24. Соединение по любому из вариантов реализации 1-22, отличающееся тем, что модифицированный олигонуклеотид имеет нуклеотидную последовательность, которая является по меньшей мере на 90% комплементарной области-мишени на протяжении всей длины олигонуклеотида.
Вариант реализации 25. Соединение по любому из вариантов реализации 1-22, отличающееся тем, что модифицированный олигонуклеотид имеет нуклеотидную последовательность, которая является по меньшей мере на 100% комплементарной области-мишени на протяжении всей длины олигонуклеотида.
Вариант реализации 26. Соединение по любому из вариантов реализации 1-25, содержащее по меньшей мере 8 смежных нуклеотидных оснований из последовательности, приведенной в любой из SEQ ID №: 23-874.
Вариант реализации 27. Соединение по любому из вариантов реализации 1-25, отличающееся тем, что модифицированный олигонуклеотид имеет нуклеотидную последовательность, содержащую по меньшей мере 10 смежных нуклеотидных оснований из последовательности, приведенной в SEQ ID №: 23-32.
Вариант реализации 28. Соединение по любому из вариантов реализации 1-25, отличающееся тем, что модифицированный олигонуклеотид имеет нуклеотидную последовательность, содержащую по меньшей мере 12 смежных нуклеотидных оснований из последовательности, приведенной в SEQ ID №: 23-32.
Вариант реализации 29. Соединение по любому из вариантов реализации 1-25, отличающееся тем, что модифицированный олигонуклеотид имеет нуклеотидную последовательность, содержащую по меньшей мере 14 смежных нуклеотидных оснований из последовательности, приведенной в SEQ ID №: 23-32.
Вариант реализации 30. Соединение по любому из вариантов реализации 1-25, отличающееся тем, что модифицированный олигонуклеотид имеет нуклеотидную последовательность, содержащую по меньшей мере 16 смежных нуклеотидных оснований из последовательности, приведенной в SEQ ID №: 23-32.
Вариант реализации 31. Соединение по любому из вариантов реализации 1-30, отличающееся тем, что модифицированный олигонуклеотид имеет нуклеотидную последовательность, которая состоит из последовательности, приведенной в SEQ ID №: 23.
Вариант реализации 32. Соединение по любому из вариантов реализации 1-14, отличающееся тем, что модифицированный олигонуклеотид имеет нуклеотидную последовательность, которая состоит из последовательности, приведенной в SEQ ID №: 25.
Вариант реализации 33. Соединение по любому из вариантов реализации 1-14, отличающееся тем, что модифицированный олигонуклеотид имеет нуклеотидную последовательность, которая состоит из последовательности, приведенной в SEQ ID №: 26.
Вариант реализации 34. Соединение по любому из вариантов реализации 1-14, отличающееся тем, что модифицированный олигонуклеотид имеет нуклеотидную последовательность, которая состоит из последовательности, приведенной в SEQ ID №: 27.
Вариант реализации 35. Соединение по любому из вариантов реализации 1-14, отличающееся тем, что модифицированный олигонуклеотид имеет нуклеотидную последовательность, которая состоит из последовательности, приведенной в SEQ ID №: 28.
Вариант реализации 36. Соединение по любому из вариантов реализации 1-14, отличающееся тем, что модифицированный олигонуклеотид имеет нуклеотидную последовательность, которая состоит из последовательности, приведенной в SEQ ID №: 29.
Вариант реализации 37. Соединение по любому из вариантов реализации 1-14, отличающееся тем, что модифицированный олигонуклеотид имеет нуклеотидную последовательность, которая состоит из последовательности, приведенной в SEQ ID №: 30.
Вариант реализации 38. Соединение по любому из вариантов реализации 1-14, отличающееся тем, что модифицированный олигонуклеотид имеет нуклеотидную последовательность, которая состоит из последовательности, приведенной в SEQ ID №: 31.
Вариант реализации 39. Соединение по любому из вариантов реализации 1-14, отличающееся тем, что модифицированный олигонуклеотид имеет нуклеотидную последовательность, которая состоит из последовательности, приведенной в SEQ ID №: 32.
Вариант реализации 40. Соединение по любому из вариантов реализации 1-14, отличающееся тем, что модифицированный олигонуклеотид имеет нуклеотидную последовательность, содержащую последовательность, приведенную в SEQ ID №: 23, 24, 25, 26, 27, 28, 29, 30, 31 или 32.
Вариант реализации 41. Соединение по любому из вариантов реализации 1-14, отличающееся тем, что модифицированный олигонуклеотид имеет нуклеотидную последовательность, содержащую последовательность, приведенную в SEQ ID №: 23, 25, 26, 27, 28, 29, 30, 31 или 32.
Вариант реализации 42. Соединение по любому из вариантов реализации 1-14, отличающееся тем, что модифицированный олигонуклеотид имеет нуклеотидную последовательность, содержащую последовательность, приведенную в SEQ ID №: 33-874.
Вариант реализации 43. Соединение по любому из вариантов реализации 1-42, отличающееся тем, что нуклеотидная последовательность модифицированного олигонуклеотида является по меньшей мере на 90% комплементарной SEQ ID №: 1-19.
Вариант реализации 44. Соединение по любому из вариантов реализации 1-34, отличающееся тем, что нуклеотидная последовательность модифицированного олигонуклеотида является по меньшей мере на 100% комплементарной SEQ ID №: 1-19.
Вариант реализации 45. Соединение по любому из вариантов реализации 1-30, отличающееся тем, что модифицированный олигонуклеотид состоит из 16 связанных нуклеозидов.
Вариант реализации 46. Соединение по любому из вариантов реализации 1-30, отличающееся тем, что модифицированный олигонуклеотид состоит из 17 связанных нуклеозидов.
Вариант реализации 47. Соединение по любому из вариантов реализации 1-30, отличающееся тем, что модифицированный олигонуклеотид состоит из 18 связанных нуклеозидов.
Вариант реализации 48. Соединение по любому из вариантов реализации 1-30, отличающееся тем, что модифицированный олигонуклеотид состоит из 19 связанных нуклеозидов.
Вариант реализации 49. Соединение по любому из вариантов реализации 1-30, отличающееся тем, что модифицированный олигонуклеотид состоит из 20 связанных нуклеозидов.
Вариант реализации 50. Соединение по любому из вариантов реализации 1-49, отличающееся тем, что модифицированный олигонуклеотид представляет собой одноцепочечный олигонуклеотид.
Вариант реализации 51. Соединение по любому из вариантов реализации 1-50, отличающееся тем, что по меньшей мере один нуклеозид содержит модифицированный сахар.
Вариант реализации 52. Соединение по любому из вариантов реализации 1-51, отличающееся тем, что по меньшей мере два нуклеозида содержат модифицированный сахар.
Вариант реализации 53. Соединение по варианту реализации 52, отличающееся тем, что каждый из модифицированных сахаров имеет одинаковую модификацию.
Вариант реализации 54. Соединение по варианту реализации 52, отличающееся тем, что по меньшей мере один из модифицированных сахаров имеет иную модификацию.
Вариант реализации 55. Соединение по любому из вариантов реализации 51-54, отличающееся тем, что по меньшей мере один модифицированный сахар представляет собой бициклический сахар.
Вариант реализации 56. Соединение по варианту реализации 55, отличающееся тем, что бициклический сахар выбран из cEt, LNA, α-L-LNA, ENA и 2'-тио LNA.
Вариант реализации 57. Соединение по варианту реализации 56, отличающееся тем, что бициклический сахар содержит cEt.
Вариант реализации 58. Соединение по варианту реализации 56, отличающееся тем, что бициклический сахар содержит LNA.
Вариант реализации 59. Соединение по варианту реализации 56, отличающееся тем, что бициклический сахар содержит α-L-LNA.
Вариант реализации 60. Соединение по варианту реализации 56, отличающееся тем, что бициклический сахар содержит ENA.
Вариант реализации 61. Соединение по варианту реализации 56, отличающееся тем, что бициклический сахар содержит 2'-тио LNA.
Вариант реализации 62. Соединение по любому из вариантов реализации 1-61, отличающееся тем, что по меньшей мере один модифицированный сахар содержит 2'-замещенный нуклеозид.
Вариант реализации 63. Соединение по варианту реализации 62, отличающееся тем, что 2'-замещенный нуклеозид выбран из: 2'-ОСН3, 2'-F и 2'-O-метоксиэтила.
Вариант реализации 64. Соединение по любому из вариантов реализации 1-63, отличающееся тем, что по меньшей мере один модифицированный сахар содержит 2'-O-метоксиэтил.
Вариант реализации 65. Соединение по любому из вариантов реализации 1-64, отличающееся тем, что по меньшей мере один нуклеозид содержит модифицированное нуклеотидное основание.
Вариант реализации 66. Соединение по варианту реализации 65, отличающееся тем, что модифицированное нуклеотидное основание представляет собой 5-метилцитозин.
Вариант реализации 67. Соединение по любому из вариантов реализации 1-67, отличающееся тем, что каждый цитозин представляет собой 5-метилцитозин.
Вариант реализации 68. Соединение по любому из вариантов реализации 1-67, отличающееся тем, что модифицированный олигонуклеотид содержит:
а. гэп-сегмент, состоящий из связанных дезоксинуклеозидов;
b. сегмент 5' крыла, состоящий из связанных нуклеозидов;
с. сегмент 3' крыла, состоящий из связанных нуклеозидов;
d. при этом гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла, а каждый нуклеозид каждого сегмента крыла содержит модифицированный сахар.
Вариант реализации 69. Соединение по варианту реализации 68, отличающееся тем, что модифицированный олигонуклеотид состоит из 16 связанных нуклеозидов.
Вариант реализации 70. Соединение по варианту реализации 68, отличающееся тем, что модифицированный олигонуклеотид состоит из 17 связанных нуклеозидов.
Вариант реализации 71. Соединение по варианту реализации 68, отличающееся тем, что модифицированный олигонуклеотид состоит из 18 связанных нуклеозидов.
Вариант реализации 72. Соединение по варианту реализации 68, отличающееся тем, что модифицированный олигонуклеотид состоит из 19 связанных нуклеозидов.
Вариант реализации 73. Соединение по варианту реализации 68, отличающееся тем, что модифицированный олигонуклеотид состоит из 20 связанных нуклеозидов.
Вариант реализации 74. Соединение по любому из вариантов реализации 68-73, отличающееся тем, что сегмент 5' крыла состоит из двух связанных нуклеозидов.
Вариант реализации 75. Соединение по любому из вариантов реализации 68-73, отличающееся тем, что сегмент 5' крыла состоит из трех связанных нуклеозидов.
Вариант реализации 76. Соединение по любому из вариантов реализации 68-73, отличающееся тем, что сегмент 5' крыла состоит из четырех связанных нуклеозидов.
Вариант реализации 77. Соединение по любому из вариантов реализации 68-73, отличающееся тем, что сегмент 5' крыла состоит из пяти связанных нуклеозидов.
Вариант реализации 78. Соединение по любому из вариантов реализации 68-73, отличающееся тем, что сегмент 5' крыла состоит из шести связанных нуклеозидов.
Вариант реализации 79. Соединение по любому из вариантов реализации 68-78, отличающееся тем, что сегмент 3' крыла состоит из двух связанных нуклеозидов.
Вариант реализации 80. Соединение по любому из вариантов реализации 68-78, отличающееся тем, что сегмент 3' крыла состоит из трех связанных нуклеозидов.
Вариант реализации 81. Соединение по любому из вариантов реализации 68-78, отличающееся тем, что сегмент 3' крыла состоит из четырех связанных нуклеозидов.
Вариант реализации 82. Соединение по любому из вариантов реализации 68-78, отличающееся тем, что сегмент 3' крыла состоит из пяти связанных нуклеозидов.
Вариант реализации 83. Соединение по любому из вариантов реализации 68-78, отличающееся тем, что сегмент 3' крыла состоит из шести связанных нуклеозидов.
Вариант реализации 84. Соединение по любому из вариантов реализации 68-83, отличающееся тем, что гэп-сегмент состоит из шести связанных дезоксинуклеозидов.
Вариант реализации 85. Соединение по любому из вариантов реализации 68-83, отличающееся тем, что гэп-сегмент состоит из семи связанных дезоксинуклеозидов.
Вариант реализации 86. Соединение по любому из вариантов реализации 68-83, отличающееся тем, что гэп-сегмент состоит из восьми связанных дезоксинуклеозидов.
Вариант реализации 87. Соединение по любому из вариантов реализации 68-83, отличающееся тем, что гэп-сегмент состоит из девяти связанных дезоксинуклеозидов.
Вариант реализации 88. Соединение по любому из вариантов реализации 68-83, отличающееся тем, что гэп-сегмент состоит из десяти связанных дезоксинуклеозидов.
Вариант реализации 89. Соединение по любому из вариантов реализации 1-31, 34, 37-45 или 53-88, отличающееся тем, что модифицированный олигонуклеотид состоит из 16 связанных нуклеозидов и содержит:
а. гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов;
b. сегмент 5' крыла, состоящий из трех связанных нуклеозидов;
с. сегмент 3' крыла, состоящий из трех связанных нуклеозидов;
d. при этом гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла, а каждый нуклеозид каждого сегмента крыла содержит бициклический сахар.
Вариант реализации 90. Соединение по любому из вариантов реализации от 1-31, 34, 37-45 или 53-88, отличающееся тем, что модифицированный олигонуклеотид состоит из 16 связанных нуклеозидов и содержит:
а. гэп-сегмент, состоящий из восьми связанных дезоксинуклеозидов;
b. сегмент 5' крыла, состоящий из четырех связанных нуклеозидов и содержащий мотив ААВВ в 5' крыле;
с. сегмент 3' крыла, состоящий из четырех связанных нуклеозидов и содержащий мотив ВВАА в 3' крыле;
d. при этом гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла.
Вариант реализации 91. Соединение по любому из вариантов реализации 1-30, 35, 36, 46 или 50-88, отличающееся тем, что модифицированный олигонуклеотид состоит из 17 связанных нуклеозидов и содержит:
а. гэп-сегмент, состоящий из семи связанных дезоксинуклеозидов;
b. сегмент 5' крыла, состоящий из пяти связанных нуклеозидов и содержащий мотив АААВВ в 5' крыле;
с. сегмент 3' крыла, состоящий из пяти связанных нуклеозидов и содержащий мотив ВВААА в 3' крыле;
d. при этом гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла.
Вариант реализации 92. Соединение по любому из вариантов реализации от 1-31, 34, 37-45 или 53-88, отличающееся тем, что модифицированный олигонуклеотид состоит из 16 связанных нуклеозидов и содержит:
а. гэп-сегмент, состоящий из восьми связанных дезоксинуклеозидов;
b. сегмент 5' крыла, состоящий из четырех связанных нуклеозидов и содержащий мотив Е-Е-K-K в 5' крыле;
с. сегмент 3' крыла, состоящий из четырех связанных нуклеозидов и содержащий мотив K-K-Е-Е в 3' крыле;
d. при этом гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла, а каждое Е представляет 2'-O-метоксиэтиловый сахар и каждое K представляет cEt-сахар.
Вариант реализации 93. Соединение по любому из вариантов реализации 1-30, 35, 36, 46 или 50-88, отличающееся тем, что модифицированный олигонуклеотид состоит из 17 связанных нуклеозидов и содержит:
а. гэп-сегмент, состоящий из семи связанных дезоксинуклеозидов;
b. сегмент 5' крыла, состоящий из пяти связанных нуклеозидов и содержащий мотив Е-Е-Е-K-K в 5' крыле;
с. сегмент 3' крыла, состоящий из пяти связанных нуклеозидов и содержащий мотив K-K-Е-Е-Е в 3' крыле;
d. при этом гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла, а каждое Е представляет 2'-O-метоксиэтиловый сахар и каждое K представляет cEt-сахар.
Вариант реализации 94. Соединение по любому из вариантов реализации от 1-30, 32, 33 или 49-88, отличающееся тем, что модифицированный олигонуклеотид состоит из 20 связанных нуклеозидов и содержит:
а. гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов;
b. сегмент 5' крыла, состоящий из пяти связанных нуклеозидов;
с. сегмент 3' крыла, состоящий из пяти связанных нуклеозидов;
d. при этом гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла, а каждый нуклеозид каждого сегмента крыла содержит 2'-O-метоксиэтиловый сахар.
Вариант реализации 95. Соединение по любому из вариантов реализации от 1-31, 34, 37-45 или 53-88, отличающееся тем, что модифицированный олигонуклеотид состоит из 16 связанных нуклеозидов и содержит:
а. гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов;
b. сегмент 5' крыла, состоящий из трех связанных нуклеозидов;
с. сегмент 3' крыла, состоящий из трех связанных нуклеозидов;
d. при этом гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла, а каждый нуклеозид каждого сегмента крыла содержит cEt-caxap.
Вариант реализации 96. Соединение по любому из вариантов реализации 1-67, отличающееся тем, что модифицированный олигонуклеотид содержит по меньшей мере 8 смежных нуклеотидных оснований, комплементарных последовательности-мишени в пределах от нуклеотидного основания 1343 до нуклеотидного основания 1368 SEQ ID NO.: 1, при этом модифицированный олигонуклеотид содержит:
а. гэп-сегмент, состоящий из связанных дезоксинуклеозидов;
b. сегмент 5' крыла, состоящий из связанных нуклеозидов;
с. сегмент 3' крыла, состоящий из связанных нуклеозидов;
d. при этом гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла, а каждый нуклеозид каждого сегмента крыла содержит модифицированный сахар.
Вариант реализации 97. Соединение по варианту реализации 96, отличающееся тем, что каждый модифицированный сахар в сегменте 5' крыла содержит те же самые модификации.
Вариант реализации 98. Соединение по варианту реализации 96, отличающееся тем, что по меньшей мере два модифицированных сахара в сегменте 5' крыла содержат разные модификации.
Вариант реализации 99. Соединение по любому из вариантов реализации 96-98, отличающееся тем, что каждый модифицированный сахар в сегменте 3' крыла содержит те же самые модификации.
Вариант реализации 100. Соединение по любому из вариантов реализации 96-98, отличающееся тем, что по меньшей мере два модифицированных сахара в сегменте 3' крыла содержат разные модификации.
Вариант реализации 101. Соединение по варианту реализации 96, отличающееся тем, что по меньшей мере один модифицированный сахар представляет собой бициклический сахар, выбранный из cEt, LNA, α-L-LNA, ENA и 2'-тио LNA.
Вариант реализации 102. Соединение по варианту реализации 90-91, отличающееся тем, что каждое В представляет бициклический сахар, выбранный из cEt, LNA, α-L-LNA, ENA и 2'-тио LNA.
Вариант реализации 103. Соединение по варианту реализации 102, отличающееся тем, что бициклический сахар содержит BNA.
Вариант реализации 104. Соединение по варианту реализации 102, отличающееся тем, что бициклический сахар содержит cEt.
Вариант реализации 105. Соединение по варианту реализации 102, отличающееся тем, что бициклический сахар содержит LNA.
Вариант реализации 106. Соединение по варианту реализации 102, отличающееся тем, что бициклический сахар содержит α-L-LNA.
Вариант реализации 107. Соединение по варианту реализации 102, отличающееся тем, что бициклический сахар содержит ENA.
Вариант реализации 108. Соединение по варианту реализации 102, отличающееся тем, что бициклический сахар содержит 2'-тио LNA.
Вариант реализации 109. Соединение по варианту реализации 90 или 91, отличающееся тем, что каждое А представляет 2'-замещенный нуклеозид, выбранный из: 2'-OCH3, 2'-F и 2'-O-метоксиэтила.
Вариант реализации 110. Соединение по варианту реализации 109, отличающееся тем, что 2'-замещенный нуклеозид содержит 2'-O-метоксиэтил.
Вариант реализации 111. Соединение по любому из вариантов реализации 1-111, отличающееся тем, что по меньшей мере одна межнуклеозидная связь представляет собой модифицированную межнуклеозидную связь.
Вариант реализации 112. Соединение по любому из вариантов реализации 1-111, отличающееся тем, что межнуклеозидная связь представляет собой тиофосфатную межнуклеозидную связь.
Вариант реализации 113. Соединение, состоящее из ISIS 486178.
Вариант реализации 114. Соединение, состоящее из ISIS 512497.
Вариант реализации 115. Соединение, состоящее из ISIS 598768.
Вариант реализации 116. Соединение, состоящее из ISIS 594300.
Вариант реализации 117. Соединение, состоящее из ISIS 594292.
Вариант реализации 118. Соединение, состоящее из ISIS 569473.
Вариант реализации 119. Соединение, состоящее из ISIS 598769.
Вариант реализации 120. Соединение, состоящее из ISIS 570808.
Вариант реализации 121. Соединение, состоящее из ISIS 598777.
Вариант реализации 122. Соединение, имеющее нуклеотидную последовательность, приведенную в SEQ ID №: 23, при этом модифицированный олигонуклеотид состоит из 16 связанных нуклеозидов и содержит:
а. гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов;
b. сегмент 5' крыла, состоящий из трех связанных нуклеозидов;
с. сегмент 3' крыла, состоящий из трех связанных нуклеозидов;
d. при этом гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла;
е. при этом каждый нуклеозид каждого сегмента крыла содержит бициклический сахар;
f. при этом каждая межнуклеозидная связь представляет собой тиофосфатную межнуклеозидную связь; и
g. при этом каждый остаток цитозина представляет собой 5-метилцитозин.
Вариант реализации 123. Соединение, имеющее нуклеотидную последовательность, приведенную в SEQ ID №: 29, при этом модифицированный олигонуклеотид состоит из 16 связанных нуклеозидов и содержит:
а. гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов;
b. сегмент 5' крыла, состоящий из трех связанных нуклеозидов;
с. сегмент 3' крыла, состоящий из трех связанных нуклеозидов;
d. при этом гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла;
е. при этом каждый нуклеозид каждого сегмента крыла содержит бициклический сахар;
f. при этом каждая межнуклеозидная связь представляет собой тиофосфатную межнуклеозидную связь; и
g. при этом каждый остаток цитозина представляет собой 5-метилцитозин.
Вариант реализации 124. Соединение, имеющее нуклеотидную последовательность, приведенную в SEQ ID №: 31, при этом модифицированный олигонуклеотид состоит из 16 связанных нуклеозидов и содержит:
а. гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов;
b. сегмент 5' крыла, состоящий из трех связанных нуклеозидов;
с. сегмент 3' крыла, состоящий из трех связанных нуклеозидов;
d. при этом гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла;
е. при этом каждый нуклеозид каждого сегмента крыла содержит бициклический сахар;
f. при этом каждая межнуклеозидная связь представляет собой тиофосфатную межнуклеозидную связь; и
g. при этом каждый остаток цитозина представляет собой 5-метилцитозин.
Вариант реализации 125. Соединение, имеющее нуклеотидную последовательность, приведенную в SEQ ID №: 26, при этом модифицированный олигонуклеотид состоит из 16 связанных нуклеозидов и содержит:
а. гэп-сегмент, состоящий из восьми связанных дезоксинуклеозидов;
b. сегмент 5' крыла, состоящий из четырех связанных нуклеозидов и содержащий мотив Е-Е-K-K в 5' крыле;
с. сегмент 3' крыла, состоящий из четырех связанных нуклеозидов и содержащий мотив K-K-Е-Е в 3' крыле;
d. при этом гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла;
е. при этом каждое Е представляет 2'-O-метоксиэтиловый сахар и каждое K представляет cEt-caxap;
f. при этом каждая межнуклеозидная связь представляет собой тиофосфатную межнуклеозидную связь; и
g. при этом каждый остаток цитозина представляет собой 5-метилцитозин.
Вариант реализации 126. Соединение, имеющее нуклеотидную последовательность, приведенную в SEQ ID №: 30, при этом модифицированный олигонуклеотид состоит из 16 связанных нуклеозидов и содержит:
а. гэп-сегмент, состоящий из восьми связанных дезоксинуклеозидов;
b. сегмент 5' крыла, состоящий из четырех связанных нуклеозидов и содержащий мотив Е-Е-K-K в 5' крыле;
с. сегмент 3' крыла, состоящий из четырех связанных нуклеозидов и содержащий мотив K-K-Е-Е в 3' крыле;
d. при этом гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла;
е. при этом каждое Е представляет 2'-O-метоксиэтиловый сахар и каждое K представляет cEt-caxap;
f. при этом каждая межнуклеозидная связь представляет собой тиофосфатную межнуклеозидную связь; и
g. при этом каждый остаток цитозина представляет собой 5-метилцитозин.
Вариант реализации 127. Соединение, имеющее нуклеотидную последовательность, приведенную в SEQ ID №: 32, при этом модифицированный олигонуклеотид состоит из 16 связанных нуклеозидов и содержит:
а. гэп-сегмент, состоящий из восьми связанных дезоксинуклеозидов;
b. сегмент 5' крыла, состоящий из четырех связанных нуклеозидов и содержащий мотив Е-Е-K-K в 5' крыле;
с. сегмент 3' крыла, состоящий из четырех связанных нуклеозидов и содержащий мотив K-K-Е-Е в 3' крыле;
d. при этом гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла;
е. при этом каждое Е представляет 2'-O-метоксиэтиловый сахар и каждое K представляет cEt-caxap;
f. при этом каждая межнуклеозидная связь представляет собой тиофосфатную межнуклеозидную связь; и
g. при этом каждый остаток цитозина представляет собой 5-метилцитозин.
Вариант реализации 128. Соединение, имеющее нуклеотидную последовательность, приведенную в SEQ ID №: 27, при этом модифицированный олигонуклеотид состоит из 17 связанных нуклеозидов и содержит:
а. гэп-сегмент, состоящий из семи связанных дезоксинуклеозидов;
b. сегмент 5' крыла, состоящий из пяти связанных нуклеозидов и содержащий мотив Е-Е-Е-K-K в 5' крыле;
с. сегмент 3' крыла, состоящий из пяти связанных нуклеозидов и содержащий мотив K-K-Е-Е-Е в 3' крыле;
d. при этом гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла;
е. при этом каждое Е представляет 2'-O-метоксиэтиловый сахар и каждое K представляет cEt-caxap;
f. при этом каждая межнуклеозидная связь представляет собой тиофосфатную межнуклеозидную связь; и
g. при этом каждый остаток цитозина представляет собой 5-метилцитозин.
Вариант реализации 129. Соединение, имеющее нуклеотидную последовательность, приведенную в SEQ ID №: 28, при этом модифицированный олигонуклеотид состоит из 17 связанных нуклеозидов и содержит:
а. гэп-сегмент, состоящий из семи связанных дезоксинуклеозидов;
b. сегмент 5' крыла, состоящий из пяти связанных нуклеозидов и содержащий мотив Е-Е-Е-K-K в 5' крыле;
с. сегмент 3' крыла, состоящий из пяти связанных нуклеозидов и содержащий мотив K-K-Е-Е-Е в 3' крыле;
d. при этом гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла;
е. при этом каждое Е представляет 2'-O-метоксиэтиловый сахар и каждое K представляет cEt-caxap;
f. при этом каждая межнуклеозидная связь представляет собой тиофосфатную межнуклеозидную связь; и
g. при этом каждый остаток цитозина представляет собой 5-метилцитозин.
Вариант реализации 130. Соединение, имеющее нуклеотидную последовательность, приведенную в SEQ ID №: 25, при этом модифицированный олигонуклеотид состоит из 20 связанных нуклеозидов и содержит:
а. гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов;
b. сегмент 5' крыла, состоящий из пяти связанных нуклеозидов;
с. сегмент 3' крыла, состоящий из пяти связанных нуклеозидов;
d. при этом гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла;
е. при этом каждый нуклеозид каждого сегмента крыла содержит 2'-O-метоксиэтиловый сахар;
f. при этом каждая межнуклеозидная связь представляет собой тиофосфатную межнуклеозидную связь; и
g. при этом каждый остаток цитозина представляет собой 5-метилцитозин.
Вариант реализации 131. Соединение по любому из вариантов реализации 1-130, содержащее конъюгат.
Вариант реализации 132. Композиция, содержащая соединение по любому из вариантов реализации 1-131 и фармацевтически приемлемый носитель или разбавитель.
Вариант реализации 133. Способ лечения МД1 у животного, включающий введение нуждающемуся в этом животному соединения согласно любому из вариантов реализации 1-130 или композиции согласно варианту реализации 132.
Вариант реализации 134. Способ по варианту реализации 133, отличающийся тем, что соединение снижает уровни мРНК DMPK.
Вариант реализации 135. Способ по варианту реализации 133, отличающийся тем, что соединение снижает экспрессию белка DMPK.
Вариант реализации 136. Способ по варианту реализации 133, отличающийся тем, что соединение снижает CUGexp DMPK.
Вариант реализации 137. Способ по варианту реализации 133, отличающийся тем, что соединение преимущественно снижает CUGexp DMPK.
Вариант реализации 138. Способ по варианту реализации 133, отличающийся тем, что соединение снижает мРНК CUGexp DMPK.
Вариант реализации 139. Способ по варианту реализации 133, отличающийся тем, что соединение преимущественно снижает мРНК CUGexp DMPK.
Вариант реализации 140. Способ по варианту реализации 138 или 139, отличающийся тем, что преимущественное снижение CUGexp происходит в мышечной ткани.
Вариант реализации 141. Способ снижения миотонии у животного, включающий введение нуждающемуся в этом животному соединения согласно любому из вариантов реализации 1-131 или композиции согласно варианту реализации 132.
Вариант реализации 142. Способ снижения MBLN-зависимой патологии сплайсинга у животного, включающий введение нуждающемуся в этом животному соединения согласно любому из вариантов реализации 1-131 или композиции согласно варианту реализации 132.
Вариант реализации 143. Способ по варианту реализации 138, отличающийся тем, что происходит исправление сплайсинга любого из Sercal, m-Titin, Cicn1 и Zasp.
Вариант реализации 144. Способ по любому из вариантов реализации 133-143, отличающийся тем, что введение представляет собой системное введение.
Вариант реализации 145. Способ по любому из вариантов реализации 133-143, отличающийся тем, что введение представляет собой парентеральное введение.
Вариант реализации 146. Способ по варианту реализации 144, отличающийся тем, что системное введение представляет собой любое введение из подкожного введения, внутривенного введения, интрацеребровентрикулярного введения и интратекального введения.
Вариант реализации 147. Способ по любому из вариантов реализации 133-143, отличающийся тем, что введение не является внутримышечным введением.
Вариант реализации 148. Способ по любому из вариантов реализации 133-143, отличающийся тем, что животное представляет собой человека.
Вариант реализации 149. Способ снижения патологии сплайсинга Sercal у нуждающегося в этом животного путем введения соединения согласно любому из вариантов реализации 1-131 или композиции согласно варианту реализации 132, что приводит к включению экзона 22 Sercal.
Вариант реализации 150. Способ снижения патологии сплайсинга m-Titin у нуждающегося в этом животного путем введения соединения согласно любому из вариантов реализации 1-131 или композиции согласно варианту реализации 132, что приводит к включению экзона 5 m-Titin.
Вариант реализации 151. Способ снижения патологии сплайсинга Cicn1 у нуждающегося в этом животного путем введения соединения согласно любому из вариантов реализации 1-131 или композиции согласно варианту реализации 132, что приводит к включению экзона 7а Cicn1.
Вариант реализации 152. Способ снижения патологии сплайсинга Zasp у нуждающегося в этом животного путем введения соединения согласно любому из вариантов реализации 1-131 или композиции согласно варианту реализации 132, что приводит к включению экзона 11 Zasp.
Вариант реализации 153. Способ снижения мРНК DMPK в клетке, включающий приведение клетки в контакт с соединением согласно любому из вариантов реализации 1-131 или композицией согласно варианту реализации 132.
Вариант реализации 154. Способ снижения белка DMPK в клетке, включающий приведение клетки в контакт с соединением согласно любому из вариантов реализации 1-131 или композицией согласно варианту реализации 132.
Вариант реализации 155. Способ снижения мРНК CUGexp в клетке, включающий приведение клетки в контакт с соединением согласно любому из вариантов реализации 1-131 или композицией согласно варианту реализации 132.
Вариант реализации 156. Способ по любому из вариантов реализации 149-151, отличающийся тем, что клетка находится в организме животного.
Вариант реализации 157. Способ по варианту реализации 156, отличающийся тем, что животное представляет собой человека.
Вариант реализации 158. Способ достижения преимущественного снижения РНК CUGexp DMPK, включающий:
а. выбор субъекта, имеющего миотоническую дистрофию 1 типа или имеющего РНК CUGexp DMPK; и
b. введение указанному субъекту соединения согласно любому из вариантов реализации 1-131 или композиции согласно варианту реализации 132;
при этом указанное соединение согласно любому из вариантов реализации 1-131 или композиция согласно варианту реализации 132 при связывании с указанной РНК CUGexp DMPK активирует рибонуклеазу и, таким образом, достигается преимущественное снижение указанной РНК CUGexp DMPK.
Вариант реализации 159. Способ достижения преимущественного снижения РНК CUGexp DMPK, включающий:
а. выбор субъекта, имеющего миотоническую дистрофию 1 типа или имеющего РНК CUGexp DMPK; и
b. системное введение указанному субъекту соединения согласно любому из вариантов реализации 1-131 или композиции согласно варианту реализации 132;
при этом указанный химически модифицированный антисмысловой олигонуклеотид при связывании с указанной РНК CUGexp DMPK приводит к достижению преимущественного снижения указанной РНК CUGexp DMPK.
Вариант реализации 160. Способ снижения патологии сплайсинга у субъекта, предполагаемо имеющего миотоническую дистрофию 1 типа или имеющего удерживаемую в ядре РНК CUGexp DMPK, включающий:
введение указанному субъекту соединения согласно любому из вариантов реализации 1-131 или композиции согласно варианту реализации 132;
при этом указанное соединение согласно любому из вариантов реализации 1-131 или композиция согласно варианту реализации 132 при связывании с указанной мутантной РНК DMPK активирует рибонуклеазу и, таким образом, происходит снижение патологии сплайсинга.
Вариант реализации 161. Способ преимущественного снижения РНК CUGexp DMPK, снижения миотонии или снижения патологии сплайсинга у животного, включающий введение животному соединения согласно любому из вариантов реализации 1-131 или фармацевтической композиции согласно варианту реализации 132, при этом соединение снижает экспрессию DMPK у животного и, таким образом, происходит преимущественное снижение РНК CUGexp DMPK, снижение миотонии или снижение патологии сплайсинга у животного.
Вариант реализации 162. Способ лечения животного с миотонической дистрофией 1 типа, включающий:
выявление указанного животного с миотонической дистрофией 1 типа;
введение указанному животному терапевтически эффективного количества соединения согласно любому из вариантов реализации 1-131 или фармацевтической композиции согласно варианту реализации 132,
при этом происходит излечение указанного животного с миотонической дистрофией 1 типа.
Вариант реализации 163. Способ снижения экспрессии DMPK, включающий введение животному соединения согласно любому из вариантов реализации 1-131 или фармацевтической композиции согласно варианту реализации 132, при этом происходит снижение экспрессии DMPK.
Вариант реализации 164. Соединение по любому из вариантов реализации 1-131 или фармацевтическая композиция согласно варианту реализации 132 для применения для лечения МД1 у животного.
Вариант реализации 165. Соединение по любому из вариантов реализации 1-131 или фармацевтическая композиция согласно варианту реализации 132 для применения для снижения миотонии у животного.
Вариант реализации 166. Соединение по любому из вариантов реализации 1-131 или фармацевтическая композиция согласно варианту реализации 132 для применения для снижения MBLN-зависимой патологии сплайсинга у животного.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Следует понимать, что как вышеприведенное общее описание, так и нижеприведенное подробное описание являются исключительно иллюстративными и пояснительными и не ограничивают заявляемое изобретение. В данном документе употребление единственного числа включает множественное число, если специально не указано иное. В данном документе употребление «или» обозначает «и/или», если не указано иное. Кроме того, употребление термина «включая», а также других его форм, таких как «включает» или «включенный», не является ограничивающим. Также, такие термины как «элемент» или «компонент» включают как элементы и компоненты, содержащие одну единицу, так и элементы и компоненты, которые содержат более одной субъединицы, если специально не указано иное.
Используемые в данном документе заглавия разделов приведены исключительно в целях упорядочения и не ограничивают описываемый объект изобретения. Все документы или части документов, перечисленные в данной заявке, включая, но не ограничиваясь этим, патенты, заявки на патенты, статьи, книги и трактаты, явным образом включены в данный документ посредством ссылки касательно обсуждаемых здесь частей документа, а также в своем полном объеме.
Определения
В случае если приведены специальные определения, описанные в данном документе процедуры и методы аналитической химии, синтетической органической химии и медицинской и фармацевтической химии, а также номенклатура, используемая в связи с ними, соответствуют общеизвестным и общепринятым в данной области техники. Для химического синтеза и химического анализа можно использовать стандартные методы. Там, где это возможно, все патенты, заявки, опубликованные заявки и другие публикации, номера доступа в GENBANK и связанная с ними информация по последовательностям, доступная из баз данных, таких как Национальный центр биотехнологической информации (NCBI), а также другие данные, ссылки на которые приведены в тексте данного документа, включены посредством ссылки касательно обсуждаемых здесь частей документа, а также в своем полном объеме.
Если не указано иное, следующие термины имеют следующие значения:
«2'-O-метоксиэтил» (а также 2'-МОЕ и 2'-O(СН2)2-ОСН3) относится к модификации 0-метоксиэтила в позиции 2' фуранозилового кольца. Модифицированный 2'-O-метоксиэтиловый сахар представляет собой модифицированный сахар.
«2'-O-метоксиэтиловый нуклеотид» означает нуклеотид, содержащий модифицированный 2'-O-метоксиэтиловый сахарный компонент.
«5-метилцитозин» означает цитозин, модифицированный метиловой группой, присоединенной в позиции 5. 5-метилцитозин представляет собой модифицированное нуклеотидное основание.
«Около» означает в пределах ±7% от величины. Например, если указано, что «соединение приводит к по меньшей мере 70% ингибированию DMPK», подразумевается, что уровни DMPK ингибируются в диапазоне 63%-77%.
«Активный фармацевтический агент» означает вещество или вещества в фармацевтической композиции, которые обеспечивают терапевтический благоприятный эффект при введении животному. Например, в определенных вариантах реализации изобретения антисмысловой олигонуклеотид, нацеленный на DMPK, является активным фармацевтическим агентом.
«Активная область-мишень» или «область-мишень» означает область, на которую нацелено одно или более активных антисмысловых соединений. «Активные антисмысловые соединения» означают антисмысловые соединения, которые снижают уровни нуклеиновой кислоты-мишени или уровни белка.
«Вводимый одновременно» относится к совместному введению двух агентов любым способом, при котором фармакологический эффект обоих проявляется у пациента в одно и то же время. Одновременное введение не требует введения обоих агентов в одной фармацевтической композиции, в одной и той же дозировочной форме или одним и тем же путем введения. Эффект обоих агентов не обязательно должен проявляться в одно и то же время. Эффекты должны лишь перекрываться на протяжении определенного периода времени и не обязательно должны иметь одинаковую протяженность во времени.
«Введение» означает внесение агента в организм животного и включает, но не ограничивается этим, введение специалистом-медиком или самостоятельное введение.
«Агент» означает активное вещество, которое обеспечивает благоприятный терапевтический эффект при введении животному. «Первый агент» означает терапевтическое соединение согласно изобретению. Например, первым агентом может быть антисмысловой олигонуклеотид, нацеленный на DMPK. «Второй агент» означает второе терапевтическое соединение согласно изобретению (например, второй антисмысловой олигонуклеотид, нацеленный на DMPK) и/или не относящееся к DMPK терапевтическое соединение.
«Облегчение» относится к уменьшению по меньшей мере одного показателя, признака или симптома связанного с ним заболевания, нарушения или патологического состояния. Тяжесть показателей можно определить по субъективным или объективным критериям, известным специалистам в данной области техники.
«Животное» относится к являющемуся человеком или не являющемуся человеком животному, включая, но не ограничиваясь этим, мышей, крыс, кроликов, собак, кошек, свиней и обезьян, включая, но не ограничиваясь этим, низших обезьян и шимпанзе.
«Антисмысловая активность» означает любую выявляемую или измеряемую активность, присущую гибридизации антисмыслового соединения со своей нуклеиновой кислотой-мишенью. В определенных вариантах реализации изобретения антисмысловая активность состоит в снижении количества или экспрессии нуклеиновой кислоты-мишени или белка, кодируемого такой нуклеиновой кислотой-мишенью.
«Антисмысловое соединение» означает олигомерное соединение, которое способно гибридизироваться с нуклеиновой кислотой-мишенью посредством водородного связывания. Примеры антисмысловых соединений включают одноцепочечные и двухцепочечные соединения, такие как антисмысловые олигонуклеотиды, миРНК, мшРНК, мноРНК, микроРНК и сателлитные повторы.
«Антисмысловое ингибирование» означает снижение уровней нуклеиновой кислоты-мишени или уровней белка-мишени в присутствии антисмыслового соединения, комплементарного нуклеиновой кислоте-мишени, по сравнению с уровнями нуклеиновой кислоты-мишени или уровнями белка-мишени в отсутствие антисмыслового соединения.
«Антисмысловой олигонуклеотид» означает одноцепочечный олигонуклеотид, имеющий нуклеотидную последовательность, которая позволяет гибридизироваться с соответствующей областью или сегментом нуклеиновой кислоты-мишени.
«Бициклический сахар» означает фуранозиловое кольцо, модифицированное путем соединения мостиком двух негеминальных атомов углерода кольца. Бициклический сахар является модифицированным сахаром.
«Бициклическая нуклеиновая кислота» или «BNA» относится к нуклеозиду или нуклеотиду, в котором фуранозная часть нуклеозида или нуклеотида содержит мостик, соединяющий два атома углерода в фуранозном кольце, тем самым образуя бициклическую кольцевую систему.
«Кэп-структура» или «терминальный кэп-компонент» означает химические модификации, которые были сделаны в любом из концов антисмыслового соединения.
«Химически отличная область» относится к области антисмыслового соединения, которая каким-либо образом химически отличается от другой области того же антисмыслового соединения. Например, область, содержащая 2'-O-метоксиэтиловые нуклеотиды, является химически отличной от области, содержащей нуклеотиды без 2'-O-метоксиэтиловых модификаций.
«Химерное антисмысловое соединение» означает антисмысловое соединение, которое содержит по меньшей мере две химически отличные области.
«Совместное введение» означает введение индивиду двух или более агентов. Два или более агента могут находиться в одной фармацевтической композиции или могут находиться в отдельных фармацевтических композициях. Каждый из двух или более агентов можно вводить одним и тем же путем или разными путями введения. Совместное введение включает параллельное или последовательное введение.
«Комплементарность» означает способность к спариванию между нуклеотидными основаниями первой нуклеиновой кислоты и второй нуклеиновой кислоты.
«Смежные нуклеотидные основания» означают нуклеотидные основания, непосредственно прилегающие друг к другу.
«CUGexp DMPK» означает мутантную РНК DMPK, содержащую экспансированный CUG-повтор (CUGexp). Ген DMPK дикого типа содержит 5-37 CTG-повторов в 3' нетранслируемой области. В «CUGexp DMPK» (например, у пациента с миотонической дистрофией I типа) это число существенно больше и соответствует, например, диапазону от 50 до более чем 3500 (Harper, Myotonic Dystrophy (Saunders, London, ed. 3, 2001); Annu. Rev. Neurosci. 29: 259, 2006; EMBO J. 19: 4439, 2000; Curr Opin Neurol. 20: 572, 2007).
«Разбавитель» означает ингредиент в композиции, не обладающий фармакологической активностью, но являющийся фармацевтически необходимым или желаемым. Например, разбавителем в инъецируемой композиции может быть жидкость, например, солевой раствор.
«DMPK» означает любую нуклеиновую кислоту или белок дистрофической миотонин-протеинкиназы. DMPK может быть мутантным DMPK, включая нуклеиновую кислоту CUGexp DMPK.
«Экспрессия DMPK» означает уровень мРНК, транскрибируемой с гена, кодирующего DMPK, или уровень белка, транслируемого с мРНК. Экспрессию DMPK можно определить известными в данной области техники методами, такими как нозерн-блоттинг или вестерн-блоттинг.
«Нуклеиновая кислота DMPK» означает любую нуклеиновую кислоту, кодирующую DMPK. Например, в определенных вариантах реализации изобретения, нуклеиновая кислота DMPK включает последовательность ДНК, кодирующую DMPK, последовательность РНК, транскрибируемую с ДНК, кодирующей DMPK (включая геномную ДНК, содержащую интроны и экзоны), и последовательность мРНК или пре-мРНК, кодирующую DMPK. «мРНК DMPK» означает мРНК, кодирующую белок DMPK.
«Доза» означает определенное количество фармацевтического агента, применяемого в виде единичного введения или в определенный временной период. В определенных вариантах реализации изобретения дозу можно вводить в виде одной, двух или более болюсных доз, таблеток или инъекций. Например, в определенных вариантах реализации изобретения, в которых желательным является подкожное введение, для желаемой дозы необходим объем, который нелегко ввести в виде одной инъекции, следовательно, чтобы достигнуть желаемой дозы можно использовать две или более инъекций. В определенных вариантах реализации изобретения фармацевтический агент вводят путем инфузии на протяжении длительного периода времени или постоянно. Дозы могут быть установлены в виде количества фармацевтического агента, применяемого в час, в день, в неделю или в месяц.
«Эффективное количество» или «терапевтически эффективное количество» означает количество активного фармацевтического агента, достаточное, чтобы привести к желаемому физиологическому эффекту у нуждающегося в агенте индивида. Эффективное количество может варьироваться для разных индивидов в зависимости от здоровья и физического состояния индивида, лечение которого проводят, таксономической группы индивидов, лечение которых проводят, состава композиции, оценки медицинского состояния индивида и других релевантных факторов.
«Полная комплементарность» или «100% комплементарность» означает, что каждое нуклеотидное основание нуклеотидной последовательности первой нуклеиновой кислоты имеет свое комплементарное нуклеотидное основание во второй нуклеотидной последовательности второй нуклеиновой кислоты. В определенных вариантах реализации изобретения первая нуклеиновая кислота представляет собой антисмысловое соединение, а нуклеиновая кислота-мишень является второй нуклеиновой кислотой.
«Гэпмер» означает химерное антисмысловое соединение, в котором внутренняя область, содержащая группу нуклеозидов, которые способствуют расщеплению РНКазой Н, расположена между внешними областями, содержащими один или более нуклеозидов, при этом нуклеозиды, составляющие внутреннюю область, химически отличны от нуклеозида или нуклеозидов, составляющих внешние области. Внутреннюю область можно называть «гэп-сегментом», а внешние области можно называть «сегментами крыльев».
«Соединение, расширенное за счет гэпа» означает химерное антисмысловое соединение, содержащее гэп-сегмент из 12 или более смежных 2'-дезоксирибонуклеозидов, расположенных между и непосредственно прилегающих к сегментам 5' и 3' крыльев, содержащим от одного до шести нуклеозидов.
«Гибридизация» означает отжиг комплементарных молекул нуклеиновых кислот. В определенных вариантах реализации изобретения комплементарные молекулы нуклеиновых кислот включают антисмысловое соединение и нуклеиновую кислоту-мишень.
«Выявление животного с миотонической дистрофией 1 типа» означает выявление животного, у которого была диагностирована миотоническая дистрофия 1 типа, связанное с ней нарушение или патологическое состояние, или выявление животного, предрасположенного к развитию миотонической дистрофии 1 типа, связанного с ней нарушения или патологического состояния. Например, индивиды с семейным анамнезом могут быть предрасположены к миотонической дистрофии 1 типа, связанному с ней нарушению или патологическому состоянию. Такое выявление можно проводить любыми способами, включая оценку истории болезни индивида и проведение стандартных клинических исследований или оценок.
«Непосредственно прилегающий» означает, что между непосредственно прилегающими элементами нет промежуточных элементов.
«Индивид» означает человека или животное, не являющееся человеком, выбранное для проведения лечения или терапии.
«Межнуклеозидная связь» означает химическую связь между нуклеозидами.
«Связанные нуклеозиды» означает прилегающие нуклеозиды, которые связаны или соединены вместе межнуклеозидной связью.
«Несовпадающее» или «некомплементарное нуклеотидное основание» относится к случаю, когда нуклеотидное основание первой нуклеиновой кислоты не способно к спариванию с соответствующим нуклеотидным основанием второй нуклеиновой кислоты или нуклеиновой кислоты-мишени.
«Модифицированная межнуклеозидная связь» относится к замещению или любому изменению естественной межнуклеозидной связи (т.е. фосфодиэфирной межнуклеозидной связи).
Модифицированное нуклеотидное основание» относится к любому нуклеотидному основанию, отличному от аденина, цитозина, гуанина, тимидина или урацила. «Немодифицированное нуклеотидное основание» означает пуриновые основания аденин (А) и гуанин (G) и пиримидиновые основания тимин (Т), цитозин (С) и урацил (U).
«Модифицированный нуклеотид» означает нуклеотид, содержащий, независимо, модифицированный сахарный компонент, модифицированную межнуклеозидную связь или модифицированное нуклеотидное основание. «Модифицированный нуклеозид» означает нуклеозид, содержащий, независимо, модифицированный сахарный компонент или модифицированное нуклеотидное основание.
«Модифицированный олигонуклеотид» означает олигонуклеотид, содержащий по меньшей мере одно модифицированное нуклеотидное основание и/или модифицированную межнуклеозидную связь.
«Модифицированный сахар» относится к замещению или изменению естественного сахарного компонента. Модифицированные сахара включают замещенные сахарные компоненты и суррогатные сахарные компоненты.
«Мотив» означает группу химически отличных областей в антисмысловом соединении.
«Миотония» означает аномально низкую релаксацию мышц после произвольного сокращения или электрической стимуляции.
«Ядерная рибонуклеаза» означает рибонуклеазу, обнаруживаемую в ядре. Ядерные рибонуклеазы включают, но не ограничиваются этим, РНКазу Н, включая РНКазу H1 и РНКазу Н2, двухцепочечную РНКазу drosha и другие двухцепочечные РНКазы.
«Природная межнуклеозидная связь» означает 3'-5' фосфодиэфирную связь.
«Природный сахарный компонент» означает ДНК (2'-Н) или РНК (2'-ОН).
«Нуклеиновая кислота» относится к молекуле, состоящей из мономерных нуклеотидов. Нуклеиновые кислоты включают рибонуклеиновые кислоты (РНК), дезоксирибонуклеиновые кислоты (ДНК), одноцепочечные нуклеиновые кислоты, двухцепочечные нуклеиновые кислоты, малые интерферирующие рибонуклеиновые кислоты (миРНК) и микро РНК (микроРНК). Также нуклеиновая кислота может содержать комбинацию этих элементов в пределах одной молекулы.
«Нуклеотидное основание» означает гетероциклический компонент, способный к спариванию с основанием другой нуклеиновой кислоты.
«Нуклеотидная последовательность» означает порядок смежных нуклеотидных оснований независимо от наличия любых модификаций сахаров, связей или нуклеотидных оснований.
«Нуклеозид» означает нуклеотидное основание, связанное с сахаром. В определенных вариантах реализации изобретения нуклеозид связан с фосфатной группой.
«Нуклеозидный миметик» включает структуры, применяемые для замещения сахара или сахара и основания, и, необязательно, связи в одной или более позициях олигомерного соединения, такие как, например, нуклеозидные миметики, содержащие морфолино-, циклогексил-, тетрагидропиранил-, бицикло- или трицикло-сахарные миметики, например, нефуранозные сахарные единицы.
«Нуклеотид» означает нуклеозид, содержащий фосфатную группу, ковалентно соединенную с сахарной частью нуклеозида.
«Нуклеотидный миметик» включает структуры, применяемые для замещения нуклеозида или связи в одной или более позициях олигомерного соединения, такие как, например, пептидные нуклеиновые кислоты или морфолино (морфолино, соединенные посредством -N(H)-C(=O)-O- или другой нефосфодиэфирной связи).
«Олигомерное соединение» или «олигомер» означает полимер из связанных мономерных субъединиц, который способен гибридизироваться по меньшей мере с одной областью молекулы нуклеиновой кислоты.
«Олигонуклеотид» означает полимер из связанных нуклеозидов, при этом каждый нуклеозид и каждая межнуклеозидная связь могут быть модифицированными или немодифицированными независимо друг от друга.
«Парентеральное введение» означает введение путем инъекции или инфузии. Парентеральное введение включает подкожное введение, внутривенное введение, внутримышечное введение, внутриартериальное введение, внутрибрюшинное введение или внутричерепное введение, например, интратекальное или интрацеребровентрикулярное введение. Введение может быть постоянным или хроническим или коротким или периодическим.
«Пептид» означает молекулу, образованную путем соединения по меньшей мере двух аминокислот амидными связями. Пептид относится к полипептидам и белкам.
«Фармацевтическая композиция» означает смесь веществ, подходящую для введения индивиду. Например, фармацевтическая композиция может содержать один или более активных агентов и стерильный водный раствор.
«Фармацевтически приемлемые соли» означают физиологически и фармацевтически приемлемые соли антисмысловых соединений, т.е. соли, которые сохраняют желаемую биологическую активность исходного олигонуклеотида и не имеют нежелательных токсикологических эффектов.
«Тиофосфатная связь» означает связь между нуклеозидами, в которой фосфодиэфирная связь модифицирована замещением одного из несвязывающих атомов кислорода атомом серы. Тиофосфатная связь представляет собой модифицированную межнуклеозидную связь.
«Часть» означает определенное количество смежных (т.е. связанных) нуклеотидных оснований нуклеиновой кислоты. В определенных вариантах реализации изобретения часть представляет собой определенное количество смежных нуклеотидных оснований нуклеиновой кислоты-мишени. В определенных вариантах реализации изобретения часть представляет собой определенное количество смежных нуклеотидных оснований антисмыслового соединения.
«Преимущественное снижение РНК CUGexp DMPK» относится к преимущественному снижению РНК-транскриптов из аллеля CUGexp DMPK по сравнению с количеством РНК-транскриптов в нормальном аллеле DMPK.
«Предотвращение» относится к отсрочке или предупреждению начала или развития заболевания, нарушения или патологического состояния на протяжении периода времени, составляющего от минут до бесконечности. Предотвращение также означает снижение степени риска развития заболевания, нарушения или патологического состояния.
«Пролекарство» означает терапевтический агент, который приготовлен в неактивной форме, которая преобразуется в активную форму в организме или его клетках под воздействием эндогенных ферментов или других химических веществ или условий.
«Побочные эффекты» означают физиологические ответы на лечение, отличные от желаемых эффектов. В определенных вариантах реализации изобретения побочные эффекты включают реакции в месте инъекции, отклонение от нормы печеночных проб, нарушение почечной функции, печеночную токсичность, почечную токсичность, нарушения центральной нервной системы, миопатии и чувство дискомфорта. Например, повышенные уровни аминотрансферазы в сыворотке крови могут свидетельствовать о печеночной токсичности или нарушении печеночной функции. Например, повышенный билирубин может свидетельствовать о печеночной токсичности или нарушении печеночной функции.
«Одноцепочечный олигонуклеотид» означает олигонуклеотид, который не гибридизирован с комплементарной цепью.
Выражение «специфически гибридизируемый» относится к антисмысловому соединению, имеющему достаточную степень комплементарности между антисмысловым олигонуклеотидом и нуклеиновой кислотой-мишенью, чтобы индуцировать желаемый эффект, и в то же время оказывать минимальное влияние или не оказывать влияние на не являющиеся мишенями нуклеиновые кислоты в условиях, в которых необходимо специфическое связывание, т.е. в физиологических условиях в случае проведения in vivo анализа и терапевтического лечения.
«Патология сплайсинга» означает изменение альтернативного сплайсинга одной или более РНК, которое приводит к экспрессии измененных продуктов сплайсинга в конкретной ткани.
«Подкожное введение» означает введение непосредственно под кожу.
«Замещенный сахарный компонент» означает фуранозил, отличный от естественного сахара РНК или ДНК.
«Сахар» или «сахарный компонент» означает естественный сахарный компонент или модифицированный сахар.
«Сахарный суррогат» перекрывается с немного более широким термином «нуклеозидный миметик», но указывает только на замещение сахарной единицы (фуранозного кольца). Сахарный суррогат способен замещать естественный сахарный компонент нуклеозида таким образом, что полученные в результате нуклеозидные субъединицы способны связываться вместе и/или связываться с другими нуклеозидами с образованием олигомерного соединения, которое способно гибридизироваться с комплементарным олигомерным соединением. Такие структуры включают кольца, содержащие отличное от фуранозила количество атомов (например, 4-, 6- или 7-членные кольца); замещение кислорода фуранозила отличным от кислорода атомом (например, углерода, серы или азота); или как изменение в количестве атомов, так и замещение кислорода. Такие структуры также могут содержать замещения, соответствующие тем, которые были описаны для замещенных сахарных компонентов (например, 6-членные карбоциклические бициклические сахарные суррогаты, необязательно содержащие дополнительные заместители). Сахарные суррогаты также включают более сложные замещения сахаров (например, некольцевые системы пептидных нуклеиновых кислот). Сахарные суррогаты включают, без ограничений, морфолино, циклогексенилы и циклогекситолы.
«Нацеливание» или «нацеленный» означает процесс получения или отбора антисмыслового соединения, которое будет специфически гибридизироваться с нуклеиновой кислотой-мишенью и индуцировать желаемый эффект.
«Нуклеиновая кислота-мишень», «РНК-мишень» и «РНК-транскрипт-мишень» относятся к нуклеиновой кислоте, на которую можно нацеливать антисмысловые соединения. В определенных вариантах реализации изобретения нуклеиновая кислота-мишень содержит область нуклеиновой кислоты DMPK.
«Сегмент-мишень» означает последовательность нуклеотидов нуклеиновой кислоты-мишени, на которую нацелено антисмысловое соединение. «5' участок-мишень» относится к крайнему 5' нуклеотиду сегмента-мишени. «3' участок-мишень» относится к крайнему 3' нуклеотиду сегмента-мишени.
«Терапевтически эффективное количество» означает количество агента, которое обеспечивает благоприятный терапевтический эффект у индивида.
«Лечение» относится к введению фармацевтической композиции, чтобы вызвать изменение или улучшение течения заболевания, нарушения или патологического состояния.
«Миотоническая дистрофия 1 типа» или «МД1» означает аутосомное доминантное расстройство, вызванное экспансией некодирующего CTG-повтора в DMPK. Эта мутация приводит к доминированию РНК-процессу, при котором экспрессия РНК, содержащей экспансированный CUG-повтор (CUGexp), индуцирует нарушение клеточной функции. Участок CUGexp взаимодействует с РНК-связывающими белками и приводит к тому, что мутантный транскрипт удерживается в ядре. Токсичность этой РНК связана с секвестрацией РНК-связывающих белков и активацией сигнальных путей.
«Немодифицированный нуклеотид» означает нуклеотид, состоящий из природных нуклеотидных оснований, сахарных компонентов и межнуклеозидных связей. В определенных вариантах реализации изобретения немодифицированный нуклеотид представляет собой нуклеотид РНК (т.е. β-D-рибонуклеозиды) или нуклеотид ДНК (т.е. β-D-дезоксирибонуклеозид).
Некоторые варианты реализации изобретения
В определенных вариантах реализации изобретения предложены способы, соединения и композиции для ингибирования экспрессии DMPK.
В определенных вариантах реализации изобретения предложен способ снижения экспрессии DMPK у животного, включающий введение животному соединения, содержащего модифицированный олигонуклеотид, нацеленный на DMPK.
В определенных вариантах реализации изобретения предложен способ преимущественного снижения РНК CUGexp DMPK, снижения миотонии или снижения патологии сплайсинга у животного, включающий введение животному соединения, содержащего модифицированный олигонуклеотид, нацеленный на DMPK, при этом модифицированный олигонуклеотид преимущественно снижает РНК CUGexp DMPK, снижает миотонию или снижает патологию сплайсинга у животного.
В определенных вариантах реализации изобретения предложен способ введения антисмыслового олигонуклеотида для противодействия доминированию РНК путем управления расщеплением патогенных транскриптов.
В определенных вариантах реализации изобретения предложен способ снижения патологии сплайсинга Sercal. В определенных вариантах реализации изобретения предложенные в данном документе способы приводят к включению экзона 22. В определенных вариантах реализации изобретения коррекция сплайсинга происходит в передней большеберцовой, икроножной и четырехглавой мышцах.
В определенных вариантах реализации изобретения предложен способ снижения патологии сплайсинга m-Titin. В определенных вариантах реализации изобретения предложенные в данном документе способы приводят к включению экзона 5. В определенных вариантах реализации изобретения коррекция сплайсинга происходит в передней большеберцовой, икроножной и четырехглавой мышцах.
В определенных вариантах реализации изобретения предложен способ снижения патологии сплайсинга Clcn1. В определенных вариантах реализации изобретения предложенные в данном документе способы приводят к включению экзона 7а. В определенных вариантах реализации изобретения коррекция сплайсинга происходит в передней большеберцовой, икроножной и четырехглавой мышцах.
В определенных вариантах реализации изобретения предложен способ снижения патологии сплайсинга Zasp. В определенных вариантах реализации изобретения предложенные в данном документе способы приводят к включению экзона 11. В определенных вариантах реализации изобретения коррекция сплайсинга происходит в передней большеберцовой, икроножной и четырехглавой мышцах.
В определенных вариантах реализации изобретения предложен способ лечения животного с миотонической дистрофией 1 типа, включающий а) выявление животного с миотонической дистрофией 1 типа и b) введение указанному животному терапевтически эффективного количества соединения, содержащего модифицированный олигонуклеотид, нацеленный на DMPK. В определенных вариантах реализации изобретения терапевтически эффективное количество соединения, вводимое животному, преимущественно снижает РНК CUGexp DMPK, снижает миотонию или снижает патологию сплайсинга у животного.
В определенных вариантах реализации изобретения предложен способ достижения преимущественного снижения РНК CUGexp DMPK, включающий введение субъекту, у которого подозревается наличие миотонической дистрофии 1 типа или наличие РНК CUGexp DMPK, модифицированного антисмыслового олигонуклеотида, комплементарного неповторяющейся области указанной РНК CUGexp DMPK. При связывании с указанной РНК CUGexp DMPK модифицированный антисмысловой олигонуклеотид позволяет достичь преимущественного снижения РНК CUGexp DMPK.
В определенных вариантах реализации изобретения предложен способ достижения преимущественного снижения РНК CUGexp DMPK, включающий выбор субъекта с наличием миотонической дистрофии 1 типа или наличием РНК CUGexp DMPK и введение указанному субъекту модифицированного антисмыслового олигонуклеотида, комплементарного неповторяющейся области указанной РНК CUGexp DMPK. При связывании с указанной РНК CUGexp DMPK модифицированный антисмысловой олигонуклеотид активирует рибонуклеазу или ядерную рибонуклеазу, и тем самым достигается преимущественное снижение РНК CUGexp DMPK в ядре.
В определенных вариантах реализации изобретения предложен способ достижения преимущественного снижения РНК CUGexp DMPK, включающий выбор субъекта с наличием миотонической дистрофии 1 типа или наличием мутантной РНК CUGexp DMPK и системное введение указанному субъекту модифицированного антисмыслового олигонуклеотида, комплементарного неповторяющейся области указанной РНК CUGexp DMPK. При связывании с мутантной РНК CUGexp DMPK модифицированный антисмысловой олигонуклеотид позволяет достичь преимущественного снижения мутантной РНК CUGexp DMPK.
В определенных вариантах реализации изобретения предложен способ снижения миотонии у нуждающегося в этом субъекта. Данный способ включает введение субъекту модифицированного антисмыслового олигонуклеотида, комплементарного неповторяющейся области РНК DMPK, при этом при связывании с РНК DMPK модифицированный антисмысловой олигонуклеотид активирует рибонуклеазу или ядерную рибонуклеазу, и тем самым достигается снижение миотонии. В определенных вариантах реализации изобретения у субъекта есть или подозревается наличие миотонической дистрофии 1 типа или наличие мутантной РНК DMPK или РНК CUGexp DMPK. В определенных вариантах реализации изобретения РНК DMPK удерживается в ядре.
В определенных вариантах реализации изобретения предложен способ снижения патологии сплайсинга у нуждающегося в этом субъекта. Данный способ включает введение субъекту модифицированного антисмыслового олигонуклеотида, комплементарного неповторяющейся области РНК DMPK, при этом при связывании с РНК DMPK модифицированный антисмысловой олигонуклеотид активирует рибонуклеазу или ядерную рибонуклеазу, и тем самым достигается снижение патологии сплайсинга. В определенных вариантах реализации изобретения у субъекта есть или подозревается наличие миотонической дистрофии 1 типа или наличие удерживаемой в ядре РНК CUGexp DMPK. В определенных вариантах реализации изобретения РНК DMPK удерживается в ядре. В определенных вариантах реализации изобретения патология сплайсинга представляет собой MBNL-зависимую патологию сплайсинга.
В определенных вариантах реализации изобретения применяемый в предложенных способах модифицированный антисмысловой олигонуклеотид является химерным. В определенных вариантах реализации изобретения применяемый в предложенных способах модифицированный антисмысловой олигонуклеотид является гэпмером.
В определенных вариантах реализации предложенных в данном документе способов введение является подкожным. В определенных вариантах реализации изобретения введение является внутривенным.
В определенных вариантах реализации изобретения применяемый в предложенных способах модифицированный антисмысловой олигонуклеотид нацелен на некодирующую последовательность в пределах неповторяющейся области РНК DMPK. В определенных вариантах реализации изобретения олигонуклеотид нацелен на кодирующую область, интрон, 5' НТО или 3' НТО мутантной РНК DMPK.
В определенных вариантах реализации предложенных в данном документе способов ядерная рибонуклеаза представляет собой РНКазу H1.
В определенных вариантах реализации предложенных способов происходит снижение РНК DMPK в мышечной ткани. В определенных вариантах реализации изобретения происходит преимущественное снижение мутантной РНК DMPK РНК CUGexp DMPK.
В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа NM_001081560.1 (включенную в данный документ как SEQ ID №: 1). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа NT_011109.15, усеченную от нуклеотида 18540696 до 18555106 (включенную в данный документ как SEQ ID №: 2). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа NT_039413.7, усеченную от нуклеотида 16666001 до 16681000 (включенную в данный документ как SEQ ID №: 3). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа NM_032418.1 (включенную в данный документ как SEQ ID №: 4). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа AI007148.1 (включенную в данный документ как SEQ ID №: 5). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа AI304033.1 (включенную в данный документ как SEQ ID №: 6). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа ВС024150.1 (включенную в данный документ как SEQ ID №: 7). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа ВС056615.1 (включенную в данный документ как SEQ ID №: 8). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа ВС075715.1 (включенную в данный документ как SEQ ID №: 9). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа BU519245.1 (включенную в данный документ как SEQ ID №: 10). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа СВ247909.1 (включенную в данный документ как SEQ ID №: 11). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа СХ208906.1 (включенную в данный документ как SEQ ID №: 12). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа СХ732022.1 (включенную в данный документ как SEQ ID №: 13). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа S60315.1 (включенную в данный документ как SEQ ID №: 14). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа S60316.1 (включенную в данный документ как SEQ ID №: 15). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа NM_001081562.1 (включенную в данный документ как SEQ ID №: 16). В определенных вариантах реализации изобретения DMPK имеет последовательность, приведенную в GenBank под номером доступа NM_001100.3 (включенную в данный документ как SEQ ID №: 17).
В определенных вариантах реализации изобретения модифицированный олигонуклеотид имеет нуклеотидную последовательность, содержащую по меньшей мере 8 смежных нуклеотидных оснований из нуклеотидной последовательности, приведенной в любой из SEQ ID №: 23, 24, 25, 26, 27, 28, 29, 30, 31, 32 или 33-874. В определенных вариантах реализации изобретения модифицированный олигонуклеотид имеет нуклеотидную последовательность, содержащую по меньшей мере 9, по меньшей мере 10 или по меньшей мере 11 смежных нуклеотидных оснований из нуклеотидной последовательности, приведенной в любой из SEQ ID №: 23, 24, 25, 26, 27, 28, 29, 30, 31, 32 или 33-874.
В определенных вариантах реализации изобретения модифицированный олигонуклеотид имеет нуклеотидную последовательность, содержащую по меньшей мере 12 смежных нуклеотидных оснований из нуклеотидной последовательности, приведенной в любой из SEQ ID №: 23, 24, 25, 26, 27, 28, 29, 30, 31, 32 или 33-874. В определенных вариантах реализации изобретения модифицированный олигонуклеотид имеет нуклеотидную последовательность, содержащую по меньшей мере 13 или по меньшей мере 14 смежных нуклеотидных оснований из нуклеотидной последовательности, приведенной в любой из SEQ ID №: 23, 24, 25, 26, 27, 28, 29, 30, 31, 32 или 33-874.
В определенных вариантах реализации изобретения модифицированный олигонуклеотид имеет нуклеотидную последовательность, содержащую по меньшей мере 15 смежных нуклеотидных оснований из нуклеотидной последовательности, приведенной в любой из SEQ ID №: 23, 24, 25, 26, 27, 28, 29, 30, 31, 32 или 33-874. В определенных вариантах реализации изобретения модифицированный олигонуклеотид имеет нуклеотидную последовательность, содержащую по меньшей мере 16 смежных нуклеотидных оснований из нуклеотидной последовательности, приведенной в любой из SEQ ID №: 23, 24, 25, 26, 27, 28, 29, 30, 31,32 или 33-874.
В определенных вариантах реализации изобретения модифицированный олигонуклеотид имеет нуклеотидную последовательность, содержащую по меньшей мере 17 смежных нуклеотидных оснований из нуклеотидной последовательности, приведенной в любой из SEQ ID №: 24, 25, 27 или 28.
В определенных вариантах реализации изобретения модифицированный олигонуклеотид имеет нуклеотидную последовательность, содержащую по меньшей мере 18 смежных нуклеотидных оснований из нуклеотидной последовательности, приведенной в любой из SEQ ID №: 24 или 25. В определенных вариантах реализации изобретения модифицированный олигонуклеотид имеет нуклеотидную последовательность, содержащую по меньшей мере 19 смежных нуклеотидных оснований из нуклеотидной последовательности, приведенной в любой из SEQ ID №: 24 или 25.
В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды нацелены на любую из следующих областей SEQ ID №: 1: 1343-1368, 1317-1366, 2748-2791, 2155-2208, 2748-2791, 730-748, 528-547, 531-567, 636-697, 1311-1331, 1314-1339, 1446-1475, 1635-1670, 1610-1638, 1457-1486, 2773-1788, 931-948, 934-949, 937-952, 942-957, 937-957, 943-958, 937-953, 1346-1363, 1346-1361, 1347-1363, 2162-2179, 2492-2508, 2696-2717 и 2683-2703. В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды нацелены на любую из следующих областей SEQ ID №: 1: 2773-2788, 1343-1358 и 1344-1359.
В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды имеют нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 8 смежных нуклеотидных оснований, комплементарную области-мишени. В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды имеют нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 8 смежных нуклеотидных оснований, комплементарную области-мишени, при этом область-мишень нацелена на нуклеотидные основания 1343-1368, 1317-1366, 2748-2791, 2155-2208, 2748-2791, 730-748, 528-547, 531-567, 636-697, 1311-1331, 1314-1339, 1446-1475, 1635-1670, 1610-1638, 1457-1486, 2773-1788, 931-948, 934-949, 937-952, 942-957, 937-957, 943-958, 937-953, 1346-1363, 1346-1361, 1347-1363, 2162-2179, 2492-2508, 2696-2717 или 2683-2703 из SEQ ID №: 1. В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды имеют нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 8 смежных нуклеотидных оснований, комплементарную области-мишени, при этом область-мишень нацелена на нуклеотидные основания 2773-2788, 1343-1358 или 1344-1359 из SEQ ID №: 1.
В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды имеют нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 10 смежных нуклеотидных оснований, комплементарную области-мишени. В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды имеют нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 10 смежных нуклеотидных оснований, комплементарную области-мишени, при этом область-мишень нацелена на нуклеотидные основания 1343-1368, 1317-1366, 2748-2791, 2155-2208, 2748-2791, 730-748, 528-547, 531-567, 636-697, 1311-1331, 1314-1339, 1446-1475, 1635-1670, 1610-1638, 1457-1486, 2773-1788, 931-948, 934-949, 937-952, 942-957, 937-957, 943-958, 937-953, 1346-1363, 1346-1361, 1347-1363, 2162-2179, 2492-2508, 2696-2717 или 2683-2703 из SEQ ID №: 1. В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды имеют нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 10 смежных нуклеотидных оснований, комплементарную области-мишени, при этом область-мишень нацелена на нуклеотидные основания 2773-2788, 1343-1358 или 1344-1359 из SEQ ID №: 1.
В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды имеют нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 12 смежных нуклеотидных оснований, комплементарную области-мишени. В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды имеют нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 12 смежных нуклеотидных оснований, комплементарную области-мишени, при этом область-мишень нацелена на нуклеотидные основания 1343-1368, 1317-1366, 2748-2791, 2155-2208, 2748-2791, 730-748, 528-547, 531-567, 636-697, 1311-1331, 1314-1339, 1446-1475, 1635-1670, 1610-1638, 1457-1486, 2773-1788, 931-948, 934-949, 937-952, 942-957, 937-957, 943-958, 937-953, 1346-1363, 1346-1361, 1347-1363, 2162-2179, 2492-2508, 2696-2717 или 2683-2703 из SEQ ID №: 1. В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды имеют нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 12 смежных нуклеотидных оснований, комплементарную области-мишени, при этом область-мишень нацелена на нуклеотидные основания 2773-2788, 1343-1358 или 1344-1359 из SEQ ID №: 1.
В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды имеют нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 14 смежных нуклеотидных оснований, комплементарную области-мишени. В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды имеют нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 14 смежных нуклеотидных оснований, комплементарную области-мишени, при этом область-мишень нацелена на нуклеотидные основания 1343-1368, 1317-1366, 2748-2791, 2155-2208, 2748-2791, 730-748, 528-547, 531-567, 636-697, 1311-1331, 1314-1339, 1446-1475, 1635-1670, 1610-1638, 1457-1486, 2773-1788, 931-948, 934-949, 937-952, 942-957, 937-957, 943-958, 937-953, 1346-1363, 1346-1361, 1347-1363, 2162-2179, 2492-2508, 2696-2717 или 2683-2703 из SEQ ID №: 1. В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды имеют нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 14 смежных нуклеотидных оснований, комплементарную области-мишени, при этом область-мишень нацелена на нуклеотидные основания 2773-2788, 1343-1358 или 1344-1359 из SEQ ID №: 1.
В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды имеют нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 16 смежных нуклеотидных оснований, комплементарную области-мишени. В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды имеют нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 16 смежных нуклеотидных оснований, комплементарную области-мишени, при этом область-мишень нацелена на нуклеотидные основания 1343-1368, 1317-1366, 2748-2791, 2155-2208, 2748-2791, 730-748, 528-547, 531-567, 636-697, 1311-1331, 1314-1339, 1446-1475, 1635-1670, 1610-1638, 1457-1486, 2773-1788, 931-948, 934-949, 937-952, 942-957, 937-957, 943-958, 937-953, 1346-1363, 1346-1361, 1347-1363, 2162-2179, 2492-2508, 2696-2717 или 2683-2703 из SEQ ID №: 1. В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды имеют нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 16 смежных нуклеотидных оснований, комплементарную области-мишени, при этом область-мишень нацелена на нуклеотидные основания 2773-2788, 1343-1358 или 1344-1359 из SEQ ID №: 1.
В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды нацелены на любую из следующих областей SEQ ID №: 2: 10195-10294, 13553-13572, 13748-13767, 13455-13475, 13628-13657, 13735-13760, 13746-13905, 13836-13851, 13553-13568, 13563-13578, 13624-13639, 13686-13701, 13760-13775, 13763-13779, 13765-13780, 2580-2595, 6446-6461, 11099-11115, 11082-11099, 1974-1993, 4435-4456, 6035-6052, 6360-6385, 6445-6468, 6807-6824, 6789-6806 и 6596-6615. В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды нацелены на любую из следующих областей SEQ ID №: 2: 13836-13831, 8603-8618 и 8604-8619.
В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды имеют нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 8 смежных нуклеотидных оснований, комплементарную области-мишени. В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды имеют нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 8 смежных нуклеотидных оснований, комплементарную области-мишени, при этом область-мишень нацелена на нуклеотидные основания 10195-10294, 13553-13572, 13748-13767, 13455-13475, 13628-13657, 13735-13760, 13746-13905, 13836-13851, 13553-13568, 13563-13578, 13624-13639, 13686-13701, 13760-13775, 13763-13779, 13765-13780, 2580-2595, 6446-6461, 11099-11115, 11082-11099, 1974-1993, 4435-4456, 6035-6052, 6360-6385, 6445-6468, 6807-6824, 6789-6806 или 6596-6615 из SEQ ID №: 2. В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды имеют нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 8 смежных нуклеотидных оснований, комплементарную области-мишени, при этом область-мишень нацелена на нуклеотидные основания 13836-13831, 8603-8618 или 8604-8619 из SEQ ID №: 2.
В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды имеют нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 10 смежных нуклеотидных оснований, комплементарную области-мишени. В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды имеют нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 10 смежных нуклеотидных оснований, комплементарную области-мишени, при этом область-мишень нацелена на нуклеотидные основания 10195-10294, 13553-13572, 13748-13767, 13455-13475, 13628-13657, 13735-13760, 13746-13905, 13836-13851, 13553-13568, 13563-13578, 13624-13639, 13686-13701, 13760-13775, 13763-13779, 13765-13780, 2580-2595, 6446-6461, 11099-11115, 11082-11099, 1974-1993, 4435-4456, 6035-6052, 6360-6385, 6445-6468, 6807-6824, 6789-6806 или 6596-6615 из SEQ ID №: 2. В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды имеют нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 10 смежных нуклеотидных оснований, комплементарную области-мишени, при этом область-мишень нацелена на нуклеотидные основания 13836-13831, 8603-8618 или 8604-8619 из SEQ ID №: 2.
В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды имеют нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 12 смежных нуклеотидных оснований, комплементарную области-мишени. В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды имеют нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 12 смежных нуклеотидных оснований, комплементарную области-мишени, при этом область-мишень нацелена на нуклеотидные основания 10195-10294, 13553-13572, 13748-13767, 13455-13475, 13628-13657, 13735-13760, 13746-13905, 13836-13851, 13553-13568, 13563-13578, 13624-13639, 13686-13701, 13760-13775, 13763-13779, 13765-13780, 2580-2595, 6446-6461, 11099-11115, 11082-11099, 1974-1993, 4435-4456, 6035-6052, 6360-6385, 6445-6468, 6807-6824, 6789-6806 или 6596-6615 из SEQ ID №: 2. В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды имеют нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 12 смежных нуклеотидных оснований, комплементарную области-мишени, при этом область-мишень нацелена на нуклеотидные основания 13836-13831, 8603-8618 или 8604-8619 из SEQ ID №: 2.
В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды имеют нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 14 смежных нуклеотидных оснований, комплементарную области-мишени. В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды имеют нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 14 смежных нуклеотидных оснований, комплементарную области-мишени, при этом область-мишень нацелена на нуклеотидные основания 10195-10294, 13553-13572, 13748-13767, 13455-13475, 13628-13657, 13735-13760, 13746-13905, 13836-13851, 13553-13568, 13563-13578, 13624-13639, 13686-13701, 13760-13775, 13763-13779, 13765-13780, 2580-2595, 6446-6461, 11099-11115, 11082-11099, 1974-1993, 4435-4456, 6035-6052, 6360-6385, 6445-6468, 6807-6824, 6789-6806 или 6596-6615 из SEQ ID №: 2. В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды имеют нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 14 смежных нуклеотидных оснований, комплементарную области-мишени, при этом область-мишень нацелена на нуклеотидные основания 13836-13831, 8603-8618 или 8604-8619 из SEQ ID №: 2.
В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды имеют нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 16 смежных нуклеотидных оснований, комплементарную области-мишени. В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды имеют нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 16 смежных нуклеотидных оснований, комплементарную области-мишени, при этом область-мишень нацелена на нуклеотидные основания 10195-10294, 13553-13572, 13748-13767, 13455-13475, 13628-13657, 13735-13760, 13746-13905, 13836-13851, 13553-13568, 13563-13578, 13624-13639, 13686-13701, 13760-13775, 13763-13779, 13765-13780, 2580-2595, 6446-6461, 11099-11115, 11082-11099, 1974-1993, 4435-4456, 6035-6052, 6360-6385, 6445-6468, 6807-6824, 6789-6806 или 6596-6615 из SEQ ID №: 2. В определенных вариантах реализации изобретения предложенные в данном документе модифицированные олигонуклеотиды имеют нуклеотидную последовательность, содержащую комплементарную область, содержащую по меньшей мере 16 смежных нуклеотидных оснований, комплементарную области-мишени, при этом область-мишень нацелена на нуклеотидные основания 13836-13831, 8603-8618 или 8604-8619 из SEQ ID №: 2.
В определенных вариантах реализации изобретения животное представляет собой человека.
В определенных вариантах реализации изобретения соединения или композиции согласно изобретению обозначены как первый агент, а способы согласно изобретению дополнительно включают введение второго агента. В определенных вариантах реализации изобретения первый агент и второй агент вводят совместно. В определенных вариантах реализации изобретения первый агент и второй агент вводят совместно последовательно или одновременно.
В определенных вариантах реализации изобретения введение включает парентеральное введение.
В определенных вариантах реализации изобретения соединение представляет собой одноцепочечный модифицированный олигонуклеотид. В определенных вариантах реализации изобретения нуклеотидная последовательность модифицированного олигонуклеотида по меньшей мере на 95% комплементарна любой из SEQ ID №: 1-19 согласно определению, проводимому относительно полной длины указанного модифицированного олигонуклеотида. В определенных вариантах реализации изобретения нуклеотидная последовательность модифицированного олигонуклеотида по меньшей мере на 100% комплементарна любой из SEQ ID №: 1-19 согласно определению, проводимому относительно полной длины указанного модифицированного олигонуклеотида. В определенных вариантах реализации изобретения соединение представляет собой одноцепочечный модифицированный олигонуклеотид. В определенных вариантах реализации изобретения нуклеотидная последовательность модифицированного олигонуклеотида по меньшей мере на 95% комплементарна любой из SEQ ID №: 1 согласно определению, проводимому относительно полной длины указанного модифицированного олигонуклеотида. В определенных вариантах реализации изобретения нуклеотидная последовательность модифицированного олигонуклеотида по меньшей мере на 100% комплементарна любой из SEQ ID №: 1 согласно определению, проводимому относительно полной длины указанного модифицированного олигонуклеотида.
В определенных вариантах реализации изобретения нуклеотидная последовательность модифицированного олигонуклеотида по меньшей мере на 90% комплементарна любой из SEQ ID №: 1 согласно определению, проводимому относительно полной длины указанного модифицированного олигонуклеотида. В определенных вариантах реализации изобретения нуклеотидная последовательность модифицированного олигонуклеотида по меньшей мере на 85% комплементарна любой из SEQ ID №: 1 согласно определению, проводимому относительно полной длины указанного модифицированного олигонуклеотида.
В определенных вариантах реализации изобретения нуклеотидная последовательность модифицированного олигонуклеотида по меньшей мере на 90% комплементарна любой из SEQ ID №: 2 согласно определению, проводимому относительно полной длины указанного модифицированного олигонуклеотида. В определенных вариантах реализации изобретения нуклеотидная последовательность модифицированного олигонуклеотида по меньшей мере на 85% комплементарна любой из SEQ ID №: 2 согласно определению, проводимому относительно полной длины указанного модифицированного олигонуклеотида.
В определенных вариантах реализации изобретения по меньшей мере одна межнуклеозидная связь указанного модифицированного олигонуклеотида представляет собой модифицированную межнуклеозидную связь. В определенных вариантах реализации изобретения каждая межнуклеозидная связь указанного модифицированного олигонуклеотида представляет собой тиофосфатную межнуклеозидную связь.
В определенных вариантах реализации изобретения по меньшей мере один нуклеозид указанного модифицированного олигонуклеотида содержит модифицированный сахар. В определенных вариантах реализации изобретения по меньшей мере один модифицированный сахар представляет собой бициклический сахар. В определенных вариантах реализации изобретения по меньшей мере один модифицированный сахар содержит 2'-O-метоксиэтиловый или а 4'-(СН2)n-O-2' мостик, где n равно 1 или 2.
В определенных вариантах реализации изобретения по меньшей мере один нуклеозид указанного модифицированного олигонуклеотида содержит модифицированное нуклеотидное основание. В определенных вариантах реализации изобретения модифицированное нуклеотидное основание представляет собой 5-метилцитозин.
В определенных вариантах реализации изобретения модифицированный олигонуклеотид содержит: а) гэп-сегмент, состоящий из связанных дезоксинуклеозидов; b) сегмент 5' крыла, состоящий из связанных нуклеозидов; и с) сегмент 3' крыла, состоящий из связанных нуклеозидов. Гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла, а каждый нуклеозид каждого сегмента крыла содержит модифицированный сахар.
В определенных вариантах реализации изобретения модифицированный олигонуклеотид содержит: а) гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов; b) сегмент 5' крыла, состоящий из пяти связанных нуклеозидов; и с) сегмент 3' крыла, состоящий из пяти связанных нуклеозидов. Гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла, каждый нуклеозид каждого сегмента крыла содержит 2'-O-метоксиэтиловый сахар, каждая межнуклеозидная связь указанного модифицированного олигонуклеотида представляет собой тиофосфатную связь, а каждый цитозин в указанном модифицированном олигонуклеотиде представляет собой 5-метилцитозин.
В определенных вариантах реализации изобретения модифицированный олигонуклеотид состоит из 20 связанных нуклеозидов. В определенных вариантах реализации изобретения модифицированный олигонуклеотид состоит из 19 связанных нуклеозидов. В определенных вариантах реализации изобретения модифицированный олигонуклеотид состоит из 18 связанных нуклеозидов. В определенных вариантах реализации изобретения модифицированный олигонуклеотид состоит из 17 связанных нуклеозидов. В определенных вариантах реализации изобретения модифицированный олигонуклеотид состоит из 16 связанных нуклеозидов.
В определенных вариантах реализации изобретения предложен способ преимущественного снижения РНК CUGexp DMPK, снижения миотонии или снижения патологии сплайсинга у животного, включающий введение животному соединения, содержащего модифицированный олигонуклеотид, содержащий гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов, сегмент 5' крыла, состоящий из пяти связанных нуклеозидов, и сегмент 3' крыла, состоящий из пяти связанных нуклеозидов. Гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла, каждый нуклеозид каждого сегмента крыла содержит 2'-O-метоксиэтиловый сахар, каждая межнуклеозидная связь указанного модифицированного олигонуклеотида представляет собой тиофосфатную связь, каждый цитозин в указанном модифицированном олигонуклеотиде представляет собой 5-метилцитозин.
В определенных вариантах реализации изобретения модифицированный олигонуклеотид содержит: а) гэп-сегмент, состоящий из восьми связанных дезоксинуклеозидов; b) сегмент 5' крыла, состоящий из четырех связанных нуклеозидов и содержащий мотив Е-Е-K-K в 5' крыле; с) сегмент 3' крыла, состоящий из четырех связанных нуклеозидов и содержащий мотив K-K-Е-Е в 3' крыле; и d) при этом гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла, а каждое Е представляет 2'-O-метоксиэтиловый сахар и каждое K представляет cEt-caxap.
В определенных вариантах реализации изобретения модифицированный олигонуклеотид содержит: а) гэп-сегмент, состоящий из семи связанных дезоксинуклеозидов; b) сегмент 5' крыла, состоящий из пяти связанных нуклеозидов и содержащий мотив Е-Е-Е-K-K в 5' крыле; с) сегмент 3' крыла, состоящий из пяти связанных нуклеозидов и содержащий мотив K-K-Е-Е-Е в 3' крыле; и d) при этом гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла, а каждое Е представляет 2'-O-метоксиэтиловый сахар и каждое K представляет cEt-caxap.
В определенных вариантах реализации изобретения модифицированный олигонуклеотид содержит: а) гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов; b) сегмент 5' крыла, состоящий из пяти связанных нуклеозидов; с) сегмент 3' крыла, состоящий из пяти связанных нуклеозидов; и d) при этом гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла, а каждый нуклеозид каждого сегмента крыла содержит 2'-O-метоксиэтиловый сахар.
В определенных вариантах реализации изобретения модифицированный олигонуклеотид содержит: а) гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов; b) сегмент 5' крыла, состоящий из трех связанных нуклеозидов; с) сегмент 3' крыла, состоящий из трех связанных нуклеозидов; и d) при этом гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла, а каждый нуклеозид каждого сегмента крыла содержит cEt-caxap.
В определенных вариантах реализации изобретения предложен способ преимущественного снижения РНК CUGexp DMPK, снижения миотонии или снижения патологии сплайсинга у животного, включающий введение животному соединения, содержащего модифицированный олигонуклеотид, содержащий: а) гэп-сегмент, состоящий из восьми связанных дезоксинуклеозидов; b) сегмент 5' крыла, состоящий из четырех связанных нуклеозидов и содержащий мотив Е-Е-K-K в 5' крыле; с) сегмент 3' крыла, состоящий из четырех связанных нуклеозидов и содержащий мотив K-K-Е-Е в 3' крыле; и d) при этом гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла, а каждое Е представляет 2'-O-метоксиэтиловый сахар и каждое K представляет cEt-caxap.
В определенных вариантах реализации изобретения предложен способ преимущественного снижения РНК CUGexp DMPK, снижения миотонии или снижения патологии сплайсинга у животного, включающий введение животному соединения, содержащего модифицированный олигонуклеотид, содержащий: а) гэп-сегмент, состоящий из семи связанных дезоксинуклеозидов; b) сегмент 5' крыла, состоящий из пяти связанных нуклеозидов и содержащий мотив Е-Е-Е-K-K в 5' крыле; с) сегмент 3' крыла, состоящий из пяти связанных нуклеозидов и содержащий мотив K-K-Е-Е-Е в 3' крыле; и d) при этом гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла, а каждое Е представляет 2'-O-метоксиэтиловый сахар и каждое K представляет cEt-caxap.
В определенных вариантах реализации изобретения предложен способ преимущественного снижения РНК CUGexp DMPK, снижения миотонии или снижения патологии сплайсинга у животного, включающий введение животному соединения, содержащего модифицированный олигонуклеотид, содержащий: а) гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов; b) сегмент 5' крыла, состоящий из пяти связанных нуклеозидов; с) сегмент 3' крыла, состоящий из пяти связанных нуклеозидов; и d) при этом гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла, а каждый нуклеозид каждого сегмента крыла содержит 2'-O-метоксиэтиловый сахар.
В определенных вариантах реализации изобретения предложен способ преимущественного снижения РНК CUGexp DMPK, снижения миотонии или снижения патологии сплайсинга у животного, включающий введение животному соединения, содержащего модифицированный олигонуклеотид, содержащий: а) гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов; b) сегмент 5' крыла, состоящий из трех связанных нуклеозидов; с) сегмент 3' крыла, состоящий из трех связанных нуклеозидов; и d) при этом гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла, а каждый нуклеозид каждого сегмента крыла содержит cEt-caxap.
В определенных вариантах реализации изобретения предложено применение любого описанного в данном документе соединения в производстве медикамента для применения в любом из описанных в данном документе терапевтических способов. Например, в определенных вариантах реализации изобретения предложено применение описанного в данном документе соединения в производстве медикамента для лечения, облегчения или предотвращения миотонической дистрофии 1 типа. В определенных вариантах реализации изобретения предложено применение описанного в данном документе соединения в производстве медикамента для ингибирования экспрессии DMPK и лечения, предотвращения, отсрочки или облегчения связанного с DMPK заболевания или его симптома. В определенных вариантах реализации изобретения предложено применение описанного в данном документе соединения в производстве медикамента для снижения экспрессии DMPK у животного. В определенных вариантах реализации изобретения предложено применение описанного в данном документе соединения в производстве медикамента для преимущественного снижения CUGexp DMPK, снижения миотонии или снижения патологии сплайсинга у животного. В определенных вариантах реализации изобретения предложено применение описанного в данном документе соединения в производстве медикамента для лечения животного с миотонической дистрофией 1 типа. В определенных вариантах реализации изобретения предложено применение описанного в данном документе соединения в производстве медикамента для лечения, предотвращения, отсрочки или облегчения симптомов и последствий, связанных с развитием МД1, включая ригидность мышц, миотонию, слабость дистальных мышц, приводящую к недееспособности, слабость мышц лица и челюсти, затрудненное глотание, нависание век (птоз), слабость мышц шеи, слабость мышц рук и ног, постоянную мышечную боль, патологическую сонливость, мышечную атрофию, дисфагию, дыхательную недостаточность, нерегулярное сердцебиение, повреждение сердечной мышцы, апатию, резистентность к инсулину и катаракты. В определенных вариантах реализации изобретения предложено применение описанного в данном документе соединения в производстве медикамента для противодействия доминированию РНК путем управления расщеплением патогенных транскриптов.
В определенных вариантах реализации изобретения предложен набор для лечения, предотвращения или облегчения миотонической дистрофии 1 типа, как описано в данном документе, при этом набор содержит: а) описанное в данном документе соединение; и, необязательно, b) описанный в данном документе дополнительный агент или вид терапии. Набор может дополнительно содержать инструкции или этикетку с рекомендациями по использованию набора для лечения, предотвращения или облегчения миотонической дистрофии 1 типа.
В определенных вариантах реализации изобретения предложены любые описанные в данном документе соединение или композиция для применения в любом из описанных в данном документе терапевтических способов. Например, в определенных вариантах реализации изобретения предложены описанные в данном документе соединение или композиция для ингибирования экспрессии DMPK и лечения, предотвращения, отсрочки или облегчения связанного с DMPK заболевания или его симптома. В определенных вариантах реализации изобретения предложены описанные в данном документе соединение или композиция для применения для снижения экспрессии DMPK у животного. В определенных вариантах реализации изобретения предложены описанные в данном документе соединение или композиция для применения для преимущественного снижения CUGexp DMPK, снижения миотонии или снижения патологии сплайсинга у животного. В определенных вариантах реализации изобретения предложены описанные в данном документе соединение или композиция для применения для лечения животного с миотонической дистрофией 1 типа. В определенных вариантах реализации изобретения предложены описанные в данном документе соединение или композиция для применения для лечения, предотвращения, отсрочки или облегчения симптомов и последствий, связанных с развитием МД1, включая ригидность мышц, миотонию, слабость дистальных мышц, приводящую к недееспособности, слабость мышц лица и челюсти, затрудненное глотание, нависание век (птоз), слабость мышц шеи, слабость мышц рук и ног, постоянную мышечную боль, патологическую сонливость, мышечную атрофию, дисфагию, дыхательную недостаточность, нерегулярное сердцебиение, повреждение сердечной мышцы, апатию, резистентность к инсулину и катаракты. В определенных вариантах реализации изобретения предложены описанные в данном документе соединение или композиция для применения для противодействия доминированию РНК путем управления расщеплением патогенных транскриптов. В определенных вариантах реализации изобретения предложены соединения, содержащие модифицированный олигонуклеотид, состоящий из 21-30 связанных нуклеозидов, имеющий нуклеотидную последовательность, содержащую по меньшей мере 12 смежных нуклеотидных оснований из любой нуклеотидной последовательности из SEQ ID №: 23, 24, 25, 26, 27, 28, 29, 30, 31, 32 или 33-874.
Также предложены другие соединения, которые можно применять в описанных в данном документе способах.
Например, в определенных вариантах реализации изобретения предложены соединения, содержащие модифицированный олигонуклеотид, состоящий из 10-80, 12-50, 12-30, 15-30, 18-24, 19-22 или 20 связанных нуклеозидов, имеющий нуклеотидную последовательность, содержащую по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18 или по меньшей мере 19 смежных нуклеотидных оснований из любой нуклеотидной последовательности из SEQ ID №: 23, 24, 25, 26, 27, 28, 29, 30, 31, 32 или 33-874.
В определенных вариантах реализации изобретения предложены соединения, содержащие модифицированный олигонуклеотид, состоящий из 10-80, 12-50, 12-30, 15-30, 18-24, 19-22 или 20 связанных нуклеозидов, имеющий нуклеотидную последовательность, содержащую по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 смежных нуклеотидных оснований из любой нуклеотидной последовательности из SEQ ID №: 23, 24, 25, 26, 27, 28, 29, 30, 31, 32 или 33-874.
В определенных вариантах реализации изобретения предложены соединения, содержащие модифицированный олигонуклеотид, состоящий из 10-80, 12-50, 12-30, 15-30 или 15-17 связанных нуклеозидов, имеющий нуклеотидную последовательность, содержащую часть из по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18 или по меньшей мере 19 смежных нуклеотидных оснований, комплементарную части эквивалентной длины из нуклеотидных оснований 1343-1368, 1317-1366, 2748-2791, 2155-2208, 2748-2791, 730-748, 528-547, 531-567, 636-697, 1311-1331, 1314-1339, 1446-1475, 1635-1670, 1610-1638, 1457-1486, 2773-1788, 931-948, 934-949, 937-952, 942-957, 937-957, 943-958, 937-953, 1346-1363, 1346-1361, 1347-1363, 2162-2179, 2492-2508, 2696-2717 или 2683-2703 из SEQ ID №: 1.
В определенных вариантах реализации изобретения предложены соединения, содержащие модифицированный олигонуклеотид, состоящий из 10-80, 12-50, 12-30, 15-30, 18-24, 19-22 или 20 связанных нуклеозидов, имеющий нуклеотидную последовательность, содержащую часть из по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18 или по меньшей мере 19 смежных нуклеотидных оснований, комплементарную части эквивалентной длины из нуклеотидных оснований 10195-10294, 13553-13572, 13748-13767, 13455-13475, 13628-13657, 13735-13760, 13746-13905, 13836-13851, 13553-13568, 13563-13578, 13624-13639, 13686-13701, 13760-13775, 13763-13779, 13765-13780, 2580-2595, 6446-6461, 11099-11115, 11082-11099, 1974-1993, 4435-4456, 6035-6052, 6360-6385, 6445-6468, 6807-6824, 6789-6806 или 6596-6615 из SEQ ID №: 2.
В определенных вариантах реализации изобретения модифицированный олигонуклеотид представляет собой одноцепочечный олигонуклеотид.
В определенных вариантах реализации изобретения нуклеотидная последовательность модифицированного олигонуклеотида по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или на 100% комплементарна любой из SEQ ID №: 23, 24, 25, 26, 27, 28, 29, 30, 31, 32 или 33-874.
В определенных вариантах реализации изобретения по меньшей мере одна межнуклеозидная связь представляет собой модифицированную межнуклеозидную связь.
В определенных вариантах реализации изобретения каждая межнуклеозидная связь указанного модифицированного олигонуклеотида представляет собой тиофосфатную межнуклеозидную связь.
В определенных вариантах реализации изобретения по меньшей мере один нуклеозид содержит модифицированный сахар.
В определенных вариантах реализации изобретения по меньшей мере один модифицированный сахар представляет собой бициклический сахар.
В определенных вариантах реализации изобретения по меньшей мере один модифицированный сахар представляет собой cEt.
В определенных вариантах реализации изобретения по меньшей мере один модифицированный сахар содержит 2'-O-метоксиэтил.
В определенных вариантах реализации изобретения по меньшей мере один нуклеозид содержит модифицированное нуклеотидное основание.
В определенных вариантах реализации изобретения модифицированное нуклеотидное основание представляет собой 5-метилцитозин. В определенных вариантах реализации изобретения каждый остаток цитозина содержит 5-метилцитозин.
В определенных вариантах реализации изобретения модифицированный олигонуклеотид состоит из 16 связанных нуклеозидов.
В определенных вариантах реализации изобретения модифицированный олигонуклеотид состоит из 17 связанных нуклеозидов.
В определенных вариантах реализации изобретения модифицированный олигонуклеотид состоит из 20 связанных нуклеозидов.
Антисмысловые соединения
Олигомерные соединения включают, но не ограничиваются этим, олигонуклеотиды, олигонуклеозиды, аналоги олигонуклеотидов, миметики олигонуклеотидов, антисмысловые соединения, антисмысловые олигонуклеотиды и миРНК. Олигомерное соединение может быть «антисмысловым» в отношении нуклеиновой кислоты-мишени, что означает, что оно способно гибридизироваться с нуклеиновой кислотой-мишенью посредством водородного связывания.
В определенных вариантах реализации изобретения антисмысловое соединение имеет нуклеотидную последовательность, которая, если записывать ее в направлении от 5' до 3', содержит обратную комплементарную последовательность сегмента-мишени нуклеиновой кислоты-мишени, на которую оно нацелено. В таких определенных вариантах реализации изобретения антисмысловой олигонуклеотид имеет нуклеотидную последовательность, которая, если записывать ее в направлении от 5' до 3', содержит обратную комплементарную последовательность сегмента-мишени нуклеиновой кислоты-мишени, на которую он нацелен.
В определенных вариантах реализации изобретения описанное в данном документе антисмысловое соединение, нацеленное на DMPK, имеет длину 10-30 нуклеотидов. Другими словами, в некоторых вариантах реализации изобретения антисмысловые соединения состоят из от 10 до 30 связанных нуклеотидных оснований. В других вариантах реализации изобретения антисмысловое соединение содержит модифицированный олигонуклеотид из 8-80, 10-80, 12-30, 12-50, 15-30, 15-18, 15-17, 16-16, 18-24, 19-22 или 20 связанных нуклеотидных оснований. В таких определенных вариантах реализации изобретения антисмысловое соединение содержит модифицированный олигонуклеотид, длина которого составляет 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79 или 80 связанных нуклеотидных оснований или находится в диапазоне, определяемом любыми двумя вышеприведенными величинами. В определенных вариантах реализации изобретения антисмысловые соединения любой приведенной длины содержат по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18 или по меньшей мере 19 смежных нуклеотидных оснований из нуклеотидной последовательности любого из типовых антисмысловых соединений, описанных в данном документе (например, по меньшей мере 8 смежных нуклеотидных оснований из нуклеотидной последовательности, приведенной в любой из SEQ ID №: 23, 24, 25, 26, 27, 28, 29, 30, 31, 32 или 33-874.
В определенных вариантах реализации изобретения антисмысловое соединение содержит укороченный или усеченный модифицированный олигонуклеотид. Укороченный или усеченный модифицированный олигонуклеотид может содержать удаление одного нуклеозида в 5' конце (5' усечение) или, в альтернативном варианте, в 3' конце (3' усечение). Укороченный или усеченный модифицированный олигонуклеотид может содержать удаление двух нуклеозидов в 5' конце или, в альтернативном варианте, удаление двух субъединиц в 3' конце. В альтернативном варианте удаленные нуклеозиды могут находиться в разных местах модифицированного олигонуклеотида, например, в антисмысловом соединении, содержащем удаление одного нуклеозида в 5' конце и удаление одного нуклеозида в 3' конце.
В случае присутствия одного дополнительного нуклеозида в удлиненном олигонуклеотиде дополнительный нуклеозид может находиться в 5' или 3' конце олигонуклеотида. В случае присутствия двух или более дополнительных нуклеозидов добавленные нуклеозиды могут прилегать друг к другу, например, в олигонуклеотиде, содержащем два добавленных нуклеозида в 5' конце (5' добавление), или, в альтернативном варианте, в 3' конце (3' добавление) олигонуклеотида. В альтернативном варианте добавленные нуклеозиды могут находиться в разных местах антисмыслового соединения, например, в олигонуклеотиде, содержащем один добавленный нуклеозид в 5' конце и одну добавленную субъединицу в 3' конце.
Существует возможность увеличивать или уменьшать длину антисмыслового соединения, такого как антисмысловой олигонуклеотид, и/или вносить несовпадающие основания с сохранением активности. Например, в Woolf et al. (Proc. Natl. Acad. Sci. USA 89: 7305-7309, 1992) группы антисмысловых олигонуклеотидов длиной в 13-25 нуклеотидных оснований исследовали в отношении их способности индуцировать расщепление РНК-мишени в инъекционной модели с ооцитами. Антисмысловые олигонуклеотиды длиной в 25 нуклеотидных оснований с 8 или 11 несовпадающими основаниями вблизи концов антисмысловых олигонуклеотидов оказались способны управлять специфическим расщеплением РНК-мишени, хоть и в меньшей степени, чем антисмысловые олигонуклеотиды, не содержавшие несовпадений. Аналогично, целевое специфическое расщепление было достигнуто при помощи антисмысловых олигонуклеотидов из 13 нуклеотидных оснований, включая те, которые содержали 1 или 3 несовпадений.
Gautschi et al (J. Natl. Cancer Inst. 93: 463-471, March 2001) продемонстрировали способность олигонуклеотида, обладающего 100% комплементарностью с bcl-2 мРНК и имеющего 3 несовпадения с bcl-xL мРНК, снижать экспрессию как bcl-2, так и bcl-xL in vitro и in vivo. Кроме того, этот олигонуклеотид продемонстрировал эффективную противоопухолевую активность in vivo.
Maher and Dolnick (Nuc. Acid. Res. 16: 3341-3358, 1988) исследовали группы тандемных антисмысловых олигонуклеотидов из 14 нуклеотидных оснований, и антисмысловых олигонуклеотидов из 28 и 42 нуклеотидных оснований, содержавших, соответственно, последовательность двух или трех тандемных антисмысловых олигонуклеотидов, в отношении их способности блокировать трансляцию человеческой ДГФР в анализе кроличьих ретикулоцитов. Каждый из трех антисмысловых олигонуклеотидов из 14 нуклеотидных оснований сам по себе был способен ингибировать трансляцию, хоть и в намного меньшей степени, чем антисмысловые олигонуклеотиды из 28 и 42 нуклеотидных оснований.
Нуклеиновые кислоты-мишени, области-мишени и нуклеотидные последовательности-мишени
Нуклеотидные последовательности, которые кодируют DMPK, включают, без ограничений, следующие последовательности, такие как приведенная под номером доступа GenBank NM_001081560.1 (включенная в данный документ как SEQ ID №: 1), под номером доступа GenBank NT_011109.15, усеченная от нуклеотида 18540696 до 18555106 (включенная в данный документ как SEQ ID №: 2), под номером доступа GenBank NT_039413.7, усеченная от нуклеотида 16666001 до 16681000 (включенная в данный документ как SEQ ID №: 3), под номером доступа GenBank NM_032418.1 (включенная в данный документ как SEQ ID №: 4), под номером доступа GenBank AI007148.1 (включенная в данный документ как SEQ ID №: 5), под номером доступа GenBank AI304033.1 (включенная в данный документ как SEQ ID №: 6), под номером доступа GenBank BC024150.1 (включенная в данный документ как SEQ ID №: 7), под номером доступа GenBank BC056615.1 (включенная в данный документ как SEQ ID №: 8), под номером доступа GenBank BC075715.1 (включенная в данный документ как SEQ ID №: 9), под номером доступа GenBank BU519245.1 (включенная в данный документ как SEQ ID №: 10), под номером доступа GenBank CB247909.1 (включенная в данный документ как SEQ ID №: 11), под номером доступа GenBank CX208906.1 (включенная в данный документ как SEQ ID №: 12), под номером доступа GenBank CX732022.1 (включенная в данный документ как SEQ ID №: 13), под номером доступа GenBank S60315.1 (включенная в данный документ как SEQ ID №: 14), под номером доступа GenBank S60316.1 (включенная в данный документ как SEQ ID №: 15), под номером доступа GenBank NM_001081562.1 (включенная в данный документ как SEQ ID №: 16) и под номером доступа GenBank NM_001100.3 (включенная в данный документ как SEQ ID №: 17). Понятно, что последовательность, приведенная в каждой SEQ ID № в Примерах данного документа, не зависит от каких-либо модификаций сахарного компонента, межнуклеозидной связи или нуклеотидных оснований. Следовательно, антисмысловые соединения, определяемые SEQ ID №, могут независимо содержать одну или более модификаций сахарного компонента, межнуклеозидной связи или нуклеотидных оснований. Антисмысловые соединения, описанные при помощи номера Isis (Isis No), указывают на комбинацию нуклеотидной последовательности и мотива.
В определенных вариантах реализации изобретения область-мишень представляет собой структурно определенную область нуклеиновой кислоты-мишени. Например, область-мишень может включать 3' НТО, 5' НТО, экзон, интрон, сочетание экзон/интрон, кодирующую область, область инициации трансляции, область терминации трансляции или другую определенную область нуклеиновой кислоты. Структурно определенные области DMPK можно получить по номерам доступа в базах данных по последовательностям, таким как NCBI, а такая информация включена в данный документ посредством ссылки. В определенных вариантах реализации изобретения область-мишень может включать последовательность от 5' участка-мишени одного сегмента-мишени в пределах участка-мишени до 3' участка-мишени другого сегмента-мишени в пределах участка-мишени.
Нацеливание включает определение по меньшей мере одного сегмента-мишени, с которым антисмысловое соединение гибридизируется таким образом, который приводит к желаемому эффекту. В определенных вариантах реализации изобретения желаемым эффектом является снижение уровней мРНК нуклеиновой кислоты-мишени. В определенных вариантах реализации изобретения желаемым эффектом является снижение уровней белка, кодируемого нуклеиновой кислотой-мишенью, или фенотипические изменения, связанные с нуклеиновой кислотой-мишенью.
Область-мишень может содержать один или более сегментов-мишеней. Множественные сегменты-мишени в пределах области-мишени могут перекрываться. В альтернативном варианте они могут не перекрываться. В определенных вариантах реализации изобретения сегменты-мишени в пределах области-мишени разделены не более чем около 300 нуклеотидами. В определенных вариантах реализации изобретения сегменты-мишени в пределах области-мишени разделены количеством нуклеотидов, которое составляет не более чем, составляет не более чем около 250, 200, 150, 100, 90, 80, 70, 60, 50, 40, 30, 20 или 10 нуклеотидов нуклеиновой кислоты-мишени, или соответствует диапазону, определяемому любыми двумя из вышеприведенных величин. В определенных вариантах реализации изобретения сегменты-мишени в пределах области-мишени разделены не более чем или не более чем около 5 нуклеотидами нуклеиновой кислоты-мишени. В определенных вариантах реализации изобретения сегменты-мишени являются смежными. Также включены области-мишени, определяемые диапазоном, чья стартовая нуклеиновая кислота представляет собой любой из 5' участков-мишеней или любой из 3' участков-мишеней, приведенных в данном документе.
Подходящие сегменты-мишени могут находиться в пределах 5' НТО, кодирующей области, 3' НТО, интрона, экзона или сочетания экзон/интрон. Сегменты-мишени, содержащие стартовый кодон или стоп-кодон также являются подходящими сегментами-мишенями. Из подходящего сегмента-мишени может быть специально исключена структурно определенная область, такая как стартовый кодон или стоп-кодон.
Определение подходящих сегментов-мишеней может включать сравнение последовательности нуклеиновой кислоты-мишени с другими последовательностями в геноме. Например, для выявления сходных областей среди разных нуклеиновых кислот можно использовать алгоритм BLAST. Это сравнение может предупредить выбор антисмыслового соединения, которое может гибридизироваться неспецифическим образом с последовательностями, отличными от выбранной нуклеиновой кислоты (т.е. нецелевыми или не являющимися мишенями последовательностями).
В пределах активной области-мишени может существовать разница в активности (например, определяемая в виде процентного снижения уровней нуклеиновой кислоты-мишени) антисмысловых соединений. В определенных вариантах реализации изобретения снижение уровней мРНК DMPK свидетельствуют об ингибировании экспрессии белка DMPK. Снижение уровней белка DMPK также свидетельствует об ингибировании экспрессии мРНК-мишени. Кроме того, об ингибировании экспрессии мРНК и/или белка DMPK могут свидетельствовать фенотипические изменения, такие как снижение миотонии или снижение патологии сплайсинга.
Гибридизация
В некоторых вариантах реализации изобретения между раскрытым в данном документе антисмысловым соединением и нуклеиновой кислотой DMPK происходит гибридизация. Наиболее распространенный механизм гибридизации включает водородное связывание (например, Уотсон-Криковское, Хугстеновское или обратное Хугстеновское водородное связывание) между комплементарными нуклеотидными основаниями молекул нуклеиновых кислот.
Гибридизация может происходить в разных условиях. Жесткие условия зависят от последовательностей и определяются природой и составом молекул нуклеиновых кислот, которые должны гибридизироваться.
Способы определения того, может ли последовательность специфически гибридизироваться с нуклеиновой кислотой-мишенью, хорошо известны в данной области техники (Sambrooke and Russell, Molecular Cloning: A Laboratory Manual, 3rd Ed., 2001). В определенных вариантах реализации изобретения предложенные в данном документе антисмысловые соединения могут специфически гибридизироваться с нуклеиновой кислотой DMPK.
Комплементарность
Антисмысловое соединение и нуклеиновая кислота-мишень комплементарны друг другу, если достаточное количество нуклеотидных оснований антисмыслового соединения может образовывать водородные связи с соответствующими нуклеотидными основаниями нуклеиновой кислоты-мишени таким образом, чтобы привести к желаемому эффекту (например, антисмысловому ингибированию нуклеиновой кислоты-мишени, такой как нуклеиновая кислота DMPK).
Антисмысловое соединение может гибридизироваться на протяжении одного или более сегментов нуклеиновой кислоты DMPK таким образом, что промежуточные или прилегающие сегменты оказываются не вовлеченными в процесс гибридизации (например, в случае петлевой структуры, несовпадения или шпилечной структуры).
В определенных вариантах реализации изобретения предложенные в данном документе антисмысловые соединения или их определенные части являются или являются по меньшей мере на 70%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% комплементарными нуклеиновой кислоте DMPK, области-мишени, сегменту-мишени или их определенной части. В определенных вариантах реализации изобретения антисмысловые соединения являются по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 86%, по меньшей мере на 87%, по меньшей мере на 88%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% комплементарными нуклеиновой кислоте DMPK, области-мишени, сегменту-мишени или их определенной части и содержат по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18 или по меньшей мере 19 смежных нуклеотидных оснований из нуклеотидной последовательности любого из типовых антисмысловых соединений, описанных в данном документе (например, по меньшей мере 8 смежных нуклеотидных оснований из нуклеотидной последовательности, приведенной в любой из SEQ ID №: 23, 24, 25, 26, 27, 28, 29, 30, 31, 32 или 33-874). Процент комплементарности антисмыслового соединения с нуклеиновой кислотой-мишенью может быть определен при помощи общеизвестных методов и оценивается на протяжении всего антисмыслового соединения.
Например, антисмысловое соединение, в котором 18 из 20 нуклеотидных оснований антисмыслового соединения комплементарны области-мишени и, следовательно, могут специфически гибридизироваться, демонстрирует 90 процентов комплементарности. В этом примере оставшиеся некомплементарные нуклеотидные основания могут быть сгруппированы или перемежаться с комплементарными нуклеотидными основаниями и не должны обязательно быть смежными по отношению друг к другу или к комплементарным нуклеотидным основаниям. Следовательно, антисмысловое соединение, длина которого составляет 18 нуклеотидных оснований, содержащее 4 (четыре) некомплементарных нуклеотидных основания, которые фланкируются двумя областями полной комплементарности с нуклеиновой кислотой-мишенью, имеет 77,8% общей комплементарности с нуклеиновой кислотой-мишенью и, таким образом, входит в объем настоящего изобретения. Процент комплементарности антисмыслового соединения с определенной областью нуклеиновой кислоты-мишени можно определить обычными методами, используя программы BLAST (основные инструменты поиска локального выравнивания) и программы PowerBLAST, известные в данной области техники (Altschul et al., J. Mol. Biol., 1990, 215, 403 410; Zhang and Madden, Genome Res., 1997, 7, 649 656). Процент гомологии, идентичности последовательностей или комплементарности можно определить, например, при помощи программы Gap (Wisconsin Sequence Analysis Package, Version 8 for Unix, Genetics Computer Group, University Research Park, Madison Wis.), применяя настройки по умолчанию, в которой используется алгоритм Смита и Уотермана (Adv. Appl. Math., 1981, 2, 482 489).
В определенных вариантах реализации изобретения предложенные в данном документе антисмысловые соединения или их определенные части являются полностью комплементарными (т.е. 100% комплементарными) нуклеиновой кислоте-мишени или ее определенной части. Например, антисмысловое соединение может быть полностью комплементарным нуклеиновой кислоте DMPK или ее области-мишени, или сегменту-мишени, или последовательности-мишени. В контексте данного документе «полная комплементарность» означает, что каждое нуклеотидное основание антисмыслового соединения способно к точному спариванию оснований с соответствующими нуклеотидными основаниями нуклеиновой кислоты-мишени. Например, антисмысловое соединение из 20 нуклеотидных оснований является полностью комплементарным последовательности-мишени, имеющей длину в 400 нуклеотидных оснований, в том случае, если существует соответствующая часть из 20 нуклеотидных оснований нуклеиновой кислоты-мишени, которая полностью комплементарна антисмысловому соединению. Термин полная комплементарность также может употребляться в отношении определенной части первой и/или второй нуклеиновой кислоты. Например, часть из 20 нуклеотидных оснований антисмыслового соединения из 30 нуклеотидных оснований может быть «полностью комплементарной» последовательности-мишени, имеющей длину в 400 нуклеотидных оснований. Часть из 20 нуклеотидных оснований олигонуклеотида из 30 нуклеотидных оснований полностью комплементарна последовательности-мишени, если последовательность-мишень содержит соответствующую часть из 20 нуклеотидных оснований, в которой каждое нуклеотидное основание комплементарно части из 20 нуклеотидных оснований антисмыслового соединения. В то же время, все антисмысловое соединение из 30 нуклеотидных оснований может быть полностью комплементарным последовательности-мишени в зависимости от того, являются ли оставшиеся 10 нуклеотидных оснований антисмыслового соединения также комплементарными последовательности-мишени.
Некомплементарное нуклеотидное снование может быть расположено в 5' конце или 3' конце антисмыслового соединения. В альтернативном варианте некомплементарное нуклеотидное основание или некомплементарные нуклеотидные основания могут находиться на внутренней позиции антисмыслового соединения. В случае присутствия двух или более некомплементарных нуклеотидных оснований они могут быть как смежными (т.е. связанными), так и несмежными. В одном варианте реализации изобретения некомплементарное нуклеотидное основание расположено в сегменте крыла гэпмерного антисмыслового олигонуклеотида.
В определенных вариантах реализации изобретения антисмысловые соединения длиной в или вплоть до 10, 12, 13, 14, 15, 16, 17, 18, 19 или 20 нуклеотидных оснований содержат не более 4, не более 3, не более 2 или не более 1 некомплементарного(ых) основания(ий) по отношению к нуклеиновой кислоте-мишени, такой как нуклеиновая кислота DMPK или ее определенная часть.
В определенных вариантах реализации изобретения антисмысловые соединения длиной в или вплоть до 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 нуклеотидных оснований содержат не более 6, не более 5, не более 4, не более 3, не более 2 или не более 1 некомплементарного(ых) основания(ий) по отношению к нуклеиновой кислоте-мишени, такой как нуклеиновая кислота DMPK или ее определенная часть.
Предложенные в данном документе антисмысловые соединения также включают те, которые комплементарны части нуклеиновой кислоты-мишени. В контексте данного документа «часть» относится к определенному количеству смежных (т.е. связанных) нуклеотидных оснований в пределах области или сегмента нуклеиновой кислоты-мишени. Также «часть» может относиться к определенному количеству смежных нуклеотидных оснований антисмыслового соединения. В определенных вариантах реализации изобретения антисмысловые соединения комплементарны по меньшей мере части из 8 нуклеотидных оснований сегмента-мишени. В определенных вариантах реализации изобретения антисмысловые соединения комплементарны по меньшей мере части из 10 нуклеотидных оснований сегмента-мишени. В определенных вариантах реализации изобретения антисмысловые соединения комплементарны по меньшей мере части из 15 нуклеотидных оснований сегмента-мишени. Также включены антисмысловые соединения, которые комплементарны части из по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19, по меньшей мере 20 или более нуклеотидных оснований сегмента-мишени или из диапазона, определяемого любыми двумя из этих величин.
Идентичность
Предложенные в данном документе антисмысловые соединения также могут обладать определенным процентом идентичности с конкретной нуклеотидной последовательностью, SEQ ID NO или соединением, представленным конкретным номером Isis, или его частью. В контексте данного документа антисмысловое соединение идентично раскрытой в данном документе последовательности, если оно обладает такой же самой способностью к спариванию. Например, РНК, которая содержит урацил вместо тимидина в раскрытой последовательности ДНК, считается идентичной последовательности ДНК, так как и урацил и тимидин спариваются с аденином. Также включены укороченные или удлиненные версии описанных в данном документе антисмысловых соединений, а также соединения, содержащие неидентичные основания по сравнению с предложенными в данном документе антисмысловыми соединениями. Неидентичные основания могут прилегать друг к другу или могут находиться в разных местах антисмыслового соединения. Процент идентичности антисмыслового соединения рассчитывают в соответствии с количеством оснований, которые характеризуются идентичным спариванием оснований, относительно последовательности, с которой проводят сравнение.
В определенных вариантах реализации изобретения антисмысловые соединения или их части являются по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% идентичными одному или более типовым антисмысловым соединениям или SEQ ID NO, или их частям, раскрытым в данном документе.
Модификации
Нуклеозид представляет собой комбинацию основания и сахара. Нуклеотидное основание (также известное как основание), как часть нуклеозида, обычно является гетероциклическим основанием. Нуклеотиды представляют собой нуклеозиды, которые дополнительно содержат фосфатную группу, ковалентно связанную с сахарной частью нуклеозида. В случае тех нуклеозидов, которые содержат пентофуранозиловый сахар, фосфатная группа может быть связана с 2', 3' или 5' гидроксильным компонентом сахара. Олигонуклеотиды образуются путем ковалентного связывания прилегающих нуклеозидов друг с другом с образованием линейного полимерного олигонуклеотида. В пределах олигонкулеотидной структуры фосфатные группы обычно называются образующими межнуклеозидные связи олигонуклеотида.
Модификации антисмысловых соединений включают замены или изменения в межнуклеозидных связях, сахарных компонентах или нуклеотидных основаниях. Модифицированные антисмысловые соединения часто являются более предпочтительными, чем нативные формы вследствие наличия желаемых свойств, таких как, например, повышенное поглощение клетками, повышенная аффинность в отношении нуклеиновой кислоты-мишени, повышенная стабильность в присутствии нуклеаз или повышенная ингибирующая активность.
Химически модифицированные нуклеозиды также можно применять, чтобы повысить аффинность связывания укороченного или усеченного олигонуклеотида в отношении нуклеиновой кислоты-мишени. Следовательно, часто в случае более коротких антисмысловых соединений, которые содержат такие химически модифицированные олигонуклеотиды, могут быть получены сопоставимые результаты.
Модифицированные межнуклеозидные связи
Природной межнуклеозидной связью РНК и ДНК является 3'-5' фосфодиэфирная связь. Антисмысловые соединения, содержащие одну или более модифицированных, т.е. неприродных, межнуклеозидных связей, часто предпочитают антисмысловым соединениям, содержащим природные межнуклеозидные связи, вследствие наличия желаемых свойств, таких как, например, повышенное поглощение клетками, повышенная аффинность в отношении нуклеиновых кислот-мишеней и повышенная стабильность в присутствии нуклеаз.
Олигонуклеотиды, содержащие модифицированные межнуклеозидные связи, включают межнуклеозидные связи, в которых сохранен атом фосфора, а также межнуклеозидные связи, в которых отсутствует атом фосфора. Типовые фосфорсодержащие межнуклеозидные связи включают, но не ограничиваются этим, фосфодиэфиры, фосфотриэфиры, метилфосфонаты, фосфорамидаты и тиофосфаты. Способы получения фосфорсодержащих и не содержащих фосфор связей хорошо известны.
В определенных вариантах реализации изобретения антисмысловые соединения, нацеленные на нуклеиновую кислоту DMPK, содержат одну или более модифицированных межнуклеозидных связей. В определенных вариантах реализации изобретения модифицированные межнуклеозидные связи представляют собой тиофосфатные связи. В определенных вариантах реализации изобретения каждая межнуклеозидная связь антисмыслового соединения представляет собой тиофосфатную межнуклеозидную связь.
Модифицированные сахарные компоненты
Антисмысловые соединения согласно изобретению могут, необязательно, содержать один или более нуклеозидов, в которых была модифицирована сахарная группа. Такие нуклеозиды с модифицированными сахарами могут обеспечивать антисмысловым соединениям повышенную устойчивость к нуклеазам, повышенную аффинность связывания или некоторые другие благоприятные биологические свойства. В определенных вариантах реализации изобретения нуклеозиды содержат химически модифицированные рибофуранозное кольцевые компоненты. Примеры химически модифицированных рибофуранозных колец включают, без ограничений, добавление замещающих групп (включая 5' и 2' замещающие группы), соединение негеминальных атомов кольца с образованием бициклических нуклеиновых кислот (BNA), замещение атома кислорода рибозильного кольца на S, N(R) или C(R1)(R2) (R, R1 и R2 каждый независимо представляет собой Н, C1-C12 алкил или защитную группу) и их комбинации. Примеры химически модифицированных сахаров включают 2'-F-5'-метилзамещенный нуклеозид (смотрите Международную заявку РСТ WO 2008/101157, опубликованную 8/21/08, в отношении других раскрытых 5',2'-бисзамещенных нуклеозидов) или замещение атома кислорода рибозильного кольца на S с последующим замещением в 2'-позиции (смотрите заявку на патент США US 2005-0130923, опубликованную 16 июня 2005 г.) или, в альтернативном варианте, 5'-замещение BNA (смотрите Международную заявку РСТ WO 2007/134181, опубликованную 11/22/07, где LNA замещена, например, 5'-метиловой или 5'-виниловой группой).
Примеры нуклеозидов, содержащих модифицированные сахарные компоненты, включают, без ограничений, нуклеозиды, содержащие 5'-виниловые, 5'-метиловые (R или S), 4'-S, 2'-F, 2'-ОСН3, 2'-ОСН2СН3, 2'-OCH2CH2F и 2'-O(СН2)2OCH3 замещающие группы. Замещение в позиции 2' также может быть выбрано из аллила, амино, азидо, тио, O-аллила, O-C1-C10 алкила, OCF3, OCH2F, O(СН2)2SCH3, O(СН2)2-O-N(Rm)(Rn), O-СН2-C(=O)-N(Rm)(Rn) и O-СН2-C(=O)-N(R1)-(СН2)2-N(Rm)(Rn), где каждый R1, Rm и Rn независимо представляет собой Н или замещенный или незамещенный C1-С10 алкил.
Примеры бициклических нуклеиновых кислот (BNA) включают, без ограничений, нуклеозиды, содержащие мостик между 4' и 2' атомами рибозильного кольца. В определенных вариантах реализации изобретения предложенные в данном документе антисмысловые соединения содержат один или более нуклеозидов BNA, при этом мостик имеет одну из формул: 4'-(СН2)-O-2' (LNA); 4'-(СН2)-S-2'; 4'-(СН2)2-O-2' (ENA); 4'-СН(СН3)-O-2' и 4'-СН(CH2OCH3)-O-2' (а также ее аналоги, смотрите патент США 7399845, выданный 15 июля 2008 г.); 4'-С(СН3)(СН3)-O-2' (а также ее аналоги, смотрите PCT/US 2008/068922, опубликованную как WO/2009/006478, опубликованную 8 января 2009 г.); 4'-СН2-N(ОСН3)-2' (а также ее аналоги, смотрите PCT/US 2008/064591, опубликованную как WO/2008/150729, опубликованную 11 декабря 2008 г.); 4'-СН2-O-N(СН3)-2' (смотрите опубликованную заявку на патент США US 2004-0171570, опубликованную 2 сентября 2004 г.); 4'-СН2-N(R)-O-2', где R представляет собой Н, C1-C12 алкил или защитную группу (смотрите патент США 7427672, выданный 23 сентября 2008 г.); 4'-СН2-С(Н)(СН3)-2' (смотрите Chattopadhyaya et al., J. Org. Chem., 2009, 74, 118-134); и 4'-СН2-С(=СН2)-2' (а также ее аналоги, смотрите PCT/US 2008/066154, опубликованную как WO 2008/154401, опубликованную 8 декабря 2008 г.).
О дополнительных бициклических нуклеозидах сообщалось в литературе (смотрите, например: Srivastava et al., J. Am. Chem. Soc., 2007, 129(26) 8362-8379; Frieden et al., Nucleic Acids Research, 2003, 21, 6365-6372; Elayadi et al., Curr. Opinion Invens. Drugs, 2001, 2, 558-561; Braasch et al., Chem. Biol., 2001, 8, 1-7; Orum et al., Curr. Opinion Mol. Ther., 2001, 3, 239-243; Wahlestedt et al., Proc. Natl. Acad. Sci. U.S.A., 2000, 97, 5633-5638; Singh et al., Chem. Commun., 1998, 4, 455-456; Koshkin et al., Tetrahedron, 1998, 54, 3607-3630; Kumar et al., Bioorg. Med. Chem. Lett., 1998, 8, 2219-2222; Singh et al., J. Org. Chem., 1998, 63, 10035-10039; патенты США №: 7399845; 7053207; 7034133; 6794499; 6770748; 6670461; 6525191; 6268490; публикации патентов США №: US 2008-0039618; US 2007-0287831; US 2004-0171570; заявки на патенты США №: 12/129154; 61/099844; 61/097787; 61/086231; 61/056564; 61/026998; 61/026995; 60/989574; Международные заявки WO 2007/134181; WO 2005/021570; WO 2004/106356; WO 94/14226; и Международные заявки согласно РСТ №: PCT/US 2008/068922; PCT/US 2008/066154; и PCT/US 2008/064591). Каждый из вышеприведенных бициклических нуклеозидов можно получить так, чтобы он имел одну или более стереохимических сахарных конфигураций, включая, например, α-L-рибофуранозу и β-D-рибофуранозу (смотрите международную заявку согласно PCT/DK 98/00393, опубликованную 25 марта 1999 г. как WO 99/14226).
В определенных вариантах реализации изобретения бициклические нуклеозиды содержат мостик между 4' и 2' атомами углерода пентофуранозильного сахарного компонента, включая, без ограничений, мостики, содержащие 1 или от 1 до 4 связанных групп, независимо выбранных из -[C(Ra)(Rb)]n-, -C(Ra)=C(Rb)-, -C(Ra)=N-, -C(=NRa)-, -C(=O)-, -C(=S)-, -O-, -Si(Ra)2-, -S(=O)x- и -N(Ra)-; где: х равно 0, 1 или 2; n равно 1, 2, 3 или 4; каждый Ra и Rb независимо представляет собой Н, защитную группу, гидроксил, C1-C12 алкил, замещенный C1-C12 алкил, C2-C12 алкенил, замещенный C2-C12 алкенил, C2-C12 алкинил, замещенный C2-C12 алкинил, C5-C20 арил, замещенный С5-С20 арил, гетероциклический радикал, замещенный гетероциклический радикал, гетероарил, замещенный гетероарил, C5-С7 алициклический радикал, замещенный C5-C7 алициклический радикал, галоген, OJ1, NJ1J2, SJ1, N3, COOJ1, ацил (С(=O)-Н), замещенный ацил, CN, сульфонил (S(=O)2-J1) или сульфоксил (S(=O)-J1); и
каждый J1 и J2 независимо представляет собой Н, C1-C12 алкил, замещенный С1-С12 алкил, C2-C12 алкенил, замещенный C2-C12 алкенил, C2-C12 алкинил, замещенный C2-C12 алкинил, С5-С20 арил, замещенный С5-С20 арил, ацил (С(=O)-Н), замещенный ацил, гетероциклический радикал, замещенный гетероциклический радикал, C1-C12 аминоалкил, замещенный C1-C12 аминоалкил или защитную группу.
В определенных вариантах реализации изобретения мостик бициклического сахарного компонента представляет собой -[C(Ra)(Rb)]n-, -[C(Ra)(Rb)]n-O-, -C(RaRb)-N(R)-O- или -C(RaRb)-O-N(R)-. В определенных вариантах реализации изобретения мостик представляет собой 4'-СН2-2', 4'-(СН2)2-2', 4'-(СН2)3-2', 4'-СН2-O-2', 4'-(СН2)2-O-2', 4'-СН2-O-N(R)-2' и 4'-СН2-N(R)-O-2'-, где каждый R независимо представляет собой Н, защитную группу или C1-C12 алкил.
В определенных вариантах реализации изобретения бициклические нуклеозиды дополнительно определены при помощи изомерной конфигурации. Например, нуклеозид, содержащий мостик 4'-(СН2)-O-2', может находиться в α-L конфигурации или в β-D конфигурации. Ранее α-L-метиленокси(4'-СН2-O-2')-BNA были включены в антисмысловые олигонуклеотиды, которые демонстрировали антисмысловую активность (Frieden et al., Nucleic Acids Research, 2003, 21, 6365-6372).
В определенных вариантах реализации изобретения бициклические нуклеозиды включают те, которые содержат 4'-2' мостик, при этом такой мостик включает, без ограничений, α-L-4'-(СН2)-O-2', β-D-4'-СН2-O-2', 4'-(СН2)2-O-2', 4'-СН2-O-N(R)-2', 4'-СН2-N(R)-O-2', 4'-СН(СН3)-O-2', 4'-СН2-S-2', 4'-СН2-N(R)-2', 4'-СН2-СН(СН3)-2' и 4'-(СН2)3-2', где R представляет собой Н, защитную группу или C1-C12 алкил.
В определенных вариантах реализации изобретения бициклические нуклеозиды имеют
формулу:
где:
Вх представляет собой гетероциклическое основание;
-Qa-Qb-Qc- представляет собой -СН2-N(Rc)-СН2-, -C(=O)-N(Rc)-СН2-, -СН2-O-N(Rc)-, -СН2-N(Rc)-O- или -N(Rc)-O-СН2;
Rc представляет собой C1-C12 алкил или аминозащитную группу; и
Та и Tb каждый независимо представляет собой Н, гидроксилзащитную группу, сопряженную группу, реактивную фосфорную группу, фосфорный компонент или ковалентное присоединение к субстрату.
В определенных вариантах реализации изобретения бициклические нуклеозиды имеют формулу:
где:
Вх представляет собой гетероциклическое основание;
Та и Tb каждый независимо представляет собой Н, гидроксилзащитную группу, сопряженную группу, реактивную фосфорную группу, фосфорный компонент или ковалентное присоединение к субстрату;
Za представляет собой C1-С6 алкил, С2-С6 алкенил, С2-С6 алкинил, замещенный C1-С6 алкил, замещенный С2-С6 алкенил, замещенный С2-С6 алкинил, ацил, замещенный ацил, замещенный амид, тиол или замещенный тиол.
В одном варианте реализации изобретения каждая из замещенных групп независимо представляет собой моно- или полизамещенную группу с замещающими группами, независимо выбранными из галогена, оксо, гидроксила, OJc, NJcJd, SJc, N3, OC(=X)Jc и NJeC(=X)NJcJd, где каждый Jc, Jd и Je независимо представляет собой Н, C1-С6 алкил или замещенный C1-С6 алкил, а Х представляет собой О или NJc.
В определенных вариантах реализации изобретения бициклические нуклеозиды имеют формулу:
где:
Вх представляет собой гетероциклическое основание;
Та и Tb каждый независимо представляет собой Н, гидроксилзащитную группу, сопряженную группу, реактивную фосфорную группу, фосфорный компонент или ковалентное присоединение к субстрату;
Zb представляет собой C1-С6 алкил, C2-С6 алкенил, С2-С6 алкинил, замещенный C1-С6 алкил, замещенный С2-С6 алкенил, замещенный С2-С6 алкинил или замещенный ацил (С(=O)-).
В определенных вариантах реализации изобретения бициклические нуклеозиды имеют формулу:
где:
Вх представляет собой гетероциклическое основание;
Та и Tb каждый независимо представляет собой Н, гидроксилзащитную группу, сопряженную группу, реактивную фосфорную группу, фосфорный компонент или ковалентное присоединение к субстрату;
Rd представляет собой C1-С6 алкил, замещенный C1-С6 алкил, C2-С6 алкенил, замещенный С2-С6 алкенил, С2-С6 алкинил или замещенный С2-С6 алкинил;
каждый qa, qb, qc и qd независимо представляет собой Н, галоген, C1-С6 алкил, замещенный C1-С6 алкил, С2-С6 алкенил, замещенный С2-С6 алкенил, С2-С6 алкинил или замещенный С2-С6 алкинил, C1-С6 алкоксил, замещенный C1-С6 алкоксил, ацил, замещенный ацил, C1-С6 аминоалкил или замещенный C1-С6 аминоалкил;
В определенных вариантах реализации изобретения бициклические нуклеозиды имеют формулу:
где:
Вх представляет собой гетероциклическое основание;
Та и Tb каждый независимо представляет собой Н, гидроксилзащитную группу, сопряженную группу, реактивную фосфорную группу, фосфорный компонент или ковалентное присоединение к субстрату;
qa, qb, qe и qf каждый независимо представляет собой водород, галоген, C1-C12 алкил, замещенный С1-С12 алкил, С2-С12 алкенил, замещенный C2-C12 алкенил, C2-C12 алкинил, замещенный C2-C12 алкинил, C1-C12 алкокси, замещенный C1-C12 алкокси, OJj, SJj, SOJj, SO2Jj, NJjJk, N3, CN, C(=O)OJj, C(=O)NJjJk, C(=O)Jj, O-C(=O)NJjJk, N(Н)С(=NH)NJjJk, N(H)C(=O)NJjJk или N(H)C(=S)NJjJk;
или qe и qf вместе представляют собой =C(qg)(qh);
qg и qh каждый независимо представляет собой Н, галоген, C1-C12 алкил или замещенный C1-C12 алкил.
Были описаны синтез и получение бициклических нуклеозидов аденина, цитозина, гуанина, 5-метилцитозина, тимина и урацила, содержащих мостик 4'-СН2-O-2', наряду с их олигомеризацией и свойствами распознавания нуклеиновых кислот (Koshkin et al., Tetrahedron, 1998, 54, 3607-3630). Синтез бициклических нуклеозидов также был описан в WO 98/39352 и WO 99/14226.
Также были получены аналоги различных бициклических нуклеозидов, которые содержат 4'-2' соединительные группы, такие как 4'-СН2-O-2' и 4'-СН2-S-2' (Kumar et al., Bioorg. Med. Chem. Lett., 1998, 8, 2219-2222). Также было описано получение олигодезоксирибонуклеотидных двойных спиралей, содержащих бициклические нуклеозиды для применения в качестве субстратов для полимераз нуклеиновых кислот (Wengel et al., WO 99/14226). Кроме того, в данной области техники также был описан синтез 2'-амино-BNA -нового конформационно ограниченного высокоаффинного олигонуклеотидного аналога (Singh et al., J. Org. Chem., 1998, 63, 10035-10039). Кроме того, были получены 2'-амино и 2'-метиламино-BNA и ранее сообщалось о термической стабильности их двойных спиралей с комплементарными цепями РНК и ДНК.
В определенных вариантах реализации изобретения бициклические нуклеозиды имеют формулу:
где:
Вх представляет собой гетероциклическое основание;
Та и Tb каждый независимо представляет собой Н, гидроксилзащитную группу, сопряженную группу, реактивную фосфорную группу, фосфорный компонент или ковалентное присоединение к субстрату;
каждый qi, qj, qk и q1 независимо представляет собой Н, галоген, C1-C12 алкил, замещенный C1-C12 алкил, C2-C12 алкенил, замещенный C2-C12 алкенил, C2-C12 алкинил, замещенный C2-C12 алкинил, C1-C12 алкоксил, замещенный C1-C12 алкоксил, OJj, SJj, SOJj, SO2Jj, NJjJk, N3, CN, C(=O)OJj, C(=O)NJjJk, C(=O)Jj, O-C(=O)NJjJk, N(H)C(=NH)NJjJk, N(H)C(=O)NJjJk или N(H)C(=S)NJjJk; и
qi и qj или ql и qk вместе представляют собой =C(qg)(qh), где qg и qh каждый независимо представляет собой Н, галоген, C1-C12 алкил или замещенный C1-C12 алкил.
Был описан один карбоциклический бициклический нуклеозид, содержащий мостик 4'-(СН2)3-2' и мостик из аналога алкенила 4'-СН=СН-СН2-2' (Frier et al., Nucleic Acids Research, 1997, 25(22), 4429-4443 and Albaek et al., J. Org. Chem., 2006, 71, 7731-7740). Также были описаны синтез и получение карбоциклических бициклических нуклеозидов наряду с их олигомеризацией и биохимическими исследованиями (Srivastava et al., J. Am. Chem. Soc. 2007, 129(26), 8362-8379).
В определенных вариантах реализации изобретения бициклические нуклеозиды включают, но не ограничиваются этим, (А) α-L-метиленокси (4'-СН2-O-2') BNA, (В) β-D-метиленокси (4'-СН2-O-2') BNA, (С) этиленокси (4'-(СН2)2-O-2') BNA, (D) аминоокси (4'-СН2-O-N(R)-2') BNA, (E) оксиамино (4'-СН2-N(R)-O-2') BNA, (F) метил(метиленокси) (4'-СН(СН3)-O-2') BNA (также называемую конформационно ограниченным этиловым аналогом нуклеозида или cEt), (G) метилентио (4'-СН2-S-2') BNA, (Н) метиленамино (4'-СН2-N(R)-2') BNA, (I) метил карбоциклическую (4'-СН2-СН(СН3)-2') BNA, (J) пропилен карбоциклическую (4'-(СН2)3-2') BNA и (K) виниловую BNA, как проиллюстрировано ниже.
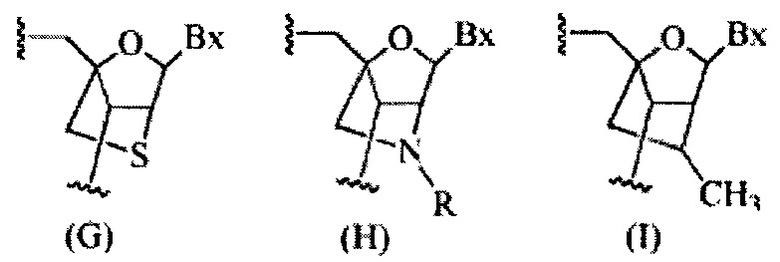
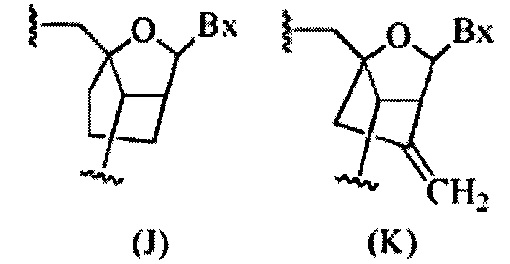
где Вх представляет собой гетероциклическое основание, a R независимо представляет собой Н, защитную группу, C1-С6 алкил или C1-С6 алкокси.
В определенных вариантах реализации изобретения нуклеозиды модифицированы путем замещения рибозильного кольца сахарным суррогатом. Такая модификация включает, без ограничений, замещение рибозильного кольца суррогатной кольцевой системой (иногда называемой аналогами ДНК), такой как морфолиновое кольцо, циклогексениловое кольцо, циклогексиловое кольцо или тетрагидропираниловое кольцо, например, имеющей одну из формул:
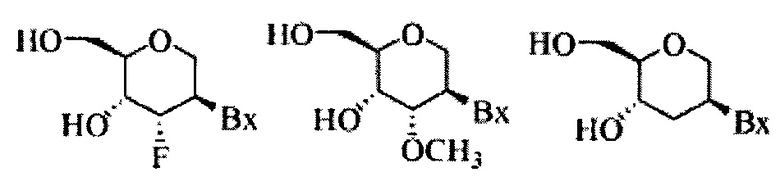
В определенных вариантах реализации изобретения выбирают сахарные суррогаты, имеющие формулу:
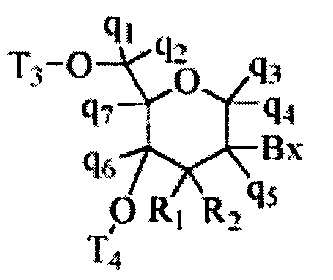
где:
Вх представляет собой гетероциклическое основание;
Т3 и Т4 каждый независимо представляет собой межнуклеозидную связывающую группу, соединяющую тетрагидропирановый нуклеозидный аналог с олигомерным соединением, или один из Т3 и Т4 представляет собой межнуклеозидную связывающую группу, соединяющую тетрагидропирановый нуклеозидный аналог с олигомерным соединением или олигонуклеотидом, а другой из Т3 и Т4 представляет собой Н, гидроксильную защитную группу, связанную сопряженную группу или 5' или 3'-терминальную группу;
q1, q2, q3, q4, q5, q6 и q7 каждый независимо представляет собой Н, C1-С6 алкил, замещенный C1-С6 алкил, С2-С6 алкенил, замещенный С2-С6 алкенил, С2-С6 алкинил или замещенный C2-С6 алкинил; и
один из R1 и R2 представляет собой водород, а второй выбран из галогена, замещенного или незамещенного алкокси, NJ1J2, SJ1, N3, OC(=X)J1, OC(=X)NJ1J2, NJ3C(=X)NJ1J2 и CN, где Х представляет собой О, S или NJ1, а каждый J1, J2 и J3 независимо представляет собой Н или C1-С6 алкил.
В определенных вариантах реализации изобретения каждый q1, q2, q3, q4, q5, q6 и q7 представляет собой Н. В определенных вариантах реализации изобретения по меньшей мере один из q1, q2, q3, q4, q5, q6 и q7 представляет собой элемент, отличный от Н. В определенных вариантах реализации изобретения по меньшей мере один из q1, q2, q3, q4, q5, q6 и q7 представляет собой метил. В определенных вариантах реализации изобретения предложены ТГФ нуклеозиды, в которых один из R1 и R2 представляет собой F. В определенных вариантах реализации изобретения R1 представляет собой фтор, a R2 представляет собой Н; R1 представляет собой метокси, a R2 представляет собой Н, и R1 представляет собой метоксиэтокси, a R2 представляет собой Н.
Такие сахарные суррогаты включают, но не ограничиваются этим, соединения, называемые в данной области техники гекситоловой нуклеиновой кислотой (HNA), альтритоловой нуклеиновой кислотой (ANA) и маннитоловой нуклеиновой кислотой (MNA) (смотрите Leumann, С.J., Bioorg. & Med. Chem., 2002, 10, 841-854).
В определенных вариантах реализации изобретения сахарные суррогаты содержат кольца, имеющие более 5 атомов и более одного гетероатома. Например, сообщалось о нуклеозидах, содержащих морфолиновые сахарные компоненты, и их применении в олигомерных соединениях (смотрите, например: Braasch et al., Biochemistry, 2002, 41, 4503-4510; и патенты США 5698685; 5166315; 5185444; и 5034506).
В контексте данного документа термин «морфолино» означает сахарный суррогат, имеющий следующую структуру:
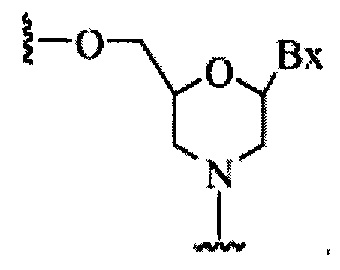
В определенных вариантах реализации изобретения морфолино могут быть модифицированными, например, путем добавления или изменения разных замещающих групп по сравнению с вышеприведенной структурой морфолино. Такие сахарные суррогаты называются в данном документе «модифицированными морфолино».
В определенных вариантах реализации изобретения антисмысловые соединения содержат один или более циклогексениловых нуклеозидов, которые представляют собой нуклеозиды, содержащие шестичленный циклогексенил на месте пентофуранозилового остатка в нуклеозидах природного происхождения. Модифицированные циклогексениловые нуклеозиды включают, но не ограничиваются этим, соединения, описанные в данной области техники (смотрите, например, опубликованную заявку согласно РСТ того же заявителя WO 2010/036696, опубликованную 10 апреля 2010, Robeyns et al., J. Am. Chem. Soc., 2008, 130(6), 1979-1984;  et al., Tetrahedron Letters, 2007, 48, 3621-3623; Nauwelaerts et al., J. Am. Chem. Soc., 2007, 129(30), 9340-9348; Gu et al.,, Nucleosides, Nucleotides & Nucleic Acids, 2005, 24(5-7), 993-998; Nauwelaerts et al., Nucleic Acids Research, 2005, 33(8), 2452-2463; Robeyns et al., Acta Crystallographica, Section F: Structural Biology and Crystallization Communications, 2005, F61(6), 585-586; Gu et al., Tetrahedron, 2004, 60(9), 2111-2123; Gu et al., Oligonucleotides, 2003, 13(6), 479-489; Wang et al., J. Org. Chem., 2003, 68, 4499-4505; Verbeure et al., Nucleic Acids Research, 2001, 29(24), 4941-4947; Wang et al., J. Org. Chem., 2001, 66, 8478-82; Wang et al., Nucleosides, Nucleotides & Nucleic Acids, 2001, 20(4-7), 785-788; Wang et al., J. Am. Chem., 2000, 122, 8595-8602; опубликованную заявку согласно РСТ WO 06/047842; и опубликованную заявку согласно РСТ WO 01/049687; содержание каждой из которых в полном объеме включено в данный документ посредством ссылки). Определенные модифицированные циклогексениловые нуклеозиды имеют формулу:
et al., Tetrahedron Letters, 2007, 48, 3621-3623; Nauwelaerts et al., J. Am. Chem. Soc., 2007, 129(30), 9340-9348; Gu et al.,, Nucleosides, Nucleotides & Nucleic Acids, 2005, 24(5-7), 993-998; Nauwelaerts et al., Nucleic Acids Research, 2005, 33(8), 2452-2463; Robeyns et al., Acta Crystallographica, Section F: Structural Biology and Crystallization Communications, 2005, F61(6), 585-586; Gu et al., Tetrahedron, 2004, 60(9), 2111-2123; Gu et al., Oligonucleotides, 2003, 13(6), 479-489; Wang et al., J. Org. Chem., 2003, 68, 4499-4505; Verbeure et al., Nucleic Acids Research, 2001, 29(24), 4941-4947; Wang et al., J. Org. Chem., 2001, 66, 8478-82; Wang et al., Nucleosides, Nucleotides & Nucleic Acids, 2001, 20(4-7), 785-788; Wang et al., J. Am. Chem., 2000, 122, 8595-8602; опубликованную заявку согласно РСТ WO 06/047842; и опубликованную заявку согласно РСТ WO 01/049687; содержание каждой из которых в полном объеме включено в данный документ посредством ссылки). Определенные модифицированные циклогексениловые нуклеозиды имеют формулу:
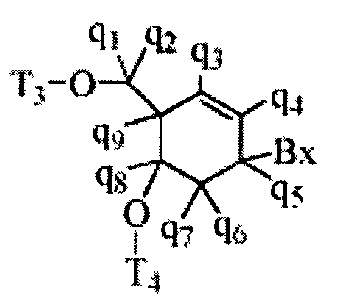
где:
Вх представляет собой гетероциклическое основание;
Т3 м Т4 каждый независимо представляет собой межнуклеозидную связывающую группу, соединяющую циклогексиниловый нуклеозидный аналог с антисмысловым соединением, или один из Т3 и Т4 представляет собой межнуклеозидную связывающую группу, соединяющую тетрагидропирановый нуклеозидный аналог с антисмысловым соединением, а другой из Т3 and Т4 представляет собой Н, гидроксильную защитную группу, связанную сопряженную группу или 5'- или 3'-терминальную группу; и q1, q2, q3, q4, q5, q6, q7, q8 и q9 каждый независимо представляет собой Н, C1-С6 алкил, замещенный C1-С6 алкил, С2-С6 алкенил, замещенный С2-С6 алкенил, С2-С6 алкинил, замещенный С2-С6 алкинил или другую замещающую сахар группу.
Также в данной области техники известно много других бициклических и трициклических сахарных суррогатных кольцевых систем, которые можно применять для модифицирования нуклеозидов для внесения в антисмысловые соединения (смотрите, например, обзорную статью: Leumann, Christian J., Bioorg. & Med. Chem., 2002, 10, 841-854). В такие кольцевые системы можно вносить различные дополнительные замены для повышения активности.
Способы получения модифицированных сахаров хорошо известны в данной области техники. Некоторые типовые патенты США, приводящие руководства по получению таких модифицированных сахаров, включают, без ограничений патенты США: 4981957; 5118800; 5319080; 5359044; 5393878; 5446137; 5466786; 5514785; 5519134; 5567811; 5576427; 5591722; 5597909; 5610300; 5627053; 5639873; 5646265; 5670633; 5700920; 5792847 и 6600032 и Международную заявку PCT/US 2005/019219, поданную 2 июня 2005 г. и опубликованную как WO 2005/121371 22 декабря 2005 г., которые все в полном объеме включены в данный документ посредством ссылки.
В нуклеотидах, содержащих модифицированные сахарные компоненты, нуклеотидные основания (природные, модифицированные или комбинированные) сохранены для гибридизации с соответствующей нуклеиновой кислотой-мишенью.
В определенных вариантах реализации изобретения антисмысловые соединения, нацеленные на нуклеиновую кислоту DMPK, содержат один или более нуклеотидов, содержащих модифицированные сахарные компоненты. В определенных вариантах реализации изобретения модифицированный сахарный компонент представляет собой 2'-МОЕ. В определенных вариантах реализации изобретения модифицированные нуклеотиды 2'-МОЕ упорядочены в гэпмерный мотив.
Модифицированные нуклеотидные основания
Модификации или замещения в нуклеотидных основаниях (или основаниях) приводят к структурным отличиям от природных или синтетических немодифицированных нуклеотидных оснований, но при этом остаются функционально взаимозаменяемыми с ними. Как природные, так и модифицированные нуклеотидные основания способны принимать участие в водородном связывании. Такие модификации в нуклеотидных основаниях могут обеспечивать антисмысловым соединениям устойчивость к нуклеазам, аффинность связывания или некоторые другие благоприятные биологические свойства. Модифицированные нуклеотидные основания включают синтетические и природные нуклеотидные основания, такие как, например, 5-метилцитозин (5-me-С). Определенные замещения в нуклеотидных основаниях, включая 5-метилцитозиновые замещения, исключительно полезны для повышения аффинности связывания антисмыслового соединения с нуклеиновой кислотой-мишенью. Например, было показано, что 5-метилцитозиновые замещения повышают стабильность двойной спирали нуклеиновой кислоты на 0,6-1,2°С (Sanghvi, Y.S., Crooke, S.T. and Lebleu, В., eds., Antisense Research and Applications, CRC Press, Boca Raton, 1993, pp. 276-278).
Дополнительные немодифицированные нуклеотидные основания включают 5-гидроксиметилцитозин, ксантин, гипоксантин, 2-аминоаденин, 6-метильные и другие алкильные производные аденина и гуанина, 2-пропильные и другие алкильные производные аденина и гуанина, 2-тиоурацил, 2-тиотимин и 2-тиоцитозин, 5-галоурацил и цитозин, 5-пропинил (-С≡С-СН3) урацил и цитозин и другие алкинильные производные пиримидиновых оснований, 6-азоурацил, цитозин и тимин, 5-урацил (псевдоурацил), 4-тиоурацил, 8-гало, 8-амино, 8-тиол, 8-тиоалкил, 8-гидроксил и другие 8-замещенные аденины и гуанины, 5-гало, в частности, 5-бром, 5-трифторметил и другие 5-замещенные урацилы и цитозины, 7-метилгуанин и 7-метиладенин, 2-F-аденин, 2-аминоаденин, 8-азагуанин и 8-азааденин, 7-деазагуанин и 7-деазааденин, и 3-деазагуанин и 3-деазааденин.
Гетероциклические основания также могут включать те, в которых пуриновое или пиримидиновое основание замещено другими гетероциклами, например, 7-деазааденин, 7-деазагуанозин, 2-аминопиридин и 2-пиридон. Нуклеотидные основания, являющиеся исключительно полезными для повышения аффинности связывания антисмысловых соединений, включают 5-замещенные пиримидины, 6-азапиримидины и N-2, N-6 и O-6 замещенные пурины, включая 2-аминопропиладенин, 5-пропинилурацил и 5-пропинилцитозин.
В определенных вариантах реализации изобретения антисмысловые соединения, нацеленные на нуклеиновую кислоту DMPK, содержат одно или более модифицированных нуклеотидных оснований. В определенных вариантах реализации изобретения антисмысловые олигонуклеотиды, расширенные за счет гэпов, нацеленные на нуклеиновую кислоту DMPK, содержат одно или более модифицированных нуклеотидных оснований. В определенных вариантах реализации изобретения модифицированное нуклеотидное основание представляет собой 5-метилцитозин. В определенных вариантах реализации изобретения каждый цитозин представляет собой 5-метилцитозин.
Некоторые мотивы антисмысловых соединений
В определенных вариантах реализации изобретения антисмысловые соединения, нацеленные на нуклеиновую кислоту DMPK, содержат химически модифицированные субъединицы, упорядоченные в группы или мотивы, которые обеспечивают антисмысловым соединениям свойства, такие как повышенная ингибиторная активность, повышенная аффинность связывания в отношении нуклеиновой кислоты-мишени или устойчивость к разрушению in vivo нуклеазами.
Химерные антисмысловые соединения, как правило, содержат по меньшей мере одну область, модифицированную таким образом, чтобы обеспечить повышенную устойчивость к разрушению нуклеазами, повышенное поглощение клетками, повышенную аффинность связывания в отношении нуклеиновой кислоты-мишени и/или повышенную ингибиторную активность. Вторая область химерного антисмыслового соединения может, необязательно, служить в качестве субстрата для клеточной эндонуклеазы РНКазы Н, которая расщепляет цепь РНК двойной спирали РНК:ДНК.
Антисмысловые соединения, содержащие гэпмерный мотив, считаются химерными антисмысловыми соединениями. В гэпмере внутренняя область, содержащая множество нуклеотидов, которые способствуют расщеплению РНКазой Н, расположена между внешними областями, содержащими множество нуклеотидов, которые химически отличаются от нуклеозидов внутренней части. В случае антисмыслового олигонуклеотида, содержащего гэпмерный мотив, гэп-сегмент в общем случае служит в качестве субстрата для расщепления эндонуклеазами, в то время как сегменты крыльев содержат модифицированные нуклеозиды. В определенных вариантах реализации изобретения области гэпмера различаются по типам сахарных компонентов, которые содержатся в каждой отдельной области. Типы сахарных компонентов, используемые для того, чтобы различать области гэпмера, могут в некоторых вариантах реализации изобретения включать β-D-рибонуклеозиды, β-D-дезоксирибонуклеозиды, 2'-модифицированные нуклеозиды (такие 2'-модифицированные нуклеозиды могут включать, помимо прочего, 2'-МОЕ и 2'-O-СН3) и нуклеозиды, модифицированные бициклическими сахарами (такие нуклеозиды, модифицированные бициклическими сахарами, могут включать те, которые содержат мостик 4'-(СН2)n-O-2', где n=1 или n=2). Мотив крыло-гэп-крыло часто описывают как «X-Y-Z», где «X» представляет длину области 5' крыла, «Y» представляет длину гэп-области, a «Z» представляет длину области 3' крыла. В контексте данного документа гэпмер, описываемый как «X-Y-Z», имеет такую конфигурацию, в которой гэп-сегмент расположен непосредственно вплотную к сегменту 5' крыла и сегменту 3' крыла. Таким образом, между сегментом 5' крыла и гэп-сегментом или гэп-сегментом и сегментом 3' крыла не существует промежуточных нуклеотидов. Любые из описанных в данном документе антисмысловых соединений могут содержать гэпмерный мотив. В некоторых вариантах реализации изобретения Х и Z одинаковые, в других вариантах реализации изобретения они разные. В предпочтительном варианте реализации изобретения Y составляет от 8 до 15 нуклеотидов. X, Y или Z могут составлять 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30 или более нуклеотидов. Таким образом, гэпмеры включают, но не ограничиваются этим, например, 5-10-5, 4-8-4, 4-12-3, 4-12-4, 3-14-3, 2-13-5, 2-16-2, 1-18-1, 3-10-3, 2-10-2, 1-10-1, 2-8-2, 6-8-6, 5-8-5, 5-7-5, 1-8-1 или 2-6-2.
В определенных вариантах реализации изобретения антисмысловое соединение содержит «вингмерный» мотив, имеющий конфигурацию крыло-гэп или гэп-крыло, т.е. конфигурацию X-Y или Y-Z, как описано выше для гэпмерной конфигурации. Таким образом, вингмерные конфигурации включают, но не ограничиваются этим, например, 5-10, 8-4, 4-12, 12-4, 3-14, 16-2, 18-1, 10-3, 2-10, 1-10, 8-2, 2-13 или 5-13.
В определенных вариантах реализации изобретения антисмысловые соединения, нацеленные на нуклеиновую кислоту DMPK, содержат 5-10-5 гэпмерный мотив. В определенных вариантах реализации изобретения антисмысловые соединения, нацеленные на нуклеиновую кислоту DMPK, содержат 5-7-5 гэпмерный мотив. В определенных вариантах реализации изобретения антисмысловые соединения, нацеленные на нуклеиновую кислоту DMPK, содержат 3-10-3 гэпмерный мотив. В определенных вариантах реализации изобретения антисмысловые соединения, нацеленные на нуклеиновую кислоту DMPK, содержат 4-8-4 гэпмерный мотив.
В определенных вариантах реализации изобретения антисмысловые соединения, нацеленные на нуклеиновую кислоту DMPK, содержат расширенный за счет гэпа мотив.
В определенных вариантах реализации изобретения антисмысловые соединения любого из этих гэпмерных или вингмерных мотивов содержат по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18 или по меньшей мере 19 смежных нуклеотидных оснований нуклеотидной последовательности любого из типовых антисмысловых соединений, описанных в данном документе (например, по меньшей мере 8 смежных нуклеотидных оснований нуклеотидной последовательности, приведенной в любой из SEQ ID №: 23, 24, 25, 26, 27, 28, 29, 30, 31, 32 или 33-874.
В определенных вариантах реализации изобретения в настоящем изобретении предложены олигомерные соединения, содержащие олигонуклеотиды. В определенных вариантах реализации изобретения такие олигонуклеотиды содержат одну или более химических модификаций. В определенных вариантах реализации изобретения химически модифицированные олигонуклеотиды содержат один или более модифицированных сахаров. В определенных вариантах реализации изобретения химически модифицированные олигонуклеотиды содержат одно или более модифицированных нуклеотидных оснований. В определенных вариантах реализации изобретения химически модифицированные олигонуклеотиды содержат одну или более модифицированных межнуклеозидных связей. В определенных вариантах реализации изобретения химические модификации (модификации сахаров, модификации нуклеотидных оснований и/или модификации межнуклеозидных связей) определяют группу или мотив. В определенных вариантах реализации изобретения группы химических модификаций сахарных компонентов, межнуклеозидных связей и нуклеотидных оснований не зависят друг от друга. Таким образом, олигонуклеотид может быть описан при помощи своего мотива с модификацией сахаров, мотива межнуклеозидной связи и/или мотива с модификацией нуклеотидных оснований (в контексте данного документа мотив с модификацией нуклеотидных оснований описывает химические модификации в нуклеотидных основаниях независимо от последовательности нуклеотидных оснований).
Некоторые сахарные мотивы
В определенных вариантах реализации изобретения олигонуклеотиды содержат один или более типов модифицированных сахарных компонентов и/или природных сахарных компонентов, упорядоченных вдоль олигонуклеотида или его области в виде определенной группы или мотива с модификацией сахаров. Такие мотивы могут содержать любую из обсуждаемых в данном документе сахарных модификаций и/или другие известные сахарные модификации.
В определенных вариантах реализации изобретения олигонуклеотиды содержат или состоят из области, содержащей гэпмерный мотив с модификацией сахаров, который содержит две внешних области или «крыла» и внутреннюю область или «гэп». Три области гэпмерного мотива (5'-крыло, гэп и 3'-крыло) образуют непрерывную последовательность нуклеозидов, в которой по меньшей мере некоторые сахарные компоненты нуклеозидов каждого из крыльев отличаются по меньшей мере от некоторых сахарных компонентов нуклеозидов гэпа. В частности, по меньшей мере сахарные компоненты нуклеозидов каждого крыла, которые расположены наиболее близко к гэпу (крайний 3' нуклеозид 5'-крыла и крайний 5' нуклеозид 3'-крыла), отличаются от сахарного компонента соседних нуклеозидов гэпа, определяя тем самым границу между крыльями и гэпом. В определенных вариантах реализации изобретения сахарные компоненты в гэпе одинаковые по отношению друг к другу. В определенных вариантах реализации изобретения гэп содержит один или более нуклеозидов, содержащих сахарный компонент, который отличается от сахарного компонента одного или более других нуклеозидов гэпа. В определенных вариантах реализации изобретения мотивы с модификациями сахаров, принадлежащие двум крыльям, одинаковые по отношению друг к другу (симметрический гэпмер). В определенных вариантах реализации изобретения мотив с модификациями сахаров 5'-крыла отличается от мотива с модификациями сахаров 3'-крыла (асимметрический гэпмер).
Некоторые 5'-крылья
В определенных вариантах реализации изобретения 5'-крыло гэпмера состоит из от 1 до 5 связанных нуклеозидов. В определенных вариантах реализации изобретения 5'-крыло гэпмера состоит из от 2 до 5 связанных нуклеозидов. В определенных вариантах реализации изобретения 5'-крыло гэпмера состоит из от 3 до 5 связанных нуклеозидов. В определенных вариантах реализации изобретения 5'-крыло гэпмера состоит из 4 или 5 связанных нуклеозидов. В определенных вариантах реализации изобретения 5'-крыло гэпмера состоит из от 1 до 4 связанных нуклеозидов. В определенных вариантах реализации изобретения 5'-крыло гэпмера состоит из от 1 до 3 связанных нуклеозидов. В определенных вариантах реализации изобретения 5'-крыло гэпмера состоит из 1 или 2 связанных нуклеозидов. В определенных вариантах реализации изобретения 5'-крыло гэпмера состоит из от 2 до 4 связанных нуклеозидов. В определенных вариантах реализации изобретения 5'-крыло гэпмера состоит из 2 или 3 связанных нуклеозидов. В определенных вариантах реализации изобретения 5'-крыло гэпмера состоит из 3 или 4 связанных нуклеозидов. В определенных вариантах реализации изобретения 5'-крыло гэпмера состоит из 1 нуклеозида. В определенных вариантах реализации изобретения 5'-крыло гэпмера состоит из 2 связанных нуклеозидов. В определенных вариантах реализации изобретения 5'-крыло гэпмера состоит из 3 связанных нуклеозидов. В определенных вариантах реализации изобретения 5'-крыло гэпмера состоит из 4 связанных нуклеозидов. В определенных вариантах реализации изобретения 5'-крыло гэпмера состоит из 5 связанных нуклеозидов.
В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит по меньшей мере один бициклический нуклеозид. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит по меньшей мере два бициклических нуклеозида. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит по меньшей мере три бициклических нуклеозида. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит по меньшей мере четыре бициклических нуклеозида. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит по меньшей мере один конформационно ограниченный этиловый аналог нуклеозида. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит по меньшей мере один нуклеозид LNA. В определенных вариантах реализации изобретения каждый нуклеозид 5'-крыла гэпмера представляет собой бициклический нуклеозид. В определенных вариантах реализации изобретения каждый нуклеозид 5'-крыла гэпмера представляет собой конформационно ограниченный этиловый аналог нуклеозида. В определенных вариантах реализации изобретения каждый нуклеозид 5'-крыла гэпмера представляет собой нуклеозид LNA.
В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит по меньшей мере один не являющийся бициклическим модифицированный нуклеозид. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит по меньшей мере один 2'-замещенный нуклеозид. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит по меньшей мере один 2'-МОЕ нуклеозид. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит по меньшей мере один 2'-ОМе нуклеозид. В определенных вариантах реализации изобретения каждый нуклеозид 5'-крыла гэпмера представляет собой не являющийся бициклическим модифицированный нуклеозид. В определенных вариантах реализации изобретения каждый нуклеозид 5'-крыла гэпмера представляет собой 2'-замещенный нуклеозид. В определенных вариантах реализации изобретения каждый нуклеозид 5'-крыла гэпмера представляет собой 2'-МОЕ нуклеозид. В определенных вариантах реализации изобретения каждый нуклеозид 5'-крыла гэпмера представляет собой 2'-ОМе нуклеозид.
В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит по меньшей мере один бициклический нуклеозид и по меньшей мере один не являющийся бициклическим модифицированный нуклеозид. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит по меньшей мере один бициклический нуклеозид и меньшей мере один 2'-замещенный нуклеозид. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит по меньшей мере один бициклический нуклеозид и по меньшей мере один 2'-МОЕ нуклеозид. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит по меньшей мере один бициклический нуклеозид и по меньшей мере один 2'-ОМе нуклеозид. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит по меньшей мере один бициклический нуклеозид и по меньшей мере один 2'-дезоксинуклеозид.
В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит по меньшей мере один конформационно ограниченный этиловый аналог нуклеозида и по меньшей мере один не являющийся бициклическим модифицированный нуклеозид. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит по меньшей мере один конформационно ограниченный этиловый аналог нуклеозида и по меньшей мере один 2'-замещенный нуклеозид. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит по меньшей мере один конформационно ограниченный этиловый аналог нуклеозида и по меньшей мере один 2'-МОЕ нуклеозид. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит по меньшей мере один конформационно ограниченный этиловый аналог нуклеозида и по меньшей мере один 2'-ОМе нуклеозид. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит по меньшей мере один конформационно ограниченный этиловый аналог нуклеозида и по меньшей мере один 2'-дезоксинуклеозид.
В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит по меньшей мере один нуклеозид LNA и по меньшей мере один не являющийся бициклическим модифицированный нуклеозид. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит по меньшей мере один нуклеозид LNA и по меньшей мере один 2'-замещенный нуклеозид. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит по меньшей мере один нуклеозид LNA и по меньшей мере один 2'-МОЕ нуклеозид. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит по меньшей мере один нуклеозид LNA и по меньшей мере один 2'-ОМе нуклеозид. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит по меньшей мере один нуклеозид LNA и по меньшей мере один 2'-дезоксинуклеозид.
В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит три конформационно ограниченных этиловых аналога нуклеозидов. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит два бициклических нуклеозида и два не являющихся бициклическими модифицированных нуклеозида. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит два конформационно ограниченных этиловых аналога нуклеозидов и два 2'-МОЕ нуклеозида. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит два бициклических нуклеозида и два не являющихся бициклическими модифицированных нуклеозида. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит два конформационно ограниченных этиловых аналога нуклеозидов и два 2'-МОЕ нуклеозида. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит два конформационно ограниченных этиловых аналога нуклеозидов и три 2'-МОЕ нуклеозида.
В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит три нуклеозида LNA. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит два нуклеозида LNA и два не являющихся бициклическими модифицированных нуклеозида. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит два нуклеозида LNA и два 2'-МОЕ нуклеозида. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит два LNA и два не являющихся бициклическими модифицированных нуклеозида. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит два нуклеозида LNA и два 2'-МОЕ нуклеозида. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит два нуклеозида LNA и три 2'-МОЕ нуклеозида.
В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит три конформационно ограниченных этиловых аналога нуклеозидов. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит два бициклических нуклеозида и два не являющихся бициклическими модифицированных нуклеозида. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит два конформационно ограниченных этиловых аналога нуклеозидов и два 2'-ОМе нуклеозида. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит два бициклических нуклеозида и два не являющихся бициклическими модифицированных нуклеозида. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит два конформационно ограниченных этиловых аналога нуклеозидов и два 2'-ОМе нуклеозида. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит два конформационно ограниченных этиловых аналога нуклеозидов и три 2'-ОМе нуклеозида.
В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит три нуклеозида LNA. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит два нуклеозида LNA и два не являющихся бициклическими модифицированных нуклеозида. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит два нуклеозида LNA и два 2'-ОМе нуклеозида. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит два LNA и два не являющихся бициклическими модифицированных нуклеозида. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит два нуклеозида LNA и два 2'-ОМе нуклеозида. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит два нуклеозида LNA и три 2'-ОМе нуклеозида.
В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит мотив ААВВ, где каждое А выбрано из 2'-МОЕ нуклеозида и 2'ОМе нуклеозида. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит мотив ААВВ, где каждое В выбрано из cEt, LNA, α-L-LNA, ENA и 2'-тио LNA нуклеозида. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит мотив ААВВ, где каждое А представляет 2'-МОЕ нуклеозид, а каждое В представляет конформационно ограниченный этиловый аналог нуклеозида.
В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит мотив АААВВ, где каждое А выбрано из 2'-МОЕ нуклеозида и 2'ОМе нуклеозида. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит мотив ААВВ, где каждое В выбрано из cEt, LNA, α-L-LNA, ENA и 2'-тио LNA нуклеозида. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит мотив ААВВ, где каждое А представляет 2'-МОЕ нуклеозид, а каждое В представляет конформационно ограниченный этиловый аналог нуклеозида.
Некоторые 3'-крылья
В определенных вариантах реализации изобретения 3'-крыло гэпмера состоит из от 1 до 5 связанных нуклеозидов. В определенных вариантах реализации изобретения 3'-крыло гэпмера состоит из от 2 до 5 связанных нуклеозидов. В определенных вариантах реализации изобретения 3'-крыло гэпмера состоит из от 3 до 5 связанных нуклеозидов. В определенных вариантах реализации изобретения 3'-крыло гэпмера состоит из 4 или 5 связанных нуклеозидов. В определенных вариантах реализации изобретения 3'-крыло гэпмера состоит из от 1 до 4 связанных нуклеозидов. В определенных вариантах реализации изобретения 3'-крыло гэпмера состоит из от 1 до 3 связанных нуклеозидов. В определенных вариантах реализации изобретения 3'-крыло гэпмера состоит из 1 или 2 связанных нуклеозидов. В определенных вариантах реализации изобретения 3'-крыло гэпмера состоит из от 2 до 4 связанных нуклеозидов. В определенных вариантах реализации изобретения 3'-крыло гэпмера состоит из 2 или 3 связанных нуклеозидов. В определенных вариантах реализации изобретения 3'-крыло гэпмера состоит из 3 или 4 связанных нуклеозидов. В определенных вариантах реализации изобретения 3'-крыло гэпмера состоит из 1 нуклеозида. В определенных вариантах реализации изобретения 3'-крыло гэпмера состоит из 2 связанных нуклеозидов. В определенных вариантах реализации изобретения 3'-крыло гэпмера состоит из 3 связанных нуклеозидов. В определенных вариантах реализации изобретения 3'-крыло гэпмера состоит из 4 связанных нуклеозидов. В определенных вариантах реализации изобретения 3'-крыло гэпмера состоит из 5 связанных нуклеозидов.
В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит по меньшей мере один бициклический нуклеозид. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит по меньшей мере один конформационно ограниченный этиловый аналог нуклеозида. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит по меньшей мере один нуклеозид LNA. В определенных вариантах реализации изобретения каждый нуклеозид 3'-крыла гэпмера представляет собой бициклический нуклеозид. В определенных вариантах реализации изобретения каждый нуклеозид 3'-крыла гэпмера представляет собой конформационно ограниченный этиловый аналог нуклеозида. В определенных вариантах реализации изобретения каждый нуклеозид 3'-крыла гэпмера представляет собой нуклеозид LNA.
В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит по меньшей мере один не являющийся бициклическим модифицированный нуклеозид. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит по меньшей мере два не являющихся бициклическими модифицированных нуклеозида. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит по меньшей мере три не являющихся бициклическими модифицированных нуклеозида. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит по меньшей мере четыре не являющихся бициклическими модифицированных нуклеозида. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит по меньшей мере один 2'-замещенный нуклеозид. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит по меньшей мере один 2'-МОЕ нуклеозид. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит по меньшей мере один 2'-ОМе нуклеозид. В определенных вариантах реализации изобретения каждый нуклеозид 3'-крыла гэпмера представляет собой не являющийся бициклическим модифицированный нуклеозид. В определенных вариантах реализации изобретения каждый нуклеозид 3'-крыла гэпмера представляет собой 2'-замещенный нуклеозид. В определенных вариантах реализации изобретения каждый нуклеозид 3'-крыла гэпмера представляет собой 2'-МОЕ нуклеозид. В определенных вариантах реализации изобретения каждый нуклеозид 3'-крыла гэпмера представляет собой 2'-ОМе нуклеозид.
В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит по меньшей мере один бициклический нуклеозид и по меньшей мере один не являющийся бициклическим модифицированный нуклеозид. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит по меньшей мере один бициклический нуклеозид и меньшей мере один 2'-замещенный нуклеозид. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит по меньшей мере один бициклический нуклеозид и по меньшей мере один 2'-МОЕ нуклеозид. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит по меньшей мере один бициклический нуклеозид и по меньшей мере один 2'-ОМе нуклеозид. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит по меньшей мере один бициклический нуклеозид и по меньшей мере один 2'-дезоксинуклеозид.
В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит по меньшей мере один конформационно ограниченный этиловый аналог нуклеозида и по меньшей мере один не являющийся бициклическим модифицированный нуклеозид. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит по меньшей мере один конформационно ограниченный этиловый аналог нуклеозида и по меньшей мере один 2'-замещенный нуклеозид. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит по меньшей мере один конформационно ограниченный этиловый аналог нуклеозида и по меньшей мере один 2'-МОЕ нуклеозид. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит по меньшей мере один конформационно ограниченный этиловый аналог нуклеозида и по меньшей мере один 2'-ОМе нуклеозид. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит по меньшей мере один конформационно ограниченный этиловый аналог нуклеозида и по меньшей мере один 2'-дезоксинуклеозид.
В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит по меньшей мере один нуклеозид LNA и по меньшей мере один не являющийся бициклическим модифицированный нуклеозид. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит по меньшей мере один нуклеозид LNA и по меньшей мере один 2'-замещенный нуклеозид. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит по меньшей мере один нуклеозид LNA и по меньшей мере один 2'-МОЕ нуклеозид. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит по меньшей мере один нуклеозид LNA и по меньшей мере один 2'-ОМе нуклеозид. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит по меньшей мере один нуклеозид LNA и по меньшей мере один 2'-дезоксинуклеозид.
В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит три конформационно ограниченных этиловых аналога нуклеозидов. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит два бициклических нуклеозида и два не являющихся бициклическими модифицированных нуклеозида. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит два конформационно ограниченных этиловых аналога нуклеозидов и два 2'-МОЕ нуклеозида. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит два бициклических нуклеозида и два не являющихся бициклическими модифицированных нуклеозида. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит два конформационно ограниченных этиловых аналога нуклеозидов и два 2'-МОЕ нуклеозида. В определенных вариантах реализации изобретения 5'-крыло гэпмера содержит два конформационно ограниченных этиловых аналога нуклеозидов и три 2'-МОЕ нуклеозида.
В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит три нуклеозида LNA. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит два нуклеозида LNA и два не являющихся бициклическими модифицированных нуклеозида. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит два нуклеозида LNA и два 2'-МОЕ нуклеозида. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит два LNA и два не являющихся бициклическими модифицированных нуклеозида. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит два нуклеозида LNA и два 2'-МОЕ нуклеозида. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит два нуклеозида LNA и три 2'-МОЕ нуклеозида.
В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит три конформационно ограниченных этиловых аналога нуклеозидов. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит два бициклических нуклеозида и два не являющихся бициклическими модифицированных нуклеозида. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит два конформационно ограниченных этиловых аналога нуклеозидов и два 2'-ОМе нуклеозида. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит два бициклических нуклеозида и два не являющихся бициклическими модифицированных нуклеозида. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит два конформационно ограниченных этиловых аналога нуклеозидов и два 2'-ОМе нуклеозида. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит два конформационно ограниченных этиловых аналога нуклеозидов и три 2'-ОМе нуклеозида.
В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит три нуклеозида LNA. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит два нуклеозида LNA и два не являющихся бициклическими модифицированных нуклеозида. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит два нуклеозида LNA и два 2'-ОМе нуклеозида. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит два LNA и два не являющихся бициклическими модифицированных нуклеозида. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит два нуклеозида LNA и два 2'-ОМе нуклеозида. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит два нуклеозида LNA и три 2'-ОМе нуклеозида.
В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит мотив ВВАА, где каждое А выбрано из 2'-МОЕ нуклеозида и 2'ОМе нуклеозида. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит мотив ВВАА, где каждое В выбрано из cEt, LNA, α-L-LNA, ENA и 2'-тио LNA нуклеозида. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит мотив ВВАА, где каждое А представляет 2'-МОЕ нуклеозид, а каждое В представляет конформационно ограниченный этиловый аналог нуклеозида.
В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит мотив ВВААА, где каждое А выбрано из 2'-МОЕ нуклеозида и 2'ОМе нуклеозида. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит мотив ВВАА, где каждое В выбрано из cEt, LNA, α-L-LNA, ENA и 2'-тио LNA нуклеозида. В определенных вариантах реализации изобретения 3'-крыло гэпмера содержит мотив ВВАА, где каждое А представляет 2'-МОЕ нуклеозид, а каждое В представляет конформационно ограниченный этиловый аналог нуклеозида.
Композиции и способы составления фармацевтических композиций
Антисмысловые олигонуклеотиды можно смешивать с фармацевтически приемлемым активным или инертным веществом для приготовления фармацевтических композиций или составов. Композиции и способы составления фармацевтических композиций зависят от большого количества критериев, включая, но не ограничиваясь этим, путь введения, степень заболевания или вводимую дозу.
Антисмысловое соединение, нацеленное на нуклеиновую кислоту DMPK, можно использовать в фармацевтических композициях, смешивая антисмысловое соединение с подходящим фармацевтически приемлемым разбавителем или носителем. Фармацевтически приемлемый разбавитель включает фосфатно-солевой буферный раствор (ФСБ). ФСБ является подходящим разбавителем для применения в композициях, предназначенных для парентеральной доставки. Соответственно, в одном варианте реализации изобретения в описанных в данном документе способах применяют фармацевтическую композицию, содержащую антисмысловое соединение, нацеленное на нуклеиновую кислоту DMPK, и фармацевтически приемлемый разбавитель. В определенных вариантах реализации изобретения фармацевтически приемлемый разбавитель представляет собой ФСБ. В определенных вариантах реализации изобретения антисмысловое соединение представляет собой антисмысловой олигонуклеотид.
Фармацевтические композиции, содержащие антисмысловые соединения, включают любые фармацевтически приемлемые соли, эфиры или соли таких эфиров, или любой другой олигонуклеотид, который после введения животному, включая человека, способен обеспечить (прямо или непрямо) наличие биологически активного метаболита или его остатка. Соответственно, например, данное изобретение также относится к фармацевтически приемлемым солям антисмысловых соединений, пролекарствам, фармацевтически приемлемым солям таких пролекарств и другим биоэквивалентам. Подходящие фармацевтически приемлемые соли включают, но не ограничиваются этим, соли натрия и калия.
Пролекарство может включать включение дополнительных нуклеозидов в одном или в обоих концах антисмыслового соединения, которые в организме отщепляются эндогенными нуклеазами с образованием активного антисмыслового соединения.
Конъюгированные антисмысловые соединения
Антисмысловые соединения могут быть ковалентно связаны с одним или более компонентами или конъюгатами, которые повышают активность, клеточное распределение или клеточное поглощение конечных антисмысловых олигонуклеотидов. Типовые конъюгационные группы включают холестериновые компоненты и липидные компоненты. Дополнительные конъюгационные группы включают углеводы, фосфолипиды, биотин, феназин, фолат, фенантридин, антрахинон, акридин, флуоресцеины, родамины, кумарины и красители.
Антисмысловые соединения также можно модифицировать таким образом, чтобы они содержали одну или более стабилизирующих групп, которые в общем случае присоединены к одному или к обоим концам антисмысловых соединений, чтобы усилить такие свойства, как, например, устойчивость к нуклеазам. В стабилизирующие группы включены кэп-структуры. Эти концевые модификации защищают антисмысловое соединение, содержащее концевую нуклеиновую кислоту, от разрушения экзонуклеазами и могут способствовать доставке и/или локализации в клетке. Кэп может находиться в 5'-конце (5'-кэп) или в 3'-конце (3'-кэп), или может присутствовать в обоих концах. Кэп-структуры хорошо известны в данной области техники и включают, например, инвертированные дезокси-кэпы с удаленными азотистыми основаниями. Дополнительные 3'- и 5'-стабилизирующие группы, которые можно применять для кэпирования одного ли обоих концов антисмыслового соединения, чтобы обеспечить устойчивость к нуклеазам, включают описанные в WO 03/004602, опубликованной 16 января 2003 г.
Клеточное культивирование и обработка антисмысловыми соединениями
Влияние антисмысловых соединений на уровни, активность или экспрессию нуклеиновых кислот DMPK можно исследовать in vitro во множестве типов клеток. Типы клеток, применяемые для такого анализа, доступны от коммерческих производителей (например, American Type Culture Collection, Manassus, VA; Zen-Bio, Inc., Research Triangle Park, NC; Clonetics Corporation, Walkersville, MD), а культивирование клеток осуществляют в соответствии с инструкциями производителя, используя коммерчески доступные реагенты (например, Invitrogen Life Technologies, Carlsbad, CA). Иллюстративные типы клеток включают, но не ограничиваются этим, клетки HepG2, клетки Hep3B, первичные гепатоциты, клетки А549, фибробласты GM04281 и клетки LLC-MK2.
In vitro исследование антисмысловых олигонуклеотидов
В данном документе описаны способы обработки клеток антисмысловыми олигонуклеотидами, которые могут быть соответствующим образом модифицированы для обработки другими антисмысловыми соединениями.
В общем случае клетки обрабатывают антисмысловыми олигонуклеотидами, когда клетки достигают приблизительно 60-80% конфлюэнтности в культуре.
Один из реагентов, который обычно используют для внесения антисмысловых олигонуклеотидов в культивируемые клетки, включает катионный липидный трансфекционный реагент LIPOFECTIN® (Invitrogen, Carlsbad, CA). Антисмысловые олигонуклеотиды смешивают с LIPOFECTIN® в OPTI-MEM® 1 (Invitrogen, Carlsbad, CA), чтобы получить желаемую конечную концентрацию антисмыслового олигонуклеотида и концентрацию LIPOFECTIN®, которая, как правило, соответствует диапазону от 2 до 12 мкг/мл на 100 нМ антисмыслового олигонуклеотида.
Другой реагент, используемый для внесения антисмысловых олигонуклеотидов в культивируемые клетки, включает LIPOFECTAMINE 2000® (Invitrogen, Carlsbad, CA). Антисмысловой олигонуклеотид смешивают с LIPOFECTAMINE 2000® в среде с уменьшенным содержанием сыворотки OPTI-MEM® 1 (Invitrogen, Carlsbad, CA), чтобы получить желаемую концентрацию антисмыслового олигонуклеотида и концентрацию LIPOFECTAMINE®, которая, как правило, соответствует диапазону от 2 до 12 мкг/мл на 100 нМ антисмыслового олигонуклеотида.
Другой реагент, используемый для внесения антисмысловых олигонуклеотидов в культивируемые клетки, включает Cytofectin® (Invitrogen, Carlsbad, CA). Антисмысловой олигонуклеотид смешивают с Cytofectin® в среде с уменьшенным содержанием сыворотки OPTI-MEM® 1 (Invitrogen, Carlsbad, CA), чтобы получить желаемую концентрацию антисмыслового олигонуклеотида и концентрацию Cytofectin®, которая, как правило, соответствует диапазону от 2 до 12 мкг/мл на 100 нМ антисмыслового олигонуклеотида.
Другой метод, используемый для внесения антисмысловых олигонуклеотидов в культивируемые клетки, включает электропорацию.
Обработку клеток антисмысловыми олигонуклеотидами осуществляют общеизвестными методами. Как правило, клетки собирают через 16-24 часа после обработки антисмысловыми олигонуклеотидами и определяют в этот момент времени уровни РНК или белка нуклеиновых кислот-мишеней методами, известными в данной области техники и описанными в данном документе. В общем случае, когда обработку проводят во множественных повторах, данные представляют в виде среднего по повторным обработкам.
Используемая концентрация антисмыслового олигонуклеотида варьируется для разных клеточных линий. Методы определения оптимальной концентрации антисмыслового олигонуклеотида для конкретной клеточной линии хорошо известны в данной области техники. Как правило, антисмысловые олигонуклеотиды используют в диапазоне концентраций, соответствующем от 1 нМ до 300 нМ, при трансфекции при помощи LIPOFECTAMINE2000®, Lipofectin или Cytofectin. Антисмысловые олигонуклеотиды используют в более высоких концентрациях в диапазоне от 625 до 20000 нМ при трансфекции при помощи электропорации.
Выделение РНК
Анализ РНК можно проводить для общей клеточной РНК или поли(А)+мРНК. Методы выделения РНК хорошо известны в данной области техники. РНК получают, используя методы, хорошо известные в данной области техники, например, используя реагент TRIZOL® (Invitrogen, Carlsbad, CA) в соответствии с рекомендуемыми производителем протоколами.
Анализ ингибирования целевых уровней или экспрессии
Ингибирование уровней или экспрессии нуклеиновой кислоты DMPK можно исследовать разными известными в данной области техники способами. Например, уровни нуклеиновой кислоты-мишени можно количественно оценить, например, при помощи нозерн-блоттинга, конкурентной полимеразной цепной реакции (ПЦР) или количественной ПЦР в режиме реального времени. Анализ РНК можно проводить для общей клеточной РНК или поли(А)+мРНК. Методы выделения РНК хорошо известны в данной области техники. Нозерн-блоттинг также является общеизвестным методом анализа в данной области техники. Количественную ПЦР в режиме реального времени можно осуществить, применяя коммерчески доступный секвенатор ABI PRISM® 7600, 7700 или 7900, доступный от РЕ-Applied Biosystems, Foster City, CA, в соответствии с инструкциями производителя.
Количественная ПЦР уровней РНК-мишени в режиме реального времени
Количественную оценку уровней РНК-мишени можно осуществить при помощи количественной ПЦР в режиме реального времени, используя секвенатор ABI PRISM® 7600, 7700 или 7900 (PE-Applied Biosystems, Foster City, CA) в соответствии с инструкциями производителя. Методы проведения количественной ПЦР в режиме реального времени хорошо известны в данной области техники.
Перед проведением ПЦР в режиме реального времени выделенную РНК подвергают реакции с обратной транскриптазой (ОТ), при помощи которой получают комплементарную ДНК (кДНК), которую затем используют в качестве субстрата для ПЦР-амплификации в режиме реального времени. Реакции ОТ и ПЦР в режиме реального времени проводят последовательно в одной лунке с образцом. Реагенты для ОТ и ПЦР в режиме реального времени получают от (Carlsbad, CA). Реакции ОТ, ПЦР в режиме реального времени осуществляют методами, хорошо известными специалистам в данной области техники.
Количества гена-мишени (или РНК-мишени), полученные при помощи ПЦР в режиме реального времени, нормируют, используя уровень экспрессии гена, экспрессия которого является постоянной, такого как циклофилин А, или путем количественной оценки общей РНК при помощи RIBOGREEN® (Invitrogen, Inc. Carlsbad, CA). Экспрессию циклофилина А количественно оценивают при помощи ПЦР в режиме реального времени, проводимой одновременно, в комбинации или отдельно. Общую РНК количественно оценивают при помощи реагента для количественной оценки РНК RIBOGREEN® (Invitrogen, Inc. Eugene, OR). Методы количественной оценки РНК при помощи RIBOGREEN® описаны в Jones, L.J., et al, (Analytical Biochemistry, 1998, 265, 368-374). Инструмент CYTOFLUOR® 4000 (РЕ Applied Biosystems) используют для измерения флуоресценции RIBOGREEN®.
Для гибридизации с нуклеиновой кислотой DMPK конструируют зонды и праймеры. Методы разработки зондов и праймеров для ПЦР в режиме реального времени хорошо известны в данной области техники и могут включать использование программного обеспечения, такого как программное обеспечение PRIMER EXPRESS® (Applied Biosystems, Foster City, CA).
Анализ уровней белка
Антисмысловое ингибирование нуклеиновых кислот DMPK можно оценить, измеряя уровни белка DMPK. Уровни белка DMPK можно оценить или количественно оценить различными хорошо известными в данной области техники путями, такими как иммунопреципитация, вестерн-блоттинг (иммуноблоттинг), энзим связанный иммуносорбентный анализ (ELISA), количественный анализ белка, анализ белковой активности (например, анализ активности каспазы), иммуногистохимия, иммуноцитохимия или сортировка флуоресцентно-активированных клеток (FACS). Антитела, направленные на мишень могут быть выявлены и получены из множества источников, таких как каталог антител MSRS (Aerie Corporation, Birmingham, MI), или могут быть получены традиционными методами генерации моноклональных или поликлональных антител, хорошо известными в данной области техники.
In vivo исследование антисмысловых соединений
Антисмысловые соединения, например, антисмысловые олигонуклеотиды, тестируют на животных, чтобы оценить их способность ингибировать экспрессию DMPK и продуцировать фенотипические изменения. Тестирование можно проводить на нормальных животных или на экспериментальных моделях заболеваний, например, мышиной модели HSALR миотонической дистрофии (МД1).
Мышиная модель HSALR является стандартной моделью МД1 (Mankodi, A. et al. Science. 289: 1769, 2000). Мыши несут трансген человеческого скелетного актина (hACTA1) с 220 CTG-повторами, вставленный в 3' НТО гена. Транскрипт hACTA1-CUGexp накапливается в ядрах скелетных мышц и приводит к миотонии, аналогичной человеческой МД1 (Mankodi, A. et al. Mol. Cell 10: 35, 2002; Lin, X. et al. Hum. Mol. Genet. 15: 2087, 2006). Следовательно, ожидается, что облегчение симптомов МД1 у мышей HSALR вследствие антисмыслового ингибирования трансгена hACTA1 будет прогнозировать облегчение аналогичных симптомов у пациентов-людей вследствие антисмыслового ингибирования транскрипта DMPK.
Экспрессия РНК CUGexp у мышей приводит к экстенсивной перестройке мышечного транскриптома, большая часть которого воспроизводится путем абляции MBNL1. Следовательно, ожидается, что нормализация транскриптома у мышей HSALR будет прогнозировать нормализацию человеческого транскриптома у пациентов с МД1 вследствие антисмыслового ингибирования транскрипта DMPK.
Для введения животным антисмысловые олигонуклеотиды готовят в составе фармацевтически приемлемого разбавителя, такого как фосфатно-солевой буферный раствор. Введение включает парентеральные пути введения. После истечения периода обработки антисмысловыми олигонуклеотидами РНК выделяют из ткани и измеряют изменения в экспрессии нуклеиновой кислоты DMPK. Также измеряют изменения в уровнях белка DMPK.
Сплайсинг
Причиной миотонической дистрофии (МД1) является экспансия CTG-повторов в 3' нетранслируемой области гена DMPK (Brook, J.D. et al. Cell. 68: 799, 1992). Эта мутация приводит к доминированию РНК-процессу, в котором экспрессия РНК, содержащейся в экспансированном повторе CUG (CUGexp), индуцирует нарушение клеточной функции (Osborne RJ and Thornton CA., Human Molecular Genetics., 2006, 15(2): R162-R169). Такие CUGexp удерживаются в ядрах скелетных мышц (Davis, B.M. et al. Proc. Natl. Acad. Sci. U.S.A. 94: 7388, 1997). Накопление CUGexp в ядрах приводит к секвестрации поли(CUG)-связывающих белков, таких как Muscleblind-like 1 (MBLN1) (Miller, J.W. et al. EMBO J. 19: 4439, 2000). MBLN1 представляет собой фактор сплайсинга, который регулирует сплайсинг таких генов, как Sercal, CIC-1, Titin и Zasp. Следовательно, секвестрация MBLN1 со стороны CUGexp приводит к нарушению регуляции альтернативного сплайсинга экзонов генов, который обычно контролируется MBLN1 (Lin, X. et al. Hum. Mol. Genet. 15: 2087, 2006). Исправление альтернативного сплайсинга у животного, у которого наблюдается подобное нарушение регуляции, такого, как, например, пациент с МД1 и мышиная модель HSALR, представляет собой полезный индикатор эффективности лечения, включая лечение антисмысловым олигонуклеотидом.
Некоторые антисмысловые механизмы
Причиной миотонической дистрофии (МД1) является экспансия CTG-повторов в 3' нетранслируемой области гена DMPK. В определенных вариантах реализации изобретения экспансия в 3' нетранслируемой области гена DMPK приводит к транскрипции РНК, содержащей экспансированный CUG-повтор, при этом РНК, содержащая экспансированный CUG-повтор (CUGexp), удерживается в ядрах скелетных мышц. В некоторых случаях клеточные механизмы, отвечающие за экспорт мРНК из ядра в цитоплазму не экспортируют РНК, содержащую экспансированный CUG-повтор, из ядра или делают это с меньшей эффективностью. В определенных вариантах реализации изобретения клетки не экспортируют мРНК CUGexp DMPK из ядра или же такой экспорт снижен. Соответственно, в определенных вариантах реализации изобретения мРНК CUGexp DMPK накапливается в ядре. В определенных вариантах реализации изобретения в ядре клетки присутствует больше копий мРНК CUGexp DMPK, чем копий мРНК DMPK дикого типа, которая экспортируется нормально. В таких вариантах реализации изобретения антисмысловые соединения, которые снижают количество мишени в ядре будут преимущественно снижать количество мутантной мРНК CUGexp DMPK по сравнению с мРНК DMPK дикого типа вследствие ее избытка в ядре, даже если антисмысловое соединение никаким другим образом не различает мутантные мРНК и мРНК дикого типа. Так как зависимые от РНКазы Н антисмысловые соединения активны в ядре, такие соединения в особенности подходят для такого применения.
В некоторых случаях ожидается, что пре-мРНК DMPK дикого типа и мутантная пре-мРНК CUGexp DMPK процессируются в мРНК на одном уровне. Соответственно, ожидается, что в ядре клетки будет присутствовать приблизительно одинаковое количество пре-мРНК DMPK дикого типа и мутантной пре-мРНК CUGexp DMPK. Однако, после процессинга мРНК DMPK дикого типа экспортируется из ядра относительно быстро, а мутантная мРНК CUGexp DMPK экспортируется медленно или не экспортируется вовсе. В таких определенных вариантах реализации изобретения мутантная мРНК CUGexp DMPK накапливается в ядре в большем количестве, чем мРНК DMPK дикого типа. В таких определенных вариантах реализации изобретения антисмысловой олигонуклеотид, нацеленный на мРНК, будет преимущественно снижать экспрессию мутантной мРНК CUGexp DMPK по сравнению с мРНК DMPK дикого типа, так как в ядре клетки находится больше копий мутантной мРНК CUGexp DMPK. В определенных вариантах реализации изобретения не ожидается, что антисмысловые соединения, нацеленные на пре-мРНК, но не на мРНК (например, нацеленные на интрон), будут преимущественно снижать мутантный DMPK по сравнению с диким типом, так как количество обеих пре-мРНК в ядре практически одинаково. В определенных вариантах реализации изобретения описанные в данном документе антисмысловые соединения не нацелены на интроны пре-мРНК DMPK. В определенных вариантах реализации изобретения описанные в данном документе антисмысловые соединения нацелены на экзоны или соединения экзон-экзон, присутствующие в мРНК DMPK. Следовательно, в определенных вариантах реализации изобретения нацеливание антисмыслового олигонуклеотида на мРНК является предпочтительным, так как антисмысловой олигонуклеотид, обладающий одной или более характеристиками, описанными в данном документе, (i) характеризуется активностью в ядре клетки и (2) будет преимущественно снижать мутантную мРНК CUGexp DMPK по сравнению с мРНК DMPK дикого типа.
Некоторые биомаркеры
Тяжесть МД1 в мышиной модели определяют, по меньшей мере частично, по уровню накопления транскрипта CUGexp в ядре или ядерных фокусах. Удобным физиологическим маркером для оценки тяжести МД1 является развитие непроизвольных часто повторяемых потенциалов действия (миотонии).
Некоторые индикаторы
В определенных вариантах реализации изобретения в данном документе предложены способы лечения индивида, включающие введении одной или более фармацевтических композиций, как описано в данном документе. В определенных вариантах реализации изобретения индивид имеет миотоническую дистрофию 1 типа (МД1).
Соответственно, в данном документе предложены способы облегчения симптома, связанного с миотонической дистрофией 1 типа у нуждающегося в этом субъекта. В определенных вариантах реализации изобретения предложен способ снижения скорости появления симптома, связанного с миотонической дистрофией 1 типа. В определенных вариантах реализации изобретения предложен способ снижения тяжести симптома, связанного с миотонической дистрофией 1 типа. В определенных вариантах реализации изобретения симптомы, связанные с МД1, включают ригидность мышц, миотонию, слабость периферийных мышц, приводящую к недееспособности, слабость мышц лица и челюсти, затрудненное глотание, нависание век (птоз), слабость мышц шеи, слабость мышц рук и ног, постоянную мышечную боль, патологическую сонливость, мышечную атрофию, дисфагию, дыхательную недостаточность, нерегулярное сердцебиение, повреждение сердечной мышцы, апатию, резистентность к инсулину и катаракты. У детей такими симптомами также могут быть отставание в развитии, проблемы с обучаемостью, языковые и речевые проблемы и проблемы личностного развития.
В определенных вариантах реализации изобретения указанные способы включают введение нуждающемуся в этом индивиду терапевтически эффективного количества соединения, нацеленного на нуклеиновую кислоту DMPK.
В определенных вариантах реализации изобретения введение антисмыслового соединения, нацеленного на нуклеиновую кислоту DMPK, приводит к снижению экспрессии DMPK по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 99% или на значение в диапазоне, определяемом любыми двумя из этих величин.
В определенных вариантах реализации изобретения фармацевтические композиции, содержащие антисмысловое соединение, нацеленное на DMPK, применяют для приготовления медикамента для лечения пациента, страдающего или предрасположенного к миотонической дистрофии 1 типа.
В определенных вариантах реализации изобретения описанные в данном документе способы включают введение соединения, содержащего модифицированный олигонуклеотид, содержащий описанный в данном документе непрерывный нуклеотидный фрагмент из последовательностей, приведенных в SEQ ID №: 23, 24, 25, 26, 27, 28, 29, 30, 31, 32 или 33-874.
Введение
В определенных вариантах реализации изобретения описанные в данном документе соединения и композиции вводят парентерально.
В определенных вариантах реализации изобретения парентеральное введение осуществляют путем инфузии. Инфузия может быть хронической или постоянной или короткой или периодической. В определенных вариантах реализации изобретения вводимые путем инфузии фармацевтические агенты доставляют при помощи насоса. В определенных вариантах реализации изобретения парентеральное введение осуществляют путем инъекции (например, болюсной инъекции). Инъекцию можно проводить при помощи шприца.
Парентеральное введение включает подкожное введение, внутривенное введение, внутримышечное введение, внутриартериальное введение, внутрибрюшинное введение или внутричерепное введение, например, интратекальное или интрацеребровентрикулярное введение. Введение может быть постоянным или хроническим или коротким или периодическим.
В определенных вариантах реализации изобретения введение представляет собой подкожное, внутривенное, интрацеребральное, интрацеребровентрикулярное, интратекальное или другое введение, которое приводит к системному действию олигонуклеотида (системное введение характеризуется системным действием, т.е. действием в более чем одном типе ткани) или доставке в ЦНС или в ЦСЖ.
Согласно измерениям ингибирования альфа актина 1 и снижения миотонии в мышиной HSALR модели МД1 продолжительность действия увеличена в мышечных тканях, включая четырехглавую мышцу, икроножную мышцу и переднюю большеберцовую мышцу (смотрите Примеры, ниже). Подкожные инъекции антисмыслового олигонуклеотида на протяжении 4 недель приводят к ингибированию альфа актина 1 по меньшей мере на 70% в четырехглавых, икроножных и передних большеберцовых мышцах мышей HSALR на протяжении по меньшей мере 11 недель (77 дней) после окончания дозирования. Подкожные инъекции антисмыслового олигонуклеотида на протяжении 4 недель приводят к устранению миотонии в четырехглавых, икроножных и передних большеберцовых мышцах мышей HSALR на протяжении по меньшей мере 11 недель (77 дней) после окончания дозирования.
В определенных вариантах реализации изобретения доставка описанного в данном документе соединения или композиции приводит к понижающей регуляции мРНК-мишени и/или белка-мишени по меньшей мере на 70% на протяжении по меньшей мере 77 дней. В определенных вариантах реализации изобретения доставка описанного в данном документе соединения или композиции приводит к понижающей регуляции мРНК-мишени и/или белка-мишени по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% на протяжении по меньшей мере 30 дней, по меньшей мере 35 дней, по меньшей мере 40 дней, по меньшей мере 45 дней, по меньшей мере 50 дней, по меньшей мере 55 дней, по меньшей мере 60 дней, по меньшей мере 65 дней, по меньшей мере 70 дней, по меньшей мере 75 дней, по меньшей мере 76 дней, по меньшей мере 77 дней, по меньшей мере 78 дней, по меньшей мере 79 дней, по меньшей мере 80 дней, по меньшей мере 85 дней, по меньшей мере 90 дней, по меньшей мере 95 дней, по меньшей мере 100 дней, по меньшей мере 105 дней, по меньшей мере 110 дней, по меньшей мере 115 дней, по меньшей мере 120 дней, по меньшей мере 1 года.
В определенных вариантах реализации изобретения антисмысловой олигонуклеотид доставляют путем инъекции или инфузии один раз каждые 77 дней. В определенных вариантах реализации изобретения антисмысловой олигонуклеотид доставляют путем инъекции или инфузии один раз каждый месяц, каждые два месяца, каждые три месяца, каждые 6 месяцев, дважды в год или один раз в год.
Некоторые виды комбинационной терапии
В определенных вариантах реализации изобретения первый агент, содержащий модифицированный олигонуклеотид согласно изобретению, вводят совместно с одним или более вторичными агентами. В определенных вариантах реализации изобретения такие вторые агенты предназначены для лечения той же самой миотонической дистрофии 1 типа, что и описанный в данном документе первый агент. В определенных вариантах реализации изобретения такие вторые агенты предназначены для лечения заболевания, нарушения или патологического состояния, отличного от того, для которого предназначен описанный в данном документе первый агент. В определенных вариантах реализации изобретения такие вторые агенты предназначены для лечения нежелательных побочных эффектов одной или более описанных в данном документе фармацевтических композиций. В определенных вариантах реализации изобретения вторые агенты вводят совместно с первым агентом для лечения нежелательного эффекта первого агента. В определенных вариантах реализации изобретения вторые агенты вводят совместно с первым агентом для получения комбинационного эффекта. В определенных вариантах реализации изобретения вторые агенты вводят совместно с первым агентом для получения синергетического эффекта.
В определенных вариантах реализации изобретения первый агент и один или более вторых агентов вводят в одно и то же время. В определенных вариантах реализации изобретения первый агент и один или более вторых агентов вводят в разное время. В определенных вариантах реализации изобретения первый агент и один или более вторых агентов готовят вместе в одном фармацевтическом составе. В определенных вариантах реализации изобретения первый агент и один или более вторых агентов готовят отдельно.
Некоторые сравнительные соединения
В определенных вариантах реализации изобретения преимуществом раскрытых в данном документе соединений по отношению к соответствующему сравнительному соединению является одно или более улучшенных in vitro и/или in vivo свойств.
В определенных вариантах реализации изобретения ISIS 445569, гэпмер 5-10-5 МОЕ, имеющий последовательность (от 5' к 3') CGGAGCGGTTGTGAACTGGC (включенную в данный документ как SEQ ID №: 24), где каждая межнуклеозидная связь представляет собой тиофосфатную связь, каждый цитозин представляет собой 5-метилцитозин, а каждый из нуклеозидов 1-5 и 16-20 содержит 2'-O-метоксиэтиловый компонент, который был ранее описан в WO 2012/012443, включенной в данный документ посредством ссылки, представляет собой сравнительное соединение.
ISIS 445569 представляет собой подходящее типовое сравнительное соединение, так как ISIS 445569 демонстрирует статистически значимое снижение человеческого DMPK in vitro согласно измерениям с использованием множества групп зондов и праймеров (смотрите, например, Пример 1 и Пример 2 в WO 2012/012443). Кроме того, ISIS 445569 демонстрирует статистически значимое дозозависимое ингибирование человеческого DMPK in vitro как в клетках человеческих скелетных мышц, так и в фибробластах МД1 (смотрите, например, Пример 4 и Пример 5 в WO 2012/012443, а также Пример 28 в WO 2012/012467). Также ISIS 445569 снижает экспрессию транскрипта человеческого DMPK у трансгенных мышей (Примеры 23 и 24 в WO 2012/012443, а также Примеры 29 и 30 в WO 2012/012467). ISIS 445569 является предпочтительным антисмысловым соединением человеческого DMPK в WO 2012/012443 и WO 2012/012467.
Некоторые соединения
В определенных вариантах реализации изобретения преимуществом раскрытых в данном документе соединений по отношению к соответствующим сравнительным соединениям, таким как ISIS 445569, является улучшенная активность и/или улучшенная переносимость. Например, в определенных вариантах реализации изобретения ISIS 598769, ISIS 598768 и/или ISIS 486178 характеризуются большей активностью и/или лучшей переносимостью, чем соответствующие сравнительные соединения, такие как ISIS 445569.
В определенных вариантах реализации изобретения раскрытые в данном документе соединения являются более эффективными, чем соответствующие сравнительные соединения, такие как ISIS 445569. Например, как показано в Примере 10 (описанном в данном документе), величина IC50, достигаемая ISIS 598769, составляла 1,9 мкМ, величина IC50, достигаемая ISIS 598768, составляла 1,2 мкМ, а величина IC50, достигаемая ISIS 486178, составляла 0,7 мкМ для кривой доза-ответ по 6 точкам (61,7 нМ, 185,2 нМ, 555,6 нМ, 1666,7 нМ, 5000,0 нМ и 15000,0 нМ) в культивируемых клетках HepG2 при трансфекции путем электропорации, в то время как величина IC50, достигаемая ISIS 445569, составляла 2,3 мкМ. Следовательно, ISIS 598769, ISIS 598768 и ISIS 486178 являются более эффективными, чем сравнительное соединение ISIS 445569.
В определенных вариантах реализации изобретения раскрытые в данном документе соединения характеризуются большей активностью, чем соответствующие сравнительные соединения, такие как ISIS 445569, в случае дозозависимого ингибирования DMPK в разных мышечных тканях. В другом примере, как показано в Примере 16 (описанном в данном документе), в случае ISIS 598768 и ISIS 598769 наблюдали большее дозозависимое ингибирование, чем в случае сравнительного соединения ISIS 445569, для нескольких разных типов мышечных тканей при подкожном введении трагсгенным мышам DMSXL дважды в неделю на протяжении 4 недель в дозировке 25 мг/кг/нд, 50 мг/кг/нд или 100 мг/кг/нд. В некоторых мышечных тканях, например, в передних большеберцовых мышцах, в случае как ISIS 598768, так и ISIS 598769 наблюдали большее ингибирование DMPK при 25, 50 и 100 мг/кг/нд, чем в случае ISIS 445569 при 200 мг/кг/нд. В четырехглавых и икроножных мышцах в случае как ISIS 598768, так и ISIS 598769 наблюдали такое же или большее ингибирование DMPK при 50 мг/кг/нд, чем в случае ISIS 445569 при 100 или 200 мг/кг/нд. Следовательно, ISIS 598768 и ISIS 598769 характеризуются большей активностью, чем ISIS 445569 в случае дозозависимого ингибирования DMPK в разных мышечных тканях.
В определенных вариантах реализации изобретения раскрытые в данном документе соединения характеризуются большей переносимостью, чем соответствующие сравнительные соединения, такие как ISIS 445569, при введении мышам CD-1. В другом примере, как показано в Примере 17 (описанном в данном документе), ISIS 598769, ISIS 598768 и ISIS 486178 демонстрировали больше признаков хорошей переносимости, чем ISIS 445569 при введении мышам CD-1. ISIS 598769, ISIS 598768 и ISIS 486178 вводили подкожно дважды в неделю на протяжении 6 недель в дозировке 50 мг/кг/нд. ISIS 445569 вводили подкожно дважды в неделю на протяжении 6 недель в дозировке 100 мг/кг/нд. После обработки уровни АЛТ, ACT и АМК были ниже у обрабатываемых ISIS 486178 и ISIS 598768 мышей, чем у обрабатываемых ISIS 445569 мышей. После обработки уровни АЛТ и ACT были ниже у обрабатываемых ISIS 598769 мышей, чем у обрабатываемых ISIS 445569 мышей. Следовательно, ISIS 598769, ISIS 598768 и ISIS 486178 характеризуются большей переносимостью, чем сравнительное соединение ISIS 445569 у мышей CD-1.
В определенных вариантах реализации изобретения раскрытые в данном документе соединения характеризуются большей переносимостью, чем соответствующие сравнительные соединения, такие как ISIS 445569, при введении крысам Спрег-Доули. В другом примере, как показано в Примере 18 (описанном в данном документе), ISIS 598769, ISIS 598768 и ISIS 486178 демонстрировали больше признаков хорошей переносимости, чем ISIS 445569 при введении крысам Спрег-Доули. ISIS 598769, ISIS 598768 и ISIS 486178 вводили подкожно дважды в неделю на протяжении 6 недель в дозировке 50 мг/кг/нд. ISIS 445569 вводили подкожно дважды в неделю на протяжении 6 недель в дозировке 100 мг/кг/нд. После обработки уровни АЛТ и ACT были ниже у обрабатываемых ISIS 486178, ISIS 598769 и ISIS 598768 крыс, чем у обрабатываемых ISIS 445569 крыс. Следовательно, ISIS 598769, ISIS 598768 и ISIS 486178 характеризуются большей переносимостью, чем сравнительное соединение ISIS 445569 у крыс Спрег-Доули.
В определенных вариантах реализации изобретения раскрытые в данном документе соединения демонстрируют больше признаков хорошей переносимости у яванских макаков, чем соответствующие сравнительные соединения, такие как ISIS 445569. В другом примере, как показано в Примере 19 (описанном в данном документе), ISIS 598769, ISIS 598768 и ISIS 486178 демонстрировали больше признаков хорошей переносимости у яванских макаков, включая оцененные уровни аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (ACT), лактатдегидрогеназы (ЛДГ) и креатинкиназы (КК). В определенных вариантах реализации изобретения уровни АЛТ и ACT используют как индикаторы гепатотоксичности. Например, в определенных вариантах реализации изобретения повышенные уровни АЛТ и ACT свидетельствуют о повреждении клеток печени. В определенных вариантах реализации изобретения повышенные уровни КК связаны с повреждением клеток в мышечной ткани. В определенных вариантах реализации изобретения повышенные уровни ЛДГ связаны с повреждением клеточной ткани.
В определенных вариантах реализации изобретения раскрытые в данном документе соединения характеризуются большей переносимостью, чем соответствующие сравнительные соединения, такие как ISIS 445569, при введении яванским макакам. Как показано в Примере 19, группу яванских макаков обрабатывали 40 мг/кг/нд ISIS 598769, ISIS 598768, ISIS 486178 и ISIS 445569. Обработка ISIS 445569 приводила к повышению уровней АЛТ и ACT на 93 день с начала обработки. Обработка ISIS 598768 и ISIS 486178 приводила к снижению уровней АЛТ и ACT на 58 и 93 день с начала обработки по сравнению с ISIS 445569. Обработка ISIS 598769 приводила к снижению уровней ACT на 58 и 93 день с начала обработки и к снижению уровней АЛТ на 93 день с начала обработки по сравнению с ISIS 445569. Кроме того, уровни АЛТ и ACT у обезьян, получавших дозы ISIS 598769, ISIS 598768 и ISIS 486178, были сопоставимы с уровнями АЛТ и ACT у обезьян, которым давали солевой раствор. Обработка ISIS 445569 приводила к повышению уровней ЛДГ по сравнению с уровнями ЛДГ, измеренными для животных, которым давали ISIS 598769, ISIS 598768 и ISIS 486178, на 93 день с начала обработки. Кроме того, обработка ISIS 445569 приводила к повышению уровней КК по сравнению с уровнями КК, измеренными для животных, которым давали ISIS 598769, ISIS 598768 и ISIS 486178, на 93 день с начала обработки. Следовательно, ISIS 598769, ISIS 598768 и ISIS 486178 характеризуются большей переносимостью, чем сравнительное соединение ISIS 445569.
Как демонстрируют вышеприведенные данные, ISIS 598769, ISIS 598768 и ISIS 486178 характеризуются более широким диапазоном хорошо переносимых доз, при которых ISIS 598769, ISIS 598768 и ISIS 486178 проявляют активность, по сравнению со сравнительным соединением ISIS 445569. Кроме того, совокупность данных, представленных в примерах данного документа и обсуждаемых выше, демонстрирует, что каждое из ISIS 598769, ISIS 598768 и ISIS 486178 обладает определенным количеством преимуществ, связанных с безопасностью и активностью, по сравнению со сравнительным соединением ISIS 445569. Другими словами, каждое из ISIS 598769, ISIS 598768 и ISIS 486178 с большой вероятностью является более безопасным и более активным лекарственным препаратом, чем ISIS 445569.
В определенных вариантах реализации изобретения ISIS 445569 с большой вероятностью является более безопасным для людей и более активным лекарственным препаратом для снижения мРНК CUGexp DMPK и/или лечения патологических состояний или симптомов, связанных с наличием миотонической дистрофии 1 типа, по сравнению с другими соединениями, раскрытыми в WO 2012/012443 и/или WO 2012/012467.
В определенных вариантах реализации изобретения ISIS 512497 характеризуется лучшим профилем безопасности у приматов и мышей CD-1, чем ISIS 445569. В определенных вариантах реализации изобретения ISIS 512497 позволяет в большей степени достичь нокдауна нуклеиновой кислоты человеческого DMPK в разных мышечных тканях при введении в той же дозе и в более низких дозах, чем ISIS 445569.
В определенных вариантах реализации изобретения ISIS 486178 характеризуется лучшим профилем безопасности у мышей, крыс и приматов, чем ISIS 445569. В определенных вариантах реализации изобретения ISIS 486178 позволяет в большей степени достичь нокдауна нуклеиновой кислоты человеческого DMPK в одной или более мышечных тканях при введении в той же дозе и в более низких дозах, чем ISIS 445569.
В определенных вариантах реализации изобретения ISIS 570808 позволяет в намного большей степени достичь нокдауна нуклеиновой кислоты человеческого DMPK в по меньшей мере пяти разных мышечных тканях при введении в той же дозе и в более низких дозах, чем ISIS 445569.
В определенных вариантах реализации изобретения ISIS 594292 позволяет в большей степени достичь нокдауна нуклеиновой кислоты человеческого DMPK в одной или более мышечных тканях при введении в той же дозе, что и ISIS 445569. В определенных вариантах реализации изобретения ISIS 486178 характеризуется лучшим профилем безопасности у приматов по сравнению с ISIS 445569.
В определенных вариантах реализации изобретения ISIS 569473 позволяет в большей степени достичь нокдауна нуклеиновой кислоты человеческого DMPK в одной или более мышечных тканях при введении в той же дозе, что и ISIS 445569. В определенных вариантах реализации изобретения ISIS 569473 характеризуется лучшим профилем безопасности у приматов по сравнению с ISIS 445569.
В определенных вариантах реализации изобретения ISIS 594300 позволяет в большей степени достичь нокдауна нуклеиновой кислоты человеческого DMPK в одной или более мышечных тканях при введении в той же дозе, что и ISIS 445569. В определенных вариантах реализации изобретения ISIS 594300 характеризуется лучшим профилем безопасности у приматов по сравнению с ISIS 445569.
В определенных вариантах реализации изобретения ISIS 598777 позволяет в большей степени достичь нокдауна нуклеиновой кислоты человеческого DMPK в одной или более мышечных тканях при введении в той же дозе, что и ISIS 445569. В определенных вариантах реализации изобретения ISIS 598777 характеризуется лучшим профилем безопасности у приматов по сравнению с ISIS 445569.
В определенных вариантах реализации изобретения ISIS 598768 позволяет в большей степени достичь нокдауна нуклеиновой кислоты человеческого DMPK в одной или более мышечных тканях при введении в той же дозе, что и ISIS 445569. В определенных вариантах реализации изобретения ISIS 598768 характеризуется лучшим профилем безопасности у приматов по сравнению с ISIS 445569.
В определенных вариантах реализации изобретения ISIS 598769 позволяет в большей степени достичь нокдауна нуклеиновой кислоты человеческого DMPK в одной или более мышечных тканях при введении в той же дозе, что и ISIS 445569. В определенных вариантах реализации изобретения ISIS 598769 характеризуется лучшим профилем безопасности у приматов по сравнению с ISIS 445569.
Неограничивающее описание и включение посредством ссылки
Хотя некоторые соединения, композиции и способы, описанные в данном документе, были специально описаны в соответствии с определенными вариантами реализации изобретения, нижеприведенные примеры служат исключительно, чтобы проиллюстрировать описанные в данном документе соединения, и не ограничивают объем изобретения. Каждая ссылка, номер доступа в GenBank и тому подобное, приведенные в настоящей заявке, в полном объеме включены в данный документ посредством ссылки.
Хотя в прилагающемся к данной заявке перечне последовательностей каждая последовательность определена как «РНК» или «ДНК», как это необходимо, в реальности эти последовательности можно модифицировать посредством любых комбинаций химических модификаций. Для специалиста в данной области техники понятно, что применение таких обозначений, как «РНК» или «ДНК» для описания модифицированных олигонуклеотидов, является в некоторых случаях произвольным. Например, олигонуклеотид, содержащий нуклеозид, содержащий 2'-ОН сахарный компонент и основание тимина, может быть описан как ДНК, содержащая модифицированный сахар (2'-ОН вместо природного 2'-Н для ДНК), или как РНК, содержащая модифицированное основание (тимин (метилированный урацил) вместо природного урацила для РНК).
Соответственно, предложенные в данном документе нуклеотидные последовательности, включая, но не ограничиваясь этим, те, которые приведены в перечне последовательностей, включают нуклеиновые кислоты, содержащие любую комбинацию модифицированных РНК и/или ДНК, включая, но не ограничиваясь этим, нуклеиновые кислоты, содержащие модифицированные нуклеотидные основания. В качестве дополнительного неограничивающего примера может служить олигомерное соединение, содержащее нуклеотидную последовательность «ATCGATCG», которое включает любые олигомерные соединения, содержащие такую нуклеотидную последовательность, как модифицированные, так и немодифицированные, включая, но не ограничиваясь этим, такие соединения, содержащие основания РНК, такие как те, которые имеют последовательность «AUCGAUCG», и те, которые содержат некоторое количество оснований ДНК и некоторое количество оснований РНК, такие как «AUCGATCG», а также олигомерные соединения, содержащие другие модифицированные или природные основания, такие как «ATmeCGAUCG», где meC означает основание цитозина, содержащее метиловую группу в 5-позиции.
ПРИМЕРЫ
Неограничивающее описание и включение посредством ссылки
Хотя некоторые соединения, композиции и способы, описанные в данном документе, были специально описаны в соответствии с определенными вариантами реализации изобретения, нижеприведенные примеры служат исключительно, чтобы проиллюстрировать описанные в данном документе соединения, и не ограничивают объем изобретения. Каждая из ссылок, приведенных в настоящей заявке, в полном объеме включена в данный документ посредством ссылки.
Пример 1: Разработка антисмысловых олигонуклеотидов, нацеленных на человеческую дистрофическую миотонин-протеинкиназу (hDMPK)
Разрабатывали группу антисмысловых олигонуклеотидов (АСО) для нацеливания на hDMPK. Разработанные олигонуклеотиды, полученные при помощи стандартного олигонуклеотидного синтеза, хорошо известного в данной области техники, описаны в Таблицах 1 и 2, ниже. Индексом «s» обозначены тиофосфатные межнуклеозидные связи; индексом «k» обозначены 6'-(S)-СН3 бициклические нуклеозиды (cEt); индексом «е» обозначены 2'-O-метоксиэтиловые (МОЕ) модифицированные нуклеозиды; а индексом «d» обозначены β-D-2'-дезоксирибонуклеозиды. «mC» обозначает 5-метилцитозиновые нуклеозиды.
Антисмысловые олигонуклеотиды нацелены на SEQ ID №: 1 (номер доступа в GENBANK NM_001081560.1) и/или SEQ ID №: 2 (комплементарная последовательность номера доступа в GENBANK NT_011109.15, усеченная от нуклеозида 18540696 до 18555106). «Сайт инициации» означает крайний 5' нуклеозид человеческой генной последовательности, на который нацелен гэпмер. «Сайт терминации» означает крайний 3' нуклеозид человеческой генной последовательности, на который нацелен гэпмер.
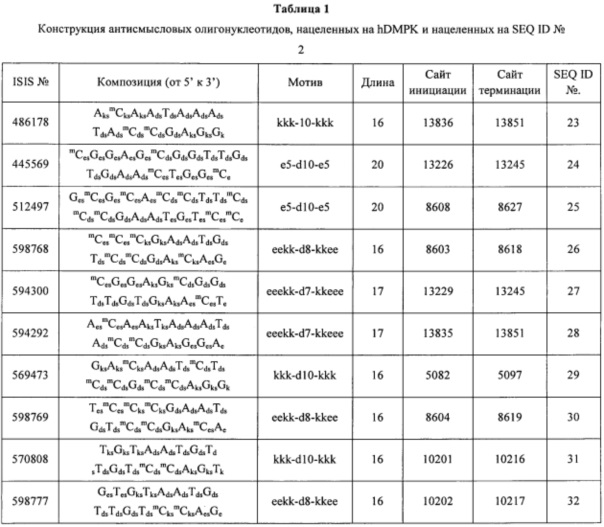
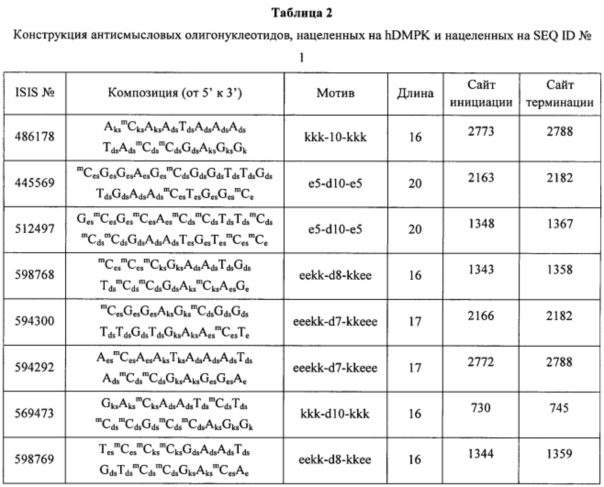
Пример 2: Антисмысловое ингибирование человеческого DMPK в человеческих клетках скелетных мышц (hSKMc)
Антисмысловые олигонуклеотиды, нацеленные на нуклеиновую кислоту человеческого DMPK, исследовали в отношении их влияния на транскрипт РНК DMPK in vitro. Культивируемые клетки hSKMc с плотностью 20000 клеток на лунку трансфицировали посредством электропорации 10000 нМ антисмыслового олигонуклеотида. Приблизительно через 24 часа РНК выделяли из клеток и измеряли уровни транскрипта DMPK при помощи количественной ПЦР в режиме реального времени. Уровни транскрипта РНК DMPK корректировали относительно общего содержания РНК, измеренного при помощи RIBOGREEN®. Результаты представлены в виде процента экспрессии DMPK в сравнении с необработанными контрольными клетками.
Антисмысловые олигонуклеотиды в Таблицах 3, 4, 5 и 6 представляют собой 5-10-5 гэпмеры, в которых гэп-сегмент содержит десять 2'-дезоксинуклеозидов, а каждый сегмент крыла содержит пять 2'-МОЕ нуклеозидов. Межнуклеозидные связи в каждом гэпмере представляют собой тиофосфатные (P=S) связи. Все остатки цитозина в каждом гэпмере представляют собой 5-метилцитозины. «Целевой сайт инициации» означает крайний 5' нуклеозид в человеческой геномной последовательности, на который нацелен антисмысловой олигонуклеотид. «Целевой сайт терминации» означает крайний 3' нуклеозид в человеческой геномной последовательности, на который нацелен антисмысловой олигонуклеотид. Все антисмысловые олигонуклеотиды, перечисленные в Таблице 3, 4 или 5, нацелены на SEQ ID №: 1 (номер доступа в GENBANK NM_001081560.1). Все антисмысловые олигонуклеотиды, перечисленные в Таблице 6, нацелены на SEQ ID №: 2 (комплементарная последовательность номера доступа в GENBANK NT_011109.15, усеченная от нуклеозида 18540696 до 18555106).
Некоторые антисмысловые олигонуклеотиды из Таблиц 2, 3, 4 и 5 демонстрировали значительное ингибирование уровней мРНК DMPK в вышеозначенных условиях.
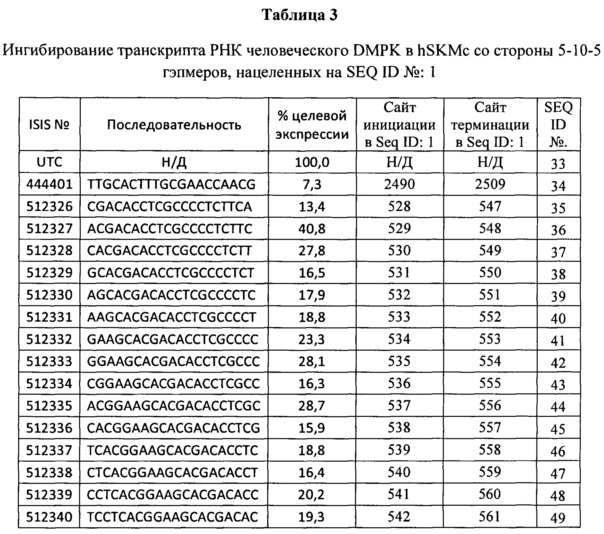
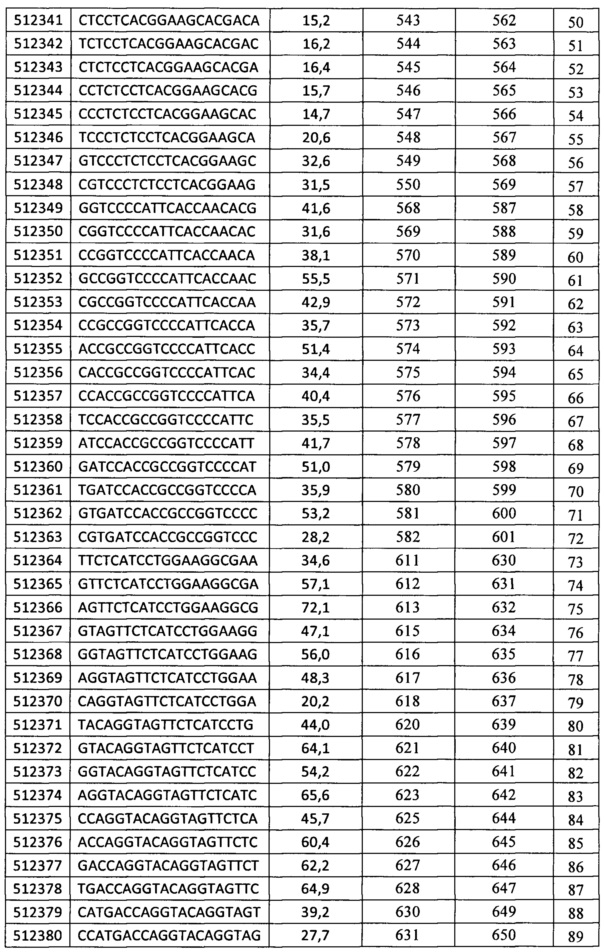
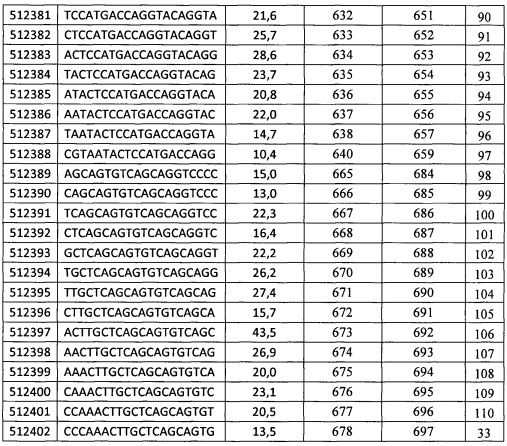

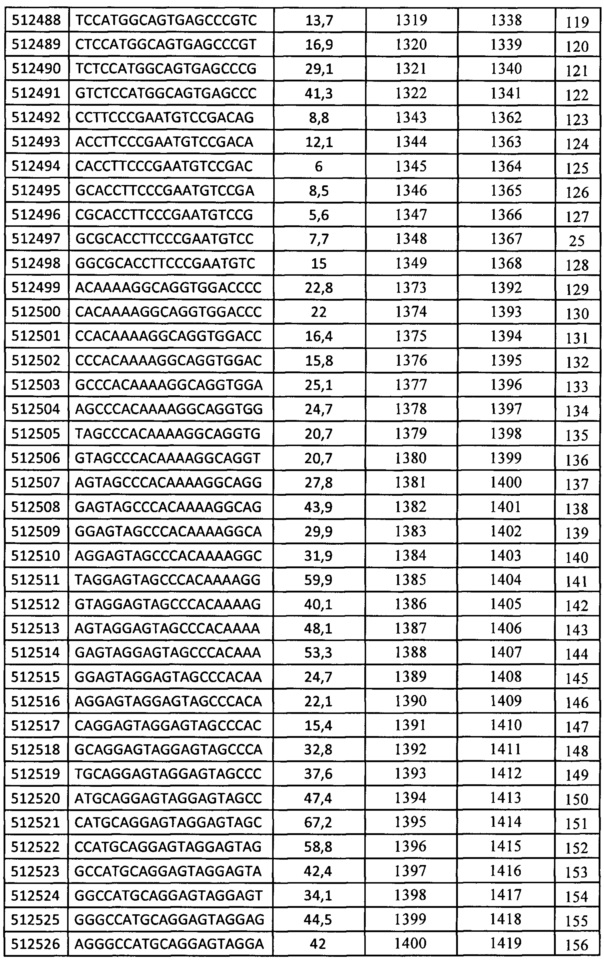
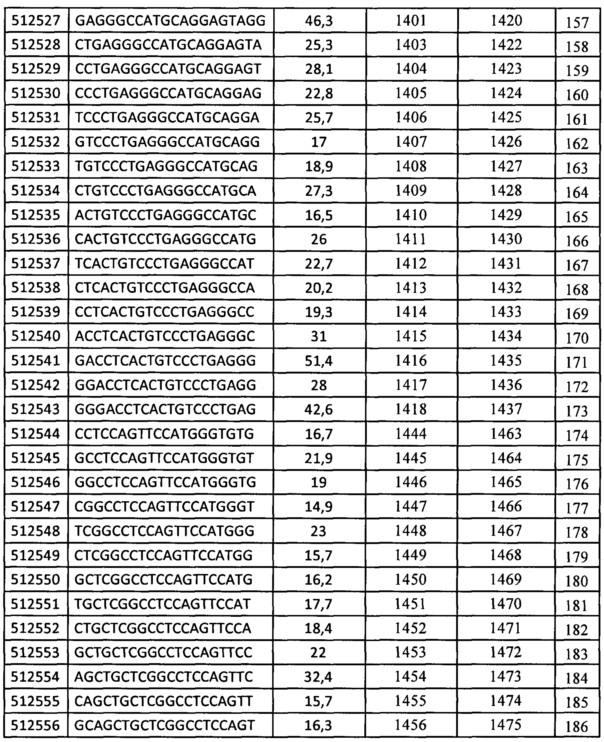

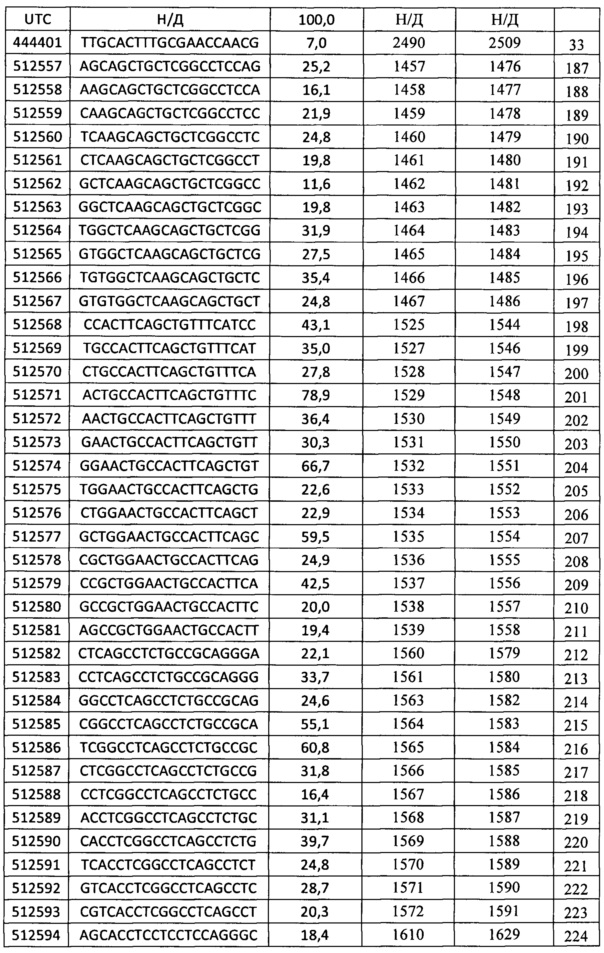
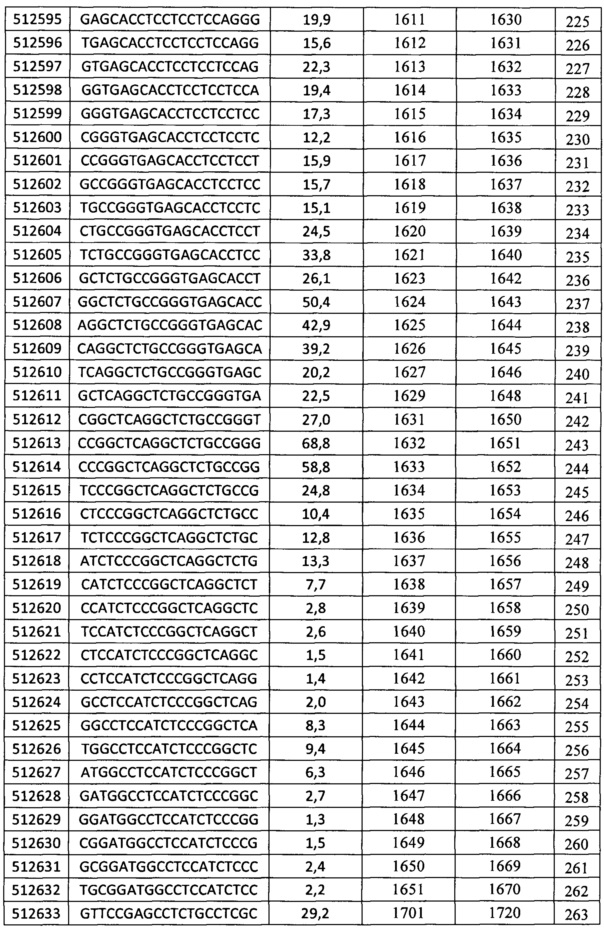
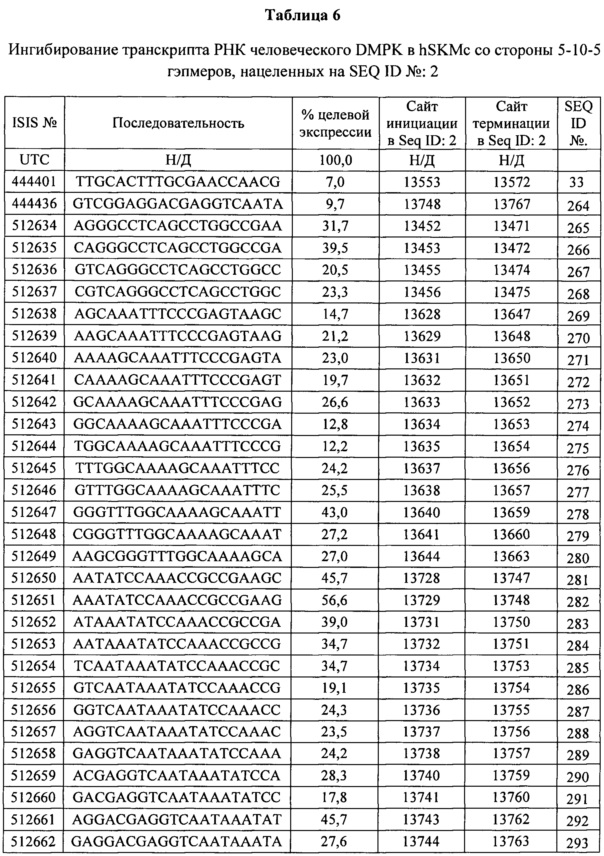
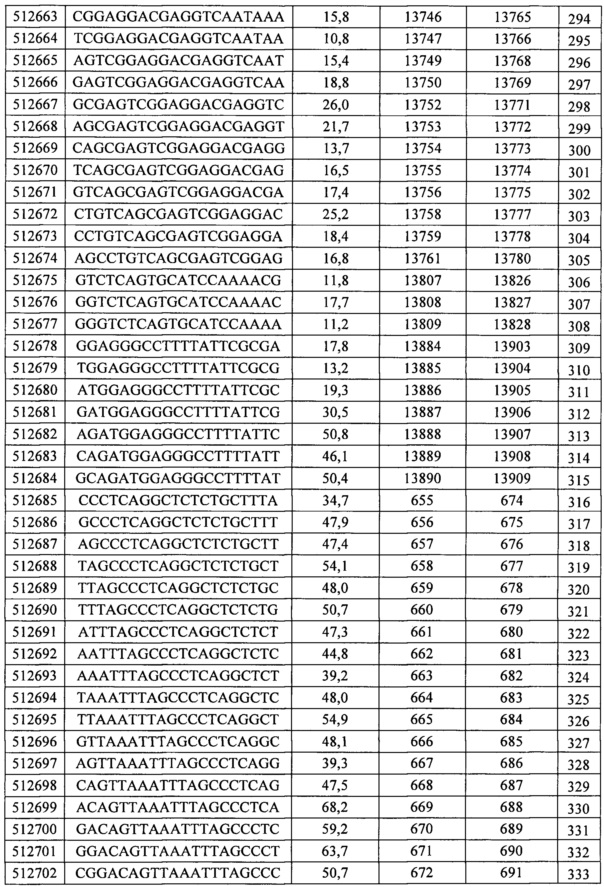
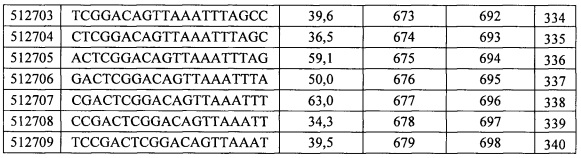
Пример 3: Разработка антисмысловых олигонуклеотидов, нацеленных на человеческую дистрофическую миотонин-протеинкиназу (hDMPK)
Разрабатывали группу антисмысловых олигонуклеотидов (АСО) для нацеливания на hDMPK. Разработанные олигонуклеотиды, полученные при помощи стандартного олигонуклеотидного синтеза, хорошо известного в данной области техники, описаны в Таблице 7, ниже. Индексом «s» обозначены тиофосфатные межнуклеозидные связи; индексом «k» обозначены 6'-(S)-СН3 бициклические нуклеозиды (cEt); индексом «е» обозначены 2'-O-метоксиэтиловые (МОЕ) модифицированные нуклеозиды; а индексом «d» обозначены β-D-2'-дезоксирибонуклеозиды. «mC» обозначает 5-метилцитозиновые нуклеозиды.
Антисмысловые олигонуклеотиды, нацеленные на нуклеиновую кислоту человеческого DMPK, исследовали в отношении их влияния на транскрипт РНК DMPK in vitro. Культивируемые клетки HepG2 с плотностью 20000 клеток на лунку трансфицировали посредством электропорации 4500 нМ антисмыслового олигонуклеотида. Приблизительно через 24 часа РНК выделяли из клеток и измеряли уровни транскрипта DMPK при помощи количественной ПЦР в режиме реального времени. Уровни транскрипта РНК DMPK корректировали относительно общего содержания РНК, измеренного при помощи RIBOGREEN®. Результаты представлены в виде процента экспрессии DMPK в сравнении с необработанными контрольными клетками.
«Целевой сайт инициации» означает крайний 5' нуклеозид в человеческой геномной последовательности, на который нацелен антисмысловой олигонуклеотид. «Целевой сайт терминации» означает крайний 3' нуклеозид в человеческой геномной последовательности, на который нацелен антисмысловой олигонуклеотид. Все антисмысловые олигонуклеотиды, перечисленные в Таблице 7, нацелены на SEQ ID №: 1 (номер доступа в GENBANK NM_001081560.1).
Некоторые антисмысловые олигонуклеотиды демонстрировали значительное ингибирование уровней мРНК DMPK в вышеозначенных условиях.
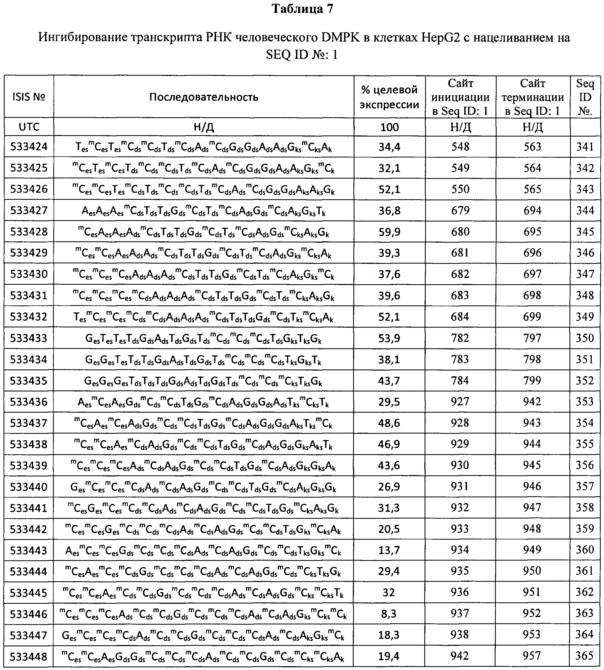
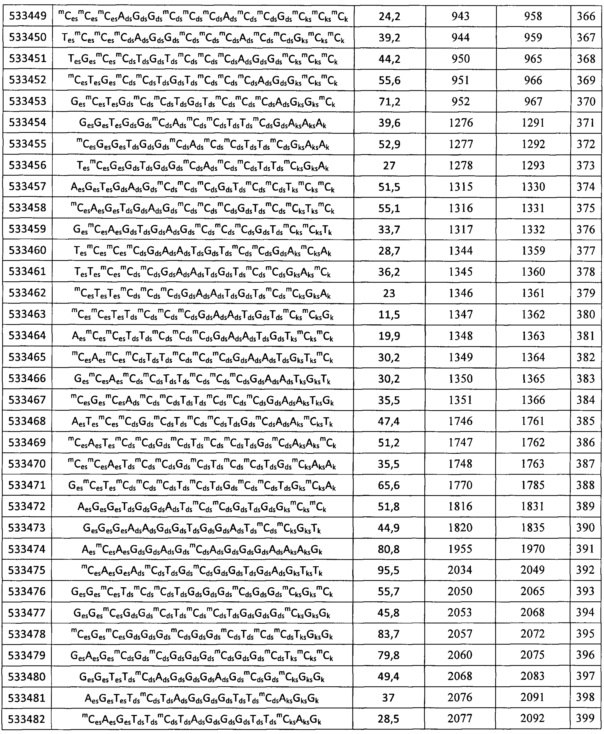
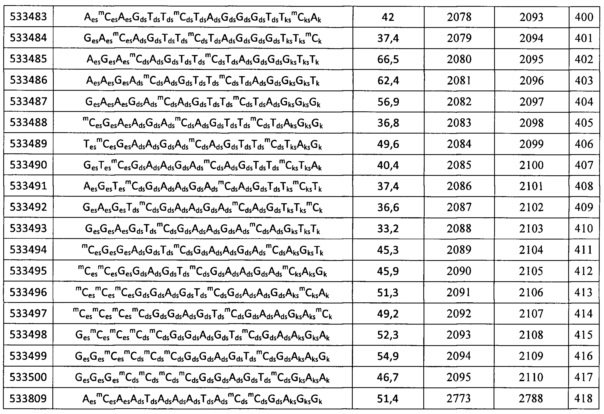
Пример 4: Разработка антисмысловых олигонуклеотидов, нацеленных на человеческую дистрофическую миотонин-протеинкиназу (hDMPK)
Доза-ответ для HepG2
Разрабатывали группу антисмысловых олигонуклеотидов (АСО) для нацеливания на hDMPK. Разработанные олигонуклеотиды, полученные при помощи стандартного олигонуклеотидного синтеза, хорошо известного в данной области техники, описаны в Таблице 8, ниже. Индексом «s» обозначены тиофосфатные межнуклеозидные связи; индексом «k» обозначены 6'-(S)-СН3 бициклические нуклеозиды (cEt); индексом «е» обозначены 2'-O-метоксиэтиловые (МОЕ) модифицированные нуклеозиды; а индексом «d» обозначены β-D-2'-дезоксирибонуклеозиды. «mC» обозначает 5-метилцитозиновые нуклеозиды.
Антисмысловые олигонуклеотиды нацелены на SEQ ID №: 1 (номер доступа в GENBANK NM_001081560.1). «Сайт инициации» означает крайний 5' нуклеозид человеческой генной последовательности, на который нацелен гэпмер. «Сайт терминации» означает крайний 3' нуклеозид человеческой генной последовательности, на который нацелен гэпмер.
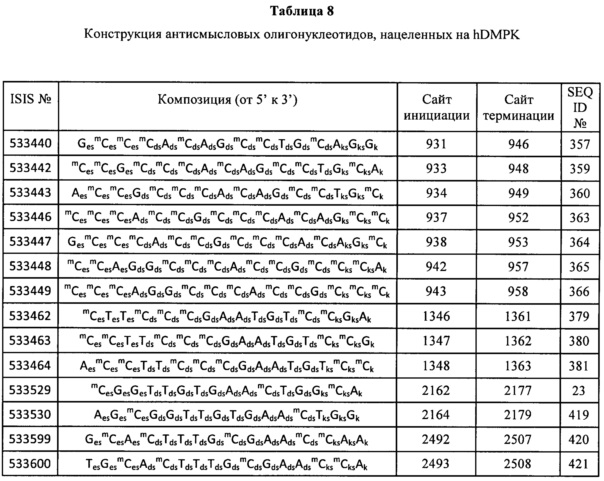
Пример 5: Доза-ответ для HepG2
Антисмысловые олигонуклеотиды, нацеленные на нуклеиновую кислоту человеческого DMPK, исследовали в отношении их влияния на транскрипт РНК DMPK in vitro. Культивируемые клетки HepG2 с плотностью 20000 клеток на лунку трансфицировали посредством электропорации концентрациями каждого антисмыслового олигонуклеотида, составлявшими 625 нМ, 1250 нМ, 2500 нМ, 5000 нМ и 10000,0 нМ. Приблизительно через 24 часа РНК выделяли из клеток и измеряли уровни транскрипта РНК DMPK при помощи количественной ПЦР в режиме реального времени, используя набор праймеров и зондов RTS3164 (прямая последовательность AGCCTGAGCCGGGAGATG, обозначаемая в данном документе как SEQ ID №: 20; обратная последовательность GCGTAGTTGACTGGCGAAGTT, обозначаемая в данном документе как SEQ ID №: 21; последовательность зонда AGGCCATCCGCACGGACAACCX, обозначаемая в данном документе как SEQ ID №: 22). Уровни транскрипта РНК человеческого DMPK корректировали относительно общего содержания РНК, измеренного при помощи RIBOGREEN®. Результаты представлены ниже в таблице в виде процента экспрессии человеческого DMPK в сравнении с необработанными контрольными (НК) клетками. Исследуемые последовательности антисмысловых олигонуклеотидов демонстрировали дозозависимое ингибирование уровней мРНК человеческого DMPK в вышеозначенных условиях.
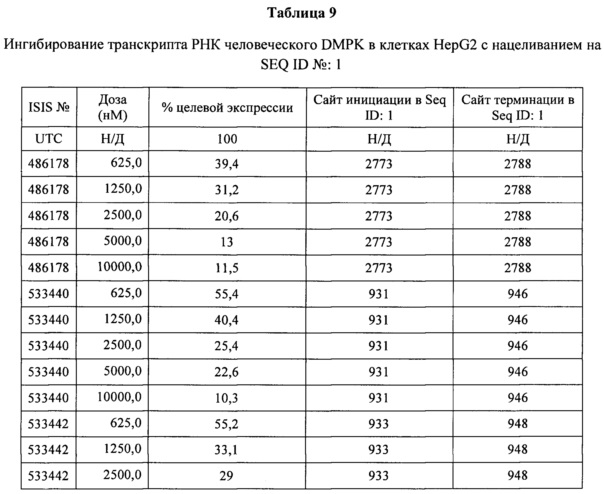
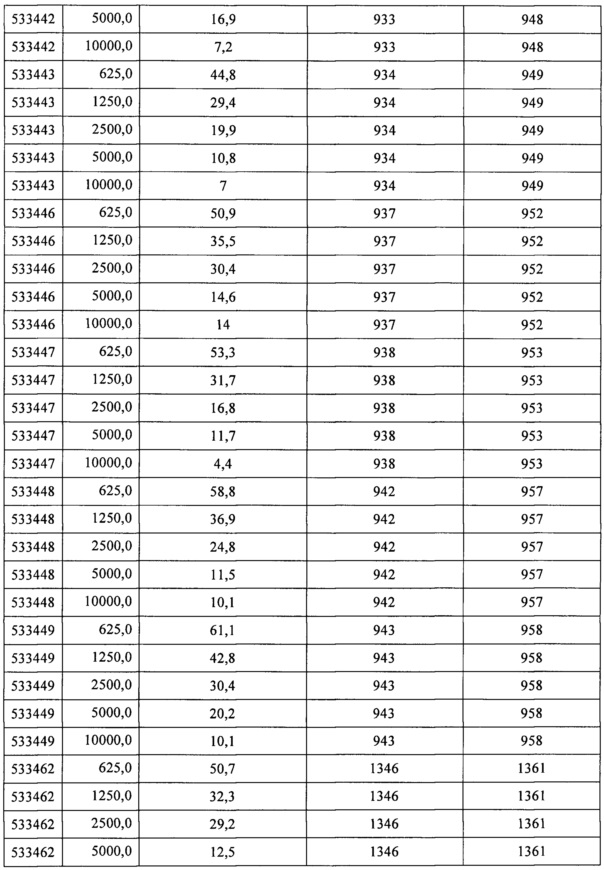
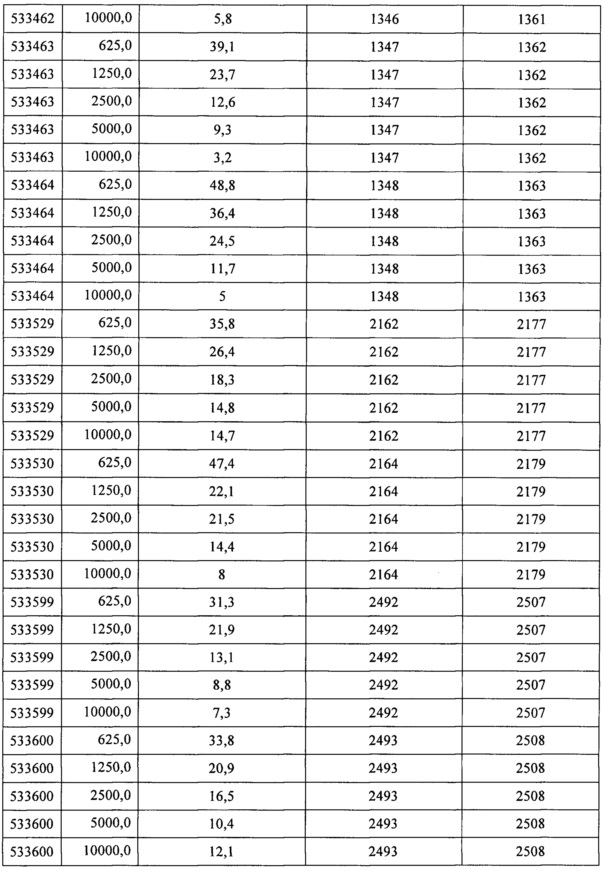
Пример 6; Разработка антисмысловых олигонуклеотидов, нацеленных на человеческую дистрофическую миотонин-протеинкиназу (hDMPK)
Разрабатывали группу антисмысловых олигонуклеотидов (АСО) для нацеливания на hDMPK. Разработанные олигонуклеотиды, полученные при помощи стандартного олигонуклеотидного синтеза, хорошо известного в данной области техники, описаны в Таблице 10, ниже. Индексом «s» обозначены тиофосфатные межнуклеозидные связи; индексом «k» обозначены 6'-(S)-СН3 бициклические нуклеозиды (cEt); индексом «е» обозначены 2'-O-метоксиэтиловые (МОЕ) модифицированные нуклеозиды; а индексом «d» обозначены β-D-2'-дезоксирибонуклеозиды. «mC» обозначает 5-метилцитозиновые нуклеозиды.
Антисмысловые олигонуклеотиды нацелены на SEQ ID №: 2 (комплементарная последовательность номера доступа в GENBANK NT_011109.15, усеченная от нуклеозида 18540696 до 18555106). «Сайт инициации» означает крайний 5' нуклеозид человеческой генной последовательности, на который нацелен гэпмер. «Сайт терминации» означает крайний 3' нуклеозид человеческой генной последовательности, на который нацелен гэпмер.
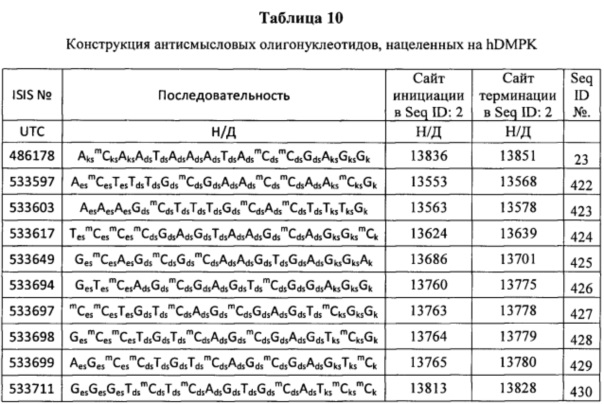
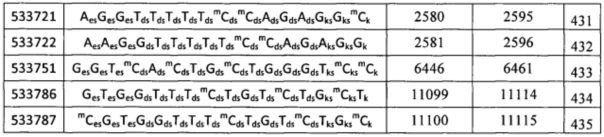
Пример 7: Доза-ответ для АСО, нацеленных на транскрипт РНК человеческого DMPK, в клетках HepG2
Антисмысловые олигонуклеотиды, нацеленные на нуклеиновую кислоту человеческого DMPK, исследовали в отношении их влияния на транскрипт РНК DMPK in vitro. Культивируемые клетки HepG2 с плотностью 20000 клеток на лунку трансфицировали посредством электропорации концентрациями каждого антисмыслового олигонуклеотида, составлявшими 625 нМ, 1250 нМ, 2500 нМ, 5000 нМ и 10000,0 нМ. Приблизительно через 24 часа РНК выделяли из клеток и измеряли уровни транскрипта РНК DMPK при помощи количественной ПЦР в режиме реального времени, используя набор праймеров и зондов RTS3164 (прямая последовательность AGCCTGAGCCGGGAGATG, обозначаемая в данном документе как SEQ ID №: 20; обратная последовательность GCGTAGTTGACTGGCGAAGTT, обозначаемая в данном документе как SEQ ID №: 21; последовательность зонда AGGCCATCCGCACGGACAACCX, обозначаемая в данном документе как SEQ ID №: 22). Уровни транскрипта РНК человеческого DMPK корректировали относительно общего содержания РНК, измеренного при помощи RIBOGREEN®. Результаты представлены в виде процента экспрессии человеческого DMPK в сравнении с необработанными контрольными (НК) клетками и показаны в таблице, ниже. Исследуемые последовательности антисмысловых олигонуклеотидов демонстрировали дозозависимое ингибирование уровней мРНК человеческого DMPK в вышеозначенных условиях.

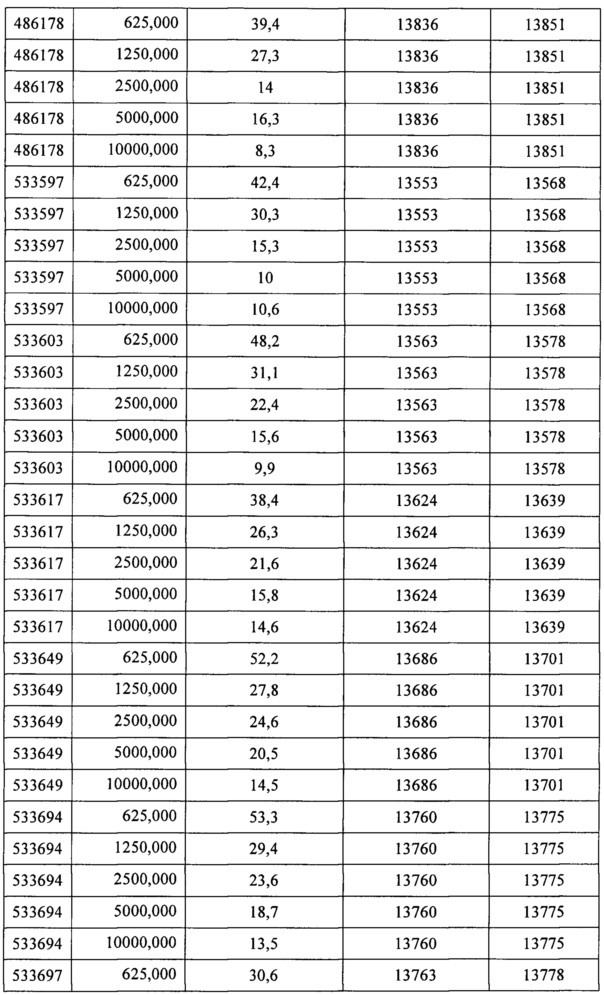
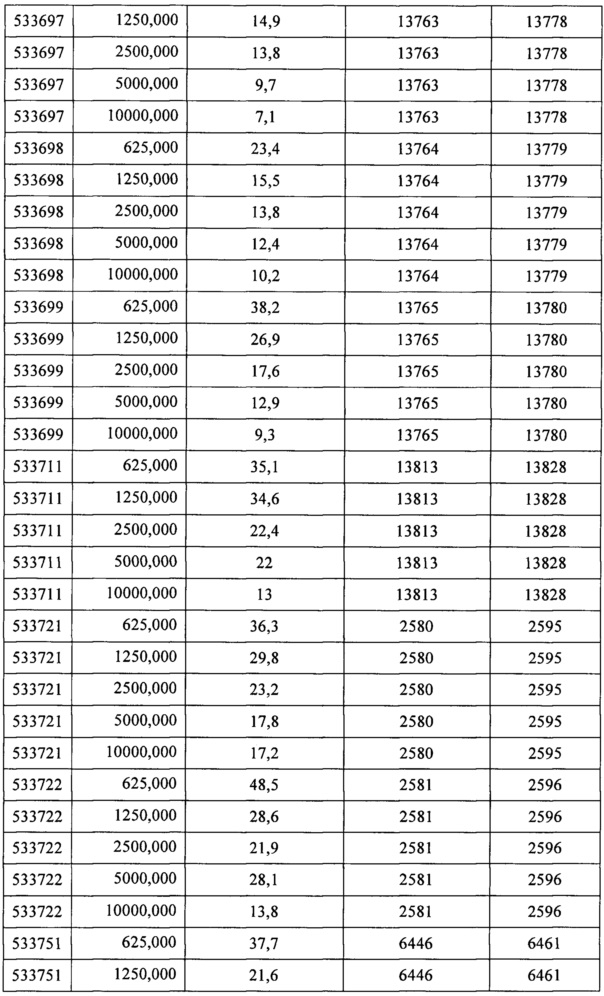
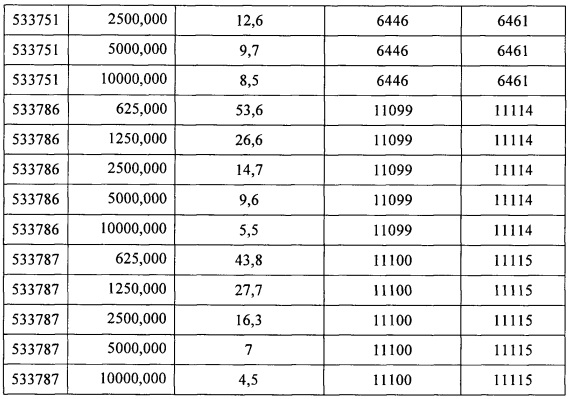
Пример 8: АСО, разработанные для нацеливания на транскрипт РНК человеческого DMPK
Разрабатывали группу антисмысловых олигонуклеотидов (АСО) для нацеливания на hDMPK. Разработанные олигонуклеотиды, полученные при помощи стандартного олигонуклеотидного синтеза, хорошо известного в данной области техники, описаны в Таблице 12, ниже. Индексом «s» обозначены тиофосфатные межнуклеозидные связи; индексом «k» обозначены 6'-(S)-СН3 бициклические нуклеозиды (cEt); индексом «е» обозначены 2'-O-метоксиэтиловые (МОЕ) модифицированные нуклеозиды; а индексом «d» обозначены β-D-2'-дезоксирибонуклеозиды. «mC» обозначает 5-метилцитозиновые нуклеозиды.
Антисмысловые олигонуклеотиды, нацеленные на нуклеиновую кислоту человеческого DMPK, исследовали в отношении их влияния на транскрипт РНК DMPK in vitro. Культивируемые клетки hSKMC с плотностью 20000 клеток на лунку трансфицировали посредством электропорации 800 нМ антисмыслового олигонуклеотида. Приблизительно через 24 часа РНК выделяли из клеток и измеряли уровни транскрипта DMPK при помощи количественной ПЦР в режиме реального времени. Уровни транскрипта РНК DMPK корректировали относительно общего содержания РНК, измеренного при помощи RIBOGREEN®. Результаты представлены в виде процента экспрессии DMPK в сравнении с необработанными контрольными клетками.
«Целевой сайт инициации» означает крайний 5' нуклеозид в человеческой геномной последовательности, на который нацелен антисмысловой олигонуклеотид. «Целевой сайт терминации» означает крайний 3' нуклеозид в человеческой геномной последовательности, на который нацелен антисмысловой олигонуклеотид. Все антисмысловые олигонуклеотиды, перечисленные в Таблице 12, нацелены на SEQ ID №: 1 (номер доступа в GENBANK NM_001081560.1).
Некоторые антисмысловые олигонуклеотиды демонстрировали значительное ингибирование уровней мРНК DMPK в вышеозначенных условиях.
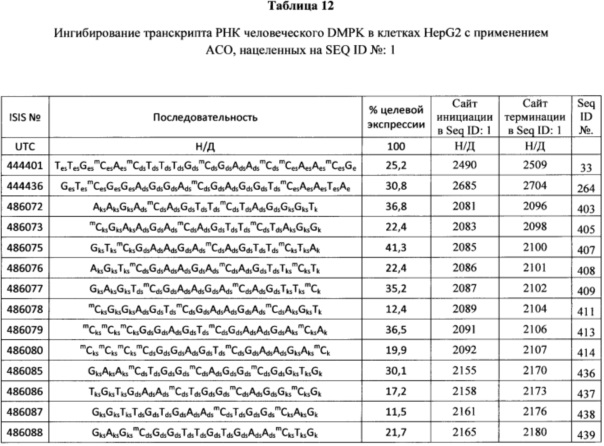
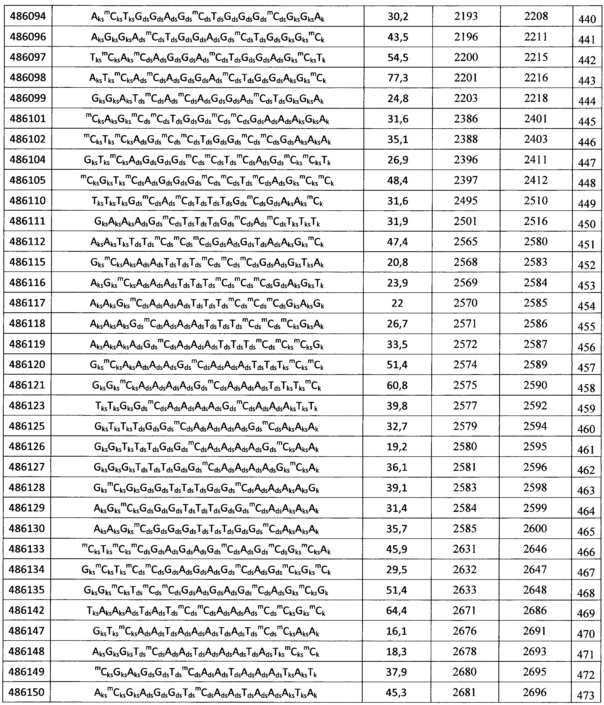
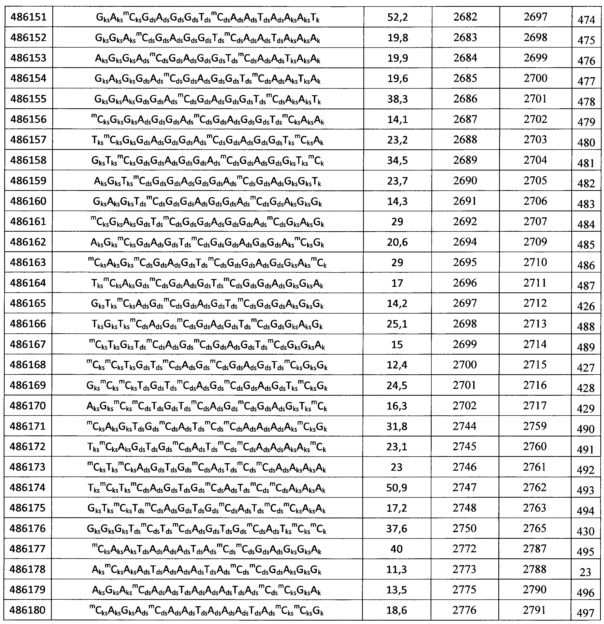
Пример 9: АСО, разработанные для нацеливания на транскрипт РНК человеческого DMPK
Разрабатывали группу антисмысловых олигонуклеотидов (АСО) для нацеливания на hDMPK. Разработанные олигонуклеотиды, полученные при помощи стандартного олигонуклеотидного синтеза, хорошо известного в данной области техники, описаны в Таблицах от 13 до 18, ниже. Индексом «s» обозначены тиофосфатные межнуклеозидные связи; индексом «k» обозначены 6'-(S)-СН3 бициклические нуклеозиды (cEt); индексом «е» обозначены 2'-O-метоксиэтиловые (МОЕ) модифицированные нуклеозиды; а индексом «d» обозначены β-D-2'-дезоксирибонуклеозиды. «mC» обозначает 5-метилцитозиновые нуклеозиды.
Антисмысловые олигонуклеотиды, нацеленные на нуклеиновую кислоту человеческого DMPK, исследовали в отношении их влияния на транскрипт РНК DMPK in vitro. Культивируемые клетки HepG2 с плотностью 20000 клеток на лунку трансфицировали посредством электропорации 4500 нМ антисмыслового олигонуклеотида. Приблизительно через 24 часа РНК выделяли из клеток и измеряли уровни транскрипта DMPK при помощи количественной ПЦР в режиме реального времени. Уровни транскрипта РНК DMPK корректировали относительно общего содержания РНК, измеренного при помощи RIBOGREEN®. Результаты представлены в виде процента экспрессии DMPK в сравнении с необработанными контрольными клетками, при этом «% целевой экспрессии» представляет процент экспрессии DMPK в сравнении с необработанными контрольными клетками.
Все антисмысловые олигонуклеотиды, перечисленные в Таблице 13, нацелены на SEQ ID №: 1 (номер доступа в GENBANK NM_001081560.1). Все антисмысловые олигонуклеотиды, перечисленные в Таблицах от 14 до 18, нацелены на SEQ ID №: 2 (комплементарная последовательность номера доступа в GENBANK NT_011109.15, усеченная от нуклеозида 18540696 до 18555106). «Целевой сайт инициации» означает крайний 5' нуклеозид в человеческой геномной последовательности, на который нацелен антисмысловой олигонуклеотид. «Целевой сайт терминации» означает крайний 3' нуклеозид в человеческой геномной последовательности, на который нацелен антисмысловой олигонуклеотид.
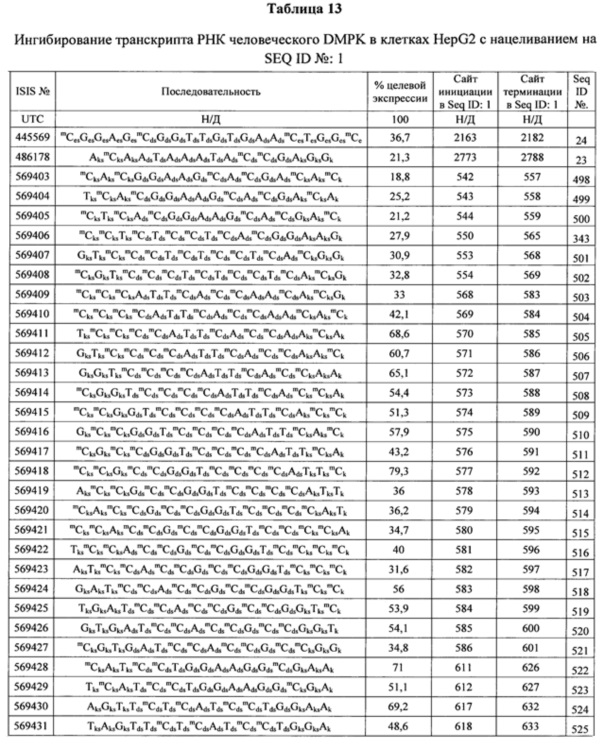
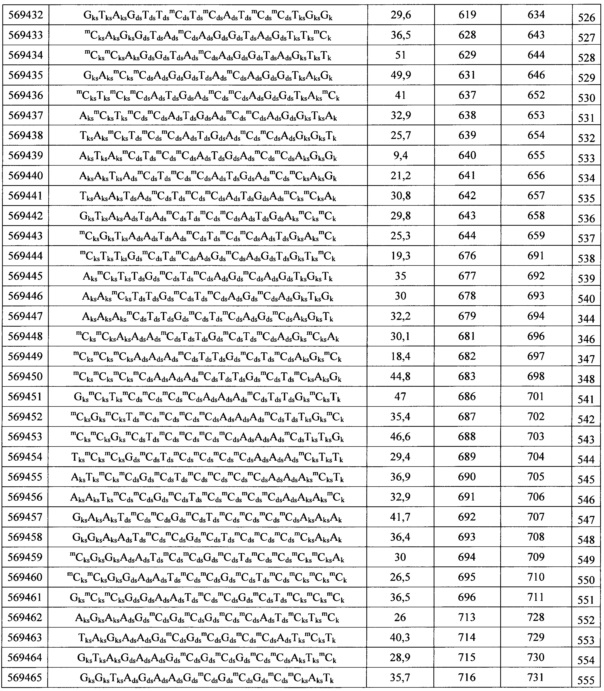
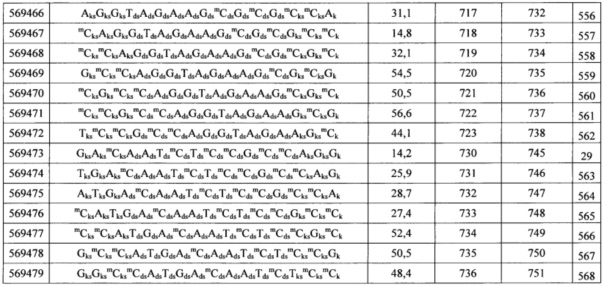

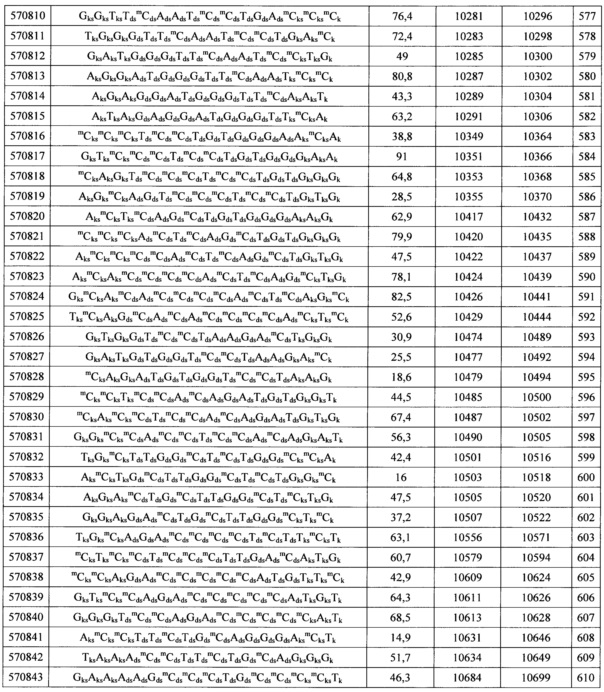
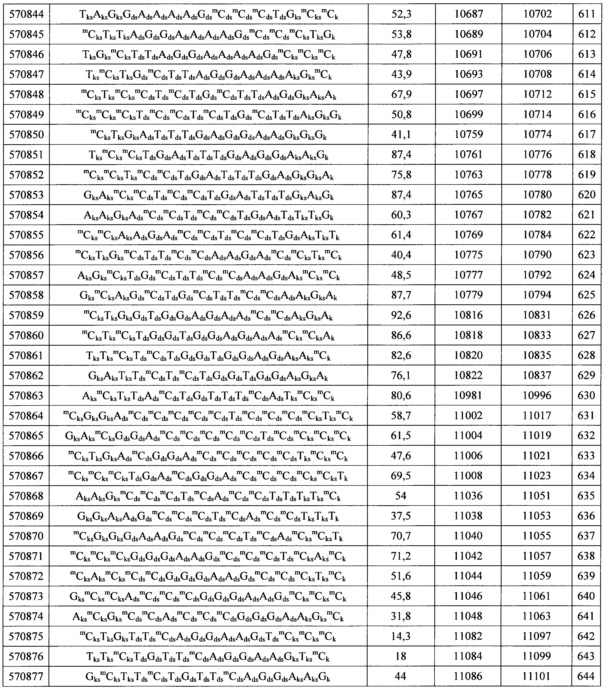
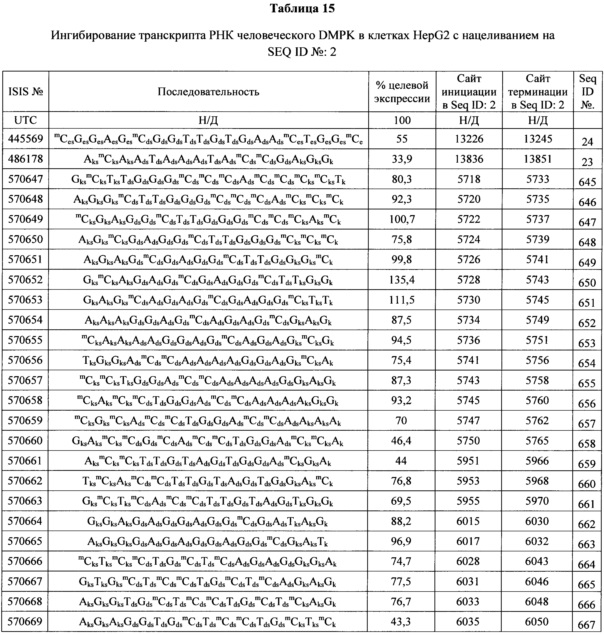
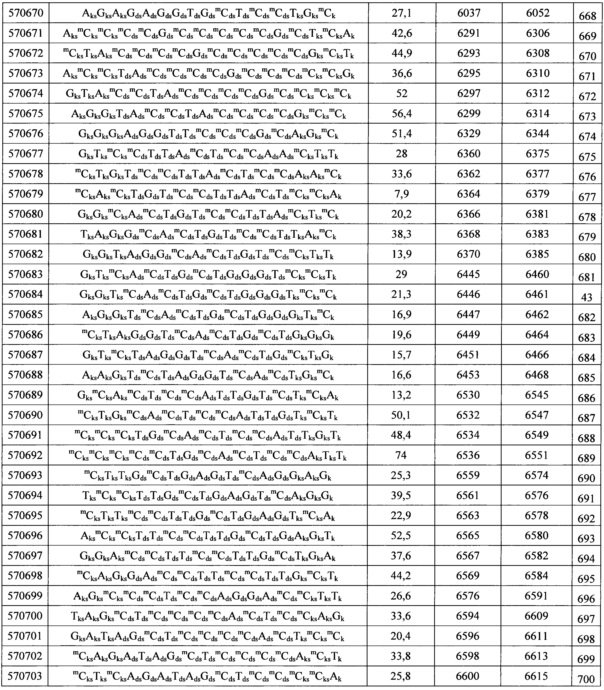
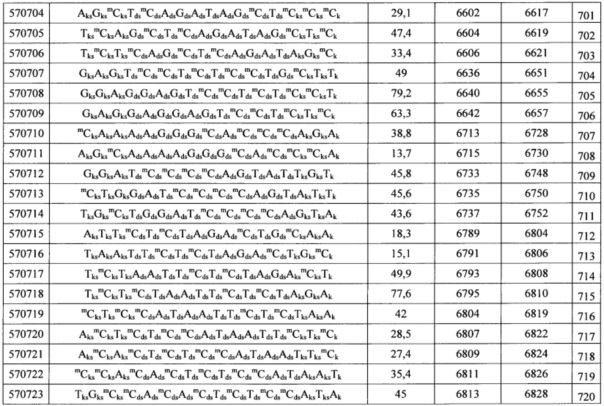

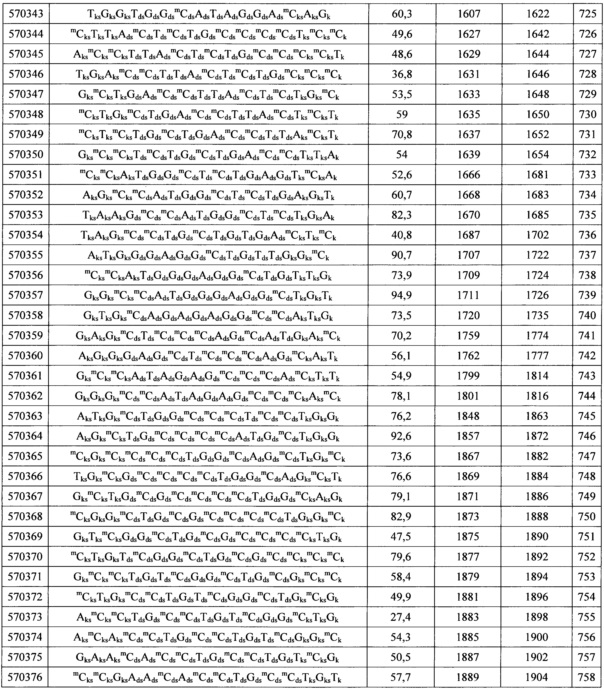
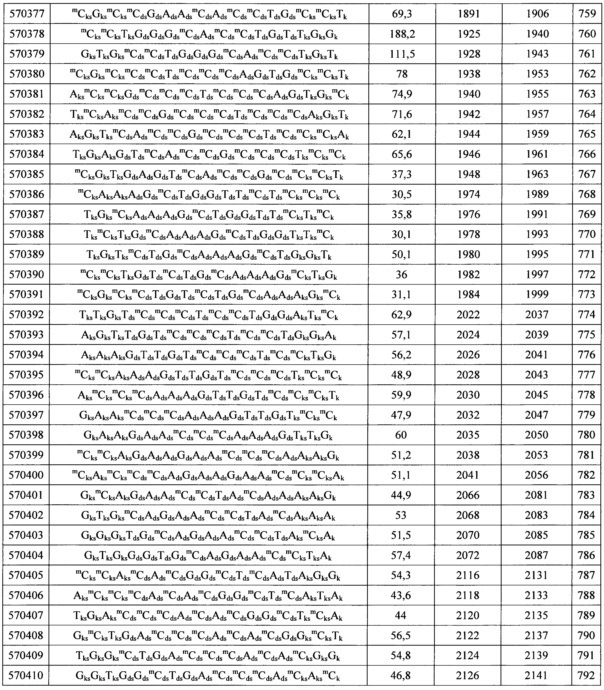

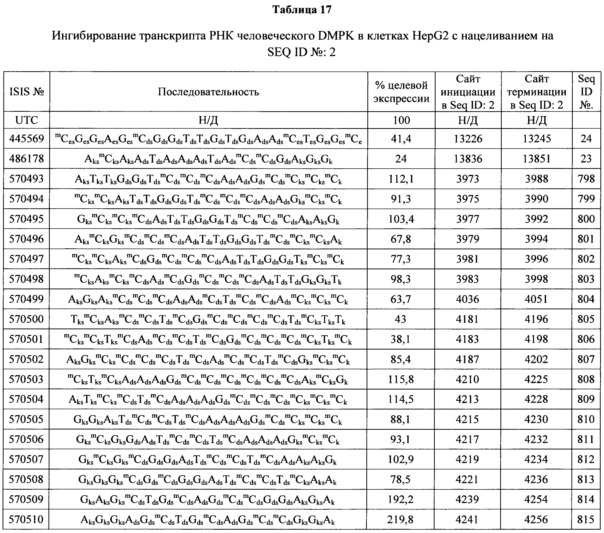
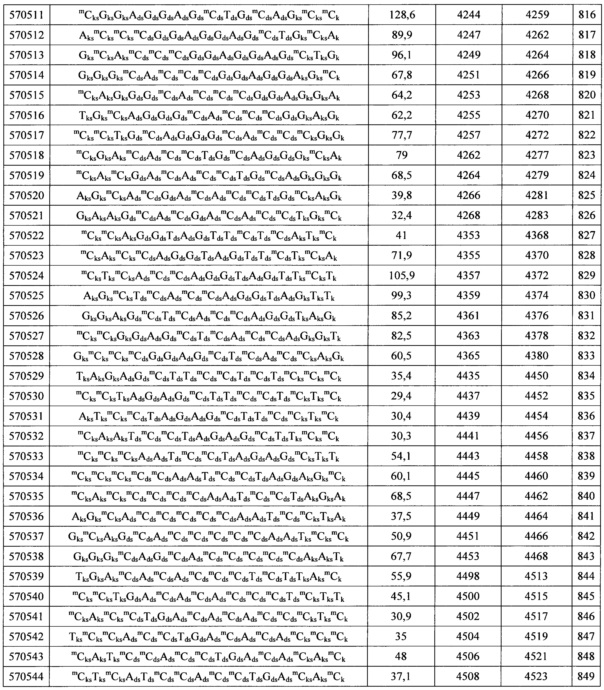
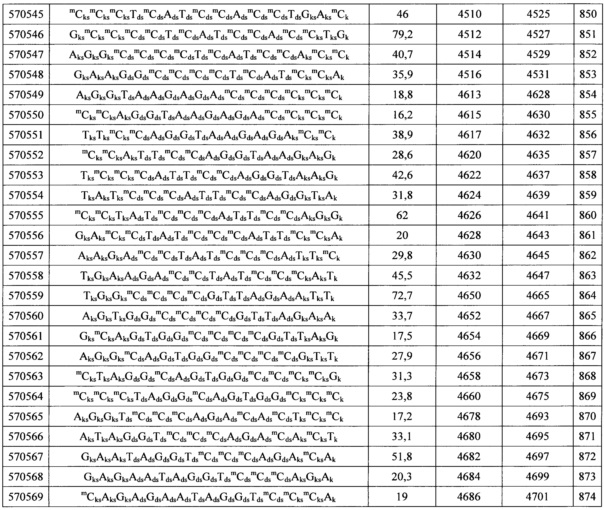
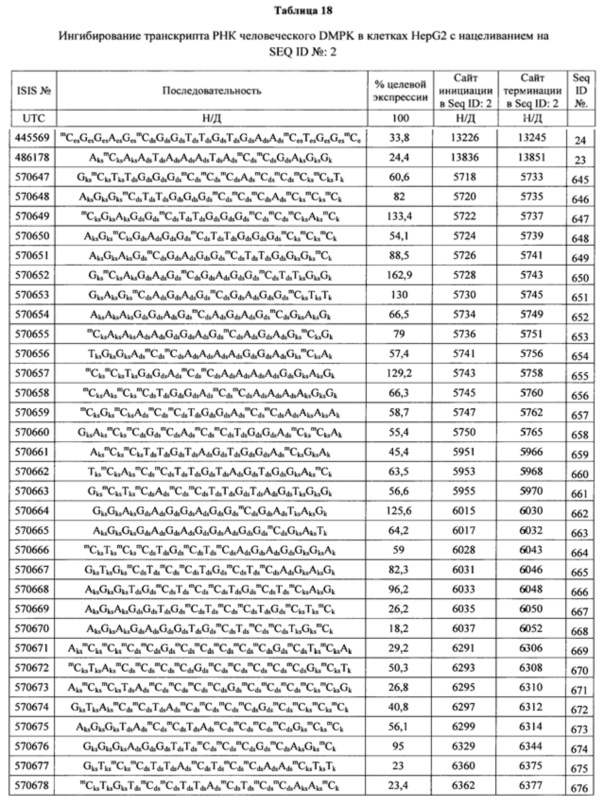
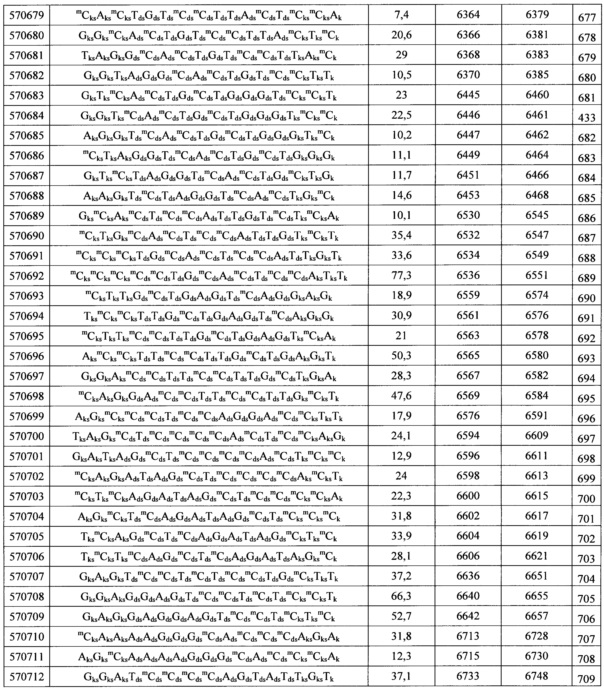
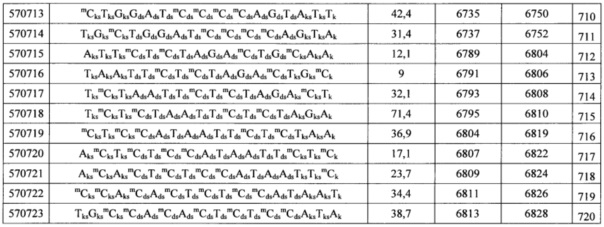
Пример 10: Исследования зависимости доза-ответ с антисмысловыми олигонуклеотидами, нацеленными на человеческую дистрофическую миотонин-протеинкиназу (DMPK), в клетках HepG2
Антисмысловые олигонуклеотиды, нацеленные на нуклеиновую кислоту человеческого DMPK, исследовали в отношении их влияния на транскрипт РНК DMPK in vitro. Культивируемые клетки HepG2 с плотностью 20000 клеток на лунку трансфицировали посредством электропорации концентрациями каждого антисмыслового олигонуклеотида, составлявшими 61,7 нМ, 185,2 нМ, 555,6 нМ, 1666,7 нМ, 5000,0 нМ и 15000,0 нМ. Приблизительно через 24 часа РНК выделяли из клеток и измеряли уровни транскрипта РНК DMPK при помощи количественной ПЦР в режиме реального времени, используя набор праймеров и зондов RTS3164 (прямая последовательность AGCCTGAGCCGGGAGATG, обозначаемая в данном документе как SEQ ID №: 20; обратная последовательность GCGTAGTTGACTGGCGAAGTT, обозначаемая в данном документе как SEQ ID №: 21; последовательность зонда AGGCCATCCGCACGGACAACCX, обозначаемая в данном документе как SEQ ID №: 22). Уровни транскрипта РНК человеческого DMPK корректировали относительно общего содержания РНК, измеренного при помощи RIBOGREEN®. Результаты представлены в виде процента экспрессии человеческого DMPK в сравнении с необработанными контрольными (НК) клетками. Например, если НК соответствует 100, а доза, составляющая 5000 нМ ISIS No. 445569, приводит к % экспрессии человеческого DMPK, равному 35, тогда доза, составляющая 5000 нМ ISIS, снижает экспрессию человеческого DMPK на 65% в сравнении с НК. Концентрация полумаксимального ингибирования (IC50) для каждого олигонуклеотида представлена ниже в таблице и была рассчитана путем построения зависимости от концентраций применяемых олигонуклеотидов процента ингибирования экспрессии мРНК человеческого DMPK, который достигался при каждой концентрации, и нахождения концентрации олигонуклеотида, при которой достигалось 50% ингибирование экспрессии мРНК человеческого DMPK в сравнении с контролем. Результаты представлены в Таблице 19.
Исследуемые последовательности антисмысловых олигонуклеотидов демонстрировали дозозависимое ингибирование уровней мРНК человеческого DMPK в вышеозначенных условиях.
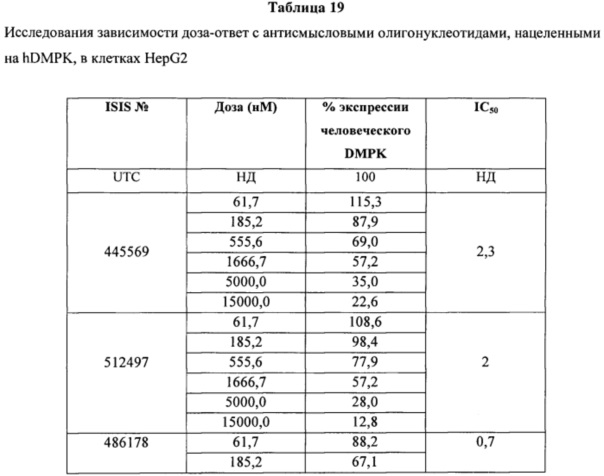
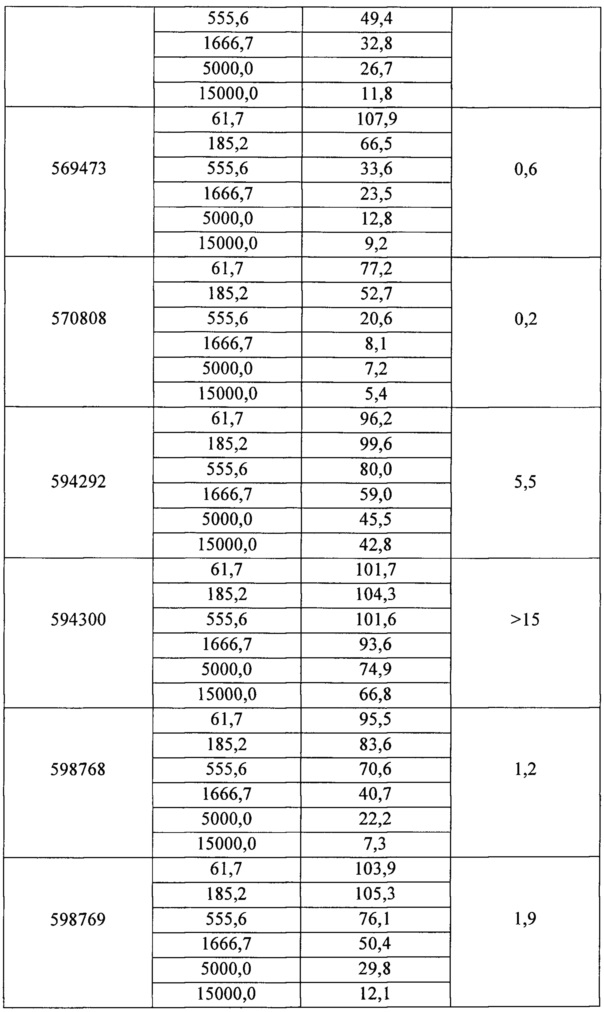
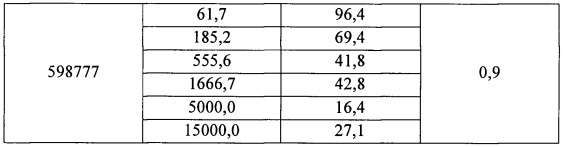
Пример 11: Исследования зависимости доза-ответ с антисмысловыми олигонуклеотидами, нацеленными на человеческую дистрофическую миотонин-протеинкиназу (hDMPK), в клетках миобластов МД1 Штейнерта
Антисмысловые олигонуклеотиды, нацеленные на нуклеиновую кислоту человеческого DMPK, исследовали в отношении их влияния на транскрипт РНК DMPK in vitro. Культивируемые клетки миобластов МД1 Штейнерта с плотностью 20000 клеток на лунку трансфицировали посредством электропорации концентрациями каждого антисмыслового олигонуклеотида, составлявшими 61,7 нМ, 185,2 нМ, 555,6 нМ, 1666,7 нМ, 5000,0 нМ и 15000,0 нМ. Приблизительно через 24 часа РНК выделяли из клеток и измеряли уровни транскрипта РНК DMPK при помощи количественной ПЦР в режиме реального времени, используя вышеописанный набор праймеров и зондов RTS3164. Уровни транскрипта РНК человеческого DMPK корректировали относительно общего содержания РНК, измеренного при помощи RIBOGREEN®. Результаты представлены в виде процента (%) экспрессии человеческого DMPK в сравнении с необработанными контрольными (НК) клетками. Концентрация полумаксимального ингибирования (IC50) для каждого олигонуклеотида представлена ниже в таблице и была рассчитана путем построения зависимости от концентраций применяемых олигонуклеотидов процента ингибирования экспрессии мРНК человеческого DMPK, который достигался при каждой концентрации, и нахождения концентрации олигонуклеотида, при которой достигалось 50% ингибирование экспрессии мРНК человеческого DMPK в сравнении с контролем. Результаты представлены в Таблице 20.
Исследуемые последовательности антисмысловых олигонуклеотидов демонстрировали дозозависимое ингибирование уровней мРНК человеческого DMPK в вышеозначенных условиях.
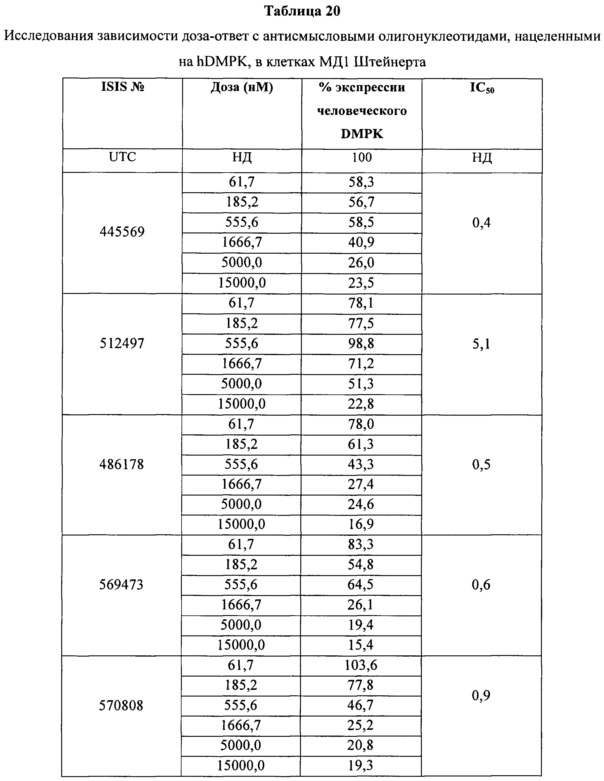
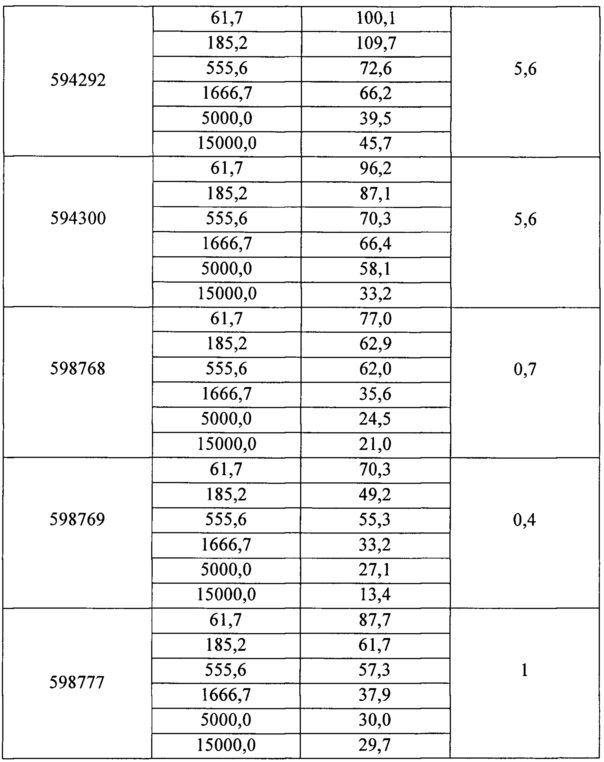
Пример 12: Исследования зависимости доза-ответ с антисмысловыми олигонуклеотидами, нацеленными на дистрофическую миотонин-протеинкиназу (DMPK) макака-резуса, в первичных гепатоцитах яванского макака
Антисмысловые олигонуклеотиды, нацеленные на нуклеиновую кислоту DMPK макака-резуса, исследовали в отношении их влияния на транскрипт РНК DMPK in vitro. Культивируемые первичные гепатоциты яванского макака с плотностью 20000 клеток на лунку трансфицировали посредством электропорации концентрациями каждого антисмыслового олигонуклеотида, составлявшими 61,7 нМ, 185,2 нМ, 555,6 нМ, 1666,7 нМ, 5000,0 нМ и 15000,0 нМ. Приблизительно через 24 часа РНК выделяли из клеток и измеряли уровни транскрипта РНК DMPK при помощи количественной ПЦР в режиме реального времени, используя вышеописанный набор праймеров и зондов RTS3164. Уровни транскрипта РНК DMPK макака-резуса корректировали относительно общего содержания РНК, измеренного при помощи RIBOGREEN®. Результаты представлены в виде процента (%) экспрессии DMPK макака-резуса в сравнении с необработанными контрольными (НК) клетками. Концентрация полумаксимального ингибирования (IC50) для каждого олигонуклеотида представлена ниже в таблице и была рассчитана путем построения зависимости от концентраций применяемых олигонуклеотидов процента ингибирования экспрессии мРНК DMPK макака-резуса, который достигался при каждой концентрации, и нахождения концентрации олигонуклеотида, при которой достигалось 50% ингибирование экспрессии мРНК DMPK макака-резуса в сравнении с контролем.
Исследуемые последовательности антисмысловых олигонуклеотидов демонстрировали дозозависимое ингибирование уровней мРНК DMPK макака-резуса в вышеозначенных условиях.
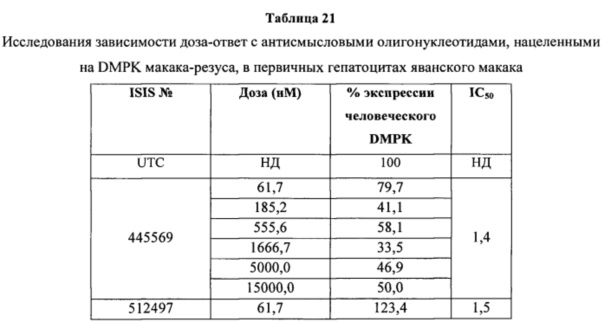
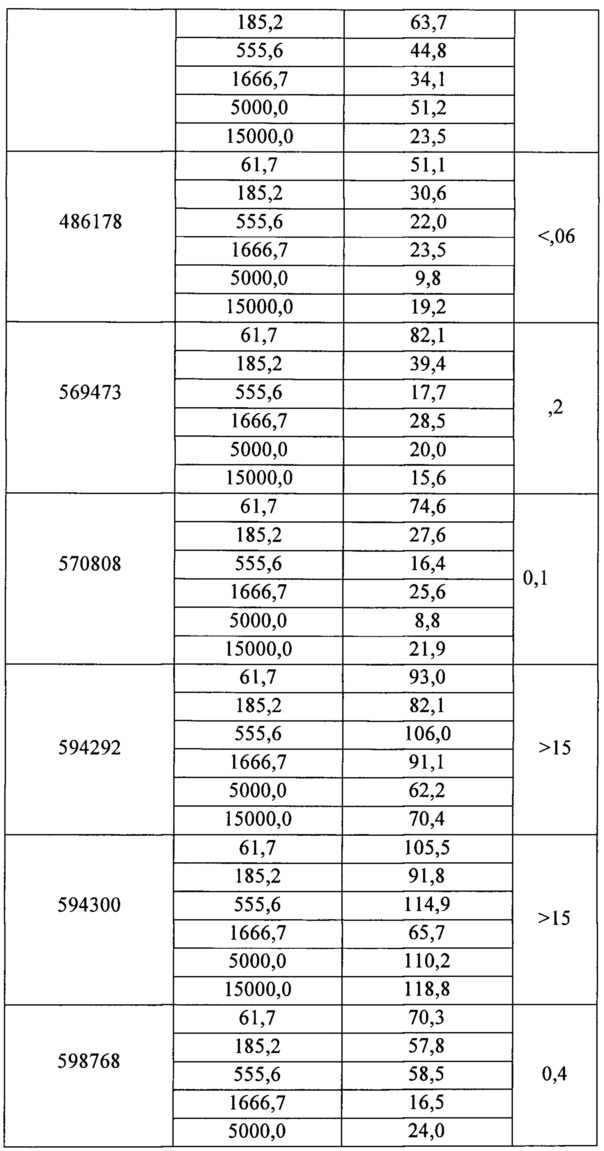
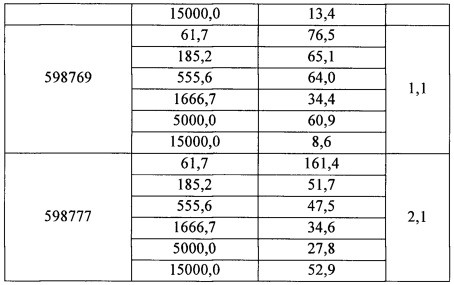
Пример 13: In vivo антисмысловое ингибирование hDMPK у трансгенных мышей DMSXL
Чтобы исследовать влияние антисмыслового ингибирования в случае лечения миотонической дистрофии 1 типа (МД1), требовалась соответствующая мышиная модель. Получали трансгенную мышиную модель DMSXL, несущую ген hDMPK с большими экспансиями, содержащими более 1000 CTG-повторов (Huguet et al., PLOS Genetics, 2012, 8(11), e1003034-e1003043). Такие мыши DMSXL экспрессируют мутантный аллель hDMPK и демонстрируют фенотип, включающий мышечную слабость, сходный с тем, который наблюдается у пациентов с МД1.
ISIS 486178 из Таблицы 1 был выбран и исследован в отношении ингибирования транскрипта hDMPK in vivo. ISIS 445569 был включен в исследование для сравнения.
Обработка
Мышей DMSXL содержали в условиях 12-часового цикла день/ночь и кормили ad libitum нормальным мышиным кормом Purina. Животных акклимировали на протяжении по меньшей мере 7 дней в исследовательском центе перед началом эксперимента. Антисмысловые олигонуклеотиды (АСО) готовили в ФСБ и стерилизовали путем фильтрации через 0,2-микронный фильтр. Для проведения инъекции АСО растворяли в 0,9% ФСБ.
Мыши DMSXL получали подкожные инъекции ISIS 445569 в дозировке 50 мг/кг или ISIS 486178 в дозировке 25 мг/кг дважды в неделю на протяжении 4 недель. Контрольная группа получала подкожные инъекции ФСБ дважды в неделю на протяжении 4 недель. Каждая обрабатываемая группа состояла из 4 животных.
Ингибирование уровней мРНК hDMPK
Через двадцать четыре часа после получения финальной дозы мышей умерщвляли и брали образцы тканей. мРНК выделяли при помощи ПЦР-анализа hDMPK в режиме реального времени и нормировали относительно 18s РНК. Для измерения уровней мРНК использовали набор человеческих праймеров и зондов RTS3164. Результаты выражали в виде среднего процента уровней мРНК hDMPK для каждой обрабатываемой группы в сравнении с ФСБ-контролем.
Набор человеческих праймеров и зондов RTS3164 (прямая последовательность AGCCTGAGCCGGGAGATG, обозначаемая в данном документе как SEQ ID №: 20; обратная последовательность GCGTAGTTGACTGGCGAAGTT, обозначаемая в данном документе как SEQ ID №: 21; последовательность зонда AGGCCATCCGCACGGACAACCX, обозначаемая в данном документе как SEQ ID №: 22).
Как представлено ниже в Таблице 22, обработка антисмысловыми олигонуклеотидами снижала экспрессию транскрипта hDMPK. Результаты свидетельствуют о том, что обработка ISIS 445569 и 486178 приводила к снижению уровней мРНК hDMPK у мышей DMSXL.
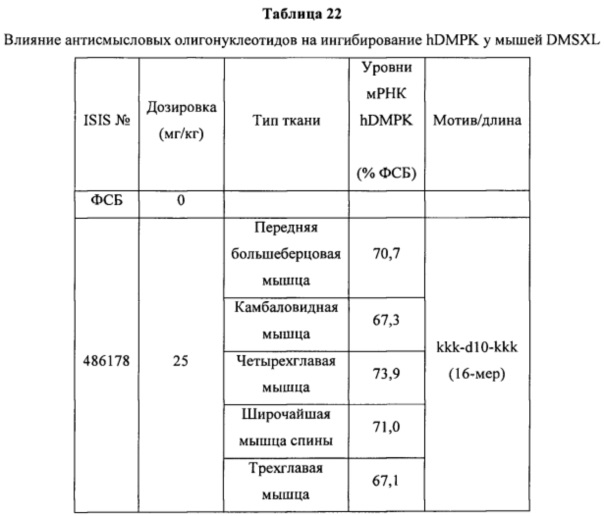

Пример 14: Влияние обработки АСО, нацеленными на hDMPK, на мышечную силу у мышей DMSXL
Тест на захват
Оценивали показатели силы захвата передних конечностей мышей дикого типа (ДТ) и мышей DMSXL, используя коммерческий динамометр для измерения силы захвата, как описано в литературе (Huguet et al., PLOS Genetics, 2012, 8(11), e1003034-e1003043).
Мыши DMSXL получали подкожные инъекции ISIS 486178 в дозировке 25 мг/кг или ISIS 445569 в дозировке 50 мг/кг дважды в неделю на протяжении 4 недель. Контрольная группа DMSXL получала подкожные инъекции ФСБ дважды в неделю на протяжении 4 недель. Каждая обрабатываемая группа состояла из 4 животных. Силу передних конечностей для каждой обрабатываемой группы и для ДТ измеряли на 0, 30 и 60 дни, используя тест на захват.Показатели силы захвата определяли путем измерения разницы в силе между 60 и 0 днями. Результаты представлены в виде средней силы передних конечностей по каждой группе.
Как проиллюстрировано ниже в Таблице 23, обработка АСО, нацеленными на hDMPK, приводила к улучшению мышечной силы у мышей DMSXL по сравнению с необрабатываемыми контрольными мышами. ISIS 486178, АСО с модификациями cEt, демонстрировал значительное улучшение силы передних конечностей (+3,4) по сравнению с ISIS 445569 с модификациями МОЕ (+0,38).
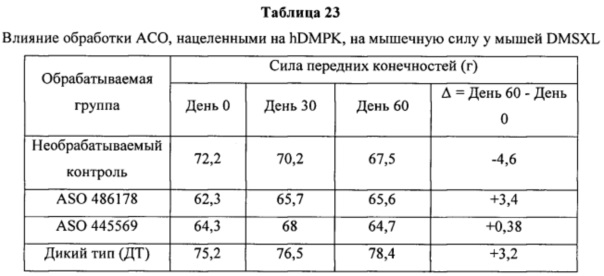
Пример 15: Влияние обработки АСО, нацеленными на hDMPK, на распространение мышечных волокон у мышей DMSXL
Также оценивали распространение мышечных волокон у мышей DMSXL с нацеливанием на hDMPK в присутствии и отсутствие ISIS 445569 и 486178. Оба АСО были ранее описаны выше в Таблице 1.
Мыши DMSXL получали подкожные инъекции ISIS 486178 в дозировке 25 мг/кг или ISIS 445569 в дозировке 50 мг/кг дважды в неделю на протяжении 4 недель. Контрольная группа DMSXL получала подкожные инъекции ФСБ дважды в неделю на протяжении 4 недель. Каждая обрабатываемая группа состояла из 4 животных. Оценивали распространение мышечных волокон, а результаты представлены ниже в Таблице 44.
Как проиллюстрировано, обработка АСО, нацеленными на hDMPK, приводила к снижению распространения мышечных волокон, ассоциированных с МД1 типа 2 с, в передних большеберцовых мышцах (ПБМ) мышей DMSXL по сравнению с необрабатываемыми контрольными мышами. Результаты демонстрируют, что при лечении АСО можно восстановить нормальное распространение волокон в скелетных мышцах. ISIS 445569 демонстрировал улучшение в распространении мышечных волокон по сравнению с необрабатываемыми контрольными мышами; при этом ISIS 486178, АСО с модификациями cEt, демонстрировал такое распространение мышечных волокон, которое больше соответствовало распространению мышечных волокон, наблюдаемому у мышей дикого типа.
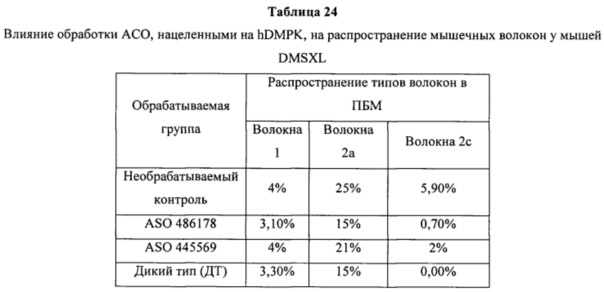
Пример 16: Дозозависимое антисмысловое ингибирование hDMPK у трансгенных мышей DMSXL
Сконструированные АСО из Таблицы 1, выше, дополнительно оценивали, проводя исследование доза-ответ для антисмыслового ингибирования транскрипта hDMPK in vivo. ISIS 445569 был включен в исследование для сравнения.
Обработка
Мышей DMSXL содержали в условиях 12-часового цикла день/ночь и кормили ad libitum нормальным мышиным кормом Purina. Животных акклимировали на протяжении по меньшей мере 7 дней в исследовательском центе перед началом эксперимента. Антисмысловые олигонуклеотиды (АСО) готовили в ФСБ и стерилизовали путем фильтрации через 0,2-микронный фильтр. Для проведения инъекции АСО растворяли в 0,9% ФСБ.
Мыши DMSXL получали подкожные инъекции ФСБ или АСО из Таблицы 1, выше, нацеленных на hDMPK. Дозирование АСО проводили дважды в неделю на протяжении 4 недель в дозах, указанных ниже в Таблице 25. Контрольная группа получала подкожные инъекции ФСБ дважды в неделю на протяжении 4 недель. Каждая обрабатываемая группа состояла из 4 животных.
Ингибирование уровней мРНК hDMPK
Через сорок восемь часов после получения финальной дозы мышей умерщвляли и выделяли ткани из передних большеберцовых мышц, четырехглавых мышц (левых), икроножных мышц, сердца и диафрагмы. мРНК выделяли для проведения ПЦР-анализа hDMPK в режиме реального времени и нормировали относительно RIBOGREEN®. Для измерения уровней мРНК использовали набор человеческих праймеров и зондов RTS3164. Результаты, обобщенные ниже в Таблице 25, были независимо получены в разных исследованиях доза-ответ. Результаты выражали в виде среднего процента экспрессии мРНК hDMPK для каждой обрабатываемой группы в сравнении с ФСБ-контролем.
Как показано, обработка антисмысловыми олигонуклеотидами приводила к дозозависимому снижению экспрессии транскрипта hDMPK.
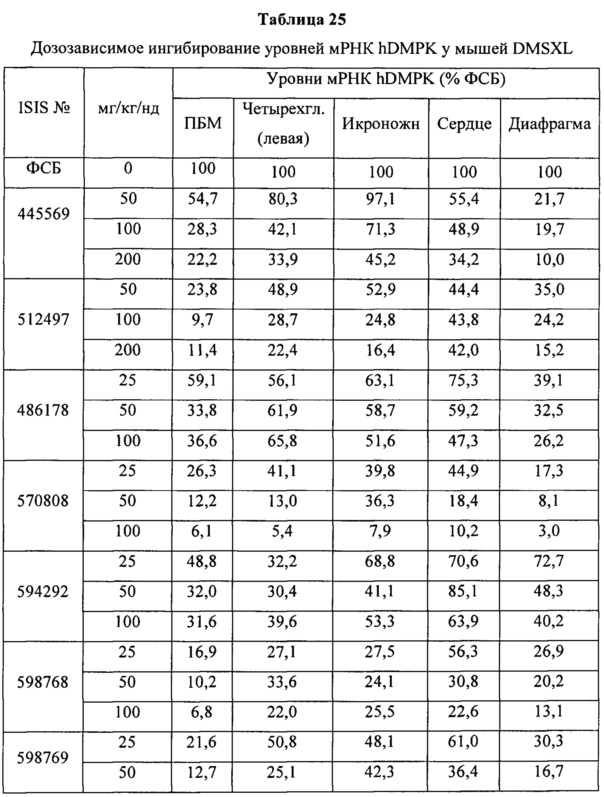
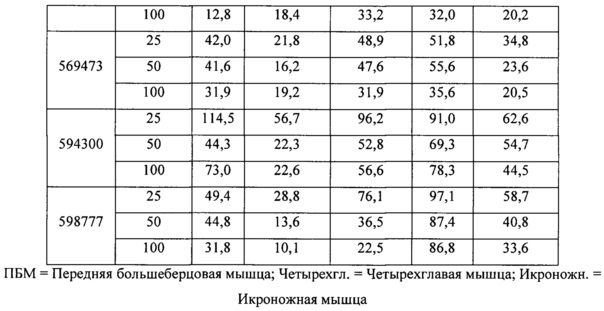
Пример 17: Шестинедельное исследование in vivo переносимости на мышах CD-1
Сконструированные АСО из Таблицы 1, выше, дополнительно оценивали, проводя 6-недельное исследование для оценки химии плазмы, массы тела/органов и гистологии. Группам мышей CD-1 вводили 100 мг/кг/нд ISIS 445569 или ISIS 512497. Дополнительным группам мышей CD-1 вводили 50 мг/кг/нд ISIS 486178, ISIS 570808, ISIS 594292, ISIS 598768, ISIS 598769, ISIS 569473, ISIS 594300 и ISIS 598777. Через шесть недель и два дня после получения каждой группой мышей последней дозы мышей умерщвляли и брали образцы тканей для анализа. Для каждой группы мышей проводили измерения уровней аланинтрансаминазы, уровней аспартатаминотрансферазы, уровней азота мочевины крови (АМК), уровней альбумина, общего билирубина и уровней креатина. Кроме того, также проводили измерения массы органов, результаты которых представлены ниже в таблицах.
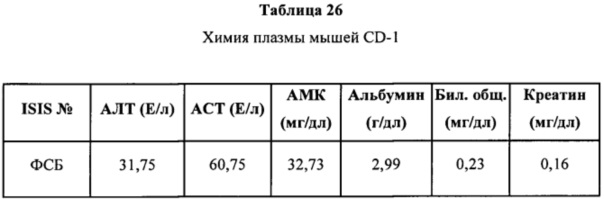
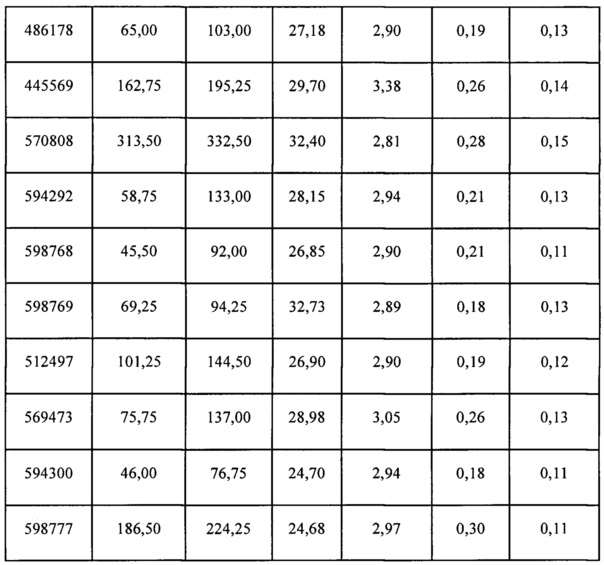
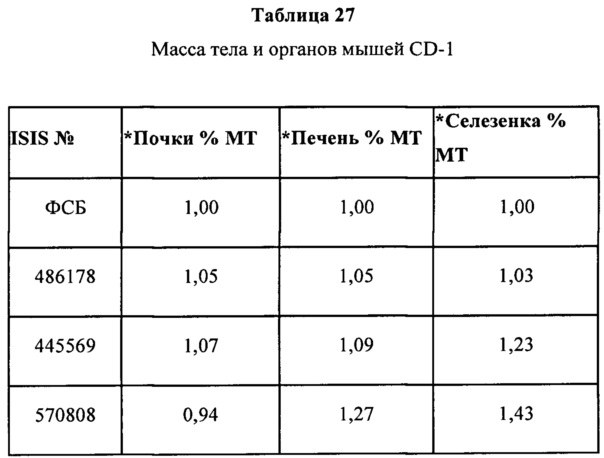
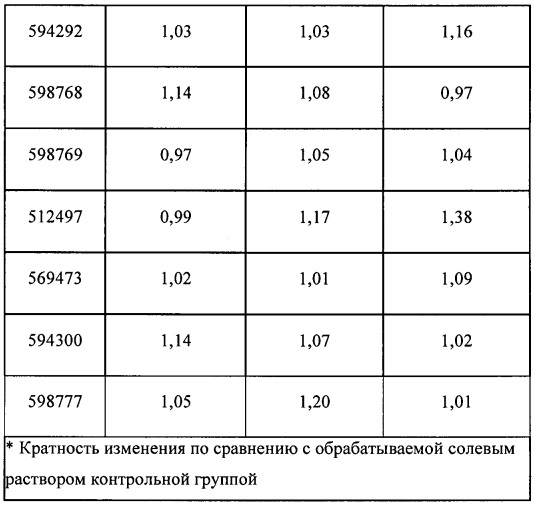
Пример 18: Шестинедельное исследование in vivo переносимости на крысах Спрег-Доули
Сконструированные АСО из Таблицы 1, выше, дополнительно оценивали, проводя 6-недельное исследование для оценки химии плазмы, массы тела/органов и гистологии. Группам крыс Спрег-Доули вводили 100 мг/кг/нд ISIS 445569 или ISIS 512497. Дополнительным группам крыс Спрег-Доули вводили 50 мг/кг/нд ISIS 486178, ISIS 570808, ISIS 594292, ISIS 598768, ISIS 598769, ISIS 569473, ISIS 594300 и ISIS 598777. Через шесть недель и два дня после получения каждой группой мышей последней дозы мышей умерщвляли и брали образцы тканей для анализа. Для каждой группы крыс проводили измерения уровней аланинтрансаминазы, уровней аспартатаминотрансферазы, уровней азота мочевины крови (АМК), уровней альбумина, общего билирубина, уровней креатина и уровней креатина в моче. Кроме того, также проводили измерения массы органов, результаты которых представлены ниже в таблицах.
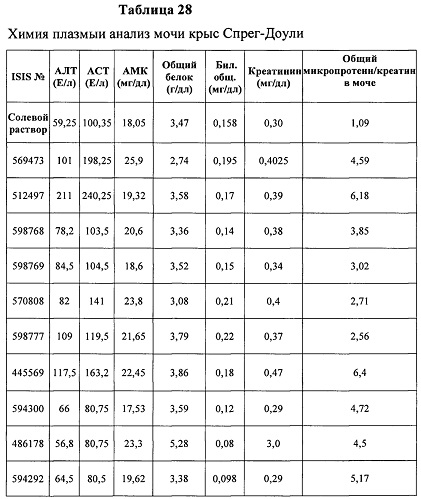

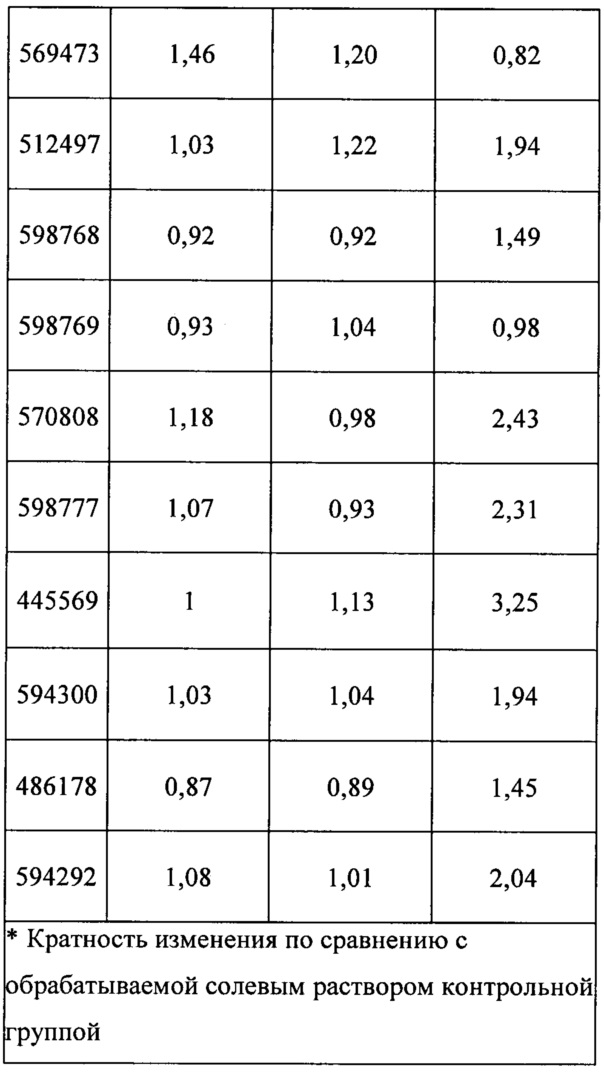
Пример 19: Тринадцати(13)-недельное исследование in vivo на яванских макаках
Группам из 4 самцов яванских макаков вводили 40 мг/кг/нд ISIS 445569, ISIS 512497, ISIS 486178, ISIS 570808, ISIS 594292, ISIS 598768, ISIS 598769, ISIS 569473, ISIS 594300 и ISIS 598777 путем подкожной инъекции. Через тринадцать недель после первой дозы животных умерщвляли и проводили анализ тканей. мРНК выделяли для проведения ПЦР-анализа DMPK макака-резуса в режиме реального времени и нормировали относительно RIBOGREEN®. Для измерения уровней мРНК использовали набор праймеров и зондов RTS3164 (описанный выше), а результаты приведены ниже в Таблице 30. Кроме того, дополнительно выделяли мРНК для проведения ПЦР-анализа DMPK макака-резуса в режиме реального времени и нормировали относительно RIBOGREEN®, используя набор праймеров и зондов RTS4447, а результаты приведены ниже в Таблице 31. RTS4447 (прямая последовательность AGCCTGAGCCGGGAGATG, обозначаемая в данном документе как SEQ ID №: 20; обратная последовательность GCGTAGTTGACTGGCGAAGTT, обозначаемая в данном документе как SEQ ID №: 21; последовательность зонда AGGCCATCCGCACGGACAACCX, обозначаемая в данном документе как SEQ ID №: 22).
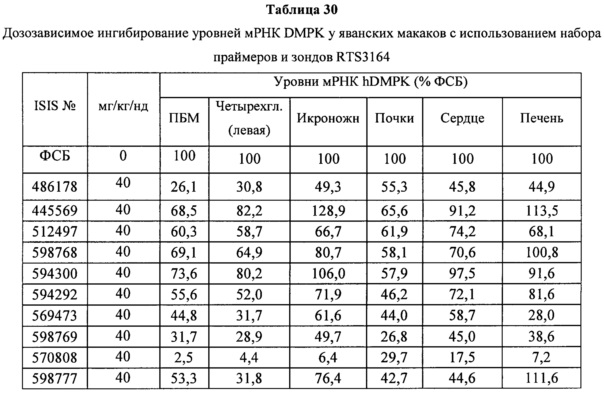
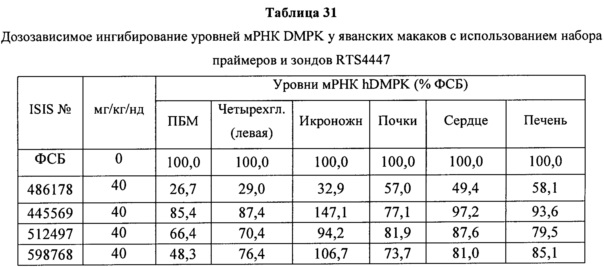
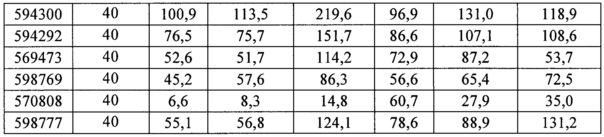
Пример 20: Тринадцати(13)-недельное исследование in vivo переносимости на яванских макаках
Группам самцов яванских макаков вводили 40 мг/кг ISIS 445569, ISIS 512497, ISIS 486178, ISIS 570808, ISIS 594292, ISIS 598768, ISIS 598769, ISIS 569473, ISIS 594300 и ISIS 598777 путем подкожной инъекции на 1, 3, 5 и 7 дни. На 7 день после введения каждой обезьяне вводили 40 мг/кг/нд ISIS 445569, ISIS 512497, ISIS 486178, ISIS 570808, ISIS 594292, ISIS 598768, ISIS 598769, ISIS 569473, ISIS 594300 и ISIS 598777 путем подкожной инъекции.
Через 48 часов после того, как каждая обезьяна получила подкожную дозу на 28 и 91 дни, брали образцы крови и мочи для проведения анализа. У некоторых обезьян кровь и мочу брали через 48 часов после дозирования, проведенного на 56 день. Для каждого животного в обрабатываемой группе измеряли уровни аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (ACT), лактатдегидрогеназы (ЛДГ) и креатинкиназы (КК), чьи средние величины представлены ниже в таблице. Дни сбора образцов со знаком минус означают временную точку до начала обработки. Например, -7 день обработки означает, что образцы брали за 7 дней до введения первой дозы. Через тринадцать недель после первой дозы животных умерщвляли и проводили анализ тканей.
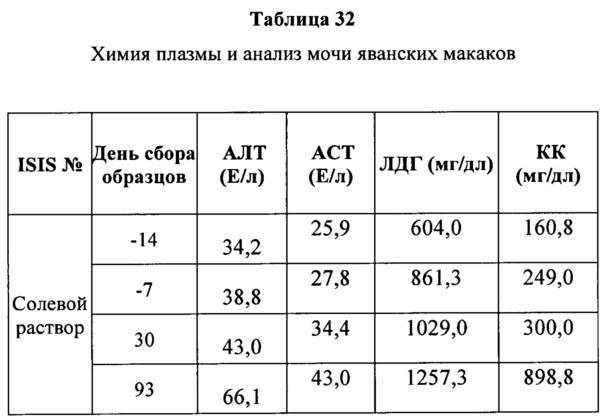
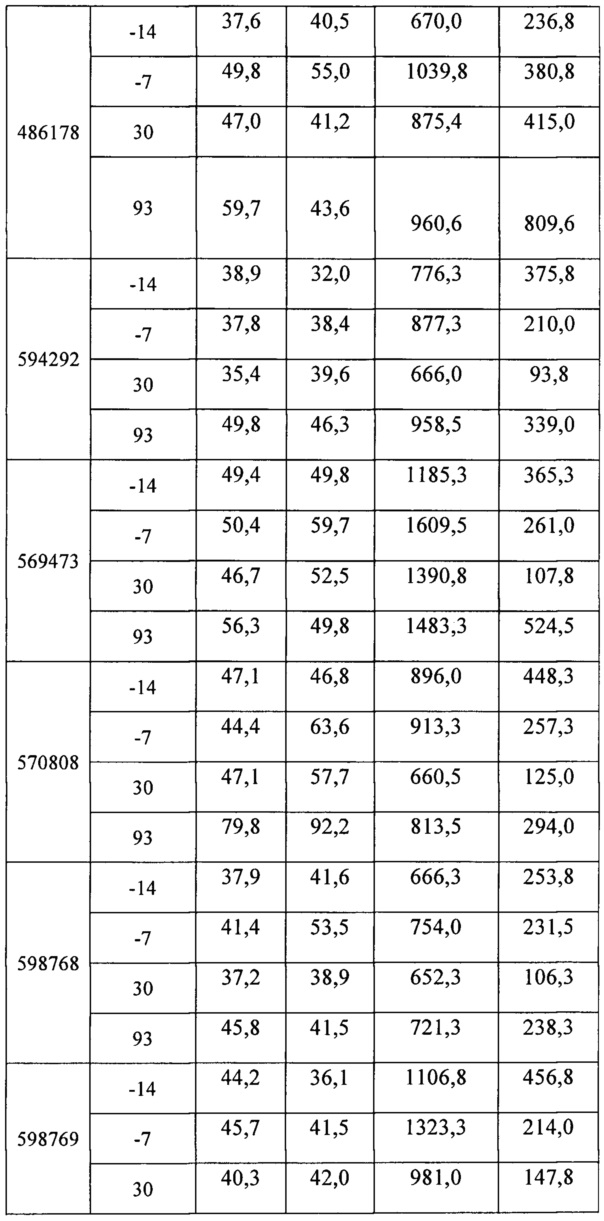
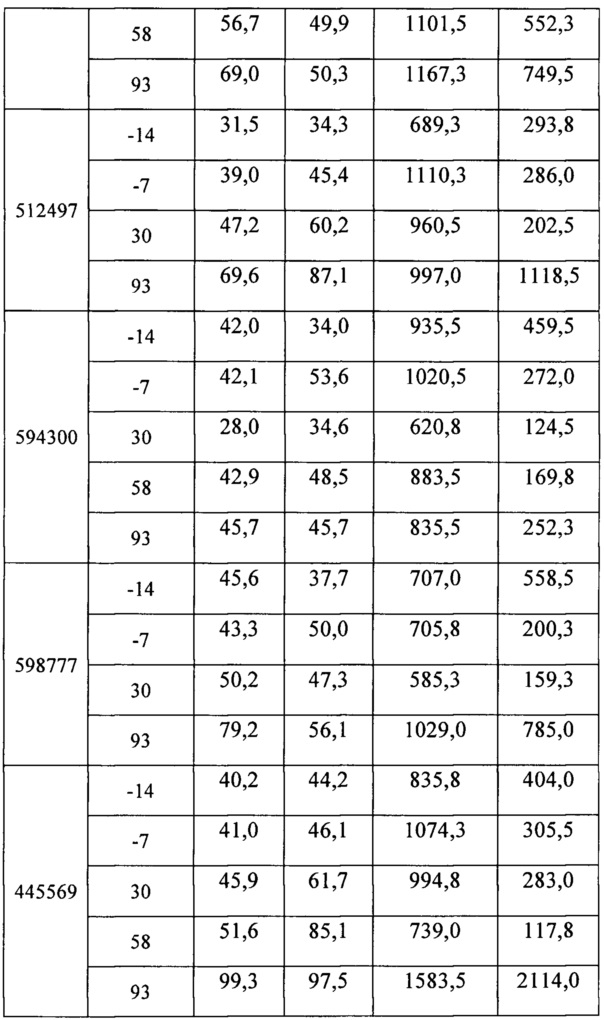
| название | год | авторы | номер документа |
|---|---|---|---|
| МОДУЛЯЦИЯ ЭКСПРЕССИИ АНГИОПОЭТИН-ПОДОБНОГО БЕЛКА 3 | 2014 |
|
RU2706964C2 |
| КОМПОЗИЦИИ ДЛЯ МОДУЛИРОВАНИЯ ЭКСПРЕССИИ SOD-1 | 2015 |
|
RU2704619C2 |
| КОМПОЗИЦИИ ДЛЯ МОДУЛЯЦИИ ЭКСПРЕССИИ АТАКСИНА 2 | 2015 |
|
RU2702838C2 |
| Модулирование экспрессии рецептора андрогенов | 2013 |
|
RU2670486C9 |
| МОДУЛЯЦИЯ ЭКСПРЕССИИ ФАКТОРА 11 | 2009 |
|
RU2535964C2 |
| МОДУЛЯЦИЯ ЭКСПРЕССИИ ФАКТОРА 11 | 2014 |
|
RU2739594C2 |
| МОДУЛЯТОРЫ РЕЦЕПТОРА ГОРМОНА РОСТА | 2014 |
|
RU2700244C2 |
| МОДУЛЯТОРЫ ФАКТОРА В КОМПЛЕМЕНТА | 2014 |
|
RU2662967C2 |
| КОМПОЗИЦИИ И СПОСОБЫ МОДУЛИРОВАНИЯ ЭКСПРЕССИИ АПОЛИПОПРОТЕИНА (А) | 2014 |
|
RU2699985C2 |
| МОДУЛИРОВАНИЕ ЭКСПРЕССИИ АПОЛИПОПРОТЕИНА С-III (АРОСIII) У ПАЦИЕНТОВ С ЛИПОДИСТРОФИЕЙ | 2016 |
|
RU2737719C2 |



















































































































































































Изобретение относится к биотехнологии. Описаны соединения для снижения экспрессии мРНК DMPK, содержащие модифицированный олигонуклеотид, состоящий из 10-30 связанных нуклеозидов и имеющий по меньшей мере один модифицированный сахарный компонент, модифицированную межнуклеозидную связь и/или модифицированное нуклеотидное основание, при этом указанная нуклеотидная последовательность модифицированного олигонуклеотида по меньшей мере на 90% комплементарна SEQ ID NO: 1 и/или SEQ ID NO: 2 на протяжении всей длины модифицированного олигонуклеотида. Также описано соединение для снижения экспрессии мРНК DMPK, содержащее модифицированный олигонуклеотид, имеющий нуклеотидную последовательность, приведенную в SEQ ID NO: 30, при этом модифицированный олигонуклеотид состоит из 16 связанных нуклеозидов и содержит: гэп-сегмент, состоящий из восьми связанных дезоксинуклеозидов; сегмент 5' крыла, состоящий из четырех связанных нуклеозидов и имеющий мотив Е-Е-K-K в 5' крыле; сегмент 3' крыла, состоящий из четырех связанных нуклеозидов и имеющий мотив K-K-Е-Е в 3' крыле; при этом гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла; при этом каждое Е представляет 2'-O-метоксиэтиловый сахар и каждое K представляет cEt-сахар; при этом каждая межнуклеозидная связь представляет собой тиофосфатную межнуклеозидную связь и при этом каждый остаток цитозина представляет собой 5-метилцитозин. Представлены композиция и способ лечения миотонической дистрофии 1 типа у животного. Изобретение позволяет снижать экспрессию мРНК и белка DMPK у животного. 10 н. и 18 з.п. ф-лы, 32 табл., 20 пр.
1. Соединение для снижения экспрессии мРНК DMPK, содержащее модифицированный олигонуклеотид, состоящий из 10-30 связанных нуклеозидов и имеющий по меньшей мере один модифицированный сахарный компонент, модифицированную межнуклеозидную связь и/или модифицированное нуклеотидное основание, при этом модифицированный олигонуклеотид имеет нуклеотидную последовательность, содержащую часть из по меньшей мере 8 смежных нуклеотидных оснований, на 100% комплементарных части равной длины нуклеотидных оснований 1343-1368 SEQ ID NO: 1 или нуклеотидных оснований 8603-8619 SEQ ID NO: 2, при этом указанная нуклеотидная последовательность модифицированного олигонуклеотида по меньшей мере на 90% комплементарна SEQ ID NO: 1 и/или SEQ ID NO: 2 на протяжении всей длины модифицированного олигонуклеотида.
2. Соединение для снижения экспрессии мРНК DMPK, содержащее модифицированный олигонуклеотид, состоящий из 10-30 связанных нуклеозидов, при этом модифицированный олигонуклеотид имеет по меньшей мере один модифицированный сахарный компонент, модифицированную межнуклеозидную связь и/или модифицированное нуклеотидное основание, где модифицированный олигонуклеотид имеет нуклеотидную последовательность, содержащую часть из по меньшей мере 8 смежных нуклеотидных оснований любой из SEQ ID NO: 30, 25, 26, 123, 124, 125, 126, 127, 128, 378, 379, 380, 381, 382, 383 и 384, при этом указанная нуклеотидная последовательность модифицированного олигонуклеотида по меньшей мере на 90% комплементарна SEQ ID NO: 1 и/или SEQ ID NO: 2 на протяжении всей длины модифицированного олигонуклеотида.
3. Соединение по п. 1 или 2, отличающееся тем, что модифицированный олигонуклеотид представляет собой одноцепочечный олигонуклеотид.
4. Соединение по п. 1 или 2, отличающееся тем, что по меньшей мере один нуклеозид содержит модифицированное нуклеотидное основание.
5. Соединение по п. 4, отличающееся тем, что модифицированное нуклеотидное основание представляет собой 5-метилцитозин.
6. Соединение по п. 1 или 2, отличающееся тем, что по меньшей мере одна межнуклеозидная связь представляет собой модифицированную межнуклеозидную связь.
7. Соединение по п. 1 или 2, отличающееся тем, что каждая межнуклеозидная связь представляет собой тиофосфатную межнуклеозидную связь.
8. Соединение по п. 1 или 2, отличающееся тем, что по меньшей мере один нуклеозид содержит модифицированный сахар.
9. Соединение по п. 8, отличающееся тем, что по меньшей мере два нуклеозида содержат модифицированный сахар.
10. Соединение по п. 9, отличающееся тем, что каждый из модифицированных сахаров имеет одинаковую модификацию.
11. Соединение по п. 9, отличающееся тем, что по меньшей мере один из модифицированных сахаров имеет иную модификацию.
12. Соединение по п. 8, отличающееся тем, что модифицированный сахар представляет собой бициклический сахар.
13. Соединение по п. 12, отличающееся тем, что бициклический сахар выбран из cEt, LNA, α-L-LNA, ENA и 2'-тио LNA.
14. Соединение по п. 1 или 2, отличающееся тем, что по меньшей мере один нуклеозид, содержащий модифицированный сахар, представляет собой 2'-замещенный нуклеозид.
15. Соединение по п. 14, отличающееся тем, что 2'-замещенный нуклеозид выбран из: 2'-ОСН3, 2'-F и 2'-O-метоксиэтила.
16. Соединение по п. 1 или 2, отличающееся тем, что модифицированный олигонуклеотид содержит:
a. гэп-сегмент, состоящий из связанных дезоксинуклеозидов;
b. сегмент 5' крыла, состоящий из связанных нуклеозидов;
c. сегмент 3' крыла, состоящий из связанных нуклеозидов;
d. при этом гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла, и каждый нуклеозид каждого сегмента крыла содержит модифицированный сахар.
17. Соединение по п. 1 или 2, отличающееся тем, что модифицированный олигонуклеотид состоит из 16, 17, 18, 19 или 20 связанных нуклеозидов.
18. Соединение для снижения экспрессии мРНК DMPK, содержащее модифицированный олигонуклеотид, имеющий нуклеотидную последовательность, приведенную в SEQ ID NO: 30, при этом модифицированный олигонуклеотид состоит из 16 связанных нуклеозидов и содержит:
a. гэп-сегмент, состоящий из восьми связанных дезоксинуклеозидов;
b. сегмент 5' крыла, состоящий из четырех связанных нуклеозидов и имеющий мотив Е-Е-K-K в 5' крыле;
c. сегмент 3' крыла, состоящий из четырех связанных нуклеозидов и имеющий мотив K-K-Е-Е в 3' крыле;
d. при этом гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла;
e. при этом каждое Е представляет 2'-O-метоксиэтиловый сахар и каждое K представляет cEt-сахар;
f. при этом каждая межнуклеозидная связь представляет собой тиофосфатную межнуклеозидную связь и
g. при этом каждый остаток цитозина представляет собой 5-метилцитозин.
19. Соединение по п. 2, при этом соединение имеет нуклеотидную последовательность, приведенную в SEQ ID NO: 25, при этом модифицированный олигонуклеотид состоит из 20 связанных нуклеозидов и содержит:
a. гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов;
b. сегмент 5' крыла, состоящий из пяти связанных нуклеозидов;
c. сегмент 3' крыла, состоящий из пяти связанных нуклеозидов;
d. при этом гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла;
e. при этом каждый нуклеозид каждого сегмента крыла содержит 2'-O-метоксиэтиловый сахар;
f. при этом каждая межнуклеозидная связь представляет собой тиофосфатную межнуклеозидную связь и
g. при этом каждый остаток цитозина представляет собой 5-метилцитозин.
20. Соединение по п. 2, при этом соединение имеет нуклеотидную последовательность, приведенную в SEQ ID NO: 26, при этом модифицированный олигонуклеотид состоит из 16 связанных нуклеозидов и содержит:
а. гэп-сегмент, состоящий из восьми связанных дезоксинуклеозидов;
b. сегмент 5' крыла, состоящий из четырех связанных нуклеозидов и имеющий мотив Е-Е-K-K в 5' крыле;
c. сегмент 3' крыла, состоящий из четырех связанных нуклеозидов и имеющий мотив K-K-Е-Е в 3' крыле;
d. при этом гэп-сегмент расположен между сегментом 5' крыла и сегментом 3' крыла;
e. при этом каждое Е представляет 2'-О-метоксиэтиловый сахар и каждое К представляет cEt-сахар;
f. при этом каждая межнуклеозидная связь представляет собой тиофосфатную межнуклеозидную связь и
g. при этом каждый остаток цитозина представляет собой 5-метилцитозин.
21. Соединение по любому из пп. 1, 2 или 18-20, при этом соединение представляет собой конъюгированное соединение.
22. Композиция для лечения миотонической дистрофии 1 типа, содержащая соединение по любому из пп. 1, 2 или 18-20 и фармацевтически приемлемый носитель или разбавитель.
23. Способ лечения миотонической дистрофии 1 типа у животного, включающий введение нуждающемуся в этом животному соединения по любому из пп. 1, 2 или 18-20.
24. Способ лечения миотонической дистрофии 1 типа у животного, включающий введение нуждающемуся в этом животному композиции по п. 22.
25. Применение соединения по любому из пп. 1, 2 или 18-20 для лечения миотонической дистрофии 1 типа у животного.
26. Применение композиции по п. 22 для лечения миотонической дистрофии 1 типа у животного.
27. Применение соединения по любому из пп. 1, 2 или 18-20 для изготовления лекарственного средства для лечения животного с миотонической дистрофией 1 типа.
28. Применение композиции по п. 22 для изготовления лекарственного средства для лечения животного с миотонической дистрофией 1 типа.
| WO 2012012443 A2, 26.01.2012 | |||
| RU 2011127211 A, 10.01.2013. |
Авторы
Даты
2019-05-31—Публикация
2014-08-11—Подача