Изобретение относится к медицине, в частности, к токсикологии веществ в наноразмерном состоянии (нанотоксикологии) и может быть использовано для снижения неблагоприятных эффектов комбинированного действия наночастиц оксидов алюминия (Аl2О3), титана (ТiO2) и кремния (SiO2) на организм в группах риска, охватывающих лиц, которые подвергаются такому воздействию в производственных условиях (в частности, при выплавке алюминий-титановых лигатур).
Опубликованы работы, в которых различными тестами и на различных биологических объектах демонстрируется, что цитотоксическое, системно-токсическое и генотоксическое действие элементных и элементо-оксидных частиц нанометрового диапазона значительно выше, чем соответствующее вредное действие химически аналогичных частиц с размерами >100 нм (например, Katsnelson, В.A.; Privalova L.I.; Sutunkova, М.Р.; Minigalieva, I.A.; Gurvich V.B.; Shur V.Y.; Shishkina E.V.; Makeyev, O.H.; Valamina I.E.; Varaksin A.N; Panov V.G. Experimental research into metallic and metal oxide nanoparticle toxicity in vivo, In: B. Yan, H. Zhou, J. Gardea-Torresdey (Eds.). "Bioactivity of Engineered Nanoparticles", Springer, 2017, Chapter 11., 259-319.)
В частности, имеется много экспериментальных данных о высокой токсичности и опасности наночастиц ТiО2 (например, Bermudez, Е.; Mangum, J.В; Wong, В.А; Asgharian В.; Hext P.M.; Warheit D.B.; Everitt J.I Pulmonary responses of mice, rats, and hamsters to subchronic inhalation of ultrafine titanium dioxide particles. Toxicol Sci. 2004, 77(2), 347-357; Grassian, V.H.; O'Shaughnessy, P.T.; Adamcakova-Dodd A.; Pettibone J.M.; Thorne P.S. Inhalation exposure study of titanium dioxide nanoparticles with a primary particle size of 2 to 5 nm. Environ. Health Perspect. 2007, 115, 397-402; Warheit, D.B; Webb, T.R; Reed, K.L; Frerichs, S.; Sayes, C.M. Pulmonary toxicity study in rats with three forms of ultrafine-TiO2 particles: differential responses related to surface properties. Toxicology. 2007, 230, 90-104; Liu, R.; Yin, L.; Pu, Y.; Liang, G.; Zhang, J.; Su, Y.; Xiao, Z.; Ye, B. Pulmonary toxicity induced by three forms of titanium dioxide nanoparticles via intra-tracheal instillation in rats. Prog. Nat. Sci. 2009, 19, 573-579; Park, E.-J.; Yoon, J; Choi, K; Yi, J.; Park K. Induction of chronic inflammation in mice treated with titanium dioxide nanoparticles by intratracheal instillation. Toxicology. 2009, 260, 37-46; Husain, M; Saber, A.T; Guo, C, Jacobsen, N.R; Jensen, K.A.; Yauk, C.L.; Williams, A.; Vogel, U.; Wallin, H.; Halappanavar, S. Pulmonary instillation of low doses of titanium dioxide nanoparticles in mice leads to particle retention and gene expression changes in the absence of inflammation. Toxicology and Applied Pharmacology. 2013, 269, 250-262; Shakeel, M; Jabeen, F; Iqbal R.; Chaudhry A.S.; Zafar, S.; Ali, M.; Khan, M.S.; Khalid, A.; Shabbir, S.; Asghar, M.S. Assessment of titanium dioxide nanoparticles (TiO2-NPs) Induced hepatotoxicity and ameliorative effects of Cinnamomum cassia in Sprague-Dawley rats. Biological Trace Element Research. 2017, 1-13; Hong, F; Zhou, Y; Zhao, X; Sheng, L.; Wang, L. Maternal exposure to nanosized titanium dioxide suppresses embryonic development in mice. Int J Nanomedicine. 2017, 12, 6197-6204; Kreyling, W.G; Holzwarth, U.; Haberl, N.; Kozempel, J.; Him, S.; Wenk, A.; Carsten, S.;  , M.; Lipka, J.; Semmler-Behnke, M.; Gibson, N. Quantitative Biokinetics of Titanium Dioxide Nanoparticles After Intravenous Injection in Rats: Part 1 Nanotoxicology. 2017, 11 (4), 434-442; Kreyling, W.G; Holzwarth, U.; Haberl, N.; Kozempel, J.; Hirn, S.; Wenk, A.; Carsten, S.;
, M.; Lipka, J.; Semmler-Behnke, M.; Gibson, N. Quantitative Biokinetics of Titanium Dioxide Nanoparticles After Intravenous Injection in Rats: Part 1 Nanotoxicology. 2017, 11 (4), 434-442; Kreyling, W.G; Holzwarth, U.; Haberl, N.; Kozempel, J.; Hirn, S.; Wenk, A.; Carsten, S.;  , M.; Lipka, J.; Semmler-Behnke, M.; Gibson, N. Quantitative Biokinetics of Titanium Dioxide Nanoparticles After Oral Application in Rats: Part 2 Nanotoxicology. 2017, 11 (4), 443-453; Kreyling, W.G; Holzwarth, U.; Haberl, N.; Kozempel, J.; Hirn, S.; Wenk, A.; Carsten, S.;
, M.; Lipka, J.; Semmler-Behnke, M.; Gibson, N. Quantitative Biokinetics of Titanium Dioxide Nanoparticles After Oral Application in Rats: Part 2 Nanotoxicology. 2017, 11 (4), 443-453; Kreyling, W.G; Holzwarth, U.; Haberl, N.; Kozempel, J.; Hirn, S.; Wenk, A.; Carsten, S.;  , M.; Lipka, J.; Semmler-Behnke, M.; Gibson, N. Quantitative Biokinetics of Titanium Dioxide Nanoparticles After Intratracheal Instillation in Rats: Part 3 Nanotoxicology. 2017, 11 (4), 454-464); SiO2 (например, Park, E.J; Park, K. Oxidative stress and pro-inflammatory responses induced by silica nanoparticles in vivo and in vitro. Toxicol. Lett. 2009, 184 (1), 18-25; Eom, H.J, Choi, J. Oxidative stress of silica nanoparticles in human bronchial epithelial cell, Beas-2B. Toxicol. In Vitro. 2009, 23 (7), 1326-1332; Kim, Y.J; Yu, M; Park, H.O; Yang, S.I. Comparative study of cytotoxicity, oxidative stress and genotoxicity induced by silica nanomaterials in human neuronal cell line. Mol. Cell. Toxicol. 2010, 6 (4), 336-343; Sergent, J.A; Paget, V; Chevillard, S. Toxicity and genotoxicity of nano-SiO2 on human epithelial intestinal HT-29 cell line. Ann. Occup. Hyg. 2012, 56 (5), 622-630; Du, Z.J.; Zhao, D.L.; Jing, L.; Cui, G.; Jin, M.; Li, Y.; Liu, X.; Liu, Y.; Du, H.; Guo, C.; Zhou, X.; Sun, Z. Cardiovascular toxicity of different sizes amorphous silica nanoparticles in rats after intratracheal instillation. Cardiovasc. Toxicol. 2013, 13 (3), 194-207; Petrick, L.; Rosenblat, M.; Paland, N.; Aviram, M. Silicon dioxide nanoparticles increase macrophage atherogenicity: stimulation of cellular cytotoxicity, oxidative stress, and triglycerides accumulation. Environ. Toxicol. 2016, 31 (6), 713-723; Guo, C.; Yang, M.; Jing 1. Amorphous silica nanoparticles trigger vascular endothelial cell injury through apoptosis and autophagy via reactive oxygen species-mediated MAPK/Bcl-2 and PI3K/Akt/mTOR signaling. Int. J. Nanomed. 2016, 11:5257-5276; Ren, L.; Zhang, J.; Zou, Y.; Zhang, L.; Wei, J.; Shi, Z.; Li, Y.; Guo, C; Sun, Z.; Zhou, X. Silica nanoparticles induce reversible damage of spermatogenic cells via RIPK1 signal pathways in C57 mice. Int J Nanomedicine. 2016, 11, 2251-2264. doi: 10.2147/IJN.S102268; Wang, J.; Yu, Y.; Lu, K. Silica nanoparticles induce autophagy dysfunction via lysosomal impairment and inhibition of autophagosome degradation in hepatocytes. Int. J. of Nanomed. 2017, 12, 809-825; Murugadoss, S.; Lison, D.; Godderis, L.; Van Den Brule, S.; Mast, J.; Brassinne, F.; Sebaihi, N.; Hoet, P.H. Toxicology of silica nanoparticles: an update. Arch Toxicol. 2017, 91(9), 2967-3010. doi: 10.1007/s00204-017-1993-y; Orlando, A.; Cazzaniga, E.; Tringali, M.; Gullo, F.; Becchetti. A.; Minniti, S.; Taraballi, F.; Tasciotti, E.; Re, F. Mesoporous silica nanoparticles trigger mitophagy in endothelial cells and perturb neuronal network activity in a size- and time-dependent manner International Journal of Nanomedicine. 2017, 12:3547-3559; Chan, W.T.; Liu, C.C.; Chiang Chiau, J.S.; Tsai, S.T.; Liang, C.K.; Cheng, M.L.; Lee, H.C.; Yeung, C.Y.; Hou, S.Y. In vivo toxicologic study of larger silica nanoparticles in mice. International Journal of Nanomedicine. 2017, 12, 3421-3432) и в значительно меньшей степени, Аl2О3 (Arul Prakash, F.; Dushendra Babu, G.J.; Lavanya, M., Shenbaga Vidhya, K.; Devasena T. Toxicity Studies of Aluminium Oxide Nanoparticles in Cell Lines. International Journal of Nanotechnology and Applications. 2011, 5(2), 99-107; Radziun, E.; Dudkiewicz
, M.; Lipka, J.; Semmler-Behnke, M.; Gibson, N. Quantitative Biokinetics of Titanium Dioxide Nanoparticles After Intratracheal Instillation in Rats: Part 3 Nanotoxicology. 2017, 11 (4), 454-464); SiO2 (например, Park, E.J; Park, K. Oxidative stress and pro-inflammatory responses induced by silica nanoparticles in vivo and in vitro. Toxicol. Lett. 2009, 184 (1), 18-25; Eom, H.J, Choi, J. Oxidative stress of silica nanoparticles in human bronchial epithelial cell, Beas-2B. Toxicol. In Vitro. 2009, 23 (7), 1326-1332; Kim, Y.J; Yu, M; Park, H.O; Yang, S.I. Comparative study of cytotoxicity, oxidative stress and genotoxicity induced by silica nanomaterials in human neuronal cell line. Mol. Cell. Toxicol. 2010, 6 (4), 336-343; Sergent, J.A; Paget, V; Chevillard, S. Toxicity and genotoxicity of nano-SiO2 on human epithelial intestinal HT-29 cell line. Ann. Occup. Hyg. 2012, 56 (5), 622-630; Du, Z.J.; Zhao, D.L.; Jing, L.; Cui, G.; Jin, M.; Li, Y.; Liu, X.; Liu, Y.; Du, H.; Guo, C.; Zhou, X.; Sun, Z. Cardiovascular toxicity of different sizes amorphous silica nanoparticles in rats after intratracheal instillation. Cardiovasc. Toxicol. 2013, 13 (3), 194-207; Petrick, L.; Rosenblat, M.; Paland, N.; Aviram, M. Silicon dioxide nanoparticles increase macrophage atherogenicity: stimulation of cellular cytotoxicity, oxidative stress, and triglycerides accumulation. Environ. Toxicol. 2016, 31 (6), 713-723; Guo, C.; Yang, M.; Jing 1. Amorphous silica nanoparticles trigger vascular endothelial cell injury through apoptosis and autophagy via reactive oxygen species-mediated MAPK/Bcl-2 and PI3K/Akt/mTOR signaling. Int. J. Nanomed. 2016, 11:5257-5276; Ren, L.; Zhang, J.; Zou, Y.; Zhang, L.; Wei, J.; Shi, Z.; Li, Y.; Guo, C; Sun, Z.; Zhou, X. Silica nanoparticles induce reversible damage of spermatogenic cells via RIPK1 signal pathways in C57 mice. Int J Nanomedicine. 2016, 11, 2251-2264. doi: 10.2147/IJN.S102268; Wang, J.; Yu, Y.; Lu, K. Silica nanoparticles induce autophagy dysfunction via lysosomal impairment and inhibition of autophagosome degradation in hepatocytes. Int. J. of Nanomed. 2017, 12, 809-825; Murugadoss, S.; Lison, D.; Godderis, L.; Van Den Brule, S.; Mast, J.; Brassinne, F.; Sebaihi, N.; Hoet, P.H. Toxicology of silica nanoparticles: an update. Arch Toxicol. 2017, 91(9), 2967-3010. doi: 10.1007/s00204-017-1993-y; Orlando, A.; Cazzaniga, E.; Tringali, M.; Gullo, F.; Becchetti. A.; Minniti, S.; Taraballi, F.; Tasciotti, E.; Re, F. Mesoporous silica nanoparticles trigger mitophagy in endothelial cells and perturb neuronal network activity in a size- and time-dependent manner International Journal of Nanomedicine. 2017, 12:3547-3559; Chan, W.T.; Liu, C.C.; Chiang Chiau, J.S.; Tsai, S.T.; Liang, C.K.; Cheng, M.L.; Lee, H.C.; Yeung, C.Y.; Hou, S.Y. In vivo toxicologic study of larger silica nanoparticles in mice. International Journal of Nanomedicine. 2017, 12, 3421-3432) и в значительно меньшей степени, Аl2О3 (Arul Prakash, F.; Dushendra Babu, G.J.; Lavanya, M., Shenbaga Vidhya, K.; Devasena T. Toxicity Studies of Aluminium Oxide Nanoparticles in Cell Lines. International Journal of Nanotechnology and Applications. 2011, 5(2), 99-107; Radziun, E.; Dudkiewicz  , J.;
, J.;  . Assessment of the cytotoxicity of aluminum oxide nanoparticles on selected mammalian cells. I Toxicol In Vitro. 2011, 25(8), 1694-700.; Park, E.J.; Lee, G.H.; Yoon, C.; Jeong, U., Kim, Y., Cho, M.H., Kim, D.W. Biodistribution and toxicity of spherical aluminum oxide nanoparticles. J Appl Toxicol. 2016, 36(3), 424-33.)
. Assessment of the cytotoxicity of aluminum oxide nanoparticles on selected mammalian cells. I Toxicol In Vitro. 2011, 25(8), 1694-700.; Park, E.J.; Lee, G.H.; Yoon, C.; Jeong, U., Kim, Y., Cho, M.H., Kim, D.W. Biodistribution and toxicity of spherical aluminum oxide nanoparticles. J Appl Toxicol. 2016, 36(3), 424-33.)
Однако информационный поиск не обнаружил ни примеров изучения хронической системной токсичности тройной комбинации рассматриваемых оксидов, ни испытания или хотя бы теоретического обоснования средств биологической защиты (биопротекторов) от вредных эффектов длительного комбинированного воздействия этих наночастиц на организм. Что же касается изолированного действия компонентов рассматриваемой комбинации, то только в отношении токсического действия наночастиц ТiO2 на печень крыс описано ослабляющее его влияние корицы (Shakeel, М; Jabeen, F; Iqbal R.; Chaudhry A.S.; Zafar, S.; Ali, M.; Khan, M.S.; Khalid, A.; Shabbir, S.; Asghar, M.S. Assessment of titanium dioxide nanoparticles (TiO2-NPs) Induced hepatotoxicity and ameliorative effects of Cinnamomum cassia in Sprague-Dawley rats. Biological Trace Element Research. 2017, 1-13).
Ранее нами был впервые обоснован эффективный комплекс биопротекторов для защиты организма от другой тройной комбинации метало-оксидных наночастиц, а именно CuO-НЧ, ZnO-НЧ и PbO-НЧ (Патент Российской Федерации №2642674). Однако применение того же самого комплекса с целью биологической защиты от вредного действия любой другой комбинации элементо-оксидных наночастиц (НЧ) недостаточно обосновано, учитывая, что все они имеют, наряду с общими для многих НЧ, также элементо-специфичные механизмы вредного действия, которые к тому же при комбинированной экспозиции вступают в сложные взаимодействия (И.А. Минигалиева (2016). Некоторые закономерности комбинированной токсичности металлооксидных наночастиц. Токс Вестник, №6:18-24; Katsnelson, В.А.; Privalova L.I.; Sutunkova, М.Р.; Minigalieva, I.A. et al. Experimental research into metallic and metal oxide nanoparticle toxicity in vivo, In: B. Yan, H. Zhou, J. Gardea-Torresdey (Eds.). "Bioactivity of Engineered Nanoparticles", Springer, 2017, Chapter 11., 259-319.).
Задачей изобретения является создание способа защиты, основанного на повышении устойчивости организма к вредным эффектам комбинированного действия наночастиц оксидов алюминия, титана и кремния.
Технический результат, достигаемый заявленным изобретением, заключается в снижении вредных эффектов токсического и генотоксического комбинированного действия наночастиц оксидов алюминия, титана и кремния на организм.
Указанный технический результат достигается тем, что предлагается способ профилактики вредных эффектов органо-системного уровня, обусловленных комбинированным общетоксическим, органотоксическим и генотоксическим действием указанных наночастиц на организм.
Способ заключается в том, что лицам, относящимся к группе риска указанного действия, назначают комплекс биологически активных препаратов, включающий глютаминат натрия, глицин, цистеин в метаболически активной форме N-ацетилцистеина, яблочный пектин, селен, йод, кальций, препарат рыбьего жира, богатый полиненасыщенными жирными кислотами класса омега-3, а также витамины А, С и Е, причем лица группы риска принимают препараты этого комплекса повторными 4-6-недельными курсами 1-2 раза в год в дозах, обеспечивающих получение в день 300 мг глицина, 600 мг цистеина, 4 г глютаминовой кислоты, 25 мл рыбьего жира с 12-15%-ным содержанием полиненасыщенных жирных кислот класса омега-3, 4-5 г пектина, а также вышеназванные микроэлементы и витамины в дозах, обеспечивающих физиологические потребности организма.
Способ поясняется фигурами иллюстраций.
На Фиг. 1 представлена микрофотография гистологических препаратов почек крысы из контрольной группы с нормальной структурой извитых канальцев.
На Фиг. 2 представлена микрофотография гистологических препаратов почек крысы из группы, подвергавшейся затравке наночастицами (Al2 О3-НЧ + ТiO2-НЧ + SiO2-НЧ), при которой видны выраженные дегенеративные некробиотические изменения клеток канальцевого эпителия вплоть до полной их десквамации, частичное разрушение щеточной каемки, расширение просвета канальцев.
На Фиг. 3 представлена микрофотография гистологических препаратов почек крысы из группы, подвергавшейся затравке наночастицами (Al2 О3-НЧ + ТiO2-НЧ + SiO2-НЧ) на фоне приема БПК, при которой гистологическая картина мало отличается от нормальной. (Окраска ШИК, увеличение ×400).
Входящие в комплекс аминокислоты, а именно глютамат, глицин и цистеин, включены в него как предшественники биосинтеза (прекурсоры) восстановленного глютатиона, который является системным протектором от оксидативного и свободно-радикального повреждения клетки и субклеточных структур, характеризующего первичные механизмы цитотоксичности и генотоксичности различных наночастиц, при том, что глютамат является еще и мощным стабилизатором клеточных мембран, а также важнейшим нейромедиатором процесса возбуждения в центральной нервной системе. Антиоксидантным действием обладают также селен и витамины А, Е и С. Введение йода в состав биопротекторного комлекса обусловлено тем, что многие хронические металло-интоксикации сопровождаются нарушениями функции щитовидной железы. Кальций (в сочетании с витамином Д3) используется как хорошо известный антагонист многих токискокинетических и токсикодинамических механизмов действия ряда токсичных металлов.
Пектиновый энтеросорбент в заявленном комплексе предназначен для блокирования кишечной абсорбции ионов металлов, образующихся при растворении наночастиц, перенесенных в желудочно-кишечный тракт после отложения в дыхательных путях, а также реабсорбции ионов выделенных печенью с желчью. Заявленный комплекс содержит также препарат рыбьего жира, богатый не только вышеупомянутыми витаминами А и Д3, но и полиненасыщенными жирными кислотами класса омега-3, внутриклеточными производными которых являются эйкозаноиды, активирующие репликацию ДНК, тем самым играя важную роль в репарации ее повреждений.
То, что лицам группы риска рекомендовано принимать препараты комплекса повторными курсами 1-2 раза в год в течение 4-6-недель ежедневно в дозах, обеспечивающих получение в день 300 мг глицина, 600 мг цистеина, 4 г глютаминовой кислоты, 25 мл рыбьего жира с 12-15%-ным содержанием полиненасыщенных жирных кислот класса омега-3, 4-5 г пектина, а также селен, кальций, железо, йод и витамины в дозах, обеспечивающих физиологические потребности организма, обосновано пересчетом содержания перечисленных активных факторов в биопротекторном комплексе (БПК), защитная эффективность которого доказана в эксперименте, проведенном на лабораторных белых крысах. Пересчет в указанные дозы для человеческого применения осуществлен на основе соотношения уровней основного обмена крысы и человека с учетом также справочных и литературных данных о суточной потребности человека в этих факторах. Только дозы био-микроэлементов и витаминов обусловлены не таким пересчетом, а нормальными физиологическими потребностями организма, включая компенсацию эндогенной витаминной недостаточности и микроэлементного дисбаланса, возникающих при интоксикации.
Механизмы защитного действия входящих в комплекс биопротекторов сложны и, по-видимому, взаимно потенцируют друг друга. Важное значение могут иметь: (а) разное по молекулярным механизмам противорадикальное (в том числе, антиоксидантное) действие, в той или иной степени присущее ряду биопротекторов заявляемого комплекса (антиоксидантный синергизм); (б) мембрано-стабилизирующее действие глютамата, поскольку оно может препятствовать повреждению митохондрий наночастицами и тем самым - оксидативному стрессу, являющемуся, по современным представлениям, одним из основных механизмов цитотоксического и генотоксического действия наночастиц (например,  , Е. Cellular targets and mechanisms in the cytotoxic action of non-biodegradable engineered nanoparticles. J. Curr. Drug. Metab. 2013, 14, 976-988).; (в) компенсация некоторых функциональных и биохических нарушений, связанных с токсикодинамическими механизмами как общего характера, так и специфичных для конкретного вида наночастиц.
, Е. Cellular targets and mechanisms in the cytotoxic action of non-biodegradable engineered nanoparticles. J. Curr. Drug. Metab. 2013, 14, 976-988).; (в) компенсация некоторых функциональных и биохических нарушений, связанных с токсикодинамическими механизмами как общего характера, так и специфичных для конкретного вида наночастиц.
Характерной особенностью заявленного способа является комплексное использование всех вышеперечисленных механизмов. Впервые показано, что на фоне перорального назначения предложенной комбинации биопротекторов хроническая системная токсичность и генотоксичность наночастиц оксидов алюминия, титана и кремния, воздействующих на организм совместно, могут быть существенно ослаблены. В результате поиска по источникам научно-технической и патентной литературы не выявлены средства, направленные на решение такой задачи.
Заявленный способ экспериментально опробован на аутбредных белых крысах-самцах с начальным весом тела 150-220 г. Животные содержались в условиях специально организованного вивария, соответствующих ветеринарным требованиям. В питье они получали артезианскую воду, доочищенную до первой категории качества, а в пищу - полнорационный комбикорм ООО «Лабораторкорм». Суспензии наночастиц изготавливались методом лазерной абляции соответствующих чистых (99,99%) элементных веществ в деионизированной воде с помощью лазерной системы для обработки материалов Fmark-20 RL (ЦЛТ, Россия). Химический состав наночастиц определялся методом Рамановской спектроскопии и был идентифицирован как Аl2О3, ТiО2 и SiO2. Характеристика распределения размеров наночастиц давалась их прямым измерением при сканирующей электронной микроскопии и методом динамического рассеяния света с помощью анализатора Zetasizer Nano ZS (Malvern Instruments, UK). Частицы имели сферическую форму со средним диаметром (±σ) 21±6 нм для Аl2О3-НЧ, 27±7 нм для ТiО2-НЧ и 43±11 нм для SiO2-НЧ. Для каждого введения животным использовались свежеприготовленные суспензии.
Водные суспензии наночастиц в дозировке 0,5 мг на крысу для ТiO2-НЧ и SiO2-НЧ и 0,25 мг на крысу для Аl2О3-НЧ (каждого вида НЧ в 1 мл соответствующей суспензии) ввели крысам внутрибрюшинно 18 раз по 3 раза в неделю. Во избежание прямого взаимодействия оксидов, ускоряющего агломерацию наночастиц, суспензии Аl2О3-НЧ, ТiO2-НЧ и SiO2-НЧ набирались в отдельные шприцы и вводились раздельно с интервалом около 1 минуты. Контрольным животным аналогичным образом вводили 3,0 мл той же стерильной деионизированной воды, на которой готовились суспензии. Отдельные группы животных получали те же инъекции на фоне перорального приема биопротекторного комплекса (БПК). Наряду с этим, одна группа крыс получала анологичные инъекции, но при половинной дозировке всех НЧ. Введение наночастиц и умерщвление животных разных групп проводились параллельно.
Препараты, содержащие вышеперечисленные биопротекторы, давались в тех дозировках, которые приведены в Таблице 1.
Состояние организма крыс во всех группах оценивалось по большому числу (свыше 50) общепризнанных функциональных, биохимических и морфологических (с морфометрией при оптической и электронной микроскопии) критериев токсического действия. Для оценки генотоксического действия наночастиц «ин виво» использовали ПДАФ анализ (ПДАФ - полиморфизм длин амплифицированных фрагментов ДНК), причем для количественной характеристики степени повреждения ДНК использовали «коэффициент фрагментации», то есть отношение суммарной радиоактивности всех фракций «хвоста» к радиоактивности «ядра».
Общая тенденция, выявленная при анализе функциональных и биохимических показателей состояния организма, состоит в том, что все те, по которым при воздействии комбинации НЧ без БПК выявлен тот или иной сдвиг по отношению к контрольной величине (особенно в том случае, если он статистически значим, как это имеет место почти по всем показателям, приведенным в Таблице 2), при таком же воздействии на фоне БПК этот сдвиг ослаблен - нередко до потери значимости отличия от контроля и появления значимости отличия от группы, получавшей те же НЧ без БПК.
Еще более очевиден защитный эффект испытанного БПК по морфометрическим показателям токсического повреждения почек (Фиг. 1 и Таблица 3), печени и селезенки (Таблица 4).
При цитологическом исследовании мазков-отпечатков разных внутренних органов крыс наиболее общим сдвигом оказалось увеличение по сравнению с контролем числа эозинофилов, свидетельствующее о гиперергическом типе воспалительной реакции на действие данной комбинации НЧ. На фоне действия БПК и эта реакция была ослаблена. Так, в отпечатках печени, селезенки и брыжеечных лимфоузлов средний процент эозинофилов (±s.e.) равнялся, соответственно: в контроле 1,33±0,17 - 3,67±0,44 - 1,67±0,17; в группе, получавшей наночастицы (в полной дозировке) 3,67±0,17* - 6,33±1,09 - 3,33±0,17*; в группе, получавшей те же наночастицы на фоне приема БПК 2,00±0,29 - 5,50±1,02 - 1,33±0,17. Звездочкой отмечены показатели, отличающиеся от соответствующих контрольных величин статистически значимо, и это наблюдалось при действии данной комбинации НЧ только в отсутствии БПК. Как видно из Таблицы 2, эозинофильный сдвиг, вызываемый действием комбинации НЧ, и его исчезновение на фоне приема БПК отмечены и по данным анализа крови.
Важнейшее значение имеет показанное в Таблице 5 статистически значимое ослабление на фоне приема БПК наиболее опасного, а именно генотоксического (прогностически - мутагенного и канцерогенного) действия. Хотя в отношении данной комбинации наночастиц этот результат получен впервые, однако в пользу его закономерности говорит то, что ранее заявители неоднократно обнаруживали подобный противо-генотоксический защитный эффект при изолированном и комбинированном действии других НЧ и испытании других составов БПК (обобщено у Privalova, L.I., Katsnelson, В.А., Sutunkova, М.Р., Minigalieva, I.A., Gurvich, V.B., Makeyev, O.H., Shur, V. Ya., Valamina, I.E., Klinova, S.V., Shishkina, E.V. and Zubarev, I.V. (2017) Looking for biological protectors against adverse health effects of some nanoparticles that can pollute workplace and ambient air (a summary of authors' experimental results). Journal of Environmental Protection, 8, 844-866.).
В целом, сопоставление полученных экспериментальных данных с литературными данными, свидетельствует о том, что в токсикологическом эксперименте на целостном организме впервые убедительно продемонстрированы, наряду с рядом функциональных и биохимических признаков хронической интоксикации, также выраженные гепатотоксичность, нефротоксичность и спленотоксичность комбинации наночастиц оксидов алюминия, титана и кремния, а также ее генотоксичность. При этом показано, что при использовании заявленного способа эти вредные эффекты существенно ослаблены. По ряду выраженных эффектов нефротоксичности, спленотоксичности и, что наиболее важно, генотоксичности это ослабление вредного действия под влиянием БПК выражено не меньше или даже больше, чем оно было получено при снижении дозы наночастиц в 2 раза.


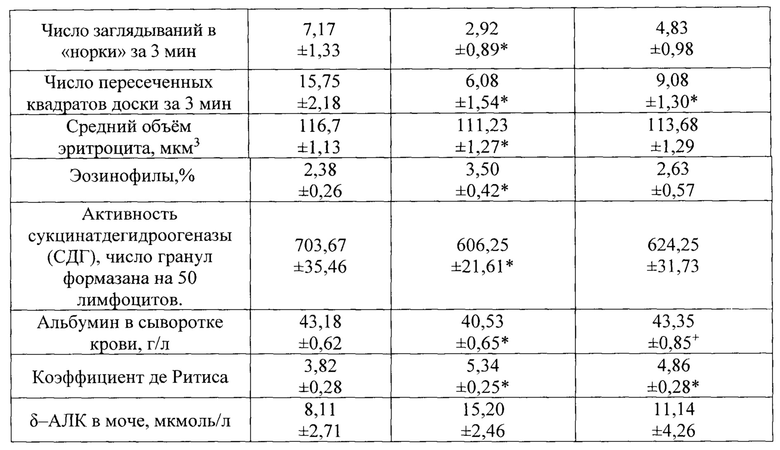
Статистически значимое отличие от контрольного показателя обозначено индексом *, а от показателя группы крыс, получавшей комбинацию НЧ без БПК - индексом + (Р<0,05 по t Стьюдента).

Примечание: значком * обозначено статистически значимое (Р<0,05 по t Стьюдента) отличие от контрольного показателя, # от показателя группы, получавшей тройную комбинацию в полой дозировке без БПК.

Примечание: значком * обозначено статистически значимое (Р<0,05 по t Стьюдента) отличие от контрольного показателя, # от показателя группы, получавшей тройную комбинацию в полой дозировке без БПК.


Примечание: статистически значимо отличается: * от контрольной группы; + от группы, получавшей НЧ в полной дозировке (Р<0.05 по t-критерию Стьюдента).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОВЫШЕНИЯ УСТОЙЧИВОСТИ ОРГАНИЗМА К КОМБИНИРОВАННОМУ ТОКСИЧЕСКОМУ ДЕЙСТВИЮ НАНОЧАСТИЦ ОКСИДОВ МЕДИ, ЦИНКА И СВИНЦА | 2017 |
|
RU2642674C1 |
| СПОСОБ ПОВЫШЕНИЯ УСТОЙЧИВОСТИ ОРГАНИЗМА К ВРЕДНОМУ ДЕЙСТВИЮ НАНОЧАСТИЦ АМОРФНОГО ДИОКСИДА КРЕМНИЯ | 2020 |
|
RU2738565C1 |
| СПОСОБ ПОВЫШЕНИЯ УСТОЙЧИВОСТИ ОРГАНИЗМА К ХРОНИЧЕСКОМУ КОМБИНИРОВАННОМУ ТОКСИЧЕСКОМУ ДЕЙСТВИЮ НАНОЧАСТИЦ ОКСИДА НИКЕЛЯ И ОКСИДА МАРГАНЦА | 2015 |
|
RU2597157C1 |
| СПОСОБ ПОВЫШЕНИЯ УСТОЙЧИВОСТИ ОРГАНИЗМА ЧЕЛОВЕКА К КОМБИНИРОВАННОМУ ЦИТОТОКСИЧЕСКОМУ ДЕЙСТВИЮ НАНОЧАСТИЦ ОКСИДОВ СЕЛЕНА И МЕДИ | 2022 |
|
RU2786819C1 |
| Способ повышения устойчивости организма к комбинированному вредному действию свинца и кадмия | 2019 |
|
RU2712954C1 |
| Способ повышения устойчивости к нейротоксическому действию наночастиц оксида свинца | 2024 |
|
RU2834031C1 |
| СПОСОБ ПРОФИЛАКТИКИ ВРЕДНЫХ ЭФФЕКТОВ ОБЩЕТОКСИЧЕСКОГО И ГЕНОТОКСИЧЕСКОГО ДЕЙСТВИЯ НАНОЧАСТИЦ ОКСИДА МЕДИ НА ОРГАНИЗМ | 2014 |
|
RU2560682C1 |
| СПОСОБ ПРОФИЛАКТИКИ ВРЕДНЫХ ЭФФЕКТОВ ОБЩЕТОКСИЧЕСКОГО И ГЕНОТОКСИЧЕСКОГО ДЕЙСТВИЯ НАНОСЕРЕБРА НА ОРГАНИЗМ | 2013 |
|
RU2530639C1 |
| СПОСОБ ПОВЫШЕНИЯ АНТИБАКТЕРИАЛЬНЫХ СВОЙСТВ НАНОЧАСТИЦ СЕРЕБРА | 2018 |
|
RU2687494C1 |
| СПОСОБ ПОВЫШЕНИЯ УСТОЙЧИВОСТИ ОРГАНИЗМА К ВРЕДНОМУ ДЕЙСТВИЮ ТОКСИЧЕСКОЙ КОМБИНАЦИИ, ЗАГРЯЗНЯЮЩЕЙ ВОЗДУХ РАБОЧЕЙ ЗОНЫ И ОКРУЖАЮЩУЮ АТМОСФЕРУ В СВЯЗИ С ДЕЯТЕЛЬНОСТЬЮ ПРОИЗВОДСТВА ЧЕРНОВОЙ МЕДИ | 2021 |
|
RU2784169C1 |

Изобретение относится к фармацевтической промышленности, а именно к способу повышения устойчивости организма к развитию вредных эффектов комбинированного действия на него наночастиц оксидов алюминия, титана и кремния. Способ повышения устойчивости организма к развитию вредных эффектов комбинированного действия на него наночастиц оксидов алюминия, титана и кремния, заключающийся в том, что лицам, относящимся к группе риска этого действия, назначают комплекс биологически активных препаратов, включающий в себя глютаминат натрия, глицин, N-ацетилцистеин, пектиновый энтеросорбент, препарат рыбьего жира, богатый неэстерифицированными жирными кислотами класса омега-3, а также витамины А, С, Д, Е, селен, кальций, железо и йодсодержащие препараты, взятые в определенных суточных дозах, причем лицам группы риска рекомендуется принимать этот комплекс повторными курсами 1-2 раза в год в течение 4-6 недель. Вышеописанный способ позволяет снизить вредный эффект токсического и генотоксического комбинированного действия наночастиц оксидов алюминия, титана и кремния на организм. 3 ил., 5 табл.
Способ повышения устойчивости организма к развитию вредных эффектов комбинированного действия на него наночастиц оксидов алюминия, титана и кремния, заключающийся в том, что лицам, относящимся к группе риска этого действия, назначают комплекс биологически активных препаратов, включающий в себя глютаминат натрия, глицин, N-ацетилцистеин, пектиновый энтеросорбент, препарат рыбьего жира, богатый неэстерифицированными жирными кислотами класса омега-3, а также витамины А, С, Д, Е, селен, кальций, железо и йодсодержащие препараты, причем лицам группы риска рекомендуется принимать этот комплекс повторными курсами 1-2 раза в год в течение 4-6 недель ежедневно в дозах, обеспечивающих получение в день 300 мг глицина, 600 мг N-ацетилцистеина, 4 г глютамината натрия. 25 мл рыбьего жира с 12-15%-ным содержанием полиненасыщенных жирных кислот класса омега-3, 4-5 г пектина, а также селен, кальций, железо, йод и указанные витамины в дозах, обеспечивающих нормальные физиологические потребности организма.
| СПОСОБ ПОВЫШЕНИЯ УСТОЙЧИВОСТИ ОРГАНИЗМА К КОМБИНИРОВАННОМУ ТОКСИЧЕСКОМУ ДЕЙСТВИЮ НАНОЧАСТИЦ ОКСИДОВ МЕДИ, ЦИНКА И СВИНЦА | 2017 |
|
RU2642674C1 |
| CN 101933937 А, 05.01.2011 | |||
| СПОСОБ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ИНТОКСИКАЦИИ ТЯЖЕЛЫМИ МЕТАЛЛАМИ У ЖИВОТНЫХ | 2008 |
|
RU2366415C1 |
| СПОСОБ ПРОФИЛАКТИКИ ВРЕДНЫХ ЭФФЕКТОВ ОБЩЕТОКСИЧЕСКОГО И ГЕНОТОКСИЧЕСКОГО ДЕЙСТВИЯ НАНОЧАСТИЦ ОКСИДА МЕДИ НА ОРГАНИЗМ | 2014 |
|
RU2560682C1 |
| БЕРЕСНЕВА О.Ю | |||
| Биологическая профилактика комбинированного действия токсичных металлов и органических веществ | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Способ обработки медных солей нафтеновых кислот | 1923 |
|
SU30A1 |
| Найдено из базы данных Электронная библиотека ДВГМУ. | |||
Авторы
Даты
2019-07-17—Публикация
2018-03-29—Подача