Область техники
Изобретение относится к биотехнологии и биохимии, а именно к моноклональному антителу, связывающемуся с интерфероном бета-1а человека и способному нейтрализовать его биологическую активность.
Уровень техники
Известны моноклональные анти-IFNα антитела, которые связываются с подтипами IFNα: IFNα1, IFNα2, IFNα4, IFNα5, IFNα8, IFNα10, IFNα21 и содержат три CDR участка тяжелой цепи. Описанные анти-IFNα антитела содержат, по-меньшей мере, одну легкую цепь и одну тяжелую. Раскрыты варианты нуклеиновых кислот, кодирующих указанные антитела, и варианты векторов для экспрессии нуклеиновых кислот, а также варианты трансформированных клеток-хозяев. Среди векторов экспрессии описаны также векторы, депонированные под №2881 и под №2882, несущие соответственно тяжелую и легкую цепь антитела. Описан способ получения антитела из указанных клеток. Раскрыта гибридомная линия клеток мыши, депонированная в АТСС под номером №РТА-2917, и антитело, продуцируемое указанной линией. Описаны также варианты фармацевтической композиции на основе антитела и способ диагностики аутоиммунного заболевания.
Раскрыто также применение антител для лечения заболевания или состояния, ассоциированного у пациента с повышенными уровнями IFNα. Использование изобретения позволяет одновременно подавлять биологическую активность, по крайней мере, семи подтипов IFNα человека, а именно IFNα1, IFNα2, IFNα4, IFNα5, IFNα8, IFNα10, IFNα21, что может найти применение в диагностике и терапии различных заболеваний человека, опосредуемых IFNα, таких как инсулинозависимый сахарный диабет или системная красная волчанка (Патент RU 2314317 http://www.findpatent.ru/patent/231/2314317.html)
Известны антитела, которые избирательно нейтрализуют биологическую активность по крайней мере двух подтипов белка интерферона-альфа ("IFNα") в отношении подтипов белка А, 2, В2, С, F, G, Н2, I, J1, К, 4а, 4b и WA, и не нейтрализуют по крайней мере одну биоактивность белка IFNα подтипа D. Также в этом патенте представлено применение антитела для производства лекарственного средства. Кроме того в этом патенте представлены продуцирующие антитело клетка-хозяин и гибридома. Антитела по изобретению эффективны для выявления подтипов IFNα в образце или ткани и/или для терапевтического применения, включающего в себя лечение и/или улучшение состояния при связанном с IFNα заболевании, таком как SLE, волчанка, диабет типа I, псориаз, СПИД и реакция "трансплантат против хозяина" (Патент RU 2431638 http://www.findpatent.ru/patent/243/2431638.html.
Известно гуманизированное антитело и его антигенсвязьпзающий фрагмент (Fab), которые селективно связывают человеческий ИФН-γ и содержат вариабельный участок тяжелой цепи (VH) и вариабельный участок легкой цепи (VL), где VH и VL имеют последовательности аминокислот соответственно SEQ ID NO: 1 и 2, представленные в описании в патенте RU 2539752. Также раскрыты фрагменты ДНК, кодирующие указанные антитело и его Fab-фрагмент; плазмидные ДНК для экспрессии указанных специфичных белков; и модифицированные клетки бактерий и эукариот, содержащие указанные плазмидные ДНК и предназначенные для экспрессии указанных антитела и его Fab-фрагмента. Предложены способы получения указанных антитела или его Fab-фрагмента, включающие культивирование указанных модифицированных клеток в питательной среде и выделение антитела и его Fab-фрагмента по настоящему изобретению из культуральной жидкости. Изобретение позволяет получить гуманизированное антитело или его Fab-фрагмент, связывающиеся с ИФН-γ с Кд 4,6 и IC50 не менее 1,5 нМ в тесте на клетках U937, с сохранением аффинности исходного мышиного моноклонального антитела (Патент RU 2539752 http://www.findpatent.ru/patent/253/2539752.html).
Раскрытие изобретения
Задачей настоящего изобретения было получение моноклонального антитела, способного к связыванию с интерфероном бета-1а человека и нейтрализации его биологической активности, и отличающегося по аминокислотной последовательности вариабельных доменов легкой и тяжелой цепей от известных из предшествующего уровня техники моноклональных антител к интерферонам человека. А также получение изолированных фрагментов ДНК, кодирующих участки легкой и тяжелой цепей указанного антитела и антигенсвязывающего фрагмента указанного моноклонального антитела.
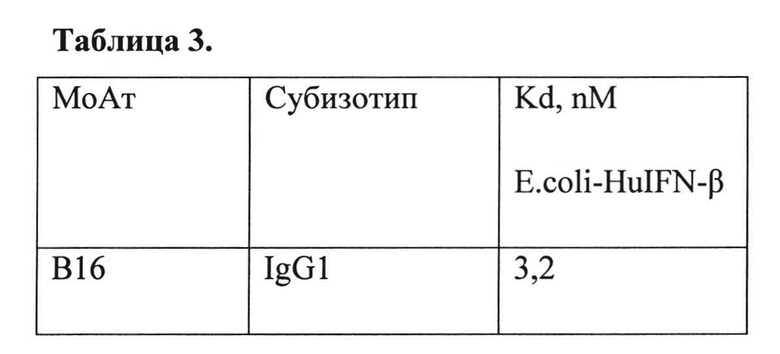
Техническим результатом является получение нового моноклонального антитела мыши IgG1-изотипа, способного к связыванию с интерфероном бета-1а человека и нейтрализации его биологической активности, и характеризующегося константой диссоциации комплекса антиген-антитело 3,2 нМ.
Также техническим результатом является расширение арсенала средств аналогичного назначения, а именно получение нового моноклонального нейтрализующего антитела к интерферону бета-1а человека.
Поставленная задача решается получением моноклонального антитела, селективно связывающего интерферон бета-1а человека и нейтрализующего его биологическую активность, включающего вариабельный участок тяжелой цепи (VH) указанного антитела, содержащего последовательность аминокислот, не менее чем на 90% гомологичную SEQ ID NO: 1; а вариабельный участок легкой цепи (VL) указанного антитела содержит последовательность аминокислот, не менее чем на 90% гомологичную SEQ ID NO: 2.
Поставленная задача решается также тем, что установлен изолированный фрагмент ДНК, кодирующий VH указанного антитела с нуклеотидной последовательностью SEQ ID NO: 3.
Поставленная задача решается также тем, что получен изолированный фрагмент ДНК, кодирующий VL указанного антитела с нуклеотидной последовательностью SEQ ID NO: 4.
Поставленная задача решается также тем, что получен антигенсвязьшающий фрагмент указанного моноклонального антитела, содержащий вариабельный участок тяжелой цепи (VH) указанного антитела с последовательностью аминокислот, не менее чем на 90% гомологичную SEQ ID NO: 1, и вариабельный участок легкой цепи (VL) указанного антитела с последовательностью аминокислот, не менее чем на 90% гомологичную SEQ ID NO: 2.
Моноклональное антитело, селективно связывающее интерферон бета-1а человека и нейтрализующее его биологическую активность, настоящего изобретения характеризуется тем, что вариабельный участок тяжелой цепи (VH) указанного антитела содержит
(i) CDR1 с последовательностью аминокислот GFTFTSYT из SEQ ID NO: 1;
(ii) CDR2 с последовательностью аминокислот ISNGGGST из SEQ ID NO: 1;
(iii) CDR3 с последовательностью аминокислот ARLDWVFAY из SEQ ID NO: 1.
При этом вариабельный участок легкой цепи (VL) указанного антитела содержит
(i) CDR1 с последовательностью аминокислот QDVGTA из SEQ ID NO: 2;
(ii) CDR2 с последовательностью аминокислот WAS из SEQ ID NO: 2;
(iii) CDR3 с последовательностью аминокислот LQYSSFPYT из SEQ ID NO: 2.
Моноклональное антитело получено путем иммунизации мышей Balb/C человеческим рекомбинантным интерфероном бета-1а, экспрессированным в E.coli (E.coli-HuIFN-β), получением и селекцией линий гибридом, продуцирующих моноклональные антитела к рекомбинантному интерферону бета-1а человека, анализа аффинности и специфичности отобранного МоАт, определения нуклеотидной и аминокислотной последовательности его вариабельных доменов.
Антитела обычно состоят из двух тяжелых цепей, связанных между собой дисульфидными связями, и легких цепей, ассоциированных с N-концом каждой из тяжелых цепей. Каждая тяжелая цепь содержит на N-конце вариабельный домен с константным доменом на другом конце. Каждая легкая цепь содержит на N-конце вариабельный домен с константным доменом на другом конце. Вариабельные домены каждой пары легкой и тяжелой цепей образуют антигенсвязывающий участок. Вариабельные домены легкой и тяжелой цепей обладают похожей общей структурой, и каждый домен включает каркас из четырех участков, последовательности которых являются относительно консервативными, связанных посредством трех участков, определяющих комплементарность (complementarity determining regions, CDRs). Четыре каркасных участка формируют конформацию типа бета-складчатого слоя. Участки CDRs расположены в близком соседстве друг с другом благодаря каркасным участкам и вносят вклад в образование антигенсвязывающего участка. Участки CDRs и каркасные участки антител могут быть определены путем ссылки на нумерационную систему Кабата (Kabat numbering system, Kabat et al., 1987 "Sequences of Proteins of Immunological Interest", US Dept. of Health and Human Services, US Government Printing Office) в сочетании с данными рентгеноструктурного анализа. Участки CDRs и каркасные участки антител могут также быть определены по номенклатуре Международной информационной системы по иммуногенетике (International Immunogenetics Information System, www.imgt.org).
Для получения антитела, которое может связываться с каким-либо специфическим антигеном, обычно используют методику Kohler и Milstein (Kohler et al., (1976) Nature 256: 495-497). Моноклональные антитела получают путем слияния клеток селезенки из иммунизированного животного и клеток миеломы с получением гибридомы. Гибридомы могут быть проверены на способность к продукции нужного антитела, затем гибридомы могут быть выращены, из них могут быть выделены указанные антитела. Термин «выращенные клетки», использованный здесь, означает гибридомы или другие линии клеток, которые производят антитела. Методы получения и проверки таких выращенных клеток описаны Harlow и др. (Antibodies, a Laboratory Manual, Cold Spring Harbor Labs Press, 1988). Получение материала, использующегося в качестве антигена для инъекции животных, включают в себя методики, хорошо известные из уровня техники, например использование полноразмерного белка, использование пептида, выбранного из иммуногенных участков белка, а также любыми другими методами, известными из уровня техники (Harlow и др. Antibodies, a Laboratory Manual, Cold Spring Harbor Labs Press, 1988)..
Подходящий способ для выделения антител, эффективных для использования в рамках настоящего изобретения, включает (а) назначение животному эффективного количества белка или пептида с целью получения антител, (b) выделение указанных антител, (с) определение последовательности антител.
Мышей линии BALB/c иммунизируют в подушечки задних лап дважды с двухнедельным интервалом. Антиген для первой иммунизации готовят следующим образом: сухой человеческий рекомбинантный интерферон бета-1а, экспрессированный в E.coli (E.coli-HuIFN-β, PeproTech, London, cat# 300-02B, Lot#03729 H084), растворяют в фосфатно-солевом буфере, рН 7,2 до концентрации 0,5 мг/мл, 100 мкл раствора смешивают с таким же объемом полного адъюванта Фройнда до образования гомогенной эмульсии. Антиген для повторной иммунизации готовят аналогичным образом, но вместо полного используют неполный адъювант Фройнда. Таким образом, разовая доза HuIFN-β составляет 50 мкг/мышь, а общая доза 100 мкг/мышь.
На четвертый день после второй иммунизации берут кровь из хвостовой вены у иммунизированной мыши и у контрольной (неиммунизированной) и проверют на наличие специфических антител против E.coli-HuIFN-β, а также против интерферона бета-1а, экспрессированного в яйцеклетках хомяка (CHO-HuIFN-β). Тестирование проводят методом иммуноферментного анализа следующим образом: антиген (E.coli-HuIFN-β либо CHO-HuIFN-β) сорбируют в лунках 96- луночного планшета в течение ночи при 4°С в фосфатно-солевом буфере рН 7,2 (ФСБ) в концентрации 2 мкг/мл в объеме 50 мкл.
Затем полученные лимфоциты гибридизуют с клетками миеломы SP2/0. Тестирование супернатантов гибридом проводят методом непрямого иммуноферментного анализа (ИФА) с использованием E.coli-HuIFN-β. Все первичные культуры, показавшие активность в ИФА, клонируют методом предельных разведений. Отбирают группы клонов - потомков одной первичной культуры. Клетки каждого из субклонов нарабатывают в культуре в количестве, достаточном для получения асцитных жидкостей. Моноклональные антитела, выделенные из асцитной жидкости, сравнивают методом непрямого ИФА, по результатам которого было отобрано антитело В16.
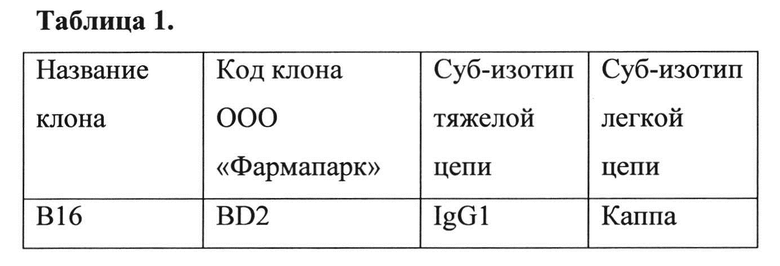
Затем определяют субизотип полученного антитела, оценивают специфичность и иммунореактивность полученного антитела методом непрямого ИФА с сорбированным на планшеты E.coli-HuIFN-β с использованием коммерческих типирующих сывороток: козьи антитела против иммуноглобулинов мыши разных изотипов, Sigma, ISO-2, Cat# М-5532 (anti-IgG1), М-5657 (anti-IgG2a), М-5782 (anti-IgG2b), М-5907 (anti-IgG3), М-6157 (anti-IgM), М-6032 (anti-IgA). В качестве источника антител используют культуральную жидкость гибридомы В16 без разведения, иммунные комплексы выявляют антителами кролика против иммуноглобулинов козы, конъюгированные с пероксидазой хрена, ООО «Импакт», Москва, в разведении, рекомендованном производителем. Субизотип тяжелой цепи полученного антитела В16 определен как IgG1.
Субизотип легкой цепи МоАт В16 определяют аналогичным образом, используя типирующие реагенты: набор Mouse Typer Isotyping Panel, Cat# 1722055, Bio-Rad. Субизотип легкой цепи полученного антитела В16 определен как каппа.
Была определена константа диссоциации моноклонального антитела В16.
Далее клонируют и секвенируют последовательности кДНК, кодирующих вариабельные домены мышиного антитела В16 к интерферону бета-1а человека. Для этого выделяют суммарную РНК из клеток гибридом, проводят реакцию обратной транскрипции-амплификации. Полученные фрагменты ДНК клонируют и секвенируют. Результаты секвенирования ДНК различных клонов сравнивают между собой и с базами данных GeneBank (IgBlast). В результате найдены нуклеотидные последовательности SEQ ID NO: 3 и SEQ ID NO: 4, на основании которых определены аминокислотные последовательности SEQ ID NO: 1 (фиг. 1) и SEQ ID NO: 2 (фиг. 1) вариабельных доменов указанного антитела. Участки CDRs определяют по номенклатуре Международной информационной системы по иммуногенетике (International Immunogenetics Information System, www.imgt.org) (Фиг. 2.).
В частности, антителом согласно настоящему изобретению является моноклональное антитело, обладающее способностью к связыванию рекомбинантного интерферона бета-1а человека и нейтрализации его биологической активности.
Таким антителом является антитело, содержащее последовательность аминокислот не менее чем на 90% гомологичную SEQ ID NO: 1 в качестве вариабельного участка тяжелой цепи (VH) указанного антитела, последовательность аминокислот не менее чем на 90% гомологичную SEQ ID NO: 2 в качестве вариабельного участка легкой цепи (VL) указанного антитела и консервативные участки обеих цепей, необходимых для функционирования указанного антитела. Такое новое антитело селективно связывается с интерфероном бета-1а человека и нейтрализует его биологическую активность. Консервативные участки тяжелой цепи человеческого иммуноглобулина IgG, IgM, IgA, IgD или IgE могут быть использованы в качестве консервативных участков для тяжелой цепи согласно настоящему изобретению. Консервативные участки легкой цепи человеческого иммуноглобулина каппа или лямбда могут быть использованы в качестве консервативных участков для легкой цепи антитела согласно настоящему изобретению.
В настоящем изобретении термин "антитело" использован для описания иммуноглобулинов или их фрагментов, мономеров или димеров легкой цепи или тяжелой цепи, одноцепочечных антител, таких как одноцепочечные антитела Fv's, в которых вариабельные домены тяжелой и легкой цепей соединены пептидным линкером, а также как природных, так и полученных методами рекомбинантных ДНК или другим образом, при условии, что антитело содержит, по крайней мере, один антигенсвязьшающий участок. Остальная часть антитела не должна обязательно включать только последовательность, производную от иммуноглобулина. Например, может быть сконструирован ген, в котором часть цепи, последовательность ДНК, кодирующая часть цепи человеческого иммуноглобулина, соединена с последовательностью ДНК, кодирующей последовательность аминокислот полипептида эффектора или молекулы-репортера. Используемый в настоящем документе термин «антитело» предназначен для обозначения молекул иммуноглобулина, составленных из четырех полипептидных цепей, при этом две тяжелые (Н) цепи и две легкие (L) цепи связываются друг с другом дисульфидными связями. Каждая тяжелая цепь содержит вариабельную область тяжелой цепи (сокращенно называемую в настоящем документе VH) и константную область тяжелой цепи. Константная область тяжелой цеписостоит из трех доменов: CH1, СН2 и СН3. Каждая легкая цепь содержит вариабельную область легкой цепи (сокращенно называемую в настоящем документе VL) и константную область легкой цепи. Константная область легкой цепи состоит из одного домена: CL. Области VH и VL могут далее подразделяться на области гипервариабельности, которые называются определяющими комплементарность областями (CDR), перемежаемые областями с более высоким уровнем консервативности, называемыми каркасными областями (FR). Каждая область VH и VL образована тремя CDR и четырьмя FR, расположенными от амино-терминального конца к карбокси-терминальному концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4.
В настоящем изобретении фраза "антитело, обладающее способностью к связыванию с рекомбинантным интерфероном бета-1а человека» означает молекулу, которая связывается с интерфероном бета-1а человека и образует стабильный комплекс. Способность антитела к связыванию с антигеном может быть определена специалистом в данной области с использованием методов, включающих, но не ограничивающихся методом иммуноферментного анализа (ИФА), равновесным диализом, с использованием плазмон-поверхностного резонанса. Методы определения аффинности хорошо известны специалисту в данной области техники, подробно описаны Janeway и др. (Immunobiology: The Immune System in Health and Disease (Garland Publishing Company, 1996)).
Изолированным фрагментом ДНК, кодирующим антитело, согласно настоящему изобретению является фрагмент ДНК, кодирующий вариабельные легкую или тяжелую цепи моноклонального антитела, селективно связывающего интерферон бета-1а человека и нейтрализующего его биологическую активность, содержащего последовательность аминокислот, не менее чем на 90% гомологичную SEQ ID NO: 1, и последовательность аминокислот, не менее чем на 90% гомологичную SEQ ID NO: 2.
Ввиду вырожденности трансляционного кода могут быть различия в последовательности ДНК. Фрагменты ДНК согласно настоящему изобретению не ограничены фрагментами, показанными в SEQ ID NO: 3 или 4 при условии, что они кодируют участки цепей антитела, содержащего последовательность аминокислот, не менее чем на 90% гомологичную SEQ ID NO: 1, и последовательность аминокислот, не менее чем на 90% гомологичную SEQ ID NO: 2.
Используемый в настоящем документе термин «антигенсвязывающая область» антитела обозначает один или несколько фрагментов антитела, которые сохраняют способность к специфическому связыванию с антигеном. К примерам связьшающих фрагментов, включенных в термин «антигенсвязывающая область» антитела, относятся (I) фрагмент Fab, моновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; (ii) фрагмент F(ab')2, бивалентный фрагмент, состоящий из двух фрагментов Fab, связанных дисульфидным мостиком в шарнирной области; (iii) фрагмент Fd, состоящий из доменов VH и CH1; (iv) фрагмент Fv, состоящий из доменов VL и VH отдельной области антитела; (v) фрагмент dAb (Ward et al. (1989) Nature 241: 544-546), состоящий из домена VH; и (vi) отдельная определяющая комплементарность область (CDR). Более того, несмотря на то что два домена в фрагменте Fv, VL и VH кодируются различными генами, их можно объединить, используя рекомбинантные технологии, посредством синтетического линкера, который позволяет построить из них единую белковую цепочку, в которой области VL и VH связываются с образованием моновалентных молекул (известных как одиночная цепь Fv (scFv); см., например, Bird et al. (1988) Science 242: 423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85: 5879-5883). Такие одноцепочечные антитела также включаются в сферу охвата термина «антигенсвязывающая область» антитела.
Краткое описание чертежей и таблиц, иллюстрирующих изобретение
На Фиг. 1 показаны аминокислотные (SEQ ID NO: 1 и 2) и нуклеотидные (SEQ ID NO: 3 и 4) последовательности МоАт В16.
На Фиг. 2 показано расположение участков CDRs в вариабельном домене легкой B16L и тяжелой В16Н цепей МоАт В10. Участки CDRs подчеркнуты.
На Фиг. 3 показана гель-электрофореграмма МоАт В16 в 10%-ом полиакриламидном геле в присутствии додецилсульфата натрия (SDS) и β-меркаптоэтанола; М - белковые маркеры молекулярного веса (Phosphorylase В, 94 kDa; BSA, 67 kDa; Ovalbumin, 43 kDa; Carbonic Anhydrase, 30 kDa; Trypsin Inhibitor, 20,1 kDa; α-Lactalbumin, 14,4 kDa), 1 - МоАт В16.
В Таблице 1 приведены результаты определения субизотипов МоАт В16 против интерферона бета-1а.
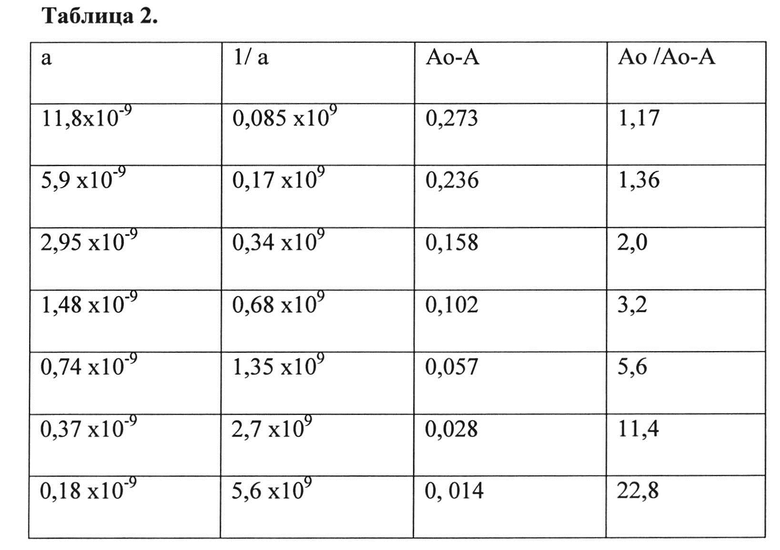
В Таблице 2 приведены параметры уравнения Клотца для МоАт В16.
В Таблице 3 приведено определение константы диссоциации МоАт В16 против интерферона бета-1а человека.
В Таблице 4 приведено ингибирование антителом В16 антипролиферативного действия интерферона-бета на клетки MCF7 (ОП - оптическая плотность).
Осуществление изобретения
Последующие примеры приведены для целей объяснения и не ограничивают каким-либо образом рамки настоящего изобретения.
Пример 1. Получение мышиного моноклонального антитела против интерферона бета-1а человека
Для иммунизации берут шестинедельных мышей линии Balb/c. Мышей линии BALB/c иммунизируют в подушечки задних лап дважды с двухнедельным интервалом. Антиген для первой иммунизации готовят следующим образом: сухой человеческий рекомбинантный интерферон бета-1а, экспрессированный в E.coli (E.coli-HuIFN-β, PeproTech, London, cat# 300-02B, Lot#03729 H084), растворяют в фосфатно-солевом буфере, рН 7,2 до концентрации 0,5 мг/мл, 100 мкл раствора смешивают с таким же объемом полного адъюванта Фройнда до образования гомогенной эмульсии. Антиген для повторной иммунизации готовят аналогичным образом, но вместо полного используют неполный адъювант Фройнда. Для первой иммунизации используют полный адъювант Фройнда, для второй иммунизации, проводимой на 14 день по той же схеме - неполный. Таким образом, разовая доза HuIFN-β составляет 50 мкг/мышь, а общая доза 100 мкг/мышь.
На четвертый день после второй иммунизации берут кровь из хвостовой вены у иммунизированной мыши и у контрольной (неиммунизированной) и проверяют на наличие специфических антител против E.coli-HuIFN-β, а также против интерферона бета-1a, экспрессированного в яйцеклетках хомяка (CHO-HuIFN-β, PeproTech, London, cat#300-02BC Lot#121SB29 H084). Тестирование проводят методом иммуноферментного анализа следующим образом: антиген (E.coli-HuIFN-β либо CHO-HuIFN-β) сорбируют в лунках 96- луночного планшета в течение ночи при 4°С в фосфатно-солевом буфере рН 7,2 (ФСБ) в концентрации 2 мкг/мл в объеме 50 мкл, далее проводят иммуноферментный анализ в стандартных условиях.
Мышей забивают, и спленоциты из подколенных лимфоузлов используют для гибридизации с клетками мышиной миеломы.
Полученные лимфоциты гибридизуют с клетками миеломы SP2/0 по стандартной методике с использованием 50% ПЭГ 4000 (Kohler G., Milstein С. Continuous cultures of fused cells secreting antibody of predefined specificity // Nature. 1975. Vol. 256. N 5517. P. 495-497). Клетки высевают в 96-луночные культуральные планшеты (по 6 планшетов на каждую гибридизацию) в ростовой среде DMEM с добавлением фетальной бычьей сыворотки до концентрации 8%, L-глутамина, пирувата, гентамицина, а также гипоксантина, тимидина и аминоптерина (HAT) в концентрациях, рекомендованных производителями добавок (полная селективная ростовая среда). Рост клеточных колоний оценивают визуально при помощи микроскопа. В большинстве лунок 96-луночных планшетов наблюдают рост 1-2 первичных культур на седьмой-десятый день после гибридизации. От каждой гибридизации получают около 4000 НАТ-устойчивых первичных культур. Тестирование супернатантов гибридом проводят методом непрямого иммуноферментного анализа (ИФА) с использованием рекомбинантного интерферона бета-1а человека.
Моноклональные антитела нарабатывают в асцитных жидкостях мышей линии Balb/c. Асцитные жидкости получают введением 1 млн. гибридомных клеток в перитонеальную полость мышей линии BALB/c. Мышам предварительно за неделю до введения клеток внутрибрюшинно вводят пристан по 0,5 мл на мышь. Через 11-14 сут после введения клеток собирают асцитную жидкость.
Определение субизотипов МоАт В16 против интерферона бета-1а проводят методом непрямого ИФА с использованием коммерческих типирующих сывороток: козьи антитела против иммуноглобулинов мыши разных изотипов, Sigma, ISO-2, Cat# М-5532 (anti-IgG1), М-5657 (anti-IgG2a), М-5782 (anti-IgG2b), М-5907 (anti-IgG3), М-6157 (anti-IgM), М-6032 (anti-IgA). Непрямой ИФА с сорбированным на планшеты E.coli-HuIFN-β проводят в стандартных условиях. В качестве источника антител используют культуральную жидкость гибридомы В16 без разведения, иммунные комплексы выявляют антителами кролика против иммуноглобулинов козы, конъюгированные с пероксидазой хрена, ООО «Импакт», Москва, в разведении, рекомендованном производителем. Субизотип тяжелой цепи полученного антитела В16 определен как IgG1 (Таблица 1).
Субизотип легкой цепи МоАт В16 определяют аналогичным образом, используя типирующие реагенты: набор Mouse Typer Isotyping Panel, Cat# 1722055, Bio-Rad. Субизотип легкой цепи полученного антитела В16 определен как каппа (Таблица 1).
Таблица 1. Результаты определения субизотипов МоАт В16 против интерферона бета-1а.
Одноименное антитело выделяют из асцитной жидкости методом аффинной хроматографии на белок G- сефарозе (GE Healthcare, США) в соответствии с протоколом, рекомендованным производителем и переводят диализом в фосфатно-солевой буфер ФСБ. Степень чистоты МоАт контролируют при помощи электрофореза в 10%-ом полиакриламидном геле в присутствии додецилсульфата натрия (SDS) и 0-меркаптоэтанола в ступенчатой буферной системе Лэммли (SDS-PAGE), используя Mini PROTEAN 3 Electrophoresis System (Фиг. 3), а также при помощи высокоэффективной жидкостной хроматографии на хроматографе «АКТА explorer/purifier/basic» (GE Healthcare, США) в режиме гель-фильтрации с использованием колонки Superdex 200 (1×40 см). По данным электрофореза в восстанавливающих условиях на геле присутствуют 2 полосы, соответствующие тяжелой и легкой цепям иммуноглобулина мыши IgG1-изотипа.
Пример 2. Анализ мышиного моноклонального антитела В16 против интерферона бета-1а человека.
Метод оценки количественных параметров, характеризующих специфическую активность моноклональных антител против интерферона бета-1а, основан на измерении константы диссоциации комплекса антиген-антитело в растворе, т.к. именно этот параметр количественно определяет аффинность и специфичность взаимодействия МоАт с целевыми белками E.coli-HuIFN-β и CHO-HuIFN-β и не зависит от концентрации антител. В основу методики определения Кд положен двухстадийный анализ, предложенный Фриге и соавторами в 1985 (В. Friguet et. al. Measurements of the True Affinity Constant in Solution of Antigen-Antibody Complex by Enzyme-Linked Immunosorbent Assay. Journal of Immunological Methods, 77 (1985) 305-319). На первом этапе проводят инкубацию МоАт в постоянной концентрации с антигеном интерфероном бета-1а в диапазоне концентраций 0.18-240 нМ в течение 2 часов при комнатной температуре с постоянным перемешиванием на шейкере для достижения термодинамического равновесия в трехкомпонентной системе: свободный антиген, свободное антитело и комплекс антиген-антитело. На втором этапе осуществляют измерение концентрации свободных антител методом твердофазного ИФА с иммобилизованным на планшет интерфероном бета-1а. На заключительном этапе рассчитывают Кд по уравнению Клотца с использованием значений общей концентрации антигена и концентрации свободных МоАт (Klotz I.M. The Proteins. Ed. H. Neurath and К. Bailey Academic Press, New York. 1953. V. 1. P. 727).
Для построения калибровочных кривых используют диапозон концентраций моноклонального антитела В16 от 200 нг/мл до 10 нг/мл.
Константу диссоциации (Kd) рассчитовают по уравнению Клотца:
Ао/Ао-А=1+1/а Kd, где
Ао - оптическая плотность, измеренная для антител в отсутствии антигена
А - оптическая плотность, измеренная для свободных антител в смеси антиген-антитело.
а - концентрация антигена.
Значения этих параметров для МоАт В16 приведены в Таблице 2. Константа диссоциации МоАт В16 определена как 3,2 пМ (Таблица 3). Концентрацию МоАт, для измерения Kd выбирают на линейном участке калибровочной кривой.
Таблица 2. Параметры уравнения Клотца для МоАт В16.
Таблица 3. Определение константы диссоциации МоАт В16 против интерферона бета-1а человека.
Пример 3. Клонирование и секвенирование последовательностей кДНК, кодирующих вариабельные домены мышиного антитела В16 к интерферону бета-1а человека.
Гены вариабельных доменов легкой и тяжелой цепей MoAT В16 получают с помощью реакции обратной транскрипции-амплификации тотальной РНК В16. РНК выделяют из 1-2×106 клеток гибридомы В16 с помощью реагента Trizol (Life Technologies, США) согласно рекомендуемому производителем протоколу. Обратную транскрипцию проводят, применяя обратную транскриптазу MMuLV (Евроген, Россия) и олиго(dT18)-праймер. Полученную кДНК амплифицируют с помощью ДНК-полимеразы Tersus (Евроген, Россия) с использованием набора праймеров, комплементарных областям константных доменов МоАт:
SMRibo 5'-AAGCAGTGGTATCAACGCAGAGTACGCrGrGrG
RT-KAP 5'-GAGTCAGCACACGAAGAACTTG
NesG 5'-CAGGGGCCAGTGGATAGAC
Полученные ПЦР-фрагменты длиной 600-650 п.о. клонируют в вектор pAL2-T (Евроген, Россия) и отбирают не менее 10 положительных клонов как для легкой, так и для тяжелой цепи МоАТ, после чего с помощью секвенирования определяют нуклеотидные последовательности, кодирующие вариабельные фрагменты. Затем проводят сравнение нуклеотидных последовательностей с помощью программ Chromas, CLC Sequence Viewer и GeneBee. В результате анализа определяют консенсусные нуклеотидные последовательности вариабельных доменов тяжелой (SEQ ID NO: 3) и легкой (SEQ ID NO: 4) цепей МоАт В16. На их основании с учетом трансляционного кода определяют аминокислотные последовательности вариабельных доменов тяжелой (SEQ ID NO: 1) и легкой (SEQ ID NO: 2) цепей МоАт В16. Для подтверждения достоверности определения аминокислотных последовательностей МоАт В16 проводят масс-спектрометрический анализ фрагментов трипсинового гидролиза легких и тяжелых цепей исходного моноклонального МоАт В16. Полученные последовательности оценивают с помощью сравнения с гомологичными последовательностями, находящимися в базе данных GeneBank (IgBlast) и подтверждают их принадлежность к генам вариабельных доменов тяжелой и легкой цепи антител Mus museums. Участки CDRs VL и VH (Фиг. 2) определяют по номенклатуре Международной информационной системы по иммуногенетике (International Immunogenetics Information System, www.imgt.org).
Таким образом, были получены аминокислотные последовательности SEQ ID NO: 1 и SEQ ID NO: 2, а также нуклеотидные последовательности SEQ ID NO: 3 и SEQ ID NO: 4.
Пример 4. Определение нейтрализующей активности мышиного антитела В16 к интерферону бета-1а человека в тестах по ингибированию антипролиферативного действия интерферона бета-1а.
Постановку антипролиферативного теста осуществляют следующим образом. Клетки MCF7 ((АТСС® НТВ-22™) карцинома рака груди) выращивают в чашках Петри до 80-90% монослоя в полной ростовой среде DMEM с добавлением 10% эмбриональной телячьей сыворотки (ЭТС). Монослой промывают дважды буфером ФСБ (0,01 М КН2РО4, 0,1 М NaCl;), затем инкубируют с буфером ФСБ с добавлением 1 мМ ЭДТА в течение 5 минут при помешивании. Затем клетки отделяют от подложки пипетированием в ФСБ с добавлением 1 мМ ЭДТА и центрифугируют в течение 10 минут при 1200 об/мин. Клеточный осадок ресуспендируют в полной ростовой среде DMEM с добавлением 2% ЭТС, подсчитывают в камере Горяева и высаживают в 96-луночный планшет из расчета 5 тысяч клеток в 100 мкл суспензии на лунку. Краевые лунки заполняют деионизованной водой.
Через 24 часа готовят разведения интерферона бета-1а 1000 ед/мл (дающее около 50% ингибирования роста клеток), интерферона бета-1а 1000 ед/мл с моноклональными антителами от 50 мкг/мл (молярное соотношение 1>>100), моноклональных антител 50 мкг/мл в полной ростовой среде DMEM с 2% ЭТС. Каждое разведение делают в трех повторах. Позитивные контроли - лунки без интерферона бета-1а: 0 (среда) и 0+50 (среда с максимальной концентрацией антител 50 мкг\мл). Негативные контроли - лунки с интерфероном бета-1а без антител (ИФН 1000 ед/мл). Смеси интерферона бета-1а с антителами инкубируют в течение 60 минут в СО2-инкубаторе при температуре 37°С для формирования иммунных комплексов.
Приготовленные разведения вносят в лунки планшетов по 100 мкл. Инкубацию проводят в течение 72 часов. В лунки добавляют МТТ до конечной концентрации 0,05% и помещают в СО2-инкубатор на 4 часа при температуре 37°С. После инкубации с МТТ супернатанты вытряхивают из лунок и добавляют по 100 мкл в лунку диметолсульфоксида и держат на шейкере при комнатной температуре в течение 15 минут.
Оптические плотности в лунках определяют при помощи спектрофотометра Thermo Multiscan EX при длине волны 594 нм. Результаты для антитела В16 к интерферону бета-1а человека приведены в Таблице 4.
Таблица 4. Ингибирование антителом В16 антипролиферативного действия интерферона бета-1а на клетки MCF7 (ОП - оптическая плотность).
| название | год | авторы | номер документа |
|---|---|---|---|
| Моноклональное антитело к интерферону бета-1а человека | 2018 |
|
RU2728696C2 |
| Гуманизированное нейтрализующее антитело к интерферону-бета человека | 2019 |
|
RU2737466C1 |
| Рекомбинантный Fab-scFv на основе нейтрализующего антитела против интерферона бета-1а человека и антитела против рецептора ErbB2 человека | 2019 |
|
RU2748953C1 |
| Вариабельные домены лёгкой и тяжёлой цепи мышиного моноклонального антитела против интерферона альфа (IFN-α) человека, антигенсвязывающий фрагмент (Fab) против IFN-α человека, содержащий указанные домены | 2018 |
|
RU2694672C1 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, СВЯЗЫВАЮЩЕЕСЯ С ГЛИКОПРОТЕИНОМ ВИРУСА ЭБОЛА, ФРАГМЕНТЫ ДНК, КОДИРУЮЩИЕ УКАЗАННОЕ АНТИТЕЛО, И АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ | 2016 |
|
RU2644334C2 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, СВЯЗЫВАЮЩЕЕСЯ С ГЛИКОПРОТЕИНОМ ВИРУСА ЭБОЛА, ФРАГМЕНТЫ ДНК, КОДИРУЮЩИЕ УКАЗАННОЕ АНТИТЕЛО, И АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ | 2015 |
|
RU2639533C2 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, СВЯЗЫВАЮЩЕЕСЯ С ГЛИКОПРОТЕИНОМ ВИРУСА ЭБОЛА, ФРАГМЕНТЫ ДНК, КОДИРУЮЩИЕ УКАЗАННОЕ АНТИТЕЛО, И АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ | 2015 |
|
RU2630304C2 |
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО И АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ (Fab), СВЯЗЫВАЮЩИЕСЯ С ИНТЕРФЕРОНОМ- γ ЧЕЛОВЕКА, ФРАГМЕНТЫ ДНК, КОДИРУЮЩИЕ УКАЗАННОЕ АНТИТЕЛО И АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ, КЛЕТКА, ТРАНСФОРМИРОВАННАЯ ФРАГМЕНТОМ ДНК, И СПОСОБ ПОЛУЧЕНИЯ УКАЗАННОГО АНТИТЕЛА И АНТИГЕНСВЯЗЫВАЮЩЕГО ФРАГМЕНТА | 2013 |
|
RU2539752C2 |
| АНТИТЕЛА РЕЦЕПТОРА 1 ИНТЕРФЕРОНА АЛЬФА И ИХ ПРИМЕНЕНИЕ | 2005 |
|
RU2600884C2 |
| ВАРИАБЕЛЬНЫЕ ДОМЕНЫ ЛЕГКОЙ И ТЯЖЕЛОЙ ЦЕПИ МЫШИНОГО МОНОКЛОНАЛЬНОГО АНТИТЕЛА ПРОТИВ ФАКТОРА НЕКРОЗА ОПУХОЛИ АЛЬФА (ФНО-α) ЧЕЛОВЕКА (ВАРИАНТЫ), АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ (Fab) ПРОТИВ ФНО-α ЧЕЛОВЕКА, СОДЕРЖАЩИЙ УКАЗАННЫЕ ДОМЕНЫ (ВАРИАНТЫ) | 2012 |
|
RU2499000C1 |

Изобретение относится к области биохимии, в частности к моноклональному антителу, селективно связывающему интерферон бета-1а человека. Также раскрыты изолированные фрагменты ДНК, кодирующие VH или VL, кодирующие указанное антитело, и антигенсвязывающий фрагмент указанного антитела. Изобретение позволяет эффективно лечить заболевания, ассоциированные с интерфероном бета-1а человека. 4 н.п. ф-лы, 3 ил., 4 табл., 4 пр.
1. Моноклональное антитело, селективно связывающее интерферон бета-1а человека и способное нейтрализовать его биологическую активность, включающее вариабельный участок тяжелой цепи (VH) указанного антитела, содержащий последовательность аминокислот SEQ ID NO: 1, а вариабельный участок легкой цепи (VL) указанного антитела содержит последовательность аминокислот SEQ ID NO: 2.
2. Изолированный фрагмент ДНК, кодирующий VH антитела по п. 1, с нуклеотидной последовательностью SEQ ID NO: 3.
3. Изолированный фрагмент ДНК, кодирующий VL антитела по п. 1, с нуклеотидной последовательностью SEQ ID NO: 4.
4. Антигенсвязывающий фрагмент моноклонального антитела по п. 1, селективно связывающий интерферон бета-1а человека, содержащий вариабельный участок тяжелой цепи (VH) указанного антитела с последовательностью аминокислот SEQ ID NO: 1, и вариабельный участок легкой цепи (VL) указанного антитела с последовательностью аминокислот SEQ ID NO: 2.
| УЛУЧШЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ АДДУКТОВ АМИНОВ С О-ГИДРОКСИАЛЬДЕГИДАМИ, ЯВЛЯЮЩИХСЯ ОСНОВАНИЯМИ ШИФФА, И АДДУКТНЫЙ КОНЕЧНЫЙ ПРОДУКТ КОНДЕНСАЦИИ | 1999 |
|
RU2201936C2 |
| Автоматическая масленка для крейцкопфов | 1928 |
|
SU9668A1 |
| АНТИТЕЛА К РЕЦЕПТОРУ КОНЕЧНЫХ ПРОДУКТОВ ГЛУБОКОГО ГЛИКИРОВАНИЯ (RAGE) И ИХ ПРИМЕНЕНИЯ | 2009 |
|
RU2518351C2 |
Авторы
Даты
2020-08-06—Публикация
2018-12-28—Подача