Изобретение относится к фармацевтике, а именно к лекарственным препаратам на основе сорафениба тозилата.
Сорафениб, имеющий химическую формулу 4-[4-({[4-хлоро-3-(трифто-рометил)фенил]карбамоил}амино)фено-кси]-N-метил-пиридин-2-карбо-ксамид- является веществом, биологическая активность солей которого оказалась перспективныой для лечения онкологических заболеваний.
В настоящее время известны соли сорафениба с такими кислотами как: хлористоводородная, бромистоводородная, серная, яблочная, метансуль-фоновая, этансульфоновая, диметилсульфоновая, п-толуолсульфоновая, нафталин-1,5-дисульфоновая и другие (WO 2006/034796, 2006.; WO 2011/076711, 2011 г.; WO 2010/142678, 2010.; US 8217061, 2014.; WO 2012/071425, 2012; RU 2420283, 2011 г.; RU 2009121653, 2010; WO 2011/058522, 2011 г.; WO 2011/092663, 2011 г.; WO 2011/036648, 2011 г. US 8552197, 2013 г. и др.).
Наиболее перспективной из солей сорафениба является - соль толуолсульфоновой кислоты. Сорафениб тозилат (далее СТ) - международное непатентованное название 4-[4-({[4-хлоро-3-(трифторометил)фенил]карбамоил}амино)фено-кси]-N-метил-пиридин-2-карбоксамида п-толуол-сульфоната, использование которого подавляет рост опухоли при печеночно-клеточном и почечно-клеточном раке у человека. Предполагаемый механизм фармакологического действия СТ заключается в том, что он подавляет многочисленные внутриклеточные киназы (BRAF, c-CRAF и мутантную BRAF) и киназы, расположенные на поверхности клетки (KIT, FLT-3, RET, VEGFR-1, VEGFR-2, VEGFR-3 и PDGFR-P), которые, как полагают, что некоторые из этих киназ задействованы в сигнальных системах опухолевой клетки, в процессах ангиогенеза и апоптоза. (http://farmaspravka.com/sorafenib-sorafenib).
Одной из особенностей СТ является способность стабильно существовать в различных кристаллических формах (WO 2006/034796, 2006; US 8618305, 2013; WO 2006/034797, 2006; WO 2009/092070, 2009 г.; г. и др.). В частности, известны полиморфные модификации СТ: кристаллические (Форма I; Форма II; Форма III), аморфная форма а также β-модификация (RU 2568638, 2015; WO 2006/034797, 2006; WO 2007/053574, 2007; WO 2009/092070, 2009; US 8217061, 2012; WO 2009/106825, 2009; WO 2010/079498, 2010; US 8604208, 2013 г.; WO 2013/175483, 2013; WO 2013/110644, 2013; WO 2014/012480, 2014; US 8609854, 2013 и др.).
Данные кристаллические формы получают по различным методам синтеза и имеют различные физико-химические свойства, такие как растворимость, ионизирующая способность, параметры кристаллической структуры и т.п., что влияет на особенностями воздействия СТ на ткани и системы организма (RU 219693, 2008; ЕР 015151, 2011; US 8609854, 2013; WO 2009/111061,2009; WO 2011/036648, 2011; WO 2009/034308, 2009; WO 2009/106825, 2009; WO 2009/054004, 2009 и др.)
Учитывая, что воздействие СТ может вызвать различные осложнения, такие как кровотечения (в т.ч., кровотечения из желудочно-кишечного тракта, дыхательных путей и кровоизлияние в головной мозг), повышение артериального давления; приливы крови к лицу; гипертонический криз, ишемия миокарда, дерматологические реакции (кожная сыпь, алопеция, ладонно-подошвенная эритродизестезия, эритема, кожный зуд; эксфолиативный дерматит, акне), диарея, тошнота, рвота, боли в животе; стоматит, крапивница и др. (http://farmaspravka.com/sorafenib-sorafenib), то важное значение приобретают характеристики лекарственной формы, содержащей СТ, в частности, время рассасывания в желудке, прочностные характеристики и т.п.
В настоящее время основной практический интерес представляют полиморфные формы I и III, которые обладают повышенной стабильностью по сравнению с другими кристаллическими формами (WO 2006/034797, 2006; WO 2013110644, 2013), что обеспечивает отсутствие нежелательного превращения в любой другой полиморф, а так-же повышает безопасность и качество фармацевтических препаратов, содержащих СТ.
Основной лекарственной формой СТ являются таблетки. Хотя известно использование СТ в виде порошка, который диспергируется в воде и вводится в организм через трубку, если пациент, нуждающийся в препарате СТ, испытывает трудности с глотанием. Тем не менее, такое использование затруднено в связи с необходимостью сложного обращения с сыпучей порошковой формой для тяжело больных пациентов.
Известны таблетки СТ формы III, разработанные международной фармацевтической компанией Sandoz (WO 2013110644, 2013). Таблетка содержит от 80 до 90 мас. % СТ формы III, от 2 до 6 масс. % МКЦ в качестве наполнителя, от 6 до 12 мас. % кроскамеллозы в качестве дезинтегранта, от 0,5 до 5 мас. % гипромеллозы в качестве связующего, от 0,2 до 0,8 мас. % стеарата магния как лубриканта и от 0,2 до 0,8 мас. %, от 0,2 до 0,8% лаурилсульфата натрия, в качестве в количестве модификатора смачиваемости.
Таблетку получают методом влажного гранулирования. При этом СТ формы III обрабатывают водным раствором, содержащим вспомогательное вещество, например, связующее и ПАВ, после чего гранулируют и сушат. Высушенные гранулы смешивают с одним дополнительным наполнителем, смазывающим веществом (стеаратом магния) и/или с дезинтегрантом - кроскармеллозой натрия, а затем наносят пленочное покрытие, по меньшей мере, с одним наполнителем.
В частности, наиболее близкой к заявляемому способу получения является технология по которой СТ формы III и маннит при соотношении СТ : маннит 1:1 обрабатывают водой очищенной, гранулируют, а затем добавляют микрокристаллическую целлюлозу и крахмал, смешивают с помощью гравитационного смесителя и прессуют на роторном таблеточном прессе.
Недостатком способа являлась недостаточная скорость растворения, необходимость воздействия на СТ водой, а также требования к содержанию СТ формы III не менее 90%, так как при наличии значительного количества примесей иных кристаллических модификаций он не позволяет обеспечить необходимую скорость растворения. Так, при использовании СТ I через 5 минут растворение происходит только на 42%, а на 95% через 15 минут, а при длительном хранении - лекарственная часть растворяется на 0% через 5 минут и на 28% через 15 минут.
Таблетки, содержащие кристаллическую модификацию СТ в форме II производит «AFINE CHEMICALS LTD», Китай, а ее \\\-модификацию ООО «НАТИВА», РФ (RU 2568638, 2015). Состав таблеток «AFINE CHEMICALS LTD» не опубликован. Таблетки «СОРАФЕНИБ-НАТИВ» (ООО «НАТИВА», РФ) получают смешением ингредиентов и содержат 73-75% СТ β-модификации, 6% МКЦ, 13,3-13,5% кроскармеллозы натрия, 0,6% натрия лаурил-сульфата, 3,7-3,8% гипромеллозы, 0,9-1% магния стеарата. (RU 2568638, 2015; https://www.rlsnet.ru/tn_index_id_95267.htm; https://he-alth.mail.m/drug/sora-fenibnativ/#composition). Препарат может храниться около 3 лет. Недостатком II формы СТ является медленная растворимость от 14 до 25 минут (RU 2568638, 2015).
Наиболее близкой по технической сущности к заявляемому изобретению в отношении таблетки является реализуемая на фармацевтическом рынке в настоящее время таблетка с покрытием для немедленного высвобождения под торговым названием «Нексавар», производства Bayer Pharma A.G., Германия, содержащая СТ полиморфной формы I. (https://www.rlsnet.ru/tn_index_id_36388.htm#sostav). Таблетка содержит 80% СТ формы I, и в качестве вспомогательных веществ - микрокристаллическую целлюлозу (МКЦ), натрия кроскармеллозу, гипромеллозу, магния стеарат, натрия лаурилсульфат, гипромеллозу. В состав оболочки входят гипромеллоза, макрогол 3350; диоксид титана; оксид железа красный.
Серьезным недостатком таблетки является длительность ее распада, который занимает около 6 минут, а также нестабильность при хранении (WO 2013110644, 2013), что обусловлено относительно высокой чувствительностью к действию влаги. Кроме того состав таблетки реализуется только с полиморфной формы I, т.е. не является универсальным.
Задачей, решаемой авторами, являлось создание состава таблетки, обеспечивающей быстрое растворение СТ формы 1, в частности, ставилась задача добиться распада таблетки менее чем за 3 минуты, т.е. создать диспергируемую таблетку, пригодную для самостоятельного изготовления суспензий пациентами. Состав таблетки должен был обеспечить растворение не менее 80% за 15 минут в среде растворения (1% раствор натрия лаурилсульфата в 0,1 М хлористоводородной кислоте), а также создать технологию получения таблетки, пригодной для различных кристаллических модификаций и их смесей.
Технический результат в отношении способа достигается путем разбавления порошка СТ наполнителем маннитом при соотношении СТ: манит от 1:1 до 1:7 (лучшие результаты достигаются при соотношении 1:2), после чего в полученную смесь добавляют натрия кроскармеллозу и натрия лаурилсульфат, перемешивают, добавляют натрия стеарилфумарат, прессуют и наносят оболочку.
Особенностью заявляемой технологии является обработка частиц СТ порошком маннита с образованием микрокапсул, внутри которых находится кристаллы СТ с последующим нанесением на поверхность капсул
Дополнительным преимуществом способа является исключение контакта СТ с водой, упрощение технологии за счет исключения стадий гранулирования и сушки.
Технический результат в отношении таблетки достигается созданием таблеточной формы, состоящей из таблетки-ядра, в состав которой входят СТ, натрия кроскармеллоза и натрия лаурилсульфат, манит в соотношении СТ : маннит от 1:1 до 1:7, натрия стеарилфумарат и коллоидный кремния диоксид при следующем соотношении ингредиентов: сорафениб тозилат 10-40% масс, маннит от 40-70% масс, кремния диоксида коллоидный 1,0- 4,0% масс, натрия стеарилфумарат 0,5-5% масс, натрия кроскармеллоза 5-20% масс, натрия лаурилсульфат 0,1-1% масс, а также оболочку, масса которой составляет 1-5% масс.
Использование СТ в концентрации менее 10% масс неэффективно, при концентрации более 40% масс не удается достичь нужной скорости растворения. В качестве активной фармацевтической субстанции, как правило, используют СТ формы I, однако данная рецептура таблетки может быть успешно использоваться для СТ формы II и СТ формы III.
При этом используемые вспомогательные вещества выполняют следующие функции:
• кремния диоксида коллоидный (аэросил) является эффективным глидантом, который при совместном размоле с СТ обеспечивает лучшую сыпучесть активной фармацевтической субстанции;
• маннит (манитол)-сахарный спирт, способный облеплять поверхность частиц СТ, образуя «миникапсулы» и при растворении, способствующий транспортировке растворителя к частицам СТ;
• натрия кроскармеллоза - дезинтегрант для твердых лекарственных средств, который благодаря своей высокой поглощающей способности способствует быстрому диспергированию частиц таблетки;
• натрия лаурилсульфат - сильное анионное поверхностно-активное вещество, проявляющее смачивающее действие для уменьшения адгезии на границе раздела фаз, таблеточная масса/ прессинструмент при получении таблеточной формы.
• натрия стеарилфумарат - высокоэффективный современный лубрикант для прямого прессования, в наименьшей степени по сравнению с аналогами негативно влияющий на процесс растворения таблетки.
В качестве покрытия используется стандартное покрытие для таблетки, например, пленочное покрытие на водной основе Опадрай АМВ II88 А1 80040 белого цвета
Использование маннита в концентрации менее 40% масс не позволяет обеспечить полное покрытие поверхности кристаллов СТ, что ведет к снижению скорости растворения, использование концентрации более 70% масс. маннита приводит к избыточному увеличению массы таблетки для необходимости сохранения эквивалентной дозировки СТ и является экономически нецелесообразным.
Использование кремния диоксида в концентрации менее 1,0% масс и натрия кроскармеллозы менее 5% масс., не гарантирует оптимальное диспергирование активной фармацевтической субстанции, концентрация кремния диоксида более 4% масс. и натрия кроскармеллозы более 20% масс. не позволяет улучшать диспергируемость и приводит к затруднениям в прессовании таблеток, снижающим их прочность.
Концентрация натрия стеарилфумарата менее 0,5 масс. и натрия лаурилсульфата менее 0,1% масс. приводит к налипанию таблеточной массы на прессинструмент и увеличивает количество отбракованных таблеток, концентрация натрия стеарилфумарата более 5% масс. и натрия лаурилсульфата более 1% масс. вызывает снижение растворения СТ в среду (1% раствор натрия лаурилсульфата в 0,1 М хлористоводородной кислоте).
Промышленная применимость изобретения иллюстрируется следующими примерами.
Пример 1. Получение образца 1. 274,00 г сорафениба тозилата и 10,96 г кремния диоксида коллоидного перемешивали в шаровой мельнице в течение 1 часа. Измельченный порошок был загружен в V-образный смеситель, где к нему было добавлено 548,00 г маннита, 85,00 г кроскармеллозы натрия и 2,74 г лаурилсульфата натрия, просеянных через сито с размером ячеек сетки 0,8 мм, и после чего компоненты были смешаны в течение 10 минут. Далее к полученной массе было добавлено 9,3 мг натрия стеарилфумарата, просеянного через сито с размером ячеек сетки 0,315 мм, и произведено дополнительное перемешивание в V-образном смесителе в течение 5 минут.
Выгруженная масса была передана на таблетирование на роторном таблеточном прессе для получения таблеток-ядер средней массы 930 мг с содержанием сорафениба 200 мг (274 мг сорафениба тозилата). После этого на таблетки было нанесено пленочное покрытие на водной основе Опадрай АМВ II88A180040 белого цвета в количестве 16 мг на таблетку-ядро.
Пример 2. По методологии примера 1 было получено 3 образца таблеток СТ I с разным соотношением ингредиентов. Состав таблеток приведен в таблице 1. Таблетки подвергали следующим испытаниям: Тестирование растворимости таблеток проводили с использованием аппарата 2 «Лопастная мешалка» со скоростью вращения 50 об/мин и температурой испытания 37°С ± 0,5°С. Среда для растворения представляла собой 900 мл 1% раствора натрия лаурилсульфата в 0,1 М хлористоводородной кислоте.
Процедура: 900 мл среды растворения вносили в сосуд лопастной мешалки. Начинали вращение и нагревали до температуры 37°С ± 0,5, в каждый из 6 сосудов помещали по 1 таблетке, включали таймер. Через 15 минут отбирали пробу и фильтровали через мембранный фильтр PTFE с диаметром пор 0,45 мкм.
Концентрацию лекарственного средства измеряли УФ-детектированием при длине волны 265 нм. В качестве раствора сравнения использовали среду растворения.
Альтернативно, образцы анализировали с помощью ВЭЖХ. Система ВЭЖХ состояла из следующих блоков: градиентный насос, автосемплер с термостатом, термостат колонки и диодноматричный детектор (система Shimadzu prominence)
Условия хроматографирования: хроматографическая колонка: XTerra RP18 50 мм × 3 мм, 5 мкм; подвижная фаза: 0,1% калия дигидрофосфат рН 2,5 50: 50 ацетонитрил; скорость потока: 3,0 мл/мин; температура колонки: 40°С; детектор: 266 нм; объем вкола: 5 мкл;
Скорость распада таблетки оценивали на тестере «Распадаемости» PharmaTest модель DIST-3 по методике ОФС.1.4.2.0013.15 Распадаемость таблеток и капсул, при температуре от 15 до 25°С.
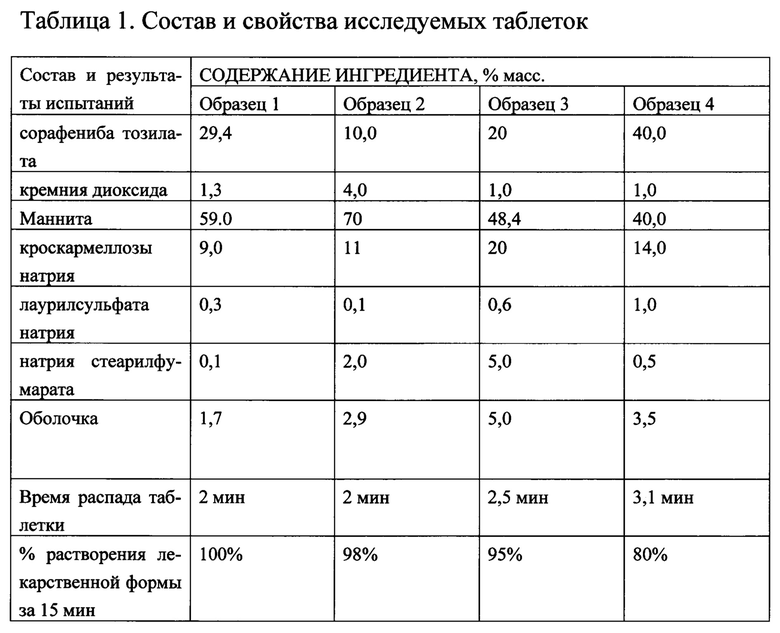
Пример 3. В условиях примера 1 проводились опыты при замене СТ I на СТ III, смеси 50% СТ I и 50% СТ III или СТ II. Полученные результаты приведены в таблице 2.
Таблица 2. Влияние природы СТ на свойства исследуемых таблеток.
Состав: 30% СТ, 1,5% кремния диоксида, 60% маннита, 10% кроскармеллозы натрия; лаурилсульфата натрия 0,3%, натрия стеарилфумарата 0,2%.
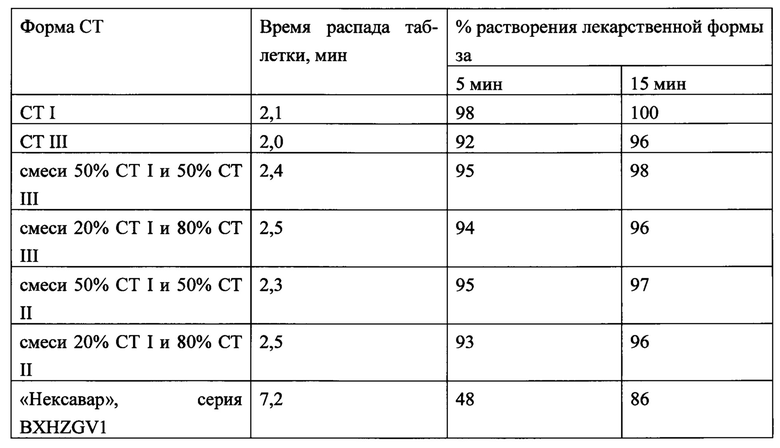
Тем самым показано, что заявляемая таблетка СТ I, или смесь полиморфных модификаций СТ I и СТ III или СТ I и СТ II, в данной композиции обладает более высокой степенью растворимости по сравнению с аналогами. Использование заявляемого способа позволяет получать таблетки с различными модификациями кристаллических структур по более простой технологии с высокой скоростью растворения.
Изобретение относится к фармацевтике, а именно к лекарственным препаратам на основе сорафениба тозилата и способам их получения. Предлагается способ получения таблетки на основе сорафениба тозилата путем смешения сорафениба тозилата с маннитом и вспомогательными веществами, в котором порошок сорафениба тозилат обрабатывают в отсутствие воды порошком маннита при соотношении сорафениба тозилат : манит от 1:1 до 1:7 (оптимально 1:2), после чего в полученную смесь добавляют натрия кроскармеллозу и натрия лаурилсульфат, перемешивают, добавляют натрия стеарилфумарат, прессуют и наносят оболочку. Таблетка на основе сорафениба тозилата содержит в качестве наполнителя маннит, натрия стеарилфумарат и коллоидный кремния диоксида при следующем соотношении ингредиентов (% масс.): сорафениб тозилат от 10 до 40; маннит от 40 до 70; кремния диоксида коллоидный от 1,0 до 4,0; натрия стеарилфумарат 0,5-5; натрия кроскармеллоза 9-20; натрия лаурилсульфат. 2 н. и 1 з.п. ф-лы, 3 пр., 1 табл.
1. Фармацевтический препарат в форме таблетки на основе сорафениба тозилата, содержащий сорафениба тозилат, наполнитель, натрия кроскармеллозу, натрия лаурилсульфат и оболочку, отличающийся тем, что он содержит дополнительно натрия стеарилфумарат и коллоидный кремния диоксида, в качестве наполнителя содержит маннит, при условии, что сорафениба тозилата, предварительно измельченный коллоидным диоксидом кремния, находится в виде микрокапсулы с маннитом и дополнительно содержит натрия стеарилфумарат и коллоидный кремния диоксида при следующем соотношении ингредиентов (% масс.):
сорафениб тозилат от 10 до 40
маннит от 40 до 70
кремния диоксида коллоидный от 1,0 до 4,0
натрия стеарилфумарат 0,5-5
натрия кроскармеллоза 9-20
натрия лаурилсульфат 0,1-1
оболочку – остальное,
при массовом соотношении сорафениб тозилат : маннит от 1:1 до 1:7.
2. Способ получения фармацевтического препарата в форме таблетки по п. 1 на основе сорафениба тозилата, отличающийся тем, что порошок сорафениба тозилат, полученный путем измельчения с коллоидным диоксидом кремния, обрабатывают в отсутствие воды порошком маннита при массовом соотношении сорафениба тозилат : манит от 1:1 до 1:7, после чего в полученную смесь добавляют натрия кроскармеллозу и натрия лаурилсульфат, перемешивают, добавляют натрия стеарилфумарат, прессуют и наносят оболочку.
3. Способ по п. 2, отличающийся тем, что порошок сорафениба тозилат обрабатывают порошком маннита при соотношении сорафениба тозилат : манит 1:2.
| CN 110339173 A, 2019.10.18 | |||
| WO 2013110644 A1, 2013.08.01 | |||
| КРИСТАЛЛИЧЕСКАЯ β-МОДИФИКАЦИЯ 4-[4-({ [4-ХЛОРО-3-(ТРИФТОРОМЕТИЛ) ФЕНИЛ]КАРБАМОИЛ} АМИНО)ФЕНОКСИ]-N-МЕТИЛ-ПИРИДИН-2-КАРБОКСАМИДА п-ТОЛУОЛСУЛЬФОНАТА, СПОСОБ ЕЁ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕЁ ОСНОВЕ | 2015 |
|
RU2568638C1 |
| Сорафениб - инструкция по применению, 14 июля 2018 г., найдено онлайн, найдено в Интернете: https://medi.ru/instrukciya/sorafenib_14959/. | |||
Авторы
Даты
2021-05-06—Публикация
2019-11-06—Подача