Область техники.
Изобретение относится области экспериментальной медицины, а именно, к способам получения моделей заболеваний и может быть использован для моделирования остеомиелита у лабораторных животных.
Известны различные способы моделирования остеомиелита у экспериментальных животных, основанные на бактериальной инокуляции и дополнительных манипуляциях с тканями. Для индукции инфекции дополнительно используют склерозирующие агенты, фибриновый клей, герметики, внедрение инородных тел (лавсан, кварцевый песок, металлические имплантаты). Также известны модели с использованием предварительно колонизированных имплантатов при отсутствии бактериальной суспензии в месте операции.
Известны способы моделирования остеомиелита, состоящие во введении бактериальной суспензии в костномозговой канал с предварительной или последующей установкой интрамедуллярного металлического имплантата (RU 2 233 486 C1, RU 2 129 735 C1, Harrasser, N. et al. (2016), Lucke M. et al. (2003), Jensen L. K. et al. (2017), Hill, P. F. et al. (2002), Stewart S. et al. (2012).
Известны способы моделирования остеомиелита с использованием имплантационного материала, предвательно контаминированного штаммом патогенного микроорганизма (Hamel A. et al. (2008), Lei M. et al. (2017), Zhang X. et al. (2017).
Известны двухэтапные способы моделирования остеомиелита, заключающиеся во введении инфицирующего материала в зону предварительно сформированного ишемического некроза (RU 2015 153 229 А, RU 2 622 3696 C1).
Известными способами не обеспечивается минимальная травматизация тканей и стабильное положение имплантата во внутрикостном канале при развитии инфекционного процесса. Не обеспечивается моделирование остеомиелита бедренной кости у мелких лабораторных животных в условиях внешней аппаратной фиксации имплантата с получением однотипных клинических, рентгенологических, гистоморфологических и лабораторных признаков.
Известен способ моделирования острой интрамедуллярной инфекции большеберцовой кости у кроликов Odekerken J. C. E. et al. (2013), заключающаяся в котаминировании костномозгового канала бактериальным штаммом, введением в него 20 миллиметрового титанового стержня через транспателлярный доступ и закрытия дефекта костным воском.
Недостатком данного способа является дополнительное травмирование собственной связки надколенника.
Известна модель Cobb L. H. et al. (2019) заключающаяся в создании у крыс бикортикального дефекта диаметром 1,2 мм в средней трети диафиза и имплантацией в него ортопедического винта, контаминированного бактериальным штаммом.
Недостатком данного способа является риск развития нестабильности ортопедического винта в процессе прогрессирования остеомиелитического процесса.
Сущность изобретения.
Задачей является создание способа моделирования остеомиелита у мелких лабораторных животных со стабильно фиксированным имплантатом при малоинвазивном хирургическом вмешательстве.
Способ расширяет арсенал известных способов моделирования остеомиелита бедренной кости у мелких лабораторных животных при этом осуществляется минимальная травматизация тканей и обеспечивается стабильное положение имплантата во внутрикостном канале при развитии инфекционного процесса, что повышает качество модели. Обеспечивается моделирование остеомиелита бедренной кости у мелких лабораторных животных в условиях внешней аппаратной фиксации имплантата с получением однотипных клинических, рентгенологических, гистоморфологических и лабораторных признаков.
Технический результат достигается тем, что в способе моделирования остеомиелита бедренной кости у мелких лабораторных животных интрамедуллярно вводят через трепанационное отверстие в кость культуру Stafilococcus aureus, затем интрамедуллярно в кость вводят имплантат, в качестве имплантата применяют крючкообразно изогнутую спицу, осуществляют стабилизацию кости при помощи внешней фиксации, путем консольного введения спицы и соединения спиц между собой самотвердеющей пластмассой.
Изобретение поясняется изображениями:
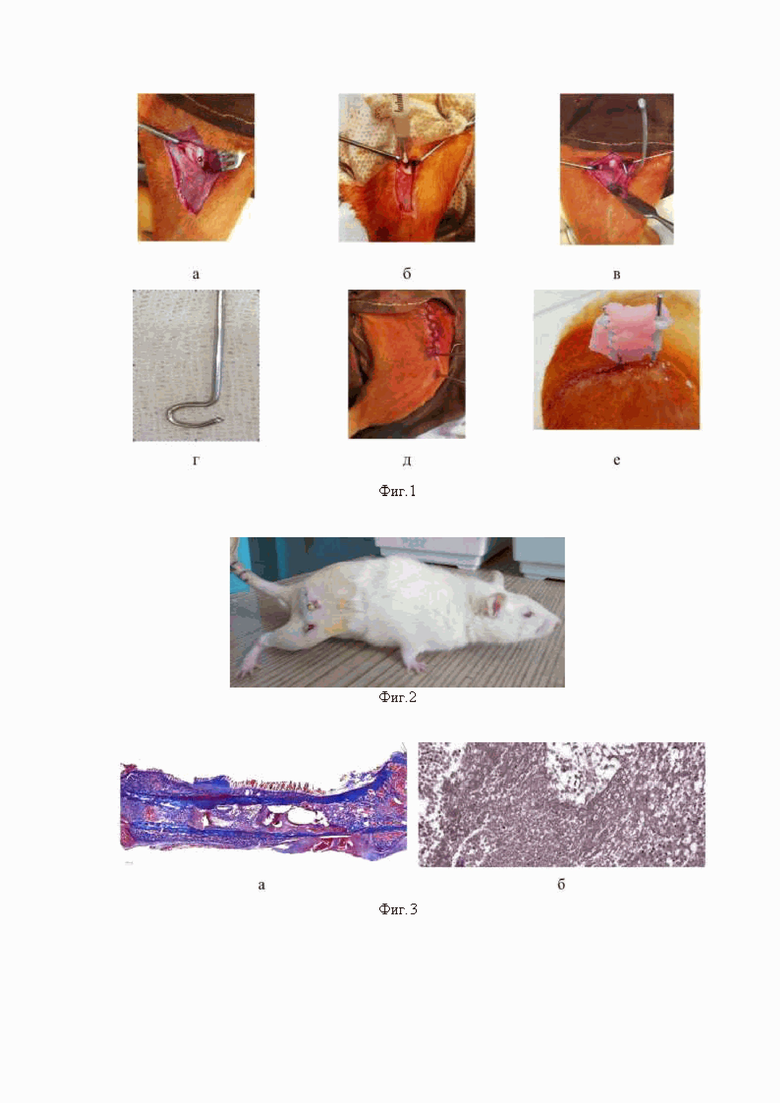
фиг. 1 - показаны этапы оперативного вмешательства, где на фотографии: а- выполнено трепанационное отверстие в диафизе бедренной кости, б - осуществляется введение культуры S.aureus в костномозговой канал, в - осуществляется введение имплантата (спица введенная в костномозговой канал), г - показан внешний вид имплантата (интрамедуллярной спицы), д - показана ушитая операционная рана, проведенная консольная спица; е-показано соединение спиц самотвердеющей пластмассой для обеспечения внешней фиксации.
фиг. 2 -внешний вид животного на этапе эксперимента. Отделение гнойного экссудата из спицевых каналов.
фиг. 3 - показаны парафиновые гистотопографические срезы, на которых видна фиброзно-абсцедирующая форма остеомиелита в метадиафизарной части бедренной кости крыс:
на фотографии а - парафиновые гистотопографические срезы. Трихромная окраска по Массону. Ув. ×10;
на фотографии б - фибриноидный некроз центральной части остеомиелитической полости Парафиновые срезы. Окрашивание по Граму. Ув. ×400
фиг. 4 - показана парафиновые срезы. Соединительнотканная оболочка полости:
а) микроабсцессы в области моделирования остеомиелитического поражения бедренной кости крыс. Парафиновые срезы. Окрашивание гематоксилином и эозином. Ув. ×200;
б - воспалительно-клеточная (преимущественно нейтрофильная) инфильтрация области микроабсцедирования. Парафиновые срезы. Окраска азуром-эозином по Максимову. Ув. ×1000;
в) колонии бактерий Staphylococcus aureus на поверхности костных секвестров. Парафиновые срезы. Окрашивание по Граму. Ув. ×1000
Осуществление изобретения.
Способ моделирования остеомиелита бедренной кости у мелких лабораторных животных заключается в интрамедуллярном введении в кость культуры Stafilococcus aureus, затем интрамедуллярно вводят имплантат и стабилизируют имплантат при помощи аппарата внешней фиксации.
В условиях операционной, под общим обезболиванием, через вертикальный разрез кожи и подкожной клетчатки выполняют доступ к передней поверхности бедренной кости. Затем производят трепанацию диафиза кости на границе верхней и средней трети (Фиг. 1, а). Далее интрамедуллярно вводят культуру Stafilococcus aureus (музейный штамм ATCC 29213) в объеме 50 мкл, концентрация микроорганизмов составляла 108 КОЕ/мл. Культуру вводят инсулиновым шприцом, полностью заглубляя иглу в костномозговой канал (Фиг. 1, б).
Следующим этапом в костномозговой канал вводят имплантат- крючкообразно изогнутую спицу диаметром 1,0 мм, на глубину 7 мм и наглухо, послойно ушивали операционную рану викрилом 4/0 (Фиг. 1, в, г, д). Завершающим этапом на уровне нижней трети бедренной кости осуществляют консольное введение спицы диаметром 0,6 мм и соединение спиц между собой методом армирования и заливки самотвердеющей пластмассой (Фиг. 1, д, е). В послеоперационном периоде антимикробные средства животным не применяют, обработку спиц и операционной раны не проводят.
В процессе наблюдений, в среднем на 9-10 сутки, у всех животных отмечали выделение гнойного экссудата из спицевых каналов. Бактериологическое исследование экссудата из интермедуллярного канала показало наличие S. aureus в 100% случаев (Фиг. 2). Рентгенологические исследования показали, что у животных уже к 15 суткам после операции развивались признаки воспаления, ограниченного интермедуллярным пространством и проявляющиеся наличием слабозаметных хаотичных округлых участков просветления. К 21 суткам эксперимента происходило распространение воспалительного процесса на все струкрутные элементы кости, что характеризовалось наличием мелкоочаговых полостей в костномозговом канале, а также признаков процессов деструкции корковой пластинки и резорбции губчатой кости дистального метафиза. При гистологическом исследовании области имплантации у животных в средней части диафиза бедренной кости на 21-е сутки после операции обнаруживалась обширная остеомиелитическая полость (Фиг. 3, а) с гнойно-геморрагическим содержимым и фибриноидным детритом, включающим микроколонии S. aureus (Фиг. 3, б).
Остеомиелитическая полость была ограничена фиброзной оболочкой, внутренний слой которой представляли реактивно измененная рыхлая соединительная и грануляционная ткани, инфильтрованные воспалительно-клеточными элементами с преобладанием нейтрофильных гранулоцитов. Внеклеточный матрикс наружных слоев соединительнотканной оболочки включал крупные пучки концентрически ориентированных коллагеновых волокон. В составе наружной части фиброзной оболочки обнаруживались микроабсцессы, представляющие собой округлые включения реактивно измененной рыхлой соединительной ткани (Фиг. 4 а). Их отличала высокая концентрация полиморфноядерных лейкоцитов (Фиг. 4, б) и центрально расположенные микроколонии стафилококков либо инфицированные ими костные секвестры (Фиг. 4, в).
Костную оболочку остеомиелитической полости, или инволюкрум, формировала мелкопетлистая сеть эндостально образованных грубоволокнистых трабекул. Межтрабекулярные промежутки заполняла реактивно измененная рыхлая соединительная ткань. В прилежащих к остеомиелитической полости участках кортикальной пластинки имелись бесклеточные зоны, активно резорбируемые остеокластами. Гаверсовы каналы некротизированных участков кости были заселены колониями стафилококков. Жизнеспособные участки компактной кости подвергались остеобластно-остеокластическому ремоделированию, костный матрикс включал участки грубоволокнистого костного вещества и нерегулярно расположенные линии склеивания. На периостальной поверхности компактной пластинки располагались объемные наслоения губчатого костного вещества, сформированные мелкопетлистой сетью массивных грубоволокнистых трабекул.
Полученные гистоморфологические описания препаратов оперированной бедренной кости животных соответствовали фиброзирующей с макро- и микроабсцедированием форме хронического остеомиелита по В.В. Григоровскому. Полуколичественная балльная оценка стадий остеомиелита показала, что у всех животных по шкале Jupiter было превышено пороговое значение 15 баллов, что свидетельствовало об остром течении хронического остеомиелита. Аналогичным образом по шкале оценки HOES было превышено пороговое значение в 6 баллов, определенное для активного хронического остеомиелита. У инфицированных животных был выражен лейкоцитоз, уровень С-реактивного белка был не значимо выше, но близок к порогу значимости (р=0,06) относительно референсных значений (норма). Средние значения данных показателей представлены в таблице.
Референсные значения
1 (0-3)
1 (0-3)
10,6 (10,2-11,4)
5,48 (5,13-5,70)
Таким образом, комплекс клинических, рентгенологических, гистоморфологических и лабораторных признаков позволяет оценить состояние животных как соответствующее хроническому остеомиелиту, что позволяет использовать способ по назначению.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ экспериментального моделирования периимплантной инфекции трубчатых костей | 2023 |
|
RU2824017C1 |
| Способ моделирования хронического травматического остеомиелита | 2015 |
|
RU2622369C1 |
| Способ артродеза коленного сустава при глубокой периэндопротезной инфекции с применением интрамедуллярного армированного антибактериального цементного имплантата | 2018 |
|
RU2711977C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ОСТРОГО ГНОЙНОГО ДЕСТРУКТИВНОГО КОКСИТА У ЛАБОРАТОРНЫХ ЖИВОТНЫХ | 2012 |
|
RU2494468C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ТРАВМАТИЧЕСКОГО ОСТЕОМИЕЛИТА | 2003 |
|
RU2233486C1 |
| СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО ОСТЕОМИЕЛИТА ДЛИННЫХ КОСТЕЙ КОНЕЧНОСТЕЙ | 2013 |
|
RU2544303C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ КОСТНОГО ДЕФЕКТА БЕДРЕННОЙ КОСТИ | 2007 |
|
RU2345423C1 |
| ИНТРАМЕДУЛЛЯРНЫЙ ФИКСАТОР ДЛЯ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ОКОЛОСУСТАВНЫХ ПЕРЕЛОМОВ ТРУБЧАТОЙ КОСТИ | 2010 |
|
RU2468764C2 |
| СПОСОБ МОДЕЛИРОВАНИЯ ТРАВМАТИЧЕСКОГО ОСТЕОМИЕЛИТА | 2015 |
|
RU2584402C1 |
| Способ моделирования локализованного метафизарного хронического остеомиелита у кролика | 2016 |
|
RU2622209C1 |

Изобретение относится к области экспериментальной медицины, а именно к способам получения моделей заболеваний, и может быть использовано для моделирования остеомиелита бедренной кости у лабораторных животных. Для этого интрамедуллярно вводят в кость культуру Stafilococcus aureus. Затем интрамедуллярно вводят имплантат, в качестве имплантата применяют крючкообразно изогнутую спицу. Далее осуществляют стабилизацию кости при помощи внешней фиксации путем консольного введения спицы и соединения спиц между собой самотвердеющей пластмассой. Изобретение обеспечивает моделирование остеомиелита бедренной кости у мелких лабораторных животных в условиях внешней аппаратной фиксации имплантата с получением однотипных клинических, рентгенологических, гистоморфологических и лабораторных признаков. 4 ил., 1 табл.
Способ моделирования остеомиелита бедренной кости у мелких лабораторных животных, характеризующийся тем, что интрамедуллярно вводят в кость культуру Stafilococcus aureus, затем интрамедуллярно вводят имплантат, в качестве имплантата применяют крючкообразно изогнутую спицу, осуществляют стабилизацию кости при помощи внешней фиксации, путем консольного введения спицы и соединения спиц между собой самотвердеющей пластмассой.
| Способ моделирования посттравматического остеомиелита у мелких лабораторных животных | 1989 |
|
SU1691876A1 |
| Способ моделирования хронического травматического остеомиелита | 2015 |
|
RU2622369C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ТРАВМАТИЧЕСКОГО ОСТЕОМИЕЛИТА | 1995 |
|
RU2129735C1 |
| ЛАДОНИН С.В | |||
| и др | |||
| Моделирование хронического остеомиелита / ВЕСТНИК ЭКСПЕРИМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ ХИРУРГИИ ТОМ IV, 2011, N 2, стр | |||
| Способ получения жидкой протравы для основных красителей | 1923 |
|
SU344A1 |
| LUCKE M | |||
| et al | |||
| Gentamicin coating of metallic implants reduces implant-related osteomyelitis in rats / Bone, 2003, 32, | |||
Авторы
Даты
2023-03-06—Публикация
2022-07-19—Подача