Изобретение относится к клинической медицине, а именно гепатологии, и предназначено для компенсации функций печени пациентов с необратимой печеночной недостаточностью, например, в период ожидания трансплантации донорского органа.
Печень является жизненно необходимым органом с множеством функций, при этом, единственным выходом для пациентов с необратимыми и серьезными патологиями органа является трансплантация печени. Несмотря на увеличение количества операций по пересадке печени, все еще существует проблема осуществления данной операции для нуждающихся по причине нехватки донорских органов и живых доноров. В связи с этим методы и устройства экстракорпоральной поддержки печени в период ожидания трансплантата имеют важную практическую значимость.
Известны искусственные системы MARS и Prometheus, представляющие собой бесклеточные экстракорпоральные устройства, которые нацелены только на выведение токсинов путем диализа альбумина (см. Evenepoel P. et al. Detoxifying capacity and kinetics of Prometheus®–a new extracorporeal system for the treatment of liver failure //Blood purification. – 2005. – Т. 23. – №. 5. – С. 349-358; Evenepoel P. et al. Prometheus versus molecular adsorbents recirculating system: comparison of efficiency in two different liver detoxification devices //Artificial organs. – 2006. – Т. 30. – №. 4. – С. 276-284).
Данные не обладают синтетическими и метаболическими функциями, например, синтезом альбумина, которые могут быть обеспечены только живыми функциональными клетками печени.
Существует ряд биоискусственных экстракорпоральных систем типа ELAD, HepatAssist, AMC-BAL, SRBAL, hiHep-BAL, особенность которых заключается в том, что функции печени обеспечивают клетки, находящиеся в составе системы, а разница – в типе заселенных в систему клеток. Например, в основе hiHep-BAL находятся индуцированные гепатоциты человека (см. Shi X. L. et al. Improved survival of porcine acute liver failure by a bioartificial liver device implanted with induced human functional hepatocytes //Cell research. – 2016. – Т. 26. – №. 2. – С. 206-216), в основе HepatAssist и SRBAL – гепатоциты свиньи (см. Demetriou A. A. et al. Prospective, randomized, multicenter, controlled trial of a bioartificial liver in treating acute liver failure //Annals of surgery. – 2004. – Т. 239. – №. 5. – С. 660; Nicolas C. T. et al. Concise review: liver regenerative medicine: from hepatocyte transplantation to bioartificial livers and bioengineered grafts //Stem Cells. – 2017. – Т. 35. – №. 1. – С. 42-50).
Несмотря на присутствие в вышеприведенных системах тех или иных гепатоцитов, у каждой системы существуют свои недостатки. Например, ELAD содержит клетки гепатокарциномы человека HepG2/C3A, которые проявляют сниженную функциональную активность по сравнению с нативными гепатоцитами человека, не могут выводить аммиак, а также существует риск проникновения опухолевых клеток в кровоток пациента (см. Shi X. L. et al. Improved survival of porcine acute liver failure by a bioartificial liver device implanted with induced human functional hepatocytes //Cell research. – 2016. – Т. 26. – №. 2. – С. 206-216; Nicolas C. T. et al. Concise review: liver regenerative medicine: from hepatocyte transplantation to bioartificial livers and bioengineered grafts //Stem Cells. – 2017. – Т. 35. – №. 1. – С. 42-50; Lee K. C. L., Stadlbauer V., Jalan R. Extracorporeal liver support devices for listed patients //Liver Transplantation. – 2016. – Т. 22. – №. 6. – С. 839-848). HepatAssist и SRBAL имеют недостатки ввиду риска ксенозооноза, поскольку содержат гепатоциты свиньи, и имеют жесткое ограничение в некоторых религиозных странах (см. Shi X. L. et al. Improved survival of porcine acute liver failure by a bioartificial liver device implanted with induced human functional hepatocytes //Cell research. – 2016. – Т. 26. – №. 2. – С. 206-216). AMC-BAL разрабатывался на основе гепатоцитов свиней, однако при первом клиническом испытании у одного из пациентов был найдена ДНК эндогенного ретровируса свиньи из-за чего испытания данного устройства ограничили (см. Lee K. C. L., Stadlbauer V., Jalan R. Extracorporeal liver support devices for listed patients //Liver Transplantation. – 2016. – Т. 22. – №. 6. – С. 839-848; Van de Kerkhove M. P. et al. Liver support therapy: an overview of the AMC-bioartificial liver research //Digestive Surgery. – 2005. – Т. 22. – №. 4. – С. 254-264). Что же касается hiHep-BAL, то данное устройство безопасно с точки зрения трансмиграции опухолевых клеток и ксенозооноза, но оно еще не протестировано на людях (см. Shi X. L. et al. Improved survival of porcine acute liver failure by a bioartificial liver device implanted with induced human functional hepatocytes //Cell research. – 2016. – Т. 26. – №. 2. – С. 206-216).
Таким образом, наиболее эффективными считают биоискусственные системы, в которых, в отличие от искусственных, главным компонентом является биореактор, содержащий функциональные клетки печени – гепатоциты. Последние при терапии обеспечивают организм пациента не только дезинтоксикационными (которыми способны обеспечивать только искусственные устройства экстракорпоральной поддержки печени), но и синтетическими, метаболическими функциями печени. Помимо поддерживающей функции во время ожидания донорского органа, подобные системы способны также индуцировать спонтанную регенерацию печени. Из литературных источников известны исследования, доказывающие благоприятное воздействие экстракорпоральных систем на процессы регенерации печени молодых пациентов с более легким течением заболеваний печени (см. Thompson J. et al. Extracorporeal cellular therapy (ELAD) in severe alcoholic hepatitis: a multinational, prospective, controlled, randomized trial //Liver Transplantation. – 2018. – Т. 24. – №. 3. – С. 380-393).
Аппарат биологической искусственной печени (см. RU №2163148, кл. А61М 1/36, опубл. 20.02.2001) содержит корпус с содержанием тканевых фрагментов печени, заполненный однородной смесью частиц нейтрального носителя, а именно агарозного геля. Обработка плазмы происходит следующим образом: гепаринизированная кровь или плазма пациента поступает в систему с помощью перистальтического насоса, проходит через биореактор, который содержит фрагменты печени, и затем возвращается в кровоток пациента.
Недостатком известного аппарата является необходимость в большом объеме биоматериала, количество которого на практике лимитировано. Кроме того, высок риск повреждения целостности клеточной мембраны гепатоцитов при фрагментации ткани печени.
Известен способ гемокоррекции при терапии печеночной недостаточности (см RU №2693677, кл. А61М 1/16, опубл. 03.07.2019), который включает поступление крови пациента в устройство, фильтрацию плазмы крови от клеток крови, перфузию плазмы через картриджи, содержащие направленно дифференцированные гепатоциты, смешивание обработанной плазмы с клетками крови и возврат крови пациенту. При этом дифференцируемые стволовые клетки являются аутоклетками, которые были получены репрограммированием мононуклеаров периферической крови.
Недостатком известного технического решения является длительность процессов получения, репрограммирования, культивирования и направленной дифференцировки стволовых аутоклеток, кроме того, выполнение процессов является трудоемким и ресурсозатратным.
Задача, на решение которой направлено заявленное изобретение, является достижение нормализации биохимических показателей крови пациентов с необратимой печеночной недостаточностью в период ожидания трансплантации донорского органа.
Технический результат, получаемый при решении поставленной задачи, выражается в достижении нормализации биохимических показателей крови пациентов с необратимой печеночной недостаточностью, например, в период ожидания трансплантации донорского органа, за счет создания системы экстракорпоральной гемоперфузии на основе проточного инкубатора с функциональными гепатоцитами человека.
Для достижения поставленной задачи способ нормализации биохимических показателей крови пациентов с необратимой печеночной недостаточностью в эксперименте, включающий гемоперфузию крови в экстракорпоральный контур, проведение фильтрации с отделением клеток крови от плазмы, перфузию плазмы крови через культуры клеток-гепатоцитов, смешивание обработанной плазмы с клетками крови и ее возврат, отличается тем, что в качестве плазмофильтра используют устройство проточного инкубатора биологического контура с модульным исполнением, отдельный модуль которого выполнен из биосовместимого полимера и состоит из послойно накладываемых элементов - крышки, полости для транспорта плазмы со спиральным расположением каналов и отводными отверстиями для ввода и вывода плазмы, полости для заселения линий гепатоцитов, повторяющей ход каналов вышележащего слоя, перегороженные пористо-проницаемой трековой мембраной с размерами пор, достаточной для предотвращения попадания клеток в циркуляцию, например, не более 5,0 мкм, полости для фильтрата, содержащей питательную среду для клеток, с отводными отверстиями для ввода и вывода жидкостей, причем, между полостью заселения линий гепатоцитов и полости для фильтрата размещена трековая мембрана с размерами пор, достаточными для предотвращения попадания клеток в циркуляцию, например, не менее 0,2 мкм, для чего биологический контур, составленный из последовательно соединенных и запечатанных в герметичном корпусе проточных модулей с гепатоцитами, подключают последовательно друг к другу посредством выходных трубок и далее к внешним средствам подачи плазмы и оттока желчи, после чего, осуществляют перфузию поступающей плазмы крови.
Сопоставительный анализ признаков заявленного решения с известными признаками свидетельствует о соответствии заявленного решения критерию «новизна».
Совокупность признаков изобретения обеспечивает решение заявленной технической задачи за счет системы экстракорпоральной поддержки, представленной сетью полупроницаемых мембран с функциональными гепатоцитами человека для последующего использования в системах экстракорпоральной гемоперфузии в качестве поддерживающей терапии печени пациентов с различными необратимыми патологиями печени с частично или полностью утраченными функциями, обеспечивающей организм дезинтоксикационной, метаболической и синтетической функциями, например, в период ожидания донорского органа.
Преимуществами заявленного решения являются: отсутствие риска ксенозооноза, поскольку используются клетки человека; компенсация не только дезинтоксикационной, но и метаболической, синтетической функции; использование биологического контура, способствующего быстрому получению и культивированию клеток; повышение регенеративного потенциала печени.
В новом техническом решении используется устройство проточного инкубатора, являющегося структурно-функциональной единицей биологического контура, где в результате гемофильтрации через особую сеть полупроницаемых мембран, помещенных в среду с культивированными гепатоцитами, происходят обменные процессы между клетками, культивируемой средой и плазмой пациента.
Таким образом, биологический контур предназначен для дальнейшего использования в гемоперфузионной системе очистки крови в качестве поддерживающей терапии для пациентов с тяжелыми формами печеночной недостаточности.
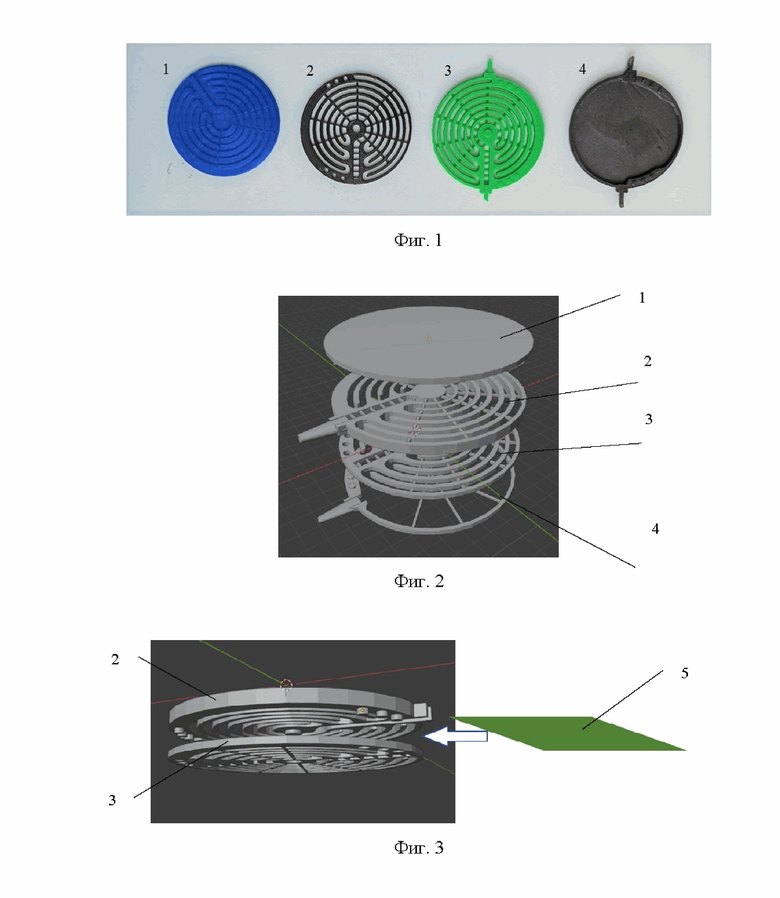
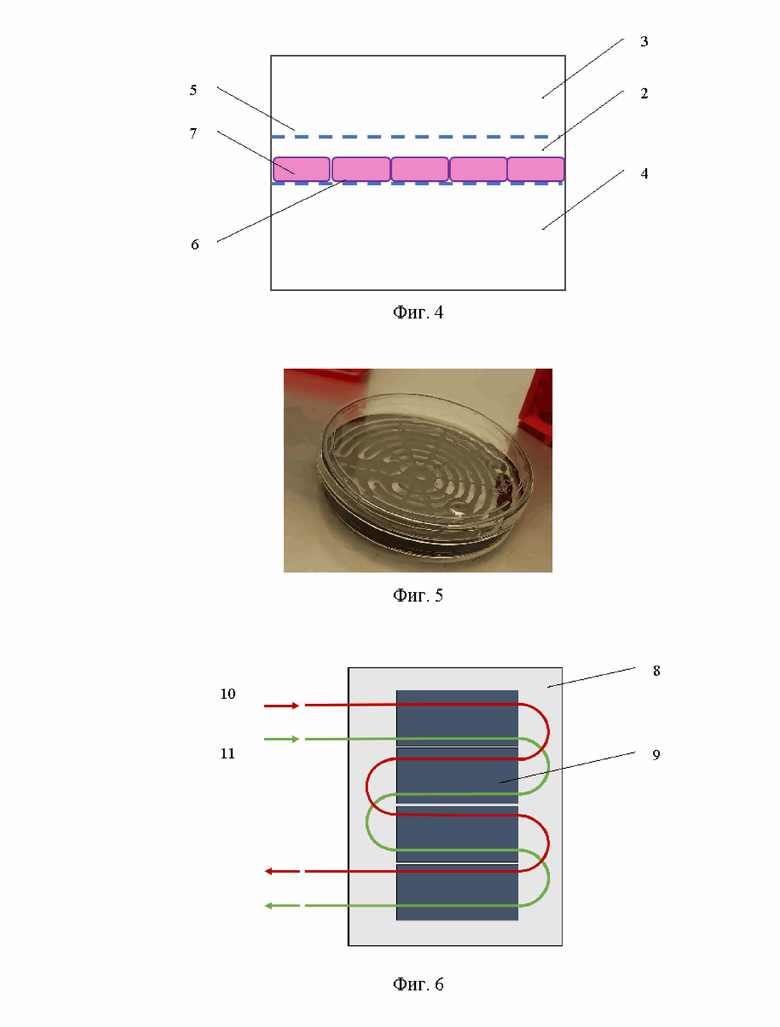
Заявленный способ иллюстрируется чертежом, где на фигуре 1 показаны элементы каркаса проточного инкубатора: крышка (1), слой для размещения клеток (2), слой для потока плазмы (полость по плазме) (3), резервуар (полость фильтрата или диализирующего раствора) (4); на фигуре 2 – схема сборки каркаса проточного инкубатора для биологического контура; на фигуре 3 - схема размещения пористо-проницаемой мембраны (5) между слоями потока плазмы и культивированных клеток; на фигуре 4 - схема конструкции проточного инкубатора с полупроницаемой мембраной (6) и гепатоцитами (7); на фигуре 5 – фото слоя размещения клеток каркаса проточного инкубатора в культуральной чашке; на фигуре 6 – схема биологического контура, подключенного к внешним системам подачи и вывода веществ (10 – направление циркуляции потока плазмы крови, 11 - направление циркуляции потока желчи), включающего последовательно расположенные проточные инкубаторы (9) в герметичном корпусе (8).
Для изготовления каркаса проточного инкубатора используют биосовместимый полимер. Каркас состоит из четырех послойных элементов: крышки 1, полости 3 для протекания плазмы со спиральным расположением каналов, полости 2 для заселения линий гепатоцитов, повторяющей ход каналов вышележащего слоя 3, резервуара 4 для культуральной среды (см фиг. 1, 2). Поскольку гепатоциты 7 должны одновременно контактировать с плазмой пациента и культуральной средой, при этом смешение двух жидкостей недопустимо, клетки располагаются посередине, а сверху и снизу накладываются трековые мембраны. Таким образом, между полостью 3 для плазмы и полостью 2 для гепатоцитов 7 размещается пористо-проницаемая мембрана 5, а между полостью 2 для гепатоцитов 7 и резервуаром 4 - полупроницаемая мембрана 6 (см. фиг. 3, 4).
В резервуаре 4 для культуральной среды будут выводиться токсины и продукты метаболизма, поэтому для плазмы крови и культуральной среды предусмотрены отдельные полости и трубки для протекания этих жидкостей в целях недопущения их смешения.
Для опытного образца диаметр конструкции проточного инкубатора составлял 84 мм, при этом послойные элементы были изготовлены из синтетического полимера полилактида путем 3D печати (см. фиг. 1, 5). Выбор материала полимера определяли по следующим свойствам: биосовместимость, что необходимо для работы с пациентами; низкая степень биорезорбции; термопластичность; доступность материала (см. Белов Д. Биоразлагаемый полимер полилактид // Наука и инновации. – 2013. – Т. 9. – №. 127; Левченко Е.В., Чернышева Н.Л. Производство биоразлагаемого полимера полилактида // Вестник молодежной науки. – 2016. – №. 4 (6)).
В качестве пористо-проницаемой и полупроницаемой мембран были выбраны трековые мембраны «Реатрек» известной конструкции из полиэтилентерефталата с диаметрами пор 5,0 и 0,2 мкм, соответственно. Преимуществом трековых мембран является их правильная геометрия пор, возможность контроля их количества, а также однородность в размерах пор, что не допускает риск проникновения, как клеточных единиц, так и их составных частей в случае деструкций (см. Волков В. В. и др. Мембраны и нанотехнологии // Российские нанотехнологии. – 2008. – Т. 3. – №. 11-12. – С. 67-99).
Диаметр пор трековой мембраны, разделяющей гепатоциты от плазмы, равный 5 мкм, был выбран из расчета недопущения риска попадания клеток в кровоток пациента, поскольку средний диаметр гепатоцитов варьирует от 20 до 30 мкм.
Для формирования биологического контура составные картриджи предварительно заселяют гепатоцитами человека, для чего, производят посев гепатоцитов в полости 2, дно которой выполнено в виде полупроницаемой трековой мембраны 6. Далее, слой 2 с трековой мембраной 6, на которой адгезированы клетки, переносят в резервуар 4 каркаса, предназначенный для культуральной среды. Затем поверх гепатоцитов накладывают пористо-проницаемую мембрану 5 для препятствия попадания гепатоцитов в кровоток пациента. После чего, накладывают остальные слои: полость 3 для протекания плазмы по сети разветвленных каналов и крышку 1. Все слои картриджа размещают друг относительно друга по типу «сэндвич» (см. фиг. 2-4).
Проточные инкубаторы 9 с гепатоцитами последовательно соединяют медицинскими трубками и запечатывают в герметичный корпус 8. Таким образом, изготовленный биологический контур поставляют в специализированное медицинское учреждение, где для использования подключают посредством выходных трубок к внешним средствам подачи и оттока веществ без образования воздушных пространств, например, к инфузионному насосу, который подает 10 кровь в биологический контур, а по другой линии обеспечивает отток 11 желчи и использованной культуральной среды (см. фиг. 6).
Заявленное техническое решение реализуется следующим образом.
В начале терапии кровь пациента выводится из вены через двухпросветный катетер с помощью насосной системы, далее поступает в плазмофильтр, где происходит сепарация плазмы крови от форменных элементов через мембрану. Например, в известных исследованиях кровь для подобных целей забиралась у пациента из правой поверхностной бедренной вены со скоростью 90-100 мл/мин (см. Chen S. C. et al. Treatment of severe liver failure with a bioartificial liver //Annals of the New York Academy of Sciences. – 1997. – Т. 831. – С. 350).
После чего, получаемая плазма через отдельный канал поступает в биологический контур, который к этому моменту должен содержать не менее 10 млн. клеток гепатоцитов, и циркулирует в капиллярной системе, взаимодействуя с гепатоцитами, которые обеспечивают биологический эффект - синтез веществ, связывание токсинов, в частности билирубинов (см. Malhi, H. Hepatocyte transplantation: new horizons and challenges / H. Malhf, S. Gupta // J. Hepatobiliary Pancreat. Surg. — 2001. — Vol. 8. — P. 40-50; Fitzpatrick, E. Human hepatocyte transplantation: state of the art / E. Fitzpatrick, R. R. Mitry, A. Dhawan // J. Intern. Med. — 2009. — Vol. 266. — P. 339-357; Nahmias Y, Berthiaume F, Yarmush ML. Integration of technologies for hepatic tissue engineering. Adv. Biochem. Eng. Biotechnol. 2007; 103: 309–329; Долгих М.С. Современные технологии создания имплантируемой биоискусственной печени / М.С. Долгих // Биомедицинская химия. – 2010. – т. 56 – вып. 4 – С. 425-442; Афанасьева Ю.И. Гистология, эмбриология, цитология. Учебник / Ю.И. Афанасьева, Н.А. Юрина // ГЕОТАР Медиа. – 2018. – с. 595; Пономарев Б.Л., Морфология гепатоцитов человека в ранние периоды онтогенеза/ Б.Л. Пономарев, Л.Е. Обухова, Ю.А. Высоцкий, Н.И. Барсукова, Т.М. Черданцева // Российский медико-биологический вестник им. акад. И.П. Павлова. 2013. №3).
Продукты метаболизма и токсины гепатоцитов выводятся в культуральную среду, которая оттекает с помощью насоса. Оптимальная скорость притока свежей среды должна составлять от 1,2 до 2,0 мл/ч (см. Басок Ю.Б. и др. Культивирование клеток печени человека и мезенхимальных стромальных клеток жировой ткани человека в перфузионном биореакторе // Вестник трансплантоологии и искусственных органов. - 2018. – Т. 20. – №. 1. – С. 70-78; Mueller D. et al. Real-time in situ viability assessment in a 3D bioreactor with liver cells using resazurin assay //Cytotechnology. – 2013. – Т. 65. – №. 2. – С. 297-305).
Поскольку гепатоциты расходуют большое количество кислорода, то допускается использовать оксигенатор для обогащения культуральной среды кислородом. Устойчивость реактора при расчетной концентрации оксигенатора не менее 0,3 нмоль/сек на 10 млн. клеток.
В завершении происходит объединение обработанной плазмы крови с эритроцитарной массой, после чего, кровь обратно возвращается пациенту, и процедура экстракорпоральной гемоперфузии завершается, устройство отключается от кровотока.
Для экспериментальных работ использовалась плазма крови десяти условно здоровых добровольцев. В целях соблюдения мер безопасности добровольцы дополнительно сдавали кровь на определение ВИЧ, гепатита В и С. Эксперимент производился в асептических условиях с соблюдением требований биологической безопасности.
Исследование биохимического спектра исследуемой плазмы проведено при помощи автоматического биохимического анализатора Horiba ABX Pentra 400, «Хориба АБИкс САС», Франция, ВР 7290-34184 (ФСЗ 2010/07857), ОКП 94 4300 с использованием колориметрической, фотометрической технологий для определения концентрации отдельных химических веществ и продуктов обмена. Были определены уровни следующих биохимических показателей: альбумина, аспартатаминотрансферазы, аланинаминотрансферазы, натрия, общего и несвязанного билирубина.
Плазма условно здоровых доноров, изготовленная в объеме около 50 мл путем центрифугирования, транспортировалась по каналу плазмофильтра через слой для потока плазмы предварительно изготовленного картриджа с заселенными гепатоцитами на поверхности фильтрационной мембраны слоя для размещения клеток (инкубационного слоя), являющейся одновременно верхней стенкой полости диализирующего раствора с питательной средой. При этом, в рамках эксперимента на одном картридже плазма задерживалась в среднем на 30 минут и выводилась через выходное отверстие полости протекания плазмы. Извлеченную плазму исследовали на предмет изменений концентрации веществ, прямо или косвенно отражающих функции печени.
На выходе наблюдался достоверный рост во всех пробах уровней аспартатаминотрансферазы, натрия и умеренный подъем уровня альбумина, а также очевидное снижение концентрации несвязанных билирубинов (см. таблицы 1-3).
Рост уровня альбумина свидетельствует о наличии синтетического процесса в гепатоцитах и их функциональности. Повышение аминотрансфераз объясняется деструкцией клеток в присутствии полимерного каркаса в одной среде. О наличии косвенных желчеобразующих признаков, связанных с метаболизмом прямого билирубина, можно судить из снижения уровня билирубина после обработки и роста концентрации ионов натрия, которые являются составной частью желчных кислот.
Таким образом установлено, что заявленная система экстракорпоральной поддержки печени способна оказывать поддерживающую функцию при печеночной недостаточности, компенсировать нарушение дезинтоксикационной, метаболической и синтетической функций печени, а значит, повысить выживаемость больных, которые ожидают донорскую печень, снизить вероятность возникновения осложнений, а также спонтанную регенерацию печени пациентов с более легким течением заболеваний печени, что позволит нацелить пул донорских органов на пациентов с более тяжелыми стадиями болезней.
Таблица 1
Результаты биохимического анализа плазмы крови после обработки плазмы в проточной системе
Таблица 2
Результаты биохимического анализа плазмы крови после обработки плазмы в проточной системе
Таблица 3
Результаты биохимического анализа плазмы крови после обработки плазмы в проточной системе
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ И ТРАНСПЛАНТАТ ДЛЯ ЛЕЧЕНИЯ ПЕЧЕНОЧНОЙ НЕДОСТАТОЧНОСТИ | 2010 |
|
RU2425645C1 |
| СПОСОБ И ТРАНСПЛАНТАТ ДЛЯ ЛЕЧЕНИЯ ПЕЧЕНОЧНОЙ НЕДОСТАТОЧНОСТИ | 2010 |
|
RU2425648C1 |
| СПОСОБ И ТРАНСПЛАНТАТ ДЛЯ ЛЕЧЕНИЯ ПЕЧЕНОЧНОЙ НЕДОСТАТОЧНОСТИ | 2010 |
|
RU2425646C1 |
| СПОСОБ И ТРАНСПЛАНТАТ ДЛЯ ЛЕЧЕНИЯ ПЕЧЕНОЧНОЙ НЕДОСТАТОЧНОСТИ | 2010 |
|
RU2425647C1 |
| Способ гемокоррекции при лечении печеночной недостаточности | 2018 |
|
RU2693677C1 |
| СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКИХ ДИФФУЗНЫХ ЗАБОЛЕВАНИЙ ПЕЧЕНИ | 2004 |
|
RU2283113C2 |
| Способ прогнозирования риска возникновения ранней дисфункции трансплантата трупной печени | 2021 |
|
RU2765462C1 |
| БИОТРАНСПЛАНТАТ, СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКИХ ЗАБОЛЕВАНИЙ ПЕЧЕНИ И СПОСОБ ЛЕЧЕНИЯ ЦИРРОЗА ПЕЧЕНИ И ПОРТАЛЬНОЙ ГИПЕРТЕНЗИИ | 2007 |
|
RU2368384C2 |
| КЛЕТОЧНЫЙ ПРОДУКТ ДЛЯ ЛЕЧЕНИЯ И КОРРЕКЦИИ ПЕЧЕНОЧНОЙ НЕДОСТАТОЧНОСТИ | 2012 |
|
RU2510833C1 |
| СПОСОБ ЛЕЧЕНИЯ ПЕЧЕНОЧНОЙ НЕДОСТАТОЧНОСТИ | 2015 |
|
RU2586952C1 |
Изобретение относится к медицине, а именно к гепатологии, и может быть использовано для нормализации биохимических показателей крови пациентов с необратимой печеночной недостаточностью в эксперименте. Осуществляют гемоперфузию крови в экстракорпоральный контур, проведение фильтрации с отделением клеток крови от плазмы, перфузию плазмы крови через культуры клеток-гепатоцитов, смешивание обработанной плазмы с клетками крови и ее возврат. В качестве плазмофильтра используют устройство проточного инкубатора биологического контура с модульным исполнением, отдельный модуль которого выполнен из биосовместимого полимера и состоит из послойно накладываемых элементов - крышки, полости для транспорта плазмы со спиральным расположением каналов и отводными отверстиями для ввода и вывода плазмы, полости для заселения линий гепатоцитов, повторяющей ход каналов вышележащего слоя, перегороженные пористо-проницаемой трековой мембраной с диаметром пор не более 5,0 мкм, полости для фильтрата, содержащей питательную среду для клеток, с отводными отверстиями для ввода и вывода жидкостей. Между полостью заселения линий гепатоцитов и полостью для фильтрата размещена трековая мембрана с диаметром пор не менее 0,2 мкм. В биологическом контуре, составленном из последовательно соединенных и запечатанных в герметичном корпусе проточных модулей с гепатоцитами, модули подключают последовательно друг к другу посредством выходных трубок и далее к внешним средствам подачи плазмы и оттока желчи. После чего осуществляют перфузию поступающей плазмы крови. Способ обеспечивает возможность достижения нормализации биохимических показателей крови пациентов с необратимой печеночной недостаточностью, например, в период ожидания трансплантации донорского органа, за счет создания системы экстракорпоральной гемоперфузии на основе проточного инкубатора с функциональными гепатоцитами человека. 6 ил., 3 табл.
Способ нормализации биохимических показателей крови пациентов с необратимой печеночной недостаточностью в эксперименте, включающий гемоперфузию крови в экстракорпоральный контур, проведение фильтрации с отделением клеток крови от плазмы, перфузию плазмы крови через культуры клеток-гепатоцитов, смешивание обработанной плазмы с клетками крови и ее возврат, отличающийся тем, что в качестве плазмофильтра используют устройство проточного инкубатора биологического контура с модульным исполнением, отдельный модуль которого выполнен из биосовместимого полимера и состоит из послойно накладываемых элементов - крышки, полости для транспорта плазмы со спиральным расположением каналов и отводными отверстиями для ввода и вывода плазмы, полости для заселения линий гепатоцитов, повторяющей ход каналов вышележащего слоя, перегороженные пористо-проницаемой трековой мембраной с диаметром пор не более 5,0 мкм, полости для фильтрата, содержащей питательную среду для клеток, с отводными отверстиями для ввода и вывода жидкостей, причем между полостью заселения линий гепатоцитов и полостью для фильтрата размещена трековая мембрана с диаметром пор не менее 0,2 мкм, в биологическом контуре, составленном из последовательно соединенных и запечатанных в герметичном корпусе проточных модулей с гепатоцитами, модули подключают последовательно друг к другу посредством выходных трубок и далее к внешним средствам подачи плазмы и оттока желчи, после чего осуществляют перфузию поступающей плазмы крови.
| Способ гемокоррекции при лечении печеночной недостаточности | 2018 |
|
RU2693677C1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| SHI X.-L | |||
| et al | |||
| Improved survival of porcine acute liver failure by a bioartificial liver device implanted with induced human functional hepatocytes// Cell Res | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| doi: | |||
Авторы
Даты
2023-06-01—Публикация
2020-12-11—Подача