Изобретение относится к области медицины, в частности, к фармакологическим средствам, а именно к трансдермальным терапевтическим системам (ТТС) (трансдермальным пластырям).
Изобретение предназначено для использования в фармакологии как необходимый компонент неинвазивного пролонгированного лекарственного средства для чрескожного введения спирторастворимых лекарственных веществ (ЛВ).
ТТС - это лекарственная форма для наружного применения, предназначенная для контролируемой доставки лекарственного вещества (ЛВ) в системный кровоток путем пассивной диффузии через неповрежденную кожу [Васильев А.Е., Краснюк И.И., Равикумар С, Тохмачи В.Н. Трансдермальные терапевтические системы доставки лекарственных веществ (обзор). Химико-фармацевтический журнал, 2001, т. 35, №11, с. 29-41].
ТТС обеспечивают подачу ЛВ в системный кровоток с постоянной скоростью без колебаний концентраций на протяжении длительного времени [Зырянов, С.К. Новые возможности фармакотерапии болезни Альцгеймера. Журнал неврологии и психиатрии. 2009. №4: 95-98]. Несомненным преимуществом ТТС является то, что запас активного вещества находится вне организма, что позволяет применять лабильные и быстро метаболизируемые ЛВ (например, гормоны).
При использовании ТТС значительно уменьшается вводимая доза активного вещества за счет лучшей биодоступности из-за отсутствия эффекта первого прохождения через печень и желудочного метаболизма по сравнению с пероральными формами [V.B. Kumbhar, P.S. Malpure, Y.M. More A Review on transdermal drug delivery system. World journal of pharmacy and pharmaceutical sciences. 2018. Vol. 7. №9: 1258-1269].
Важным положительным фактором является отсутствие контакта полимерных составляющих ТТС с внутренней средой организма.
Еще одним преимуществом ТТС является простота и безопасность использования. Трансдермальное введение дает возможность применения препарата у различных групп пациентов, которые в силу ряда причин и/или противопоказаний не могут использовать существующие лекарственные формы [J. Torin Huzill, S. Sivaloganathan, M. Kohande et al. Drug delivery through the skin: molecular simulations of barrier lipids to design more effective noninvasive dermal and transdermal delivery systems for small molecules, biologies, and cosmetics. WIREs Nanomedicine and Nanobiotechnology. 2011. Vol. 3. №5: 449-462].
Все существующие ТТС можно отнести к одному из трех видов конструкций: резервуарная, матричная и комбинированная. Следует отметить, что удобство в применении и простая технология изготовления матричных систем, особенно подтипа «лекарство в адгезиве», делает их в настоящее время более предпочтительными для большинства производителей и потребителей [С.О. Лосенкова, Е.Д. Тюнина, Н.А. Павлюченкова, П.В. Лосенков, А.А. Емельянов, М.В. Махотина Современный ассортимент транедермальных лекарственных форм на фармацевтическом рынке России, Вестник Смоленской государственной медицинской академии 2022, Т. 21, №1: 152-159]. Высокомолекулярные полимеры, используемые в роли адгезивов, должны обеспечивать эффективное высвобождение ЛВ, но при этом не участвовать в чрескожном переносе и не проникать в глубокие слои кожи.
При выборе полимера, помимо его безопасности, важно учитывать такие свойства, как класс полимера (акриловый, полиизобутиленовый, силиконовый и т.д.), содержание функциональных групп (-ОН, -СООН), вязкость, силу адгезии к коже, сдвиговое сопротивление, растворимость в органических растворителях и т.д.
Большинство выпускаемых в настоящее время ТТС изготовлены на основе матрицы из акриловых адгезивов, таких как, например, Duro-Tak и Gelva фирмы Хенкель. Они обладают способностью образовывать прочное адгезионное соединение с кожей, при этом легко удаляются после использования, не оставляя следов на коже. Они имеют различную вязкость (1800-15000 мПа⋅с) и низкое сдвиговое сопротивление, что позволяет их использовать в ТТС без добавления пластификаторов [Product selection guid. Henkel. DURO-TAK and GELVA Transdermal Pressure Sensitive Adhesives [Электронный ресурс]. - ULR: https://www.henkel-adhesives.com/content/dam/uai/AIH/master/images/drug-delivery-polymers/durotak-gelva-production-guide-US-4pager-160920.pdf (дата обращения 21.03.2022)].
Основными элементами матричных ТТС являются: непроницаемая подложка (внешний покровный слой), препятствующий диффузии лекарственного вещества в сторону противоположную коже, а также попаданию влаги извне; полимерная матрица со вспомогательными веществами; лекарственное вещество; адгезивный слой для фиксации на коже и защитная антиадгезионная пленка, которая снимается перед аппликацией.
В состав матрицы вводят формообразующие вспомогательные вещества, а также активаторы чрескожного переноса.
Альфа-токоферола ацетат известен своими антиоксидантными свойствами [А.С. Гаврилов. Фармацевтическая технология. Изготовление лекарственных препаратов (учебное пособие). Глава 5. Вспомогательные вещества. Под ред. А.С. Гаврилова. Москва, ГЭОТАР-Медиа, 2010. 624 с].
Дигидрокверцетин известен как антиоксидант натурального происхождения. Фармакологическое действие дигидрокверцетина - ангиопротекторное, регенерирующее, дезинтоксикационное, противоотечное, антибиотическое, радиопротекторное и иммуномодулирующее. [В.А. Тутельян, Л.В. Кравченко, Л.И. Авреньева, С.В. Морозов. Оценка антиоксидантной и антитоксической эффективности природного флавоноида дигидрокверцетина. Токсикологический вестник. 2005, №1, 14-20].
Известно, что при производстве ТТС могут использоваться различные жидкие растительные масла для введения в матрицу липофильных вспомогательных веществ [С.Ф. Быкова, Е.К. Давиденко, С.Г. Ефименко Перспективы развития сырьевой базы производства новых типов пищевых растительных масел / Масла и жиры. - 2014. - №1. - С. 20-24.], например, масло ядер косточек абрикоса, которое хорошо впитывается в кожу и усиливает проникновение в глубокие слои кожи других активных компонентов [Т.-K. Lin, L. Zhong, J.L. Santiago. Anti-Inflammatory and Skin Barrier Repair Effects of Topical Application of Some Plant Oils. Int. J. Mol. Sci. 2018. Vol. 19. №1: 70].
Известна ТТС с фентанилом (производитель ФГУП «Московский эндокринный завод») с полимерной матрицей из полиакрилата «Duro-Tak 87-4287». [Инструкция по медицинскому применению лекарственного препарата Фентанил. [Электронный ресурс]. - ULR: https://www.takeda.com/siteassets/ru-ru/home/what-we-do/1/26/fendivia-26112014.pdf (дата обращения 1.12.2022)]. ТТС обеспечивает постоянное системное высвобождение фентанила в течение 72 часов. После аппликации ТТС концентрация фентанила в плазме крови постепенно увеличивается в течение первых 12-24 часов и остается постоянной в течение оставшегося периода времени. Уровень концентрации фентанила в плазме крови пропорционален размеру ТТС. К концу 72-часовой аппликации достигается равновесная концентрация фентанила в плазме крови, которая поддерживается с помощью последующих аппликаций ТТС того же размера.
К недостаткам аналога относятся:
- отсутствие активаторов чрескожного переноса действующего ЛВ влечет за собой увеличение периода времени (12-24 часа), необходимого для достижения постоянной концентрации ЛВ в крови;
- низкая чрескожная диффузия ЛВ, приводящая к необходимости увеличения контактной площади ТТС (42 см2 при содержании ЛВ 16,8 мг).
Известен пластырь трансдермальный с сахароснижающим веществом гликлазид 0,6 г на основе полиэтиленгликоля-400 (ПЭГ-400) (2,0 г) и пласдона К25 (4,0 г) для терапии сахарного диабета 2 типа площадью 250 см2 [RU 2736081, С1].
Отличительной особенностью данного пластыря является наличие следующих активаторов переноса: ДМСО 2,0 г и спирт этиловый 95% 10,0 г, что позволяет увеличить примерно в 2 раза выход ЛВ в объем в модельных экспериментах по сравнению с пластырями, имеющими в своем составе другие активаторы переноса (пропиленгликоль-1,2 или изопропилмеристат). Данный пластырь обладает способностью к длительному хранению с сохранением фармакологической активности в течении 2 лет при хранении с соблюдением температурных режимов (не ниже +5 и не выше +25). При изготовлении данного пластыря после смешивания всех компонентов пластырную массу наносят на внешний покровный слой и сушат при температуре 40°С в течении 12 часов.
К недостаткам указанного пластыря относятся:
- низкая чрескожная диффузия ЛВ, приводящая к необходимости увеличения контактной площади ТТС (250 см2);
- проникновение в слои кожи основного компонента полимерной матрицы ПЭГ-400;
- снижение адгезивных свойств пластыря за счет добавления пластификатора пласдона К25 в количестве в 2 раза превышающем количество полимера ПЭГ-400;
- аллергические реакции со стороны кожных покровов в местах аппликации пластыря за счет использования активатора переноса ДМСО.
Известна эмульсионная матрица, содержащая диоктилсульфосукцинат натрия в качестве активатора переноса бромокаина, а также альфа-токоферола ацетат и масло ядер косточек абрикоса [В.А. Рыжикова, А.А. Тихобаева, Л.А. Саломатина, С.В. Курсаков, Е.Г. Кузнецова, О.М. Курылева, В.И. Севастьянов. Влияние активатора переноса на функциональные свойства матричных трансдермальных терапевтических систем бромокаина. Перспективные материалы, 2014, №2, с. 26-32] (прототип). Эмульсионная матрица позволяет вводить в нее только водорастворимые или жирорастворимые ЛВ. К недостаткам эмульсионной матрицы относится отсутствие адгезивных свойств, что требует дополнительного адгезивного слоя для обеспечения контакта с кожей, тем самым усложняя конструкцию ТТС. Известная матрица не обеспечивает активацию трансдермального переноса для спирторастворимых ЛВ.
Техническая проблема, решаемая с помощью заявляемого изобретения, заключается в создании полимерной матрицы для ТТС, содержащей комплекс активаторов переноса (КАП), усиливающий диффузию ЛВ через неповрежденную кожу.
Техническим результатом, достигаемым при использовании предлагаемого изобретения, является:
- усиление чрескожной диффузии спирторастворимых ЛВ за счет добавления КАП, включающего в себя масло ядер косточек абрикоса, диоктилсульфосукцинат натрия, дигидрокверцетин и альфа-токоферола ацетат;
- достижение постоянной концентрации ЛВ в крови через 2-4 часа от начала аппликации ТТС за счет использования КАП;
- уменьшение контактной площади ТТС за счет увеличения скорости чрескожной диффузии ЛВ;
- снижение риска раздражения кожи в месте аппликации ТТС;
- увеличение срока годности ТТС за счет использования патентуемой матрицы.
Сущность изобретения заключается в следующем.
Предложена матрица для ТТС системы, включающая акриловый адгезив, масло ядер косточек абрикоса, диоктилсульфосукцинат натрия, дигидрокверцетин, альфа токоферола ацетат при следующем соотношении компонентов, масс. %:
Полимерная матрица для ТТС может быть использована для чрескожного введения спирторастворимых ЛВ, преимущественно молекулярной массы от 180 Да до 339 Да. В ТТС с помощью предлагаемой матрицы могут быть введены, например, сахароснижающие ЛВ, местные анестетики, психостимулирующие ЛВ, противовоспалительные и антитромботические ЛВ и другие.
Количество ЛВ, вводимого в виде спиртового раствора в матрицу ТТС, определяется в соответствии с желаемым терапевтическим эффектом. Эффективные количества ЛВ при этом могут быть определены с учетом известных рекомендуемых доз для конкретных ЛВ.
При изготовлении предлагаемой полимерной матрицы для ТТС отвешивают активаторы чрескожного переноса, а именно: альфа-токоферола ацетат, диоктилсульфосукцинат натрия, дигидрокверцетин, и растворяют в масле косточек ядер абрикоса, перемешивая с помощью мешалки при скорости 50 об/мин при температуре 60°С до полного растворения (визуальный контроль). Далее для получения матрицы в акриловый адгезив добавляют полученный масляной раствор активаторов чрескожного переноса.
Для доказательства возможности реализации заявленного назначения и достижения указанного технического результата - усиления чрескожной диффузии ЛВ из ТТС с патентуемой полимерной матрицей с КАП, приводим следующие данные. Пример 1.
При изготовлении полимерной матрицы для ТТС с хлорпропамидом отвешивают активаторы чрескожного переноса, а именно: диоктилсульфосукцинат натрия (0,06 масс. %), дигидрокверцетин (0,04 масс. %), альфа-токоферола ацетат (0,02 масс. %), и растворяют в масле косточек ядер абрикоса (4,0 масс. %), перемешивая с помощью мешалки при скорости 50 об/мин при температуре 60°С до полного растворения (визуальный контроль). Далее для получения матрицы в акриловый адгезив (95,88 масс. %) добавляют масляной раствор активаторов чрескожного переноса. Массовые проценты компонентов приведены от массы полимерной матрицы.
Отвешивают хлорпропамид в количестве, достаточном для получения смеси, содержащей 11,5 мас. % хлорпропамида от состава ТТС, и растворяют его в 95% спирте этиловом. Далее спиртовой раствор хлорпропамида добавляют в полученную полимерную матрицу и перемешивают.
Состав полученной композиции с хлорпропамидом и акриловой матрицей с КАП представлен в таблице 1.

Для изготовления ТТС полученную композицию наносят на внешний покровный слой типа Cotran 9715 film (3М, США) и сушат при комнатной температуре в течение 2 часов. Затем наносят защитный слой типа Scotchpack 1022 pet film (3М, США). Готовую ТТС разрезают до требуемого размера и герметично упаковывают.
Пример 2.
При изготовлении полимерной матрицы для ТТС с кофеин бензоатом отвешивают активаторы чрескожного переноса, а именно: диоктилсульфосукцинат натрия (0,14 масс. %), дигидрокверцетин (0,14 масс. %), альфа-токоферола ацетат (0,10 масс. %), и растворяют в масле косточек ядер абрикоса (9,6 масс. %), перемешивая с помощью мешалки при скорости 50 об/мин при температуре 60°С до полного растворения (визуальный контроль). Далее для получения матрицы в акриловый адгезив (90,02 масс. %) добавляют масляной раствор активаторов чрескожного переноса. Массовые проценты компонентов приведены от массы полимерной матрицы.
Отвешивают кофеина бензоат в количестве, достаточном для получения смеси, содержащей 30,3 масс. % кофеина бензоата от состава ТТС, и растворяют его в 95% спирте этиловом. Далее спиртовой раствор кофеина бензоата добавляют в полученную полимерную матрицу и перемешивают.
Состав полученной композиции с кофеина бензоатом и акриловой матрицей с КАП представлен в таблице 2.

Для изготовления ТТС полученную композицию наносят на внешний покровный слой типа Cotran 9715 film (3М, США) и сушат при комнатной температуре в течение 2 часов. Затем наносят защитный слой типа Scotchpack 1022 pet film (3М, США). Готовую ТТС разрезают до требуемого размера и герметично упаковывают.
Пример 3.
Были проведены исследования диффузии хлорпропамида из ТТС с полимерной матрицей с КАП и без него через неконсервированную кожу кроликов in vitro. Изготовление полимерной матрицы описано в примере 1.
Изучение проводили в стеклянных диффузионных ячейках Франца на анализаторе диффузии лекарственных препаратов HDT 1000 (Copley Scientific Ltd., Великобритания). Приемную камеру диффузионных ячеек заполняли дегазированным 0,9% раствором хлорида натрия. Дегазацию раствора осуществляли в ультразвуковой ванне Elmasonic S 60 Н (Elma, Германия). Отбор проб из стеклянного патрубка приемной камеры диффузионных ячеек осуществляли через 24 часа инкубации. Пробы водных растворов ЛВ, отобранные в ходе эксперимента из приемных камер диффузионных ячеек, исследовали аналитическим методом высокоэффективной жидкостной хроматографии (ВЭЖХ) (Agilent 1200, насос G1311A, детектор G1314B).
В таблице 3 приведены результаты исследования чрескожной диффузии хлорпропамида из ТТС (15 мг ЛВ, 10 см2) в зависимости от состава полимерной матрицы.
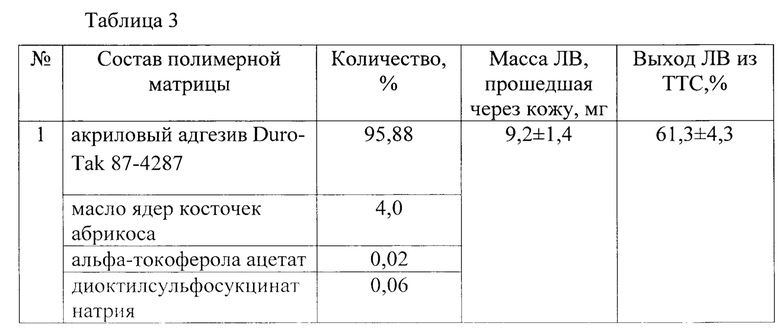
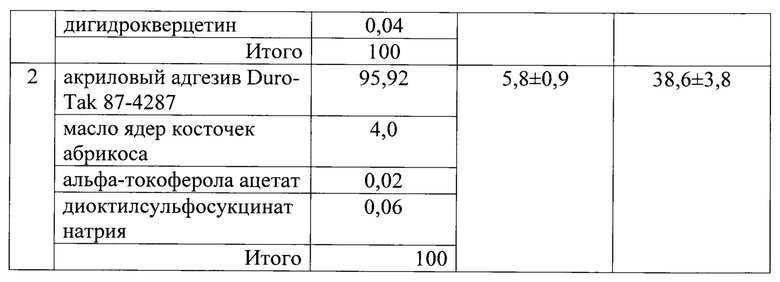
Заявляемое техническое решение обеспечивает достижение усматриваемого заявителем технического результата, а именно - обеспечение возможности усиления чрескожного переноса ЛВ из ТТС с полимерной матрицей с КАП.
Пример 4.
Были проведены исследования диффузии кофеин бензоата из ТТС с полимерной матрицей с КАП и без него через неконсервированную кожу кроликов in vitro. Изготовление полимерной матрицы описано в примере 2. Методика исследования диффузии ЛВ изложена в примере 3.
В таблице 4 приведены результаты чрескожной диффузии кофеина из ТТС (50 мг ЛВ, 10 см) в зависимости от состава полимерной матрицы:
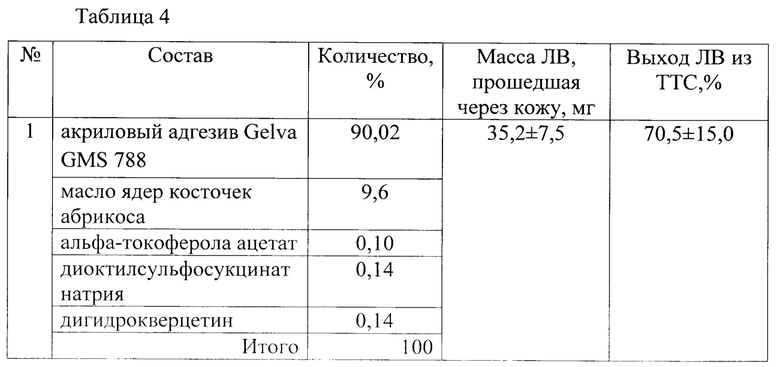
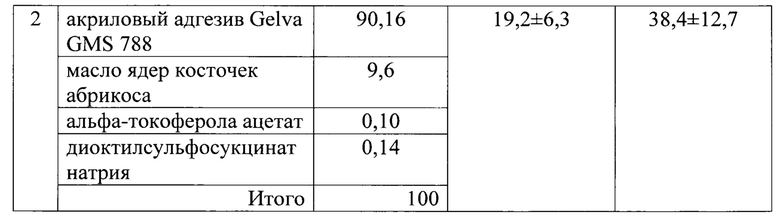
Заявляемое техническое решение обеспечивает достижение усматриваемого заявителем технического результата, а именно - обеспечение возможности усиления чрескожного переноса ЛВ из ТТС с полимерной матрицей с КАП.
Пример 5.
Для подтверждения уменьшения времени достижения постоянной концентрации ЛВ в крови за счет использования полимерной матрицы с КАП были проведены фармакокинетические исследования ТТС in vivo.
Способ изготовления ТТС изложен в примерах 1 и 2.
Исследование концентрации ЛВ в плазме крови кроликов при чрескожном введении проводили согласно разработанному дизайну. Животные были разделены на две группы по 3 особи. Первой группе животных проводили аппликацию ТТС с полимерной матрицей с КАП в течении 24 часов, второй группе проводили аппликацию ТТС с полимерной матрицей без КАП в тех же условиях.
Аппликацию ТТС производили на предварительно выбритый участок кожи спины лабораторных животных у основания шеи. Препарат наклеивали на здоровую кожу не ранее, чем через сутки после процедуры удаления шерсти.
Забор крови животных производился до аппликации ТТС, а также в дискретные интервалы времени из краевой ушной вены в пробирку с 3,8% раствором цитрата натрия. Время забора крови составило: 1, 2, 4, 6, 12, 15, 18, 20 и 24 часа аппликации ТТС. Пробирку центрифугировали 5 минут при 1500 об/мин, затем аккуратно отбирали плазму. Определение концентрации ЛВ в плазме крови кроликов производили методом ВЭЖХ (Agilent 1200, насос G1311A, детектор G1314B).
В таблице 5 приведены результаты фармакокинетических исследований ТТС с хлорпропамидом (15 мг ЛВ, 10 см2) с полимерной матрицей разного состава.
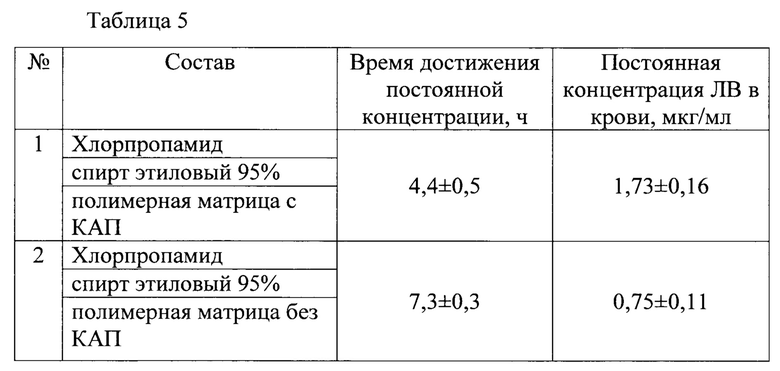
В таблице 6 приведены результаты фармакокинетических исследований ТТС с кофеином бензоатом (50 мг ЛВ, 10 см) с полимерной матрицей разного состава.
Заявляемое техническое решение обеспечивает уменьшение времени достижения постоянной концентрации ЛВ в крови за счет использования ТТС с полимерной матрицей с КАП.
Пример 6.
По результатам экспериментов, описанных в Примерах 3 и 4, был произведен расчет контактной площади необходимой для ТТС с полимерной матрицей без КАП для достижения такой же постоянной концентрации ЛВ в крови, как при аппликации ТТС с полимерной матрицей с КАП. Для ТТС хлорпропамида с полимерной матрицей без КАП необходимая контактная площадь должна составлять 23 см2, что в 2,3 раз больше, чем для ТТС хлорпропамида с полимерной матрицей с КАП.
Для ТТС с кофеин бензоатом с полимерной матрицей без КАП необходимая контактная площадь составила 27 см2, что в 2,7 раз больше, чем для ТТС с кофеин бензоатом с полимерной матрицей с КАП.
Уменьшение контактной площади ТТС происходит благодаря увеличению скорости чрескожной диффузии ЛВ за счет применения полимерной матрицы с КАП.
Пример 7.
Оценка местно-раздражающего действия была проведена при аппликации ТТС лидокаина (50 мг) с полимерной матрицей с КАП и без КАП в экспериментах in vivo на кроликах в соответствии с ГОСТ ISO 1099-10-2011 «Изделия медицинские. Оценка биологического действия медицинских изделий» Часть 10 - Исследования раздражающего и сенсибилизирующего действия.
Способ изготовления полимерной матрицы для ТТС с лидокаином аналогичен, изложенному в примере 2.
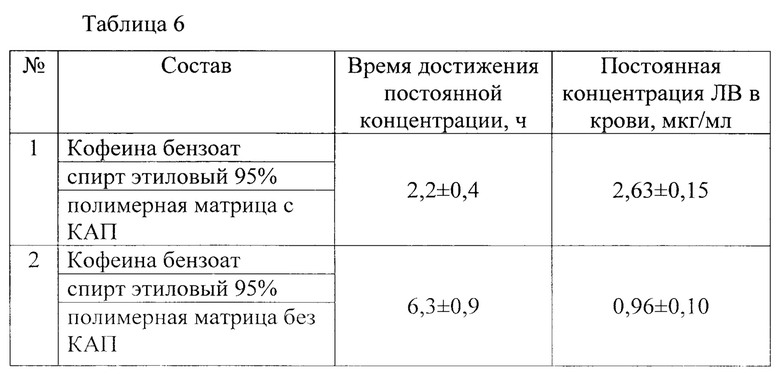
Для исследования раздражающего действия использовали половозрелых молодых кроликов породы Новозеландские белые весом от 2 до 3,7 кг только со здоровой кожей. Было две группы животных по 3 кролика в каждой для аппликации ТТС лидокаина с полимерной матрицей с КАП и без КАП. За сутки до проведения исследований выстригали шерсть на участках площадью примерно 10×10 см2 по обеим сторонам спины. Аппликацию двух образцов ТТС размером 2,5×4,0 см2 производили на кожу спины кролика с каждой стороны позвоночника и фиксировали повязкой. Через 24 часа снимали повязку и ТТС, отмечали положения участков аппликации и протирали их теплой водой. Регистрировали состояние каждого участка кожи, где производили аппликацию, через 1, 24, 48 и 72 ч после удаления ТТС. Оценка степени кожной реакции кроликов на аппликацию ТТС с лидокаином представлена в таблице 7.
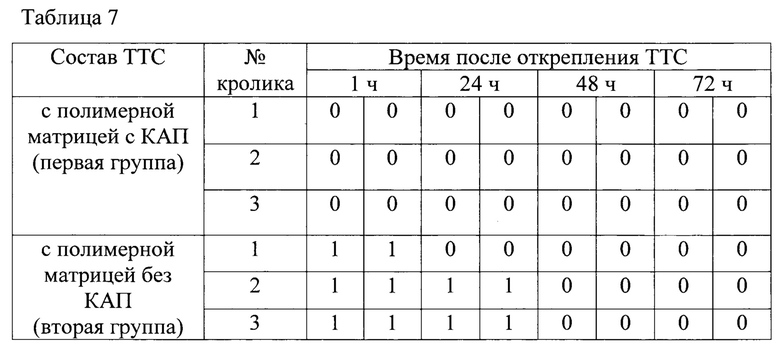
Из таблицы 7 видно, что у всех трех кроликов из второй группы через час после открепления ТТС лидокаина с полимерной матрицей без КАП была обнаружена слегка заметная эритема на обеих областях аппликации, которая сохранялась у двух кроликов еще в течение суток. В последующие сутки эти признаки раздражения исчезли.
У всех животных после открепления ТТС лидокаина с полимерной матрицей с КАП кожа в месте аппликации оставалась неповрежденной на протяжении всего периода исследования.
Таким образом, продемонстрировано отсутствие раздражения кожи в месте аппликации ТТС лидокаина с полимерной матрицей с КАП.
Пример 8.
Срок годности ТТС хлорпропамида (15 мг) с полимерной матрицей с КАП и без КАП в условиях хранения определяли по результатам исследования количественного содержания ЛВ в ТТС с полимерной матрицей на протяжении 3-х лет (таблица 8).
Способ изготовления ТТС изложен в примере 1.
Определение содержания в ТТС проводили следующим образом. В коническую колбу с притертой пробкой вместимостью 200 мл помещали 200 мл 0,01H раствора кислоты хлористоводородной. ТТС освобождали от защитного и покровного слоя и помещали в ту же колбу. Колбу закрывали пробкой, помещали в кипящую водяную баню и выдерживали в течение 1 часа.
Через 1 час, полученный раствор переносили в мерную колбу вместимостью 2000 мл. Извлечение повторяли еще 4 раза в тех же условиях, перенося полученные растворы в ту же мерную колбу. Объем раствора в колбе доводили 0,01 Н раствором кислоты хлористоводородной до метки.
Измеряли оптическую плотность полученного раствора и раствора стандартного образца (РСО) хлорпропамида в максимуме поглощения при длине волны 230±2 нм в кювете с толщиной слоя 10 мм. В качестве раствора сравнения использовали 0,01 Н раствор кислоты хлористоводородной.
Приготовление стандартного образца хлорпропамида. Около 0,0080 г (точная навеска) хлорпропамида помещали в мерную колбу вместимостью 100 мл, прибавляли 60 мл 0,01 Н раствора кислоты хлористоводородной, растворяли на кипящей водяной бане в течение 10 минут, доводили объем раствора тем же растворителем до метки, перемешивали. 5 мл полученного раствора переносили в мерную колбу вместимостью 50 мл, доводили 0,01 Н раствором кислоты хлористоводородной до метки и снова перемешивали. Срок годности раствора - 14 суток.
Содержание хлорпропамида в ТТС в граммах (X) вычисляли по формуле:
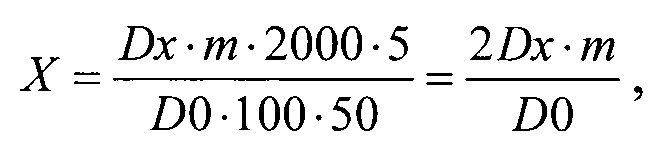
где Dx - оптическая плотность испытуемого раствора;
D0 - оптическая плотность раствора РСО хлорпропамида;
m - навеска хлорпропамида, взятая для приготовления РСО, г.
Опыт повторяли шесть раз с ТТС одной серии, рассчитывали средний результат. Содержание хлорпропамида в одной ТТС должно быть не менее 0,0150±0,0015 г.
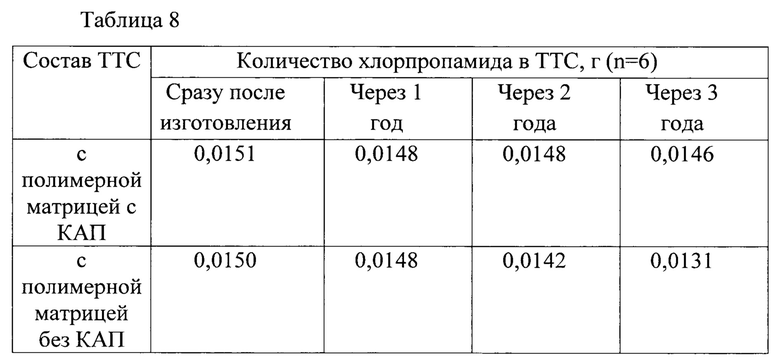
Срок годности ТТС хлорпропамида с КАП увеличивается до 3-х лет.
Пример 9.
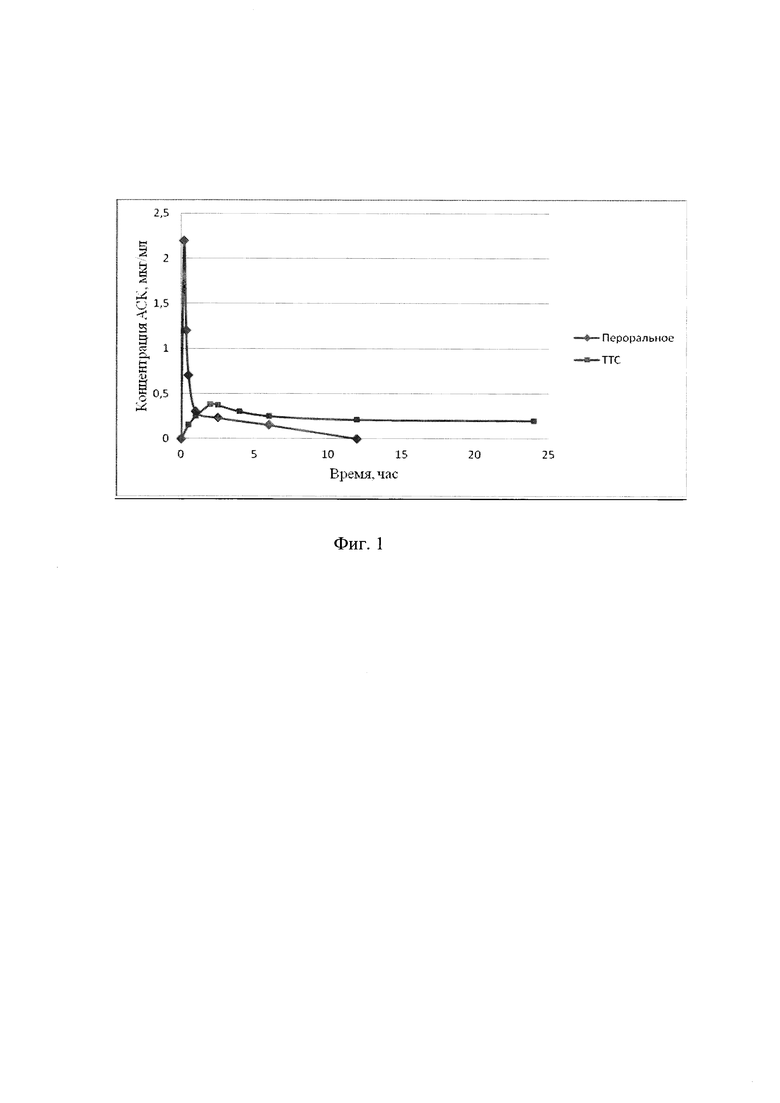
Пролонгированное действие ТТС ЛВ с КАП было продемонстрировано при изучении динамики концентрации ацетилсалициловой кислоты (АСК) при пероральном и трансдермальном введении в одинаковой дозе (50 мг) в экспериментах in vivo.
Способ изготовления полимерной матрицы для ТТС с АСК аналогичен, изложенному в примере 2.
Аппликацию ТТС с полимерной матрицей (10 civr) с КАП производили на предварительно выбритый участок кожи спины трех лабораторных животных у основания шеи. Препарат наклеивали на здоровую кожу не ранее, чем через сутки после процедуры удаления шерсти. Забор крови животных производился до аппликации ТТС, а также в дискретные интервалы времени из краевой ушной вены в пробирку с 3,8% раствором цитрата натрия. Время забора крови составило: 0,5 ч., 1 ч., 2 ч., 2,5 ч., 4 ч., 6 ч., 12 ч. и 24 ч. аппликации ТТС.
На тех же животных через 2 недели после исследования ТТС АСК проводили исследование перорального введения АСК. Забор крови животных производили до приема препарата и через 10 мин., 20 мин., 30 мин., 1 ч., 2,5 ч., 6 ч., 12 ч. и 24 ч.
Пробы крови во всех экспериментах центрифугировали 5 минут при 1500 об/мин, затем аккуратно отбирали плазму. Определение концентрации ЛВ в плазме крови кроликов производили методом ВЭЖХ (Agilent 1200, насос G1311A, детектор G1314B).
На фиг. 1 представлена динамика концентрации АСК в плазме крови кролика после перорального и трансдермального введения.
Проведенные эксперименты показали пролонгированное действие ТТС АСК с КАП в течение 24 часов.
| название | год | авторы | номер документа |
|---|---|---|---|
| МИКРОЭМУЛЬСИОННЫЕ КОМПОЗИЦИИ ДЛЯ СОЗДАНИЯ ТРАНСДЕРМАЛЬНЫХ И ТРАНСМУКОЗАЛЬНЫХ ФОРМ ФАРМАЦЕВТИЧЕСКИХ СРЕДСТВ И КОСМЕТИЧЕСКИХ ПРЕПАРАТОВ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2481822C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ТРАНСДЕРМАЛЬНОЙ ТЕРАПЕВТИЧЕСКОЙ СИСТЕМЫ, СОДЕРЖАЩАЯ АЛПРАЗОЛАМ | 2018 |
|
RU2694232C1 |
| ТРАНСДЕРМАЛЬНЫЙ ПЛАСТЫРЬ | 2010 |
|
RU2445123C2 |
| ТРАНСДЕРМАЛЬНЫЙ ПЛАСТЫРЬ | 2010 |
|
RU2445084C2 |
| ТРАНСДЕРМАЛЬНЫЕ ПЛАСТЫРИ | 2011 |
|
RU2553350C2 |
| ТРАНСДЕРМАЛЬНАЯ ТЕРАПЕВТИЧЕСКАЯ СИСТЕМА (ТТС), СОДЕРЖАЩАЯ ТОЛТЕРОДИН | 2000 |
|
RU2251413C2 |
| САМОРАЗРУШАЮЩАЯСЯ ТРАНСДЕРМАЛЬНАЯ ТЕРАПЕВТИЧЕСКАЯ СИСТЕМА С УЛУЧШЕННЫМИ ФУНКЦИОНАЛЬНЫМИ ПОКАЗАТЕЛЯМИ И ЭФФЕКТИВНОСТЬЮ | 2009 |
|
RU2506948C2 |
| СПОСОБ ТРАНСДЕРМАЛЬНОГО ВВЕДЕНИЯ ИНСУЛИНА И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2012 |
|
RU2534521C2 |
| ТРАНСДЕРМАЛЬНАЯ ТЕРАПЕВТИЧЕСКАЯ СИСТЕМА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1993 |
|
RU2108812C1 |
| ТРАНСДЕРМАЛЬНАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ДОНЕПЕЗИЛ В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2015 |
|
RU2713207C2 |
Изобретение относится к области медицины, а именно к матрице для трансдермальной терапевтической системы. Матрица для трансдермальной терапевтической системы включает акриловый адгезив, масло ядер косточек абрикоса, диоктилсульфосукцинат натрия, дигидрокверцетин, альфа токоферола ацетат при следующем соотношении компонентов, мас.%: масло ядер косточек абрикоса 4,0-9,6; диоктилсульфосукцинат натрия 0,06-0,14; дигидрокверцетин 0,04-0,14; альфа токоферола ацетат 0,02-0,1; акриловый адгезив - остальное. Вышеописанное изобретение позволяет усилить чрескожную диффузию спирторастворимых ЛВ; установить постоянную концентрацию ЛВ в крови через 2-4 часа от начала аппликации; уменьшить контактную площадь ТТС за счет увеличения скорости чрескожной диффузии ЛВ; снизить риск раздражения кожи в месте аппликации ТТС; увеличить срока годности ТТС за счет использования матрицы. 1 ил., 8 табл., 9 пр.
Матрица для трансдермальной терапевтической системы, включающая акриловый адгезив, масло ядер косточек абрикоса, диоктилсульфосукцинат натрия, дигидрокверцетин, альфа токоферола ацетат при следующем соотношении компонентов, мас.%:
| РЫЖИКОВА В.А | |||
| и др | |||
| Влияние активатора переноса на функциональные свойства матричных трансдермальных терапевтических систем бромокаина // Перспективные материалы, 2014, No2, с | |||
| Прибор для получения стереоскопических впечатлений от двух изображений различного масштаба | 1917 |
|
SU26A1 |
| US 2021228497 A1, 29.07.2021 | |||
| US 2007280972 A1, 06.12.2007. | |||
Авторы
Даты
2024-01-24—Публикация
2023-02-03—Подача