ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] В данной заявке испрашиваются преимущества и приоритет предварительной патентной заявки U.S. с серийным номером 62/751,391, поданной 26 октября 2018 г.; содержание которой полностью включено в настоящее описание посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[0002] Изобретение обеспечивает способы, композиции и наборы, содержащие альфа-адренергический антагонист, такой как фентоламин, для использования в монотерапии или как часть комбинированной терапии для лечения пациентов, страдающих пресбиопией, мидриазом и/или другими глазными расстройствами.
УРОВЕНЬ ТЕХНИКИ
[0003] Пресбиопия - это расстройство глаза, связанное со старением, которое приводит к неспособности сосредоточиться на близлежащих объектах. Пресбиопия обычно возникает из-за затвердевания хрусталика глаза, что снижает его способность сгибаться. Люди часто впервые замечают последствия пресбиопии примерно в 40 лет, и в последующие два десятилетия эффекты становятся все более выраженными. Последствия пресбиопии могут иметь значительное негативное влияние на качество жизни, например, мешать занятиям, связанным с чтением.
[0004] Существующие способы лечения пресбиопии не эффективны для всех пациентов и/или имеют нежелательные характеристики. Распространенным способом лечения пресбиопии является использование корректирующих линз (например, очков для чтения или бифокальных очков), которые затем должен носить с собой пациент. Кроме того, бифокальные или мультифокальные линзы, включая контактные линзы, могут быть трудными в использовании, особенно при выполнении задач, требующих частой смены просмотра близких и удаленных объектов. Подходы к лечению монозрения, при которых один глаз оптимизирован для зрения вдаль и линзы или хирургические способы компенсируют пресбиопию в другом глазу, приводят к нарушению восприятия глубины и могут дезориентировать. Хирургические подходы, такие как LASIK и линзы-вкладыши, также представляют все риски, присущие хирургическим процедурам. Несмотря на продолжающиеся исследования, в настоящее время не существует неинвазивных фармакологических способов лечения пресбиопии, которые были бы признаны безопасными и эффективными Управлением США по санитарному надзору за качеством пищевых продуктов и медикаментов.
[0005] Мидриаз - это расстройство глаза, характеризующееся необычно расширенным зрачком, часто вызываемое одним или несколькими заболеваниями, травмами или фармакологическим агентом. Фармакологическим агентом может быть, например, агент, вводимый в глаз, чтобы вызвать расширение зрачка в рамках обследования глаза. Альтернативно, фармакологический агент может быть агентом, вводимым пациенту по другим причинам, и может быть однократным введением агента пациенту или агентом, вводимым несколько раз. Негативные эффекты мидриаза могут включать чувствительность к свету и неспособность фокусироваться, особенно в яркой среде. Существующие способы лечения мидриаза различаются в зависимости от причины мидриаза, но не эффективны для всех пациентов и/или имеют нежелательные характеристики. Одним из способов лечения мидриаза, описанным в литературе, является REV-EYES™ (офтальмологический раствор дапипразола гидрохлорида). Типичным протоколом введения REV-EYES™ является введение двух капель офтальмологического раствора в глаз пациента, и затем, через пять минут, введение еще двух капель офтальмологического раствора в глаз пациента. Некоторые недостатки REV-EYES™ заключаются в том, что, как сообщается, он вызывает сильное жжение при введении, что неприятно для пациента, а также значительное покраснение глаз. Существует потребность в лучших способах лечения мидриаза.
[0006] Данное изобретение направлено на указанную выше потребность в способах и композициях для лечения пациентов, страдающих пресбиопией, мидриазом и другими глазными расстройствами, при минимизации нежелательных побочных эффектов, и изобретение обеспечивает другие связанные преимущества.
СУТЬ ИЗОБРЕТЕНИЯ
[0007] Изобретение обеспечивает способы, композиции и наборы, содержащие альфа-адренергический антагонист, такой как фентоламин, для использования в монотерапии или как часть комбинированной терапии для лечения пациентов, страдающих пресбиопией, мидриазом и/или другими глазными расстройствами. Альфа-адренергический антагонист, такой как фентоламин, вводят местно в глаз пациента, предпочтительно в форме жидкого водного офтальмологического препарата. Желательно, чтобы альфа-адренергический антагонист вводился пациенту один раз в день, отдельно или в комбинации с дополнительным агентом, чтобы уменьшить диаметр зрачка пациента, например, чтобы диаметр зрачка составлял менее 2 мм, 1,8 мм или 1,6 мм, или чтобы уменьшение диаметра зрачка составляло не менее 1 мм, 2 мм, 3 мм или более. В некоторых вариантах реализации альфа-адренергический антагонист вводят пациенту один раз в день, отдельно или в комбинации с дополнительным агентом, чтобы уменьшить диаметр зрачка пациента, например, чтобы диаметр зрачка составлял менее 3,0, 2,8, 2,6, 2,4 или 2,2 мм. Такое уменьшение диаметра зрачка из-за альфа-адренергического антагониста обеспечивает терапевтические преимущества для пациентов, страдающих пресбиопией или мидриазом. Уменьшение диаметра зрачка может быть охарактеризовано в соответствии с процентным уменьшением диаметра зрачка из-за введения альфа-адренергического антагониста, например, когда уменьшение диаметра зрачка составляет не менее 5%, 10%, 15%, 20%, 30% или 40%. Одним из преимуществ терапевтических способов, описанных в данном документе, является то, что у пациента может наблюдаться улучшение зрительных характеристик, например, улучшение способности пациента ясно видеть и/или способности различать объект и его фон. Улучшение зрительных характеристик может включать улучшение зрительных характеристик как на близком, так и на большом расстоянии. Другое преимущество терапевтических способов, описанных в данном документе, состоит в том, что существуют способы, обеспечивающие протокол введения один раз в день, который проще для пациентов, чем протокол дозирования, требующий введения терапевтического агента(ов) несколько раз в день. Еще одно преимущество терапевтических способов, описанных в данном документе, заключается в том, что существуют способы, обеспечивающие быстрое начало лечения, при которых, например, терапевтический эффект может наблюдаться уже в течение около 30 минут после введения, например, альфа-адренергического антагониста, такого как фентоламин в глаз пациента. В некоторых вариантах реализации терапевтический эффект можно наблюдать в течение 30-60 минут после введения, например, альфа-адренергического антагониста, такого как фентоламин в глаз пациента. В некоторых вариантах реализации терапевтический эффект можно наблюдать уже в течение около 1 часа после введения, например, альфа-адренергического антагониста, такого как фентоламин в глаз пациента. Примерные аспекты и варианты реализации изобретения описаны ниже.
[0008] Один аспект изобретения обеспечивает способ лечения пресбиопии у пациента. Способ включает введение в глаз пациента, нуждающегося в этом, дозы альфа-адренергического антагониста в количестве, эффективном для лечения пресбиопии, при этом дозу вводят в глаз не чаще, чем один раз в день. Доза может быть введена пациенту перед сном или незадолго до него. Одним из преимуществ такого протокола дозирования является то, что он сводит к минимуму покраснение глаз, испытываемое пациентом в часы бодрствования, при этом достигается уменьшение диаметра зрачка, что желательно для лечения пресбиопии. В некоторых вариантах реализации дозировка содержит мезилат фентоламина.
[0009] Другой аспект изобретения обеспечивает способ лечения пресбиопии у пациента с минимизацией покраснения глаз в часы бодрствования пациента. Способ включает введение в глаз пациента, нуждающегося в этом, только перед сном или незадолго до него дозы альфа-адренергического антагониста в количестве, эффективном для лечения пресбиопии. Одним из преимуществ протокола дозирования является то, что он сводит к минимуму покраснение глаз, испытываемое пациентом в часы бодрствования, при этом достигается уменьшение диаметра зрачка, что желательно для лечения пресбиопии. В некоторых вариантах реализации дозировка содержит мезилат фентоламина. В некоторых вариантах реализации способ дополнительно включает введение в указанный глаз пациента дополнительного агента, который способствует уменьшению зрачка пациента или улучшает зрительные характеристики. В некоторых вариантах реализации способ дополнительно включает введение в указанный глаз пациента дополнительного агента, который способствует уменьшению зрачка пациента. В некоторых вариантах реализации способ дополнительно включает введение в указанный глаз пациента дополнительного агента, улучшающего зрительные характеристики. В других вариантах реализации изобретения альфа-адренергический антагонист является единственным вводимым агентом, который лечит пресбиопию.
[0010] Другой аспект изобретения обеспечивает способ лечения пресбиопии у пациента согласно режиму лечения монотерапией. Способ включает введение в глаз пациента, нуждающегося в этом, дозы единственного терапевтического агента в количестве, эффективном для лечения пресбиопии, где единственный терапевтический агент представляет собой альфа-адренергический антагонист. Доза может вводиться в глаз пациента в соответствии с конкретным протоколом дозирования, таким как введение в глаз пациента один раз в день, что может быть, например, перед сном пациента или незадолго до него. Такой протокол дозирования может включать, например, введение дозы в глаз пациента в течение по меньшей мере трех или семи дней подряд. В некоторых вариантах реализации единственным терапевтическим агентом является мезилат фентоламина.
[0011] Другой аспект изобретения обеспечивает способ лечения мидриаза у пациента. Способ включает введение в глаз пациента, нуждающегося в этом, дозы альфа-адренергического антагониста в количестве, эффективном для лечения мидриаза. В некоторых вариантах реализации изобретения мидриаз обусловлен тем, что пациент получил один или несколько адренергических или парасимпатолитических агентов. В некоторых вариантах реализации мидриаз обусловлен тем, что пациент получил один или несколько из альфа-агонистов, агонистов TAAR1 или NSAID. В некоторых вариантах реализации мидриаз обусловлен тем, что пациент получил один или несколько из атропина, циклопентолата, гоматропина, скополамина, тропикамида, фенилэфрина или их фармацевтически приемлемую соль. В некоторых вариантах реализации мидриаз обусловлен тем, что пациент получил один или несколько из атропина, циклопентолаат, гоматропина, скополамина, тропикамида или его фармацевтически приемлемой солм. В некоторых вариантах реализации мидриаз обусловлен тем, что пациент получил один или несколько из атропина, циклопентолата, гоматропина, скополамина, тропикамида, флубипрофена, супрофена, гидроксиамфетамина, фенилэфрина, циклопентолата, кеторолака или его фармацевтически приемлемой соли. В некоторых вариантах реализации единственным терапевтическим агентом является мезилат фентоламина.
[0012] Изобретение также обеспечивает уменьшение покраснения глаз из-за введения альфа-адренергического антагониста. В некоторых вариантах реализации способ дополнительно включает введение агента, уменьшающего покраснение глаз. Примеры агентов, уменьшающих покраснение глаз, включают бримонидин, тетрагидрозолин, оксиметазолин, нафтазолин или их фармацевтически приемлемую соль, такие как Lumify® (который представляет собой коммерчески доступный офтальмологический раствор, содержащий тартрат бримонидина (0,025% мас./мас.)).
[0013] Другой аспект изобретения обеспечивает фармацевтическую композицию, содержащую альфа-адренергический антагонист и второй терапевтический агент, выбранный из группы, состоящей из агониста ацетилхолинового мускаринового рецептора, альфа-2 адренергического агониста, простагландина и холинового эфира липоевой кислоты. Предпочтительно фармацевтическая композиция составлена для офтальмологического введения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0014] На Фиг. 1 показан пример покраснения глаз, измеренный согласно (1) шкале оценки покраснения CCLRU и (2) шкале оценки покраснения NYX-001.
[0015] Фиг. 2 представляет собой график, показывающий наблюдаемое изменение диаметра зрачка, наблюдаемое в клиническом исследовании, описанном в Примере 5.
[0016] Фиг. 3 представляет собой график, показывающий наблюдаемое покраснение глаз, наблюдаемое в клиническом исследовании, описанном в Примере 5.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0017] Изобретение обеспечивает способы, композиции и наборы, содержащие альфа-адренергический антагонист, такой как фентоламин, для использования в монотерапии или как часть комбинированной терапии для лечения пациентов, страдающих пресбиопией, мидриазом и/или другими глазными расстройствами. Альфа-адренергический антагонист, такой как фентоламин, вводят местно в глаз пациента, предпочтительно в форме жидкого водного офтальмологического препарата. Желательно, чтобы альфа-адренергический антагонист вводился пациенту один раз в день, отдельно или в комбинации с дополнительным агентом, чтобы уменьшить диаметр зрачка пациента, например, чтобы диаметр зрачка составлял менее 2 мм, 1,8 мм или 1,6 мм, или чтобы уменьшение диаметра зрачка составлял не менее 1 мм, 2 мм, 3 мм или более. В некоторых вариантах реализации альфа-адренергический антагонист вводят пациенту один раз в день, отдельно или в комбинации с дополнительным агентом, чтобы уменьшить диаметр зрачка пациента, например, чтобы диаметр зрачка составлял менее 3,0, 2,8, 2,6, 2,4 или 2,2 мм. Уменьшение диаметра зрачка может быть охарактеризовано в соответствии с процентным уменьшением диаметра зрачка из-за введения альфа-адренергического антагониста, например, когда уменьшение диаметра зрачка составляет не менее 5%, 10%, 15%, 20%, 30% или 40%. Такое уменьшение диаметра зрачка из-за альфа-адренергического антагониста обеспечивает терапевтические преимущества для пациентов, страдающих пресбиопией или мидриазом. Одним из преимуществ терапевтических способов, описанных в данном документе, является то, что у пациента может наблюдаться улучшение зрительных характеристик, например, улучшение способности пациента ясно видеть и/или способности различать объект и его фон. Улучшение зрительных характеристик может включать улучшение зрительных характеристик как на близком, так и на большом расстоянии. Другое преимущество терапевтических способов, описанных в данном документе, состоит в том, что существуют способы, обеспечивающие протокол введения один раз в день, который проще для пациентов, чем протокол дозирования, требующий введения терапевтического агента(ов) несколько раз в день. Еще одно преимущество терапевтических способов, описанных в данном документе, заключается в том, что существуют способы, обеспечивающие быстрое начало лечения, при которых, например, терапевтический эффект может наблюдаться уже в течение около 30 минут после введения, например, альфа-адренергического антагониста, такого как фентоламин в глаз пациента. В некоторых вариантах реализации терапевтический эффект можно наблюдать в течение 30-60 минут после введения, например, альфа-адренергического антагониста, такого как фентоламин в глаз пациента. В некоторых вариантах реализации терапевтический эффект можно наблюдать уже в течение около 1 часа после введения, например, альфа-адренергического антагониста, такого как фентоламин в глаз пациента. Примерные аспекты и варианты реализации изобретения описаны ниже. Различные аспекты изобретения изложены ниже в разделах; однако аспекты изобретения, описанные в одном конкретном разделе, не должны ограничиваться каким-либо конкретным разделом.
Определения
[0018] Для облегчения понимания настоящего изобретения ниже определен ряд терминов и фраз.
[0019] Термины обозначающие единственное число в контексте настоящего описания означают «один или несколько» и включают множественное число, если контекст не является неподходящим.
[0020] Используемый в данном документе термин «пациент» относится к организмам, которые подлежат лечению способами данного изобретения. Такие организмы предпочтительно включают, но не ограничиваются ими, млекопитающих (например, мыши, обезьяны, лошади, крупный рогатый скот, свиньи, собаки, кошки и т.п.) и наиболее предпочтительно включают людей.
[0021] Используемый в данном документе термин «эффективное количество» относится к количеству соединения, достаточному для достижения благоприятных или желаемых результатов. Если не указано иное, эффективное количество можно вводить за одно или несколько введений, применений или дозировок, и оно не предназначено для ограничения конкретным составом или путем введения. Используемый в данном документе термин «лечение» включает любой эффект, например, уменьшение, снижение, модуляцию, улучшение или устранение, который приводит к улучшению состояния, заболевания, расстройства и т.п. или улучшению их симптомов.
[0022] Используемый в данном документе термин «фармацевтическая композиция» относится к комбинации активного агента с носителем, инертным или активным, что делает композицию особенно подходящей для терапевтического использования in vivo или ex vivo.
[0023] Используемый в данном документе термин «фармацевтически приемлемый носитель» относится к любому из стандартных фармацевтических носителей, таким как фосфатно-солевой буферный раствор, вода, эмульсии (например, такие как эмульсии масло/вода или вода/масло) и различные типы смачивающих агентов. Композиции также могут включать стабилизаторы и консерванты. Примеры носителей, стабилизаторов и адъювантов см. в Martin in Remington's Pharmaceutical Sciences, 15th Ed., Mack Publ. Co., Easton, PA [1975].
[0024] Используемый в данном документе термин «фармацевтически приемлемая соль» относится к любой фармацевтически приемлемой соли (например, кислота или основание) соединения данного изобретения, которая при введении субъекту способна обеспечить соединение данного изобретения. Как известно специалистам в данной области, «соли» соединений данного изобретения могут быть производными неорганических или органических кислот и оснований. Примеры кислот включают, но не ограничиваются ими, соляную, бромистоводородную, серную, азотную, хлорную, фумаровую, малеиновую, фосфорную, гликолевую, молочную, салициловую, янтарную, толуол-п-сульфоновую, винную, уксусную, лимонную, метансульфоновую, этансульфоновую, муравьиную, бензойную, малоновую, нафталин-2-сульфоновую, бензолсульфоновую кислоту и тому подобное. Другие кислоты, такие как щавелевая, хотя сами по себе не являются фармацевтически приемлемыми, могут быть использованы при получении солей, используемых в качестве промежуточных продуктов при получении соединений изобретения и их фармацевтически приемлемых кислотно-аддитивных солей.
[0025] Примеры оснований включают, но не ограничиваются ими, гидроксиды щелочных металлов (например, натрий), щелочноземельные металлы (например, магний), гидроксиды, аммиак и соединения формулы NW3, где W представляет собой C1-4 алкил, и подобное.
[0026] Примеры солей включают, но не ограничиваются ими: ацетат, адипат, альгинат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанепропионат, диглюконат, додецилсульфат, этаносульфонат, фумарат, флукогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидроиодид, 2-гидроксиэтансульфонат, лактат, малеат, метансульфонат (мезилат), 2-нафталинсульфонат, никотинат, оксалат, пальмоат, пектинат, персульфат, фенилпропионат, пикрат, пивалат, пропионат, сукцинат, сульфат, тартрат, тиоцианат, тозилат, ундеканоат и т.п. Другие примеры солей включают анионы соединений данного изобретения, соединенные с подходящим катионом, таким как Na+, NH4+ и NW4+ (где W представляет собой C1-4 алкильную группу) и тому подобное.
[0027] Считается, что для терапевтического использования соли соединений данного изобретения являются фармацевтически приемлемыми. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми, также могут найти применение, например, при получении или очистке фармацевтически приемлемого соединения.
[0028] Термин «алканоат» известен в данной области и относится к алкил-C(O)O-.
[0029] Термин «алкил» известен в данной области техники и включает насыщенные алифатические группы, включая алкильные группы с прямой цепью, алкильные группы с разветвленной цепью, циклоалкильные (алициклические) группы, замещенные алкилом циклоалкильные группы и замещенные циклоалкилом алкильные группы. В некоторых вариантах реализации алкил с прямой или разветвленной цепью имеет около 30 или меньше атомов углерода в своей основной цепи (например, C1-C30 для прямой цепи, C3-C30 для разветвленной цепи) и, альтернативно, около 20 или меньше. Подобным образом циклоалкилы имеют от около 3 до около 10 атомов углерода в своей кольцевой структуре и, альтернативно, около 5, 6 или 7 атомов углерода в кольцевой структуре.
[0030] Используемый в данном документе термин «EV06» относится к соединению, имеющему следующую химическую структуру: 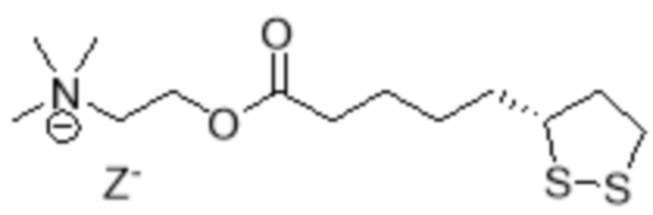 , оптический изомер или их смесь, где Z представляет собой анион. Анион Z- может быть любым фармацевтически приемлемым анионом. Неограничивающие примеры анионов включают хлорид, бромид, йодид, сульфат, метансульфонат, нитрат, малеат, ацетат, цитрат, фумарат, гидрофумарат, тартрат (например, (+)-тартрат, (-)-тартрат или их смесь), сукцинат, бензоат и анионы аминокислоты, такой как глутаминовая кислота. В некоторых вариантах реализации анион представляет собой хлорид. В некоторых вариантах реализации анион представляет собой тартрат.
, оптический изомер или их смесь, где Z представляет собой анион. Анион Z- может быть любым фармацевтически приемлемым анионом. Неограничивающие примеры анионов включают хлорид, бромид, йодид, сульфат, метансульфонат, нитрат, малеат, ацетат, цитрат, фумарат, гидрофумарат, тартрат (например, (+)-тартрат, (-)-тартрат или их смесь), сукцинат, бензоат и анионы аминокислоты, такой как глутаминовая кислота. В некоторых вариантах реализации анион представляет собой хлорид. В некоторых вариантах реализации анион представляет собой тартрат.
[0031] На протяжении всего описания, где композиции и наборы описаны как имеющие, включающие или содержащие определенные компоненты, или где процессы и способы описаны как имеющие, включающие или содержащие конкретные стадии, предполагается, что, кроме того, существуют композиции и наборы данного изобретения, которые по сути состоят из перечисленных компонентов или состоят из них, и что существуют процессы и способы в соответствии с данным изобретением, которые по сути состоят из перечисленных стадий обработки или состоят из них.
[0032] Как правило, композиции с указанием процентного содержания являются массовыми, если не указано иное. Кроме того, если переменная не сопровождается определением, то используется предыдущее определение переменной.
I. Терапевтические способы
[0033] Изобретение обеспечивает способы лечения пациентов, страдающих пресбиопией, мидриазом и/или другими глазными расстройствами, путем введения в глаз пациента альфа-адренергического антагониста, такого как фентоламин. Альфа-адренергический антагонист вводят местно в глаз пациента, предпочтительно в форме жидкого водного офтальмологического препарата. Различные аспекты и варианты реализации терапевтических способов описаны в разделах ниже. Разделы организованы для удобства, и информация в одном разделе не должна ограничиваться этим разделом, но может применяться к способам в других разделах.
А. Первый способ
[0034] Один аспект изобретения обеспечивает способ лечения пресбиопии у пациента, включающий введение в глаз пациента, нуждающегося в этом, дозы альфа-адренергического антагониста в количестве, эффективном для лечения пресбиопии, при этом дозу вводят в глаз не чаще одного раза в день.
[0035] Способ может дополнительно характеризоваться дополнительными признаками, такими как режим дозирования и идентичность дозировки, как более подробно описано ниже. Изобретение охватывает все варианты и комбинации этих признаков. Например, в некоторых вариантах реализации дозу вводят пациенту перед сном или незадолго до него. В некоторых вариантах реализации дозу вводят в течение 1 часа перед сном.
[0036] В некоторых вариантах реализации доза содержит фармацевтически приемлемую соль фентоламина. В некоторых вариантах реализации доза содержит мезилат фентоламина.
Б. Второй способ
[0037] Другой аспект изобретения обеспечивает способ лечения пресбиопии у пациента с одновременным уменьшением покраснения глаз в часы бодрствования пациента, включающий введение в глаз пациента, нуждающегося в этом, только перед сном пациента или незадолго до него, дозы альфа-адренергического антагониста в количестве, эффективном для лечения пресбиопии.
[0038] Способ может дополнительно характеризоваться дополнительными признаками, такими как режим дозирования и введение, идентичность и количество дополнительного агента, как более подробно описано ниже. Изобретение охватывает все варианты и комбинации этих признаков. Например, в некоторых вариантах реализации дозу вводят в глаз не чаще, чем один раз в день. В некоторых вариантах реализации доза содержит фармацевтически приемлемую соль фентоламина. В некоторых вариантах реализации доза содержит мезилат фентоламина.
В. Третий способ
[0039] Другой аспект изобретения обеспечивает способ лечения пресбиопии у пациента, включающий введение в глаз пациента, нуждающегося в этом, дозы альфа-адренергического антагониста в количестве, эффективном для лечения пресбиопии.
[0040] Способ может дополнительно характеризоваться дополнительными признаками, такими как режим дозирования и введение, идентичность и количество дополнительного агента, как более подробно описано ниже. Изобретение охватывает все варианты и комбинации этих признаков.
[0041] В некоторых вариантах реализации дозу вводят пациенту ежедневно. В некоторых вариантах реализации дозу вводят пациенту два раза в день. В некоторых вариантах реализации доза содержит фармацевтически приемлемую соль фентоламина. В некоторых вариантах реализации доза содержит мезилат фентоламина.
[0042] В некоторых вариантах реализации доза альфа-адренергического антагониста составляет 1% мас./мас. раствора мезилата фентоламина. В некоторых вариантах реализации доза альфа-адренергического антагониста составляет 1,5% мас./мас. раствора мезилата фентоламина. В некоторых вариантах реализации доза альфа-адренергического антагониста составляет 2% мас./мас. раствора мезилата фентоламина.
[0043] В некоторых вариантах реализации дозу вводят в виде одной глазной капли. В некоторых вариантах реализации дозу вводят в виде двух глазных капель.
[0044] В некоторых вариантах реализации дозу вводят пациенту в виде комбинации фиксированной дозы с дополнительным терапевтическим агентом. В некоторых вариантах реализации дополнительный терапевтический агент представляет собой пилокарпин.
Г. Дополнительные признаки первого, второго и третьего терапевтических способов
[0045] Первый, второй и третий терапевтические способы могут быть дополнительно охарактеризованы дополнительными признаками. Один признак заключается в том, вводится ли дополнительный агент (например, агент, который способствует уменьшению зрачка пациента или улучшает зрительные характеристики). Другим признаком является то, вводится ли доза альфа-адренергического антагониста последовательно или одновременно с дополнительным агентом.
[0046] В некоторых вариантах реализации способ дополнительно включает введение в указанный глаз пациента дополнительного агента, который способствует уменьшению зрачка пациента или улучшению зрительных характеристик. В некоторых вариантах реализации способ дополнительно включает введение в указанный глаз пациента дополнительного агента, который способствует уменьшению зрачка пациента. Это желательно приводит к дальнейшему уменьшению диаметра зрачка пациента по сравнению с тем, которое достигается при введении только альфа-адренергического антагониста. В некоторых вариантах реализации способ дополнительно включает введение в указанный глаз пациента дополнительного агента, который способствует улучшению зрительных характеристик.
[0047] В некоторых вариантах реализации дополнительный агент вводят в указанный глаз пациента одновременно с дозой альфа-адренергического антагониста. В некоторых вариантах реализации дополнительный агент вводят в указанный глаз пациента последовательно либо до, либо после введения в указанный глаз пациента дозы альфа-адренергического антагониста.
[0048] Способ может быть дополнительно охарактеризован в соответствии с количеством дополнительного агента, вводимого в глаз пациента. Например, в некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,0001 мг до около 0,001 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,001 мг до около 0,01 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,01 мг до около 0,1 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,1 мг до около 0,5 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,5 мг до около 1,0 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 1,0 мг до около 1,5 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 1,5 мг до около 2,0 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 2,0 мг до около 2,5 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 2,5 мг до около 3,0 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 2,5 мг до около 3,0 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,001 мг до около 0,1 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,1 мг до около 1,0 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 1,0 мг до около 2,0 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,1 мг до около 0,125 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,125 мг до около 0,25 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,25 мг до около 0,50 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,50 мг до около 0,75 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,75 мг до около 1,0 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 1,25 мг до около 1,5 мг.
[0049] Способ может быть дополнительно охарактеризован в соответствии с идентичностью дополнительного агента. В некоторых вариантах реализации дополнительный агент улучшает зрительные характеристики. В некоторых вариантах реализации дополнительный агент способствует уменьшению зрачка пациента. В некоторых вариантах реализации дополнительный агент выбран из группы, состоящей из агониста ацетилхолинового мускаринового рецептора, альфа-2 адренергического агониста, простагландина и холинового эфира липоевой кислоты.
[0050] В некоторых вариантах реализации дополнительный агент представляет собой агонист ацетилхолинового мускаринового рецептора.
[0051] В некоторых вариантах реализации дополнительный агент представляет собой пилокарпин или его фармацевтически приемлемую соль. В некоторых вариантах реализации дополнительный агент представляет собой гидрохлорид пилокарпина. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,1 мг до около 1,0 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,1 мг до около 0,3 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве около 0,2 мг. В некоторых других вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,3 мг до около 0,6 мг.
[0052] В некоторых вариантах реализации дополнительный агент представляет собой пилокарпин или его фармацевтически приемлемую соль, которые вводят пациенту в форме офтальмологического раствора. В некоторых вариантах реализации офтальмологический раствор содержит пилокарпин или его фармацевтически приемлемую соль в количестве от около 0,1% мас./мас. до около 3% мас./мас. В некоторых вариантах реализации офтальмологический раствор содержит пилокарпин или его фармацевтически приемлемую соль в количестве от около 0,2% мас./мас. до около 0,4% мас./мас. В некоторых вариантах реализации офтальмологический раствор содержит пилокарпин или его фармацевтически приемлемую соль в количестве от около 1% мас./мас. до около 2% мас./мас. В некоторых вариантах реализации одна капля офтальмологического раствора, содержащего пилокарпин или фармацевтически приемлемую соль, вводится в глаз пациента.
[0053] В некоторых вариантах реализации одна капля глазного состава вводится в глаз пациента, причем глазной состав содержит пилокарпин в количестве от около 0,001% до около 0,1% мас./мас., от около 0,001% до около 2% мас./мас., от около 0,01% до около 2% мас./мас., или от около 0,01% до около 4% мас./мас. В некоторых вариантах реализации одна капля глазного состава вводится в глаз пациента, причем глазной состав содержит пилокарпин в количестве около 0,01%, 0,25%, 0,5%, 1%, 2% или 4% мас./мас.
[0054] В некоторых вариантах реализации дополнительный агент представляет собой карбахол или его фармацевтически приемлемую соль. В некоторых вариантах реализации дополнительный агент представляет собой карбахол. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,5 мг до около 2,5 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,5 мг до около 1,0 мг. В некоторых других вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 1,0 мг до около 1,5 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве около 1,2 мг.
[0055] В некоторых вариантах реализации одна капля глазного состава вводится в глаз пациента, причем глазной состав содержит карбохол в количестве от около 0,001% до около 0,1% мас./мас., от около 0,001% до около 3% мас./мас., от около 0,1% до около 1,5% мас./мас. или от около 0,1% до около 2% мас./мас. В некоторых вариантах реализации одна капля глазного состава вводится в глаз пациента, причем глазной состав содержит карбохол в количестве около 0,1%, 0,25%, 0,5%, 0,75, 1,5%, 2%, 2,25%, или 3% мас./мас.
[0056] В некоторых вариантах реализации дополнительный агент представляет собой бетанехол или его фармацевтически приемлемую соль. В некоторых вариантах реализации дополнительный агент представляет собой соль бетанехола. В некоторых вариантах реализации дополнительный агент представляет собой хлорид бетанехола. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,1 мг до около 3 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,1 мг до около 1 мг. В некоторых других вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 1 мг до около 2 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве около 1,2 мг.
[0057] В некоторых вариантах реализации одна капля глазного состава вводится в глаз пациента, причем глазной состав содержит хлорид бетанехола в количестве от около 0,001% до около 0,1% мас./мас., от около 0,001% до около 0,01% мас./мас. или от около 0,01% до около 0,1% мас./мас. В некоторых вариантах реализации одна капля глазного состава вводится в глаз пациента, причем глазной состав содержит хлорид бетанехола в количестве около 0,001%, 0,01% или 0,1% мас./мас.
[0058] В некоторых вариантах реализации дополнительный агент представляет собой ацеклидин или его фармацевтически приемлемую соль. В некоторых вариантах реализации дополнительный агент представляет собой гидрохлорид ацеклидина. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,01 мг до около 4 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,01 мг до около 0,1 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве около 0,01 мг. В некоторых других вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,1 мг до около 1,5 мг.
[0059] В некоторых вариантах реализации одна капля глазного состава вводится в глаз пациента, причем глазной состав содержит гидрохлорид ацеклидина в количестве от около 0,001% до около 0,1% мас./мас., от около 0,001% до около 1,5% мас./мас., от около 0,001% до около 3% мас./мас., от около 1,35% до около 1,65% мас./мас. или от около 0,01% до около 2% мас./мас. В некоторых вариантах реализации одна капля глазного состава вводится в глаз пациента, причем глазной состав содержит гидрохлорид ацеклидина в количестве около 0,01%, 0,1%, 0,25%, 0,5%, 1%, 1,5%, 2%, 3% или 4% мас./мас.
[0060] В некоторых вариантах реализации дополнительный агент представляет собой оксотреморин или его фармацевтически приемлемую соль. В некоторых вариантах реализации дополнительный агент представляет собой оксотреморин. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,1 мг до около 1,0 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,1 мг до около 0,3 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве около 0,2 мг. В некоторых других вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,3 мг до около 0,6 мг.
[0061] В некоторых вариантах реализации одна капля глазного состава вводится в глаз пациента, причем глазной состав содержит оксотреморин в количестве от около 0,001% до около 0,1% мас./мас., от около 0,001% до около 2% мас./мас., от около 0,01% до около 2% мас./мас. или от около 0,01% до около 4% мас./мас. В некоторых вариантах реализации одна капля глазного состава вводится в глаз пациента, причем глазной состав содержит оксотреморин в количестве около 0,01%, 0,25%, 0,5%, 1%, 2% или 4% мас./мас.
[0062] В некоторых вариантах реализации дополнительный агент представляет собой метахолин или его фармацевтически приемлемую соль. В некоторых вариантах реализации дополнительный агент представляет собой метахолин. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,1 мг до около 1,0 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,1 мг до около 0,3 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве около 0,2 мг. В некоторых других вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,3 мг до около 0,6 мг.
[0063] В некоторых вариантах реализации одна капля глазного состава вводится в глаз пациента, причем глазной состав содержит метахолин в количестве от около 0,001% до около 0,1% мас./мас., от около 0,001% до около 2% мас./мас., от около 0,01% до около 2% мас./мас. или от около 0,01% до около 4% мас./мас. В некоторых вариантах реализации одна капля глазного состава вводится в глаз пациента, причем глазной состав содержит метахолин в количестве около 0,01%, 0,25%, 0,5%, 1%, 2% или 4% мас./мас.
[0064] В некоторых вариантах реализации дополнительный агент представляет собой мускарин или его фармацевтически приемлемую соль. В некоторых вариантах реализации дополнительный агент представляет собой мускарин. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,1 мг до около 1,0 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,1 мг до около 0,3 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве около 0,2 мг. В некоторых других вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,3 мг до около 0,6 мг.
[0065] В некоторых вариантах реализации одна капля глазного состава вводится в глаз пациента, причем глазной состав содержит мускарин в количестве от около 0,001% до около 0,1% мас./мас., от около 0,001% до около 2% мас./мас., от около 0,01% до около 2% мас./мас. или от около 0,01% до около 4% мас./мас. В некоторых вариантах реализации одна капля глазного состава вводится в глаз пациента, причем глазной состав содержит мускарин в количестве около 0,01%, 0,25%, 0,5%, 1%, 2% или 4% мас./мас.
[0066] В некоторых вариантах реализации дополнительный агент представляет собой альфа-2 адренергический агонист. В некоторых вариантах реализации дополнительный агент представляет собой бримонидин или его фармацевтически приемлемую соль. В некоторых вариантах реализации дополнительный агент представляет собой тартрат бримонидина. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,01 мг до около 4 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,01 мг до около 0,1 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве около 0,1 мг. В некоторых других вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,1 мг до около 1 мг.
[0067] В некоторых вариантах реализации одна капля глазного состава вводится в глаз пациента, причем глазной состав содержит тартрат бримонидина в количестве от около 0,01% до около 4% мас./мас., от около 0,02% до около 4% мас./мас., от около 0,02% до около 0,2% мас./мас., от около 0,2% до около 3% мас./мас. или от около 0,01% до около 2% мас./мас. В некоторых вариантах реализации одна капля глазного состава вводится в глаз пациента, причем глазной состав содержит тартрат бримонидина в количестве около 0,01%, 0,02%, 0,1%, 0,2%, 0,5%, 1%, 1,5%, 2%, 3% или 4% мас./мас.
[0068] В некоторых вариантах реализации дополнительный агент представляет собой карбамоилхолин или его фармацевтически приемлемую соль. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,01 мг до около 4 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,01 мг до около 0,1 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве около 0,1 мг. В некоторых других вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,1 мг до около 1 мг.
[0069] В некоторых вариантах реализации одна капля глазного состава вводится в глаз пациента, причем глазной состав содержит карбамоилхолин или его фармацевтически приемлемую соль в количестве от около 0,01% до около 4% мас./мас., от около 0,02% до около 4% мас./мас., от около 0,02% до около 0,2% мас./мас., от около 0,2% до около 3% мас./мас. или от около 0,01% до около 2% мас./мас. В некоторых вариантах реализации одна капля глазного состава вводится в глаз пациента, причем глазной состав содержит карбамоилхолин или его фармацевтически приемлемую соль в количестве около 0,01%, 0,02%, 0,1%, 0,2%, 0,5%, 1%, 1,5%, 2%, 3% или 4% мас./мас.
[0070] В некоторых вариантах реализации дополнительный агент представляет собой физостигмин или его фармацевтически приемлемую соль. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,01 мг до около 4 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,01 мг до около 0,1 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве около 0,1 мг. В некоторых других вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,1 мг до около 1 мг.
[0071] В некоторых вариантах реализации одна капля глазного состава вводится в глаз пациента, причем глазной состав содержит физостигмин или его фармацевтически приемлемую соль в количестве от около 0,01% до около 4% мас./мас., от около 0,02% до около 4% мас./мас., от около 0,02% до около 0,2% мас./мас., от около 0,2% до около 3% мас./мас. или от около 0,01% до около 2% мас./мас. В некоторых вариантах реализации одна капля глазного состава вводится в глаз пациента, причем глазной состав содержит физостигмин или его фармацевтически приемлемую соль в количестве около 0,01%, 0,02%, 0,1%, 0,2%, 0,5%, 1%, 1,5%, 2%, 3% или 4% мас./мас.
[0072] В некоторых вариантах реализации дополнительный агент представляет собой экотиофат или его фармацевтически приемлемую соль. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,01 мг до около 4 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,01 мг до около 0,1 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве около 0,1 мг. В некоторых других вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,1 мг до около 1 мг.
[0073] В некоторых вариантах реализации одна капля глазного состава вводится в глаз пациента, причем глазной состав содержит экотиофат или его фармацевтически приемлемую соль в количестве от около 0,01% до около 4% мас./мас., от около 0,02% до около 4% мас., от около 0,02% до около 0,2% мас./мас., от около 0,2% до около 3% мас./мас. или от около 0,01% до около 2% мас./мас. В некоторых вариантах реализации одна капля глазного состава вводится в глаз пациента, причем глазной состав содержит экотиофат или его фармацевтически приемлемую соль в количестве около 0,01%, 0,02%, 0,1%, 0,2%, 0,5%, 1%, 1,5%, 2%, 3% или 4% мас./мас.
[0074] В некоторых вариантах реализации дополнительный агент представляет собой ацетилхолин или его фармацевтически приемлемую соль. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,01 мг до около 4 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,01 мг до около 0,1 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве около 0,1 мг. В некоторых других вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,1 мг до около 1 мг.
[0075] В некоторых вариантах реализации одна капля глазного состава вводится в глаз пациента, причем глазной состав содержит ацетилхолин или его фармацевтически приемлемую соль в количестве от около 0,01% до около 4% мас./мас., от около 0,02% до около 4% мас., от около 0,02% до около 0,2% мас./мас., от около 0,2% до около 3% мас./мас. или от около 0,01% до около 2% мас./мас. В некоторых вариантах реализации одна капля глазного состава вводится в глаз пациента, причем глазной состав содержит ацетилхолин или его фармацевтически приемлемую соль в количестве около 0,01%, 0,02%, 0,1%, 0,2%, 0,5%, 1%, 1,5%, 2%, 3% или 4% мас./мас.
[0076] В некоторых вариантах реализации дополнительный агент представляет собой простагландин. В некоторых вариантах реализации дополнительный агент представляет собой динопростон или его фармацевтически приемлемую соль. В некоторых вариантах реализации дополнительный агент представляет собой динопростон. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,1 мг до около 4 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,1 мг до около 1 мг. В некоторых других вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 1 мг до около 3 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,001 мг до около 0,1 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,0025 мг до около 0,01 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве около 0,0025 мг. В некоторых вариантах реализации одна капля глазного состава вводится в глаз пациента, причем глазной состав содержит динопростон в количестве около 0,002%, 0,003%, 0,004%, 0,005%, 0,006%, 0,007% или 0,01% мас./мас.
[0077] В некоторых вариантах реализации дополнительный агент представляет собой латанапрост или его фармацевтически приемлемую соль. В некоторых вариантах реализации дополнительный агент представляет собой латанапрост. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,001 мг до около 0,1 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,0025 мг до около 0,01 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве около 0,0025 мг. В некоторых вариантах реализации одна капля глазного состава вводится в глаз пациента, причем глазной состав содержит латанапрост в количестве около 0,002%, 0,003%, 0,004%, 0,005%, 0,006%, 0,007% или 0,01% мас./мас. В некоторых вариантах реализации дополнительный агент представляет собой латанапрост, который вводят в глаз пациента в количестве от около 0,5 до около 1,0 мкг, от около 1,0 до около 1,5 мкг, от около 1,5 до около 2,0 мкг латанаопроста или от около 2,0 мкг до около 5,0 мкг латанаопроста.
[0078] В некоторых вариантах реализации дополнительный агент представляет собой биматопрост или его фармацевтически приемлемую соль. В некоторых вариантах реализации дополнительный агент представляет собой биматопрост. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,001 мг до около 0,1 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,001 мг до около 0,003 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве около 0,002 мг. В некоторых вариантах реализации одна капля глазного состава вводится в глаз пациента, причем глазной состав содержит биматопрост в количестве около 0,001%, 0,005%, 0,008%, 0,009, 0,01%, 0,02%, 0,03%, 0,04% или 0,05% мас./мас.
[0079] В некоторых вариантах реализации дополнительный агент представляет собой травопрост или его фармацевтически приемлемую соль. В некоторых вариантах реализации дополнительный агент представляет собой травопрост. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,001 мг до около 0,1 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,001 мг до около 0,01 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве около 0,005 мг. В некоторых вариантах реализации одна капля глазного состава вводится в глаз пациента, причем глазной состав содержит травопрост в количестве около 0,002%, 0,003%, 0,004%, 0,005%, 0,006%, 0,007% или 0,01% мас./мас.
[0080] В некоторых вариантах реализации дополнительный агент представляет собой EV06 или его фармацевтически приемлемую соль. В некоторых вариантах реализации дополнительный агент представляет собой хлорид EV06. В некоторых вариантах реализации дополнительный агент представляет собой тартрат EV06. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,25 мг до около 1,2 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,25 мг до около 0,5 мг. В некоторых других вариантах реализации дополнительный агент вводят в глаз пациента в количестве от около 0,5 мг до около 0,75 мг. В некоторых вариантах реализации дополнительный агент вводят в глаз пациента в количестве около 0,6 мг.
[0081] В некоторых вариантах реализации дополнительный агент представляет собой ингибитор холинэстеразы.
[0082] В некоторых вариантах реализации еще один терапевтический агент вводят в глаз пациента. В таких вариантах реализации способ дополнительно включает введение в глаз пациента альфа-адренергического агониста, такого как бримонидин или его фармацевтически приемлемую соль.
Д. Четвертый способ
[0083] Другой аспект изобретения обеспечивает способ лечения пресбиопии у пациента согласно режиму лечения монотерапией, включающему введение в глаз пациента, нуждающегося в этом, дозы одного терапевтического агента в количестве, эффективном для лечения пресбиопии, при этом единственным терапевтическим агентом является альфа-адренергический антагонист.
[0084] Способ может дополнительно характеризоваться дополнительными признаками, такими как режим дозирования и идентичность дозировки, как более подробно описано ниже. Изобретение охватывает все варианты и комбинации этих признаков.
[0085] Соответственно, в некоторых вариантах реализации дозу вводят пациенту перед сном или незадолго до него. В некоторых вариантах реализации дозу вводят в течение 1 часа перед сном. В некоторых вариантах реализации доза содержит фармацевтически приемлемую соль фентоламина. В некоторых вариантах реализации доза содержит мезилат фентоламина.
[0086] В некоторых вариантах реализации дозировка одного терапевтического агента составляет 1% мас./мас. раствора мезилата фентоламина. В некоторых вариантах реализации дозировка одного терапевтического агента составляет 1,5% мас./мас. раствора мезилата фентоламина. В некоторых вариантах реализации дозировка одного терапевтического агента составляет 2% мас./мас. раствора мезилата фентоламина.
[0087] В некоторых вариантах реализации дозу вводят в виде одной глазной капли. В некоторых вариантах реализации дозу вводят в виде двух глазных капель.
Е. Пятый способ
[0088] Другой аспект изобретения относится к способу лечения мидриаза у пациента, включающему введение в глаз пациента, нуждающегося в этом, дозы альфа-адренергического антагониста в количестве, эффективном для лечения мидриаза.
[0089] Способ может дополнительно характеризоваться дополнительными признаками, такими как причина мидриаза и степень уменьшения диаметра зрачка, которую испытывает пациент. Изобретение охватывает все варианты и комбинации этих признаков.
[0090] Соответственно, в некоторых вариантах реализации мидриаз возникает из-за того, что пациент получил агент, вызывающий расширение зрачка. В некоторых вариантах реализации изобретения мидриаз обусловлен тем, что пациент получил один или несколько адренергических или парасимпатолитических агентов. В некоторых вариантах реализации мидриаз обусловлен тем, что пациент получил один или несколько из альфа-агонистов, агонистов TAAR1 или NSAID. В некоторых вариантах реализации мидриаз обусловлен тем, что пациент получил один или несколько из атропина, циклопентолата, гоматропина, скополамина, тропикамида, флубипрофена, супрофена, гидроксиамфетамина, фенилэфрина, циклопентолата, кеторолака или их фармацевтически приемлемые соли. В некоторых вариантах реализации мидриаз обусловлен тем, что пациент получил один или несколько из атропина, циклопентолата, гоматропина, скополамина, тропикамида, фенилэфрина или их фармацевтически приемлемые соли. В некоторых вариантах реализации мидриаз обусловлен тем, что пациент получил один или несколько из атропина, циклопентолата, гоматропина, скополамина, тропикамида или их фармацевтически приемлемые соли. В некоторых вариантах реализации мидриаз обусловлен тем, что пациент получил атропин, гоматропин, скополамин или их фармацевтически приемлемые соли. В некоторых вариантах реализации мидриаз обусловлен тем, что пациент получил циклопентолат или его фармацевтически приемлемую соль. В некоторых вариантах реализации мидриаз обусловлен тем, что пациент получил тропикамид или его фармацевтически приемлемую соль. В некоторых вариантах реализации мидриаз обусловлен тем, что пациент получил фенилэфрин или его фармацевтически приемлемую соль.
[0091] В некоторых вариантах реализации мидриаз обусловлен тем, что пациент получил флубипрофен или его фармацевтически приемлемую соль. В некоторых вариантах реализации мидриаз обусловлен тем, что пациент получил натрий-флубипрофен. В некоторых вариантах реализации мидриаз обусловлен тем, что пациент получил супрофен или его фармацевтически приемлемую соль. В некоторых вариантах реализации мидриаз обусловлен тем, что пациент получил гидроксиамфетамин или его фармацевтически приемлемую соль. В некоторых вариантах реализации мидриаз обусловлен тем, что пациент получил тропикамид или его фармацевтически приемлемую соль. В некоторых вариантах реализации мидриаз обусловлен тем, что пациент получил циклопентолат или его фармацевтически приемлемую соль. В некоторых вариантах реализации мидриаз обусловлен тем, что пациент получил кеторолак или его фармацевтически приемлемую соль. В некоторых вариантах реализации мидриаз обусловлен тем, что пациент получил гидробромид гидроксиамфетамина и тропикамид, которые продаются как PAREMYD®. В некоторых вариантах реализации мидриаз обусловлен тем, что пациент получил гидрохлорид циклопентолата и гидрохлорид фенилэфрина, которые продаются как CYCLOMYDRIL®. В некоторых вариантах реализации мидриаз обусловлен тем, что пациент получил скополамин и фенилэфрин. В некоторых вариантах реализации мидриаз обусловлен тем, что пациент получил кеторолак и фенилэфрин, которые продаются как OMIDRIA®.
[0092] Способ можно дополнительно охарактеризовать в соответствии с режимом дозирования. Например, в некоторых вариантах реализации дозу вводят в глаз не чаще, чем один раз в день. В некоторых вариантах реализации дозу вводят в глаз не чаще одного раза в два дня. В некоторых вариантах реализации дозу вводят в глаз пациента после того, как пациент завершил обследование глаза, при котором в глаз пациента вводили агент, расширяющий зрачок.
[0093] Способ можно дополнительно охарактеризовать по степени уменьшения диаметра зрачка. Например, в некоторых вариантах реализации у пациента наблюдается уменьшение диаметра зрачка по меньшей мере на 1 мм при измерении в мезопических условиях относительно диаметра зрачка пациента в тех же мезопических условиях, но без получения указанной дозы. В некоторых вариантах реализации у пациента наблюдается уменьшение диаметра зрачка по меньшей мере на 2 мм при измерении в мезопических условиях относительно диаметра зрачка пациента в тех же мезопических условиях, но без получения указанной дозы. В некоторых вариантах реализации у пациента наблюдается уменьшение диаметра зрачка по меньшей мере на 3 мм при измерении в мезопических условиях относительно диаметра зрачка пациента в тех же мезопических условиях, но без получения указанной дозы. В некоторых вариантах реализации у пациента наблюдается уменьшение диаметра зрачка по меньшей мере на 4 мм, 5 мм или более при измерении в мезопических условиях относительно диаметра зрачка пациента в тех же мезопических условиях, но без получения указанной дозы. В некоторых других вариантах реализации у пациента наблюдается уменьшение диаметра зрачка в диапазоне от около 0,5 мм до около 5 мм при измерении в мезопических условиях относительно диаметра зрачка пациента в тех же мезопических условиях, но без получения указанной дозы.
[0094] В некоторых вариантах реализации у пациента наблюдается уменьшение диаметра зрачка по меньшей мере на 1 мм при измерении в фотопических условиях относительно диаметра зрачка пациента в тех же фотопических условиях, но без получения указанной дозы. В некоторых вариантах реализации у пациента наблюдается уменьшение диаметра зрачка по меньшей мере на 2 мм при измерении в фотопических условиях по сравнению с диаметром зрачка пациента в тех же фотопических условиях, но без получения указанной дозы. В некоторых вариантах реализации у пациента наблюдается уменьшение диаметра зрачка по меньшей мере на 3 мм при измерении в фотопических условиях относительно диаметра зрачка пациента в тех же фотопических условиях, но без получения указанной дозы. В некоторых вариантах реализации у пациента наблюдается уменьшение диаметра зрачка, по меньшей мере, на 4 мм, 5 мм или более при измерении в фотопических условиях относительно диаметра зрачка пациента в тех же фотопических условиях, но без получения указанной дозы. В некоторых других вариантах реализации у пациента наблюдается уменьшение диаметра зрачка в диапазоне от около 0,5 мм до около 5 мм при измерении в фотопических условиях относительно диаметра зрачка пациента в тех же фотопических условиях, но без получения указанной дозы.
[0095] В некоторых вариантах реализации у пациента наблюдается уменьшение диаметра зрачка по меньшей мере на 1 мм по сравнению с диаметром зрачка пациента, измеренным в тех же условиях (например, мезопических или фотопических), но без получения указанной дозы. В некоторых вариантах реализации у пациента наблюдается уменьшение диаметра зрачка по меньшей мере на 2 мм по сравнению с диаметром зрачка пациента, измеренного в тех же условиях (например, мезопических или фотопических), но без получения указанной дозы. В некоторых вариантах реализации у пациента наблюдается уменьшение диаметра зрачка по меньшей мере на 3 мм по сравнению с диаметром зрачка пациента, измеренным в тех же условиях (например, мезопических или фотопических), но без получения указанной дозы. В некоторых вариантах реализации у пациента наблюдается уменьшение диаметра зрачка по меньшей мере на 4 мм, 5 мм или более по сравнению с диаметром зрачка пациента, измеренным в тех же условиях (например, мезопических или фотопических), но без получения указанной дозы. В некоторых вариантах реализации у пациента наблюдается уменьшение диаметра зрачка по меньшей мере на 4 мм, 5 мм или более по сравнению с диаметром зрачка пациента, измеренным в тех же условиях (например, мезопических или фотопических), но без получения указанной дозы. В некоторых других вариантах реализации у пациента наблюдается уменьшение диаметра зрачка в диапазоне от около 0,5 мм до около 5 мм по сравнению с диаметром зрачка пациента в тех же условиях (например, мезопических или фотопических), но без получения указанной дозы.
Ж. Шестой способ
[0096] Другой аспект изобретения обеспечивает способ предотвращения прогрессирующей миопии у пациента, включающий введение в глаз пациента, нуждающегося в этом, дозы альфа-адренергического антагониста в количестве, эффективном для предотвращения прогрессирующей миопии.
[0097] Способ может быть дополнительно охарактеризован дополнительными признаками. Например, в некоторых вариантах реализации пациентом является взрослый человек. В некоторых других вариантах реализации пациентом является педиатрический человек. В некоторых вариантах реализации способ дополнительно включает введение в глаз пациента одного или нескольких дополнительных агентов, описанных в данном документе. Изобретение охватывает все варианты и комбинации этих признаков.
З. Дополнительные признаки Первого, Второго, Третьего и Четвертого терапевтических способов
[0098] Дополнительные признаки, которые могут охарактеризовать Первый, Второй, Третий и Четвертый терапевтические способы, описанные в данном документе (например, способы, описанные в Частях A-Г выше), представлены ниже и включают, например, степень покраснения глаз, режим дозирования альфа-адренергического антагониста, продолжительность терапевтического эффекта против пресбиопии и диаметр зрачка глаза, получившего дозу. Ниже приводится более подробное описание таких признаков. Изобретение охватывает все варианты и комбинации этих признаков.
Степень покраснения глаз
[0099] Способы можно дополнительно охарактеризовать в зависимости от степени покраснения глаз, которое испытывает пациент. Степень покраснения глаз можно оценить и охарактеризовать с помощью процедур, описанных в литературе, такой как шкала оценки покраснения Cornea and Contact Lens Research Unit (CCLRU) (Блок исследования роговицы и контактных линз) разработанной School of Optometry, University of New South Wales. См., например, Terry et al. в Optom Vis. Sci. (1993) vol. 70, pages 234-243; и Pult et al. in Ophthal. Physiol. Opt. (2008) vol. 28, pages 13-20. Шкала оценки покраснения CCLRU оценивает покраснение глаз по четырехбалльной шкале: (0) отсутствие покраснения глаз, (1) очень легкое покраснение глаз, (2) легкое покраснение глаз, (3) умеренное покраснение глаз и (4) сильное покраснение глаз. См. Фиг. 1 для иллюстрации шкалы покраснения глаз.
[00100] В некоторых вариантах реализации у пациента наблюдается усиление покраснения глаз не более чем на два балла, измеренных с использованием шкалы оценки покраснения CCLRU в часы бодрствования, по сравнению с уровнем покраснения глаз пациента без приема указанной дозы альфа-адренергического антагониста. В некоторых вариантах реализации у пациента наблюдается усиление покраснения глаз не более чем на один балл, измеренный с использованием шкалы оценки покраснения CCLRU в часы бодрствования, по сравнению с уровнем покраснения глаз пациента без приема указанной дозы альфа-адренергического антагониста. В некоторых вариантах реализации любое усиление покраснения глаз, испытываемое пациентом, составляет менее одного балла, измеренного с использованием шкалы оценки покраснения CCLRU в часы бодрствования пациента, по сравнению с уровнем покраснения глаз пациента без приема указанной дозы альфа-адренергического антагониста.
Режим дозирования альфа-адренергического антагониста
[00101] Способы можно дополнительно охарактеризовать в соответствии с режимом дозирования альфа-адренергического антагониста. Например, в некоторых вариантах реализации дозу альфа-адренергического антагониста вводят ежедневно.
[00102] В некоторых вариантах реализации дозу альфа-адренергического антагониста вводят по меньшей мере в течение трех дней подряд. В некоторых вариантах реализации дозу альфа-адренергического антагониста вводят по меньшей мере в течение семи дней подряд. В некоторых вариантах реализации дозу альфа-адренергического антагониста вводят в течение по меньшей мере четырнадцати дней подряд.
[00103] В некоторых вариантах реализации дозу вводят один раз в день. В некоторых вариантах реализации дозу вводят несколько раз в день, например, два или три раза в день.
[00104] В некоторых вариантах реализации дозу вводят в виде одной глазной капли. В некоторых вариантах реализации дозу вводят в виде двух глазных капель.
Продолжительность терапевтического эффекта против пресбиопии
[00105] Способы можно дополнительно охарактеризовать в зависимости от продолжительности терапевтического эффекта против пресбиопии. Например, в некоторых вариантах реализации способ обеспечивает терапевтический эффект против пресбиопии продолжительностью не менее 6 часов. В определенных вариантах реализации способ обеспечивает терапевтический эффект против пресбиопии продолжительностью не менее 12 часов. В определенных вариантах реализации способ обеспечивает терапевтический эффект против пресбиопии продолжительностью не менее 16 часов. В определенных вариантах реализации способ обеспечивает терапевтический эффект против пресбиопии продолжительностью не менее 18 часов. В определенных вариантах реализации способ обеспечивает терапевтический эффект против пресбиопии продолжительностью не менее 20 часов. В определенных вариантах реализации способ обеспечивает терапевтический эффект против пресбиопии продолжительностью не менее 24 часов. В определенных вариантах реализации способ обеспечивает терапевтический эффект против пресбиопии продолжительностью не менее 36 часов. В определенных вариантах реализации способ обеспечивает терапевтический эффект против пресбиопии продолжительностью не менее 48 часов.
Улучшение зрительных характеристик пациента
[00106] Способы могут быть дополнительно охарактеризованы в соответствии с улучшением зрительных характеристик пациента. Например, в некоторых вариантах реализации способ обеспечивает улучшение остроты зрения, характеризующееся улучшением зрения пациента по меньшей мере на одну строку, измеренного при помощи таблицы зрения. В некоторых вариантах реализации способ приводит к повышению остроты зрения, характеризующемуся улучшением зрения пациента по меньшей мере на две строки, измеренного с использованием таблицы зрения. В некоторых вариантах реализации способ приводит к повышению остроты зрения, характеризующемуся улучшением зрения пациента по меньшей мере на три строки, измеренного с использованием таблицы зрения. В некоторых вариантах реализации способ приводит к повышению остроты зрения, характеризующемуся улучшением зрения пациента на четыре или более строк, измеренного с использованием таблицы зрения. В некоторых вариантах реализации таблица зрения представляет собой таблицу Снеллена. В некоторых других вариантах реализации таблица зрения представляет собой таблицу Джегера. В некоторых других вариантах реализации таблица зрения представляет собой таблицу Розенбаума или диаграмму ETDRS. В некоторых вариантах реализации улучшение остроты зрения измеряется на близком расстоянии (например, около 1, 2 или 3 фута). В некоторых вариантах реализации улучшение остроты зрения измеряется на большом расстоянии (например, около 20, 25 или 30 футов). В некоторых вариантах реализации улучшение остроты зрения представляет собой улучшение остроты зрения вблизи. В некоторых вариантах реализации улучшение остроты зрения представляет собой улучшение остроты зрения вдаль. В некоторых вариантах реализации улучшение остроты зрения представляет собой (i) улучшение остроты зрения вблизи и (ii) улучшение остроты зрения вдаль.
[00107] Способ может быть дополнительно охарактеризован в зависимости от продолжительности улучшения зрения пациента. В некоторых вариантах реализации пациент испытывает указанное улучшение в течение по меньшей мере 6 часов. В некоторых вариантах реализации пациент испытывает указанное улучшение в течение по меньшей мере 12 часов. В некоторых вариантах реализации пациент испытывает указанное улучшение в течение по меньшей мере 18 часов. В некоторых вариантах реализации пациент испытывает указанное улучшение в течение по меньшей мере 20 часов. В некоторых вариантах реализации пациент испытывает указанное улучшение в течение по меньшей мере 24 часов. В некоторых вариантах реализации пациент испытывает указанное улучшение в течение по меньшей мере 30 часов. В некоторых вариантах реализации пациент испытывает указанное улучшение в течение по меньшей мере 48 часов.
Диаметр зрачка глаза, получившего дозу
[00108] Способы могут быть дополнительно охарактеризованы в соответствии с диаметром зрачка глаза, который получил дозу, и продолжительностью, в течение которой сохраняется указанный диаметр зрачка. Например, в некоторых вариантах реализации в результате введения пациент испытывает эффект диаметра зрачка менее 3,0, глаза, который получал указанную дозу, при измерении в фотопических условиях. В некоторых вариантах реализации в результате введения пациент испытывает эффект диаметра зрачка менее 2,8, в глазе, который получал указанную дозу, при измерении в фотопических условиях. В некоторых вариантах реализации в результате введения пациент испытывает эффект диаметра зрачка менее 2,6 мм, в глазе, который получал указанную дозу, при измерении в фотопических условиях. В некоторых вариантах реализации в результате введения пациент испытывает эффект диаметра зрачка менее 2,4 мм, в глазе, который получал указанную дозу, при измерении в фотопических условиях. В некоторых вариантах реализации в результате введения пациент испытывает эффект диаметра зрачка менее 2,2 мм, в глазе, который получал указанную дозу, при измерении в фотопических условиях. В некоторых вариантах реализации в результате введения пациент испытывает эффект диаметра зрачка менее 2 мм, в глазе, который получал указанную дозу, при измерении в фотопических условиях. В некоторых вариантах реализации в результате введения пациент испытывает эффект диаметра зрачка менее 1,9 мм, в глазе, который получал указанную дозу, при измерении в фотопических условиях. В некоторых вариантах реализации в результате введения пациент испытывает эффект диаметра зрачка менее 1,8 мм, в глазе, который получал указанную дозу, при измерении в фотопических условиях. В некоторых вариантах реализации в результате введения пациент испытывает эффект диаметра зрачка менее 1,7 мм, в глазе, который получал указанную дозу, при измерении в фотопических условиях. В некоторых вариантах реализации в результате введения пациент испытывает эффект диаметра зрачка менее 1,6 мм, в глазе, который получал указанную дозу, при измерении в фотопических условиях.
[00109] В некоторых вариантах реализации пациент испытывает указанный эффект в течение по меньшей мере 6 часов. В некоторых вариантах реализации пациент испытывает указанный эффект в течение по меньшей мере 12 часов. В некоторых вариантах реализации пациент испытывает указанный эффект в течение по меньшей мере 18 часов. В некоторых вариантах реализации пациент испытывает указанный эффект в течение по меньшей мере 20 часов. В некоторых вариантах реализации пациент испытывает указанный эффект в течение по меньшей мере 24 часов. В некоторых вариантах реализации пациент испытывает указанный эффект в течение по меньшей мере 30 часов. В некоторых вариантах реализации пациент испытывает указанный эффект в течение по меньшей мере 48 часов.
Снижение внутриглазного давления
[00110] Еще одно преимущество, которое могут испытывать пациенты, представляет собой снижение внутриглазного давления в глазу, который получает альфа-адренергический антагонист.
I. Общие положения о терапевтических способах
[00111] Общие положения, которые могут быть применены к терапевтическим способам, описанным в данном документе (например, способы, описанные в частях A-З выше), представлены ниже и включают, например, идентичность альфа-адренергического антагониста, дозировку альфа-адренергического антагониста, состав дозировки и группы пациентов, которые могут получить особую пользу от терапевтических способов. Ниже приводится более подробное описание таких признаков. Изобретение охватывает все варианты и комбинации этих признаков.
Идентичность альфа-адренергического антагониста
[00112] Способы могут быть дополнительно охарактеризованы в соответствии с идентичностью альфа-адренергического антагониста. Например, в некоторых вариантах реализации альфа-адренергический антагонист представляет собой фентоламин, феноксибензамин, толазолин, тразодон, альфузозин, доксазозин, празозин, тамсулозин, теразозин, силодозин, атипамезол, идазоксан, миртазапин, йохимбин, фенолдопам, тимоксамин или фармацевтически приемлемую соль любого из вышеперечисленных. В некоторых вариантах реализации альфа-адренергический антагонист представляет собой фентоламин или его фармацевтически приемлемую соль. В некоторых вариантах реализации альфа-адренергический антагонист представляет собой фармацевтически приемлемую соль фентоламина. В некоторых вариантах реализации альфа-адренергический антагонист представляет собой мезилат фентоламина. В некоторых других вариантах реализации альфа-адренергический антагонист представляет собой фенолдопам или его фармацевтически приемлемую соль. В некоторых вариантах реализации альфа-адренергический антагонист представляет собой мезилат фенолдопама.
[00113] В некоторых вариантах реализации альфа-адренергический антагонист представляет собой неселективный альфа-адренергический антагонист. В некоторых вариантах реализации альфа-адренергический антагонист представляет собой обратимый неселективный альфа-адренергический антагонист.
[00114] В некоторых вариантах реализации альфа-адренергический антагонист характеризуется в соответствии с его активностью по отношению к определенным альфа-адренергическим рецепторам. Соответственно, в некоторых вариантах реализации альфа-адренергический антагонист имеет антагонистическую активность в отношении альфа-1 адренергического рецептора. Активность по отношению к альфа-1 адренергическому рецептору может быть дополнительно охарактеризована в соответствии с тем, есть ли активность в отношении одного или нескольких подтипов альфа-1 адренергического рецептора (например, альфа-1A, альфа-1B и альфа-1D). Соответственно, в некоторых вариантах реализации альфа-адренергический антагонист имеет антагонистическую активность в отношении альфа-1А адренергического рецептора. В некоторых вариантах реализации альфа-адренергический антагонист имеет антагонистическую активность в отношении альфа-1B адренергического рецептора. В некоторых вариантах реализации альфа-адренергический антагонист имеет антагонистическую активность в отношении альфа-1D адренергического рецептора. В некоторых вариантах реализации альфа-адренергический антагонист имеет антагонистическую активность в отношении к каждому из подтипов альфа-1 адренергического рецептора.
[00115] В некоторых вариантах реализации альфа-адренергический антагонист имеет антагонистическую активность в отношении альфа-2 адренергического рецептора. Активность в отношении альфа-2 адренергического рецептора может быть дополнительно охарактеризована в соответствии с тем, есть ли активность в отношении одного или нескольких подтипов альфа-2-адренергического рецептора (например, альфа-2A, альфа-2B и альфа-2C). Соответственно, в некоторых вариантах реализации альфа-адренергический антагонист имеет антагонистическую активность в отношении альфа-2А адренергического рецептора. В некоторых вариантах реализации альфа-адренергический антагонист имеет антагонистическую активность в отношении альфа-2B адренергического рецептора. В некоторых вариантах реализации альфа-адренергический антагонист имеет антагонистическую активность в отношении альфа-2С адренергического рецептора. В некоторых вариантах реализации альфа-адренергический антагонист имеет антагонистическую активность в отношении каждого из подтипов альфа-2 адренергического рецептора.
[00116] Альфа-адренергический антагонист может быть охарактеризован в соответствии с его активностью в отношении (i) альфа-1 адренергического рецептора по сравнению с (ii) альфа-2 адренергическим рецептором. В некоторых вариантах реализации альфа-адренергический антагонист имеет антагонистическую активность как в отношении (i) альфа-1 адренергического рецептора, так и (ii) альфа-2 адренергического рецептора. В некоторых вариантах реализации альфа-адренергический антагонист имеет антагонистическую активность в отношении (i) альфа-1 адренергического рецептора, но не (ii) альфа-2 адренергического рецептора. В некоторых вариантах реализации альфа-адренергический антагонист имеет антагонистическую активность в отношении (i) альфа-2 адренергического рецептора, но не (ii) альфа-1 адренергического рецептора. В некоторых вариантах реализации ингибирующая активность (например, измеренная по значению IC50) альфа-адренергического антагониста по меньшей мере в 10 раз выше в отношении (i) альфа-1 адренергического рецептора по сравнению с (ii) альфа-2 адренергическим рецептором. В некоторых вариантах реализации ингибирующая активность (например, измеренная по значению IC50) альфа-адренергического антагониста по меньшей мере в 10 раз выше в отношении (i) альфа-2 адренергического рецептора по сравнению с (ii) альфа-1 адренергическим рецептором.
Дозировка альфа-адренергического антагониста
[00117] Способы можно дополнительно охарактеризовать в соответствии с дозировкой альфа-адренергического антагониста. Например, в некоторых вариантах реализации доза альфа-адренергического антагониста составляет менее около 2 мг. В некоторых вариантах реализации дозировка альфа-адренергического антагониста составляет менее около 1,5 мг. В некоторых вариантах реализации дозировка альфа-адренергического антагониста составляет менее около 1 мг. В некоторых вариантах реализации дозировка альфа-адренергического антагониста составляет менее около 0,5 мг.
Дозировка фентоламина или его фармацевтически приемлемой соли
[00118] Когда альфа-адренергический антагонист представляет собой фентоламин или его фармацевтически приемлемую соль, способы могут быть дополнительно охарактеризованы в соответствии с количеством фентоламина или его фармацевтически приемлемой соли в дозе. Например, в некоторых вариантах реализации доза содержит от около 0,1 мг до около 2,0 мг фентоламина или его фармацевтически приемлемой соли. В некоторых вариантах реализации доза содержит от около 0,5 мг до около 1,0 мг фентоламина или его фармацевтически приемлемой соли.
[00119] В некоторых других вариантах реализации доза содержит от около 0,1 мг до около 2,0 мг мезилата фентоламина. В некоторых вариантах реализации доза содержит от около 0,2 мг до около 0,7 мг мезилата фентоламина. В некоторых вариантах реализации доза содержит около 0,25 мг мезилата фентоламина. В некоторых других вариантах реализации доза содержит от около 0,4 мг до около 0,6 мг мезилата фентоламина. В некоторых вариантах реализации доза содержит около 0,5 мг мезилата фентоламина. В некоторых других вариантах реализации доза содержит от около 0,8 мг до около 1,2 мг мезилата фентоламина. В некоторых вариантах реализации доза содержит около 1 мг мезилата фентоламина.
[00120] Дозу фентоламина или его фармацевтически приемлемой соли желательно вводить в глаз пациента в форме офтальмологического раствора, который доставляется в глаз в форме глазных капель. В определенных вариантах реализации доза вводится в виде одной глазной капли. Стандартные глазные капли обычно содержат от около 0,03 мл до около 0,05 мл раствора. Предпочтительно, чтобы глазные капли содержали около 0,05 мл раствора.
[00121] В некоторых вариантах реализации доза может быть в форме офтальмологического раствора. Например, в некоторых вариантах реализации доза представляет собой офтальмологический раствор, содержащий водный фармацевтически приемлемый носитель и фентоламин или его фармацевтически приемлемую соль. В некоторых вариантах реализации доза представляет собой офтальмологический раствор, содержащий воду, полиол и фентоламин или его фармацевтически приемлемую соль. В некоторых вариантах реализации доза представляет собой офтальмологический раствор, содержащий воду, полиол, карбоксилат щелочного металла и фентоламин или его фармацевтически приемлемую соль.
[00122] В некоторых других вариантах реализации доза представляет собой офтальмологический раствор, содержащий водный фармацевтически приемлемый носитель и мезилат фентоламина. В некоторых вариантах реализации доза представляет собой офтальмологический раствор, содержащий воду, маннит и мезилат фентоламина. В некоторых вариантах реализации доза представляет собой офтальмологический раствор, содержащий воду, маннит, ацетат натрия и мезилат фентоламина.
[00123] В некоторых других вариантах реализации доза представляет собой водный офтальмологический раствор, свободный от хелатирующего агента, содержащий:
(a) от около 0,1% (мас./об.) до около 2% (мас./об.) мезилата фентоламина;
(б) от около 1% (мас./об.) до около 6% (мас./об.) по меньшей мере одного полиольного соединения, выбранного из группы, состоящей из маннита, глицерина и пропиленгликоля;
(в) от около 1 мМ до около 6 мМ ацетата щелочного металла; и
(г) воду;
причем раствор имеет pH в диапазоне от 4 до 6 и свободен от хелатирующего агента.
[00124] В некоторых вариантах реализации доза представляет собой водный офтальмологический раствор, свободный от хелатирующего агента, содержащий:
(a) от около 0,5% (мас./об.) до около 2% (мас./об.) мезилата фентоламина;
(б) от около 1% (мас./об.) до около 6% (мас./об.) по меньшей мере одного полиольного соединения, выбранного из группы, состоящей из маннита, глицерина и пропиленгликоля;
(в) от около 1 мМ до около 6 мМ ацетата щелочного металла; и
(г) воду;
причем раствор имеет pH в диапазоне от 4,5 до 5,5 и свободен от хелатирующего агента.
[00125] В некоторых вариантах реализации по меньшей мере один полиол представляет собой маннит. В некоторых вариантах реализации раствор содержит 4% (мас./об.) маннита. В некоторых вариантах реализации ацетат щелочного металла представляет собой ацетат натрия. В некоторых вариантах реализации раствор содержит 3 мМ ацетата натрия.
[00126] В некоторых вариантах реализации доза представляет собой водный офтальмологический раствор, свободный от хелатирующего агента, содержащий:
(a) от около 0,25% (мас./об.) до около 2% (мас./об.) мезилата фентоламина;
(б) от около 3% (мас./об.) до около 5% (мас./об.) маннита;
(в) от около 2 мМ до около 4 мМ ацетата натрия; и
(г) воду;
причем раствор имеет pH в диапазоне от 4,5 до 5,2 и свободен от хелатирующего агента.
[00127] В некоторых вариантах реализации доза представляет собой водный офтальмологический раствор, свободный от хелатирующего агента, содержащий:
(a) от около 0,5% (мас./об.) до около 2% (мас./об.) мезилата фентоламина;
(б) от около 3% (мас./об.) до около 5% (мас./об.) маннита;
(в) от около 2 мМ до около 4 мМ ацетата натрия; и
(г) воду;
причем раствор имеет pH в диапазоне от 4,6 до 5,2 и свободен от хелатирующего агента.
[00128] В некоторых вариантах реализации доза представляет собой водный офтальмологический раствор, свободный от хелатирующего агента, содержащий:
(a) от около 0,5% (мас./об.) до около 1% (мас./об.) мезилата фентоламина;
(б) около 4% маннита;
(в) около 3 мМ ацетата натрия; и
(г) воду;
причем раствор имеет pH в диапазоне от 4,6 до 5,2 и свободен от хелатирующего агента.
[00129] В некоторых вариантах реализации доза представляет собой водный офтальмологический раствор, содержащий:
(a) от около 0,25% (мас./об.) до около 2% (мас./об.) мезилата фентоламина;
(б) от около 3% (мас./об.) до около 5% (мас./об.) маннита;
(в) от около 1 мМ до около 6 мМ ацетата натрия; и
(г) воду;
причем раствор имеет pH в диапазоне от 4,5 до 5,2 и свободен от какого-либо дополнительного компонента, который представляет собой хелатирующий агент.
[00130] В некоторых вариантах реализации доза представляет собой водный офтальмологический раствор, содержащий:
(a) около 1% (мас./об.) мезилата фентоламина;
(б) от около 3% (мас./об.) до около 5% (мас./об.) маннита;
(в) от около 2 мМ до около 4 мМ буфера, содержащего ацетат натрия; и
(г) воду;
причем раствор имеет pH в диапазоне от 4,5 до 5,2 и свободен от какого-либо дополнительного компонента, который представляет собой хелатирующий агент.
[00131] В некоторых вариантах реализации доза представляет собой водный офтальмологический раствор, содержащий:
(a) от около 0,25% (мас./об.) до около 2% (мас./об.) мезилата фентоламина;
(б) от около 3% (мас./об.) до около 5% (мас./об.) маннита;
(в) от около 2 мМ до около 4 мМ ацетата натрия; и
(г) воду;
причем раствор имеет pH в диапазоне от 4,5 до 5,2 и свободен от какого-либо дополнительного компонента, который представляет собой хелатирующий агент.
[00132] В некоторых вариантах реализации доза представляет собой водный офтальмологический раствор, содержащий:
(a) от около 0,5% (мас./об.) до около 2% (мас./об.) мезилата фентоламина;
(б) от около 3% (мас./об.) до около 5% (мас./об.) маннита;
(в) от около 2 мМ до около 4 мМ буфера, содержащего ацетат натрия; и
(г) воду;
причем раствор имеет pH в диапазоне от 4,6 до 5,2 и свободен от какого-либо дополнительного компонента, который представляет собой хелатирующий агент.
[00133] В некоторых вариантах реализации доза представляет собой водный офтальмологический раствор, содержащий:
(a) от около 0,5% (мас./об.) до около 1% (мас./об.) мезилата фентоламина;
(б) около 4% маннита;
(в) около 3 мМ буфера, содержащего ацетат натрия; и
(г) воду;
причем раствор имеет pH в диапазоне от 4,6 до 5,2 и свободен от какого-либо дополнительного компонента, который представляет собой хелатирующий агент.
[00134] В некоторых вариантах реализации доза представляет собой водный офтальмологический раствор, содержащий: (а) около 1% (мас./об.) мезилата фентоламина; (б) около 4% (мас./об.) маннита; (в) около 3 мМ буфера, содержащего ацетат натрия; и (г) воду; причем раствор имеет pH в диапазоне от 4,5 до 5,5 и свободен от какого-либо дополнительного компонента, который представляет собой хелатирующий агент.
[00135] В некоторых вариантах реализации доза представляет собой водный офтальмологический раствор, свободный от хелатирующего агента, содержащий: (а) около 1% (мас./об.) мезилата фентоламина; (б) около 4% (мас./об.) маннита; (в) около 3 мМ буфера, содержащего ацетат натрия; и (г) воду; причем раствор имеет pH в диапазоне от 4,0 до 7,5 и свободен от хелатирующего агента.
Рекомендации по дозированию при комбинированной терапии
[00136] В вариантах реализации, где вводят более одного терапевтического агента, количество каждого терапевтического агента и относительное время введения каждого терапевтического агента могут быть выбраны для достижения желаемого комбинированного терапевтического эффекта. Например, при назначении комбинированной терапии пациенту, нуждающемуся в таком введении, терапевтические агенты в комбинации или фармацевтическая композиция или композиции, содержащие терапевтические агенты, могут вводиться в любом порядке, таком как, например, последовательно, параллельно, вместе, одновременно и тому подобное.
[00137] В некоторых вариантах реализации терапевтические агенты могут действовать аддитивно или синергетически. Синергетическая комбинация может позволить использовать более низкие дозировки одного или нескольких агентов и/или менее частое введение одного или нескольких агентов комбинированной терапии. Более низкая дозировка или менее частое введение одного или нескольких агентов могут снизить токсичность терапии без снижения эффективности терапии.
Группы пациентов, которым терапевтические способы могут принести особую пользу
[00138] Способы могут быть дополнительно охарактеризованы в соответствии с группами пациентов, которые могут получить особую пользу от терапевтических способов. Например, в некоторых вариантах реализации пациент является человеком. В некоторых вариантах реализации пациент является взрослым человеком. В некоторых вариантах реализации пациент является гериатрическим человеком. В некоторых вариантах реализации пациент является педиатрическим человеком.
Время введения
[00139] Различные способы, описанные выше, требуют введения дозы пациенту перед сном или незадолго до него. Соответственно, в некоторых вариантах реализации дозу вводят в течение 2 часов, 1,5 часов, 1 часа, 45 минут, 30 минут или 15 минут перед сном пациента. В некоторых вариантах реализации дозу вводят в течение 1 часа перед сном.
Введение агента, уменьшающего покраснение глаз
[00140] Способы могут быть дополнительно охарактеризованы тем, вводится ли агент, уменьшающий покраснение глаз, в глаз пациента. В некоторых вариантах реализации способ дополнительно включает введение в глаз пациента эффективного количества агента, уменьшающего покраснение глаз. Примеры агентов, уменьшающих покраснение глаз, включают бримонидин, тетрагидрозолин, оксиметазолин, нафтазолин или его фармацевтически приемлемую соль. Ожидается, что эти агенты не изменят диаметр зрачка. В некоторых вариантах реализации агент, уменьшающий покраснение глаз, представляет собой бримонидин или его фармацевтически приемлемую соль (например, тартрат бримонидина). Тартрат бримонидина продается как LUMIFY® (который представляет собой офтальмологический раствор, содержащий тартрат бримонидина (0,025% мас./мас.)). В некоторых вариантах реализации агент, уменьшающий покраснение глаз, представляет собой оксиметазолин или его фармацевтически приемлемую соль. Офтальмологический раствор, содержащий оксиметазолин, коммерчески доступен как VISINE L.R.®. В некоторых вариантах реализации агент, уменьшающий покраснение глаз, представляет собой нафтазолин или его фармацевтически приемлемую соль, такую как гидрохлорид нафтазолина, который продается как CLEAR EYES®.
Улучшение зрительных характеристик
[00141] Одним из преимуществ терапевтических способов является то, что у пациента может наблюдаться улучшение зрительных характеристик. Зрительные характеристики относятся к общему качеству зрения пациента и включают способность пациента ясно видеть, а также способность различать объект и его фон.
[00142] Одним из аспектов зрительных характеристик является острота зрения. Острота зрения - это мера способности пациента ясно видеть. Остроту зрения можно измерить, например, с помощью таблицы Снеллена. Кроме того, измерение остроты зрения можно проводить в скотопических условиях, мезопических условиях и/или фотопических условиях.
[00143] Другой аспект зрительных характеристик - это контрастная чувствительность. Контрастная чувствительность - это мера способности пациента различать объект и его фон. Контрастную чувствительность можно измерить, например, при помощи автоматизированной системы контрастной чувствительности Holladay. Контрастная чувствительность может быть измерена при различных условиях освещения, включая, например, фотопические условия, мезопические условия и скотопические условия, в каждом из которых есть блики или нет. В некоторых вариантах реализации контрастная чувствительность измеряется в мезопических условиях с или без бликов.
[00144] В некоторых вариантах реализации улучшение зрительных характеристик, обеспечиваемое этим способом, представляет собой повышение остроты зрения. В некоторых вариантах реализации улучшение зрительных характеристик, обеспечиваемое этим способом, представляет собой улучшение остроты зрения в скотопических условиях. В некоторых вариантах реализации улучшение зрительных характеристик, обеспечиваемое этим способом, представляет собой улучшение остроты зрения в мезопических условиях. В некоторых вариантах реализации улучшение зрительных характеристик, обеспечиваемое этим способом, представляет собой повышение остроты зрения в фотопических условиях. В некоторых вариантах реализации улучшение остроты зрения представляет собой улучшение зрения пациента на три строчки, измеренное с использованием таблицы зрения. В некоторых вариантах реализации улучшение остроты зрения представляет собой улучшение зрения пациента на две строки, измеренное с использованием таблицы зрения. В некоторых других вариантах реализации улучшение остроты зрения представляет собой улучшение зрения пациента на одну строку, измеренное с использованием таблицы зрения. В некоторых вариантах реализации таблица зрения представляет собой таблицу Снеллена. В некоторых других вариантах реализации таблица зрения представляет собой таблица Джегера. В некоторых других вариантах реализации таблица зрения представляет собой таблица Розенбаума или таблица ETDRS. В некоторых вариантах реализации улучшение остроты зрения измеряется на близком расстоянии (например, около 1, 2 или 3 фута). В некоторых вариантах реализации улучшение остроты зрения измеряется на большом расстоянии (например, около 20, 25 или 30 футов). В некоторых вариантах реализации улучшение остроты зрения представляет собой улучшение остроты зрения вблизи. В некоторых вариантах реализации улучшение остроты зрения представляет собой улучшение остроты зрения вдаль. В некоторых вариантах реализации улучшение остроты зрения представляет собой (i) улучшение остроты зрения вблизи и (ii) улучшение остроты зрения вдаль.
[00145] В некоторых вариантах реализации улучшение зрительных характеристик, обеспечиваемое этим способом, представляет собой улучшенную контрастную чувствительность. Улучшение контрастной чувствительности можно измерить при различных условиях освещения, таких как фотопические условия, мезопические условия и скотопические условия. В некоторых вариантах реализации улучшение зрительных характеристик, обеспечиваемое этим способом, представляет собой улучшенную контрастную чувствительность в фотопических условиях. В некоторых вариантах реализации улучшение зрительных характеристик, обеспечиваемое этим способом, представляет собой улучшенную контрастную чувствительность в мезопических условиях. В некоторых вариантах реализации улучшение зрительных характеристик, обеспечиваемое этим способом, представляет собой улучшенную контрастную чувствительность в скотопических условиях. Кроме того, контрастная чувствительность может быть измерена при наличии или отсутствии бликов. Предусмотрены все комбинации условий освещения и бликов.
[00146] Преимущества, обеспечиваемые терапевтическими способами, можно охарактеризовать в соответствии с улучшением контрастной чувствительности пациента. Например, в некоторых вариантах реализации улучшение контрастной чувствительности составляет по меньшей мере 10% (или 20%, 30%, 50%, 60% или 70%) улучшение, измеренное в мезопических условиях с использованием автоматизированной системы контрастной чувствительности Holladay. В некоторых вариантах реализации улучшение контрастной чувствительности составляет по меньшей мере 10% (или 20%, 30%, 50%, 60% или 70%) улучшение, измеренное в фотопических условиях с использованием автоматизированной системы контрастной чувствительности Holladay. В некоторых других вариантах реализации улучшение контрастной чувствительности составляет по меньшей мере 10% (или 20%, 30%, 50%, 60% или 70%) улучшение, измеренное в мезопических условиях или скотопических условиях с использованием автоматизированной системы контрастной чувствительности Holladay. В некоторых других вариантах реализации улучшение контрастной чувствительности измеряется с использованием таблицы контрастной чувствительности Пелли-Робсона.
[00147] В некоторых других вариантах реализации улучшение зрительных характеристик, обеспечиваемое данным способом, представляет собой как (i) улучшенную остроту зрения (например, в скотопических условиях, мезопических условиях и/или фотопических условиях), так и (ii) улучшенную контрастную чувствительность (например, в скотопических условиях, мезопических условиях и/или фотопических условия).
[00148] В некоторых других вариантах реализации улучшение зрительных характеристик характеризуется одним или несколькими из следующего:
оценка нескорректированной остроты зрения вблизи (например, бинокулярная оценка нескорректированной остроты зрения вблизи);
среднее изменение нескорректированной остроты зрения вблизи от исходного уровня (НОЗВ); или
доля субъектов с улучшением по крайней мере на 3 строки (например, 15 букв) в исследуемом глазу при измерении монокулярной остроты зрения с максимальной коррекцией зрения на расстоянии 45 см после лечения по сравнению с исходной монокулярной остротой зрения с наилучшей коррекцией зрения на расстоянии 45 см после лечения.
[00149] В некоторых других вариантах реализации улучшение зрительных характеристик характеризуется одним или несколькими из следующего:
оценка нескорректированной остроты зрения вблизи (например, бинокулярная оценка нескорректированной остроты зрения вблизи);
среднее изменение нескорректированной остроты зрения вблизи от исходного уровня (НОЗВ, бинокулярная); или
доля субъектов с улучшением по крайней мере на 3 строки (например, 15 букв) в исследуемом глазу при измерении монокулярной остроты зрения с максимальной коррекцией зрения на расстоянии 35 см после лечения по сравнению с исходной монокулярной остротой зрения с максимальной коррекцией зрения на расстоянии 35 см после лечения.
Уменьшение диаметра зрачка
[00150] Одно из преимуществ терапевтических способов состоит в том, что у пациента может наблюдаться уменьшение диаметра зрачка. Уменьшение диаметра зрачка может улучшить зрительные характеристики.
[00151] Уменьшение диаметра зрачка может быть охарактеризовано в соответствии с процентным уменьшением диаметра зрачка из-за введения альфа-адренергического антагониста, например, когда уменьшение диаметра зрачка составляет по меньшей мере 5%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации уменьшение диаметра зрачка находится в диапазоне от около 10% до около 40% по сравнению с диаметром зрачка пациента в тех же условиях, но не получившего терапию, определенную данным способом. В некоторых вариантах реализации уменьшение диаметра зрачка находится в диапазоне от около 20% до около 30% по сравнению с диаметром зрачка пациента в тех же условиях, но не получившего терапию, определенную данным способом. В некоторых вариантах реализации уменьшение диаметра зрачка находится в диапазоне от около 20% до около 40% по сравнению с диаметром зрачка пациента в тех же условиях, но не получившего терапию, определенную данным способом. В некоторых вариантах реализации уменьшение диаметра зрачка измеряется в фотопических условиях.
[00152] В более конкретном варианте реализации уменьшение диаметра зрачка может быть охарактеризовано, например, в соответствии с процентным уменьшением диаметра зрачка и размером зрачка, измеренными при определенных условиях освещения. Соответственно, в некоторых вариантах реализации уменьшение диаметра зрачка в мезопических условиях составляет по меньшей мере 5% по сравнению с диаметром зрачка пациента в тех же мезопических условиях, но не получившего терапию, определенную данным способом. В некоторых других вариантах реализации уменьшение диаметра зрачка в мезопических условиях составляет по меньшей мере 10% по сравнению с диаметром зрачка пациента в тех же мезопических условиях, но не получившего терапию, определенную данным способом. В некоторых других вариантах реализации уменьшение диаметра зрачка в мезопических условиях составляет по меньшей мере 20% по сравнению с диаметром зрачка пациента в тех же мезопических условиях, но не получившего терапию, определенную данным способом. В некоторых других вариантах реализации уменьшение диаметра зрачка в мезопических условиях составляет по меньшей мере 30% по сравнению с диаметром зрачка пациента в тех же мезопических условиях, но не получившего терапию, определенную данным способом. В некоторых других вариантах реализации у пациента наблюдается уменьшение диаметра зрачка по меньшей мере на 0,5 мм при измерении в мезопических условиях по сравнению с диаметром зрачка пациента в тех же мезопических условиях, но не получившего терапию, определенную данным способом. В некоторых других вариантах реализации у пациента наблюдается уменьшение диаметра зрачка в диапазоне от около 0,6 мм до около 3 мм, от около 0,6 мм до около 2,5 мм или от около 0,6 мм до около 2 мм при измерении в мезопических условиях относительно диаметра зрачка пациента в тех же мезопических условиях, но не получившего терапию, определенную данным способом. В некоторых других вариантах реализации у пациента наблюдается уменьшение диаметра зрачка в диапазоне от около 0,6 мм до около 1,2 мм при измерении в мезопических условиях относительно диаметра зрачка пациента в тех же мезопических условиях, но не получившего терапию, определенную данным способом. В других вариантах реализации зрачок пациента уменьшается до диаметра от около 3 мм до около 5 мм, от около 3 мм до около 6 мм, от около 4 мм до около 5 мм, от около 4 мм до около 6 мм или от около 4 мм до около 7 мм в мезопических условиях из-за терапии, определенной данным способом. В некоторых вариантах реализации зрачок пациента уменьшается до диаметра от около 4 мм до около 6 мм в мезопических условиях из-за терапии, определенной данным способом.
[00153] В некоторых вариантах реализации уменьшение диаметра зрачка в фотопических условиях составляет по меньшей мере 5% по сравнению с диаметром зрачка пациента в тех же фотопических условиях, но не получившего терапию, определенную данным способом. В некоторых других вариантах реализации уменьшение диаметра зрачка в фотопических условиях составляет по меньшей мере 10% по сравнению с диаметром зрачка пациента в тех же фотопических условиях, но не получившего терапию, определенную данным способом. В некоторых других вариантах реализации уменьшение диаметра зрачка в фотопических условиях составляет по меньшей мере 20% по сравнению с диаметром зрачка пациента в тех же фотопических условиях, но не получившего терапию, определенную данным способом. В некоторых других вариантах реализации уменьшение диаметра зрачка в фотопических условиях составляет по меньшей мере 30% по сравнению с диаметром зрачка пациента в тех же фотопических условиях, но не получившего терапию, определенную данным способом. В некоторых других вариантах реализации у пациента наблюдается уменьшение диаметра зрачка по меньшей мере на 0,5 мм при измерении в фотопических условиях по сравнению с диаметром зрачка пациента в тех же фотопических условиях, но не получившего терапию, определенную данным способом. В некоторых других вариантах реализации у пациента наблюдается уменьшение диаметра зрачка в диапазоне от около 0,6 мм до около 3 мм, от около 0,6 мм до около 2,5 мм или от около 0,6 мм до около 2 мм при измерении в фотопических условиях относительно диаметра зрачка пациента в тех же фотопических условиях, но не получившего терапию, определенную данным способом. В некоторых других вариантах реализации у пациента наблюдается уменьшение диаметра зрачка в диапазоне от около 0,6 мм до около 1,2 мм при измерении в фотопических условиях относительно диаметра зрачка пациента в тех же фотопических условиях, но не получившего терапию, определенную данным способом. В других вариантах реализации зрачок пациента уменьшается до диаметра от около 3 мм до около 5 мм, от около 3 мм до около 6 мм, от около 4 мм до около 5 мм, от около 4 мм до около 6 мм или от около 4 мм до около 7 мм в фотопических условиях из-за терапии, определенной данным способом. В некоторых вариантах реализации зрачок пациента уменьшается до диаметра от около 4 мм до около 6 мм в фотопических условиях из-за терапии, определенной данным способом.
[00154] Уменьшение диаметра зрачка можно проанализировать и охарактеризовать с помощью таких процедур, как описанные ниже, в которых раствор мезилата фентоламина вводили в глаза пациента и измеряли и характеризовали изменение диаметра зрачка. Данные процедуры были выполнены в контексте клинических исследований с участием пациентов не моложе 18 лет, у которых в истории болезни был размер зрачка по меньшей мере 7 мм в диаметре в условиях тусклого света. Раствор мезилата фентоламина содержал 0,2% (мас./об.) мезилата фентоламина, 0,4% (мас./об.) мезилата фентоламина или 0,8% (мас./об.) мезилата фентоламина.
Часть I - Экспериментальные процедуры
[00155] Шестнадцать пациентов были рандомизированы в четыре группы (по четыре человека в каждой). Каждую группу лечили во время трех последовательных посещений, разделенных по меньшей мере 4 днями, одной каплей офтальмологического раствора оксиметазолина (Visine LR®) в каждый глаз, а затем по одной капле тестируемого препарата в каждый глаз. Тестируемый препарат представлял собой 0,2% (мас./об.) раствор мезилата фентоламина, 0,4% (мас./об.) раствор мезилата фентоламина, 0,8% (мас./об.) раствор мезилата фентоламина или плацебо. Тестируемые препараты содержали заданное количество мезилата фентоламина в растворе Tears Naturale II® (от Alcon Labs). Плацебо представлял собой Tears Naturale II® (от Alcon Labs). Tears Naturale II® (от Alcon Labs) содержит Декстран 70 (0,1% по массе), Гидроксипропилметилцеллюлозу 2910 (0,3% по массе), Поликватерний-1 (0,001% по массе), хлорид калия, воду (очищенная), борат натрия, хлорид натрия и соляную кислоту и/или гидроксид натрия по мере необходимости, чтобы отрегулировать pH. Диаметр зрачка пациентов регистрировали на исходном уровне (т.е. до введения лечения) и через 30 минут, 1 час, 2 часа, 4 часа и 8 часов после введения тестируемых препаратов. Общая продолжительность исследования составила около девяти часов. Графики рандомизации групп лечения представлены в Таблице 1 ниже.
[00156] Пациенты соответствовали критериям включения в исследование, если им было (а) не менее 18 лет и (б) документально подтвержденный размер зрачка в тусклом свете превышал 7 мм. Пациенты не соответствовали критериям включения в исследование, если они соответствовали любому из следующих критериев: (а) имели гипертонию от умеренной до тяжелой степени, (б) имели в истории болезни аномалии сердечного ритма, (в) принимали какой-либо исследуемый препарат в течение 14 дней до скрининга, (г) имелась известная местная или системная гиперчувствительность к адренергическим антагонистам, или (д) имелась центральная патология роговицы.
[00157] Диаметр зрачка измерялся с точностью до 0,1 мм для каждого глаза на исходном уровне и в каждой последующей временной точке с использованием пупилометра NeurOpticsTM. Сравнения изменений средних значений в группах лечения были проверены на значимость с использованием двусторонних парных двухвыборочных t-критериев с порогом значимости, установленным на уровне p < 0,01 (поправка Бонферрони для нескольких парных t-критериев). Различия между группами лечения в отношении средних значений размера зрачка в ходе исследования были проверены на значимость с использованием дисперсионного анализа с повторными измерениями (который отбрасывает данные от субъектов, у которых отсутствуют какие-либо точки данных). Различия в средних значениях между группами лечения в отдельные моменты времени проверяли на значимость при помощи однофакторного дисперсионного анализа. Если однофакторный дисперсионный анализ показал значимость в заданный момент времени, проводилось специальное тестирование Фишера для выявления значимых различий между средними значениями отдельных групп.
Часть II - Результаты
[00158] Пятнадцать из 16 пациентов завершили исследование. Один пациент, рандомизированный в Группу 3, выполнил только два из трех посещений в клинику, пропустив дозу 0,8% (мас./об.) мезилата фентоламина. Результаты измерений зрачка описаны ниже.
[00159] Одним из критериев включения в исследование была документация о размере зрачка > 7 мм при измерении в условиях тусклого освещения. В Таблице 2 представлены средние диаметры зрачков, стандартное отклонение диаметров зрачков и наблюдаемый диапазон диаметров, записанный непосредственно перед введением каждого лечения.
b - один субъект пропустил посещение дозирования 0,8% фентоламина
[00160] Средние исходные диаметры зрачков были сопоставимы во всех четырех группах лечения, при этом наблюдаемые различия в средних значениях (Таблица 2) не были статистически значимыми (P=0,766). Из 94 исходных диаметров зрачков, собранных в ходе исследования, было двенадцать случаев (представляющих 3 субъекта; Таблица 3), в которых исходные диаметры зрачков были меньше критерия включения 7 мм. Исходные диаметры зрачков менее 7 мм были равномерно распределены между группами лечения (2, 3, 4 и 3 зрачка в группах лечения плацебо, 0,2%, 0,4% и 0,8% (мас./об.) мезилата фентоламина, соответственно).
исследования
б - 20 зрачков; данные за 8 часов для субъектов 2 и 11, посещений - 2, не регистрировались
в - 22 зрачка; данные за 2 часа от субъекта 7, посещение 1 не регистрировалось
г - 22 зрачка; данные за 4 часа от субъекта 16, посещение 1 не регистрировалось
д - 22 зрачка в каждый момент времени, субъект 16 пропустил посещение 3
[00161] Для всех исследуемых групп средний диаметр зрачка оставался относительно неизменным через 30 минут после лечения. Через час после лечения средний диаметр зрачка был ниже (P=0,47) у субъектов, получавших фентоламин. Средний диаметр зрачка у субъектов, получавших плацебо, был относительно постоянным в течение 8 часов наблюдения после лечения.
[00162] Повторные измерения ANOVA показали значительную (p < 0,001) разницу между группами лечения в отношении диаметра зрачка в ходе исследования. Значительные различия в средних диаметрах зрачков между лечением были идентифицированы с помощью однофакторного ANOVA через 2 часа (p=0,0006), 4 часа (p=0,0027) и 8 часов (p=0,0016) после лечения. Специальные тесты Фишера на значимость между средними значениями отдельных групп продемонстрировали значительные различия в средних диаметрах зрачков у субъектов, получавших любую концентрацию мезилата фентоламина, по сравнению с плацебо через 2, 4 и 8 часов (Таблица 5). Напротив, не было статистически значимых различий в средних диаметрах зрачков, наблюдаемых между разными дозами фентоламина в любой момент времени.
[00163] Для всех групп лечения средний диаметр зрачка был относительно неизменным по сравнению с исходным уровнем через 30 минут после лечения (Таблица 6). Через час после лечения изменение среднего диаметра зрачка по сравнению с исходным уровнем было значительным (p < 0,01) для субъектов, получавших 0,2% (мас./об.), 0,4% (мас./об.) и 0,8% (мас./об.) мезилата фентоламина. Средний диаметр зрачка существенно не изменился по сравнению с исходным уровнем у субъектов, получавших плацебо, в течение 8 часов наблюдения после лечения.
[00164] Различия в среднем диаметре зрачка в группах лечения выражены как средние изменения диаметра от исходного уровня в Таблице 6. Когда средние изменения диаметра зрачка от исходного уровня оцениваются как функция времени, становится очевидным, что у субъектов, получавших мезилат фентоламина, наблюдалось значительное уменьшение размера зрачка в ходе исследования.
Влияние на остроту зрения вдаль пациента
[00165] Способы можно дополнительно охарактеризовать в зависимости от того, оказывает ли способ отрицательное влияние на остроту зрения вдаль пациента. В определенных вариантах реализации острота зрения вдаль пациента не снижена.
Введение дозы в один или оба глаза пациента
[00166] Способы можно дополнительно охарактеризовать в зависимости от того, вводится ли альфа-адренергический антагонист в один или оба глаза пациента. В некоторых вариантах реализации дозу вводят только в один глаз пациента. В некоторых вариантах реализации дозу вводят в оба глаза пациента.
Уменьшение аберрантной фокусировки лучей рассеянного света в глазу пациента
[00167] Одним из преимуществ терапевтических способов является то, что у пациента может наблюдаться снижение аберрантной фокусировки рассеянных световых лучей в глазу пациента. Это может обеспечить улучшение зрительных характеристик пациента. В некоторых вариантах реализации терапевтический способ обеспечивает уменьшение аберрантной фокусировки рассеянных световых лучей в глазу пациента по меньшей мере на двадцать часов. В некоторых вариантах реализации терапевтический способ обеспечивает уменьшение аберрантной фокусировки рассеянных световых лучей в глазу пациента в течение по меньшей мере на двадцать четыре часа. В других вариантах реализации терапевтический способ обеспечивает уменьшение аберрантной фокусировки рассеянных световых лучей в глазу пациента в течение по меньшей мере на тридцать шесть часов, сорок восемь часов, шестьдесят часов или семьдесят два часа.
Имплантируемое глазное устройство
[00168] Композиции, описанные в данном документе, можно вводить в глаз пациента через имплантируемое глазное устройство, которое распределяет композицию. Имплантируемое глазное устройство может быть выполнено с возможностью дозирования композиции с желаемой скоростью и/или частотой. В определенных вариантах реализации имплантируемое глазное устройство представляет собой вставку с медленным высвобождением.
III. Офтальмологические растворы
[00169] Терапевтически активные агенты желательно вводить в глаз пациента в форме офтальмологического раствора. Такой офтальмологический раствор содержит один или несколько терапевтически активных агентов и фармацевтически приемлемый носитель. Желательно, чтобы офтальмологический раствор демонстрировал хорошую стабильность при хранении, чтобы обеспечить распределение офтальмологического раствора по нормальным каналам распределения для фармацевтических препаратов. В некоторых вариантах реализации фармацевтически приемлемый носитель представляет собой воду. К офтальмологическому раствору могут быть добавлены дополнительные компоненты, чтобы оптимизировать рабочие характеристики офтальмологического раствора. Примеры дополнительных компонентов включают, например, хелатирующий агент (например, ЭДТА), полиольное соединение, полимер поли(C2-4алкилен)гликоля, декстран, целлюлозный агент, буфер, модификатор тоничности, консервант, антиоксидант, модификатор вязкости, агент усиливающий проницаемость в роговицу, солюбилизирующий агент, стабилизирующий агент, поверхностно-активное вещество, смягчающий полимер, смачивающий агент и другие материалы.
[00170] Офтальмологические растворы могут быть дополнительно охарактеризованы в соответствии с наличием или отсутствием одного или нескольких из хелатирующего агента (например, ЭДТА), полиольное соединение, полимер поли(C2-4алкилен)гликоля, декстрана, целлюлозного агента, буфера, модификатора тоничности, консерванта, антиоксиданта, модификатора вязкости, агента усиливающего проницаемость в роговицу, солюбилизирующего агента, стабилизирующего агента, поверхностно-активного вещества, смягчающего полимера, смачивающего агента и других материалов. В некоторых вариантах реализации офтальмологический раствор свободен от хелатирующего агента (например, ЭДТА). В некоторых вариантах реализации офтальмологический раствор свободен от консерванта. В некоторых вариантах реализации офтальмологический раствор содержит консервант.
[00171] Различные вышеупомянутые терапевтические способы включают введение пациенту дозы фентоламина или его фармацевтически приемлемой соли. Дозировка фентоламина или его фармацевтически приемлемой соли желательна в форме офтальмологического раствора. Офтальмологический раствор составлен так, чтобы быть подходящим для введения в глаз пациента, и, желательно, обеспечивает немедленное высвобождение фентоламина, то есть офтальмологический раствор не является составом с замедленным высвобождением, который доставляет фентоламин в течение длительного периода времени, такого как часы, дни или недели.
[00172] Желательно, чтобы офтальмологический раствор содержал водный фармацевтически приемлемый носитель и фентоламин или его фармацевтически приемлемую соль. Офтальмологический раствор может содержать эксципиент(ы), подходящие для введения в глаз. В литературе описаны различные фармацевтически приемлемые соли. Предпочтительной солевой формой фентоламина является мезилат фентоламина. Соответственно, в способах можно использовать офтальмологический раствор, который содержит водный фармацевтически приемлемый носитель и мезилат фентоламина.
[00173] Соответственно, в некоторых вариантах реализации дозировка, используемая в способах, представляет собой офтальмологический раствор, содержащий водный фармацевтически приемлемый носитель и фентоламин или его фармацевтически приемлемую соль. В некоторых других вариантах реализации дозировка представляет собой офтальмологический раствор, содержащий водный фармацевтически приемлемый носитель и мезилат фентоламина. В некоторых других вариантах реализации дозировка представляет собой офтальмологический раствор, содержащий воду, полиол и фентоламин или его фармацевтически приемлемую соль. В некоторых других вариантах реализации дозировка представляет собой офтальмологический раствор, содержащий воду, маннит и мезилат фентоламина. В некоторых других вариантах реализации дозировка представляет собой офтальмологический раствор, содержащий воду, полиол, карбоксилат щелочного металла и фентоламин или его фармацевтически приемлемую соль. В некоторых других вариантах реализации дозировка представляет собой офтальмологический раствор, содержащий воду, маннит, ацетат натрия и мезилат фентоламина.
[00174] Другие офтальмологические растворы, которые предполагается использовать в настоящем изобретении, включают, например, (i) водные офтальмологические растворы, не содержащие хелатирующего агента, и (ii) составы поливинилпирролидоновых искусственных слез, каждый из которых более подробно описан ниже.
[00175] Офтальмологические растворы можно дополнительно охарактеризовать вязкостью раствора. В некоторых вариантах реализации офтальмологический раствор при температуре около 25 °C имеет вязкость в диапазоне от 0,9 сП до около 1,1 сП. В некоторых вариантах реализации офтальмологический раствор при температуре около 25 °C имеет вязкость около 1 сП.
[00176] В некоторых вариантах реализации офтальмологический раствор содержит альфа-адренергический антагонист (например, фентоламин или его фармацевтически приемлемую соль) и один или несколько дополнительных агентов (например, пилокарпин), описанных в данном документе.
Водный офтальмологический раствор, свободный от хелатирующего агента
[00177] В некоторых вариантах реализации доза, используемая в способах, представляет собой водный офтальмологический раствор, свободный от хелатирующего агента, причем указанный раствор содержит (а) фентоламин или его фармацевтически приемлемую соль; (б) по меньшей мере одно полиольное соединение, такое как полиольное соединение, имеющее молекулярную массу менее 250 г/моль; (в) по меньшей мере, один буфер; и (г) воду; причем раствор свободен от хелатирующего агента. Количество ингредиентов в водных офтальмологических растворах может быть выбрано для достижения определенных рабочих характеристик, таких как стабильность при хранении, минимизация раздражения глаз пациента и усиление проникновения фентоламина в глаз пациента.
[00178] Один примерный предпочтительный раствор представляет собой водный офтальмологический раствор, свободный от хелатирующего агента, содержащий: (а) от около 0,1% (мас./об.) до около 4% (мас./об.) фентоламина или его фармацевтически приемлемой соли; (б) от около 1% (мас./об.) до около 6% (мас./об.) по меньшей мере одного полиольного соединения, имеющего молекулярную массу менее 250 г/моль; (в) от около 0,1 мМ до около 10 мМ по меньшей мере одного буфера; и (г) воду; причем раствор имеет pH в диапазоне от 4,0 до 7,5 и свободен от хелатирующего агента.
[00179] Примеры компонентов и признаков водных офтальмологических растворов более подробно описаны ниже.
Фентоламин и фармацевтически приемлемые соли
[00180] Водный офтальмологический раствор содержит фентоламин или фармацевтически приемлемую соль фентоламина. Примеры фармацевтически приемлемых солей включают, например, соль соляной кислоты и соль мезилата. Соответственно, в некоторых вариантах реализации раствор содержит фентоламин (т.е. в виде свободного основания). В некоторых других вариантах реализации раствор содержит гидрохлорид фентоламина. В некоторых еще других вариантах реализации раствор содержит мезилат фентоламина.
[00181] Количество фентоламина или его фармацевтически приемлемой соли в водном офтальмологическом растворе можно регулировать для достижения желаемых рабочих характеристик. Например, если желательно предоставить пациенту большее количество фентоламина (или его фармацевтически приемлемой соли) при однократном введении водного офтальмологического раствора, концентрация фентоламина (или его фармацевтически приемлемой соли) увеличивается в водном офтальмологическом растворе. Однократное введение водных офтальмологических растворов, содержащих более высокую концентрацию фентоламина (или его фармацевтически приемлемой соли), может обеспечить пациенту пониженное внутриглазное давление на более длительный период времени, поскольку пациенту вводят большее количество фентоламина (или его фармацевтически приемлемой соли).
[00182] Соответственно, в некоторых вариантах реализации водный офтальмологический раствор содержит от около 0,1% (мас./об.) до около 5% (мас./об.) фентоламина или его фармацевтически приемлемой соли. В некоторых вариантах реализации водный офтальмологический раствор содержит от около 0,1% (мас./об.) до около 1% (мас./об.) фентоламина или его фармацевтически приемлемой соли, от около 1% (мас./об.) до около 2% (мас./об.) фентоламина или его фармацевтически приемлемой соли, от около 2% (мас./об.) до около 3% (мас./об.) фентоламина или его фармацевтически приемлемой соли, от около 3% (мас./об.) до около 4% (мас./об.) фентоламина или его фармацевтически приемлемой соли, от около 4% (мас./об.) до около 5% (мас./об.) фентоламина или его фармацевтически приемлемой соли. В некоторых вариантах реализации водный офтальмологический раствор содержит от около 0,1% (мас./об.) до около 2% (мас./об.) фентоламина или его фармацевтически приемлемой соли. В некоторых вариантах реализации водный офтальмологический раствор содержит от около 0,25% (мас./об.) до около 2% (мас./об.) фентоламина или его фармацевтически приемлемой соли. В некоторых других вариантах реализации водный офтальмологический раствор содержит от около 0,5% (мас./об.) до около 2% (мас./об.) фентоламина или его фармацевтически приемлемой соли. В некоторых других вариантах реализации водный офтальмологический раствор содержит от около 0,25% (мас./об.) до около 1% (мас./об.) фентоламина или его фармацевтически приемлемой соли. В некоторых других вариантах реализации водный офтальмологический раствор содержит около 1% (мас./об.) фентоламина или его фармацевтически приемлемой соли. В некоторых других вариантах реализации водный офтальмологический раствор содержит от около 0,1% (мас./об.) до около 4% (мас./об.) мезилата фентоламина. В некоторых других вариантах реализации водный офтальмологический раствор содержит от около 0,1% (мас./об.) до около 2% (мас./об.) мезилата фентоламина. В некоторых других вариантах реализации водный офтальмологический раствор содержит от около 0,25% (мас./об.) до около 2% (мас./об.) мезилата фентоламина. В некоторых других вариантах реализации водный офтальмологический раствор содержит от около 0,5% (мас./об.) до около 2% (мас./об.) мезилата фентоламина. В некоторых других вариантах реализации водный офтальмологический раствор содержит от около 0,25% (мас./об.) до около 1% (мас./об.) мезилата фентоламина. В некоторых других вариантах реализации водный офтальмологический раствор содержит около 1% (мас./об.) мезилата фентоламина. В некоторых других вариантах реализации водный офтальмологический раствор содержит около 0,25% (мас./об.) или около 0,5% (мас./об.) мезилата фентоламина.
Полиольные соединения
[00183] Водный офтальмологический раствор содержит одно или несколько полиольных соединений. Полиольное соединение представляет собой органическое соединение, имеющее по меньшей мере две гидроксильные группы (например, от 2 до около 6 гидроксильных групп). Полиольное соединение полезно для водного офтальмологического раствора, потому что, например, оно может повышать стабильность водного офтальмологического раствора при хранении и/или изменять тоничность водного офтальмологического раствора. Примеры соединений полиола включают, например, маннит, глицерин, пропиленгликоль, этиленгликоль, сорбит и ксилит.
[00184] Водный офтальмологический раствор может содержать одно полиольное соединение или смесь одного или нескольких полиольных соединений. Другими словами, водный офтальмологический раствор содержит по меньшей мере одно полиольное соединение. В некоторых вариантах реализации водный офтальмологический раствор содержит по меньшей мере одно полиольное соединение, которое представляет собой маннит, глицерин, пропиленгликоль, этиленгликоль, сорбит или ксилит. В некоторых других вариантах реализации по меньшей мере одно полиольное соединение представляет собой маннит. В некоторых других вариантах реализации по меньшей мере одно полиольное соединение представляет собой глицерин. В некоторых других вариантах реализации по меньшей мере одно полиольное соединение представляет собой пропиленгликоль. В некоторых других вариантах реализации по меньшей мере одно полиольное соединение представляет собой маннит и раствор дополнительно содержит глицерин. В некоторых других вариантах реализации по меньшей мере одно полиольное соединение представляет собой маннит и раствор дополнительно содержит пропиленгликоль. В некоторых других вариантах реализации по меньшей мере одно полиольное соединение представляет собой глицерин и раствор дополнительно содержит пропиленгликоль. В некоторых других вариантах реализации маннит, описанный в вариантах реализации выше, представляет собой D-маннит.
[00185] Количество по меньшей мере одного полиольные соединения в водном офтальмологическом растворе может быть выбрано для достижения желаемых рабочих характеристик раствора. Полиольное соединение может, например, повышать стабильность раствора при хранении и/или изменять тоничность раствора, чтобы сделать его более подходящим для введения в глаз пациента. В некоторых вариантах реализации водный офтальмологический раствор содержит от около 2% (мас./об.) до около 5% (мас./об.) по меньшей мере одного полиольного соединения. В некоторых других вариантах реализации водный офтальмологический раствор содержит от около 3,5% (мас./об.) до около 4,5% (мас./об.) по меньшей мере одного полиольного соединения. В некоторых других вариантах реализации водный офтальмологический раствор содержит около 4% (мас./об.) по меньшей мере одного полиольные соединения. В некоторых других вариантах реализации водный офтальмологический раствор содержит от около 2% (мас./об.) до около 3% (мас./об.) маннита и от около 0,5% (мас./об.) до около 1,5% (мас./об.) глицерина. В некоторых других вариантах реализации маннит, описанный в вариантах реализации выше, представляет собой D-маннит.
[00186] В некоторых вариантах реализации количество полиола может быть выбрано на основе количества фентоламина (или его фармацевтически приемлемой соли), так что существует обратная зависимость между количеством фентоламина (или его фармацевтически приемлемой соли) и полиола, чтобы добиться изотоничности с глазом. Например, в вариантах реализации, где водный офтальмологический раствор содержит около 2% (мас./об.) фентоламина, маннит присутствует в растворе в концентрации около 3% (мас./об.). В вариантах реализации, где водный офтальмологический раствор содержит около 1% (мас./об.) фентоламина, маннит присутствует в растворе в концентрации около 4% (мас./об.). Чтобы дополнительно проиллюстрировать этот принцип, в вариантах реализации, где водный офтальмологический раствор содержит около 0,5% (мас./об.) фентоламина, маннит может присутствовать в растворе в концентрации около 4,5% (мас./об.). В некоторых вариантах реализации маннит, описанный в вариантах реализации выше, представляет собой D-маннит.
[00187] Понятно, что водный офтальмологический раствор может содержать дополнительные ингредиенты, описанные в данном документе, такие как различные полимерные материалы. Одним из таких вариантов реализации является водный офтальмологический раствор, содержащий, например, по меньшей мере одно полиольное соединение, которое представляет собой пропиленгликоль, и дополнительно содержащий полипропиленгликоль, такой как полипропиленгликоль, имеющий средневесовую молекулярную массу в диапазоне от около 5000 г/моль до около 100000 г/моль.
Полимер поли(C2-4алкилен)гликоля
[00188] Водный офтальмологический раствор может необязательно содержать полимер поли(C2-4алкилен)гликоля. Примером полимера поли(C2-4алкилен)гликоля является полипропиленгликоль, такой как полипропиленгликоль, имеющий средневесовую молекулярную массу в диапазоне от около 5000 г/моль до около 100000 г/моль, от около 10000 г/моль до около 50000 г/моль или от около 50000 г/моль до около 100000 г/моль.
Декстран
[00189] Водный офтальмологический раствор может необязательно содержать декстран. Декстран представляет собой коммерчески доступный разветвленный полисахарид, содержащий молекулы глюкозы. Количество декстрана в водном офтальмологическом растворе может быть выбрано для достижения определенных рабочих характеристик. В некоторых вариантах реализации водный офтальмологический раствор содержит от около 0,01% (мас./об.) до около 2% (мас./об.) декстрана. В некоторых других вариантах реализации водный офтальмологический раствор содержит от около 0,01% (мас./об.) до около 1% (мас./об.) декстрана.
[00190] Декстран можно дополнительно охарактеризовать в соответствии с его средневесовой молекулярной массой. В некоторых вариантах реализации декстран имеет средневесовую молекулярную массу в диапазоне от около 65000 г/моль до около 75000 г/моль. В некоторых других вариантах реализации декстран имеет средневесовую молекулярную массу около 70000 г/моль. В других вариантах реализации декстран имеет средневесовую молекулярную массу в диапазоне от около 5000 г/моль до около 100000 г/моль, от около 10000 г/моль до около 50000 г/моль или от около 50000 г/моль до около 100000 г/моль.
Целлюлозный агент
[00191] Водный офтальмологический раствор может необязательно содержать целлюлозный агент. Примеры целлюлозных агентов включают, например, целлюлозу, карбоксиметилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. В некоторых вариантах реализации целлюлозный агент представляет собой гидроксипропилметилцеллюлозу. В некоторых других вариантах реализации целлюлозный агент представляет собой целлюлозу, карбоксиметилцеллюлозу, гидроксиэтилцеллюлозу или гидроксипропилцеллюлозу. Количество целлюлозного агента в водном офтальмологическом растворе может быть выбрано для достижения желаемых рабочих характеристик. Например, в некоторых вариантах реализации водный офтальмологический раствор содержит от около 0,01% (мас./об.) до около 2% (мас./об.) целлюлозного агента.
[00192] Целлюлозный агент может быть дополнительно охарактеризован в соответствии с его средневесовой молекулярной массой. В некоторых вариантах реализации целлюлозный агент имеет средневесовую молекулярную массу в диапазоне от около 5000 г/моль до около 100000 г/моль, от около 10000 г/моль до около 50000 г/моль или от около 50000 г/моль до около 100000 г/моль.
Буфер
[00193] Водный офтальмологический раствор содержит по меньшей мере один буфер. Буфер придает раствору буферную емкость, то есть способность нейтрализовать в определенных пределах либо кислоты, либо основания (щелочь) с относительно небольшим изменением исходного pH или без него. Буфер может быть кислотой, основанием или комбинацией кислоты и основания. Буфер может быть органическим, неорганическим или комбинацией органических и неорганических компонентов. Следует понимать, что буфер, по меньшей мере, частично диссоциирует в водном растворе с образованием смеси, например, кислоты и конъюгата основания или основания и конъюгата кислоты. Например, буфер может представлять собой комбинацию карбоновой кислоты и ее карбоксилатной соли (например, комбинацию уксусной кислоты и ацетата натрия). В другом варианте реализации буфер может представлять собой комбинацию кислоты и основания, где кислота и основание не являются конъюгатами. Например, кислота может быть борной кислотой и основанием может быть трис(гидроксиметил)аминометаном (TRIS).
[00194] Примеры буферов включают органические кислоты (например, уксусную кислоту, сорбиновую кислоту и щавелевую кислоту), боратную соль, гидрокарбонатную соль, карбонатную соль, глюконатную соль, лактатную соль, фосфатную соль, пропионатную соль, перборатную соль, трис(гидроксиметил)аминометан (TRIS), бис(2-гидроксиэтил)-имино-трис-(гидроксиметил)аминоспирт (бис-tris), N-[2-гидрокси-1,1-бис(гидроксиметил)этил]глицин (трицен), N-[2-гидрокси-1,1-бис(гидроксиметил)этил]глицин, 3-(N-морфолино)пропансульфоновую кислоту, N-(карбамоилметил)таурин (ACES), аминокислоту, их соли и их комбинации. Следует понимать, что солевая форма буфера может содержать любой подходящий противоион. Например, солевая форма кислоты может содержать противоион щелочного или щелочноземельного металла.
[00195] Буфер можно охарактеризовать по его силе, т. е. по буферной емкости. Буферная емкость может быть проверена, например, путем определения миллимолей (мМ) сильной кислоты или основания (или, соответственно, ионов водорода или гидроксида), необходимых для изменения pH буферного раствора на одну единицу при добавлении одного литра (условная единица) буферного раствора. Буферная емкость обычно зависит от типа и концентрации компонентов буфера и может быть больше в определенных диапазонах pH. Например, буфер может иметь оптимальную буферную емкость в диапазоне pH, близком к pKa буфера, например, в пределах около 1 единицы pH или около 2 единиц pH от pKa буфера. В некоторых вариантах реализации буфер представляет собой слабый буфер, такой как карбоксилат щелочного металла (например, ацетат натрия).
[00196] В некоторых вариантах реализации буфер представляет собой буфер со слабой кислотой, имеющий одну или несколько из следующих характеристик: (а) pKa от около 4,0 до около 6,0; более предпочтительно от около 4,5 до около 5,5; и (б) значение липофильности Log P от около -0,50 до около 1,5; более предпочтительно от около -0,25 до около 1,35.
[00197] Количество буфера можно регулировать для достижения желаемых рабочих характеристик водного офтальмологического раствора. Например, в некоторых вариантах реализации буфер может присутствовать в концентрации менее около 10 мМ, менее около 7 мМ, менее около 5 мМ, менее около 3 мМ или менее около 2 мМ. В некоторых вариантах реализации буфер может присутствовать в концентрации от около 1 мМ до около 10 мМ, от около 1 мМ до около 7 мМ, от около 1 мМ до около 5 мМ, от около 1 мМ до около 3 мМ, от около 1 мМ до около 2 мМ, от около 2 мМ до около 5 мМ или от около 2 мМ до около 3 мМ. В еще других вариантах реализации буфер присутствует в концентрации около 3 мМ.
[00198] Количество и тип буфера могут быть выбраны для достижения определенных рабочих характеристик водного офтальмологического раствора. Например, количество буфера может повлиять на количество кислоты, которая может быть нейтрализована до того, как произойдет существенное изменение pH водного офтальмологического раствора. Также количество буфера может влиять на тоничность водного офтальмологического раствора. Желательно, чтобы количество и тип буфера выбирались таким образом, чтобы свести к минимуму любое раздражение, которое может быть вызвано введением водного офтальмологического раствора в глаз пациента. Соответственно, в некоторых вариантах реализации буфер присутствует в концентрации в диапазоне от около 2 мМ до около 4 мМ. В еще других вариантах реализации буфер присутствует в концентрации около 3 мМ. В некоторых вариантах реализации буфер содержит алкилкарбоксилат щелочного металла. В некоторых других вариантах реализации буфер содержит ацетат щелочного металла. В еще других вариантах реализации буфер содержит ацетат натрия.
pH раствора
[00199] Водный офтальмологический раствор можно охарактеризовать в соответствии с pH раствора. Желательно, чтобы водный офтальмологический раствор имел pH в диапазоне от 4,0 до 7,5. В некоторых вариантах реализации водный офтальмологический раствор имеет pH в диапазоне от 4,5 до 7,5. В некоторых вариантах реализации раствор имеет pH в диапазоне от 4,5 до 6,0. В некоторых других вариантах реализации раствор имеет pH в диапазоне от 4,5 до 5,5. В еще других вариантах реализации раствор имеет pH в диапазоне от 4,7 до 5,1.
Дополнительные материалы для водных офтальмологических растворов
[00200] Водные офтальмологические растворы могут содержать дополнительные материалы, чтобы сделать композицию более подходящей для введения в глаз пациента. Примеры дополнительных материалов описаны ниже и включают, например, модификатор тоничности, консервант, антиоксидант, модификатор вязкости, стабилизирующий агент, агент, усиливающий проникновение в роговицу, и поверхностно-активные вещества.
A. Модификатор тоничности
[00201] Водный офтальмологический раствор может необязательно содержать один или несколько модификаторов тоничности. Модификатор тоничности может быть ионным или неионным. В некоторых вариантах реализации модификатор тоничности может быть солью, углеводом или полиолом. Типичные модификаторы тоничности включают галогениды щелочных или щелочноземельных металлов (такие как LiBr, LiCl, LiI, KBr, KCl, KI, NaBr, NaCl, NaI, CaCl2 и MgCl2), борную кислоту, декстран (например, Декстран 70), циклодекстрин, декстрозу, маннит, глицерин, мочевину, сорбит, пропиленгликоль или их комбинацию.
[00202] Понятно, что модификатор тоничности может быть добавлен к водному офтальмологическому раствору в количестве, достаточном для обеспечения желаемой осмоляльности. В некоторых вариантах реализации модификатор тоничности присутствует в водном офтальмологическом растворе в количестве, достаточном для того, чтобы водный офтальмологический раствор имел осмоляльность в диапазоне от около 50 до около 1000 мОсм/кг, от около 100 до около 400 мОсм/кг, от около 200 до около 400 мОсм/кг или от около 280 до около 380 мОсм/кг. В некоторых вариантах реализации модификатор тоничности может присутствовать в количестве от около 0,01% (мас./об.) до около 7% (мас./об.), от около 0,01% (мас./об.) до около 5% (мас./об.), от около 0,01% (мас./об.) до около 1% (мас./об.), от около 0,1% (мас./об.) до около 1% (мас./об.), от около 0,05% (мас./об.) до около 5% (мас./об.), от около 0,05% (мас./об.) до около 0,5% (мас./об.), от около 1% (мас./об.) до около 3% (мас./об.) или от около 2% (мас./об.) до около 4% (мас./об.) водного офтальмологического раствора.
B. Консервант
[00203] Водный офтальмологический раствор может необязательно содержать один или несколько консервантов, например, для уменьшения или предотвращения микробного загрязнения. Примеры консервантов включают соли четвертичного аммония, такие как поликватерний-1, цетримид, бензалкония хлорид или бензоксония хлорид; алкилртутные соли тиосалициловой кислоты, такие как тиомерсал, нитрат фенилртути, ацетат фенилртути или борат фенилртути; парабены, такие как метилпарабен или пропилпарабен; спирты, такие как хлорбутанол, бензиловый спирт, фенилэтанол, циклогексанол, 3-пентанол или резорцин; перекись; диоксид хлора или PURITE; производные гуанидина, такие как глюконат хлоргексидина или полиаминопропилбигуанид; и их комбинации.
[00204] Количество консерванта можно регулировать для достижения желаемых рабочих характеристик водного офтальмологического раствора. В некоторых вариантах реализации консервант присутствует в количестве менее около 5% (мас./об.), 3% (мас./об.), 1% (мас./об.) или 0,1% (мас./об.) водного офтальмологического раствора. В некоторых других вариантах реализации консервант присутствует в количестве от около 0,01% (мас./об.) до около 5% (мас./об.), от около 0,01% (мас./об.) до около 1% (мас./об.), от около 0,1% (мас./об.) до около 1% (мас./об.), от около 0,05% (мас./об.) до около 5% (мас./об.) или от около 0,05% (мас./об.) до около 0,5% (мас./об.) водного офтальмологического раствора.
C. Антиоксидант
[00205] Водный офтальмологический раствор может необязательно содержать один или несколько антиоксидантов. Примеры антиоксидантов для использования в водных офтальмологических растворах, описанных в данном документе, включают водорастворимые антиоксиданты, такие как аскорбиновая кислота, гидрохлорид цистеина, бисульфат натрия, метабисульфит натрия, бисульфит натрия, сульфит натрия и тому подобное; и маслорастворимые антиоксиданты, такие как аскорбилпальмитат, бутилированный гидроксианизол (BHA), бутилированный гидрокситолуол (BHT), лецитин, пропилгаллат, альфа-токоферол и тому подобное.
[00206] Количество антиоксиданта можно регулировать для достижения желаемых рабочих характеристик водного офтальмологического раствора. В некоторых вариантах реализации антиоксидант присутствует в количестве менее около 5% (мас./об.), 3% (мас./об.), 1% (мас./об.) или 0,1% (мас./об.) водного офтальмологического раствора. В некоторых других вариантах реализации антиоксидант присутствует в количестве от около 0,01% (мас./об.) до около 5% (мас./об.), от около 0,01% (мас./об.) до около 1% (мас./об.), от около 0,1% (мас./об.) до около 1% (мас./об.), от около 0,05% (мас./об.) до около 5% (мас./об.) или от около 0,05% (мас./об.) до около 0,5% (мас./об.) водного офтальмологического раствора.
D. Модификатор вязкости
[00207] Водный офтальмологический раствор может необязательно содержать один или несколько модификаторов вязкости. Модификатор вязкость, можно использовать, например, для увеличения абсорбции активного агента или увеличения времени удерживания водного офтальмологического раствора в глазу. Примеры модификаторов вязкость, включают поливинилпирролидон, метилцеллюлозу, гидроксипропилметилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, карбоксиметилцеллюлозу (CMC) и их соли (например, натриевую соль CMC), желатин, гликолят целлюлозы, сорбитол, ниацинамид, альфа-циклодекстран, поливиниловый спирт, полиэтиленгликоль, гиалуроновую кислоту, полисахарид, моносахарид и их комбинации.
[00208] Количество модификатора вязкости можно регулировать для достижения желаемых рабочих характеристик водного офтальмологического раствора. В некоторых вариантах реализации модификатор вязкости, присутствует в количестве менее около 10% (мас./об.), 5% (мас./об.), 3% (мас./об.), 1% (мас./об.) или 0,1% (мас./об.) водного офтальмологического раствора. В некоторых других вариантах реализации модификатор вязкости, присутствует в количестве от около 0,01% (мас./об.) до около 5% (мас./об.), от около 0,01% (мас./об.) до около 1% (мас./об.), от около 0,1% (мас./об.) до около 1% (мас./об.), от около 0,05% (мас./об.) до около 5% (мас./об.) или от около 0,05% (мас./об.) до около 0,5% (мас./об.) водного офтальмологического раствора. В некоторых других вариантах реализации модификатор вязкости, присутствует в количестве, достаточном для обеспечения водного офтальмологического раствора с вязкостью в диапазоне от около 30 сантипуаз до около 100 сантипуаз.
[00209] Модификатор вязкости, может быть полимером, который приводит к замедленному высвобождению одного или нескольких терапевтических агентов в растворе. Тип полимера может быть выбрана так, чтобы достичь желаемого профиля времени высвобождения для одного или нескольких терапевтических агентов.
E. Агент, усиливающий проникновение в роговицу
[00210] Водный офтальмологический раствор может необязательно содержать один или несколько агентов для усиления проникновения в роговицу фентоламина (или его фармацевтически приемлемой соли). Примеры агентов для усиления проникновения в роговицу включают полимеры, органические кислоты, сложные эфиры органической кислоты (например, моноглицерид жирной кислоты, имеющей от 8 до 12 атомов углерода), циклодекстрин, бензалконийхлорид (BAK), ЭДТА, каприловую кислоту, лимонную кислоту, борную кислоту, сорбиновую кислоту, полиоксиэтилен-20-стеариловый эфир (РСО), полиэтоксилированное касторовое масло (PCO), натриевую соль дезоксихолевой кислоты (DC), хлорид цетилпиридиния (CPC), лаурокапрам, гексаметиленелаурамид, гексаметиленоктанамид, децилметилсульфоксид, метилсульфон, диметилсульфоксид и их комбинации.
[00211] Количество агента, усиливающего проникновение в роговицу, можно регулировать для достижения желаемых рабочих характеристик водного офтальмологического раствора. В некоторых вариантах реализации агент, усиливающий проникновение в роговицу, присутствует в количестве менее около 10% (мас./об.), 5% (мас./об.), 1% (мас./об.) или 0,1% (мас./об.) водного офтальмологического раствора. В некоторых других вариантах реализации агент, усиливающий проникновение в роговицу, присутствует в количестве от около 0,01% (мас./об.) до около 5% (мас./об.), от около 0,01% (мас./об.) до около 1% (мас./об.), от около 0,1% (мас./об.) до около 1% (мас./об.), от около 0,05% (мас./об.) до около 5% (мас./об.), от около 0,05% (мас./об.) до около 0,5% (мас./об.), от около 1% (мас./об.) до около 3% (мас./об.) или от около 2% (мас./об.) до около 4% (мас./об.) водного офтальмологического раствора.
F. Солюбилизирующий агент
[00212] Водный офтальмологический раствор может необязательно содержать один или несколько солюбилизирующих агентов для улучшения растворимости фентоламина (или его фармацевтически приемлемой соли) в водном офтальмологическом растворе. Типичные солюбилизирующие агенты включают, например, сложный эфир поли-низшего алкиленгликоля глицерина жирной кислоты (т.е. линейный или разветвленный C1-C7), сложный эфир поли-низшего алкиленгликоля жирной кислоты, полиалкиленгликоль (например, полиэтиленгликоль), глицериновый эфир витамина E, токоферол полиэтиленгликоль 1000 сукцинат (TPGS), тилоксапол, полисорбат 20, полисорбат 40, полисорбат 60, полисорбат 80, поверхностно-активные вещества полиоксиэтилен/полиоксипропилен (например, Pluronic F-68, F-84 и P-103), циклодекстрин, модифицированные циклодекстрины и их комбинации. В некоторых вариантах реализации солюбилизирующий агент представляет собой модифицированный циклодекстрин, например, продаваемый под торговой маркой CAPTISOL®.
[00213] Количество солюбилизирующего агента можно регулировать для достижения желаемых рабочих характеристик водного офтальмологического раствора. В некоторых вариантах реализации солюбилизирующий агент присутствует в количестве менее около 10% (мас./об.), 5% (мас./об.), 3% (мас./об.), 1% (мас./Об.) или 0,1%. (мас./об.) водного офтальмологического раствора. В некоторых других вариантах реализации солюбилизирующий агент присутствует в количестве от около 0,01% (мас./об.) до около 5% (мас./об.), от около 0,01% (мас./об.) до около 1% (мас./об.), от около 0,1% (мас./об.) до около 1% (мас./об.), от около 0,05% (мас./об.) до около 5% (мас./об.) или от около 0,05% (мас./об.) до около 0,5% (мас./об.) водного офтальмологического раствора.
G. Стабилизирующий агент
[00214] Водный офтальмологический раствор может необязательно содержать один или несколько стабилизирующих агентов для улучшения стабильности водного офтальмологического раствора при хранении и т.д. Стабилизирующие агенты, описанные в фармацевтической литературе, считаются пригодными для использования в водных офтальмологических растворах, описанных в данном документе. Примеры стабилизирующих агентов включают спирт (например, полиолы, такие как маннит, глицерин, пропиленгликоль, сорбитол и ксилит), полиалкиленгликоли, такие как полиэтиленгликоль, полипропиленгликоль, полиэтиленгликоль-нонфеноловый эфир, полиэтиленгликольсорбитанмонолаурат, полиэтиленгликольсорбитанмонолаурат моноолеат, полиэтиленгликольсорбитан моноолеат, стерат полиэтиленгликоля, эфир полиэтиленгликоля и полипропиленгликоля, поливиниловый спирт, поливинилпирролидин, аскорбиновая кислота, витамин E, N-ацетилкарнозин (NAC), сорбиновая кислота и их комбинации. В некоторых вариантах реализации стабилизирующий агент представляет собой полимер, такой как один из упомянутых выше полимеров.
[00215] Количество стабилизирующего агента можно регулировать для достижения желаемых рабочих характеристик водного офтальмологического раствора. В некоторых вариантах реализации стабилизирующий агент присутствует в количестве менее около 10% (мас./об.), 5% (мас./об.) или 1% (мас./об.) водного офтальмологического раствора. В некоторых других вариантах реализации стабилизирующий агент присутствует в количестве от около 0,01% (мас./об.) до около 5% (мас./об.), от около 0,01% (мас./об.) до около 1% (мас./об.) или от около 0,01% (мас./об.) до около 0,1% (мас./об.) водного офтальмологического раствора.
H. Поверхностно-активное вещество
[00216] Водный офтальмологический раствор может необязательно содержать одно или несколько поверхностно-активных веществ. Примеры поверхностно-активных веществ включают полисорбат 20 (т.е. полиоксиэтилен (20) монолаурат сорбитана), полисорбат 40 (т.е. полиоксиэтилен (20) монопальмитат сорбитана), полисорбат 60 (т.е. полиоксиэтилен (20) моностеарат сорбитана), полисорбат 80 (полиоксиэтилен (20) моноолеат сорбитана), глицерилстеарат, изопропилстеарат, полиоксилстеарат, стеарат пропиленгликоля, стеарат сахарозы, полиэтиленгликоль, оксид полипропилена, сополимер полипропиленоксида, Pluronic F68, Pluronic F-84, Pluronic P-103, этоксилат спирта, этоксилат алкилфенола, алкилгликозид, алкилполигликозид, жирный спирт, гидроксипропилметилцеллюлоза (HPMC), карбоксиметилцеллюлозу (CMC), циклодекстрин, полиакриловую кислоту, фосфатидилхолин, фосфатидилсерин и их комбинации.
[00217] Количество поверхностно-активного вещества можно регулировать для достижения желаемых рабочих характеристик водного офтальмологического раствора. В некоторых вариантах реализации поверхностно-активное вещество присутствует в количестве менее около 10% (мас./об.), 5% (мас./об.), 3% (мас./об.), 1% (мас./об.) или 0,1% (мас./об.) водного офтальмологического раствора. В некоторых других вариантах реализации поверхностно-активное вещество присутствует в количестве от около 0,01% (мас./об.) до около 5% (мас./об.), от около 0,01% (мас./об.) до около 1% (мас./об.), от около 0,1% (мас./об.) до около 1% (мас./об.), от около 0,05% (мас./об.) до около 5% (мас./об.) или от около 0,05% (мас./об.) до около 0,5% (мас./об.) водного офтальмологического раствора.
I. Смягчающие полимеры
[00218] Водный офтальмологический раствор может необязательно содержать один или несколько смягчающих полимеров. Благодаря своей способности удерживать большое количество воды смягчающие полимеры полезны для покрытия и увлажнения роговицы глаза. Типичные смягчающие полимеры включают производные целлюлозы, декстран 40, декстран 70, желатин и жидкие полиолы.
J. Смачивающие агенты
[00219] Водный офтальмологический раствор может необязательно содержать один или несколько смачивающих агентов. Смачивающие агенты можно использовать для увлажнения поверхности глаза. Примеры смачивающих агентов включают полисорбаты, полоксамеры, тилоксапол и лецитин.
K. Дополнительные материалы
[00220] Водные офтальмологические растворы могут необязательно содержать один или несколько дополнительных материалов, таких как ацетилцистеин, цистеин, гидросульфит натрия, бутилгидроксианизол, бутилгидрокситолуол, ацетат альфа-токоферола, тиомочевину, тиосорбитол, диоктилсульфосукцинат натрия, монотиоглицерин, сложный эфир сорбита лауриновой кислоты, олеат триэтаноламина или сложные эфиры пальмитиновой кислоты.
[00221] Кроме того, водные офтальмологические растворы могут содержать носитель, такой как один или несколько типичных носителей, описанных, например, в Martin, Remington’s Pharmaceutical Sciences, 15th Ed., Mack Publ. Co., Easton, PA [1975]). Носитель может быть, например, смесью воды и смешивающегося с водой растворителя (например, спирта, такого как глицерин, растительное масло или минеральное масло). Другие иллюстративные носители включают смесь воды и одного или нескольких из следующих материалов: гидроксиэтилцеллюлоза, карбоксиметилцеллюлоза, метилцеллюлоза, соль карбоксиметилцеллюлозы щелочного металла, гидроксиметилцеллюлоза, метилгидроксипропилцеллюлоза, гидроксипропилцеллюлоза, этилолеат, поливинилпирролидон, поливинилпирролидон, акрилатный полимер, метакрилатный полимер, полиакриламид, желатин, альгинат, пектин, трагакант, камедь карайи, ксантановая камедь, каррагенин, агар, аравийская камедь, крахмал (такой как ацетат крахмала или гидроксипропилкрахмал), поливиниловый спирт, поливинилметиловый эфир, полиэтиленоксид или поперечно-сшитая полиакриловая кислота.
Примеры водных офтальмологических растворов
[00222] Водные офтальмологические растворы, в целом описанные выше, теперь будут более конкретно описаны со ссылкой на следующие более конкретные примеры. Следующие более конкретные примеры являются только иллюстративными и никоим образом не предназначены для ограничения объема изобретения.
[00223] Один такой примерный раствор представляет собой водный офтальмологический раствор, свободный от хелатирующий агент, содержащий: (а) от около 0,1% (мас./об.) до около 2% (мас./об.) мезилата фентоламина; (б) от около 1% (мас./об.) до около 6% (мас./об.) по меньшей мере одного полиольные соединения, выбранного из группы, состоящей из маннита, глицерина и пропиленгликоля; (в) от около 1 мМ до около 6 мМ ацетата щелочного металла; и (г) воду; причем раствор имеет pH в диапазоне от 4 до 6 и свободен от хелатирующего агента.
[00224] Водный офтальмологический раствор может быть более конкретно определен в соответствии со следующими вариантами реализации. Например, в некоторых вариантах реализации водный офтальмологический раствор содержит от около 0,25% (мас./об.) до около 1% (мас./об.) мезилата фентоламина. В некоторых вариантах реализации водный офтальмологический раствор содержит от около 1% (мас./об.) до около 4% (мас./об.) маннита. В некоторых других вариантах реализации водный офтальмологический раствор содержит 4% (мас./об.) маннита. В некоторых вариантах реализации ацетат щелочного металла представляет собой ацетат натрия. В некоторых других вариантах реализации водный офтальмологический раствор содержит 3 мМ ацетата натрия. В других вариантах реализации водный офтальмологический раствор состоит из (i) от около 0,25% (мас./об.) до около 1% (мас./Об.) мезилата фентоламина; (ii) от около 1% (мас./об.) до около 6% (мас./об.) одного или нескольких соединений полиола, выбранных из группы, состоящей из маннита, глицерина и пропиленгликоля; (iii) от около 1 мМ до около 6 мМ ацетата щелочного металла; (iv) уксусной кислоты; и (v) воды; причем раствор имеет pH в диапазоне от 4 до 6.
[00225] Другой такой примерный раствор представляет собой водный офтальмологический раствор, свободный от хелатирующего агента, содержащий: (а) от около 0,5% (мас./об.) до около 2% (мас./об.) мезилата фентоламина; (б) от около 1% (мас./об.) до около 6% (мас./об.) по меньшей мере одного полиольные соединения, выбранного из группы, состоящей из маннита, глицерина и пропиленгликоля; (в) от около 1 мМ до около 6 мМ ацетата щелочного металла; и (г) воду; причем раствор имеет pH в диапазоне от 4,5 до 5,5 и свободен от хелатирующего агента.
[00226] Водный офтальмологический раствор может быть более конкретно определен в соответствии со следующими вариантами реализации. Например, в некоторых вариантах реализации по меньшей мере один полиол представляет собой маннит. В некоторых вариантах реализации водный офтальмологический раствор содержит от около 1% (мас./об.) до около 4% (мас./об.) маннита. В некоторых других вариантах реализации водный офтальмологический раствор содержит 4% (мас./об.) маннита. В некоторых вариантах реализации ацетат щелочного металла представляет собой ацетат натрия. В некоторых других вариантах реализации водный офтальмологический раствор содержит 3 мМ ацетата натрия. В других вариантах реализации водный офтальмологический раствор состоит из (i) от около 0,5% (мас./об.) до около 2% (мас./об.) мезилата фентоламина; (ii) от около 1% (мас./об.) до около 6% (мас./об.) одного или нескольких соединений полиола, выбранных из группы, состоящей из маннита, глицерина и пропиленгликоля; (iii) от около 1 мМ до около 6 мМ ацетата щелочного металла; (iv) уксусной кислоты; и (v) воды; при этом раствор имеет pH в диапазоне от 4,5 до 5,5.
[00227] Другой такой примерный раствор представляет собой водный офтальмологический раствор, свободный от хелатирующего агента, содержащий: (а) от около 0,25% (мас./об.) до около 2% (мас./об.) мезилата фентоламина; (б) от около 1% (мас./об.) до около 6% (мас./об.) по меньшей мере одного полиольные соединения, выбранного из группы, состоящей из маннита, глицерина и пропиленгликоля; (в) от около 1 мМ до около 6 мМ ацетата щелочного металла; и (г) воду; причем раствор имеет pH в диапазоне от 4,5 до 5,5 и свободен от хелатирующего агента.
[00228] Водный офтальмологический раствор может быть более конкретно определен в соответствии со следующими вариантами реализации. Например, в некоторых вариантах реализации водный офтальмологический раствор содержит от около 0,25% (мас./об.) до около 1% (мас./об.) мезилата фентоламина. В некоторых других вариантах реализации водный офтальмологический раствор содержит от около 1% (мас./об.) до около 4% (мас./об.) маннита. В некоторых других вариантах реализации водный офтальмологический раствор содержит 4% (мас./об.) маннита. В некоторых вариантах реализации ацетат щелочного металла представляет собой ацетат натрия. В некоторых других вариантах реализации водный офтальмологический раствор содержит 3 мМ ацетата натрия. В других вариантах реализации водный офтальмологический раствор состоит из (i) от около 0,5% (мас./об.) до около 1% (мас./об.) мезилата фентоламина; (ii) от около 1% (мас./об.) до около 6% (мас./об.) одного или нескольких соединений полиола, выбранных из группы, состоящей из маннита, глицерина и пропиленгликоля; (iii) от около 1 мМ до около 6 мМ ацетата щелочного металла; (iv) уксусной кислоты; и (v) воды; при этом раствор имеет pH в диапазоне от 4,5 до 5,5.
[00229] Дополнительные примерные водные офтальмологические растворы представлены в Таблицах 1-3 ниже, причем в каждом случае раствор имеет pH в диапазоне от 4,7 до 5,1.
(% мас./об.)
(% мас./об.)
об.)
об.)
[00230] Другой примерный водный офтальмологический раствор содержит мезилат фентоламина (например, 1% мас./об.), маннит (например, 4% мас./об.), декстран, имеющий средневесовую молекулярную массу около 70000 г/моль (например, 0,1% мас./об.), гидроксипропилметилцеллюлозу (например, 0,3% мас./об.), хлорид калия, очищенную воду, борат натрия и хлорид натрия; причем раствор имеет pH в диапазоне от около 4 до около 6. В некоторых вариантах реализации раствор имеет pH в диапазоне от 4,5 до 5,1. В некоторых вариантах реализации водный офтальмологический раствор состоит по сути из мезилата фентоламина (например, 1% мас./об.), маннита (например, 4% мас./об.), декстрана, имеющего средневесовую молекулярную массу около 70000 г/моль (например, 0,1% мас./об.), гидроксипропилметилцеллюлозы (например, 0,3% мас./об.), хлорида калия, очищенной воды, бората натрия и хлорида натрия; при этом раствор имеет pH в диапазоне от 4 до 6. В некоторых других вариантах реализации водный офтальмологический раствор состоит из мезилата фентоламина (например, 1% мас./об.), маннита (например, 4% мас./об.), декстрана, имеющего средневесовую молекулярную массу около 70000 г/моль (например, 0,1% мас./об.), гидроксипропилметилцеллюлозы (например, 0,3% мас./об.), хлорида калия, очищенной воды, бората натрия и хлорида натрия; причем раствор имеет pH в диапазоне от 4,5 до 5,1.
[00231] Другой примерный водный офтальмологический раствор содержит мезилат фентоламина (например, 1% мас./об.), маннит (например, 4% мас./об.), ацетат натрия (например, 3 мМ) и воду, причем раствор имеет pH в диапазоне от около 4 до около 6. В некоторых вариантах реализации раствор имеет pH в диапазоне от 4,5 до 5,1. В некоторых вариантах реализации водный офтальмологический раствор состоит по сути из мезилата фентоламина (например, 1% мас./об.), маннита (например, 4% мас./об.), ацетата натрия (например, 3 мМ) и воды, причем раствор имеет pH в диапазоне от 4 до 6. В некоторых вариантах реализации водный офтальмологический раствор содержит 1% мезилата фентоламина, 4% маннита, 3 мМ ацетата натрия и воду, причем pH раствора находится в диапазоне от 4,5 до 5,1. В некоторых других вариантах реализации водный офтальмологический раствор состоит из мезилата фентоламина (например, 1% мас./Об.), маннита (например, 4% мас./об.), ацетата натрия (например, 3 мМ) и воды, причем раствор имеет pH в диапазоне от 4,5 до 5,1. В некоторых вариантах реализации водный офтальмологический раствор состоит по сути из 1% мас./об. мезилата фентоламина, 4% мас./об. маннита, 3 мМ ацетата натрия и воды, причем раствор имеет pH в диапазоне от 4,5 до 5,1.
[00232] Еще один примерный раствор представляет собой водный офтальмологический раствор, свободный от хелатирующего агента, который содержит: (а) от около 0,1% (мас./об.) до около 2% (мас./об.) мезилата фентоламина; (б) от около 1% (мас./об.) до около 6% (мас./об.) по меньшей мере одного полиольные соединения, выбранного из группы, состоящей из маннита, глицерина и пропиленгликоля; (в) от около 1 мМ до около 6 мМ ацетата щелочного металла; и (г) воду; причем раствор имеет pH в диапазоне от 4 до 6 и свободен от хелатирующего агента.
[00233] Еще один примерный раствор представляет собой водный офтальмологический раствор, свободный от хелатирующего агента, который содержит: (а) от около 0,25% (мас./об.) до около 2% (мас./об.) мезилата фентоламина; (б) от около 3% (мас./об.) до около 5% (мас./об.) маннита; (в) от около 2 мМ до около 4 мМ ацетата щелочного металла; и (г) воду; причем раствор имеет pH в диапазоне от 4,6 до 5,2 и свободен от хелатирующего агента.
[00234] Еще один примерный раствор представляет собой водный офтальмологический раствор, свободный от хелатирующего агента, который содержит: (а) от около 0,1% (мас./об.) до около 2% (мас./об.) мезилата фентоламина; (б) от около 3% (мас./об.) до около 5% (мас./об.) маннита; (в) от около 2 мМ до около 4 мМ ацетата натрия; и (г) воду; причем раствор имеет pH в диапазоне от 4,6 до 5,2 и свободен от хелатирующего агента. В некоторых вариантах реализации водный офтальмологический раствор, свободный от хелатирующего агента, содержит от около 0,25% (мас./об.) до около 1% (мас./об.) мезилата фентоламина.
[00235] Еще один примерный раствор представляет собой водный офтальмологический раствор, свободный от хелатирующего агента, содержащий: (а) от около 0,25% (мас./об.) до около 2% (мас./об.) мезилата фентоламина; (б) от около 3% (мас./об.) до около 5% (мас./об.) маннита; (в) от около 2 мМ до около 4 мМ ацетата натрия; и (г) воду; причем раствор имеет pH в диапазоне от 4,5 до 5,2 и свободен от хелатирующего агента.
[00236] Еще один примерный раствор представляет собой водный офтальмологический раствор, свободный от хелатирующего агента, который содержит: (а) от около 0,5% (мас./об.) до около 2% (мас./об.) мезилата фентоламина; (б) от около 3% (мас./об.) до около 5% (мас./об.) маннита; (в) от около 2 мМ до около 4 мМ ацетата натрия; и (г) воду; причем раствор имеет pH в диапазоне от 4,6 до 5,2 и свободен от хелатирующего агента.
[00237] Еще один примерный раствор представляет собой водный офтальмологический раствор, свободный от хелатирующего агента, который содержит: (а) от около 0,5% (мас./об.) до около 1% (мас./об.) мезилата фентоламина; (б) от около 3% (мас./об.) до около 5% (мас./об.) маннита; (в) от около 1 мМ до около 4 мМ ацетата натрия; и (г) воду; причем раствор имеет pH в диапазоне от 4,6 до 5,2 и свободен от хелатирующего агента.
[00238] Еще один примерный раствор представляет собой водный офтальмологический раствор, свободный от хелатирующего агента, содержащий: (а) от около 0,1% (мас./об.) до около 1% (мас./об.) мезилата фентоламина; (б) около 4% маннита; (в) около 3 мМ ацетата натрия; и (г) воду; причем раствор имеет pH в диапазоне от 4,6 до 5,2 и свободен от хелатирующего агента. В некоторых вариантах реализации водный офтальмологический раствор, свободный от хелатирующего агента, содержит от около 0,25% (мас./об.) до около 1% (мас./об.) мезилата фентоламина.
[00239] Еще один примерный раствор представляет собой водный офтальмологический раствор, свободный от хелатирующего агента, содержащий: (а) от около 0,5% (мас./об.) до около 1% (мас./об.) мезилата фентоламина; (б) около 4% маннита; (в) около 3 мМ ацетата натрия; и (г) воду; причем раствор имеет pH в диапазоне от 4,6 до 5,2 и свободен от хелатирующего агента.
[00240] Еще один примерный раствор представляет собой водный офтальмологический раствор, свободный от хелатирующего агента, содержащий: (а) от около 0,25% (мас./об.) до около 2% (мас./об.) мезилата фентоламина; (б) от около 3% (мас./об.) до около 5% (мас./об.) маннита; (в) от около 2 мМ до около 4 мМ буфера содержащего ацетата натрия; и (г) воду; причем раствор имеет pH в диапазоне от 4,5 до 5,2 и свободен от хелатирующего агента.
[00241] Еще один примерный раствор представляет собой водный офтальмологический раствор, свободный от хелатирующего агента, который содержит: (а) от около 0,5% (мас./об.) до около 2% (мас./об.) мезилата фентоламина; (б) от около 3% (мас./об.) до около 5% (мас./об.) маннита; (в) от около 2 мМ до около 4 мМ буфера содержащего ацетата натрия; и (г) воду; причем раствор имеет pH в диапазоне от 4,6 до 5,2 и свободен от хелатирующего агента.
[00242] Еще один примерный раствор представляет собой водный офтальмологический раствор, свободный от хелатирующего агента, который содержит: (а) от около 0,5% (мас./об.) до около 1% (мас./об.) мезилата фентоламина; (б) от около 3% (мас./об.) до около 5% (мас./об.) маннита; (в) от около 1 мМ до около 4 мМ буфера содержащего ацетата натрия; и (г) воду; причем раствор имеет pH в диапазоне от 4,6 до 5,2 и свободен от хелатирующего агента.
[00243] Еще один примерный раствор представляет собой водный офтальмологический раствор, свободный от хелатирующего агента, содержащий: (а) от около 0,1% (мас./об.) до около 1% (мас./об.) мезилата фентоламина; (б) около 4% маннита; (в) около 3 мМ буфера, содержащего ацетата натрия; и (г) воду; причем раствор имеет pH в диапазоне от 4,6 до 5,2 и свободен от хелатирующего агента. В некоторых вариантах реализации водный офтальмологический раствор, свободный от хелатирующего агента, содержит от около 0,25% (мас./об.) до около 1% (мас./об.) мезилата фентоламина.
[00244] Еще один примерный раствор представляет собой водный офтальмологический раствор, свободный от хелатирующего агента, содержащий: (а) от около 0,5% (мас./об.) до около 1% (мас./об.) мезилата фентоламина; (б) около 4% маннита; (в) около 3 мМ буфера содержащего ацетата натрия; и (г) воду; причем раствор имеет pH в диапазоне от 4,6 до 5,2 и свободен от хелатирующего агента.
[00245] Еще один примерный раствор представляет собой водный офтальмологический раствор, свободный от хелатирующего агента, содержащий: (а) от около 0,25% (мас./об.) до около 2% (мас./об.) мезилата фентоламина; (б) от около 3% (мас./об.) до около 5% (мас./об.) маннита; (в) от около 2 мМ до около 4 мМ буфера, содержащего ацетат натрия; (г) воду; и (д) пилокарпин (например, от около 0,1% мас./мас. до около 1% мас./мас. пилокарпина); причем раствор имеет pH в диапазоне от 4,5 до 6,0 и свободен от хелатирующего агента.
[00246] Еще один примерный раствор представляет собой водный офтальмологический раствор, свободный от хелатирующего агента, который содержит: (а) от около 0,5% (мас./об.) до около 2% (мас./об.) мезилата фентоламина; (б) от около 3% (мас./об.) до около 5% (мас./об.) маннита; (в) от около 2 мМ до около 4 мМ буфера, содержащего ацетат натрия; (г) воду; и (д) пилокарпин (например, от около 0,1% мас./мас. до около 1% мас./мас. пилокарпина); причем раствор имеет pH в диапазоне от 4,6 до 6,0 и свободен от хелатирующего агента.
[00247] Еще один примерный раствор представляет собой водный офтальмологический раствор, свободный от хелатирующего агента, который содержит: (а) от около 0,5% (мас./об.) до около 1% (мас./об.) мезилата фентоламина; (б) от около 3% (мас./об.) до около 5% (мас./об.) маннита; (в) от около 1 мМ до около 4 мМ буфера, содержащего ацетат натрия; (г) воду; и (д) пилокарпин (например, от около 0,1% мас./мас. до около 1% мас./мас. пилокарпина); причем раствор имеет pH в диапазоне от 4,6 до 6,0 и свободен от хелатирующего агента.
[00248] Еще один примерный раствор представляет собой водный офтальмологический раствор, свободный от хелатирующего агента, содержащий: (а) от около 0,1% (мас./об.) до около 1% (мас./об.) мезилата фентоламина; (б) около 4% (мас./об.) маннита; (в) около 3 мМ буфера, содержащего ацетат натрия; (г) воду; и (д) пилокарпин (например, от около 0,1% мас./мас. до около 1% мас./мас. пилокарпина); причем раствор имеет pH в диапазоне от 4,6 до 6,0 и свободен от хелатирующего агента. В некоторых вариантах реализации водный офтальмологический раствор, свободный от хелатирующего агента, содержит от около 0,25% (мас./об.) до около 1% (мас./об.) мезилата фентоламина.
[00249] Еще один примерный раствор представляет собой водный офтальмологический раствор, свободный от хелатирующего агента, содержащий: (а) от около 0,5% (мас./об.) до около 1% (мас./об.) мезилата фентоламина; (б) около 4% (мас./об.) маннита; (в) около 3 мМ буфера, содержащего ацетат натрия; (г) воду; и (д) пилокарпин (например, от около 0,1% мас./мас. до около 1% мас./мас. пилокарпина); причем раствор имеет pH в диапазоне от 4,6 до 6,0 и свободен от хелатирующего агента.
[00250] Еще один примерный раствор представляет собой водный офтальмологический раствор, содержащий: (а) от около 0,25% (мас./об.) до около 2% (мас./об.) мезилата фентоламина; (б) от около 3% (мас./об.) до около 5% (мас./об.) маннита; (в) от около 2 мМ до около 4 мМ буфера, содержащего ацетат натрия; (г) воду; и (д) пилокарпин (например, от около 0,1% мас./мас. до около 1% мас./мас. пилокарпина); причем раствор имеет pH в диапазоне от 4,5 до 6,0.
[00251] Еще один примерный раствор представляет собой водный офтальмологический раствор, содержащий: (а) от около 0,5% (мас./об.) до около 2% (мас./об.) мезилата фентоламина; (б) от около 3% (мас./об.) до около 5% (мас./об.) маннита; (в) от около 2 мМ до около 4 мМ буфера, содержащего ацетат натрия; (г) воду; и (д) пилокарпин (например, от около 0,1% мас./мас. до около 1% мас./мас. пилокарпина); причем раствор имеет pH в диапазоне от 4,6 до 6,0.
[00252] Еще один примерный раствор представляет собой водный офтальмологический раствор, содержащий: (а) от около 0,5% (мас./об.) до около 1% (мас./об.) мезилата фентоламина; (б) от около 3% (мас./об.) до около 5% (мас./об.) маннита; (в) от около 1 мМ до около 4 мМ буфера, содержащего ацетат натрия; (г) воду; и (д) пилокарпин (например, от около 0,1% мас./мас. до около 1% мас./мас. пилокарпина); причем раствор имеет pH в диапазоне от 4,6 до 6,0.
[00253] Еще один примерный раствор представляет собой водный офтальмологический раствор, содержащий: (а) от около 0,1% (мас./об.) до около 1% (мас./об.) мезилата фентоламина; (б) около 4% (мас./об.) маннита; (в) около 3 мМ буфера, содержащего ацетат натрия; (г) воду; (д) пилокарпин (например, от около 0,1% мас./мас. до около 1% мас./мас. пилокарпина); и (е) глицерин; причем раствор имеет pH в диапазоне от 4,6 до 6,0. В некоторых вариантах реализации водный офтальмологический раствор, свободный от хелатирующего агента, содержит от около 0,25% (мас./об.) до около 1% (мас./об.) мезилата фентоламина.
[00254] Еще один примерный раствор представляет собой водный офтальмологический раствор, содержащий: (а) от около 0,5% (мас./об.) до около 1% (мас./об.) мезилата фентоламина; (б) около 4% (мас./об.) маннита; (в) около 3 мМ буфера, содержащего ацетат натрия; (г) воду; (д) пилокарпин (например, от около 0,1% мас./мас. до около 1% мас./мас. пилокарпина); и (е) глицерин; причем раствор имеет pH в диапазоне от 4,6 до 6,0.
Признаки стабильности водных офтальмологических растворов
[00255] Описанные в данном документе водные офтальмологические растворы могут быть дополнительно охарактеризованы в соответствии с их признаками стабильности, такими как процентное содержание фентоламина (или его фармацевтически приемлемой соли), которое присутствует в водном офтальмологическом растворе после хранения в течение определенного периода времени. Как объяснено выше, одним из преимуществ данных водных офтальмологических растворов является то, что они обладают хорошей стабильностью в течение продолжительных периодов времени, даже если они не содержат хелатирующего агента.
[00256] Соответственно, в некоторых вариантах реализации водный офтальмологический раствор характеризуется тем, что менее чем 2% по массе фентоламина или его фармацевтически приемлемой соли разлагается при хранении раствора при 25°C в течение 12 недель. В некоторых других вариантах реализации водный офтальмологический раствор характеризуется тем, что менее 2% по массе фентоламина или его фармацевтически приемлемой соли разлагается при хранении при 25°C в течение 24 недель (или 36 недель, или 48 недель). В других вариантах реализации менее 7% по массе фентоламина или его фармацевтически приемлемой соли разлагается при хранении при 40°C в течение 12 недель (или 24, 36 или 48 недель). В других вариантах реализации водный офтальмологический раствор характеризуется тем, что менее 10% по массе фентоламина или его фармацевтически приемлемой соли разлагается при хранении при 25°C в течение 18 месяцев, 24 месяцев или 36 месяцев. В других вариантах реализации водный офтальмологический раствор характеризуется тем, что менее 10% по массе фентоламина или его фармацевтически приемлемой соли разлагается при хранении при температуре в диапазоне 2-8°C в течение 18 месяцев, 24 месяцев или 36 месяцев. В других вариантах реализации водный офтальмологический раствор характеризуется тем, что менее 4% по массе (или предпочтительно менее 3% по массе) фентоламина или его фармацевтически приемлемой соли разлагается при хранении при 25°C в течение 18 месяцев, 24 месяцев, или 36 месяцев. В других вариантах реализации менее 10% по массе фентоламина или его фармацевтически приемлемой соли разлагается при хранении при 40°C в течение 4, 5 или 6 месяцев.
Состав искусственных слез на основе поливинилпирролидона
[00257] Другой офтальмологический раствор, предполагаемый для использования в данном изобретении, представляет собой офтальмологический раствор, содержащий терапевтический агент (например, альфа-адренергический антагонист, такой как фентоламин или его фармацевтически приемлемую соль) и композицию искусственных слез на основе поливинилпирролидона. Примерные композиции искусственных слез из поливинилпирролидона описаны, например, в патентах U.S. № 5895654; 5627611; и 5591426; и публикации патентной заявки U.S. № 2002/0082288, содержание которых включены в данный документ посредством ссылки. Подразумевается, что композиции искусственных слез способствуют смачиванию и растеканию, имеют хорошее удерживание и стабильность на глазу и, желательно, не вызывают какого-либо значительного дискомфорта у пользователя. Соответственно, примерная композиция искусственной слезы из поливинилпирролидона содержит: (1) поливинилпирролидон, предпочтительно в количестве около 0,1-5% от массы раствора; (2) хлорид бензалкония, предпочтительно в количестве около 0,01-0,10% от массы раствора; (3) гидроксипропилметилцеллюлозу, предпочтительно в количестве около 0,2-1,5% от массы раствора; (4) глицерин, предпочтительно в количестве около 0,2-1,0% от массы раствора, и (5) воду, причем композиция представляет собой водный раствор, имеющий изотонические свойства.
Системы доставки с пролонгированным высвобождением
[00258] Когда желательно обеспечить пролонгированное высвобождение одного или нескольких терапевтических агентов для пациента, терапевтический(ые) агент(ы) можно вводить пациенту в форме системы доставки с пролонгированным высвобождением. Системы доставки с пролонгированным высвобождением описаны в опубликованной литературе. Примерные системы доставки с пролонгированным высвобождением включают интраканаликулярные вставки, контактную линзу с пролонгированным высвобождением, биоразлагаемую вставку IVT и внутрикамерную вставку. Вставки могут быть биоразлагаемыми или не биоразлагаемыми. Примеры материалов, описанных в литературе для использования в системах доставки с пролонгированным высвобождением, включают смесь полимеров EVA и PVA, смесь силикона и полимера PVA, смесь полиимида и полимера PVA, смесь полимеров PMMA и EVA, полимер PLGA и липосомы. В некоторых вариантах реализации офтальмологический раствор может содержать масло, такое как масло, с достаточно высокой вязкостью, чтобы препятствовать удалению активного ингредиента с поверхности глаза, когда аликвоту офтальмологического раствора наносят на поверхность глаза.
IV. Медицинские наборы
[00259] Другой аспект изобретения обеспечивает медицинский набор, содержащий, например, (i) терапевтический агент, описанный в данном документе, и (ii) инструкции по лечению пресбиопии, мидриаза и/или других глазных расстройств в соответствии со способами, описанными в данном документе.
ПРИМЕРЫ
[00260] Изобретение, которое теперь описывается в целом, будет легче понять со ссылкой на следующие примеры, которые включены только в целях иллюстрации определенных аспектов и вариантов реализации данного изобретения и не предназначены для ограничения изобретения.
ПРИМЕР 1 - Лечение пресбиопии у людей мезилатом фентоламина
[00261] Способность мезилата фентоламина лечить человека, страдающего пресбиопией, можно оценить в соответствии с клиническим исследованием, в котором водный офтальмологический раствор, содержащий мезилат фентоламина, вводят в глаз пациента и затем оценивают улучшение зрительных характеристик пациента, включая зрительные характеристики на близком расстоянии. Ниже описаны экспериментальные процедуры и результаты.
Часть I - Экспериментальные процедуры
[00262] Люди проходят скрининг на предмет потенциального включения в исследование и, если они соответствуют требованиям, включаются в исследование. Примерные критерии включения и критерии исключения для исследования изложены ниже. Если субъект не соответствует критериям включения/исключения, но исследователь считает, что субъект должен участвовать в исследовании, может быть разрешено отклонение после обсуждения между главным исследователем и спонсором исследования.
Критерии включения
От 45 до 55 лет.
Скорректированная острота зрения вблизи хуже 20/40.
Наилучшая скорректированная острота зрения вдаль 20/20 или выше для каждого глаза.
Способен и желает дать информированное согласие и соблюдать все предусмотренные протоколом процедуры.
Критерий исключения
Определенные характеристики зрачка.
Значительный астигматизм, глаукома, диабет, катаракта, хирургия глаза, травма глаза или проблемы с аккомодацией.
Ношение контактных линз в течение 3 дней до и во время исследования.
Использование запрещенного лекарства.
Участие в любом исследовательском исследовании в течение последних 30 дней.
[00263] Люди, включенные в исследование, должны быть рандомизированы на две (или более) группы лечения с рандомизацией 1:1. Группы лечения получат разовые дозы либо:
Офтальмологический раствор плацебо,
1% мас./мас. офтальмологический раствор мезилата фентоламина или
2% мас./мас. офтальмологический раствор мезилата фентоламина.
Описание исследуемых препаратов представлено в Таблице 1.
3 мМ ацетат натрия
вода
pH в диапазоне от 4,8 до 5,0
4% мас./мас. маннита
3 мМ ацетат натрия
вода
pH в диапазоне от 4,8 до 5,0
4% мас./мас. маннита
3 мМ ацетат натрия
вода
pH в диапазоне от 4,8 до 5,0
[00264] Дозы исследуемого препарата вводятся один раз в день в течение одной или нескольких недель. Будут оцениваться зрительные характеристики, что может включать анализ остроты зрения вблизи, наилучшую скорректированную остроту зрения вдаль (НСОЗВ), скорректированную остроту зрения вблизи (СОЗВ) и/или опросник по зрению.
ПРИМЕР 2 - Лечение пресбиопии у людей мезилатом фентоламина
[00265] Способность мезилата фентоламина лечить человека, страдающего пресбиопией, можно оценить в соответствии с клиническим исследованием, в котором водный офтальмологический раствор, содержащий мезилат фентоламина, вводят в глаз пациента, и затем оценивают улучшение зрительных характеристик пациента включая зрительные характеристики вблизи. Ниже описаны экспериментальные процедуры и результаты.
Часть I - Экспериментальные процедуры
[00266] Люди проходят скрининг на предмет потенциального включения в исследование и, если они соответствуют требованиям, включаются в исследование. Примерные критерии включения и критерии исключения для исследования изложены ниже. Если субъект не соответствует критериям включения/исключения, но исследователь считает, что субъект должен участвовать в исследовании, может быть разрешено отклонение после обсуждения между главным исследователем и спонсором исследования.
Критерии включения
Имеет возможность и желание предоставить письменное информированное согласие и подписать Закон о преемственности страхования и отчетности в области здравоохранения (HIPAA) до проведения любой процедуры исследования.
Умеет и желает следовать всем инструкциям и посещать предусмотренные посещения исследования.
Быть в возрасте 48-64 лет любого пола и любой расы или этнической принадлежности на момент посещения 1.
Имеет пресбиопию от ранней до средней, определяемую скринингом монокулярной остроты зрения вдаль с наилучшей коррекцией (ОЗ) на расстоянии 45 см.
Умеет и желает избегать приема всех запрещенных лекарств в течение соответствующего периода вымывания и во время исследования без значительного риска для субъекта.
Критерий исключения
Быть женщиной детородного возраста, которая в настоящее время беременна, кормит грудью или планирует беременность.
Имеет известные противопоказания или чувствительность к использованию любого из исследуемых препаратов или их компонентов.
Имеет активную глазную инфекцию при посещении 1 (бактериальную, вирусную или грибковую), положительную историю болезни глазной герпетической инфекции, преаурикулярную лимфаденопатию или текущее активное глазное воспаление (например, средний или тяжелый блефарит, аллергический конъюнктивит, периферический язвенный кератит, склерит, увеит) в любом глазу.
Имеет сухой глаз средней или тяжелой степени.
Имеет клинически значимые патологические изменения хрусталика (например, катаракту), включая раннюю замену хрусталика и/или любые признаки помутнения среды в любом глазу.
Имеет пупиллометрию, адаптированную к темноте, < 4,0 мм на любом глазу.
Имеет внутриглазное давление (ВГД) менее 5 миллиметров ртутного столбика (мм рт. ст.) или более 22 мм рт. ст. в каждом глазу при посещении 1 или имеет предварительный диагноз глазной гипертензии или глаукомы, или в настоящее время лечится любым типом местных препаратов для снижения ВГД (глаукомы) при посещении 1.
Имеет аномальные результаты при осмотре расширенного глазного дна на любом глазу, задокументированные в течение 3 месяцев после посещения 1, или известную историю отслоения сетчатки или клинически значимого заболевания сетчатки на любом глазу.
Имеет в прошлом известную историю болезни или диагноз: ирит, склерит или увеит, активные или неактивные.
Перенес хирургическое вмешательство (глазное или системное) в течение 6 месяцев до визита 1 или имеет запланированное хирургическое вмешательство в течение 30 дней после визита 4.
Перенес рефракционные операции на глазу (послеоперационная кератотомия, фоторефрактивная кератэктомия [PRK], лазерный кератомилез in situ [LASIK], субэпителиальная кератэктомия с помощью лазера [LACOK]), процедуры наложения роговицы, удаление катаракты или установка интраокулярных линз.
Ежедневно использует искусственные слезы или смазывающую мазь для глаз.
Неспособен или отказывается от ношения мягких контактных линз за 7 дней до визита 1 и ношения жестких газопроницаемых (RGP) контактных линз за 14 дней до визита 1 и во время исследования.
Использует любое из следующих запрещенных лекарств в течение 2 недель (14 дней) до визита 1 и во время исследования: (1) наркотические (опиатные) обезболивающие (например, кодеин, OxyContin®, Vicodin®, Tramadol®); (2) лекарства для мочевого пузыря (например, Urecholine®, бетанехол); (3) нейролептики; (4) антидепрессанты; (5) лекарства от синдрома дефицита внимания/гиперактивности (СДВГ); (6) альфа-блокаторы (например, тамсулозин, Flomax®, Jayln®, Uroxatral®, Rapaflo®); (7) холинолитики (например, атропин, белладонна, бензтропин, дицикломин, донепезил, гиосциамин, пропантелин, скополамин, тригексфенидил); (8) агонисты мускариновых рецепторов или холинергические агонисты (например, Salagen®, Evoxac®); (9) антигистаминные или противоотечные средства, отпускаемые без рецепта или по рецепту; (10) любые прописанные местные офтальмологические препараты; или (11) наркотики для рекреации (например, марихуана, метадон, героин, кокаин).
Имеет диагноз сахарный диабет или повышенный уровень сахара в крови в истории болезни.
Имеет состояние или ситуацию, которые, по мнению исследователя, могут подвергнуть субъекта повышенному риску, спутать данные исследования или существенно повлиять на участие субъекта в исследовании, включая, помимо прочего, нестабильные: сердечно-сосудистые, печеночные, почечные, респираторные, желудочно-кишечные, эндокринные, иммунологические, дерматологические, гематологические, неврологические или психические заболевания.
[00267] Люди, включенные в исследование, должны быть рандомизированы на две (или более) группы лечения с рандомизацией 1:1. Группы лечения получат разовые дозы либо:
Офтальмологический раствор плацебо,
1% мас./мас. офтальмологический раствор мезилата фентоламина или
2% мас./мас. офтальмологический раствор мезилата фентоламина.
Описание исследуемых препаратов представлено в Таблице 1.
3 мМ ацетат натрия
вода
pH в диапазоне от 4,8 до 5,0
4% мас./мас. маннита
3 мМ ацетат натрия
вода
pH в диапазоне от 4,8 до 5,0
4% мас./мас. маннита
3 мМ ацетат натрия
вода
pH в диапазоне от 4,8 до 5,0
[00268] Дозы исследуемого препарата вводятся один раз в день в течение одной или нескольких недель. Будут оцениваться зрительные характеристики, что может включать анализ остроты зрения вблизи, наилучшую скорректированную остроту зрения вдаль (НСОЗВ), скорректированную остроту зрения вблизи с (СОЗВ) и/или опросник по зрению.
[00269] Одним из показателей эффективности является доля субъектов, у которых наблюдается улучшение по крайней мере на 3 строки (15 букв) в исследуемом глазу при измерении монокулярной остроты зрения на расстоянии 45 см с наилучшей коррекцией после лечения по сравнению с исходной монокулярной остротой зрения с наилучшей коррекцией на расстоянии 45 см через 7 часов после лечения.
[00270] Другим показателем эффективности является доля субъектов, у которых наблюдалось улучшение по меньшей мере на 3 строки (15 букв) в исследуемом глазу при измерении остроты зрения вблизи после лечения по сравнению с исходным уровнем, например, через 7 часов после лечения.
ПРИМЕР 3 - Лечение мидриаза у людей с помощью мезилата фентоламина
[00271] Способность мезилата фентоламина обращать фармакологически индуцированный мидриаз в глазах нормальных, здоровых людей оценивалась в соответствии с рандомизированным перекрестным двойным слепым плацебо-контролируемым клиническим исследованием. Приблизительно 32 субъекта были включены в исследование и рандомизированы в соотношении 1:1 в одну из двух последовательностей лечения. Всем субъектам сначала вводили мидриатический агент (фенилэфрин (2,5% мас./мас.) или тропикамид (1% мас./мас.)) путем доставки глазных капель, содержащих мидриатический агент, в глаза субъекта. Затем, через около час после приема мидриатического агента, субъекту вводили исследуемое лекарство в соответствии с Протоколом лечения 1 или Протоколом лечения 2.
[00272] В Протоколе лечения 1 субъект получал плацебо в первый день лечения (посещение 1/день 1) и получал 1% мас./мас. офтальмологического раствора мезилата фентоламина на второй день лечения (посещение 2/день 8+2 дня). В Протоколе лечения 2 субъект получал 1% мас./мас. офтальмологический раствор мезилата фентоламина в первый день лечения (посещение 1/день 1) и получал плацебо на второй день лечения (посещение 2/день 8+2 дня). Исследуемый глаз был определен как глаз с максимальным диаметром зрачка (через 1 час после закапывания мидриатического агента) при посещении 1. Если оба глаза имели максимально одинаковый диаметр зрачка, то исследуемый глаз был правым глазом. Это был глаз исследования для оценок посещения 1 и посещения 2.
[00273] Все лечение вводили субъекту в оба глаза. При каждом посещении измеряли диаметр зрачка, аккомодацию, остроту зрения (ОЗ) вблизи и вдаль и покраснение в каждом глазу до (-1 час/исходный уровень) и через 1 час (0 минут/максимум) после закапывания мидриатического агента в каждый глаз (т.е. непосредственно перед введением исследуемого препарата) и через 30 минут, 1 час, 2 часа, 4 часа и 6 часов после введения лечебной дозы. Были оценены эффективность и безопасность, включая анализ уменьшения диаметра зрачка. Дальнейшие аспекты экспериментальных процедур и результатов описаны ниже.
Часть I - Экспериментальные процедуры
[00274] Людей проверяли на предмет возможного включения в исследование и, если они соответствовали требованиям, включались в исследование. Критерии включения и исключения из исследования изложены ниже. Субъекты, включенные в исследование, были рандомизированы в соотношении 1:1 к одной из двух последовательностей лечения (первая последовательность лечения включала субъектов, получавших плацебо в первый день лечения и получавших 1% мас./мас. офтальмологического раствора мезилата фентоламина на второй день лечения; вторая последовательность лечения включала субъектов, получавших 1% мас./мас. офтальмологического раствора мезилата фентоламина в первый день лечения и получавших плацебо во второй день лечения). Рандомизация была стратифицирована мидриатическим агентом (фенилэфрин или тропикамид), при этом рандомизация в каждую группу ограничивалась примерно 16 субъектами (примерно половина рандомизированных субъектов получала фенилэфрин, половина - тропикамид). Субъекты получали мидриатический агент за 1 час до лечения. Посещение лечения 1 было в день 1, когда субъект получал первое лечение в его/ее последовательности лечения. Посещение лечения 2 было в день 8+2 дня, когда субъект получал второе лечение в его/ее последовательности лечения. Каждый субъект получал один и тот же мидриатический агент на протяжении всего исследования. Эффективность и безопасность оценивали, как описано ниже. Исследуемые препараты перечислены в Таблице 1.
4% мас./мас. маннита
3 мМ буфер, содержащий ацетат натрия и уксусную кислоту
вода
pH в диапазоне от 4,8 до 5,0
3 мМ буфер, содержащий ацетат натрия и уксусную кислоту
вода
pH в диапазоне от 4,8 до 5,0
Критерий включения
1. Мужчины или женщины ≥ 18 и ≤ 45 лет только с коричневыми радужками.
2. В остальном здоровые и хорошо контролируемые субъекты.
3. Имеет возможность соблюдать все предписанные протоколом процедуры и посещать все запланированные посещения в клинику.
4. Готов дать письменное информированное согласие на участие в этом исследовании.
Критерий исключения
1. По мнению исследователя, клинически значимое глазное заболевание (например, катаракта, глаукома, отек роговицы, увеит, тяжелый сухой кератоконъюнктивит), которое может помешать проведению исследования.
2. Нежелание или невозможность прекратить использование контактных линз во время лечебных визитов.
3. Травма глаза, глазная хирургия или лечение лазером без рефракции в течение 6 месяцев до обследования.
4. Глазные препараты любого вида в течение 30 дней после скрининга, за исключением а) скрабов для век (которые могли использоваться до, но не после скрининга) или б) смазывающие капли для лечения сухого глаза (искусственные слезы без консервантов), которые разрешалось использовать в промежутках между днями исследуемого лечения.
5. Недавние или текущие данные при скрининге глазной инфекции или воспаления. Текущие доказательства клинически значимого блефарита, конъюнктивита или истории болезни простого герпеса или кератита опоясывающего герпеса при скрининге.
6. История диабетической ретинопатии.
7. Закрытые или очень узкие углы, которые, по мнению исследователя, были потенциально закрытыми, если зрачок субъекта был расширен.
8. История любого травматического (хирургического или нехирургического) или нетравматического состояния, затрагивающего зрачок или радужку (например, зрачок неправильной формы, нейрогенное расстройство зрачка, атрофия радужки, иридотомия).
9. Известная аллергия или противопоказание к любому компоненту мидриатических агентов или композиции носителя.
10. Известная гиперчувствительность или противопоказания к антагонистам α- и/или β-адренорецепторов (например, хроническая обструктивная болезнь легких или бронхиальная астма; аномально низкое артериальное давление (АД) или частота сердечных сокращений (ЧСС); блокада сердца второй или третьей степени или застойная сердечная недостаточность (ЗСН); тяжелый диабет).
11. Клинически значимое системное заболевание (например, неконтролируемый диабет, тяжелая миастения, рак, печеночные, почечные, эндокринные или сердечно-сосудистые заболевания), которое может помешать исследованию.
12. Начало лечения или любые изменения в текущей дозировке, лекарстве или режиме любых местных или системных адренергических или холинергических препаратов не позднее, чем за 7 дней до скрининга или во время исследования.
13. Участие в любом исследовательском исследовании в течение 30 дней до скрининга.
14. Женщины детородного возраста, которые были беременны, кормили грудью, планировали беременность или не использовали приемлемые с медицинской точки зрения формы контроля над рождаемостью. Приемлемые способы включают использование по меньшей мере одного из следующих способов: внутриматочная спираль (ВМС), гормональное (пероральное, инъекционнре, пластырь, имплант, кольцо), барьер со спермицидом (презерватив, диафрагма) или воздержание. Считалось, что взрослая женщина имеет детородный потенциал, за исключением случаев, когда она была в постменопаузе в течение 1 года или после 3 месяцев после хирургической стерилизации. Все женщины детородного возраста должны иметь отрицательный результат анализа мочи на беременность при обследовании на скрининговом посещении 1 и посещении 2 и не должны намереваться забеременеть во время исследования.
15. ЧСС в покое за пределами нормального диапазона (50-110 ударов в минуту) во время скринингового посещения. Разрешалось повторить измерение ЧСС только один раз, если выходила за пределы нормального диапазона после по меньшей мере 5-минутного периода отдыха в сидячем положении.
16. Артериальная гипертония с диастолическим АД в покое >105 мм рт. ст. или систолическим АД >160 мм рт. ст. во время скринингового посещения. Разрешалось повторить измерение АД только один раз, если выходило за пределы указанного диапазона после по меньшей мере 5-минутного периода отдыха в сидячем положении.
[00275] Как указано в критериях исключения, во время исследования запрещалось:
Использование офтальмологических препаратов в течение 30 дней после скринингового посещения или предполагаемое использование во время исследования, за исключением смазывающих капель для лечения синдрома сухого глаза (искусственные слезы без консервантов), которые разрешалось использовать на протяжении всего исследования.
Начало лечения или любые изменения в текущей дозировке, лекарстве или режиме любых местных или системных адренергических или холинергических препаратов не позднее, чем за 7 дней до скрининга или во время исследования. Большое количество лекарств, как рецептурных, так и безрецептурных (OTC), содержащие активные ингредиенты, которые могут повлиять на диаметр зрачка. Сюда входят многие глазные капли, такие как Visine, которые будут использоваться для уменьшения покраснения, большинство препаратов от кашля или простуды, антигистаминные и бронхолитические средства, большинство капель для носа, большинство лекарств от кровяного давления, многие лекарства, используемые от мигрени, и многие другие продукты.
[00276] Периодическое использование безрецептурных смазывающих капель для лечения синдрома сухого глаза (искусственные слезы без консервантов) было приемлемым между посещениями врача. Однако никакие другие офтальмологические препараты (безрецептурные или по рецепту) не разрешались в течение 30 дней после скринингового посещения или во время исследования.
Анализ эффективности
[00277] Первичной конечной точкой эффективности было изменение фармакологически индуцированного мидриатического (максимального) диаметра зрачка (0 минут) через 2 часа после лечения в исследуемом глазу. Исследуемый глаз был определен как глаз с максимальным диаметром зрачка (через 1 час после закапывания мидриатического агента) на посещении 1. Если оба глаза имели максимально одинаковый диаметр зрачка, то исследуемый глаз был правым глазом. Это был глаз исследования для оценок посещения 1 и посещения 2.
[00278] Вторичные конечные точки эффективности (для исследуемого глаза; для неисследуемого глаза; и для обоих глаз) включали:
Изменение (в мм) от максимального диаметра зрачка (0 минут) в каждый оставшийся момент времени (30 мин, 1 час, 4 часа, 6 часов).
Процент субъектов, достигших заранее указанного уменьшения на ≥2 мм, ≥3 мм и ≥4 мм от максимального диаметра зрачка в каждый момент времени (30 мин, 1 час, 2 часа, 4 часа, 6 часов).
Процент субъектов, у которых диаметр зрачка не более чем на 0,5 мм выше исходного (-1 час) в каждый момент времени (0 мин, 30 мин, 1 час, 2 часа, 4 часа, 6 часов).
Изменение от исходного уровня (-1 час) в аккомодации в каждый момент времени (0 мин, 30 мин, 1 час, 2 часа, 4 часа, 6 часов).
Процент субъектов с неизмененной аккомодацией от исходного уровня (-1 час) в каждый момент времени (0 мин, 30 мин, 1 час, 2 часа, 4 часа, 6 часов).
Изменение от исходного уровня (-1 час) в НСОЗВ в каждый момент времени (0 мин, 30 мин, 1 час, 2 часа, 4 часа, 6 часов).
Процент субъектов, которые вернулись к исходному уровню (-1 час) НСОЗВ в каждый момент времени (0 мин, 30 мин, 1 час, 2 часа, 4 часа, 6 часов).
Изменение от исходного уровня (-1 час) в СОЗВ в каждый момент времени (0 мин, 30 мин, 1 час, 2 часа, 4 часа, 6 часов).
Процент субъектов, которые вернулись к исходному уровню (-1 час) СОЗВ в каждый момент времени (0 мин, 30 мин, 1 час, 2 часа, 4 часа, 6 часов).
Изменение гиперемии конъюнктивы по сравнению с исходным уровнем (-1 час) в каждый момент времени (30 мин, 1 час, 2 часа, 4 часа, 6 часов) для исследуемого глаза и не исследуемого глаза; у всех субъектов, у субъектов, принимающих LUMIFY® (который представляет собой офтальмологический раствор, содержащий тартрат бримонидина (0,025% мас/мас.), продаваемый Bausch & Lomb, Inc.) и у субъектов, не принимающих LUMIFY®.
[00279] Каждую конечную точку эффективности анализировали в целом и по мидриатическому агенту.
Оценка, запись и анализ параметров эффективности
[00280] Диаметр зрачка, аккомодацию, остроту зрения вблизи и вдаль измеряли во время скринингового посещения (которое также было в тот же день, что и посещение лечения 1) и посещения лечения 2.
Диаметр зрачка измеряли с помощью пупиллометра Neuroptics (мм).
Аккомодацию измеряли правилом ближней точки (диоптрия). Ухудшение аккомодации определялось как уменьшение амплитуды более чем на 1 диоптрию по сравнению с исходным уровнем. Отсутствие изменений также включало улучшение аккомодации.
СОЗВ чтение/вблизи измерялось стандартной картой для чтения (первая серия таблицы Слоуна исследования раннего лечения диабетической ретинопатии (ETDRS), блоки LogMAR).
Расстояние НСОЗВ измерялось стандартным графиком ETDRS (Буквы).
Покраснение оценивали визуально по шкале бульбарного покраснения CCLRU (0-3).
[00281] Все оценки проводились в фотопических условиях. Условия фотопического освещения должны были оставаться неизменными во время 2 посещений лечения. Были предприняты все усилия, чтобы один и тот же человек выполнял измерения во все моменты времени и во время всех посещений.
Скрининг/День 1
[00282] Исследовательский центр связывался с людьми, которые были потенциальными субъектами, для планирования посещения для скрининга. Это посещение произошло в тот же день, что и посещение лечения 1, когда была введена первая доза исследуемого препарата.
[00283] После того, как субъекты прибыли в исследовательский центр, член персонала исследовательского центра опросил субъектов относительно их квалификации для участия в исследовании, и, если субъект желал продолжить, была подписана Форма информированного согласия и был присвоен номер для скрининга. Скрининг включал объяснение исследования, медицинскую и офтальмологическую историю болезни, ЧСС и АД и обзор предшествующих/сопутствующих лекарств. Вторая стадия скрининга включала такие процедуры, как анализ мочи на беременность (для женщин детородного возраста), оценку ВГД и офтальмологическое обследование, которое включало биомикроскопию и прямую или непрямую офтальмоскопию без дилатации.
Посещение лечения 1/День 1
[00284] Посещение лечения 1 было в тот же день, что и скрининг. После того, как субъект завершил часть посещения со скрининговыми оценками и было подтверждено, что он/она соответствовал всем критериям включения, но ни одному из критериев исключения, посещение затем перешел к оценкам посещения лечения 1. В рамках посещения лечения 1 испытуемый:
Был рандомизирован к одной из двух последовательностей лечения, с рандомизацией, стратифицированной мидриатическим агентом.
Получал один из двух одобренных мидриатических агентов (1% тропикамида или 2,5% фенилэфрина) на -1 часу/исходный уровень. Мидриатический агент вводили по одной капле в каждый глаз. Если капля была пропущена, исследователь должен был ввести каплю повторно.
Получал первое из двух исследуемых курсов лечения на основе его/ее рандомизированной последовательности лечения через 0 ± 5 минут/максимум.
Глазная переносимость была оценена через 0 ± 5 минут/максимум после закапывания исследуемого лекарства.
Была оценена на уровне -1 час/исходный уровень, 0 ± 5 минут/максимум, 30 ± 5 минут, 1 час ± 5 минут, 2 часа ± 10 минут, 4 часа ± 15 минут и 6 часов ± 15 минут относительно исследуемого лечения для следующего: диаметр зрачка; НСОЗВ; СОЗВ; аккомодация; покраснение конъюнктивы, а также любые побочные эффекты (ПЭ).
Оценку ВГД проводили через 6 часов ± 15 минут.
Оценивался при скрининге -1 час/исходный уровень, 2 часа ± 10 минут и 6 часов ± 15 минут относительно исследуемого лечения на ЧСС и АД.
[00285] Исследуемый глаз был определен как глаз с максимальным диаметром зрачка (через 1 час после закапывания мидриатического агента) при посещении 1. Если оба глаза имели максимально одинаковый диаметр зрачка, то исследуемый глаз был правым глазом. Это был глаз исследования для оценок посещения 1 и посещения 2.
[00286] При необходимости, через два часа после лечения, субъектам разрешалось запросить введение LUMIFY® (который представляет собой офтальмологический раствор, содержащий тартрат бримонидина (0,025% мас./мас.), продаваемый Bausch & Lomb, Inc.) в неисследуемый глаз (и исследовательский центр должен был регистрировать такое использование).
Посещение лечения 2/день 8+2 дня
[00287] В день исследования 8+2 дня субъект вернулся в клинику для посещения лечения 2. В рамках посещения лечения 2 испытуемый:
Прошел обзор сопутствующих лекарств и женщины детородного возраста получили тест мочи на беременность.
Получил тот же одобренный мидриатический агент, который он/она получал на посещении лечения 1 (1% тропикамид или 2,5% фенилэфрин) на -1 часу/исходный уровень. Мидриатический агент вводили по одной капле в каждый глаз. Если капля была пропущена, исследователь должен был ввести каплю повторно.
Получал второе из двух исследуемых лечений на основе его/ее рандомизированной последовательности лечения через 0 ± 5 минут/максимум.
Глазная переносимость была оценена на уровне 0 ± 5 минут/максимум после закапывания исследуемого препарата.
Была оценена на уровне -1 час/исходный уровень, 0 ± 5 минут/максимум, 30 ± 5 минут, 1 час ± 5 минут, 2 часа ± 10 минут, 4 часа ± 15 минут и 6 часов ± 15 минут относительно исследуемого лечения для следующего: диаметр зрачка; НСОЗВ; СОЗВ; аккомодация; покраснение конъюнктивы, а также любые ПЭы.
Оценку ВГД проводили через 6 часов ± 15 минут.
Оценивался на уровне -1 час/исходный уровень, 2 часа ± 10 минут и 6 часов ± 15 минут относительно исследуемого лечения на ЧСС и АД.
[00288] При необходимости, через два часа после лечения, субъектам разрешалось запросить введение LUMIFY® (который представляет собой офтальмологический раствор, содержащий тартрат бримонидина (0,025% мас./мас.), продаваемый Bausch & Lomb, Inc.) в неисследуемый глаз и такое использование будет зарегистрировано.
Незапланированные посещения
[00289] Незапланированное посещение - это любое посещение исследователя, кроме конкретных посещений, указанных в протоколе, которые, возможно, необходимы для офтальмологического состояния субъекта. Исследователь должен был выполнить все процедуры, необходимые для оценки участника исследования во время этих посещений, и зарегистрировать любые ПЭы в карточке участника клинического исследования (КУКИ).
Вариант посещения
[00290] Посещения на 8-й день могут быть задержаны до 2 дней.
Определение эффективности
[00291] Эффективность оценивалась с использованием полной выборки для анализа (ПВА) с субъектами, включенными в последовательность лечения, в которую они были рандомизированы, независимо от последовательности лечения, которую они фактически получали. Для анализа первичной конечной точки эффективности использовались данные наблюдаемых случаев (подстановка отсутствующих данных не производилось) для первичного анализа. Подтверждающие анализы могли быть выполнены с использованием всей рандомизированной группы (ВРГ) с подстановкой, проводимой для недостающих данных. Для анализа вторичных конечных точек эффективности использовались только данные наблюдаемых случаев. Если это было оправдано, подтверждающий анализ с использованием ВРГ с подстановкой отсутствующих данных также проводился для вторичных конечных точек эффективности.
[00292] Для всех конечных точек эффективности, исходный уровень для конкретного дня (посещение 1, посещение 2) был определен за -1 час до лечения. Максимальный момент времени был определен как время 0 минут, в течение которого ожидался максимальный диаметр зрачка.
[00293] Все данные об эффективности суммировали по группам лечения, дням исследования и временным точкам (-1 час, 0 минут, 30 минут, 1 час, 2 часа, 4 часа, 6 часов; при посещении 1 и при посещении 2), в зависимости от ситуации.
[00294] Первичной конечной точкой эффективности было изменение фармакологически индуцированного мидриатического (максимального) диаметра зрачка (0 минут) через 2 часа после лечения в исследуемом глазу. Первичная конечная точка эффективности была проанализирована с использованием анализа ковариации (ANCOVA) с изменением от максимального диаметра зрачка (0 минут) до 2 часов в среднем диаметре зрачка (мм) в качестве зависимой переменной; последовательность лечения, субъект в последовательности лечения, период, лечение и мидриатический агент в качестве факторов; и максимальный диаметр зрачка (0 минут) как ковариант. ANCOVA проводился с использованием ПВА, при этом субъекты включались в их рандомизированную последовательность лечения независимо от того, какое лечение они фактически получали. Использовались только данные наблюдаемых случаев; то есть пропущенные значения не подставлялись. Среднее значение наименьших квадратов (СЗНК) и стандартная ошибка (СОШ) были предоставлены для обеих групп лечения, а также СЗНК с поправкой на плацебо, его 95% доверительный интервал (ДИ) и соответствующее значение p. Подтверждающий анализ первичной конечной точки эффективности мог быть выполнен с использованием ВРГ с подставленным пропущенными значениями. Кроме того, первичная конечная точка эффективности была проанализирована мидриатическим агентом с использованием той же модели, что и выше, но без мидриатического агента в качестве фактора.
[00295] Для каждой из непрерывных вторичных конечных точек эффективности использовался один и тот же ANCOVA для первичной конечной точки эффективности с соответствующим исходным (-1 час) значением, включенным в качестве ковариаты [обратите внимание, что все вторичные конечные точки эффективности были связаны с исходным уровнем (-1 час), тогда как первичная конечная точка эффективности относилась к максимуму (0 минут)]. Каждый анализ ANCOVA проводился с использованием ПВА с субъектами, включенными в их рандомизированную последовательность лечения, независимо от того, какую последовательность лечения они фактически получали. Использовались только данные о наблюдаемых случаях; то есть пропущенные значения для оценок после рандомизации не подставлялись. Выходные данные каждого ANCOVA включали СЗНК и СОШ для обеих групп лечения, а также СЗНК с поправкой на плацебо, его 95% доверительный интервал и соответствующее значение p.
[00296] Для каждой из вторичных конечных точек, относящихся к проценту субъектов, достигших определенных критериев, был проведен анализ с использованием PROC GENMOD с логит-связью (обобщенная линейная модель), чтобы учесть перекрестное сравнение случаев. Анализ включал последовательность лечения, субъект в последовательности лечения, период, лечение, мидриатический агент и соответствующий исходный уровень, как и в случае ANCOVA для непрерывных конечных точек. Для каждого анализа был предоставлен процент субъектов в каждой группе лечения, отвечающих критериям, отношение шансов (ОШ) с 95% доверительным интервалом и значением p. Для этих конечных точек, ПВА использовался с субъектами, включенными в их рандомизированную последовательность лечения, независимо от последовательности лечения, которую они фактически получали.
[00297] Кроме того, каждая вторичная конечная точка эффективности анализировалась мидриатическим агентом с использованием той же модели, указанной выше, но без мидриатического агента в качестве фактора.
Анализ безопасности
[00298] Оценку безопасности оценивали:
Гиперемия конъюнктивы измерялась по 4-балльной шкале CCLR.
Нет (0) = Нормально. Выглядит белой, легко просматривается небольшое количество кровеносных сосудов.
Легкая (+1) = Явно выраженный розовато-красный цвет как бульбарной, так и конъюнктивы век.
Умеренная (+2) = Яркий, багряный цвет бульбарной и конъюнктивы век.
Тяжелая (+3) = Мясисто-красный цвет с петехиями, темно-красным бульбарной и конъюнктивой век с признаками субконъюнктивального кровоизлияния.
Субъективная глазная переносимость оценивается по 4-балльной шкале.
0 - Без дискомфорта
1 - Легкий дискомфорт
2 - Умеренный дискомфорт
3 - Сильный дискомфорт
Внутриглазное давление (ВГД).
Частота сердечных сокращений (ЧСС) и артериальное давление (АД).
Побочные эффекты.
[00299] Побочным эффектом (ПЭ) было любое неблагоприятное медицинское происшествие у пациента или субъекта клинического исследования, которым вводили исследуемый препарат (фармакологический/биологический продукт), которое не обязательно имело причинно-следственную связь с этим препаратом. Следовательно, ПЭ мог быть любым неблагоприятным и непредусмотренным проявлением (включая отклонения от нормы в лабораторных исследованиях), симптомом или заболеванием, временно связанными с использованием исследуемого препарата, независимо от того, связано ли оно с исследуемым препаратом или нет. Исследуемый препарат включал исследуемый лекарственный препарат, подлежащий оценке, и препарат сравнения или носитель плацебо, которые давали или вводили на любой стадии исследования.
[00300] Медицинские состояния/заболевания, имевшие место до начала исследуемого лечения, считались ПЭи только в том случае, если они ухудшились после начала исследуемого лечения. Аномальные результаты тестов считались ПЭ только в том случае, если они вызывали клинические признаки или симптомы, считались клинически значимыми или требовали лечения.
[00301] Степень тяжести ПЭ определялась как качественная оценка уровня дискомфорта от ПЭ, определенного исследователем или сообщенного ему/ей субъектом. Оценка степени тяжести проводилась независимо от связи с исследуемыми препаратами или серьезности события и должна была оцениваться по следующей шкале:
1=Легкая: присутствует, но не вызывает беспокойства и не нарушает нормальную повседневную деятельность.
2=Умеренная: дискомфорт, достаточный, чтобы уменьшить или повлиять на нормальную повседневную активность.
3=Тяжелая: выводит из строя, с неспособностью работать или выполнять нормальную повседневную деятельность.
[00302] Для изменения степени тяжести ПЭ, о которой было сообщено, требуется дата окончания для предыдущей степени тяжести и новая дата начала и окончания для новой степени тяжести. Например, изменение степени тяжести может измениться с легкой на тяжелую или с тяжелой на умеренную. В любом случае должны были быть записаны даты начала или окончания.
Часть II - Результаты
[00303] Данные о наблюдаемом уменьшении диаметра зрачка представлены в Таблицах 1A-1F, 2A-2L и 3A-3C ниже. Данные, характеризующие субъектов в зависимости от изменения условий аккомодации, представлены в Таблицах 4A и 4B. Анализ проводился для всех субъектов и субъектов, получавших тропикамид (где снижение аккомодации считалось вероятным), но не для фенилэфрина (где снижение аккомодации считалось маловероятным). Данные, характеризующие наблюдаемое покраснение глаз (гиперемия конъюнктивы), представлены в Таблицах с 5А по 5Е. Ни один из субъектов в этом исследовании не запрашивал введение LUMIFY® (офтальмологический раствор, содержащий тартрат бримонидина (0,025% мас./мас.), продаваемый Bausch & Lomb, Inc.).
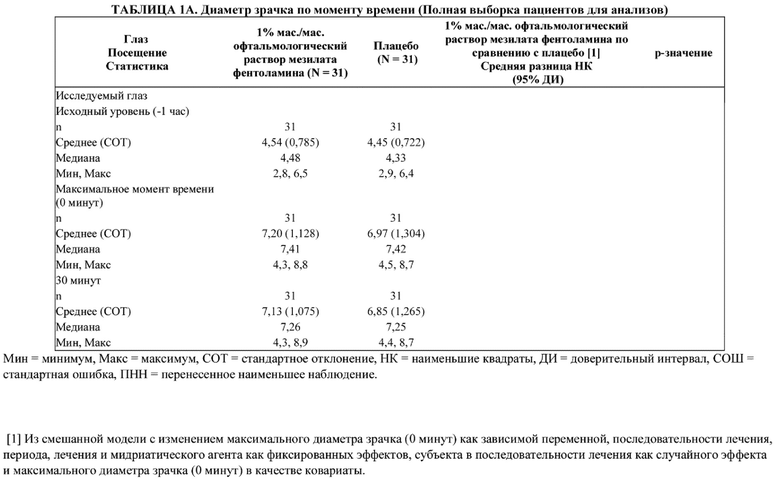
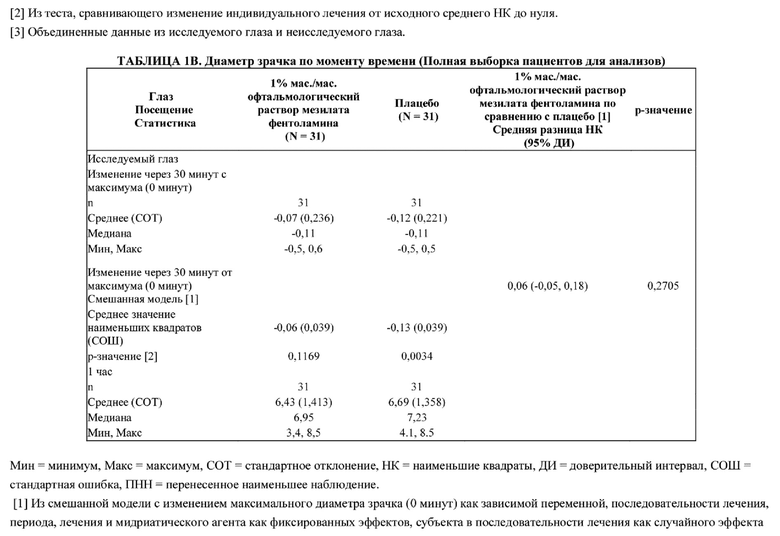






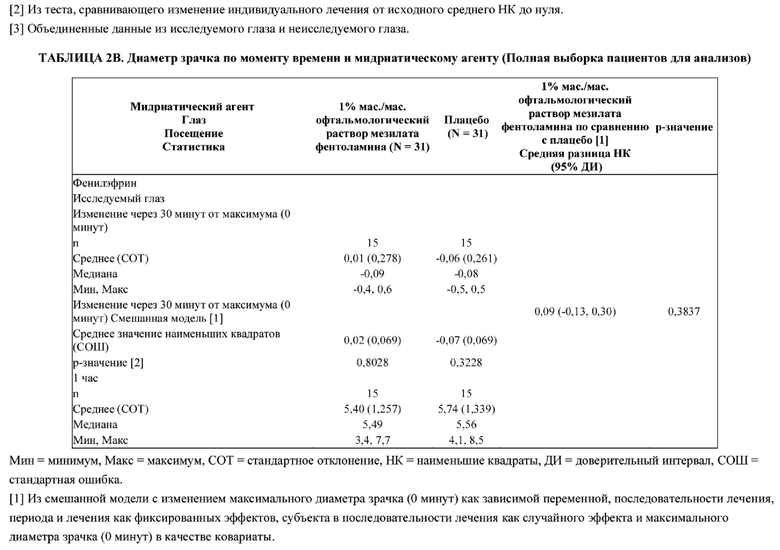

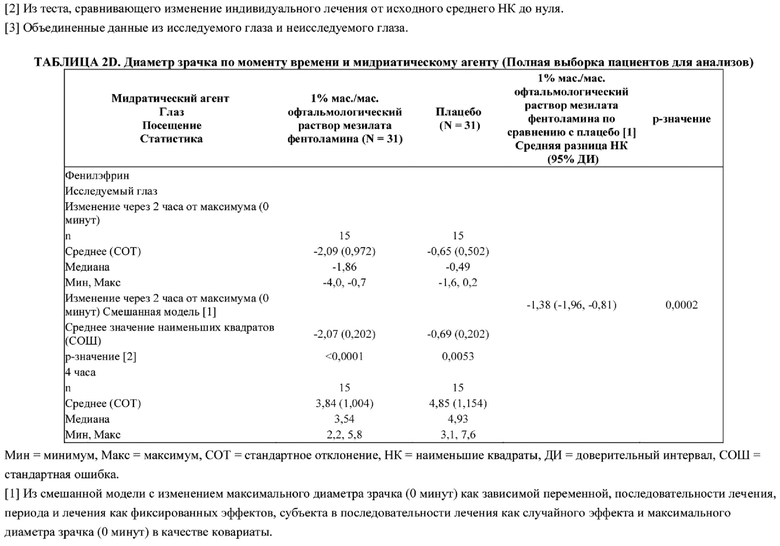
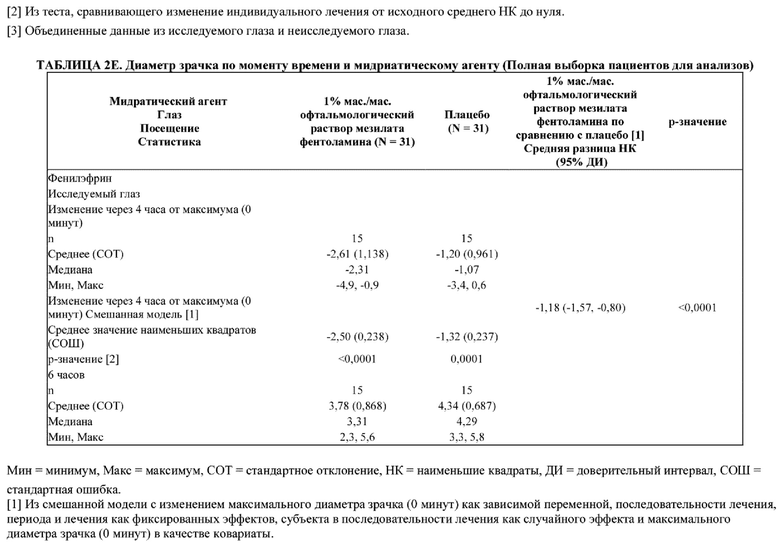
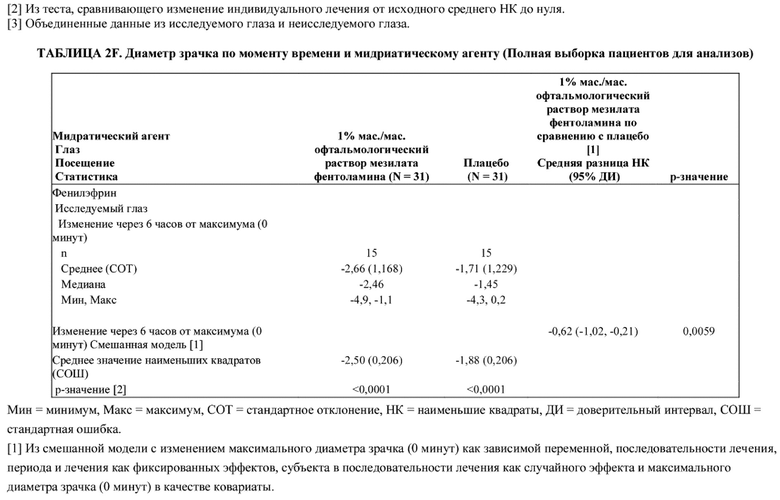


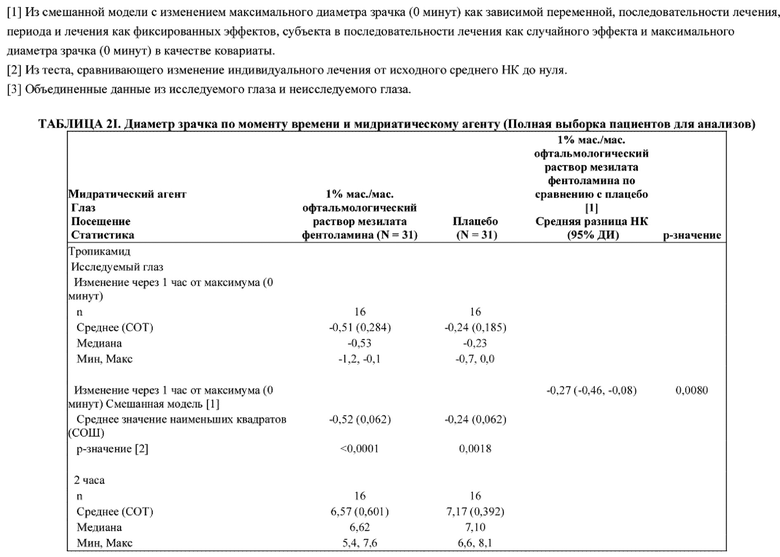














[00304] Наблюдаемые экспериментальные результаты измерений ВГД представлены в Таблицах 6 и 7 ниже.
** Согласно измерениям на неделе 1 исходного уровня; изменения, измеренные через 6-8 часов после введения дозы.
**Согласно измерениям на неделе 1 исходного уровня; изменения, измеренные через 6-8 часов после введения дозы.
Пример 4 - Улучшение остроты зрения вблизи используя мезилат фентоламина у людей с открытоугольной глаукомой или глазной гипертензией
[00305] Способность мезилата фентоламина улучшать остроту зрения вблизи у людей с двусторонней открытоугольной глаукомой (ОУГ) или глазной гипертензией (ГГП) оценивалась в соответствии с клиническим исследованием, в котором водный офтальмологический раствор, содержащий мезилат фентоламина, вводили в глаз пациента и затем оценивали улучшение остроты зрения вблизи в глазу, который получал водный офтальмологический раствор, содержащий мезилат фентоламина. Около 40 субъектов с ОУГ или ГГП были рандомизированы для требуемых 36 завершенных субъектов. Субъекты были рандомизированы в соотношении 1:1 чтобы получить 1% мас./мас. офтальмологического раствора мезилата фентоламина или плацебо один раз в день в течение 14 дней, начиная с 20:00 до 22:00 в день 1 и продолжая до дня 14. Оценка остроты зрения вблизи проводилась на исходном уровне и в дни посещения для исследования лечения (день 8 ± 1 день и день 15 ± 1 день) в 8:00, 10:00 и 16:00. Были проведены контрольные посещения на 16-й день в 8:00 ± 15 минут и по телефону на 22-й день (через 7 дней после последнего посещения для исследования лечения). Дальнейшие экспериментальные процедуры и результаты описаны ниже.
Часть I - Экспериментальные процедуры
[00306] Общая продолжительность участия субъектов составляла от около 7 до 8 недель с шестью посещениями клиники и одним последующим телефонным звонком, как кратко изложено ниже:
Скрининговый визит (1 день).
Посещение/период вымывания (при необходимости) (4-5 недель с посещением для проверки безопасности через 2 недели).
Квалификационное/исходное посещение (1 день).
Посещение исследования лечения, день 8 (1 неделя).
Посещение исследования лечения, день 15 (1 неделя).
Последующее посещение клиники, день 16 (1 день).
Последующий телефонный звонок, день 22 (1 неделя).
[00307] Люди были проверены на предмет возможного включения в исследование и, если они соответствовали требованиям, были включены в исследование. Критерии включения и исключения из исследования изложены ниже. Люди могли подходить для любого глаза.
Критерии включения
18 лет и старше.
Диагностика ОУГ или ГГП. Диагноз ГГП должен быть поставлен на оба глаза. Для ОУГ, диагноз мог быть на любом глазу с ГГП в парном глазу. Предпочтительно наличие в истории болезни нелеченой ГГП с ВГД ≥22 мм рт. ст. и ≤ 30 мм рт. ст.
Нелеченые или пролеченные ОУГ/ГГП двумя или меньшим количеством глазных гипотензивных препаратов.
Нелеченое (после промывки) среднее ВГД ≥ 22 мм рт. ст. и ≤ 30 мм рт. ст. в исследуемом глазу во время квалификационного посещения (8:00).
Скорректированная острота зрения в каждом глазу +1,0 logMAR или лучше по данным исследования раннего лечения диабетической ретинопатии (ETDRS) в каждом глазу (эквивалент 20/200 или лучше) во время скринингового посещения и квалификационного посещения.
В остальном здоровые и хорошо контролируемые субъекты.
Способен и готов дать подписанное информированное согласие и следовать инструкциям по исследованию.
Возможность самостоятельно принимать исследуемое лекарство или получать исследуемое лекарство от лица, осуществляющего уход, в течение всего периода исследования.
Критерий исключения
Закрытые или очень узкие углы (степень 0-1 по Шафферу) или углы, которые исследователь считает окклюзируемыми и/или с признаками периферической передней синехией (PAS) ≥ 180 градусов при гониоскопии в течение 6 месяцев до скринингового посещения в любом глазу.
Глаукома: компонент псевдоэксфолиации или дисперсии пигмента, закрытие угла в истории болезни или узкие углы. Примечание: Предшествующая лазерная периферическая иридотомия не разрешалась.
Известная гиперчувствительность к любым антагонистам α-адренорецепторов.
Предшествующая лазерная и/или нелазерная хирургия глаукомы или процедура на любом глазу.
Рефракционная хирургия любого глаза (например, лучевая кератотомия, фоторефракционная кератэктомия (PRK), лазерный кератомилез in situ (LASIK) или поперечное сшивание роговицы).
Глазная травма любого глаза в течение 6 месяцев до скрининга или глазная хирургия или лечение лазером без рефракции в течение 3 месяцев до скрининга.
Недавние или текущие доказательства глазной инфекции или воспаления в любом глазу. Текущие доказательства клинически значимого блефарита, конъюнктивита или кератита простого герпеса или опоясывающего герпеса в истории болезни при скрининге любого глаза.
Глазные препараты любого типа в течение 30 дней после скрининга, за исключением а) гипотензивных лекарств для глаз (которые необходимо было вымыть), б) скрабов для век (которые можно использовать до скрининга, но нельзя использовать после скрининга) или в) смазывающие капли для сухого глаза (искусственные слезы без консервантов), которые можно было использовать на протяжении всего исследования.
Клинически значимое глазное заболевание любого глаза, по мнению исследователя (например, отек роговицы, увеит или тяжелый сухой кератоконъюнктивит), которое может помешать исследованию, в том числе глаукоматозное поражение настолько тяжелое, что вымывание глазных гипотензивных препаратов в течение 1 месяца не считалось безопасным (то есть отношение диаметров экскавации и диска зрительного нерва >0,8, тяжелый дефект поля зрения).
История диабетической ретинопатии.
Ношение контактных линз в течение 3 дней до и на время исследования.
Толщина центральной роговицы в любом глазу >600 мкм при скрининге.
Любая аномалия в любом глазу, препятствующая надежной аппланационной тонометрии (например, центральное рубцевание роговицы).
Известная гиперчувствительность или противопоказания к антагонистам α- и/или β-адренорецепторов (например, хроническая обструктивная болезнь легких или бронхиальная астма; аномально низкое артериальное давление или частота сердечных сокращений; блокада сердца второй или третьей степени или застойная сердечная недостаточность; или тяжелый диабет).
Клинически значимое системное заболевание (например, неконтролируемый диабет, тяжелая миастения, рак, печеночные, почечные, эндокринные или сердечно-сосудистые заболевания), которое может помешать проведению исследования.
Участие в любом исследовательском исследовании в течение 30 дней до скрининга.
Использование любых местных или системных адренергических или холинергических препаратов за 30 дней до скрининга или во время исследования, если лекарственное средство, доза и режим не были согласованы в течение 30 дней до скрининга.
Изменения в системных препаратах, которые могут повлиять на ВГД в течение 30 дней до скрининга или ожидаемые во время исследования.
Женщины детородного возраста, которые были беременны, кормили грудью, планировали беременность или не использовали приемлемые с медицинской точки зрения формы контроля над рождаемостью. Считалось, что взрослая женщина имеет детородный потенциал, за исключением случаев, когда она была в постменопаузе в течение 1 года или после 3 месяцев после хирургической стерилизации. Все женщины детородного возраста должны иметь отрицательный результат анализа мочи на беременность на скрининговых и квалификационных обследованиях и не намереваются забеременеть во время исследования.
Частота сердечных сокращений (ЧСС) в состоянии покоя за пределами нормального диапазона (50-110 ударов в минуту) во время скринингового или квалификационного посещения. ЧСС может быть повторно измерена только один раз, если выходит за пределы нормального диапазона, после периода отдыха не менее 5 минут в сидячем положении.
Гипертония с диастолическим артериальным давлением (АД) в покое >105 мм рт. ст. или систолическим АД >160 мм рт. ст. во время скринингового или квалификационного посещения. АД может быть повторно измерена только один раз, если оно выходит за пределы указанного диапазона, после периода отдыха не менее 5 минут в сидячем положении.
[00308] Для участия в исследовании отбирались субъекты с офтальмологической историей повышенного ВГД (≥ 22 мм рт. ст. и ≤ 30 мм рт. ст.) и обследовались на пригодность к участию в исследовании.
[00309] После скрининга подходящие субъекты, если они лечились в это время препаратами от глаукомы, должны были вымыть и воздержаться от приема любых препаратов от глаукомы в течение по меньшей 28 дней и не более 35 дней до квалификационного посещения. Субъекты вымывания были возвращены через около две недели после начала периода вымывания для проверки безопасности ВГД. По мнению исследователя, если был какой-либо риск для глаза субъекта или если среднее ВГД в любом глазу во время отмывания составляло >30 мм рт. ст., вводилось соответствующее спасательное или предшествующее лечение, и субъект считался не прошедшим скрининг. Во время этого посещения также оценивались нежелательные явления, произошедшие в период вымывания. После вымывания, если применимо, перед дозированием в день 1 проводилось квалификационное посещение.
[00310] Субъектам, ранее не лечившимся какими-либо препаратами от глаукомы, не требовался период вымывания, и они могли вернуться на следующий день или до 35 дней спустя для их квалификационного/исходного посещения.
[00311] Во время квалификационного/исходного посещения:
Женщины детородного возраста сдавали анализ мочи на беременность в 8 утра.
Проверка сопутствующих лекарств проводилась в 8:00.
В 8:00 измеряли диаметр зрачка с помощью пупиллометра Neuroptics, остроту зрения вблизи с использованием стандартной таблицы, удерживаемой на расстоянии 14 дюймов, и остроту зрения вдаль с помощью ETDRS.
Покраснение глаз (гиперемия конъюнктивы) проверяли визуально в 8:00, 10:00 и 16:00 с использованием шкалы бульбарного покраснения CCLRU.
Побочные эффекты анализировались в каждый момент времени.
[00312] Первая доза исследуемого препарата принималась с 20:00 до 22:00 во время исходного посещения (день 1). Персонал исследовательского центра демонстрировал субъекту правильную технику закапывания во время квалификационного/исходного посещения (день 1), и субъект самостоятельно вводил дозу искусственной слезы в месте исследования, закапывая по 1 капле в каждый глаз из флакона с стандартной дозой (Примечание: Если капля не была закапана в глаз, субъект был проинструктирован подождать около 10-15 секунд и ввести вторую каплю). Субъект получал следующие инструкции относительно правильной техники закапывания:
Субъект должен находиться в сидячем положении и наклонять голову назад для введения исследуемого препарата. Флакон с исследуемым препаратом следует держать почти вертикально над глазом, при этом нижнее веко осторожно опускается и 1 капля помещается в свод конъюнктивы. Кончик флакона не должен касаться глаза. После закапывания капель в каждый глаз субъект должен держать глаза закрытыми в течение около 30 секунд. После успешного закапывания капли в каждый глаз субъект должен осторожно удалить все оставшееся содержимое в соответствии с указаниями.
[00313] Субъекту предоставляли бутылочки-капельницы с исследуемым препаратом, инструкции, когда вводить глазные капли (с 20:00 до 22:00) и когда возвращаться в клинику.
[00314] Субъект был проинструктирован вводить по одной капле в каждый глаз из нового флакона с однократной дозой каждый вечер дозирования и осторожно закрывать глаза на 30 секунд, затем опорожнять оставшееся содержимое флакона (и хранить открытый флакон в предоставленном мешочке и поместить его в коробку с препаратами для возврата в место исследования во время посещения в день 8). Субъект был проинструктирован выполнять одни и те же процедуры каждый вечер после приема доз (около 24 часа между дозами). Во время посещения в день 8 коробка с препаратами вместе с открытыми бутылками и всеми неоткрытыми исследуемыми препаратами должна была быть возвращена в исследовательский центр, где мешочки с открытыми препаратами удалялись и коробка с исследуемыми препаратами была повторно выдана с неоткрытым препаратом. В течение второй недели лечения субъектов проинструктировали продолжать вводить одну каплю исследуемого препарата в каждый глаз каждую ночь, используя новую бутылку для каждой дозы, затем опорожнять оставшееся содержимое этой бутылки (и хранить открытые бутылки в мешочках и поместить их обратно в коробку, чтобы вернуть в исследовательский центр во время посещения в день 15). Посещение в день 15 было последним днем исследуемого лечения; во время этого посещения никаких других исследуемых препаратов не выдавалось.
[00315] Субъект был проинструктирован связаться с исследователем в случае возникновения побочных эффектов, вызывающих обеспокоенность (например, одышка, обморок и т. д.), или обратиться в отделение неотложной помощи, если эффект был опасным для жизни.
[00316] Посещения для исследования проводились дважды - в день 8 ± 1 день и день 15 ± 1 день. В день 8 исследования было выполнено следующее:
Проверка сопутствующих лекарств проводилась в 8:00.
Измерялась острота зрения вблизи и вдаль.
Покраснение глаз (гиперемия конъюнктивы) проверяли визуально по шкале бульбарного покраснения CCLRU.
[00317] В день 15 исследования было выполнено следующее:
Субъекты должны были принести с собой использованные флаконы-капельницы и любые неиспользованные препараты для целей учета препарата.
Субъектов спрашивали, были ли у них проблемы со зрением после последнего посещения, и были ли какие-либо изменения в их состоянии здоровья или сопутствующих лекарствах с момента их последнего посещения. Любые изменения в состоянии субъекта регистрировались как побочные эффекты.
Измерялась острота зрения вблизи и вдаль.
Покраснение глаз (гиперемия конъюнктивы) проверяли визуально в каждый момент времени с помощью шкалы бульбарного покраснения CCLRU.
Побочные эффекты анализировались в каждый момент времени.
Измерение остроты зрения вдаль и вблизи, диаметра зрачка и полное офтальмологическое обследование, включая биомикроскопию также были выполнены в 16:00.
Субъектам, завершившим посещение на день 15, было дано указание не возобновлять прием оригинальных препаратов от глаукомы до завершения контрольного телефонного разговора в день 22.
[00318] Контрольное посещение произошло в 8:00 ± 15 минут в день 16. Оценка, проведенная во время этого посещения, включала измерение ВГД в 8:00 ± 15 минут, остроты зрения, диаметр зрачка и меры безопасности. В частности, было выполнено следующее:
Субъектов спрашивали, были ли у них проблемы со зрением после последнего посещения, и были ли какие-либо изменения в их состоянии здоровья или сопутствующих препаратов с момента их последнего посещения. Любые изменения в состоянии субъекта регистрировались как побочный эффект.
Проверка сопутствующих препаратов проводилась в 8:00.
ВГД измеряли дважды в исследуемом глазу в 8:00 ± 15 минут, и эти два значения усредняли. Если разница в двух измерениях ВГД была >5 мм рт.ст., получали третье измерение, и три значения усредняли.
Измеряли диаметр зрачка, остроту зрения вблизи и вдаль, ЧСС и АД в покое в 8:00. Артериальное давление с использованием той же руки, манжеты того же размера, соответствующего окружности руки на протяжении всего исследования, и частота сердечных сокращений измерялись после как минимум 3-х минутного отдыха в сидячем положении. Если ЧСС или АД были вне нормального диапазона (ЧСС <50 или >110 ударов в минуту, диастолическое артериальное давление (АД) в покое >105 мм рт. ст. или систолическое АД >160 мм рт.ст.), они могли быть измерены повторно после по меньшей 5 минут в состоянии покоя в сидячем положении.
Покраснение глаз (гиперемия конъюнктивы) проверяли визуально в каждый момент времени с помощью шкалы бульбарного покраснения CCLRU.
Побочные эффекты анализировались в 8 утра.
Субъектам, завершившим посещение в день 16, напомнили, что они не должны возобновлять прием оригинальных препаратов от глаукомы до завершения контрольного телефонного звонка в день 22.
[00319] Контрольный телефонный звонок произошел в день 22, через семь дней после последней дозы. Были собраны данные обо всех сопутствующих препаратах, покраснении конъюнктивы и побочных эффектах (ПЭы), о которых сообщали субъекты.
[00320] Посещения на 8-й и 15-й дни были разрешены на 1 день раньше или позже. Если посещение было запоздалым, субъекту рекомендовали принять дополнительную дозу из одного из 2 запасных флаконов-капельниц, предоставленных в коробке с исследуемым препаратом, за ночь до визита. Субъекту было был проинструктирован затем вылить оставшееся содержимое, поместить открытый флакон в предоставленный мешочек и поместить его в коробку с препаратами для возврата в исследовательский центр при следующем посещении. Если посещение в день 15 происходило на один день раньше или позже, посещение в день 16 и телефонный звонок в день 22 корректировались соответственно.
[00321] Любому субъекту было разрешено добровольно выйти из исследования в любое время без ущерба. Субъект, не завершивший исследование определялся как тот, кто вышел из исследования по собственному желанию или по усмотрению исследователя и/или медицинского наблюдателя до завершения всех процедур исследования, требуемых протоколом.
[00322] Субъекты исследования получали исследуемый препарат, как указано в Таблице 1, в соответствии с группой лечения, к которой был отнесен субъект. Исследуемые препараты перечислены в Таблице 2.
4% мас./мас. маннита
3 мМ буфер, содержащий ацетат натрия и уксусную кислоту
вода
pH в диапазоне от 4,8 до 5,0
3 мМ буфер, содержащий ацетат натрия и уксусную кислоту
вода
pH в диапазоне от 4,8 до 5,0
Часть II - Результаты
[00323] Исходные данные остроты зрения, собранные у субъектов до введения мезилата фентоламина в начале исследования, представлены в Таблицах 1-4. Наблюдаемое улучшение остроты зрения вблизи представлено в Таблицах 5 и 6. Результаты наблюдений за гиперемией конъюнктивы представлены в Таблицах 7 и 8. Данные в Таблицах 7 и 8 показывают, что не было статистически значимой разницы в наблюдаемой гиперемии конъюнктивы между пациентами, получавшими плацебо, и пациентами, получавшими 1 мас./мас. офтальмологический раствор мезилата фентоламина. Наблюдаемые изменения диаметра зрачка представлены в Таблицах 9A, 9B, 10A, 10B, 11A и 11B.



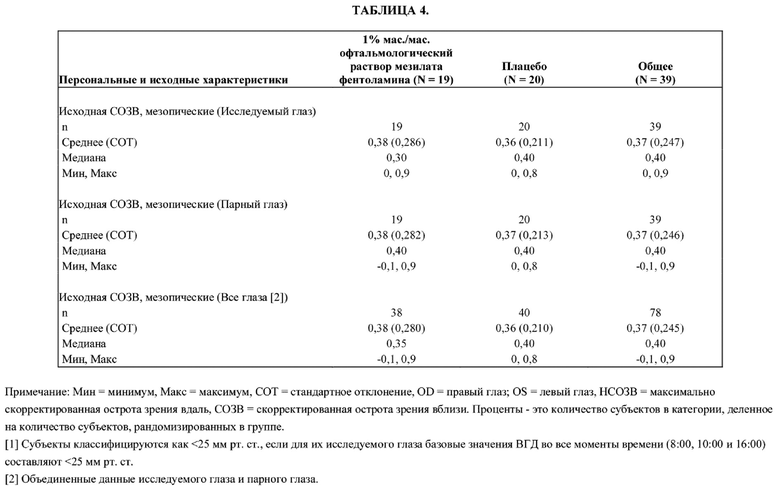

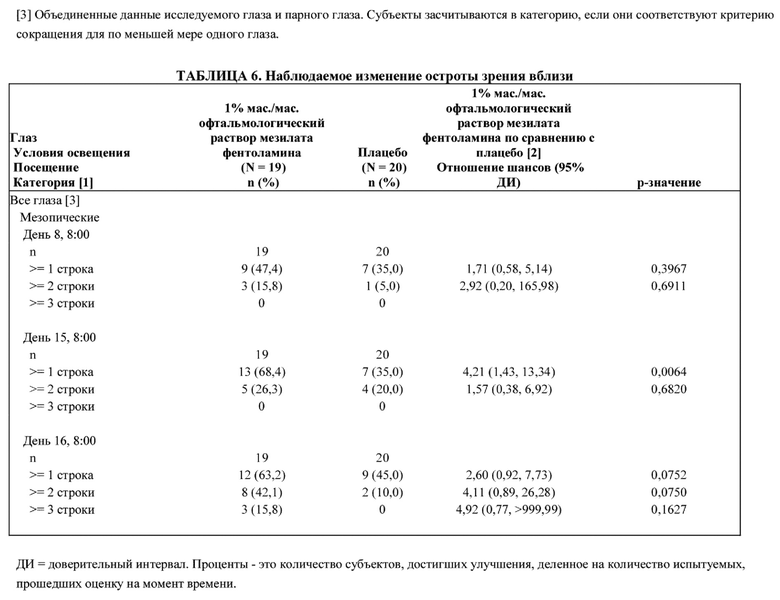

(N=19)
(N=20)
точного критерия Фишера
(N=19)
(N=20)
точного критерия Фишера
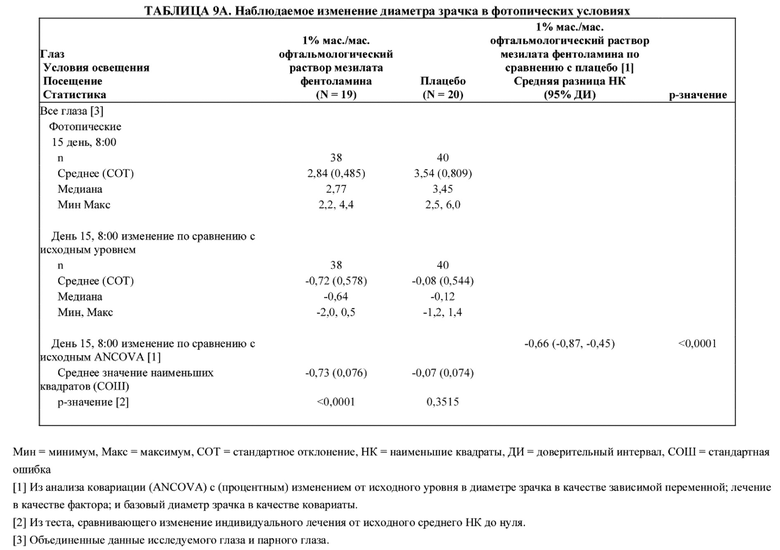





ПРИМЕР 5 - Оценка влияния тетрагидрозолина на уменьшение зрачков с помощью мезилата фентоламина у субъектов
[00324] Было проведено двойное слепое рандомизированное трехстороннее параллельное исследование однократной дозы, в котором сравнивали переносимость и влияние тетрагидрозолина, мезилата фентоламина или тетрагидрозолин плюс мезилат фентоламина на размер зрачка после местного введения агента(ов) в глаз. Всего 45 человек были рандомизированы в 3 группы (по 15 субъектов в каждой), и все субъекты получали последовательно одну каплю на глаз двух отдельных растворов.
[00325] Группа 1 получала одну каплю офтальмологического тетрагидрозолина (VISINE®) в каждый глаз, а затем по одной капле 0,2% (мас./об.) офтальмологического раствора глазных капель мезилата фентоламина GENTEAL™ (т.е. группа тетрагидрозолин+мезилат фентоламина). Раствор глазных капель GENTEAL™ представляет собой стерильный водный офтальмологический раствор, коммерчески продаваемый компанией Alcon.
[00326] Группа 2 получала одну каплю плацебо (раствор глазных капель GENTEAL®) в каждый глаз, а затем по одной капле 0,2% (мас./об.) офтальмологического раствор глазных капель мезилата фентоламина GENTEAL ® (т.е. группа мезилат фентоламина). Группа 3 получала одну каплю офтальмологического тетрагидрозолина (VISINE ®) в каждый глаз, а затем по одной капле плацебо (раствор глазных капель GENTEAL ®) (т.е. группа тетрагидрозолина). Измеряли размер зрачка. Дополнительно было измерено покраснение глаз.
[00327] Результаты, полученные в ходе исследования, показали, что введение VISINE® (офтальмологический раствор тетрагидрозолина) не снижает способность 0,2% (мас./об.) офтальмологического мезилата фентоламина уменьшать диаметр зрачка. Результаты экспериментов для диаметра зрачка показаны на Фиг. 2. Результаты исследования также показали, что (офтальмологический раствор тетрагидрозолина) уменьшение покраснения глаз, вызвано мезилатом фентоламина. Результаты экспериментов для покраснения глаз показаны на Фиг. 3.
ПРИМЕР 6 - Оценка мезилата фентоламина на предмет возникновения ощущения жжения или гиперемии при введении в глаза субъектов
[00328] Одну каплю 1% мас./мас. офтальмологического раствора мезилата фентоламина вводили в глаза человека. Субъектов просили сообщать о любых ощущениях жжения или гиперемии. Наблюдаемые результаты представлены в Таблице 1 ниже для исследования с участием 32 пациентов, которые получали 1% мас./мас. офтальмологический раствор мезилата фентоламина. Одна капля 1% мас./мас. офтальмологического раствора мезилата фентоламина вызывала меньшее жжение и меньшую гиперемию по сравнению с REV-EYES® (0,5% мас./мас. офтальмологический раствор дапипразола гидрохлорида, содержащий маннит (2% мас./мас.), хлорид натрия, гидроксипропилметилцеллюлозу (0,4% мас./мас.), эдетат натрия (0,01% мас./мас.), двухосновный фосфат натрия, одноосновный фосфат натрия, воду для инъекций и бензалкония хлорид (0,01% мас./мас.), имеющий pH около 6,6 и осмолярность около 415 мОсм)), при котором две капли раствора REV-EYES® вводили в глаз пациента и затем через 5 минут вводили еще две капли раствора REV-EYES® в глаз пациента.
[00329] Композиция 1% мас./мас. офтальмологического раствора мезилата фентоламин представлена в таблице ниже.
4% мас./мас. маннита
3 мМ буфер, содержащий ацетат натрия и уксусную кислоту
вода
pH в диапазоне от 4,8 до 5,0
ПРИМЕР 7 - Лечение пресбиопии мезилатом фентоламина у человека
[00330] Способность мезилата фентоламина лечить субъекта, страдающего пресбиопией, оценивали в соответствии с экспериментальной процедурой, описанной ниже. Наблюдаемые результаты описаны ниже.
Часть I - Экспериментальные процедуры
[00331] Диаметр зрачка и острота зрения испытуемого определялись на исходном уровне (Время = -5 минут), затем субъекту вводили 1% мас./мас. офтальмологический раствор мезилата фентоламина (по 1 капле в каждый глаз, Время=0 минут). В момент времени=40 минут одну каплю 1% офтальмологического раствора пилокарпина HCl вводили только в левый глаз субъекта.
[00332] Диаметр зрачка и остроту зрения измеряли в фотопических и мезопических условиях при Времени = -5 минут, 15 минут, 30 минут, 45 минут, 60 минут, 75 минут и 90 минут. Диаметр зрачка дополнительно измеряли при Времени=14 часов. Диаметр зрачка измеряли при помощи инфракрасного пупилометра в скотопических условиях («мезопический диаметр зрачка») и фотопических условиях («фотопический диаметр зрачка»). Острота зрения измерялась при помощи таблицы ETDRS, расположенной на расстоянии 14 дюймов в мезопических условиях с мезопическим фильтром («мезопическая острота зрения») и в фотопических условиях без мезопического фильтра («фотопическая острота зрения»). Для справки: строки в таблице ETDRS: 20/125, 20/100, 20/80, 20/63, 20/50, 20/40, 20/32, 20/25 и 20/20.
[00333] Композиция 1% мас./мас. офтальмологического раствора мезилата фентоламин представлена в таблице ниже.
4% мас./мас. маннита
3 мМ буфер, содержащий ацетат натрия и уксусную кислоту
вода
pH в диапазоне от 4,8 до 5,0
0,01% бензалкония хлорид
0,5% гипромеллозы 2910
борная кислота
хлорид натрия
цитрат натрия
вода
pH в диапазоне от 3,5 до 5,5
Часть II - Результаты
[00334] Данные о диаметре зрачка и остроте зрения вблизи, полученные в результате исследования, представлены в Таблице 1 ниже. В каждом глазу, по сравнению с исходным уровнем, диаметр зрачка был уменьшен и острота зрения вблизи снизилась на 1, 2, 3 или 4 строки.
ПРИМЕР 8 - Лечение пресбиопии мезилатом фентоламина у человека
[00335] Способность мезилата фентоламина лечить человека, страдающего пресбиопией, можно оценить в соответствии с клиническим исследованием, в котором водный офтальмологический раствор, содержащий мезилат фентоламина, вводят в глаз пациента и затем оценивают улучшение зрения пациента в том числе зрительные характеристики включая зрительные характеристики вблизи. Ниже описаны экспериментальные процедуры и результаты.
Часть I - Экспериментальные процедуры
[00336] Субъекты проходят скрининг на предмет потенциального включения в исследование и, если они соответствуют требованиям, включаются в исследование. Примерные критерии включения и критерии исключения для исследования изложены ниже. Если субъект не соответствует критериям включения/исключения, но исследователь считает, что субъект должен участвовать в исследовании, может быть разрешено отклонение после обсуждения между главным исследователем и спонсором исследования.
Критерии включения
Возраст ≥ 40 и ≤ 65 лет.
Скорректированная острота зрения вблизи (СОЗВ) на расстоянии 20/50 или хуже в обоих глазах.
Наилучшая скорректированная острота зрения вдаль (НСОЗВ) 20/20 или выше на оба глаза и в настоящее время зависит от очков для чтения или бифокальных очков, в которых прибавка вблизи составляет >+1,00 диоптрию.
В остальном субъект здоров и хорошо контролируем.
Уметь и желать дать подписанное информированное согласие и следовать инструкциям исследования.
Уметь самостоятельно принимать исследуемый препарат или получать исследуемый препарат от лица, осуществляющего уход, в течение всего периода исследования.
Критерий исключения
Офтальмологические:
Клинически значимое глазное заболевание по мнению исследователя (например, нелеченная катаракта, пролеченная глаукома, отек роговицы, увеит, тяжелый сухой кератоконъюнктивит), которое может помешать проведению исследования.
Известная гиперчувствительность к любым антагонистам α-адренорецепторов или холинергическим парасимпатомиметическим агентам.
Нежелание или невозможность прекратить использование контактных линз в период лечения.
Глазная травма, глазная хирургия (например, IOНК) или лазерная процедура (например, LASIK, PRK) в течение 5 недель до скрининга.
Недавние или текущие свидетельства глазной инфекции или воспаления в любом глазу. Текущие свидетельства клинически значимого блефарита, конъюнктивита или кератита простого герпеса или опоясывающего герпеса в истории болезни при скрининге любого глаза.
Глазные препараты любого типа в течение 30 дней после скрининга, за исключением а) гипотензивных лекарств для глаз (которые должны быть вымыты в соответствии с предоставленным графиком), б) скрабов для век (которые можно использовать до скрининга, но нельзя использовать после скрининга) или c) смазывающие капли от сухого глаза (искусственные слезы), которые можно использовать на протяжении всего исследования.
Системный:
Известная гиперчувствительность или противопоказания к антагонистам α- и/или β-адренорецепторов (например, хроническая обструктивная болезнь легких или бронхиальная астма; аномально низкое артериальное давление (АД) или частота сердечных сокращений (ЧСС); сердечная блокада второй или третьей степени или застойная сердечная недостаточность (ЗСН); тяжелый диабет).
Известная гиперчувствительность или противопоказания к холинергическим парасимпатомиметическим агентам.
Клинически значимое системное заболевание (например, неконтролируемый диабет, тяжелая миастения, рак, печеночные, почечные, эндокринные или сердечно-сосудистые заболевания), которые могут помешать проведению исследования.
Начало лечения или любые изменения в текущей дозировке, лекарстве или режиме любых местных или системных адренергических или холинергических препаратов не позднее, чем за 7 дней до скрининга или во время исследования.
Участие в любом исследовательском исследовании в течение 30 дней до скрининга.
Женщины детородного возраста, которые беременны, кормят грудью, планируют беременность или не используют приемлемые с медицинской точки зрения формы контроля над рождаемостью. Приемлемые способы включают использование по крайней мере одного из следующих способов: внутриматочная спираль (ВМС), гормональный (пероральный, инъекционный, пластырь, имплант, кольцо), барьер со спермицидом (презерватив, диафрагма) или воздержание. Считается, что взрослая женщина имеет детородный потенциал, если не прошел 1 год в постменопаузе или 3 месяца после хирургической стерилизации. Все женщины детородного возраста должны иметь отрицательный результат теста мочи на беременность при посещении 1/скрининге и посещении 2 и не иметь намерения забеременеть во время исследования.
ЧСС в покое за пределами нормального диапазона (50-110 ударов в минуту) во время скринингового посещения. Измерение ЧСС может быть повторено только один раз, если она выходит за пределы нормального диапазона после по меньшей мере 5-минутного периода отдыха в сидячем положении.
Гипертензия с диастолическим АД в покое >105 мм рт. ст. или систолическим АД >160 мм рт. ст. при скрининговом посещении. Измерение АД можно повторить только один раз, если оно выходит за пределы указанного диапазона после по меньше мере 5-минутного периода отдыха в сидячем положении.
[00337] Люди, включенные в исследование, должны быть рандомизированы на две (или более) группы лечения с рандомизацией 1:1. Группы лечения получат следующие дозы:
Офтальмологический раствор плацебо,
1% мас./мас. офтальмологический раствор мезилата фентоламина,
1,5% мас./мас. офтальмологический раствор мезилата фентоламина,
2% мас./мас. офтальмологический раствор мезилата фентоламина,
1% мас./мас. офтальмологический раствор мезилата фентоламина и 1% офтальмологический раствор пилокарпина HCl,
1% мас./мас. офтальмологический раствор мезилата фентоламина и 0,2-0,25% офтальмологического раствора пилокарпина HCl, или
1% мас./мас. офтальмологический раствор мезилата фентоламина и 0,4-0,5% офтальмологический раствор пилокарпина HCl.
[00338] Предпочтительно доза представляет собой одну каплю офтальмологического раствора, вводимого в глаз субъекта. Группы лечения, получающие препараты, содержащие пилокарпин, могут получать их в виде водных растворов с добавлением или без добавления растительного или минерального масла (например, касторового масла). Описание некоторых исследуемых препаратов представлено в следующей таблице.
3 мМ буфер, содержащий ацетат натрия и уксусную кислоту
вода
pH в диапазоне от 4,8 до 5,0
4% мас./мас. маннита
3 мМ буфер, содержащий ацетат натрия и уксусную кислоту
вода
pH в диапазоне от 4,8 до 5,0
4% мас./мас. маннита
3 мМ буфер, содержащий ацетат натрия и уксусную кислоту
вода
pH в диапазоне от 4,8 до 5,0
4% мас./мас. маннита
3 мМ буфер, содержащий ацетат натрия и уксусную кислоту
вода
pH в диапазоне от 4,8 до 5,0
[00339] Дозы исследуемого препарата вводятся один раз в день в течение первой недели и два раза в день в течение второй недели. Будут оцениваться зрительные характеристики, что может включать анализ остроты зрения вблизи, скорректированную остроту зрения вблизи (СОЗВ), нескорректированную остроту зрения вблизи (НОЗВ), нескорректированную остроту зрения на среднем расстоянии (НОЗСР), наилучшую скорректированную остроту зрения вдаль (НСОЗВ), другие виды измерения остроты зрения и/или опросник по зрению.
[00340] Показатели эффективности включают изменение исходной остроты зрения для исследуемого глаза, неисследуемого глаза, обоих глаз и/или бинокулярного зрения. Примеры конечных точек эффективности включают: долю субъектов, у которых мезопическая, высококонтрастная, бинокулярная СОЗВ достигает 3 строк или более; доля субъектов с улучшением на 2 строки больше или равным от исходного уровня в НОЗВ; ответы на вопросник по зрительным характеристикам между группами лечения в момент времени до лечения на исходном уровне и в различные дни исследования; и другие показатели зрения и безопасности.
ВКЛЮЧЕНИЕ ПРИЗНАКОВ ПО ССЫЛКЕ
[00341] Полное описание каждого из патентных документов и научных статей, упомянутых в данном документе, включено посредством ссылки для всех целей.
ЭКВИВАЛЕНТЫ
[00342] Изобретение может быть реализовано в других конкретных формах без отклонения от его сути или существенных характеристик. Следовательно, вышеизложенные варианты реализации следует рассматривать во всех отношениях как иллюстративные, а не ограничивающие изобретение, описанное в данном документе. Таким образом, объем изобретения указан в прилагаемой формуле изобретения, а не в предшествующем описании, и все изменения, которые подпадают под значение и диапазон эквивалентности формулы изобретения, предназначены для включения в нее.

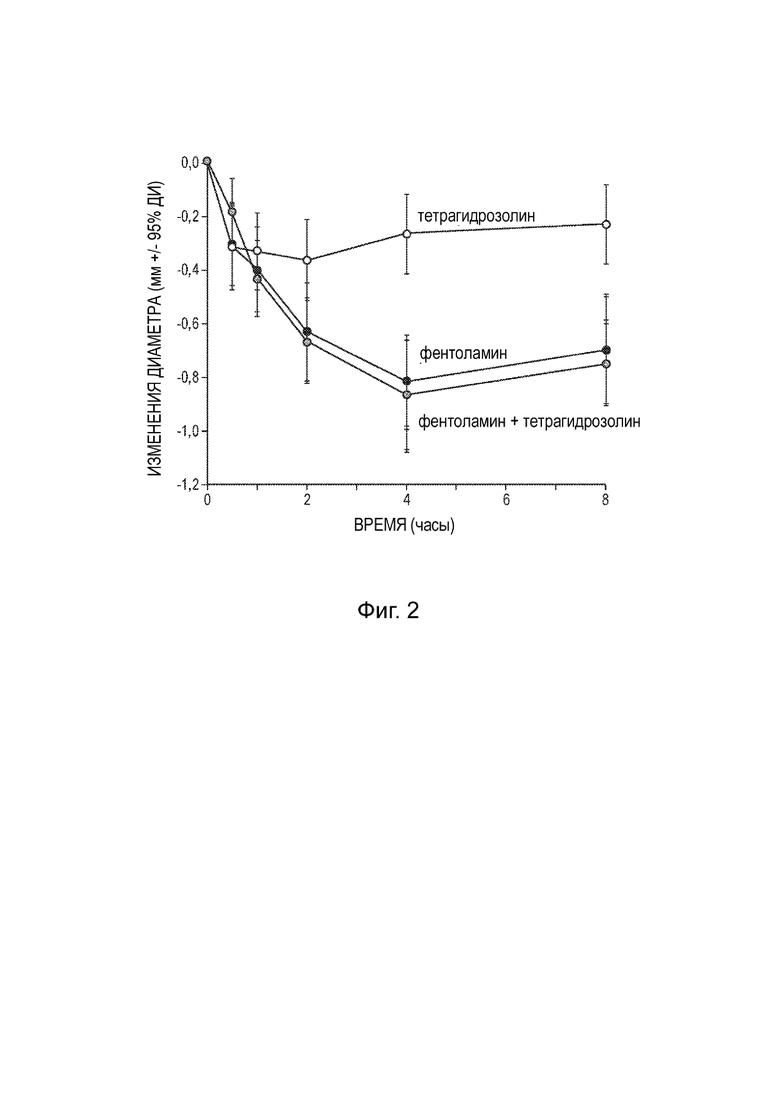
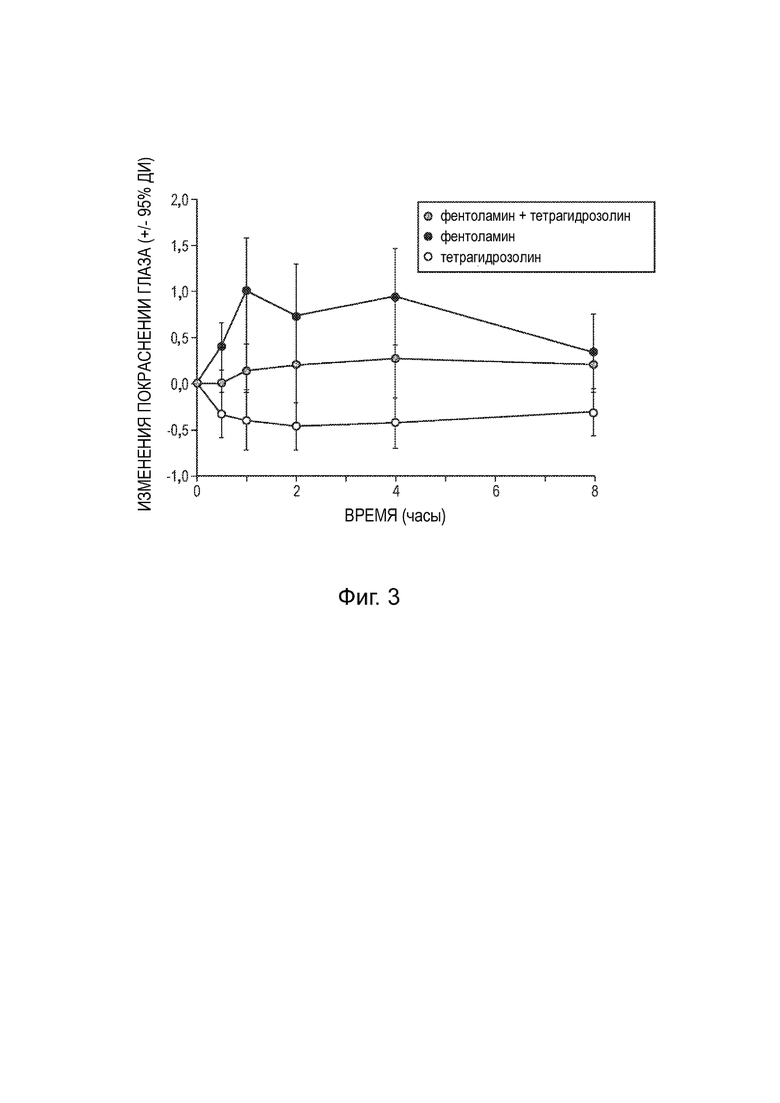
Группа изобретений относится к области фармацевтической промышленности, а именно к способам лечения мидриаза. Способ лечения мидриаза у пациента включает введение в глаз пациента, нуждающегося в этом, дозы альфа-адренергического антагониста, которая составляет от 0,2 до 0,7 мг мезилата фентоламина, для лечения мидриаза, где мидриаз возникает из-за того, что пациент получил средство, вызывающее расширение зрачка. Способ лечения мидриаза у пациента, включающий введение в глаз пациента, нуждающегося в этом, дозы альфа-адренергического антагониста, которая представляет собой одну или две глазные капли раствора, содержащего мезилат фентоламина, для лечения мидриаза отличается тем, что мидриаз вызван тем, что пациент получил средство, вызывающее расширение зрачка. Использование группы изобретений обеспечивает длительное уменьшение диаметра зрачка в диапазоне от 1,8 до 2,1 мм в течение более 3 часов, не вызывая нежелательных побочных эффектов в виде покраснения глаз, жжения, боли в бровях или чрезмерного уменьшения диаметра зрачка ниже 1,6 мм, а также группа изобретений позволяет улучшить аккомодацию и снизить внутриглазное давление. 2 н. и 39 з.п. ф-лы, 3 ил., 34 табл., 8 пр.
1. Способ лечения мидриаза у пациента, включающий введение в глаз пациента, нуждающегося в этом, дозы альфа-адренергического антагониста, которая составляет от 0,2 до 0,7 мг мезилата фентоламина, для лечения мидриаза, где мидриаз возникает из-за того, что пациент получил средство, вызывающее расширение зрачка.
2. Способ лечения мидриаза у пациента, включающий введение в глаз пациента, нуждающегося в этом, дозы альфа-адренергического антагониста, которая представляет собой одну или две глазные капли раствора, содержащего мезилат фентоламина, для лечения мидриаза, отличающийся тем, что мидриаз вызван тем, что пациент получил средство, вызывающее расширение зрачка.
3. Способ по п. 1 или 2, отличающийся тем, что мидриаз вызван тем, что пациент получил одно или несколько из атропина, циклопентолата, гоматропина, скополамина, тропикамида, флубипрофена, супрофена, гидроксиамфетамина, фенилэфрина, циклопентолата, кеторолака или их фармацевтически приемлемой соли.
4. Способ по п. 1 или 2, отличающийся тем, что мидриаз вызван тем, что пациент получил одно или несколько из атропина, циклопентолата, гоматропина, скополамина, тропикамида или их фармацевтически приемлемой соли.
5. Способ по п. 1 или 2, где мидриаз вызван приемом пациентом одного или нескольких из тропикамида, фенилэфрина или их фармацевтически приемлемой соли.
6. Способ по п. 1 или 2, где мидриаз вызван приемом пациентом тропикамида или его фармацевтически приемлемой соли.
7. Способ по п. 1 или 2, где мидриаз вызван приемом пациентом фенилэфрина или его фармацевтически приемлемой соли.
8. Способ по любому из пп. 1-7, отличающийся тем, что дозу вводят в глаз не чаще одного раза в день.
9. Способ по любому из пп. 1-8, отличающийся тем, что пациент испытывает уменьшение диаметра зрачка по меньшей мере на 1 мм при измерении в фотопических условиях относительно диаметра зрачка пациента в тех же фотопических условиях, но не получившего указанную дозу.
10. Способ по любому из пп. 1-8, отличающийся тем, что пациент испытывает уменьшение диаметра зрачка по меньшей мере на 2 мм при измерении в фотопических условиях относительно диаметра зрачка пациента в тех же фотопических условиях, но не получившего указанную дозу.
11. Способ по любому из пп. 1-8, отличающийся тем, что пациент испытывает уменьшение диаметра зрачка по меньшей мере на 3 мм при измерении в фотопических условиях относительно диаметра зрачка пациента в тех же фотопических условиях, но не получившего указанную дозу.
12. Способ по любому из пп. 1-8, отличающийся тем, что у пациента наблюдается уменьшение диаметра зрачка в диапазоне от 0,5 до 5 мм при измерении в фотопических условиях относительно диаметра зрачка пациента в тех же фотопических условиях, но не получившего указанную дозу.
13. Способ по любому из пп. 1-8, отличающийся тем, что у пациента наблюдается уменьшение диаметра зрачка по меньшей мере на 1 мм при измерении в мезопических условиях относительно диаметра зрачка пациента в тех же мезопических условиях, но не получившего указанную дозу.
14. Способ по любому из пп. 1-8, отличающийся тем, что у пациента наблюдается уменьшение диаметра зрачка по меньшей мере на 2 мм при измерении в мезопических условиях относительно диаметра зрачка пациента в тех же мезопических условиях, но не получившего указанную дозу.
15. Способ по любому из пп. 1-8, отличающийся тем, что у пациента наблюдается уменьшение диаметра зрачка по меньшей мере на 3 мм при измерении в мезопических условиях относительно диаметра зрачка пациента в тех же мезопических условиях, но не получившего указанную дозу.
16. Способ по любому из пп. 1-8, отличающийся тем, что у пациента наблюдается уменьшение диаметра зрачка в диапазоне от 0,5 до 5 мм при измерении в мезопических условиях относительно диаметра зрачка пациента в тех же мезопических условиях, но не получившего указанную дозу.
17. Способ по любому из пп. 1-16, отличающийся тем, что доза альфа-адренергического антагониста содержит 0,25 мг мезилата фентоламина.
18. Способ по любому из пп. 1-16, отличающийся тем, что доза альфа-адренергического антагониста содержит от 0,4 до 0,6 мг мезилата фентоламина.
19. Способ по любому из пп. 1-16, отличающийся тем, что доза альфа-адренергического антагониста содержит 0,5 мг мезилата фентоламина.
20. Способ по любому из пп. 1-19, отличающийся тем, что доза альфа-адренергического антагониста находится в форме 1%-ного по массе раствора мезилата фентоламина.
21. Способ по любому из пп. 1-20, отличающийся тем, что доза альфа-адренергического антагониста находится в форме офтальмологического раствора, содержащего воду, полиол и мезилат фентоламина.
22. Способ по любому из пп. 1-20, отличающийся тем, что доза альфа-адренергического антагониста находится в форме офтальмологического раствора, содержащего воду, полиол, карбоксилат щелочного металла и мезилат фентоламина.
23. Способ по любому из пп. 1-20, отличающийся тем, что доза альфа-адренергического антагониста находится в форме офтальмологического раствора, содержащего водный фармацевтически приемлемый носитель и мезилат фентоламина.
24. Способ по любому из пп. 1-20, отличающийся тем, что доза альфа-адренергического антагониста находится в форме офтальмологического раствора, содержащего воду, маннит и мезилат фентоламина.
25. Способ по любому из пп. 1-20, отличающийся тем, что доза альфа-адренергического антагониста находится в форме офтальмологического раствора, содержащего воду, маннит, ацетат натрия и мезилат фентоламина.
26. Способ по любому из пп. 1-19, отличающийся тем, что доза альфа-адренергического антагониста находится в форме офтальмологического раствора, свободного от хелатирующего агента, содержащего:
(a) от 0,1 до 2% мас./об. мезилата фентоламина;
(б) от 1% мас./об. до 6% мас./об. по меньшей мере одного полиольного соединения, выбранного из группы, состоящей из маннита, глицерина и пропиленгликоля;
(в) от 1 до 6 мМ ацетата щелочного металла; и
(г) воду;
причем раствор имеет pH в диапазоне от 4 до 6 и свободен от хелатирующего агента.
27. Способ по любому из пп. 1-19, отличающийся тем, что доза альфа-адренергического антагониста находится в форме офтальмологического раствора, свободного от хелатирующего агента, содержащего:
(a) от 0,5% мас./об. до 2% мас./об. мезилата фентоламина;
(б) от 1% мас./об. до 6% мас./об. по меньшей мере одного полиольного соединения, выбранного из группы, состоящей из маннита, глицерина и пропиленгликоля;
(в) от 1 мМ до 6 мМ ацетата щелочного металла; и
(г) воду;
причем раствор имеет pH в диапазоне от 4,5 до 5,5 и свободен от хелатирующего агента.
28. Способ по п. 26 или 27, отличающийся тем, что по меньшей мере один полиол представляет собой маннит.
29. Способ по п. 26 или 27, отличающийся тем, что раствор содержит 4% мас./об. маннита.
30. Способ по любому из пп. 26-29, отличающийся тем, что ацетат щелочного металла представляет собой ацетат натрия.
31. Способ по любому из пп. 26-29, отличающийся тем, что раствор содержит 3 мМ ацетата натрия.
32. Способ по любому из пп. 1-19, отличающийся тем, что доза альфа-адренергического антагониста находится в форме офтальмологического раствора, свободного от хелатирующего агента, содержащего:
(a) от 0,25 до 2% мас./об. мезилата фентоламина;
(б) от 3 до 5% мас./об. маннита;
(в) от 2 до 4 мМ ацетата натрия; и
(г) воду;
причем раствор имеет pH в диапазоне от 4,5 до 5,2 и свободен от хелатирующего агента.
33. Способ по любому из пп. 1-19, отличающийся тем, что доза альфа-адренергического антагониста находится в форме офтальмологического раствора, свободного от хелатирующего агента, содержащего:
(a) от 0,5 до 2% мас./об. мезилата фентоламина;
(б) от 3 до 5% мас./об. маннита;
(в) от 2 до 4 мМ ацетата натрия; и
(г) воду;
причем раствор имеет pH в диапазоне от 4,6 до 5,2 и свободен от хелатирующего агента.
34. Способ по любому из пп. 1-19, отличающийся тем, что доза альфа-адренергического антагониста находится в форме офтальмологического раствора, свободного от хелатирующего агента, содержащего:
(a) от 0,5 до 1% мас./об. мезилата фентоламина;
(б) 4% маннита;
(в) 3 мМ ацетата натрия; и
(г) воду;
причем раствор имеет pH в диапазоне от 4,6 до 5,2 и свободен от хелатирующего агента.
35. Способ по любому из пп. 1-19, отличающийся тем, что доза альфа-адренергического антагониста находится в форме офтальмологического раствора, содержащего:
(a) от 0,25 до 2% мас./об. мезилата фентоламина;
(б) от 3 до 5% мас./об. маннита;
(в) от 1 до 6 мМ ацетата натрия; и
(г) воду;
причем раствор имеет pH в диапазоне от 4,5 до 5,2 и свободен от какого-либо дополнительного компонента, который представляет собой хелатирующий агент.
36. Способ по любому из пп. 1-19, отличающийся тем, что доза альфа-адренергического антагониста находится в форме офтальмологического раствора, содержащего: (а) 1% мас./об. мезилата фентоламина; (б) 4% мас./об. маннита; (в) 3 мМ буфера, содержащего ацетат натрия; и (г) воду; причем раствор имеет pH в диапазоне от 4,5 до 5,5 и свободен от какого-либо дополнительного компонента, который является хелатирующим агентом.
37. Способ по любому из пп. 1-36, отличающийся тем, что дозу альфа-адренергического антагониста вводят в виде глазных капель.
38. Способ по любому из пп. 1-36, отличающийся тем, что дозу альфа-адренергического антагониста вводят в виде одной глазной капли.
39. Способ по любому из пп. 1-38, отличающийся тем, что пациентом является взрослый человек.
40. Способ по любому из пп. 1-38, отличающийся тем, что пациентом является гериатрический человек.
41. Способ по любому из пп. 1-40, отличающийся тем, что острота зрения пациента вдаль не снижена.
| WO 2010135731 A1, 25.11.2010 | |||
| Электроподогреватель воздуха аэродинамической трубы преимущественно больших сверхзвуковых скоростей | 1958 |
|
SU119364A1 |
| US 2002187986 A1, 12.12.2002 | |||
| WO 2009077736 A2, 25.06.2009 | |||
| WO 2014121027 A1, 07.08.2014. | |||
Авторы
Даты
2024-08-06—Публикация
2019-10-25—Подача