Область, к которой относится изобретение
Изобретение относится к соединениям, которые обладают антиангиогенной активностью. В частности изобретение относится к конъюгатам антиангиогенных пептидов и гиалуроновой кислоты, а также к методам их получения и применения.
Предшествующий уровень техники
Известно, что возрастная макулярная дистрофия (ВМД) и диабетическая ретинопатия (ДР) являются наиболее распространенными заболеваниями глаз, которые существенно ухудшают качество жизни и являются главной причиной потери зрения среди возрастных групп старше 40 лет. Данные заболевания имеют несколько подтипов, за каждым из которых стоят различные патологические процессы, но основным, приводящим к слепоте, является неоваскуляризация, связанная с избыточной активностью фактора роста эндотелия сосудов (VEGF). Использование ингибиторов VEGF на основе антител и аптамеров, таких как пегаптаниб (Macugen®, Eyetech/Pfizer), ранибизумаб (Lucentis®, Novartis), афлиберцепт (Eylea®, Bayer), бевацизумаб (Avastin®, Genetech), позволило создать эффективные препараты для блокирования патологической неоваскуляризации, купирования нарушения зрения и, в лучшем случае, восстановления зрения. Одним из основных недостатков использования таких ингибиторов является необходимость в частых интравитреальных инъекциях с интервалом в 1, максимум 2 месяца, курсом 3-8 инъекций в связи с быстрым выведением ингибиторов VEGF из интравитреальной области, что очень неудобно для пациента и может спровоцировать такие осложнения, как повышение внутриглазного давления, гемофтальм, эндофтальмит и другие. Недостатком данного метода лечения является также то, что концентрация препарата при интравитриальных введениях может значительно колебаться.
Активно разрабатываемым направлением решения данной проблемы является получение конъюгатов ингибиторов VEGF с биополимерными носителями, которые способствуют увеличению времени нахождения ингибитора в месте, где необходимо блокирование неоваскуляризации. Например, для этой цели были использованы гликозаминогликаны, такие как гепарин или гепаран сульфат [1], полимерные частицы на основе полимолочной и полигликолевой кислот и их сополимера [2], гидрогели на основе полиэтиленгликоля [3]. С этой точки зрения наиболее перспективным носителем является гиалуроновая кислота как один из основных компонентов стекловидного тела, области, куда вводятся терапевтические инъекции при лечении ВМД и ДР, который имеет период полуобновления в нем порядка 70 дней [4]. Например, в патентах [5] и [6] гиалуроновая кислота использовалась как носитель VEGF ингибиторов (антител) путем их ковалентного присоединения карбодиимидным методом. В [7] анти-VEGF полипептиды с молекулярной массой от 5 до 2000 кДа также ковалентно присоединяли к гиалуроновой кислоте для увеличения продолжительности их действия.
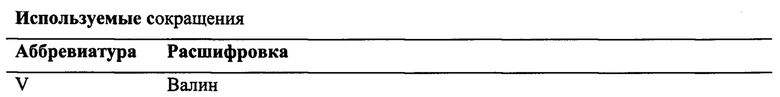
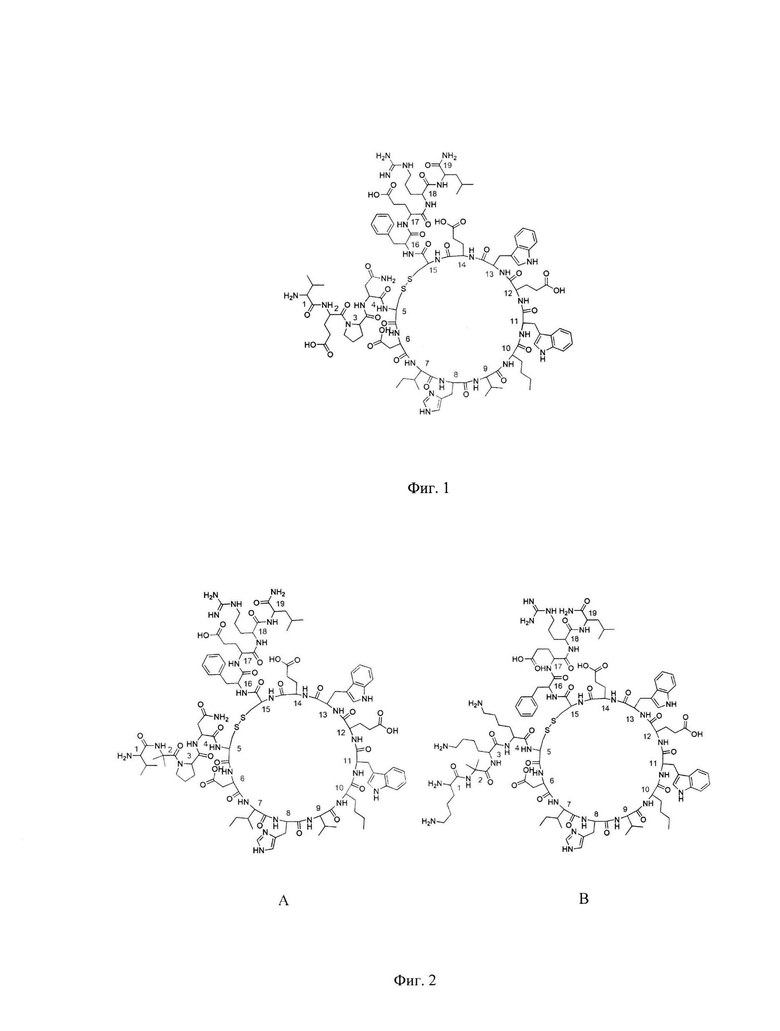
Небольшие пептиды (до 3 кДа) как ингибиторы VEGF имеют ряд преимуществ, таких как простота получения и модификации для увеличения протеолитической стабильности с одновременным сохранением VEGF-связывающей активности. Например, Haase описал пептид v114* (VEPNCDIHVnLWEWECFERL) с высокой анти-VEGF активностью (Фиг. 1, Seq ID NO: 1) [8]. В патенте авторов Гурьянов И.А. и др. [9] путем введения в структуру данного пептида остатка α-аминоизобутановой кислоты были получены пептиды Aib2 (VAibPNCDIHVnLWEWECFERL, Seq ID NO: 2) и kv114* (KAibKKCDIHVLWEWECFERL, Seq ID NO :3) с высокой аффинностью к VEGF и увеличенной устойчивостью к действию ферментов. Однако недостатком дан,ных пептидов является быстрое выведение их из витреального тела.
Известны конъюгаты, описанные в патенте [10], в котором Aib2 и kv114* были ковалентно присоединены к наночастицам на основе полиаминокислот как носителям, было показано, что при этом аффинность пептида Aib2 не меняется, а аффинность kv114* увеличивается вследствие его взаимодействия с носителем. При этом антиангиогенная активность конъюгатов исследована не была.
Недостатком известного способа [10], принятого в качестве наиболее близкого аналога (прототипа), помимо неисследованной антиангиогенной активности конъюгатов, является трудоемкость получения наночастиц на основе полиаминокислот, которое включает в себя большое количество стадий, таких как синтез мономеров, полимеризация, деблокирование защитных групп, получение наночастиц, ковалентное присоединение пептидов и очистка полученных конъюгатов. Кроме того, описанные полиаминокислоты имеют молекулярную массу 6-8 кДа, недостаточную для длительного удержания в витреальной жидкости глаза.
Заявляемое изобретение свободно от указанных недостатков и в нем предложены простые в получении конъюгаты пептидов kv114* и Aib2 с окисленной высокомолекулярной гиалуроновой кислотой с улучшенной антиангиогенной активностью по сравнению со свободными пептидами. Общий принцип построения таких конъюгатов без раскрытия особенностей структуры и количественных характеристик, условий получения и применения был ранее опубликован авторами в виде Материалов конференции [11].
Целью заявленного изобретения и технической задачей, лежащей в его основе, является увеличение аффинности пептида kv114* к фактору роста эндотелия сосудов и увеличение антиангиогенной активности пептидов kv114* и Aib2 путем их взаимодействия с окисленной гиалуроновой кислотой. Было обнаружено, что комбинирование окисленной гиалуроновой кислоты с пептидом kv114* приводит к существенному увеличению его способности к связыванию VEGF. Кроме того, такое комбинирование приводит к улучшенной антиангиогенной активности пептидов kv114* и Aib2, по сравнению с коммерчески используемым ингибитором VEGF (Авастином).
Указанная цель достигается тем, что в соответствии с заявленным изобретением конъюгат пептида и окисленной гиалуроновой кислоты с молекулярной массой 115-3000 кОа включает образование анти-VEGF пептидом альдиминной связи с одной или двумя альдегидными группами, имеющимися во фрагменте окисленной гиалуроновой кислоты.
Заявленное изобретение поясняется Фиг. 1-15, на которых представлены структуры и физико-химические харктеристики описываемых соединений и их VEGF-связывающая активность, а также антиангиогенная активность, исследованная на модельных животных:
Фиг. 1: Структура пептида v114* (Seq ID NO: 1).
Фиг. 2: Структура пептидов Aib2 (A, Seq ID NO :2) и kv114* (В, Seq ID NO:3).
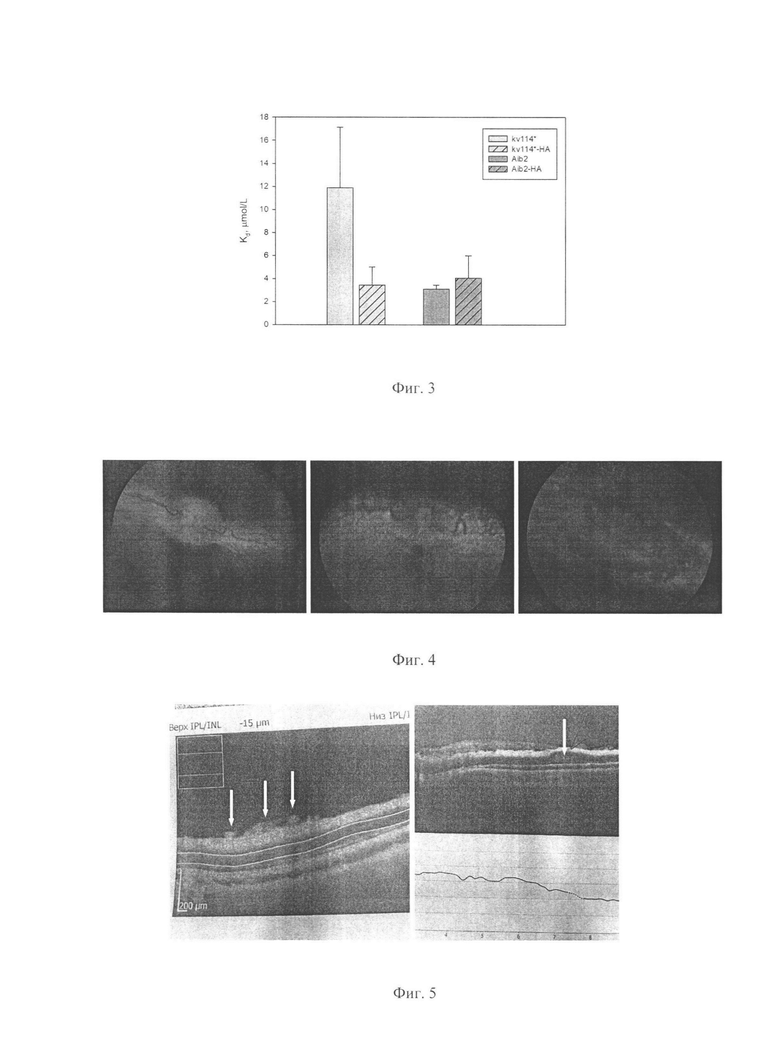
Фиг. 3: Аффинность связывания фактора роста эндотелия сосудов анти-VEGF пептидами и их конъюгатами с окисленной гиалуроновой кислотой.
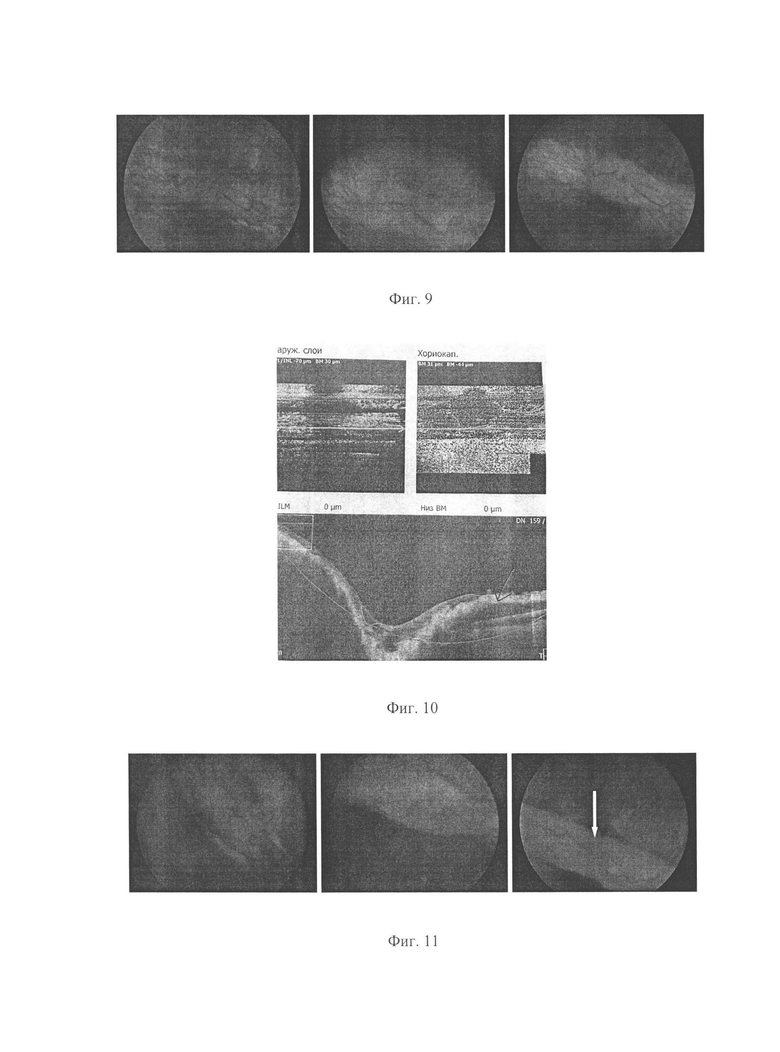
Фиг. 4: Развитие патологического процесса на глазном дне кролика в динамике (слева направо): Нормальное глазное дно кролика. ДЗН контурирован, от диска ЗН отходят миелиновые волокна с сосудами в соотношении а/в=2/3, сетчатка в перипапиллярной зоне розовая, патологических рефлексов нет; глазное дно этого же кролика на 21 сутки от начала формирования модели: ДЗН гиперемирован, границы стушеваны, соотношение артерии/вены=1/6, сетчатка вокруг отечная, геморрагий нет, миелиновые волокна скрыты под сетью расширенных сосудов; глазное дно этого же кролика на 30 сутки от начала введения VEGF 165: контуры ДЗН не дифференцируются, диск ЗН резко гиперемирован, сосуды резко расширены, извиты, по ходу сосудов множественные геморрагии, миелиновые волокна практически не просматриваются.
Фиг. 5: Ангио-томограммы сетчатки кролика с патологическим ангиогенезом. Профиль внутренней сетчатки волнообразно деформирован за счет гипорефлективного пространства между пигментным эпителием и нейросенсорной сетчаткой (отек): (слева) визуализируются активные новообразованные сосуды преретинально (указаны стрелкой); (справа) визуализируются активные новообразованные сосуды в слоях сетчатки. Фиг. 6: Глазное дно кролика № 2 (1 группа, контроль), слева направо: на 1-й день после последнего введения VEGF, на 7-й день после последнего введения VEGF, на 30-й день после последнего введения VEGF. Сохраняется отек сетчатки и ЗН, выраженные изменения сосудов, геморрагии.
Фиг. 7: Глазное дно кролика № 7 (2 группа, Авастин) на 15-й день (слева) и на 30-й день (справа) после введения Авастина. К концу исследования сохраняются измененные ретинальные сосуды и пролиферативные изменения (указаны стрелками).
Фиг. 8: Ангио-томограмма сетчатки кролика № 4 (2 группа, Авастин): преретинально определяются точечные гиперрефлективные включения над ДЗН и перипапиллярно. Перипапиллярно просматривается «изъеденность» ВПМ и миелиновых волокон. Сосудистая активность не определяется.
Фиг. 9: Глазное дно кролика № 5 (3 группа, kv114*-аГК) (слева направо): перед введением kv114*-аГК, на 7-й день после введения kv114*-аГК, на 30-й день после введения kv114*-аГК - при офтальмоскопии видна положительная динамика сосудистых изменений и регресс отека сетчатки и зрительного нерва. Отмечается значительное уменьшение отека диска ЗН и сетчатки, уменьшение толщины миелиновых волокон, нормализация ретинальных сосудов, отсутствие геморрагий к концу исследования.
Фиг. 10: Ангио-томограмма сетчатки кролика № 1 (3 группа, kv114*-arK) на 45-й день после введения kv114*-arK. Значительно уменьшилась толщина слоя миелиновых волокон (с 420 μm до 187 μm) и увеличилась их плотность. Отек нейроэпителия сетчатки уменьшился, сосудистая активность значительно снизилась.
Фиг. 11: Глазное дно кролика № 6 (4 группа, Aib2-aTK) (слева направо): перед введением Аш2-аГК, на 7-й день после введения A1b2-аГК, на 30-й день после введения Aib2-аГК. Отмечается выраженное уменьшение отека диска ЗН и сетчатки, уменьшение толщины миелиновых волокон, нормализация ретинальных сосудов, отсутствие геморрагии. Стрелкой указаны преретинальные пролиферативные изменения.
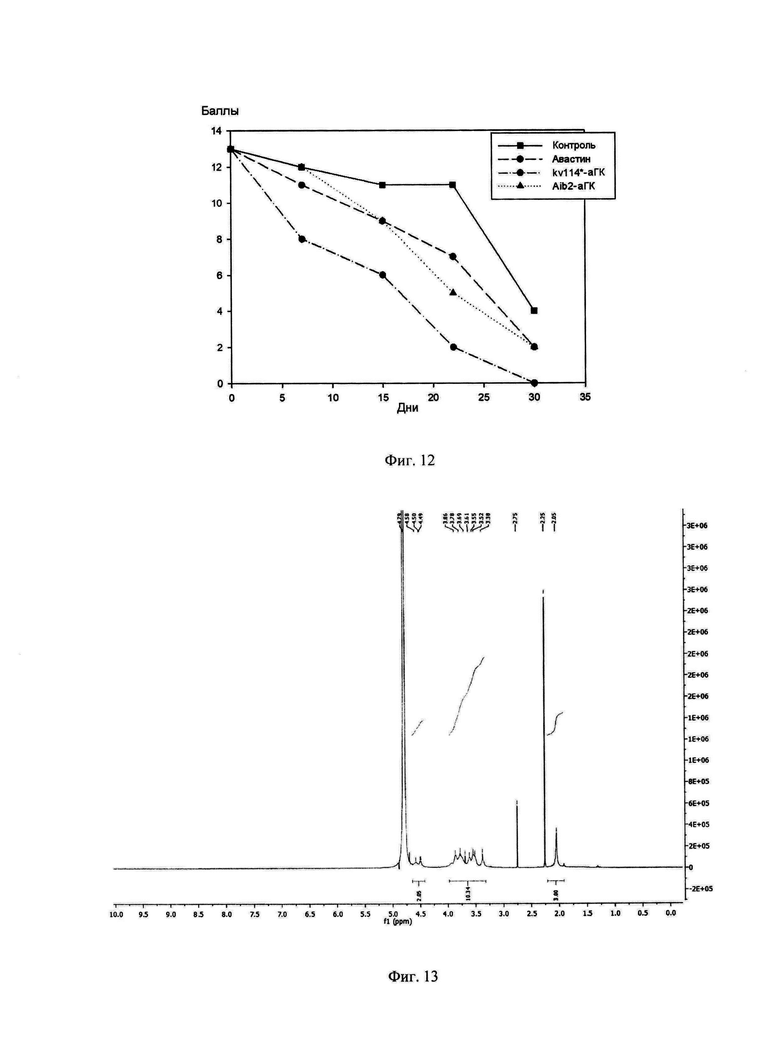
Фиг. 12: Динамика регресса патологических состояний при введении Анти-VEGF препаратов.
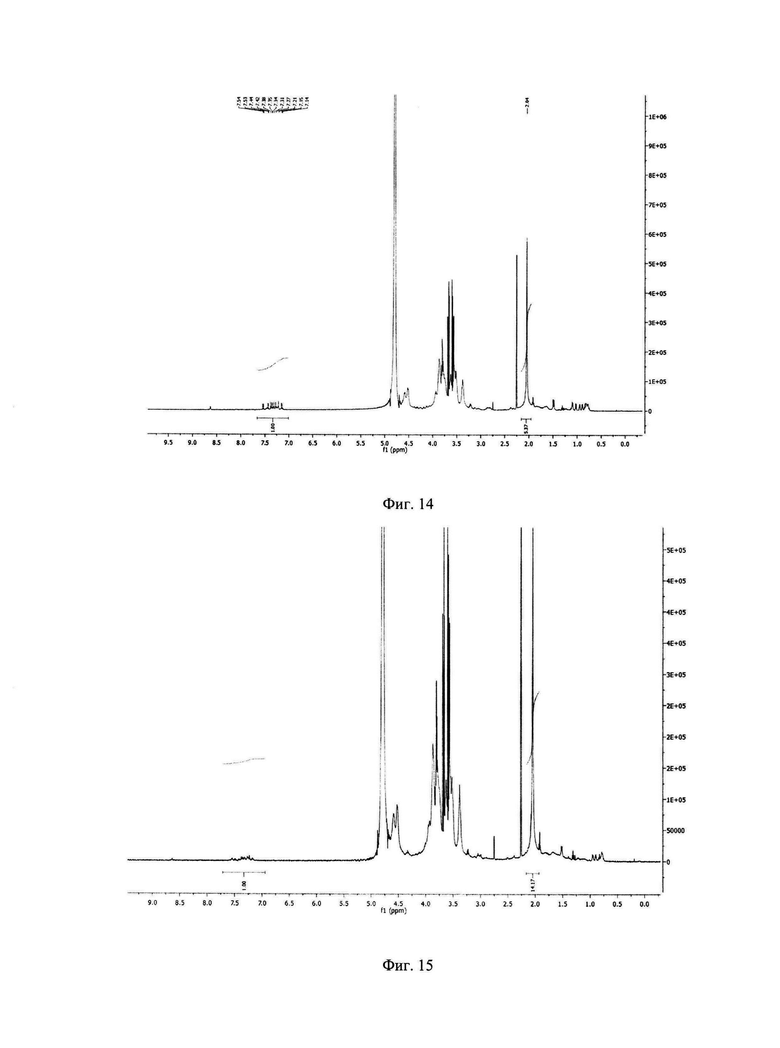
Фиг. 13: Спектр ЯМР окисленной гиалуроновой кислоты.
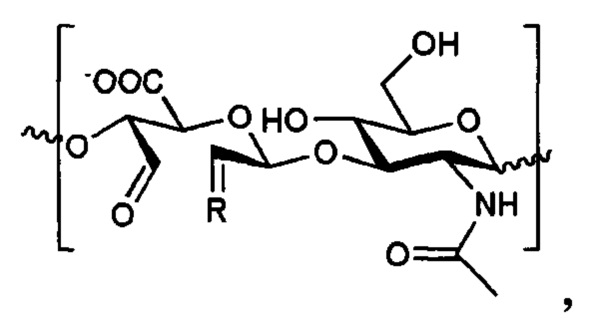
Фиг. 14: Спектр ЯМР Aib2-aHA.
Фиг. 15: Спектр ЯМР kv114*-аНА.
Описание изобретения
Определения
Пептид представляет собой индивидуальное соединение, состоящее из аминокислот, соединенных амидной связью и чередующихся в четко определенном порядке. Пептиды могут быть получены с помощью пошагового присоединения аминокислот, например, с помощью твердофазного метода или путем синтеза в растворе.
«Связывание» или аффинность определяется как способность описанных в данном изобретении соединений образовывать комплекс с другим соединением, в данном случае с VEGF. Пептиды и конъюгаты в данном изобретении связывают VEGF с констатной диссоциации (KD) предпочтительно меньше чем 12 μМ, более предпочтительно, меньше чем 5 5 μМ.
Под окисленной гиалуроновой кислотой в данном изобретении понимается гиалуроновая кислота, содержащая альдегидные группы.
Под конъюгатом окисленной гиалуроновой кислоты и пептида в данном изобретении понимается соединение, содержащее в своем составе окисленную гиалуроновую кислоту и анти-VEGF пептид.
Получение пептидов Aib2 и kv114*, содержащих α-аминоизобутановую кислоту
Пептиды Aib2 и kv114*, содержащие α-аминоизобутановую кислоту, могут быть получены различными методами, широко известными специалистам в этой области, например, как описано в [9]. В данном изобретении пептиды были получены твердофазным методом на Ринк-амидной смоле. Схема твердофазного синтеза предполагает иммобилизацию С-концевой аминокислоты на полимерной смоле посредством ковалентной связи с линкером. Последний фиксирует пептид в течение пошаговых реакций конденсации и промежуточных очисток реакционной смеси для построения аминокислотной последовательности. По окончании формирования пептида его легко удалить с носителя. Образование дисульфидной связи предпочтительно проводить в щелочной среде, например, в водном растворе аммиака, в связи с тем, что аммиак легко удаляется из реакционной среды и не образует примесей на этапе лиофильной сушки. Для ускорения реакции окисления можно использовать добавление раствора пероксида водорода. На последней стадии синтеза пептиды могут быть очищены с помощью ВЭЖХ и лиофилизованы. Структуры пептидов приведены на Фиг. 2.
Получение гиалуроновой кислоты, содержащей альдегидные группы
Окисление гиалуроновой кислоты может быть проведено с помощью различных окислителей с образованием альдегидных групп [12]. Они легко вступают в обратимую реакцию с первичными аминогруппами и образуют соединения с альдиминной связью (основания Шиффа). В данном изобретении было использовано окисление периодатом натрия, которое является наиболее распространенным и доступным способом получения альдегид-содержащих производных гиалуроновой кислоты. Реакции окисления и гидролиза сопряжены с рисками фрагментации полимерных цепей и значительного уменьшения средних молекулярных масс гиалуроновой кислоты, что может ухудшать свойства ее окисленного производного в качестве пролонгирующего носителя вследствие более быстрой деградации и выведения in vivo, поскольку при уменьшении длины полимерной цепи время, необходимое для ферментативного расщепления и гидролиза также уменьшается [13]. Для решения задачи увеличения времени деградации конъюгатов с анти-VEGF препаратами в физиологических условиях предпочтительной молекулярной массой окисленной гиалуроновой кислоты является масса не ниже 500 кДа [13]. При окислении важным фактором является фотохимический катализ реакции. При проведении реакции на свету скорость окисления полисахаридной цепи существенно возрастает, поэтому его необходимо проводить в темноте [14]. При проведении реакции на свету содержание альдегидных групп увеличивается, а при уменьшении количества введенного в реакцию периодата натрия существенно уменьшается (Табл. 2).

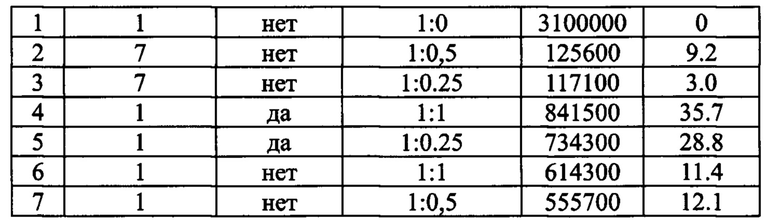
Конъюгаты пептид-аГК с образованием иминной связи могут быть получены смешиванием компонентов в воде с последующим удалением непрореагировавшего пептида путем фильтрования с помощью подходящей мембраны, позволяющей отделить низкомолекулярный компонент (пептид) от высокомолекулярного конъюгата, например, с помощью центрифужного концентрирования и промывания водой для удаления непрореагировавшего пептида с последующей лиофилизацией продукта (Табл. 3).

Определение VEGF-связывающей активности пептидов.
Данные по исследованию взаимодействия пептидов и конъюгатов аГК-пептид, полученные методом микроскопического термофореза (МСТ) показывают, что присоединение пептида увеличивает или не меняет VEGF-связывание, по сравнению со свободным пептидом (Фиг. 3). Подобная зависимость была обнаружена в случае ковалентного присоединения пептидов к наночастицам на основе полиаминокислот [10].
Модель патологического ангиогенеза может быть получена различными методами, например, лазерной фотокоагуляцией [15] или путем интраретинального введения VEGF 165 [16]. Во втором случае последовательное нарушение проницаемости ретинальных сосудов и индукция роста новообразованных сосудов сетчатки и зрительного нерва у кроликов за счет 6-кратного введения VEGF 165 в общей сложности 15 мкг в полость стекловидного тела дает возможность анализировать вышеуказанные патологические изменения в динамике. Развитие процесса у экспериментальных животных протекает достаточно быстро, но вместе с тем позволяет контролировать процесс неоваскуляризации. Пример развития патологического ангиогенного процесса на глазном дне животных после введения VEGF 165 представлен на Фиг. 4.
Офтальмоскопическая картина включала изменения на глазном дне кроликов в виде отека сетчатки в перипапиллярной зоне и зрительного нерва. После последней инъекции VEGF 165 на глазном дне экспериментальных животных регистрировались ретинальные геморрагии и выраженное расширение сосудов сетчатки, диск ЗН был гиперемирован, границы стушеваны, миелиновые волокна четко не визуализировались. Соотношение артерий к венам определялось, как 1/6-1/8, вены были полнокровны, расширены, резко извиты. При этом на 6 глазах были выявлены геморрагии по ходу сосудов, ДЗН и миелиновых волокнах. Активные новообразованные сосуды (как субретинальные, так и по поверхности ДЗН) были зарегистрированы у всех животных. Данные изменения были в 100% случаев (N=8 глаз). Группы были однородными по составу: модель неоваскуляризации сетчатки и зрительного нерва была сформирована у всех животных на левом глазу (N=8 глаз), что было подтверждено как офтальмоскопически, так и при помощи ангио-ОКТ сетчатки (Фиг. 5, Табл. 4).
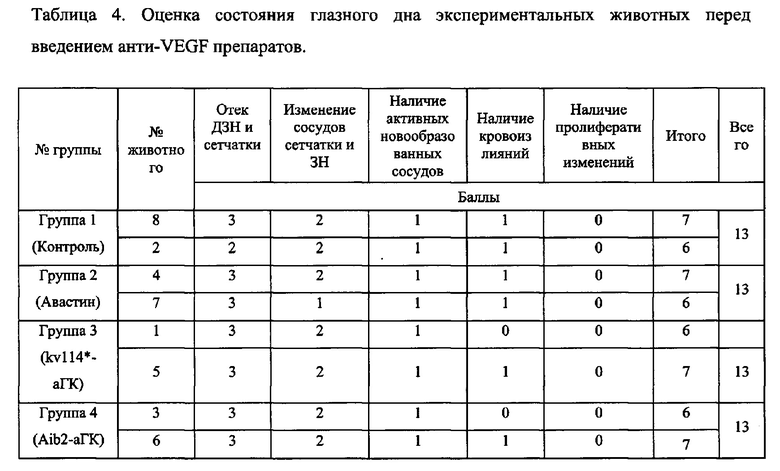
Для тестирования антиангиогенных препаратов в данном изобретении использовалось 8 кроликов:
В зависимости от введения препарата кролики были распределены следующим образом (Таблица 5).

При интравитреальном введении всех анти-VEGF препаратов наблюдалась положительная динамика сосудистых изменений и регресс отека сетчатки и зрительного нерва уже с 7-10 дня наблюдения. На 37-й день эксперимента у всех животных регистрировалась положительная динамика на глазном дне в виде уменьшения отека сетчатки. Кроме того, в 3-й группе (kv114*-аГК), отмечалась также положительная динамика со стороны сосудов сетчатки и ЗН в виде нормализации соотношения артерий к венам. Также у 2-х животных из 3-й группы (kv114*-arK) и одного животного из 4-й группы (Aib2-аГК) отмечался регресс геморрагий, чего не было в группе контроля. К 45-му дню исследования у всех животных отмечалась резорбция геморрагий сетчатки, за исключением одного животного из контрольной группы, где ретинальные кровоизлияния сохранялись до конца эксперимента (до 60-го дня). Процесс блокирования ангиогенного процесса представлен на рис Фиг 6-11.
На Фиг 12 представлена динамика изменений на глазном дне животных. Суммарное количество баллов в 3-й группе к 15-му дню было в 1,5 раза меньше, чем в 4-й группе (6 и 9 баллов соответственно) и почти в 2 раза меньше, чем в группе контроля (6 и 11 баллов соответственно). Через месяц после введения Анти-VEGF регресс отека сетчатки и ЗН, также, как и нормализация сосудов на глазном дне был более быстрым и выраженным в группе 3 (0 баллов в группе 3 и 4 балла в контроле). При этом сосудистые изменения, геморрагии, а также умеренный отек ЗН и сетчатки сохранялись до завершения эксперимента. В группах, где использовался kv114*-аГК и Aib2-aTK отмечалась более быстрая и выраженная положительная динамика изменений на глазном дне кроликов по сравнению с контрольной группой. Несмотря на то, что отек сетчатки и ЗН у животных 1-й группы (контроль) через 6 недель стал уменьшаться, сосудистые изменения сохранялись до конца исследования.
При сравнительной оценке динамики регресса патологических сосудистых изменений на глазном дне после однократного интравитриального введения Авастина, kv114*-аГК и Aib2-aTK было выявлено следующее. В течение 2-х недель после введения ингибиторов ангиогенеза положительная динамика отмечалась во всех трех группах исследования. При офтальмоскопии глазного дна кроликов было выявлено, что лучшие результаты были достигнуты в группе 3, где применялся kv114*-аГК (6 баллов на 45-й день). По ангио-томографии сетчатки выявлено, что новообразованных сосудов стало гораздо меньше, а кровоток замедлился. В группе 4 (Aib2-aTK) и группе 2 (Авастин) динамика регресса изменений на глазном дне была одинаковой (по 9 баллов на 45-й день исследования). В практически равной степени уменьшался отек сетчатки и ЗН, ретинальные сосуды становились менее извиты и расширены. К концу эксперимента тенденция регресса патологических изменений сохранялась на прежнем уровне. Быстрее и в большей степени уменьшался отек сетчатки и ЗН, нормализовалось соотношение сосудов, уменьшалась их проницаемость, рассасывались геморрагии, уменьшался кровоток в новообразованных сосудах в группе, где использовался kv114*-аГК. У всех животных из 2-й группы (Авастин) измененные сосуды и умеренный отек сетчатки и зрительного нерва сохранялись до 6,5 недель. К концу эксперимента в данной группе ретинальные сосуды пришли в норму лишь у одного животного, на этом фоне были отмечены пролиферативные изменения в преретинальной области к концу исследования (30-й день от введения Авастина).
Детальная картина изменений состояния глазного дна животных представлена в Табл. 6.
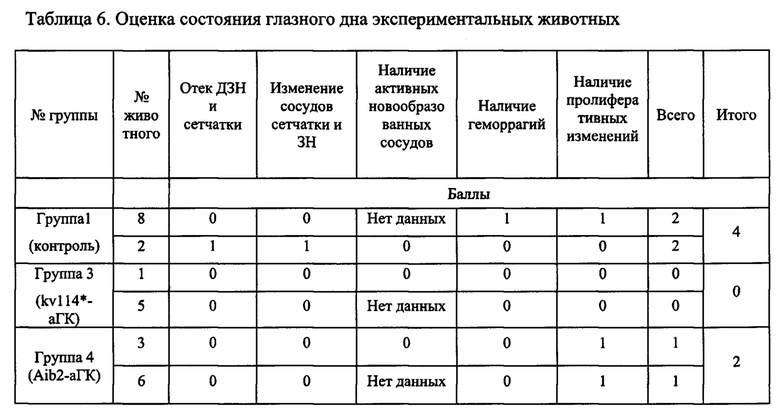
Таким образом, как показывают приведенные результаты апробации на модельных животных, использование конъюгатов kv114*-аГК и АЛ2-аГК для лечения экспериментальной неоваскуляризации сетчатки выявило высокую эффективность этих препаратов при их однократном введении в полость стекловидного тела. Это заключалось, в первую очередь, в нормализации патологически измененных сосудов, уменьшении количества активных новообразованных сосудов и снижению в них кровотока. Положительное влияние данных препаратов на сосудистую патологию сетчатки приводило к уменьшению отека сетчатки и зрительного нерва, а также к резорбции геморрагий. При сравнительной оценке эффективности kv114*-аГК, Aib2-aTK и Авастина в лечении экспериментальной неоваскуляризации сетчатки показывает, что наиболее выраженным антиангиогенным действием обладает вещество kv114*-аГК. Это было подтверждено более быстрым ответом патологически измененных сосудов сетчатки на введение препарата, а также более короткими сроками сокращения отека сетчатки и ЗН, рассасывания геморрагий. Также высокую эффективность в подавлении хориоидальной неоваскуляризации имеет Aib2-аГК (по сравнению с Авастином).

Примеры
Твердофазный синтез пептидов.
Синтез пептидов, их циклизацию и очистку с помощью высокоэффективной жидкостной хроматографии проводили, как описано ранее в [9].
Получение окисленной гиалуроновой кислоты
Для приготовления окисленной гиалуроновой кислоты с альдегидными группами гиалуронат натрия был растворен в воде, очищенной с помощью системы NANOpure, с получением раствора концентрации 2 мг/мл. Затем по каплям был добавлен 0.5 М водный раствор периодата натрия, после чего реакционная смесь перемешивалась в течение 2 ч при комнатной температуре в темноте. Затем добавлялись 0.1 мл этиленгликоля на 1 мл воды для инактивации непрореагировавшего периодата. Раствор перемешивался еще в течение часа, реакционная смесь была очищена диализом против воды, время диализа составляло 2-3 дня. Конечное выделение чистого вещества осуществлялось с помощью лиофильной сушки. Определение фактического содержания альдегидных групп в окисленной гиалуроновой кислоте проводилось спектрофотометрическим методом с использованием реагента Шиффа после получения калибровочной зависимости с помощью глутарового альдегида.
Определение молекулярной массы окисленной гиалуроновой гислоты Определение молекулярной массы окисленной гиалуроновой гислоты осуществлялась методом эксклюзионной хроматографии на приборе фирмы Shimadzu серии «Prominence» с рефрактометрическим детектором и колонкой OHpak SB-806M HQ, 8 × 300 мм, в изократическом режиме при 40°С с использованием в качестве элюента 0.1 М раствора нитрата натрия, содержащем 0,05% азида натрия. Предварительная калибровка системы проводилась с использованием пуллуланов в качестве стандартов с молекулярными массами от 11800 Да до 788000 Да.
Получение конъюгатов окисленной гиалуроновой кислоты и пептидов К 0.1 мл раствора окисленной гиалуроновой кислоты с концентрацией 2 мг/мл было добавлено 0.4 мг пептида в 0.1 мл воды, очищенной с помощью системы NANOpure. Реакционная смесь была оставлена при перемешивании на 24 часа. После окончания реакции раствор был разбавлен водой, а несвязанный пептид был отделен от конъюгата центрифугированием с использованием пробирок-концентраторов Amicon Ultra 0.5 (MWCO: 30 000; 7000×g, 10 мин) и полученный конъюгат был промыт дважды водой с заменой растворителя на воду. Сухое вещество получалось после лиофильной сушки.
Определение количества конъюгированного пептида
Содержание пептидов в конъюгатов было определено с помощью ЯМР в дейтерированной воде на приборе Brucker Avance (500 MHz) путем интегрирования сигналов пептида в диапазоне 7.0-7.8 ppm (протоны ароматических групп аминокислот и амидные протоны, 38Н) [17] и ацетильной группы гиалуроновой кислоты при 2.05 ppm (ЗН) и расчетом их соотношения (Фиг. 13-15).
Определение VEGF-связывающей активности пептидов.
Аффинность связывания конъюгатов пептидов и окисленной гиалуроновой кислоты с VEGF была определена с использованием метода микроскопического термофореза (МСТ) на приборе NanoTemper Monolith NT. 115 с капиллярами Monolith NT. 115 Premium. В качестве раствора использовался фосфатно-солевой буфер Dulbecco. В качестве лиганда для связывания использовался рекомбинантный человеческий VEGF165 чистоты более 97% фирмы R&D Systems, который был связан с флюоресцентной меткой по методике, прилагаемой к коммерческому набору флюоресцентных меток «Monolith Protein Labeling Kit RED-NHS 2nd Generation)). В результате был получен меченый белок VEGF-RED. Для измерения аффинности в микроэппендорфах готовилась серия из 16 титрующих растворов с одинаковым объемом и разной концентрацией пептида/конъюгата с осуществлением 15 последовательных разбавлений. К приготовленным образцам добавлялся заданный объем раствора VEGF-RED с концентрацией 5 нМ. Готовая смесь мишени с лигандом инкубировалась в темноте в течение 30 минут.Взаимодействие конъюгата или пептида с VEGF-RED детектировалось прибором на основе изменения флуоресценции комплекса конъюгат-белок под воздействием ИК-лазера, которое пропорционально термофоретической подвижности меченого белка VEGF. Для анализа полученной кривой использовалось программное обеспечение компании NanoTemper - МО Affinity Ananlysis.
Модельные животные и их содержание
Все исследования были выполнены в соответствии с:
- «Council of Europe. European Convention for the Protection of Vertebrate Animals used for Experimental and other Scientific Purposes. CETSNo. 123,1991»;
- ГОСТ 33215-2014 «Правила оборудования помещений и организации процедур при работе с лабораторными животными»;
- ГОСТ 33216-2014 «Правила работы с лабораторными грызунами и кроликами».
В исследование включены результаты динамического наблюдения за 8 здоровыми (неинфицированными) кроликами породы "Советская шиншилла". Животные были получены из лаборатории питомника животных «Рапполово» ФГУ «Национальный центр «Курчатовский институт» и содержались в сертифицированном виварии ФГБУ " СПб НИИФ" Минздрава России. Кроликов размещали по одной особи в клетках из нержавеющей стали тип NYA K (S=4200 см2), оборудованными кормушками и стандартными поилками. Животные содержались в контролируемых условиях окружающей среды. Световой режим: 12 часов - свет, 12 часов - темнота. Температура поддерживалась в пределах 23-25°С, относительная влажность 50-70%. Воздухообмен поддерживался с помощью приточно-вытяжной вентиляции, стерилизация воздуха осуществлялась ежедневно путем кварцевания. Корм и вода (согласно СОП ОЖ-Х-3v1 и соответствующая СОП AB-38v2) давались ad libitum. Модельные животные до начала исследования проходили карантин (акклиматизационный период) сроком 14 дней. Во время этого периода у животных контролировали клиническое состояние путем визуального осмотра, регистрировали поведение и общее состояние, качество волосяного покрова, потребление ими кормов и воды. Еженедельно осуществляли мониторинг динамики массы тела животных, для взвешивания использовали электронные весы модели Adventurer™ точность взвешивания ±0,1 г. Критерии для включения модельных животных в эксперимент: положительная динамика живой массы животных в период карантина 14 дней, отсутствие видимых симптомов заболевания.
Формирование модели неоваскуляризации сетчатки и ЗН у кроликов
Для моделирования неоваскуляризации сетчатки и ЗН у кроликов использовалось кратное интравитриальное введение рекомбинантного человеческого VEGF 165 по схеме: в первые и третьи сутки эксперимента вводили 3 мкг VEGF, на седьмые и одиннадцатые сутки - 1,5 мкг VEGF, на пятнадцатые сутки - 1,0 мкг препарата. На двадцать четвертые сутки после начала эксперимента производилась инъекция разрешающей дозы VEGF - 5,0 мкг. Суммарная доза VEGF составила 15 мкг. Интравитреальное введение VEGF осуществлялось с помощью иглы 26 gauge, в 4 мм от лимба, в меридиане 12 часов. В качестве растворителя использовали стерильную воду для инъекций из расчета 100 мкг лиофилизированного препарата в 1,0 мл. Путем дальнейшего разведения получали необходимое количество вещества в 0,05-0,1 мл раствора. Для анестезии применяли внутримышечное введение препаратов «Золетил» (золозепам + тилетамин (Вирбак СА, Франция) в дозе 25 мг/кг массы тела) и «Ксила» (Xylazinum, Interchemie Werken «deAdelaar» BV, Нидерланды) в виде 2% раствора в объеме 1,0-1,5 мл. Контроль формирования патологии сосудов сетчатки и ЗН у животных осуществлялся с использованием: офтальмоскопии (при помощи сферической линзы 15 дптр), оптической когерентной томографии сетчатки (ОКТ), фундус-камеры.
Процедура введения исследуемых веществ
После формирования неоваскуляризации сетчатки и ЗН в стекловидное тело на 30 день вводились исследуемые препараты ингибиторы ангиогенеза - kv114*-аГК, Aib2-аГК, а также Авастин. Интравитреальное введение исследуемых препаратов осуществлялось с помощью иглы 26 gauge, в 4 мм от лимба, в меридиане 12-13 часов, однократно, в объеме 0,05 мл.
Всем животным до и после введения ингибторов фактора роста (kv114*-аГК, Aib2-аГК и Авастин), а также из контрольной группы осуществляли офтальмоскопическое исследование (офтальмоскоп Heine Beta 200, сферическая линза 15 дптр), биомикроскопию (щелевая лампа Shin-Nippon, SL-45, Япония), фотографирование глазного дна (ретинальная фундус-камера Optomed Smartscope М5, Финляндия) и оптическую когерентную томографию с функцией ангиографии (ангио-ОКТ «Optopol REVO NX»).
Эффективность применения kv114*-аГК и Aib2-аГК на модели экспериментальной васкуляризации сетчатки и зрительного нерва у кроликов определяли по совокупности следующих показателей: уменьшение проницаемости сосудов, снижение кровотока и запустевание новообразованных сосудов, рассасывание геморрагий, уменьшение отека сетчатки и зрительного нерва. Для определения динамики состояния глазного дна экспериментальных животных была разработана балльная система оценки патологических изменений:
• ДЗН и сетчатка:
Выраженный отек и гиперемия - 3 балла,
Умеренный отек -2 балла,
Незначительный отек - 1 балл,
Отсутствие отека - 0 баллов.
• Изменение сосудов:
Наличие активных новообразованных сосудов - 1 балл,
Отсутствие активных новообразованных сосудов - 0 баллов,
Вены резко расширены, извиты- 2 балла,
Вены умеренно расширены, извиты- 1 балл,
Нормальное состояние сосудов - 0 баллов.
• Кровоизлияния в сетчатку и ЗН
Геморрагии есть - 1 балл,
Геморрагий нет -0 баллов.
Наличие пролиферации в области сетчатки и ЗН - 1 балл,
Отсутствие пролиферации в области сетчатки и ЗН - 0 баллов.
Биомикроофтальмоскопия, фотографирование глазного дна экспериментальных животных проводились 1 раз в неделю, что позволило отслеживать динамику патологического процесса. Ангио-ОКТ была выполнена 3-м животным дважды - до и через 4 недели после введения Анти-VEGF.
Через 30 дней после введения ингибиторов VEGF животные выводились из эксперимента путем передозировки средств для наркоза (при введении в ушную краевую вену уха кролика): тиопентал натрия 250 мг (ОАО «Синтез», Россия) и пипекурония бромида 1 мг (АО «Верофарм» Россия).
Список использованных источников информации
[1] WO 2020219497 A1
[2] WO 2010009034 A2
[3] WO 2014056923 A1
[4] Laurent et al. Adv. Drug Deliv. Rev. 1991, 7, 237-256
[5] WO 2011066417 A2
[6] WO 2018175752 A1
[7] WO 2017100470 A1
[8] Haase et al. J. Am. Chem. Soc. 2012,134, 7652-7655
[9] RU2739246C1
[10] RU2781974 (Конъюгаты пептида и полиаминокислоты, связывающие фактор роста эндотелия сосудов; МПК С07K 7/08; С07K 1/107; С07K 17/02; С07K 17/08; C08G 69/10; дата приоритета 30.10.2020; Авторы: Гурьянов И. А.; Коржиков-Влах В. А.; Коржикова-Влах Е. Г.; Тенникова Т. Б.) - прототип
[11] Материалы Международной научной конференции студентов, аспирантов и молодых ученых «Ломоносов-2022», секция «Химия», Издательство «Перо», 2022, с. 977
[12] Basu et al. Bioconjugate Chem. 2015,26,1396-1412 [13] Famili A. et al. Bioconjugate Chem. 2019, 30, 2782-2789 [14] Tan H. et al. J. Tissue Eng. Regen. Med. 2011, 5, 790-797
[15] Shah et al. J. Vis. Exp.2015,106, e53502
[16] RU2408083
[17] Guryanov et al. J. Med. Chem. 2021, 64,15, 10900-10907.
--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing originalFreeTextLanguageCode="ru"
nonEnglishFreeTextLanguageCode="ru" dtdVersion="V1_3"
fileName="Список последовательностей.xml" softwareName="WIPO
Sequence" softwareVersion="2.3.0" productionDate="2023-11-10">
<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>2023124462</ApplicationNumberText>
<FilingDate>2023-09-21</FilingDate>
</ApplicationIdentification>
<ApplicantFileReference>053759</ApplicantFileReference>
<EarliestPriorityApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>2023124462</ApplicationNumberText>
<FilingDate>2023-09-21</FilingDate>
</EarliestPriorityApplicationIdentification>
<ApplicantName languageCode="ru">Федеральное государственное
бюджетное образовательное учреждение высшего образования
"Санкт-Петербургский государственный университет
(СПбГУ)"</ApplicantName>
<ApplicantNameLatin>Saint-Petersburg State
University</ApplicantNameLatin>
<InventorName languageCode="ru">Иван Гурьянов</InventorName>
<InventorNameLatin>Ivan Guryanov</InventorNameLatin>
<InventionTitle languageCode="ru">Антиангиогенные конъюгаты пептида
и окисленной гиалуроновой кислоты (варианты)</InventionTitle>
<SequenceTotalQuantity>3</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>19</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..19</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
<INSDFeature>
<INSDFeature_key>SITE</INSDFeature_key>
<INSDFeature_location>10</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier id="q15">
<INSDQualifier_name>note</INSDQualifier_name>
<INSDQualifier_value>Nle</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
<INSDFeature>
<INSDFeature_key>DISULFID</INSDFeature_key>
<INSDFeature_location>5..15</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier id="q8">
<INSDQualifier_name>note</INSDQualifier_name>
<INSDQualifier_value>DISULFID</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>VEPNCDIHVXWEWECFERL</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>19</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..19</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q4">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
<INSDFeature>
<INSDFeature_key>SITE</INSDFeature_key>
<INSDFeature_location>2</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier id="q16">
<INSDQualifier_name>note</INSDQualifier_name>
<INSDQualifier_value>Aib</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
<INSDFeature>
<INSDFeature_key>SITE</INSDFeature_key>
<INSDFeature_location>10</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier id="q17">
<INSDQualifier_name>note</INSDQualifier_name>
<INSDQualifier_value>Nle</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
<INSDFeature>
<INSDFeature_key>DISULFID</INSDFeature_key>
<INSDFeature_location>5..15</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier id="q11">
<INSDQualifier_name>note</INSDQualifier_name>
<INSDQualifier_value>DISULFID</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>VXPNCDIHVXWEWECFERL</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="3">
<INSDSeq>
<INSDSeq_length>19</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..19</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q6">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
<INSDFeature>
<INSDFeature_key>SITE</INSDFeature_key>
<INSDFeature_location>2</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier id="q18">
<INSDQualifier_name>note</INSDQualifier_name>
<INSDQualifier_value>Aib</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
<INSDFeature>
<INSDFeature_key>SITE</INSDFeature_key>
<INSDFeature_location>10</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier id="q19">
<INSDQualifier_name>note</INSDQualifier_name>
<INSDQualifier_value>Nle</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
<INSDFeature>
<INSDFeature_key>DISULFID</INSDFeature_key>
<INSDFeature_location>5..15</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier id="q14">
<INSDQualifier_name>note</INSDQualifier_name>
<INSDQualifier_value>DISULFID</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>KXKKCDIHVXWEWECFERL</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ МОДЕЛИРОВАНИЯ ДИАБЕТИЧЕСКОЙ МАКУЛЯРНОЙ НЕОВАСКУЛЯРИЗАЦИИ | 2012 |
|
RU2504844C1 |
| ФАРМАЦЕВТИЧЕСКАЯ АНТИАНГИОГЕННАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ГЛАЗ | 2013 |
|
RU2526825C1 |
| СРЕДСТВО, ИНГИБИРУЮЩЕЕ АНГИОГЕНЕЗ ПРИ ЗАБОЛЕВАНИЯХ ОРГАНА ЗРЕНИЯ | 2001 |
|
RU2177801C1 |
| АНТАГОНИСТЫ ИНТЕГРИНОВЫХ РЕЦЕПТОРОВ И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2721907C2 |
| ЛИПОСОМАЛЬНЫЕ ПРЕПАРАТЫ | 2013 |
|
RU2817350C2 |
| ЛИПОСОМАЛЬНЫЕ ПРЕПАРАТЫ | 2013 |
|
RU2680096C2 |
| СПОСОБ МОДЕЛИРОВАНИЯ НЕОВАСКУЛЯРИЗАЦИИ СЕТЧАТКИ И ЗРИТЕЛЬНОГО НЕРВА У КРОЛИКОВ | 2009 |
|
RU2408083C1 |
| ПЕПТИДЫ ДЛЯ ИНГИБИРОВАНИЯ АНГИОГЕНЕЗА | 2016 |
|
RU2708375C2 |
| ОФТАЛЬМОЛОГИЧЕСКОЕ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ НЕОАНГИОГЕННЫХ ПАТОЛОГИЙ ГЛАЗА | 2009 |
|
RU2519739C2 |
| СПОСОБ МОДЕЛИРОВАНИЯ НЕОВАСКУЛЯРИЗАЦИИ ПЕРЕДНЕГО ОТРЕЗКА ГЛАЗА У КРЫС | 2012 |
|
RU2488891C1 |

Изобретение относится к области биотехнологии, в частности к антиангиогенному конъюгату (варианты). Указанный конъюгат, получаемый смешением пептида kv114* или Aib2 и окисленной гиалуроновой кислоты с молекулярной массой 115-3000 кДа, содержит в структуре один из следующих фрагментов:
 или
или 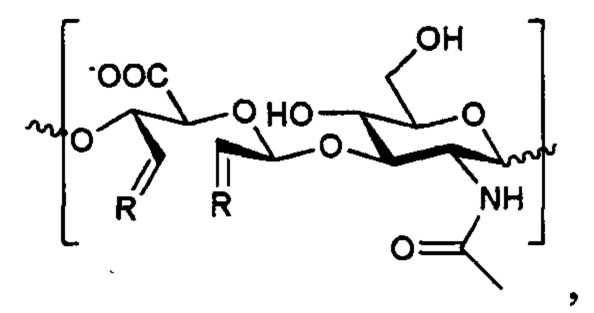 ,
,
причем молярное соотношение Aib2-ГК составляет 1:60, а kv114*-ГК составляет 1:170. Настоящее изобретение обеспечивает конъюгаты пептидов kv114* и Aib2 с окисленной высокомолекулярной гиалуроновой кислотой с улучшенной антиангиогенной активностью по сравнению со свободными пептидами. 2 н.п. ф-лы, 15 ил., 5 табл., 1 пр.
1. Антиангиогенный конъюгат, получающийся смешением пептида kv114* или Aib2 и окисленной гиалуроновой кислоты с молекулярной массой 115-3000 кДа, имеющий молярное соотношение Aib2-аГК 1:60 и kv114*-аГК 1:170 и имеющий в структуре фрагмент
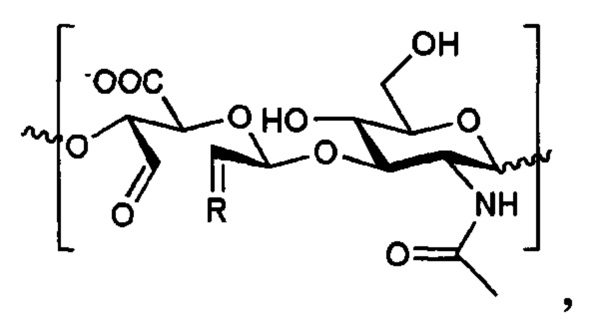
где R - пептид kv114*, который присоединен за счет аминогруппы и аминокислотная последовательность которого представляет собой:
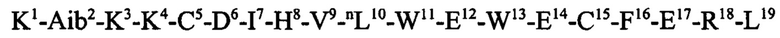
или R - пептид Aib2, который присоединен за счет аминогруппы и аминокислотная последовательность которого представляет собой:
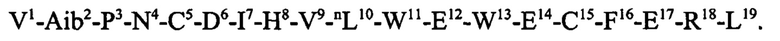
2. Антиангиогенный конъюгат, получающийся смешением пептида kv114* или Aib2 и окисленной гиалуроновой кислоты с молекулярной массой 115-3000 кДа, имеющий молярное соотношение Aib2-аГК 1:60 и kv114*-аГК 1:170 и имеющий в структуре фрагмент
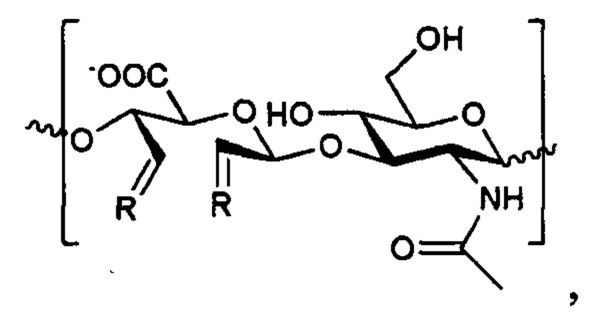
где R - пептид kv114*, который присоединен за счет аминогруппы и аминокислотная последовательность которого представляет собой:
или R - пептид Aib2, который присоединен за счет аминогруппы и аминокислотная последовательность которого представляет собой:
| Материалы Международной научной конференции студентов, аспирантов и молодых ученых "Ломоносов-2022", секция "Химия", Издательство "Перо", 2022, 977 с | |||
| Конъюгаты пептида и полиаминокислоты, связывающие фактор роста эндотелия сосудов | 2020 |
|
RU2781974C2 |
| Пептиды, связывающие фактор роста эндотелия сосудов | 2019 |
|
RU2739246C1 |
| GURYANOV, IVAN et al., Conformationally Constrained Peptides with High Affinity to the Vascular Endothelial Growth Factor, Journal of medicinal | |||
Авторы
Даты
2025-03-06—Публикация
2023-09-21—Подача