Изобретение относится к новым производным 3-аминопиперидина и родственным соединениям, фармацевтическим композициям, содержащим такие соединения, и к использованию таких соединений при лечении и предупреждении воспалительных процессов и расстройств центральной нервной системы, а также некоторых других нарушений. Фармацевтически активные соединения настоящего изобретения являются антагонистами вещества Р. Настоящее изобретение относится также к новым интермедиатам, используемым при синтезе таких антагонистов вещества Р.
Вещество P является встречающимся в природе ундекапептидам, принадлежащим к тахикининовому семейству пептидов, причем последние называются так из-за их быстрого стимулирующего действия на ткани гладкой мышцы. Точнее, вещество P является фармакологически активным нейропептидом, который получается у млекопитающих (первоначально было выделено из кишки) и обладает характерной аминокислотной последовательностью, которая показывается Вебером и др. (D. F. Vever et al.) в патенте США N 4680283. Широкое вовлечение вещества P и других тахикининов в патофизиологию разнообразных заболеваний продемонстрировано в достаточной степени в данной области. Например, вещество P, как было недавно показано, вовлекается в передачу боли или мигрени (Сэндберг и др. B.E. Sandberg et al. Journal of Medicinal Chemistry25, 1009 (1982)), а также при расстройствах центральной нервной системы, таких как тревога и шизофрения, при распираторных и воспалительных заболеваниях, таких как астма и ревматоидный артрит, при ревматических заболеваниях, таких как фиброз, и при желудочно-кишечных нарушениях и заболеваниях желудочно-кишечного тракта, таких как неспецифический язвенный колит и болезнь Кроуна, и так далее (Д. Реголи в "Общие направления в "гистаминовой" головной боли (мигрени)", изданном под ред. Сикутери и др. D. Regoli in "Trends in Cluster Headache" edited by F. Sicuteri et al. Elsevier Scientific Publishers, Amsterdam, p. p. 85-95, 1987.
B недалеком прошлом были приняты некоторые попытки выработать антагонисты для вещества P и других тахикининовых пептидов для того, чтобы более эффективно вылечивать разнообразные нарушения и болезни, перечисленные выше. Несколько таких антагонистов, до сих пор описанных, являются в большинстве случаев пептидо-подобными по природе и поэтому являются слишком лабильными (неустойчивыми) с точки зрения метаболизма, чтобы быть полезными в качестве практически используемых терапевтических средств при лечении болезни. С другой стороны, не пептидные антагонисты настоящего изобретения не обладают таким недостатком, являясь намного более стабильными с точки зрения метаболизма, чем упомянутые выше средства.
Настоящее изобретение относится к соединениям общей формулы (l):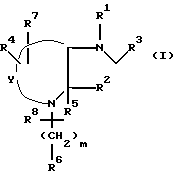
в которой
Y представляет собой группу (CH2)n, где n является целым числом от 2 до 4 и где любой из атомов углерода в указанном (CH2)n необязательно может быть замещен радикалом R4;
m представляет собой целое число от 0 до 6, и любая углерод- углеродная простая связь группы (CH2)m необязательно может быть заменена на углерод-углеродную двойную связь или углерод-углеродную тройную связь, и любой один из углеродных атомов группы (CH2)m необязательно может быть замещен радикалом R8;
R1 представляет собой водород или (C1-C6)-алкил, необязательно замещенный гидрокси-, алкокси-группой или фтором,
R2 представляет собой радикал, выбранный из водорода, метила, трет-бутила, (C5-C6)-циклоалкила, бензила, бензгидрила, нафтила, тиенила, фуранила, индонила или фенила, который необязательно может быть замещен трифторметилом, одним или двумя атомами галогена, алкоксигруппой, (C1-C3)-гидроксиалкилом, фенилом или -NH(C1-C3) алкилом;
R3 представляет собой фенил, который необязательно может быть замещен одним, двумя или тремя заместителями, выбранными из галогена, метила, (C1-C4)-алкокси-, трифторметила и диалкиламина;
тиенил или 2-метоксинафтил;
R4 представляет водород, метил, метокси, галоген;
R5 представляет водород;
или R2 и R5 вместе с атомом углерода кольца могут образовывать спиро-кольцо 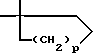 где p равно 1 или 2;
где p равно 1 или 2;
R6 представляет собой водород, фенил, гидрокси, фенокси, амино, циано, карбокси, карбоэтокси, ацетамидо, бензамидо, бензоил, 4-фторбензил, α -оксибензил, a -окси-4-фторбензил, оксиминобензил, 4,41-дифторбензгидрил, карбоксамидо, N-метилкарбоксамидо, n-толилсульфонамидо, тиофенил, 2-нафтамидо- или нафтил-2-метиламино;
R7 представляет водород,
R8 представляет водород или гидроксил.
Настоящее изобретение относится также к фармацевтически приемлемым кислотно-аддитивным солям соединений формулы I.
Кислоты, которые используются, чтобы получить фармацевтически приемлемые кислотно-аддитивные соли соединений настоящего изобретения, являются такими, которые образуют нетоксичные соли при присоединении кислот, т. е. соли, содержащие фармакологически приемлемые анионы, такие как хлористоводородные, бромистоводородные, иодистоводородные, нитраты, сульфаты, бисульфаты, фосфаты, кислые фосфаты, ацетаты, лактаты, цитраты, кислые цитраты, тартраты, битартраты, сукцинаты, малеаты, фумараты, глюконаты, сахараты, бензоаты, метансульфонаты, этансульфонаты, бенолсульфонаты, пара-толуолсульфонаты и памоаты (т. е. 1,1'-метилен-бис-(2-гидрокси-3-нафтоатная соль).
Настоящее изобретение относится также к производным пиперидина формулы VII;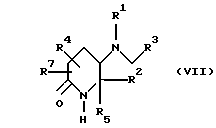
в которой
R1, R2, R3, R4, R5 и R7 являются такими, как определено для соединений формулы I. Соединения формулы VII являются новыми промежуточными, используемыми при синтезе соединений формулы I.
Настоящее изобретение относится также к соединению 3-амино-2- фенилпиперидина.
Настоящее изобретение относится также к фармацевтической композиции для лечения или предупреждения состояния, выбираемого из группы, состоящей из воспалительных заболеваний (например, артрит, псориаз, астма и воспалительное кишечное заболевание), страха (тревоги), депрессивных или дистимических расстройств, колита, психоза, боли, аллергий, таких как экзема и ринит, хронического обструктивного заболевания дыхательных путей, аллергических (повышенной чувствительности) нарушений, таких как вызванных ядовитым растением poison ivy, вазоспастических заболеваний, таких как ангина, мигрень и болезнь Рейнауда, фиброзных и коллагеновых болезней, таких как склеродермия и эозинофильный фасциолез, рефлекторно-симпатической дистрофии, такой как плечевой синдром, хронических (наркотических) нарушений, таких как алкоголизм, соматических расстройств, связанных со стрессом, периферической невропатии, невралгии, невропатологических расстройств, таких как болезнь Алцгеймера, слабоумие, связанное со СПИДом, диабетическая невропатия и множественный склероз, нарушений, связанных с иммунным усилением или угнетением (супрессией), таких как системная красная волчанка, и ревматических заболеваний, таких как фиброз у млекопитающих, включая человека, включающей количество соединения формулы I, или фармацевтически приемлемую соль его, эффективное при лечении или предупреждении такого состояния, и фармацевтически приемлемый носитель.
Настоящее изобретение относится также к способу лечения или предупреждения состояния, выбираемого из группы, состоящей из воспалительных заболеваний (например, артрит, псориаз, астма и воспалительное кишечное заболевание), страха (тревоги), депрессивных или дистимических расстройств, колита, психоза, боли, аллергий, таких как экзема и ринит, хронического обструктивного заболеваний дыхательных путей, аллергических (повышенной чувствительности) нарушений, таких как ядовитый плющ, вазоспастических заболеваний, таких как ангина, мигрень и болезнь Рейнауда, фиброзных и коллагеновых болезней, таких как склеродермия и эозинофильный фасциолез, рефлекторно-симпатическиой дистрофии, такой как плечевой синдром, хронических нарушений, таких как алкоголизм, соматических расстройств, связанных со стрессом, периферической невропатии, невралгии, невропатологических расстройств, таких как болезнь Алцгеймера, слабоумие, связанное со СПИДом, диабетическая невропатия и множественный склероз, нарушений, связанных с иммунным усилением или угнетением (супрессией), таких как системная красная волчанка, и ревматических заболеваний, таких как фиброз у млекопитающих, включая человека, включающему введение указанному млекопитающему количества соединения формулы I, или фармацевтически приемлемой соли его, эффективного при лечении или предупреждении такого состояния.
Настоящее изобретение относится также к фармацевтической композиции для антагонизирования действий вещества P у млекопитающих, включая человека, включающей антагонизирующее для вещества P количество соединения формулы I, или фармацевтически приемлемой соли его и фармацевтически приемлемый носитель.
Настоящее изобретение относится также к способу антагонизирования действий вещества P у млекопитающих, включая человека, включающему введение указанному млекопитающему антагонизирующее вещество P количество соединения формулы I, или фармацевтически приемлемой соли его.
Настоящее изобретение относится также к фармацевтической композиции для лечения или предупреждения расстройства у млекопитающего, включая человека, происходящего в результате действия избытка вещества P, включающей антагонизирующее вещество P количество соединения формулы I, или фармацевтически приемлемой соли его и фармацевтически приемлемый носитель.
Настоящее изобретение относится также к способу лечения или предупреждения расстройства у млекопитающих, включая человека, происходящего в результате действия избытка вещества P, включающему введение указанному млекопитающему антагонизирующее вещество P количество соединения формулы I, или фармацевтически приемлемой соли его.
Настоящее изобретение относится также к фармацевтической композиции для лечения или предупреждения состояния, выбираемого из группы, состоящей из воспалительных заболеваний (например, артрита, псориаза, астмы и воспалительного кишечного заболеваний), страха (тревоги), депрессивных или дистимических расстройств, колита, психоза, боли, аллергий, таких как экзема и ринит, хронического обструктивного заболевания дыхательных путей, аллергических нарушений, таких как ядовитый плющ, вазоспастических заболеваний, таких как ангина, мигрень и болезнь Рейнауда, фиброзных и коллагеновых болезней, таких как склеродермия и эозинофильный фасциолез, рефлекторно-симпатической дистрофии, такой как плечевой синдром, хронических нарушений, таких как алкоголизм, соматических расстройств, связанных со стрессом, периферической невропатии, невралгии, невропатологических расстройств, таких как болезнь Алцгеймера, слабоумие, связанное со СПИДом, диабетическая невропатия и множественный склероз, нарушений, связанных с иммунным усилением или угнетением (супрессией), таких как системная красная волчанка, и ревматических заболеваний, таких как фиброз у млекопитающих, включая человека, включающей количество соединения формулы I, или фармацевтически приемлемой соли его, эффективное при антагонизировании действия вещества P на его клеточный рецептор, и фармацевтически приемлемый носитель.
Настоящее изобретение относится также к способу лечения или предупреждения состояния, выбираемого из группы, состоящей из воспалительных заболеваний (например, артрита, псириаза, астмы и воспалительного кишечного заболевания), страха (тревоги), депрессивных или дистимических расстройств, колита, психоза, боли, аллергий, таких как экзема и ринит, хронического обструктивного заболевания дыхательных путей, аллергических нарушений, таких как ядовитый плющ, вазоспастических заболеваний, таких как ангина, мигрень и болезнь Рейнауда, фиброзных и коллагеновых болезней, таких как склеродермия и эазинофильный фасциолез, рефлекторно-симпатической дистрофии, такой как плечевой синдром, хронических нарушений, таких как алкоголизм, соматических расстройств, связанных со стрессом, периферической невропатии, невралгии, невропатологических расстройств, таких как болезнь Алцгеймера, слабоумие, связанное со СПИДом, диабетическая невралгия и множественный склероз, нарушений, связанных с иммунным усилением или угнетением (супрессией), таких как системная красная волчанка, и ревматических заболеваний, таких как фиброз у млекопитающих, включая человека, включающему введение указанному млекопитающему количества соединения формулы I, или фармацевтически приемлемой соли его, эффективного при антагонизировании действия вещества P на его клеточный рецептор.
Настоящее изобретение относится также к фармацевтической композиции для лечения или предупреждения нарушений у млекопитающих, включая человека, лечение или предупреждение которого осуществляется или облегчается уменьшением нейротрансмиссии, связанной с веществом P, включающей количество соединения формулы I или фармацевтически приемлемой соли его, эффективное при антагонизировании действия вещества P на его клеточный рецептор, и фармацевтически приемлемый носитель.
Настоящее изобретение относится также к способу лечения или предупреждения расстройства у млекопитающих, включая человека, лечение или предупреждение которого осуществляется или облегчается уменьшением нейротрансмиссии, связанной с веществом P, включающему введение указанному млекопитающему количества соединения формулы I или фармацевтически приемлемой соли его, эффективного при антагонизировании действия вещества P на его клеточный рецептор.
Настоящее изобретение относится также к фармацевтической композиции для лечения или предупреждения расстройства у млекопитающих, включая человека, лечения или предупреждения которых осуществляется или облегчается уменьшением нейротрансмиссии, связанной с веществом P, включающей количество соединения формулы I или фармацевтически приемлемой соли его, эффективное при лечении или предупреждении такого расстройства, и фармацевтически приемлемый носитель.
Настоящее изобретение относится также к способу лечения или предупреждения расстройства у млекопитающих, включая человека, лечение или предупреждение которых осуществляется или облегчается уменьшением нейротрансмиссии, связанной с веществом P, включающему введение указанному млекопитающему количества соединения формулы I или фармацевтически приемлемой соли его, эффективного при лечении или предупреждении такого расстройства.
Соединения формулы I имеют хиральные центры и поэтому существуют в различных энзитиомерных формах. Настоящее изобретением относится ко всем оптическим изомерам и всем стереоизомерам соединений формулы I, и смесям их.
Формулы I и VII, представленные выше, включают соединения, идентичные описанным соединениям, но в которых один или более атомов водорода или углерода заменяются на их радиоактивные изотопы. Такие соединения, меченые радиоактивными атомами, являются полезными в качестве исследовательских и диагностических инструментов (средств) при фармокинетических исследованиях метаболизма и при анализах связывания. Специфические применения при исследовании включают испытания связывания с использованием радиоактивного лиганда, исследования ауторадиографии и исследования ин виво связывания, тогда как специфические применения в диагностической области включают исследования рецептора вещества P в мозге при ин виво связывании в соответствующих тканях для воспаления, например, клетки иммунного типа или клетках, которые непосредственно вовлекаются в воспалительные кишечные расстройства и тому подобные. Включенными среди радиоактивно меченых форм соединений формул I и VII являются их соединения с тритием и изотопами C14.
Соединения формулы I могут быть получены как это описано в следующих схемах реакций и в обсуждении. Каждая из формул, обозначенных IA, IB, IC и ID представляет различную группу соединений, имеющих общую формулу I. Если не оговорено особо, R1, R2, R3, R4, R5, R6, R7, R8, Y, n и m в схемах реакций и в обсуждении, которое следует за ними, определяются так, как это описано выше.
Схема 1 показывает получение соединений формул IA, IB и IC. Формула IA представляет соединения формулы I, в которой каждый из R1 и R6 является водородом, m является 0, а n является 3, при условии, что R2 не является бензгидрилом, и ни R4, ни R7 не присоединяются к положению "6" пиперидинового цикла. Формула IB представляет соединения формулы I, в которой R1 является водородом, а n является 3, при условии, что R2 не является бензгидрилом и ни R4, ни R7 не присоединяются в положение "6" пиперидинового цикла. Формула IC представляет соединения формулы I, в которой ни R4, ни R7 не присоединяются к положению "6" пиперидинового цикла.
Ссылаясь на схему 1, соединение формулы II подвергается реакции с соединением формулы R5-CO-R2 в присутствии ацетата аммония, в полярном растворителе, таком как этанол, уксусная кислота или диметилсульфоксид. Этанол является предпочтительным растворителем. Температуры примерно от комнатной температуры до примерно 150oC являются пригодными, причем температура кипения растворителя с обратным холодильником является предпочтительной. Эта реакция дает, по реакции межмолекулярной конденсации, соединение формулы III (Vol. M. Mahlstadt and B. Schulze. J. Prakt. Chem. 317, 919 (1975)).
Продукт реакции конденсации формулы III превращается затем, по реакции Нефа, в оксим формулы IV. Эта реакция может быть проведена, используя реагенты, такие как водный хлористый Ti(III), перманганат калия, пиридин- гексаметилфосфороамидный комплекс пятиокиси молибдена, трибутилфосфин-дифенилдисульфид или озон в присутствии основания. Подходящие температуры варьируют в пределах примерно от -100oC до около 0oC. Предпочтительно, реакция осуществляется пробулькиванием озона через реакционную смесь в присутствии трет-бутоксида калия примерно при -78oC, а затем гашением реакционной смеси солянокислым гидроксиламином при температуре окружающей среды.
Оксим формулы IV восстанавливают затем, чтобы получить как цис-, так и транс-изомеры соединения формулы V. Подходящие восстанавливающие агенты включают никель Ренея/водород, 10% палладия на угле водород, и амальгаму алюминия. Предпочтительно, восстановление проводится с использованием никеля Ренея в этаноле под давлением водорода (газа) примерно 3 атм и при температуре примерно 25oC. Температуры примерно от 10oC до около 60oC и давления примерно от 1 до около 10 атмосфер также являются подходящими.
Восстановительное аминирование смеси цис- и транс-изомеров соединения формулы V из вышеуказанной стадии с помощью цианоборгидрида натрия или триацетоксиборгидрида натрия вместе с соединением формулы R3CHO дает смесь цис- и транс-изомеров соединения формулы VI. Эта реакция обычно проводится в полярном растворителе, таком как уксусная кислота или низший алкиловый спирт, при температуре примерно от 0oC до около 50oC. Метанол является предпочтительным растворителем и примерно 25oC является предпочтительной температурой. Предпочитается также, чтобы pH реакционной смеси составлял примерно от 4 до около 5. Цис- и транс-изомеры соединения формулы VI, образуемые таким образом, могут быть легко разделены путем использования флэш-хроматографии на силикагеле, элюируя с помощью 3%-ного метанола в хлористом метилене.
Восстановление либо цис-, либо транс-изомера соединения формулы VI или смеси их, дает соединение формулы IA, имеющее ту же самую стереохимию. Подходящие восстанавливающие агенты включают боран- диметилсульфидный комплекс с тетрагидрофуране ("ТГФ"), литийалюминийгидрид, боран в ТГФ и боргидрид натрия хлористый титан (IV). Лучшие результаты получаются при использовании боран- диметилсульфидного комплекса в ТГФ. Реакция может быть проведена при температуре примерно от комнатной температуры до около 150oC, и предпочтительно проводится при температуре кипения растворителя с обратным холодильником.
Соединение формулы IA, образующееся таким образом, может быть превращено в соединение формулы IB, имеющее ту же самую стереохимию, как это показывается в схеме 1, путем взаимодействия его с соединением формулы R6-(CH2)m-X, в которой X является галогеном, в которой одна из углерод-углеродных простых связей указанного (CH2)m необязательно может быть заменена на углерод-углеродную двойную связь и в которой один из углеродов указанного (CH2)m необязательно может быть замещен радикалом R8. Эта реакция обычно проводится в присутствии основания, такого как триэтиламин или трет-бутилат калия, и полярном растворителе, таком как хлористый метилен или дихлорэтан, и при температуре примерно от комнатной температуры до около 150oC. Предпочтительно, реакция проводится при температуре кипения с обратным холодильником в хлористом метилене в присутствии триэтиламина.
Соединения формулы IC могут быть получены так, как это показано в схеме 1 и описано ниже. Соединение формулы VI подвергается реакции с соединением формулы R1X, в которой X является галогеном, чтобы получить соединение формулы VII, имеющее ту же самую стереохимию (например, цис-, транс- или их смесь). Эта реакция обычно проводится в присутствии основания, такого как триэтиламин или трет-бутилат калия в полярном растворителе, таком как хлористый метилен или дихлорэтан, при температуре примерно от комнатной температуры до около 150oC. Предпочтительно, реакция проводится примерно при температуре кипения с обратным холодильником в хлористом метилене в присутствии триэтиламина.
Восстановление соединения формулы VII, образующегося таким образом, дает соединение формулы IC, имеющее ту же самую стереохимию. Примерами подходящих восстанавливающих агентов являются литийалюминийгидрид, боран- диметилсульфидный комплекс в ТГФ, боран в ТГФ и боргидрид натрия хлористый титан (IV). Лучшие результаты получаются при использовании боран-диметилсульфидного комплекса в ТГФ. Реакция может быть проведена при температурах примерно от комнатной температуры до около 150oC, и предпочтительно проводится при температуре кипения растворителя с обратным холодильником.
Схема 2 показывает альтернативный метод получения соединений формулы IB. Исходным соединением для этого метода является соединение формулы VI, которое показывается в схеме 1. В первой стадии этого метода, основный азот исходного соединения защищается группой, такой как трет- бутоксикарбонил (Boc), трифторацетил, карбобензилокси или карбоэтокси, путем взаимодействия его, соответственно, с ди-трет- бутилдикарбонатом, ангидридом трифторуксусной кислоты, бензиловым эфиром хлормуравьиной кислоты или этиловым эфиром хлормуравьиной кислоты. Предпочтительная защитная группа, трет-бутоксикарбонил, показывается в схеме 2. Реакция исходного соединения с ди-трет-бутилдикарбонатом (ди- трет-бутиловым эфиром угольной кислоты) обычно проводится в полярном растворителе, таком как ТГФ, хлористый метилен или хлороформ, при температуре примерно от 0oC до около 100oC. Предпочтительным растворителем является хлористый метилен, а предпочтительной температурой является комнатная температура. Реакция в большинстве случаев проводится в течение примерно от 0,5 до 72 часов. Эта реакция дает соединение формулы VIII, имеющее ту же стереохимию, что и исходное соединение.
Соединение формулы VIII, образуемое таким образом, подвергается затем реакции с соединением формулы X-(CH2)m-R6, в которой X является галогеном, или CH3SO2-O-(CH2)m-R6, чтобы образовать соединение формулы IX, имеющее ту же самую стереохимию. В каждом из X-(CH2)m-R6 и CH3SO2-O-(CH2)m-R6, один из углеродов указанного радикала (CH2)m необязательно может быть замещенным радикалом R8 и одна из углерод-углеродных простых связей указанного (CH2)m необязательно может быть заменена углерод-углеродной двойной связью или углерод-углеродной тройной связью. Эта реакция в большинстве случаев проводится в присутствии основания, такого как гидроокись калия, трет-бутилат калия, диизопропиламин-литий или метилат натрия, в полярном растворителе, таком как трет-бутанол или ДМФА, в течение примерно от 0,5 до около 24 часов. Предпочтительным основанием является трет-бутилат калия, а предпочтительным растворителем является трет-бутанол. Температуры реакции в большинстве случаев варьируют от -25oC до около 150oC. Предпочтительной температурой в большинстве случаев является температура кипения растворителя с обратным холодильником.
Защитная группа удаляется затем из соединения формулы IX путем взаимодействием его с кислотой, такой как хлористоводородная кислота, трифторуксусная кислота или хлорная кислота, чтобы получить соединение формулы X, имеющее ту же самую стереохимию. Соответствующими растворителями для этой реакции являются полярные растворители, такие как хлористый метилен, диоксан, простой эфир или ТГФ, предпочтительно диоксан. Реакция обычно проводится при температуре примерно от -10oC до около 50oC, предпочтительно примерно при 25oC, в течение примерно от 0,5 до около 24 ч.
Восстановление соединения формулы X, образующегося таким образом, дает соединение формулы IB, имеющее ту же самую стереохимию. Эта реакция проводится таким же образом, что и описанная выше при обсуждении схемы 1 для получения соединений формулы IA из соединений формулы IV, и для получения соединений формулы IC из соединений формулы VII.
Схема 3 показывает метод получения соединений формулы ID. Формула ID представляет соединения формулы I, в которой каждый из R1 и R6 является водородом, m является 0, а n является 2, 3 или 4. Эта группа соединений включает соединения формулы IA. Метод схемы 3 может быть использован для получения чистого 2S,3S-энантиомера, чистого 2R, ЗR-энантиомера или рацемической смеси соединения формулы ID, в зависимости от того, является ли исходное соединение, соответственно, R-энантиомером, S-энантиомером или рацемической смесью исходного соединения формулы XI. Кроме того, так как формула ID включает соединения формулы IA, метод схемы 3 может быть использован для получения соединений формулы IA, в которой R4 присоединяется к положению "6" азотсодержащего цикла. Метод схемы 3 может быть использован также для получения соединений формулы ID, в которой R2 является бензгидрилом.
Ссылаясь на схему 3, соединения формулы ID могут быть получены следующим образом. Чистый R-этантиомер, S-энантиомер или рацемическая смесь соединения формулы XI подвергается реакции с азотсодержащим реагентом, таким как хлористый трет-бутилдиметилсилил (TBDMS-C1), трифлат (трифторацетат) трет-бутилдиметилсилила (TBDMS-OTf) или бензилбромид/ трет-бутоксид, предпочтительно TBDMS-C1, чтобы получить соединение формулы XII. Эта реакция обычно проводится в полярном растворителе, таком как ДМФА или триэтиламин, предпочтительно в триэтиламине, при температуре примерно от 0oC до около 140oC. Комнатная температура является предпочтительной.
Вышеуказанная реакция осуществляется путем стереоспецифического алкилирования соединения XII, чтобы образовать транс-стереоизомер соединения формулы XIII. Сначала соединение формулы XII подвергается реакции с диэтиламидом лития в полярном растворителе, таком как простой эфир или ТГФ, предпочтительно ТГФ, при температуре примерно от -100oC до около комнатной температуры, предпочтительно примерно при -78oC. Затем соединение формулы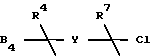
добавляется к реакционной смеси, чтобы получить транс-изомер соединения формулы XIII. Одновременное удаление TBDMS группы и расщепление β -лактама, используя концентрированную серную или хлорную кислоту, предпочтительно серную кислоту, в полярном растворителе, таком как метанол или этанол, предпочтительно метаноле, дает соединение формулы XIV. Эта реакция обычно проводится при температуре примерно от комнатной температуры до около 150oC, предпочтительно примерно при температуре кипения растворителя с обратным холодильником, в течение примерно от 0,5 до около 16 часов.
Циклизация соединения формулы XIV, чтобы получить соединение формулы XV, выполняется нагреванием сырого продукта формулы XIV из вышеприведенной реакции при температуре примерно от 80oC до около 140oC, предпочтительно примерно при 100oC, в течение примерно от 5 минут до около 2 дней, предпочтительно в течение примерно 15 минут, в высококипящем растворителе, таком как ДМФА или толуол, предпочтительно в ДМФА. В большинстве случаев эта реакция проводится в присутствии йодистого натрия и бикарбоната натрия. В соединении формулы XV, получаемом по этой реакции, R2 и -COCH3 находятся в цис-положениях относительно друг друга.
Соединение формулы XV обрабатывается затем бензиловым эфиром хлормуравьиной кислоты в полярном растворителе, таком как вода, вода/ацетон, хлороформ, дихлорэтан или этилацетат, в присутствии основания, такого как триэтиламин или бикарбонат натрия, чтобы получить N-карбобензилоксипиперидин (N-Cbz пиперидин) формулы XVI, имеющий ту же самую стереохимию (т. е. в котором R2 и -COOCH3 находятся в цис-конфигурации). Эта реакция может быть проведена при температурах примерно от 0oC до 100oC, предпочтительно примерно при 25oC, и в течение примерно от 5 минут до 18 часов. Обработка соединения формулы XVI, образуемого таким образом, с примерно 5 эквивалентами каждого триметилалюминия и хлористого аммония в неполярном растворителе, таком как бензол или толуол, в течение примерно от 0,5 до около 16 часов дает соединение формулы XVII, имеющее ту же самую стереохимию. Температуры реакции могут варьировать в пределах примерно от комнатной температуры до около 100oC, причем примерно 50oC является предпочтительной температурой.
Превращение карбоксамидной группы соединения формулы XVII для образования соединения формулы XVIII, имеющего ту же самую стереохимию, может быть осуществлено по реакции деградации Гофмана, используя реагенты, такие как бром/метилат натрия в метаноле, тетраацетат свинца в трет- бутиловом спирте, хлористое олово (IV), бис-(трифторацетат)йодобензола в водном ацетонитриле, бромистый натрий или трехбромистый бензилтриметиламмоний. Предпочтительно, соединение формулы XVII обрабатывается тетраацетатом свинца в трет-бутаноле. Эта реакция обычно проводится при температуре примерно от комнатной температуры до температуры кипения растворителя с обратным холодильником, предпочтительно при температуре кипения с обратным холодильником, в течение примерно от 15 минут до около 10 часов, предпочтительно в течение примерно от 3 до около 5 часов. Реакция соединения формулы XVIII с кислотой, такой как хлористоводородная кислота, трифторуксусная кислота или хлорная кислота, дает соединение формулы XIX, имеющее ту же самую стереохимию. Растворителем обычно является полярный растворитель, такой как хлористый метилен, диоксан, простой эфир или ТГФ, предпочтительно диоксан. Эта реакция обычно проводится при температуре примерно от -10oC до около 50oC, предпочтительно примерно при 25oC, в течение примерно от 0,5 до около 24 часов.
Восстановительное аминирование соединения формулы XIX из вышеуказанной стадии с помощью цианоборогидрида натрия или триацетоксиборгидрида натрия вместе с соединением формулы R3-CHO дает соединение формулы XX, имеющее ту же самую стереохимию. Эта реакция в большинстве случаев проводится в полярном растворителе, таком как уксусная кислота или низший алкиловый спирт, при температуре примерно от 0oC до около 50oC. Метанол является предпочтительным растворителем и примерно 25oC является предпочтительной, pH реакционной смеси предпочтительна примерно от 4 до около 5.
Соединение формулы XX превращают в соединение формулы ID, в которой R2 и аминогруппа находятся в цис-положении друг к другу, путем взаимодействия его с муравьинокислым аммонием в присутствии палладия на древесном угле (например, 10% палладия на древесном угле). Обычно, полярный растворитель, такой как этилацетат или низший алкиловый спирт, используется, а реакция проводится при температуре примерно от комнатной температуры до около 150oC в течение примерно от 0,5 до около 24 часов. Предпочтительно, реакция проводится в этаноле при комнатной температуре в течение примерно от 3 до около 24 часов.
Транс-изомер соединения формулы ID (т. е. соединение, в котором аминогруппа и R2 находятся в транс-положении относительно друг друга) может быть получен по той же методике, что и описанная выше для получения цис-изомера, со следующей модификацией. Чтобы получить транс-изомер или соединение формулы XV, или соединение формулы XVI, после его образования, как это описано выше, обрабатывается трет-бутоксидом калия или диалкиламидом лития. Растворителем для этой реакции является в большинстве случаев полярный растворитель, такой как ТГФ или простой эфир, а реакцию проводят в большинстве случаев при температуре примерно от -78oC до комнатной температуры, предпочтительно примерно при 0oC, в течение примерно от 5 минут до около 10 часов.
Альтернативный метод получения соединений формулы ID, где R2 является бензгидрилом, описывается в примерах 21-26.
Схема 4 показывает предпочтительный метод получения соединений формулы ID, в которой n является 2. Согласно этому методу, соединение формулы XXI обрабатывают газообразным водородом в присутствии металлического катализатора, такого как палладий на древесном угле, платина на древесном угле или двуокись платины, предпочтительно палладий на древерном угле, и в присутствии кислоты, такой как трифторуксусная кислота или хлористоводородная кислота, чтобы получить соединение формулы XXII. В большинстве случаев используют полярный инертный растворитель. Предпочтительным растворителем является этанол. Эта реакция обычно проводится примерно от 1,5 атм до примерно 5 атм, предпочтительно примерно при 3,0 атм, при температуре примерно 0oC-60oC, предпочтительно примерно при 25oC. Соединение формулы XXII, образуемое таким образом, превращают затем в соединение формулы ID по методике, показанной в схеме 3 и описанной выше.
Энантиомерно чистые соединения формулы IC (т. е. соединения формулы ID), в которой R1 является (C1-C6)-алкилом, а не водородом) могут быть получены следующим образом. Соединение формулы XX, полученное как это описано выше, алкилируется путем взаимодействия его с соединением формулы R1X, в которой X является галогеном. Эта реакция обычно проводится в присутствии основания, такого как триэтиламин или трет-бутилат калия, в полярном растворителе, таком как хлористый метилен или дихлорэтан, и при температуре примерно от комнатной температуры до около 200oC. Предпочтительно, реакцию проводят при температуре кипения с обратным холодильником в хлористом метилене в присутствии триэтиламина. Алкилированный продукт реакции, который имеет ту же самую стереохимию, что и исходное соединение формулы XX, превращают затем в соединение формулы IC, имеющее ту же самую стереохимию, путем взаимодействия его с муравьинокислым аммонием в присутствии палладия на древесном угле (например, 10% палладий на древесном угле). Обычно используют полярный растворитель, такой как этилацетат или низший алкиловый спирт, а реакцию проводят при температуре примерно от комнатной температуры до около 80oC в течение примерно от 3 до около 24 часов. Реакцию предпочтительно проводят в этаноле при температуре примерно от 0,5 до около 24 часов.
Энантиомерно чистые соединения формулы IB могут быть получены путем взаимодействия аналогичного соединения формулы ID, имеющего ту же самую стереохимию, с соединением формулы R6-(CH2)m-X, в которой X является галогеном или мезилатом (метансульфонатной группой). В каждом из соединений X-(CH2)m-R6 и CH3SO2-O-(CH2)m-R6 один из углеродов указанного (CH2)m необязательно может быть замещен радикалом R8, а одна из углерод-углеродных простых связей указанного (CH2)m, необязательно может быть заменена углерод-углеродной двойной связью. Реакцию осуществляют таким же образом, что и описанная выше для превращения соединений формулы IA в соединения формулы IB.
Соединения, имеющие формулу IA, в которой R4, R5 и R7 каждый является водородом, а R2 является фенилом, могут быть получены, дополнительно, путем восстановительного аминирования 3-амино-2-фенилпиперидина, используя соответствующий альдегид формулы R3CHO, как это описано для превращения соединений формулы V в соответствующие соединения формулы VI. Исходное соединение для этой реакции, 3-амино-2-фенил-пиперидин, может быть получено путем гидрогенолиза 3-(2-метоксибензиламино)-2-фенил пиперидина. Реакцию гидрогенолиза обычно проводят с использованием катализатора, такого как палладий на угле или гидроокись палладия, в инертном растворителе, таком как уксусная кислота или спиртовой растворитель, при температуре примерно от 0oC до около 50oC. Она предпочтительно проводится примерно при комнатной температуре в метанол/этанольном растворителе. Предпочитается также проводить эту реакцию в присутствии неорганической кислоты, такой как хлористоводородная или серная кислота.
Вышеуказанный двухстадийный способ получения соединений формулы IA, в которой R4, R5 и R7 каждый является водородом, а R2 является фенилом, из 3-(2-метоксибензиламино)-2-фенилпиперидина сохраняет стереохимию при положениях "2" и "3" пиперидинового цикла. Он может быть поэтому использован для получения либо чистого энантиомера, либо рацемической смеси продукта формулы IA из, к примеру, 3-(2-метоксибензиламино)-2-фенилпиперидина, имеющего такую же стереохимию. В общем, первая стадия указанного выше процесса может быть использована для получения либо чистого энантиомера либо рацемической смеси 3-амино-2-фенилпиперидина.
Альтернативный метод получения рацемического 3-амино-2- фенилпиперидина состоит в восстановлении 3-амино-2-фенилпиперидина. Это восстановление в большинстве случаев осуществляется с использованием либо натрия в спирте, литийалюминийгидрид/треххлористого алюминия, электролитического восстановления, либо водорода в присутствии металлического катализатора. Восстановление с помощью натрия проводят в большинстве случаев в кипящем спирте, предпочтительно бутаноле, при температуре примерно от 20oC до около температуры кипения растворителя с обратным холодильником, предпочтительно примерно при 120oC. Восстановление с помощью литийалюминийгидрид треххлористого алюминия обычно проводят в простом эфире, ТГФ или диметоксиэтане, предпочтительно в простом эфире; при температуре примерно от 25oC до около 100oC, предпочтительно примерно при комнатной температуре. Электролитическое восстановление проводит, предпочтительно, при комнатной температуре, но температуры примерно от 10oC до около 60oC также являются приемлемыми.
Гидрирование в присутствии металлического катализатора является предпочтительным методом восстановления. Подходящие катализаторы гидрирования включают палладий, платину, никель и родий. Предпочтительным катализатором для гидрирования является окись платины. Температуру реакции можно варьировать в пределах примерно от 10oC до около 50oC, причем примерно 25oC является предпочтительной температурой. Гидрирование в большинстве случаев проводят при давлении примерно от 1,5 до около 4 атмосфер, предпочтительно примерно при давлении 3,0 атмосфер.
Соединения формулы IA, в которой R4, R5 и R7 каждый является водородом, а R2 является фенилом, могут быть получены также по следующему методу. Согласно этому методу, 3-амино-2-фенилпиридин сначала превращают в пиридиновый аналог целевого пиперидина формулы IA путем взаимодействия его с соответствующим соединением формулы R3CHO или R3CH2X, в которой X является уходящей группой (например, хлором, бромом, йодом, мезилатом или тозилатом).
Реакцию 3-амино-2-фенилпиридина с соединением формулы R3CHO для получения пиридинового аналога пиперидина формулы IA обычно производят в присутствии восстанавливающего агента, такого как цианоборогидрид натрия, триацетоксиборогидрид натрия, борогидрид натрия, водород и металлический катализатор, цинк и хлористоводородная кислота, или муравьиная кислота, при температуре примерно от -60oC до около 50oC. Подходящие инертные в реакции растворители для этой реакции включают низшие спирты (например, метанол, этанол и изопропанол), уксусная кислота и ТГФ. Предпочтительно, растворителем является метанол, температурой является температура примерно 25oC, а восстанавливающим агентом является циано- борогидрид натрия.
Дополнительно, реакция 3-амино-2-фенилпиридина с соединением формулы R3CHO может быть проведена в присутствии осушителя или, используя аппарат, предназначенный для удаления азеотропно образующейся воды, чтобы получить имин формулы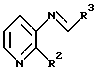
который затем подвергают реакции с восстанавливающим агентом, как это описано выше, предпочтительно с триацетоксиборогидридом натрия, примерно при комнатной температуре. Получение имина в большинстве случаев проводят в инертном для реакции растворителе, таком как бензол, ксилол или толуол, предпочтительно, толуоле, при температуре примерно от 25oC до около 110oC, предпочтительно примерно при температуре кипения растворителя с обратным холодильником. Подходящие системы осушителя- растворителя включают четыреххлористый титан/хлористый метилен и молекулярные сита/ТГФ. Четыреххлористый титан/хлористый метилен является предпочтительной системой.
Реакцию 3-амино-2-фенилпиридина с соединением формулы R3CH2X проводят обычно в инертном для реакции растворителе, таком как хлористый метилен или ТГФ, предпочтительно в хлористом метилене, при температуре примерно от 0oC до около 60oC, предпочтительно примерно 25oC.
Образуемый таким образом пиридин восстанавливают затем для образования целевого пиперидина формулы IA по методике, описанной выше для восстановления 3-амино-2-фенилпиридина.
Соединения формулы IB могут быть получены, в дополнение к методу, показанному в схеме 1 и описанному выше, из других соединений формулы IB модификацией R6- и R8-содержащей боковой цепи. Соответствующие модификации могут быть осуществлены с использованием методов, хорошо известных специалистам, сведующим в данной области техники. Некоторые из этих модификаций описываются в примерах 93-104.
Получение других соединений формулы I, не описанных особо в предшествующей экспериментальной части, может быть выполнено с использованием сочетаний реакций, описанных выше и которые будут очевидными специалистам, сведующим в данной области техники.
В каждой из реакций, рассмотренных или показанных в вышеприведенных схемах от 1 до 4, давление не является решающим параметром, если не указано особо. Давление примерно от 0,5 атмосфер до около 5 атмосфер в большинстве случаев является приемлемым, а давление окружающей среды, т. е. примерно 1 атмоcфера, является предпочтительным из-за удобства.
Новые соединения формулы I и их фармацевтически приемлемые соли являются полезными в качестве антагонистов вещества P, т. е. они обладают способностью противодействовать действиям вещества P на его клеточный рецептор у млекопитающих, и поэтому они способны функционировать в качестве терапевтических средств при лечении вышеупомянутых нарушений и болезней у страдающих млекопитающих.
Соединения формулы I, которые являются основными по природе, способны образовывать широкий ряд различных солей с разнообразными неорганическими и органическими кислотами. Хотя такие соли должны быть фармацевтически приемлемыми для введения животным, часто желательно на практике вначале выделить соединение формулы I из реакционной смеси в виде фармацевтически неприемлемой соли, а затем просто превратить последнее обратно в свободное основное соединение обработкой щелочным реагентом и затем перевести последнее свободное основание в фармацевтически приемлемую соль присоединения кислоты. Соли присоединения кислот основных соединений настоящего изобретения легко получаются обработкой основного соединения, в основном, с эквивалентным количеством выбранной неорганической или органической кислоты в водной среде растворителя или в подходящем органическом растворителе, таком как метанол или этанол. При осторожном выпаривании растворителя легко получается целевая твердая соль.
Соединения формулы I и их фармацевтически приемлемые соли проявляют рецепторсвязывающую активность для вещества P и поэтому являются ценными при лечении и предупреждении широкого ряда клинических состояний, лечение и предупреждение которых осуществляются с веществом Р. Такие состояния включают воспалительные заболевания (например, артрит, псориаз, астму и воспалительное кишечное заболевание), страх (тревогу), депрессивные или дистимические расстройства, колит, психоз, боль, аллергии, такие как экзема и ринит, хроническое обструктивное заболевание дыхательных путей, аллергические нарушения, такие как ядовитый плющ, вазоспастические заболевания, такие как ангина, мигрень и болезнь Рейнауда, фиброзные и коллагеновые болезни, такие как склеродермия и эозинофильный фасциолез, рефлекторно-симпатическую дистрофию, такую как плечевой синдром, хронические расстройства, связанные со стрессом, периферическую невропатию, невралгию, невропатологические расстройства, такие как болезнь Алцгеймера, слабоумие, связанное со СПИДом, диабетическая невропатия и множественный склероз, нарушения, связанные с иммунным усилением или угнетением (супрессией), такие как системная красная волчанка, и ревматические заболевания, такие как фиброз. Следовательно, эти соединения легко приспосабливаются к терапевтическому использованию в качестве антагонистов для вещества P при контроле и/или лечении любого из вышеуказанных клинических состояний у млекопитающих, включая людей.
Соединения формулы I и их фармацевтически приемлемые соли могут быть введены либо перорально, либо парентерально, либо наружным путем. Вообще эти соединения наиболее желательно вводятся при дозировках, варьируемых в пределах примерно от 5,0 мг вплоть до примерно 1500 мг в день, хотя неизбежно встречаются вариации, зависящие от веса и состояния субъекта, который вылечивается, и определенного пути введения средства. Однако наиболее желательно применяется уровень дозировки, который находится в пределах примерно от 0,07 мг до около 21 мг на кг живого веса в день. Тем не менее, могут происходить изменения, зависящие от вида животного, которое вылечивается, и его индивидуальной реакции на указанное лекарственное средство, а также от типа фармацевтического состава, выбранного при этом, и от периода времени и интервала, при котором такое введение проводится. В некоторых случаях, уровни дозировок ниже низшего предела от вышеуказанного предела могут быть более чем достаточными, тогда как в других случаях все еще большие дозы могут быть применены, не вызывая какого-либо вредного побочного действия, при условии, что такие большие дозы сначала разделяются на несколько малых доз для введения в течение всего дня.
Соединения изобретения могут быть введены индивидуально или в сочетании с фармацевтически приемлемыми носителями или разбавителями любым из трех ранее указанных путей, и такое введение может быть проведено в разовых или кратных дозах. Более конкретно, новые терапевтические средства настоящего изобретения могут быть введены в широком разнообразии различных лекарственных форм, т. е. они могут быть смешаны с различными фармацевтически приемлемыми инертными носителями в форме таблеток, капсул, лепешек, пастилок, жестких леденцов, порошков, распыляемых растворов (аэрозолей), кремов, целебных мазей, суппозиториев, желе, гелей, паст, лосьонов, мазей, водных суспензий, инъецируемых растворов, элексиров, сиропов и тому подобных. Такие носители включают твердые разбавители или наполнители, стерилизованные водные среды и разнообразные нетоксичные органические растворители и т. п. Кроме того, пероральные фармацевтические композиции могут подходящим образом подслащиваться и/или ароматизироваться. Вообще, терапевтически эффективные соединения настоящего изобретения представляются в таких лекарственных формах при уровнях концентраций, варьируемых в пределах примерно от 5,0% до около 70 мас.
Для перорального приема таблетки, содержащие разнообразные наполнители, такие как микрокристаллическая целлюлоза, цитрат натрия, карбонат кальция, дикальций-фосфат и глицин, могут быть применены вместе с разнообразными дезинтеграторами (веществами, вызывающими распадаемость лекарственной формы), такими как крахмал (и предпочтительно кукурузный или картофельный крахмал, или крахмал из тапиоки), альгиновая кислота и некоторые сложные силикаты, вместе со связывающими веществами для гранулирования, подобно поливинилпирролидону, сахарозе, желатину и акации. Дополнительно, смазывающие вещества, такие как стеарат магния, лаурилсульфат натрия и тальк, часто являются весьма полезными для целей таблетирования. Твердые композиции подобного типа могут быть также применены в качестве наполнителей в желатиновых капсулах, предпочтительными веществами в этой связи являются также лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли. Когда водные суспензии и/или эликсиры являются желательными для перорального приема, действующий ингредиент может быть смешан с разнообразными подслащивателями или веществами, придающими вкус или аромат, красящими веществами или красителями, и, если настолько необходимо, эмульгаторами и/или суспендирующими веществами, с таким же успехом, вместе с такими разбавителями, как вода, этанол, пропиленгликоль, глицерин и различные подобные сочетания их.
Для парентерального приема могут быть применены растворы лечебного соединения настоящего изобретения либо в масле кунжута или земляного ореха, либо в водном пропиленгликоле. Водные растворители должны быть подходящим образом подвергнуты действию буфера (предпочтительно pH выше, чем 8), если это необходимо, и жидкий разбавитель сначала делается изотоническим. Эти водные растворы являются подходящими для целей внутривенного инъецирования. Масляные растворы являются подходящими для интраартикулярного (внутрисуставного), внутримышечного и подкожного инъецирований. Приготовление всех этих растворов при стерильных условиях легко осуществляется с помощью стандартных фармацевтических способов, хорошо известных специалистам, сведующим в данной области техники.
Дополнительно, возможным является также нанесение соединений настоящего изобретения наружно, когда вылечиваются воспалительные состояния кожи, и это можно предположительно осуществить с помощью кремов, желе, гелей, паст, мазей и тому подобных, в соответствии со стандартной фармацевтической практикой.
Активность соединений настоящего изобретения в качестве антагонистов вещества P определяется по их способности ингибировать связывание вещества P на его клеточном рецепторе в тканях бычьего хвоста, применяя радиоактивные лиганды, чтобы визуализировать тахикининовые рецепторы посредством ауторадиографии. Антагонизирующая активность вещества P описанных здесь соединений может быть оценена с использованием стандартной методики анализа, описанной Каскиери и др. (M.A.Cascieri et al.), как это сообщено в Journal of Biological Chemistry, vol. 258, p. 5158 (1988). Этот метод включает по существу определение концентрации индивидуального соединения, требуемой для понижения на 50% количества лигандов вещества P, меченых радиоактивными атомами, на их клеточных рецепторах в указанных выделенных коровьих тканях, тем самым предоставляя характерные величины 1С50 (концентрация для ингибирования активностей на 50%) для каждого испытуемого соединения.
В этой методике ткань бычьего хвоста вынимают из холодильника при -70oC и гомогенизируют в 50 объемах (вес/объем) охлажденного льдом 50 мМ трис- (т. е. триметамина, который является 2-амино-2-гидроксиметил- 1,3-пропандиолом)-хлоргидратного буфера, имеющего pH 7,7. Гомогенат подвергается центрифугированию при 30.000 х G в течение 20-минутного периода времени. Осадок в пробирке после центрифегирования заново суспендируется при 30.000 х G в течение дополнительных 20 минут. Осадок в пробирке повторно суспендируется затем в 40 объемах охлажденного льдом 50 мМ трис-буфера (pH 7,7), содержащего 2 мМ хлористого кальция, в 2 мМ хлористого магния, 40 г/мл бацитрацина, 4 мкг/мл лейпептина, 2 мкг хивостатина и 200 г/мл бычьего сывороточного альбумина. Эта стадия завершает получение тканевого препарата.
Методика радиолигандного связывания проводится затем путем инициирования реакции через добавление 100 мкл испытуемого соединения, доведением до концентрации 1 мкМ, за которым следует добавление 100 мкл радиоактивного лиганда, доведением до конечной концентрации 0,5 мМ, а затем, наконец, добавлением 800 мкл тканевого препарата, полученного как это описано выше. Конечный объем составляет 1,0 мл, и реакционная смесь затем подвергается завихрению и инкубируется при комнатной температуре (приблизительно 20oC) в течение 20 минут. Содержимое пробирок затем фильтруется, используя сборник клеток, и стекловолоконные фильтры (Ватман GF/B) промываются четыре раза с 50 мМ трис-буфера (pH 7,7), с фильтрами, предварительно перепропитанными в течение двух часов до процесса фильтрации. Затем определяется радиоактивность в счетчике Бета-частиц при 53%-ной эффективности отсчета, а величины 1С50 вычисляются путем использования стандартных статистических методов. В таблице 1 представлены результаты испытаний.
Антипсихотическая активность соединений настоящего изобретения в качестве нейролептических средств или борьбы с (регулирования) различными психотическими расстройствами определяется главным образом исследованием их способности подавлять у морских свинок гиперподвижность индуцированную веществом P или агонистом вещества P. Это исследование проводилось сначала введением морским свинкам контрольных соединений или соответствующих испытуемых соединений настоящего изобретения, затем инъецированием морских свинок веществом P или агонистом вещества P путем антрацеребрального введения через канюлю и после этого измерением их индивидуальной опорно- двигательной реакции на указанный стимул.
Ниже представлены данные, показывающие противорвотную активность (2S, 3S)-2-фенил-3-(2-метоксибензиламино)пиперидина, соединения формулы I, испытанного на животной модели хорька.
Противорвотная активность, определенная на модели хорька.
Взрослых хорьков-самцов (фермы Маршалла, от 800 до 1200 г) не менее чем за 48 часов перед экспериментом помещали индивидуально в обстановку, контролируемую по температуре, свету и влажности. Животным давали стандартную гранулированную пищу и воду по потребности. Перед введением цис-платины животных лишали пищи на ночь.
Определенными дозами давали NK' селективные антагонисты вещества P либо перед, либо после введения цис-платины на основе ранее проведенных исследований по определению оптимального времени введения лекарства. СР- 99,994 (СР-99,994 это (2S,3S)-2-фенил-3-(2-метоксибензиламино)-пиперидин, 3,0 или 10 мг/кг) давали в виде разовой пероральной дозы через 30 минут после введения цис-платины (10 мг/кг внутрибрюшинно). Цис-платина (П) диамминдихлорид (цис-платина) была приобретена у фирмы Сигма Кемикал Компани, Сейнт-Луис, Миссури, США.
Вслед за дачей цис-платины хорьки наблюдались непрерывно в индивидуальных поликарбонатных клетках в течение не менее 120 минут. Время и количество наблюдавшихся позывов на рвоту и выбросов рвотных масс записывались для каждого животного. Позывы на рвоту количественно определялись путем подсчета ритмических сокращений живота. Выбросом рвотных масс считалось каждое оральное исторжение жидкого или твердого содержимого верхнего желудочно-кишечного тракта. Каждое животное испытывалось лишь один раз.
Результаты представлены в виде диаграммы (см. фиг. 1 и 2).
На фиг.1 показана диаграмма рвоты у хорьков при введении внутрибрюшинно цис-платины (10 мг/кг); на фиг. 2 то же.
Настоящее изобретение поясняется следующими примерами. Однако должно быть понятным, что изобретение не ограничивается конкретными деталями этих примеров.
Пример 1. Цис-3-(2-метоксибензиламино)-2-фенилпиперидин.
A. 2-Оксо-5-оксимино-6-фенилпиперидин.
К перемешиваемому раствору транс-5-нитро-2-оксо-6- фенилпиперидина (27,0 г, 122,6 ммоль) в 1:1 смеси хлористого метилена:метанола добавляют трет-бутилат калия (135 ммоль, 15,1 г) при 25oC. Эту реакционную смесь охлаждают до -78oC и газообразный озон пробулькивается до тех пор, пока (3 часа) ТСХ (10% -ный метанол в хлористом метилене) не будет показывать исходного вещества. Реакционную смесь продувают затем азотом, чтобы удалить избыток озона, а затем обрабатывают диметилсульфидом (60 мл) при 78oC. После подогревания до комнатной температуры в течение 30 минусе обрабатывают водным раствором гидроксиламина (85,2 г, 1,22 моль) и ацетата натрия (50,3 г, 613 ммоль) в воде (220 мл). После перемешивания в течение 16 часов, легкотекучие вещества удаляют, используя роторный испаритель. Остаток выливают в 1,2 л холодной воды и перемешивают в течение 30 мин. Выпадающее в осадок твердое вещество фильтруют, чтобы получить 2-оксо-3-оксамино-6-фенилпиперидин (14,0 г, 56,0% ). Т.пл. 178oC.
1H ЯМР (DMCO-d6, 300 МГц, δ ): 2,04-2,22 (2H, мультиплет), 2,4-2,42 (1H, мультиплет), 2,71 (1H, дублет и триплет, J 8 и 16 Гц), 5,02 (1H, дублет, J 4 Гц), 7,28-7,41 (5H, мультиплет), 8,35 (1H, дублет, J 4 Гц), 10,99 (1H, синглет).
ТСХ: (90:10 смесь хлористого метилена:метанола) Rf 0,54.
B. Цис-5-(2-метоксибензиламино)-2-оксо-6-фенилпиперидин.
2-Оксо-5-оксимино-6-фенилпиперидин (28,2 г, 138 ммоль) растворяют (нагревание на паровой бане является необходимым, чтобы получить прозрачный раствор) в этаноле (500 мл), содержащем метанол (50 мл). Добавляют нейтральный никель Ренея (80 г) и смесь встряхивают на трясучке Парра в атмосфере водорода (40 psi 2,81 кг/см2). После 18 часов реакционную смесь фильтруют через диатомовую землю (Целит (торговая марка)), которую тщательно промывают метанолом. Органические растворители удаляют, используя роторный испаритель, чтобы получить масло, которое затвердевает при стоянии (26,2 г, 100%). 1H-ЯМР показывает, что продукт реакции является (3:1) смесью цис-5-амино-2-оксо-6- фенилпиперидина и транс-5-амино-2-оксо-6-фенилпиперидина соответственно. Эту смесь растворяют в метаноле (345 мл) и pH доводят до 5 с помощью насыщенного метанольного раствора хлористоводородной кислоты. К системе добавляют сита 4  (55 г), цианоборогидрид натрия (138 ммоль) и орто-метоксибензальдегид (22,5 г, 165 ммоль). Перемешивание продолжают (4 часа) до тех пор, пока реакция не завершится, как это показывается с помощью ТСХ. Реакционную смесь фильтруют через диатомовую землю (Целит (торговая марка)) и фильтрат концентрируют, используя роторный выпариватель. Остаток суспендируют в воде и pH делают основным. Водную фазу экстрагируют хлористым метиленом (4 х 200 мл), промывают водой, рассолом, а затем высушивают (безводным сульфатом магния) и концентрируют, чтобы получить масло (47,0 г), которое подвергается флеш- хроматографии. Элюирование с помощью 3%-ного метанола в хлористом метилене дает белое твердое вещество (19,6 г, т. пл. 122oC).
(55 г), цианоборогидрид натрия (138 ммоль) и орто-метоксибензальдегид (22,5 г, 165 ммоль). Перемешивание продолжают (4 часа) до тех пор, пока реакция не завершится, как это показывается с помощью ТСХ. Реакционную смесь фильтруют через диатомовую землю (Целит (торговая марка)) и фильтрат концентрируют, используя роторный выпариватель. Остаток суспендируют в воде и pH делают основным. Водную фазу экстрагируют хлористым метиленом (4 х 200 мл), промывают водой, рассолом, а затем высушивают (безводным сульфатом магния) и концентрируют, чтобы получить масло (47,0 г), которое подвергается флеш- хроматографии. Элюирование с помощью 3%-ного метанола в хлористом метилене дает белое твердое вещество (19,6 г, т. пл. 122oC).
1H-ЯМР (CDCl3) δ 1,81-1,96 (1H, мультиплет), 2,0-2,18 (1H, мультиплет), 2,4 (1H, дублет и триплет, J 4,5 и 16 Гц), 2,75 (1H, три дублета, J 6,5, 10,5 и 16 Гц), 3,48 (3H, синглет), 3,54 (1H, два дублета, J 13,8 Гц), 3,76 (1H, два дублета, J 13,8 Гц), 4,72 (1H, дублет, J 4 Гц), 5,72 (1H, уширенный синглет), 6,71 (1H, дублет, J 8 Гц), 6,8 (1H, триплет, J 6,8 Гц), 7,04 (1H, два дублета, J 1,8 и 7,2 Гц), 7,17 (1H, дублет и триплет, J 1,6 и 8,2 Гц), 7,2-7,44 (5H, мультиплет).
HRMS Вычислено для C19H22N2O2: 310, 1682.
Найдено: 310, 1649.
ТСХ: (90:10 смесь хлористого метилена:метанола)Rf 0,47.
C. Цис-3-(2-метоксибензиламино)-2-фенилпиперидин.
Борандиметилсульфидный комплекс в тетрагидрофуране (2М, 158 мл, 315 ммоль) добавляют к раствору цис-5-(2-метоксибензиламино)-2-оксо-6- фенилпиперидина (19,6 г, 63,0 ммоль) в тетрагидрофуране (500 мл) в атмосфере азота и реакционную смесь нагревают при температуре кипения с обратным холодильником в течение 18 часов. К концу этого периода реакционную смесь охлаждают и избыток борандиметилсульфидного комплекса осторожно разлагают добавлением по каплям метанола. Содержимое реакционной смеси концентрируют затем под вакуумом. Этанол (500 мл) и порошкообразный карбонат калия (17,5 г, 126 ммоль) добавляют к остатку и реакционную смесь нагревают при температуре кипения с обратным холодильником (18 часов). Затем реакционную смесь концентрируют под вакуумом и остаток экстрагируют хлористым метиленом (4 х 250 мл) и высушивают (безводным сульфатом магния). Органические растворители удаляют под вакуумом, чтобы получить остаток, который растворяют в минимальном количестве хлористого метилена. К этому раствору добавляют избыток раствора хлористоводородной кислоты в простом эфире, таким образом получают дигидроморидную соль цис-3-(2-метоксибензиламино)-2-фенилпиперидина, которую выделяют фильтрацией. Эту соль нагревают при температуре кипения с обратным холодильником в хлороформе (400 мл) в течение 3 часов и фильтруют, чтобы получить по существу чистую хлористоводородную соль названного выше соединения (22,4 г, т. пл. 245oC, 96%), которую кристаллизуют из смеси горячего метанола-этанола, чтобы получить белое кристаллическое твердое вещество (19,2 г, 83%).
Т. пл. 255oC (соль HCl). 1H-ЯМР (CDCl, свободное основание) d 7,1-7,3 (6H, мультиплет), 6,97 (1H, два дублета, J 1,7 и 7,4 Гц), 6,79 (1H, уширенный триплет, J 7,4 Гц), 6,66 (1H, дублет, J 8,2 Гц), 3,87 (1H, дублет, J 2,3 Гц), 3,67 (1H, дублет, J 11,4 Гц), 3,44 (3H, синглет), 3,4 (1H, дублет, J 14 Гц), 3,22-3,3 (1H, уширенный дублет, J 12,2 Гц), 2,72-2,86 (2H, мультиплет), 2,09-2,19 (1H, уширенный дублет, J 13,7 Гц), 1,84-2,01 (1H, дублет и триплет, J 4,0 и 13,0 Гц), 1,53-1,7 (1H, дублет и триплет, J 3,5 и 13,4 Гц), 1,33-1,45 (1H, уширенный дублет, J 12,5 Гц). 13C-ЯМР (CDCl3, свободное основание) d 157,6, 142,5, 129,6, 128,3, 128,2, 127,8, 126,5, 126,3, 120,0, 109,8, 64,0, 54,8, 54,7, 47,8, 46,7, 28,2, 20,4.
HRMS: вычислено для C19H24N2O:
296, 1886.
Найдено: 296, 1904.
ТСХ: (90:10 смесь хлористого метилена:метанола) Rf 0,39.
Пример 2. Цис-1-аллил-3-(2-метоксибензиламино)-2-фенилпиперидин.
В атмосфере азота, в круглодонную колбу помещают 60 мг (0,2 ммоль) названного выше соединения примера 1 и 0,2 мл хлористого метилена. К этой системе добавляют 28 мкл (0,2 ммоль) триэтиламина и 17,5 мкл (0,2 ммоль) бромистого аллила, и реакционную смесь перемешивают при комнатной температуре в течение ночи. Смесь разделяют на слои между хлористым метиленом и насыщенным водным раствором бикарбоната натрия, слои разделяют, и водную фазу экстрагируют тремя порциями хлористого метилена. Объединенные органические фракции высушивают (сульфатом натрия) и концентрируют с помощью роторного испарителя. Сырое вещество очищают с помощью флеш-хроматографии, чтобы получить 26 мг названного выше соединения.
1H-ЯМР (CDCl3) d 7,20 (мультиплет, 5H), 7,03 (триплет, 1H, J 6 Гц), 6,79 (дублет, 1H, J 6 Гц), 6,88 (триплет, 1H, J 6 Гц), 6,57 (дублет, 1H, J 6 Гц), 5,78 (мультиплет, 1H), 4,95 (мультиплет, 2H), 3,62 (дублет, 1H, J 12 Гц), 3,40 (синглет, 3H), 3,32 (дублет, 1H, J 12 Гц), 3,26 (дублет, 1H, J 2 Гц), 3,18 (мультиплет, 1H), 2,56 (мультиплет, 1H), 2,36 (мультиплет, 1H), 1,98 (мультиплет, 3H), 1,68 (мультиплет, 1H), 1,38 (мультиплет, 2H).
HRMS вычислено для C22H28N2O: 336, 2202.
Найдено: 336, 2216.
Пример 3. Цис-1-этил-3-(2-метоксибензиламино)-2-фенилпиперидин.
Цис-5-(N-трет-бутоксикарбонил-2-метоксибензиламино)-2- оксо-6-фенилпиперидин.
В атмосфере азота в круглодонную колбу помещают 2,0 г (6,4 ммоль) цис-5-(2-метоксибензиламино)-2-оксо-6-фенилпиперидина, 7 мл хлористого метилена и 14,1 г (64,5 моль) ди-трет-бутилдикарбоната. Реакционную смесь перемешивают при комнатной температуре в течение 4 дней, выливают в насыщенный водный раствор бикарбоната натрия и экстрагируют двумя порциями хлористого метилена. Объединенные органические фракции промывают водой, высушивают (сульфатом натрия) и концентрируют с помощью роторного испарителя, чтобы получить 16 г масла. Сырое вещество очищают флеш-колоночной хроматографией, чтобы получить 2,4 (91%-ный выход) цис-5-(N-трет-бутоксикарбонил-2-метоксибензиламино)-2-оксо-6- фенилпиперидина в виде белого твердого вещества.
1H-ЯМР (CDCl3) d 7,34 (мультиплет, 3H), 7,14 (мультиплет, 2H), 7,04 (мультиплет, 1H), 6,92 (дублет, 1H, J 7 Гц), 6,79 (триплет, 1H, J 7 Гц), 6,62 (дублет, J 7 Гц), 5,00 и 4,86 (2 мультиплета, 1H), 4,68 и 4,46 (2 мультиплета, 1H), 4,00 и 3,78 (2 дублета, 1H, J 18 Гц), 3,58 (синглет, 3H), 2,82 (дублет, 1H, J 18 Гц), 2,20 (мультиплет, 2H), 1,80 (мультиплет, 1H), 1,44 (мультиплет, 1H), 1,53 и 1,36 (2 синглета, 3H).
B. Цис-N-этил-5-(2-метоксибензиламино)-2-оксо-6-фенилпиперидин.
В атмосфере азота в круглодоннун) колбу помещают 50 мг (0,12 ммоль) цис-5-(N-трет-бутоксикарбонил-2-метоксибензил-амино)-2-оксо-6- фенилпиперидина и 0,2 мл ТГФ. К этой системе добавляют 13,5 мг (0,12 ммоль) трет-бутилата калия и 20 мкл (0,24 ммоль) йодистого этила. Реакционную смесь перемешивают при комнатной температуре в течение 3 часов (во время этого периода времени к системе добавляют дополнительное количество трет-бутилаnа калия (13,5 мг) и йодистого этила (20 мкл). Смесь разделяют на слои между хлористым метиленом и водным раствором бикарбоната натрия, слои разделяют и водную фазу экстрагируют тремя порциями хлористого метилена. Объединенные органические фракции высушивают (сульфатом натрия) и концентрируют с помощью роторного испарителя. Сырое вещество очищают флеш-колоночной хроматографией, используя 3:97 смесь метанола/хлороформа в качестве элюента, чтобы получить 42 мг цис-N-этил-5- (2-метоксибензиламино)-2-оксо-6-фенилпиперидина.
1H-ЯМР (CDCl3) d 7,36 (мультиплет, 3H), 7,10 (мультиплет, 3H), 6,92 (дублет, 1H, J 6,0 Гц), 6,80 (триплет, 1H, J 6 Гц), 6,63 (дублет, 1H, J 6 Гц), 4,97 и 4,82 (2 мультиплета, 1H), 4,60 и 4,40 (2 мультиплета, 1H), 4,00 (мультиплет, 1H), 3,80 (мультиплет, 1H, J 18 Гц), 3,58 (синглет, 3H), 2,80 (дублет, 1H, J 18 Гц), 2,50 (мультиплет, 3H), 1,80 (мультиплет, 1H), 1,56 и 1,38 (2 синглета, 9H), 1,06 (триплет, 3H, J 7 Гц).
Масс-спектр м/е 438 (сигнал, соответствующий недиссоциированной молекуле).
С. Цис-1-этил-3-(2-метоксибензиламино)-2-оксо-6-фенилпиперидин.
В круглодонную колбу помещают 173 мг (0,39 ммоль) цис-N-этил-5-(N-трет-бутоксикарбонил-2-метоксибензиламино)-2-оксо-6- фенилпиперидина и 0,5 мл диоксана. К этой системе добавляют 5 мл диоксана, насыщенного хлористым водородом. Реакционную смесь перемешивают при комнатной температуре в течение 2,5 часов и концентрируют с помощью роторного испарителя. Остаток разделяют на части между насыщенным водным раствором бикарбоната натрия и хлороформом и экстрагируют тремя порциями хлороформа. Объединенные органические фракции высушивают (сульфатом натрия) и концентрируют, чтобы получить 84 мг цис-1-этил-3-(2- метоксибензиламино)-2-оксо-6-фенилпиперидина, который используют немедленно без дальнейшей очистки.
1H-ЯМР (CDCl3) d 7,28 (мультиплет, 7H), 6,90 (триплет, 1H, J 6 Гц), 6,81 (дублет, 1H, J 6 Гц), 4,68 (дублет, 1H, J 2 Гц), 3,88 (мультиплет, 3H), 3,74 (синглет, 3H), 3,14 (мультиплет, 1H), 2,56 (мультиплет, 3H), 1,76 (мультиплет, 1H), 1,54 (мультиплет, 1H), 1,04 (триплет, 3H, J 6 Гц).
D. Цис-1-этил-3-(2-метоксибензиламино)-2-фенилпиперидин.
В атмосфере азота в круглодонную колбу помещают 80 мг (0,24 ммоль) амина, полученного выше, и 5 мл ТГФ. К этой системе добавляют 0,59 мл (1,18 ммоль), 2,0 М борандиметилсульфидного комплекса в ТГФ, и реакционную смесь нагревают в течение ночи при 60oC. Смесь охлаждают, к системе осторожно добавляют приблизительно 2 мл метанола и смесь перемешивают в течение 1 часа и концентрируют с помощью роторного испарителя. К системе добавляют 66 мг (0,48 ммоль) карбоната калия в 2 мл этанола и смесь нагревают при температуре кипения с обратным холодильником в течение 2,5 часов, охлаждают и концентрируют. Остаток разделяют на части между водой и хлористым метиленом, слои разделяют и водную фазу экстрагируют тремя порциями хлористого метилена. Объединенные органические фракции высушивают (сульфатом натрия) и концентрируют, чтобы получить 64 мг желтого масла. Это масло растворяют в хлористом метилене, а затем к раствору добавляют эфир, насыщенный хлористым водородом. Полученное твердое вещество собирают, получая 60 мг хлористоводородной соли названного выше соединения.
1H-ЯМР (свободное основание, CDCl3) d 7,22 (мультиплет, 5H), 7,03 (триплет, 1H, J 6 Гц), 6,78 (дублет, 1H, J 6,0 Гц), 6,68 (триплет, 1H, J 6 Гц), 6,56 (дублет, 1H, J 6 Гц), 3,62 (дублет, 1H, J 12 Гц), 3,39 (синглет, 3H), 3,31 (дублет, 1H, J 12 Гц), 3,25 (дублет, 1H J 2 Гц), 3,16 (мультиплет, 1H), 2,55 (мультиплет, 2H), 1,99 (мультиплет, 2H), 1,86 (мультиплет, 2H), 1,40 (мультиплет, 2H), 0,90 (триплет, 3H, J 6 Гц).
HRMS: Вычислено для C21H28N2O: 324, 2201.
Найдено: 324, 2193.
Названные выше соединения примеров 4-14 получают по методике, подобно описанной в примере 2.
Пример 4. Цис-3-(2-метоксибензиламино)-2-фенил-1-(проп-1-ил)-пиперидин.
Т. пл. 223-225oC.
1H-ЯМР (CDCl3) d 7,28 (мультиплет, 5H), 7,10 (триплет, 1H, J 6 Гц), 6,87 (дублет, 1H, J 6 Гц), 6,74 (триплет, 1H, J 6 Гц), 6,60 (дублет, 1H, J 6 Гц), 3,86 (дублет, 1H, J 12 Гц), 3,46 (дублет, 1H, J 12 Гц), 3,40 (синглет, 3H), 3,29 (мультиплет, 1H), 2,64 (мультиплет, 1H), 2,50 (мультиплет, 1H), 2,02 (мультиплет, 4H), 1,46 (мультиплет, 4H), 0,72 (триплет, 3H, J 7 Гц). Масс-спектр м/е 338 (сигнал, соответствующий недиссоциированной молекуле).
Пример 5. Цис-1-бутил-3-(2-метоксибензиламино)-2-фенилпиперидин.
Т.пл. 139-140oC (соль, HCl).
1H-ЯМР (CDCl3) d 7,20 (мультиплет, 5H), 7,02 (триплет, 1H, J 6 Гц), 6,77 (дублет, 1H, J 6 Гц), 6,66 (триплет, 1H, J 6 Гц), 6,55 (дублет, 1H, J 6 Гц), 3,60 (дублет, J 14 Гц), 3,37 (синглет, 1H), 3,30 (дублет, 1H, J 14 Гц), 3,22 (дублет, 1H, J 2 Гц), 3,16 (мультиплет, 1H), 2,48 (мультиплет, 2H), 1,98 (мультиплет, 3H), 1,36 (мультиплет, 3H), 1,08 (мультиплет, 3H), 0,71 (триплет, 3H, J 9 Гц). Масс-спектр м/е 352 (сигнал, соответствующий недиссоциированной молекуле).
Пример 6. Цис-3-(2-метоксибензиламино)-2-фенил-1-(2-фенилэт-1-ил)пиперидин.
1H-ЯМР (CDCl3) d 7,18 (мультиплет, 10H), 6,92 (дублет, 1H, J 6 Гц), 6,82 (дублет, 1H, J 6 Гц), 6,71 (триплет, 1H, J 6 Гц), 6,00 (дублет, 1H, J 6 Гц), 3,66 (дублет, 1H, J 15 Гц), 3,44 (синглет, 3H), 3,35 (мультиплет, 2H), 2,72 (мультиплет, 3H), 2,60 (мультиплет, 1H), 2,12 (мультиплет, 4H), 1,68 (мультиплет, 1H), 1,44 (мультиплет, 2H).
HRMS: вычислено для C27H32N2O: 400, 2515.
Найдено: 400, 2521.
Пример 7. Цис-3-(2-метоксибензиламино)-2-фенил-1-пропаргилпиперидин.
Т.пл. 147-149oC (соль HCl, разл.).
1H-ЯМР (CDCl3) d 7,22 (мультиплет, 5H), 7,02 (триплет, 1H, J 7 Гц), 6,82 (дублет, 1H, J 7 Гц), 6,68 (триплет, 1H, J 7 Гц), 6,56 (дублет, 1H, J 7 Гц), 3,62 (дублет, 1H, J 12 Гц), 3,47 (дублет, 1H, J 2 Гц), 3,38 (мультиплет, 4H), 3,30 (дублет, 1H, J 12 Гц), 3,21 (дублет, 1H, J 2 Гц), 3,15 (дублет, 1H, J 2 Гц), 2,94 (мультиплет, 1H), 2,55 (мультиплет, 2H), 2,06 (мультиплет, 3H), 1,40 (мультиплет, 1H). Масс-спектр м/е 334 (сигнал, соответствующий недиссоциированной молекуле).
Вычислено для C22H26N2O•2HCl•2,75 H2O: C 57,83, H 7,39, N 6,13.
Найдено: C 57,81, H 7,58, N 5,91.
1 Пример 8. Цис-3-(2-метоксибензиламино)-2-фенил-1-(3-фенилпроп-1-ил) пиперидин.
Т.пл. 120-125oC (соль CHl, разл.).
1H-ЯМР (CDCl3) d 7,14 (мультиплет, 1H), 6,80 (дублет, 1H, J 6 Гц), 6,68 (триплет, 1H, J 6 Гц), 6,58 (дублет, 1H, J 8 Гц), 3,62 (дублет, 1H, J 14 Гц), 3,40 (синглет, 3H), 3,32 (дублет, 1H, J 14 Гц), 3,26 (дублет, 1H, J 2 Гц), 3,18 (мультиплет, 1H), 2,52 (мультиплет, 2H), 2,35 (мультиплет, 1H), 2,00 (мультиплет, 3H), 1,76 (мультиплет, 4H), 1,42 (мультиплет, 2Н). Масс-спектр м/е 414 (сигнал, соответствующий недиссоциированной молекуле).
Вычислено для C28H34ON2•2HCl•2,75 H2O: C 62,62, H 7,69, N 5,22.
Пример 9. Цис-1-(карбоксамидометил)-3-(2-метоксибензиламино)- 2-фенилпиперидин,
Т.пл. 235oC (соль CHl).
1H-ЯМР (CDCl3) d 7,20 (мультиплет, 5H), 7,05 (триплет, 1H, J 7 Гц), 6,82 (дублет, 1H, J 7 Гц), 6,68 (триплет, 1H, J 7 Гц), 6,56 (дублет, 1H, J 7 Гц), 3,64 (дублет, 1H, J 16 Гц), 3,39 (дублет, J 2 Гц), 3,30 (синглет, 3H), 3,29 (дублет, 1H, J 16 Гц), 3,20 (дублет, 1H, J 18 Гц), 3,06 (мультиплет, 1H), 2,57 (мультиплет, 1H), 2,36 (дублет, 1H, J 18 Гц), 2,06 (мультиплет, 3H), 1,41 (мультиплет, 2H), Масс-спектр м/е 353 (сигнал, соответствующий недиссоциированной молекуле).
Пример 10. Цис-1-карбоксиметил-3-(2-метоксибензиламино)-2-фенил-пиперидин.
Т.пл. 58oC (соль HCl, очень гигроскопична).
1H-ЯМР (CD3OD) d 7,72 (мультиплет, 2H), 7,62 (мультиплет, 3H), 7,36 (триплет, 1H, J 7 Гц), 7,28 (дублет, 1H, J 7 Гц), 6,96 (мультиплет, 2H), 5,14 (мультиплет, 1H), 4,18 (мультиплет, 2H), 4,00 (мультиплет, 1H), 3,66 (мультиплет, 3H), 3,40 (мультиплет, 1H), 2,34 (мультиплет, 5H), 2,07 (мультиплет, 1H ). Масс-спектр м/е (сигнал, соответствующий недиссоциированной молекуле).
Пример 11. Цис-3-(2-метоксибензиламино)-2-фенил-1-(5-фенилпант-1-ил)-пиперидин.
Т.пл. 109oC (соль, HCl, разл.).
1Н-ЯМР (CDCl3) d 7,14 (мультиплет, 1H), 6,78 (дублет, 1H, J 6 Гц), 6,68 (триплет, 1H, J 6 Гц), 6,56 (дублет, 1H, J 6 Гц), 3,62 (дублет, 1H, J 14 Гц), 3,40 (синглет, 3H), 3,32 (дублет, 1H, J 14 Гц), 2,50 (мультиплет, 4H), 2,00 (мультиплет, 4H), 1,76 (мультиплет, 1H), 3,24 (дублет, 1H, J 2 Гц), 3,16 (мультиплет, 1H), 1,42 (мультиплет, 5H), 1,14 (мультиплет, 2H). Масс-спектр м/е 442 (сигнал, соответствующий недиссоциированной молекуле).
Пример 12. Цис-(2-метоксибензиламино)-2-фенил-1-(4-фенил-бут-1-ил) пиперидин.
Т.пл. 65-70oC (соль CHl).
1H-ЯМР (CDCl3) d 7,20 (мультиплет, 11H), 6,84 (дублет, 1H, J 7 Гц), 6,73 (триплет, 1H, J7 Гц), 6,62 (дублет, 1H, J 7 Гц), 3,68 (дублет, 1H, J 12 Гц), 3,44 (синглет, 3H), 3,38 (дублет, 1H, J 12 Гц), 3,30 (дублет, 1H, J 3 Гц), 3,18 (мультиплет, 1H), 2,34 (мультиплет, 4H), 2,02 (мультиплет, 3H), 1,80 (мультиплет, 1H), 1,47 (мультиплет, 6H), Масс-спектр м/е 428 (сигнал, соответствующий недиссоциированной молекуле).
Пример 13. Цис-3-(2-метоксибензиламино)-2-фенил-1-(3-фенилпроп- 2-ен-1-ил)пиперидин.
Т.пл. 54-58oC (соль, HCl, разл.).
1H-ЯМР (CDCl3) d 7,20 (мультиплет, 11H), 6,84 (дублет, 1H, J 6 Гц), 6,72 (триплет, 1H, J 6 Гц), 6,60 (дублет, 1H, J 6 Гц), 6,28 (мультиплет, 2H), 3,76 (дублет, 1H, J 12 Гц), 3,40 (мультиплет, 5H), 3,20 (мультиплет, 1H), 2,56 (мультиплет, 2H), 2,04 (мультиплет, 4H), 1,44 (мультиплет, 1H). Масс-спектр м/е 412 (сигнал, соответствующий недиссоциированной молекуле).
Пример 14. Цис-3-(2-метоксибензиламино)-1-(2-феноксиэтил-1-ил) 2- фенилпиперидин.
1H-ЯМР (CDCl3) d 7,26 (мультиплет, 7H), 7,08 (триплет, 1H, J 6 Гц), 6,80 (мультиплет, 5H), 6,61 (дублет, 1H, J 6 Гц), 4,04 (мультиплет, 1H), 3,68 (дублет, 1H, J 14 Гц), 3,42 (синглет, 3H), 3,37 (дублет, 1H, J 14 Гц), 2,97 (мультиплет, 1H, ) 2,60 (мультиплет, 1H), 2,22 (мультиплет, 2H), 2,06 (мультиплет, 3H), 1,47 (мультиплет, 1H), 1,26 (мультиплет, 3H). Масс-спектр м/е 323 (сигнал, соответствующий недиссоциированной молекуле).
Названные выше соединения примеров 15-17 получают по методике, подобно описанной в примере 3.
Пример 15. Цис-3-(2-метоксибензиламино)-1-метил-2-фенилпиперидин.
Т.пл. 58oC (соль HCl, очень гидроскопична, разл.).
1H-ЯМР (CDCl3) d 7,22 (мультиплет, 5H), 7,04 (триплет, 1H, J 6 Гц), 6,82 (дублет, 1H, J 6,0 Гц), 6,78 (триплет, 1H, J 6 Гц), 6,58 (дублет, 1H, J 6 Гц), 3,62 (дублет, 1H, J 12 Гц), 3,42 (синглет, 3H), 3,32 (дублет, 1H, J 12 Гц), 3,02 (мультиплет, 2H), 2,56 (мультиплет, 1H), 2,04 (мультиплет, 3H), 2,02 (синглет, 3H), 2,38 (мультиплет, 2H). Масс-спектр м/е 310 (сигнал, соответствующий недиссоциированной молекуле).
Пример 16. Цис-1-бензил-3-(2-метоксибензиламино)-2-фенилпиперидин
Т.пл. 68-70oC (соль HCl, разл.).
1H-ЯМР (CDCl3) d 7,28 (мультиплет, 11H), 6,83 (дублет, 1H, J 6 Гц), 6,70 (триплет, 1H, J 6 Гц), 6,61 (дублет, 1H, J 6 Гц), 3,85 (дублет, 1H, J 14 Гц), 3,64 (дублет, 1H, J 14 Гц), 3,47 (синглет, 3H), 3,35 (мультиплет, 2H), 2,96 мультиплет, 1H), 2,79 (дублет, 1H, J 14 Гц), 2,62 (мультиплет, 1H), 1,96 (мультиплет, 3H), 1,38 (мультиплет, 2H). Масс-спектр м/е 386 (сигнал, соответствующий недиссоциированной молекуле).
Пример 17. Цис-1-(2-гидроксиэт-1-ил)-3-(2-метоксибензиламино) 2- фенилпиперидин.
Т.пл. 148-149oC (соль HCl, разл.).
1H-ЯМР (CDCl3) d 7,28 (мультиплет, 5H), 7,12 (триплет, 1H, J 7 Гц), 6,88 (дублет, 1H, J 7 Гц), 6,75 (триплет, 1H, J 7 Гц), 6,63 (дублет, 1H, J 7 Гц), 3,70 (мультиплет, 3H), 3,44 (мультиплет, 5H), 3,26 (мультиплет, 1H), 2,85 (мультиплет, 1H), 2,64 (мультиплет, 1H), 2,06 (мультиплет, 3H), 1,88 (мультиплет, 1H), 1,30 (мультиплет, 2H).
Вычислено для C21H28N2O3: 340, 2150.
Найдено: 340, 2142.
Вычислено для C21H28O2N2•2HCl•2,6 H2O: C 54,81, H 7,71, N 6,08.
Найдено: C 54,816, H 8,02, N 5,82.
Пример 18. Цис-3-(2-метоксибензиламино)-2-фенилпирролидин.
1-Бензил- 3-карбоэтокси-2-фенил-2,3-дидегидропирролидин, полученный по методике, описанной Селерьером и др. (Celerier et al, Tetragedron Lett. 28, 6597 (1987)) (2,0 г, 6,5 ммоль) растворяют в 70 мл этанола. К этому раствору добавляют 1 мл концентрированного водного раствора хлористого водорода и 2,0 г 5% палладия на угле. Смесь помещают в аппарат Парра (40 psi. 2,81 кг/см2 водорода) в течение 1 часа. Смесь фильтруют через диатомовую землю (Целит (торговая марка)) и фильтрат концентрируют с помощью роторного испарителя. К остатку добавляют насыщенный водный раствор бикарбоната натрия до тех пор, пока жидкость не станет основной (pH 8), и вещество экстрагируют тремя порциями хлористого метилена. Объединенные органические фракции высушивают сульфатом натрия и концентрируют (роторным испарителем), чтобы получить 1,1 г масла. Это вещество суспендируют в 10 мл 10%-ного водного раствора бикарбоната натрия и смесь охлаждают в ледяной бане. К смеси добавляют 0,65 мл (4,6 ммоль) бензилового эфира хлормуравьиной кислоты, холодная баня удаляется и смесь перемешивают в течение 30 минут. Затем добавляют эфир, слои отделяют и эфирную фазу промывают водой, высушивают (сульфатом натрия) и концентрируют с помощью роторного испарителя. Сырое вещество очищают с помощью флеш-колоночной хроматографии (80 г силикагеля), используя 1:3 смесь этилацетата/гексана в качестве элюента, чтобы получить 940 мг чистого 1-бензил-3-карбоэтокси-2- фенилпирролидина.
1H-ЯМР (CDCl3) d 7,16 (мультиплет, 9H), 6,76 (мультиплет, 1H), 5,02 (мультиплет, 3H), 3,78 (мультиплет, 1H), 3,54 мультиплет, 1H), 3,34 (мультиплет, 1H), 2,40 (мультиплет, 1H), 2,02 (мультиплет, 1H), 1,94 (триплет, 3H, J 6 Гц). Масс-спектр м/е 353 (сигнал, соответствующий недиссоциированной молекуле).
Это вещество превращают в названное выше соединение по методике, подобно описанной в примере 63 E-G. 1H-ЯМР (CDCl3) d 7,26 (мультиплет, 5H), 7,12 (триплет, 1H, J 7 Гц), 6,98 (дублет, 1H, J 7 Гц), 6,80 (триплет, 1H, J 7 Гц), 6,70 (дублет, 1H, J 6 Гц), 4,11 (дублет, 1H, J 4 Гц), 3,86 (дублет, 1H, J 12 Гц), 3,52 (синглет, 3H), 3,42 (дублет, 1H, J 12 Гц), 3,34 (мультиплет, 1H), 3,25 (мультиплет, 1H), 2,98 (мультиплет, 1H), 1,9 (мультиплет, 2H ).
Пример 19. Цис-3-(N,N-метил-2-метоксибензиламино)-2-фенилпиперидин.
В атмосфере азота в круглодонную колбу помещают 75 мг (0,24 ммоль) лактама 5-(2-метоксибензиламино)-2-оксо-6-фенилпиперидина, 0,036 мл (0,48 ммоль) йодистого метила, 0,066 мл (0,48 ммоль) триэтиламина и 0,2 мл ТГФ. Реакционную смесь перемешивают при комнатной температуре в течение 5 часов и выливают в насыщенный водный раствор бикарбоната натрия. Эту смесь экстрагируют тремя порциями хлористого метилена. Метиленхлоридные экстракты высушивают (сульфатом натрия) и концентрируют с помощью роторного испарителя. Остаток повторно подвергают воздействию вышеуказанных условий, применяя следующие количества реагентов: 0,11 мл (1,4 ммоль йодистого метила и 0,066 мл (0,48 ммоль) триэтиламина. Смесь перемешивают при комнатной температуре в течение 7,5 часов, и во время этого периода времени к системе добавляют дополнительное количество йодистого метила (0,11 мл). Реакционную смесь обрабатывают так, как это описано выше, чтобы получить 70 мг прозрачного бесцветного масла. Сырое вещество очищают с помощью флеш-колоночной хроматографии (7 силикагеля), используя 3:97 смесь метанола/хлороформа в качестве элюента, чтобы получить 44 мг цис-3-(N,N-метил-2-метокси-бензиламино)-2-фенилпиперидин- 6-она.
1H-ЯМР (CDCl3) d 1,86 (мультиплет, 5H), 2,52 (мультиплет, 1H), 2,70 (мультиплет, 1H), 3,34 (мультиплет, 1H), 3,52 (дублет, 1H, J 14 Гц), 3,74 (дублет, 1H, J 14 Гц), 3,84 (синглет, 3H), 4,68 (мультиплет, 1H), 6,90 (мультиплет, 2H), 7,80 (мультиплет, 7H).
HRMS: Вычислено для C20H24N2O2: 324, 1838.
Найдено: 324, 1884.
В атмосфере азота в круглодонную колбу помещают 54 мг (0,17 ммоль) цис-3-(N, N-метил-(2-метокси)бензиламино)-2-фенилпиперидин-6-она и 2,5 мл ТГФ. К системе добавляют медленно 0,43 мл (0,86 ммоль) 2,0 М борандиметилсульфидного комплекса в ТГФ, и реакционную смесь нагревают при 60oC в течение ночи. Реакционную смесь охлаждают до комнатной температуры, к системе медленно добавляют метанол и смесь перемешивают при комнатной температуре в течение 30 мин и концентрируют с помощью роторного испарителя. Затем добавляют 2 мл этанола и 48 мг (0,35 ммоль) карбоната калия и реакционную смесь нагревают при температуре кипения с обратным холодильником в течение 4 часов и охлаждают до комнатной температуры. Растворитель удаляют с помощью роторного испарителя. Остаток разделяют на части между хлороформом и водой, слои разделяют и водную фазу экстрагируют хлороформом. Объединенные органические фракции высушивают (сульфатом натрия) и концентрируют, чтобы получить 75 мл масла. Это масло растворяют в минимальном объеме хлористого метилена и к раствору добавляют эфир, насыщенный хлористым водородом. К системе добавляют воду и смесь промывают двумя порциями хлористого метилена. Водную фазу подщелачивают водой гидроокисью натрия и экстрагируют четырьмя порциями хлористого метилена. Эти объединенные фракции высушивают и концентрируют, чтобы получить 20 мг названного выше соединения в виде масла.
1H-ЯМР (CDCl3) d 7,62 (дублет, 2H, J 6 Гц), 7,22 (мультиплет, 1H), 7,06 (триплет, 1H, J 7 Гц), 6,82 (дублет, 1H, J 6 Гц), 6,70 (мультиплет, 2H), 4,06 (дублет, 1H, J 2 Гц), 3,71 (синглет, 3H), 3,62 (дублет, 1H, J 12 Гц), 3,44 (дублет, 1H, J 12 Гц), 3,11 (мультиплет, 1H), 2,81 (мультиплет, 2H), 2,19 (синглет, 3H), 1,73 (мультиплет, 4H), Масс-спектр м/е 310 (сигнал, соответствующий недиссоциированной молекуле).
Пример 20. Цис-2,4-дифенил-3-(2-метоксибензиламино)-пиперидин.
В атмосфере азота в круглодонную колбу, снабженную обратным холодильником, помещают 21,1 г (89 ммоль) этилового эфира 4-нитро-3-фенилмасляной кислоты (Mc Murray, J. E. et al. Syn Comm. 8, 53 (1978)) и 90 мл этанола. К смеси добавляют 9,04 мл (89 ммоль) бензальдегида и 13,7 г (180 ммоль) ацетата аммония и реакционную смесь нагревают при 70oC в течение ночи. Реакционную смесь охлаждают, добавляют незначительный объем этанола и суспензию фильтруют. Собранное твердое вещество промывают малым объемом этанола, > которым следует эфир, чтобы получить 22,7 г 4,6-дифенил-5-нитро-2-оксо-пиперидина.
1H-ЯМР (ДМCO) d 2,53 (два дублета, 1H, J 6 и 18 Гц), 2,82 (мультиплет, 1H), 3,88 (мультиплет, 1H), 4,80 (дублет, 1H, J 8 Гц), 5,47 (триплет, 1H, J 8 Гц), 7,3 (мультиплет, 10H ). Масс-спектр м/е 296 (сигнал, соответствующий недиссоциированной молекуле).
В круглодонную колбу помещают 15 г (50,6 ммоль) нитролактама 4,6-дифенил-5-нитро-2-оксопиперидина и 85 мл хлористого метилена. Добавляют трет-бутилат калия (5,72 г, 50,6 ммоль) и смесь перемешивают в течение 15 мин. К этой системе добавляют 85 мл метанола. Смесь перемешивают в течение 15 мин и систему охлаждают до -78oC. Озон пробулькивают через реакционную смесь в течение 4 часов, через смесь пробулькивают азот, добавляют 10 мл диметилсульфида и азот пробулькивают через смесь в течение ночи. К системе добавляют смесь воды и хлористого метилена и получают твердое вещество (8,8 г смеси нитролактама 4,6-дифенил-5-нитро-2-оксопиперидина и 2,5- диоксо-4,6-дифенилпиперидина), которое собирают фильтрацией путем отсасывания. Фильтрат концентрируют с помощью роторного испарителя и остаток разделяют на части между слоями хлористого метилена и воды. Слои разделяют и водную фазу экстрагируют двумя порциями хлористого метилена. Объединенные органические фракции высушивают (сульфатом натрия) и концентрируют, чтобы получить 5,14 г сырого 2,5-диоксо-4,6- дифенилпиперидина, который используют немедленно без дальнейшей очистки. В атмосфере азота в круглодонную колбу помещают 2,5-диоксо-4,6- дифенилпиперидин (5,14 г, 19 ммоль) и 75 мл этанола. Раствор 3,96 г (57 ммоль) солянокислого гидроксиламина и 7,74 г (95 ммоль) ацетата натрия в 25 мл воды добавляют и реакционную смесь перемешивают при комнатной температуре. Реакционную смесь концентрируют примерно до 1/2 от ее первоначального объема и получающийся осадок собирают фильтрацией путем отсасывания. Этот осадок (1,5 г) промывают насыщенным водным раствором бикарбоната натрия, водой и эфиром, чтобы получить 722 мг 4,6-дифенил-5-оксимино-2-оксопиперидина в виде белого твердого вещества.
1H-ЯМР (DMCO) d 2,52 (мультиплет, 2H), 2,76 (мультиплет, 1H), 4,12 (мультиплет, 1H), 5,80 (мультиплет, 1H), 7,30 (мультиплет, 10H), 8,24 (мультиплет, 1H). Масс-спектр м/е 280 (сигнал, соответствующий недиссоциированной молекуле).
К раствору 4,6-дифенил-5-оксимино-2-оксопиперидина (700 мг, 2,5 ммоль) добавляют приблизительно 2 г влажного никеля Ренея, который промыт водой (до тех пор, пока промывные воды не будут иметь нейтральную pH), за которым следует этанол, и смесь помещают в атмосферу водорода (40 psi 2,81 кг/см2, в аппарате Парра) на ночь. Смесь фильтруют через заполненный слой диатомовой земли (Целит (торговая марка)) и отжатый осадок на фильтре промывают хорошо с помощью этанола. Фильтрат концентрируют, чтобы получить 500 мг 5-амино-4,6-дифенил-2-оксопиперидина в виде пенообразного вещества.
1H-ЯМР (CDCl3) d 2,96 (мультиплет, 4H), 4,12 и 4,5 (мультиплет, 1H), 7,2 (мультиплет, 10H), Масс-спектр: м/е 266 (сигнал, соответствующий недиссоциированной молекуле).
В атмосфере азота в круглодонную колбу помещают 500 мг (1,9 ммоль) 5-амино-4,6-дифенил-2-оксопиперидина и 5 мл метанола. К системе добавляют 1 г молекулярных сит 3  и pH смеси доводят до 4,5, используя метанол, насыщенный хлористым водородом. К этой системе добавляют 284 мг (2,1 ммоль) 2-метоксибензальдегида и смесь перемешивают при комнатной температуре в течение ночи. Смесь фильтруют через диатомовую землю (Целит (торговая марка)), отжатый на фильтре осадок тщательно промывают метанолом и фильтрат концентрируют с помощью роторного испарителя. Остаток разделяют на части между слоями насыщенного водного раствора бикарбоната натрия и хлороформа, слои разделяют и водную фазу экстрагируют тремя порциями хлороформа. Объединенные хлороформные экстракты высушивают (сульфатом натрия) и концентрируют и остаток подвергают флеш- колоночной хроматографии (30 г силикагеля), используя 3:97 смеси метанол/хлороформ в качестве элюента, чтобы получить 115 мг 4,6-дифенил-5-(2- метоксибензиламино)-2-оксопиперидина.
и pH смеси доводят до 4,5, используя метанол, насыщенный хлористым водородом. К этой системе добавляют 284 мг (2,1 ммоль) 2-метоксибензальдегида и смесь перемешивают при комнатной температуре в течение ночи. Смесь фильтруют через диатомовую землю (Целит (торговая марка)), отжатый на фильтре осадок тщательно промывают метанолом и фильтрат концентрируют с помощью роторного испарителя. Остаток разделяют на части между слоями насыщенного водного раствора бикарбоната натрия и хлороформа, слои разделяют и водную фазу экстрагируют тремя порциями хлороформа. Объединенные хлороформные экстракты высушивают (сульфатом натрия) и концентрируют и остаток подвергают флеш- колоночной хроматографии (30 г силикагеля), используя 3:97 смеси метанол/хлороформ в качестве элюента, чтобы получить 115 мг 4,6-дифенил-5-(2- метоксибензиламино)-2-оксопиперидина.
1H-ЯМР (CDCl3) δ 2,36 (два дублета, 1H, J 6 и 18 Гц), 2,99 (мультиплет, 2H), 3,30 (мультиплет, 1H), 3,35 (синглет, 3H), 3,62 (дублет, 1H, J 16 Гц), 3,74 (дублет, 1H, J 16 Гц), 4,22 (мультиплет, 1H), 6,62 (дублет, 1H, J 6 Гц), 6,80 (триплет, 1H, J 6 Гц), 6,96 (мультиплет, 3H), 7,18 (мультиплет, 10H). Масс-спектр: м/е 386 (сигнал, соответствующий недиссоциированной молекуле).
В атмосфере азота в круглодонную колбу помещают 115 мг (0,3 ммоль) амина 4,6-дифенил-5-(2-метоксибензиламино)-2-оксопиперидина и 5 мл ТГФ. К системе добавляют 0,74 мл (1,5 ммоль), 2,0 М боранметилсульфидного комплекса в ТГФ, и реакционную смесь нагревают при 60oC в течение ночи. Смесь охлаждают до комнатной температуры и к системе осторожно добавляют метанол. Смесь перемешивают в течение 2 часов и концентрируют с помощью роторного испарителя. К этой системе добавляют 83 мг (0,6 ммоль) карбоната калия и приблизительно 3 мл этанола, и смесь нагревают при 85oC в течение 3 часов. Смесь охлаждают до комнатной температуры, концентрируют, разделяют на части по слоям между хлористым метиленом и насыщенным водным раствором бикарбоната натрия и экстрагируют тремя порциями хлористого метилена. Объединенные метиленхлоридные фракции высушивают (сульфатом натрия) и концентрируют, чтобы получить 109 мг масла. Это сырое вещество подвергают флеш-хроматографии на колонке (5 мг силикагеля), используя 1: 19 смесь метанол/хлороформ в качестве элюента, чтобы получить 56 мг названного выше соединения. Гидрохлоридная соль этого вещества получается обработкой метиленхлоридного раствора продукта реакции эфиром, насыщенным хлористым водородом, концентрированием, растиранием в порошок с помощью эфира, царапанием в эфире и повторением концентрирования из эфира. Т.пл. 176- 178oC (соль HCl, разл.).
1H-ЯМР (CDCl3) d 7,18 (мультиплет, 11H), 6,92 (дублет, 1H, J 6 Гц), 6,76 (триплет, 1H, J 6 Гц), 6,61 (дублет, 1H, J 6 Гц), 4,01 (дублет, 1H, J 2 Гц), 3,66 (дублет, 1H, J 12 Гц), 3,53 (дублет, 1H, J 12 Гц), 3,38 (синглет, 3H). 3,30 (мультиплет, 1H), 3,12 (мультиплет, 3H), 2,12 (мультиплет, 2H).
Вычислено для C25H28N2O: 372, 2202.
Найдено: 372, 2193.
Соединения примеров 21-26 имеют следующую общую формулу
и получаются по следующей методике.
A. Метиловый эфир 4-гидрокси-5-нитро-6,6-дифенилгексановой кислоты.
Раствор 2,2-дифенилнитроэтан (42,6 г, 187 ммоль) и трет-бутилата калия (3,15 г, 28 ммоль) перемешивают в смеси тетрагидрофурана и трет-бутанола (1,5: 1 смесь, 320 мл) при -78oC и добавляют метиловый эфир 3-формилпропионовой кислоты (24,0 г, 206 ммоль). Затем реакционную смесь оставляют подогреваться до 10oC в течение 1 часа, после которого ее гасят уксусной кислотой (1,8 мл). Смесь концентрируют под вакуумом, разбавляют буфером pH 7 (400 мл) и экстрагируют хлористым метиленом (3 х 400 мл). Объединенные экстракты высушивают (сульфатом магния), фильтруют и концентрируют, чтобы получить оранжевое масло, которое при растирании в порошок с помощью эфира дает метиловый эфир 4-гидрокси-5-нитро- 6,6-дифенилгексановой кислоты (29,94 г). Фильтрат концентрируют и подвергают флеш-хроматографии. Элюирование с помощью 10%-ного этилацетата в гексане дает дополнительно 20,66 г метилового эфира 4-гидрокси-5-нитро-6,6-дифенил-гексановой кислоты. Общий выход (79%).
1H-ЯМР (CDCl3) δ 7,2-7,4 (10H, мультиплет), 5,3 (1H, два дублета, J 2,5 и 12 Гц), 4,9 (1H, дублет, J 12 Гц), 3,6 (3H, синглет), 2,6 (1H, мультиплет), 2,45 (2H, триплет, J 7 Гц), 1,7-2,0 (1H, мультиплет), 1,6-1,7 (1H, мультиплет).
B. 2-Оксо-5-гидрокси-6-бензгидрилпиперидин
К перемешиваемому раствору метилового эфира 4-гидрокси-5-нитро- 6,6-дифенил-гексановой кислоты (50,5 г, 147 ммоль) в этаноле (200 мл) при 25oC добавляют нейтрализованный никель Ренея (50 г). Реакционную смесь встряхивают на трясучке Парра под давлением водорода (30 psi 2,11 кг/см2). После 18 часов реакционную смесь фильтруют через диатомовую землю (Целит (торговая марка)), которая тщательно промывается этанолом (400 мл) и хлористым метиленом (600 мл). Органические фазы объединяют и концентрируют под вакуумом до желтого масла (40,25 г), которое при растирании в порошок с помощью холодного эфира дает 2-оксо-5-гидрокси-6-бензгидрилпиперидин (18,5 г, т.пл. 208oC, 45%). Выпаривание меточника дает маслянистый остаток при обработке трет- бутилата калия в тетрагидрофуране при комнатной температуре в течение 6 часов. Экстракты с помощью хлористого метилена и растирание в порошок с помощью эфира дает дополнительно 2,55 г 2-оксо-5-гидрокси-6- бензгидрилпиперидина (общий выход 51%). ИК (чистый, макс 3380 и 1640 см-1)
1H-ЯМР (CDCl3) d 7,17-7,4 (10H, мультиплет), 5,49 (1H, уширенный синглет), 4,18 (2H, синглет), 3,86 (1H, уширенный синглет), 2,54-2,7 (1H, мультиплет), 2,3-2,42 (1H, мультиплет), 1,8-2,08 (2H, мультиплет).
Вычислено для C18H20N2O: 282, 1495.
Найдено: 282, 1495.
C. 2,5-Диоксо-6-бензгидрилпиперидин.
К перемешиваемому раствору 2-оксо-5-гидрокси-6-бензгидрилпиперидин (18,15 г, 64,5 ммоль) в ацетоне (150 мл) при -5oC добавляют реагент Джонса (2,67 М, 94 ммоль), и реакционную смесь дополнительно перемешивают в течение 4 часов. К концу этого периода времени избыток реагента разлагают 2-пропанолом и раствор концентрируют под вакуумом до половины его объема. Содержимое колбы разбавляют затем водой (1000 мл) и экстрагируют хлористым метиленом (3 х 1000 мл). Объединенные органические фазы высушивают (безводным сульфатом магния) и хлористый метилен удаляют под вакуумом, чтобы получить 2,5-диоксо-6-бензгидрилпиперидин (15,35 г, 85%).
1H-ЯМР (CDCl3) d 7,18-7,4 (10H, мультиплет), 4,8 (1H, дублет, J 4 Гц), 4,7 (1H, 2 дублета, J 4 и 1,6 Гц), 2,38-2,6 (2H, мультиплет), 2,16-2,3 (2H, мультиплет), 1,9-2,01 (1H, мультиплет).
D. 2-Оксо-5-оксимино-6-бензгидрилпиперидин.
К перемешиваемому раствору 2,5-диоксо-6-бензгидрилпиперидина (15,35 г, 55 ммоль) в пиридине (150 мл) добавляют солянокислый гидроксиламин (10,63 г, 165 ммоль) и реакционную смесь перемешивают в течение 15 мин. Реакционную смесь концентрируют под вакуумом и содержимое выливают в 1 NHCl (250 мл). Водную фазу экстрагируют хлористым метиленом (2 х 300 мл) и высушивают (безводным сульфатом магния). Хлористый метилен удаляют под вакуумом, чтобы получить 2-оксо-5-оксимино-6-бензгидрилпиперидин (10,62 г, 65%).
1H-ЯМР (CDCl3) d 7,18-7,4 (10H, мультиплет), 5,96 (1H, уширенный дублет), 5,59 (1H, уширенный синглет), 4,8 (1H, мультиплет), 3,8 (1H, дублет, J 10 Гц), 2,98-3,09 (1H, мультиплет), 2,05-2,42 (3H, мультиплет).
Названные соединения примеров 21-26 получают из названного выше соединения "1" по методике, подобно описанной в примерах 1(B) и 1(C).
Пример 21. Цис-3-бензиламино-2-бенгидрилпиперидин (X=H, n=1).
Т.пл. 117oC.
1H-ЯМР (CDCl3) d 7,0 7,4 (15H, мультиплет), 4,39 (1H, дублет, J 10 Гц), 3,76 (1H, дублет, J 12 Гц), 3,4 (1H, дублет, J 12 Гц), 3,28 (1H, дублет, J 10 Гц), 2,94 (1H, мультиплет), 2,54 (1H, мультиплет), 2, 2,0 (2H, мультиплет), 1,7 (1H, мульти.), 1,22 (1H, мультиплет).
HRMS: Вычислено для C25H28N2: 356, 2253.
Найдено: 356, 2256.
Пример 22. Транс-3-бензиламино-2-бензгидрилпиперидин (X=H, n=1).
Т.пл. 186oC (соль HCl).
1H-ЯМР (CDCl3) d 7,1-7,6 (15H, мультиплет), 4,57 (1H, дублет, J 10 Гц), 3,82 (1H, дублет, J 14 Гц), 3,65 (1H, дублет, J 14 Гц), 3,46 (1H, уширенный триплет), 2,9 (1H, мультиплет), 2,5 (3H, мультиплет), 2,05 (1H, мультиплет), 1,72 (1H, мультиплет), 1,45 (1H, мультиплет).
HRMS: Вычислено для C25H28N2: 356, 2253.
Найдено: 356, 2269.
Пример 23. Цис-3-(2-метоксибензиламино)-2-бензгидрилпиперидин (X=2-OMe, n 1).
Т.пл. 258oC (разл. соль HCl).
1H-ЯМР (CDCl3) d 6,7-7,4 (14H, мультиплет), 4,4 (1H, дублет, J 10 Гц), 3,8 (3Н, синглет), 3,75 (2H, два дублета, J 12 Гц), 3,45 (1H, уширенный дублет), 3,39 (1H, дублет, J 10 Гц), 3,0 (1H, уширенный дублет), 2,62 (2H, мультиплет), 2,08 (1H, мультиплет), 1,7 (1H, мультиплет), 1,4 (1H, мультиплет), 1,2 (1H, мультиплет).
HRMS: Вычислено для C26H30N2O: 386, 2358.
Найдено 386, 2358.
Пример 24. Транс-3-(2-метоксибензиламино)-2-бензгидрилпиперидин (X=2-OMe, n 1).
Масло, 1H-ЯМР (CDCl3) d 6,7-7,4 (14H, мультиплет), 4,55 (1H, дублет, J 10 Гц), 3,8 (3H, синглет), 3,81 (1H, дублет, J 14 Гц), 3,6 (1H, дублет, J 14 Гц), 3,4 (1H, мультиплет), 2,9 (1H, мультиплет), 2,54 (2H, мультиплет), 2,0 (2H, мультиплет), 1,53 (1H, мультиплет), 1,45 (1H, мультиплет).
HRMS: Вычислено для C26H30N2O: 386, 2358
Найдено: 386, 2318.
Пример 25. Цис-3-бензиламино-2-бензгидрилазепин (X=H, n 2)
Т.пл. 111-112oC.
1H-ЯМР (CDCl3 d 6,94-7,45 (15H, мультиплет), 4,33 (1H, дублет, J 10 Гц), 3,52 (1H, дублет, J 12 Гц), 3,34 (1H, дублет, J 12 Гц), 3,21 (1H, два дублета, J 2,1 и 10 Гц), 3,16 (1H, уширенный дублет), 2,4-2,58 (2H, мультиплет), 1,8 (1H, мультиплет), 1,56 (3H, мультиплет), 1,32 (2H, мультиплет).
Пример 26. Транс-3-бензиламино-2-бензгидрилазепин (X=Н, n 2)
Т.пл. 186-187oC (соль HCl).
1Н-ЯМР (CDCl3) d 7,0-7,5 (15H, мультиплет), 3,88 (1H, дублет, J 11 Гц), 3,45-3,6 (2H, мультиплет), 3,22 (1H, дублет, J 12 Гц), 3,0 (1H, дублет, J 12 Гц), 2,45-2,62 (2H, мультиплет), 1,75 (1H, мультиплет), 1,5 (2H, мультиплет), 1,08-1,25 (3H, мультиплет).
HRMS: Вычислено для C26H31N2: 371, 2487.
Найдено: 371, 2495.
Названные соединения примеров 27-33 имеют следующую общую формулу и получают по методике, подобно описанной в примере 1.
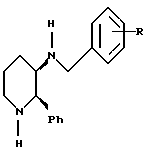
Пример 27. Цис-3-бензиламино-2-фенилпиперидин (R H).
Т.пл. 250oC (соль HCl). 1H-ЯМР (CDCl3 δ 6,94-7,0 (10H, мультиплет), 3,89 (1H, дублет, J 2,3 Гц), 3,52 (1H, дублет, J 13 Гц), 3,32 (1H, дублет, J 13 Гц), 3,25 (1H, уширенный дублет, J 12 Гц), 2,88 (1H, дублет, J 2,5 Гц), 2,78 (1H, дублет и триплет, J 12 и 3 Гц), 2,4 (1H, дублет, J 12 Гц), 1,8-1,98 (1H, мультиплет), 1,6 (1H, 2 триплет, J 12 и 2,5 Гц), 1,42 (1H, дублет, J 12 Гц).
Пример 28. Цис-3-(2-фторбензиламино)-2-фенилпиперидин (R 2F).
Т. пл. > 260oC (разл. соль HCl). 1H-ЯМР (CDCl3) d 7,31-7,2 (5H, мультиплет), 7,15-7,07 (1H, мультиплет), 6,97-6,85 (3H, мультиплет), 3,88 (1H, дублет, J 3 Гц), 3,64 (1H, дублет, J 14 Гц), 3,50 (1H, дублет, J 14 Гц), 3,36-3,2 (1H, мультиплет), 2,87-2,73 (3H, мультиплет), 2,07 (1H, уширенный дублет, J 13 Гц), 1,88 (1H, квартет и триплет, J 13 и 4 Гц), 1,67-1,58 (1H, мультиплет), 1,43 (1H, уширенный дублет, J 13 Гц).
13H-ЯМР (CDCl3) d 162,6, 159,4, 142,6, 130, 129,8, 128,2, 128, 127, 127,8, 127,6, 126,8, 126,4, 123,73, 123,7, 115, 114,7, 64,3, 55,5, 47,8, 44,5, 44,4, 29,1, 29,4.
HRMS: Вычислено для C18H21: 284,1689.
Найдено 284, 1701.
Пример 29. Цис-3-(2,6-дифторбензиламино)-2-фенилпиперидин (R 2,6-диF).
Т.пл. > 260oC (разл. соль HCl).
1H-ЯМР (CDCl3) d 7,33-7,02 (6H, мультиплет), 6,7 (2H, триплет, J 8 Гц), 3,86 (1H, дублет, J 2 Гц), 3,63 (1H, дублет, J 14 Гц), 3,52 (1H, дублет, J 14 Гц), 3,24 (1H, уширенный дублет, J 10 Гц), 2,83-2,74 (1H, мультиплет), 2,09 (1H, уширенный дублет, J 13 Гц), 1,9 (1H, квартет и триплет, J 14 и 4 Гц), 1,63 (1H, 2 триплета, J 14 и 4 Гц), 1,4 (1H, уширенный дублет, J 12 Гц).
13С-ЯМР (CDCl3) d 142,1, 128,3, 126,7, 126, 111,1, 110,8, 110,7, 63,8, 55,2, 47,7, 38,5, 28,9, 20,4.
HRMS: Вычислено для 302, 1595. Найдено: 302, 1607.
Пример 30. Цис-3-(2-метилбензиламино)-2-фенилпиперидин (R 2-CH3).
Т. пл. 254oC (разл. соль HCl), 1H-ЯМР (CDCl3) d 7,31-7,21 (4H, мультиплет), 7,09-6,96 (4H, мультиплет), 3,9 (1H, дублет, J 2 Гц), 3,54 (1H, дублет, J 14 Гц), 3,28 (1H, дублет, J 14 Гц), 3,22-3,14 (1H, мультиплет, 2,91-2,87 (1H, мультиплет), 2,79 (1H, триплет и дублет, J 8 и 4 Гц), 2,14 (1H, уширенный дублет, J 9 Гц), 1,98 (3H, синглет), 1,97-1,75 (1H, мультиплет), 1,7-1,48 (3H, мультиплет).
13С-ЯМР (CDCl3) d 142,7, 138,6, 136,4, 130, 128,4, 128,2, 126,7, 126,6, 125,5, 63,3, 56,2, 49,7, 29,3, 20,5, 18,5.
HRMS: Вычислено для C19H24N2: 280, 1939.
Найдено: 280, 1952.
Пример 31.Цис-3-(2-трифторметилбензиламино)-2-фенилпиперидин (R 2-CF3).
Т. пл. 249oC (разл. соль HCl). 1H-ЯМР (CDCl3) d 7,49 (1H, дублет, J 8 Гц), 7,49-7,16 (8H, мультиплет), 3,89 (1H, дублет, J 2 Гц), 3,7 (1H, дублет, J 15 Гц), 3,57 (1H, дублет, J 15 Гц), 3,25 (1H, уширенный дублет, J 12 Гц), 2,86-2,74 (2H, мультиплет), 2,08 (1H, уширенный дублет, J 12 Гц), 1,93-1,8 (1H, мультиплет), 1,67-1,55 (2H, мультиплет), 1,44 (уширенный дублет, J 14 Гц).
13C-ЯМР (CDCl3) d 142,7, 139,8, 131,95, 129,7, 128,2, 126,8, 126,5, 126,2, 125,4, 64,6, 56,2, 47,8, 47,0, 29, 20,5.
HRMS: Вычислено для C19H21N2F3: 334, 1657.
Найдено: 334, 1665.
Пример 32. Цис-3-(2-хлорбензиламино)-2-фенилпиперидин (R 2-Cl).
Т. пл. 256oC (разл. соль HCl). 1H-ЯМР (CDCl3) d 7,31-6,97 (9H, мультиплет), 3,88 (1H, дублет, J 2 Гц), 3,63 (1H, дублет, J 15 Гц), 3,48 (1H, дублет, J 15 Гц), 3,25 (1H, уширенный дублет, J 10 Гц), 2,87-2,74 (2H, мультиплет), 2,09 (1H, уширенный дублет, J 15 Гц), 1,9 (1H, квартет и триплет, J 13 и 4 Гц), 1,68-1,57 (1H, мультиплет), 1,43 (1H, уширенный дублет, J 13 Гц), 13C-ЯМР (CDCl3) d 142,5, 138,1, 133,6, 129,7, 129,1, 128,3, 127,7, 126,8, 126,4, 64,3, 55,6, 48,7, 47,8, 29, 20,4,
HRMS: Вычислено для C18H21N2Cl: 300, 1394.
Найдено: 300, 1394.
Пример 33. Цис-3-(3-трифторметилбензиламино)-2-фенилпиперидин (R 32CF3).
Т.пл. 240oC (разл. соль HCl) 1H-ЯМР (CDCl3) d 7,41-7,14 (9H, мультиплет, 3,88 (1H, дублет, J 2 Гц), 3,55 (1H, дублет, J 14 Гц), 3,38 (1H, дублет, J 14 Гц), 3,22 (1H, уширенный дублет, J 14 Гц), 2,84-2,74 (2H, мультиплет), 2,01 (1H, уширенный дублет, J 14 Гц), 1,85 (1H, квартет и триплет, J 12 и 4 Гц), 1,63-1,54 (1H, мультиплет), 1,45 (1H, уширенный дублет, J 13 Гц),
13C-ЯМР (CDCl3) d 142,8, 142,1, 131,1, 128,4, 128,3, 127, 126,4, 124,5, 123,3, 64,5, 55,8, 51, 47,7, 29,4, 20,4.
HRMS: Вычислено для C19H21N2F3: 334, 1657.
Найдено: 334, 1663.
Названные соединения примеров 34-35 имеют следующую общую формулу и получают по методике, подобной описанной в примере 1.
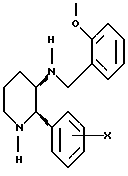
Пример 34. Цис-3-(2-метоксибензиламино)-2-(2-фторфенил)пиперидин (C=2-F).
Т. пл. 253oC (соль HCl). 1H-ЯМР (CDCl3) δ 8,03 (1H, триплет, J 7 Гц), 7,62-7,54 (1H, мультиплет), 7,47-7,35 (2H, мультиплет), 7,27- 7,19 (2H, мультиплет), 6,94 (2H, 2 дублета, J 9 и 2 Гц), 5,25 (1H, дублет, J 4 Гц), 5,25 (1H, дублет, J 13 Гц), 4,03-4,00 (1H, мультиплет), 3,87 (1H, дублет, J 13 Гц), 3,75 (3H, синглет), 3,67 (1H, уширенный дублет, J 13 Гц), 3,42-3,37 (2H, мультиплет), 2,6-2,42 (2H, мультиплет), 2,38-2,3 (1H, мультиплет), 2,08-1,96 (1H, мультиплет).
HRMS: Вычислено для C19H23N2OF: 314, 1795.
Найдено: 314, 1778.
Пример 35. Цис-3-(2-метоксибензиламино)-2-(2-хлорфенил)пиперидин (X=2-Cl).
Т. пл. 264oC (соль HCl). 1H-ЯМР (CDCl3) d 8,15 (1H, дублет, J 6 Гц), 7,66-7,5 (1H, мультиплет), 7,39 (1H, триплет, J 8 Гц), 7,15 (1H, дублет, J 6 Гц), 6,94 (2H, триплет, J 8 Гц), 5,21 (1H, дублет, J 3 Гц), 4,19-4,1 (2H, мультиплет), 3,27 (1H, дублет, J 12 Гц), 3,78 (3H, синглет), 3,76-3,64 (1H, мультиплет), 3,52-3,4 (1H, мультиплет), 2,64-2,44 (2H, мультиплет), 2,38-2,26 (1H, мультиплет), 2,16- 1,96 (1H, мультиплет).
HRMS: Вычислено для C19H23N2OCl: 330, 1499.
Найдено: 330, 1412.
Пример 36. Цис-3-(2-метоксибензиламино)-2-(2-метилфенил)-пиперидин (X 2-CH3).
Т.пл. 260oC (соль HCl). 1H-ЯМР (CDCl3) d 7,97 (1H, уширенный дублет, J 8 Гц), 7,49-7,32 (4H, мультиплет), 7,08 (1H, дублет, J 6 Гц), 6,95-6-88 (2H, мультиплет), 5,04(1H, дублет, J 3 Гц), 4,1 (1H, дублет, J 14 Гц), 3,88-3,8 (2H, мультиплет), 3,68 (3H, синглет), 3,49-3,36 (1H, мультиплет), 2,59-2,27 (4H, мультиплет), 2,25 (3H, синглет), 2,0 (1H, уширенный дублет, J 10 Гц).
HRMS: Вычислено для C20H26N2O: 310, 2045.
Найдено; 310, 2080.
Вычислено: C 62,66, H 7,36, N 7,31.
Найдено: C 62,75, H 7,46, N 7,2.
Пример 37. Цис-3-(2-метоксибензиламино)-2-(3-трифторметилфенил) пиперидин (X 3-CF3).
Т. пл. 268oC (соль HCl). 1H-ЯМР (CDCl3) d 8,03-7,94 (2H, мультиплет), 7,84 (1H, дублет, J 8 Гц), 7,77 (1H, триплет, J 8 Гц), 7,37 (1H, триплет, J 8 Гц), 7,16 (1H, дублет, J 8 Гц), 6,93 (2H, триплет, J 7 Гц), 5,05 (1H, дублет, J 2 Гц), 4,14 (1H, дублет, J 13 Гц), 3,86 (1H, дублет, J 13 Гц), 3,72 (3H, синглет), 3,7-3,62 (1H, мультиплет), 3,3-3,2 (1H, мультиплет), 2,49-2,34 (2H, мультиплет), 2,3-2,18 (1H, мультиплет), 2,01 (1H, уширенный дублет, J 14 Гц).
Пример 38. Цис-3-(2-метоксибензиламино)-2-(3-фторфенил)пиперидин (X=3-F).
Т.пл. 264oC (соль HCl). 1H-ЯМР (CDCl3) d 7,62-7,5 (3H, мультиплет), 7,38 (1H, триплет, J 7 Гц), 7,3-7,21 (2H, мультиплет), 6,93 (2H, триплет, J 8 Гц), 5,03 (1H, дублет, J 3 Гц), 4,16 (1H, дублет, J 15 Гц), 4,06-3,96 (1H, мультиплет), 3,85 (1H, дублет, J 13 Гц), 3,75 (3H, синглет), 3,66 (1H, уширенный дублет, J 12 Гц), 2,74-2,40 (2H, мультиплет), 2,30-2,15 (1H, мультиплет), 2,06-1,92 (1H, мультиплет),
HRMS: Вычислено для C19H23N2OF: 314, 1795.
Найдено: 314, 1790.
Пример 39. Цис-3-(2-метоксибензиламино)-2-(3-хлорфенил)пиперидин (X=3 - Cl).
Т. пл. 258-260oC (соль HCl). 1H-ЯМР (CDCl3 d 7,72 (1H, уширенный синглет), 7,7-7,58 (1H, мультиплет), 7,54 (2H, дублет, J 4 Гц), 7,4 (1H, триплет, J 8 Гц), 7,2 (1H, дублет, J 7 Гц), 6,97-6,92 (2H, мультиплет), 5,01 (1H, дублет, J 4 Гц), 4,17 (1H, дублет, J 13 Гц), 3,99 (1H, уширенный синглет), 3,8 (1H, дублет, J 13 Гц), 3,75 (2H, синглет), 3,69-3,54 (1H, мультиплет), 3,17-3,14 (1H, мультиплет), 2,49-2,4 (2H, мультиплет), 2,3- 2,16 (1H, мультиплет), 2,05-1,94 (1H, мультиплет).
HRMS: Вычислено для C19H23N2OCl: 330, 1499.
Найдено: 330, 1508.
Пример 40. Цис-3-(2-метоксибензиламино)-2-(3-метоксифенил) пиперидин (X 3-OMe).
Т. пл. 252oC (соль HCl). 1H-ЯМР (CDCl3) d 7,49-7,34 (2H, мультиплет), 7,28-7,16 (3H, мультиплет), 7,07 (1H, дублет, J 6 Гц), 6,96-6,91 (2H, мультиплет), 4,94 (1H, дублет, J 4 Гц), 4,15 (1H, дублет, J 13 Гц), 3,96 (1H, уширенный синглет), 3,86 (1H, дублет, J 13 Гц), 3,83 (3H, синглет), 3,69 (3H, синглет), 3,68-3,6 (1H, мультиплет), 3,28-3,22 (1H, мультиплет), 2,49-2,35 (2H, мультиплет), 2,32-2,16 (1H, мультиплет), 2,06-1,94 (1H, мультиплет).
HRMS: Вычислено для C20H26N2O2: 326, 1994.
Найдено: 326, 1983.
Вычислено: C 60,15, H 7,07, N 7,01.
Найдено: C 59,78, H 6,75, N 7,01.
Пример 41. Цис-3-(2-метоксибензиламино)-2-(3-метилфенил) пиперидин (X=3
CH3).
Т. пл. 243oC (соль HCl). 1H-ЯМР (CDCl) d 7,15 (2H, два дублета, J 8,7 Гц), 7,07-6,94 (4H, мультиплет), 6,79 (1H, триплет, J 7 Гц), 6,67 (1H, дублет, J 8 Гц), 3,83 (1H, дублет, J 2 Гц), 3,68 (1H, дублет, J 14 Гц), 3,44 (3H, синглет), 3,4 (1H, дублет, 14 Гц), 3,26 (1H, уширенный дублет, J 12 Гц), 2,85-2,73 (1H, мультиплет), 2,3 (3H, синглет), 2,12 (1H, уширенный дублет, J 14 Гц), 1,92 (1H, квартет и триплет, J 13 и 4 Гц), 1,58 (1H, два триплета, J 14 Гц), 1,38 (1H, уширенный дублет, J 13 Гц),
HRMS: Вычислено для C20H26N2O: 310, 2045.
Найдено: 310, 2069.
Вычислено: C 62,66, H 7,36, N 7,31.
Найдено: C 62,61, H 7,44 N 7,24.
Пример 42. Цис-3-(2-метоксибензиламино)-2-(4-фенилфенил) пиперидин (X= 4-Ph).
Т. пл. 255oC (соль HCl). 1H-ЯМР (CDCl3) d 7,77-7,7 (4H, мультиплет), 7,63-7,44 (3H, мультиплет), 7,41 (2H, триплет, J 2 Гц), 7,39-7,31 (2H, мультиплет), 7,15 (1H, два дублета, J 6 и 2 Гц), 6,92 (1H, триплет, J 7 Гц), 6,79 (1H, дублет, J 8 Гц), 5,03 (1H, уширенный синглет), 4,13 (1H, дублет, J 13 Гц), 3,87 (2H, дублет, J 13 Гц), 3,6 (4H, синглет), 3,34-3,3 (2H, уширенный синглет), 2,58-2,1 (3H, мультиплет), 2,00-1,89 (1H, мультиплет).
HRMS: Вычислено для C25H28N2O: 372, 2202.
Найдено: 373, 2220.
Пример 43. Цис-3-(2-метоксибензиламино)-2-(4-фторфенил) пиперидин (X= 4-F).
Т.пл. 252oC (соль HCl). ИК(KBr) макс: 3280, 2600, 1605, 1520, 1240, 1020 см-1.
1H-ЯМР (CDCl3) d 7,25-7,12 (3H, мультиплет), 6,99-6,94 (3H, мультиплет), 6,8 (1H, триплет, J 6 Гц), 6,68 (1H, дублет, J 8 Гц), 3,83 (1H, уширенный синглет), 3,67 (1H, дублет, J 14 Гц), 3,49 (3H, синглет), 3,38 (1H, дублет, J 14 Гц), 3,26-3,2 (1H, мультиплет), 2,82- 2,71 (2H, мультиплет), 2,11 (1H, уширенный дублет, J 13 Гц), 1,97-1,83 (1H, мультиплет), 1,63-1,52 (1H, мультиплет), 1,38 (1H, уширенный дублет, J 13 Гц).
13C-ЯМР (CDCl3) d 157,6, 138,3, 129,6, 128,3, 127,9, 127,8, 120, 114,9, 114,6, 109,8, 63,4, 54,8, 54,6, 47,8, 46,7, 28,2, 20,3.
HRMS: Вычислено для C19H23N2OF: 314, 1795.
Найдено: 314, 1802.
Пример 44. Цис-3-(2-метоксибензиламино)-2-(4-метилфенил) пиперидин (X= 4-CH3).
Т. пл. 233oC (соль HCl). ИК(KBr) макс: 3400, 2700, 1610, 1570, 1460, 1260, 1040 см-1.
1H-ЯМР (CDCl3) d 7,18-7,11 (5H, мультиплет), 5,97 (1H, два дублета, J 7 и 2 Гц), 6,79 (1H, триплет, J 8 Гц), 6,67 (1H, дублет, J 8 Гц), 3,84 (1H, дублет, J 2 Гц), 3,67 (1H, дублет, J 14 Гц), 3,45 (3H, синглет), 3,4 (1H, дублет, J 14 Гц), 3,25 (1H, уширенный дублет, J 8 Гц), 2,82-2,73 (2H, мультиплет), 2,31 (3H, синглет), 2,11 (1H, уширенный дублет, J 13 Гц), 1,91 (1H, квартет и триплет, J 9 и 4 Гц), 1,57 (1H, два триплета, J 14 и 4 Гц), 1,37 (1H, уширенный дублет, J 13 Гц),
13C-ЯМР (CDCl3) d 157,6, 139,4, 135,9, 129,6, 128,8, 128,4, 127,7, 126,2, 120, 109,8, 63,7, 54,8, 54,7, 47,8, 46,7, 28,2, 21,0, 20,4.
HRMS: Вычислено для C20H26N2O: 310, 2045.
Найдено: 310, 2043.
Пример 45. Цис-3-(2-метоксибензиламино)-2-(4-хлорфенил)пиперидин (X 4-Cl).
Т. пл. 247oC (соль HCl). ИК (KBr) макс: 2950, 2640, 2610, 1570, 1500, 1450, 1250 см-1.
1H-ЯМР (CDCl3) d 7,26-7,13 (5H, мультиплет), 6,97 (1H, два дублета, J7 и 2 Гц), 6,81 (1H, триплет, J 8 Гц), 6,68 (1H, дублет, J 8 Гц), 3,84 (1H, дублет, J 9 Гц), 3,7 (1H, дублет, J 14 Гц), 3,48 (3H, синглет), 3,37 (1H, дублет, J 14 Гц), 3,26 (1H, уширенный дублет, J 8 Гц), 2,83-2,72 (2H, мультиплет), 2,12 (1H, уширенный дублет, J 9 Гц), 1,91 (1H, квартет и триплет, J 13 и 4 Гц), 1,58 (1H, два триплета, J 13 и 4 Гц), 3,83 (1H, уширенный дублет, J 13 Гц).
13C-ЯМР (CDCl3) d 157,6, 140,96, 132,4, 129,7, 128,2, 128, 127,7, 120, 109,9, 63,3, 54,8, 54,5, 47,7, 46,8, 28,20.
HRMS; Вычислено для C19H23N2OCl: 330, 1498.
Найдено: 330, 1489.
Вычислено: C 56,52, H 6,24, N 6,94.
Найдено: C 56,52, H 6,2 N 6,86.
Пример 46. Цис-3-(2-метоксибензиламино)-2-(4-метоксифенил)пиперидин (X 4-OMe).
Т. пл. 245oC (соль HCl). 1H-ЯМР (CDCl3) d 7,14 (3H, триплет, J 8 Гц), 6,97 (1H, два дублета, J 7 и 2 Гц), 6,84 -6,77 (3H, мультиплет), 6,67 (1H, дублет, J 8 Гц), 3,81 (1H, дублет, J 2 Гц), 3,78 (1H, синглет), 3,67 (1H, дублет, J 14 Гц), 3,47 (3H, синглет), 3,4 (1H, дублет, J 14 Гц), 3,24 (1H, уширенный дублет, J 10 Гц), 2,81-2,72 (2H, мультиплет), 2,1 (1H, уширенный дублет, J 14 Гц), 1,9 (1H, квартет и триплет, J 14 и 4 Гц), 1,56 (1H, два триплета, J 14 и 4 Гц), 1,36 (1H, уширенный дублет, J 14 Гц).
13C-ЯМР (CDCl3) d 158,3, 157,6, 134,6, 129,6, 128,4, 127,7, 127,3, 120, 113,5, 109,8, 63,4, 55,2, 54,8, 54,7, 47,8, 46,7, 28,2, 20,3.
HRMS: Вычислено для C20H26N2O2: 226, 1996.
Найдено: 326, 1968.
Вычислено: C 60,15, H 7,07, N 7,01.
Найдено: C 59,36, H 6,79, N 6,82.
Пример 47. Цис-3-(2-метоксибензиламино)-2-(4-трифторметилфенил) пиперидин (X=4-CF3).
Т. пл. 250oC (разл. соль HCl). 1H-ЯМР (CDCl3) d 7,51 (2H, дублет, J 8 Гц), 7,33 (2H, дублет, J 8 Гц), 7,13 (1H, триплет, J 8 Гц), 6,98 (1H, дублет, J 8 Гц), 6,77 (1H, триплет, J 8 Гц), 6,63 (1H, дублет, J 8 Гц), 3,89 (1H, синглет), 3,67 (1H, дублет, J 14 Гц), 3,39 (3H, синглет), 3,33 (1H, дублет, J 14 Гц), 3,24 (1H, уширенный дублет, J 12 Гц), 2,82-2,74 (2H, мультиплет), 2,13 (1H, уширенный дублет, J 14 Гц), 1,98-1,78 (1H, мультиплет), 1,64-1,46 (1H, мультиплет), 1,38 (1H, уширенный дублет, J 14 Гц).
13C-ЯМР (CDCl3) d 157,4, 146,5, 129,5, 127,8, 126,5, 124,8, 124,7, 119,8, 109,7, 63,6, 54,4, 54,3, 47,5, 46,6, 28,10.
HRMS: Вычислено для C20H23N2OF3: 364, 1762.
Найдено: 364, 1710.
Пример 48. Цис-3-(2-метоксибензиламино)-2-(4-бромфенил)пиперидин (X=4-Br).
Т. пл. 250oC (соль HCl). 1H-ЯМР (CDCl3) d 7,36 (2H, дублет, J 8 Гц), 7,14-7,05 (3H, мультиплет), 6,95 (1H, два дублета, J 8 и 2 Гц), 6,79 (1H, триплет, J 8 Гц), 6,67 (1H, дублет, J 8 Гц), 3,79 (1H, дублет, J 2 Гц), 3,66 (1H, дублет, J 14 Гц), 3,48 (3H, синглет), 3,34 (1H, дублет, J 14 Гц), 3,22 (1H, уширенный дублет, J 14 Гц), 2,78-2,68 (2H, мультиплет), 2,17 (1H, уширенный дублет, J 14 Гц), 1,96-1,78 (1H, мультиплет), 1,56 (1H, два триплета, J 14 Гц и 4 Гц), 1,38 (1H, уширенный дублет, J 14 Гц).
13C-ЯМР (CDCl3) d 157,6, 141,4, 131,1, 129,7, 128,1, 128, 127,9, 120,4, 120, 109,8, 63,4, 54,8, 54,4, 47,6, 46,8, 28,1, 20,2.
HRMS: Вычислено для C18H23N2OBr: 374, 0980.
Найдено: 374, 0926.
Вычислено: C 50,91, H 5,62, N 6,25.
Найдено: C 51,41, H 5,48 N 6,23.
Пример 49. Цис-3-(2-метоксибензиламино)-2-(4-гидроксиметилфенил) пиперидин (X=4-CH2OH).
Т.пл. 248oC (соль HCl). 1H-ЯМР (CDCl3) d 7,2-7,04 (5H, мультиплет), 6,95 (1H, два дублета, J 8 и 2 Гц), 6,7 (1H, триплет, J 8 Гц), 6,64 (1H, дублет, J 8 Гц), 4,6 (2H, синглет), 3,82 (1H, дублет, J 2 Гц), 3,62 (1H, дублет, J 14 Гц), 3,43 (3H, синглет), 3,37 (1H, дублет, J 14 Гц), 3,24 (1H, уширенный дублет, J 8 Гц), 2,8- 2,68 (2H, мультиплет), 1,96-1,8 (1H, мультиплет), 1,56 (1H, два триплета, J 14 и 4 Гц), 1,36 (1H, уширенный дублет, J 8 Гц).
HRMS: Вычислено для C20H26N2O2: 326, 1994.
Найдено: 326, 1979.
Вычислено: C 60,15, H 7,07, N 7,02.
Найдено: C 60,04, H 6,93, N 6,83.
Пример 50. Цис-3-(2-метоксибензиламино)-2-(3-фтор-4-метоксифенил) пиперидин (X=3-F, 4-OMe).
Т. пл. 250oC (разл. соль HCl). 1H-ЯМР (CDCl3 d 7,15 (1H, дублет и триплет, J 8 и 2 Гц), 7,01-6,93 (3H, мультиплет), 6,89-6,78 (2H, мультиплет), 6,7 (1H, дублет, J 8 Гц), 3,87 (3H, синглет), 3,78 (1H, дублет, J 2 Гц), 3,68 (1H, дублет, J 14 Гц), 3,52 (3H, синглет), 3,38 (1H, дублет, J 14 Гц), 3,22 (1H, уширенный дублет, J 9 Гц), 2,75 (2H, триплет и дублет, J 13 и 3 Гц), 2,1 (1H, уширенный дублет, J 13 Гц), 1,86 (1H, квартет и триплет, J 13 и 4 Гц), 1,56 (1H, два триплета, J 13 и 3 Гц), 1,35 (1H, уширенный дублет, J 13 Гц).
13С-ЯМР (CDCl3) d 157,6, 135,8, 129,7, 128,2, 128, 121,8, 121,7, 120, 114,3, 114,1, 113, 109,8, 63, 56,3, 54,7, 54,5, 47,7, 46,8, 28,2, 20,3.
Пример 51. Цис-3-(2-метоксибензиламино)-2-(2,3-дифторфенил)-пиперидин (X=2,3-ди-F).
Т.пл. 243oC (соль HCl). 1H-ЯМР (CDCl3) d 7,21-7,12
(2H, мультиплет), 7,09-7,01 (1H, мультиплет), 6,98 (1H, два дублета, J 7,2 Гц), 6,81 (1H, триплет, J 7 Гц), 6,69 (1H, дублет, J 8 Гц), 4,17 (1H, синглет), 3,61 (1H, дублет, J 14 Гц), 3,54 (3H, синглет), 3,36 (1H, дублет, J 14 Гц), 3,23 (1H, дублет, J 14 Гц), 2,89 (1H, уширенный синглет), 2,79 (1H, триплет и дублет, J 12 и 3 Гц), 2,03 (1H, уширенный дублет, J 13 Гц), 1,85 (1H, квартет и триплет, J 13 и 4 Гц), 1,68-1,56 (1H, мультиплет), 1,41 (1H, уширенный дублет, J 14 Гц),
13С-ЯМР (CDCl3) d 157,5, 132,6, 132,4, 129,5, 128,3, 127,9, 123,6, 122,8, 120,2, 115,3, 115,1, 109,9, 58,3, 54,8, 53,2, 47,1, 28,6, 20,4.
Пример 52. Цис-3-(2-метоксибензиламино)-2-(2,3-дихлорфенил) пиперидин (X=2,3-ди-Cl).
Т.пл. 249oC (соль HCl). 1H-ЯМР (CDCl3) d 7,42 (1H, дублет, J 8 Гц), 7,35 (1H, дублет, J 8 Гц), 7,19 (1H, триплет, J 8 Гц), 7,14 (1H, триплет, J 8 Гц), 6,91 (1H, дублет, J 8 Гц), 6,79 (1H, триплет, J 8 Гц), 6,68 (1H, дублет, J 8 Гц), 4,19 (1H, дублет, J 2 Гц), 3,55 (1H, дублет, J 12 Гц), 3,53 (3H, синглет), 3,32 (1H, дублет, J 14 Гц), 3,23 (1H, уширенный дублет, J 12 Гц), 3,03-2,98 (1H, мультиплет), 2,81 (1H, триплет и дублет, J 13 и 3 Гц), 2,01 (1H, уширенный дублет, J 13 Гц), 1,97-1,75 (1H, мультиплет), 1,7-1,62 (1H, мультиплет), 1,42 (1H, уширенный дублет, J 12 Гц).
Пример 53. Цис-3-(2-метоксибензиламино)-2-(4-этиламинофенил) пиперидин (X=4-Net).
Т. пл. 241oC (соль HCl). 1H-ЯМР (CDCl3) d 7,14 (1H, триплет, J 8 Гц), 7,08-6,94 (3H, мультиплет), 6,78 (1H, триплет, J 8 Гц), 6,67 (1H, дублет, J 8 Гц), 6,52 (2H, дублет, J 8 Гц), 3,77 (1H, уширенный синглет), 3,69 (1H, дублет, J 14 Гц), 3,5 (3H, синглет), 3,43 (1H, дублет, J 14 Гц), 3,33 (1H, уширенный дублет, J 2 Гц), 3,12 (1H, квартет, J 8 Гц), 2,84-2,68 (1H, мультиплет), 2,09 (1H, уширенный дублет, J 4 Гц), 1,96-1,49 (1H, мультиплет), 1,61-1,49 (1H, мультиплет), 1,35 (1H, уширенный дублет, J 14 Гц), 1,25 (3H, триплет, J 8 Гц).
Пример 54. Цис-3-(2-метоксибензиламино)-2-(3-метил-4-метоксифенил) пиперидин (X=3-Me, 4-OMe)
Т. пл. 248oC (соль HCl). ИК (KBr) макс. 3540, 2600, 1610, 1560, 1460, 1270, 1030 см-1. 1H-ЯМР (CDCl3) d 7,13 (1H, триплет, J 8 Гц), 7,02 (1H, дублет, J 8 Гц), 6,94-6,9 (2H, мультиплет), 6,74 (1H, триплет, J 8 Гц), 6,7 (1H, дублет, J 8 Гц), 6,64 (1H, дублет, J 8 Гц), 3,79 (3H, синглет), 3,78 (1H, синглет), 3,67 (1H, дублет, J 1 Гц), 3,43 (3H, синглет), 3,38 (1H, дублет, J 14 Гц), 3,21 (1H, уширенный дублет, J 14 Гц), 2,14 (3H, синглет), 2,11-2,07 (1H, мультиплет), 1,93-1,74 (1H, мультиплет), 1,59-1,53 (1H, мультиплет), 1,38-1,33 (1H, мультиплет),
13C-ЯМР (CDCl3) d 157,6, 156,5, 134,1, 129,6, 128,6, 128,4, 127,7, 126,1, 124,4, 119,9, 109,7, 109,6, 63,3, 55,4, 54,7, 53,4, 47,8, 46,6, 28,1, 20,4, 16,3.
HRMS: Вычислено для C21H28N2O2: 340.2151. Найдено: 340.2172.
Пример 55. Цис-3-(2-метоксибензиламино)-2-(2-фтор-6-хлорфенил) пиперидин (X 2-F, 6-Cl).
Т.пл. 245-246oC (HCl соль). ИК (KBr) макс. 3280, 2700, 1610, 1580, 1500, 1450, 1260, 1010 см-1. 1H-ЯМР (CDCl3) d 7,16-7,1 (3H, мультиплет), 6,99-6,92 (2H, мультиплет), 6,79 (1H, триплет, J 8 Гц), 6,68 (1H, дублет, J 8 Гц), 4,37 (1H, дублет, J 2 Гц), 3,68 (1H, дублет, J 14 Гц), 3,55 (1H, синглет), 3,47 (1H, дублет, J 14 Гц), 3,2 (1H, уширенный дублет, J 14 Гц), 2,87-2,78 (1H, мультиплет), 2,7 (1H, триплет, J 14 Гц), 2,4-2,0 (1H, мультиплет), 1,84- 1,6 (2H, мультиплет), 1,36 (1H, уширенный дублет, J 14 Гц).
13C-ЯМР (CDCl3) d 157,4, 129,3, 128,3, 128,2, 127,8, 125,7, 125,6, 120,3, 115,4, 115, 109,9, 62,8, 62,8, 54,9, 53, 47,9, 28,6, 20,8.
HRMS: Вычислено для C19H22N2OClF: 348, 1405.
Найдено: 348, 1369.
Названные соединения примеров 56-60 имеют следующую общую формулу и получают по методике, подобно описанной в примере 1.
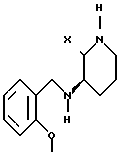
Пример 56. 3-(2-Метоксибензиламино)пиперидин (X=H)
Т.пл. 198oC (соль HCl). 1H-ЯМР (соль HCl в CD3OH) δ 7,48 (2H, триплет, J 6 Гц), 7,12 (1H, дублет, J 6 Гц), 7,04 (1H, триплет, J 8 Гц), 4,33 (2H, дублет, J 4 Гц), 3,95 (3H, синглет), 3,8 (1H, уширенный дублет, J 9 Гц), 3,7-3,54 (1H, мультиплет), 3,41 (уширенный дублет, 1H, J 9 Гц), 3,25 (1H, триплет, J 12 Гц), 3,18-3,01 (1H, мультиплет), 2,48-2,4 (1H, мультиплет), 2,24-2,1 (1H, мультиплет), 2,01-1,79 (1H, мультиплет).
HRMS: Вычислено для C13H22N2O: 220, 1576.
Найдено: 220, 1587.
Пример 57. Цис-3-(2-метоксибензиламино)-2-(5-индалил)пиперидин (X 5-индан).
Т. пл. 243oC (соль HCl). 1H-ЯМР (CDCl3) d 7,24-7,11 (3H, мультиплет), 6,97 (2H, триплет, J 8 Гц), 6,79 (1H, триплет, J 8 Гц), 6,65 (1H, дублет, J 8 Гц), 3,83 (1H, уширенный синглет), 3,68 (1H, дублет, J 14 Гц), 3,43 (3H, синглет), 3,39 (1H, дублет, J 14 Гц), 2,23 (1H, уширенный дублет, J 14 Гц), 2,88-2,72 (6H, мультиплет), 2,13-1,86 (5H, мультиплет), 1,56 (1H, два триплета, J 13 и 4 Гц), 1,37 (1H, уширенный дублет, J 14 Гц).
Пример 58. Цис-3-(2-метоксибензиламино)-2-(1-нафтил)пиперидин (X= 1-нафтил).
Т. пл. 251oC (соль HCl). 1H-ЯМР (соль HCl в CD3OH) d 8,16 (1H, дублет, J 6 Гц), 8,08 (1H, дублет, J 7 Гц), 8,04-7,98 (1H, мультиплет), 7,94-7,86 (1H, мультиплет), 7,71 (1H, триплет, J 8 Гц), 7,64-7,61 (1H, мультиплет), 7,17 (1H, триплет, J 8 Гц), 6,84 (1H, дублет, J 6 Гц), 6,66 (1H, триплет, J 8 Гц), 5,73 (1H, уширенный синглет), 4,06-3,99 (1H, мультиплет), 3,8-3,74 (2H, мультиплет), 3,49-3,4 (4H, мультиплет), 2,72-2,44 (3H, мультиплет), 6,84 (1H, уширенный дублет, J 8 Гц).
HRMS: Вычислено для C23H26N2O: 346, 2045.
Найдено: 346, 2062.
Пример 59. Цис-3-(2-метоксибензиламино)-2-(2-нафтил)пиперидин (X 2- нафтил).
Т. пл. >250oC (разл. соль HCl). 1H-ЯМР (CDCl3) d 7,87-7,78 (3H, мультиплет), 7,69 (1H, дублет, J 8 Гц), 7,5-7,39 (2H, мультиплет), 7,14 (1H, дублет, J 8 Гц), 7,1 (1H, триплет, J 8 Гц), 6,92 (1H, дублет, J 8 Гц), 6,75 (1H, триплет, J 8 Гц), 6,47 (1H, дублет, J 8 Гц), 4,02 (1H, дублет, J 2 Гц), 3,66 (1H, дублет, J 14 Гц), 3,37-3,2 (2H, мультиплет), 2,97 (3H, синглет), 2,89 (1H, уширенный синглет), 2,88-2,79 (1H, мультиплет), 2,16 (1H, уширенный дублет, J 14 Гц), 1,98 (1H, квартет, триплет, J 8 и 3 Гц), 1,63 (1H, два триплета, J 4 и 12 Гц), 1,43 (1H, уширенный дублет, J 13 Гц).
Пример 60. Цис-3-(2-метоксибензиламино)-2-циклопентилпиперидин (X циклопентил).
Т. пл. 161oC (соль HCl). ИК (KBr) nмакс. 3480, 3420, 2960, 1610, 1500, 1260, 1020 см-1. 1H-ЯМР (CDCl3)) δ 7,48 (1H, дублет, J 8 Гц), 7,17 (1H, триплет, J 8 Гц), 6,9 (1H, триплет, J 8 Гц), 6,8 (1H, дублет, J 8 Гц), 3,78 (3H, синглет), 3,67 (1H, дублет, J 13 Гц), 3,57 (1H, дублет, J 13 Гц), 2,97 (1H, уширенный дублет, J 13 Гц), 2,69-2,64 (2H, мультиплет), 2,47 (1H, триплет, J 9 Гц), 2,3-2,2 (2H, мультиплет), 1,75 (1H, уширенный дублет, J 9 Гц), 1,6-1,16 (7H, мультиплет), 1,0-0,9 (1H, мультиплет),
13С-ЯМР (CDCl3) d 157,9, 130,6, 128,5, 127,5, 120,2, 110, 61,3, 59,2, 55,1, 47,9, 47,2, 39, 29,2, 27,3, 26,2, 25,8, 24,1, 23,1.
HRMS: Вычислено для C18H28N2O: 288, 2201.
Найдено: 288, 2172.
Названные соединения примеров 61-62 имеют следующую общую формулу и получают по методике, подобной описанной в примере 1.
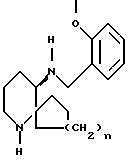
Пример 61. 5-(2-Метоксибензиламино)-1-аза-спиро-[5,5] -ундеккан (n 2).
Т. пл. 257oC (соль HCl). ИК (KBr) νмакс. 2940, 1605, 1580, 1500, 1460, 1250, 1020 см-1. 1H-ЯМР (CDCl3) δ 7,27-7,18 (2H, мультиплет), 6,89 (1H, триплет, J 8 Гц), 6,84 (1H, дублет, J 8 Гц), 3,86 (1H, дублет, J 14 Гц), 3,82 (3H, синглет), 3,68 (1H, дублет, J 14 Гц), 2,74-2,68 (2H, мультиплет), 2,25-2,08 (1H, мультиплет), 1,81-1,25 (13H, мультиплет),
HRMS: Вычислено для C18H28N2O: 288, 2202.
Найдено: 288, 2182.
Пример 62. 10-(2-Метоксибензиламино)-6-аза-спиро-[4,5]-декан (n 1)
Т. пл. 247oC (соль HCl). ИК (KBr) nмакс. 2960, 2700, 1605, 1580, 1500, 1480, 1260, 1030 см-1. 1H-ЯМР (CDCl3 δ 7,23-7,18 (2H, мультиплет), 6,89 (1H, триплет, J 8 Гц), 6,84 (1H, дублет, J 8 Гц), 3,89 (1H, дублет, J 13 Гц), 3,83 (3H, синглет), 3,66 (1H, дублет, J 14 Гц), 2,76-2,7 (2H, мультиплет), 2,31 (1H, два дублета, J 8и 3 Гц), 1,81-1,24 (12H, мультиплет),
HRMS: Вычислено для C17H26N2O: 274, 2085
Найдено: 274, 2057.
Пример 63. Цис-3-(2-метоксибензиламино)-2-фенилпиперидин.
A. 4-Фенил-1-(трет-бутилдиметилсилил) азетидин-2-он.
4-Фенилазетидин-2-он (10,4 г, 71,0 ммоль) (Graf Chem. Ber. 111 (1963), Durst et al. J. Org. Chem. 35, 2043 (1970)) растворяют в ДМФА (200 мл) и обрабатывают хлористым трет-бутилдиметилсилилом (12,8 г, 85 ммоль) и триэтиламином (11,8 мл, 85 ммоль). Смесь перемешивают при комнатной температуре в течение 16 часов и переносят в эфир (500 мл). Эфирный раствор промывают 1 N раствором соляной кислоты (1 х 100 мл), водой (2 х 50 мл) и рассолом (1 х 50 мл). После этого раствор высушивают (безводным сульфатом магния) и выпаривают, остаток подвергают флеш-хроматографии на силикагельной колонке. Элюирование с помощью 15%-ного этилацетата в гексане дает 4-фенил-1-(трет-бутилдиметилсилил)азетилин-2-он (18,4 г, 99% ) в виде масла, которое затвердевает при стоянии.
1H-ЯМР (CDCl3) d 7,37-7,29 (5H, мультиплет), 4,51 (1H, два дублета, J 6 и 3 Гц), 3,5 (1H, два дублета, J 16 и 6 Гц), 2,93 (1H, два дублета, J 16 и 3 Гц), 0,9 (3H, синглет), 0,89 (9H, синглет), 0,19 (3H, синглет).
B. 3-(З'-Xлорпропил)-4-фенил-1-(трет-бутилдиметилсилил) азатидин-2-он.
К перемешиваемому раствору 4-фенил-1-(трет-бутилдиметилсилил) азатидин-2-она (9,75 г, 37 ммоль) в ТГФ (100 мл) при -50oC в атмосфере азота быстро добавляют свежеприготовленный раствор диэтиламида лития (1 М в ТГФ, 44 мл, 45 ммоль). Реакционную смесь перемешивают в течение 15 минут при -50oC, а затем добавляют раствор 1-бром-3-хлорпропана (7,4 мл, 75 ммоль) в ТГФ (20 мл). Получающийся раствор перемешивают в течение 15 мин при -50oC, после чего добавляют хлористый аммоний (насыщенный водный раствор). После этого смесь обрабатывают эфиром (2 х 300 мл) и промывают насыщенным водным раствором хлористого натрия. Эфирный раствор высушивают (сульфатом магния) и концентрируют, а остаток (17,0 г) хроматографируют на силикагелевой колонке. Элюирование 5% -ным этилацетатом в гексане дает 3-(3'-хлорпропил)-4-фенил-1-(трет-бутилдиметилсилил) азатидин-1-он в виде масла (7,6 г, 58%).
1H-ЯМР (CDCl3) d 7,2-7,4 (1H, мультиплет), 4,18 (1H, дублет, J 2,5 Гц), 3,5 (2H, триплет, J 5 Гц), 3,04 (1H, дублет и триплет, J 2,5 и 7,5 Гц), 1,7-2,05 (4H, мультиплет), 0,9 (9H, синглет), 0,2 (3H, синглет).
C. Цис-Метил-2-фенилпиперидин-3-карбоксилат (метиловый эфир кислоты).
3-(3'-Хлорпропил)-4-фенил-1-(трет-бутилдиметилсилил)азетидин-2-он (3,07 г, 9,0 ммоль) растворяют в 10%-ном метанольном растворе серной кислоты и кипятят с обратным холодильником в течение 16 часов. К концу этого периода времени реакционную смесь охлаждают, серную кислоту нейтрализуют бикарбонатом натрия и смесь обрабатывают эфиром (2 х 200 мл). Эфирный раствор промывают водой (2 х 50 мл) и высушивают (безводным сульфатом магния). Выпаривание дает в основном чистый 5-хлор-2- карбометокси-1-фенилпент-1-иламин в виде масла (2,11 г). Полученный таким образом 5-хлор-2-карбометокси-1-фенилпент-1-ил-амин растворяют в диметилформамиде ("ДМФА") (20 мл) и добавляют йодистый натрий (2,11 г) и бикарбонат натрия (2,11 г). Получающуюся смесь кипятят с обратным холодильником в течение 15 мин. К концу этого периода времени реакционную смесь охлаждают и обрабатывают эфиром (200 мл). Эфирный раствор промывают водой (2 х 50 мл) и высушивают (безводным сульфатом магния). Выпаривание эфира дает хроматографически чистый метиловый эфир цис-2- фенилпиперидин-3-карбоновой кислоты в виде масла (1,54 г, 78%).
1H-ЯМР (CDCl3) d 7,31-7,5 (5H, мультиплет), 3,95 (2H, дублет, J 3,5 Гц), 3,42 (3H, синглет), 3,39-3,30 (1H, мультиплет), 3,01-2,93 (1H, мультиплет), 2,84-2,74 (1H, мультиплет), 2,22-2,11 (1H, мультиплет), 1,90-1,66 (3H, мультиплет), 1,53-1,46 (1H, мультиплет).
D. Метиловый эфир цис-2-фенилпиперидин-1-(бензилоксикарбонил)- 3-карбоновой кислоты.
Метиловый эфир цис-2-фенилпиперидин-3-карбоновой кислоты (1,54 г, 7,0 ммоль), триэтиламин (1,5 мл, 11,0 ммоль) и бензиловый эфир хлормуравьиной кислоты (1,5 мл, 11,0 ммоль) смешивают в хлористом метилене (45 мл) при 25oC перемешивают в течение 15 часов. К концу этого периода времени реакционную смесь обрабатывают эфиром (100 мл), эфирный раствор промывают водой (2 х 50 мл) и высушивают (безводным сульфатом магния). Растворитель удаляют при пониженном давлении, чтобы получить остаток, который хроматографируют на флеш- силикагелевой колонке. Элюирование 1:1 смесью этилацетат/гексан дает метиловый эфир цис-2-фенилпиперидин-1-(бензилоксикарбонил)-3-карбоновой кислоты в виде масла (1,91 г, 77%).
1H-ЯМР (CDCl3) d 7,34-7,12 (10H, мультиплет), 5,97 (1H, уширенный дублет), 5,30-5,1 (1H, мультиплет), 5,17 (1H, синглет), 4,15-3,90 (1H, мультиплет), 3,59 (3H, синглет), 2,98-2,91 (1H, мультиплет), 2,75 (1H, уширенный триплет, J 12 Гц), 2,14-2,00 (2H, мультиплет), 1,85-1,48 (2H, мультиплет),
13C-ЯМР (CDCl3) d 172,9, 138,3, 126,7, 128,5, 128,0, 127,9, 127,3, 67,4, 54,6, 51,8, 39,7, 25,1, 21,5.
E. Цис-2-фенилпиперидин-1-(бензилоксикарбонил)-3-карбоксамид.
К суспензии хлористого аммония (1,66 г, 31 ммоль) в бензоле (60 мл) при -5oC медленно добавляют 2 М раствор (15,6 мл, 31 ммоль) триметилалюминия в гексане. После завершения добавления реакционной смеси позволяют подогреваться до комнатной температуры и ее перемешивают до тех пор, пока (1 час) не прекратится выделение газа. Раствор метилового эфира цис-2- фенилпиперидин-1-(бензилоксикарбонил)- 3-карбоновой кислоты (2,2 г, 6,2 ммоль) в бензоле (10 мл) добавляют к смеси и раствор поддерживают при 50oC в течение 10 часов. Реакционную смесь охлаждают до комнатной температуры и осторожно гасят с помощью 5%-ного HCl. Получающуюся смесь фильтруют через диатомовую землю (Целит (торговая марка)) и остаток промывают хлористым метиленом (200 мл). Органический слой разделяют, в то время как водный слой подщелачивают и экстрагируют хлористым метиленом (200 мл). Органические экстракты объединяют, высушивают (безводным сульфатом магния) и концентрируют в вакууме, чтобы получить остаток, который суспендируют в 1:1 смеси эфир /пентан, чтобы получить цис-2-фенилпиперидин-1-(бензилоксикарбонил)-3- карбоксамид (амид кислоты) в виде белого твердого вещества (1,4 г, 66%). Т.пл. 171oC.
1H-ЯМР (CDCl3) d 7,35-7,28 (10H, мультиплет), 5,86 (1H, дублет, J 4,9 Гц), 5,66-5,58 (1H, мультиплет), 5,48- 5,37 (1H, мультиплет), 5,21 (1H, дублет, J 12 Гц), 5,13 (1H, дублет, J 12 Гц), 4,02 (1H, уширенный дублет, J 13 Гц), 2,9-2,74 (2H, мультиплет), 2,11-1,98 (2H, мультиплет), 1,86-1,76 (1H, мультиплет), 1,66- 1,5 (1H, мультиплет).
HRMS: Вычислено для C20H22N2O3: 338, 1630.
Найдено: 338, 1634.
F. Цис-1-(бензилоксикарбонил)-3-амино-2-фенилпиперидин.
Цис-2-фенилпиперидин-1-(бензилоксикарбонил)-3-карбоксамид (1,4 г, 4,1 ммоль) растворяют в сухом трет-бутаноле (40 мл) при 50oC и добавляют тетрацетат свинца (1,9 г, 4,3 ммоль). Получившуюся коричневую реакционную смесь кипятят с обратным холодильником в течение 0,5 час. В течение 1 часа добавляют дополнительное количество тетрацетата свинца (1,9 г, 4,3 ммоль). К концу этого периода времени реакционную смесь выливают в холодную 1 N соляную кислоту и фильтруют через диатомовую землю (Целит (торговая марка)). Водную фазу экстрагируют этилацетатом (3 х 100 мл) и объединенные органические слои промывают последовательно, водой, 5%-ной водной гидроокисью натрия, водой и рассолом, а затем высушивают (безводным сульфатом магния). Выпаривание растворителя при пониженном давлении дает остаток, который хроматографируют на колонке с силикагелем. Элюирование 25%-ным этилацетатом в гексане дает хроматографически однородный цис-1-(бензилоксикарбонил)-3-(N-трет-бутоксикарбонил)-2- фенилпиперидин (1,1 г) в виде масла. Это вещество растворяют в этилацетате (20 мл) и через него пробулькивают в течение 5 мин газообразный хлористый водород. Затем реакционную смесь обрабатывают водным аммиаком и экстрагируют хлористым метиленом (2 х 200 мл). Органические экстракты объединяют, высушивают и выпаривают, чтобы получить хроматографически чистый цис-1-(бензилоксикарбонил)-3-амино-2- фенилпиперидин в виде масла (0,830 г, 65%).
Цис-1-(бензилоксикарбонил)-3-(N-трет-бутоксикарбонил)- 2-фенилпиперидин: 1H-ЯМР (CDCl3) d 7,39-7,16 (10H, мультиплет), 5,46 (1H, уширенный дублет, J 6 Гц), 5,13 (1H, дублет, J 13 Гц), 4,98 (1H, дублет, J 13 Гц), 4,14-3,93 (2H, мультиплет), 3,23 (1H, уширенный триплет), 1,9-1,5 (5H, мультиплет), 1,39 (9H, синглет).
Цис-1-(бензилоксикарбонил)-3-амино-2-фенилпиперидин:
1H-ЯМР (CDCl3) d 7,42-7,36 (2H, мультиплет), 7,32-7,12 (8H, мультиплет), 5,26 (1H, дублет, J 5 Гц), 5,07 (1H, дублет, J 12 Гц), 4,95 (1H, дублет, J 12 Гц), 4,06 (1H, дублет, уширенный, J 12 и 5 Гц), 3,12-3,08 (2H, мультиплет), 1,88 -1,53 (4H, мультиплет).
G. Цис-3-(2-метоксибензиламино)-2-фенилпиперидин.
Цис-1-(бензилоксикарбонил)-3-амино-2-фенилпиперидин (0,78 г, 2,5 ммоль) растворяют в метаноле (25 мл) и pH среды доводят до 5 с помощью метанольного раствора хлористоводородной кислоты. К смеси добавляют раздробленные молекулярные сита (1,0 г), цианоборгидрид натрия (0,163 г, 2,5 ммоль) и ортометоксибензальдегид (0,411 г, 3,0 ммоль) и полученную реакционную смесь перемешивают при комнатной температуре в течение 16 часов. К концу этого периода времени реакционную смесь фильтруют через диатомовую землю (Целит (торговая марка)) и фильтрат обрабатывают водной гидроокисью аммония. Водную фазу экстрагируют хлористым метиленом (3 х 60 мл) и высушивают (безводным сульфатом магния). Растворитель удаляют при пониженном давлении, чтобы получить маслянистый остаток (1,18 г). Этот остаток растворяют в этаноле (27 мл) и добавляют 10% палладий на угле (1,2 г) и аммонийную соль муравьиной кислоты (0,864 г, 14 ммоль). Полученную реакционную смесь перемешивают при 25oC в течение 16 часов. К концу этого периода времени реакционную смесь фильтруют через диатомовую землю (Целит (торговая марка)), которую промывают этанолом (50 мл) и хлористым метиленом (100 мл). Растворители удаляют под вакуумом, чтобы получить твердое вещество, которое обрабатывают водной гидроокисью аммония и экстрагируют хлористым метиленом (3 х 60 мл). Органические экстракты объединяют и высушивают (безводным сульфатом магния). Выпаривание растворителей при пониженном давлении дает желтое масло, из которого выделяют цис-3-(2- метоксибензиламино)-2-фенилпиперидин (728 мг, 83%) в виде твердого вещества путем обработки масла эфирным раствором HCl. Это вещество кристаллизуют из смеси этанол /метанол, чтобы получить хлористоводородную соль названного выше соединения (0,58 мг, т.пл. 250oC).
Пример 64. (+)S,S-Цис-3-(2-метоксибензиламино)-2-фенилпиперидин.
Названное выше соединение получают по методике примера 63, исходя из энантиомерно чистого (+) R-4-фенилазетидин-2-она. Т.пл. 249oC (разл. соль HCl). [α]D +77o (с 1, CH3OH).
Пример 65. (-)R,R-Цис-3-(2-метоксибензиламино)-2- фенилпиперидин.
Названное выше соединение получают по методике, описанной в примере 63, исходя из энантиомерно чистого-)S-4-фенилазетидин-2-она. Т.пл. 251oC (разл. соль HCl). [α]D -79oC (с 1, CH3OH).
Названные соединения примеров 66-70 имеют следующую общую формулу и получают по методике, подобной описанной в примере 1.
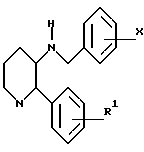
Пример 66. Транс-3-(2-хлорбензиламино)-2-фенилпиперидин (X 2-CL).
Т. пл. >255oC (разл. соль HCl). 1H-ЯМР (CDCl3) δ 7,42- 7,02 (9H, мультиплет), 3,69 (1H, дублет, J 13,9 Гц), 3,56 (1H, дублет, J 13,8 Гц), 3,80 (1H, дублет, J 9,1 Гц), 3,09 (1H, уширенный дублет, J 11,4 Гц), 2,75 (1H, дублет и триплет, J 11,8 и 2,9 Гц), 2,62-2,54 (1H, мультиплет), 2,29-2,23 (1H, мультиплет), 1,79-2,23 (2H, мультиплет), 1,34-1,24 (1H, мультиплет),
HRMS: Вычислено для C18H21N2Cl: 300, 1392.
Найдено: 300, 1387.
Пример 67. Цис-3-бензиламино-2-(3-трифторфенил)пиперидин (R1 3-CF3, X H).
Т. пл. > 270oC (разл. соль HCl). 1H-ЯМР (соль HCl в смеси MeOH-CDCl3) d 8,85 (2H, уширенный синглет), 8,74- 8,44 (2H, мультиплет), 8,21 (1H, мультиплет), 8,16-8,02 (4H, мультиплет), 5,97 (1H, уширенный синглет), 4,86 (1H, уширенный синглет), 4,58 (1H, триплет, J 10 Гц), 4,46-4,36 (2H, мультиплет), 4,2- 4,14 (2H, мультиплет), 3,24-3,08 (3H, мультиплет), 2,75 (1H, уширенный дублет, J 10 Гц),
HRMS: Вычислено для C19H21N2CD3: 296, 1889.
Найдено: 296, 1904.
Пример 68. Цис-3-бензиламино-2-фенилпиперидин (R1 H, X H).
Т. пл. 250oC (разл. соль HCl) 1H-ЯМР (CDCl3) d 6,94-7,4 (10H, мультиплет), 3,89 (1H, дублет, J 2,3 Гц), 3,52 (1H, дублет, J 13 Гц), 3,32 (1H, дублет, J 13 Гц), 3,25 (1H, уширенный дублет, J 12 Гц), 2,88 (1H, дублет, J 2,5 Гц), 2,78 (1H, дублет и триплет, J 12 и 3 Гц), 2,4 (1H, дублет, J 12 Гц), 1,8-1,98 (1H, мультиплет), 1,6 (1H, дублет, J 12 и 2,5 Гц), 1,42 (1H, дублет, J 12 Гц).
Пример 69. Транс-3-(2-метоксибензиламино)-2-фенилпиперидин (R1= X, X 2-OMe).
Т. пл. > 250oC (разл. соль HCl). 1H-ЯМР (CDCl3 d 7,29-7,24 (5H, мультиплет), 7,14 (1H, триплет, J 8 Гц), 6,97 (1H, дублет, J 8 Гц), 6,81 (1H, триплет, J 8 Гц), 6,67 (1H, дублет, J 8 Гц), 3,68 (1H, дублет, J 14 Гц), 3,47 (1H, дублет, J 14 Гц), 3,39 (3H, синглет), 3,38-3,34 (1H, мультиплет), 3,06 (1H, уширенный дублет, J 14 Гц), 2,73 (1H, триплет и дублет, J 9 и 3 Гц), 2,51 (1H, триплет и дублет, J 8 и 3 Гц), 2,32-2,2 (1H, мультиплет), 1,76-1,52 (2H, мультиплет), 1,36- 1,2 (1H, мультиплет), Масс-спектр: (М+ 298,18).
Пример 70. Цис-3-бензиламино-2-(4-фенил-фенил) пиперидин (R1=4-Ph, X H).
Т. пл. > 268oC (соль HCl). 1H-ЯМР (CD3OH, соль HCl) d 7,8 (4H, мультиплет), 7,59 (2H, дублет, J 5 Гц), 7,40 (2H, триплет, J 3 Гц), 7,38-7,24 (6H, мультиплет), 4,98 (1H, уширенный синглет), 3,98 (1H, уширенный синглет), 3,87 (1H, дублет, J 10 Гц), 3,68-3,58 (2H, мультиплет), 3,34-3,22 (3H, мультиплет), 2,46-2,16 (3H, мультиплет), 2,01- 1,90 (1H, мультиплет),
HRMS: Вычислено для C24H26N2: 342, 2096.
Найдено: 342, 2057.
Названные соединения примеров 71-75 имеют следующую общую формулу и получают по методике, подобной описанной в примере 1.
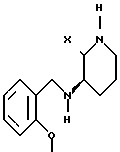
Пример 71. Цис-3-(2-метоксибензиламино)-2-(3-тиенил)пиперидин (X 3-тиенил).
Т. пл. > 239oC (соль HCl). 1H-ЯМР (CDCl3) δ 7,25-7,11 (3H, мультиплет), 7,03 (1H, два дублета, J 7,3 и 7,1 Гц), 6,85-6,82 (2H, мультиплет), 6,73 (1H, дублет, J 8,2 Гц), 3,94 (1H, уширенный синглет), 3,73 (1H, дублет, J 13,7 Гц), 3,57 (3H, синглет), 3,45 (1H, дублет, J 13,7 Гц), 3,20 (1H, уширенный дублет, J 10,4 Гц), 2,82 (1H, дублет, J 2,7 Гц), 2,76 (1H, дублет и триплет, J 12,5 и 3,1 Гц), 2,11 (1H, уширенный дублет, J 13,4 Гц), 1,97-1,84 (1H, мультиплет), 1,57 (1H, два триплета, J 13,4 и 3,5 Гц), 1,36 (1H, уширенный дублет, J 13,2 Гц),
HRMS: Вычислено для C17H22N2OS: 302, 1535.
Найдено: 302, 1444.
Пример 72. Цис-3-(2-метоксибензиламино)-2-бензилпиперидин (X бензил),
Т. пл. > 241oC (соль HCl). 1H-ЯМР (CDCl3) d 7,37 (1H, два дублета, J 7,3 и 1,6 Гц), 7,29-7,2 (6H, мультиплет), 6,93 (1H, дублет и триплет, J 7,4 и 1,0 Гц), 6,88 (1H, два дублета, J 8,2 и 0,7 Гц), 3,89 (1H, дублет, J 13,5 Гц), 3,85 (1H, синглет), 3,70 (1H, дублет, J 13,5 Гц), 3,00-2,89 (2H, мультиплет), 2,82 (1H, синглет), 2,79 (1H, дублет, J 3,6 Гц), 2,71-2,67 (1H, мультиплет), 2,57 (1H, дублет и триплет, J 10,7 и 3,2 Гц), 1,97-1,92 (1H, мультиплет), 1,75-1,63 (1H, мультиплет), 1,44-1,36 (2H, мультиплет),
HRMS: Вычислено для C20H26N2O: 310, 2045.
Найдено: 310, 2073.
Пример 73. Цис-3-(2-метоксибензиламино)-2-циклогексилпиперидин (X циклогексил).
Т. пл. > 225oC (соль HCl). 1H-ЯМР (CDCl3) d 7,13-7,31 (2H, мультиплет), 6,9 (1H, триплет, J 8 Гц), 6,82 (1H, дублет, J 9 Гц), 3,9 (1H, дублет, J 14 Гц), 3,81 (3H, синглет), 3,6 (1H, дублет, J 15 Гц), 3,11 (1H, уширенный дублет, J 9 Гц), 2,72 (1H, уширенный синглет), 2,6 (1H, триплет, J 10 Гц), 2,19 (1H, дублет, J 9 Гц), 2,11 (1H, уширенный дублет, J 12 Гц), 2,01-1,53 (1H, мультиплет), 1,38-1,04 (6H, мультиплет), 0,92-0,65 (2H, мультиплет).
HRMS: Вычислено для C19H30N2O: 302, 2358.
Найдено: 302, 2352.
Пример 74. Цис-3-(2-метоксибензиламино)-2-трет-бутилпиперидин (X трет-бутил).
Т. пл. > 251oC (соль HCl). 1H-ЯМР (CDCl3) d 7,33 (1H, два дублета, J 7,3 и 2,6 Гц), 7,21 (1H, два дублета, J 7,8 и 1,7 Гц), 6,90 (1H, дублет и триплет, J 7,4 и 0,95 Гц), 6,84 (1H, дублет, J 8,2 Гц), 3,91 (1H, дублет, J 13,6 Гц), 3,81 (3H, синглет), 3,55 (1H, дублет, J 13,6 Гц), 3,13 (1H, уширенный дублет, J 12,1 Гц), 2,88 (1H, уширенный синглет), 2,61 (1H, дублет и триплет, J 12,3 и 2,9 Гц), 2,19 (1H, дублет, J 1,9 Гц), 2,12 (1H, уш.дубл. J 12,9 Гц), 1,76-1,66 (1H, мультиплет), 1,35-1,22 (2H, мультиплет), 0,95 (9H, синглет).
HRMS: Вычислено для C17H28N2O: 276, 2201.
Найдено: 276, 2217.
Пример 75. Цис-3-(2-метоксибензиламино)-2-(3-фуранил)пиперидин (X 3-фуранил).
Т. пл. > 247oC (соль HCl). 1H-ЯМР (CDCl3) d 7,34 (2H, дублет, J 1,4 Гц), 7,19 (1H, дублет и триплет, J 7,7 и 1,7 Гц), 7,11 (1H, два дублета, J 7,3 и 1,6 Гц), 6,85 (1H, триплет, J 7,4 Гц), 6,77 (1H, дублет, J 8,1 Гц), 6,15 (1H, триплет и дублет, J 1,2 Гц), 3,8 (2H, дублет, J 1,4 Гц), 3,65 (3H, синглет), 3,54 (1H, дублет, J 13,6 Гц), 3,14 (1H, уширенный дублет, J 12,7 Гц), 2,75 (2H, дублет и триплет, J 12,1 и 3,2 Гц), 2,09 (1H, уширенный дублет, J 13,6 Гц), 1,93-1,83 (1H, мультиплет), 1,54 (1H, два триплета, J 13,2 и 3,5 Гц), 1,36 (1H, уширенный дублет, J 13,1 Гц).
HRMS: Вычислено для C17H22N2O: 286, 1681.
Найдено: 286, 1682.
Пример 76. Цис-3-(2-метоксибензиламино)-2-фенилазациклогептан.
Названное выше соединение получают по методике примера 63, исходя из (±)-4-фенилазетидин-2-она и используя 1-бром-4-хлорбутан в методике B вместо 1-бром-3-хлорпропана. Т.пл. ≈ 230oC (разл. соль HCl).
1H-ЯМР (CDCl3) d 1,21 (мультиплет, 1H), 1,55 (мультиплет, 1H), 1,80 (мультиплет, 5H), 2,75 (мультиплет, 1H), 3,06 (мультиплет, 1H), 3,36 (мультиплет, 1H), 3,39 (синглет, 1H), 3,45 (дублет, 1H, J 13 Гц), 3,50 (мультиплет, 1H), 6,62 (дублет, 1H, J 6 Гц), 6,76 (триплет, 1H, J 6 Гц), 6,91 (дублет, 1H, J 6 Гц), 7,12 (мультиплет, 2H), 7,22 (мультиплет, 4H).
HRMS: Вычислено для C20H27N2O: 311, 2134.
Найдено: 311, 2132.
Названные соединения примеров 77-81 имеют следующую общую формулу и получают по методике, подобно описанной в примере 1.
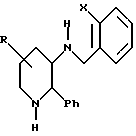
Пример 77. 3α -(Бензиламино)-3-метил-2-фенилпиперидин (R CH3, X H).
Т. пл. 269oC (разл. соль HCl). 1H-ЯМР (CDCl3, 300 МГц) d 7,1- 7,45 (мультиплет, 10H), 3,81 (два дублета, J 13 Гц, 1H), 3,71 (синглет, 1H), 3,66 (два дублета, J 13 Гц, 1H), 3,05-3,1 (мультиплет, 1H), 2,78 (дублет и триплет, J 3 и 11 Гц, 1H), 1,4-2,0 (мультиплет, 4H), 1,15 (синглет, 3H).
13C-ЯМР (CDCl3) d 141,6, 141,1, 128,8, 128,3, 127,83 127,81, 127,3, 126,6, 70,0, 65,9, 54,8, 47,9, 45,5, 37,1, 23,5, 18,9 и 15,3. Вычислено для C19H24N2•2HCl•1/8 H2O: C 64,18, H 7,44, N 7,88. Найдено: C 64,12, H 7,36, N 7,85.
HRMS: Вычислено для C19H24N2: 280, 1933
Найдено: 280, 1932.
Пример 78. 3β -(Бензиламино)- 3α -метил- 2β -фенилпиперидин (R CH3, X H)./
Т. пл. 238oC (соль HCl). 1H-ЯМР (CDCl3, 300 МГц) d 7,1-7,4 (10H, мультиплет), 3,64 (два дублета, J 13 Гц, 1H) 3,52 (два дублета, J 13 Гц, 1H), 3,50 (синглет, 1H), 3,13-3,18 (мультиплет, 1H), 2,73 (дублет и триплет, J 12 и 3 Гц, 1H), 2,1 (уширенный дублет, J 13,8 Гц, 1H), 1,45-1,52 (мультиплет, 1H), 1,25-1,4 (мультиплет, 1H), 0,93 (синглет, 3H),
13H-ЯМР (CDCl3) d 142,1, 141, 129,1, 128,1, 127,9, 127,5, 127, 126,4, 72,1, 53,3, 47,9, 45,3, 34,5, 24,7, 22,5.
HRMS: Вычислено для C19H24N2: 280, 1933
Найдено: 280, 1930.
Пример 79. 3α -(2-Метоксибензиламино)- 3β -метил- 2β фенилпиперидин (R CH3, X OCH3).
Т. пл. 233oC (разл. соль HCl). 1H-ЯМР (CDCl3, 300 МГц) d 7,15-7,46 (мультиплет, 7H), 6,85 (дублет и триплет, J 7 и 1 Гц, 1H), 6,74 (дублет, J 8 Гц, 1H,), 3,7 (синглет, 1H), 3,68 (два дублета, J 13 Гц, 1H), 3,6 (синглет, 3H), 3,16 (мультиплет, 1H), 2,76 (дублет и триплет, J3 и 11 Гц, 1H), 1,97 (уширенный дублет, J 11 Гц, 1H), 1,55-1,83 (мультиплет, 3H), 1,14 (синглет, 3H),
HRMS: Вычислено для C20H26N2O: 310, 2046.
Найдено: 310, 2038.
Пример 80. 3β -(2-Метоксибензиламино)- 3α -метил- 2β -фенилпиперидин (R CH3, X OCH3).
Т. пл. 242oC (соль, HCl). 1H-ЯМР (CDCl3, 300 МГц) d 7,15- 7,4 (7H, мультиплет), 6,91 (дублет, триплет, J 7 и 1 Гц, 1H), 6,81 (дублет, J 8 Гц, 1H), 3,73 (синглет, 3H), 3,63 (два дублета, J 13 Гц, 1H), 3,52 (синглет, 1H), 3,5 (два дублета, J 13 Гц, 1H), 3,13-3,21 (мультиплет, 1H), 2,75 (дублет и триплет, J 12 и 3 Гц), 2,16 (уширенный дублет, J 14 Гц, 1H), 1,73-1,91 (мультиплет, 1H), 1,48 (уширенный дублет, J 13 Гц, 1H), 1,33 (дублет и триплет, J 14 и 4 Гц, 1H), 0,93 (синглет, 3H),
HRMS: Вычислено для C20H26N2O: 310, 2045.
Найдено: 310, 2092.
Пример 81. 3α -(2-Метоксибензиламино)- 5β -метил- 2β фенилпиперидин (R CH3, X OCH3).
Т. пл. 208oC (разл.). 1H-ЯМР (CDCl3, 300 МГц) d 7,22-7,31 (мультиплет, 5H), 7,16 (дублет и триплет, J 7 и 1 Гц, 1H), 6,99 (два дублета, J 8 и 1 Гц, 1H), 6,81 (дублет, триплет, J 8 и 1 Гц, 1H), 6,69 (уширенный дублет, J 8 Гц, 1H), 3,66 (два дублета, J 13 Гц, 1H), 3,46 (два дублета, J 13 Гц, 1H), 3,43 (синглет, 3H), 3,36 (дублет, J 9 Гц, 1H), 2,97 (два дублета, J 11 и 3 Гц, 1H), 2,67-2,86 (мультиплет, 2H), 1,97-2,09 (мультиплет, 1H), 1,43-1,58 (мультиплет, 2H), 1,13 (дублет, J 7 Гц, 3H),
HRMS: Вычислено для C20H26N2O: 310, 2046.
Найдено: 310, 2045.
Пример 82. 3β -(2-Триенилметиламино)- 2β -(3-тиенил)пиперидин
Т. пл. 262oC (соль HCl). 1H-ЯМР (CDCl3, 300 МГц) d 7,05-7,3 (3H, мультиплет), 6,97 (два дублета, J 5 и 1 Гц, 1H), 6,88 (мультиплет, 1H), 6,77 (два дублета, J 5 и 1 Гц, 1H), 3,98 (дублет, J 2 Гц, 1H), 3,6 (два дублета, J 14 Гц, 1H), 3,44 (два дублета, J 14 Гц, 1H), 3,16-3,21 (мультиплет, 1H), 2,89-2,92 (мультиплет, 4H), 2,76 (два триплета, J 12 Гц, 1 Гц, 1H), 1,3-2,1 (мультиплет, 4H).
13С-ЯМР (CDCl3) d 144,1, 142, 127,5, 126,2, 125,7, 125,3, 120, 120,3, 61,2, 54,8, 47,5, 46,4, 28,7, 20,5.
HRMS: Вычислено для C14H18N2S: 278, 0906. Найдено: 278, 0922 C 47,86, H 5,74, N 7,97. Найдено: C 47,87, H 5,79, N 7,61.
Названное выше соединение было получено согласно процедуре, описанной в примере 1.
Пример 82-A. Названное ниже соединение получают по методике, подробно описанной в Примере 1. Транс-3-бензиламино-2-фенилпиперидин (R X H).
Т. пл. 269oC (разл. соль HCl). 1H-ЯМР (CDCl3, 300 МГц) d 6,9-7,4 (мультиплет, 10H), 3,63 (два дублета, J 13 Гц, 1H), 3,42 (два дублета, J 13 Гц, 1H), 3,38 (дублет, J 7,4 Гц, 1H), 3,07 (уширенный дублет и триплет, J 11,6 Гц, 1H), 2,14-2,24 (мультиплет, 1H), 1,56-1,8 (мультиплет, 3H), 1,2-1,38 (мультиплет, 1H),
HRMS: Вычислено для C18H22N2: 266, 1783.
Найдено: 266, 1764.
Пример 83. Димезилат цис-(2S,3S)-1-(4,4-бис-(4-фторфенил)бутил)-3-(2- метоксибензил)амино-2-фенилпиперидина.
Названное выше соединение получают по методике, подобно описанной в примере 2.
C35H38F2N2O • 2CH3SO3H, пл. 55-60oC (41%)
1H-ЯМР (CDCl3) d 1,20-1,80 (мультиплет, 4H), 1,92-2,20 (мультиплет, 4H), 2,40 (мультиплет, 1H), 2,46-2,66 (мультиплет, 2H), 3,14 (мультиплет, 1H), 3,25 (синглет, 3H), 3,45 (синглет, 1H), 3,60-3,82 (мультиплет, 4H), 4,32 (мультиплет, 1H), 6,60 (дублет, 1H), 6,78-6,95 (мультиплет, 5H), 7,00 (дублет, 1H), 7,06-7,24 (мультиплет, 5H), 7,26-7,42 (мультиплет, 5H).
Масс-спектр (м/е,): 540 (5,M+), 364 (100), 314 (15), 148 (58), 121 (87), 91 (90).
Пример 84. Цис-(23,35)-3-(2-метоксибензил) амино-2-фенил-1-[4-(тио-фен-2-ил)-бут-1-ил]
Названное соединение получают по методике, подобно описанной в примере 2.
C27H34N2OS, масло.
1H-ЯМР (CDCl3) d 1,32-1,60 (мультиплет, 6H), 2,8-2,9 (мультиплет, 1H), 1,96-2,3 (мультиплет, 4H), 2,50-2,72 (мультиплет, 4H), 3,16-3,38 (мультиплет, 3H), 3,40 (синглет, 3H), 3,65-3,80 (мультиплет, 1H), 6,59-6,76 (мультиплет, 3H), 6,81-6,88 (мультиплет, 2H), 7,02-7,12 (мультиплет, 2H), 7,20-7,38 (мультиплет, 5H).
Масс-спектр (м/е, ): 434 (60, M+), 271 (31), 258 (100), 121 (32), 91 (35).
Названные соединения примеров 85-89 получают по методике, подобно описанной в примере 1.
Пример 85. Димезилат-цис-3-(5-хлор-2-метоксибензил) амино-2-(3-фторфенил) пиперидина.
C19H22FN2O•2CH3SO3H, гигроскопичное твердое вещество (34%).
1H-ЯМР (CDCl3) d 1,40 (мультиплет, 1H), 1,60 (мультиплет, 1H), 1,78 (синглет, 2H), 1,87 (мультиплет, 1H), 2,09 (мультиплет, 1H), 2,79 (мульиплет, 2H), 3,25 (мультиплет, 1H), 3,36 (дублет, 1H), 3,51 (синглет, 3H), 3,62 (дублет, 1H), 3,87 (дублет, 1H, J 2 Гц), 6,61 (дублет, 1H, J 8,7 Гц), 6,89-7,12 (мультиплет, 5H), 7,22-7,31 (мультиплет, 1H).
Масс-спектр-FAB(m/e,): 349 (100, M+), 351 (35), 178 (25), 155 (29), 119 (31).
Пример 85. Дихлоргидрид ци-3-(2,5-диметоксибензил) амино-2-(3-метоксифенил) пиперидина.
C21H28N2O3•2HCl, т.пл. 235-237oC (6%)
1H-ЯМР (CDCl3, свободное основание) d 1,42 (мультиплет, 1H), 1,60 (мультиплет, 1H), 1,83-2,20 (мультиплет, 4H), 2,72-2,87 (мультиплет, 2H), 3,27 (мультиплет, 1H), 3,40 (дублет, 1H), 3,43 (синглет, 3H), 3,65 (дублет, 1H), 3,72 (синглет, 3H), 2,77 (синглет, 3H), 3,86 (дублет, 1H), 6,58-6,70 (мультиплет, 2H), 6,73-6,88 (мультиплет, 3H), 7,18-7,28 (мультиплет, 2H).
Масс-спектр FAB (m/e,): 357 (100, M+), 190 (18), 151 (26), 119 (29).
Пример 87. Димезилат цис-3-(2,5-диметоксибензил) амино-1-этил-2-(3-фторфенил) пиперидина.
C22H29FN2O2•2CH3SO3H, масло.
1H-ЯМР (CDCl3, свободное основание) d 0,97 (триплет, 3H), 1,5 (мультиплет, 2H), 1,86-2,15 (мультиплет, 5H), 2,55-2,70 (мультиплет, 2H), 3,23 (мультиплет, 1H), 3,32 (синглет, 1H), 3,40 (дублет, 1H), 3,50 (синглет, 3H), 3,68 (дублет, 1H), 3,70 (синглет, 3H), 6,58-6,7 (мультиплет, 3H), 6,93 (мультиплет, 1H), 7,10 (два дублета, 2H), 7,25 (мультиплет, 1H).
Масс-спектр-FAB (m/e,): 373 (100, M+), 359 (10), 206 (46).
Пример 88. Дихлоргидрат цис-3-(5-хлор-2-метоксибензил) амино-2-(3-метоксифенил) пиперидина.
C20H25ClN2O2•2HCl, т.пл. 256-259oC (25%).
1H-ЯМР (CDCl3, свободное основание) d 1,40 (мультиплет, 1H), 1,58 (мультиплет, 1H), 1,80-2,15 (мультиплет, 4H), 2,78 (мультиплет, 2H), 3,25 (мультиплет, 1H), 3,32 (дублет, 1H), 3,46 (синглет, 3H), 3,63 (дублет, 1H), 3,75 (синглет, 3H), 3,85 (дублет, 1H), 6,58 (дублет, 1H), 5,75-6,88 (мультиплет, 3H), 6,95 (дублет, 1H), 7,08 (два дублета, 1H), 7,20 (триплет, 1H).
13C-ЯМР (CDCl3, свободное основание) d 20,1, 28,2, 46,1, 47,6, 54,7, 55,0, 55,1, 63,9, 110,8, 111,1, 112,8, 118,5, 124,8, 127,2, 129,13, 129,18, 130,2, 143,9, 156,0, 159,6.
Пример 89. Дихлоргидрат цис-3-(5-хлор-2-метоксибензил) амино-2-(3-хлорфенил) пиперидина.
C19H2Cl2N2O•2HCl, т.пл. 270-273oC (6%).
1H-ЯМР (DMCO-d6, соль 2 HCl) d 1,39-1,65 (мультиплет, 3H), 1,87 (мультиплет, 4H), 2,13 (дублет, 1H), 2,77 (триплет, 2H), 3,21-3,66 (мультиплет, 6H), 3,84 (синглет, 1H), 6,60 (дублет, 1H, J 8,7 Гц), 6,94 (дублет, 1H, J 2,6 Гц), 7,07-7,27 (мультиплет, 5H).
Пример 90. (+)-(2S,3S)-3-Амино-2-фенилпиперидин.
В бутыль помещают 10 г 10% палладия на угле, 100 мл метанола, 150 мл этанола, 3,5 мл концентрированной соляной кислоты и 5 г хлористоводородной соли названного выше соединения примера 64. Смесь встряхивают в атмосфере водорода (40 psi 2,81 кг/см2) в течение ночи, к системе добавляют 5 г дополнительного количества катализатора и смесь встряхивают в атмосфере водорода в течение 3 дней. Смесь разбавляют водой, фильтруют через диатомовую землю (Целит (торговая марка) и Целит (торговая марка) промывают с помощью H2O. Фильтрат концентрируют, чтобы удалить большую часть спирта, оставшуюся жидкость экстрагируют хлороформом и хлороформные экстракты высушивают (сульфат натрия) и концентрируют, чтобы получить 2,16 г названного выше соединения.
[α]D (соль HCl) +62,8o (с 0,46, MeOH)
1H-ЯМР (CDCl3) δ 1,68 (мультиплет, 4H), 2,72 (мультиплет, 1H), 2,95 (мультиплет, 1H), 3,16 (мультиплет, 1H), 3,80 (дублет, 1H, J 3 Гц), 7,24 (мультиплет, 5H).
HRMS: Вычислено для C11H16N2: 176, 1310. Найдено: 176, 1309.
Вычислено для C11H16N2•2HCl•1/3 H2O: C 51,78, H 7,36, N 10,98
Найдено: C 51,46, H 7,27, N 10,77.
Пример 91. (+)-(2S,3S)-3-(2,5-Диметоксибензил) амино-2-фенилпиперидин.
В атмосфере азота в круглодонную колбу помещают 600 мг (3,4 ммоль) (+)-(2S, 3S)-3-амино-2-фенилпиперидина, 8 мл уксусной кислоты и 662 мг (3,7 ммоль) 2,5-диметоксибензальдегида, и смесь перемешивают в течение 30 минут. К системе добавляют 1,58 г (7,5 ммоль) триацетоксиборгидрида натрия и смесь перемешивают при комнатной температуре в течение ночи. Смесь концентрируют, подщелачивают с помощью 1 M водной гидроокиси натрия и экстрагируют хлористым метиленом. Метиленхлоридные экстракты промывают водой и экстрагируют 1 М водной соляной кислотой. Экстракты солянокислые подщелачивают с помощью 1 М гидроокиси натрия и экстрагируют хлористым метиленом. Метиленхлоридные экстракты высушивают (сульфатом натрия) и концентрируют, чтобы получить 528 мг бесцветного масла. Масло растворяют в хлористом метилене и к раствору добавляют эфир, насыщенный хлористым водородом. Получающееся белое твердое вещество собирают фильтрацией и перемешивают в изопропаноле при 60oC в течение 2 часов. Фильтрация дает 414 мг названного выше соединения в виде его гидрохлорида. Дополнительное количество вещества (400 мг) получают экстракцией начального щелочного слоя дополнительным количеством хлористого метилена, высушивая (сульфатом натрия) и концентрируя экстракт.
[α]D (соль HCl) +60,5o (с 0,58, CH3OH).
1H-ЯМР (CDCl3) δ 1,38 (мультиплет, 1H), 1,58 (мультиплет, 1H), 1,88 (мультиплет, 1H), 2,13 (мультиплет, 1H), 2,78 (мультиплет, 2H), 3,25 (мультиплет, 1H), 3,36 (дублет, 1H, J 18 Гц), 3,44 (синглет, 3H), 3,62 (дублет, 1H, J 18 Гц), 3,72 (синглет, 3H), 3,88 (дублет, 1H, J 3 Гц), 6,62 (мультиплет, 3H), 7,24 (мультиплет, 5H).
Масс-спектр: м/е 326 (сигнал, соответствующий недиссоциированной молекуле). Вычислено для C20H26N2O2•2HCl•0,25H2O: C 59,48, H 7,11, N 6,93.
Найдено: C 59,33, H 6,91 N 7,23.
Пример 92. 3-(2-Метокси-5-метилбензил) амино-2-фенилпиперидин.
A. 3-(2-Метокси-5-метилбензил) амино-2-фенилпиперидин.
В атмосфере азота в круглодонную колбу помещают 1,5 г (10 ммоль) 2- метокси-5-метилбензальдегида и 22 мл уксусной кислоты. К системе, охлажденной в ледяной бане, добавляют 3,6 г (17 ммоль) по частям триацетоксиборгадрида натрия. Смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь концентрируют и разделяют на части по слоям между водной гидроокисью натрия и хлористым метиленом. Слои разделяют, водную фазу экстрагируют хлористым метиленом и объединенные органические фракции высушивают (сульфатом натрия) и концентрируют, чтобы получить 2,5 г коричневого масла. Сырой продукт реакции очищают флеш-хроматографией на колонке, используя 5:1 смесь гексаны/этилацетат в качестве элюента, чтобы получить 1,65 г названного выше соединения в виде желтого масла.
1H-ЯМР (CDCl3) d 2,22 (синглет, 3H), 3,72 (синглет, 3H), 4,24 (дублет, 2H, J 4 Гц), 4,73 (уширенный триплет, 1H), 6,70 (дублет, 1H, J 5 Гц), 7,0 (мультиплет, 4H), 7,33 (мультиплет, 1H), 7,44 (мультиплет, 2H), 7,59 (дублет, 2H, J 4 Гц), 7,99 (дублет, 1H, J 1 Гц).
B. 3-(2-метокси-5-метилбензил) амино-2-фенилпиперидин.
В бутыль помещают 600 мг (1,97 ммоль) названного выше соединения примера 92 A, 32 мл этанола, 118 мкл (2,07 ммоль) уксусной кислоты и 30 мг окиси платины (встряхивают в атмосфере водорода приблизительно 40 psi 2,81 кг/см2). В течение примерно 30 часов. Во время этого периода времени в систему добавляют дополнительное количество (270 мг) окиси платины и уксусной кислоты (примерно 18 мл). Реакционную смесь фильтруют через диатомовую землю (Целит (торговая марка)), отжатый на фильтре осадок промывают атанолом и фильтрат концентрируют. Остаток разделяют на части по слоям между хлористым метиленом и водной гидроокисью натрия (1 М раствором). Слои разделяют и водную фазу экстрагируют хлористым метиленом. Объединенные органические фракции высушивают (сульфатом натрия) и концентрируют, чтобы получить 540 мг желтого масла. Это масло разделяют по слоям между хлористым метиленом и 1 М водной соляной кислотой, слои разделяют и органическую фазу экстрагируют 1 М соляной кислотой. Объединенные водные экстракты промывают хлористым метиленом и подщелачивают 1 М водной гидроокисью натрия. Водный раствор экстрагируют хлористым метиленом и экстракты высушивают (сульфатом натрия) и концентрируют. Получающееся масло очищают флеш-хроматографией на колонке, используя 4,5-5% метанол в хлороформе в качестве элюента, чтобы получить 110 мг названного выше соединения, которое превращает в его солянокислую соль. Т.пл. 245- 247oC.
1H-ЯМР (CDCl3) d 1,30-1,42 (мультиплет, 1H), 1,48- 1,98 (мультиплет, 2H), 2,04-2,16 (мультиплет, 1H), 2,18 (синглет, 3H), 2,68-2,7 (мультиплет, 2H), 3,18-3,30 (мультиплет, 1H), 3,35 (дублет, 1H, J 12 Гц), 3,40 (синглет, 3H), 3,58 (дублет, 1H, J 12 Гц), 3,85 (1H, дублет, J 3 Гц), 6,53 (дублет, 1H, J 8 Гц), 6,71 (дублет, 1H, J 2 Гц), 6,88 (два дублета, 1H, J4 и 10 Гц), 7,14-7,26 (мультиплет, 5H),
HRMS: Вычислено для C20H26N2O: 310, 2041.
Найдено: 310, 2024.
Анализ: Вычислено для C20H26N2O•2HCl•1,2H2O: C 59,31, H 7,56, N 6,92. Найдено: C 59,31, H 7,40, N 6,85.
Пример 93. (2S, 3S)-1-(3-Цианопроп-1-ил)-3-(2-метоксибензил) амино-2- фенилпиперидин.
Названное соединение получают по методике, аналогично таковой примера 2, заменяя аллил бромистый 4-бромбутиронитрилом. Т.пл. 63-67oC (разл.).
1H-ЯМР (CDCl3) d 1,40 (мультиплет, 2H), 1,80 (мультиплет, 6H), 2,12 (мультиплет, 1H), 2,23 (мультиплет, 1H), 2,52 (мультиплет, 2H), 3,08 (мультиплет, 1H), 3,21 (дублет, 1H, J 3 Гц), 3,34 (дублет, 1H, J 13 Гц), 3,40 (синглет, 3H), 3,60 (дублет, 1H, J 13 Гц), 6,58 (дублет, 1H, J 9 Гц), 6,68 (триплет, 1H, J 6 Гц), 6,78 (дублет, 1H, J 6 Гц), 7,02 (триплет, 1H, J 9 Гц), 7,20 (мультиплет, 5H).
Масс-спектр: м/е 363 (сигнал, соответствующий недиссоциированной молекуле).
Пример 94. (2S,3S)-1-(4-Аминобут-1-ил)-3-(2-метоксибензил) амино-2- фенилпиперидин.
Названное соединение примера 93 (1,9 г) растворяют в 10 мл уксусной кислоты в бутыли. К системе добавляют 1,9 г 5% платину на угле (60% воды) и смесь встряхивают в атмосфере водорода (40 psi 2,81 кг/см2) в течение 4 часов. Смесь разбавляют этанолом, фильтруют через диатомовую землю (Целит (торговая марка)) и фильтрат концентрируют. К остатку добавляют насыщенный водный раствор бикарбоната натрия до тех пор, пока pH смеси не станет примерно 8 и смесь экстрагируют хлороформом. Хлороформные экстракты высушивают (сульфатом натрия) и концентрируют, чтобы получить 1,6 г названного соединения в виде масла.
1H-ЯМР (CDCl3) d 1,50 (мультиплет, 8H), 2,02 (мультиплет, 3H), 2,52 (мультиплет, 3H), 3,18 (мультиплет, 1H), 3,26 (дублет, 1H, J3 Гц), 3,32 (дублет, 1H, J 15 Гц), 3,43 (синглет, 3H), 3,64 (1H, дублет, J 15 Гц), 4,77 (уширенный синглет, 2H), 6,60 (дублет, 1H, J 9 Гц), 6,71 (триплет, 1H, J 6 Гц), 6,82 (дублет, 1H, J 6 Гц), 7,07 (триплет, 1H, J 9 Гц), 7,26 (мультиплет, 5H).
Масс-спектр: м/е 367 (сигнал, соответствующий недиссоциированной молекуле).
Пример 95. (2S,3S)-3-(2-Метоксибензил)амино-1-[4-(2-нафтамидо-бут-1-ил] -2- фенилпиперидин.
В атмосфере азота в круглодонную колбу помещают 100 мг (0,27 ммоль) названного соединения примера 94 и 0,5 мл хлористого метилена, и систему охлаждают в ледяной бане. К системе добавляют 38 мкл (0,27 ммоль) хлорангидрида 2-нафтойной кислоты и смесь перемешивают в течение 20 минут. Смесь выливают в насыщенный водный раствор бикарбоната натрия и экстрагируют хлороформом. Хлороформные экстракты высушивают (сульфатом натрия) и концентрируют, чтобы получить 150 мг масла. Сырой продукт реакции очищают флеш-хроматографией на колонке (6 г силикагеля), используя 1:10 смесь метанол/хлороформ в качестве элюента, чтобы получить 71 мг названного соединения, которое превращают в его хлористоводородную соль. Т.пл. 105-107oC (разл.).
1H-ЯМР (CDCl3) d 1,50 (мультиплет, 6H), 1,70 (мультиплет, 2H), 2,04 (мультиплет, 3H), 2,60 (мультиплет, 2H), 3,22 (мультиплет, 1H), 3,30 (дублет, 1H, J 1 Гц), 3,40 (мультиплет, 5H), 3,68 (дублет, 1H, J 15 Гц), 6,28 (уширенный синглет, 1H), 6,61 (дублет, 1H, J9 Гц), 6,72 (триплет, 1H, J 6 Гц), 6,84 (дублет, 1H, J 6 Гц), 7,08 (1H, триплет, J 9 Гц), 7,26 (мультиплет, 5H), 7,52 (мультиплет, 2H), 7,82 (мультиплет, 4H), 8,22 (синглет, 1H).
Масс-спектр: м/е 521 (сигнал, соответствующий недиссоциированной молекуле).
Пример 96. (2S, 3S)-3-(2-Метоксибензил) амино-1-[N-нафт-2-ил-метил)-4- аминобут-1-ил)]-2-фенилпиперидин.
Названное соединение примера 95 обрабатывают борандиметилсульфидным комплексом, применяя условия, аналогичные таковым, описанным в примере 1B, чтобы получить названное выше соединение.
Пример 97. (2RS,ЗRS-1-(5-Карбоэтоксипент-1-ил)-3-(2-метоксибензил) амино-2-фенилпиперидин.
Названное выше соединение получают по методике, аналогично описанной в примере 2, заменяя аллил бромистый на этиловый эфир 6-бромгексановой кислоты. Т.пл. 80-95oC.
1H-ЯМР (CDCl3) d 1,12 (мультиплет, 5H), 1,42 (мультиплет, 6H), 1,72 (мультиплет, 1H), 1,98 (мультиплет, 3H), 2,16 (триплет, 2H, J 7 Гц), 2,46 (мультиплет, 1H), 2,54 (мультиплет, 1H), 3,15 (мультиплет, 1H), 3,23 (мультиплет, 1H, J 3 Гц), 3,30 (дублет, 1H, J 15 Гц), 3,41 (синглет, 3H), 3,60 (дублет, 1H, J 15 Гц), 4,02 (квартет, 2H, J 6 Гц), 6,58 (дублет, 1H, J 9 Гц), 6,78 (триплет, 1H, J 6 Гц), 6,80 (дублет, 1H, J 6 Гц), 7,04 (триплет, 1H, J 9 Гц), 7,22 (мультиплет, 5H).
Масс-спектр: м/е 438 (сигнал, соответствующий недиссоциированной молекуле).
Пример 98. (2RS, ЗRS)-1-(6-Гидроксигекс-1-ил)-3-(2-метоксибензил) амино-2-фенилпиперидин.
В атмосфере азота в круглодонную колбу помещают 95 мг (0,22 ммоль) названного соединения примера 97 и 1 мл ТГФ. Систему охлаждают в бане со льдом и ацетоном, к системе добавляют 0,44 мл (0,44 ммоль) 1 М раствора литийалюминийгидрида в эфире и смесь перемешивают в течение 10 минут. Охлаждающую баню удаляют, смесь перемешивают при комнатной температуре в течение 20 минут и охлаждающую баню ставят обратно. В системе осторожно добавляют примерно 0,4 мл 2 М водной гидроокиси натрия и смесь перемешивают при комнатной температуре в течение 20 минут. К системе добавляют сульфат натрия, смесь перемешивают в течение 30 минут, твердые вещества удаляют фильтрацией путем отсасывания и фильтрат концентрируют. Сырой продукт реакции очищают флеш-хроматографией на колонке (5 г силикагеля), используя 3:47 смесь метанол-хлороформ в качестве элюента, чтобы получить 49 мг названного выше соединения. Т.пл. (соль HCl) 67-68oC (разл.).
1H-ЯМР (CDCl3) d 1,18 (мультиплет, 4H), 1,42 (мультиплет, 4H), 1,72 (мультиплет, 1H), 2,00 (мультиплет, 5H), 2,50 (мультиплет, 2H), 3,16 (мультиплет, 1H), 3,23 (дублет, 1H, J 3 Гц), 3,30 (дублет, 1H, J 15 Гц), 3,41 (синглет, 3H), 3,52 (триплет, 2H, J 6 Гц), 3,62 (дублет, 1H, J 15 Гц), 6,58 (дублет, 1HJ 9 Гц), 6,69 (триплет, 1H, J 6 Гц), 6,81 (дублет, 1H, J6 Гц), 7,05 (триплет, 1H, J 9 Гц), 7,22 (мультиплет, 5H).
Масс-спектр: м/е 396 (сигнал, соответствующий недиссоциированной молекуле).
Пример 99. (2S,3S)-1-(5-Карбоксипентил)-3-(2-метоксибензил) амино- 2-фенилпиперидин,
(2S, 3S)-1-(5-Карбоэтоксипентил)-3-(2-метоксибензил) амино-2- фенилпиперидин получают по способу примера 97, используя индивидуальный энантиомеру (2S, 3S)-3-(2-метоксибензил) амино-2-фенилпиперидин вместо соответствующего рацемата. В круглодонную колбу помещают 250 мг этого сложного эфира и 8 мл 4М водной соляной кислоты. Реакционную смесь нагревают при 60oC в течение 2 часов и концентрируют. Сырой продукт реакции растирают в порошок с помощью эфира и смеси изопропанол/эфир, чтобы получить названное выше соединение в виде его хлористоводородной соли.
1H-ЯМР (DMCO-d6) d 1,14 (мультиплет, 2H), 1,40 (мультиплет, 2H), 1,78 (мультиплет, 3H), 2,36 (мультиплет, 10H), 3,00 (мультиплет, 1H), 3,80 (мультиплет, 4H), 4,22 (мультиплет, 1H), 6,98 (мультиплет, 2H), 7,38 (мультиплет, 2H), 7,60 (мультиплет, 3H), 7,92 (м, 2H). HRMS: Вычислено для C25H34N2O3: 410, 2569. Найдено: 410, 2546.
Пример 100. (2S, 3S)-3-(2-Метоксибензил) амино-1-(N-метил-5- карбоксамидопент-1-ил)-2-фенилпиперидин.
В атмосфере азота в круглодонную колбу помещают 75 мг (0,17 ммоль) названного соединения примера 99 и 0,5 мл ТГФ. К этой перемешиваемой суспензии добавляют 47 мкл (0,34 ммоль) триэтиламина и 54 мг (0,34 ммоль) N,N-карбонилдиимидазола. Реакционную смесь перемешивают в течение 30 минут и концентрируют. К системе добавляют 0,25 мл 40%-ного раствора метиламина в воде. Реакционную смесь перемешивают в течение 30 минут и выливают в смесь насыщенного водного раствора бикарбоната натрия и хлороформа. Смесь экстрагируют хлороформом и хлороформные экстракты высушивают (сульфатом натрия) и концентрируют. Сырой продукт реакции очищают флеш-хроматографией на колонке (5 г силикагеля), используя 1: 9 смесь метанол/хлороформ в качестве элюента, чтобы получить 36 мг названного выше соединения в виде масла.
1H-ЯМР d 1,14 (мультиплет, 2H), 1,48 (мультиплет, 6H), 1,82 (1H, мультиплет), 2,04 (мультиплет, 5H), 2,32 (мультиплет, 2H), 2,72 (дублет, 3H, J 5 Гц), 3,18 (мультиплет, 1H), 3,27 (дублет, 1H, J 3 Гц), 3,32 (дублет, 1H, J 15 Гц), 3,44 (синглет, 3H), 3,66 (дублет, 1H, J 15 Гц), 6,61 (дублет, 1H, J 9 Гц), 6,72 (триплет, 1H, J 6 Гц), 6,83 (дублет, 1H, J 6 Гц), 7,08 (триплет, 1H, J 9 Гц), 7,24 (мультиплет, 5H).
Масс-спектр: м/е 423 (сигнал, соответствующий недиссоциированной молекуле).
Пример 101. (2S,3S)-1-[4-(4-Фторфенил)-4-оксобут-1-ил] -3-(2- метоксибензил) амино-2-фенилпиперидин.
Названное соединение получают по методике, аналогично описанной в примере 2, заменяя аллил бромистый на 4-йодо-бутил-4- фторфенилетон. Т.пл. 59-69oC (разл.).
1H-ЯМР (CDCI3) d 1,46 (мультиплет, 2H), 1,96 (мультиплет, 6H), 2,58 (мультиплет, 2H), 2,84 (мультиплет, 2H), 3,24 (мультиплет, 1H), 3,30 (дублет, 1H, J 3 Гц), 3,38 (дублет, 1H, J 16 Гц), 3,44 (3H, синглет), 3,68 (дублет, 1H, J 16 Гц), 6,62 (дублет, 1H, J 9 Гц), 6,72 (триплет, 1H, J 6 Гц), 6,84 (дублет, 1H, J 6 Гц), 7,08 (3H, мультиплет), 7,27 (мультиплет, 5H), 7,92 (мультиплет, 2H).
HRMS: Вычислено для C29H33N2O2F: 460, 2532. Найдено: 460, 2528.
Пример 102. (2S,3S)-1-[4-(4-Фторфенил)-4-гидроксибут-1-ил]-3-(2- метоксибензил) амино-2-фенилпиперидин.
В атмосфере азота в круглодонную колбу помещают 569 мг (1,24 ммоль) названного соединения примера 101 и 2,5 мл метанола и систему охлаждают в ледяной бане. К системе добавляют 47 мг (1,24 ммоль) борогидрида натрия двумя порциями. Смесь перемешивают в течение 30 минут, добавляют 12 мг борогидрида натрия и смесь перемешивают в течение 30 минут. К системе добавляют 0,5 мл насыщенного водного раствора бикарбоната натрия. Смесь разбавляют хлороформом, оставляют нагреваться до комнатной температуры и выливают в смесь хлороформа и насыщенного водного раствора бикарбоната натрия. Смесь экстрагируют хлороформом, высушивают (сульфатом натрия) и концентрируют, чтобы получить 500 мг масла. Сырой продукт реакции очищают флеш-хроматографией на колонке (20 г силикагеля), используя 1:19 смесь метанол/хлороформ в качестве элюента, чтобы получить 295 мг названного выше соединения, которое превращают в его метансульфонатную соль.
1H-ЯМР (CDCl3) d 1,50 (мультиплет, 4H), 1,94 (мультиплет, 6H), 2,40 и 2,55 (2 мультиплета, 1H), 2,72 (мультиплет, 1H), 2,98 и 3,40 (2 мультиплета, 3H), 3,52 (синглет, 3H), 3,66 (мультиплет, 1H), 4,57 и 4,71 (2 мультиплета, 1H), 6,62 (дублет, 1H, J 9 Гц), 6,70 (мультиплет, 1H), 6,94 (мультиплет, 3H), 7,08 (мультиплет, 1H), 7,28 (мультиплет, 6H), 7,46 (мультиплет, 1H).
HRMS: Вычислено для C29H35N2O2F: 462, 2678. Найдено: 462, 2688.
Пример 103. (2S,3S)-1-(5,6-Диметилметилендиоксигекс-1-ил)-3-(2- метоксибензил) амино-2-фенилпиперидин.
Названное соединение получают по методике, аналогично описанной в примере 2, заменяя аллил бромистый на 5,6-диметилендиокси- 1-метилсульфонилоксигексан.
1H-ЯМР (CDCl3) d 1,34 (синглет, 3H), 1,40 (синглет, 3H), 1,44 (мультиплет, 4H), 1,76 (мультиплет, 2H), 2,00 (мультиплет, 3H), 2,50 (мультиплет, 2H), 3,17 (мультиплет, 1H), 3,25 (мультиплет, 1H), 3,32 (дублет, 1H, J 15 Гц), 3,44 (синглет, 3H), 3,48 (мультиплет, 2H), 3,60 (мультиплет, 1H), 3,98 (мультиплет, 4H), 6,58 (дублет, 1H, J 9 Гц), 6,70 (триплет, 1H, J 6 Гц), 6,80 (дублет, 1H, J 6 Гц), 7,05 (триплет, 1H, J 9 Гц), 7,24 (мультиплет, 5H).
Пример 104. (2S, 3S)-1-(5,6-Дигидроксигекс-1-ил)-3-(2- метоксибензил) амино-2-фенилпиперидин.
В круглодонную колбу помещают 3,2 г названного соединения примера 103 и 100 мл 1:1 смеси метанола и хлористого метилена. К системе добавляют 50 мл хлористого метилена, насыщенного хлористым водородом, и реакционной смеси позволяют стоять при комнатной температуре в течение 3 часов и концентрируют. Остаток растворяют в горячем изопропаноле и добавляют эфир. Растворитель сливают с получающейся смолы и отбрасывают. Смолу растирают в порошок с помощью горячего изопропанола/эфира и этот растворитель оставляют стоять. Получающуюся смесь растирают до образования твердого вещества (630 мг). Источник концентрируют и остаточное масло растирают в порошок с помощью горячего изопропанола/эфира и эфира, чтобы получить твердое вещество (850 мг). Каждую из этих партий продукта реакции перемешивают в 50 мл эфира в течение 2 часов и растворитель удаляют с помощью пипетки. Последнее твердое вещество дополнительно очищают разделением по слоям между хлористым метиленом и 1 М водным раствором гидроокиси натрия, экстракцией водной фазы хлористым метиленом, высушиванием (сульфатом натрия) и концентрированием объединенных органических фракций и обработкой остатка хлористо-метиленового раствора эфирным раствором хлористого водорода. Эта последовательность обработок дает 710 мг названного выше соединения (гидрохлорид) в виде весьма гигроскопичного не совсем белого твердого вещества.
1H-ЯМР (CDCl3) d 1,34 (мультиплет, 8H), 1,80 (мультиплет, 1H), 2,08 (мультиплет, 3H), 2,54 (мультиплет, 4H), 3,20 (мультиплет, 1H), 3,34 (мультиплет, 2H), 3,44 (синглет, 3H), 3,56 (мультиплет, 1H), 3,66 (дублет, 1H, J 12 Гц), 6,60 (дублет, 1H, J 9 Гц), 6,74 (1H, триплет, J 6 Гц), 6,84 (дублет, 1H, J 6 Гц), 7,09 (триплет, 1H, J 9 Гц), 7,26 (мультиплет, 5H).
HRMS: Вычислено для C25H36N2O3: 412, 2726. Найдено: 412, 2699.
Названное соединение примеров 105 и 106 получают по методике, подобно описанной в примере 1.
Пример 105. (2RS,3RS,5SR)-3-(2-Метоксибензиламино)-5-метил-2-фенилпиперидин.
Т.пл. 179-181oC (соль HCl, разл.).
1H-ЯМР (CDCl3) d 7,20 (мультиплет, 6H), 7,00 (дублет, 1H, J 7 Гц), 6,76 (триплет, 1H, J 7 Гц), 6,66 (дублет, 1H, J 6 Гц), 3,97 (дублет, 1H, J 2 Гц), 3,64 (дублет, 1H, J 12 Гц), 3,51 (дублет, 1H, J 12 Гц), 3,48 (синглет, 3H), 2,84 (мультиплет, 3H), 1,78 (мультиплет, 3H), 1,13 (дублет, 3H, J 7 Гц).
HRMS: Вычислено для C20H26N2O: 310, 2045. Найдено: 310, 2101.
Пример 106. (2RS,3RS,5RS)-3-(2-Метоксибензиламино)-5-метил-2- фенилпиперидин.
Т.пл. 248-249oC (соль HCl, разл.).
1H-ЯМР (CDCl3) d 7,18 (мультиплет, 5H), 7,07 (триплет, 1H, J 7 Гц), 6,90 (дублет, 1H, J 7 Гц), 6,72 (триплет, 1H, J 7 Гц), 6,60 (дублет, 1H, J 7 Гц), 3,77 (дублет, 1H, J 2 Гц), 3,60 (дублет, 1H, J 12 Гц), 3,38 (синглет, 3H), 3,34 (синглет, 1H, J 12 Гц), 3,14 (мультиплет, 1H), 2,77 (мультиплет, 1H), 2,32 (триплет, 1H, J 10 Гц), 2,02 (мультиплет, 2H), 1,18 (мультиплет, 1H), 0,81 (дублет, 3H, J 6 Гц).
HRMS: Вычислено для C20H26N2O: 310, 2045. Найдено: 310, 2076.
Вычислено для C20H26N2O•2HCl•2/3H2O: C 60,75, H 7,47, N 7,09. Найдено: C 60,78, H 7,32 N 6,84.
Пример 107. Цис-3-(2,5-диметоксибензиламино)-1-[4-(4-фторфенил)- 4-оксобут-1-ил]-2-фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 101.
1H-ЯМР (CDCl3) d 1,38 (мультиплет, 2H), 1,86 (мультиплет, 6H), 2,50 (мультиплет, 2H), 1,86 (мультиплет, 6H), 2,50 (мультиплет, 2H), 2,74 (мультиплет, 2H), 3,16 (синглет, 1H), 3,26 (мультиплет, 2H), 3,38 (синглет, 3H), 3,54 (мультиплет, 4H), 6,50 (мультиплет, 3H), 7,00 (мультиплет, 2H), 7,16 (мультиплет, 5H), 7,82 (мультиплет, 2H).
HRMS: Вычислено для C30H35N2FO: 490, 2629.
Найдено: 490, 2633.
Вычислено для C30H35N2O3F•2CH3SO3H •4,75H2O: C 50,01, H 6,88 N 3,64.
Найдено: C 49,93, H 6,52, N 3,56.
Пример 108. Цис-3-(4,5-Дифтор-2-метоксибензиламино)-2-фенил-пиперидин.
Названное соединение получают по методике, подобно описанной в примере 91.
1H-ЯМР (CDCl3) d 1,30 (мультиплет, 1H), 1,62 (мультиплет, 2H), 1,96 (мультиплет, 1H), 2,68 (мультиплет, 2H), 3,18 (мультиплет, 2H), 3,32 (синглет, 3H), 3,44 (дублет, 1H, J 14 Гц), 3,82 (дублет, 1H, J 3 Гц), 6,38 (два дублета, 1H, J 6 и 12 Гц), 6,66 (два дублета, 1H, J 8 и 10 Гц), 7,16 (мультиплет, 5H).
HRMS: Вычислено для C19H22N2OF2: 332, 1697.
Найдено: 332, 1698.
Вычислено для C19H22N2OF2•2HCl•0,85 H2O: C 54,25, H 6,15, N 6,66. Найдено: C 54,26, H 5,84, N 6,94.
Пример 109. Цис-3-(2-хлор-4-фторбензиламино)-2-фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 91.
1H-ЯМР (CDCl3) d 1,44 (мультиплет, 1H), 2,06 (мультиплет, 1H), 2,78 (мультиплет, 2H), 3,24 (мультиплет, 1H), 3,40 (дублет, 1H, J 12 Гц), 3,58 (дублет, 1H, J 12 Гц), 3,88 (дублет, 1H, J 3 Гц), 6,75 (мультиплет, 1H), 6,92 (мультиплет, 1H), 7,26 (мультиплет, 5H).
HRMS: Вычислено для C18H20N2 35ClF: 318, 1294.
Найдено: 318, 1280.
Пример 110. Цис-3-(2-этоксибензиламино)-2-фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 91.
1H-ЯМР (CDCl3) d 1,10 (триплет, 3H, J 5 Гц), 1,40 (мультиплет, 1H), 1,62 (мультиплет, 1H), 1,90 (мультиплет, 1H), 2,14 (мультиплет, 1H), 2,80 (мультиплет, 2H), 3,27 (мультиплет, 1H), 3,38 (дублет, 1H, J 15 Гц), 3,69 (мультиплет, 3H), 3,86 (дублет, 1H, J 2 Гц), 6,64 (дублет, 1H, J 8 Гц), 6,78 (триплет, 1H, J 6 Гц), 6,94 (1H, дублет, J 6 Гц), 7,12 (триплет, 1H, J 8 Гц), 7,24 (мультиплет, 5H).
HRMS: Вычислено для C20H26N2O: 310, 2041.
Найдено: 310, 2045.
Пример 111. Цис-3-(2-гидроксибензиламино)-2-фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 91.
1H-ЯМР (CDCl3) d 1,62 (мультиплет, 3H), 2,10 (мультиплет, 1H), 2,79 (мультиплет, 1H), 2,92 (мультиплет, 1H), 3,20 (мультиплет, 1H), 3,48 (синглет, 2H), 3,82 (дублет, 1H, J 2 Гц), 6,72 (мультиплет, 3H), 7,08 (мультиплет, 1H), 7,36 (мультиплет, 5H).
HRMS: Вычислено для C18H22N2O: 282, 1732.
Найдено: 282, 1724.
Вычислено для C18H22N2O•2HCl•2H2O: C 55,26, H 7,20 N 7,16 Найдено: C 55,13, H 7,12 N 6,84.
Пример 112. Цис-3-(3,5-дифтор-2-метоксибензиламино)-2-фенилпиперидин,
Названное соединение получают по методике, подобно описанной в примере 91.
1H-ЯМР (CDCl3) d 1,5 (мультиплет, 1H), 1,64 (мультиплет, 1H), 1,86 (мультиплет, 1H), 2,08 (мультиплет, 1H), 2,80 (мультиплет, 2H), 3,24 (мультиплет, 1H), 3,44 (дублет, 1H, J 15 Гц), 3,54 (дублет, 1H, J 15 Гц), 3,68 (синглет, 3H), 3,90 (дублет, 1H, 3 Гц), 6,57 (два дублета, 1H, J 8 и 9 Гц), 6,69 (два дублета, 1H, J 9 и 12 Гц), 7,28 (мультиплет, 5H).
HRMS: Вычислено для C19H22N2OF2: 332, 1698.
Найдено: 332, 1700.
Вычислено для C19H22N2OF2•2HCl: C 56,30, H 5,97, N 6,92.
Найдено: C 56,17, H 5,84, N 6,59.
Пример 113. Цис-3-(2-хлор-6-фторбензиламино)-2-фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 91.
1H-ЯМР (CDCl3) d 1. 40 (мультиплет, 1H), 1,66 (мультиплет, 1H), 1,90 (мультиплет, 1H), 2,15 (мультиплет, 1H), 2,78 (мультиплет, 2H), 3,26 (мультиплет, 1H), 3,68 (дублет,
2H, J 18 Гц), 3,72 (дублет, 1H, J 18 Гц), 6,82 (мультиплет, 1H), 7,04 (мультиплет, 2H), 7,22 (мультиплет, 5H).
HRMS: Вычислено для C18H20N2ClF•2HCl•2/3H2O: C 53,56, H 5,83, N 6,95. Найдено: C 53,63, H 5,53, N 6,83.
Пример 114. (2S,3S)-3-(5-хлор-2-метоксибензиламино)-2-фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 91. Т.пл. 275-277oC (соль HCl).
1H-ЯМР (CDCl3) d 1,40 (мультиплет, 1H), 1,60 (мультиплет, 1H), 1,90 (мультиплет, 1H), 2,08 (мультиплет, 1H), 2,79 (мультиплет, 2H), 3,26 (мультиплет, 1H), 3,36 (дублет, 1H, J 15 Гц), 3,45 (синглет, 3H), 3,60 (дублет, 1H, J 15 Гц), 3,88 (дублет, 1H, J 3 Гц), 6,56 (дублет, 1H, J 8 Гц), 6,92 (дублет, 1H, J 3 Гц), 7,06 (два дублета, 1H, J 3 и 8 Гц), 7,28 (мультиплет, 5H).
Масс-спектр: м/е 330 (сигнал, соответствующий недиссоциированной молекуле).
Пример 115. Цис-3-(5-хлор-2-метоксибензиламино)-2- фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 91.
1H-ЯМР (CDCl3) d 1,37 (мультиплет, 1H), 1,56 (мультиплет, 1H), 1,86 (мультиплет, 1H), 2,06 (мультиплет, 1H), 2,76 (мультиплет, 2H), 3,23 (мультиплет, 1H), 3,32 (дублет, 1H, J 15 Гц), 3,42 (синглет, 3H), 3,58 (дублет, 1H, J 15 Гц), 3,85 (дублет, 1H, J 3 Гц), 6,54 (дублет, 1H, J 8 Гц), 6,90 (дублет, 1H, J 3 Гц), 7,04 (два дублета, 1H, J 3 и 8 Гц), 7,24 (мультиплет, 5H).
Пример 116. (2S, 3S)-1-(5-Ацетамидопент-1-ил)-3-(2-метоксибензил-амино)-2- фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 95.
1H-ЯМР (CDCl3) d 1,14 (мультиплет, 2H), 1,40 (мультиплет, 5H), 1,86 (мультиплет, 1H), 1,91 (синглет, 3H), 2,00 (мультиплет, 3H), 2,52 (мультиплет, 2H), 3,12 (мультиплет, 3H), 3,22 (дублет, 1H, J3 Гц), 3,34 (дублет, 1H, J 15 Гц), 3,42 (синглет, 3H), 3,62 (1H, дублет, J 15 Гц), 6,60 (дублет, 1H, J 9 Гц), 6,70 (триплет, 1H, J 9 Гц), 6,82 (дублет, 1H, J 6 Гц), 7,06 (триплет, 1H, H 6 Гц), 7,22 (мультиплет, 5H).
HRMS: Вычислено для C26H37N3O2: 423, 2885.
Найдено: 423, 2869.
Пример 117. (2S,3S)-1-(5-Аминопент-1-ил-3-(2-метоксибензиламино)- 2-фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 94.
1H-ЯМР (CDCl3) d 1,30 (мультиплет, 7H), 1,76 (мультиплет, 3H), 2,02 (мультиплет, 3H), 2,54 (мультиплет, 3H), 3,02 (мультиплет, 1H), 3,28 (дублет, 1H, J 3 Гц), 3,36 (дублет, 1H, J 15 Гц), 3,46 (3H, синглет), 3,66 (дублет, 1H, J 15 Гц), 6,60 (дублет, 1H, J 6 Гц), 6,72 (триплет, 1H, J 6 Гц), 6,83 (дублет, 1H, J 6 Гц), 7,08 (1H, триплет, J 6 Гц), 7,24 (мультиплет, 5H).
HRMS: Вычислено для C24H35N3O: 381, 2780.
Найдено: 381, 2755.
Пример 118. (2S,3S)-1-(5-Бензамидопент-1-ил)-3-(2-метоксибензил-амино) -2-фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 95.
1H-ЯМР (CDCl3) d 1,40 (мультиплет, 8H), 1,96 (мультиплет, 5H), 2,54 (мультиплет, 2H), 3,34 (мультиплет, 7H), 3,80 (мультиплет, 1H), 6,61 (дублет, 1H, J 9 Гц), 6,76 (триплет, 1H, J 6 Гц), 6,88 (1H, дублет, J 9 Гц), 7,12 (триплет, 1H, J 6 Гц), 7,26 (мультиплет, 5H), 7,40 (мультиплет, 3H), 7,78 (дублет, 2H, J 6 Гц).
HRMS: Вычислено для C31H39N3O2: 485, 3042.
Найдено: 485, 3001.
Пример 119. (2S,3S)-1-(6-гидроксигекс-1-ил)-3-(2-метоксибензил-амино)-2- фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 98.
1H-ЯМР (CDCl3) d 1,22 (мультиплет, 4H), 1,48 (мультиплет, 4H), 1,84 (мультиплет, 1H), 2,10 (мультиплет, 5H), 2,54 (мультиплет, 1H), 2,62 (дублет, 1H, J 3 Гц), 3,26 (мультиплет, 1H), 3,32 (дублет, 1H, J 3 Гц), 3,39 (дублет, 1H, J 15 Гц), 3,48 (синглет, 3H), 3,60 (триплет, 2H, J 6 Гц), 3,70 (дублет, 1H, J 15 Гц), 6,66 (дублет, 1H, J 9 Гц), 6,78 (триплет, 1H, J 6 Гц), 6,89 (дублет, 1H, J 6 Гц), 7,14 (триплет, 1H, J 9 Гц), 7,28 (мультиплет, 5H).
HRMS: Вычислено для C25H36N2O2: 396, 2777.
Найдено: 396, 2738.
Пример 120. (2S,3S)-1-(5-Карбоэтоксипент-1-ил)-3-(2- метоксибензиламино)-2-фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 97.
1H-ЯМР (CDCl3) d 1,14 (мультиплет, 5H), 1,48 (мультиплет, 6H), 1,96 (мультиплет, 4H), 2,20 (триплет, 2H, J 7 Гц), 2,74 (мультиплет, 2H), 3,19 (мультиплет, 1H), 3,26 (дублет, 1H, J 3 Гц), 3,34 (дублет, 1H, J 15 Гц), 3,44 (синглет, 3H), 3,64 (дублет, 1H, J 15 Гц), 4,06 (квартет, 2H, J 6 Гц), 6,61 (дублет, 1H, J 9 Гц), 6,72 (триплет, 1H, J 6 Гц), 6,83 (дублет, 1H, J 6 Гц), 7,08 (1H, триплет, J 9 Гц), 7,22 (мультиплет, 5H).
HRMS: Вычислено для C27H38N2O3: 438, 2879.
Найдено: 438, 2839.
Пример 121. Цис-1-(5-гидроксипент-1-ил)-3-(2-метоксибензиламино)-2- фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 98.
1H-ЯМР (CDCl3) d 1,08 (мультиплет, 2H), 1,22 (мультиплет, 4H), 1,72 (мультиплет, 3H), 2,00 (мультиплет, 3H), 2,48 (мультиплет, 1H), 2,54 (мультиплет, 1H), 3,16 (мультиплет, 1H), 3,25 (дублет, 1H, J 3 Гц), 3,32 (дублет, 1H, J 15 Гц), 3,42 (синглет, 3H), 3,52 (триплет, 2H, J 6 Гц), 3,62 (дублет, 1H, J 15 Гц), 6,58 (дублет, 1H, J 9 Гц), 6,69 (триплет, 1H, J 6 Гц), 6,81 (дублет, 1H, J 6 Гц), 7,05 (триплет, 1H, J 9 Гц), 7,22 (мультиплет, 5H).
HRMS: Вычислено для C24H34N2O2: 382, 2616.
Найдено: 382, 2565.
Пример 122. Цис-1-(4-карбоэтоксибут-1-ил)-3-(2-метоксибензиламино)-2- фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 97.
1H-ЯМР (CDCl3) d 1,22 (триплет, 3H, J6 Гц), 1,46 (мультиплет, 4H), 1,74 (мультиплет, 3H), 2,02 (мультиплет, 3H), 2,16 (2H, мультиплет), 2,54 (мультиплет, 2H), 3,28 (мультиплет, 1H), 3,26 (мультиплет, 1H), 3,34 (дублет, 1H, J 15 Гц), 3,46 (синглет, 3H), 3,62 (дублет, 1H, J 15 Гц), 4,06 (квартет, 2H, J 6 Гц), 6,61 (дублет, 1H, J 9 Гц), 6,72 (триплет, 1H, J 6 Гц), 6,83 (дублет, 1H, J 6 Гц), 7,08 (триплет, 1H, J 9 Гц), 7,28 (мультиплет, 5H).
HRMS: Вычислено для C26H36N2O3: 424, 2723.
Найдено: 424, 2734.
Пример 123. Цис-1-(5-карбоксипент-1-ил)-3-(2-метоксибензиламино)-2- фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 99. Т.пл. 53-65oC.
1H-ЯМР (DMCO-d6) d 1,10 (мультиплет, 2H), 1,36 (мультиплет, 2H), 1,70 (мультиплет, 3H), 2,30 (мультиплет, 10H), 2,96 (мультиплет, 1H), 3,70 (мультиплет, 2H), 3,90 (мультиплет, 2H), 4,20 (мультиплет, 1H), 6,98 (мультиплет, 2H), 7,38 (мультиплет, 2H), 7,60 (мультиплет, 3H), 7,90 (мультиплет, 2H).
Масс-спектр: м/е 410 (сигнал, соответствующий недиссоциированной молекуле).
Пример 124. Цис-1-(3-гидроксипроп-1-ил)-3-(2-метоксибензиламино)-2- фенилпиперидин.
Названное соединение получают по методике, описанной в примере 98. Т.пл. 93-96oC (разл.).
1H-ЯМР (CDCl3) d 1,34 (мультиплет, 3H), 2,00 (мультиплет, 4H), 2,65 (мультиплет, 1H), 2,76 (мультиплет, 1H), 3,31 (мультиплет, 3H), 3,38 (дублет, 1H, J 15 Гц), 3,51 (синглет, 3H), 3,62 (дублет, 1H, J 15 Гц), 3,74 (мультиплет, 2H), 6,64 (дублет, 1H, J 9 Гц), 6,73 (триплет, 1H, J 6 Гц), 6,88 (дублет, 1H, J 6 Гц), 7,08 (триплет, J 9 Гц), 7,30 (мультиплет, 5H).
Масс-спектр: м/е 354 (сигнал, соответствующий недиссоциированной молекуле).
Вычислено для C22H30N2O2•2HCl•2,65H2O: C 55,61, H 7,90, N 5,89. Найдено: C 55,62, H 7,75, N 5,67.
Пример 125. Цис-1-(3-карбоксипроп-1-ил)-3-(2-метоксибензиламино)-2- фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 99. Т.пл. 100-105oC (разл.).
1H-ЯМР (DMCO-d6) d 1,92 (мультиплет, 3H), 2,20 (мультиплет, 6H), 3,46 (мультиплет, 4H), 3,78 (мультиплет, 3H), 4,00 (мультиплет, 3H), 6,94 (мультиплет, 2H), 7,36 (мультиплет, 2H), 7,56 (мультиплет, 3H), 7,86 (мультиплет, 2H).
Масс-спектр: м/е 382 (сигнал, соответствующий недиссоциированной молекуле).
Пример 126. Цис-1-(2-карбоэтоксиэт-1-ил)-3-(2-метоксибензиламино)-2- фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 97. Т.пл. 110-112oC.
1H-ЯМР (CDCl3) d 1,18 (триплет, 3H, J 6 Гц), 1,46 (мультиплет, 2H), 1,62 (мультиплет, 1H), 2,08 (мультиплет, 3H), 2,23 (мультиплет, 1H), 2,42 (мультиплет, 2H), 2,60 (мультиплет, 1H), 2,90 (1H, мультиплет), 3,16 (мультиплет, 1H), 3,36 (дублет, 1H, J 15 Гц), 3,45 (синглет, 3H), 3,66 (дублет, 1H, J 15 Гц), 4,04 (квартет, 2H, J 6 Гц), 6,62 (дублет, 1H, J 9 Гц), 6,74 (триплет, 1H, J 6 Гц), 6,85 (дублет, 1H, J 6 Гц), 7,08 (триплет, 1H, J 9 Гц), 7,28 (мультиплет, 5H).
Масс-спектр: м/е 396 (сигнал, соответствующий недиссоциированной молекуле).
Пример 127. Цис-1-(3-карбоэтоксипроп-1-ил)-3-(2-метоксибензил-амино)-2- фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 97. Т.пл. 75-90oC.
1H-ЯМР (CDCl3) d 1,14 (триплет, 3H, J 6 Гц), 1,42 (мультиплет, 2H), 1,74 (мультиплет, 3H), 2,08 (мультиплет, 5H), 2,50 (мультиплет, 2H), 3,17 (мультиплет, 1H), 3,24 (дублет, 1H, J 3 Гц), 3,30 (дублет, 1H, J 1 Гц), 3,42 (синглет, 3H), 3,60 (дублет, 1H, J 15 Гц), 4,00 (квартет, 2H, J 6 Гц), 6,58 (дублет, 1H, J 9 Гц), 6,68 (триплет, 1H, J 6 Гц), 6,81 (дублет, 1H, J 6 Гц), 7,04 (триплет, 1H, J 9 Гц), 7,22 (мультиплет, 5H).
Масс-спектр: м/е 410 (сигнал, соответствующий недиссоциированной молекуле).
Пример 128. Цис-1-(4-гидроксибут-1-ил)-3-(2-метоксибензиламино)-2- фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 98.
1H-ЯМР (CDCl3) d 1,80 (мультиплет, 10H), 2,50 (мультиплет, 1H), 2,64 (мультиплет, 1H), 3,26 (мультиплет, 1H), 3,44 (мультиплет, 6H), 3,66 (мультиплет, 2H), 6,60 (дублет, 1H, J 9 Гц), 6,70 (триплет, 1H, J 9 Гц), 6,94 (дублет, 1H, J 6 Гц), 7,06 (триплет, 1H, J 6 Гц), 7,30 (мультиплет, 5H).
Масс-спектр: 368 (сигнал, соответствующий недиссоциированной молекуле). Вычислено для C25H34N2O3•2HCl•3/4H2O: C60,71, H 7,68, N 6,16. Найдено: C 60,75, H 7,55, N 6,05.
Пример 129. Цис-1-(гекс-1-ил)-3-(2-метоксибензиламино)-2- фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 2. Т.пл. 48-50oC.
1H-ЯМР (CDCl3) d 0,85 (триплет, 3H, J 7 Гц), 1,15 (мультиплет, 7H), 1,50 (мультиплет, 3H), 2,05 (мультиплет, 4H), 2,55 (1H, мультиплет), 2,40 (мультиплет, 1H), 3,30 (мультиплет, 1H), 3,50 (мультиплет, 5H), 3,80 (дублет, 1H, J 15 Гц), 6,65 (дублет, 1H, J 7 Гц), 6,80 (триплет, 1H, J 7 Гц), 6,93 (дублет, 1H, J 7 Гц), 7,13 (триплет, 1H, J 7 Гц), 7,35 (мультиплет, 5H).
HRMS: Вычислено для C25H36N2O: 380, 2827. Найдено: 380, 2808.
Пример 130. Цис-3-(2-метоксибензиламино)-2-фенил-1-(6-фенилгекс-1-ил) пиперидин
Названное соединение получают по методике, подобно описанной в примере 2. Т.пл. 48-53oC.
1H-ЯМР (CDCl3) d 1,25 (мультиплет, 4H), 1,55 (мультиплет, 5H), 1,90 (мультиплет, 1H), 2,05 (мультиплет, 6H), 2,55 (мультиплет, 2H), 2,70 (мультиплет, 1H), 3,35 (мультиплет, 2H), 3,50 (синглет, 3H), 3,80 (мультиплет, 1H), 6,65 (синглет, 1H), 6,80 (синглет, 1H), 7,20 (мультиплет, 3H), 7,30 (мультиплет, 8H).
HRMS: Вычислительно для C31H40N2O•2HCl•3,2H2O: C 63,40, H 4,77, N 7,95. Найдено: C 63,40, H 4,71 N 7,89.
Пример 131. Цис-3-(2-метоксибензиламино)-2-бензил-1-(7-фенилгепт-1-ил) пиперидин.
Названное соединение получают по методике, подобно описанной в примере 2. Т.пл. 67-77oC.
1H-ЯМР (CDCl3) d 1,15 (мультиплет, 5H), 1,50 (мультиплет, 4H), 1,90 (мультиплет, 1H), 2,10 (мультиплет, 7H), 2,50 (мультиплет, 3H), 3,40 (мультиплет, 2H), 3,45 (синглет, 3H), 3,80 (мультиплет, 2H), 6,65 (триплет, 1H, J 8 Гц), 6,75 (триплет, 1H, J 8 Гц), 6,90 (дублет, 1H, J 8 Гц), 7,30 (мультиплет, 11H).
HRMS: Вычислено для C33H44NO: 470, 3297.
Найдено: 470, 3281.
Пример 132. Цис-3-(4-метоксибензиламино)-2-фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 91. Т.пл. 264-266oC.
1H-ЯМР (CDCl3) d 1,28-1,40 (мультиплет, 1H), 1,44- 1,88 (мультиплет, 2H), 1,92-2,02 (мультиплет, 1H), 2,64-2,84 (мультиплет, 2H), 3,10-3,22 (мультиплет, 1H), 3,19 (дублет, 1H, J 12 Гц), 3,39 (дублет, 1H, J 12 Гц), 3,70 (синглет, 3H), 3,81 (дублет, 1H, J 3 Гц), 6,65 (дублет, 2H, J 8 Гц), 6,83 (дублет, 2H, J 6 Гц), 7,12- 7,28 (мультиплет, 5H).
HRMS: Вычислено для C19H24N2O: 296, 1885. Найдено: 296, 1871.
Анализ. Вычислено для C19H24N2O•2HCl•0,6H2O: C 60,03, H 7,21, N 7,37. Найдено: C 60,08, H 7,11, N 7,45.
Пример 133. Цис-2-фенил-3-(тиен-2-илметиламино) пиперидин.
Названное соединение получают по методике, подобно описанной в примере 91. Т.пл. 250-252oC.
1H-ЯМР (CDCl3) d 1,30-1,40 (мультиплет, 1H), 1,46- 1,52 (мультиплет, 1H), 1,68-1,86 (мультиплет, 1H), 1,92-2,00 (мультиплет, 1H), 2,64-2,78 (мультиплет, 1H), 2,84-2,92 (мультиплет, 1H), 3,12-3,22 (мультиплет, 1H), 3,44 (дублет, 1H, J 12 Гц), 3,54 (дублет, 1H, J 12 Гц), 3,81 (дублет, 1H, J 3 Гц), 6,53 (дублет, 1H, J 4 Гц), 6,72 6,80 (мультиплет, 1H), 7,02 (дублет, 1H, J 6 Гц), 7,12-7,30 (мультиплет, 5H).
HRMS: Вычислено для C16H20N2S: 272, 1373. Найдено: 272, 1327.
Анализ: Вычислено для C16H20N2S•2HCl•1,1H2O: C 52,62, H 6,67, N 7,67. Найдено: C 52,64, H 6,38, N 7,65.
Пример 134. Цис-3-(2-метоксинафт-1-ил-метиламино)-2-фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 91. Т.пл. 222-225oC.
1H-ЯМР (CDCl3) d 1,36-1,48 (мультиплет, 1H), 1,52-2,04 (мультиплет, 2H), 2,18-2,32 (мультиплет, 1H), 2,68-2,82 (мультиплет, 1H), 2,90 (дублет, 1H, J 3 Гц), 3,18-3,28 (мультиплет, 1H), 3,64 (синглет, 3H), 3,80 (дублет, 1H, J 12 Гц), 3,86 (дублет, 1H, J4 Гц), 4,07 (дублет, 1H, J 12 Гц), 7,02-7,32 (мультиплет, 8H), 7,57 (1H, дублет, J 8 Гц), 7,60-7,70 (мультиплет, 2H).
HRMS: Вычислено для C23H26N2O: 346, 2041. Найдено: 346, 2043.
Пример 135. Цис-2-фенил-3-(тиен-3-ил-метиламино)-пиперидин.
Названное соединение получают по методике, подобно описанной в примере 91. Т.пл. 264-267oC.
1H-ЯМР (CDCl3) d 1,30-1,40 (мультиплет, 1H), 1,46-1,64 (мультиплет, 1H), 1,70-1,88 (мультиплет, 1H), 1,92-2,02 (мультиплет, 1H), 2,68-2,78 (мультиплет, 1H), 2,80-2,88 (мультиплет, 1H), 3,14-3,22 (мультиплет, 1H), 3,31 (дублет, 1H, J 12 Гц), 3,48 (дублет, 1H, J 12 Гц), 3,84 (дублет, 1H, J 3 Гц), 6,65 (дублет, 1H, J 6 Гц), 6,72 (дублет, 1H, J 3 Гц), 7,04-7,10 (мультиплет, 1H), 7,14-7,28 (мультиплет, 5H).
HRMS: Вычислено для C16H20N2S: 272, 1342. Найдено: 272, 1364.
Анализ: Вычислено для C16H20N2S•2HCl•0,6 H2O: C 53,96, H 6,57, N 7,87. Найдено: C 53,97, H 6,25, N 7,77.
Пример 136. Цис-3-(2,5-дифторбензиламино)-2-фенилпиперидин.
Названное соединение получают по методике, аналогично таковой, описанной в примере 91. Т.пл. 274-276oC.
1H-ЯМР (CDCl3) d 1,28-1,40 (мультиплет, 1H), 1,44-1,62 (мультиплет, 1H), 1,66-1,84 (мультиплет, 1H), 1,90-2,00 (мультиплет, 1H), 2,64-2,76 (мультиплет, 2H), 2,10-3,20 (мультиплет, 1H), 3,32 (дублет, 1H, J 12 Гц), 3,44 (дублет, 1H, J 12 Гц), 3,81 (дублет, 1H, J 3 Гц), 6,50-6,58 (мультиплет, 1H), 6,62-6,78 (мультиплет, 2H), 7,10-7,26 (мультиплет, 5H).
HRMS: Вычислено для C18H20N2F2: 302, 1590. Найдено: 302, 1560.
Анализ: Вычислено для C18H20N2F2•2HCl•0,2H2O: C 57,06, H 5,96, N 7,39. Найдено: C 56,94, H 5,94, N 7,37.
Пример 137.Цис-3-(3-метоксибензиламино)-2-фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 92. Т.пл. 243-246oC.
1H-ЯМР (CDCl3) d 1,32-1,42 (мультиплет, 1H), 1,48- 1,90 (мультиплет, 2H), 1,96-2,04 (мультиплет, 1H), 2,68-2,78 (мультиплет, 1H), 2,85 (дублет, 1H, J 4 Гц), 3,16-3,26 (мультиплет, 1H), 3,29 (дублет, 1H, J 12 Гц), 3,46 (дублет, 1H, J 12 Гц), 3,68 (синглет, 3H), 3,85 (дублет, 1H, J 3 Гц), 6,50-6,58 (мультиплет, 2H), 6,62-6,68 (мультиплет, 1H), 7,04 (триплет, 1H, J 8 Гц), 7,16-7,38 (5H, мультиплет).
HRMS: Вычислено для C19H24N2O: 296, 1885.
Найдено: 296, 1873.
Анализ: Вычислено для C19H24N2O•2HCl•0,3H2O: C 60,89, H 6,75, N 7,48. Найдено: C 60,72, H 6,84, N 7,27.
Пример 138. (2S,3S)-1-(4-оксо-4-фенилбут-1-ил)-3-(2-метоксибенэил-амино)-2- фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 101. Т.пл. 217-219oC.
1H-ЯМР (CDCl3) d 1,32-1,56 (мультиплет, 2H), 1,68-2,20 (мультиплет, 6H), 2,48-2,64 (мультиплет, 2H), 2,68-3,00 (мультиплет, 2H), 3,20-3,28 (мультиплет, 1H), 3,31 (дублет, 1H, J 4 Гц), 3,36 (дублет, 1H, J 15 Гц), 3,44 (синглет, 3H), 3,65 (дублет, 1H, J15 Гц), 6,61 (дублет, 1H, J 7 Гц), 6,72 (триплет, 1H, J 6 Гц), 6,84 (триплет, 1H, J 6 Гц), 7,08 (триплет, 1H, J 8 Гц), 7,10-7,30 (мультиплет, 6H), 7,40 (триплет, 1H, J 6 Гц), 7,50 (дублет, 1H, J 6 Гц), 7,87 (дублет, 2H, J 6 Гц).
HRMS: Вычислено для C29H34N2O2:442, 2616.
Найдено: 442, 2577.
Пример 139. (2S,3S)-1-(4-гидрокси-4-фенилбут-1-ил)-3-(2- метоксибензиламино)-2-фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 102. Т.пл. 190-194oC.
1H-ЯМР (CDCl3) d 1,40-2,24 (мультиплет, 10H), 2,42- 2,66 (мультиплет, 1H), 2,74-2,84 (мультиплет, 1H), 3,02-3,14 и 3,30-3,40 (1H, 2 мультиплета), 3,44-3,62 (мультиплет, 5H), 3,66- 3,82 (мультиплет, 1H), 4,50 (уширенный синглет, 2H), 4,62-4,70 и 4,76-4,82 (2 мультиплета, 1H), 6,68 (дублет, 1H, J 8 Гц), 6,74-6,82 (мультиплет, 1H), 6,98 (триплет, 1H, J 6 Гц), 7,08-7,18 (мультиплет, 1H), 7,20-7,62 (мультиплет, 10H).
HRMS: Вычислено для C29H36N2O2: 444, 2772.
Найдено: 444, 2745.
Анализ: Вычислено для C29H36N2O2•2HCl•3H2O: C 64,38, H 7,56, N 5,18. Найдено: C 64,27, H 7,31, N 5,15.
Пример 140. Цис-3-(2,5-диметоксибензиламино)-2-фенилпиперидин.
Названное соединение получают по методике, подобно описанному в примере 91. Т.пл. 190-194oC.
1H-ЯМР (CDCl3) d 1,28-1,40 (мультиплет, 1H), 1,48- 1,92 (мультиплет, 2H), 2,02-2,14 (мультиплет, 1H), 2,66-2,80 (мультиплет, 2H), 3,14-3,24 (мультиплет, 1H), 3,32 (дублет, 1H, J 18 Гц), 3,38 (синглет, 3H), 3,56 (дублет, 1H, J 18 Гц), 3,66 (синглет, 3H), 3,83 (дублет, 1H, J 3 Гц), 6,48-6,62 (мультиплет, 3H), 7,10-7,26 (мультиплет, 5H).
HRMS: Вычислено для C20H26N2O2: 326, 1995.
Найдено: 326, 1959.
Анализ: Вычислено для C20H26N2O2•2HCl•0,3H2O: C 59,34, H7,12, N 6,92. Найдено: C 59,33, H 6,96, N 6,76.
1 Пример 141. Цис-3-(3-фтор-4-метоксибензиламино)-2- фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 92. Т.пл. 272-274oC.
1H-ЯМР (CDCl3) d 1,34-2,04 (мультиплет, 4H), 2,68-2,82 (мультиплет, 2H), 3,12-3,26 (мультиплет, 1H), 3,22 (дублет, 1H, J 12 Гц), 3,40 (дублет, 1H, J 12 Гц), 3,82 (синглет, 3H), 3,85 (дублет, 1H, J 4 Гц), 6,60-6,76 (мультиплет, 3H), 7,10-7,32 (мультиплет, 5H).
HRMS: Вычислено для C19H23FN2O: 314, 1791.
Найдено: 314, 1773.
Анализ: Вычислено для C19H23FN2O•2HCl•1,1H2O: C 56,05, H 6,73, N 6,88. Найдено: C 55,96, H 6,48, N 6,71.
Пример 142. Цис-3-(5-фтор-2-метоксибензиламино)-2- фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 91. Т.пл. 270-272oC.
1H-ЯМР (CDCl3) d 1,30-1,42 (мультиплет, 1H), 1,48-2,12 (мультиплет, 3H), 2,64-2,82 (мультиплет, 2H), 3,12-3,26 (мультиплет, 1H), 3,32 (дублет, 1H, J 12 Гц), 3,42 (синглет, 3H), 3,56 (дублет, 1H, J 12 Гц), 3,84 (дублет, 1H, J 3 Гц), 6,53 (два дублета, 1H, J5и 10 Гц), 6,64 (два дублета, 1H, J З и 8 Гц), 6,70-6,80 (мультиплет, 1H), 7,12-7,40 (мультиплет, 5H).
HRMS: Вычислено для C19H23FN2O: 314, 1791.
Найдено: 314, 1766.
Анализ: Вычислено для C19H23FN2O•2HCl•0,5H2O: C 57,58, H 6,61, N 7,07. Найдено: C 57,35, H 6,36, N 7,03.
Пример 143. Цис-3-(5-хлор-2-метоксибензиламино)-2- фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 91. Т.пл. 270-273oC.
1H-ЯМР (CDCl3) d 1,32-1,42 (мультиплет, 1H), 1,50-2,12 (мультиплет, 3H), 2,68-2,82 (мультиплет, 2H), 3,18-3,28 (мультиплет, 1H), 3,32 (дублет, 1H, J 12 Гц), 3,42 (синглет, 3H), 3,58 (дублет, 1H, J 12 Гц), 3,85 (дублет, 1H, J 4 Гц), 6,54 (дублет, 1H, J 8 Гц), 6,90 (дублет, 1H, J 3 Гц), 7,04 (два дублета, 1H, J Зи 8 Гц), 7,12-7,32 мультиплет, 5H).
HRMS: Вычислено для C19H23ClN2O: 330, 1495.
Найдено: 330, 1491.
Анализ: Вычислено для C19H23ClN2O•2HCl•0,4H2O: C 55,52, H 6,33, N 6,82. Найдено: C 55,53, H 6,10, N 6,70.
Пример 144. Цис-3-(5-хлор-4-метоксибензиламино)-1-(5,6-дигидрокси-гекс-1-ил)- 2-фенилпиперидин.
Названное соединение получают по методbке, подобно описанной в примере 104.
1H-ЯМР (CDCl3) d 1, 34 (мультиплет, 8H), 1,78 (мультиплет), 2,00 (мультиплет, 3H), 2,54 (мультиплет, 2H), 3,32 (мультиплет, 3H), 3,44 (синглет, 3H), 3,54 (мультиплет, 3H), 6,52 (дублет, 1H, J 9 Гц), 6,80 (уширенный синглет, 1H), 7,02 (мультиплет, 1H), 7,22 (мультиплет, 5H).
Масс-спектр: м/е 446 (сигнал, соответствующий недиссоциированной молекуле).
Пример 145. Цис-1-(5,6-дигидроксигекс-1-ил)-3-(2,5-диметоксибензиламино)-2- фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 104.
1H-ЯМР (CDCl3) d 1,38 (мультиплет, 8H), 1,78 (мультиплет, 1H), 2,00 (мультиплет, 3H), 2,50 (мультиплет, 1H), 2,60 (мультиплет, 1H), 3,30 (мультиплет, 3H), 3,40 (синглет, 3H), 3,60 (мультиплет, 4H), 3,65 (синглет, 3H), 6,56 (мультиплет, 3H), 7,26 (мультиплет, 5H).
Масс-спектр: м/е 442 (сигнал, соответствующий недиссоциированной молекуле).
Пример 146. Цис-2-фенил-3-[2-проп-2-илокси)-бензиламино]-пиперидин.
Названное соединение получают по методике, подобно описанной в примере 91.
1H-ЯМР (CDCl3) d 1,00 (мультиплет, 6H), 1,30 (мультиплет, 1H), 1,70 (мультиплет, 2H), 2,10 (мультиплет, 1H), 2,72 (мультиплет, 2H), 3,18 (мультиплет, 1H), 3,30 (мультиплет, 1H), 3,50 (мультиплет, 1H), 3,80 (уширенный синглет, 1H), 4,06 (мультиплет, 1H), 6,66 (мультиплет, 2H), 6,90 (мультиплет, 1H), 7,05 (мультиплет, 1H), 7,20 (5H, мультиплет).
HRMS: Вычислено для C21H28N2O: 324, 2197.
Найдено: 324, 2180.
Вычислено для C21H28N2O•2HCl•1,66H2O: C 59,02, H 7,85, N 6,55. Найдено: C 59,07, H 7,77, N 6,69.
Пример 147. Цис-3-(3-фтор-2-метоксибензиламино)-2-фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 91.
1H-ЯМР (CDCl3) d 1,40 (мультиплет, 1H), 1,60 (мультиплет, 1H), 1,86 (мультиплет, 1H), 2,08 (мультиплет, 1H), 2,80 (мультиплет, 2H), 3,23 (мультиплет, 1H), 3,36 (мультиплет, 1H), 3,58 (мультиплет, 4H), 3,88 (мультиплет, 1H), 6,80 (мультиплет, 3H), 7,26 (мультиплет, 5H).
HRMS: Вычислено для C19H23N2OF: 314, 1794.
Найдено: 314, 1768.
Вычислено для C19H23N2OF•2HCl•1,5H2O: C 55,08, H 6,80, N 6,76. Найдено: C 54,89, H 6,49, N 6,79.
Пример 148. Цис-3-(5-хлор-3-фтор-2-метоксибензиламино)-2-фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 91.
1H-ЯМР (CDCl3) d 1,42 (мультиплет, 1H), 1,54 (мультиплет, 1H), 1,80 (мультиплет, 1H), 2,06 (мультиплет, 1H), 2,78 (мультиплет, 2H), 3,20 (мультиплет, 1H), 3,42 (дублет, 1H, J 15 Гц), 3,58 (дублет, 1H, J 15 Гц), 3,64 (синглет, 3H), 3,86 (мультиплет, 1H), 6,66 (дублет, 1H, J 9 Гц), 6,91 (дублет, 1H, J 9 Гц), 7,26 (мультиплет, 5H).
HRMS: Вычисление для C19H22N2OClF: 348, 1401.
Найдено: 348, 1406.
Пример 149. Цис-3-(3-хлор-5-фтор-2-метоксибензиламино)-2- фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 91.
1H-ЯМР (CDCl3) d 1,44 (мультиплет, 1H), 1,58 (мультиплет, 1H), 1,80 (мультиплет, 1H), 2,06 (мультиплет, 1H), 2,80 (мультиплет, 2H), 3,22 (мультиплет, 1H), 3,42 (дублет, 1H, J 18 Гц), 3,54 (дублет, 1H, J 18 Гц), 3,66 (синглет, 3H), 3,88 (дублет, 1H, J2 Гц), 6,55 (дублет, 1H, J 6 Гц), 6,92 (дублет, 1H, J 9 Гц), 7,26 (5H, мультиплет).
HRMS: Вычислено для C19H22N2OClF: 348, 1401.
Найдено: 348, 1411.
Вычислено для C19H22N2OClF•2HCl•0,25H2O: C 53,53, H 5,79, N 6,57. Найдено: C 53,58, H 5,60, N 6,41.
Пример 150. Цис-3-(3,5-дихлор-2-метоксибензиламино)-2-фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 91.
1H-ЯМР (CDCl3) d 1,44 (мультиплет, 1H), 1,56 (мультиплет, 1H), 1,82 (мультиплет, 1H), 2,08 (мультиплет, 1H), 2,80 (мультиплет, 2H), 3,20 (мультиплет, 1H), 3,50 (мультиплет, 2H), 3,64 (синглет, 3H), 3,88 (мультиплет, 1H), 6,68 (синглет, 1H), 7,26 (мультиплет, 6H).
HRMS: Вычислено для C19H22N2OCl2: 364, 1105.
Найдено: 354, 1105.
Вычислено для C19H22N2OCl2•2HCl: C 52,07, H 5,52, N 6,39.
Найдено: C 51,69, H 5,50, N 6,32.
Пример 151. Цис-3-(2-метоксибензиламино)-4-метил-2-фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 1.
1H-ЯМР (CDCl3) d 7,10 (мультиплет, 6H), (дублет, 1H, J 7 Гц), 6,68 (триплет, 1H, J 7 Гц), 6,68 (триплет, 1H, J 7 Гц), 6,55 (дублет, 1H, J 7 Гц), 3,97 (дублет, 1H, J 2 Гц), 3,56 (дублет, 1H, J 14 Гц), 3,34 (синглет, 3H), 3,28 (дублет, 1H, J 14 Гц), 2,90 (мультиплет, 2H), 2,36 (синглет, 1H), 2,16 (синглет, 1H), 2,04 (синглет, 1H), 1,12 (мультиплет, 1H), 1,06 (дублет, 3H, J 6 Гц).
HRMS: Вычислено для C20H26N2O: 310, 2045.
Найдено: 310, 2035.
Пример 152. (2S,3S)-1-(4-оксимино-4-фенил бут-1-ил)-3-(2- метоксибензиламино)-2-фенилпиперидин.
В атмосфере азота в круглодонную колбу помещают 445 мг (1 ммоль) (2S, 3S)-1-(4-оксо-4-фенилбут-1-ил)-3-(2-метоксибензиламино)-2- фенилпиперидина и 6 мл этанола. К системе добавляют 209 мг (3,2 ммоль) солянокислого гидроксиламина и 417 мг (5 ммоль) ацетата натрия в 6 мл воды и смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь концентрируют и разделяют по слоям между хлороформом и водой. Слои разделяют и водную фазу экстрагируют дважды хлороформом. Объединенные органические экстракты высушивают (сульфатом натрия) и концентрируют до 368 мг золотистого масла. Сырой продукт реакции очищают флеш-хроматографией на колонке, используя 7% в хлороформе в качестве элюента, чтобы получить 174 мг названного выше соединения в виде масла.
1H-ЯМР (CDCl3) d 1,78 (мультиплет, 7H), 2,56 (мультиплет, 3H), 2,80 (мультиплет, 1H), 3,18 (мультиплет, 1H), 3,38 (мультиплет, 2H), 3,45 (синглет, 3H), 3,72 (мультиплет, 2H), 6,61 (дублет, 1H, J 8 Гц), 6,72 (триплет, 1H, J 6 Гц), 6,87 (дублет, 1H, J 6 Гц), 7,08 (триплет, 1H, J 8 Гц), 7,28 (мультиплет, 8H), 7,48 (мультиплет, 2H).
Образец этого соединения кристаллизуют медленным выпариванием из хлороформа/метанола и структуру подтверждают рентгено-структурным анализом монокристалла.
Пример 153. (2RS, 3RS, 6RS) и (2RS, 3RS,6RS)-3-(2-метоксибензиламино-6- метилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 63.
Более полярный изомер, Rf≈0,28 (1: 9 смесь MeOH/CH2Cl2). Т.пл. 274-176oC (соль HCl). 1H-ЯМР (CDCl3) d 7,28-7,02 (мультиплет, 6H), 6,92 (дублет, 1H, J 6 Гц), 6,72 (триплет, 1H, J 6 Гц), 6,60 (1H, дублет, J 8 Гц), 4,16 (дублет, 1H, J 3 Гц), 3,61 (дублет, 1H, J 14 Гц), 3,44-3,26 (мультиплет, 5H), 2,76 (дублет, 1H, J 4 Гц), 2,20-1,96 (мультиплет, 1H), 1,90-1,64 (мультиплет, 4H), 1,24-1,08 (мультиплет, 4H).
Менее полярный изомер Rf≈0,34 (1:9 смесь MeOH/CH2Cl2). Т.пл. 203-206oC (соль HCl). 1H-ЯМР (CDCl3) d 7,32-7,06 (мультиплет, 6H), 6,90 (дублет, 1H, J 6 Гц), 6,76 (триплет, 1H, J 6 Гц), 6,63 (1H, дублет, J 7 Гц), 3,90 (дублет, 1H, J 3 Гц), 3,63 (дублет, 1H, J 14 Гц), 3,39 (синглет, 3H), 3,36 (дублет, 1H, J 14 Гц), 2,84-2,64 (мультиплет, 2H), 2,14-2,02 (мультиплет, 1H), 1,72-1,30 (мультиплет, 5H), 1,16 (дублет, 3H, J 6 Гц).
Пример 154. (2S,3S)-3-(2-метоксибензиламино)-1-[4-(4- метилфенилсульфонамидо)-бут-1-ил] -2-фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 95.
1H-ЯМР (CDCl3) d 1,40 (мультиплет, 6H), 1,85 (мультиплет, 1H), 1,96 (мультиплет, 5H), 2,39 (синглет, 3H), 2,60 (мультиплет, 1H), 2,83 (мультиплет, 1H), 3,14 (мультиплет, 1H), 3,26 (дублет, 1H, J 3 Гц), 3,41 (мультиплет, 4H), 3,68 (дублет, 1H, J 15 Гц), 6,60 (дублет, 1H, J 9 Гц), 6,69 (триплет, 1H, J 9 Гц), 6,80 (дублет, 1H, J 6 Гц), 7,06 (триплет, 1H, J 6 Гц), 7,22 (мультиплет, 7H), 7,68 (дублет, 2H, J 6 Гц).
HRMS: Вычислено для C30H39N3O3 521, 2708.
Найдено: 521, 2715.
Пример 155. (2S,3S)-1-(4-цианобут-1-ил)-3-(2-метокси бензиламино)-2- фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 93. Т.пл. 89-91oC (разл,).
1H-ЯМР (CDCl3) d 1,48 (мультиплет, 5H), 1,90 (мультиплет, 5H), 2,20 (триплет, 2H, J 9 Гц), 2,52 (мультиплет, 2H), 3,18 (мультиплет, 1H), 3,06 (дублет, 1H, J 3 Гц), 3,32 (дублет, 1H, J 12 Гц), 3,40 (синглет, 3H), 3,68 (дублет, 1H, J 12 Гц), 6,58 (дублет, 1H, J 9 Гц), 6,70 (триплет, 1H, J 6 Гц), 6,82 (дублет, 1H, J 6 Гц), 7,06 (триплет, 1H, J 9 Гц), 7,24 (мультиплет, 5H).
HRMS: Вычислено для C24H31N3O: 377, 2467.
Найдено: 377, 2449.
Пример 156. Цис-3-(5-хлор-2-метоксибензиламино)-1-[4-(4-фторфенил)-4- оксобут-1-ил]-2-фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 101.
1H-ЯМР (CDCl3) d 1,48 (мультиплет, 2H), 1,96 (мультиплет, 5H), 2,58 (мультиплет, 2H), 2,81 (мультиплет, 3H), 3,28 (мультиплет, 3H), 3,45 (синглет, 3H), 3,62 (дублет, 1H, J 15 Гц), 6,52 (дублет, 1H, J 9 Гц), 6,82 (дублет, 1H, J 3 Гц), 7,05 (мультиплет, 3H), 7,26 (мультиплет, 5H), 7,88 (мультиплет, 2H).
Пример 157. (2S,3S)-1-(4-Ацетамидобут-1-ил)-3-(2-метоксибензил-амино)- 2-фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 95.
1H-ЯМР (CDCl3) d 1,42 (мультиплет, 6H), 1,82 (мультиплет, 1H), 1,94 (синглет, 3H), 2,00 (мультиплет, 3H), 2,50 (мультиплет, 1H), 2,59 (мультиплет, 1H), 3,06 (мультиплет, 1H), 3,20 (мультиплет, 2H), 3,27 (дублет, 1H, J 3 Гц), 3,34 (дублет, 1H, J 15 Гц), 3,42 (3H, синглет), 3,66 (дублет, 1H, J 15 Гц), 6,61 (дублет, 1H, J 9 Гц), 6,72 (триплет, 1H, J 6 Гц), 6,83 (дублет, 1H, J 6 Гц), 7,09 (1H, триплет, J 9 Гц), 7,26 (мультиплет, 5H).
Масс-спектр: м/е 409 (сигнал, соответствующий недиссоциированной молекуле).
Пример 158. (2S,3S)-1-(4-Бензамидобут-1-ил)-3-(2-метоксибензиламино)-2- фенилпиперидин.
Названное соединение получают по методике, подобно описанной в примере 95.
Т.пл. 146-150oC (разл.).
1H-ЯМР (CDCl3) d 1,46 (мультиплет, 6H), 1,72 (мультиплет, 1H), 1,98 (мультиплет, 3H), 2,52 (мультиплет, 2H), 3,16 (мультиплет, 1H), 3,25 (дублет, 1H, J 3 Гц), 3,30 (мультиплет, 3H), 3,38 (синглет, 3H), 3,68 (мультиплет, 1H), 6,24 (уширенный синглет, 1H), 6,56 (1H, дублет, J 9 Гц), 6,70 (триплет, 1H, J 6 Гц), 7,05 (триплет, 1H, J 9 Гц), 7,22 (мультиплет, 5H), 7,36 (мультиплет, 3H), 7,68 (2H, дублет, J 6 Гц).
HRMS: Вычислено для C30H37N3O2: 471, 2885.
Найдено: 471, 2851.
Пример 159. Цис-2-(3,5-Дибромфенил)-3-(2-метоксибензиламино)пиперидин.
Названное соединение получают по методике, подобно описанной в примере 1. Т.пл. > 240oC (соль HCl).
1H-ЯМР (CDCl3) d: 7,48 (синглет, 1H), 7,31 (синглет, 2H), 7,14 (триплет, 1H, J 6 Гц), 6,94 (дублет, 1H, J 6 Гц), 6,79 (триплет, 1H, J 6 Гц), 6,49 (1H, дублет, J 6 Гц), 3,74 (синглет, 1H), 3,68 (дублет, 1H, J 12 Гц), 3,54 (синглет, 3H), 3,34 (дублет, 1H, J 12 Гц), 3,20 (мультиплет, 1H), 2,70 (мультиплет, 2H), 2,07 (1H, мультиплет), 1,82 (мультиплет, 7H), 1,54 (мультиплет, 1H), 1,46 (мультиплет, 1H).
HRMS: Вычислено для C15H22N2OBr79Br81: 454, 0078.
Найдено: 454, 0143.
В табл.2 и 3 приведены рецептурные примеры 1 и 2 соответственно.
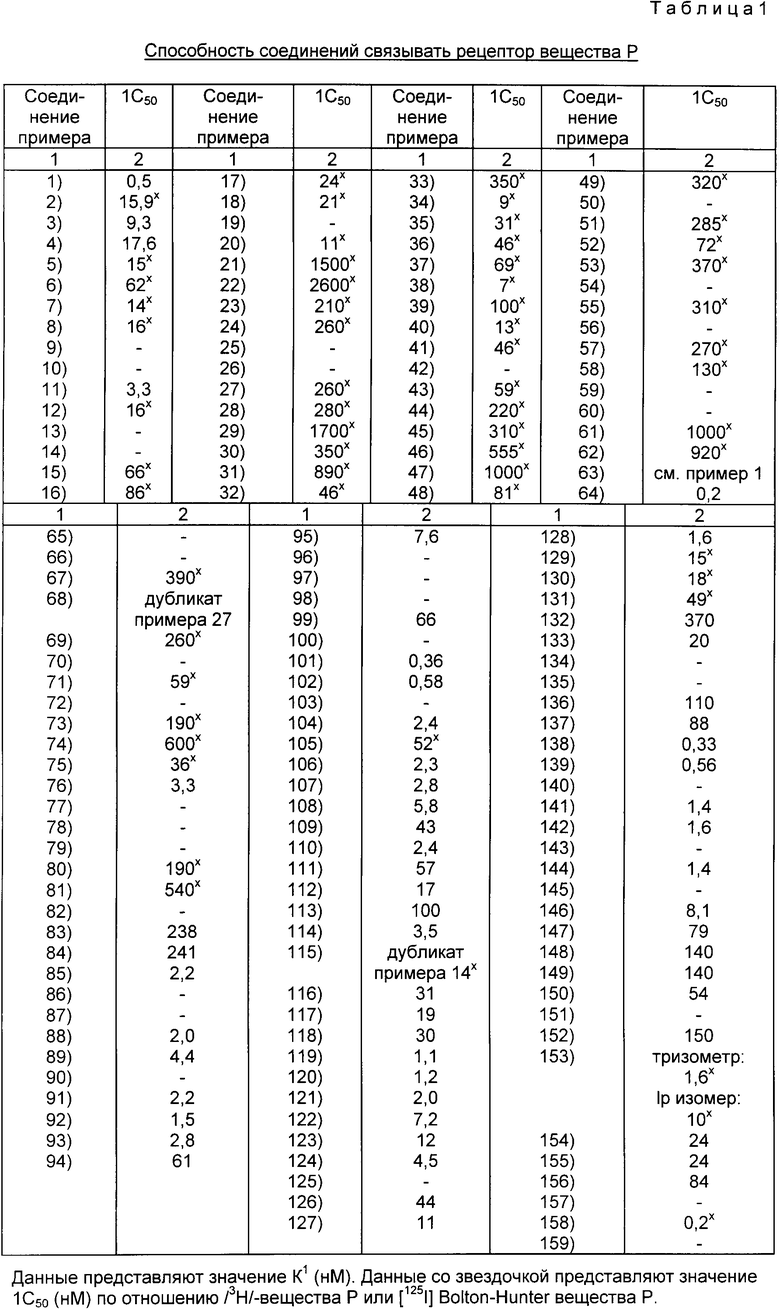
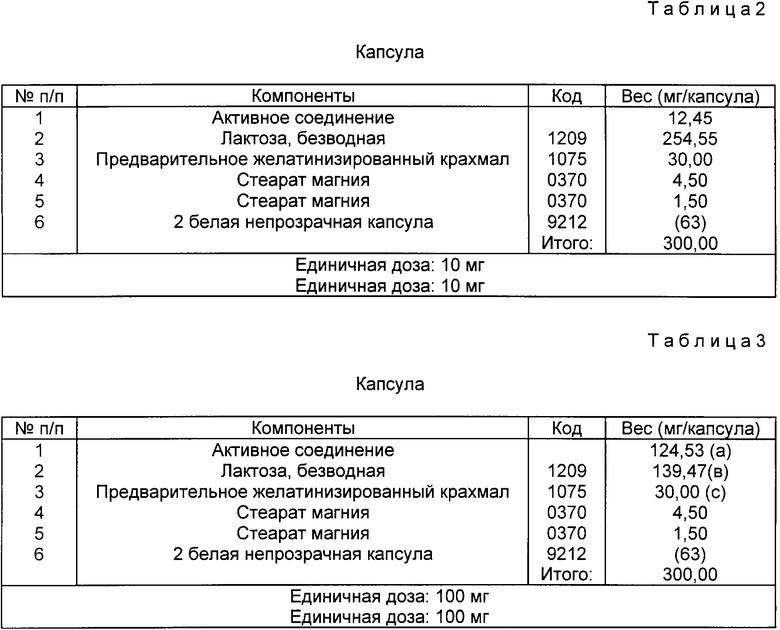
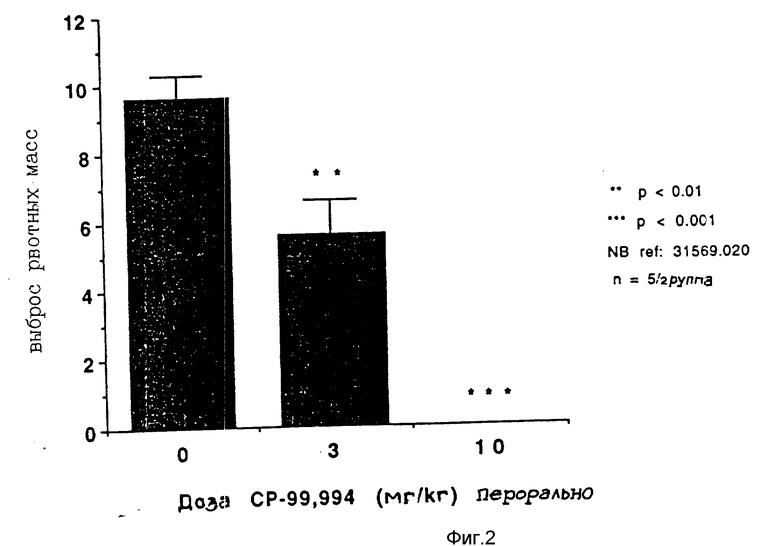
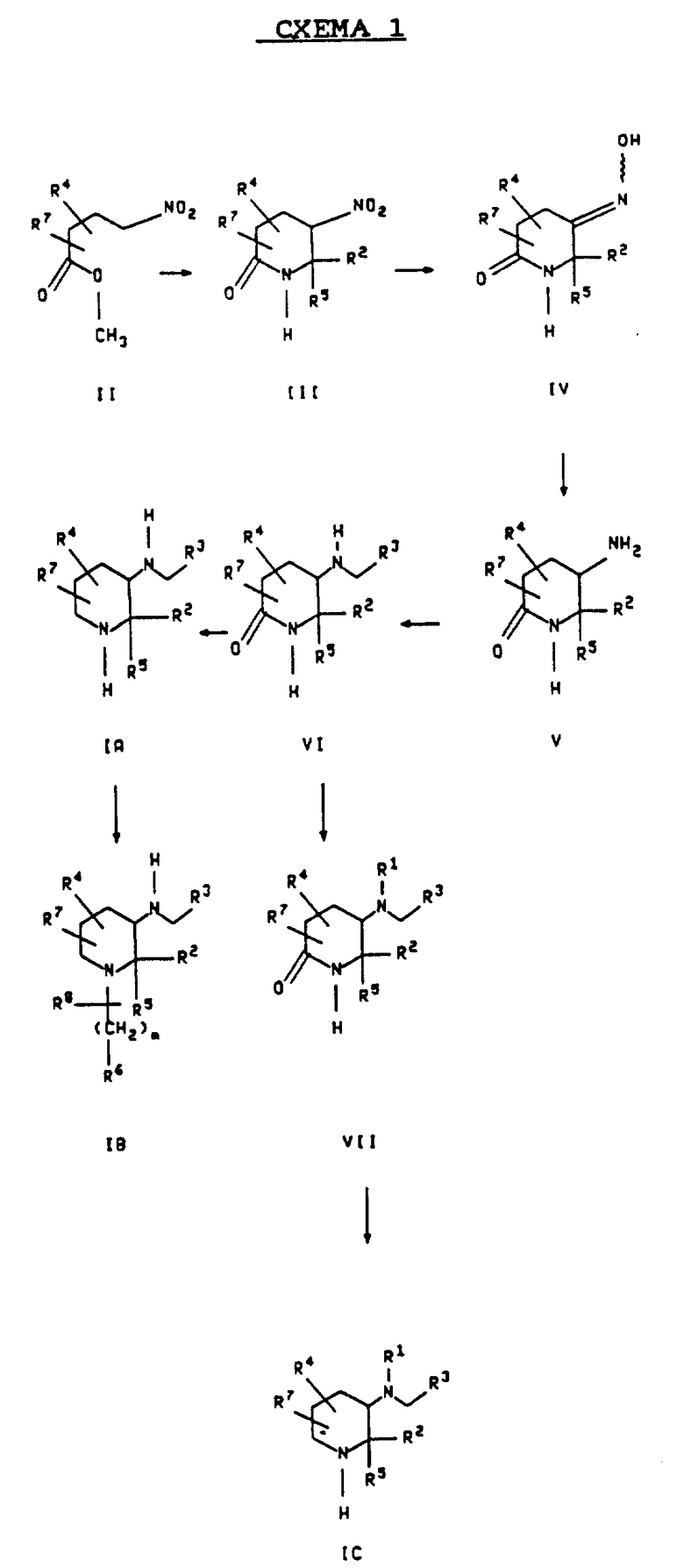
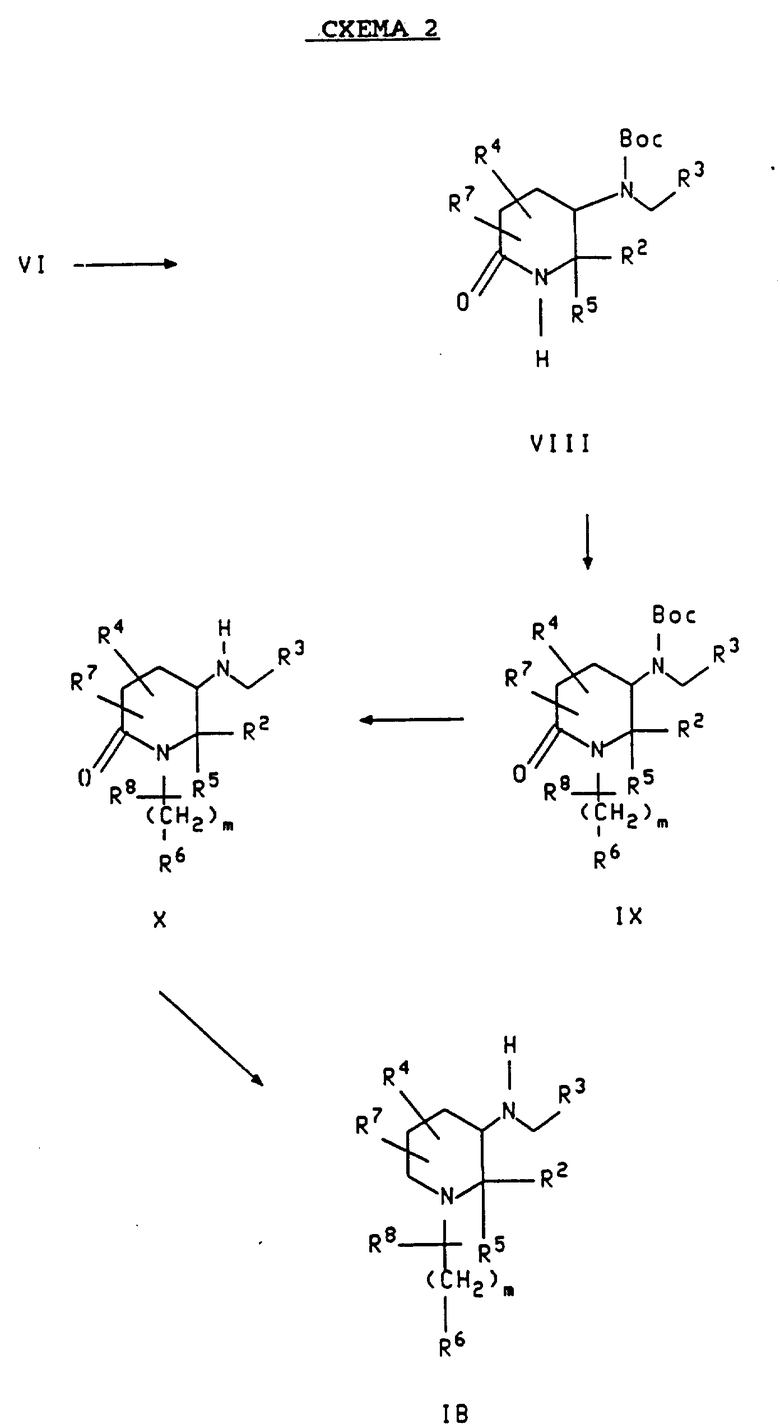
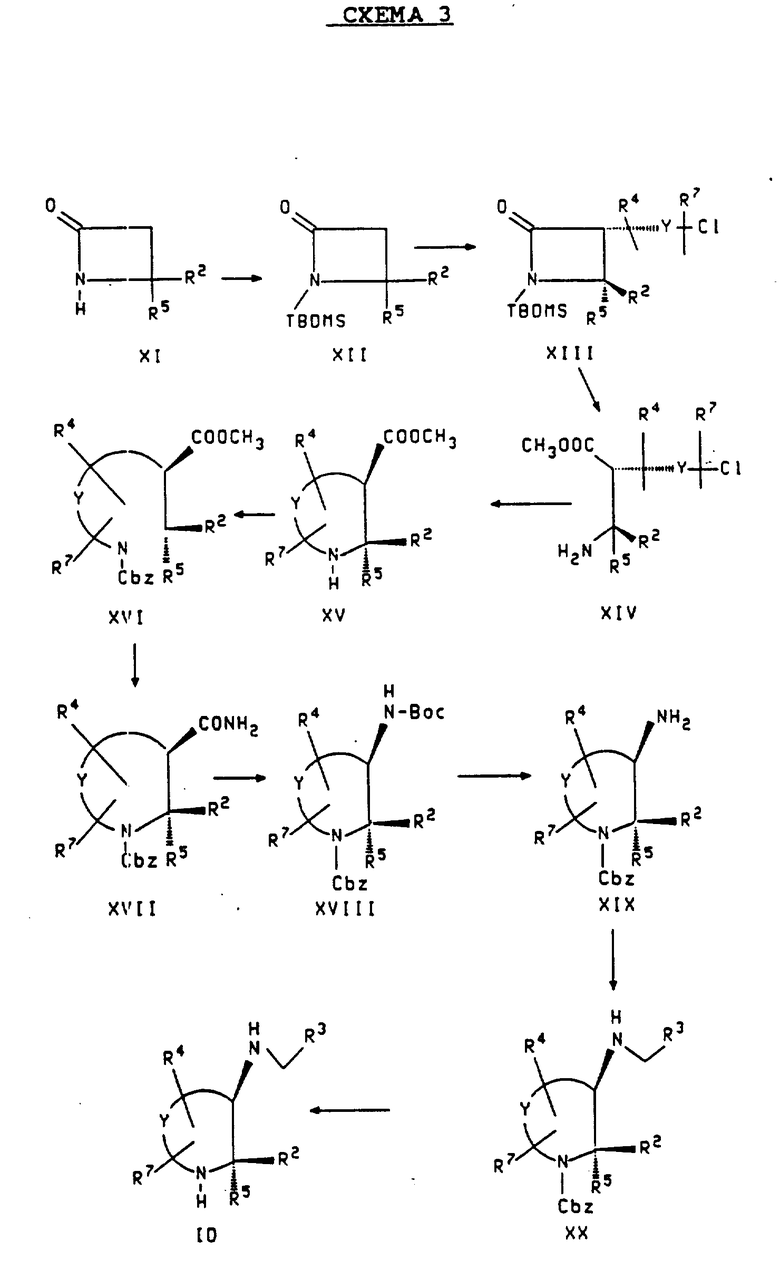
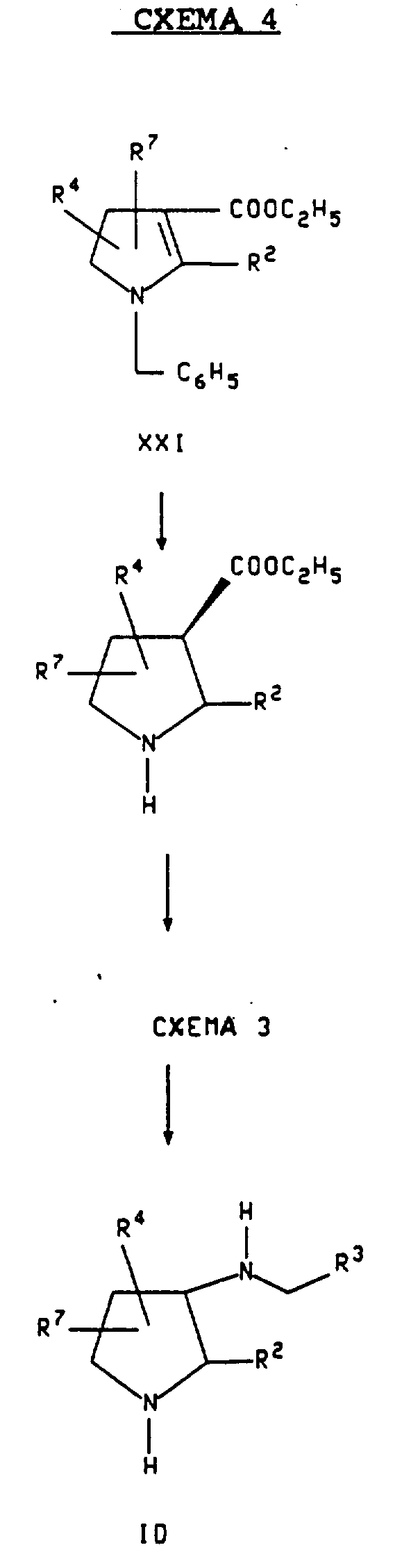
Использование: в медицине для лечения и предупреждения воспалительных процессов и расстройств центральной нервной системы. Сущность изобретения: продукты - гидрированные азотсодержащие гетероциклические соединения ф-лы I, где y - (CH2)n - группа, где n = 2,3 или 4, m = 0-6, R1 - водород, С1-С6-алкил, R2 - водород, метил, трет-бутил, С5-С6-циклоалкил, бензил, бензгидрил, нафтил, тиенил, фуранил, инданил, фенил, R3 - незамещенный или замещенный фенил, R4 - водород, метил, метокси, галоген, R5 - водород, R6 - водород, фенил, гидроксил, фенокси, амино, циано, карбокси, карбоэтокси, ацетамидо, бензамидо, 4,41-дифторбензгидрил, карбоксамидо, R7 - водород, R8 - водород или гидроксилэ. Промежуточные соединения ф-лы II где R1-R5 и R7 определены выше. Фармацевтическая композиция, проявляющая антагонистическое действие в отношении вещества Р и содержащая в качестве активного начала вещество формулы I в эффективном количестве. 6 с. и 3 з.п.ф-лы, 3 табл., 2 ил.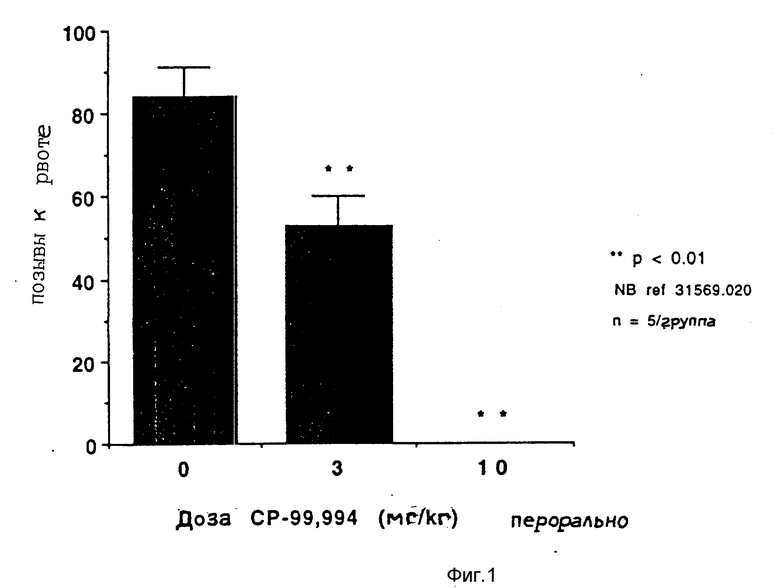
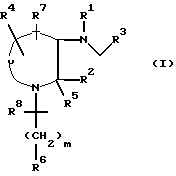
в которой Y представляет собой (CH2)n группу, где n - целое положительное число 2, 3 или 4, любой из атомов углерода в группе (CH2)n необязательно может быть замещен радикалом R4;
m целое положительное число от 0 до 6, причем любая из одинарных связей углерод-углерод группы (CH2)m может быть заменена необязательно двойной или тройной связью углерод-углерод, а любой из атомов углерода в группе (CH2)m может быть замещен необязательно радикалом R8;
R1 водород или (C1 C6) алкил, необязательно замещенный гидрокси- или алкоксигруппами или фтором;
R2 радикал, выбранный из группы, включающей водород, метил, трет-бутил, (С5 С6) циклоалкил, бензил, бензгидрил, нафтил, тиенил, фуранил, инданил или фенил, который может быть необязательно замещен трифторметилом, одним или двумя атомами галогена, алкокси, (С1 - С3) гидроксиалкилом, фенилом или -NH(C1 C3) алкилом;
R3 фенил, который может быть замещен одним, двумя или тремя заместителями, выбранными из метила, (С1 С4)алкоксила, галогена, трифторметила, диалкиламина, тиенил или 2-метоксинафтил;
R4 водород, метил, метокси, галоген;
R5 водород;
или R2 и R5 вместе с атомом углерода кольца могут образовывать спиро-кольцо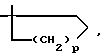
где p 1 или 2;
R6 водород, фенил, гидроксил, фенокси, амино, циано, карбокси, карбоэтокси, ацетамидо, бензамидо, бензоил, 4-фторбензоил, α-оксибензил, a-окси-4-фторбензил, оксиминобензил, 4,41-дифторбензгидрил, карбоксамидо, N-метилкарбоксамидо, п-толилсульфонамидо, тиофенил, 2-нафтамидо- или нафтил-2-метиламино;
R7 водород;
R8 водород или гидроксил,
или их фармацевтически приемлемые кислотно-аддитивные соли.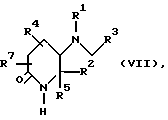
где R1 R5 и R7 определены в п.1.
| EP, заявка N 0333174, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1998-02-27—Публикация
1991-12-23—Подача