Предлагаемый способ относится к способам умягчения жесткой (сверхжесткой) воды и может быть использован для умягчения воды (для питьевых и пищевых целей) из природных источников, содержащих большое количество солей жесткости. Кроме того, данный способ применим для осветления и очистки навозных стоков и сточных вод предприятий пищевой и химической промышленности.
Известен способ умягчения жесткой воды, по которому на первой стадии с помощью соединения кальция, например гидроокиси кальция, добавляемой в воду в количестве, определяемом зависимостью 37 Жвр+1,7 CO2+1,8 MgO, где Жвр - временная жесткость, мг-экв./л, MgO и CO2 - найденные при анализе воды количества MgO и CO2 в мг на 1 л воды, устраняют жесткость, обусловленную соединениями Ca(HCO3)2, Mg(HCO3)2, MgCO3, MgSO4 (и других солей магния), а также CO2[1,2].
Эта стадия позволяет, в основном, устранить временную жесткость.
Для дальнейшего умягчения воды на второй стадии способа используют соединения щелочного металла, например NaOH и(или) Na2CO3. При добавлении к воде Na2CO3 устраняется жесткость, обусловленная соединениями CaCI2, CaSO4, MgSO4 (и другими соединениями магния) [1,2].
При использовании для умягчения воды NaOH в воде образуются Ca(OH)2 и Na2 CO3, действие которых на умягчение воды описано выше.
Недостатком использования для умягчения воды соединений щелочного металла натрия является сравнительно медленное снижение жесткости умягчаемой воды.
Кроме того, побочным отрицательным эффектом использования соединений щелочного металла натрия является то, что при высокой постоянной жесткости исходной воды в умягченной воде образуются большие количества сульфатов и хлоридов натрия, а также не исключается содержание карбоната и бикарбоната натрия. Употребление такой мягкой воды для питья и пищевых целей вредно, т.к. такая вода вызывает сердечно-сосудистые заболевания. В этом убедились, например, англичане, когда статистические данные показали, что в Глазго, где мягкая вода содержит много натрия (его содержание достигает 200 мг/л), смертность от болезни сердечно-сосудистой системы на 50% выше, чем в Лондоне, где содержание натрия не превышает 10 мл/л [3, с.48].
Подобные статистические исследования, проведенные в других странах, дали такие же результаты [3, с.49].
Для питьевой воды рекомендуется концентрация натрия не более 10 мг/л [4] , а в качестве ПДК 50 мг/л [5]. Правда в последние годы в связи со все ухудшающейся ситуацией с качеством питьевой воды ПДК увеличено вдвое, однако это изменение не приносит пользы здоровью людей.
Ближайшим к предложению является способ [1, 2].
Недостатками данного способа являются сравнительно медленное снижение жесткости воды и низкое качество получаемой воды.
Целью изобретения является интенсификация способа и улучшение качества питьевой воды, получаемой при умягчении сверхжесткой природной воды.
Достигается поставленная цель тем, что по способу умягчения воды путем введения в нее при перемешивании соединений кальция, например гидроокиси кальция, в количестве, определяемом зависимостью 37 Жвр+1,7 CO2 + 1,8 MgO, где Жвр - временная жесткость, MgO и CO2 - найденные при анализе воды количества MgO и CO2 в мг на 1 л воды, последующего введения при перемешивании в умягчаемую воду соединения щелочного металла, отстаивания осадка, отделения от осадка осветленной воды, в отличие от прототипа в качестве соединения щелочного металла используют смесь K2CO3 и KOH, причем K2CO3 используют в количестве, определяемом зависимостью 48-53 Жп, где Жп - постоянная жесткость исходной воды, а KOH используют в количестве 0-50 мг/л, при этом KOH вводят при перемешивании в умягчаемую воду не ранее чем через 30 мин после введения K2CO3, при этом после отстаивания осадка и отделения отстоявшейся воды от осадка умягченную воду нейтрализуют пищевой, например фосфорной, кислотой до pH≤8.
С целью дополнительной интенсификации способа умягчаемую воду предварительно нагревают до 35-50oC.
С целью расширения сырьевой базы в качестве источника K2CO3 используют растворимую часть золы подсолнечника (концентрированный раствор среднего состава K2CO3-15 %, KCl - 3,3 %, K2SO4 - 1,7 %) или растворимую часть бардяного угля и золы, сухое вещество которых содержит 81-96 % K2CO3, а также 0,5-2,5 % K2SO4, 1 - 6,4 % KCl, 0,5 - 1 % Na2CO3.
С целью интенсификации процесса коагуляции осаждающихся частиц через воду после введения в нее всех добавок пропускают переменный электрический ток.
Обоснование выбора параметров способа.
Использование в качестве соединений щелочного металла K2CO3 и KOH позволяет интенсифицировать процесс умягчения воды. Так, например, после введения в воду с исходной жесткостью 12 мг-экв./л ( в две пробы) по 0,2 г/л Ca(OH)2 и выдержки в течение 2 ч в воду ввели равные количества (по 0,2 г/л) Na2CO3 и K2CO3, производя каждый час замеры жесткости воды. Эти замеры показали, что в пробе с добавкой Na2CO3 снижение жесткости происходит медленнее, чем в пробе с добавкой K2CO3 (см. табл. 1).
Кроме того, использование в качестве соединений щелочного металла K2CO3 и KOH позволяет снизить вредное влияние умягченной воды на здоровье людей.
Установлено, что соли калия не могут быть заменены в организме человека никакими другими солями, в том числе и солями натрия. Клетки человеческого организма избирательно концентрируют калий, который содержится в основном в протоплазме клеток и крови. Богаты калием печень и селезенка. Значительна роль этого элемента в регулировании деятельности ферментов. Ионы калия участвуют в генерации и проведении биоэлектрических потенциалов в нервах и мышцах, в регуляции сокращений сердца и других мышц, поддерживают осмотическое давление и гидратацию коллоидов в клетках, активизируют некоторые ферменты. Метаболизм калия тесно связан с углеводным обменом, ионы калия влияют на синтез белков.
Угнетение гликолиза, дыхания, нарушение проницаемости наружной клеточной мембраны приводят к выходу калия из клеток, часто в обмен на натрий, что еще больше усугубляет болезненное состояние организма [6].
Организм ребенка, как и молодое растение, требует больше калия, чем организм взрослого человека. Суточная потребность а калии у ребенка составляет 30 мг на 1 кг веса, у взрослого - 2-3 г в день, т.е. такая же, как и в натрии.
Если натрий мы получаем в больших количествах с поваренной солью (от 2-3 г до 15 г при больших потерях пота в день) на человека, естественно здорового (многим больным соль противопоказана), а также с продуктами питания, то дефицит калия прослеживается сильнее, особенно при несбалансированном питании. Покрыть этот дефицит в калии можно частично за счет воды, обрабатываемой по предлагаемому способу.
В отличие от натрия, содержание которого в питьевой воде не должно превышать 10 мг/л, концентрация калия 1000-2000 мг/л (в 100-200 раз больше, чем натрия) в питьевой воде считывается допустимой [7].
Исходя из вышеизложенного можно сделать вывод, что для умягчения питьевой воды, особенно сверхжесткой, нельзя использовать соединения натрия, т.к. такая вода токсична для человека. Для соединений калия такой запрет не прослеживается.
С другой стороны, осадок, выделяемый при умягчении воды с помощью соединений калия, можно использовать как удобрение, в то время как при натриевом умягчении воды в составе осадка наряду с соединениями кальция и магния содержатся соединения NaCl, Na2CO3, являющиеся токсичными соединениями для растений. Особенно вредным является соединение Na2CO3, которое фактически убивает растения [8]. Использование получаемых осадков с соединениями натрия для других целей также затруднено из-за наличия этих же натриевых соединений.
Таким образом, с точки зрения охраны здоровья человека и охраны окружающей среды использование соединений щелочного металла калия (KOH, K2CO3) более оправдано, чем использование соединений натрия, хотя производство калийных соединений обходится примерно в два раза дороже.
Кажущаяся выгода в стоимостном отношении соединений натрия оборачивается высокой смертностью людей и уничтожением плодородия почвы (хотя бы через сливы осадков в водоемы или их хранение в отвалах).
Использование смеси K2CO3 и KOH объясняется тем, что K2CO3 применяется для устранения постоянной жесткости, а KOH - для нейтрализации хлорорганических соединений (пестицидов и т.д.), которые попадают в природные воды с полей. Так, например, очень опасным хлорорганическим соединением в водах Башкирии является пестицид 2,4-a (диоксин). Как показали предварительные исследования, при присутствии KOH в воде концентрация этого пестицида резко снижается.
Использование K2CO3 в количестве, определяемом зависимостью 48-53 Жп, где Жп - постоянная жесткость, объясняется тем, что в ряде случаев нет смысла умягчать питьевую воду очень сильно, т.к. такая вода излишне лишена соединений кальция и магния, которые также необходимы в определенных количествах человеческому организму.
Потребность человека в кальции составляет 600-1200 мг в сутки. С пищей человек потребляет 0,4-2 г кальция в сутки [9]. Но по данным [10] кальций в питьевой воде в концентрации 100 - 150 мг/л увеличивает заболеваемость населения болезнями почек, артритами и полиартритами.
Кальций, потребляемый с пищей, в основном представлен более усвояемыми органическими соединениями нежели кальций, содержащийся в воде в виде минеральных солей. Однако и в виде минеральных соединений кальций необходим человеческому организму и хорошо усваивается, если его содержание в рационе человека сравнительно не велико.
Предельно допустимая концентрация кальция в питьевой воде рекомендуется 75 мг/л [11] , в воде для пищевых целей - 10 мг/л, в воде для пивоваренных заводов: для темного пива - 200-500 мг/л, для светлого пива - 100-200 мг/л [13].
Потребность человека в магнии также составляет 600-1200 мг/сут [3]. Магний чрезвычайно необходим для устранения склероза, заболеваний сердца, снятия состояний нервозности, страха, бессонницы, устранения внезапных головокружений, быстрой утомляемости и многого другого [3, c. 54-72].
Предельно допустимая концентрация магния в питьевой воде рекомендована в 15 мг/л [11] , установлена B03 30 мг/л при содержании сульфатов менее 250 мг/л [14], во Франции установлена 125 мг/л [12], для пивоваренных заводов - 30 мг/л [13].
Потребность человека в магнии должна в основном покрываться за счет MgO (окиси магния), сульфат магния менее предпочтителен, а хлорид магния, например, токсичен для человека в концентрации 100 мг/л [15].
Учеными установлено, что усвояемость кальция усиливается в присутствии достаточного количества магния, поэтому в питьевой воде необходимо оставлять часть соединений этих элементов с учетом области использования питьевой воды и той информации, что вода с жесткостью порядка 3-5 мг-экв./л гораздо более полезна для людей, чем вода мягкая (с жесткостью менее 3 мг-экв./л) [3, стр. 50] . Так, по рекомендациям американского доктора Доусона нужно употреблять ежедневно 2 л воды, содержащей 60 мг магния и 100 мг кальция. Подсчитано, что если бы все люди, пьющие мягкую воду (с жесткостью менее 3 мг-экв./л), следовали советам доктора Доусона и восполняли недостаток магния и кальция за счет воды, содержащей 30 мг/л магния и 50 мг/л кальция, то в течение 10 лет на каждые 100000 жителей было бы на 100 смертельных случаев от инфарктов меньше, чем сейчас [3, стр. 50].
Таким образом, на основании обобщения приведенной выше информации нами было принято то количество K2CO3 в предлагаемом способе, которое позволяет оставить конечную жесткость умягчаемой воды порядка 3-5 мг-экв./л (в ряде случаев до 9 мг-экв./л, например, при использовании умягчаемой воды для разбавления сухого молока).
Введение КОН в умягченную воду не ранее, чем через 20 мин после добавления K2CO3 при наличии в воде хлорпроизводных углеводородов и хлорорганических кислот, попадающих в воду в виде интенсивного загрязнения окружающей среды промышленными и сельскохозяйственными предприятиями, позволяет частично нейтрализовать эти токсичные соединения за счет замещения иона хлора на другие нетоксичные ионы.
Так, например, при содержании в уфимской водопроводной воде гербицида 2,4-a в количестве 0,86•10-4 мг/л после обработки воды по предлагаемому способу содержание этого токсичного соединения снизилось до 0,03•10-4 мг/л.
В случае, если хлорорганических соединений в воде не содержится, то KOH можно не применять, т.е. его концентрация в воде будет равна 0, если же есть необходимость перевести хлорорганику в менее токсичные соединения, то KOH можно использовать в концентрации до 50 мг/л. Это его ПДК в питьевой воде. Часть этого соединения реагирует с солями жесткости (доумягчает воду), а часть, очевидно, вытесняет токсичный хлор из хлорорганических соединений.
Необходимость отделения осадка от умягченной воды обусловлена тем, что эта стадия способа позволяет значительно снизить в последующем расход H3PO4 на доведение pH полученной воды до 8. Иначе осадок связывает вводимую H3PO4 в фосфаты и расход ее увеличивается в 5-10 раз.
Предварительный нагрев воды до 35-50oC позволяет ускорить умягчение воды не менее чем в 2-3 раза.
Как показали анализы, при введении умягчающих агентов в подогретую воду образование хлопьев в воде происходит значительно интенсивнее и они значительно более агрегатированы, быстрее происходит выпадение осадка, т.к. образующиеся флокулы крупные и тяжелые.
Так, например, при введении Ca(OH)2 в холодную воду (10-15oC) образуется мелкая взвесь, которую необходимо выдерживать не менее 2-3 ч для полного завершения процесса устранения временной жесткости, а при введении этого же соединения в нагретую до 35-50oC воду этот процесс завершается примерно в течение 0,5-1 ч (при этом чем выше жесткость исходной воды, тем медленнее идет процесс ее умягчения). То же самое наблюдается и при последующем введении K2CO3. Если в холодной воде необходимо не менее 10-15 ч для снятия необходимой величины постоянной жесткости, то в нагретой воде этот процесс завершается за 6-7 ч.
Следует добавить к вышеизложенному, что в тех случаях, когда для использования в пищевых целях нужна более мягкая вода, то K2CO3 необходимо использовать в количестве, определенном зависимостью 53 Жп.
Использование пищевой фосфорной кислоты для доведения pH воды до величины ≤ 8 объясняется тем, что в результате обработки воды умягчающими агентами pH воды может повыситься до 11 (при умягчении сверхжесткой воды). Чтобы снизить pH до допустимой нормы и, кроме того, получить в воде соединения фосфата кальция, потребность в котором для человека составляет около 55 мг в сутки (в Швейцарии выпускается поливитаминный препарат "Супрадин", содержащий 51,3 мг фосфата кальция в 1 драже и рекомендуемый на употребление по 1 драже в сутки для взрослых и детей), предлагается использовать пищевую фосфорную кислоту. При этом предварительное устранение осадка из отстоявшейся воды позволяет довести расход этой добавки до 15-30 мл на 1000 л воды, при этом концентрация фосфора в воде составляет 7-14 мг/л. Связавшись в фосфат кальция, часть этого фосфора выпадает в осадок в виде фосфатов, а часть остается. Содержание получающего в воде соединения не превышает указанную выше потребность человеческого организма в этом соединении.
Содержание фосфора в указанном выше препарате "Супрадин Рош" составляет 23,8 мг на одно драже.
Использование для устранения постоянной жесткости вместо K2CO3 растворимой части золы подсолнечника или растворимой части бардяного угля и золы позволяет расширить сырьевую базу, удешевить обработку воды, а также применять предлагаемый способ для очистки сточных вод (навозных стоков или сточных вод предприятий пищевой промышленности).
Пропускание переменного тока через воду после введения в нее всех добавок позволяет интенсифицировать процесс коагуляции осаждающихся частиц, что будет показано в примерах осуществления способа.
Доказательство существенности отличий предлагаемого способа.
В научно-технической и патентной литературе не обнаружено сведений о том, что заявляемая совокупность признаков известна.
В связи с тем, что в научно-технической литературе не содержатся сведения со заявляемой совокупности признаков предлагаемого способа, а также тем, что эта совокупность признаков служит достижению поставленной цели - интенсификации способа и улучшению качества питьевой воды, получаемой при умягчении сверхжесткой природной воды, то она соответствует критерию "существенные отличия".
В табл. 2 представлены примеры осуществления предлагаемого способа, а также примеры при запредельных параметрах способа.
Источники информации, принятые во внимание.
1. Краткий справочник химика. Составитель В.И.Перельман, издание 6, Государственное научно-техническое издательство химической литературы, М., 1963, с. 366-370.
2. Ф.И.Белан, Водоподготовка, М.: Энергия, 1979.
3. Александрович Ю., Гумовска И. Кухня и медицина. Пер. с пол. М.: Наука, 1001, с 224.
4. Hibbard P.L. - J. Am. Water Works Assoc., 1934, v.21, p.884.
5. Cheremisinoff P., Valent J., Wright D. - Water Senage Works, 1976, v. 123, N 3, p. 80.
6. Большая советская энциклопедия. М.: Советская энциклопедия, 1073, т. 11, с.598, 599.
7. Moore E.W. Thge desalting of saline waters : A review of the present status. Report to the subcommitee on water supply comm. on san. engin. and environm natl research couneil (24 may 1950).
8. Радов А. С. и др. Практикум по агрохимии. /Под ред. И.В. Пустового. 4-е изд., переработ. и доп. М.: Агропромиздат. 1985, с. 312 и 173.
9. Taytor E.W. the examination of waters and waters supplies. P. Blakiston s son and Co., 1949.
10. Litte A. D. Water quality criteria data book. v.2. Inorganic chemical pollution of fresh water U. S. environmental protection agency. Water pollutionn control series. wash, 1971, 273 p.
11. Международные стандарты питьевой воды. 3-е изд. Женева, Всемирная организация здравоохранения, 1973, с.36.
12. Lund H. F. (ed.). Industrial pollution control handbook. New York ets., 1971, 864 p.
13. McKim I. M., Wold H. W. Water quality criteria. 2 nd ed. Sacramento, 1963. 548 p.
14. Европейские стандарты питьевой воды. 2-е изд. ВОЗ, Женева. М.: Медицина, 1972, с.60.
15. Dawcon G. W., Chuckrow A. I., Swift W.H., Control of spillage of hazardous polluting substances. Water pollution control series 15090 F02. Depart. of interior. Federal water quality administration. Wash., 1970, p. 55.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ УМЯГЧЕНИЯ ВОДЫ | 1993 |
|
RU2091334C1 |
| СОСТАВ ДЛЯ УМЯГЧЕНИЯ ВОДЫ | 1994 |
|
RU2093479C1 |
| СОСТАВ ДЛЯ УМЯГЧЕНИЯ ВОДЫ | 1994 |
|
RU2109694C1 |
| СОСТАВ ДЛЯ УМЯГЧЕНИЯ ВОДЫ (ВАРИАНТЫ) | 1994 |
|
RU2090521C1 |
| СПОСОБ УМЯГЧЕНИЯ ВОДЫ ОТ СОЛЕЙ ЖЕСТКОСТИ | 2011 |
|
RU2462422C1 |
| СОСТАВ ДЛЯ УМЯГЧЕНИЯ ВОДЫ | 1995 |
|
RU2100293C1 |
| СПОСОБ УМЯГЧЕНИЯ ВОДЫ | 1997 |
|
RU2151746C1 |
| СПОСОБ УМЯГЧЕНИЯ ВОДЫ | 1995 |
|
RU2114072C1 |
| СПОСОБ УМЯГЧЕНИЯ И ОБЕЗЖЕЛЕЗИВАНИЯ ВОДЫ | 2013 |
|
RU2541017C1 |
| Способ умягчения воды | 1979 |
|
SU842034A1 |
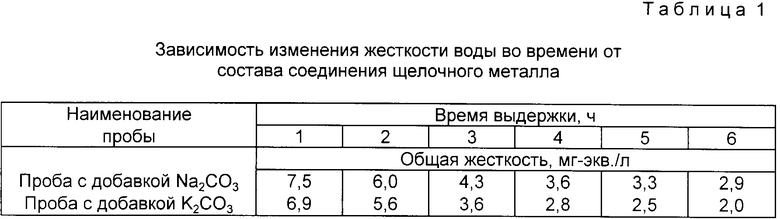
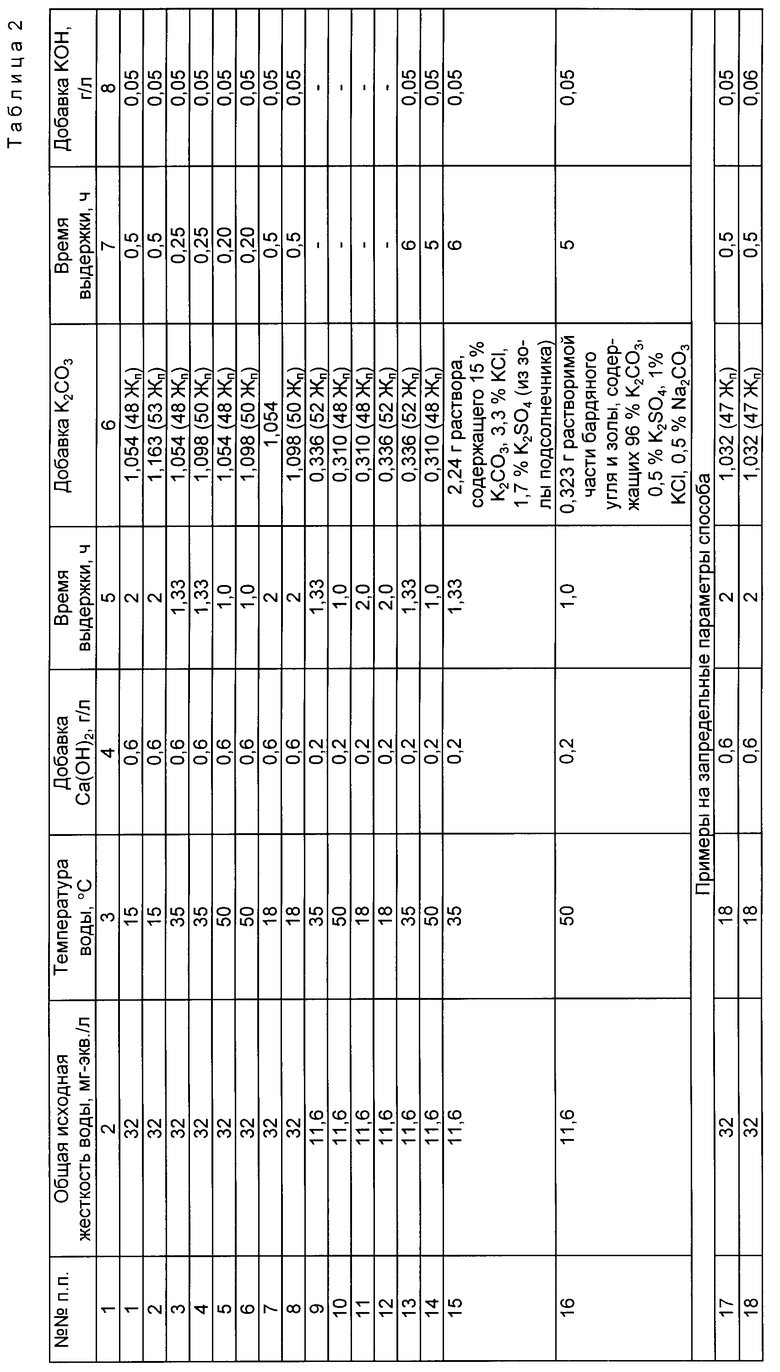
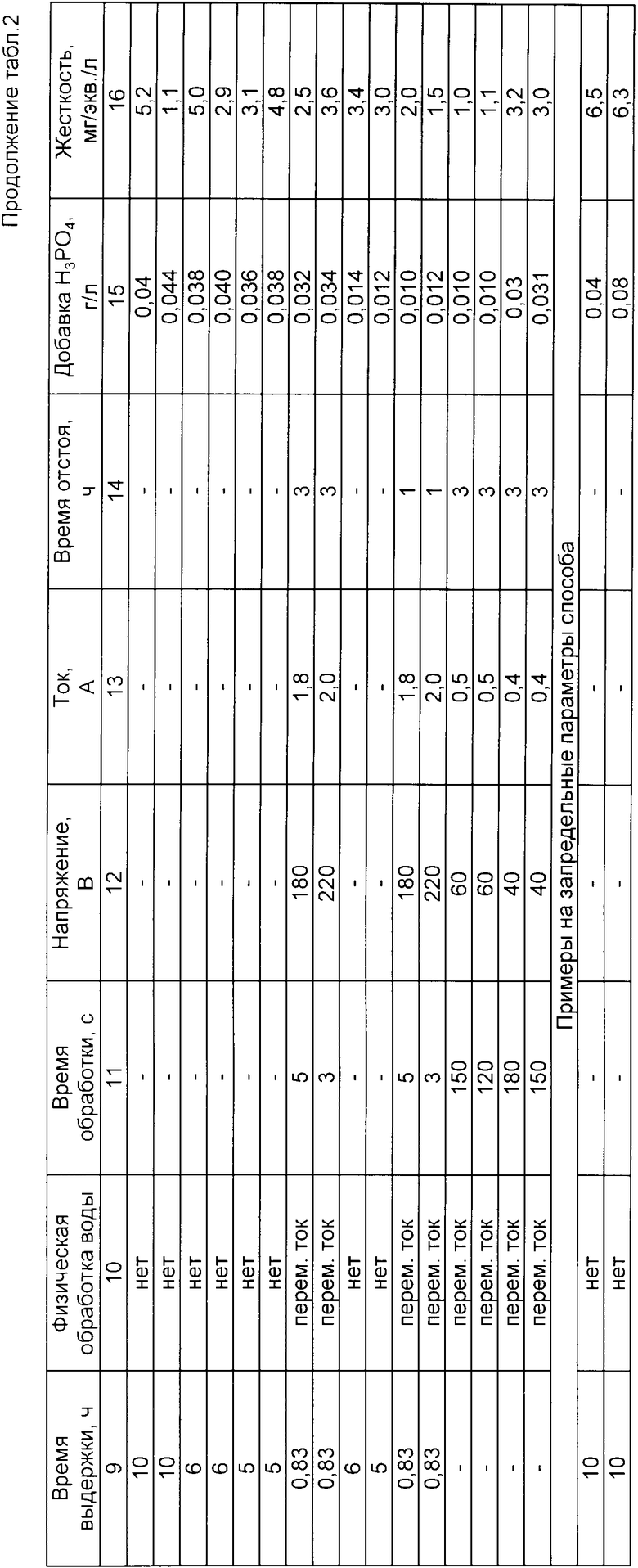
Использование: умягчение и улучшение качества питьевой воды. Сущность изобретения: в воду последовательно вводят гидроксид кальция, углекислый калий и едкий калий. Углекислый калий вводят в количестве, определяемом зависимостью 48 - 53 Жп, где Жп - постоянная жесткость исходной воды, а едкий калий вводят в количестве не более 50 мг/л. После отделения осадка воду обрабатывают пищевой кислотой до рН ≤ 8. В качестве углекислого калия можно использовать растворимую часть золы подсолнечника состава: углекислый калий 15%, хлористый калий 3,3%, сернокислый калий 1,7% или растворимую часть бардяного угля и золы, сухое вещество которых содержит углекислого калия 81 - 96%, сернокислого калия 0,5 - 2,5%, хлористого калия 1,0 - 6,4%, углекислого натрия 0,5 - 10,0%. Перед введением добавок воду предварительно нагревают до температуры 35 - 50oС. После введения всех добавок воду обрабатывают в переменном электрическом поле. 4 з.п.ф-лы, 2 табл.
| Краткий справочник химиков | |||
| Составитель В.И.Перельман, изд, 6, Государственное научно-техническое издательство химической литературы, М., 1963, с | |||
| 336 - 370. |
Авторы
Даты
1998-03-10—Публикация
1993-08-25—Подача