Изобретение относится к способам повышения выживаемости и жизнеспособности личинок и молоди рыб и рыбообразных в условиях воздействия стрессорных факторов, возникающих в процессе пересадки, сортировки, транспортировки рыб, а также при воздействии некоторых токсикантов, загрязняющих водную среду, и может быть использовано в рыбоводстве.
В настоящее время для повышения выживаемости и жизнестойкости рыб на ранних стадиях развития широко известно использование биологически активных веществ, влияющих на физиологические процессы у рыб.
Известен способ выращивания молоди рыб карпа и форели, который включает кормление рыб кормом, содержащим биологически активное вещество, в качестве которого использован порошок, полученный путем лиофилизации водно-спиртового экстракта тканей растения Serratula inermis, при этом его вводят в корм в количестве 0,002 - 0,003 мг/кг, кормление карпа осуществляют в течение 100 сут, а форели - 120 сут [1].
Для стимуляции жизненных процессов по данному способу используют препарат, содержащий в основном гормоны стероидной природы. Однако такие вещества накапливаются в организме и не выводятся, при длительном употреблении могут воздействовать на геном клетки и способствовать появлению мутаций. Кроме того, способ неудобен тем, что предполагает длительный срок кормления (100 - 120 сут).
Известен способ повышения жизнестойкости рыб путем обработки икры биологически активным веществом в водной среде [2]. По данному способу с целью увеличения выживаемости икры и личинок рыб при токсикологической ситуации икру обрабатывают раствором витамина B12 в количестве 0,4 - 1,0 мг/л воды в течение 2-6 ч. Однако использование данного способа затруднено в промышленных условиях, так как витамин B12 относится к веществам, трудно растворимым в воде.
Наиболее близким по технической сущности к предлагаемому является способ стимуляции физиологических процессов у рыб на ранних стадиях развития, который выбран за прототип [3].
По данному способу икру и личинки рыб, преимущественно лососевых, выдерживают в водном растворе биологически активного вещества, в качестве которого используют синтетический аналог энкефалина - (Д-Ала)2-(Д-Арг)6-Лей-энкефалин ("даларгин"), при этом указанное вещество добавляют до концентрации его в воде 1-10 мг/л, выдерживание объектов осуществляют в течение 1-4 ч.
Даларгин представляет собой низкомолекулярное соединение пептидной природы и относится к нейропептидам, которые обладают широким спектром эффектов, в том числе воздействуют на нервную систему организма. Обработка даларгином увеличивает жизнеспособность икры и личинок, стимулирует их рост. При этом даларгин не накапливается в организме рыб, не вызывает аллергических реакций.
Однако указанный способ используется для стимуляции физиологических процессов у рыб на ранних стадиях онтогенеза (икры, предличинок, личинок) и не предполагает обработку молоди рыб. При этом способ предназначен для повышения выживаемости и стимуляции развития рыб, но не предусматривает повышение устойчивости рыб к кратковременным стрессорным воздействиям. Между тем для промышленного рыбоводства актуальной задачей является повышение резистентности как личинок, так и молоди рыб к воздействию стрессорных факторов, связанных с пересадкой, сортировкой, транспортировкой рыб, а также к воздействию химических стрессорных факторов (токсикантов), загрязняющих водную среду.
Предлагаемый способ решает задачу повышения жизнеспособности рыб и рыбообразных за счет увеличения резистентности объектов (личинок и молоди рыб) к воздействию стрессорных факторов различной природы путем обработки их биологически активным веществом, выделенным из ткани пинеальной железы.
Указанный биотехнологический результат достигается тем, что личинок или молодь рыб и рыбообразных выдерживают в водном растворе биологически активного вещества, представляющего собой комплекс пептидов, полученный путем лиофилизации кислотного экстракта ткани пинеальной железы крупного рогатого скота, при этом концентрацию раствора устанавливают 10-50 мг/л, а экспозицию объектов в растворе осуществляют в течение 1-1,5 ч.
Используемое в предлагаемом способе биологически активное вещество получают следующим образом. Ткань пинеальной железы крупного рогатого скота гомогенизируют, проводят двукратную экстракцию 0,1-1,0 н. водным раствором перхлорной кислоты при температуре 2-6oC в течение 12-48 ч, после чего полученный экстракт нейтрализуют водным раствором гидроокиси калия, осуществляют очистку и выделение полученного препарата прогреванием и двойной лиофилизацией нейтрализованного экстракта.
В результате выделяется вещество, представляющее собой комплекс пептидов, содержащий 5 - 22 фракции, основную массу (70-80%) комплекса составляют пептиды мол. м. 1000 - 4500 Дальтон. Полученный продукт является аморфным веществом белого или слегка желтоватого цвета, хорошо растворимым в воде, слабой щелочи и солевых растворах. Препарат эффективно применяли ранее для стимуляции роста и иммунной активности, подавления половых функций различных представителей позвоночных животных (грызуны, птицы).
Выдерживание личинок и молоди рыб и рыбообразных в водном растворе комплекса пептидных фракций, полученного из пинеальной ткани, основано на том, что пептиды, проникая в организм рыб и рыбообразных, вызывают изменения метаболических процессов, способствующих оптимизации механизмов нейроэндокринной регуляции жизнедеятельности. В результате повышается адаптация организмов к воздействию стрессорных факторов различной природы и тем самым повышается жизнеспособность рыб и рыбообразных.
В связи с тем, что используемый комплекс пептидов влияет на метаболические процессы и нейроэндокринную систему, обработке водным раствором комплекса пептидов подвергают рыб и рыбообразных как на самых ранних стадиях развития, так и в то время, когда в организме уже сформированы и функционируют основные элементы указанных систем, то есть обрабатывают и молодь. Использование в качестве биологически активного вещества не индивидуального пептида, а комплекса пептидных фракций, вызывает сбалансированную ответную реакцию различных систем организма, что обеспечивает эффективность увеличения жизнеспособности рыб и рыбообразных и повышает надежность способа. Выбор концентрации водного раствора препарата, используемого в данном способе, обусловлен тем, что максимальный эффект повышения жизнеспособности рыб и рыбообразных наблюдался при концентрации 10-50 мг/л. Повышение концентрации раствора более 50 мг/л не приводило к заметному повышению положительного эффекта способа. При концентрации раствора менее 10 мг/л способ оказывается малоэффективным. Время экспозиции рыб и рыбообразных в водном растворе препарата выбрано 1-1,5 ч, так как это время обеспечивает достаточно полное проявление биологического эффекта. Увеличение времени более 1,5 ч не приводит к заметному усилению эффекта обработки рыб и рыбообразных указанным раствором препарата.
Способ осуществляют следующим образом.
В емкость с водой добавляют аморфное вещество белого или желтоватого цвета, хорошо растворимое в воде, представляющее собой биологически активный препарат, полученный из пинеальной ткани по приведенной ранее методике. Концентрацию водного раствора препарата в емкости устанавливают 10-50 мг/л. Личинки или молодь рыб (рыбообразных) помещают в данную емкость и выдерживают их в указанном растворе в течение 1-1,5 ч. После этого рыб (рыбообразных) вынимают из емкости с раствором и переводят в чистую воду.
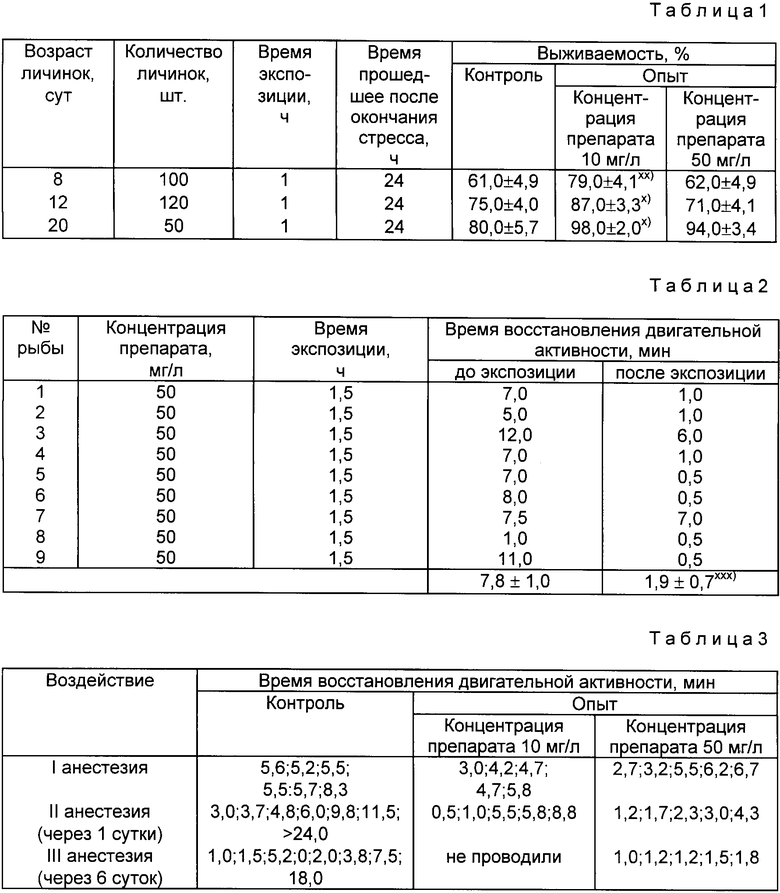
Пример 1. Осуществляли обработку личинок стерляди предлагаемым способом с целью повышения их жизнеспособности к хендлингу, который является стрессорным фактором для рыб.
Опытные группы личинок стерляди в возрасте 8, 12 и 20 сут помещали в емкость с водой, в которой предварительно растворили биологически активный препарат, содержащий комплекс пептидов, полученный из ткани пинеальной железы. Концентрацию препарата в растворе устанавливали 10 мг/л для одних опытных групп и 50 мг/л для других опытных групп. Время экспозиции личинок в указанных растворах составило 1 ч.
По окончании экспозиции личинки подвергали стрессу, возникающему в связи с пересадкой личинок. Для этого многократно отлавливали личинок сачком и переносили из одной емкости в другую с чистой водой. После окончания стрессорного воздействия личинки помещают в обычную водную среду.
Спустя 24 ч после указанной процедуры в каждой группе определяли выживаемость объектов, для чего подсчитывали количество выживших личинок и вычисляли процентное отношение выживших личинок к общему количеству личинок, участвовавших в опыте.
Для сравнения брали контрольные группы личинок стерляди, содержащие такое же количество личинок в возрасте 8, 12 и 20 сут, что и опытные группы. Контрольных личинок выдерживали 1 ч в обычной водной среде, после чего их также подвергали стрессорному воздействию, возникающему при многократной пересадке личинок из емкости в емкость. После окончания воздействия контрольных личинок помещали в обычную водную среду. Спустя 24 ч после окончания стрессорного воздействия аналогичным образом (как для опытных групп личинок) определяли выживаемость контрольных личинок.
Результаты исследований приведены в табл. 1.
В табл. 1-4 имеются следующие сноски: х достоверность отличия результатов измерения, полученных для личинок в данной опытной группе, от результатов измерения, полученных для контрольных личинок, находится на уровне p < 0,05; хх достоверность отличия находится на уровне p < 0,01; ххх достоверность отличия находится на уровне p < 0,001.
Как следует из табл.1, выживаемость личинок, обработанных предлагаемым способом в растворе препарата с концентрацией 10 мг/л, достоверно выше во всех группах опытных личинок, чем у контрольных личинок. Для личинок, обработанных в растворе препарата с концентрацией препарата 50 мг/л, выживаемость достоверно выше оказалась в группе, содержащей 50 личинок в возрасте 20 сут.
В целом можно сделать вывод о положительном влиянии обработки личинок стерляди по предлагаемому способу на повышение их жизнеспособности в случае воздействия стрессорного фактора - хендлинга.
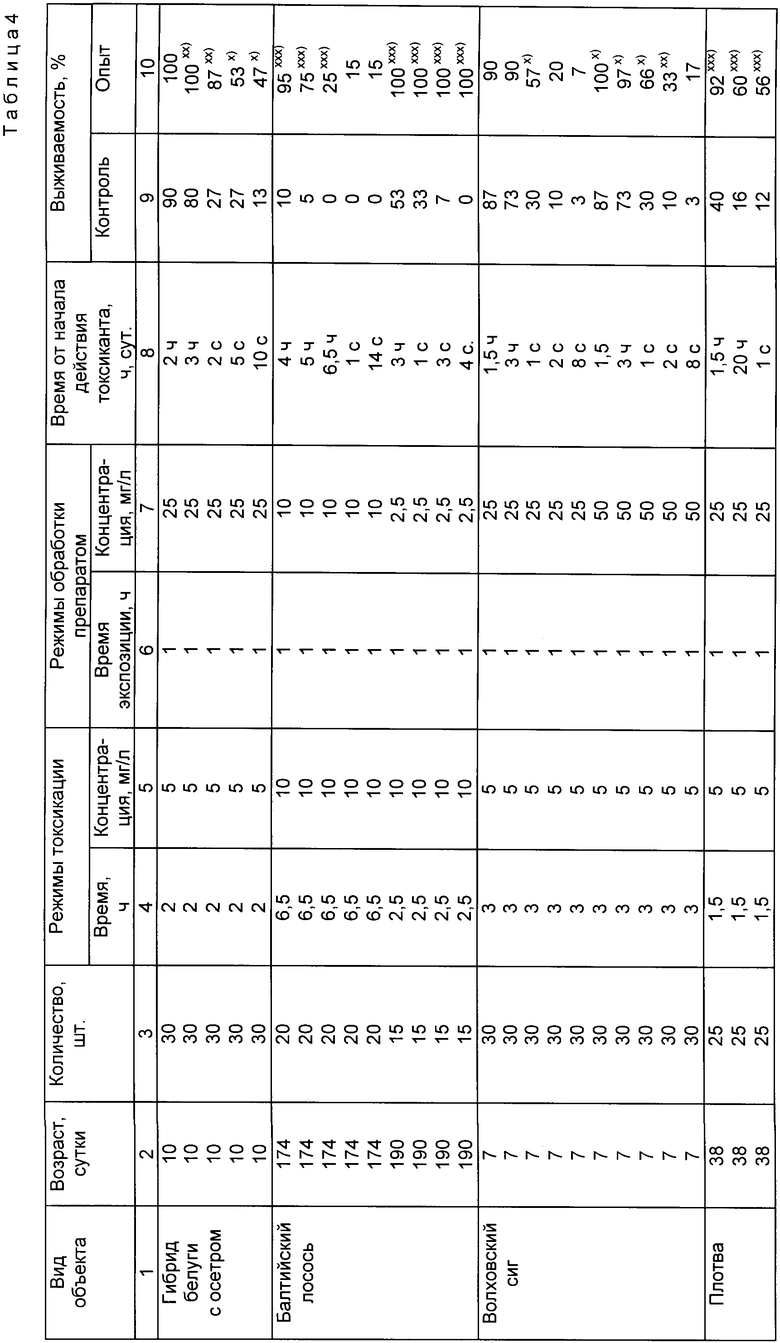
Пример 2. Осуществляли обработку молоди гибрида осетра и белуги с целью повышения ее жизнеспособности после воздействия стрессорного фактора - асфиксии.
Об устойчивости рыб к асфиксии судили по времени восстановления их двигательной активности.
Группу рыб, содержащую 9 шт. молоди гибрида осетра и белуги в возрасте 9-10 мес, помещали в кюветы с водой, разделенные на ряд секторов. Регистрировали двигательную активность каждой рыбы, подсчитывая количество пересечений ею границ секторов за 1 мин.
После регистрации исходной двигательной активности рыб подвергали асфиксии, для чего извлекали их из воды и выдерживали на воздухе в течение 2-2,5 мин (в зависимости от размера рыбы). После выдерживания на воздухе рыб вновь возвращали в кюветы. В течение 10-20 с рыбы совершали судорожные движения, а затем теряли подвижность на несколько минут. После этого рыбы вновь начинали плавать. Определяли время восстановления двигательной активности для каждой рыбы, регистрируя период времени (мин), в течение которого количество пересечений рыбой границ секторов в кювете за 1 мин составило 30-60% от исходного количества пересечений, совершаемых рыбой до асфиксии.
Каждую рыбу обрабатывали предлагаемым способом, для чего рыб погружали в емкость, содержащую водный раствор препарата, полученного из пинеальной ткани. Концентрацию препарата в растворе устанавливали 50 мг/л, время экспозиции рыб в растворе препарата составило 1,5 ч.
Вынимали рыб из емкости и вновь подвергали их асфиксии, для чего выдерживали рыб на воздухе в течение 2-2,5 мин. После окончания стрессорного воздействия рыб помещали в кюветы с секторами, заполненные обычной водной средой. Аналогичным образом, как указано выше, определяли время восстановления двигательной активности для каждой рыбы.
Результаты испытаний представлены в табл.2.
Как следует из табл.2, двигательная активность рыб после экспозиции их в растворе препарата, полученного из пинеальной железы, восстанавливалась значительно быстрее, чем без экспозиции. Таким образом, можно сделать вывод о положительном влиянии обработки рыб предлагаемым способом на повышение их устойчивости к асфиксии.
Пример 3. Осуществляли обработку молоди гибрида белуги и осетра предлагаемым способом с целью повышения устойчивости их организма к наркотическому воздействию менокаина, используемого в рыбоводстве, в частности, при транспортировке рыбы, сортировке, мечении.
Устойчивость к наркотическому воздействию определяли по времени восстановления двигательной активности рыб в чистой воде после полной анестезии их менокаином. Исследовали контрольную группу рыб, содержащую 7 шт. молоди гибрида белуги и осетра. Подвергали контрольных рыб полной анестезии водным раствором менокаина в концентрации 220 мг/л (I анестезия). После анестезии рыб опускали в аквариум с чистой водой и определяли время восстановления двигательной активности каждой рыбы, регистрируя период времени (мин), в течение которого рыбы впервые, после полной неподвижности, начинают поступательно перемещаться в толще воды.
Через 1 сут после начала эксперимента проводили повторную анестезию рыб раствором менокаина (II анестезия) и вновь регистрировали время восстановления их двигательной активности. Через 6 сут после начала эксперимента вновь проводили анестезию рыб раствором менокаина (III анестезия) и определяли время восстановления их двигательной активности.
Исследовали две опытные группы рыб, содержащие по 5 шт. молоди гибрида белуги и осетра.
Опытные группы рыб обрабатывались предлагаемым способом, для чего рыб помещали в емкости, содержащие водный раствор препарата, полученного из пинеальной ткани. Концентрацию препарата в растворе для одной группы рыб устанавливали 10 мг/л, для другой группы - 50 мг/л. Время экспозиции рыб в растворе препарата составило 1 ч.
После окончания экспозиции рыб в растворе препарата осуществляли их полную анестезию раствором менокаина концентрацией 220 мг/л (I анестезия). После анестезии рыб переводили в емкости с чистой водой и определяли время восстановления двигательной активности каждой рыбы аналогично определению для контрольных рыб.
Через 1 сут осуществляли повторную анестезию опытных рыб раствором менокаина (II анестезия) и определяли время восстановления их двигательной активности.
Через 6 сут для опытной группы рыб, обработанных препаратом концентрацией 50 мг/л, осуществляли анестезию рыб раствором менокаина (III анестезия) и определяли время восстановления их двигательной активности.
Результаты исследования представлены в табл. 3.
Как следует из табл.3, после I-й анестезии отмечалась явная тенденция к снижению времени восстановления двигательной активности в каждой опытной группе рыб, обработанных предлагаемым способом. Достоверное снижение времени восстановления двигательной активности (P < 0,01) выявлено для опытной группы рыб, обработанных препаратом концентрацией 50 мг/л после II-й и III-й анестезии.
Таким образом, обработка молоди гибрида белуги и осетра предлагаемым способом повышает их устойчивость к наркотическому воздействию.
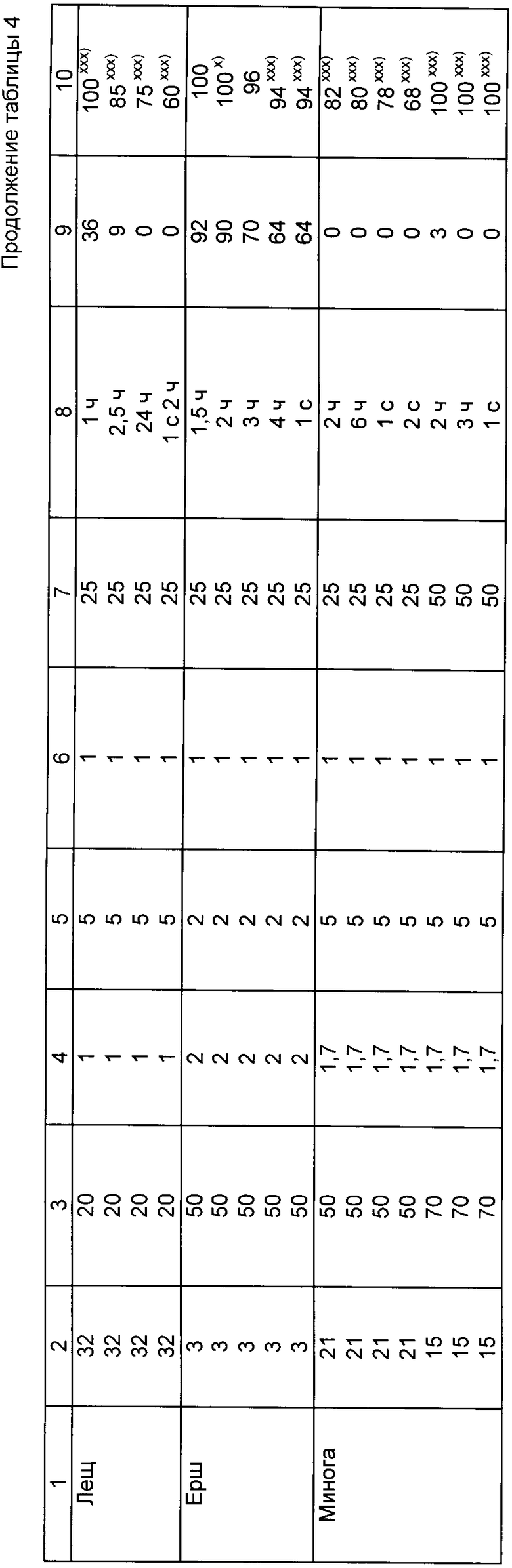
Пример 4. Осуществляли обработку личинок и молоди различных видов рыб и рыбообразных с целью повышения их устойчивости к воздействию стрессорного фактора химической природы.
Опытные группы личинок или молоди различных видов рыб или рыбообразных (минога) обрабатывали предлагаемым способом, выдерживая их в течение 1 ч в емкостях, содержащих водный раствор препарата, полученного из пинеальной ткани. Концентрацию препарата в растворе устанавливали в диапазоне 10-50 мг/л.
Контрольные группы рыб, содержащие то же самое количество личинок или молоди того же вида и возраста, выдерживались такое же время в обычной воде без добавления препарата.
После этого в емкости, содержащие группы контрольных и обработанных препаратом личинок или молоди, добавляли раствор токсиканта (медный купорос) до концентрации 2-10 мг CuSO4 • 5H2O/л воды (сублетальная или летальная доза). Продолжительность выдерживания личинок или молоди рыб в растворе медного купороса 1 - 6,5 ч.
Определяли выживаемость объектов исследования, подсчитывая процентное отношение выживших объектов к исходному количеству объектов в каждой группе. Выживаемость объектов определяли в течение нескольких суток (1 - 14 сут) после окончания воздействия, а также во время воздействия CuSO4 (для некоторых групп объектов).
Результаты исследования представлены в табл. 4.
Как следует из табл. 4, для всех видов объектов отмечено достоверное увеличение выживаемости объектов, обработанных предлагаемым способом, по сравнению с контрольными группами. Следовательно, обработка рыб и рыбообразных предлагаемым способом положительно сказывается на повышении жизнеспособности к воздействию стресса химической природы - токсикации CuSO4.
Как следует из приведенных примеров, предлагаемый способ оказывает положительное влияние на повышение жизнеспособности рыб и рыбообразных на ранних стадиях развития. При этом важным преимуществом данного способа является повышение резистентности организмов личинок и молоди рыб и рыбообразных к воздействию стрессорных факторов различной природы, которые испытывают рыбы и рыбообразные при пересадке, сортировке, транспортировке, асфиксии, а также к наркотическим воздействиям и некоторым химическим загрязнениям.
Способ безопасен, так как используемый в нем комплекс пептидов, выделенный из пинеальной ткани, не накапливается в организме, не оказывает вредное влияние на ДНК, не вызывает аллергических реакций.
Способ прост, удобен для использования в промышленных условиях, экономичен и экологически безопасен, так как в нем используется не синтетический, а натуральный препарат с высокой биоразлагаемостью. Способ имеет широкую область применения, так как в нем используется препарат, не обладающий видовой специфичностью.
Источники информации.
1. Авторское свидетельство СССР N 1671210, кл. A 01 K 61/00.
2. Авторское свидетельство СССР N 1243667, кл. A 01 K 61/00.
3. Авторское свидетельство СССР И 1286138, кл. A 01 K 61/00.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНОГО ПЕПТИДНОГО ПРЕПАРАТА, ОБЛАДАЮЩЕГО АДАПТОГЕННЫМИ СВОЙСТВАМИ | 1992 |
|
RU2082429C1 |
| Способ повышения эффективности выращивания молоди рыбы семейства карповых | 2019 |
|
RU2708152C1 |
| СПОСОБ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ ВЫРАЩИВАНИЯ МОЛОДИ РЫБЫ | 2014 |
|
RU2582340C1 |
| ПРЕПАРАТ АНТИСТРЕССОВОГО ДЕЙСТВИЯ НА РЫБ И СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ | 1999 |
|
RU2156571C1 |
| КОМПОЗИЦИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ ПРЕПАРАТОВ ДЛЯ ПОВЫШЕНИЯ ВЫЖИВАЕМОСТИ ОСЕТРОВЫХ РЫБ ПРИ ИСКУССТВЕННОМ ВОСПРОИЗВОДСТВЕ | 2010 |
|
RU2453112C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИЧИНОК И МАЛЬКОВ ОСЕТРОВЫХ РЫБ | 2013 |
|
RU2564840C2 |
| СПОСОБ СТИМУЛЯЦИИ РАЗВИТИЯ ОСЕТРОВЫХ РЫБ | 2005 |
|
RU2298921C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОРМОВОЙ ДОБАВКИ ДЛЯ РЕАЛИЗАЦИИ БИОЛОГИЧЕСКОГО ПОТЕНЦИАЛА РЫБ | 2016 |
|
RU2619984C1 |
| СПОСОБ ВЫРАЩИВАНИЯ МОЛОДИ РЫБ | 2014 |
|
RU2574131C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИЧИНОК И МАЛЬКОВ РЫБ | 2005 |
|
RU2303352C2 |
Изобретение предназначено для повышения жизнеспособности личинок и молоди рыб и рыбообразных и может быть использовано в рыбоводстве, что позволяет решить задачу повышения резистентности объектов к воздействию стрессорных факторов различной природы. Способ предусматривает добавление в водную среду биологически активного вещества, полученного путем лиофилизации кислотного экстракта ткани пинеальной железы, и выдерживание рыб и рыбообразных в указанном водном растворе в течение 1 - 1,5 ч при концентрации раствора 10 - 50 мг/л. 4 табл.
Способ повышения жизнеспособности предличинок, личинок и молоди рыб и рыбообразных (на ранних стадиях их развития) путем добавления в водную среду биологически активного вещества и выдерживания объектов в полученном растворе в течение 1,0 - 1,5 ч, отличающийся тем, что в качестве биологически активного вещества используют комплекс пептидов, полученный путем лиофилизации кислотного экстракта ткани пинеальной железы, при этом добавление указанного вещества проводят до концентрации 10 - 50 мг/л.
| SU, авторское свидетельство, 1286138, кл | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
1998-07-20—Публикация
1994-07-21—Подача