Эта заявка является частичным продолжением заявки США N 08/057288 от 5 мая 1993 г.
Изобретение касается области лечения и профилактики болезни. В частности, оно касается лечения и профилактики инфекций Toxoplasma gondii.
Токсоплазмоз вызывается паразитическим простейшим, Toxoplasma gondii. У человека болезнь обычно связана с развивающимся плодом, у него она может вызывать тяжелые нейрологические проблемы, проявляющиеся как водянка головного мозга, умственная отсталость и/или слепота [1, 2]. У взрослого человека болезнь обычно проявляется в мягкой форме, вызывая немногие, если вообще вызывает, симптомы. У взрослого человека со слабым иммунитетом, однако, паразит может вызывать тяжелые или даже фатальные заболевания [3, 4, 5]. Болезнь также встречается у других млекопитающих и ведет к самопроизвольному выкидышу у овец.
Паразит широко распространен и обычно приобретается при потреблении недоготовленного мяса, ткани которого содержат цисты паразита. Эта разновидность очень инфекционна, если мясо не очень хорошо приготовлено. Альтернативно паразитами могут заражаться при потреблении пищи, содержащей ооцисты, которые распространяются фекалиями зараженных кошек. Ооцисты являются результатом общего полового цикла. Форма ооцисты является высоко устойчивой к разложению природными факторами и существует в почве более одного года после выделения кошкой. В США серологическое изучение показывает, что приблизительно 10 - 50% населения контактирует с паразитом, распространение зависит от географического расположения и этнической группы [21]. В странах, где потребляют слегка поджаренное или сырое мясо обычно картина может повышаться до 85% (например, во Франции)[7]. Случаи заболеваний у развивающегося плода, к счастью, не столь высоки, как эта картина, потому что предполагают, что плод женщин, которые подвергаются заражению задолго до наступления беременности, обычно не подвергается риску [21].
Диагноз врожденной инфекции в прошлом делали на основе серологии (обзор в [1, 2] ). Его можно проверить после родов или идеально до родов по относительным титрам IgG и IgM (для выяснения или титров, обусловленных текущей инфекцией, или последствиями прошлой инфекции). Факторы, обуславливающие тяжесть болезни развивающегося плода плохо понятны. Хорошо установленным фактором является фактор, что время начального заражения матери относительно зачатия является критическим: инфекции задолго до зачатия устанавливает у матери эффективную ответную иммунную реакцию, давая в результате очень небольшую, если вообще давая, болезнь плода. Инфекция непосредственно перед или после зачатия (т.е. в первые три месяца беременности) дает в результате тяжелое поражение для приблизительно 10 - 15% плодов [21].
В последние два десятилетия токсоплазмоз существенно увеличился для относительно новой группы пациентов, обладающих в некоторых случаях иммунным дефицитом в результате терапии после трансплантации [5, 9, 10, 22], в результате новообразований [11, 12, 13, 22] или совсем недавно появившегося синдрома иммунного дефицита (СПИД) [3, 4, 5]. У пациентов с иммунным дефицитом паразит может вызывать рассеянную, потенциально фатальную, форму болезни [5, 22, 27].
Обычно больные СПИДом с токсоплазмозом проявляют признаки, относящиеся к центральной нервной системе, в качестве первого симптома болезни (сообщено в [22] ), так как одной из наиболее подверженных воздействию паразита тканей является мозг, где может быть найдено большое число паразитов и тканевых цист. Однако заражение не ограничивается мозгом, и паразиты и тканевые цисты могут быть найдены во всем теле [11]. Обычным способом диагностики является серология, компьютерная томография, магнитный резонанс и/или биопсия мозга [1, 15, 16]. Из этих методов точным путем диагноза является только биопсия мозга, так как это дает возможность прямого визуального определения паразита при использовании иммунного метода с пероксидазным окрашиванием [17].
Почти у всех больных СПИДом и в большинстве случаев токсоплазмоза у раковых больных и у больных с пересаженными почками токсоплазмоз является результатом рецидива предыдущей (т. е. хронической) инфекции Toxoplasma. Противоположностью являются пациенты с риском острой приобретенной инфекции, такие как плоды предварительно незараженных беременных женщин или предварительно незараженный реципиент трансплантируемого органа, который получает орган от донора с положительной серологической реакцией (т.е. зараженного Toxoplasma).
В общих чертах существует три типа терапии: острая терапия, первичная профилактика и вторичная профилактика. Острая терапия включает лечение острой фазы заражения. У некоторых групп пациентов с тяжело ослабленной иммунной системой за острой терапией следует вторичная профилактика (известная также как поддерживающая терапия), которая может продолжаться всю жизнь. Первичная профилактика отражает мероприятия, предохраняющие от возникновения заражения. Первичная профилактика часто используется для больных с пересаженным сердцем. Первичная профилактика используется также для беременных женщин для предохранения перенесения от матери плоду; так что лечение предполагается для предохранения матери, которая подверглась острой инфекции во время беременности, от проникновения паразита к ее плоду, так же как и для лечения плода в матке. Первичная профилактика часто также используется для больных СПИДом для предупреждения активирования их латентных (хронических) токсоплазмоинфекций.
Ход лечения токсоплазмоза у беременных определяется сроком беременности и тем, является ли инфекция острой или хронической. Целью раннего лечения является попытка предохранить перенос паразита к плоду. Однако плод может лечиться при лечении матери в период беременности. Если инфекция острая, то может вводиться антибиотический спирамицин, но эффективность этого не подтверждена. Более эффективные препараты, такие как пириметамин и сульфадиазин, особенно при использовании в комбинации, часто используются после первых трех месяцев беременности (пириметамин может быть тератогенным) при диагнозе заражения плода с помощью техники диагностики беременных. Иначе говоря, эта данная комбинация лекарственных препаратов обычно не используется в течение беременности из-за потенциальной токсичности для матери и развивающегося плода [21].
Лечение токсоплазмоза у небеременных начинается и продолжается курсом препаратов, включающих комбинацию антагонистов фолата, таких как пириметамин и сульфадиазин [1, 14]. Если болезнь идентифицируется достаточно скоро, лечение довольно эффективно при борьбе с острым заболеванием. Однако вследствие плохой толерантности препаратов, особенно сульфасоединений для больных СПИДом, проведение лекарственной терапии часто невозможно и часто наблюдают рецидив инфекции (так что лекарственная терапия снижает, но не исключает инфекцию паразитом).
Рифамициновые соединения являются макроциклическими антибиотиками, которые проявляют пригодность для ряда селективных терапевтических применений. Например рифамин имеет следующую структуру: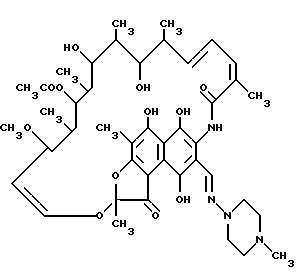
Однако при испытании рифампина на эффективность при лечении токсоплазмоза показано отсутствие защитного действия на мышах, подвергшихся заражению летальной дозой таксоплазмы [18]. Рифампин в концентрации 50 мкг/мл и более значительно ингибирует размножение токсоплазмы в культуре L-клеток. Однако подобные концентрации также ингибируют рост L-клеток. Так как токсичность рифампина для L-клеток и его внутриклеточное ингибирование размножения токсоплазма in vitro имело место при одних и тех же концентрациях препарата, то сообщается [18], что рифампин, вероятно, ингибирует размножение токсоплазмы с помощью токсического эффекта на L-клетки. С другой стороны рифамициновые соединения в большинстве случаев рассматриваются эффективными против ограниченного ряда патологических организмов, обычно грамположительных бактерий (включая микобактерии, стафилококки и стрептококки) и некоторых грамотрицательных бактерий (например, Brucella, Chlamydia, Haemophilus, Legonella и Neisseria spp); другие грамотрицательные бактерии (например энтеробактерии) менее чувствительны, и спирохеты и микоплазмы известны нечувствительными для лечения [19]. Индивидуальные соединения из серии рифамицина могут быть вполне специфическими при их клинических показаниях. Например, Physicians Desk Reference (1993 редакция) перечисляет только туберкулез и бессимптомную инфекцию с N. meningitidis в качестве показаний для лечения рифамидином. Родственное соединение рифабутин, которое является спиропиперидиновым производным рифамицина, также главным образом используется для лечения микобактериальных инфекций, особенно туберкулеза [20]. Недавно он использовался для первичной профилактики Mycobacterium avium-intracellulare инфекций у пациентов со СПИДом [25]. Однако эти применения направлены на бактерии, не на простейших, которые являются членами царства животных.
Таким образом, остается необходимость в разработке терапевтических и профилактических методов, которые могут заметно сокращать заболеваемость токсоплазмозом. С помощью расширения спектра препаратов для лечения токсоплазмоза могут быть преодолены проблемы, возникающие из-за резистентности паразита и побочного действия существующих медикаментов.
Целью настоящего изобретения является создание класса соединений, эффективного для защиты зараженных или потенциально зараженных хозяев-млекопитающих от токсоплазмоза.
Дополнительной целью изобретения является создание такого класса соединений с минимальным побочным эффектом.
Еще одной дополнительной целью изобретения является создание композиции, эффективной in vivo для предупреждения летального действия токсоплазмоза или, иначе говоря, снижения тяжести заболевания, предпочтительно с классом соединений с испытанной клинической толерантностью для других показаний.
Эти и другие цели изобретения, как становится далее очевидно, достигаются с помощью предлагаемого метода снижения тяжести токсоплазмоза, обусловленного заражением млекопитающего-хозяина Toxoplasma gondii, который включает введение млекопитающим при необходимости такого лечения или после заражения, или перед воздействием такой инфекции терапевтически эффективного количества соединения, которое является спиропиперидиновым производным рифамицина S, где производные содержат имидазольное кольцо, включающее атомы углерода в положениях 3 и 4 из рифамицинового кольца, атом углерода в положении 2 имидазольного кольца также является атомом углерода положения 4 пиперидинового кольца, тем самым образуя спиропиперидиновую систему колец, которая необязательно включает низший углеводородный заместитель у атома азота пиперидина.
Изобретение лучше понимается при ссылке на следующее детальное описание специфических воплощений, когда они рассматриваются в комбинации с чертежами, являющимися частью описания.
Фиг. 1 является графиком, показывающим выживаемость мышей: а - зараженных T. gondii и обработанных различными концентрациями рифабутина (RIF), б - после заражения цистами штамма C56 T. gondii и обработанных различными концентрациями рифабутина (RIF).
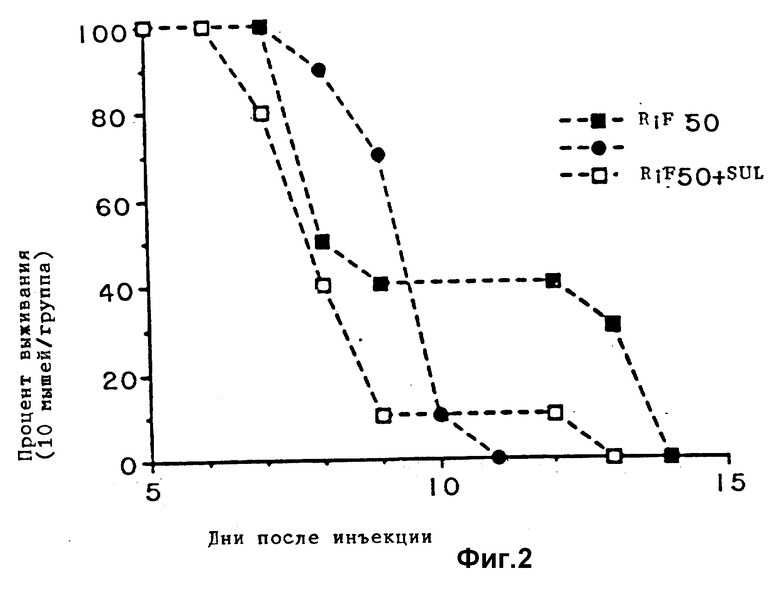
фиг. 2 является графиком, показывающим выживаемость мышей, зараженных T. gondii и обработанных низкими концентрациями рифабутина (RIF) одного или в комбинации с сульфадиазином (SUL).
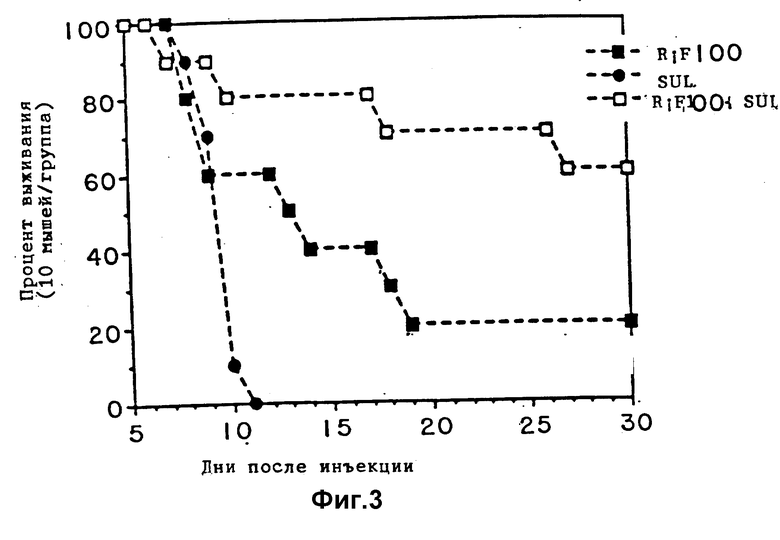
Фиг. 3 является графиком, показывающим выживание мышей, зараженных T. gondii и обработанных умеренными концентрациями рифабутина одного или в комбинации с сульфадиазином.
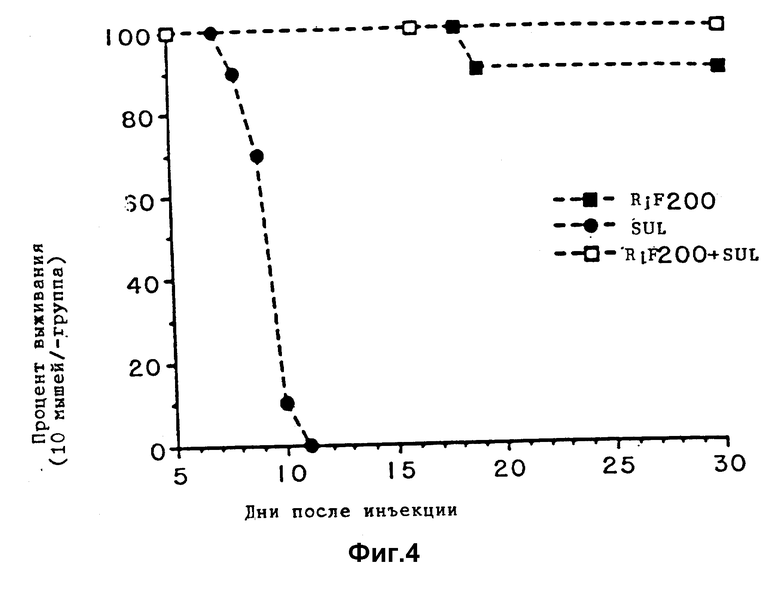
Фиг. 4 является графиком, показывающим выживание мышей, зараженных T. gondii и обработанных высокими концентрациями рифабутина одного или в комбинации с сульфадиазином.
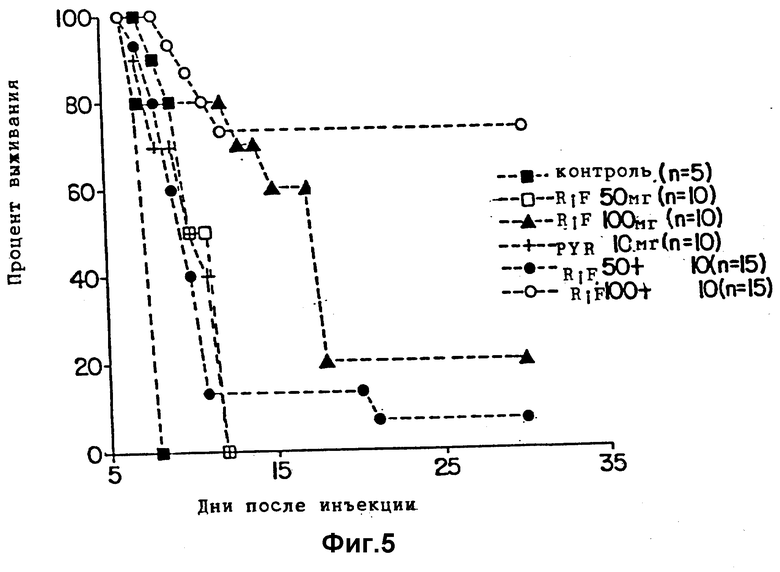
Фиг. 5 является графиком, показывающим выживание мышей, зараженных T. gondii и обработанных рифабутином (RIF) одним или в комбинации с пириметамином (PYR).
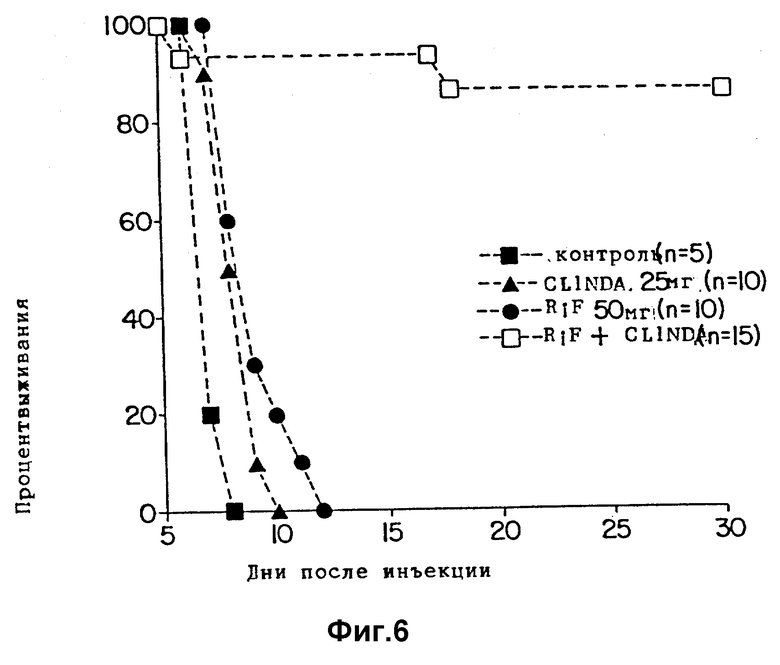
Фиг. 6 является графиком, показывающим выживание мышей, зараженных T.gondii и обработанных рифабутином (RIF) одним или в комбинации с клиндамицином (CLINDA).
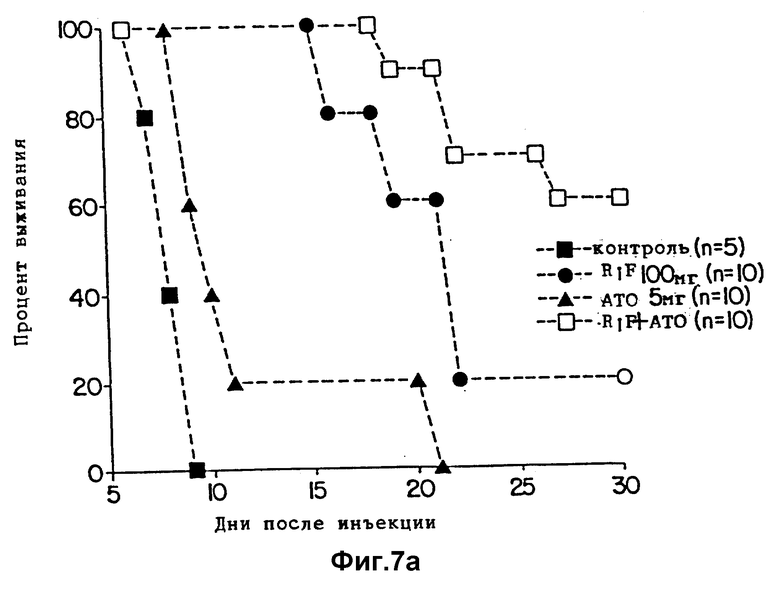
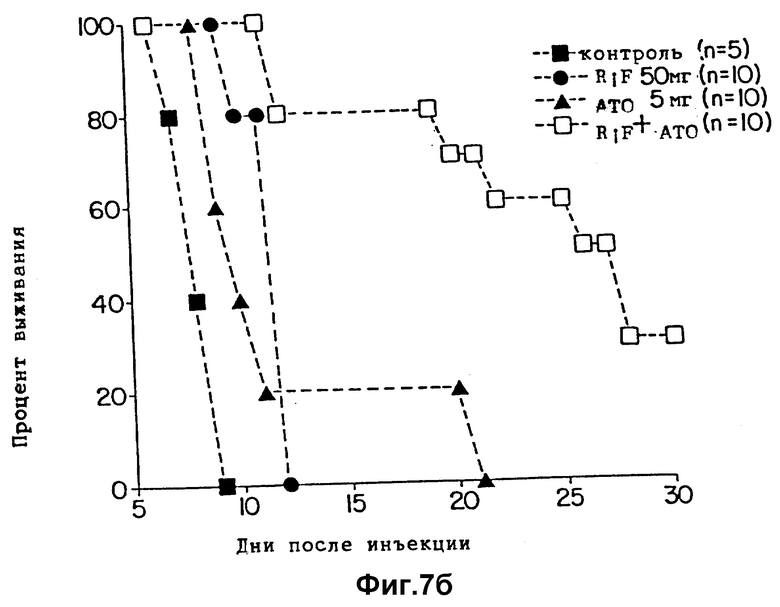
Фиг. 7(а, б) показывает выживание мышей, зараженных T.gondii и обработанных рифабутином (RIF) одним или в комбинации с атовакваном (ATO).
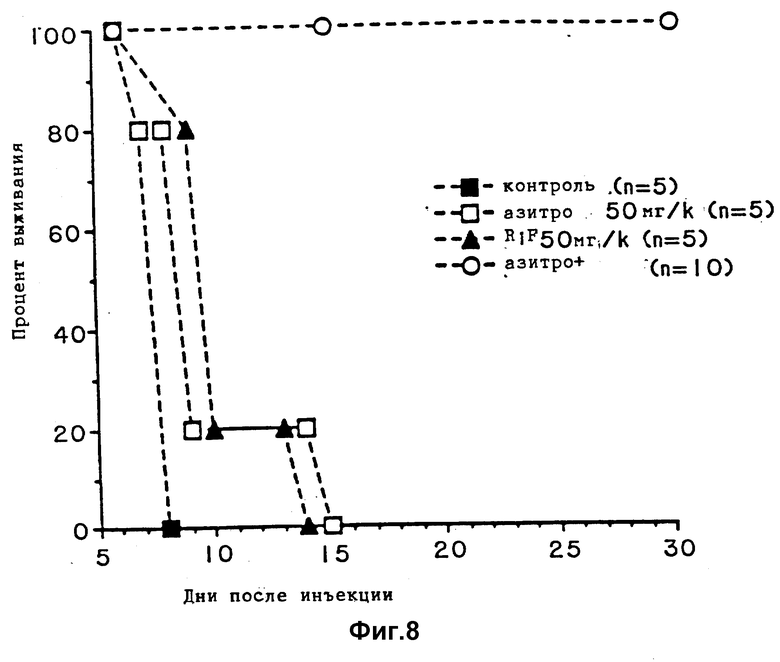
Фиг. 8 показывает выживание мышей, зараженных T.gondii и обработанных рифабутином (RIF) одним или в комбинации с азитромицином (AZITHRO).
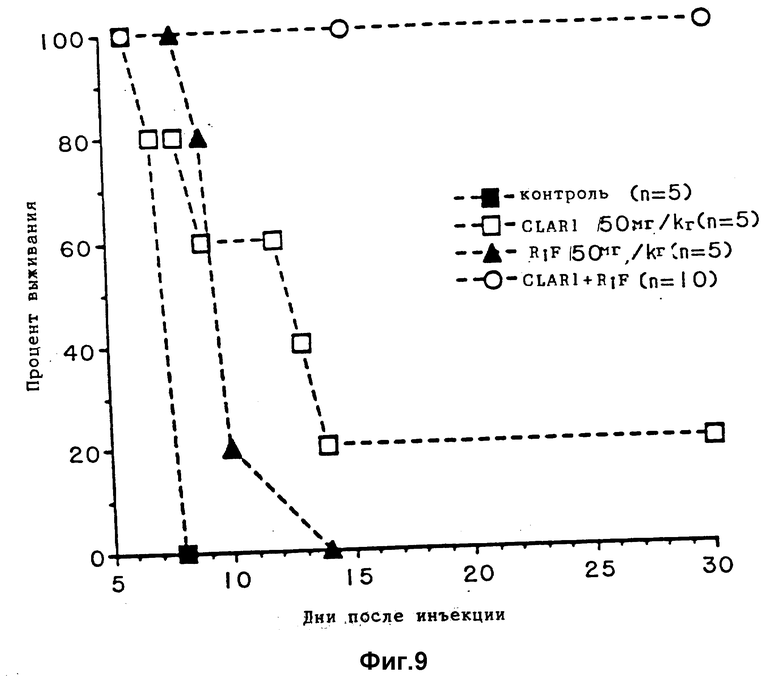
Фиг. 9 является графиком, показывающим выживание мышей, зараженных T.gondii и обработанных рифабутином (RIF) одним или комбинацией с кларитромицином (CLARI).
Спиропиперидиновые производные рифамицина S являются неожиданно эффективными для защиты млекопитающих против заражения организмами, вызывающими болезнь и связанными с токсоплазмозом. Это открытие противоречит предварительно приведенной информации об эффективности соединений рифамицина, таких как рифампин, о котором сказано, что он является неэффективным для защиты от токсоплазмоза. Эти результаты особенно неожиданны с точки зрения относительно закрытой структуры неэффективного соединения рифампина и спиропиперидиновых производных рифамицина S, которые теперь показаны эффективными.
Соединения изобретения являются полусинтетическими производными рифамицина S, содержащего конденсированное имидазольное кольцо, которое включает атомы углерода в положениях 3 и 4 из рифамицинового кольца, атом углерода во 2 положении имидазольного кольца, являющийся также атомом углерода 4 положения пиперидинового кольца, тем самым образуя спиропиперидиновую систему колец. Атом азота пиперидинового кольца необязательно замещен низшим углеводородным заместителем, обычно содержащим от 1 до 8 (предпочтительно 3-5) атомов углерода, обычно разветвленным, и более предпочтительно является изобутильной группой. Однако в этом положении могут присутствовать другие углеводородные группы, такие как метил, этил, пропил, изопропил, бутил, втор-бутил, трет-бутил, пентил, изо-пентил, гексил и изогексил. Также допускаются ненасыщенные аналоги этих насыщенных алкильных групп (особенно алкены, в частности такие, в которых двойная связь (или связи) размещаются так, что Sp3 гибридизованный атом углерода прикрепляется к атому азота пиперидинового кольца).
Таким образом, соединения, используемые в настоящем изобретении, обычно имеют формулу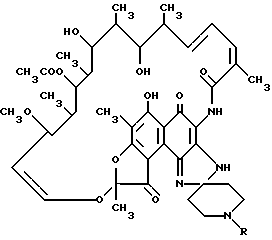
где
R является одной из указанных алкильных групп.
Эти соединения не являются новым классом соединений, скорее это соединения, которые были известны ранее для других применений. Спиропиперидиновые производные рифамицина S являются полусинтетическими молекулами, полученными модификацией природных рифамицинов, продуцируемых Nocardia mediterranei (также известных как Streptomyces mediterranei). Обычно в культуре продуцируется смесь рифамицинов A - E, но часть требуемого промежуточного рифамицина B может быть увеличена с помощью добавления диэтилбарбитурата к среде роста. Только рифамицин B является промежуточным продуктом, так как водные насыщенные кислородом растворы самопроизвольно дают другие рифамицины, такие как O и S. Рифамицин S является исходным продуктом ряда полусинтетических рифамицинов. Они включают специфическое соединение, известное под именем рифамицин (также называемое рифамицин SV), которое получают мягким восстановлением рифамицина S. Другие производные, полученные модификацией рифамицина S, включают рифамид и рифампицин (также называемый рифампин), последний имеет структуру, приведенную выше.
Также описан общий синтез рифамицина S в публикациях H.Nagaoka et al. J. Am. Chem. Soc. 102:7962 (1980); H.Iio, et al, там же, 7965; H.Nagaoka и Y. Kishi Tetrahedron 37: 3873 (1981). Для обзора химии рифамицинов смотри K.L. Reinhart et al. Forster. Chem. Org. Naturst. 33: 231-307 (1976). Синтез спиропиперидиновых рифамицинов описан в L. Marsili et al. J. Antibiot, 34: 1033-1038 (1981). Спиропиперидиновые рифамиционовые соединения и их активность в качестве антибактериальных препаратов против грамположительных и грамотрицательных бактерий, включая Microbacterium tuberculosis, описаны в пат. США N 4219478. Также смотри родственные патенты США N 4086225 и 4327096. В качестве примера систематической химической номенклатуры соединений изобретения рифабутин представляет собой (9S, 12E, 14S, 15R, 16S, 17R, 18R, 19R, 20S, 21S, 22E, 24Z)-6,16,18,20-тетрагидрокси- 1'-изобутил-14-метокси-7,9,15,17,19,21,25-гептаметил-спиро[9,4- (эпоксипентадека[1,11,13] триенимино)-2H-фуро[2', 3', 7,8] нафт[1,2- d] имидазол-2,4'-пиперидин] -5,10,26-(3H,9H)-трион-16-ацетат.
Соединения изобретения растворимы в хлороформе и метаноле, умеренно растворимы в этаноле и плохо растворимы в воде.
Соединения могут быть получены в стандартных фармацевтических композициях того же типа, что используются и для других рифамициновых соединений. Композиция для применения in vivo обычно содержит фармацевтически приемлемый носитель. Для этого предполагается или твердый, или жидкий материал, который может быть неорганического или органического и синтетического или природного происхождения, с которым активный компонент композиции смешивается или формулируется для облегчения введения пациенту. Пригоден любой другой материал, обычно используемый при получении фармацевтических препаратов. Твердые носители включают природные или синтетические силикаты клуазонне, например природные силикаты, такие как диатомовая земля; силикаты магния, например тальки; алюмосиликаты магния, например атапульгиты и вермикулиты; алюмосиликаты, например каолиниты, монтмориллониты и слюды; карбонат кальция; сульфат кальция; синтетические гидратированные оксиды кремния и синтетические алюмосиликаты и силикаты кальция; элементы, такие как углерод или сера; природные и синтетические смолы, такие как поливиниловый спирт; воски, такие как парафины и пчелиный воск. Примерами пригодных жидких носителей являются вода и водные растворы, содержащие кислородорганические соединения, такие как этанол. Также могут присутствовать буферы и другие материалы, обычно присутствующие в фармацевтических препаративных формах, такие как ароматичные вещества и суспендирующие агенты. Фармацевтические носители отличаются от обычных растворов и суспензий в том, что они специально готовятся для использования in vivo для исключения веществ, которые могут быть вредными для хозяина, которому вводился состав (например, удаление бактериальных токсинов).
В качестве примера фармацевтической композиции может быть приведен рифабутин, содержащийся в дозе 150 мг на капсулу, предназначенную для орального введения. Оставшаяся часть капсулы будет содержать, например, неактивные ингредиенты, микрокристаллическую целлюлозу, стеарат магния, красный оксид железа, силикагель, лаурилсульфат натрия, двуоксид титана и съедобный белый краситель.
Композиции, содержащие спиропиперидиновые рифамицины, предназначены для другого фармацевтического применения, такого как антимикобактериальные показания, включая туберкулез. Таким образом, клиническая фармакология этих соединений известна. Например, после единичного орального приема 300 мг рифабутина обычным субъектом рифабутин быстро абсорбируется из желудочно-кишечного тракта со средним (±SD) уровнем пика в плазме (Cmax) 375 (±267) мг/мл (от 141 до до 1033 мг/мл), который достигается за 3,3 (± 0,9) часа (Tmax ряд: от 2 до 4 часов). Концентрации в плазме пост-Cmax снижаются, по-видимому, бифазным способом. Кинетику доза - пропорциональность показывают на здоровых нормальных добровольцах и на пациентах с ранней симптоматикой вируса иммунодефицита (ВИЧ) при дозах от 300 мг до 900 мг.
Из плазмы рифабутин медленно выделяется тем же способом, что и в случае других рифамициновых соединений.
Как предварительно показано, специфический метод настоящего изобретения направлен на лечение и/или профилактику токсоплазмоза. Для лечения доза в первый день (названная доза загрузки) часто, но необязательно более высокая, чем в последующие дни. Обычно доза загрузки составляет 0,25-400 мг/кг/день (предпочтительно 1-200, более предпочтительно 2 - 200) при обычных дозах лечения - половина от этих величин. Эти дозы находятся на уровне других рифамициновых соединений. Для профилактического использования применяются дозы менее половины обычного уровня, обычно без загрузочной дозы.
При обычном режиме лечения спиропиперидиновые рифамицины могут вводиться человеку как единичная доза приблизительно 300 мг per os ("po"; орально) раз в день, обычно за завтраком, или, если единичная доза непереносима, можно разделить введение на две дозы по приблизительно 150 мг каждая во время утреннего и вечернего приема пищи. Период полураспада в сыворотке рифабутина составляет 16 часов.
Препарат частично выводится почками при концентрациях в моче приблизительно в 100 раз выше, чем в плазме. Препарат появляется в желче в концентрациях, аналогичных концентрациям в моче. Препарат поглощается всеми тканями и особенно концентрируется в легких, где уровни достигают 5-10-кратного повышения в сравнении с уровнем в плазме. Для изучения клинического эффекта рифабутина смотри R. J. O'Brien et al. Reviews of Infections Diseases 9: 519-530 (1987).
Лечению подвергаются субъекты с острой инфекцией Toxoplasma gondii и для профилактического применения, такие субъекты, которые могут в дальнейшем подвергнуться воздействию организмов, вызывающих болезнь, или пациенты с иммунным дефицитом при хроническом токсоплазмозе для предупреждения рецидива или повторения инфекции.
Ввиду широкого распространения организмов этот вид применения может включать всех пациентов с ослабленным иммунитетом. Беременные женщины, особенно предварительно незараженные беременные женщины, составляют предпочтительную часть подвергающихся лечению людей. Выбор данной дозы и определение времени введения дозы лучше сделать по решению врача или ветеринара тем же способом, что и при лечении другими рифамициновыми соединениями, так что при необходимости доза может быть увеличена или уменьшена. Хотя метод предполагается для использования на человеке, отчасти также рассматривается ветеринарное использование, особенно для домашних животных (таких, как овцы, свиньи и кошки), являющихся также известными хозяевами для T. gondii.
Особенно интересным аспектом спиропиперидиновых рифамициновых соединений является их способность действовать синергистически с сульфонамидами. Сульфонамиды включают известную группу антимикробных агентов, которые являются большей частью производными сульфаниламида (п-аминобензолсульфонамида). Они останавливают или задерживают рост широкого ряда грамположительных и грамотрицательных бактерий так же, как и простейших (таких, как кокцидии и Plasmodium spp.). Сульфаниламиды часто используются в комбинации с другими хемотерапевтическими агентами для лечения инфекций мочевой системы и различных кишечных расстройств.
Организмы, которые синтезируют свою собственную фолиевую кислоту и которые не могут использовать экзогенное питание витамина, чувствительны к сульфонамидам при условии, что клетки проницаемы для препарата. Это является результатом способности сульфонамидов действовать как структурные аналоги п-аминобензойной кислоты (PABA). Сульфонамиды конкурентно ингибируют включение PABA в синтез фолиевой кислоты. Таким образом, комбинации, в которых они наиболее часто используются, включают другие антагонисты фолиевой кислоты. Организмы, которые требуют для роста экзогенную фолиевую кислоту, нечувствительны к лечению сульфонамидами.
Большинство сульфонамидных препаратов отличаются по своим клиническим свойствам и токсичности. Большинство являются производными, содержащими заместители у атома азота сульфонамидной группы (то есть, NH2C6H4SO2NHR, где R является заместителем).
Замещение по п-аминогруппе обычно дает в результате потерю антибактериальной активности. Однако такие производные часто гидролизуются in vivo до активной формы и могут поэтому вводиться в неактивной форме. Например, п-N-сукцинилсульфатиазол и фталилсульфатиазол неактивны, но при гидролизе в нижнем кишечнике высвобождается активный компонент сульфатиазол.
Ряд активных сульфонамидов включают, например, сульфацетамид (N-[4-аминофенол)сульфонил] -ацетамид); сульфадиазин; сульфадиметоксин(4-амино-N-(2,6-диметокси-4- пиримидинил)бензолсульфонамид); сульфамидин(сульфаметазин: 4-амино-N-(4,6-диметил-2- пиримидинил)бензолсульфонамид); сульфагуанидин(4-амино-N-(аминоиминометил)бензолсульфонамид); сульфаметоксазол(4-амино-N-(5-метил-1,3,4-тиадиазол-2- ил)бензолсульфонамид); сульфаматоксазол(4-амино-N-(5-метил-3-изоксазолил)бензолсульфонамид); сульфатиазол(4-азино-N-2-тиаамид); и сульфатиазол(4-амино-N-2-тиазолилбензолсульфонамид).
Авторы настоящего изобретения обнаруживают, что, кроме синергистического взаимодействия спиропиперидил рифамициновых соединений с сульфонамидами, спиропиперидиновые рифамициновые соединения также синергистически взаимодействуют, как показано здесь, с рядом антимикробных соединений при лечении токсоплазмоза, включая антибактериальные препараты, клиндамицин, кларитромицин и азитромицин; антималярийные препараты, пирипириметамин; и атоваквин. Эти синергистические взаимодействия обеспечивают дополнительное преимущество внутри основной области изобретения (лечение спиропиперидиновыми рифамицинами или в комбинации или не в комбинации с другими препаратами) с помощью обеспечения определенного синергистического эффекта при использовании спиропиперидиновых рифамицинов в комбинации с выбранным другим классом препаратов.
Таким образом, одним воплощением изобретения является использование спиропиперидиновых рифамициновых соединений в комбинации с линкозамидами для достижения синергистического эффекта. Линкозамиды включают хорошо известную группу антимикробных агентов, которые содержат линкозамин (то есть, 6-амино-6,8-дидеоксиоктозу). Они останавливают или задерживают рост ряда грамположительных и грамотрицательных бактерий. Большинство линкозамидных препаратов отличаются по их клиническим свойствам и токсичности. Любой линкозамид может использоваться в комбинации с рифабутином или другими спиропиперидиновыми рифамициновыми соединениями для лечения или предупреждения токсоплазмоза; предпочтительным является то, что они, кроме того, действуют синергистически, как указано здесь. Активные линкозамиды включают линкомицин, его полусинтетические производные, клиндамицин (7-хлор-7-деоксилинкомицин) и селестицетин. Другие пригодные производные линкозамиды включают те, которые могут быть гидролизованы in vivo до активной формы и поэтому могут вводиться в неактивной форме. Например, гидрохлорид пальмитата клиндамицина является неактивным in vitro, но быстрый гидролиз in vivo превращает его в активный антибактериальный клиндамицин, фосфат клиндамицина, водорастворимый эфир клиндамицина и фосфорной кислоты, которые являются другим предпочтительным линкомициновым производным.
Ряд индивидуальных соединений и классов соединений действует синергистически со спиропиперидиновыми рифамициновыми соединениями. Например, спиропиперидиновые рифамициновые соединения действуют синергистически с пириметамином. Пириметамин является антагонистом фолиевой кислоты, эффективным против простейших. Также спиропиперидиновые рифамициновые соединения действуют синергистически с гидроксинафтохинонами. Предпочтительным гидроксинафтохиноном является атоваквин. Другими предпочтительными гидроксинафтохиноновыми антибиотиками являются такие, которые обладают активностью против T.gondii, когда используются одни. Спиропиперидиновые рифамициновые соединения действуют синергистически с азалидами. Предпочтительными азалидами являются азитромицин и его производные. Другими предпочтительными азалидовыми антибиотиками являются такие, которые активны против T.gondii, когда используются одни. Кроме того, спиропиперидиновые рифамициновые соединения действуют синергистически с макролидными антибиотиками. Предпочтительными макролидами являются кларитромицин и его производные. Другими предпочтительными макролидными антибиотиками являются такие, которые обладают активностью против T. gondii, когда используются одни. Такие предпочтительные макролиды включают рокситромицин и спирамицин. Макролиды изобретения также включают анголамицин, карбомицин, халкомицин, пиррамицин, эритромицин, ланкомицин, лейкомицин, мегаломицин, метимицин, нарбомицин, ниддамицин, олеандомицин, реломицин, толеандомицин, тилозин, полиеновые антибиотики и их активные производные.
Эти и другие антимикробные агенты, обсуждаемые здесь, могут быть природными (полученными из природных источников или генной инженерией), полусинтетическими или полностью синтетическими. Так как все соединения являются известными, то описания синтезов могут быть найдены в опубликованной научной литературе.
В одном из аспектов изобретения эти препараты используются в комбинации с рифабутином или другими спиропиперидиновыми рифамициновыми соединениями в качестве фармацевтических препаратов или для получения медикаментов, пригодных для лечения или предупреждения токсоплазмоза или токсоплазматического энцефалита (TE).
Фармацевтический препарат включает терапевтически эффективное количество рифабутина или другого спиропиперидинового рифамицинового соединения в комбинации с терапевтически эффективным количеством одного или более препаратов, обсужденных здесь в качестве синергистически эффективных против токсоплазмы. Альтернативно, эти препараты могут быть использованы отдельно для получения медикаментов, которые затем используются в комбинации с рифабутином или другими спиропиперидиновыми рифамициновыми соединениями для лечения или предупреждения токсоплазмоза или ТЕ. Комбинация медикаментов или курсы лечения включают рифабутин или другие спиропиперидиновые рифамициновые соединения с по крайней мере одним другим антитоксаплазмозным соединением, как сказано здесь. Фармацевтические носители, дозы, пути введения и курсы лечения являются такими, как предварительно здесь обсуждалось, однако они могут быть эффективно изменены клиницистами при использовании в качестве руководства доз, указанных здесь, и доз, предварительно известных для использования при лечении токсоплазмозов. Конечно, вследствие синергистической активности, обнаруженной здесь, более низкие дозы, чем те, что предварительно сообщались, теперь доступны клиницистам или ветеринарам.
Кроме их синергистического взаимодействия с указанными выше соединениями, спиропиперидиновые рифамициновые соединения будут также действовать сирегистически с рядом антибиотических соединений для лечения токсоплазмоза, включая антивирусные препараты, такие как γ-интерферон, с соединениями эффективными против T.gondii, такими как макролиды, рокситромицин и спирамицин, и тетрацилины, например миноциклин и его родственные соединения, и с другими соединениями, эффективными против других простейших, вызывающих болезни.
Одним аспектом изобретения в области лечения токсоплазмоза является метод снижения тяжести токсоплазматического энцефалита, возникающего из-за инфекции млекопитающих Toxoplasmа gondii. Тяжесть ТЕ может быть уменьшена введением хозяину при необходимости лечения или после заражения, или перед воздействием заражения T.gondii терапевтически эффективного количества соединения, которое является спиропиперидиновым производным рифамицина S, где производное включает имидазольное кольцо, которое включает атомы углерода в положениях 3 и 4 из рифамицинового кольца, атом углерода в положении 2 имидазольного кольца, который также является атомом углерода кольца в положении 4 пиперидиновой системы колец, необязательно содержащей низший углеводородный заместитель у атома азота пиперидина. Предпочтительным соединением для лечения является рифабутин. Фармацевтические носители, дозы, пути введения и порядок лечения являются такими, как обсуждается здесь для лечения токсоплазмоза. Дополнительным аспектом изобретения включается, что тяжесть ТЕ может быть уменьшена введением терапевтически эффективного количества комбинации спиропиперидинового рифамицинового соединения с препаратом, рассмотренным здесь, который усиливает эффективность спиропиперидинового рифамицинового соединения для лечения или предупреждения токсоплазмоза. Фармацевтические носители, дозы, пути введения и порядок лечения являются такими, как рассмотрено здесь предварительно, для препарата из комбинации веществ для лечения токсоплазмоза.
Как дано здесь и как показано следующими примерами, спиропиперидиновые рифамициновые производные, в частности рифабутин, являются эффективными для защиты млекопитающих, включая больных с ослабленным иммунитетом, от инфекции Toxoplasma gondii. Соединения также проявляют синергистический эффект в комбинации с другими препаратами, особенно с сульфонамидами и дают полную защиту в этом модельном изучении против токсоплазмоза. Результаты in vivo для рифабутина, представленные в примере 1, которые показывают, что рифабутин один является эффективным для лечения болезней, родственных токсоплазмозу, противоположны и являются неожиданными в свете результатов, полученных с рифампином [18]. Показано, что рифабутин один является эффективным для лечения болезней, родственных токсоплазмозу и, кроме того, что рифабутин действует синергистически в комбинации с другими препаратами. Это значительно прибавляет к спектру действия препаратов, пригодных для лечения токсоплазмоза, тем самым преодолеваются проблемы, возникающие из-за резистентности паразита и побочного действия существующих медикаментов. Кроме того, рифабутин уменьшает воспалительную реакцию, обусловленную токсоплазматическим энцефалитом (пример 8). Таким образом, приведенные результаты предусматривают терапевтический и профилактический методы, которые заметно добавляют надежность снижению болезни при инфекциях токсоплазмы.
Анти-T.gondii эффект у мышей с рассеянным острым токсоплазмозом, обусловленным инфекцией с RH тахизоитами, значительно повышается, когда рифабутин используется в комбинации с пириметамином, сульфадиазином, клиндамицином или атоваквином, как показано в примерах. Эти препараты предпочтительны, так как они или уже используются, или проходят клинические испытания для лечения токсоплазмоза. Азитромицин или кларитромицин в комбинации с рифабутином также показаны в примерах, как усиливающие анти-T.gondii эффект. Настоящее изобретение учитывает эффективное лечение токсоплазмоза и токсоплазматического энцефалита у больных с тяжело ослабленным иммунитетом. Как показано здесь, комбинации неэффективной дозы рифабутина и клиндамицина дает в результате заметную и значительную защиту мышей с рассеянным острым токсоплазмозом (пример 4). и T. gondii-инфицированных мышей с ослабленным иммунитетом (пример 9). Клиндамицин в данное время наиболее часто используется в качестве альтернативы сульфонамидов при развитии побочного действия при лечении комбинацией пириметамина-сульфонамида [34, 35]. Кроме того, хотя пириметамин и сульфонамиды могут быть ответственными за неподходящий побочный эффект, особенно у больных СПИДом, комбинации, названные здесь, позволяют значительно уменьшить их дозы для уменьшения или исключения их неблагоприятного побочного эффекта. Комбинация рифабутин - атоваквин показывает эффективность против токсоплазмоза (пример 5). Атоваквин является активным и против T.gondii [31, 32] и против Pneumocystis carinii [39]. С другой стороны рифабутин является активным против микобактерий и сейчас используется для лечения и профилактики организмов комплекса Micobacterium avium [36]. Таким образом, результаты с комбинацией рифабутин - атоваквин показывают использование этой комбинации для лечения и профилактики трех из наиболее часто встречающихся агентов у больных СПИДом.
Следующие примеры предлагаются только для иллюстрации и не ограничивают изобретения.
Пример 1. Активность рифабутина против T.gondii при моделировании острого токсоплазмоза на мышах.
Эксперимент выполняется для определения in vivo защитной активности рифабутина против токсоплазмоза. Используемая модель является моделью, использующей самок мышей линии Swiss Webster весом приблизительно 20 г на время эксперимента. Используемый в эксперименте рифабутин получают коммерческий из Adria как фармакологически чистое соединение, солюбилизируют в фосфатном буфере, pH 7,2, подвергают обработке ультразвуком, четыре импульса по одной минуте каждый. Эксперимент выполняется на 4 группах мышей (3 экспериментальных и 1 контрольная) по 10 мышей в группе. Мышей заражают T.gondii тахизоитами RH штамма, полученными из перитонеальной жидкости мыши-носителя, согласно опубликованным стандартным методикам для этой модели [26]. Перитональную жидкость собирают в сбалансированный солевой раствор Еарле, содержащий 10% сыворотки плода и 10 единиц гепарин/мл. Затем препарат фильтруют через стекловату, центрифугируют при 500xg 5 минут при 4oC, осадок повторно суспендируют и пропускают через иглу 27-го размера.
Организмы количественно подсчитывают на гемацитометре Neubauer-Levy и делают соответствующее разбавление в минимально необходимой среде Еагла (МЕМ). Летальное заражение RH штаммом T.gondii приблизительно один тахизоит. Мыши, зараженные нашим RH штаммом, никогда не выживают с живущими паразитами. Таким образом, оставшиеся в живых в нашем изучении имеют организмы, уничтоженные лечением. Мыши заражаются внутрибрюшинно (в/б) дозой 2,5•103 тахизоитов RH штамма (доза, которая обычно дает в результате смерть 100% нормальных мышей на 8 или 9 день). Начиная с 24 часа после в/б заражения одна группа мышей обрабатывается 50 мг/кг/день рифабутина, вторая - 100 мг/кг/день и третья - 200 мг/кг/день при введении орально в течение 10 дней. С этого времени за мышами наблюдают дополнительно 20 дней и дату смерти записывают. Умершие в процессе эксперимента мыши изучаются на присутствие T. gondii в перитонеальной жидкости для выяснения причины смерти.
Как показано на фиг. 1а, значительная защита описана для мышей, обработанных дозой рифабутина 100 мг/кг/день и выше. Введение 200 мг/кг/день дает выживание 9 из 10 мышей в этой группе за весь 30-дневный период. В группе, получавшей 100 мг/кг/день, 6 мышей были все еще живы на 15 день после заражения, в то время как за 30-дневный период выживают две мыши.
В противоположность все 10 контрольных мышей умирают за ожидаемый 9-дневный период и только 4 мыши выживают более 10 дней у группы, получавшей 50 мг/кг/день, но все из последних умирают к 14 дню.
Таким образом, доза 50 мг/кг/день дает значительное пролонгирование времени до наступления смерти в сравнении с необработанным контролем, хотя и все мыши в конце концов умирают. 100% мышей, зараженных в/б тахизоитами RH штамма, выживают при обработке 300 или 400 мг/кг/день рифабутина. Идентичные результаты получают, когда рифабутин получают растворением в фосфатном буфере , pH 6,8, с последующей обработкой ультразвуком 30 секунд.
Рассматривается также активность различных доз рифабутина (RIF) при рассеянном остром токсоплазмозе мышей с последующим в/б заражении цистами штамма C56 T. gondii. Используют самок взрослых мышей линии Swiss-Webster (SW) весом 20 г на начало каждого эксперимента [26, 29, 30, 31]. Лечение начинают на 3 день после заражения. Лечение проводят 10 дней. Рифабутин готовят растворением в фосфатном буфере, pH 6,8, с последующей обработкой ультразвуком в течение 30 секунд. Как показано на фиг. 1б, значительную защиту наблюдают для мышей, обработанных дозами рифабутина 100 мг/кг/день и выше. Введение 200 мг/кг/день дает выживание 9 из 10 мышей в этой группе за полный 30-дневный период. Введение 300 мг/кг/день дает выживание 10 из 10 мышей в этой группе за полный 30-дневный период. У группы, получавшей 100 мг/кг/день, были все еще живы на 15 день после заражения 6 мышей, в то время как за 30-дневный период наблюдения выживают 2 мыши. Все 10 контрольных мышей умирают за ожидаемый 9-дневный период, в то время как 4 мыши выживают более 10 дней у группы, получившей 50 мг/кг/день, но все из последних умирают за 14 дней. 10 из 10 зараженных мышей выживают за полный испытательный период при обработке 300 мг/кг/день.
Приведенные выше результаты показывают значительную активность рифабутина для лечения рассеянного острого токсоплазмоза мышей, вызванного различными штаммами T.gondii.
Введение дозы 200 мг/кг/день в течение 10 дней защищает по крайней мере 80% мышей от смерти, обусловленной заражением или тахизоитами RH штамма или цистами C56 штамма. Дозы 300 или 400 мг/кг/день защищают 100% мышей и, по-видимому, не токсичны для животных, так как незараженные мыши, обработанные этими дозами, не показывают клинических симптомов токсичности, и эти дозы не вызывают потерю веса. Хотя в настоящем исследовании не проводились фармакологические исследования, у здоровых добровольцев [42] рафабутин быстро, но не полностью абсорбировался из желудочно-кишечного тракта. Среднее конечное время полураспада у человека после орального введения составляет 36 часов и биопригодность - 84,8% [42].
RH тахизоиты и C56 цисты используются в этих экспериментах вследствие предварительных сообщений о том, что наблюдается отклонение в чувствительности различных штаммов T.gondii к различным препаратам [29].
Кроме того, различен патогенез заражения, обусловленного инокуляцией тахизоитов или цист. Иконуляция в/б RH тахизоитов дает скоротечную инфекцию с большим количеством тахизоитов, продуцированных в брюшной полости. Обычно 100% смертность наблюдается на 5-8 день после заражения инокулятом таким небольшим, как 102 организмов. В противоположность, оральное заражение цистами C56 штамма дает заражение, которое прогрессирует медленно. В зависимости от размера инокулята смертность не встречается до приблизительно 15 дня от заражения.
Пример 2. Активность in vivo рифабутина в комбинации с сулофонамидом против T.gondii при моделировании острого токсоплазмоза на мышах.
Эксперимент выполняется способом, описанным в примере 1, но с дополнительным введением сульфонамида. Условия принимают описанные в первом примере, за исключением следующих изменений, 6 групп мышей (10 мышей в группе) заражают внутрибрюшинным введением 2,5•103 тахизоитов T.gondii и затем подвергают обработке оральным введением рифабутина, начиная после 24 часов после заражения и в течение 10 дней. Сульфадиазин, натриевая соль, получают от Sigma Chemical Co. , или City Chem. Corp. New York NY вводят по желанию в течение полного периода лечения с питьевой водой в концентрации 80 мг/л некоторым группам следующим образом:
Группа 1 - рифабутин, один, 50 мг/кг/день.
Группа 2 - рифабутин, один, 100 мг/кг/день.
Группа 3 - рифабутин, один, 200 мг/кг/день.
Группа 4 - сульфадиазин, один, 80 мг/л.
Группа 5 - рифабутин, 50 мг/кг/день, плюс сульфадиазин, 80 мл/л.
Группа 6 - рифабутин, 100 мг/кг/день, плюс сульфадиазин, 80 мг/л.
Группа 7 - рифабутин, 200 мг/кг/день, плюс сульфадиазин, 80 мл/л.
Группа 1, 2 и 3 подобны трем рассмотренным экспериментальным группам и представлены отдельно в примере 1 на фиг. 1а. Для контрольной группы смотри пример 1. Результаты эксперимента представлены на фиг. 2 - 4. Фиг. 2 показывает результаты обработки низкими концентрациями одного рифабутина, одного сульфадиазина или комбинации двух. Эффект одного сульфадиазина незначителен, при этом только одна мышь выжила более 9-дневного периода выживания для контрольных животных. Эта единственная мышь умерла на 11 день. Комбинация низкой дозы рифабутина и сульфадиазина не так эффективна, как низкая доза рифабутина самого. Только одно животное выживает более 9 дней для комбинации, которое погибает на 13 день. 4 животных выживают более 9 дней для рифабутина одного, последнее животное погибает на 14 день.
Более высокие дозы рифабутина обеспечивают большую защиту, как показано на фиг. 3 и 4. Синергистический эффект проявляется, когда доза рифабутина 100 мг/кг/день используется в комбинации с дозой сульфадиазина 80 мг/л (фиг. 3). 6 животных выживают более 9 дней при обработке одним рифабутином в дозе 100 мг/кг/день и 2 животных выживают за полный 30-дневный период. Неожиданно, 8 из 10 животных, обработанных комбинацией препаратов, выживают более 10 дней и 6 из них выживают полный 30-дневный испытательный период (фиг. 3). Как показано на фиг. 4, рифабутин в дозе 200 мг/кг/день является высокоэффективным и сульфадиазин прибавлялся к его эффективности. 9 из 10 животных выживают за полный тестируемый период при использовании рифабутина одного в этой концентрации, в то время как все 10 животных выживают в случае комбинации.
Пример 3. Активность in vivo рифабутина в комбинации с пириметамином против T.gondii при моделировании острого токсоплазмоза на мышах.
Эксперимент выполняется способом, описанным в примерах 1 и 2, но с дополнительным введением пириметамина вместо сульфонамида. Пириметамин (lot 3F991, burroughs Wellcome Co., Research Triangle, Park N.C.) растворяют в растворе 0,25% карбоксиметилцеллюлозы. Условия принимают, как описано в первом примере, за исключением следующих изменений. 6 групп мышей (5 в контрольной группе, 10 или 15 в обрабатываемых группах, как показано на фиг. 5) заражаются при внутрибрюшинном введении 2,5•103 тахизоитов T.gondii. Обработку рифабутином одним (50 или 100 мг/кг/день) или в комбинации с пириметамином (10 мг/кг/день) начинают через 24 часа после заражения и продолжают 10 дней. Оба препарата вводят орально как единичную ежедневную дозу одного или в комбинации. Тестируемые группы являются следующими:
Группа 1 - контроль.
Группа 2 - рифабутин, один, 50 мг/кг/день.
Группа 3 - рифабутин, 100 мг/кг/день.
Группа 4 - пириметамин один, 10 мг/кг/день.
Группа 5 - рифабутин, 50 мг/кг/день, плюс пириметамин, 10 мг/кг/день.
Группа 6 - рифабутин, 100 мг/кг/день, плюс пириметамин, 10 мг/кг/день.
Результаты эксперимента приведены на фиг. 5. Действие рифабутина одного подобного действию, показанному в предыдущих примерах, в которых средняя степень выживания расширяется, давая при более высокой дозе лучшую долговременную защиту (30-дневный период). Комбинация низкой дозы рифабутина и пириметамина дает лучшую защиту, чем любого препарата, действующего одного. Более высокая доза рифабутина в комбинации с пириметамином дает лучшую защиту.
Пример 4. Активность in vivo рифабутина в комбинации с клиндамицином против T. gondii при моделировании острого токсоплазмоза на мышах.
Эксперименты выполняются способом, описанным в примерах 1 и 3, но с дополнительным введением клиндамицина вместо пириметамина. Клиндамицин (гидрохлорид, lot 6327H J. Upjohn Co., Kalamazoo M1) растворяют в стерильном PBS и вводят орально единичной суточной дозой 25 или 50 мг/кг. Условия принимают, как описано в первом примере, за исключением следующих изменений. 4 группы мышей (5 в контрольной группе, 10 или 15 в обрабатываемых группах, как показано на фиг. 6) заражаются внутрибрюшинно 2,5•103 тахизоитами T. gondii RH штамма. Обработка рифабутином (RIF) одним при 50 мг/кг/день или в комбинации с клиндамицином (CLINDA) при 25 мг/кг/день начинается через 24 часа после заражения и продолжается 10 дней. Оба препарата вводятся орально как единичная суточная доза или раздельно, или в комбинации.
Результаты показаны на фиг. 6. Защита, обеспечивающаяся комбинацией рифабутина с клиндамицином, заметна. 90% мышей, зараженных в/б RH тахизоитами, выживают при обработке комбинацией 50 мг/кг рифабутина плюс 25 мг/кг клиндамицина. Эти дозы соответствующих препаратов имеют только слабый эффект для защиты мышей от гибели, когда вводятся по отдельности. Во втором эксперименте 100% зараженных мышей выживают после обработки комбинацией препаратов.
Клиндамицин является препаратом, наиболее часто используемым в качестве замены сульфонамидов, когда при лечении комбинацией с пириметамин-сульфонамидом развивается побочный эффект [34, 35]. Комбинация неэффективных доз рифабутина и клиндамицина дает синергистический эффект и значительную защиту мышей при рассеянном остром токсоплазмозе.
Пример 5. Активность in vivo рифабутина в комбинации с атоваквином против T. gondii при моделировании острого токсоплазмоза у мышей.
Эксперименты выполняются способом, описанным в примерах 1 и 3, но при дополнительном введении атоваквина вместо пириметамина. Исходный раствор атоваквина (lot 8810001-158, Burroughs - Wellcome Co.) получают PBS и обрабатывают ультразвуком по 3 импульса по 30 секунд каждый. Рабочие растворы для получения дозы для каждого животного в 5 или 10 мг/кг получают в 0,25% карбоксиметилцеллюлозе и обрабатывают ультразвуком, одним импульсом в 30 секунд сразу перед введением дозы. Условия принимают, как описано в первом примере, за исключением следующих изменений. 4 группы мышей (5 в контрольной группе, 10 в обрабатываемых группах, как показано на фиг. 7а и 7б) заражаются внутрибрюшинным введением 2,5•103 тахизоитов T. gondii RH штамма. Обработку рифабутином (RIF) одним в дозе 100 мг/кг/день или 50 мг/кг/день или в комбинации с атоваквином (ATO) в дозе 5 мг/кг/день начинают через 24 часа после заражения и продолжают 10 дней. Оба препарата вводили орально как единичную суточную дозу, или раздельно, или в комбинации.
Контрольные мыши обрабатываются только разбавителем препарата.
Результаты приведены на фиг. 7а и 7б. Обработка комбинацией 50 или 100 мг/кг рифабутина с 5 мг/кг атоваквина дает защиту мышей от гибели. 100 мг/кг рифабутина плюс 5 мг/кг атоваквина защищает по крайней мере 60% мышей от гибели (фиг. 7а). Статистический анализ данных, однако, не обнаруживает значительных различий между группой мышей, обработанной рифабутином одним, и группой, обработанной комбинацией. В противоположность, когда доза рифабутина снижается до 50 мг/кг и используется в комбинации с дозой 5 мг/кг/день атоваквина, наблюдают пролонгирование времени до гибели и 30% мышей выживают (фиг. 7б). Различия меду группами мышей, обработанными рифабутином одним, и мышами, обработанными комбинацией, статистически значимы (P=0,011).
Так как атоваквин является активным и против T. gondii [30, 31] и Pneumocystis carinii [39], а рифабутин является активным против микобактерий и используется для лечения и профилактики организмов комплекса Mycobacterium avium [36], результаты, представленные здесь, показывают эффективность комбинации рифабутин - атоваквин против T. gondii, обеспечивают использование этой комбинации для лечения и профилактики трех наиболее важных часто встречающихся агентов у больных СПИДом.
Пример 6. Активность in vivo рифабутина в комбинации с азитромицином против T. gondii при моделировании острого токсоплазмоза на мышах.
Эксперименты выполняются способом, описанным в примерах 1 и 3, но при дополнительном введении азитромицина вместо пириметамина. Условия принимаются, как описаны в первом примере, за исключением следующих изменений. 4 группы взрослых самок мышей линии Swiss-Webster (5 в контрольной группе, 5 или 10 в обрабатываемых группах, как показано на фиг. 8) заражаются внутрибрюшинным введением 2,5•103 тахизоитов T. gondii RH штамма. Обработку 50 мг/кг азитромицина (AZITHRO) или 50 мг/кг рифабутина (RIF) одного или в комбинации проводят при использовании питающего патрона, обработку начинают через 24 часа после заражения и продолжают 10 дней. Контрольные животные обрабатываются только разбавителем препаратов.
Результаты показаны на фиг. 8. 100% мышей, обработанных комбинацией выживают за 30 дней, тогда как никто из мышей, обработанных любым одним препаратом не выживает 30 дней.
Пример 7. Активность in vivo рифабутина в комбинации с кларитромицином против T. gondii при моделировании острого токсоплазмоза на мышах.
Эксперименты выполняются способом, описанным в примерах 1 и 3, но при дополнительном введении кларитромицина вместо пириметамина. Условия принимаются, как описано в первом примере, за исключением следующих изменений. 4 группы взрослых самок мышей линии Swiss-Webster (5 в контрольной группе, 5 или 10 в обрабатываемых группах, как показано на фиг. 9) заражаются при внутрибрюшинном введении 2,5•103 тахизоитов T. gondii RH штамма. Обработку 50 мг/кг рифабутина (RIF) или 50 мг/кг кларитромицина (CLARI) по одному или в комбинации проводят при использовании питающего патрона, начинают через 24 часа после заражения и продолжают 10 дней.
Контрольные мыши обрабатываются только разбавителем препарата.
Результаты показаны на фиг. 9. 100% мышей, обработанных комбинацией, выживают 30 дней, тогда как 20% мышей, обработанных кларитромицином одним, выживают 30 дней.
Пример 8. Активность in vivo рифабутана против T. gondii при моделировании токсоплазматического энцефалита (ТЕ) на мышах.
Для определения активности рифабутана при лечении токсоплазматического энцефалита, обусловленного инфекцией цистами штамма ME49 T. gondii используют взрослых самок мышей линии CBA/Ca (CBA), весом 17 г на начало каждого эксперимента [29, 30]. Все мыши покупаются у Simonsen Laboratories Gilroy CA и их кормят регулярно лабораторной мышиной пищей и поят водой ad. lib. Каждая CBA мышь заражается орально 20 цистами ME49 штамма [30, 32].
Зараженные CBA мыши используются 5 недель после заражения [37, 39]. Гистологическое изучение мозга 3 мышей, умерщвленных в это время, обнаруживает обширный TE с распространенными воспалительными инфильтратами в мягких мозговых оболочках, паренхиме и вокруг маленьких капилляров так же, как и большое количество цист T. gondii. Рифабутин растворяют в фосфатном буфере, pH 6,8, и обрабатывают ультразвуком 30 секунд. Затем начинают обработку 200 мг/кг рифабутина, введенного как единичная суточная оральная доза и продолжают ее 30 дней. 5 обработанных и 5 контрольных мышей умерщвляют CO2 наркозом на 15 и 30 день после начала обработки, и их мозг собирают для определения количества T. gondii, цист и для гистологического изучения, как предварительно описано [30, 32, 41].
Гистологию мозга контрольных мышей на 30 день после заражения сравнивают с гистологией мозга мышей, обработанных рифабутином, на 30 день после заражения. Гистология мозга контрольных мышей, обработанных только разбавителем, обнаруживает широкие воспалительные эксудаты в мягких мозговых оболочках, паренхиме и вокруг маленьких капилляров так же, как и большое количество цист T. gondii. Обработка зараженных CBA мышей 200 мг/кг/день одного рифабутина, введенного в течение 15 дней незначительно уменьшает воспалительную реакцию или количество цист T. gondii в мозге 5 обработанных мышей в сравнении с контролем. Однако обработка 200 мг/кг/день рифабутина в течение 30 дней дает заметное снижение воспалительной реакции у каждой обработанной мыши в сравнении с контролем. Количество цист T. gondii в мозге обработанных мышей незначительно снижается в сравнении с необработанным контролем.
Эти результаты показывают, что рифабутин один является эффективным для лечения инфекции центральной нервной системы. Так как количество цист T. gondii в мозге обработанных мышей незначительно уменьшается в конце лечения, эти результаты могут быть обусловлены не сообщенной ранее антивоспалительной активностью рифабутина. Альтернативно, рифабутин может действовать только против паразитов и/или против быстро воспроизводящихся внутри клеток паразитов. Препараты могут быть не способными действовать против медленно воспроизводящихся брадизоитов, защищенных внутри стенок цисты. Однако настоящее изобретение не ограничивается данным механизмом действия рифабутина.
Пример 9. Активность in vivo рифабутина в комбинации с клиндамицином против T. gondii у млекопитающих с ослабленным иммунитетом.
Изучается лечение зараженных T. gondii млекопитающих с ослабленным иммунитетом при использовании рифабутина в комбинации с клиндамицином. Мышей с иммунодефицитом T- и B-клеток SCID ("тяжелый комбинированный дефицит") [44] заражают цистами ME49 штамма T. gondii. ME49 цисты являются менее вирулентными, чем C56 цисты, и, таким образом, более пригодными для изучения включающих их иммунодефицитных хозяев. Клиндамицин растворяют в стерильном PBS. Единичные суточные дозы комбинаций препаратов, 50 мг/кг клиндамицина со 100 мг/кг рифабутина, вводят орально, начиная с 48 часов после инфекции. Контроль SCID обрабатывается только основным раствором без препарата. Смертность мышей контролируется после заражения. На 25 день после заражения 100% зараженных иммуноослабленных мышей, получающих ежедневную обработку комбинацией 100 мг/кг рифабутина и 50 мг/кг клиндамицина, выживают, тогда как 100% зараженного иммуноослабленного контроля погибает. Это - синергистический эффект, так как эти дозы соответствующих препаратов не обладают защитным действием иммуноослабленных мышей от гибели при введении по одному в условиях этого примера. Прекращение ежедневной обработки комбинацией препаратов приводит к гибели всех зараженных иммуноослабленных тестируемых животных.
В заключении, эти примеры показывают эффективность спиропиперидиновых рифамициновых производных, особенно рифабутина, для защиты млекопитающих, включая иммуноослабленных хозяев, от инфекций Toxoplasma gondii. Соединения также показывают синергистический эффект в комбинации с другими препаратами, особенно с сульфонамидами, и обеспечивают полную защиту в этом модельном изучении от токсоплазмоза.
Все публикации и заявки патентов, указанные в этом описании, включены здесь ссылками до некоторой степени, как если бы индивидуальная публикация или заявка патента показывалась особо и индивидуально для включения ссылкой.
Изобретение теперь полностью описано, оно будет очевидно одной из частей этой области техники, большинство изменений и модификаций может быть сделано к этому без отступления от смысла и области прилагаемой формулы изобретения.
Изобретение относится к медицине, в частности к способу снижения тяжести токсоплазмоза, обусловленного Toxoplasma gondii, введением терапевтически эффективного количества соединения, которое является спиропиперидиновым производным рифамицина S, где производное содержит имидазольное кольцо, которое включает атомы углерода в положениях 3 и 4 рифамицинового кольца, атом углерода в положении 2 имидазольного кольца, являющийся также атомом углерода пиперидинового кольца, образует таким образом спиропиперидиновую систему колец, необязательно содержащую низший углеводородный заместитель у атома азота пиперидина. Способ позволяет повысить эффективность защиты организма от инфекции. 4 с. и 8 з.п.ф-лы, 9 ил.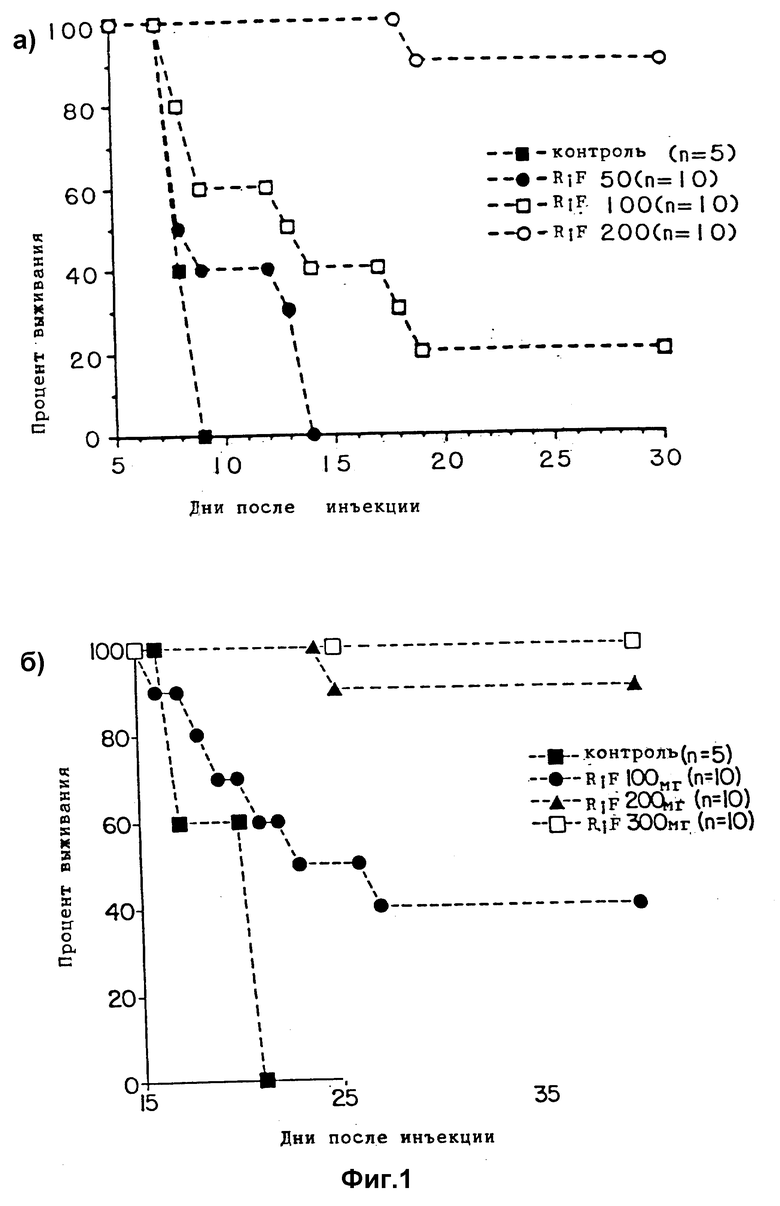
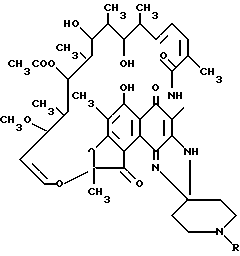
где R представляет собой алкильную группу, содержащую 3 - 5 атомов углерода.
Приоритет по пунктам:
05.05.93 по пп.1-9, 11 и 12;
28.02.94 по п.10.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Remington J.S | |||
| et al - The effect of rifampin on Toxoplasma gondii - Proc | |||
| Soc | |||
| Exp | |||
| Biol | |||
| and Med., 1970, 135 : 167 - 172 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| US 4219478 A, C 07 D 491/20, 26.08.80. | |||
Авторы
Даты
1998-11-20—Публикация
1994-04-29—Подача