Изобретение относится к фармакологии и медицине, в частности к новому конъюгату антибиотика и антибактериальному лекарственному средству на его основе, пригодному для лечения хронических инфекционных заболеваний, таких как туберкулез, токсоплазмоз, сибирская язва, лейшманиоз и других, связанных с инфицированием макрофагов бактериями, одноклеточными паразитами и вирусами.
Многие облигатные паразиты, такие как токсоплазмы, бактерии туберкулеза, сибирской язвы, бруцеллеза, вирусы гепатита и СПИДа, персистируют в макрофагах человека и именно эти клетки участвуют в диссеминации инфекционного процесса. Внутриклеточная локализация инфекционных агентов делает их устойчивыми к проводимой терапии антибиотиками и антивирусными препаратами вследствие их ограниченного поступления в макрофаги, что ведет к длительному лечению, увеличению доз токсичных препаратов и приводит к серьезным побочным эффектам. Эта проблема может быть решена при использовании конъюгатов антибиотиков с лигандами к скэвинжер-рецепторам класса А, расположенных преимущественно на поверхности макрофагов и обеспечивающих быстрый эндоцитоз крупных полианионных молекул (отрицательно заряженных полисахаридов и белков). Техническое решение данного вопроса позволит резко уменьшить дозу применяемых лекарств и увеличить их терапевтическую эффективность.
Известны лекарственные средства, состоящие из липосом, содержащих антибиотики рифампицин и гентамицин, повышающих эффективность лечения гнойно-воспалительных заболеваний легких (патент RU (11) 2063770 (13) C1 (51) 6 A61K47/00, A61K31/71 от 20.07.1996) и лечения туберкулеза (патент, БP N 5614 от 24.06.2003).
Существенным недостатком липосомальных препаратов, наряду с трудоемкой и дорогостоящей технологией изготовления и хранения, является использование в качестве компонентов липосом фосфолипидов, которые подвергаются окислению в условиях производства и становятся нестабильными. Кроме того, применение липосом в клинических условиях значительно ограничено вследствие возможности развития у больных эмболии сосудов, так как фосфолипиды обладают большой гидрофобностью и в кровотоке наблюдается их агрегация.
Наиболее близким аналогом настоящего изобретения является конъюгат изониазида на декстране пролонгированного действия (патент РФ 2192865, кл. А61К31/715, опубл. 20.11.02; патент РФ 2163120, кл. А61К31/455, опубл. 20.02.01).
Указанный конъюгат получают следующим образом. Раствор смеси коммерческого плазмозамещающего лекарственного препарата "Реополиглюкин" декстрана с молекулярной массой 30-60 кДа и изониазида подвергают действию ионизирующего излучения. В этих условиях на декстране иммобилизуется 50% изониазида. Данный препарат, в силу лизосомотропности использованной матрицы, накапливается в лизосомах макрофагов (в том числе и в инфицированных микобактериями туберкулеза макрофагах гранулем). В лизосомах происходит гидролиз пролонгированного препарата с высвобождением изониазида в активной форме и созданием вследствие этого на длительный период высоких концентраций изониазида в микроокружении микобактерий туберкулеза. Этим и объясняется увеличение терапевтической эффективности данного препарата и снижение его токсичности по сравнению со свободным изониазидом. Недостатком прототипа является использование в качестве компонента конъюгата неполярного декстрана, который неспособен проникать в макрофаги через специфические рецепторы, а захватывается не специфически эндоцитозом различными типами клеток, что существенно ограничивает его накопление именно в инфицированных макрофагах. Декстран быстро деградирует внутри лизосом, что также ограничивает время пролонгации антибиотика. Эти недостатки ограничивают повышение терапевтической эффективности данного препарата.
Несмотря на целый ряд положительных свойств данного препарата, дальнейшие исследования показали, что возможно создание препарата, положительные свойства которого могут быть усилены по сравнению с прототипом.
Задачей настоящего изобретения является создание новых конъюгатов антибиотиков с полимерным носителем и полианионным модифицированным полисахаридом, а также лекарственного средства, пригодного для лечения хронических внутримакрофагальных инфекций.
Поставленная задача достигается настоящим конъюгатом антибиотика с полимерным носителем, выбранным из полиэтиленоксида (ПЭО) с ММ 2-10 кДа, полиэтиленвинилацетата, коллагена, желатины, полиуретана или их смеси c молекулярными массами 2-10 кДа, и полианионным модифицированным полисахаридом, таким как декстран или глюкан, имеющим карбоксильные, карбонильные, альдегидные, сульфатные, хлоридные или другие отрицательно заряженные группы, при соотношении компонентов полисахарид: полимерный носитель антибиотик, равном 1-10:10-20:1-5. Причем конъюгат получен облучением смеси полимерного носителя, модифицированного полисахарида и антибиотика в потоке ускоренных электронов или гамма-излучения в дозах 1,0-4.5 Мрад.
Конъюгат антибиотика настоящего изобретения отличается от конъюгата прототипа тем, что имеет в своем составе полимерный носитель - полиэтиленоксид ММ 2-10 кДa, полиэтиленвинилацетат, коллаген, желатин, полиуретан или их смесь, предпочтительно, полиэтиленоксид ММ 2-10 кДa, и отрицательно заряженный полисахарид, причем молекулярная масса (MM) конъюгата составляет 25-110 кДа. Предложенный конъюгат по сравнению с прототипом обладает более высокой скоростью избирательного накопления в макрофагах путем скэвинжер-рецептор-зависимого эндоцитоза, повышенной терапевтической эффективностью при использовании меньших доз, большей пролонгацией действия и сниженной общей токсичностью.
Изобретение также относится к антибактериальному лекарственному средству, включающему конъюгат антибиотика, полимерный носитель и модифицированный отрицательно заряженный полисахарид, пригодному для лечения хронических инфекционных заболеваний, таких как туберкулез, токсоплазмоз, сибирская язва, лейшманиоз и других, связанных с инфицированием макрофагов бактериями, одноклеточными паразитами и вирусами.
Конъюгат по изобретению может per se использоваться как лекарственное средство, но в случае необходимости, в зависимости от пути введения, использоваться в комбинации с фармацевтически приемлемыми аддитивами, которые тщательно смешивают с эффективным количеством конъюгата по изобретению и формулируют в форму, предназначенную для введения (таблетки, пилюли, растворы и т.д.).
После составления композиции с соответствующим фармацевтически приемлемым носителем в желательной дозировке фармацевтическую композицию данного изобретения можно ввести людям и животным перорально, парентерально, местно (в виде порошков, мазей или капель), буккально, в виде орального или назального аэрозоля или подобными им путями, в зависимости от тяжести подвергаемой лечению инфекции. В некоторых вариантах реализации соединения изобретения можно вводить при уровнях дозировки от около 0,001 мг/кг до около 50 мг/кг, от около 0,01 мг/кг до около 25 мг/кг или от около 0,1 мг/кг до около 10 мг/кг массы тела индивидуума в 1 день, 1 или более раз/день, для получения желательного терапевтического эффекта.
В некоторых вариантах реализации соединения вводят перорально или парентерально.
Жидкие лекарственные формы для перорального введения включают, но не ограничиваются, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активным соединениям, жидкие лекарственные формы могут содержать инертные разбавители, обычно используемые в данной области, такие как, например, вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, масло семян хлопка, арахисовое, кукурузное, семенное, оливковое, касторовое и кунжутное), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот сорбитана и их смеси. Кроме инертных разбавителей, пероральные композиции могут также включать адъюванты, такие как смачивающие агенты, эмульгирующие и суспендирующие агенты, подслащивающие, ароматизирующие агенты и отдушки.
Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах активное соединение смешано, по меньшей мере, с одним инертным, фармацевтически приемлемым эксципиентом или носителем, таким как цитрат натрия или дикальцийфосфат, и/или а) наполнители или агенты для увеличения объема, такие как крахмалы, лактоза, сахароза, глюкоза, маннит и кремневая кислота, b) связывающие агенты, такие как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и акация, с) увлажнители, такие как глицерин, d) разрыхляющие агенты, такие как агар-агар, карбонат кальция, крахмал картофеля или тапиоки, альгиновая кислота, некоторые силикаты и карбонат натрия, е) агенты, замедляющие растворение, такие как парафин, f) ускорители всасывания, такие как соединения четвертичного аммония, g) смачивающие агенты, такие как, например, цетиловый спирт и моностеарат глицерина, h) поглотители, такие как каолин и бентонитовая глина, и i) смазывающие агенты, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси. В случае капсул, таблеток и пилюль лекарственные формы могут также включать агенты, придающие буферные свойства.
Твердые композиции аналогичного типа можно также использовать в качестве наполнителей в мягких и твердых заполненных желатиновых капсулах с использованием таких эксципиентов, как лактоза или молочный сахар, а также полиэтиленгликоли с высокой молекулярной массой и им подобные. Твердые лекарственные формы таблеток, драже, капсул, пилюль и гранул можно получить с покрытиями и оболочками, такими как растворяющиеся в кишечнике покрытия и другие покрытия, хорошо известные в области составления фармацевтических композиций. Они могут необязательно содержать агенты, придающие непрозрачность, и могут также состоять только из композиции, которая высвобождает активный ингредиент (ингредиенты), или, предпочтительно, в определенной части кишечного тракта, необязательно отсроченным образом. Примеры внедренных в носитель композиций, которые можно использовать, включают полимерные вещества и воски. Твердые композиции аналогичного типа можно также использовать в качестве наполнителей в мягких и твердых заполненных желатиновых капсулах с использованием таких эксципиентов, как лактоза или молочный сахар, а также полиэтиленгликоли с высокой молекулярной массой и им подобные.
Изобретение иллюстрируется следующими примерами получения конъюгатов моксифлоксацина, изониазида и пириметамина, скэвинжер-рецептор-зависимого накопления конъюгатов этих антибиотиков в макрофагах и терапевтической активности полученных конъюгатов моксифлоксацина, изониазида и пириметамина в сравнении со свободными формами антибиотиков и прототипом на экспериментальных моделях туберкулеза и токсоплазмоза.
1.Получение конъюгатов антибиотиков
Конъюгаты антибиотиков получают облучением смеси соответствующих полимерного носителя (полиэтиленоксид, полиэтиленвинилацетат, коллаген, желатин, полиуретан или их смесь), отрицательно заряженного полисахарида и антибиотика при их мас.% соотношении, равном 1-10:10-20:1-5 в потоке ускоренных электронов или гамма-излучения в дозах 1,0-4,5 Мрад, что демонстрируется следующими примерами.
Пример 1
К 90 мл водного раствора, содержащего 5% полиэтиленоксид ММ 2-10 кДа, 10% карбоксиметилированный глюкан ММ 60 кДа, 50 мМ фосфатный буфер и 0,9% NaCl вносят 10 мл 20% раствора моксифлоксацина до конечной концентрации 20 мг в 1 мл (% соотношение полиэтиленоксид:карбоксилированный глюкан:антибиотик соответствует 5:10:2). Смесь перемешивают 15 мин и облучают потоком ускоренных электронов в дозе 2,5-3,5 Мрад на ускорителе электронов ЭЛВ-6. Получают конъюгат моксифлоксацина с карбоксиметилированным глюканом и полиэтиленоксидом в виде слегка опалесцирующего раствора и удаляют не связанный с полисахаридом и полиэтиленоксидом антибиотика хроматографическими методами. Полученный раствор лиофилизируют. Выход готового продукта составляет 99%.
Пример 2
Аналогично получают конъюгат изониазида, используя вместо моксифлоксацина изониазид, соотношение полиэтиленоксид: карбоксилированный глюкан:антибиотик равно 1:10:2.
Пример 3
Аналогично получают конъюгат пириметамина, используя вместо моксифлоксацина пириметамин, соотношение полиэтиленоксид:карбоксилированный глюкан:антибиотик равно 5:20:2.
Пример 4
К 90 мл водного раствора, содержащего 5% полиэтиленоксид ММ 2-10 кДа, 10% сульфатированный дестран ММ 20-60 кДа, 50 мМ фосфатный буфер и 0,9% NaCl вносят 10 мл раствора 20% моксифлоксацина до конечной концентрации 20 мг в 1 мл (мас.% соотношения полиэтиленоксид:сульфатированный декстран:антибиотик соответствует 5:10:2). Смесь перемешивают 15 мин и облучают потоком ускоренных электронов в дозе 2,5-4,5 Мрад на ускорителе электронов ЭЛВ-6. Получают конъюгат моксифлоксацина с сульфатированным декстраном ММ 30-60 кДа и полиэтиленоксидом в виде прозрачного раствора. Полученный раствор лиофилизируют. Выход готового продукта составляет 99%.
Пример 5
Аналогично получают конъюгат изониазида, используя вместо моксифлоксацина изониазид, соотношение полиэтиленоксид:полисахарид:антибиотик равно 10:20:5.
Пример 6
Аналогично получают конъюгат пириметамина, используя вместо моксифлоксацина пириметамин, соотношение полиэтиленоксид:полисахарид:антибиотик равно 5:20:1.
Пример 7
К 90 мл водного раствора, содержащего 5% полиэтиленоксида ММ 2-10 кДа, 20% карбоксиметилированный глюкан ММ 100 кДа, 50 мМ фосфатный буфер и 0,9% NaCl вносят 10 мл раствора 20% моксифлоксацина до конечной концентрации 20 мг в 1 мл (% соотношение полиэтиленоксид:карбоксилированный глюкан:антибиотик соответствует 5:20:2). Смесь перемешивают 15 мин и облучают потоком ускоренных электронов в дозе 4,5 Мрад на ускорителе электронов ЭЛВ-6. Получают конъюгат моксифлоксацина с карбоксиметилированным глюканом и полиэтиленоксидом в виде слегка опалесцирующего раствора. Полученный раствор лиофилизируют. Выход готового продукта составляет 99%.
Пример 8
Аналогично получают конъюгат изониазида, используя вместо моксифлоксацина изониазид, а в качестве полимерного носителя используют полиэтиленвинилацетат, соотношение полимерный носитель:карбоксилированный глюкан:антибиотик равно 5:20:1.
Пример 9
Аналогично получают конъюгат пириметамина, используя вместо моксифлоксацина пириметамин, а в качестве полимерного носителя - коллаген, соотношение полимерный носитель:полисахарид:антибиотик равно 5:20:2.
Аналогичными способами получены конъюгаты указанных антибиотиков с другими полимерными носителями, такими как желатин или полиуретан, а также конъюгаты других антибиотиков, в частности итромидазола и амфотерицина В.
Все они обладают очень близкими биологическими свойствами, которые демонстрируются ниже.
2.Сведения, подтверждающие быстрое и эффективное скэвинжер-рецептор-зависимое накопление конъюгатов в макрофагах in vitro и in vivo.
2.1.Сведения о накоплении конъюгатов, полученные в опытах in vitro
Изучение скэвинжер-рецептор-зависимого накопления конъюгатов моксифлоксацина (таблица 1), пириметамина (таблица 2) с полиэтиленоксидом (ММ 2-10 кДа) и карбоксиметилированным глюканом (ММ 20-60 кДа), а также конъюгатов изониазида (таблица 3) с полиэтиленоксидом (ММ 10 КДа) и сульфатированным декстраном (ММ 60 кДа) проводилось параллельно с исследованием неконъюгированных форм моксифлоксацина, пириметамина, изониазида, а также конъюгата изониазида с немодифицированным декстраном (ММ 60 кДа) (таблица 4) в опытах на культуре перитонеальных макрофагов мыши.
Конъюгаты указанных антибиотиков, полученные методом облучения в потоке ускоренных электронов (см. пример 1-9), содержащие 10 мг моксифлоксацина, или изониазида, или пириметамина на 100 мг конъюгата и неконъюгированные моксифлоксацин, или изониазид, или пириметамин вносили в культуральную среду в конечной концентрации антибиотика в среде инкубации клеток 1-10 мкг/ мл среды. С целью выявления скэвинжер-рецептор-зависимого захвата препаратов макрофагами использовали метод конкуренции избыточных концентраций лигандов этих рецепторов карбоксиметилированного глюкана или сульфатированного декстрана, внося их среду инкубации одновременно с конъюгатами антибиотиков. После инкубации макрофагов в течение 2 ч клетки гомогенизировали, экстрагировали соответствующие антибиотики и определяли концентрацию моксифлоксацина, или изониазида, или пириметамина методом жидкостной хроматографии высокого давления на колонке с Нуклеосилом С 18 с флуорометрической или спектрофотометрической детекцией.
Как видно из результатов, представленных в таблицах 1-3, внутриклеточная концентрация моксифлоксацина (таблица 1), изониазида (таблица 3) и пириметамина (таблица 2) в макрофагах при инкубации макрофагов с конъюгатами моксифлоксацина, изониазида и пириметамина была выше в 10-15 раз, чем при инкубации клеток с неконъюгированными формами соответствующих антибиотиков. Дозозависимое накопление моксифлоксацина (таблица 1), изониазида (таблица 3) или пириметамина (таблица 2) в макрофагах в зависимости от концентрации конъюгатов моксифлоксацина, или изониазида, или пириметамина имеет сходный характер и проявляет признаки рецептор-зависимого захвата конъюгатов данных антибиотиков. При внеклеточной концентрации конъюгатов моксифлоксацина, или изониазида, или пириметамина 5 мкг/мл внутриклеточное накопление соответствующих антибиотиков достигает насыщения, характерного для рецептор-зависимого захвата. Накопление неконъюгированных моксифлоксацина, или изониазида, или пириметамина в макрофагах происходит пропорционально их концентрации в среде, что свидетельствует о неспецифическом рецептор-независимом диффузионном процессе проникновения неконъюгированных антибиотиков в клетки. Добавление в среду избыточной концентрации лигандов скэвинжер-рецепторов карбоксиметилглюкана или декстрансульфата полностью блокирует рецептор-опосредованный захват конъюгатов моксифлоксацина, изониазида или пириметамина клетками, но не влияет на захват соответствующих неконъюгированных антибиотиков. Сравнительное исследование захвата клетками конъюгата изониазида с полиэтиленоксидом и сульфатированной формой декстрана и прототипа данного изобретения - конъюгата изониазида с немодифицированным декстраном показывают (таблица 4), что конъюгат в соответствии с прототипом значительно медленнее накапливается в клетках и его накопление не зависит от взаимодействия со скэвинжер-рецепторами макрофагов.
Полученные результаты показали, что в отличие от неконъюгированных форм антибиотиков и в отличие от препарата прототипа изониазида, конъюгированного с незаряженной формой декстрана (прототип), конъюгаты антибиотиков по изобретению значительно быстрее и в больших концентрациях накапливаются в макрофагах и их накопление опосредовано скэвинжэр-рецептор-зависимым эндоцитозом.
2.2.Сведения о накоплении конъюгата антибиотиков, полученные в опытах in vivo
Данные о накоплении конъюгата антибиотиков in vivo демонстрируются на примере конъюгата моксифлоксацина.
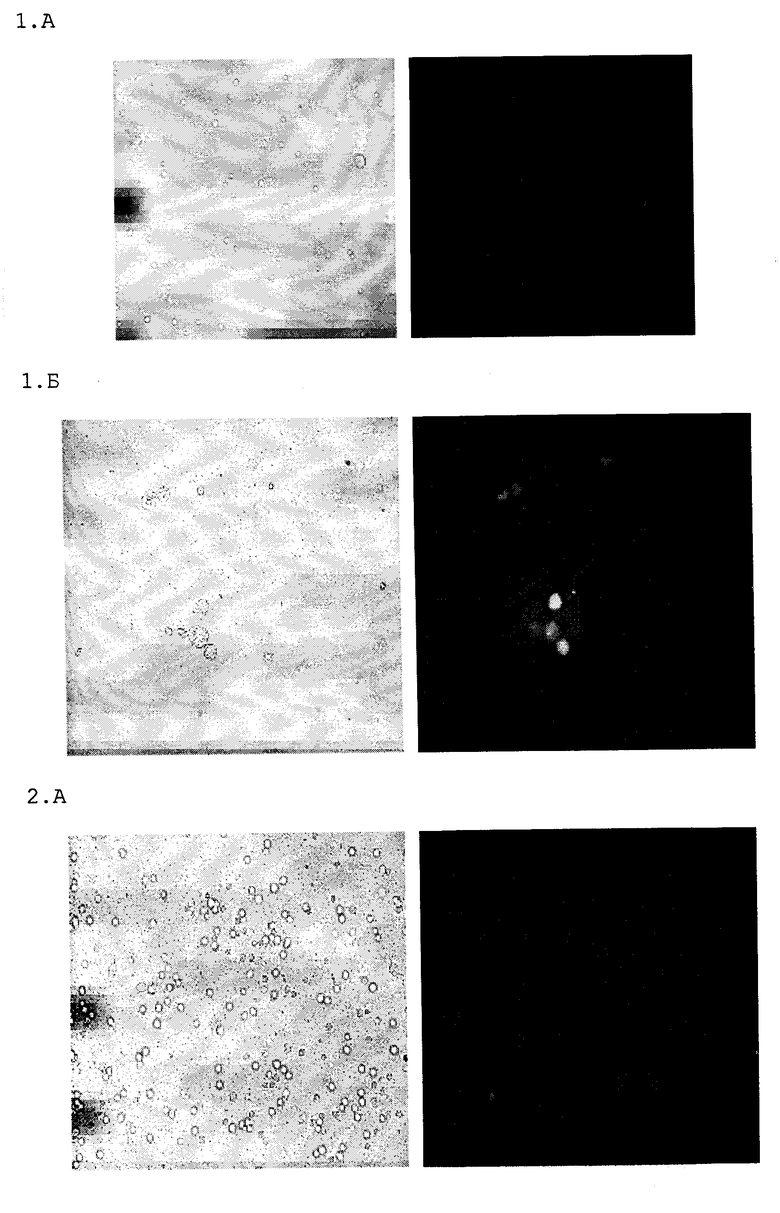
На чертеже представлены результаты световой (фото слева) и флуоресцентной микроскопии (фото справа) макрофагов легких (фиг. 1А и 2Б) и селезенки (фиг. 2А и Б), полученных при внутривенном ретроарбитальном введении мышам конъюгата моксифлоксацина (фиг. 1Б и 2Б) и неконъюгированного моксифлоксацина (фиг. 1А и 1Б) в концентрации моксифлоксацина 10 мг/кг массы тела животным. Как видно на чертеже-фотографии, полученной с помощью флуоресцентного микроскопа, в макрофагах, выделенных из легочного лаважа и селезенки мышей после введения конъюгата моксифлоксацина, но не свободного моксифлоксацина, наблюдается характерное для моксифлоксацина свечение, отражающее его накопление в клетках. Наблюдаемая при введении конъюгата моксифлоксацина величина интенсивности эмиссии легочных макрофагов в 60 раз, а макрофагов селезенки в 130 раз выше, чем при введении неконъюгированного моксифлоксацина.
Полученные результаты показывают, что конъюгаты моксифлоксацина уже через 10-15 минут после внутривенного введения животным избирательно накапливаются в макрофагах легких и селезенки, что проявляется появлением специфической флуоресценции клеток с высокой интенсивностью эмиссии, характерной для моксифлоксацина. При введении неконъюгированных форм моксифлоксацина в аналогичных концентрациях величина флуоресценции клеток оставалась сходной с контрольным уровнем.
На фиг.1 дана световая (слева) и флуоресцентная микроскопия легочных макрофагов и макрофагов селезенки (фиг.2), полученных после введения неконъюгированного моксифлоксацина (фиг.1А и 2А) и конъюгата моксифлоксацина (фиг.1Б и фиг.2Б) мышам.
3.Сведения о терапевтической эффективности конъюгатов антибиотиков, полученные в опытах in vivo
Терапевтическая эффективность конъюгатов антибиотиков исследована на экспериментальных моделях туберкулеза и токсоплазмоза у мышей. Исследования конъюгатов антибиотиков проводились параллельно с исследованием их неконъюгированных аналогов. Дополнительно проводились исследования конъюгатов изониазида (по изобретению) в сравнении с прототипом изобретения конъюгатом немодифицированного декстрана и изониазида.
3.1.Сведения о антимикобактериальной активности конъюгатов изониазида и моксифлоксацина
Антимикобактериальный эффект конъюгатов моксифлоксацина или изониазида оценивали на модели развития острого генерализованного туберкулеза при заражении мышей M. tuberculosis линии Erdman. На 7 день после инфицирования внутривенно вводили моксифлоксацин, изониазид, конъюгат моксифлоксацина в дозах 5-200 мкг/массы тела или конъюгат изониазида в дозах 1-10 мг/кг массы тела в концентрациях, эквивалентных концентрациям неконъюгированного моксифлоксацина или неконъюгированного изониазида. Антимикобактериальную активность оценивали по числу бактериальных колоний в гомогенатах печени, селезенки и легких на 21 сутки после инфицирования животных. Как видно из данных таблицы 5, конъюгат моксифлоксацина (по изобретению) в 20 раз более эффективно подавлял рост микобактерий в печени, селезенке и легких, чем свободный моксифлоксацин. Наибольший терапевтический эффект конъюгат моксифлоксацина проявлялся в селезенке, органе относительно богатом макрофагами. Терапевтический эффект дозы конъюгата моксифлоксацина 5 мкг/кг массы тела сопоставим с дозой 200 мкг/кг массы тела моксифлоксацина.
При исследовании конъюгата изониазида с полиэтиленоксидом и сульфатированным декстраном (по изобретению) (таблица 6) было показано, что его антимикобактериальная активность приблизительно в 5 раз превосходит активность неконъюгированного изониазида и в 3 раза превосходит активность прототипа изобретения конъюгата изониазида с немодифицированным декстраном.
Полученные данные свидетельствуют, что конъюгаты изониазида и моксифлоксацина по изобретению оказывают в несколько раз более выраженный антимикобактериальный эффект в сравнении с препаратами в соответствии с прототипом и неконъюгированными формами изониазида и моксифлоксацина, что позволяет существенно снизить их терапевтическую дозу.
3.2.Сведения о антитоксоплазмозной активности конъюгатов пиромитамина по изобретению
Антитоксоплазмозный эффект конъюгата пиромитамина оценивали на модели развития токсоплазмоза при заражении мышей Toxoplasma gondii.
Через сутки после инфицирования цистами Toxoplasma gondii внутрибрюшинно вводили неконъюгированный пиромитамин или конъюгат пиромитамина по изобретению в эквивалентных концентрациях (10-40 мг/массы тела). Антимикобактериальную активность оценивали по % выживаемости мышей в течение 30 суток наблюдения. Как видно из данных таблицы 7, конъюгат пиромитамина уже в концентрации 10 мг/кг массы в 5-7,5 раз более эффективно, чем неконъюгированный пиромитамин сокращал % смертности животных от токсоплазмоза. В концентрации 20 мг/кг массы конъюгат пиромитамина полностью предотвращал гибель животных на 10 и 20 сутки и проявлял в 12 раз более эффективную защиту на 30 сутки, чем неконъюгированный пиромитамин. Наибольший терапевтический эффект конъюгата пиромитамина отмечался в концентрации 30 мг/кг массы, при которой в отличие от неконъюгированного пиромитамина смертность животных была равна 0.
Проведенные исследования показали, что конъюгат пиромитамина по изобретению обладает значительно большей по сравнению с неконъюгированной формой пиромитамина терапевтической эффективностью, которая проявляется в значительном снижении % смертности животных при развитии токсоплазмоза.
4.Сведения о пролонгированном действии предлагаемых конъюгатов антибиотиков по изобретению
Изучение пролонгированного действия конъюгатов антибиотиков демонстрируется на примере исследования конъюгата моксифлоксацина по изобретению, проводимого в сравнении с неконъюгированной формой моксифлоксацина.
Фармакокинетические данные были получены при внутривенном введении мышам неконъюгированного моксифлоксацина или конъюгата моксифлоксацина в дозе 3,3 мг моксифлоксацина на кг массы тела мыши с последующим определением концентрации моксифлоксацина в крови (таблица 8) и в печени (таблица 9) методом жидкостной хроматографии высокого давления. Фармакологические параметры подсчитывались, используя программу SCI of Prophylactic Medicine, Moscow. Как видно из таблицы 8, кривая «концентрация-время» в полулогарифмических координатах для конъюгата моксифлоксацина нелинейна, в то время как для моксифлоксацина она имеет линейный характер. Фаза α и величина kα у конъюгата моксифлоксацина значительно выше, чем у моксифлоксацина. Фармакокинетические параметры крови свидетельствуют о значительно более быстром перераспределении конъюгата моксифлоксацина из крови в печень, чем моксифлоксацина. В то же время данные таблицы 9 свидетельствуют, что по сравнению с неконъюгированным моксифлоксацином конъюгат моксифлоксацина значительно медленнее выводится из печени, что демонстрирует пролонгированную персистенцию конъюгата моксифлоксацина по изобретению в сравнении с неконъюгированным моксифлоксацином.
Результаты исследования показывают, что конъюгат моксифлоксацина характеризуется увеличенным пролонгированным действием по сравнению с неконъюгированным моксифлоксацином. Период полувыведения неконъюгированного моксифлоксацина составляет 12 часов, а предлагаемого препарата 7,5 суток.
(мин-1)
(мин-1)
(мл/мин)
5.Сведения об общей токсичности терапевтических доз конъюгатов антибиотиков по изобретению
Предлагаемые конъюгаты моксифлоксацина, изониазида и пириметамина в 25-30 раз менее токсичны, чем неконъюгированные моксифлоксацин, изониазид и пириметамин; а конъюгат изониазида по изобретению в 1,8 раза менее токсичен, чем его конъюгат с немодифицированным декстраном по прототипу.
Таким образом, предлагаемые конъюгаты антибиотиков по изобретению выгодно отличаются от неконъюгированных форм антибиотиков и от прототипа изониазид-немодифицированный декстран по ряду параметров - быстрому и избирательному накоплению антибиотиков в макрофагах, пролонгированным действием и по уровню общей токсичности.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНЪЮГАТ ИЗОНИАЗИД-ДЕКСТРАН И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОТИВОТУБЕРКУЛЕЗНОГО ПРЕПАРАТА | 1999 |
|
RU2163120C1 |
| СПОСОБ ИММОБИЛИЗАЦИИ БИОЛОГИЧЕСКИ АКТИВНОГО ВЕЩЕСТВА (БАВ) НА НОСИТЕЛЬ (ВАРИАНТЫ) И КОНЪЮГАТ БАВ-НОСИТЕЛЬ, ПОЛУЧЕННЫЙ ДАННЫМИ СПОСОБАМИ | 2008 |
|
RU2409669C9 |
| СПОСОБ ПРЕДОТВРАЩЕНИЯ ДЕСУЛЬФАТИРОВАНИЯ И ПОВЫШЕНИЯ БИОДОСТУПНОСТИ БИОЛОГИЧЕСКИ АКТИВНЫХ СУЛЬФАТИРОВАННЫХ ПОЛИСАХАРИДОВ ПРИ ИХ ПЕРОРАЛЬНОМ ПРИМЕНЕНИИ | 2009 |
|
RU2421230C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА | 2008 |
|
RU2372914C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ АНТИКОАГУЛЯНТНЫМИ И ГИПОХОЛЕСТЕРИНЕМИЧЕСКИМИ СВОЙСТВАМИ | 2007 |
|
RU2414907C2 |
| АНТИБАКТЕРИАЛЬНОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ВНУТРИКЛЕТОЧНЫХ ИНФЕКЦИЙ | 2006 |
|
RU2308970C1 |
| КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ЛЕГОЧНЫХ ИНФЕКЦИЙ | 2001 |
|
RU2185818C1 |
| КОНЪЮГАТЫ ПОЛИМИКСИНА | 1996 |
|
RU2164149C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОНЪЮГАТА ИЗОНИАЗИД-ДЕКСТРАН | 1994 |
|
RU2125451C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИЗОНИАЗИДА ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ | 2000 |
|
RU2192865C2 |

Конъюгат антибиотика с полианионным полисахаридом, содержащим карбоксильные, сульфатные, карбонильные, альдегидные, хлоридные или другие отрицательно заряженные группы, и с полимерным носителем имеет молекулярную массу (ММ) 25-110 кДа. Конъюгат антибиотика получают облучением в потоке ускоренных электронов или гамма-излучения в дозах 1,0-4,5 Мрад. В качестве антибиотика используют изониазид, моксифлоксацин или пириметамин. В качестве полисахарида используют сульфатированный дестран с ММ 20-60 кДа, карбоксиметилированный глюкан с ММ 60-100 кДа. В качестве полимерного носителя используют полиэтиленоксид с ММ 2-10 кДа или полиэтиленвинилацетат, коллаген, желатин, полиуретан или их смесь с ММ каждого из указанных полимерных носителей 2-10 кДа. Антибактериальное лекарственное средство включает указанный конъюгат антибиотика и может дополнительно включать фармацевтически приемлемые аддитивы. Технический результат - конъюгат антибиотика обладает более высокой скоростью избирательного накопления в макрофагах путем скэвинжер-рецептор-зависимого эндоцитоза, повышенной терапевтической эффективностью при использовании меньших доз, большей пролонгацией действия и сниженной общей токсичностью. 2 н. и 8 з.п. ф-лы, 4 ил., 9 табл.
1. Конъюгат антибиотика с полианионным полисахаридом и полимерным носителем, причем молекулярная масса конъюгата составляет 25-110 кДа.
2. Конъюгат антибиотика по п.1, где полианионный полисахарид представляет собой полисахарид, содержащий карбоксильные, сульфатные, карбонильные, альдегидные или хлоридные отрицательно-заряженные группы.
3. Конъюгат антибиотика по п.1, полученный облучением в потоке ускоренных электронов или гамма-излучения в дозах 1,0-4,5 Мрад.
4. Конъюгат антибиотика по п.1, отличающийся тем, что в качестве антибиотика используют изониазид, моксифлоксацин или пириметамин.
5. Конъюгат антибиотика по п.1, отличающийся тем, что в качестве полисахарида используют сульфатированный декстран с молекулярной массой 20-60 кДа.
6. Конъюгат антибиотика по п.1, отличающийся тем, что в качестве полисахарида используют карбоксиметилированный глюкан с молекулярной массой 60-100 кДа.
7. Конъюгат антибиотика по п.1, отличающийся тем, что в качестве полимерного носителя используют полиэтиленоксид с молекулярной массой 2-10 кДа.
8. Конъюгат антибиотика по п.1, отличающийся тем, что в качестве полимерного носителя используют полиэтиленвинилацетат, коллаген, желатин, полиуретан или их смесь с молекулярной массой каждого из указанных полимерных носителей 2-10 кДа.
9. Антибактериальное лекарственное средство, включающее конъюгат антибиотика с полианионным полисахаридом и полимерным носителем, имеющий молекулярную массу 25-110 кДа по п.1.
10. Лекарственное средство по п.9, дополнительно включающее фармацевтически приемлемые аддитивы.
| КОНЪЮГАТ ИЗОНИАЗИД-ДЕКСТРАН И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОТИВОТУБЕРКУЛЕЗНОГО ПРЕПАРАТА | 1999 |
|
RU2163120C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИЗОНИАЗИДА ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ | 2000 |
|
RU2192865C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА С НИЗКИМ УРОВНЕМ ФИБРОТИЧЕСКИХ ОСЛОЖНЕНИЙ | 2000 |
|
RU2185166C2 |
| RU 2063770 C1, 20.07.1996 | |||
| УСТРОЙСТВО ДЛЯ ПОСТРОЕНИЯ ПРОСТРАНСТВЕННЫХ | 0 |
|
SU409076A1 |
Авторы
Даты
2009-10-27—Публикация
2007-10-05—Подача