Изобретение относится к новым сильнодействующим антагонистам кальция дигидропиридинового типа с очень кратковременным действием и высокой васкулярной селективностью. Соединения изобретения очень эффективны при снижении кровяного давления и благодаря их очень короткой продолжительности действия очень эффективны для регулируемого контроля кровяного давления после внутривенного введения. Настоящее изобретение относится также к способам получения этих соединений, а также пригодным фармацевтическим композициям для их введения. Кроме того, изобретение относится к применению соединений изобретения для консервативного лечения.
Регулируемый контроль кровяного давления имеет большое значение во многих острых клинических ситуациях, например у большинства пациентов, подвергаемых операции на сердце, церебральной хирургической операции, хирургической ортопедии или микрохирургии. В таких условиях часто важно быстро и безопасно снизить кровяное давление до заданного уровня, поддерживать его в течение заданного времени и затем быстро снова его нормализовать.
Хотя некоторые лекарственные средства в настоящее время применяют в клинике для таких целей, ни одно из них на самом деле недостаточно для эффективного регулирования кровяного давления.
Лекарственными средствами, наиболее часто применяемыми при таких показаниях, являются нитропруссит натрия, нитроглицерин и никардипин. Нитропруссит натрия является давно известным, сильнодействующим и очень кратковременно действующим соединением, которое в большинстве стран является единственным доступным лекарственным средством с пригодными показателями действия, т. е. он в основном вызывает артериальную дилатацию. Однако несколько серьезных побочных действий ограничивают его пригодность. Основным неблагоприятным аспектом его применения является риск цианидной интоксикации. Вторым неблагоприятным аспектом является его действие на региональный кровоток сердечной мышцы у пациентов с заболеванием венечной артерии. Нитроглицерин является средством очень кратковременного действия, но имеет слишком низкую активность, чтобы быть действительно эффективным, при применении его в больших дозах происходит также нежелательное снижение минутного сердечного выброса. Никардипин, который является антагонистом кальция дигидропиридинового типа, обладает высокой васкулярной селективностью и высокой активностью, но продолжительность действия его слишком длинная, как обычно бывает в случае этого класса соединений.
Таким образом, в настоящее время существует несомненная медицинская необходимость в новых, регулируемых гипотензивных лекарственных средствах кратковременного действия для внутривенного введения. Соединения настоящего изобретения пригодны для этой цели.
Гипотензивные антагонисты кальция дигидропиридонового типа являются теперь хорошо известными средствами для профилактики и лечения различных сердечно-сосудистых заболеваний (Opic L.H. Clinical use of Calcium channel antagonist Drugs. Kluwer Academic Publ. 1990. ISBN 0-7923-0872-7). Основным стимулом их разработки являлась идентификация безопасных, высокоактивных лекарственных средств с большой продолжительностью действия. Однако не было никаких достижений в направлении разработки дигидропиридинов кратковременного действия.
Несколько соединений, подобные типу соединений настоящего изобретения, были ранее описаны (EP 0474129 A2: Tetrahedron Letters 32.5805-8, (1991); Tetrahedron Letters 33, 7157-60, (1992)). Описаны следующие соединения:
метилпивалоксиметил-1,4-дигидро-2,6-диметил-4-(2', 3'-дихлорфенил)- 3,5-пиридиндикарбоксилат,
метилпивалоксиметил-1,4-дигидро-2,6-диметил-4-(2'-трифторметилфенил)- 3,5-пиридиндикарбоксилат,
метилпивалоксиметил-1,4-дигидро-2,6-диметил-4-фенил-3,5- пиридиндикарбоксилат,
метилпивалоксиметил-1,4-дигидро-2,6-диметил-4-(3'-нитрофенил)- 3,5-пиридиндикарбоксилат,
метилизобутироксиметил-1,4-дигидро-2,6-диметил-4-(3'-нитрофенил)- 3,5-пиридиндикарбоксилат,
метилбутироксиметил-1,4-дигидро-2,6-диметил-4-(3'-нитрофенил)- 3,5-пиридиндикарбоксилат,
метилпропионоксиметил-1,4-дигидро-2,6-диметил-4-(3'-нитрофенил)- 3,5-пиридиндикарбоксилат,
метилацетилоксиметил-1,4-дигидро-2,6-диметил-4-(3'-нитрофенил)- 3,5-пиридиндикарбоксилат.
Эти соединения получали для облегчения синтеза чистых энантиомеров обычных дигидропиридинов долговременного действия и не было описано их медицинское применение.
Для применения в качестве антагонистов кальция кратковременного действия при лечении пациентов с критическими сердечно-сосудистыми заболеваниями описаны производные 1,5-бензотиазепина (EP 0416479 A1).
В настоящее время найдено, что 1,4-дигидропиридины общей формулы I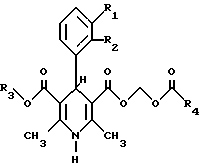
где R1 и R2 независимо выбирают из группы, состоящей из водорода, хлора, брома, нитрогруппы, цианогруппы, трифторметила и R3 и R4 независимо выбирают из нормальных или разветвленных алкильных групп (1-5 атомов углерода), включая все оптические изомеры, при условии, что, если R3 является метилом и R4 является трет-бутилом, то R1/R2 не могут быть водород/водород, водород/2'-трифторметил, 2'-хлор/3'-хлор, и, если R3 является метилом и R1/R2 является водород/3'-нитрогруппа, то R4 не является метилом, этилом, пропилом, изопропилом, трет-бутилом, эффективны в качестве сильнодействующих и вазоселективных гипотензивных средств очень кратковременного действия, пригодных для внутривенного введения.
Предпочтительными соединениями изобретения являются:
1) Ацетоксиметилметил-4-(2', 3'-дихлорфенил) -2,6-диметил-1,4- дигидропиридин-3,5-дикарбоксилат,
2) Пропионоксиметилметил-4-(2',3'-дихлорфенил)-2,6-диметил-1,4- дигидропиридин-3,5-дикарбоксилат,
3) Бутироксиметилметил-4-(2', 3'-дихлорфенил)-2,6-диметил-1,4- дигидропиридин-3,5-дикарбоксилат,
4) (4)-Бутироксиметилметил-4-(2', 3'-дихлорфенил)-2,6-диметил- 1,4-дигидропиридин-3,5-дикарбоксилат,
5) (4P)-Бутироксиметил-4-(2', 3'-дихлорфенил)-2,6-диметил-1,4- дигидропиридин-3,5-дикарбоксилат,
6) изоБутироксиметилметил-4-(2',3'-дихлорфенил)-2,6-диметил-1,4- дигидропиридин-3,5-дикарбоксилат.
Особенно предпочтительными соединениями изобретения являются:
1) Бутироксиметилметил-4-(2', 3'-дихлорфенил)-2,6-диметил-1,4- дигидропиридин-3,5-дикарбоксилат,
2) (4)-Бутироксиметилметил-4-(2', 3'-дихлорфенил)-2,6-диметил- 1,4-дигидропиридин-3,5-дикарбоксилат,
3) (4P)-Бутироксиметилметил-4-(2', 3'-дихлорфенил)-2,6-диметил- 1,4-дигидропиридин-3,5-дикарбоксилат.
Способ получения
Соединения изобретения можно получить как описано ниже. Однако изобретение не ограничивается этими способами, соединения можно также получить как описано в известной области.
Способ A:
Соединения настоящего изобретения можно получить из соответствующей, пригодно замещенной 1,4-дигидропиридинмонокарбоновой кислоты (II) стандартным алкилированием ацилоксихлорметанами в присутствии основания, как показано ниже.
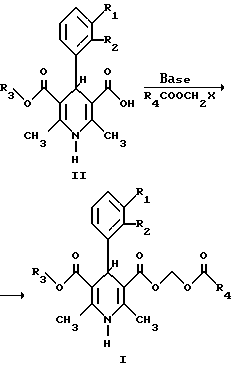
где R1-R4 имеют те же значения, как описанные выше, и основание является, например, гидридом натрия, бикарбонатом натрия, триэтиламином и X обычная отщепляемая группа, например атом галогена, тозилатная или мезилатная группа. В качестве растворителя можно применять полярный апротонный растворитель, например диметилформамид.
Способ B:
Соединения настоящего изобретения (I) можно получить конденсацией пригодного бензилиденового соединения (III) с аминокротонатом (IV), как показано ниже:
где R1-R4 имеют указанные выше значения.
Способ C:
Соединения настоящего изобретения (I) можно получить путем конденсации пригодного бензилиденового соединения (V) с аминокротонатом (VI), как показано ниже.

где R1-R4 имеют указанные выше значения.
Способ D:
Соединения настоящего изобретения (I) можно получить реакцией пригодного бензальдегида (VIII) с пригодным ацетоацетатом (VII) и аминокротонатом (VI), как показано ниже.
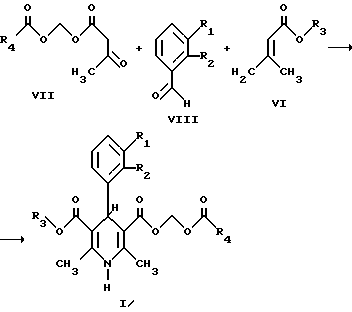
где R1-R4 имеют указанные выше значения.
Метод E:
Соединения настоящего изобретения (I) можно получить реакцией пригодного бензальдегида (VIII) с подходящим ацетоацетатом (IX) и аминокротонатом (IV), как показано ниже.

где R1-R4 имеют указанные выше значения.
Способ F:
Соединения настоящего изобретения (I) можно получить реакцией подходящего бензилиденового соединения (III) с пригодным ацетоацетатом (VII) в присутствии аммиака, как показано ниже:
где R1-R4 имеют указанные выше значения.
Способ G:
Соединения настоящего изобретения (I) можно получить реакцией подходящего бензилиденового соединения (V) с пригодным ацетоацетатом (IX) в присутствии аммиака, как показано ниже:
где R1-R4 имеют указанные выше значения.
Способ H:
Соединения настоящего изобретения (I) можно получить реакцией подходящих ацетоацетатов (VII) и (IX) с пригодным бензальдегидом (VIII) в присутствии аммиака, как показано ниже:
где R1-R4 имеют указанные выше значения.
В каждом из способов A-H полученное соединение можно превратить в оптический изомер.
Фармацевтические композиции
Соединение формулы (I) будет вводиться инъекцией. Лекарственная форма может быть:
- жидким раствором, готовым для применения или предназначенным для разбавления,
- лиофилизованным или наполненным порошком до добавления пригодного наполнителя для восстановления (воссоздания).
Раствор может содержать сорастворители, поверхностно-активные вещества и/или комплексообразующие агенты для повышения растворимости вещества (I).
Раствор может содержать также другие компоненты для установления pH, тоничности и т. д., его можно обычным образом выпускать в различных унифицированных дозах.
Фармакологические свойства
Соединения изобретения (I) обладают кратковременным сильным гипотензивным действием. Соединения оценивали после внутривенной инфузии самопроизвольно гипертензивным крысам (SHR). Продолжительность действия определяли путем ступенчатого повышения скорости инфузии в течение 15 мин до снижения среднего артериального кровяного давления до 30% контрольного уровня. После окончания инфузии определяли время, требуемое для нормализации кровяного давления (от 70% до 90% контрольного уровня). Полученные таким образом "времена возвращения к норме", которые являются критерием длительности действия, приводятся в табл. 1. Активность лекарственного средства измеряли на гипертензивных крысах по количеству (нмоль/кг), требуемому для ступенчатого снижения артериального давления на 30% в течение 15 мин.
Ожидается, что терапевтические дозы для человека будут находиться в диапазоне от 0,01 до 100 мг/час.
Выводы
Данные испытания в соответствии с изобретением показывают, что эти соединения обладают гипотензивной активностью очень небольшой продолжительности со "временем возвращения к норме", подобным времени нитропруссита натрия, который является чаще всего применяемым в настоящее время лекарственным средством для лечения до- и послеоперационной гипертензии.
Настоящее изобретение относится к лекарственным средствам, классифицированным как антагонисты кальция, и как таковые они вряд ли генерируют токсичные метаболиты в процессе долговременной инфузии, что имеет место в случае нитропруссита натрия и что ограничивает применение последнего лекарственного средства.
Настоящее изобретение можно, следовательно, рассматривать как более безопасное и более пригодное для лечения до- и послеоперационного кровяного давления, чем существующая терапия.
Примеры
Настоящее изобретение подробно иллюстрируется следующими примерами, которые не должны истолковываться так, чтобы ограничивать его.
Пример 1. Ацетоксиметилметил-4-(2',3'-дихлорфенил)-2,6-диметил- 1,4-дигидропиридин-3,5-дикарбоксилат
В перемешиваемую смесь 1,4-дигидро-2,6-диметил-4-(2',3'- дихлорфенил)-5-карбоксиметил-3-пиридинкарбоновой кислоты (0,3 г, 0,83 ммоля) и бикарбоната натрия (0,14 г, 1,69 ммоля) в ДМФ (15 мл) в атмосфере азота добавляли хлорметилацетат (0,137 г, 1,26 ммоля). Реакционную смесь нагревали при 80oC в течение 18 час. Из смеси выпаривали растворитель и добавляли воду. Смесь экстрагировали дихлорметаном, экстракт сушили над сульфатом натрия и концентрировали. Полученное масло очищали флеш-хроматографией силикагель, градиент дихлорметан-дихлорметан/метанол (9: 1), получая бесцветные кристаллы (0,17 г, 48%), т.пл. 144,5-147,6oC. 1H ЯМР-спектр (CDCl3): 7,30-7,04 (Ar, 3H); 5,97 (с, 1H), 5,73 (д, J = 5,6 Гц, 1H); 5,69 (д, J = 5,5 Гц, 1H); 5,46 (с, 1H), 3,60 (с, 3H); 2,32 (с, 2H); 2,30 (с, 3H); 2,03 (с, 3H); 13C ЯМР-спектр (CDCl3): 169,64; 167,63; 165,81; 147,46; 146,77; 143,85; 132,86; 131,15; 129,83; 128,31; 126,98; 103,97; 101,89; 78,73; 50,93; 38,45; 20,80; 19,86; 19,26.
Пример 2. Пропионоксиметилметил-4-(2', 3'-дихлорфенил)-2,6- диметил-1,4-дигидропиридин-3,5-дикарбоксилат.
В перемешиваемую смесь 1,4-дигидро-2,6-диметил-4-(2',3'- дихлорфенил)-5-карбоксиметил 3-пиридинкарбоновой кислоты (5 г, 14 ммолей) и гидрида натрия (0,6 г, 14 ммоля) в ДМФ (25 мл) в атмосфере азота добавляли хлорметилпропионат (1,71 г, 14 ммолей). Реакционную смесь нагревали при 80oC в течение 18 час. Из смеси выпаривали растворитель и добавляли воду. Смесь экстрагировали дихлорметаном, экстракт сушили над сульфатом натрия и концентрировали. Полученные желтые кристаллы очищали флеш-хроматографией силикагель, градиент дихлорметан-дихлорметан/метанол (9:1), получая бледно-желтые кристаллы (2,21 г, 36%), т.пл. 123,8-125,5oC. 1H ЯМР-спектр (CDCl3): 7,30-7,03 (Ar, 3H); 5,97, (с, 1H); 5,75 (д, J = 5,5 Гц, 1H); 5,72 (д, J = 5,5 Гц, 1H); 5,46 (с, 1H); 3,60 (с, 3H); 2,34-2,25 (м, 8H); 1,09 (т, J = 7,5 Гц, 3H). 13C ЯМР-спектр (CDCl3): 173,11; 167,65; 165,83; 147,47; 146,70; 143,87; 132,86; 131,14; 129,83; 128,30; 126,96; 103,95; 101,94; 78,70; 50,92; 38,45; 27,25; 19,86; 19,25; 8,61.
Пример 3. Бутироксиметилметил-4-(2',3'-дихлорфенил)-2,6-диметил- 1,4-дигидропиридин-3,5-дикарбоксилат.
В перемешиваемую смесь 1,4-дигидро-2,6-диметил-4-(2',3'- дихлорфенил)-5-карбоксиметил 3-пиридинкарбоновой кислоты (2,62 г, 7,35 ммоля) и бикарбоната натрия (1,26 г, 15 ммоля) в ДМФ (130 мл) в атмосфере азота добавляли хлорметилбутират (1,53 г, 11,21 ммоля). Реакционную смесь нагревали при 80oC в течение 24 час. Реакционную смесь фильтровали и затем выпаривали из нее растворитель. Неочищенный остаток хроматографировали на силикагеле с применением 45% этилацетата в изооктане. Перекристаллизацией из диизопропилового простого эфира получали бесцветные кристаллы (2,20 г, 66%), т.пл. 136,2-138,5oC. 1H ЯМР-спектр (CDCl3): 7,30-7,03 (м, 3H); 5,89 (с, 1H); 5,74 (д, J = 5,5 Гц, 1H); 5,70 (д, J = 5,5 Гц, 1H); 5,46 (с, 1H); 3,60 (с, 3H), 2,33 (м, 8H); 1,65-1,55 (м, 2H); 0,90 (т, J = 7,4 Гц, 3H). 13C ЯМР-спектр (CDCl3): 172,25; 176,61; 101,99; 78,63; 50,92; 38,49; 35,79; 19,91; 19,30; 18,01; 13,50.
Пример 4. (4S)-Бутироксиметилметил-4-(2',3'-дихлорфенил)-2,6- диметил-1,4-дигидропиридин-3,5-дикарбоксилат
В перемешиваемую смесь (4R)-1,4-дигидро-2,6-диметил-4-(2',3'- дихлорфенил)-5-карбоксиметил 3-пиридинкарбоновой кислоты (2,93 г, 8,23 ммоля) и бикарбоната натрия (1,38 г, 16,5 ммоля) в ДМФ (130 мл) в атмосфере азота добавляли хлорметилбутират (1,72 г, 12,6 ммоля). Реакционную смесь нагревали при 80oC в течение 17 час. Реакционную смесь фильтровали и затем выпаривали из нее растворитель. Неочищенный остаток хроматографировали на силикагеле с применением 5% этилацетата в дихлорметане. Перекристаллизацией из диизопропилового простого эфира получали бесцветные кристаллы (2,62 г, 70%), т.пл. 128-129oC. Данные спектров ЯМР были идентичны данным рацемата, приведенным в примере 3. [α]
Пример 5. (4R)-Бутироксиметилметил-4-(2',3'-дихлорфенил)-2,6- диметил-1,4-дигидропиридин-3,5-дикарбоксилат
В перемешиваемую смесь (4S)-1,4-дигидро-2,6-диметил-4-(2',3'- дихлорфенил)-5-карбоксиметил 3-пиридинкарбоновой кислоты (2,0 г, 5,61 ммоля) и бикарбоната натрия (0,96 г, 11,4 ммоля) в ДМФ (100 мл) в атмосфере азота добавляли хлорметилбутират (1,16 г, 8,5 ммоля). Реакционную смесь нагревали при 80oC в течение 23 час. Реакционную смесь фильтровали и затем выпаривали из нее растворитель. Неочищенный остаток растворяли в дихлорметане и промывали раствором бикарбоната натрия. Органическую фазу сушили над сульфатом натрия и выпаривали. Перекристаллизацией сначала из смеси 45% этилацетата в изооктане и затем из диизопропилового эфира получали бесцветные кристаллы (1,08 г, 42%), т. пл. 128-129oC. Данные спектров ЯМР были идентичны данным рацемата, приведенным в примере 3. [α]
Пример 6. Изобутироксиметилметил-4-(2', 3'-дихлорфенил)-2,6- диметил-1,4-дигидропиридин-3,5-дикарбоксилат.
В перемешиваемую смесь 1,4-дигидро-2,6-диметил-4-(2',3'- дихлорфенил)-5-карбоксиметил 3-пиридинкарбоновой кислоты (5,11 г, 14 ммоля) и бикарбоната натрия (2,39 г, 28 ммоля) в ДМФ (250 мл) в атмосфере азота добавляли хлорметилизобутират (2,93 г, 21 ммоль). Реакционную смесь нагревали при 80oC в течение 18 час. Из реакционной смеси выпаривали растворитель. Неочищенный остаток растворяли в дихлорметане и промывали раствором бикарбоната натрия. Органический слой сушили и выпаривали. Остаток хроматографировали на силикагеле с применением градиентного элюирования (от дихлорметана до 25% этилацетата в дихлорметане). Перекристаллизацией из диизопропилового эфира получали бесцветные кристаллы (3,35 г, 52%), т. пл. 145oC. 1H ЯМР-спектр (CDCl3): 7,30-7,04 (м, 3H); 5,73 (д, J = 5,5 Гц, 1H); 5,71 (д, J = 5,5 Гц, 1H); 5,68 (с, 1H); 5,47 (с, 1H); 3,60 (с, 3H); 2,49 (м, 1H); 2,33 (с, 3H); 2,31 (с, 3H); 1,10 (м, 6H). 13C ЯМР-спектр (CDCl3) 175,66; 167,62; 165,77; 147,44; 146,47; 143,78; 132,97; 131,24; 129,81; 128,33; 126,93; 103,99; 102,06; 78,89; 50,86; 38,63; 33,69; 19,83; 19,22; 18,55.


Дигидропиридины общей формулы
где R1, R2-H, хлор, бром, нитро, циано, СF3; R3, R4-С1-5алкил, включая все оптические изомеры - сильнодействующие антагонисты кальция с очень кратковременным действием и высокой васкулярной селективностью, эффективны при снижении кровяного давления. 4 с. и 5 з.п. ф-лы, 1 табл.
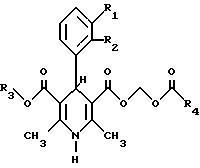
где R1 и R2 независимо выбирают из группы, состоящей из водорода, хлора, брома, нитрогруппы, цианогруппы, трифторметила;
R3 и R4 независимо выбирают из нормальных или разветвленных С1 - С5-алкильных групп, включая все оптические изомеры при условии, что если R3 является метилом и R4 является трет-бутилом, то R1/R2 могут быть водород/водород, водород/, 2'-трифторметил, 2'-хлор/3'-хлор, и, если R3 является метилом и R1/R2 являются водород/3'-нитрогруппа, то R4 не может быть метилом, этилом, пропилом, изопропилом, трет-бутилом.
алкилируют соединением общей формулы
R4COOCH2X,
где R1 - R4 имеют значения, указанные в п.1,
Х - отщепляемая группа,
в присутствии основания, после чего полученное соединение, в случае необходимости, превращают в оптический изомер.
| Пэаны и корнцанги | 1926 |
|
SU12180A1 |
| КВАРЦЕВЫЙ ФИЛЬТР | 0 |
|
SU366548A1 |
| Взрывчатая смесь | 1972 |
|
SU474129A3 |
| Машковский М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, 1987, ч.1, с.412, 413. | |||
Авторы
Даты
1999-10-10—Публикация
1994-11-03—Подача