Изобретение относится к области органической химии, в частности к способу получения простых эфиров адамантана (1-адамантилалкиловых эфиров).
Простые эфиры адамантана могут служить добавками, повышающими окислительную стабильность и вязкость смазочных масел и трансмиссионных жидкостей, а также являются исходным сырьем при получении лекарственных препаратов (Е. И. Багрий, Адамантаны. М.: Наука, 1989, с. 264 /1/; R.C. Fort, Adamantane: The Chemistry of Diamond Molecules. N.Y.: Dekker, 1976, 385 p. /2/).
Одним из известных методов получения 1-адамантилалкиловых эфиров является фотолиз 1-иод-(1) и 1-бромадамантанов (2) в различных растворителях (Hg-лампа низкого давления, λ 254 нм, в атмосфере N2) (P.J. Kropp, G.S.Poindexter, N. J. Pienta, D. C. Hamilton, J.Amer, Chem. Soc., V. 98, N 25, 8135-8144 (1976) /3/; R.R. Perkins, P.E. Pincock, Tetrahedron Letters, N 11, 943-946 (1975) /4/).
Фотолиз 1-иодадамантана (1) в течение 24 часов в метаноле в атмосфере азота при ~ 100% конверсии галоидадамантана приводит к образованию 1-метоксиадамантана (3) с 95% выходом. При насыщении раствора кислородом выход эфира (3) падает до 90% из-за образования адамантанола-1 (4) (выход 10%).
Аналогичная реакция 1-бромадамантана (2) с метанолом проходит за более продолжительное время (48 ч) и с низкой селективностью из-за восстановления (2) в адамантан (5)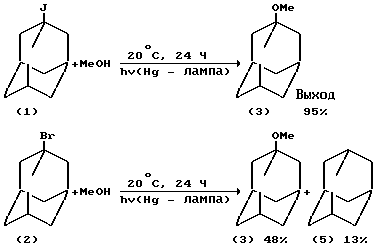
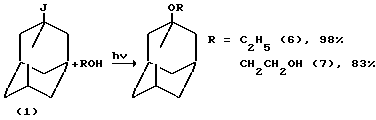
При замене метанола на этанол или этиленгликоль были получены 1-этокси-(6) и 1-(2-гидроксиэтокси)адамантан (7) с общим выходом 98 и 83%, соответственно.
Фотохимический метод получения 1-метокси-(3) и 1-этоксиадамантанов (6) имеет ряд существенных недостатков:
1. Дороговизна и труднодоступность исходных реагентов - 1-иод-(1) и 1-бромадамантанов (2).
2. Значительная продолжительность процесса (20-48 часов) и связанные с этим большие энерго- и трудозатраты.
3. Фотохимические реакции проходят исключительно в прозрачном стеклянном и кварцевом оборудовании, объем которого строго лимитирован. По этой причине данный способ характеризуется низкой производительностью и не поддается масштабированию, т.е. является нетехнологичным.
С умеренным выходом 1-метокси-(3) и 1-этоксиадамантан (6) были получены электролизом 1-адамантанкарбоновой кислоты (7) в присутствии метилата (этилата)натрия в среде метанола, или этанола с добавками уксусной кислоты. Катодом служил платиновый электрод при силе тока 2А и напряжении 65В.
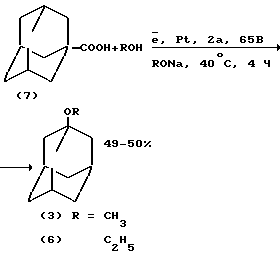
Из-за низкого выхода целевых продуктов, труднодоступности исходного реагента и малой производительности данный способ представляет лишь теоретический интерес (В.Ф. Баклан, С.С. Гуц "Вести. Киевск. политехн. института. Сер. хим.-технол", N 2, 3-5 (1966) /5/).
1-Метоксиадамантан (3) был получен окислением 1-иодадамантана (1) с помощью метахлорнадбензойной кислоты, взятой в трехкратном избытке, в среде метанола (R.I.Davidson, P.J.Kropp. J.Org. Chem., N 10 1904-1909 (1982) /6/). Реакция проходит неселективно и приводит к образованию смеси (3) (выход 84%) и адамантанола-1 (4) (выход 16%)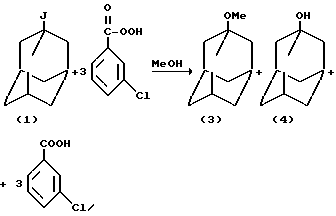
К недостаткам данного способа следует отнести:
1. Труднодоступность и дороговизна исходных реагентов - 1-иодадамантана и надкислоты.
2. Большой расход окислителя (3 моля на 1 моль реагента).
3. Повышенная опасность процесса из-за использования высокореакционноспособной надкислоты.
4. Образование большого количества агрессивных отходов (3 моля метахлорбензойной кислоты).
5. Значительные трудности при выделении целевого продукта, связанные с нейтрализацией метахлорбензойной кислоты и удалением ее натриевой соли из реакционной массы.
Известен метод получения 1-метоксиадамантана (3) из 1-хлорадамантана (8) в присутствии перхлората серебра в метаноле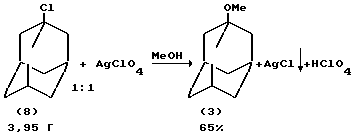
Реакция частично обратима, поэтому выпавший осадок необходимо сразу же отфильтровать. После этого избыток ионов серебра осаждают добавлением хлорида лития в ацетоне (D.N. Kevill, K.C. Kolwysk, F.L. Weite, J.Amer. Chem. Soc., V.92, N 25, 7300-7306 (1970) /7/).
По указанной методике из 1-иодадамантана (1), 2-пропанола в присутствии AgClO4 был получен 1-адамантилизопропиловый эфир с выходом 83%. Аналогичным способом был также получен 1-адамантил-трет-бутиловый эфир (80%) /7/.
На основании сходства по трем признакам (идентичные исходные реагенты: галоидадамантан и спирты, использование катализатора, образование в результате реакции 1-алкоксиадамантана) за прототип взят метод алкоксилирования 1-галоидадамантана с помощью спиртов под действием AgClO4 /7/.
Прототип имеет следующие недостатки:
1. Большой расход катализатора (AgClO4 используется в эквимолярном количестве по отношению к галоидадамантану).
2. Использование стехиометрических количеств AgClO4 влечет за собой целый ряд негативных последствий. Так, сильно усложняется процедура выделения и очистки целевого продукта.
3. Образуется значительное количество неорганических отходов (AgCl) и сточных вод, которые необходимо утилизировать, что требует больших затрат (трудо-, энергозатраты).
4. Процесс в целом является нетехнологичным и дорогим (большой расход катализатора, образование отходов, добавление целой технологической стадии по осаждению катализатора, невозможность повторного использования дорогостоящего AgClO4, в связи с его превращением в нерастворимый в воде хлорид серебра.
5. Образование стехиометрического количества сильной кислоты HClO4 (которая обладает высокой окислительной активностью), необходимость ее нейтрализации и образование отходов NaClO4.
Авторами предлагается способ получения 1-адамантилалкиловых эфиров, не имеющий указанных недостатков.
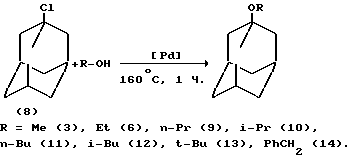
Сущность способа заключается в алкоголизе 1-хлорадамантана с помощью спиртов под действием катализаторов: комплексов палладия, таких как Pd(PPh3)4 и Pd(PPh3)2Cl2 при 120-160oC, в течение 1-5 часов, при мольном соотношении [AdCl] : [Pd] : [ROH] = 1 : 0,005 - 0,01 : 1,5 - 5, предпочтительно 1 : 0,005 : 3.
Комплексы палладия предварительно активированы при 200oC, 3 ч, в инертной атмосфере, в среде CH2Cl2, в герметичном автоклаве.
В оптимальных условиях выход 1-адамантилалкилового эфира достигает 90-98% при полной конверсии 1-хлорадамантана.
Процесс отличается высокой селективностью по 1-адамантилалкиловым эфирам (нет примесей 2-адамантилалкиловых эфиров и адамантанола и диэфиров адамантана).
Существенные отличия предлагаемого способа от прототипа.
1. Для получения 1-алкоксиадамантанов алкоголизом с помощью спиртов используются новые катализаторы на основе палладия.
2. Если в известном методе алкоксилирования катализатор AgClO4 используется в эквимолярном количестве, то в предлагаемом только 0,05-0,01 молей комплекса палладия по отношению к 1-хлорадамантану (8).
Преимущества предлагаемого метода.
1. Высокий выход целевого продукта и высокая селективность процесса по 1-адамантилалкиловым эфирам.
2. Незначительный расход катализатора.
3. Упрощение технологии выделения целевого продукта. Из-за использования небольших количеств катализатора из технологического цикла исключаются стадии разложения катализатора, его отделения и утилизации. Целевые 1-адамантилалкиловые эфиры выделяют перегонкой (после фильтрования реакционной массы через слой силикагеля).
4. Уменьшение количества отходов.
5. Уменьшение трудо-, энергозатрат и экологическая безопасность процесса.
Способ поясняется примерами.
Пример 1. Реакции проводили в стеклянной ампуле (V = 0,015 л) или в стальном микроавтоклаве (V = 0,017 л) (результаты параллельных опытов практически не отличаются).
В стальной микроавтоклав помещали 0,1-0,15 ммолей комплекса палладия в 0,5 мл CH2Cl2, продували аргоном, герметично закрывали и нагревали 2-3 часа при 200oC. Автоклав охлаждали до ~ 20°C, вскрывали и помещали туда в инертной атмосфере 3,4 г (20 ммолей) 1-хлорадамантана и 3 мл метанола и нагревали при 160oC 1 час.
После окончания реакции микроавтоклав охлаждали (~ 20°C), вскрывали, реакционную массу фильтровали через слой SiO2 (2 гр), непрореагировавший метанол отгоняли, остаток перегоняли в вакууме.
Выделенный 1-метоксиадамантан (3) имел т. кип. 67-68o /3 мм, nD 20= 1,4971, d4 20 = 1,0267 (лит. данные т.кип. 66-68o /3 мм, nD 20 = 1,4969 /7/).
Получено 3,25 г (3), выход 98%.
Другие примеры, подтвреждающие способ, приведены в таблице. Полученные 1-адамантилалкиловые эфиры / (3), (6), (9-14)/ были проанализированы, их строение подтверждено спектральными методами и сравнением их с известными образцами /3-7/.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ДИ-1-АДАМАНТИЛОВОГО ЭФИРА | 1998 |
|
RU2147571C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-АДАМАНТИЛАЛКИЛОВЫХ ЭФИРОВ | 2012 |
|
RU2582620C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1- И 2-ХЛОРАДАМАНТАНОВ ИЗ 1- И 2-АДАМАНТАНОЛОВ | 2000 |
|
RU2178400C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ХЛОРАДАМАНТАНА, 1- И 4-ХЛОРДИАМАНТАНОВ | 2000 |
|
RU2185364C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1,3-ДИХЛОРАДАМАНТАНА | 2000 |
|
RU2178401C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕКСАХЛОРЭТАНА | 2001 |
|
RU2185365C1 |
| СПОСОБ ПОЛУЧЕНИЯ 5-АЛКОКСИПЕНТАНОНОВ-2 | 1999 |
|
RU2171797C2 |
| СПОСОБ КАТАЛИТИЧЕСКОЙ ИЗОМЕРИЗАЦИИ ЭНДО-ТЕТРАГИДРОДИЦИКЛОПЕНТАДИЕНА В ЭКЗО-ТЕТРАГИДРОДИЦИКЛОПЕНТАДИЕН | 2000 |
|
RU2191172C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ХЛОРАДАМАНТАНА | 1996 |
|
RU2126784C1 |
| СПОСОБ СОВМЕСТНОГО ПОЛУЧЕНИЯ E3, E8-ДИМЕТИЛТРАНСБИЦИКЛО[4.4.0]ДЕКАНА И E3, E9-ДИМЕТИЛТРАНСБИЦИКЛО[4.4.0]ДЕКАНА | 2000 |
|
RU2188813C2 |

Изобретение относится к способу получения простых эфиров адамантана (1-адамантилалкиловых эфиров), которые служат добавками, повышающими окислительную стабильность и вязкость смазочных масел, а также являются исходным сырьем при получении лекарственных препаратов. Сущность способа заключается в алкоголизе 1-хлорадамантана с помощью спиртов при повышенной температуре с использованием в качестве катализаторов комплексов палладия, таких как Pd(PPh3)4, Pd(PPh3)2CI2 при температуре 120 - 160oC в течение 1 - 5 ч, при мольном соотношении [AdCI] : [Pd] : [RОН] = 1 : 0,005 - 0,01 : 1,5 - 5. Конверсия 1-хлорадамантана составляет ≈ 100%. При этом снижается расход катализатора и упрощается технология процесса. 1 табл.
Способ получения 1-адамантилалкиловых эфиров каталитическим алкоголизом 1-хлорадамантана с помощью спиртов при повышенной температуре, отличающийся тем, что процесс ведут в присутствии палладиевого катализатора Pd(PPh3)4, Pd(PPh3)2Cl2 при температуре 120 - 160oC в течение 1 - 5 ч при мольном соотношении [AdCl] : [Pd] : [ROH] = 1 : 0,005 - 0,01 : 1,5 - 5.
| D.N.KEVILL et al., J.Amer.Chem | |||
| Кинематографический аппарат | 1923 |
|
SU1970A1 |
| Багрий Е.И | |||
| Адамантаны | |||
| - М.: Наука, с.137-150, 182-198 | |||
| EP 0377274 A3, 1990. | |||
Авторы
Даты
2000-02-20—Публикация
1998-06-22—Подача