Область техники
Изобретение относится к новым производным 6-R-1,3,4-тиадиазин-2-аминов, их применению в качестве анестезирующих, сердечно-сосудистых и гипометаболических средств, используемых в медицине и ветеринарии, и к содержащим их фармацевтическим композициям.
Предпосылки изобретения
Анестезия может быть в общем описана как состояние, при котором пагубные явления, такие как хирургические процедуры, оказываются незаметными для организма; это состояние может сопровождаться потерей сознания (общая анестезия), либо может иметь место без потери сознания (местная анестезия). Полный или общий анестетик, вводимый ингаляционно или внутривенно, вызывает состояние глубокого сна и потерю двигательной активности (гипноз), анальгезию, релаксацию мышц и обеспечивает защиту от возрастания кровяного давления и сердцебиения от хирургического стресса. Анестетики в общем проявляют гипометаболическую активность и часто действуют как дыхательные или сердечно-сосудистые депрессанты. Некоторые анестетики могут использоваться для преднамеренного создания гипотензивного эффекта, что очень ценно для внутричерепных и других хирургических операций. Несмотря на то, что большое количество химических препаратов, обладающих анестезирующей и сердечно-сосудистой активностью, созданы и/или доведены до фармацевтического рынка, существует постоянная потребность в новых средствах, обладающих гипометаболической активностью, которые могли бы вызывать сон, снижать моторную активность, вызывать гипотензию, брадикардический, гипокоагулирующий, антиагрегантный и другие гипобиотические эффекты, такие как пониженное потребление кислорода и снижение температуры тела, что было бы ценным для применения в сложных хирургических операциях или при лечении угрожающих жизни и/или травматических состояний, таких как сотрясение мозга, инфаркт миокарда, и которые обладали бы высокой активностью, продолжительным действием и отличными профилями токсичности для ЦНС и сердечно-сосудистой системы без побочных эффектов, таких как тремор, конвульсии, нарушение дыхания и сердцебиения.
Имеется значительное количество данных относительно 6-R-1,3,4-тиадиазин-2-аминов (см. обзоры [1-3]). Также в патентной литературе имеются данные о миорелаксантной (4-7], седативной [8, 9], спазмолитической (1-12] и других видах биологической активности [3]. Ряд 5-арилзамещенных 1,3,4-тиадиазинов специфически описаны в изобретениях [14-20], также как их 6-алкил и 6-фенильные аналоги [13 и 21]. Ценность 6-R-1,3,4-тиадиазин-2-аминов как гипометаболических анестетиков и сердечно-сосудистых агентов до сих пор никем не признавалась. Более того, многие из этих веществ являются новыми и прежде не были описаны в литературе.
Предшествующие изобретения по 6-R-1,3,4-тиадиазин-2-аминам включают:
1. Н. Beyer, Z. Chem., 1969, Bd. 9, S. 361.
2. С. В. Усольцева, Г.П. Андронникова, В.С.Мокрушин, Химия гетероцикл. соедин., 1991, N. 4, с. 435.
3. А.П. Новикова, Н.М. Перова, О.Н. Чупахин, Химия гетероцикл. соедин., 1991, N. 11, с. 1443.
4. W.D. Jones and F.P. Miller. US-A-4309426 (1982).
5. W.D. Jones and F.P. Miller. BE-A-884991 (1980).
6. W.D. Jones and F.P. Miller. DE-A-3042295 (1982).
7. FR-A-2493 844 (1982).
8. US-A-4272532 (1981).
9. F.P. Miller and W.D. Jones. BE-A-884990 (1980).
10. W.D. Jones and F.P. Miller. DE-A-3031703 (1981).
11. Fisons PLC, Japan Kokai, Tokyo Koho JP-A-6253976.
12. W.D. Pfeiffer and E. Bulka, DD-A-220311 (1985).
13. N. Yoshida, K. Tanaka, and Y.Iizuka. Japan Kokai 7488889 (1974).
14. Л. Н. Расина, О. Н. Чупахин, М.В. Чибиряк, Радиобиология, 30 (2), 162-5 (1990).
15. А. В. Белик и др. Химико-фармацевтический журнал, 26(3), 62-64 (1992).
16. Н.М. Перова и др. Химия гетероцикл. соедин., N 4, 565-6 (1993).
17. E. Bulka and W.D. Pfeiffer, DD-A-288824.
18. W.D. Pfeiffer and E. Bulka, Synthesis, N 7, 485-6 (1977).
19. Т. Werner et al, US-A-4940790 (1990).
20. А.П. Новикова и др. SU-A-172 6478.
21. E. Bulka et al, DD-A-228248.
Краткое изложение сущности изобретения
Согласно одному из аспектов изобретения предлагается применение замещенных 6-R-1,3,4-тиадиазин-2-аминов следующей общей формулы в качестве анестетиков или сердечно-сосудистых средств: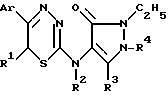
где Ar представляет фенил или фенил, замещенный одним или более атомами хлора, брома, C1-C4 алкокси или C1-C4 алкильными группами; каждый из R1 и R2 представляет, независимо, атом водорода или C1-C4 алкильный остаток; и R3 и R4 независимо выбраны из C1-C4 алкильных групп; и их фармацевтически приемлемых солей.
Согласно следующему аспекту изобретения предлагаются новые замещенные 6-К-1,3,4-тиадиазин-2-амины приведенной выше общей формулы. Согласно еще одному аспекту изобретения предлагаются фармацевтические композиции, включающие в качестве активного агента одно или более из приведенных выше замещенных производных 6-R-1,3,4-тидиазин-2-аминов или их фармацевтически приемлемых солей.
Описание изобретения
1,3,4-Тиадиазины, подходящие для использования в данном изобретении, замещены в положении 5 тиадиазинового кольца незамещенным фенилом или фенилом, замещенным одной или несколькими, прямыми или разветвленными C1-C4 алкильными, алкенильными, алкокси или ацилокси группами, одной или несколькими гидроксигруппами, или атомами галогена. В предпочтительных соединениях этой формулы Ar представляет собой либо незамещенный фенил или фенил, замещенный одной или несколькими алкильными или алкоксильными группами, атомами хлора или брома, замещение предпочтительнее в положениях 3 или 4 арильного фрагмента. Кроме того, соединения содержат в положении 2 тиадиазинового цикла остаток 4-амино-1-фенил-2,3-диалкилпиразол-5-она или 4-(N-алкиламино)-1-фенил-2,3-диалкил-пиразол-5-она, в которых фенильный фрагмент является незамещенным фенилом или фенилом, замещенным C1-C4 алкильной, алкенильной, алкокси или ацилокси группами, одной или несколькими гидроксигруппами или атомами галогена. Кроме того, соединения могут быть замещены в положении 6 тиадиазинового кольца (R1) и/или в аминогруппе в положении 2 тиадиазинового кольца (R2) одной из R1-R4 алкильных групп.
Согласно изобретению описанные выше 1,3,4-тиадиазины могут быть получены взаимодействием α-галоарилалканона формулы Ar-CO-CH(R1)X с тиосемикарбазидом формулы NH2-NH-CS-NR2Y, где Ar, R1 и R2 определены выше, X является галогеном, предпочтительно, атомом хлора или брома, и Y представляет 1-фенил-2,3-диалкилпиразол-5-он-4-ил, в котором алкильная или диалкильная группы, предпочтительно, являются прямыми или разветвленными алкильными C1-C4 цепями, и в котором фенильный остаток является незамещенным фенилом или фенилом, замещенным C1-C4 алкильной, алкенильной, алкоксильной, или ацилоксильной группами, или одним и более атомами галогена или гидроксигруппами.
1,3,4-Тиадиазины могут быть выделены и/или использованы в свободном виде или преобразованы в аддитивные соли с фармакологически приемлемыми минеральными или органическими кислотами. Подходящими для приготовления аддитивных солей с кислотами являются, например, минеральные кислоты, такие как бромистоводородная кислота, соляная, серная или фосфорная кислоты; органические карбоновые кислоты, такие как уксусная, молочная, малеиновая, фумаровая, щавелевая, винная, лимонная или глюконовая кислоты; или
органические сульфокислоты, такие как сульфоновые кислоты, бензолсульфокислота, пара-толуолсульфокислота, метансульфокислота, трифтор-метансульфокислота и циклогексиламидосульфоновая кислота.
α-Галоарилалканоны, используемые в качестве исходных веществ "при получении описанных выше тиадиазинов, известны из литературы или могут быть получены из арилалканонов посредством реакции с подходящими галогенирующими агентами по методу, описанному в справочнике Губен-Вейля, том. E4 (1960), стр. 171-189. Подходящими соединениями являются, например, α-бромоарилэтанон и α-бромоарилбутанон, в которых арил может быть фенилом или замещенным фенилом, получаемые галогенированием соответственным образом замещенных 1-арилалканонов элементарным бромом или бромидом меди (II) по методу Кинга и Острума, J. Org. Chem. 29, 3459-3461 (1964).
Замещенные тиосемикарбазиды, которые используются в качестве исходных материалов, в большинстве случаев известны из литературы или могут быть получены методами, описанными в справочнике Губен-Вейля, том. Е4, стр. 506-515 и К. Йенсеном с сотр., Acta Chem. Scand. 22, 1-50 (1968). Так, тиосемикарбазиды могут быть получены добавлением гидразида к изотиоцианатам или реакцией соответственным образом N,N-дизамещенных тиокарбамоилхлоридов с гидразином, или взаимодействием этилдитиокарбаматов формулы 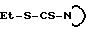 с гидразином. Для того, чтобы избежать осложнений, связанных с побочными реакциями, получение тиосемикарбазидов ведут преимущественно в апротонных растворителях, таких как, например, хлороформ, тетрахлорметан, диэтиловый эфир или диоксан.
с гидразином. Для того, чтобы избежать осложнений, связанных с побочными реакциями, получение тиосемикарбазидов ведут преимущественно в апротонных растворителях, таких как, например, хлороформ, тетрахлорметан, диэтиловый эфир или диоксан.
Реакцию α-галоарилалканонов с тиосемикарбазидами целесообразно проводить, используя эквимолярные количества обоих реагентов в растворителе или разбавителе, который инертен по отношению к этим реагентам. Подходящими для этой цели являются, в частности, низшие спирты, такие как метанол, этанол, н-пропанол, изопропанол и различные бутанолы, или этилацетат и смеси этих растворителей, но преимущество следует отдать этанолу. Реакция обычно проводится при температурах между 20oC и точкой кипения данной реакционной среды, но чаще всего, между 20oC и 70oC. В зависимости от реакционной способности реагентов, природы реакционной среды и температуры, время реакции может быть в пределах от 5 минут до 2 часов. Конечные продукты обычно кристаллизуются в аналитически чистом виде при медленном охлаждении реакционной смеси.
В зависимости от растворимости вещества могут вводиться либо перорально, либо через парентеральные инъекции растворенной формы. Они могут применяться самостоятельно, например, в форме микрокапсул, в смесях друг с другом, или в комбинациях с подходящими вспомогательными средствами и/или наполнителями.
Изобретение также касается фармацевтических композиций, в состав которых входит эффективное количество, по крайней мере, одного из упомянутых выше тиадиазиновых соединений, если требуется, то в форме одной из аддитивных солей с кислотами, и которые содержат, по крайней мере, одно из этих активных веществ в дополнение к фармацевтически приемлемым наполнителям, разбавителям и/или другим вспомогательным веществам. Подходящие твердые или жидкие лекарственные формы включают, к примеру, гранулы, порошки, покрытые оболочкой таблетки, таблетки, (микро)капсулы, суппозитории, сиропы, эликсиры, суспензии, эмульсии, капли или инъекционные растворы, а также препараты с целевой доставкой активной субстанции, в производстве которых обычно используются вспомогательные вещества, такие как наполнители, дезинтеграторы, связующие, создающие оболочку агенты, разрыхлители, смазочные добавки, отдушки, подсластители или солюбилизаторы. Подходящими вспомогательными веществами являются, например, карбонат магния, диоксид титана, лактоза, маннитол и другие сахара, тальк, молочный альбумин, желатин, мука, целлюлоза и ее производные, животные и растительные масла, полиэтиленгликоли и растворители, такие как стерильная вода и моноатомные и полиатомные спирты, например глицерин.
Фармацевтические препараты предпочтительно производятся и используются для лечения в дозированных формах, каждая из которых содержит в качестве активного компонента определенную дозу, по крайней мере, одного тиадиазинового соединения и/или, по крайней мере, одну соответствующую аддитивную соль с кислотой. В случае инъекционных растворов тиадиазин преимущественно используется для лечения в дозах от 10 до примерно 600, предпочтительно от примерно 20 до примерно 500, еще более предпочтительно от примерно 30 до примерно 400 мг/кг.
Соединения, подходящие для использования, представлены следующими примерами:
1. 2-N-Метил-N-(1-фенил-2,3-диметилпиразол-5-он-4-ил)-амино-5-фенил-6Н-1,3,4-тиадиазин;
2. 2-N-Метил-N-(1-фенил-2,3-диметилпиразол-5-он-4-ил)-амино-5-(4-бромфенил)-6Н-1,3,4-тиадиазин;
3. 2-N-(1-фенил-2,3-диметилпираэол-5-он-4-ил)-амино-5-фенил-6Н-1,3,4-тиадиазин;
4. 2-N-Mетил-N-(1-фенил-2,3-диметилпираэол-5-он-4-ил)-амино-5-фенил-6Н-6-этил-1,3,4-тиадиазин;
5. 2-N-(1-фенил-2,3-диметилпиразол-5-он-4-ил)-амино-5-фенил-6Н-6-этил-1,3,4-тиадиазин;
6. 2-N-Метил-N-(1-фенил-2,3-диметилпиразол-5-он-4-ил)-амино-5-(4-этоксифенил)-6Н-1,3,4-тиадиазин;
7. 2-N-Метил-N-(1-фенил-2,3-диметилпиразол-5-он-4-ил)-амино-5-(4-хлорфенил)-6Н-1,3,4-тиадиазин;
8. 2-N-(1-фенил-2,3-диметилпиразол-5-он-4-ил)-амино-5-(3-бромфенил) -6Н-1,3,4-тиадиазин;
9. 2-N-Метил-N-(1-фенил-2,3-диметилпиразол-5-он-4-ил)-амино-5-(3-бромфенил)-6Н-1,3,4-тиадиазин.
Примеры
Все соединения получены с выходами 60-80% путем конденсации α-галоарилалканонов с соответствующими 4-замещенными тиосемикарбазидами, протекающей гладко при нагревании в этаноле. Строение соединений доказано спектральными данными (УФ, ИК, 1H ЯМР); их чистота подтверждается данными тонкослойной хроматографии и элементного анализа.
Пример 1.
2-N-Метил-N-(1-фенил-2,3-диметилпираэол-5-он-4-ил)-амино-5- фенил-6Н-1,3,4-тиадиазин.
Соединение 1 было получено нагреванием 2 г (0.01 моль) α-бромацетофенона с 2.9 г (0.01 моль) 4-метил-4-(1-фенил-2,3-диметилпиразол-5-он-4-ил)-тиосемикарбазида в этаноле в течение 20 минут. Реакционную смесь охлаждали и подщелачивали разбавленным раствором аммиака до pH 8-9. Бесцветный осадок отфильтровывали, перекристаллизовывали из 30% смеси вода-этанол и сушили. Выход 2.7 г (70%). Т. пл. 154-156oC. Rf = 0.6 (элюент: этанол-хлороформ 1: 8). Найдено, %: C 64.4; H 5.4; N 17.7. C21H21N5OS. Вычислено, %: C 64.4; H 5.4; N 17.9. 1H ЯМР в DMSO-d6, δ ppm: 2.2 (3Н, s, CH3); 3.2 (3Н, br. s, NCH3); 3.35 (3H, br. s, NCH3); 3.7 (2Н, s, CH2S); 7.4-7.9 (10Н, m, два C6H5).
Пример 2.
2-N-Метил-N-(1-фенил-2,3-диметилпиразол-5-он-4-ил)-амино-5- (4-бромфенил)-6Н-1,3,4-тиадиазин.
Соединение 2 получали аналогично синтезу соединения 1 из α -бром-4-бромацетофенона и 4-метил-4-(1-фенил-2,3-диметилпиразол-5-он-4-ил)- тиосемикарбазида. Выход 72%. Т.пл. 169-170oC. Rf = 0.5 (элюент: этанол-хлороформ 10: 1). Найдено, %: C 53.6; H 4.3; N 14.6. C21H20BrN5OS. Вычислено, %: C 53.6; H 4.3; N 14.9. 1H ЯМР в DMSO-d6, δ, ppm: 2.2 (3H, s, CH2); 3.2 (3Н, br. s, NCH3); 3.35 (3H, br. s, NCH3); 3.65 (2H, s, CH2S); 7.4-8.0 (9H, m, C6H5 и C6H4).
Пример 3.
2-N-(1-Фенил-2,3-диметилпиразол-5-он-4-ил)-амино-5-фенил-6Н-1,3,4- тиадиазин.
Соединение 3 получали аналогично синтезу соединения 1 из α -бромацетофенона и 4-(1-фенил-2,3- диметилпиразол-5-он-4-ил)-тиосемикарбазида. Выход 88%. Т. пл. 112-114oC. Rf = 0.58 (элюент: этанол-хлороформ 1:8). Найдено, %: C 63.5; H 5.2; N 18.4. C20H19N5OS. Вычислено, %: C 63.6; H 5.1; N 18.5. 1H ЯМР в DMSO-d6, δ, ppm: 2.2 (3Н, s, CH3); 3.1 (3Н, s, NCH3); 3.9 (2Н, s, CH2S); 7.3-8.0 (10Н, m, два C6H5).
Пример 4.
2-N-Mетил-N-(1-фенил-2,3-диметилпиразол-5-он-4-ил)- амино-5-фенил-6Н-6-этил-1,3,4-тиадиазин.
Соединение 4 было получено нагреванием 0.5 г (0.002 моль) α -бромбутирофенона с 0.5 г (0.002 моль) 4-метил-4-(1-фенил-2,3-диметилпиразол-5-он-4- ил)-тиосемикарбазида в 10 мл этанола в течение 20 минут. Реакционную смесь охлаждали, подщелачивали 7% раствором аммиака до pH 9 и выдерживали в течение 30 минут. Желтоватый осадок отфильтровывали, перекристаллизовывали из смеси воды и изопропанола 30:70 и сушили. Выход 0.6 г (75%). Т. пл. 88-89oC. Rf = 0.35 (элюент; этанол-хлороформ 1:10). Найдено, %: C 64.4; H 6.0; N 16.7. C23H25N5OS. Вычислено, %: C 64.5; H 6.2; N 16.3. 1H ЯМР в DMSO-d6, d, ppm: 0.9 (3H, t, -CH3); 2.2 (3H, s, CH3); 3.05 (2H, q, -CH2-); 3.18 (3Н, br. s, NCH3); 3.30 (3Н, br. s, NCH3); 4.25 (1H, m, =CHS); 7.2-8.1 (10Н, m, два C6H5).
Пример 5.
2-N-(1-фенил-2,3-диметилпиpaзoл-5-oн-4-ил)-aминo-5-фенил-6Н-6-Этил- 1,3,4-тиадиазин.
Соединение 5 получено аналогично синтезу соединения 4 из α -бромбутирофенона и 4-(1-фенил-2,3-диметилпиразол-5-он-4-ил)-тиосемикарбазида. Выход 74%. Т. пл. 79-80oC. Rf = 0.32 (элюент: этанол-хлороформ 1:10). Найдено, %: C 63.3; H 5.7; N 17.6. C22H23N5OS. 0.5H2O. Вычислено, %: C 63.8; H 5.8; N 17.8. 1H ЯМР в DMSO-d6, d, ppm: 1.05 (3Н, t, -CH3); 1.70 (2H, m, CH2); 2.20 (3Н, s, CH3); 3.10 (3Н, br. s, NCH3); 4.35 (1H, m, =CHS); 7.0-8.1 (10H, m, два C6H5).
Пример 6.
2-N-Метил-N-(1-фенил-2,3-диметилпиразол-5-он-4-ил)- амино-5-(4-этоксифенил)-6Н-1,3,4-тиадиазин.
Соединение 6 было получено нагреванием 2.4 г (0.01 моль) 4-этокси-α-бромацетофенона с 2.8 г (0.01 моль) 4-метил-4-(1-фенил-2,3-диметилпиразол-5-он-4-ил)-тиосемикарбазида в 100 мл абсолютного этанола в течение 20 минут. Реакционную смесь охлаждали, подщелачивали 7% раствором аммиака до pH 8-9. Желтоватый осадок отфильтровывали, перекристаллизовывали из смеси воды и этанола 80: 20 и сушили. Выход 3.5 g (74%). Т. пл. 164-165oC. Rf = 0.25 (элюент: этанол-хлороформ 1: 10). Найдено, %: C 63.3; H 5.9; N 15.8. C23H25N5O2S. Вычислено, %: C 63.4; H 5.8; N 16.1. 1H ЯМР в DMSO-d6, d, ppm: 1.34 (3Н, t, -CH3); 2.2 (3Н, s, CH3); 3.14 (3Н, s, NCH3); 3.30 (3Н, br. s, NCH3); 3.60 (2H, br. s, CH2S); 4.13 (2H, q, OCH2-); 7.45 (5H, m, C6H5).
Пример 7.
2-N-Метил-N-(1-фенил-2,3-диметилпиразол-5-он-4-ил)-амино- 5-(4-хлорфенил)-6Н-1,3,4-тиaдиaзин.
Соединение 7 получали аналогично синтезу соединения 6 из 4-хлор-α-бромацетофенона и 4-метил-4-(1-фенил-2,3-диметилпиразол-5-он-4-ил)тиосемикарбазида. Выход 77%. Т.пл. 178-179oC. Rf = 0.3 (элюент: этанол-хлороформ 1:10). Найдено, %: C 57.7; H 4.7; N 15.8. C21H20ClN5OS•5H2O. Вычислено, %; C 58.0; H 4.8; N 16.2. 1H ЯМР в DMSO-d6, δ, ppm: 2.20 (3H, s, CH3); 3.15 (3H, br. s, NCH3); 3.30 (3H, br. s, NCH3); 3.65 (2H, s, CH2S); 7.3-8.0 (9H, m, C6H5 и C6H4).
Пример 8.
2-N-(1-фенил-2,3-диметилпиразол-5-он-4-ил)-амино-5-(3- бромфенил)-6Н-1,3,4-тиадиазин.
Соединение 8 получали аналогично синтезу соединения 6 из 3-бром-α-бромацетофенона и 4-(1-фенил-2,3-диметилпиразол-5-он-4-ил)тиосемикарбазида. Выход 76%. Т. пл. 69-70oC. Rf = 0.38 (элюент: этанол - хлороформ 1:10). Найдено, %: C 50.6; H 4.2; N 14.6. C20H18BrN5OS•H2O. Вычислено, %: C 50.2; H 3.9; N 14.8. 1H ЯМР в DMSO-d6, δ, ppm: 2.20 (3H, s, CH3); 3.10 (3Н, br. s, NCH3); 3.95 (2H, s, CH2S); 7.1-8.0 (9H, m, C6H5 и C6H4).
Пример 9.
2-N-Метил-N-(1-фенил-2,3-диметилпиразол-5-он-4-ил)-амино- 5-(3-бромфенил)-6Н-1,3,4-тиадиазин.
Соединение 9 получали аналогично синтезу соединения 6 из 3-бром- α- бромацетофенона и 4-N-метил-(1-фенил-2,3-диметилпиразол-5- он-4-ил)тиосемикарбазида. Выход 82%. Т. пл. 88-90oC. Rf = 0.48 (элюент: этанол-хлороформ 1: 10). Найдено, %: C 49.4; H 4.4; N 14.7. C21H20BrN5OS • 2Н2О. Вычислено, %: C 49.8; H 4.7; N 14.9. 1H ЯМР в DMSO-d6, δ, ppm: 2.20 (3Н, s, CH3); 3.15 (3Н, br. s, NCH3); 3.25 (3Н, br. s, NCH3); 3.55 (2Н, s, CH2S); 7.0-8.2 (9Н, m, C6H5 и C6H4).
Экспкриментальная биологическая часть
Гипометаболическая активность используемых здесь соединений была продемонстрирована следующим образом. Во всех случаях испытания проводились на мышах линии BALB 3-4 месячного возраста. Во всех экспериментах использовались нетоксичные дозы исследуемых веществ, которые варьировались от 60 до 400 мг/кг. В случае водорастворимых веществ водные растворы тестируемых соединений вводились внутрибрюшинно (i.p.), в то время как нерастворимые соединения вводились перорально (p.o.).
Чтобы продемонстрировать влияние исследуемых веществ на температуру тела и потребление кислорода, в экспериментах in vivo для каждой дозы использовалось 5-6 мышей.
Изменения ректальной температуры (абсолютные величины - в oC) измерялись медицинским электротермометром TREM-1 (Табл. 1). Скорость потребления кислорода контролировали измерением концентрации кислорода в закрытом сосуде с помощью оптико-акустического газоанализатора MN 5130. Данные по потреблению кислорода приведены в процентах относительно исходной концентрации кислорода, взятой за 100% (Табл. 2).
Найдено, что при использовании в нетоксических дозах все соединения понижают ректальную температуру в пределах от 3 до 15oC в зависимости от структуры вещества, дозы и метода введения. Установлено, что некоторые из тестируемых веществ вызывают резкое падение температуры тела (7-8oC в течение 30 минут), в то время как другие обнаруживают только умеренный эффект (7-10oC в течение 3 часов), что иллюстрирует табл. 1.
Соединение 1 вводили перорально в дозе 0.16 мг/кг (1/2 LD16), и затем измеряли ректальную температуру. Через 1 час температура тела была примерно на 5oC ниже первоначальной. В течение следующих 4 часов она понижалась далее, достигая 26.4oC (при этом общее падение составляет 12.5oC), в то время как через 24 часа температура восстанавливалась до уровня 96% от начальной точки. Двигательная активность мышей также полностью восстанавливалась. В случае меньших доз (1/4 LD16 или 1/8 LD16) наблюдалось меньшее падение температуры.
При введении в дозе 1/2 LD16 соединение 1 также вызывало значительное падение потребления кислорода: 76% от начального уровня через 5 минут с максимальным падением до уровня 58% через 60-90 минут (Табл. 2). Период максимального падения температуры сопровождается выраженной акинезией и подавлением рефлекторных функций, однако никакого тремора или конвульсий не наблюдалось.
Пример 10.
Композиция для изготовления таблеток
2-N-метил-N-(1-фенил-2,3-диметилпиразол-5-он-4-ил)амино-5-фенил- 6Н-1,3,4-тиадиазин - 200 мг
Пшеничный крахмал - 30 мг
Лактоза - 67 мг
Стеарат магния - 3 мг
Часть пшеничного крахмала используют для приготовления гранулированной пасты крахмала, которую вместе с остатком пшеничного крахмала гранулируют, просеивают и смешивают с активным ингредиентом и стеаратом магния. Смесь прессуют в таблетки массой 300 мг каждая.
Подобным образом изготавливают таблетки, активным ингредиентом которых являются следующие соединения по изобретению:
2-N-метил-N-(1-фенил-2,3-диметилпиразол-5-он-4-ил)амино-5-(4-бромфенил) -6Н-1,3,4-тиадиазин;
2-N-(1-фенил-2,3-диметилпиразол-5-он-4-ил)амино-5-фенил-6Н-1,3,4-тиадиазин;
2-N-метил-N-(1-фенил-2,3-диметилпиразол-5-он-4-ил)амино-5-фенил-6Н-1,3,4-тиадиазин;
2-N-(1-фенил-2,3-диметилпиразол-5-он-4-ил)амино-5-фенил-6Н-6-этил-1,3,4- тиадиазин;
2-N-Метил-N-(1-фенил-2,3-диметилпиразол-5-он-4-ил)амино-5-(4-этоксифенил) -6Н-1,3,4-тиадиазин;
2-N-метил-N-(1-фенил-2,3-диметилпиразол-5-он-4-ил)амино-5-(4-хлорфенил)- 6Н-1,3,4-тиадиазин;
2-N-(1-фенил-2,3-диметилпиразол-5-он-4-ил)амино-5-(3-бромфенил)- 6H-1,3,4-тиадиазин и
2-N-Метил-N-(1-фенил-2,3-диметилпиразол-5-он-4-ил)амино-5-(3-бромфенил)- 6Н-1,3,4-тиадиазин.
Описываются новые замещенные 6-R-1,3,4-тиадиазин-2-амины следующей общей формулы I, где Аr представляет фенил или фенил, замещенный одним или более атомами хлора, брома, C1-C4 алкокси или C1-C4 алкильными группами; каждый из R1 и R2 представляет, независимо, атом водорода или C1-C4 алкильный остаток; R3 и R4 независимо выбраны из C1-C4 алкильных групп; и их фармацевтически приемлемые соли, их применение в качестве анестезирующих, сердечно-сосудистых и гипометаболических средств и содержащие их фармацевтические композиции. 3 c. и 3 з.п. ф-лы, 2 табл.
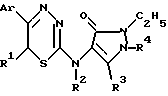
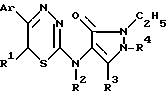
где Ar представляет фенил или фенил, замещенный одним или более атомами хлора, брома, C1 - C4 алкокси или C1 - C4 алкильными группами;
каждый из R1 и R2 представляет, независимо, атом водорода или C1 - C4 алкильный остаток;
R3 и R4 независимо выбраны из ряда C1 - C4 алкильных групп;
и их фармацевтически приемлемые соли.
| SU, 1827257, A1, 15.07.1993 | |||
| US, 3956311 A, 11.05.1976 | |||
| US, 4558045, A, 10.12.1985 | |||
| US, 4645528, A, 24.02.1987. |
Авторы
Даты
2000-10-20—Публикация
1995-12-28—Подача