Настоящее изобретение касается новых жидких стабильных болеутоляющих композиций на основе парацетамола, ассоциированного или неассоциированного с анальгетиком.
Уже давно известно и, в частности, из статьи Fairbrother J.E. "Acetaminophen" в "Analytical Profiles of Drug Substanсеs"1974),т. 3, с. 1-109, что парацетамол, помещенный во влажную среду, тем более когда он находится в водном растворе, способен подвергаться гидролизу с образованием парааминофенола, который, в свою очередь, способен разлагаться на хинонимин. Скорость разложения парацетамола увеличивается с увеличением температуры и света.
К тому же достаточно широко известна нестабильность парацетамола в водном растворе в зависимости от рН раствора. Так, в статье "Stability of aqueous solutions of N-acetyl-p-aminophenol" (Koshy K.T. et Lach J.I., J. Pharm. Sci. , 50, (1961), с.113-118) утверждается, что парацетамол в водном растворе нестабилен, и эта нестабильность, в первую очередь, вызвана гидролизом как в кислой, так и в щелочной среде. Это разложение является минимальным при рН около 6, период полураспада достигает в этом случае 21,8 лет при 25oС.
Применение закона Arrenius с использованием константы специфической реакции, определенной этими авторами, позволило определить, что потребуется приблизительно 19 месяцев для 5%-го снижения содержания парацетамола в водном растворе, поддерживаемом при 25oС и при оптимальном рН. Независимо от гидролиза молекула парацетамола подвергается другому типу разложения, в результате которого образуется хинонимин, способный полимеризоваться, давая начало азотным полимерам.
Эти полимеры, и особенно полимеры N-ацетилпарабензохинонимина, были описаны, кроме того, как токсические метаболиты парацетамола, в частности цитотоксические и гемолитоксические. Разложение этого метаболита в водной среде носит еще более сложный характер и дает начало парабензохинону и гидрохинону (D.Dahlin J.Med.Chem., 25 (1982), 885-886).
При настоящем уровне техники и при современных требованиях к качеству, свойственных фармацевтической регламентации, стабильность парацетамола в водном растворе недостаточна и не позволяет получить впрыскиваемые жидкие фармацевтические композиции. Следовательно, разработка жидких фармацевтических форм парацетамола, особенно впрыскиваемых, до сих пор оставалась неразрешенной.
Были проведены определенные исследования, цель которых заключалась в том, чтобы ограничить разложение парацетамола в водном растворе. Так, в одной статье под заглавием: Stabilisation by ethylenediamine tetraacetic acid of amid and other groups in drug compound (Fogg Q.G. et Summan A.M., J.Clin. Pharm. Ther. , 17 (1992), 107-109) указано, что 0,19%-ный водный раствор парацетамола содержит парааминофенол, являющийся продуктом гидролиза парацетамола, его содержание достигает 19,8% от начального количества парацетамола после его консервации в темноте в течение 120 дней. Добавка ЕДТА в количестве 0,0075% ограничивает это разложение до 7%. К тому же дистилляция щелочного раствора парацетамола приводит к получению 14%-го содержания гидрата окиси аммония в присутствии или нет 1000 ppm аскорбиновой кислоты. На самом деле аскорбиновая кислота обладает удовлетворительными свойствами для такой стабилизации. Однако помещенный в сильно освещенное место раствор парацетамола, содержащий 1000 ppm аскорбиновой кислоты, производит несмотря на это гидрат окиси аммония с выходом 98%. Наоборот, добавление ЕДТА (0,0075%) к этому раствору ограничивает разложение, выход гидрата окиси аммония не превышает 14%.
Несмотря на все эти попытки, не удалось получить стабильные водные жидкие растворы парацетамола, особенно впрыскиваемые.
Настоящее изобретение имеет целью разрешить эту проблему, причем очень удобным и удовлетворительным способом. Оно касается стабильных фармацевтических композиций, содержащих парацетамол в водной среде, к которому добавляют антирадикальный агент. Водным растворителем может быть вода или водные смеси, состоящие из воды и многоатомного спирта, например полиэтиленгликоля (PEG) 300, 400, 1000, 1540, 4000 или 8000, пропиленгликоля или тетрагликоля. Можно также использовать алканол, растворимый в воде, как, например, этанол.
Стабильность этих водных растворов обусловливается не только выбором растворителя. Она определяется также другими параметрами, например, регулирование рН, удаление растворенного кислорода и добавление антирадикального агента или поглотителя свободных радикалов.
Удаление растворенного кислорода осуществляют путем барботирования инертного газа, преимущественно азота.
Соответствующий антирадикальный агент выбирают из производных аскорбиновой кислоты соединений, содержащих, по меньшей мере, одну тиоловую группу, а также из линейных или циклических полиолов.
Предпочтительно производным аскорбиновой кислоты является D- или L-аскорбиновая кислота, аскорбат щелочного металла, аскорбат щелочноземельного металла или сложный эфир аскорбиновой кислоты, растворимый в водной среде.
Поглотителем свободных радикалов, содержащим тиоловую группу, может быть органическое соединение, замещенное одной или несколькими тиоловыми группами, относящееся к алифатическому ряду, такое как цистеин, ацетилцистеин, тиогликолевая кислота и ее соли, тиомолочная кислота и ее соли, дитиотреитол, восстановленный глутатион, тиомочевина, α-тиоглицерин, метионин и меркаптоэтансульфоновая кислота.
Полиолом, который является поглотителем свободных радикалов, предпочтительно является многоатомный спирт, линейный или циклический, такой как маннит, сорбит, инозит, изосорбит, глицерин, глюкоза и пропиленгликоли.
Из поглотителей свободных радикалов, присутствие которых необходимо для стабильности парацетамола, предпочтительным производным аскорбиновой кислоты является аскорбат натрия. Предпочтительными соединениями с тиоловой группой являются цистеин, восстановленный глутатион, N-ацетилцистеин и меркаптоэтансульфоновая кислота.
Заявитель обнаружил, что целесообразно использовать несколько поглотителей свободных радикалов, если они растворимы в воде и совместимы между собой. Предпочтительными поглотителями свободных радикалов являются маннит, глюкоза, сорбит или глицерин. Они без труда смешиваются друг с другом.
К препарату целесообразно добавить один или несколько комплексообразующих агентов, чтобы обеспечить наилучшую стабильность молекулы, потому что активное начало очень чувствительно к присутствию следов металлов, которые способствуют его разложению.
Хелатирующими агентами являются, например, нитрилтриуксусная кислота, этилендиаминотетрауксусная кислота, этилендиамино-N, N'-диуксусная-N, N'-дипропионовая кислота, этилендиаминтетрафосфоновая кислота, 2,2'-(этилендиамино)бутановая кислота или этиленгликолевый эфир бис-(диаминэтилэфир) N, N, N',N'-тетрауксусной кислоты и их натриевые или кальциевые соли.
Роль хелатирующего агента заключается также в том, что он образует комплексы с двухвалентными ионами (медь, цинк, кадмий), которые могут присутствовать и неблагоприятно влиять на состояние формы препарата во время хранения.
Газом, используемым для барботирования раствора с целью удаления кислорода, может быть азот или двуокись углерода или благородный газ. Предпочтительным газом является азот.
Изотония препарата может быть получена путем добавления разумно выбранного количества хлорида натрия, глюкозы, левулозы или хлорида натрия, или хлорида кальция, или глюконоглюкогептоната кальция, или их смесей. Предпочитаемый изотонирующий агент - это хлорид натрия.
Используемым буфером является буфер, совместимый с инъецируемым препаратом, вводимым человеку, рН этого буфера может быть установлен от 4 до 8. Предпочитаемый буфер - это буфер на основе ацетатов или фосфатов щелочного металла, или щелочноземельного металла. Наиболее предпочитаемый буфер - это ацетат натрия, гидрофенофосфат, рН которого регулируется хлористоводородной кислотой или гидроокисью натрия. Концентрация буфера может быть равна 0,1-10 мг/мл. Предпочтительная концентрация заключена между 0,25 и 5 мг/мл.
Кроме того, инъецируемые препараты должны быть стерильны и должны выдерживать стерилизацию нагревом. Известно при этом, что в некоторых условиях антиоксиданты, такие как глутатион, могут разлагаться: [Fialaire A. et al., J. Pharm. Biomed.Anal., т. 10, 6, с.457-460 (1992). Степень разложения глутатиона, уменьшаемая при стерилизации нагревом, изменяется от 40 до 77% в зависимости от температурных условий. Во время таких стерилизаций разумно применять средства, способные сохранять целостность этих антиоксидантов. Добавление комплексообразующих агентов к водным растворам задерживает тепловое разложение тиоловых производных, таких как глутатион, например.
Жидкие фармацевтические композиции согласно изобретению предпочтительно являются инъецируемыми композициями. Концентрация парацетамола в растворе может быть равна 2 мг/мл - 50 мг/мл, если речь идет о растворах, называемых "разбавленными", т.е. непосредственно готовых для перфузии внутривенным путем, и может быть равна 60-350 мг/мл, если речь идет о растворах, называемых "концентрированными", т. е. либо готовых для введения непосредственно внутривенным или внутримышечным путем, либо разбавляемых перед их введением путем медленной перфузии. Предпочтительные концентрации составляют 5-20 мг/мл для разбавленных растворов и 100-250 мг/мл для концентрированных растворов.
Фармацевтические композиции согласно изобретению могут также содержать другое активное начало, которое усиливает присущий парацетамолу эффект.
В частности, фармацевтические композиции согласно изобретению могут содержать анальгетик широкого действия, такой, например, как морфиновый анальгетик.
Морфиновый анальгетик выбирают из морфиновых производных, полученных в результате экстрагирования, полусинтеза или синтеза и пиперидиновых производных, выбираемых из следующего синтеза, который не является исчерпывающим: бупренорфин, цирамадол, кодеин, декстроморамид, декстропропоксифен, гидрокодон, гидроморфон, кетобемидон, левометадон, леворфанол, мептазинол, метадон, морфин, налбуфин, никоморфин, дизоцин, диаморфин, дигидрокодеин, дипипанон, меторфан, декстрометорфан.
Предпочитаемыми морфиновыми производными являются сульфат кодеина или хлоргидрат морфина.
Концентрация кодеина или производного кодеина в расчете на исходный кодеин составляет 0,2-25% от концентрации парацетамола. Предпочтительным производным кодеина является сульфат кодеина. Его предпочтительная концентрация составляет 0,5-15% от концентрации парацетамола.
Концентрация морфина или производного формина в расчете на исходный морфин составляет 0,05-5% от концентрации парацетамола. Предпочтительным производным морфина является хлоргидрат морфина. Его предпочтительная концентрация составляет 0,5-15% от концентрации парацетамола.
К композициям согласно изобретению могут быть добавлены противовоспалительные агенты типа AINS и, в частности, производное фенилуксусной кислоты. Примером таких агентов могут быть кетопрофен, флурбипрофен, тиапрофеновая кислота, нифлюминовая кислота, диклофенак или напроксен.
К композициям согласно изобретению могут быть также добавлены противорвотные агенты либо нейролептики широкого действия, такие как галоперидол или хлорпромазин, или метопимазин, либо гастрокинетического действия, такие как метохлопрамид или домперидон, или еще серотонинэргический агент.
К композициям согласно изобретению может быть также добавлено антиэпилептическое лекарство, например, такое как валпроат натрия, хлоназепам, карбамазепин или фенитоин.
Можно также сочетать с парацетамолом кортикостероид, как, например, преднизон, преднизолон, метилпреднизон, дексаметазон, бетаметазон или один из их сложных эфиров.
Можно также сочетать с парацетамолом трициклический антидепрессант, такой как амитриптилин, имипрамин, хломипрамин.
Концентрации противовоспалительных агентов могут изменяться от 0,100 до 0,500 г на 1000 мл препарата.
Для концентрированных растворов.
Количество используемой воды в процентном отношении преимущественно больше 5% конечного объема и предпочтительно составляет 10-65%. Количество используемого пропиленгликоля в процентном отношении предпочтительно больше 5% и составляет 20-50%.
Используемый полиэтиленгликоль - это преимущественно PEG 300, PEG 400, PEG 1000, PEG 1540 или PEG 4000. Используемые концентрации составляют 10-60 мас. %. Полиэтиленгликоль 300 и полиэтиленгликоль 400 являются предпочтительными. Их предпочтительные концентрации - 20-60%.
Концентрации этанола составляют 0-30% конечного объема и предпочтительно 0-20%.
Используемые концентрации тетрагликоля не превышают 15% с учетом максимальной суточной парентеральной дозы, а именно 0,7 мл/кг веса тела.
Концентрация глицерина варьирует от 0,5 до 5% в зависимости от вязкости совместимой среды и от способа введения.
Для разбавленных растворов.
Процентное содержание используемой воды преимущественно должно быть больше 20% конечного объема и предпочтительно - 25-100%.
Процентное содержание пропиленгликоля преимущественно составляет 0-10%.
Используемый полиэтиленгликоль - это предпочтительно полиэтиленгликоли 300, 400 или 4000. Более предпочтителен полиэтиленгликоль 4000.
Предпочитаемые концентрации - 0-10%.
Используемые концентрации тетрагликоля не превышают 5%. Предпочтительно 0-4%.
Концентрация используемой аскорбиновой кислоты или производного аскорбиновой кислоты больше 0,05 мг/мл и предпочтительно составляет 0,15 - 5 мг/мл. Большие количества могут быть использованы в пределах растворимости. Более высокие дозы аскорбиновой кислоты или производного аскорбиновой кислоты могут быть предписаны человеку в качестве профилактики или в лечебных целях.
Концентрация тиолового производного составляет 0,001%-30% и преимущественно - 0,005%-0,5% для разбавленных растворов и 0,1%-20% - для концентрированных растворов.
рН раствора устанавливают преимущественно с учетом оптимальной стабильности парацетамола в водном растворе, т.е. около 6,0.
Композиция, приготовленная таким образом, может быть кондиционирована в стеклянные запечатанные ампулы или в стеклянные флаконы с пробками, или флаконы из полимера, такого как полиэтилен, или в гибкие полиэтиленовые мешочки, мешочки из винилполихлорида или полипропилена.
Композиция может быть стерилизована путем термической обработки, например при 121oС, в течение 20 мин или стерилизующей фильтрации.
Предпочтительные в настоящее время композиции согласно изобретению представлены в табл. 1.
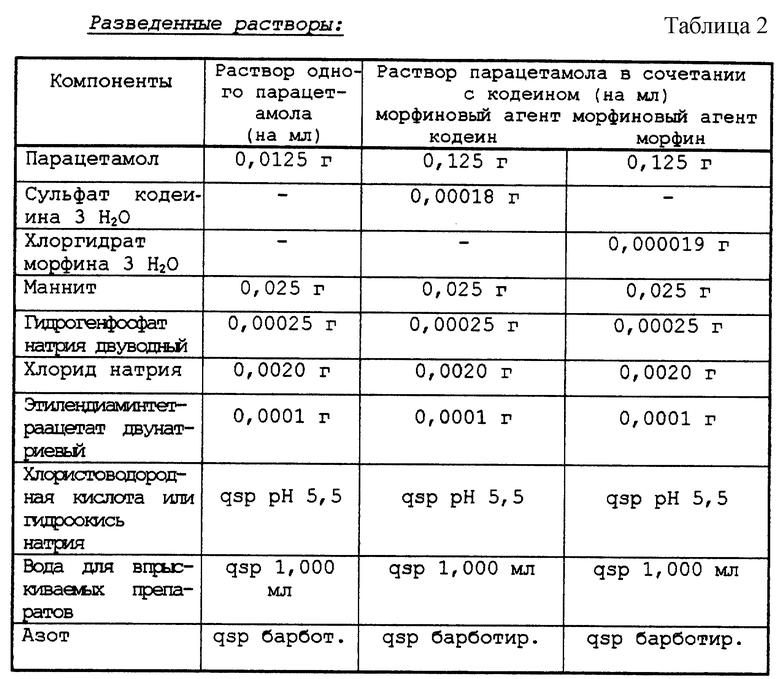
Этот раствор, куда входят 30% пропиленгликоля, 40% полиэтиленгликоля 400 и 30% воды (раствор 20), позволяет растворять приблизительно 200 мг/мл парацетамола при 20oС. Выбор концентрации 160 мг/мл позволяет избежать всякого риска рекристаллизации, в частности, при низкой температуре. В этих условиях объем 6,25 мл названного раствора заключает в себя 1000 мг парацетамола (см. табл. 2).
Композиции согласно изобретению находят свое применение в терапии как лекарство от боли. Для умеренных болей растворы содержат только парацетамол. Для более острых болей растворы содержат еще морфиновый анальгетик. К тому же растворы парацетамола обладают жаропонижающим свойством.
Следующие примеры иллюстрируют изобретение, не ограничивая его.
ПРИМЕР I. Определение оптимальной растворяющей смеси
1.1. - Концентрированные растворы
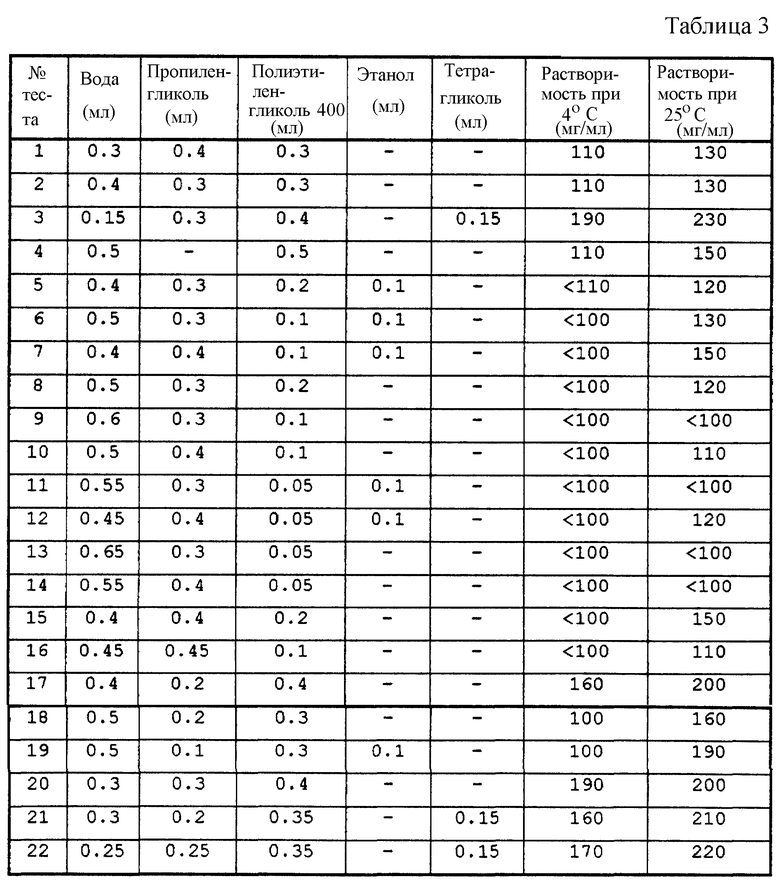
Возрастающие количества парацетамола были введены в смеси растворителей. Скорость растворения парацетамола увеличивалась с температурой, тесты на растворимость в этих разных средах были осуществлены с подогреванием смеси растворителей до 60oС. После полного растворения парацетамола растворы были помещены в среду с температурой 25oС и в среду с температурой 4oС на 72 ч.
Характеристики полученных растворов приведены в табл. 3.
Растворимость в смесях растворителей не всегда увеличивается с температурой. Добавление этанола не увеличивает растворимость.
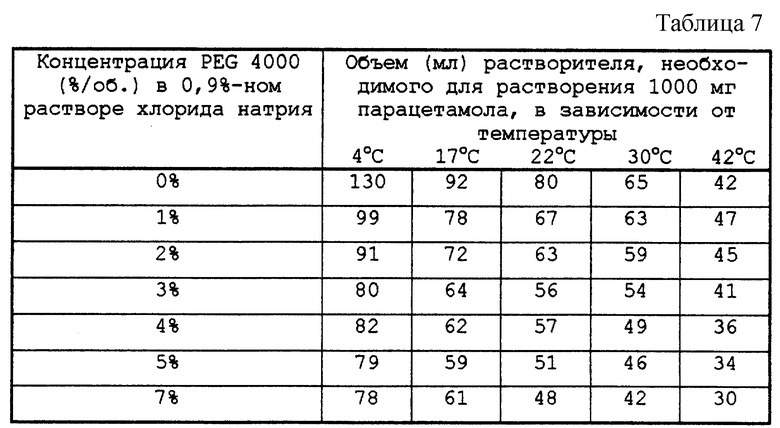
Кроме того, из-за явлений перенасыщения, которые появляются в таких растворах, особенно в средах, содержащих полиэтиленгликоль, наблюдается задержка кристаллизации после охлаждения. В этих условиях эти растворы содержались в течение 14 дней при температуре 20oС, затем в растворы, не имеющие кристаллов после этого периода, добавили кристалл парацетамола, чтобы вызвать кристаллизацию растворов с возможным перенасыщением. В конечном итоге раствор 20 или раствор 3 имели наиболее высокую растворимость парацетамола, равную 160 -170 мг/мл в зависимости от температуры.
1.2. - Разведенные растворы
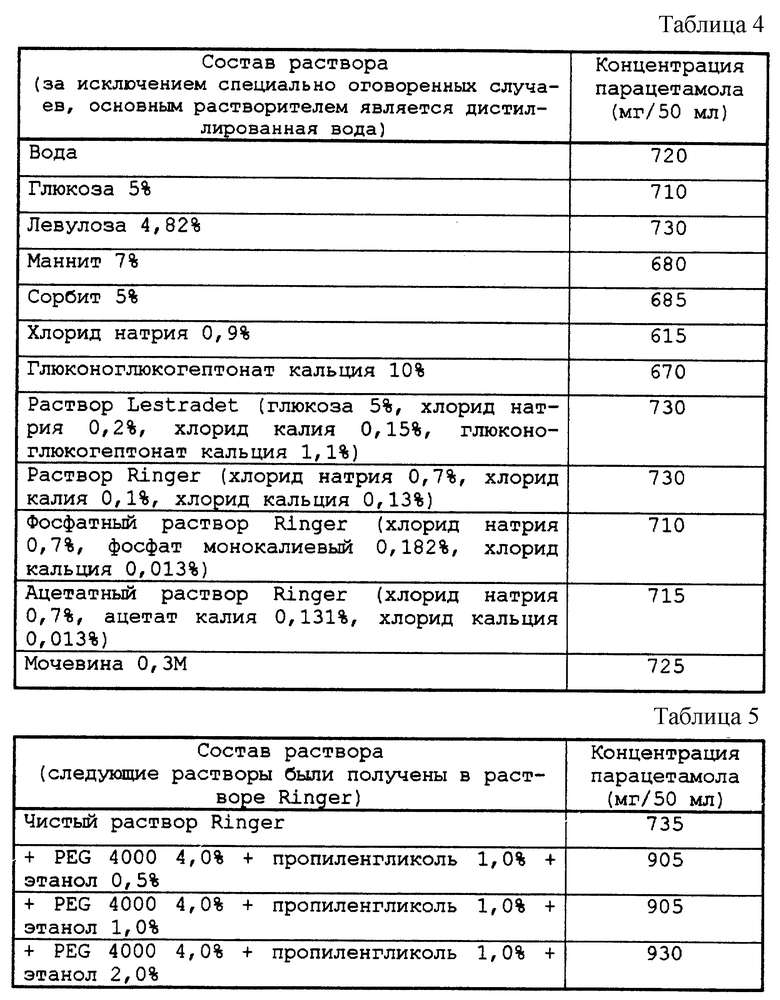
Количества парацетамола, намного превышающие предел растворимости, были введены в смеси растворителей, имеющих температуру 30oС. После перемешивания и охлаждения до 20oС растворы были профильтрованы. Содержание в этих растворах парацетамола определяли по поглощению раствора, отфильтрованного и разведенного 1/200, при 240 нм.
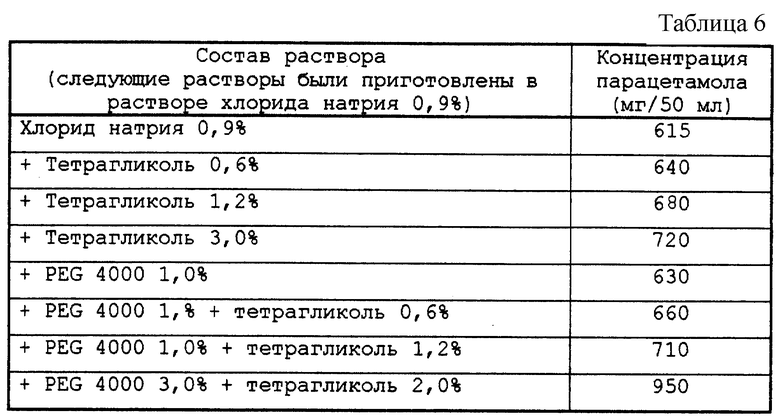
Результаты приведены ниже в табл. 4-6.
Присутствие PEG (полиэтиленгликоля) увеличивает растворимость парацетамола.
Определяли растворимость парацетамола в смесях PEG 4000 и в 0,9%-ом растворе хлорида натрия в дистиллированной воде при концентрациях, изменяющихся от 0 до 7% в зависимости от температуры.
Результаты приведены в табл. 7.
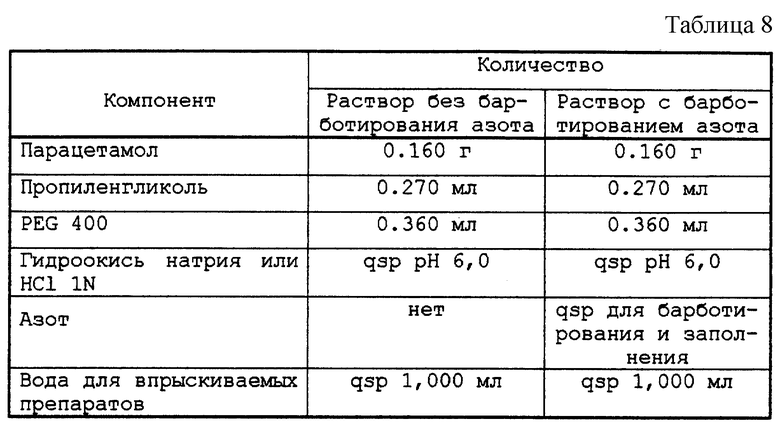
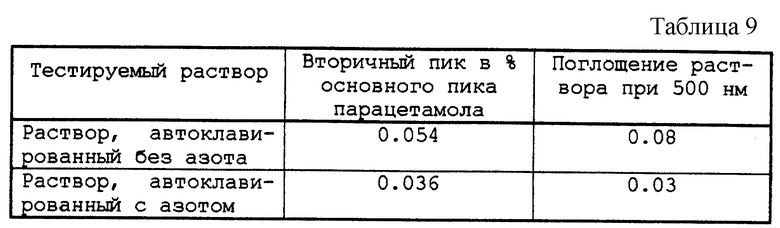
Раствор 20, содержащий парацетамол в количестве 160 мг/мл, с pH 6,0, установленным с помощью натрия или хлористоводородной кислоты 1N, претерпевает или не претерпевает барботирование азота ( см. табл. 8). Флаконы, заполненные в атмосфере азота или в атмосфере воздуха, по 10 мл этих растворов, тщательно закрытые пробками и оправленные, были стерилизованы в автоклаве при 121oС в течение 20 мин. Затем методом жидкостной хроматографии определяли процентное содержание вторичных пиков по отношению к основному пику парацетамола, а также интенсивность розовой окраски по поглощению раствора, определяемому методом абсорбционной спектрофотометрии при максимальной длине волны абсорбции 500 нм.
Таким образом, азот существенно влияет на окраску раствора.
Для проверки того, что 0%-ый и 1%-ый растворы парацетамола с полиэтиленгликолем остаются прозрачными на холоде, были приготовлены растворы, представленные в табл. 10.
После содержания этих растворов при 4oС в течение 10 дней ни в одном из флаконов, проходящих тест, не происходила кристаллизация. Присутствие PEG не является, следовательно, необходимым для поддержания прозрачности раствора в изучаемый промежуток времени.
ПРИМЕР II. Исследования по определению природы разрушения парацетамола в растворе.
2.1. Выявление нестабильности парацетамола в растворе
Раствор парацетамола в воде или в растворе 20 быстро окрашивается в розовый цвет при его помещении на свет и при повышенной температуре. При 50oС этот цвет появляется через 2 недели. Такая окраска сопровождается увеличением поглощения раствора при максимуме 500 нм. Согласно статье Fairbrother, указанной выше, помещение парацетамола во влажную среду может привести к гидролизу до парааминофенола, за которым следует окисление с появлением розового цвета, что характерно для образования хинонимина.
2.2. Природа продуктов разложения парацетамола
В водных растворах или частично водных в процессе консервации не обнаруживают парааминофенола. Соединения с розоватой окраской образуются быстро, причем скорость реакции зависит от температуры и от освещенности. Со временем интенсивность окрашивания этих производных увеличивается и развивается до коричневого цвета. Все происходит таким образом, как если бы, в противоположность описанному в литературе, разложение парацетамола проходило сначала окислительную стадию, а затем стадию гидролиза. Согласно этой гипотезе парацетамол мог бы реагировать на окислитель, содержащийся в растворе, например, кислород, растворенный в водной фазе. Это привело бы к образованию свободных радикалов, вызывающих взаимодействие молекул, отвечающих за образование цветных производных, цвет которых развивается от розового до коричневого.
2.3. Исследования по торможению образования соединений, содержащих свободные радикалы.
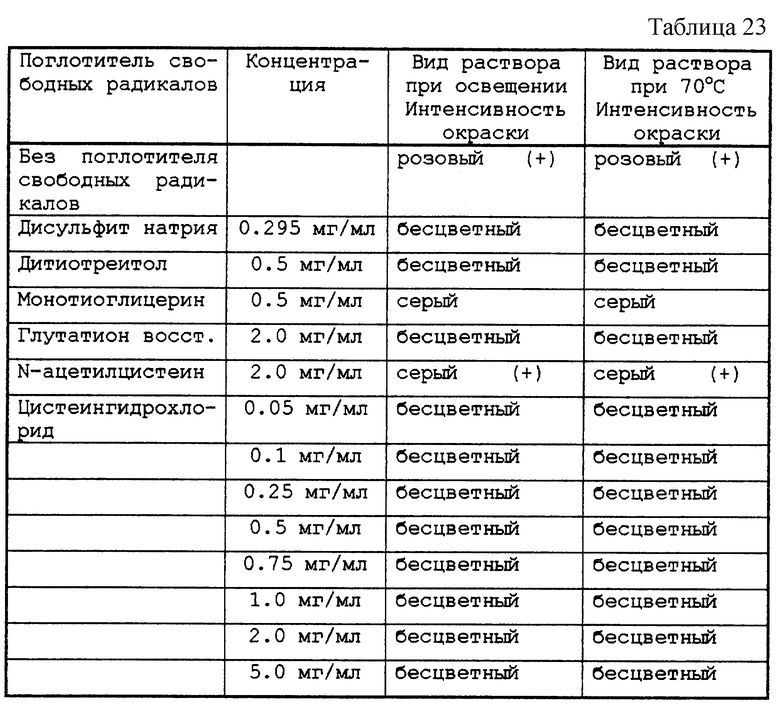
Типичная реакция, запускающая образование свободных радикалов, происходит при присоединении 30%-ного водного раствора перекиси водорода и 62,5 мг/мл сульфата пентагидрата меди к 1,25%-ному водному раствору парацетамола. Через несколько минут начинает развиваться цветная реакция, эволюционирующая от желтого цвета к коричневому и темно-коричневому. Интенсивность полученного окрашивания уменьшается, если предварительно к раствору парацетамола добавляют поглотители свободных радикалов или глицерин. Интенсивность окрашивания зависит от природы поглотителя свободных радикалов в порядке убывания интенсивности:
один парацетамол > парацетамол+N-ацетилцистеин > парацетамол+цистеин > парацетамол+сорбит > парацетамол+маннит > парацетамол+глицерин.
ПРИМЕР III. Стабилизация парацетамола в растворе с оптимально подобранным значением рН.
3.1. - Концентрированный раствор
Тестируемый раствор представлен в табл. 11.
В растворе 20, содержащем парацетамол в количестве 160 мг/мл, устанавливали разные значения рН: от рН мнимого до рН реального после разбавления 1/5 (даны в скобках) - 7,0 (5,8)-8,0 (6,7)-8,5 (7,1)-9,0 (7,5)-9,5 (8,0)-10,0 (8,5) - раствором 1N гидроокиси натрия или 1N хлористоводородной кислоты. Флаконы заполняли по 10 мл этих растворов в атмосфере азота, тщательно закрывали и оправляли, затем стерилизовали в автоклаве при 121oС в течение 20 мин, а потом помещали либо на 72 ч в темноте при 105oС, либо на 264 ч при актиничном освещении при 5000К и при температуре 25oС.
Результаты.
После автоклавирования только раствор, имеющий рН 10, приобретал розовую окраску. После консервации при 105oС в течение 72 ч поглощение при 500 нм, а также содержание продуктов разложения парацетамола являются минимальными в диапазоне рН от 7,5 до 9,5. После консервации при освещении интенсивность окрашивания растет с увеличением рН. Она минимальна при рН 7,0 (реальный 5,8). Ни содержание парацетамола, ни содержание продуктов разложения не зависят от рН.
3.2. - Разбавленный раствор
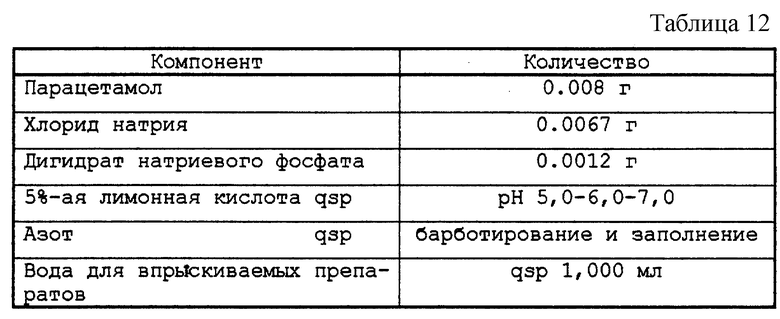
Тестируемый раствор представлен в табл. 12.
В водном растворе, разбавленном и забуференном, содержащем парацетамол в количестве 8 мг/мл, с помощью раствора лимонной кислоты устанавливали разные значения рН: рН 5,0-6,0-7,0.
Флаконы заполняли по 10 мл этих растворов в атмосфере азота, тщательно закрывали пробками и оправляли. Затем их стерилизовали или не стерилизовали в автоклаве при 121oС в течение 20 мин, потом обязательно помещали в темное место при 70oС на 231 ч.
Результаты.
После автоклавирования только раствор, имевший рН 7,0, приобретал розовую окраску. После консервации тот же раствор имел более интенсивный розовый цвет. При рН 6,0 и 5,0 растворы были окрашены слабо.
ПРИМЕР IV. Стабилизация парацетамола в растворе путем удаления кислорода барботированием азота.
4.2. - Разбавленный раствор
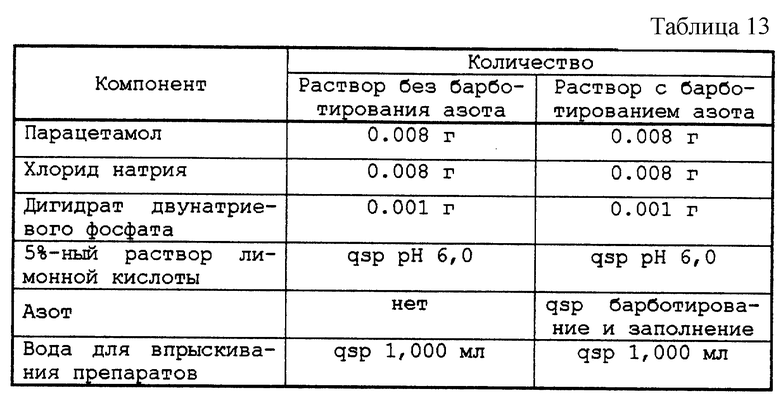
Тестируемый раствор представлен в табл. 13.
Разбавленный водный раствор, содержащий парацетамол, в котором pH 6,0 установлен с помощью раствора лимонной кислоты.
Флаконы, заполненные в атмосфере азота этими растворами в количестве 10 мл, тщательно закрытые пробками и оправленные, содержали в сушильной камере при температуре 98oС в течение 15 ч. Затем измеряли с помощью жидкостной хроматографии процентное отношение вторичных пиков (верхняя точка) парацетамола к основному пику парацетамола, а также интенсивность розовой окраски методом абсорбционной спектрофотометрии путем измерения поглощения раствора при максимальной длине волны 500 нм.
Результаты представлены в табл. 14.
Розовая окраска раствора, кондиционированного в атмосфере азота, значительно слабее, чем окраска, полученная после стерилизации в атмосфере азота раствора, кондиционированного без азота.
ПРИМЕР V. Стабилизация растворов парацетамола путем добавления антирадикальных агентов
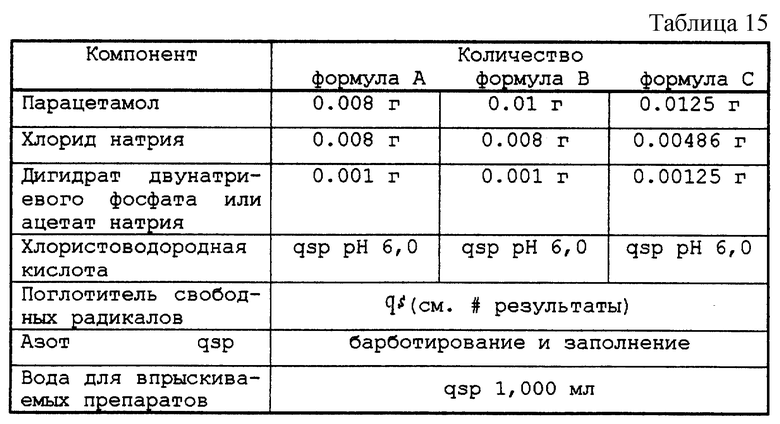
5.1. - Концентрированный раствор
Тестируемый раствор представлен в табл. 15.
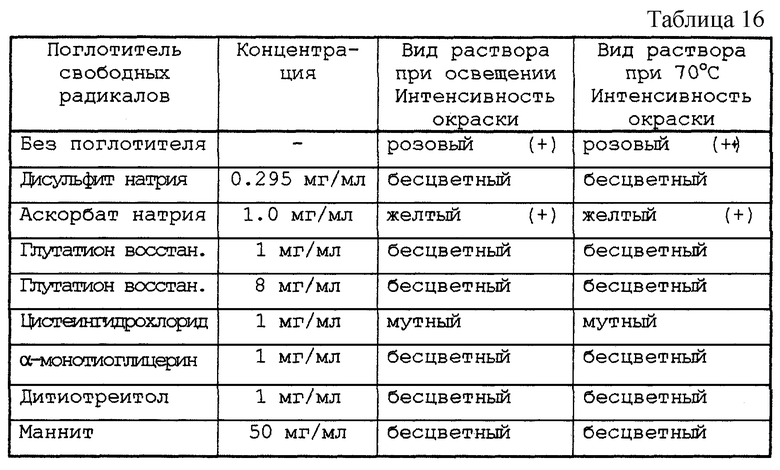
Растворы, приготовленные таким образом, распределяли по флаконам, 10 мл в каждый, закрывали с помощью пробки из бромбутила и закатывали алюминиевой капсулой. После автоклавирования при 121oС в течение 20 мин, флаконы выдерживали в течение 48 ч либо при актиничном освещении 5500К при комнатной температуре, либо при 70oС в темноте. Изучали возможное появление окраски препаратов.
Результаты представлены в табл. 16.
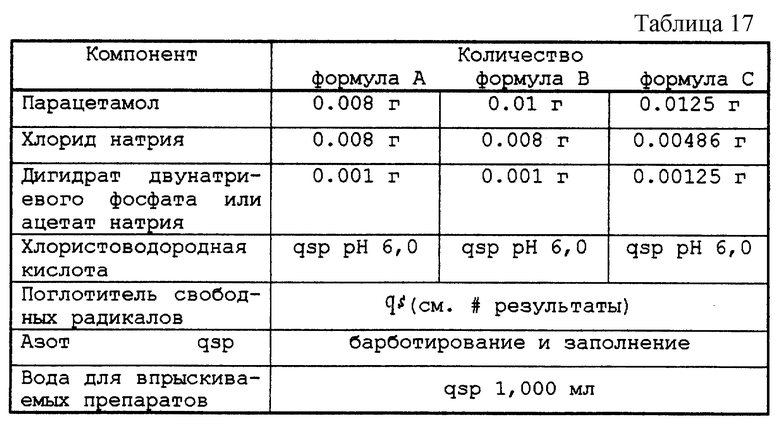
5.2. - Разбавленный раствор
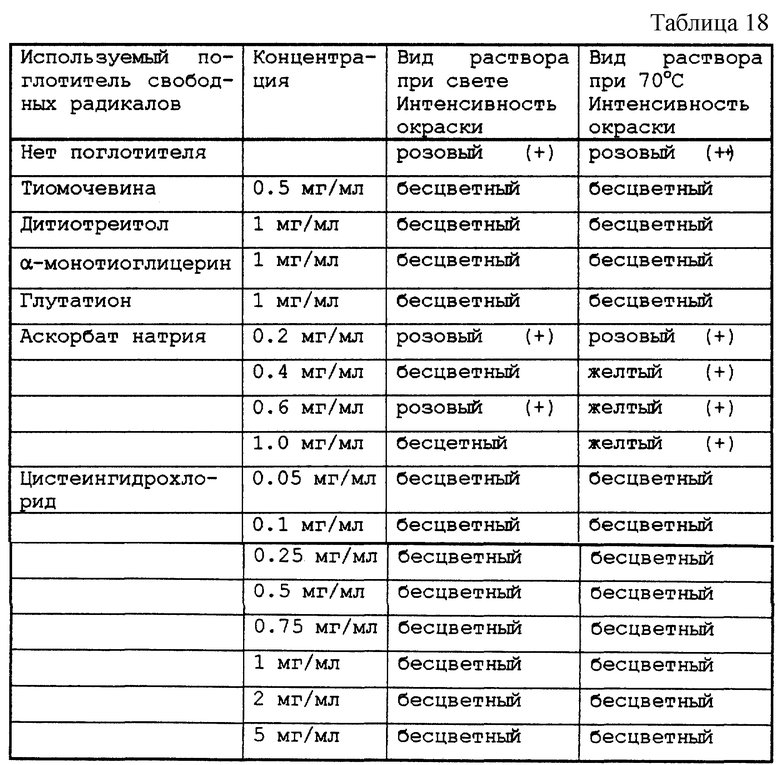
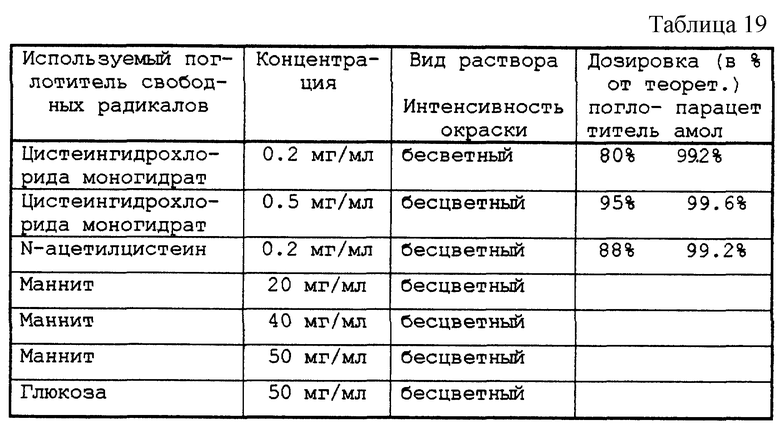
Тестируемые растворы представлены в табл. 17.
Полученные растворы распределяли по флаконам объемом в 10 мл, 100 мл или 80 мл, закрывали пробками из бромбутила и закатывали алюминиевой капсулой. Затем проверяли возможное окрашивание препарата в розовый цвет.
После автоклавирования при 121oС в течение 20 мин флаконы выдерживали в течение 48 ч либо при актиничном освещении 5500К при комнатной температуре, либо при 70oС в темноте (формула А).
После автоклавирования при 124oС в течение 7 мин флаконы выдерживали в течение 48 ч при комнатной температуре в темноте (формулы В и С). Проверяли возможное возникновение розовой окраски препарата и дозировали парацетамол, а также поглотитель свободных радикалов, когда таковым являлось тиоловое производное.
Результаты приведены в табл. 18-19.
VI. Стабилизация растворов парацетамола, содержащих морфиновое производное, путем добавления поглотителя свободных радикалов
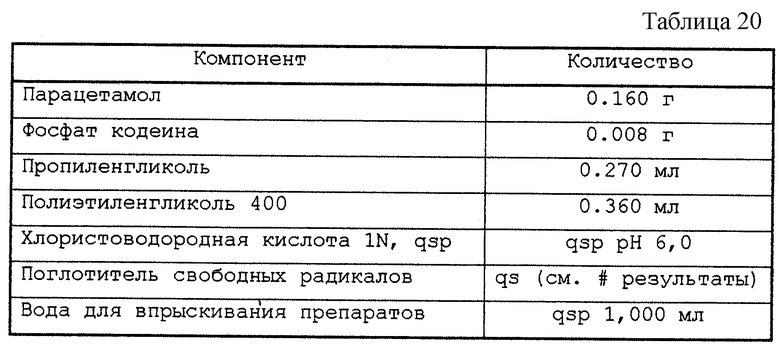
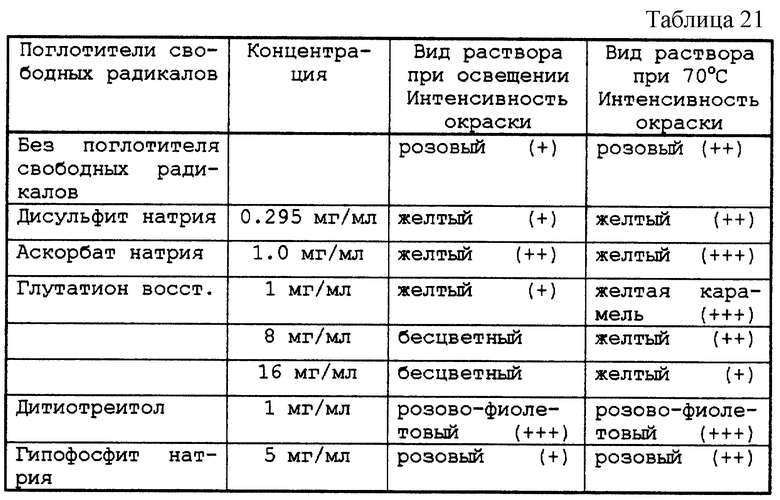
6.1. - Концентрированный раствор
Тестируемые растворы представлены в табл. 20.
Приготовленные таким образом растворы разливали во флаконы емкостью 10 мл, закрывали пробками из бромбутила и закатывали алюминиевой капсулой. После автоклавирования при 121oС в течение 20 мин флаконы выдерживали в течение 48 ч либо при актиничном освещении 5500К при комнатной температуре, либо при 70oС в темноте. Затем контролировали возможное возникновение окраски препарата.
Результаты приведены в табл. 21.
6.2. - Разбавленный раствор
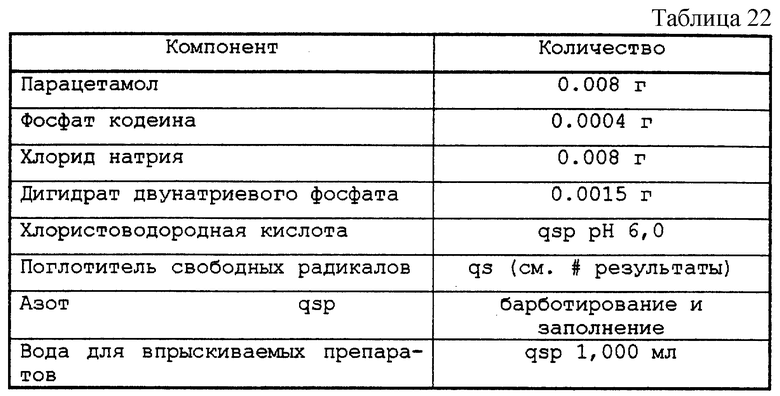
Тестируемые растворы представлены в табл. 22.
Полученные растворы заливали во флаконы емкостью 10 мл, закрывали пробками из бромбутила и закатывали алюминиевой капсулой. После автоклавирования при 121oС в течение 20 мин флаконы выдерживали в течение 48 ч либо при актиничном освещении в 5500К при комнатной температуре, либо при 70oС в темноте. Затем контролировали возникновение окраски препарата.
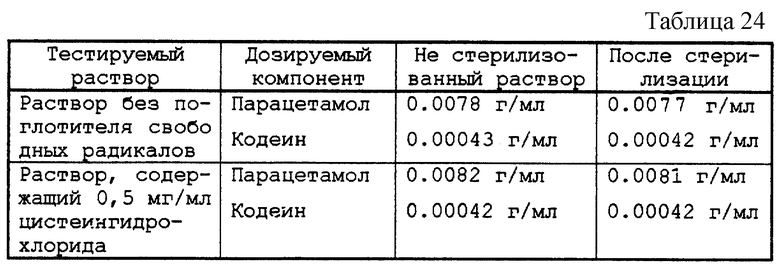
На растворе, не содержащем поглотитель свободных радикалов, и на растворе, содержащем 0,5 мг/мл цистеингидрохлорида в качестве агента, не образующего свободных радикалов, отрабатывали дозировку парацетамола и кодеина с помощью метода высокоэффективной жидкостной хроматографии непосредственно после автоклавирования путем сравнения с теми же растворами, но не автоклавированными.
Результаты по внешнему виду растворов приведены в табл. 23.
Результаты по дозировке парацетамола и кодеина представлены в табл. 24.
Таким образом добились, с одной стороны, отсутствия возникновения окраски и, с другой стороны, отличной сохранности активного начала после стерилизации в условиях нагрева.
ПРИМЕР VII. Биологическая устойчивость препарата.
7.1. Гематологическая устойчивость
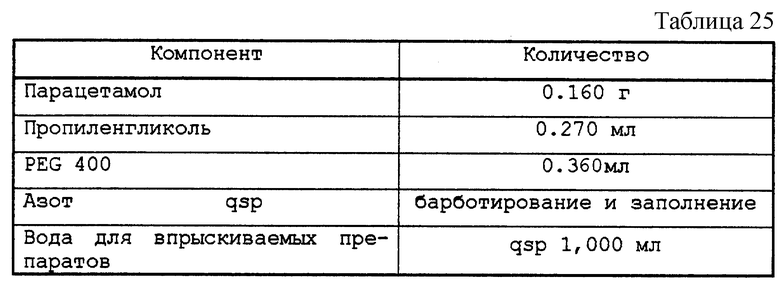
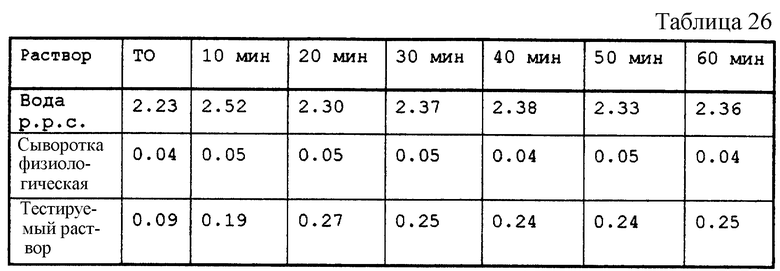
Тестируемый раствор представлен в табл. 25.
рН этого раствора не был выверен. рН мнимый - 7,6; реальный - 6,5.
Цельную кровь человека инкубировали с тестируемым раствором в равных объемах. Каждые 10 мин отбирали 2 мл смеси и центрифугировали 5 мин при 5000 об/мин. 100 мкл супернатанта разбавляли 1 мл дистиллированной воды. Поглощение этого раствора определяли против воды при 540 нм, максимальной длине волны поглощения гемоглобина.
Провели сравнительное изучение отрицательного контроля (физиологическая сыворотка крови) и положительного контроля (чистая вода для впрыскиваемых препаратов).
Результаты.
В табл. 26 приведены данные по поглощению различных растворов после разных времен инкубации.
Никакого эффекта гемолиза не было обнаружено.
7.2. Мышечная устойчивость
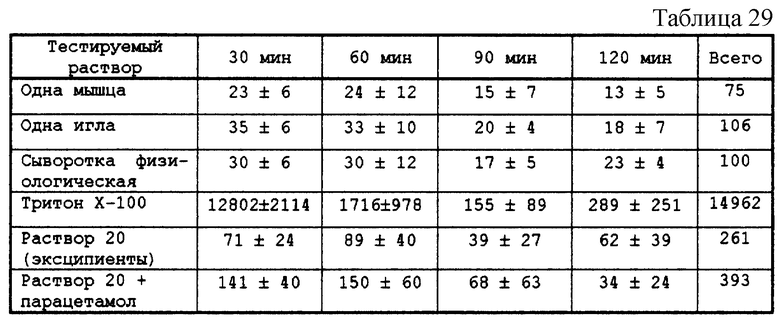
Тестируемый раствор представлен в табл. 27.
рН этого раствора не был выверен. рН мнимый - 7,6.
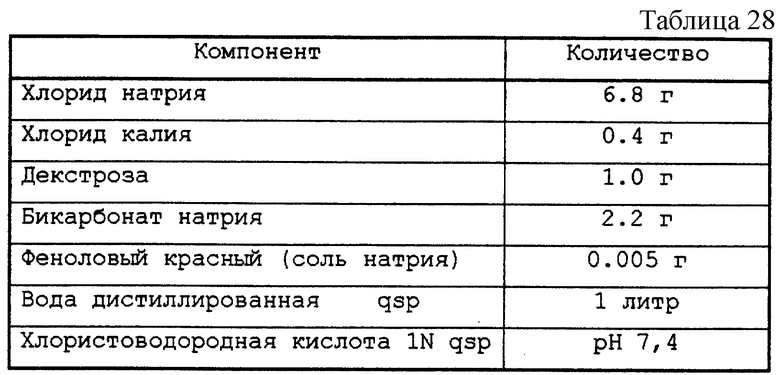
Крыс Spraque-Dawley с весом от 260 до 450 г анастезировали инъекцией этилкарбамида внутрибрюшинно (2 мл/кг 50%-ного водного раствора). Мышцу extensor dlqitorum longus брали с задней лапки, левой и правой, и помещали в буферный раствор состава, приведенного в табл. 28.
Мышцу предварительно закрепляли на планшете и поддерживали с помощью сухожилий. Изучаемый продукт впрыскивали в количестве 15 мкл с помощью шприца Hamilton 702 емкостью в 25 мкл. Мышцу затем помещали на решетку и погружали в буферный раствор, поддерживаемый при температуре 37oС при барботировании углекислым газом в течение всего периода инкубации. Каждые 30 мин мышцы вводили в пробирку, содержащую новый буферный раствор при 37oС. Операция повторялась 4 раза. Инкубируемый буферный раствор анализировался на предмет определения активности креатинкиназы.
Исследование проводилось путем сравнения с:
- интактной (не инъецированной) мышцей (белой)
- одной иглой (введение иглы без инъекции)
- сывороткой физиологической
- раствором Triton X-100 (положительная контрольная проба)
- раствором 20
- раствором 20+парацетамол 160 мг/мл.
Креатинкиназу дозировали на автомате Hitachi 704 с помощью КИТ-реактива Enzyline CK NAC, оптимизированного 10 (Biomerieux).
Результаты.
Активность креатинкиназы (UI/I) в разных растворах после разного времени инкубации показана в табл. 29.
Феномена некроза с композициями согласно изобретению констатировано не было, существенных различий с раствором-эксципиентом не обнаружено.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЖИДКАЯ КОМПОЗИЦИЯ ДЛЯ СТИРКИ ИЛИ ЧИСТЯЩЕЙ ОБРАБОТКИ ТВЕРДЫХ ПОВЕРХНОСТЕЙ, СОДЕРЖАЩАЯ МИКРОКАПСУЛЫ | 2009 |
|
RU2518117C2 |
| СТАБИЛЬНАЯ ГОТОВАЯ К ПРИМЕНЕНИЮ КОМПОЗИЦИЯ ПАРАЦЕТАМОЛА ДЛЯ ИНЪЕКЦИЙ | 2011 |
|
RU2519764C1 |
| КОМПОЗИЦИЯ АЦЕТАМИНОФЕНА | 2011 |
|
RU2583922C2 |
| КОМПОЗИЦИЯ ПОДСЛАСТИТЕЛЯ | 2005 |
|
RU2392834C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2007 |
|
RU2445077C2 |
| Соль гликопептидного антибиотика и фармацевтические композиции на ее основе | 2023 |
|
RU2827992C1 |
| ОФТАЛЬМОЛОГИЧЕСКИ ПРИЕМЛЕМАЯ КОМПОЗИЦИЯ ДЛЯ НЕЙТРАЛИЗАЦИИ ОСТАТОЧНОГО ПЕРОКСИДА, ОФТАЛЬМОЛОГИЧЕСКИ БЕЗОПАСНЫЙ СПОСОБ ИНДЕНТИФИКАЦИИ В РАСТВОРЕ ОТСУТСТВИЯ ПЕРОКСИДА И ОФТАЛЬМОЛОГИЧЕСКИ БЕЗОПАСНАЯ КОМПОЗИЦИЯ ДЛЯ КОНТАКТНЫХ ЛИНЗ | 1992 |
|
RU2114638C1 |
| СТАБИЛИЗИРОВАННЫЕ КОМПОЗИЦИИ ТЕХНЕЦИЯ-99m (Tc) | 2005 |
|
RU2403067C2 |
| ФАРМАЦЕВТИЧЕСКАЯ ПРЕПАРАТИВНАЯ ФОРМА | 2004 |
|
RU2362560C2 |
| ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ ОКСАЛИПЛАТИНА В ВИДЕ СТАБИЛЬНОГО ВОДНОГО РАСТВОРА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 1999 |
|
RU2207857C2 |





Изобретение относится к области медицины, в частности к галеновой фармации, и касается новых стабильных композиций на основе парацетамола, содержащих парацетамол в растворенном состоянии в водосодержащем растворителе, к которому добавляют буфер, имеющий рН 4-8, агент, поглощающий свободные радикалы, а также барботируют в водосодержащем растворителе инертный газ, не растворимый в воде, для удаления кислорода из среды. К препаратам могут также добавлять болеутоляющий агент центрального или периферического действия. Композиции в виде впрыскиваемых препаратов для лечения болей представляют собой стабильные водные жидкие растворы парацетамола. 22 з.п.ф-лы, 29 табл.
| US 5474757 А, 12.12.1995 | |||
| US 4314989 A, 09.02.1982 | |||
| МАШКОВСКИЙ М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, 1993, ч.1, с.203. |
Авторы
Даты
2002-11-10—Публикация
1997-08-05—Подача