Область изобретения
Настоящее изобретение относится к стабилизированным 99mTc радиофармацевтическим композициям 99mTc-тетрофосмина, которые включают радиозащитный агент, представляющий собой аскорбиновую кислоту или аскорбат, при отсутствии противомикробного консерванта. Также раскрыты лиофилизированные наборы, подходящие для массового изготовления многократных стандартных для пациента доз радиофармацевтической композиции 99mTc-тетрофосмина, вместе со способами изготовления таких стандартных доз из флакона с лиофилизированной партией.
Предшествующий уровень техники
Радиофармацевтические агенты для диагностической визуализации на основе радиоизотопа технеция-99m (99mTc) известны для ряда клинических диагностик, включая функциональные исследования (например, почек) и перфузию (в частности, сердца и головного мозга). Радиоизотоп 99mTc имеет период полураспада 6 часов, следовательно, такие радиофармацевтические препараты 99mTc обычно готовят из так называемых "наборов".
Эти наборы для приготовления радиофармацевтических препаратов 99mTc позволяют пользователю хранить исходные запасы нерадиоактивных лиофилизированных флаконов, содержащих необходимые реагенты, которые предназначены для восстановления 99mTc-пертехнетатом (TcO4 -) из запасов 99mTc с получением желаемого стерильного радиофармацевтического препарата 99mTc простым способом. Стерильный раствор 99mTc-пертехнетата в изотоническом солевом растворе получают путем элюции генератора технеция стерильным солевым раствором, как известно в данной области техники.
Наборы для приготовления радиофармацевтических препаратов 99mTc типично содержат:
(1) лиганд, который образует комплекс металла с 99mTc,
(2) биосовместимый восстанавливающий агент, способный к восстановлению пертехнетата, то есть Tc(VII), до более низкой степени окисления желаемого продукта, представляющего собой комплекс металла 99mTc.
Биосовместимый восстанавливающий агент для пертехнетата 99mTc типично представляет собой ион олова, то есть Sn(II). Набор может содержать дополнительные эксципиенты, такие как слабые хелатирующие агенты (такие, как глюконат, глюкогептонат, тартрат, фосфонат или этилендиаминтетрауксусная кислота (ЭДТА)); стабилизаторы; pH-регулирующие агенты; буферы; солюбилизаторы или наполнители (такие, как маннит, инозит или хлорид натрия), чтобы облегчить обращение с компонентами набора и их лиофилизацию. Для облегчения хранения и распределения нерадиоактивные наборы обычно поставляют в лиофилизированном виде в стерильном флаконе с крышкой. Лиофилизированный препарат также дает возможность быстрого восстановления конечными потребителями стерильным 99mTc-пертехнетатом в солевом растворе с получением желаемого стерильного инъекционного радиофармацевтического препарата 99mTc для применения человеком. Срок годности набора нерадиоактивного технеция может составлять несколько месяцев.
Радиофармацевтические композиции могут подвергаться радиолизу, в частности растворителя (типично воды), с последующим образованием высокореактивных свободных радикалов, которые могут разрушать один или более чем один компонент состава набора после восстановления. Известно применение радиозащитных агентов или поглотителей свободных радикалов, чтобы способствовать подавлению такого разрушения. Типично поглотители свободных радикалов берут из известных классов соединений-антиоксидантов. В US 4364920 раскрыто, что аскорбиновая кислота и аскорбаты функционируют в качестве стабилизаторов для оловосодержащих нерадиоактивных наборов для приготовления радиофармацевтических препаратов 99mTc, и впоследствии их стали широко применять в радиофармацевтических препаратах 99mTc. Стабилизаторы для радиофармацевтических препаратов 99mTc, представляющие собой гентизиновую кислоту, раскрыты в US 4233284. Пара-аминобензойная кислота (ПАБК) и родственные стабилизаторы для радиофармацевтических препаратов 99mTc раскрыты в US 4451451.
Набор Myoview™ представляет собой флакон на 10 мл, содержащий лиофилизированный препарат:
который запаян в атмосфере газообразного азота USP/NF в 10-мл стеклянный флакон, который после восстановления стерильным инъекционным пертехнетатом натрия (99mTc) согласно фармакопее США/Европейской фармакопее (USP/Ph.Eur.) дает раствор, содержащий радиофармацевтический 99mTc-тетрофосмин для визуализации сердца. Таким образом, набор Myoview™ не содержит радиозащитный агент.
Готовая к инъекции или "конъюгатная" форма Myoview™ имеется в продаже в Японии с 1997 года. Эта "конъюгатная" форма содержит предварительно образованный комплекс технеция 99mTc-тетрофосмин в водном растворе в шприце-флаконе, то есть во флаконе с отдельным поршнем и иглой, который сконструирован таким образом, чтобы его можно было легко собрать с получением шприца, содержащего радиофармацевтический препарат. "Конъюгатный" раствор Myoview™ содержит аскорбиновую кислоту в концентрации 1,36 мг/мл (7,7 ммоль).
Bastien et al. [Nucl. Med. Comm., 20, 480-Abstract 84 (1999)] сообщают, что порядок добавления солевого раствора и пертехнетата к набору Myoview™ может влиять на радиохимическую частоту (РХЧ) 99mTc-тетрофосмина. Murray et al. [Nucl. Med. Comm., 21. 845-849 (2000)] сообщают, что присутствие слишком большого количества газообразного азота в верхнем пространстве флакона Myoview™ во время восстановления может привести к варьирующим результатам РХЧ вследствие нежелательных радиохимических примесей. Murray et al. и инструкции на упаковке к набору Myoview™ предлагают, чтобы воздух осторожно втягивался во флакон во время восстановления во избежание этих проблем. Этого достигают путем оттягивания 2 мл газа из верхнего пространства, когда вентиляционная игла находится на месте, так чтобы 2 мл воздуха втягивалось во флакон. Считают, что причиной проблемы является восстановительный авторадиолиз и что введение кислорода ингибирует это разрушение.
Patel et al. [J. Nucl. Med. Technol., 26(4), 269-273 (1998)] сообщают о результатах исследования имеющегося в продаже Myoview™ во флаконах и делают вывод, что восстановление двойным количеством, соответствующим верхнему пределу радиоактивности по инструкции изготовителя (вплоть до 18 ГБк 99mTc), является успешным, но непонятно, какие ограничения были сделаны в отношении используемого элюата генератора 99mTc-пертехнетата. Указано, что такие более высокие уровни радиоактивности дают преимущества сниженного воздействия радиации для персонала (один препарат вместо множества препаратов) и сниженной вариабельности результатов QC. В действительности Murray et al. (цитирован выше) сообщают, что использование радиоактивных концентраций, которые превышают таковые по инструкциям на упаковке Myoview™, приводит к худшим результатам РХЧ.
В WO 02/053192 раскрыты стабилизированные радиофармацевтические композиции, которые содержат:
(1) комплекс металла 99mTc;
(2) радиозащитный агент, который включает аскорбиновую кислоту, пара-аминобензойную кислоту или гентизиновую кислоту, либо ее соль с биосовместимым катионом;
(3) один или более чем один противомикробный консервант формулы (I):
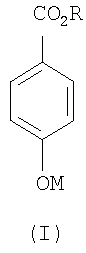
где R представляет собой С1-4алкил,
и М представляет собой Н или биосовместимый катион.
Примеры WO 02/053192 включают приготовление стабилизированных композиций комплекса 99mTc-тетрофосмин посредством добавления радиозащитного агента и растворов противомикробных консервантов к общепринятым наборам Myoview™. Конкретные примеры лиофилизированных наборов, содержащих как тетрофосмин, так и радиозащитный агент, не раскрыты в WO 02/053192.
Настоящее изобретение
Настоящее изобретение относится к наборам для приготовления стабилизированных радиофармацевтических композиций 99mTc-тетрофосмина, вместе со способом изготовления стандартных доз 99mTc-тетрофосмина.
Решение проблемы пролонгированной доступности после восстановления радиофармацевтического агента 99mTc означает, что при восстановлении исходный уровень радиоактивности 99mTc должен быть высоким. То есть, поскольку 6-часовой период полураспада 99mTc означает, что половина радиоактивности, которая будет использована для получения диагностического изображения, теряется за счет радиоактивного распада каждые 6 часов, и, следовательно, только 1/4 исходной радиоактивности будет сохраняться по истечении 12 часов. Такие высокие уровни радиоактивности для пролонгированных периодов ставят значительные проблемы потенциального радиолиза для радиофармацевтической композиции 99mTc.
Настоящее изобретение, таким образом, включает радиозащитный агент в композиции. Активный ингредиент 99mTc-тетрофосмин склонен к разрушению либо путем восстанавливающего действия восстановителя (присутствующего, чтобы способствовать эффективному мечению 99mTc), либо радиолиза. В результате использования стабилизированных композиций по настоящему изобретению возможно продлить полезный срок годности после радиоактивного мечения, даже при повышенных уровнях радиоактивности 99mTc.
Подробное описание изобретения
В первом аспекте в настоящем изобретении предложен лиофилизированный нерадиоактивный набор, который после восстановления раствором 99mTc-пертехнетата дает стабилизированную радиофармацевтическую композицию 99mTc-тетрофосмина, где указанный набор имеет состав, содержащий:
(1) тетрофосмин;
(2) радиозащитный агент, выбранный из аскорбиновой кислоты или ее соли с биосовместимым катионом;
(3) биосовместимый восстановитель;
(4) pH-регулирующий агент в количестве, эффективном для обеспечения того, что, когда набор восстанавливают солевым раствором, полученный в результате раствор имеет pH в интервале от 8,0 до 9,2;
при условии, что ни набор, ни радиофармацевтическая композиция 99mTc-тетрофосмина не содержат противомикробный консервант.
Под термином "тетрофосмин" подразумевают замещенный эфиром дифосфиновый хелатирующий агент 1,2-бис[бис(2-этоксиэтил)фосфино)]этан, показанный ниже:
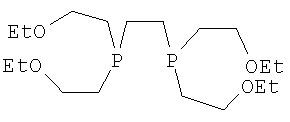
который используют в имеющемся в продаже наборе 99mTc для изготовления 99mTc-тетрофосмина, то есть 99mTc(O)2(тетрофосмин)2 +, названный Myoview™.
Под термином "радиозащитный агент" подразумевают соединение, которое ингибирует реакции разложения, такие как окислительно-восстановительные процессы, путем улавливания высокореактивных свободных радикалов, таких как кислородсодержащие свободные радикалы, образующиеся в результате радиолиза воды. Радиозащитные агенты по настоящему изобретению подходящим образом выбраны из аскорбиновой кислоты и ее солей с биосовместимым катионом.
Под термином "биосовместимый катион" подразумевают положительно заряженный противоион, который образует соль с ионизированной, отрицательно заряженной анионной группой, где указанный положительно заряженный противоион является также нетоксичным в необходимой дозировке и, следовательно, подходящим для введения в организм млекопитающего, особенно организм человека. Примеры подходящих биосовместимых катионов включают: щелочные металлы - натрий или калий; щелочноземельные - металлы кальций и магний; а также ион аммония. Предпочтительными биосовместимыми катионами являются натрий и калий, наиболее предпочтительно натрий.
Под термином "биосовместимый восстановитель" подразумевают восстанавливающий агент, подходящий для восстановления пертехнетата Tc(VII) до более низких степеней окисления технеция, который является нетоксичным в необходимой дозировке и, следовательно, подходящим для введения в организм млекопитающего, особенно организм человека. Такие подходящие восстановители включают: дитионит натрия, бисульфит натрия, аскорбиновую кислоту, формамидинсульфиновую кислоту, ион олова, Fe(II) или Cu(I). Биосовместимый восстановитель предпочтительно представляет собой соль олова, такую как хлорид олова или тартрат олова.
Термин "лиофилизированный" имеет общепринятое значение, то есть композицию, высушенную сублимацией, предпочтительно изготовленную в стерильных условиях.
Под термином "противомикробный консервант" подразумевают агент, который ингибирует рост потенциально вредных микроорганизмов, таких как бактерии, дрожжи или плесени. Противомикробный консервант может также проявлять некоторые бактерицидные свойства в зависимости от дозы. Противомикробный(е) консервант(ы) типично используют для ингибирования роста микроорганизмов в радиофармацевтической композиции после восстановления, то есть в самом радиоактивном диагностическом продукте. Противомикробные консерванты, однако, также иногда используют для ингибирования роста потенциально вредных микроорганизмов в одном или более чем одном компоненте таких нерадиоактивных наборов до восстановления. Противомикробный(е) консервант(ы) включает(ют): парабены, то есть метил-, этил-, пропил- или бутилпарабен или их смеси; бензиловый спирт; фенол; крезол; цетримид и тиомерсал. Некоторые такие противомикробные консерванты являются слишком летучими, чтобы выдержать лиофилизацию (например, бензиловый спирт или фенол), или обладают слишком низкой растворимостью в воде. Это делает их включение в лиофилизированный набор, предназначенный для восстановления водным растворителем для получения радиофармацевтического раствора, проблематичным. Некоторые такие противомикробные консерванты могут также образовывать комплексы металла с 99mTc и могут, следовательно, оказывать неблагоприятное воздействие на радиохимическую чистоту (РХЧ) и, следовательно, биораспределение 99mTc-тетрофосмина. Присутствие противомикробного консерванта в препарате также повышает риск проблем химической несовместимости при хранении набора, например, вследствие отщепления атома кислорода или серы фосфинами тетрофосмина.
Такие наборы предназначены для получения стерильных радиофармацевтических продуктов, подходящих для введения человеку, например, посредством прямой инъекции в кровоток. Лиофилизированный набор предназначен для восстановления стерильным раствором 99mTc-пертехнетата (TcO4 -) из радиоизотопного генератора 99mTc с получением раствора, подходящего для введения человеку без дополнительных манипуляций. В раствор 99mTc-пертехнетата добавлен биосовместимый носитель. "Биосовместимый носитель" представляет собой жидкость, в частности жидкость, в которой радиофармацевтический препарат суспендирован или растворен, так чтобы композиция была физиологически переносимой, то есть ее можно было вводить в организм млекопитающего без проявления токсичности или нежелательного дискомфорта. Биосовместимый носитель подходящим образом представляет собой инъекционную жидкость-носитель, такую как стерильная апирогенная вода для инъекций; водный раствор, такой как солевой раствор (который может быть предпочтительно сбалансирован так, чтобы конечный продукт для инъекции был либо изотоническим, либо не гипотоническим); водный раствор одного или более чем одного вещества, регулирующего тоничность (например, солей катионов плазмы с биосовместимыми противоионами), сахара (например, глюкоза или сахароза), сахарные спирты (например, сорбит или маннит), гликоли (например, глицерин) или другие неионные полиоловые вещества (например, полиэтиленгликоли, пропиленгликоли и тому подобное). Биосовместимый носитель может также включать биосовместимые органические растворители, такие как этанол. Такие органические растворители полезны для солюбилизации более лиофильных соединений или препаратов. Предпочтительно биосовместимый носитель представляет собой апирогенную воду для инъекций, изотонический солевой раствор или водный раствор этанола. Как указано выше, pH биосовместимого носителя для внутривенной инъекции подходящим образом находится в интервале от 4,0 до 10,5. Биосовместимый носитель предпочтительно содержит водный растворитель и наиболее предпочтительно содержит изотонический солевой раствор. Биосовместимый носитель по настоящему изобретению используют в отсутствие противомикробного консерванта.
Наборы по настоящему изобретению содержат подходящий контейнер, содержащий композицию по первому воплощению. Тетрофосмин может находиться либо в форме свободного основания, либо в форме кислой соли, либо может представлять собой комплекс тетрофосмина с нерадиоактивным металлом, который после добавления технеция претерпевает переметаллирование (то есть, обмен металла) с получением желаемого продукта. Предпочтительно тетрофосмин находится в форме свободного основания. Подходящими контейнерами являются те, которые герметично закрыты и, следовательно, дают возможность сохранения стерильной целостности и/или радиоактивной безопасности, плюс, возможно, инертный газ верхнего пространства (например, азот или аргон), также позволяя в то же время добавлять и извлекать растворы шприцом. Предпочтительно такой контейнер представляет собой флакон с герметичной мембранной крышкой, где газонепроницаемая крышка герметично навинчивается на нее сверху (типично из алюминия). Такие контейнеры обладают дополнительным преимуществом в том, что эта крышка может выдерживать вакуум, если желательно, например, для смены газа верхнего пространства или дегазации растворов.
Нерадиоактивные наборы могут, возможно, дополнительно содержать дополнительные компоненты, такие как трансхелатирующий агент, pH-регулирующий агент или наполнитель. "Трансхелатирующий агент" представляет собой соединение, которое быстро взаимодействует с образованием слабого комплекса с технецием, а затем вытесняется лигандом. Это минимизирует риск образования восстановленного гидролизованного технеция (RHT) вследствие быстрого восстановления пертехнетата, конкурирующего с комплексообразованием технеция. Такими подходящими трансхелатирующими агентами являются соли органических кислот с биосовместимым катионом, в частности "слабых органических кислот", имеющих рКа в интервале от 3 до 7. Такими подходящими слабыми органическими кислотами являются уксусная кислота, лимонная кислота, винная кислота, глюконовая кислота, глюкогептоновая кислота, бензойная кислота, фенолы или фосфоновые кислоты. Следовательно, подходящими солями являются ацетаты, цитраты, тартраты, глюконаты, глюкогептонаты, бензоаты, феноляты или фосфонаты. Предпочтительно такими солями являются тартраты, глюконаты, глюкогептонаты, бензоаты или фосфонаты, наиболее предпочтительно фосфонаты, особенно дифосфонаты. Предпочтительно такой трансхелатирующий агент представляет собой соль глюконовой кислоты с биосовместимым катионом, в частности глюконат натрия. Дополнительным предпочтительным трансхелатирующим агентом является 5-сульфосалициловая кислота или ее соль с биосовместимым катионом. Два или более чем два трансхелатирующих агента могут быть использованы в комбинации, и тетрофосминовые наборы по настоящему изобретению наиболее предпочтительно содержат комбинацию 5-сульфосалицилата натрия и глюконата натрия.
Термин "pH-регулирующий агент" означает соединение или смесь соединений, полезных для обеспечения того, что pH восстановленного набора находится в приемлемых пределах (примерно pH от 4,0 до 10,5) для введения человеку или млекопитающему. Такие подходящие pH-регулирующие агенты включают фармацевтически приемлемые буферы, такие как трицин, фосфат или Трис [то есть трис(гидроксиметил)аминометан], и фармацевтически приемлемые основания, такие как карбонат натрия, бикарбонат натрия или их смеси. Предпочтительным pH-регулирующим агентом для тетрофосминовых наборов по настоящему изобретению является бикарбонат натрия.
Под термином "наполнитель" подразумевают фармацевтически приемлемый наполнитель, который может облегчать обращение с материалом во время его изготовления и лиофилизации. Подходящие наполнители включают неорганические соли, такие как хлорид натрия, и водорастворимые сахара или сахарные спирты, такие как сахароза, мальтоза, маннит или трегалоза. Некоторые pH-регулирующие агенты могут также действовать в качестве наполнителей. Предпочтительно таким наполнителем двойной функции является бикарбонат натрия. Предпочтительные наборы по настоящему изобретению содержат наполнитель для облегчения лиофилизации. Предпочтительно таким наполнителем для тетрофосминовых наборов по настоящему изобретению является наполнитель двойной функции бикарбонат натрия.
Обнаружено, что включение радиозащитного агента в наборы по настоящему изобретению дает преимущество в том, что получают комплекс 99mTc-тетрофосмин с хорошей РХЧ и хорошей стабильностью после восстановления в течение вплоть до 12 часов после приготовления препарата без необходимости в стадии добавления воздуха, указываемой как предшествующим уровнем техники, так и инструкциями на упаковке Myoview™. Это является полезным упрощением, поскольку удаляет стадию процесса, что означает процесс на одну манипуляцию меньше и, следовательно, приводит в результате к сниженной дозе радиации для оператора, а также быстрее и проще для осуществления. Стадия добавления воздуха также является некоторым образом необычной в радиофармацевтической практике и, следовательно, существует риск, что она может быть случайно пропущена с последующим неблагоприятным воздействием на РХЧ.
Концентрация радиозащитного агента для использования в наборах по настоящему изобретению подходящим образом является от 0,0003 до 0,7 молярной, предпочтительно от 0,001 до 0,07 молярной, наиболее предпочтительно от 0,0025 до 0,01 молярной. Для аскорбиновой кислоты это соответствует подходящей концентрации от 0,05 до 100 мг/см3, предпочтительно от 0,2 до 10 мг/см3, наиболее предпочтительно от 0,4 до 1,5 мг/см3.
Когда радиофармацевтический препарат 99mTc-тетрофосмина по данному изобретению вводят человеку, подходящее количество радиоактивности, которое следует использовать, находится в интервале от 185 до 1221 МБк (5-33 мКи). Для визуализации сердца, когда инъекции покоя и нагрузки вводят на одни и те же сутки, первая доза должна составлять 185-444 МБк (5-12 мКи) с последующей второй дозой 555-1221 МБк (15-33 мКи), даваемой примерно спустя 1-4 часа. Следовательно, исходная активность 99mTc в стабилизированных радиофармацевтических композициях 99mTc по настоящему изобретению находится в интервале от 0,2 до 100 ГБк, что дает возможность многократного дозирования из одного и того же препарата даже после предоставления возможности для радиоактивного распада 99mTc.
Препарат лиофилизированного набора по настоящему изобретению предпочтительно готовят таким образом, чтобы pH раствора после восстановления водой или солевым раствором составлял от 8,0 до 9,2, наиболее предпочтительно от 8,0 до 8,6. Это означает, что когда радиозащитный агент представляет собой аскорбиновую кислоту, то есть кислоту, количество pH-регулирующего агента необходимо регулировать. Это необходимо для гарантии того, чтобы сохранялся оптимум pH набора для: радиоактивного мечения 99mTc тетрофосмина; стабильности после восстановления и пригодности для введения пациенту. Предпочтительно такой препарат набора для предоставления в 30-мл флаконе приведен в Примере 2, который показывает, что количество бикарбоната натрия необходимо значительно повысить по сравнению с общепринятым препаратом Myoview™ в 10-мл флаконе. Авторы настоящего изобретения обнаружили, что для набора в 30-мл флаконе повышение количества аскорбиновой кислоты до 5,5 мг/флакон или снижение количества бикарбоната натрия до 10 мг/флакон приводит в результате к лиофилизированным комкам с неприемлемым внешним видом. Это считают следствием низкой температуры стеклования аскорбиновой кислоты (-54°С), которая возможно снижает температуру стеклования препарата. Следовательно, существует верхний предел количества аскорбиновой кислоты, которое можно добавить, если необходимо изготовить приемлемый лиофилизированный набор. Обнаружено, что необходимы значительно более высокие уровни бикарбоната натрия для аккомодации аскорбиновой кислоты и, кроме того, они дают приемлемую застывшую лиофилизированную массу.
Радиозащитные агенты по настоящему изобретению имеются в продаже от ряда поставщиков. Тетрофосмин может быть получен, как описано Chen et al. [Zhong. Heyix. Zazhi, 17(1) 13-15 (1997)] или Reid et al. [Synth. Appl. Isotop. Lab. Comp., Vol 7, 252-255 (2000)]. Обычный синтез включает сначала получение 1,2-бис(фосфино)этана или Н2РСН2СН2РН2, а затем свободно-радикальное присоединение избытка этилвинилового эфира с использованием свободно-радикального инициатора, как описано в Примере 1.
Во втором аспекте в настоящем изобретении предложен многодозовый набор, который содержит лиофилизированный препарат по первому воплощению в герметично закрытом стерильном контейнере, снабженном крышкой, которая дает возможность добавления и извлечения растворов, сохраняя в то же время стерильную целостность; где этот набор изготовлен таким образом, чтобы можно было получить от 4 до 30 стандартных для пациента доз радиофармацевтического препарата 99mTc-тетрофосмина из одного набора.
Многодозовый набор должен быть достаточно устойчивым, чтобы выдерживать значительно более высокие уровни радиоактивности, а также большие объемы раствора, чем общепринятый набор Myoview™. Контейнеры для многодозового флакона подходящим образом имеют объем от 20 до 50 см3, предпочтительно от 20 до 40 см3, наиболее предпочтительно объем 30 см3. Контейнер снабжен газонепроницаемым уплотнителем, который подходит для многократного прокалывания подкожной иглой (например, навинчиваемой мембранной герметичной крышкой).
Многодозовый набор содержит достаточно материала для многократных доз для пациента (например, вплоть до 100 ГБк 99mTc на флакон), посредством чего стандартные для пациента дозы можно, таким образом, извлекать шприцом клинического качества через различные интервалы времени в течение жизнеспособного срока годности стабилизированного препарата для соответствия клинической ситуации. Стандартная доза радиофармацевтического препарата 99mTc-тетрофосмина может быть альтернативно представлена в герметичном контейнере, как описано выше. Термин "стандартная для пациента доза" или "стандартная доза" означает радиофармацевтическую композицию 99mTc-тетрофосмина с содержанием радиоактивного 99mTc, подходящим для визуализации in vivo после введения одному пациенту. Такие "стандартные дозы" дополнительно описаны в пятом воплощении (ниже). Многодозовые наборы по настоящему изобретению готовят таким образом, чтобы они были пригодны для получения от 4 до 30, предпочтительно от 6 до 24 таких стандартных доз радиофармацевтического препарата 99mTc-тетрофосмина, воспроизводимым образом для интервала элюатов генератора 99mTc. Однако возможно использование многодозового набора для получения от 1 до 40, и, вероятно, даже более 40 таких стандартных доз.
Как и для первого воплощения, многодозовый набор по второму воплощению не требует стадии добавления воздуха в протоколе восстановления, что является важным преимуществом. Многодозовый набор по настоящему изобретению также дает возможность значительно более быстрого времени приготовления для множественных радиофармацевтических препаратов 99mTc-тетрофосмина при существенно сниженной дозе радиации для оператора. Многодозовый набор также проявляет повышенную стабильность в течение срока хранения по меньшей мере 78 недель, тогда как общепринятый набор Myoview™ обладает стабильностью в течение срока хранения 37 недель. Дополнительные преимущества многодозового набора описаны в способе по третьему воплощению (ниже).
В третьем аспекте в настоящем изобретении предложен способ изготовления многократных для пациента доз радиофармацевтического препарата 99mTc-тетрофосмина, включающий:
(1) восстановление многодозового набора по второму воплощению либо стерильным раствором 99mTc-пертехнетата, либо сначала биосовместимым носителем, а затем стерильным раствором 99mTc-пертехнетата;
(2) возможно, проведение стадии (1) в присутствии противомикробного консерванта;
(3) обеспечение возможности образования комплекса 99mTc-тетрофосмин с получением раствора, содержащего общую партию желаемого радиофармацевтического препарата 99mTc-тетрофосмина;
(4) возможно, проверку радиохимической чистоты общей партии комплекса 99mTc-тетрофосмин;
(5) извлечение стандартной дозы из общей партии со стадии (3) в подходящий шприц или контейнер;
(6) повторение стадии (5) с использованием дополнительного шприца или контейнера в последующие моменты времени для получения дополнительных стандартных доз.
Стандартная доза является такой, как определено для первого воплощения (выше), и описана более полно в четвертом воплощении (ниже). Биосовместимый носитель и его предпочтительные воплощения являются такими, как определено для первого воплощения (выше). Предпочтительным биосовместимым носителем для данного способа является стерильный солевой раствор.
Этот способ предпочтительно осуществляют в отсутствие противомикробного консерванта.
Стерильный раствор 99mTc-пертехнетата предпочтительно получают из генератора технеция. Радиоактивное содержание 99mTc-пертехнетата для использования на стадии (1) подходящим образом находится в интервале от 2 до 100 ГБк, предпочтительно от 5 до 75 ГБк. Радиоактивная концентрация 99mTc предпочтительно составляет не более чем 10 ГБк/см3, наиболее предпочтительно не более чем 2,5 ГБк/см3. После приготовления общая партия желаемого радиофармацевтического препарата 99mTc-тетрофосмина имеет приемлемый срок хранения вплоть до 12 часов.
Образование комплекса 99mTc-тетрофосмин, то есть стадия (3), обычно завершается в пределах 15 минут при комнатной температуре.
Способ по настоящему изобретению обладает преимуществами по сравнению с альтернативой восстановления множества 10-мл флаконов Myoview™ в том, что:
(а) число манипуляций, в которые вовлечена радиоактивность (99mTc-пертехнетат), значительно снижено;
(б) отсутствует необходимость в стадии добавления воздуха;
(в) только единственное определение QC на партию стандартных доз должно быть необходимо в противоположность определению QC на дозу;
(г) препарат в общем флаконе готовят таким образом, чтобы этот препарат мог выдержать интервал состояний элюата генератора 99mTc;
(д) вовлечено меньшее количество стадий, поэтому автоматизация является более простой;
(е) необходимо меньшее количество флаконов нерадиоактивного набора, что экономит пространство для хранения в холодильнике.
Ключевыми следствиями являются меньшее количество времени для обработки оператором (то есть эффективность) и сниженная доза радиации для оператора, которая является тем более существенной, чем больше число стандартных доз, которые нужно приготовить.
В четвертом аспекте в настоящем изобретении предложена стабилизированная радиофармацевтическая композиция, которая содержит:
(1) комплекс 99mTc тетрофосмина в биосовместимом носителе;
(2) радиозащитный агент в концентрации от 0,5 до 6,0 ммоль, который выбран из аскорбиновой кислоты или ее соли с биосовместимым катионом;
при условии, что радиофармацевтическая композиция не содержит противомикробный консервант.
"Биосовместимый носитель" и его предпочтительные воплощения являются такими, как определено выше.
Миллимолярная концентрация (ммоль) является такой, что 1,0 ммоль равен 0,001 моль. Концентрация радиозащитного агента предпочтительно находится в интервале от 0,6 до 5,7 ммоль, наиболее предпочтительно от 0,7 до 5,5 ммоль. Это соответствует интервалам концентрации, получаемой при восстановлении предпочтительных наборов по первому воплощению необходимым интервалом объема 99mTc-пертехнетата в солевом растворе. Эти концентрации радиозащитного агента также являются более низкими, чем используемые в препарате "конъюгатного" раствора Myoview™, который имеется в продаже в Японии.
Предпочтительные радиозащитные агенты для стабилизированной композиции являются такими, как определено для первого воплощения.
Предпочтительно pH стабилизированной композиции находится в интервале от 7,5 до 9,0, наиболее предпочтительно от 8,0 до 8,6.
В пятом аспекте в настоящем изобретении предложена стандартная для пациента доза радиофармацевтического препарата 99mTc-тетрофосмина, включающая композицию по четвертому воплощению, с радиоактивным содержанием 99mTc, подходящим для визуализации одного пациента.
Стандартная для пациента доза является такой, как определено в первом воплощении, и представлена в стерильной форме, подходящей для введения человеку, в подходящем контейнере или шприце. Такие шприцы подходящим образом представляют собой шприцы для клинического применения, и предпочтительно одноразовые, так что шприц будет использован только для индивидуального пациента. Шприц может быть также возможно обеспечен защитным кожухом для защиты оператора от дозы радиации. Такие подходящие кожухи для радиофармацевтических шприцов имеются в продаже и предпочтительно содержат либо свинец, либо вольфрам, как описано Logan [J. Nucl. Med. Technol, 21(3), 167-170 (1993)].
Стандартная доза радиофармацевтического препарата 99mTc-тетрофосмина может быть альтернативно представлена в контейнере, который имеет уплотнитель, подходящий для многократного прокалывания подкожной иглой (например, навинчиваемая мембранная герметичная крышка). Стандартная доза по настоящему изобретению предпочтительно поставляется в шприце клинического качества, и наиболее предпочтительно снабженном защитным кожухом.
Радиоактивное содержание 99mTc стандартной дозы подходящим образом составляет от 150 до 1500 МБк, предпочтительно от 185 до 1250 МБк. Когда инъекции покоя и нагрузки вводят на одни и те же сутки, первая доза должна составлять от 185 до 450 МБк, за которой спустя 1-4 часа следует вторая доза от 550 до 1250 МБк. Предпочтительные композиции, используемые в стандартной дозе, являются такими, как описано в третьем воплощении (выше).
Изобретение проиллюстрировано неограничивающими примерами, подробно описанными ниже.
В примере 1 предложен синтез тетрофосмина. В примере 2 предложен многодозовый набор, или «набор в виде партии», по настоящему изобретению, где предпочтительная форма названа Myoview30. В примере 3 показано, как можно использовать многодозовый набор, или «набор в виде партии», по настоящему изобретению для приготовления множественных стандартных доз 99mTc-тетрофосмина. В примере 4 показано, что лиофилизированные наборы, содержащие радиозащитный агент, проявляют отличную радиохимическую чистоту в течение многих часов после восстановления 99mTc-пертехнетатом.
В примере 5 показано, что даже без стадии добавления воздуха для набора Myoview30 стабильность после восстановления набора Myoview30 является превосходящей при возрастающих радиоактивных концентрациях (RACs), чем Myoview™. В примере 5 также показано, что набор Myoview30 можно успешно использовать в более широком диапазоне интервалов элюции генератора 99mTc. Диапазон как радиоактивных концентраций (RACs), так и интервалов элюции генератора 99mTc означает, что наборы по настоящему изобретению обладают полезной гибкостью, в частности, для радиофармацевтических операций, где может быть необходимым приготовление множества препаратов 99mTc-тетрофосмина каждый день.
В примере 6 показано, что набор Myoview30 по настоящему изобретению дает возможность значительно более быстрого времени приготовления для множества радиофармацевтических препаратов 99mTc-тетрофосмина при существенно сниженной дозе радиации для оператора. Количество радиоактивности, использованное для образца QC, является одинаковым для Myoview30 и Myoview™, но Myoview30 требует на 70% меньше времени и на 75% меньше радиоактивности. Кроме того, для оператора легче поместить за радиационную защитную ширму 4 полоски для QC-хроматографии, чем 16.
В примере 7 показано, что многодозовый флакон по настоящему изобретению можно использовать для приготовления 30 стандартных доз 99mTc-тетрофосмина, сохраняя при этом удовлетворительную РХЧ, а также не подвергая риску стерильность содержимого флакона. Таким образом, через 12 часов после восстановления РХЧ соответствует спецификации даже после многократных прокалываний пробки. Никакого роста не появилось в культуральной среде через 12 часов, и продукт соответствовал тесту на стерильность согласно USP/Ph.Eur. Исследованные разведения препарата показали содержание бактериальных эндотоксинов менее чем 313 МЕ/флакон. Это означает, что никаких жизнеспособных бактерий или продуктов их распада не было обнаружено и что, следовательно, многодозовый флакон эффективно функционирует без необходимости в противомикробном консерванте.
В примере 8 показано, что крышки многодозовых флаконов по настоящему изобретению выдерживают прокалывание иглой вплоть до 35 раз. В примере 9 показано, что многодозовые флаконы по настоящему изобретению обладают приемлемым нерадиоактивным сроком годности в течение 78 недель (18 месяцев) при хранении при 5°С (от 2 до 8°С) и в защищенном от света месте.
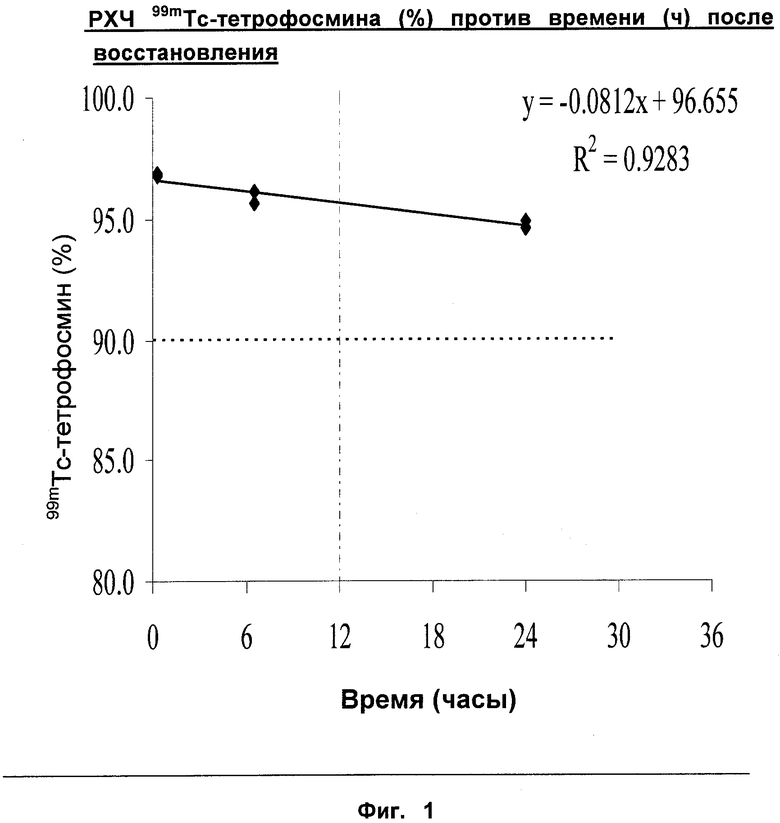
На Фиг.1 показано, что композиции с радиозащитным агентом по настоящему изобретению дают удовлетворительную РХЧ более 95% вплоть до 12 часов после восстановления (то есть, полезный срок годности препарата).
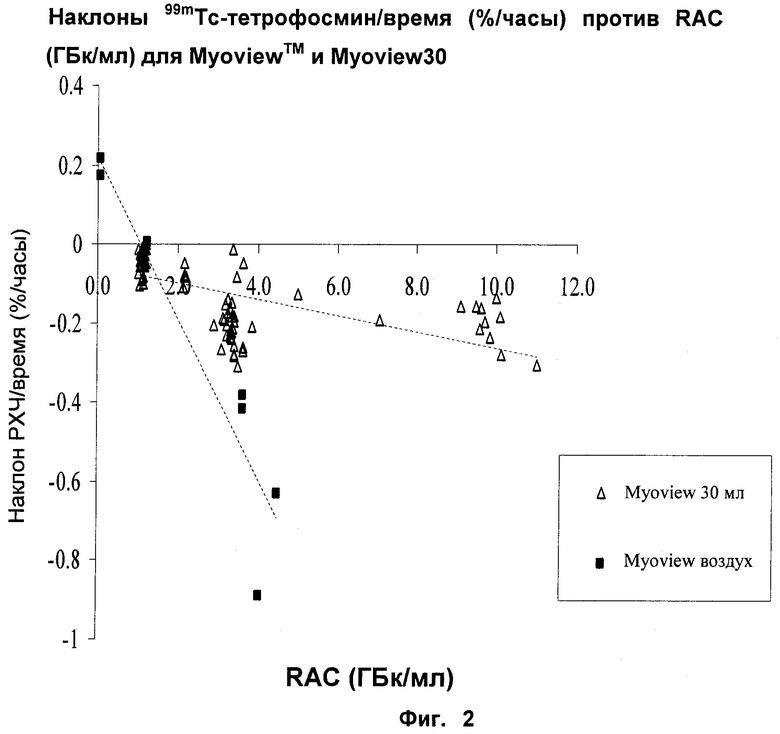
На Фиг.2 показаны результаты сравнения скорости потери РХЧ 99mTc-тетрофосмина с течением времени как функции радиоактивной концентрации (RAC) для Myoview30 и Myoview™ (с добавлением воздуха). Видно, что набор Myoview30 по настоящему изобретению является значительно более устойчивым.
Пример 1: Синтез тетрофосмина
Все реакции и манипуляции проводили либо в вакууме, либо в свободной от кислорода атмосфере азота. Растворители сушили и дегазировали продуванием азота перед использованием. α-Азо-изобутиронитрил (AIBN) и этилвиниловый эфир получили от BDH и Aldrich соответственно. Бис(дифосфино)этан получали в соответствии с литературой [Inorganic Synthesis, Vol 14, 10].
В герметичную колбу Фишера, оборудованную мешалкой Teflon™, загружали этилвиниловый эфир (5 см3, 52,3 ммоль), бис(дифосфино)этан (1 см3, 10 ммоль) и α-азо-изобутиронитрил (0,1 г, 0,61 ммоль). Затем эту реакционную смесь перемешивали и нагревали до 75°С в течение 16 часов. После охлаждения снова до комнатной температуры вязкую жидкость переносили в 50-см3 круглодонную колбу. Удаление летучих веществ проводили путем нагревания в вакууме. Полученное в результате нелетучее вещество было чистым по ЯМР. Выход: 3,0 г, 80%.
1H ЯМР (CDCl3): δ 1.12 (12H, dt J=1.16 Гц, 7.15 Гц; OCH2CH 3), 1.51 (4Н, br m; PC2H4P), 1.7 (8Н; br t, J=7.4 Гц; PCH 2CH2OEt), 3.4 (8H, dt J=1.16 Гц, 7.15 Гц, ОСН 2СН3), 3.49 (8H; br m; PCH2CH 2OEt) млн-1.
31Р ЯМР: δ -33,17 млн-1.
Тетрофосмин превращали в сульфосалицилат тетрофосмина путем взаимодействия с 2,3-2,5 молярными эквивалентами 5-сульфосалициловой кислоты при комнатной температуре в этаноле с последующей перекристаллизацией из этанола/эфира.
Пример 2: Препарат и изготовление набора во флаконе в виде лиофилизировнаной партии
Оптимизированный состав для 30-мл флакона с партией препарата является следующим:
Этот состав набора назван "Myoview30".
Готовили партии по 500 мл. Таким образом, примерно 90% суммарного объема воды для инъекций (ВДИ) добавляли в сосуд для препарата. ВДИ дезоксигенировали путем продувания азотом. Сульфосалицилат тетрофосмина, дигидрат хлорида олова, D-глюконат натрия, аскорбиновую кислоту и гидрокарбонат натрия распределяли, добавляли и растворяли в последовательном порядке при постоянном перемешивании. Распределительные химические стаканы ополаскивали дезоксигенированной ВДИ. Объем общего раствора доводили до 100% конечного объема дезоксигенированной ВДИ при непрерывном перемешивании. Продувание азотом прекращали. Азотный слой наносили в верхнее пространство во время остального процесса изготовления.
Раствор стерильно фильтровали и 3,0 мл фильтрованного раствора распределяли в 30-мл флаконы. Флаконы частично закупоривали и затем лиофилизировали.
Пример 3: Методика восстановления общего набора, содержащего радиозащитный агент
Набор Myoview30 в 30-мл флаконе (из Примера 2) помещали в подходящий, защитный от радиоактивности контейнер, и резиновую мембрану дезинфицировали протиркой изопропиловым спиртом. Стерильную иглу (вентиляционную иглу) вводили через резиновую мембрану. Элюат генератора 99mTc-пертехнетата [объем 10-30 см3; разведен инъекционным раствором хлорида натрия, фармакопея США, как подходит, который не содержит бактериостатический агент; при радиоактивной концентрации вплоть до 10 ГБк/см3 и суммарном содержании радиоактивного 99mTc вплоть до 100 ГБк (2,7 Ки)] добавляли, используя стерильный шприц с защитным кожухом. Затем вентиляционную иглу извлекали. Восстановленный флакон осторожно перемешивали в течение 10 секунд, чтобы обеспечить полное растворение лиофилизированного порошка, и затем инкубировали при комнатной температуре в течение 15 минут.
Восстановленный Myoview30 хранили при 2-25°С и содержимое использовали в пределах 12 часов после приготовления. Отобранные аликвоты также хранили при 2-25°С и использовали в пределах того же 12-часового периода, что и восстановленный флакон Myoview30.
Пример 4: Радиохимический анализ лиофилизированного набора, содержащего радиозащитный агент, РХЧ в зависимости от времени
Радиохимическую чистоту [РХЧ] восстановленного набора Myoview30 (Пример 2) измеряли, используя две хроматографические системы:
Система 1: Стационарная фаза: ITLC-SG
Подвижная фаза: Ацетон/дихлорметан [35:65 об./об.]
Эта система осуществляет отделение липофильного 99mTc-тетрофосмина от 99mTc-гидрофильных веществ и от липофильных примесей [типа В, С и X] и 99mTc-пертехнетата.
Система 2: Стационарная фаза: бумага Ватман №1
Подвижная фаза: Ацето нитрил/вода [50:50 об./об.]
Эта система осуществляет отделение восстановленного гидролизованного технеция [RHT], который остается в начале полосы, от других комплексов технеция, которые мигрируют.
Флакон Myoview30 восстанавливали без использования стадии добавления воздуха. Результаты восстановления флакона Myoview30 99mTc-пертехнетатом (37,9 ГБк в 17,5 мл; RAC=2,2 ГБк/мл) приведены на Фиг.1.
Пример 5: Радиохимический анализ лиофилизированного набора. содержащего радиозащитный агент, РХЧ в зависимости от времени по сравнению с предшествующим уровнем техники
Наборы Myoview™ были получены от Amersham plc (теперь часть GE Healthcare). Сравнивали стабильность после восстановления препарата в виде набора Myoview30 по настоящему изобретению и коммерческого 10-мл препарата в виде набора Myoview™ по возрастанию радиоактивной концентрации (RAC). Следовали методике восстановления согласно вкладышу упаковки для Myoview™, то есть выполняли стадию добавления воздуха.
Исследование было основано на 8 препаратах Myoview™ и 89 препаратах Myoview30. Флаконы Myoview™ восстанавливали вплоть до 4,5 ГБк/мл, а флаконы Myoview30 вплоть до 11,0 ГБк/мл. Для всех 8 препаратов Myoview™ восстанавливали элюатом из генератора 99mTc в пределах 24-часового интервала элюции. Флаконы Myoview30 восстанавливали элюатами из генераторов 99mTc с различными интервалами элюции, вплоть до 96 часов, без использования стадии добавления воздуха. Результаты приведены на Фиг.2.
Пример 6: Сравнение времени приготовления и дозы радиации для оператора для Mvoview30 по сравнению с Mvoview™
16 стандартных доз, каждая по 18,5 ГБк (500 мКи) 99mTc-тетрофосмина, готовили либо:
способом 1: восстановление 4 флаконов Myoview30 (из Примера 2), каждый 74 ГБк 99mTc-пертехнетата; либо
способом 2: восстановление 16 флаконов Myoview™ каждый 18,5 ГБк 99mTc-пертехнетата.
Результаты приведены в таблице 1:
Пример 7: Демонстрация стерильности многодозового флакона
Исследовали три отдельных партии Myoview30, изготовленные, как описано в Примере 2. Сразу после восстановления в каждый из двух флаконов из трех партий по 30 мл Myoview30 вводили вентиляционную иглу BD Microlance 21G, собранную с 0,22-мкм стерильным и апирогенным фильтром Millex GP. Флаконы восстанавливали 23 мл стерильного солевого раствора. Разведенный элюат 99mTc (2 мл) сразу после этого впрыскивали во флаконы, так что радиоактивное содержание составляло примерно 2 ГБк/флакон. Флаконы хранили при 25°С в течение 12 часов. Через 15 минут флаконы обрабатывали, как показано в таблице 2:
Таким образом, 30 имитируемых доз отбирали через 15 минут, 6 часов и в конце срока хранения, 12 часов. Дозы отбирали, используя 1-мл шприцы BD (Becton Dickinson), собранные с иглами 25 калибра BD Microlance. Для каждого отбора использовали новые шприц/иглу. Дозы номер 1 и 21 отправляли на анализы РХЧ. Последнюю 'дозу' (номер 30) отправляли на ЛАЛ-тест (анализ бактериальных эндотоксинов с использованием лизата амебоцитов Limulus) и тест осмотического давления. Оставшийся объем во флаконах Myoview30 после 12 часов, примерно 7,5 мл, тестировали на стерильность в соответствии с тестом современных USP/Ph.Eur. Таким образом, оставшийся объем делили на два, и тесты на стерильность проводили и инкубировали в тиогликолевой среде (TGY) и трипсинизированном соевом бульоне (TSB) в течение 14 суток при 25°С и 32°С инкубациях.
ЛАЛ-тест
Дозу номер 30 из каждого флакона отправляли на тестирование на бактериальные эндотоксины. Содержимое во флаконах сначала восстанавливали 25 мл стерильного солевого раствора. Следующее разведение делали путем взятия 0,1 мл данного раствора и добавления к 9,9 мл воды для инъекций (ВДИ). ЛАЛ-тест проводили, используя пробирочный способ. Предел бактериальных эндотоксинов при данном разведении составлял: 313 МЕ/флакон.
Результаты
Стерильность: Результат показал, что если никакого роста не появляется в культуральной среде, продукт удовлетворяет тесту на стерильность (прошел = Р).
РХЧ: Все препараты показали РХЧ 99mTc-тетрофосмина 96-97%.
pH: В каждом флаконе pH составлял при измерении 8,2.
ЛАЛ: Результат из каждого флакона показал, что продукт удовлетворяет данному пределу, прошел (Р).
Результаты суммированы в таблице 3:
Пример 8: Демонстрация целостности крышки многодозового флакона
Используемая крышка Myoview30 представляла собой РН 701/45, красно-коричневая (1178), и контейнер представляет собой 30-мл флакон типа 1, Schott. Десять флаконов Myoview30 тестировали в соответствии с Ph.Eur.3.2.9, за исключением того, что проводили 35 проколов по сравнению с 10 согласно Ph.Eur. Это было необходимо для имитации увеличенного числа многократных дозировок многодозового флакона. Каждую крышку прокалывали 35 раз новой подкожной иглой с наружным диаметром 0,8 мм. Каждый прокол проводили в другом месте. Последний прокол также представлял собой впрыскивание ультрафильтрованной воды до номинального объема, то есть 30 мл. 10 проколотых и заполненных флаконов погружали вертикально в химический стакан с раствором метиленового синего (1 г/л). Внешнее давление понижали на 270 мбар (28,35 Па) до 750 мбар (78,75 Па) в течение 10 мин. Затем восстанавливали атмосферное давление, и флаконы оставляли еще на 30 минут погруженными в раствор метиленового синего. Флаконы тщательно ополаскивали и осматривали на какое-либо изменение цвета против белого фона. Результат тестирования показал отсутствие интрузии красителя в любом из флаконов.
Пример 9: Тестирование на стабильность многодозовых флаконов
Множественные флаконы из трех отдельных партий Myoview30, изготовленных, как в Примере 2, хранили при контролируемой температуре 5°С в защищенном от света месте. Флаконы тестировали через интервалы вплоть до 52 недель хранения. Оценивали содержание тетрофосмина, аскорбиновой кислоты, олова, сульфосалицилата динатрия, кислорода и влаги. Мониторинг чистоты тетрофосмина проводили путем 1H и 31P ЯМР. РХЧ 99mTc-тетрофосмина, полученного с использованием хранящихся наборов, также измеряли в каждый момент времени.
Все полученные результаты показывают, что продукт соответствует всем спецификациям при хранении при 5°С (2-8°С) в защищенном от света месте в течение полного 52-недельного периода. Все результаты оценили и провели статистический анализ. Анализ линейной регрессии проводили по количественным параметрам для исследования зависимостей между каждым из параметров и сроком хранения. Коэффициент корреляции, полученный на основании регрессионного анализа, тестировали на значимость, используя критерий Пирсона. Вычисляли 95%-ный доверительный интервал для индивидуального параметра. Когда параметр может только снижаться (или повышаться) со временем, вычисляли односторонний доверительный интервал. 95%-ные доверительные интервалы и кривые регрессии экстраполировали до 78 недель (18 месяцев), что составляет на 6 месяцев больше периода, охватываемого долгосрочными данными. Это является максимальным продлением срока хранения на основании доступных результатов согласно ICH (The International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use) правило Q1E. Самый ранний момент времени, при котором 95%-ный доверительный интервал для среднего пересекает предполагаемый критерий приемлемости, находится после 78 недель для образцов, хранимых при 5°С. Партии Myoview30, хранимые, как описано выше, в течение 78 недель, проявляли РХЧ выше 90% через 12 часов после восстановления при восстановлении от 5,5 до 89 ГБк 99mTc-пертехнетата.
| название | год | авторы | номер документа |
|---|---|---|---|
| РАДИОФАРМАЦЕВТИЧЕСКИЕ ПРОДУКТЫ | 2007 |
|
RU2448733C2 |
| СТАБИЛИЗАЦИЯ РАДИОФАРМАЦЕВТИЧЕСКИХ КОМПОЗИЦИЙ | 2008 |
|
RU2474435C2 |
| СПОСОБ И СОСТАВ ДЛЯ ПОЛУЧЕНИЯ РЕАГЕНТА ДЛЯ РАДИОНУКЛИДНОЙ ДИАГНОСТИКИ НА ОСНОВЕ МЕЧЕННОЙ ТЕХНЕЦИЕМ-99m 5-ТИО-D-ГЛЮКОЗЫ | 2014 |
|
RU2568888C1 |
| УСОВЕРШЕНСТВОВАННЫЕ КОНЪЮГАТЫ N4 ХЕЛАТООБРАЗУЮЩИХ АГЕНТОВ | 2005 |
|
RU2360701C2 |
| РАДИОФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО ДЛЯ ДИАГНОСТИКИ И ЛЕЧЕНИЯ (ТЕРАПИИ) КОСТНЫХ ПОРАЖЕНИЙ СКЕЛЕТА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2008 |
|
RU2407746C2 |
| ЛИОФИЛИЗАТ ДЛЯ ПОЛУЧЕНИЯ ДИАГНОСТИЧЕСКОГО РАДИОФАРМАЦЕВТИЧЕСКОГО ЛЕКАРСТВЕННОГО ПРЕПАРАТА НА ОСНОВЕ РАДИОНУКЛИДА Tc | 2022 |
|
RU2799325C2 |
| КОМПЛЕКС ТЕХНЕЦИЯ-99М С РЕКОМБИНАНТНЫМИ АДРЕСНЫМИ МОЛЕКУЛАМИ БЕЛКОВОЙ ПРИРОДЫ С АНКИРИНОВЫМИ ПОВТОРАМИ ДЛЯ РАДИОНУКЛИДНОЙ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ ОБРАЗОВАНИЙ С ГИПЕРЭКСПРЕССИЕЙ HER2/NEU И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2023 |
|
RU2812633C1 |
| Состав и способ получения реагента для радионуклидной диагностики на основе меченной технецием-99m 1-тио-D-глюкозы | 2016 |
|
RU2644744C1 |
| УЛУЧШЕННЫЕ ХЕЛАТНЫЕ КОНЪЮГАТЫ | 2002 |
|
RU2298012C2 |
| АВТОМАТИЧЕСКИЙ СПОСОБ ВВЕДЕНИЯ РАДИОАКТИВНЫХ ИЗОТОПОВ | 2006 |
|
RU2459632C2 |
Изобретение относится к многодозовому лиофилизированному нерадиоактивному набору, содержащему тетрофосмин, радиозащитный агент, выбранный из аскорбиновой кислоты или ее соли с биосовместимым катионом, биосовместимый восстановитель и pH-регулирующий агент в количестве, эффективном для обеспечения того, что, когда набор восстанавливают солевым раствором, полученный в результате раствор имеет pH в интервале от 8,0 до 9,2. Указанный набор после восстановления раствором 99mTc-пертехнетата дает стабилизированную радиофармацевтическую композицию 99mTc-тетрофосмина, при этом ни набор, ни радиофармацевтическая композиция 99mTc-тетрофосмина не содержат противомикробный консервант. Изобретение относится также к способу изготовления многократных стандартных для пациента доз, в котором стадию восстановления набора проводят без добавления воздуха. Изобретение обеспечивает пролонгирование доступности радиоактивного технеция и повышение радиохимической чистоты. 2 н. и 7 з.п. ф-лы, 2 ил., 3 табл.
1. Многодозовый, лиофилизированный нерадиоактивный набор, содержащий лиофилизированный препарат в герметичном стерильном контейнере, оборудованном крышкой, которая дает возможность добавления и извлечения растворов при сохранении стерильной целостности, причем этот набор изготовлен таким образом, чтобы можно было получить от 4 до 30 стандартных для пациента доз радиофармацевтического препарата 99mTc-тетрофосмина из одного многодозового набора, и где указанный набор содержит препарат, включающий
(1) тетрофосмин;
(2) радиозащитный агент, выбранный из аскорбиновой кислоты или ее соли с биосовместимым катионом;
(3) биосовместимый восстановитель;
(4) pH-регулирующий агент в количестве, эффективном для обеспечения того, что, когда набор восстанавливают солевым раствором, полученный в результате раствор имеет pH в интервале от 8,0 до 9,2;
где указанный набор является подходящим для восстановления раствором 99mTc-пертехнетата с получением стабилизированной радиофармацевтической композиции 99mTc-тетрофосмина с удовлетворительной радиохимической чистотой без необходимости добавления воздуха в указанный контейнер во время восстановления;
при условии, что ни набор, ни стабилизированная радиофармацевтическая композиция 99mTc-тетрофосмина не содержат противомикробный консервант.
2. Многодозовый набор по п.1, где контейнер представляет собой флакон, герметично закрытый мембраной, объемом от 20 до 40 см3.
3. Многодозовый набор по пп.1 или 2, который дополнительно содержит по меньшей мере один трансхелатирующий агент, выбранный из 5-сульфосалициловой кислоты и глюконовой кислоты или их солей с биосовместимым катионом.
4. Многодозовый набор по пп.1 или 2, где биосовместимый восстановитель включает ион олова.
5. Многодозовый набор по пп.1 или 2, где pH-регулирующий агент включает бикарбонат натрия.
6. Способ изготовления многократных стандартных для пациента доз радиофармацевтического препарата 99mTc-тетрофосмина, включающий
(1) восстановление многодозового набора по п.1 либо стерильным раствором 99mTc-пертехнетата, либо сначала биосовместимым носителем, а затем стерильным раствором 99mTc-пертехнетата;
(2) образование комплекса 99mTc-тетрофосмин путем перемешивания и инкубирования с получением раствора, содержащего общую партию желаемого радиофармацевтического препарата 99mTc-тетрофосмина;
(3) возможно, проверка радиохимической чистоты общей партии комплекса 99mTc-тетрофосмин;
(4) извлечение стандартной дозы из общей партии со стадии (2) в подходящий шприц или контейнер;
(5) повторение стадии (4) с использованием дополнительного шприца или контейнера в последующие моменты времени для получения дополнительных стандартных доз;
где восстановление на стадии (1) проводят без добавления воздуха.
7. Способ по п.6, где 99mTc-пертехнетат, используемый на стадии (1), имеет радиоактивное содержание в интервале от 5 до 100 ГБк.
8. Способ по п.6, где стандартная для пациента доза представлена в шприце, имеющем защитный кожух для защиты оператора от дозы радиации.
9. Способ по п.6, где стандартная для пациента доза имеет радиоактивное содержание 99mTc от 150 до 850 МБк.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
Авторы
Даты
2010-11-10—Публикация
2005-10-14—Подача