Изобретение относится к производным бензопиран-2-она, способу их получения, фармацевтической композиции на их основе и к промежуточным соединениям.
Объектом изобретения являются производные бензопиран-2-она формулы (I)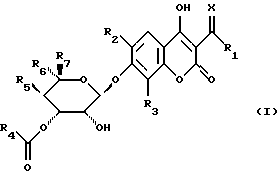
в которой R1 обозначает атом водорода, гидроксильный радикал, алкильный радикал, необязательно прерванный атомом кислорода, серы или азота, содержащий до 12 атомов углерода, линейный, разветвленный или циклический, необязательно замещенный радикалом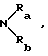
в котором Ra и Rb, одинаковые или разные, обозначают атом водорода, алкильный радикал, содержащий до 8 атомов углерода, или Ra и Rb образуют с атомом азота, с которым они связаны, гетероцикл, необязательно содержащий другой гетероатом, выбираемый среди азота, серы или кислорода,
или R1 обозначает алкоксильный радикал, содержащий до 8 атомов углерода,
или R1 обозначает радикал NRcRd, в котором Rc и Rd, одинаковые или разные, обозначают атом водорода или алкильный радикал, содержащий до 12 атомов углерода,
или Rc и Rd образуют вместе с атомом азота, с которым они связаны, гетероцикл, необязательно содержащий другой гетероатом, выбираемый среди азота, серы или кислорода,
Х обозначает атом кислорода или радикал N-N(CH3)2 или NOalc2, в котором аlс2 обозначает алкильный радикал, необязательно прерванный атомом кислорода, серы или азота, содержащий до 12 атомов углерода, в случае необходимости замещенный одним или несколькими атомами галогена, одним или несколькими радикалами 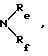 в которых Re и Rf, одианковые или отличающиеся друг от друга, обозначают атом водорода, алкильный радикал, содержащий до 8 атомов углерода, необязательно замещенный, или Re и Rf могут образовывать вместе с атомом азота, с которым они связаны, гетероцикл, который может содержать, кроме того, атом кислорода, атом серы и другой атом азота,
в которых Re и Rf, одианковые или отличающиеся друг от друга, обозначают атом водорода, алкильный радикал, содержащий до 8 атомов углерода, необязательно замещенный, или Re и Rf могут образовывать вместе с атомом азота, с которым они связаны, гетероцикл, который может содержать, кроме того, атом кислорода, атом серы и другой атом азота,
R2 обозначает атом водорода или атом галогена,
R3 обозначает атом водорода, алкильный радикал, содержащий до 8 атомов углерода, или атом галогена,
R4 обозначает радикал 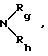 в котором Rg и Rh, одинаковые или отличающиеся друг от друга, обозначают атом водорода, алкильный радикал, линейный, разветвленный или циклический, содержащий до 8 атомов углерода, арильный или гетероарильный радикал, необязательно замещенный, или Rg и Rh образуют с атомом азота, с которым они связаны, гетероцикл, который может содержать, кроме того, атом кислорода, атом серы и другой атом азота,
в котором Rg и Rh, одинаковые или отличающиеся друг от друга, обозначают атом водорода, алкильный радикал, линейный, разветвленный или циклический, содержащий до 8 атомов углерода, арильный или гетероарильный радикал, необязательно замещенный, или Rg и Rh образуют с атомом азота, с которым они связаны, гетероцикл, который может содержать, кроме того, атом кислорода, атом серы и другой атом азота,
или R4 обозначает арильный или гетероарильный радикал, необязательно замещенный одним или несколькими атомами галогена, одним или несколькими гидроксильными радикалами, одним или несколькими алкильными или алкоксильными радикалами, содержащими до 8 атомов углерода,
R5 обозначает атом водорода, радикал О-алкил, содержащий до 4 атомов углерода,
R6 обозначает радикал алкил или СН2-О-алкил, в котором алкил обозначает алкильный радикал, содержащий до 8 атомов углерода,
R7 обозначает атом водорода или алкильный радикал, содержащий до 8 атомов углерода,
также, как их соли.
В качестве примеров солей можно назвать соли натрия, калия, лития, кальция или магния, соли, полученные с азотсодержащими основаниями, такими как триметиламин, триэтиламин, метиламин, пропиламин, N,N-диметилэтаноламин и трис-(гидроксиметил)метиламин.
В качестве примеров солей можно также назвать соли, образованные с кислотами: уксусной, пропионовой, трифторуксусной, малеиновой, винной, метансульфоновой, бензолсульфоновой, п-толуолсульфокислотой, соляной, бромистоводородной, иодистоводородной, серной, фосфорной и в особенности со стеариновой, этилянтарной или лаурилсульфоновой кислотами.
В определении заместителей:
- алкильный, алкенильный или алкинильный радикал представляет собой предпочтительно радикал метил, этил, пропил, изопропил, н-бутил, изобутил, третичный бутил, децил или додецил, винил, аллил, этинил, пропинил, циклобутил, циклопентил или циклогексил,
- галоген предпочтительно представляет собой фтор или хлор, или бром,
- арильный радикал предпочтительно представляет собой радикал фенил,
- гетероциклический радикал предпочтительно представляет собой радикал пирролил, пирролидинил, пиридил, пиразинил, пиримидил, пиперидинил, пиперазинил, хинуклидинил, оксазолил, изоксазолил, морфолинил, индолил, имидазолил, бензимидазолил, тиазолил, азетидинил, азиридинил.
Среди предпочтительных соединений согласно изобретению можно назвать соединения, в которых R2 обозначает атом водорода, те, в которых R3 обозначает метильный радикал, те, в которых R6 обозначает метильный радикал, те, в которых R7 обозначает атом водорода или метильный радикал, и те, в которых R5 обозначает радикал ОСН3.
В особенности предметом изобретения являются соединения формулы (I), в которых R4 обозначает радикал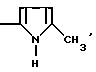
или еще те, в которых R4 обозначает радикал NH-циклопропил.
Среди соединений согласно изобретению можно в особенности назвать соединения формулы (I), в которых Х обозначает атом кислорода, те, в которых Х обозначает радикал NOR, в котором R обозначает алкильный радикал, необязательно замещенный одним или несколькими атомами галогена и необязательно прерванный атомом кислорода, азота, серы, и необязательно несущий гетероциклический радикал, необязательно замещенный, например те, в которых Х обозначает радикал NОСН3, равным образом в качестве предпочтительных соединений можно назвать соединения формулы (I), в которых R1 обозначает алкильный радикал, необязательно прерванный атомом кислорода или серы, радикал O-алкил, необязательно прерванный атомом кислорода или серы, радикал NH2, например соединения, в которых R1 представляет собой метильный радикал,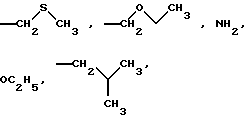
и предпочтительно соединения формулы (I), в которых R1 обозначает радикал метил или O-этил.
Среди предпочтительных соединений согласно изобретению можно назвать, совсем особенно, соединения, получение которых дано ниже в экспериментальной части, в особенности следующие соединения:
3'-[5-метил-1Н-пиррол-2-карбоксилат] 3-ацетил-7-((6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси)-4-гидрокси-8-метил-2Н-1-бензопиран-2-она,
3'-[5-метил-1Н-пиррол-2-карбоксилат) 7-((6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси)-4-гидрокси-8-метил-2-оксо-2Н-1-бензопиран-3-этилкарбоксилата,
3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-((6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси)-4-гидрокси-3-(1-метоксиимино)этил)-8-метил-2Н-1-бензопиран-2-она,
3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-((6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси)-3-(этоксиацетил)-4-гидрокси-8-метил-2Н-1-бензопиран-2-она,
3'-[5-метил-1Н-пиррол-2-карбоксилат] 3-(циклопропилкарбонил)-7-((6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси)-4-гидрокси-8-метил-2Н-1-бензопиран-2-она,
3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-((6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси)-4-гидрокси-8-метил-2-оксо-2Н-1-бензопиран-3-карбоксамида.
Продукты общей формулы (I) обладают очень высокой антибактериальной активностью по отношению к грамположительным бактериям, таким как стафилококки, стрептококки, пневмококки, энтерококки, листерии, анаэробные организмы.
Таким образом, соединения согласно изобретению могут быть использованы в качестве лекарств при лечении инфекций с чувствительными возбудителями, в особенности стафилококковых инфекций, таких как стафилококковые сепсисы, поверхностные или кожные злокачественные стафилококковые инфекции, пиодермиты, септические или гнойные раны, фурункулы, карбункулы, флегмоны, рожистые воспаления и угри, таких стафилококковых инфекций, как первичные или постгриппозные острые ангины, бронхопневмония, легочные нагноения, таких стрептококковых инфекций, как острые ангины, отиты, синуситы, скарлатина, таких пневмококковых инфекций, как пневмонии, бронхиты и дифтерия.
Продукты настоящего изобретения, равным образом, активны по отношению к инфекциям, вызываемым такими возбудителями, как Haemophilus influenzae.
Таким образом, предметом изобретения являются соединения формулы (I) в качестве лекарств.
Преимущественно предметом изобретения в качестве лекарств являются соединения, указанные выше, как предпочтительные соединения.
Равным образом, предметом изобретения являются фармацевтические композиции, содержащие в качестве действующего начала, по меньшей мере, одно из лекарств, определенных выше.
Эти композиции могут быть введены перорально, ректально, парентерально или локально при местном нанесении на кожу и слизистые оболочки, но предпочтительным путем введения является буккальный путь.
Они могут быть твердыми или жидкими и находиться в фармацевтических формах, обычно используемых в терапии человека, таких как, например, простые таблетки или драже, желатиновые капсулы, гранулы, свечи, препараты для инъекций, мази, кремы, гели; их получают обычными способами. Действующее начало, или действующие начала, могут быть введены туда с эксципиентами, обычно используемыми в этих фармацевтических композициях, такими как тальк, гуммиарабик, лактоза, крахмал, стеарат магния, масло какао, водные или неводные связующие, твердые жиры животного или растительного происхождения, парафиновые производные, гликоли, различные смачивающие агенты, диспергаторы или эмульгаторы, консерванты.
Эти композиции, равным образом, могут быть представлены в виде порошка, предназначенного для растворения перед самым употреблением в подходящем растворителе, например стерильной апирогенной воде.
Назначаемая доза изменяется сообразно излечиваемому заболеванию, конкретному пациенту, пути введения и рассматриваемому препарату. Для взрослых, для предпочтительных препаратов, она может быть, например, заключена между 50 и 3000 мг в день для введения пероральным путем или путем инъекции.
Равным образом, предметом изобретения является способ, отличающийся тем, что соединение формулы (II)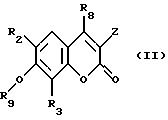
в которой
R8 обозначает свободный или блокированный гидроксильный радикал,
Z обозначает атом водорода или радикал 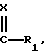 X, R1, R2 и R3 сохраняют их предыдущее значение,
X, R1, R2 и R3 сохраняют их предыдущее значение,
ОR9 обозначает свободный или блокированный гидроксильный радикал,
подвергают воздействию соединения формулы (III)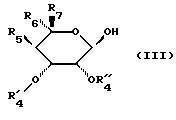
в которой R5, R6 и R7 сохраняют их предыдущее значение,
OR'4 обозначает блокированный гидроксильный радикал,
R''4 обозначает атом водорода или лучше,
R'4 и R''4 образуют вместе с атомами углерода, с которыми они связаны, цикл
чтобы получить соединение формулы (IV)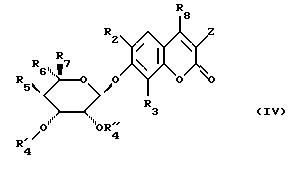
в которой заместители сохраняют их предыдущее значение, затем полученное таким образом соединение формулы (IV) подвергают следующим стадиям, в совокупности или частично:
- высвобождению гидроксила в положении 4 после возможного блокирования гидроксила сахара в α-положений OR'4,
- если Z является атомом водорода, введению радикала  после возможного блокирования реакционноспособных гидроксильных групп,
после возможного блокирования реакционноспособных гидроксильных групп,
- введению радикала 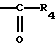 путем замещения этим радикалом радикала R'4,
путем замещения этим радикалом радикала R'4,
- модификации радикала X.
Исходные продукты для получения соединений согласно изобретению, а именно продукты формул (II) и (III), являются новыми продуктами, примеры получения этих соединений даны ниже в экспериментальной части.
Соединения формулы (IV), полученные при осуществлении способа согласно изобретению, являются новыми.
Таким образом, предметом изобретения в качестве новых химических продуктов являются соединения формул (II), (III) и (IV).
В предпочтительной форме реализации способа согласно изобретению:
- реакция между соединениями формул (II) и (III) происходит в присутствии диалкилазодикарбоксилата, такого как диэтилазодикарбоксилат или диизопропилазодикарбоксилат,
- возможное высвобождение гидроксила в положении 4 кумарина осуществляют путем гидрогенолиза или путем изомеризации и последующего гидролиза,
- другие защищенные гидроксильные группы высвобождаются путем кислотного гидролиза, например, в присутствии п-толуолсульфокислоты,
- введение радикала 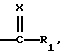 когда Z является водородом, осуществляют путем ацилирования и последующей перегруппировки,
когда Z является водородом, осуществляют путем ацилирования и последующей перегруппировки,
- гликозилирование происходит по реакции Митцунобу,
- другие модификации осуществляют в обычных условиях.
Следующие неограничивающие примеры иллюстрируют изобретение.
СИНТЕЗ 1: 3-(5-метил-1Н-пиррол-2-карбоксилат) 6-дезокси-5-С-метил-4-О-метил-L-ликсогексопиранозы
СТАДИЯ А: 6-дезокси-5-С-метил-4-О-метил-L-ликсо-фенилметилгексопиранозид
Через суспензию, содержащую 80 г 6-дезокси-5-С-метил-4-О-метил-L-ликсогексопиранозы и 400 мл бензилового спирта при 20-22oС в течение 2 часов барботируют поток газообразного хлористого водорода. Добавляют 120 мл деминерализованной воды и добавляют 40 г карбоната натрия, затем 240 мл этилацетата. Декантируют и экстрагируют этилацетатом. Органические фазы соединяют и промывают насыщенным раствором хлорида натрия. Сушат, обезвоживают, промывают и перегоняют при перемешивании под вакуумом 45-50 мбар. Бензиловый спирт отгоняют под вакуумом 2 мбар. Получают 118,8 г продукта, который очищают хроматографически на диоксиде кремния, элюируя смесью метиленхлорид-метанол (95:5). Таким образом получают 109,9 г искомого продукта.
СТАДИЯ Б: 2,3-О-карбонил-6-дезокси-5-С-метил-4-О-метил-L-ликсо-фенилметилгексопиранозид.
В раствор, содержащий 109 г продукта, полученного на стадии А, и 1,1 л 1,2-дихлорэтана при 20-22oС добавляют 67,5г 1,1-карбонилдиимидазола. Кипятят в колбе с обратным холодильником в течение 2 часов. Охлаждают до 20-22oС, затем доводят до сухого состояния при пониженном давлении при 25-30oС. Получают 200,8 г продукта, который хроматографически очищают на диоксиде кремния, элюируя смесью метиленхлорид-метанол (99:1). Таким образом получают 91,6 г искомого продукта.
ИК-спектр, см-1:
Кетон - 1813
Бензил - 1498
Используемый на стадии В 2-метил-1Н-пиррол получают следующим образом.
В суспензию, содержащую 5 л этиленгликоля и 370 г пиррол-2-карбоксальдегида, добавляют 750 г чистого гидроксида калия. Затем в течение 30 минут добавляют 544 см3 64%-ного гидразингидрата. Кипятят в колбе с обратным холодильником в течение 1 часа 30 минут и добавляют 2 л деминерализованной воды, затем выливают в смесь воды со льдом. Экстрагируют метиленхлоридом, сушат, обезвоживают, промывают и доводят до сухого состояния. Получают 270,3 г продукта, который очищают перегонкой под давлением 15 мбар. Извлекают 227 г искомого продукта. Ткип.46-47oС при давлении 15 мбар.
СТАДИЯ В: 3-(5-метил-1Н-пиррол-2-карбоксилат) 6-дезокси-5-С-метил-4-О-метил-L-ликсо-фенилметилгексопиранозида
Раствор, содержащий 60,2 г 2-метил-1Н-пиррола в 460 мл простого этилового эфира, добавляют в течение часа при 0-2oС в 248 мл трехмолярного раствора метилмагнийбромида в простом эфире. Реакционную смесь выдерживают при перемешивании при 0-2oС в течение 30 минут и в течение 15 минут добавляют 460 см3 толуола, освобожденного от тиофена. Перемешивают в течение 15 минут при 0±2oС и вводят в течение 45 минут раствор 91,3 г продукта, полученного на стадии Б, в 460 мл толуола, освобожденного от тиофена. Продолжают перемешивание при 0±2oС в течение 2 часов. Выливают в водный раствор хлорида аммония. Декантируют, экстрагируют этилацетатом, промывают, сушат, прополаскивают и доводят до сухого состояния при пониженном давлении. Получают 134,6 г продукта, который очищают хроматографически на диоксиде кремния, элюируя смесью метиленхлорид-ацетон (8:2), затем (9:1). Таким образом получают искомый продукт.
СТАДИЯ Г: 3-(5-метил-1Н-пиррол-2-карбоксилат) 6-дезокси-5-С-метил-4-О-метил-L-ликсо-гексопиранозы
В раствор, содержащий 72,4 г продукта, полученного на стадии В, и 1,45 л денатурированного этанола, добавляют 14,7 г 10% Pd на активированном угле. Выдерживают под давлением водорода в течение 1 часа при 60-62oС. Дают охладиться до комнатной температуры. Вновь добавляют 1,5 г 10% Pd на активированном угле. Перемешивают под давлением водорода в течение 1 часа. Возвращают температуру к 20-22oС. Обезвоживают, фильтруют, промывают, доводят до сухого состояния и получают 57 г искомого продукта.
СИНТЕЗ 2: 7-гидрокси-8-метил-4-(2-пропенилокси)-2Н-1-бензопиран-2-он
СТАДИЯ А: 1-[2-гидрокси-3-метил-4-[(тетрагидро-2Н-пиран-2-ил)окси]фенилэтанон
Смесь, содержащую 200 г 1-[2,4-дигидрокси-3-метил]фенилэтанона и 1,2 л простого этилового эфира, охлаждают до 8oС. Добавляют 200 мл дигидро-2Н-пирана и 1 г п-толуолсульфокислоты (ПТСК). Охлаждают до комнатной температуры. Осуществляют перемешивание в течение 3 часов и добавляют 253 мг ПТСК. Вливают полученный продукт в 400 мл одномолярного раствора вторичного фосфата калия. Декантируют, промывают водой и сушат. Испаряют и получают 302,5 г неочищенного искомого продукта, который очищают таким образом: растворяют продукт в 2 л метиленхлорида, промывают органическую фазу аммиаком, разбавленным в десять раз, затем пикельным раствором, сушат, фильтруют и испаряют досуха. Получают 272,55 г искомого продукта.
СТАДИЯ Б: 4-гидрокси-8-метил-7-[(тетрагидро-2Н-пиран-2-ил)окси]-2Н-1-бензопиран-2-он
Смесь, содержащую 750 мл толуола, 129,9 г продукта, полученного на стадии А, и 126 мл диэтилкарбоната в 620 мл толуола, нагревают до 90oС. Поддерживая температуру 90oС, добавляют 52 г 55% NaH в масле. Поддерживают при перемешивании при 90oС и дают охладиться до комнатной температуры. Добавляют 10 мл этилового спирта. Обезвоживают и промывают простым этиловым эфиром, затем обезвоживают. Приливают к 1 л одномолярного водного раствора вторичного фосфата натрия. Обезвоживают и промывают водой, ацетоном и простым эфиром. Получают продукт, который сушат при 50oС в присутствии P2О5. Получают 141,89 г искомого продукта.
СТАДИЯ В: 8-метил-4-(2-пропенилокси)-7-[(тетрагидро-2Н-пиран-2-ил)окси] -2Н-1-бензопиран-2-он
В смесь, содержащую 13,814 г продукта, полученного на предыдущей стадии, 4,07 мл аллилового спирта, 15,74 г трифенилфосфина и 150 мл дихлорметана, при 0oС добавляют 9,45 мл диэтилазокарбоксилата. Поддерживают при перемешивании в течение 15 минут при 0oС, затем в течение 2 часов при комнатной температуре. Вновь добавляют 5,25 г трифенилфосфина, 1,36 мл аллилового спирта и 3,15 мл диэтилазодикарбоксилата. Перемешивают 2 часа при комнатной температуре. Полученный продукт концентрируют и хроматографируют на диоксиде кремния, элюируя смесью гексан-этилацетат (3:1). Получают 7,85 г продукта.
СТАДИЯ Г: 7-гидрокси-8-метил-4-(2-пропенилокси)-2Н-1-бензопиран-2-он
При комнатной температуре в течение 6 часов перемешивают смесь, содержащую 7,80 г продукта, полученного на предыдущей стадии, в 150 мл тетрагидрофурана, в которую добавляют 100 мл раствора 1М НСl. Затем добавляют насыщенный раствор хлорида натрия и экстрагируют этилацетатом. Органическую фазу сушат на сульфате магния и концентрируют досуха. Сушат и получают 4,40 г искомого продукта. В смеси гексан-этилацетат (1:1). Rf=0,26.
ПРИМЕР 1: 3'-[5-метил-1Н-пиррол-2-карбоксилат] 7((6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси)-4-гидрокси-8-метил-3-((метилтио)ацетил)-2Н-1-бензопиран-2-она
СТАДИЯ А: 3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -8-метил-4-(2-пропенилокси)-2Н-1-бензопиран-2-она
Смешивают 5 г продукта синтеза 1, 4,65 г продукта синтеза 2 и 5,26 г трифенилфосфина и 500 мл дихлорметана. Добавляют 4 мл диизопропилазодикарбоксилата при 0oС. Перемешивают 1 час при комнатной температуре, добавляют 2,19 г трифенилфосфина и 1,65 мл диэтилазодикарбоксилата. Перемешивают 1 час при комнатной температуре и вновь добавляют 2,19 г трифенилфосфина и 1,65 мл диизопропилазодикарбоксилата. Промывают водным раствором первичного фосфата натрия и пикельным раствором. Сушат, фильтруют и концентрируют досуха. Хроматографируют на диоксиде кремния, элюируя смесью гексан-этилацетат (60:40). Получают, с одной стороны, 3,51 г продукта А, который измельчают в порошок в простом этиловом эфире. Центрифугируют, сушат и получают 3,0 г неочищенного искомого продукта.
С другой стороны, получают 3,24 г продукта Б, который хроматографируют на диоксиде кремния, элюируя смесью мети-ленхлорид-этилацетат 90:10, затем 80: 20, затем смесью метиленхлорид-этилацетат-тетрагидрофуран (70-20-10), и получают 0,88 г продукта, который при помощи ультразвука измельчают в порошок в простом этиловом эфире. Центрифугируют и получают неочищенный искомый продукт.
Соединяют оба количества неочищенного искомого продукта, измельчают их в порошок в простом этиловом эфире, центрифугируют и сушат. Получают 3,625 г искомого продукта.
СТАДИЯ Б: 3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-[(6-дезокси-5-С-метил-4-О-метил-2-О-(тетрагидро-2Н-пиран-2-ил)-альфа-L-ликсо-гексопиранозил)окси)-8-метил-4-(2-пропенилокси)-2Н-1-бензопиран-2-она
Смешивают 3,77 мл дигидро-(2Н)-пирана, 200 мг п-толуолсульфокислоты (ПТСК) и 11 г продукта, полученного на предыдущей стадии. Перемешивают при комнатной температуре в течение 2 часов. Обрабатывают реакционную среду насыщенным раствором бикарбоната натрия. Экстрагируют метиленхлоридом. Соединяют и сушат органические фазы. Растворитель испаряют досуха, остаток измельчают в порошок в смеси гексан-этилацетат (3:1). Центрифугируют, сушат и получают 8,40 г искомого продукта.
СТАДИЯ В: 3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-[(6-дезокси-5-С-метил-4-О-метил-2-О-(тетрагидро-2Н-пиран-2-ил)-альфа-L-ликсо-гексопиранозил)окси]-4-гидрокси-8-метил)-2Н-1-бензопиран-2-она
В раствор, содержащий 8,90 г продукта, полученного на предыдущей стадии, и 90 мл тетрагидрофурана, при 0oС добавляют 5,88 мл изопропиламина и 1,67 г тетракис-трифенилфосфинпалладия. Перемешивают реакционную смесь при 0oС в течение 20 минут и приливают ее к смеси 50 мл водного раствора бисульфата натрия и 100 мл смеси гексан-этилацетат (1:2). Водную фазу экстрагируют смесью гексан-этилацетат (1: 2). Соединяют органические фазы и сушат их. Испаряют растворители и очищают остаток хроматографически на диокиде кремния, элюируя смесью метиленхлорид-метанол (95:5). Получают 2,50 г искомого продукта. Rf=0,22, элюент - CH2Cl2-CH3OH (95:5).
СТАДИЯ Г: 3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-[(6-дезокси-5-С-метил-4-О-метил-2-О-(тетрагидро-2Н-пиран-2-ил)-альфа-L-ликсо-гексопиранозил)окси]-4-гидрокси-8-метил-3-[(метилтио)ацетил]-2Н-1-бензопиран-2-она
Готовят раствор, содержащий 400 мг продукта, полученного на предыдущей стадии, и 5 мл безводного дихлорметана. Добавляют 67 мкл 2-метилтиоуксусной кислоты, 280 мг 4-диметиламинопиридина и 147 мг хлоргидрата N-(3-диметиламинопропил)-N'-этилкарбодиимида. Перемешивают в течение 18 часов при комнатной температуре. Разбавляют 100 мл этилацетата. Промывают водным раствором бисульфата натрия, водой и пикельным раствором. Сушат, фильтруют и концентрируют досуха. Получают 401 мг продукта, который очищают хроматографически, элюируя смесью хлороформ-метанол (98:2). Сушат и получают 324 мг искомого продукта. Rf=0,68, элюент - метиленхлорид-метанол (95:5).
СТАДИЯ Д: 3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокси-8-метил-3-((метилтио)ацетил)-2Н-1-бензопиран-2-она
В раствор, содержащий 293 мг продукта, полученного на предыдущей стадии, и 10 мл метанола, добавляют 60 мг п-толуолсульфокислоты (ПТСК), перемешивают в течение 5 часов при комнатной температуре. Разбавляют реакционную среду смесью этилацетат-гексан (67:33) и промывают разбавленным раствором бикарбоната натрия. Прополаскивают водой, затем пикельным раствором. Сушат и испаряют досуха. Получают 227 мг продукта, который хроматографируют на диоксиде кремния, элюируя смесью хлороформ-метанол (93:7). Собирают 171 мг неочищенного искомого продукта, который хроматографируют на диоксиде кремния, элюируя смесью хлороформ-метанол (94:6). Выделяют таким образом искомый продукт. Rf= 0,42, элюент - хлороформ-метанол (94:6).
Спектр ЯМР на протонах (300 МГц, ДМСО-d6, м.д.) δ: 1,06 (с, 3Н), 1,31 (с, 3Н), 2,11 (с, 3Н), 2,23 (с, 3Н), 2,25 (с, 3Н), 3,47 (с, 3Н), 3,66 (д, 1Н, J=10,0 Гц), 3,92 (АВ, 2Н, J=14,0 Гц), 4,19 (с, 1Н), 5,48 (дд, 1Н, J=3,0 и 10,0 Гц), 5,70(д, 1Н, J=2,5 Гц), 5,74(м, 1Н), 5,93 (м, 1Н), 6,79(м, 1Н), 7,26(д, 1Н, J=9,0 Гц), 7,94(д, 1Н, J=9,0 Гц), 11,66 (ш.с, 1Н).
ПРИМЕР 2: 3' - [5-метил-1Н-пиррол-2-карбоксилат] 7-((6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси)-3-(этоксиацетил)-4-гидрокси-8-метил-2Н-1-бензопиран-2-она
СТАДИЯ А: 3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-[(6-дезокси-5-С-метил-4-О-метил-2-О-(тетрагидро-2Н-пиран-2-ил)-альфа-L-ликсо-гексопиранозил)-окси]-3-(этоксиацетил)-4-гидрокси-8-метил-2Н-1-бензопиран-2-она
В раствор, содержащий 300 мг продукта, полученного на стадии В предыдущего примера, 210 мг 4-диметиламинопиридина (ДМАП) и 110 мг хлоргидрата N-(3-диметиламинопропил)-N'-этилкарбодиимида, добавляют 55 мкл 2-этоксиуксусной кислоты. Перемешивают 18 часов при комнатной температуре. Разбавляют реакционную среду 100 мл этилацетата. Промывают 10%-ным водным раствором бисульфата натрия, водой, затем пикельным раствором. Органическую фазу сушат, фильтруют и концентрируют. Получают 362 мг продукта, который очищают хроматографически на диоксиде кремния, элюируя смесью метиленхлорид-метанол (97,5: 2,5). Растворители испаряют и сушат полученный продукт при пониженном давлении. Таким образом получают 265 мг искомого продукта. Rf=0,30, элюент - метиленхлорид-метанол (95:5).
СТАДИЯ Б: 3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-((6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси)-3-(этоксиацетил)-4-гидрокси-8-метил-2Н-1-бензопиран-2-она
В раствор, содержащий 245 мг продукта, полученного на стадии А, и 10 мл метанола, добавляют 50 мг п-толуолсульфокислоты. Перемешивают 5 часов при комнатной температуре. Разбавляют смесью этилацетат-гексан и промывают разбавленным раствором бикарбоната натрия. Промывают водой, пикельным раствором, сушат и испаряют досуха. Получают 163 мг продукта, который хроматографируют на диоксиде кремния, элюируя смесью метиленхлорид-метанол (92: 8). Получают 116 мг продукта. Rf=0,20, элюент - хлороформ-метанол (94:6).
Спектр ЯМР на протонах (300 МГц, ДМСО-d6, м.д.) δ: 1,07 (с, 3Н), 1,17 (т, 3Н, J=7,0 Гц), 1,30 (с, 3Н), 2,22 (с, 3Н), 2,26 (с, 3Н), 3,56 (к, 2Н, J= 7,0 Гц), 3,66 (д, 1Н, J=10,0 Гц), 4,18(м, 1Н), 4,71(ш.с, 2Н), 5,48(дд, 1Н, J= 3,0 и 10,0 Гц), 5,66(ш. с, 1Н), 5,72(д, 1Н, J=5,0 Гц), 5,93 (м, 1Н), 6,78(м, 1Н), 7,21(д, 1Н, J=9,0 Гц), 7,90(д, 1Н, J=9,0 Гц), 11,65 (ш.с, 1Н), 15,25(оч.ш, 1Н).
ПРИМЕР 3: (Z)-3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-((6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси)-4-гидрокси-3-(1-гидрокси-2-(2-пиридинил)этенил)-8-метил-2Н-1-бензопиран-2-она
СТАДИЯ А: (Z)-3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-[(6-дезокси-5-С-метил-4-О-метил-2-О-(тетрагидро-2Н-пиран-2-ил)-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокси-3-(1-гидрокси-2-(2-пиридинил)этенил)-8-метил-2Н-1-бензопиран-2-она
Действуя, как на стадии А предыдущего примера, исходя из 300 мг продукта стадии В примера 1 и 100 мг хлоргидрата 2-пиридилуксусной кислоты, получают 135 мг искомого продукта. Rf= 0,64 элюент - СН2Сl2-ТГФ (50:50); Rf=0,45 элюент - СН2Сl2-СН3ОН (94:6).
СТАДИЯ Б: (Z)-3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-((6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси)-4-гидрокси-3-(1-гидрокси-2-(2-пиридинил)этенил)-8-метил-2Н-1-бензопиран-2-она
Действуют, как на последней стадии примера 1, и получают 29 мг искомого продукта, исходя из 135 мг продукта, полученного на стадии A. Rf=0,34, элюент - CH2Cl2-CH3OH (94-6).
Спектр ЯМР на протонах (300 МГц, ДМСО-d6, м.д.) δ: 1,09(с, 3Н), 1,30(с, 3Н), 2,23(с, 3Н), 2,25(с, 3Н), 3,48 (с, 3Н), 3,66(д, 1Н, J=10,0 Гц), 4,16(м, 1Н), 5,49(дд, 1Н, J= 3,0 и 10,0 Гц), 5,60(д, 1Н, J=2,0 Гц), 5,93 (м, 1Н), 6,78(м, 1Н), 6,82 (с, 1Н), 7,08(дд, 1Н, J=5,0 и 7,5 Гц), 7,12(д, 1H, J=9,0 Гц), 7,62(ш. д, 1H, J=8,0 Гц), 7,80(д, 1Н, J=9,0 Гц), 7,94 (дд, 1H, J=7,5 и 8,0 Гц), 8,16(д, 1H, J=5,0 Гц), 11,65 (ш.с, 1H), 13,04(м, 1H), 13,81(м, 1H).
СИНТЕЗ 3: 7-гидрокси-8-метил-2-оксо-4-(фенилметокси)-2Н-1-бензопиран-3-этилкарбоксилат
СТАДИЯ А: 4-гидрокси-8-метил-2-оксо-7-[(тетрагидро-2Н-пиран-2-ил)окси] -2Н-1-бензопиран-3-этилкарбоксилат
В смесь, состоящую из 1,2 л метиленхлорида и 120,65 г продукта, полученного на стадии Б синтеза 2, добавляют 106,7 г ДМАП. Охлаждают полученную смесь в ванне со льдом и в течение 50 минут вводят 57,1 мл этилового эфира хлоругольной кислоты, сохраняя температуру ниже 5oС. Вновь добавляют 26,6 г ДМАП и 21 мл этилового эфира хлоругольной кислоты, затем вновь 21,3 г ДМАП и 8,4 мл этилового эфира хлоругольной кислоты. Реакционную среду приливают к 1 л одномолярного водного раствора вторичного фосфата натрия (1М NaHPО4), затем добавляют порошкообразный вторичный фосфат натрия, чтобы получить значение рН, равное 6. Водную фазу экстрагируют метиленхлоридом. Соединяют органические фазы и промывают их раствором I н. HCl. Промывают водой, декантируют, сушат, фильтруют и доводят до сухого состояния. Получают 144,63 г искомого продукта.
СТАДИЯ Б: 8-метил-2-оксо-4-(фенилметокси)-7-[(тетрагидро-2Н-пиран-2-ил)окси]-2Н-1-бензопиран-3-этилкарбоксилат
В раствор, содержащий 1,2 л метиленхлорида, 120,90 г продукта, полученного на предыдущей стадии, 54 мл бензилового спирта и 109,1 г трифенилфосфина, при 0oС в течение 1 часа 30 минут вводят 76 мл диалкилазодикарбоксилата (ДЭАД). Фильтруют и приливают фильтрат к 500 мл одномолярного раствора вторичного фосфата натрия. Экстрагируют метиленхлоридом, промывают, сушат, фильтруют и доводят до сухого состояния. Получают 355,5 г продукта, который обрабатывают метиленхлоридом. Выдерживают реакционную смесь в течение ночи в холодильнике. Фильтруют, испаряют фильтрат и сушат его. Получают 324,7 г продукта, который обрабатывают простым изопропиловым эфиром, перемешивают, фильтруют, промывают простым эфиром и сушат. Испаряют при пониженном давлении и получают 251 г неочищенного продукта, который очищают хроматографически на диоксиде кремния, элюируя метиленхлоридом, затем смесью метиленхлорид-этилацетат (90:10). Таким образом получают искомый продукт.
СТАДИЯ В: 7-гидрокси-8-метил-2-оксо-4-(фенилметокси)-2Н-1-бензопиран-3-этилкарбоксилат
В раствор, содержащий 90 г продукта, полученного на предыдущей стадии, и 2 л ТГФ, вводят 1 л раствора I н. HCl. Перемешивают в течение 4 часов при комнатной температуре. Добавляют 2 л метиленхлорида, промывают 10%-ным водным раствором бикарбоната натрия, затем соляным раствором. Сушат и испаряют досуха. Размешивают продукт в простом эфире, центрифугируют, промывают и сушат при пониженном давлении. Получают 59,8 г искомого продукта. Rf=0,15, элюент - CH2Cl2-CH3CO2Et (95 : 5).
Спектр ЯМР (ДМСО):
Н в положении 6 - 6,89 м.д.
Н ОН-группы - 10,71 (с) м.д.
Н метоксигруппы - 5,29 (с) м.д.
Н группы 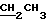 - 4,33 (а)
- 4,33 (а)
Н группы 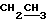 - 1,29 (т)
- 1,29 (т)
Н метильной группы в положении 8 - 2,16 (с) м.д.
ПРИМЕР 4: 3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-((6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси) -4-гидрокси-8-метил-2-оксо-2Н-1-бензопиран-3-этилкарбоксилата
СТАДИЯ А: 3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-((6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -8-метил-2-оксо-4-(фенилметокси)- 2Н-1-бензопиран-3-этилкарбоксилата
Действуя, как в примере 1 на стадии А, исходя из продуктов синтезов 1 и 3 получают искомый продукт. Rf=0,55, элюент - простой этиловый эфир-гексан (1:2).
СТАДИЯ Б: 3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-((6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси)-4-гидрокси-8-метил-2-оксо-2Н-1-бензопиран-3-этилкарбоксилата
В раствор, содержащий 330 мг продукта, полученного на стадии А, и 10 мл абсолютного этилового спирта, добавляют 35 мг 10% Pd на угле. Перемешивают смесь в течение 5 часов при комнатной температуре при небольшом давлении водорода. Фильтруют, испаряют этанол досуха, остаток в присутствии простого изопропилового эфира измельчают в порошок при помощи ультразвука. Центрифугируют и сушат. Получают 189,4 г искомого продукта. Rf=0,43, элюент - СН2Сl2-СН3ОН (91:9).
Спектр ЯМР на протонах (300 МГц, ДМСО-d6, м.д.) δ: 1,07(с, 3Н), 1,30(с, 3Н), 1,32(т, 3Н, J= 7,0 Гц), 2,22 (с, 3Н), 2,25 (с, 3Н), 3,48 (с, 3Н), 3,66(д, 1Н, J=10,0 Гц), 4,18(ш.с, 1Н), 4,37 (к, 2Н, J=7,0 Гц), 5,48(дд, 1Н, J= 3,0 и 10,0Гц), 5,66(д, 1Н, J=2,0Гц), 5,73(ш.с., 1Н), 5,93 (т, 1Н, J=3,0 Гц), 6,78 (т, 1Н, J=3,0 Гц), 7,23(д, 1Н, J=9,0 Гц), 7,86(д, 1Н, J=9,0Гц), 11,66(ш.с, 1Н).
ПРИМЕР 5: 3' - [5-метил-1H-пиррол-2-карбоксилат] 3-ацетил-7-((6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси)-4-гидрокси-8-метил-2Н-1-бензопиран-2-она
СТАДИЯ А: 7-((6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси)-8-метил-2-оксо-4-(фенилметокси)-2Н-1-бензопиран-3-этилкарбоксилат
В раствор, содержащий 1 г продукта, полученного на стадии В примера 1, 764 мг 4-диметиламинопиридина, 433 мг хлоргидрата N-(3-диметиламинопропил)-N'-этилкарбодиимида и 20 мл дихлорметана, добавляют 136 мкл уксусной кислоты. Перемешивают реакционную смесь в течение 16 часов при комнатной температуре и разбавляют дихлорметаном. Промывают полученный раствор 10%-ным водным раствором кислого сульфата натрия. Сушат, фильтруют и концентрируют досуха. Реакционную смесь измельчают в порошок в смеси гексан-этилацетат (2-1). Центрифугируют и сушат. Получают 634 мг искомого продукта. Rf=0,63, элюент - СН2Сl2 - СН3ОН (94:6).
СТАДИЯ Б: 3'-[5-метил-1Н-пиррол-2-карбоксилат] 3-ацетил-7-((6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гекопиранозил)окси)-4-гидрокси-8-метил-2Н-1-бензопиран-2-она
В раствор, содержащий 568,4 г продукта, полученного на стадии А, 20 мл метанола и 15 мл дихлорметана, добавляют 80 мг п-толуолсульфокислоты. Перемешивают при комнатной температуре в течение 4 часов. Приливают реакционную смесь к смеси дихлорметана и насыщенного водного раствора бикарбоната натрия. Водную фазу экстрагируют дихлорметаном. Сушат, фильтруют и концентрируют досуха при пониженном давлении. Получают 254 мг искомого продукта. Rf= 0,39, элюент - СН2Сl2-СН3ОН (94:6).
Спектр ЯМР на протонах (300 МГц, ДМСО-d6, м.д.) δ: 1,06(с, 3Н), 1,30(с, 3Н), 2,22(с, 3Н), 2,24(с, 3Н), 2,66 (с, 3Н), 3,47 (с, 3Н), 3,66(д, 1Н, J=9,5 Гц), 4,18 (ш.с, 1Н), 5,48(дд, 1Н, J=3,0 и 9,5 Гц), 5,69 (д, 1Н, J=2,5 Гц), 5,75(д, 1Н, J= 5,0 Гц), 5,93(т, 1Н, J=3,0 Гц), 6,79 (т, 1Н, J=3,0 Гц), 7,25(д, 1Н, J= 8,5 Гц), 7,92(д, 1Н, J=8,0 Гц), 11,66 (ш.с, 1Н), 15,44(ш.с, 1Н).
СИНТЕЗ 4: 7-гидрокси-8-метил-2-оксо-4-(фенилметокси)-2Н-1-бензопиран-3-(2-метилпропил)карбоксилат
СТАДИЯ А: [8-метил-2-оксо-7-[(тетрагидро-2Н-пиран-2-ил)окси]-2Н-1-бензопиран-4-ил]-2-(метилпропил)карбонат
В раствор, содержащий 6,907 г продукта стадии Б синтеза 2 и 40 мл тетрагидрофурана, добавляют 6,96 мл триэтиламина, затем 3,57 мл изобутилового эфира хлоругольной кислоты. Перемешивают в течение 1 часа при комнатной температуре, разбавляют тетрагидрофураном и промывают 10%-ным водным раствором бисульфата натрия. Сушат и концентрируют досуха. При помощи ультразвука измельчают в порошок в присутствии смеси гексан-этилацетат (2-1). Центрифугируют и сушат. Получают 7,475 г продукта. Rf=0,74, элюент - СН2Cl2 - СН3ОН (94:6).
СТАДИЯ Б: 4-гидрокси-8-метил-2-оксо-7-[(тетрагидро-2Н-пиран-2-ил)окси] -2Н-1-бензопиран-3-(2-метилпропил)карбоксилат
В раствор, содержащий 7,30 г продукта, полученного на стадии А, добавляют 2,37 г ДМАП. Перемешивают 5 часов при комнатной температуре. Разбавляют реакционную смесь метиленхлоридом и промывают ее 10%-ным водным раствором бисульфата натрия, сушат и концентрируют при пониженном давлении. Полученный продукт хроматографируют на диоксиде кремния, элюируя смесью гексан-этилацетат (1:1). Испаряют растворители и сушат. Получают 3 г искомого продукта. Rf=0,38, элюент - гексан-этилацетат (1:1).
СТАДИЯ В: 8-метил-2-оксо-4-(фенилметокси)-7-[(тетрагидро-2Н-пиран-2-ил)окси]-2Н-1-бензопиран-3-(2-метилпропил)карбоксилат
В смесь, содержащую 2,80 г продукта, полученного на предыдущей стадии, 928 мкл бензилового спирта и 2,34 г трифенилфосфина, при 0oС добавляют 1,422 мл диэтилазодикарбоксилата. Перемешивают 2 часа при комнатной температуре. Добавляют 976 мг трифенилфосфина и 585 мкл диэтилазодикарбоксилата и перемешивают 2 часа при комнатной температуре. Концентрируют, хроматографируют на диоксиде кремния, элюируя смесью гексан-этилацетат (2:1). Испаряют растворители и сушат. Получают 2,18 г искомого продукта. Rf=0,25, элюент - гексан-этилацетат (2:1).
СТАДИЯ Г: 7-гидрокси-8-метил-2-оксо-4-(фенилметокси)-2Н-1-бензопиран-3-(2-метилпропил)карбоксилат
В раствор, содержащий 2,00 г продукта, полученного на предыдущей стадии, и 70 мл тетрагидрофурана, добавляют 35 мл одномолярного водного раствора соляной кислоты. Перемешивают 7 часов при комнатной температуре. Разбавляют смесью гексан-этилацетат (1:1). Разделяют фазы и экстрагируют водную фазу
смесью гексан-этилацетат (1:1). Соединяют органические фазы, промывают их одномолярным раствором первичного фосфата натрия и сушат их. Концентрируют досуха. Остаток измельчают при помощи ультразвука в смеси гексан-этилацетат (4: 1). Центрифугируют, сушат и собирают 1,27 г продукта. Rf=0,64, элюент - - метиленхлорид-метанол (94:6).
ПРИМЕР 6: 3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокси-8-метил-2-оксо-2Н-1-бензопиран-3-(2-мeтилпpoпил)карбоксилата
СТАДИЯ А: 3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -8-метил-2-оксо-4-(фенилметокси)-2Н-1-бензопиран-3-(2-метилпропил)карбоксилата
Действуя, как в примере 1, стадия А, исходя из продукта синтеза 4 и продукта синтеза 1 получают искомый продукт.
СТАДИЯ Б: 3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокси-8-метил-2-оксо-2Н-1-бензопиран-3-(2-метилпропил)карбоксилата
В раствор, содержащий 430 мг продукта, полученного на стадии А, 4 мл этанола и 3 мл тетрагидрофурана, добавляют 50 мг 10% Pd на угле. Перемешивают в течение 3 часов в атмосфере водорода и фильтруют. Испаряют растворитель досуха. Остаток измельчают при помощи ультразвука в присутствии простого изопропилового эфира и центрифугируют. Сушат продукт и получают таким образом 279 мг искомого продукта.
Спектр ЯМР на протонах (300 МГц, ДМСО-d6, м.д.) δ: 0,94(д, 6Н, J=6,5 Гц), 1,10 (с, 3Н), 1,29 (с, 3Н), 1,92 (м, 2Н), 2,17(с, 3Н), 2,25(с, 3Н), 3,47 (с, 3Н), 3,64 (д, 1Н, J=10,0 Гц), 3,89(д, 2Н, J=6,5 Гц), 4,15(м, 1Н), 5,48(дд, 1Н, J= 3,0 и 10,0 Гц), 5,54(ш.с, 1Н), 5,64 (д, 1Н, J=5,0 Гц), 5,92(м, 1Н), 6,77(м, 1Н), 6,99 (д, 1Н, J=9,0 Гц), 7,76(д, 1Н, J=9,0 Гц), 11,66(ш.с, 1Н).
ПРИМЕР 7: 7- ((3-О-(аминокарбонил) -6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси)-4-гидрокси-8-метил-2Н-1-бензопиран-3-(2-метил-пропил) карбоксилат
СТАДИЯ А: 7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -8-метил-2-оксо-4-(фенилметокси)-2Н-1-бензопиран-3-(2-метилпропил)карбоксилат
Действуя, как в примере 1 на стадии А, исходя из 6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозы и 2-метилпропилового эфира 7-гидрокси-8-метил-2-оксо-4-(фенилметокси)-2Н-1-бензопиран-3-карбоновой кислоты получают искомый продукт. Rf=0,22, элюент - гексан-этилацетат (1:2).
СТАДИЯ Б: 7-[(2,3-О-карбонил-6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -8-метил-2-оксо-4-(фенилметокси)-2Н-1-бензопиран-3-(2-метилпропил)карбоксилат
В колбу с обратным холодильником помещают раствор, содержащий 700 мг продукта, полученного на стадии А, 408 мг карбонилдиимидазола и 10 мл ТГФ. Раствор кипятят в колбе с обратным холодильником в течение 30 минут и разбавляют 50 мл смеси гексан-этилацетат (1:2). Промывают одномолярным водным раствором первичного фосфата натрия. Сушат, фильтруют и концентрируют досуха. Хроматографируют полученный продукт, элюируя смесью гексан-этилацетат (1: 1). Получают 530 мг искомого продукта. Rf=0,63, элюент - гексан-этилацетат (1:2).
СТАДИЯ В: 7-[(2,3-О-карбонил-6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокси-8-метил-2-оксо-2Н-1-бензопиран-3-(2-метилпропил)карбоксилат
В атмосфере водорода при комнатной температуре в течение часа перемешивают смесь, содержащую 4 мл этанола, 2 мл ТГФ и 300 мг продукта, полученного на предыдущей стадии. Фильтруют, прополаскивают катализатор ТГФ, выпаривают полученный продукт досуха, измельчают при помощи ультразвука в присутствии простого этилового эфира. Центрифугируют и сушат. Получают 180 мг продукта. Rf=0,52, элюент - гексан-этилацетат (1:1).
СТАДИЯ Г: 7-((3-О-(аминокарбонил)-6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси)-4 -гидрокси-8-метил-2Н-1-бензопиран-3-(2-метилпропил)карбоксилат
В раствор, содержащий 506 мг продукта, полученного на стадии В, и 3 мл ТГФ, добавляют 15 мл жидкого аммиака. Дают аммиаку испариться. Растворяют в смеси ТГФ-этилацетат-гексан (5: 3: 2). Промывают 10%-ным водным раствором бисульфата натрия, сушат и концентрируют досуха, остаток измельчают при помощи ультразвука в присутствии простого изопропилового эфира. Центрифугируют и сушат. Получают 310 мг искомого продукта. Rf=0,25, элюент - СН2Сl2 - СН3ОН (91:9).
Спектр ЯМР на протонах (400 МГц, ДМСО-d6, м.д.) δ: 0,98(д, 6Н, J=6,5 Гц), 1,02 (с, 3Н), 1,27 (с, 3Н), 2,01 (м, 1Н), 2,18 (с, 3Н), 3,46 (с, 3Н), 3,47(д, 1Н, J=10,0 Гц), 3,47(с, 1Н), 4,08(ш.т, 1Н, J=2,5 Гц), 4,11(д, 2Н, J= 6, 5 Гц), 5,14(дд, 1Н, J=5,0 и 10,3 Гц), 5,57 (д, 1Н, J=2, 5 Гц), 5,63(с, 1Н), 6,61(ш.с, 2Н), 7,19(д, 1Н, J=9,0 Гц), 7,84(д, 1Н, J=9,0 Гц).
СИНТЕЗ 5: (E)-3-[1-((2-бромэтокси)имино)этил]-7-гидрокси-8-метил-4-(2-пропенилокси)-2Н-1-бензопиран-2-он
СТАДИЯ А: (E)-3-[1-((2-бромэтокси)имино)этил] -4-гидрокси-3-метил-7-[(тетрагидро-2Н-пиран-2-ил)окси]-2Н-1-бензопиран-2-он
В колбе с обратным холодильником в течение 1 часа нагревают смесь 3,183 г продукта, полученного на стадии А синтеза 7, 4,118 г бромгидрата бромэтил-О-гидроксиламина и 2,94 г ацетата калия в 20 см3 этанола. Выпаривают этанол и растворяют остаток в 100 мл дихлорметана в присутствии 50 мл водного раствора первичного фосфата натрия. Сушат, выпаривают метиленхлорид, хроматографируют остаток на диоксиде кремния, элюируя смесью гексан-этилацетат (2: 1). Выпаривают растворители и сушат. Получают 2,00 г продукта. Rf=0,57, элюент - CH2Cl2 - CH3OH (94:6).
СТАДИЯ Б: (E)-3-[1-((2-бромэтокси)имино)этил]-7-гидрокси-8-метил-4-(2-пропенилокси)-2Н-1-бензопиран-2-он
В раствор, содержащий 1,96 г продукта, полученного на предыдущей стадии, 360 мкл аллилового спирта, 1,401 г трифенилфосфина и 30 мл дихлорметана, при 0oС добавляют 914 мкл диэтилазодикарбоксилата. Перемешивают 2 часа при комнатной температуре, добавляют при 0oС 180 мкл аллилового спирта, 700 мг трифенилфосфина и 457 мкл диэтилазодикарбоксилата. Перемешивают в течение еще 2 часов при комнатной температуре, концентрируют и хроматографируют на диоксиде кремния, элюируя смесью гексан-этилацетат (4:1). Получают 2,0 г продукта, который вливают в 40 мл тетрагидрофурана. Добавляют 20 мл одномолярного водного раствора соляной кислоты и перемешивают 2 часа при комнатной температуре. Разбавляют 30 мл смеси гексан-этилацетат (1:2). Соединяют органические фазы, промывают их водным раствором первичного фосфата натрия, сушат, фильтруют и концентрируют. Измельчают при помощи ультразвука в присутствии смеси гексан-этилацетат (3:1). Фильтруют и сушат. Получают 1,17 г искомого продукта. Rf=0,25, элюент - гексан-этилацетат (4:1).
ПРИМЕР 8: (E)-3'-[5-метил-1Н-пиррол-2-карбоксилат] 3-[1-[(2-бромэтокси)имино] этил] -7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси]-4-гидрокси-8-метил-2Н-1-бензопиран-2-она
СТАДИЯ А: (E)-3'-[5-метил-1Н-пиррол-2-карбоксилат] 3-[1-[(2-бромэтокси)имино] этил] -7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси]-8-метил-4-(2-пропенилокси)-2Н-1-бензопиран-2-она
В смесь, содержащую 1,12 г продукта, полученного на стадии А синтеза 5, 1,015 г продукта синтеза 1, 890 г трифенилфосфина и 15 мл дихлорметана, при 0oС по каплям добавляют 580 мкл диэтилазодикарбоксилата. Перемешивают в течение 2 часов при комнатной температуре и добавляют 450 мг трифенилфосфина и 295 мкл диэтилазодикарбоксилата. Перемешивают в течение 1 часа и вновь добавляют 300 мг трифенилфосфина и 196 мкл диэтилазодикарбоксилата. Перемешивают 1 час и концентрируют, два раза хроматографируют на диоксиде кремния, элюируя смесью гексан-этилацетат (2: 1). Выпаривают растворители и сушат. Получают 862 мг искомого продукта.
СТАДИЯ Б: (E)-3'-[5-метил-1Н-пиррол-2-карбоксилат] 3-[1-[(2-бромэтокси)имино] этил] -7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси]-4-гидрокси-8-метил-2Н-1-бензопиран-2-она
Продукт получают исходя из продукта, полученного на предыдущей стадии, действуя, как на стадии В примера 1. Rf=0,28, элюент - простой этиловый эфир-гексан (2:1).
Спектр ЯМР на протонах (300 МГц, ДМСО-d6, м.д.) δ: 1,08(с, Н), 1,30(с, 3Н), 2,24(с, 3Н), 2,25(с, 3Н), 2,28 (с, 3Н), 3,47 (с, 3Н), 3,65(д, 1Н, J=9, 5 Гц), 3,74 (т, 2Н, J=5,5Гц), 4,17(м, 1Н), 4,48 (т, 2Н, J=5,5 Гц), 5,48 (дд, 1Н, J= 3,0 и 9,5 Гц), 5,64(д, 1Н, J=2,5 Гц), 5,71(м, 1Н), 5,93 (м, 1Н), 6,78(м, 1Н), 7,21(д, 1Н, J=9,0 Гц), 7,81(д, 1Н, J=9,0Гц), 11,66(ш.с, 1Н), 13,14(ш.м, 1Н).
ПРИМЕР 9: (E)-3' - [5-метил-1Н-пиррол-2-карбоксилат] 7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликcо-гекcопиранозил) окси]-3-(1-(2-(диметиламино)этокси)имино)этил-4-гидрокси-8-метил-2Н-1-бензопиран-2-она
К раствору, содержащему 150 мг продукта примера 8 в 2 мл безводного ДМФ, добавляют 10 мг иодида тетрабутиламмония, затем раствор 53 мг 4-диметиламина в 1 мл ДМФ. Перемешивают реакционную смесь в течение 4 часов при комнатной температуре. Приливают к смеси 50 мл ТГФ-этилацетат-гексан (2:2:1) и 50 мл воды. Экстрагируют водную фазу, промывают органические фазы, сушат и концентрируют до сухого состояния. Измельчают при помощи ультразвука в присутствии простого изопропилового эфира. Центрифугируют и сушат, получая 55 мг искомого продукта. Rf=0,10, элюент - СН2Сl2 - СН3ОН (91:9).
Спектр ЯМР на протонах (300 МГц, ДМСО-d6, м.д.) δ: 1,09(с, 3Н), 1,29(с, 3Н), 2,06(с, 3Н), 2,25(с, 3Н), 2,19(с, 3Н), 2,86(с, 6Н), 3,36 (ш, 2Н), 3,47(с, 3Н), 3,64 (д, 1Н, J=9,5 Гц), 4,15(м, 1Н), 4,34(ш, 2Н), 5,48(дд, 1Н, J= 2,5 и 9,5Гц), 5,63(ш, 1Н), 5,93(ш, 1Н), 6,78(ш, 1Н), 7,00(ш.м, 1Н), 7,75(ш.м, 1Н).
ПРИМЕРЫ 10, 11, 12, 13.
Действуя, как в примере 9, получают следующие продукты.
(E)-3'-[5-Метил-1Н-пиррол-2-карбоксилат] 7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокси] -8-метил-3-(1-((2-(4-морфолинил)этокси)имино)этил)-2Н-1-бензопиран-2-она. Rf= 0,33, элюент - СН2Сl2 - СН3ОН (91-9).
Спектр ЯМР на протонах (300 МГц, ДМСО-d6, м.д.) δ: 1,10(с, 3Н), 1,30(с, 3Н), 2,03(с, 3Н), 2,19(с, 3Н), 2,22(с, 3Н), 3,25-3,42(ш, 4Н), 3,47(с, 3Н), 3,63 (д, 1Н, J=9,5Гц), 4,02(ш, 6Н), 4,14(ш.с, 1Н), 4,34(ш, 2Н), 5,48 (дд, 1Н, J=3,0 и 9,5 Гц), 5,54(д, 1Н, J=2,0 Гц), 5,64 (д, 1Н, J=4,5 Гц), 5,93 (т, 1Н, J=3,0 Гц), 6,77 (т, 1Н, J=3,0 Гц), 7,03 (д, 1Н, J=8,5Гц), 7,75(д, 1Н, J= 8,5Гц), 11,66(ш.с, 1Н).
(E)-3'-[5-Метил-1Н-пиррол-2-карбоксилат] 7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокси-3-[1-[[2-(4-гидрокси-1-пиперидинил)этокси] имино] этил] -8-метил-2Н-1-бензопиран-2-она. Rf=0,05, элюент - СН2Сl2 - СН3ОН (94:6).
Спектр ЯМР на протонах (300 МГц, ДMCO-d6, м.д.) δ: 1,10(с, 3Н), 1,30(с, 3Н), 1,70-2,25(м, 4Н), 2,02(с, 3Н), 2,19(с, 3Н), 2,24(с, 3Н), 3,34 (м, 6Н), 3,47 (с, Н), 3,63(д, 1Н, J=9,5Гц), 3,87(ш.с, 1Н), 4,13(м, 1Н), 4,34(ш.с, 2Н), 5,00(с, 1Н), 5,48(дд, 1Н, J= 3,0 и 9,5 Гц), 5,53(д, 1Н, J=2,0 Гц), 5,63(д, 1Н, J= 5,0 Гц), 5,92 (т, 1Н, J=3,0 Гц), 6,78 (т, 1Н, J=3,0 Гц), 6,98(д, 1Н, J=9,0 Гц), 7,71(д, 1Н, J=9,0Гц), 11,66(ш.с, 1Н).
(E)-3'-[5-Метил-1Н-пиррол-2-карбоксилат] 7-((6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокси-3-[1-[[2-[(1Н-имидазол-2-ил)тио] этокси] имино] этил] -8-метил-2Н-1-бензопиран-2-она. Rf=0,20, СН2Сl2 - СН3ОН (94:6).
Спектр ЯМР на протонах (300 МГц, ДМСО-d6, м.д.) δ: 1,09(с, 3Н), 1,30(с, 3Н), 2,23(с, 3Н), 2,25(с, 3Н), 3,38 (м, 2Н), 3,48 (с, 3Н), 3,66(д, 1Н, J=9,5 Гц), 4,17(дд, 1Н, J=2,0 и 3,0 Гц), 4,37 (т, 2Н, J=5,5 Гц), 5,48(дд, 1Н, J= 3,0 и 9,5 Гц), 5,62(д, 1Н, J=2,0 Гц), 5,93 (т, 1Н, J=3,0 Гц), 6,78(т, 1Н, J= 3,0 Гц), 7,16(д, 1Н, J=9,0 Гц), 7,21(с, 2Н), 7,82(д, 1Н, J=9,0Гц), 11,66 (с, 1Н).
(E)-3'-[5-Метил-1Н-пиррол-2-карбоксилат] 7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокси-8-метил-3-[l-[2-(1Н-1,2,4-триазол-1-ил)этокси]имино]этил]-2Н-1-бензопиран-2-она. Rf=0,36, элюент - СН2Сl2 - СН3ОН (91:9).
Спектр ЯМР на протонах (300 МГц, ДМСО-d6, м.д.) δ: 1,07(с, 3Н), 1,30(с, 3Н), 2,14(с, 3Н), 2,25(с, 3Н), 3,47 (с, 3Н), 3,66(д, 1Н, J=9,5 Гц), 4,17 (с, 1Н), 4,51(м, 4Н), 5,48(дд, 1Н, J=2,5 и 9,5 Гц), 5,64 (д, 1Н, J=2,0 Гц), 5,72(ш, 1Н), 5,93(ш.с., 1Н), 6,78(т, 1Н, J=3,0 Гц), 7,21(д, 1Н, J=9,0 Гц), 7,81(д, 1Н, J=9,0 Гц), 8,01 (с, 1Н), 8,54 (с, 1Н), 11,66(ш, 1Н).
СИНТЕЗ 6: (E)-3-[2-этокси-1-(метоксиимино)этил]-7-гидрокси-8-метил-4-(2-пропенилокси)-2Н-1-бензопиран-2-он
СТАДИЯ А: (E)-3-(этоксиацетил)-4-гидрокси-8-метил-7-[(тетрагидро-2Н-пиран-2-ил)окси]-2Н-1-бензопиран-2-он
В раствор, содержащий 5,00 г 4-гидрокси-8-метил-7-[(тетрагидро-2Н-пиран-2-ил)окси] -2Н-бензопиран-2-она, 7,30 г 4-диметиламинопиридина и 3,816 г хлоргидрата N-(3-диметиламинопропил)-N'-этилкарбодиимида, прибавляют 2,21 мл этоксиуксусной кислоты. Перемешивают эту смесь в течение 16 часов при комнатной температуре. Разбавляют дихлорметаном, промывают водным раствором первичного фосфата натрия, затем пикельным раствором. Сушат сульфатом магния, фильтруют и выпаривают досуха. Измельчают полученный продукт в смеси гексан-этилацетат (4:1). Центрифугируют и сушат полученный продукт. Получают таким образом 5,40 г искомого продукта.
СТАДИЯ Б: (E)-3-[2-этокси-1-(метоксиимино)этил]-4-гидрокси-8-метил-7-[(тетрагидро-2Н-пиран-2-ил)окси]-2Н-1-бензопиран-2-он
В колбе с обратным холодильником в течение 2 часов нагревают смесь 2 г продукта, полученного на предыдущей стадии, 922 мг хлоргидрата метоксиамина и 1,62 г ацетата калия и 20 мл этанола. Выпаривают досуха этанол. Хроматографируют полученный продукт на диоксиде кремния, элюируя смесью гексан-этилацетат (1: 1), затем смесью метиленхлорид-метанол (94:6). Выпаривают растворители и сушат. Получают 1,014 г продукта. Rf=0,22, элюент - СН2Сl2 - СН3ОН (94:6).
СТАДИЯ В: (E)-3-[2-этокси-1-(метоксиимино)этил]-8-метил-4-(2-пропенилокси)-7-[(тетрагидро-2Н-пиран-2-ил)окси]-2Н-1-бензопиран-2-он
В смесь, содержащую 1 г продукта, полученного на предыдущей стадии, 208 мкл аллилового спирта, 804 мг трифенилфосфина и 15 мл дихлорметана, при 0oС добавляют 534 мкл диэтилазодикарбоксилата. Перемешивают в течение 2 часов при комнатной температуре, добавляют 402 мг трифенилфосфина, 104 мкл аллилового спирта и 267 мкл диэтилазодикарбоксилата. Перемешивают в течение 2 часов при комнатной температуре, концентрируют при пониженном давлении и хроматографируют на диоксиде кремния, элюируя смесью гексан-этилацетат (2:1). Выпаривают растворители, сушат и получают 672 мг продукта. Rf=0,60, элюент - гексан-этилацетат (1:2).
СТАДИЯ Г: (E)-3-[2-этокси-1-(метоксиимино)этил]-7-гидрокси-8-метил-4-(2-пропенилокси)-2Н-1-бензопиран-2-он
В раствор, содержащий 650 мг предыдущего продукта в 12 мл тетрагидрофурана, добавляют 12 мл водного раствора соляной кислоты. Перемешивают 6 часов при комнатной температуре, разбавляют 50 мл смеси гексан-этилацетат (1: 2). Экстрагируют смесью гексан-этилацетат (1:2). Органические фазы соединяют, промывают их раствором первичного фосфата натрия, сушат, фильтруют и концентрируют досуха. Остаток измельчают при помощи ультразвука в присутствии смеси гексан-этилацетат (3:1). Центрифугируют, сушат и получают 410 мг искомого продукта. Rf=0,50, элюент - гексан-этилацетат (1:1).
ПРИМЕР 14: (E)-3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси]-3-(2-этокси-1-(метоксиимино)этил)-4-гидрокси-8-метил-2Н-1-бензопиран-2-она
СТАДИЯ А: (E)-3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси]-3-[2-этокси-1-(метоксиимино)этил]-8-метил-4-(2-пропенилокси)-2Н-1-бензопиран-2-она
Действуя, как на стадии 1 примера 1, исходя из продукта синтеза 1 и продукта синтеза 6, получают искомый продукт. Rf=0,41, элюент - гексан-этилацетат (1:1).
СТАДИЯ Б: (E)-3'-(5-метил-1Н-пиррол-2-карбоксилат] 7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси]-3-(2-этокси-1-(метоксиимино)этил)-4-гидрокси-8-метил-2Н-1-бензопиран-2-она
В раствор, содержащий 170 мг продукта, полученного на предыдущей стадии, 188 мкл диизопропиламина и 5 мл тетрагидрофурана, добавляют 31 мг тетракис-трифенилфосфинпалладия. Перемешивают при 0oС в течение 20 минут и приливают к 25 мл смеси 10%-ного водного раствора бисульфата натрия и 50 мл раствора гексан-этилацетат (1-4). Органическую фазу промывают, сушат, фильтруют и концентрируют досуха. Остаток хроматографируют на диоксиде кремния, элюируя дихлорметаном, содержащим 5% метанола. Растворители испаряют и остаток измельчают при помощи ультразвука в присутствии простого этилового эфира. Центрифугируют и сушат. Получают 72 мг искомого продукта. Rf=0,41, элюент - гексан-этилацетат (1:1).
Спектр ЯМР на протонах (300 МГц, ДMCO-d6, м.д.) δ: 0,96(т, J=7,0 Гц), 1,03(т, J= 7,0 Гц), 1,08(с), 1,29(с), 2,20-2,30(м), 3,30(м), 3,47(с), 3,50(м), 3,65(д, J= 10,0 Гц), 3,76(с), 3,87(с), 4,16(м), 4,23(с), 4,42(с), 5,48(дд, 1Н, J= 3,0 и 10,0 Гц), 5,60(м), 5,68(д, J=5,0 Гц), 5,93 (м), 6,78(м), 7,10 (д, J=9,0 Гц), 7,16(д, J=9,0 Гц), 7,77(д, J=9,0 Гц), 11,65 (ш. с).
СИНТЕЗ 7: (E)-7-гидрокси-3-[1-(метоксиимино)этил]-8-метил-4-(2-пропенилокси)-2Н-1-бензопиран-2-он
СТАДИЯ А: 3-ацетил-4-гидрокси-8-метил-7-[(тетрагидро-2Н-пиран-2-ил)окси] -2Н-1-бензопиран-2-он
В раствор, содержащий 10,00 г продукта стадии Б синтеза 2, 14,59 г 4-диметиламинопиридина и 7,63 г хлоргидрата N-(3-диметиламинопропил)-N'-этилкарбодиимида, добавляют 2,39 мл уксусной кислоты. Перемешивают в течение 5 часов при комнатной температуре. Вновь добавляют 4,86 г 4-диметиламинопиридина и 3,82 г хлоргидрата N-(3-диметиламинопропил)-N'-этилкарбодиимида и дополнительно перемешивают в течение 16 часов. Разбавляют дихлорметаном и промывают 10%-ным водным раствором бисульфата натрия. Сушат, фильтруют и концентрируют досуха. Остаток измельчают при помощи ультразвука в присутствии смеси гексан-этилацетат (2:1). Центрифугируют и сушат. Получают 10,04 г искомого продукта. Rf=0,79, элюент - СН2Сl2 - СН3ОН (95:5).
СТАДИЯ Б: (E)-4-гидрокси-3-[1-(метоксиимино)этил]-8-метил-7-[(тетрагидро-2Н-пиран-2-ил)окси]-2Н-1-бензопиран-2-он
Смесь 1,7 г продукта, полученного на предыдущей стадии, 892 мг хлоргидрата метоксиамина, 1,151 г ацетата калия и 20 мл этанола нагревают 30 минут при 80oС. Выпаривают досуха и остаток обрабатывают дихлорметаном в присутствии воды. Промывают водным раствором (1М) первичного фосфата натрия, сушат, фильтруют и выпаривают досуха. Измельчают при помощи ультразвука в присутствии смеси гексан-этилацетат (4:1). Сушат. Получают 1,60 г продукта. Rf=0,28, элюент - CH2Cl2 - CH3OH (99,5:0,5).
СТАДИЯ В: (E)-3-[1-(метоксиимино)этил]-8-метил-4-(2-пропенилокси)-7-[(тетрагидро-2Н-пиран-2-ил)окси]-2Н-1-бензопиран-2-он
В смесь, содержащую 1,56 г продукта, полученного на стадии Б, 366 мкл аллилового спирта, 1,413 г трифенилфосфина и 15 мл дихлорметана, при 0oС добавляют 937 мкл диэтилазодикарбоксилата. Перемешивают в течение 2 часов при комнатной температуре. Добавляют 706 г трифенилфосфина, 183 мкл аллилового спирта и 468 мкл диэтилазодикарбоксилата. Дополнительно перемешивают 2 часа при комнатной температуре. Концентрируют реакционную смесь и хроматографируют ее на диоксиде кремния, элюируя смесью гексан-этилацетат (4:1). Выпаривают растворители досуха. Получают 1,00 г искомого продукта. Rf=0,38, элюент - гексан-этилацетат (4:1).
СТАДИЯ Г: (E)-7-гидрокси-3-[1-(метоксиимино)этил]-8-метил-4-(2-пропенилокси)-2Н-1-бензопиран-2-он
В раствор, содержащий 1 г продукта, полученного на стадии В, и 20 мл тетрагидрофурана, добавляют 10 мл одномолярного водного раствора соляной кислоты. Перемешивают в течение 7 часов при комнатной температуре. Разбавляют 50 мл смеси гексан-этилацетат (1:1). Разделяют фазы и экстрагируют водную фазу смесью гексан-этилацетат (1:1). Соединяют органические фазы и промывают их одномолярным раствором первичного фосфата натрия, сушат, фильтруют и концентрируют досуха. Остаток измельчают при помощи ультразвука в присутствии смеси гексан-этилацетат (4:1). Центрифугируют, сушат и собирают 770 мг продукта.
ПРИМЕР 15: (E)-3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокси-3-(1-(метоксиимино)этил)-8-метил-2Н-1-бензопиран-2-она
СТАДИЯ А: (E)-3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -3-[1-(метоксиимино)этил] -8-метил-4-(2-пропенилокси)-2Н-1-бензопиран-2-она
Действуя, как в примере 1, исходя из 455 мг продукта, полученного в синтезе 7, и 539 мг продукта синтеза 1, получают искомый продукт. Rf=0,33, элюент - гексан-этилацетат (1:1).
СТАДИЯ Б: (E)-3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокси-3-(1-(метоксиимино)этил)-8-метил-2Н-1-бензопиран-2-она
В 6 мл тетрагидрофурана и 380 мг продукта предыдущей стадии при 0oС добавляют 460 мкл диизопропиламина, затем 75 мг тетракис-трифенилфосфинпалладия. Перемешивают при 0oС в течение 20 минут и приливают к смеси 10%-ного раствора бисульфата натрия и тетрагидрофуран-гексан-этилацетата (1:1:1). Разделяют фазы, водную фазу экстрагируют смесью тетрагидрофуран-гексан-этилацетата (1:1:1). Соединяют органические фазы, их сушат, фильтруют и концентрируют досуха. Остаток измельчают при помощи ультразвука в присутствии простого изопропилового эфира. Центрифугируют и сушат при пониженном давлении. Получают 180 мг искомого продукта. Rf=0,35, элюент - CH2Cl2 - CH3OH (94:6).
Спектр ЯМР на протонах (300 МГц, ДМСО-d6, м.д.) δ: 1,08(с, 3Н), 1,30 (с, 3Н), 2,23 (с, 3Н), 2,25 (с, 3Н), 2,27 (с, 3Н), 3,47 (с, 3Н), 3,65(д, 1Н, J= 10,0 Гц), 3,95 (с, 3Н), 4,17(м, 1Н), 5,48(дд, 1Н, J=3, 0 и 10,0 Гц), 5,63 (д, 1Н, J=2,5 Гц), 5,70(д, 1Н, J=5,0 Гц), 5,93 (м, 1Н), 6,78(м, 1Н), 7,20(д, 1Н, J=9,0 Гц), 7,80(д, 1Н, J=9,0 Гц), 11,65 (ш.с, 1Н), 13,69 (ш.м, 1Н).
СИНТЕЗ 8: (E)-7-гидpoкcи-3-[(мeтoкcииминo)мeтил]-8-метил-4-(2-пропенилокси)-2Н-1-бензопиран-2-он
СТАДИЯ А: 4-гидрокси-8-метил-2-оксо-7-[(тетрагидро-2Н-пиран-2-ил)окси] -2Н-1-бензопиран-3-карбоксальдегид
В раствор, содержащий 75 мл дихлорметана, 5,0 г продукта, полученного на стадии Б синтеза 2, 6,625 г 4-диметиламинопиридина и 3,825 г хлоргидрата N-(3-диметиламинопропил)-N'-этилкарбодиимида, при комнатной температуре добавляют 700 мкл муравьиной кислоты. Перемешивают в течение 16 часов, разбавляют дихлорметаном, промывают 10%-ным водным раствором бисульфата натрия, затем одномолярным раствором. Сушат, фильтруют, выпаривают досуха. Измельчают при помощи ультразвука в присутствии простого эфира, центрифугируют, сушат и собирают 4,04 г искомого продукта.
СТАДИЯ Б: (E)-4-гидрокси-3-[(метоксиимино)метил]-8-метил-7-[(тетрагидро-2Н-пиран-2-ил)окси]-2Н-1-бензопиран-2-он
В колбе с обратным холодильником в течение 1 часа нагревают смесь, содержащую 2,0 г продукта, полученного на стадии А, 1,08 г хлоргидрата метоксиамина, 1,93 г ацетата калия и 20 мл этанола. Выпаривают досуха, растворяют полученный продукт в смеси дихлорметана с водой (100 мл/100 мл). Промывают разбавленным раствором вторичного фосфата натрия и сушат. Выпаривают, остаток измельчают при помощи ультразвука в присутствии простого этилового эфира, центрифугируют и сушат. Получают 1,90 г продукта.
СТАДИЯ В: (E)-3-[(метоксиимино)метил] -8-метил-4-(2-пропенилокси)-7-[(тетрагидро-2Н-пиран-2-ил)окси]-2Н-1-бензопиран-2-он
В смесь, содержащую 1,80 г продукта, полученного на предыдущей стадии, 441 мкл аллилового спирта, 1,70 г трифенилфосфина и 15 мл дихлорметана, при 0oС добавляют 1,02 мл диэтилазодикарбоксилата. Перемешивают 2 часа при комнатной температуре. При 0oС добавляют 845 мг трифенилфосфина, 220 мкл аллилового спирта и 564 мкл ДЭАД. Перемешивают в течение 2 часов, концентрируют при пониженном давлении и хроматографируют на диоксиде кремния, элюируя смесью гексан-этилацетат (3:1). Выпаривают растворители, сушат и получают 1,60 г продукта.
СТАДИЯ Г: (E)-7-гидрокси-3-[(метоксиимино)метил]-8-метил-4-(2-пропенилокси)-2Н-1-бензопиран-2-он
В раствор, содержащий 1,60 г продукта, полученного на предыдущей стадии, и 20 мл ТГФ, добавляют одномолярный водный раствор соленой кислоты. Перемешивают в течение 6 часов при комнатной температуре. Разбавляют реакционный раствор 30 мл смеси гексан-этилацетат (1:2). Разделяют фазы и водную фазу экстрагируют смесью гексан-этилацетат (1:2). Промывают органические фазы одномолярным раствором первичного фосфата, сушат, фильтруют и концентрируют досуха. Остаток измельчают при помощи ультразвука в присутствии смеси гексан-этилацетат (3: 1). Центрифугируют и сушат. Получают 920 мг искомого продукта. Rf=0,47, элюент - гексан-этилацетат (1:2).
ПРИМЕР 16: (E)-3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокси-8-метил-3-((метоксиимино)метил)-2Н-1-бензопиран-2-она
СТАДИЯ А: (E)-3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -3-[(метоксиимино)-метил] -8-метил-4-(2-пропенилокси)-2Н-1-бензопиран-2-она
Действуя, как в примере 1, исходя из продукта синтеза 8 и продукта синтеза 1, получают искомый продукт. Rf=0,34, элюент - гексан-этилацетат (1: 1).
СТАДИЯ Б: (E)-3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокси-8-метил-3-((метоксиимино)метил)-2Н-1-бензопиран-2-она
В раствор, содержащий 430 мг продукта, полученного на стадии А, 533 мкл диизопропиламина и 10 мл безводного тетрагидрофурана, при 0оС добавляют 87 мг тетракис-трифенилфосфинпалладия. Перемешивают при 0oС в течение 20 минут, приливают реакционную смесь к 50 мл водного раствора бисульфата натрия и 50 мл смеси гексан-этилацетат (1:2). Промывают и сушат. Фильтруют и концентрируют досуха. Хроматографируют на диоксиде кремния, элюируя смесью метиленхлорид-метанол (95:5). Выпаривают растворители, остаток измельчают при помощи ультразвука в присутствии простого этилового эфира. Центрифугируют и сушат. Получают 176 мг искомого продукта. Rf=0,34, элюент - гексан-этилацетат (1: 1).
Спектр ЯМР на протонах (300 МГц, ДMCO-d6, м.д.) δ: 1,08(с, 3Н), 1,30 (с, 3Н), 2,22 (с, 3Н), 2,25 (с, 3Н), 3,47 (с, 3Н), 3,65(д, 1Н, J=10,0 Гц), 3,90 (с, 3Н), 4,16(м, 1Н), 5,48(дд, 1Н, J=3,0 и 10,0 Гц), 5,61 (д, 1Н, J=2,0 Гц), 5,70(д, 1Н, J= 5,0 Гц), 5,93(м, 1Н), 6,78(м, 1Н), 7,16(д, 1Н, J=9,0 Гц), 7,78(д, 1Н, J=9,0 Гц), 8,35(с, 1Н), 11,66 (ш.с).
ПРИМЕР 17: 3'-циклопропилкарбамат 3-ацетил-7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокси-8-метил-2Н-1-бензопиран-2-она
СТАДИЯ А: 7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси]-8-метил-4-(2-пропенилокси)-2Н-1-бензопиран-2-он
В смесь, содержащую 8,50 г продукта синтеза 2, 8,44 г 6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозы, 11,52 г трифенилфосфина, 100 мл дихлорметана и 20 мл тетрагидрофурана, по каплям добавляют 8,10 мл диэтилазодикарбоксилата. Выдерживают при перемешивании в течение 2 часов при комнатной температуре и добавляют 5,70 г трифенилфосфина и 4,05 мл диэтилазодикарбоксилата. Поддерживают перемешивание в течение ночи при комнатной температуре. Концентрируют, очищают продукт путем хроматографирования на диоксиде кремния, элюируя смесью метиленхлорид-ацетон (90:10). Выпаривают, сушат и собирают 8,304 г искомого продукта.
СТАДИЯ Б: 7-[(2,3-О-карбонил-6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси]-8-метил-4-(2-пропенилокси)-2Н-1-бензопиран-2-он
В колбе с обратным холодильником в течение 30 минут нагревают смесь 2 г продукта, полученного на стадии А, и 1,995 г карбонилдиимидазола. Охлаждают и разбавляют 100 мл смеси тетрагидрофуран-этилацетат (1:1). Промывают водой, сушат, фильтруют и концентрируют. Остаток растворяют в дихлорметане, затем полученный раствор хроматографируют на диоксиде кремния, элюируя смесью метиленхлорид-ацетон (9: 1). Растворители выпаривают и получают 1,32 г искомого продукта. Rf=0,69, элюент - СН2Сl2 - СН3СОСН3 (90:10).
СТАДИЯ В: 7-[(2,3-О-карбонил-6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси]-4-гидрокси-8-метил-2Н-1-бензопиран-2-он
В смесь, содержащую 1 г продукта, полученного на предыдущей стадии, и 10 мл тетрагидрофурана, добавляют 1 мл изопропиламина. Добавляют 267 мг тетракис-трифенилфосфинпалладия. Поддерживают перемешивание в течение 30 минут при 0oС, добавляют 10 мл диэтилового эфира и фильтруют. Получают продукт, который фильтруют. Центрифугируют и прополаскивают смесью простой этиловый эфир-тетрагидрофуран (1: 1). Сушат и получают 880 мг продукта, который вливают в 75 мл смеси тетрагидрофуран-этилацетат-гексан (2:2:1). Водную фазу экстрагируют смесью растворителей. Соединяют органические фазы, сушат их, фильтруют и концентрируют. Получают 726 мг искомого продукта.
СТАДИЯ Г: 3-ацетил-7-[(2,3-О-карбонил-6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси]-4-гидрокси-8-метил-2Н-1-бензопиран-2-он
В раствор, содержащий 1,29 г продукта, полученного на стадии В, 1,344 г 4-диметиламинопиридина, 719 мг хлоргидрата N-(3-диметиламинопропил)-N'-этилкарбодиимида и 15 мл дихлорметана, добавляют 225 мкл уксусной кислоты. Перемешивают 6 часов при комнатной температуре, разбавляют 50 мл дихлорметана. Промывают 10%-ным водным раствором бисульфата натрия. Выпаривают растворители и хроматографируют на диоксиде кремния, элюируя смесью метиленхлорид-метанол (98: 2). Выпаривают растворители и сушат. Получают 1,18 г искомого продукта. Rf=0,73, элюент - метиленхлорид-метанол (94:6).
СТАДИЯ Д: 3'-циклопропилкарбамат 3-ацетил-7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокси-8-метил-2Н-1-бензопиран-2-она
В раствор, содержащий 1,137 г продукта, полученного на предыдущей стадии, и 5 мл диметилформамида, добавляют 783 мкл DBUt и 362 мкл циклопропиламина. Поддерживают при перемешивании в течение 3 часов и добавляют 181 мкл циклопропиламина. Перемешивают в течение 3 часов. Приливают к 80 мл смеси гексан-этилацетат (1: 2) в присутствии водного раствора бисульфата натрия. Экстрагируют смесью гексан-этилацетат (1:2). Соединяют органические фазы, промывают их, сушат и фильтруют. Остаток выпаривают и сушат. Получают 1,040 г искомого продукта. Rf=0,58, элюент - СН2Сl2 - СН3ОН (90:10).
Спектр ЯМР на протонах (300 МГц, ДМСО-d6, м.д.) δ: ≈0,43(м, 2Н), 0,60(м, 2Н), 1,04(с, 3Н), 1,18 (с, 3Н), 2,19 (с, 3Н), 2,65 (с, 3Н), 3,12 (м, 1Н), 3,45 (с, 3Н), ≈3,49 (м, 1Н), ≈4,02 (ш.с, 1Н), 5,18(дд, 1Н, J=3,0 и 10,0 Гц), 5,60(ш.с, 1Н), 7,21(д, 1Н, J=9,0 Гц), 7,50(ш.с, 1Н), 7,90 (д, 1Н, J=9,0 Гц), 13,75(ш.с, 1Н).
ПРИМЕР 18: (E)-3'-циклопропилкарбамат 7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси]-4-гидрокси-3-(1-(метоксиимино)этил)-8-метил-2Н-1-бензопиран-2-она
В колбе с обратным холодильником в течение 1 часа нагревают смесь 100 мг продукта, полученного в предыдущем примере, 34 мг хлоргидрата метоксиамина, 50 мг ацетата калия и 2 мл этанола. Выпаривают этанол досуха и извлекают в 40 мл дихлорметана. Промывают одномолярным водным раствором первичного фосфата натрия и сушат над сульфатом магния. Выпаривают растворитель и хроматографируют на препаративных пластинах. Экстрагируют и выпаривают растворители, затем растворяют полученный продукт в простом этиловом эфире и добавляют н-пентан. Центрифугируют и сушат полученный продукт. Получают 56 мг искомого продукта. Rf=0,41, элюент - CН2Cl2 - CH3OH (94:6).
Спектр ЯМР на протонах (300 МГц, ДМСО-d6, м.д.) δ: 0,44(м, 2Н), 0,60(м, 2Н), 1,04 (с, 3Н), 1,26 (с, 3Н), 2,20(с, 3Н), 2,27(с, 3Н), 3,45(м, 1Н), 3,45(с, 3Н), 3,95(с, 3Н), 4,09(м, 1Н), 5,19(дд, 1Н, J=3,0 и 10,0 Гц), 5,55(ш. с, 1Н), 5,64(д, 1Н, J=5,0 Гц), 7,16(д, 1Н, J=9,0 Гц), 7,51(м, 1Н), 7,79(д, 1Н, J=9,0 Гц), 13,67(ш.м, 1Н).
ПРИМЕР 19: (E)-3'-циклопропилкарбамат 7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -3-(1-(диметилгидразоно)этил)-4-гидрокси-8-метил-2Н-1-бензопиран-2-она
Действуя, как в предыдущем примере, используя Me2N-NH2 вместо NH2OMe•HCl, получают искомый продукт.
Спектр ЯМР на протонах (300 МГц, ДМСО-d6, м.д.) δ: 0,43(м, 2Н), 0,60(м, 2Н), 1,04 (с, 3Н), 1,25(с, 3Н), 2,16 (с, 3Н), 2,68 (с, 6Н), 2,76 (с, 3Н), 3,44 (с, 3Н), 3,48(д, 1Н, J=10,0 Гц), 4,07(ш.с, 1Н), 5,18 (дд, 1Н, J=3,0 м 10,0 Гц), 5,51(ш. с, 1Н), 5,61(д, 1Н, J=5,0 Гц), 7,05(д, 1Н, J=9,0 Гц), 7,50(ш.с, 1Н), 7,78(д, 1Н, J=9,0 Гц), 14,50 (ш.с, 1Н).
ПРИМЕР 20: 7-[(6-дезокси-5-С-метил-4-О-метил-3-О-(((5-метил-3-изоксазолил)амино)карбонил)-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокси-8-метил-2-оксо-2Н-1-бензопиран-3-этилкарбоксилат
СТАДИЯ А: 7-[(2,3-О-карбонил-6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -8-метил-2-оксо-4-(фенилметокси)-2Н-1-бензопиран-3-этилкарбоксилат
В смесь, содержащую 8,00 г продукта синтеза 3, 5,207 г 6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозы и 50 мл дихлорметана, при 0оС добавляют 5,33 мл диизопропилазодикарбоксилата. Перемешивают в течение 2 часов при комнатной температуре. Добавляют 3,6 г трифенилфосфина и 2,7 мл азодикарбоксилата и перемешивают в течение 2 часов. Концентрируют реакционную среду и хроматографируют на диоксиде кремния, элюируя смесью гексан-этилацетат (2: 3). Получают 8,43 г продукта, который вливают в 70 мл тетрагидрофурана. Добавляют 5,17 г карбонилдиимидазола и нагревают в колбе с обратным холодильником в течение 30 минут. Раствор охлаждают и разбавляют его 100 мл смеси гексан-этилацетат (1:2). Промывают водным раствором первичного фосфата натрия. Сушат, фильтруют и выпаривают растворители. Хроматографируют полученный продукт на диоксиде кремния, элюируя смесью гексан-этилацетат (1: 1). Выпаривают растворители и сушат. Получают 6,48 г искомого продукта.
СТАДИЯ Б: 7-[(2,3-О-карбонил-6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокси-8-метил-2-оксо-2Н-1-бензопиран-3-этилкарбоксилат
В раствор, содержащий 6,00 г продукта, полученного на стадии А, 30 мл этанола и 15 мл тетрагидрофурана, добавляют 600 мг 10% Pd на угле. Перемешивают эту смесь под давлением водорода в течение 6 часов, фильтруют и промывают ТГФ. Выпаривают растворители и сушат. Получают 4,572 г искомого продукта. Rf=0,59, элюент - CH2Cl2 - CH3OH (91:9).
СТАДИЯ В: 7-[(6-дезокси-5-С-метил-4-О-метил-3-О-(((5-метил-3-изоксазолил)амино)карбонил)-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокси-8-метил-2-оксо-2Н-1-бензопиран-3-этилкарбоксилат
Раствор, содержащий 254 мг 5-метиламиноизоксазола и 2 мл безводного тетрагидрофурана, охлаждают до -76oС. При -76oС добавляют 1,08 мл раствора 1,6 М н-бутиллития в гексане. Поддерживают реакционную смесь при перемешивании в течение 15 минут. Добавляют раствор 400 мг продукта, полученного на предыдущей стадии, в 2 мл ТГФ. Реакционную смесь поддерживают при перемешивании при -76oС в течение 2 часов, затем при -20oС в течение 40 минут. Разбавляют 150 мл 20%-ного раствора этилацетата в гексане, промывают 70 мл 10%-ного водного раствора бисульфата натрия, водой и пикельным раствором, сушат и после фильтрации выпаривают досуха. Собирают 504 мг продукта, который солюбилизируют в минимальном количестве дихлорметана, содержащего 10% метанола. Хроматографируют на диоксиде кремния, элюируя смесью метиленхлорид-10% этанола. После выпаривания растворителей получают 264 мг продукта, который хроматографируют на диоксиде кремния смесью метиленхлорид-метанол (94:6). Получают 145 мг продукта. Получают искомый продукт. Rf=0,21, элюент - СН2Сl2 - СН3ОН (95: 5).
Спектр ЯМР на протонах (300 МГц, ДМСО-d6, м.д.) δ: 1,05(с, 3Н), 1,28(м, 3Н), 1,28(м, 3Н), 2,19(с, 3Н), 2,37 (с, 3Н), 3,49 (с, 3Н), 3,57(д, 1Н, J= 10,0 Гц), 4,19 (ш.с, 1Н), 4,32(к, 2Н, J=7,0 Гц), 5,25(дд, 1Н, J=3,0 и 10,0 Гц), 5,61 (ш. с, 1Н), 5,83(с, 1Н), 6,56 (с, 1Н), 7,16(д, 1Н, J=9,0 Гц), 7,83(д, 1Н, J=9,0 Гц).
Действуя, как в предыдущем примере, исходя из продукта, полученного на стадии Б предыдущего примера, и соответствующих аминов, получают следующие продукты.
ПРИМЕР 21: 7-[(6-дезокси-5-С-метил-4-О-метил-3-О-(((2-тиазолил)амино)карбонил)-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокси-8-метил-2-оксо-2Н-1-бензопиран-3-этилкарбоксилат. Rf=0,07, элюент - СН2С12 - СН3ОН (95:5).
Спектр ЯМР на протонах (300 МГц, ДМСО-d6, м.д.) δ:
1,07 (с, 3Н), 1,25 (т, 3Н, J=7,0 Гц), 1,29 (с, 3Н), 2,18 (с, 3Н), 3,51 (с, 3Н), 3,57(д, 1Н, J=10,0 Гц), 4,21(м, 3H), 5,28(дд, 1Н, J=3,0 и 10,0 Гц), 5,57(ш. с, 1Н), 5,80(д, 1Н, J=5,0 Гц), 7,05(ш.д, 1Н, J=9,0 Гц), 7,77(д, 1Н, J=9,0 Гц), 7,22(д, 1Н, J=3,5 Гц), 7,42(д, 1Н, J=3,5 Гц), 11,95 (ш.с, 1Н).
ПРИМЕР 22: 7-[(6-дезокси-5-С-метил-4-О-метил-3-О-(((фенилметил)амино)карбонил)-альфа-L-ликсо-гексопиранозил)окси]-4-гидрокси-8-метил-2-оксо-2Н-1-бензопиран-3-этилкарбоксилат. Rf=0,30, элюент - СН2Сl2 - СН3ОН (95:5).
Спектр ЯМР на протонах (300 МГц, ДМСО-d6, м.д.) δ: 1,02 (с, 3Н), 1,27 (с, 3Н), 1,32 (т, 3Н, J=7,0 Гц), 2,17 (с, 3Н), 3,48 (с, 3Н), 3,51(д, 1Н, J= 10,0 Гц), 4,11(ш.с, 1Н), 4,21(м, 2Н), 4,37 (к, 2Н, J=7,0 Гц), 5,22(дд, 1Н, J=3,0 и 10,0 Гц), 5,59(д, 1Н, J=2,0 Гц), 5,71(ш, 1Н), 7,21(д, 1Н, J=9,0 Гц), 7,30(ш.м, 5Н), 7,85(д, 1Н, J=9,0 Гц), 7,92 (т, 1Н, J=6,0 Гц).
ПРИМЕР 23: 7- [(3-О-(((циклопентил)амино)карбонил)-6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокси-8-метил-2-оксо-2Н-1-бензопиран-3-этилкарбоксилат. Rf=0,32, элюент - СН2Сl2 - СН3ОН (95: 5).
Спектр ЯМР на протонах (300 МГц, ДМСО-d6, м.д.) δ: 1,26 (с, 3Н), 1,32 (с, 3Н), 1,32 (т, 3Н, J=7,0 Гц), 1,40-1,90(м,8Н), 2,18(с,3Н), 3,46(с,3Н), 3,50(д, 1Н, J= 10,0 Гц), 3,82(м,1Н), 4,08 (ш, 1Н), 4, 32 (к, 2Н, J=7,0 Гц), 5,19(дд, 1Н, J=3,0 и 10,0 Гц), 5,58(ш.с, 1Н), 5,64 (ш, 1Н), 7,18(д, 1Н, J= 9,0 Гц), 7,33(д, 1Н, J=7,0 Гц), 7,85(д, 1Н, J=9,0 Гц).
ПРИМЕР 24: 7-[(3-О-(аминокарбонил)-6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -4-гидpoкcи-8-мeтил-2-oкco-2H-1-бeнзопиpaн-3-этилкарбоксилат. Rf=0,06, элюент - CH2Cl2 - CH3OH (95:5).
Спектр ЯМР на протонах (300 МГц, ДМСО-d6, м.д.) δ: 1,03 (с, 3Н), 1,26 (с, 3Н), 1,32 (т, 3Н, J=7,0 Гц), 2,18 (с, 3Н), 3,47 (с, 3Н), 3,48(ш, 1Н), 4,08(дд, 1Н, J=2,5 и 3,0 Гц), 4,37 (к, 2Н, J=7,0 Гц), 5,15(дд, 1Н, J=3,0 и 10,0 Гц), 5,58(д, 1Н, J=2,5 Гц), 6,55-6,75 (ш, 2Н), 7,19(д, 1Н, J=9,0 Гц), 7,85(д, 1Н, J=9,0 Гц).
ПРИМЕР 25: 7-[(6-дезокси-5-С-метил-4-О-метил-3-О-(((2-пиридинилметил)амино)карбонил)-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокси-8-метил-2-оксо-2Н-1-бензопиран-3-этилкарбоксилат. Rf= 0,11, элюент - СН2Сl2 - СН3ОН (95:5).
Спектр ЯМР на протонах (300 МГц, ДМСО-d6, м.д.) δ: 1,02 (с, 3Н), 1,28 (с, 3Н), 1,32 (т, 3Н, J=7,0 Гц), 2,16 (с, 3Н), 3,50 (с, 3Н), 3,54(д, 1Н, J= 10, О Гц), 4,11 (ш.с, 1Н), 4,36(м, 4Н), 5,22(дд, 1Н, J=3,0 и 10,0 Гц), 5,60 (д, 1Н, J= 2,0 Гц), 5,73(ш, 1Н), 7,19(д, 1Н, J=9,0 Гц), 7,29(т, 1Н, J=6,0 Гц), 7,36(д, 1Н, J=8,0 Гц), 7,83(м, 2Н), 7,97 (т, 1Н, J=6,0 Гц), 8,22 (м, 1Н).
ПРИМЕР 26: 7-[(3-О-(цилопропиламино)карбонил)-6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокси-8-метил-2-оксо-2Н-1-бензопиран-3-этилкарбоксилат. Rf=0,32, элюент - СН2Сl2 - СН3ОН (92:8).
Спектр ЯМР на протонах (300 МГц, ДМСО-d6, м.д.) δ: 0,43(м, 2Н), 0,59(м, 2Н), 1,03 (с, 3Н), 1,26 (с, 3Н), 1,32(т, 3Н, J=7,0 Гц), 2,19 (с, 3Н), 3,45-3,48 (м, 2Н), 3,44 (с, 3Н), 4,09 (ш.с, 1Н), 4,37 (к, 2Н, J=7,0 Гц), 5,17(ш. д, 1Н, J= 10,0 Гц), 5,58(ш.с, 1Н), 5,65 (м, 1Н), 7,19(д, 1Н, J=9,0 Гц), 7,50(ш.с, 1Н), 7,85(д, 1Н, J=9,0 Гц).
ПРИМЕР 27: 7-[(3-О-((циклобутиламино)карбонил)-6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -4-гидpoкcи-8-мeтил-2-oксo-2H-1-бензопиран-3-этилкарбоксилат. Rf=0,38, элюент - СН2Сl2 - СН3ОН (92:8).
Спектр ЯМР на протонах (300 МГц, ДМСО-d6, м.д.) δ: 1,01 (с, 3Н), 1,26 (с, 3Н), 1,32 (т, 3Н, J=7,0 Гц), 1,58 (м, 2Н), 1,93(м, 2Н), 2,15(м, 2Н), 2,17 (с, 3Н), 3,46 (с, 3Н),
3,28(д, 1H, J=10,0 Гц), 4,00(м, 1H), 4,07(ш.с, 1H), 4,36 (к, 2Н, J=7,0 Гц), 5,15(дд, 1H, J=3,0 и 10,0 Гц), 5,57 (д, 1Н, J=2,0 Гц), 5,67 (м, 1H), 7,18(д, 1Н, J=9,0 Гц), 7,63(д, 1Н, J=8,0 Гц), 7,85(д, 1Н, J=9,0 Гц).
ПРИМЕР 28: 7-[(6-дезокси-5-С-метил-4-О-метил-3-О-(((1-метилэтил)амино)карбонил)-альфа-L-ликсо-гексопиранозил)окси] -4-гидpoкcи-8-мeтил-2-oксo-2H-1-бензопиран-3-этилкарбоксилат. Rf=0,30, элюент - СН2Сl2 - СН3ОН (92:8).
Спектр ЯМР на протонах (300 МГц, ДМСО-d6, м.д.) δ: 1,03(с, 3Н), 1,09(д, 6Н, J= 6,5 Гц), 1,26(с, 3Н), 1,32 (т, 3Н, J=7,0 Гц), 2,18 (с, 3Н), 3,46 (с, 3Н), 3,50(д, 1Н, J=10,0 Гц), 3,67(м, 1Н), 4,08(ш.с, 1Н), 4,37 (к, 2Н, J=7,0 Гц), 5,19(дд, 1Н, J=3,0 и 10,0 Гц), 5,58 (д, 1Н, J=2,0 Гц), 5,65(ш.с, 1Н), 7,18(д, 1Н, J=9,0 Гц), 7,22(д, 1Н, J=7,5 Гц), 7,85(д, 1Н, J=9,0 Гц).
ПРИМЕР 29: 7-[(6-дезокси-3-0-(((1,1-диметилэтил)амино)карбонил)-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокси-8-метил-2Н-1-бензопиран-3-этилкарбоксилат. Rf=0,37, элюент - СН2Сl2 - СН3ОН (92:8).
Спектр ЯМР на протонах (300 МГц, ДМСО-d6, м.д.) δ: 1,02(c, 3Н), 1,26 (с, 12Н), 1,32 (т, 3Н, J=7,0 Гц), 2,19 (с, 3Н), 3,46 (с, 3Н), 4,06(ш.с, 1Н), 4,37(к, 2Н, J= 7,0 Гц), 5,17(дд, 1Н, J=3,0 и 10,0 Гц), 5,58 (д, 1Н, J=2,5 Гц), 5,62 (ш.с, 1Н), 7,03 (ш.с, 1Н), 7,19(д, 1Н, J=9,0 Гц), 7,85 (д, 1Н, J= 9,0 Гц).
ПРИМЕР 30: 7-[(3-О-((циклогексиламино)карбонил)-6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокcи-8-метил-2Н-1-бензопиран-3-этилкарбоксилат. Rf=0,33, элюент - CH2Cl2 - CH3OH (92:8).
Спектр ЯМР на протонах (300 МГц, ДМСО-d6, м.д.) δ: 1,00-1,80 (м, 10Н), 1,03 (с, 3Н), 1,26 (с, 3Н), 1,32 (т, 3Н, J=7,0 Гц), 2,18 (с, 3Н), 3,46(с, 3Н), 3,63(д, 1Н, J=10,0 Гц), 4,08(ш.с, 1Н), 4,37 (к, 2Н, J=7,0 Гц), 5,20(дд, 1Н, J=3,0 и 10,0 Гц), 5,61(д, 1Н, J=2,0 Гц), 5,65(ш.с, 1Н), 7,19 (д, 1Н, J= 9,0 Гц), 7,25(д, 1Н, J=8,0 Гц), 7,86 (д, 1Н, J=9, 0 Гц).
ПРИМЕР 31: 7-[(6-дезокси-5-С-метил-4-О-метил-3-О-((4-метил-1-пиперазинил)карбонил)-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокcи-8-метил-2Н-1-бензопиран-3-этилкарбоксилат. Rf=0,22, элюент - CH2Cl2 - CH3OH (85:15).
Спектр ЯМР на протонах (300 МГц, ДМСО-d6, м.д.) δ: 1,02 (с, 3Н), 1,20 (т, 3Н, J=7,0 Гц), 1,30 (с, 3Н), 2,12 (с, 3Н), 2,60(ш.с, 3Н), 3,04(ш, 8Н), 3,44 (с, 3Н), 3,54 (д, 1Н, J=10,0 Гц), 4,05(м, 3Н), 5,4 (дд, 1Н, J=3,0 и 10,0 Гц), 5,50(д, 1Н, J=2,0 Гц), 5,62(д, 1Н, J=4,5 Гц), 6,93(д, 1Н, J=9,0 Гц), 7,65(д, 1Н, J=9,0 Гц).
ПРИМЕР 32: (Z)-7-[(6-дезокси-5-С-метил-4-О-метил-2,3-О-(1-метилэтилиден)-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокси-3-(1-гидрокси-2-(2-пиридинил)этенил)-8-метил-2Н-1-бензопиран-2-он
В раствор, содержащий 1,452 г (Z)-7-[(6-дезокси-5-С-метил-4-О-метил-2,3-О-(1-метилэтилиден)-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокси-8-метил-2Н-1-бензопиран-2-она и 15 мл безводного дихлорметана, добавляют 611 мг хлоргидрата пиридилуксусной кислоты и 1,29 мг 4-диметиламинопиридина. Затем добавляют 606 мкл диизопропилкарбодиимида. Поддерживают при перемешивании в течение 20 часов. Добавляют 305,5 мг хлоргидрата пиридилуксусной кислоты и 0,645 мг 4-диметиламинопиридина. Вновь перемешивают в течение 12 часов. Разбавляют 250 мл дихлорметана. Промывают 70 мл однонормального водного раствора первичного фосфата натрия. Промывают водой, пикельным раствором, сушат, фильтруют и выпаривают досуха. Получают 4,06 г продукта, который извлекают в простой этиловый эфир при 0oС. Центрифугируют и получают 1,594 г продукта, который очищают хроматографически на диоксиде кремния, элюируя смесью СН2Сl2 - СН3ОН (96,5:3,5). Получают 1,54 г продукта, который измельчают в абсолютном этаноле, охлажденном до -10oС. Центрифугируют и сушат. Маточные растворы концентрируют досуха и получают 0,317 г продукта, который измельчают в 5 мл этанола, к которому добавляют 4 мл диэтилового эфира. После выделения и сушки получают 287 г искомого продукта. Rf=0,40, элюент - СН2Сl2 - СН3ОН (95:5).
ПРИМЕР 33: (Z)-7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокси-3-(1-гидрокси-2-(2-пиридинил)этенил)-8-метил-2Н-1-бензопиран-2-он
В 5 мл раствора трифторуксусной кислоты, содержащего 10% воды, при 0oС добавляют 1,15 г продукта, полученного в предыдущем примере. Перемешивают 4 минуты при 0oС, затем добавляют 80 мл буферного раствора, составленного из 40 мл 2М КН2РО4 и 40 мл 2М К2НРО4. Осадок выделяют. Обрабатывают дихлорметаном и тетрагидрофураном. Промывают 10%-ным раствором бикарбоната натрия, затем пикельным раствором и сушат. Выпаривают растворители и собирают 1,09 г продукта, который диспергируют в 4 мл абсолютного этанола. Нерастворимый продукт выделяют путем фильтрования. Промывают этанолом. Сушат и собирают 291 мг искомого продукта.
ПРИМЕР 34: (Z)-3'-кapбaмaт 7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокси-3-(1-гидрокси-2-(2-пиридинил)этенил)-8-метил-2Н-1-бензопиран-2-она
СТАДИЯ A: (Z)-7-[(2,3-0-карбонил-6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси]-4-гидрокси-3-(1-гидрокси-2-(2-пиридинил)этенил)-8-метил-2Н-1-бензопиран-2-он
В раствор, содержащий 210 мг продукта предыдущего примера и 10 мл тетрагидрофурана, добавляют 84 мг карбонилдиимидазола, выдерживают в колбе с обратным холодильником в течение 1 часа, добавляют 40 мг карбонилдиимидазола. Нагревают еще один час в колбе с обратным холодильником и разбавляют этилацетатом. Промывают одномолярным раствором вторичного фосфата натрия, затем пикельным раствором. Сушат, фильтруют и концентрируют досуха. Сушат и получают 107 мг искомого продукта.
СТАДИЯ Б: (Z)-3'-карбамат 7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокси-3-(1-гидрокси-2-(2-пиридинил)этенил)-8-метил-2Н-1-бензопиран-2-она
В колбу конденсируют приблизительно 15 мл аммиака. Добавляют 107 мг продукта, полученного на стадии А. Перемешивают реакционный раствор с рефлюксом аммиака в течение 30 минут. Дают аммиаку испариться. Вливают полученный продукт в 100 мл тетрагидрофурана в присутствии 50 мл 10%-ного водного раствора бисульфата натрия. Промывают органический раствор пикельным раствором и сушат. Фильтруют и выпаривают досуха. Измельчают полученный продукт при помощи ультразвука с изопропиловым эфиром. Центрифугируют и сушат. Получают 89 мг искомого продукта. Rf=0,27, элюент - CH2Cl2 - CH3OH (90:10).
Спектр ЯМР на протонах (300 МГц, ДМСO-d6, м.д.) δ: 1,05 (с, 3Н), 1,26 (с, 3Н), 2,19 (с, 3Н), 3,47 (с, 3Н), 3,50(ш, 1Н), 4,07(ш.с, 1Н), 5,15(дд, 1Н, J= 3,0 и 10,0 Гц), 5,52(д, 1Н, J=2,5 Гц), 5,60(ш.c, 1Н), 6,50-6,70 (ш, 2Н), 6,82 (с, 1Н), 7,05 (т, 1Н, J=8,0 Гц), 7,09(д, 1Н, J=9,0 Гц), 7,63(м, 1Н), 7,79(д, 1Н, J=9,0 Гц), 7,92(ш.т, lH, J=7,5 Гц), 8,16(т, 1Н, J=6,0 Гц), 13,81(ш.с, 1Н), 16,0 (ш.с, 1H).
ПРИМЕР 35: 3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокси-8-метил-2-оксо-2Н-1-бензопиран-3-карбоксамида
СТАДИЯ А: 3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-[(6-дeзoкcи-5-C-мeтил-4-О-мeтил-2-О-(тетрагидро-2Н-пиран-2-ил)-альфа-L-ликсо-гексопиранозил)окси]-8-метил-2-оксо-4-(фенилметокси)-2Н-1-бензопиран-3-этилкарбоксилата
В раствор, содержащий 4,51 г продукта стадии А примера 4, добавляют 1,3 мл 1,2-дигидропирана, затем 70 мг п-толуолсульфокислоты. Перемешивают при комнатной температуре в течение 1 часа 30 минут, промывают карбонатом натрия, сушат сульфатом магния и фильтруют. Очищают при помощи хроматографии на диоксиде кремния, элюируя смесью гексан-этилацетат (7:3). Получают 1,92 г искомого продукта.
Rf=0,38, элюент - гексан-этилацетат (1:1).
СТАДИЯ Б: 3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-[(6-дезокси-5-С-метил-4-О-метил-2-О-(тетрагидро-2Н-пиран-2-ил)-альфа-L-ликсо-гексопиранозил)окси]-4-гидрокси-8-метил-2-оксо-2Н-1-бензопиран-3-этилкарбоксилата
В раствор, содержащий 1,92 г продукта стадии А и 25 мл тетрагидрофурана, добавляют 200 мг палладия на угле. Перемешивают при комнатной температуре под давлением водорода в течение 1 часа. Фильтруют с целью удаления катализатора и выпаривают растворитель досуха. Растворяют в простом этиловом эфире, осаждают гексаном, выпаривают досуха растворитель и сушат при пониженном давлении. Получают 1,629 г продукта с Rf=0,30, элюент - гексан-этилацетат (1:4).
СТАДИЯ В: 3'-[5-метил-1Н-пиррол-2-карбоксилат) 7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси] -4-гидрокси-8-метил-2-оксо-2Н-1-бензопиран-3-карбоксамида
Раствор 350 мг продукта предыдущей стадии в 10 мл тетрагидрофурана насыщают аммиаком при 0oС (путем барботирования аммиака). Перемешивают реакционный раствор при комнатной температуре в течение 2 дней. Разбавляют 50 мл смеси гексан-этилацетат (1:4), промывают 50 мл 10%-ного водного раствора бисульфата натрия. Сушат и концентрируют досуха. Полученный продукт (340 мг) растворяют в 10 мл метанола и 10 мл дихлорметана. Добавляют 50 мг моногидрата п-толуолсульфокислоты. Перемешивают 3 часа при комнатной температуре, разбавляют 70 мл дихлорметана и промывают насыщенным водным раствором бикарбоната натрия. Сушат и концентрируют досуха. Измельчают в присутствии простого изопропилового эфира. Нерастворимый продукт сушат и собирают 170 мг искомого продукта.
Спектр ЯМР 1H (300 МГц, ДMCO-d6, м.д.) δ: 1,07 (с, 3Н), 1,30 (с, 3Н), 2,23 (с, 3Н), 2,24(с, 3Н), 3,47(с, 3Н), 3,66(д, 1Н, J=10,0 Гц), 4,18(ш.с, 1Н), 5,48 (дд, 1Н, J=3,0 и 10,0 Гц), 5,66(д, 1Н, J=2,5 Гц), 5,74 (ш.с, 1Н), 5,93(т, 1Н, J= 3,0 Гц), 6,78 (т, 1Н, J=3,0 Гц), 7,24(д, 1Н, J=9,0 Гц), 7,85(д, 1Н, J= 9,0 Гц), 8,73(ш. с, 1Н), 8,98(ш.с, 1Н), 11,66(ш.с, 1Н), 13,50(ш.с, 1Н).
ПРИМЕР 36: 3'-[5-метил-1Н-пиррол-2-карбоксилат] 3-(циклопропилкарбонил)-7-[(6-дезокси-5-С-метил-4-О-метил-альфа-L-ликсо-гексопиранозил)окси]-4-гидрокси-8-метил-2Н-1-бензопиран-2-она
В раствор, содержащий 400 мг продукта стадии В примера 1, 173 мг хлоргидрата N-(3-диметиламинопропил)-N'-этилкарбодиимида и 306 мг 4-диметиламинопиридина в дихлорметане, добавляют 78 мкл циклопропилкарбоновой кислоты. Перемешивают 5 часов при комнатной температуре. Вновь добавляют 86 мг хлоргидрата N-(3-диметиламинопропил)-N'-этилкарбодиимида и 159 мг 4-диметиламинопиридина. Перемешивают в течение одной ночи при комнатной температуре. Разбавляют 50 мл дихлорметана и промывают 50 мл 10%-ного водного раствора бисульфата натрия. Сушат. Выпаривают досуха растворители. Получают 408 мг продукта [Rf= 0,78, элюент - СН2Сl2 - СН3ОН (94:6)]. Растворяют продукт в смеси 15 мл метанола и 10 мл дихлорметана. Добавляют 60 мг п-толуолсульфокислоты и перемешивают 3 часа при комнатной температуре. Разбавляют дихлорметаном, промывают водным раствором бикарбоната натрия. Сушат сульфатом магния и концентрируют досуха. Очищают хроматографически на диоксиде кремния, элюируя смесью CH2Cl2 - CH3OH (94:6). Продукт растворяют в 1 мл простого этилового эфира, затем осаждают путем добавления 5 мл н-пентана. Центрифугируют и сушат. Получают 139 мг искомого продукта.
Спектр ЯМР 1H (300 МГц, ДМСО-d6, м.д.) δ: 1,07(с, 3Н), 1,30(с, 3Н), 1,24(ш. с, 2Н), 1,27(ш.с, 2Н), 2,24 (с, 3Н), 2,25 (ш.с, 3Н), 3,48 (с, 3Н), 3,58 (м, 1Н), 3,66(д, 1Н, J=10,0 Гц), 4,18(ш, 1Н), 5,48(дд, 1Н, J=3,0 и 10,0 Гц), 5,68(д, 1Н, J=2,5 Гц), 5,75(д, 1Н, J=5,0 Гц), 5,93 (т, 1Н, J=3,0 Гц), 6,79 (т, 1Н, J=3,0 Гц), 7,24(д, 1Н, J=9,0 Гц), 7,91(д, 1Н, J=9,0 Гц), 11,67 (с, 1Н), 13,88 (ш, 1Н).
ПРИМЕРЫ ФАРМАЦЕВТИЧЕСКИХ КОМПОЗИЦИЙ
Изготовляют таблетки, содержащие:
Продукт примера 4 150 мг, эксципиент - достаточное количество до 1 г.
Состав эксципиента: крахмал, тальк, стеарат магния.
Продукт примера 5 150 мг, эксципиент - достаточное количество до 1 г.
Состав эксципиента: крахмал, тальк, стеарат магния.
Продукт примера 2 150 мг, эксципиент - достаточное количество до 1 г.
Состав эксципиента: крахмал, тальк, стеарат магния.
Равным образом, исходя из соответствующих солей изготовляют растворы, предназначенные для инъекций.
ФАРМАКОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ ПРОДУКТОВ СОГЛАСНО ИЗОБРЕТЕНИЮ
А. Метод разведений в жидкой среде.
Готовят серию пробирок, в которые помещают одно и то же количество стериальной питательной среды. В пробирки вносят возрастающие количества исследуемого продукта, затем каждую пробирку засевают бактериальным штаммом. После инкубации в течение 24 часов в термостате при 37oC определяют степень ингибирования роста путем просвечивания пробирок, что позволяет определить минимальные ингибирующие концентрации (МИК), выраженные в мкг/см3, на следующих штаммах:
S.aureus - 011HT3
S.aureus - 011UC4
S.aureus - 011HT28
S.epidermidis - 012G020
S.aureus - 011DU5
S.aureus - 011СВ20
S.aureus - 011НТ26
S.epidermidis - 012G039
S.epidermidis - 012НI1
Staph.coag.negative - 012HT5
Staph.coag.negative - 014HI1
S.pyogenes - 02A1UC1
Были получены следующие результаты:
0,04<МИК<20.
Б. ингибирование гиразы В.
Продукты являются ингибиторами гиразы В; доза для 50% супервитков ДНК меньше 5 мкг/мл.
Изобретение относится к производным бензопиран-2-она формулы I, где R1 обозначает атом водорода, гидроксильный радикал, необязательно замещенный алкильный радикал, необязательно прерванный атомом кислорода, серы или азота, алкоксильный радикал или радикал NRcRd, X обозначает атом кислорода или радикал N-N(СН3)2, или радикал NOalc2, в котором alc2 обозначает необязательно замещенный алкильный радикал, необязательно прерванный атомом кислорода, серы или азота, R2 обозначает атом водорода или атом галогена, R3 обозначает атом водорода, алкильный радикал или атом галогена, R4 обозначает радикал NRgRh, необязательно замещенный арильный или гетероарильный радикал, R5 обозначает атом водорода или O-алкил, R6 обозначает алкил или СН2-O-алкил, R7 обозначает атом водорода или алкил. Указанные соединения обладают антибактериальной активностью. Описан способ получения соединений формулы I и используемые в нем промежуточные соединения формул II, III и IV, а также фармацевтическая композиция на основе соединений формулы I. 7 с. и 14 з.п. ф-лы.
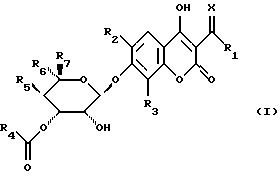
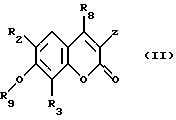
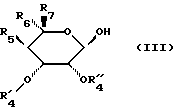
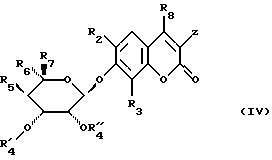
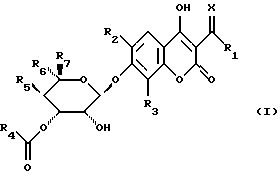
в которой Ri обозначает атом водорода, гидроксильный радикал, алкильный радикал, необязательно прерванный атомом кислорода, серы или азота, содержащий до 12 атомов углерода, линейный, разветвленный или циклический, необязательно замещенный радикалом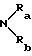
в котором Ra и Rb, одинаковые или разные, обозначают атом водорода, алкильный радикал, содержащий до 8 атомов углерода, или Ra и Rb образуют с атомом азота, с которым они связаны, гетероцикл, необязательно содержащий другой гетероатом, выбираемый среди азота, серы или кислорода;
или R1 обозначает алкоксильный радикал, содержащий до 8 атомов углерода, или R1 обозначает радикал NRcRd, в котором Rc и Rd, одинаковые или разные, обозначают атом водорода или алкильный радикал, содержащий до 12 атомов углерода;
или Rc и Rd образуют вместе с атомом азота, с которым они связаны, гетероцикл, необязательно содержащий другой гетероатом, выбираемый среди азота, серы или кислорода;
X обозначает атом кислорода, или радикал N-N(CH3)2, или радикал NOalc2, в котором аlс2 обозначает алкильный радикал, необязательно прерванный атомом кислорода, серы или азота, содержащий до 12 атомов углерода, необязательно замещенный одним или несколькими атомами галогена, одним или несколькими радикалами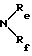
в которых Re и Rf, одинаковые или отличающиеся друг от друга, обозначают атом водорода, алкильный радикал, содержащий до 8 атомов углерода, необязательно замещенный, или Re и Rf могут образовывать вместе с атомом азота, с которым они связаны, гетероцикл, который может содержать, кроме того, атом кислорода, серы и другой атом азота;
R2 обозначает атом водорода или атом галогена;
R3 обозначает атом водорода, алкильный радикал, содержащий до 8 атомов углерода, или атом галогена;
R4 обозначает радикал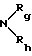
в котором Rg и Rh, одинаковые или отличающиеся друг от друга, обозначают атом водорода, алкильный радикал, линейный, разветвленный или циклический, содержащий до 8 атомов углерода, арильный или гетероарильный радикал, необязательно замещенный, или Rg и Rh образуют с атомом азота, с которым они связаны, гетероцикл, который может содержать, кроме того, атом кислорода, серы и другой атом азота,
или R4 обозначает арильный или гетероарильный радикал, необязательно замещенный одним или несколькими атомами галогена, одним или несколькими гидроксильными радикалами, одним или несколькими алкильными или алкоксильными радикалами, содержащими до 8 атомов углерода;
R5 обозначает атом водорода, радикал O-алкил, содержащий до 4 атомов углерода;
R6 обозначает радикал алкил или СН2-О-алкил, в котором алкил обозначает алкильный радикал, содержащий до 8 атомов углерода;
R7 обозначает атом водорода или алкильный радикал, содержащий до 8 атомов углерода, также как соли соединений формулы I.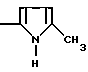
8. Соединения формулы I по любому из пп. 1-6, в которых R4 обозначает радикал NH-циклопропил.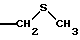
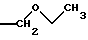
NH2, OC2H5
14. Соединения формулы I по п. 13, в которых R1 представляет собой радикал метил или O-этил.
3'-[5-метил-1Н-пиррол-2-карбоксилат] 3-ацетил-7-((6-дезокси-5-С-метил-4-O-метил-альфа-L-ликсо-гексопиранозил)-окси)-4-гидрокси-8-метил-2Н-1-бензопиран-2-она,
3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-((6-дезокси-5-С-метил-4-O-метил-альфа-L-ликсо-гексопиранозил)окси)-4-гидрокси-8-метил-2-оксо-2Н-1-бензопиран-3-этилкарбоксилата,
3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-((6-дезокси-5-С-метил-4-O-метил-альфа-L-ликсо-гексопиранозил)окси)-4-гидрокси-3(1-(метоксиимино)этил)-8-метил-2Н-1-бензопиран-2-она,
3'-[5-метил-1Н-пиррол-2-карбоксилат] 7((6-дезокси-5-С-метил-4-O-метил-альфа-L-ликсо-гексопиранозил)окси)-3-(этокси-ацетил)-4-гидрокси-8-метил-2Н-1-бензопиран-2-она,
3'-[5-метил-1Н-пиррол-2-карбоксилат] 3-(циклопропилкарбонил)-7-((6-дезокси-5-С-метил-4-O-метил-альфа-L-ликсо-гексо-пиранозил)окси)-4-гидрокси-8-метил-2Н-1-бензопиран-2-она,
3'-[5-метил-1Н-пиррол-2-карбоксилат] 7-((6-дезокси-5-С-метил-4-O-метил-альфа-L-ликсо-гексопиранозил)окси)-4-гидрокси-8-метил-2-оксо-2Н-1-бензопиран-3-карбоксамида.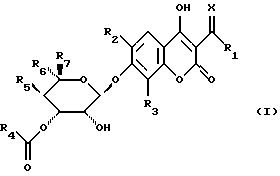
в которых заместители имеют значение, указанное в любом из пп. 1-15,
отличающийся тем, что соединение формулы II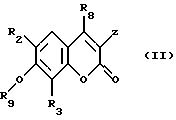
в которой R8 обозначает свободный или блокированный гидроксильный радикал;
Z обозначает атом водорода или радикал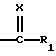
X, R1, R2 и R3 имеют указанное выше значение;
OR9 обозначает свободный или блокированный гидроксильный радикал,
подвергают воздействию соединения формулы III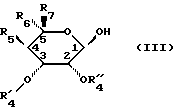
в которой R5, R6 и R7 имеют указанное выше значение;
OR'4 обозначает блокированный гидроксильный радикал;
R"4 обозначает атом водорода или R'4 и R''4 образуют вместе с атомами углерода, с которыми они связаны, цикл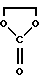
согласно реакции Мицунобу,
с получением соединения формулы IV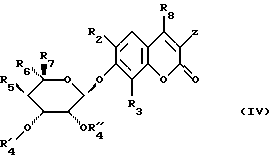
в которой заместители сохраняют их предыдущее значение,
затем полученное таким образом соединение формулы IV подвергают следующим стадиям, в совокупности или частично: высвобождению гидроксила в положении 4 кумарина после возможного блокирования гидроксила сахара в альфа-положениии OR'4, если Z является атомом водорода, введению радикала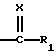
после возможного блокирования реакционноспособных гидроксильных групп, введению радикала -СO-R4 путем замещения этим радикалом радикала R'4, модификации радикала X.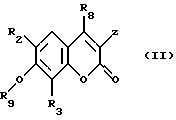
в которой R8 обозначает свободный или блокированный гидроксильный радикал;
Z обозначает атом водорода или радикал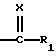
X, R1, R2 и R3 имеют значения, указанные в п. 1;
OR9 обозначает свободный или блокированный гидроксильный радикал.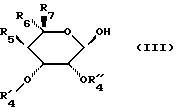
в которой R5, R6 и R7 имеют значения, указанные в п. 1,
OR'4 обозначает блокированный гидроксильный радикал;
R"4 обозначает атом водорода или R'4 и R"4 образуют вместе с атомами углерода, с которыми они связаны, цикл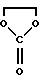
19. Соединения формулы IV
в которой R2, R3, R5, R6 и R7 имеют значения, указанные в п. 1;
OR'4, R'4 и R''4 имеют значения, указанные в п. 18;
R8, имеет значение, указанное в п. 17;
Z обозначает атом водорода или радикал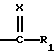
20. Соединения формулы I по любому из пп. 1-15 в качестве лекарственного антибактериального средства.
| FR 1580886 A, 12.09.1969 | |||
| FR 1515929 A, 08.03.1968 | |||
| Насадка на объектив телескопической системы | 1947 |
|
SU84092A2 |
| Экономайзер | 0 |
|
SU94A1 |
| 6-Гексадеканоиламино-4-метилумбеллиферил- @ - @ -галактопиранозид в качестве флуорогенного субстрата для определения активности галактоцереброзид- @ -галактозидазы | 1983 |
|
SU1119334A1 |
Авторы
Даты
2002-12-10—Публикация
1997-06-10—Подача