Изобретение главным образом имеет отношение к текущему контролю сердечной деятельности и особенно касается определения частоты сердечных сокращений (HR), ударного объема сердца (SV) и минутного сердечного выброса (СО) за счет получения сигналов торакального биоимпеданса и электрокардиограмм (ЭКГ) и их комплексного анализа, что позволяет точно определить начало левого желудочкового выброса.
Частота сердечных сокращений (HR) представляет собой число биений сердца в минуту. Ударный объем сердца (SV) представляет собой объем крови, нагнетаемой во время одного сердечного сокращения. Минутный сердечный выброс (СО) представляет собой объем крови, нагнетаемой в течение одной минуты, что обычно считают наиболее существенным средством измерения работоспособности сердца. Терапевты зачастую должны полагаться на указанные параметры сердца для диагностики заболеваний сердца, для оценки общего состояния пациента, определения наиболее подходящего метода лечения и для быстрого обнаружения внезапного ухудшения сердечной деятельности.
Существующие в настоящее время методы измерения минутного сердечного выброса и других параметров сердца могут быть подразделены на две категории: инвазивные и неинвазивные. Инвазивные методы требуют, чтобы практикующий врач вводил в тело пациента измерительное устройство, такое как, например, катетер в горло, что создает множество неудобств как для пациента, так и для врача. При этом пациент часто должен испытывать сильную боль и дискомфорт, а врач должен производить относительно сложную процедуру и иногда подвергать себя риску контакта с инфекционной кровью.
Используемые в настоящее время неинвазивные методы являются большим шагом вперед, но все еще страдают существенными ограничениями. Для расчета параметров сердца чаще всего применяют ультразвук, фонокардиографию или электрический биоимпеданс.
Способы, в которых используется измерение биоимпеданса, предусматривают размещение множества электродов на поверхности кожи пациента (главным образом в торакальной области), генерирование электрического тока высокой частоты и малой амплитуды от некоторых электродов в тело пациента, измерение изменений электрического импеданса тканей пациента в течение времени, и коррелирование изменений электрического импеданса с параметрами сердца.
Вид установки электродов на теле пациента играет важную роль в обеспечении точности измерений конечного параметра сердца. По причине различных анатомических факторов электроды должны быть установлены в определенных зонах тела, чтобы получить оптимальную корреляцию между измеренными изменениями биоимпеданса и параметрами сердца. Многие из используемых в настоящее время конфигураций электродов не могут адекватно учитывать прохождение линий электрического потенциала через грудную клетку, в результате чего создаются искажения при измерениях сердечной деятельности. Более того, при установке небольшого числа электродов требуется использовать ленточные электроды, например воздействующие ленточные электроды А, В и измерительные ленточные электроды С, D, каждый из которых имеет ширину "n" (см. фиг.1). Эти ленточные электроды обычно обертывают вокруг пациента подобно поясу, дополнительно ограничивая доступ к пациенту, что особенно нежелательно в ходе процедур реанимации. Движение, связанное с дыханием, также делает ленточные электроды очень неудобными для их установки на шее и груди.
Может быть наиболее существенной проблемой при использовании существующих в настоящее время способ измерения биоимпеданса является неточный математический расчет параметров сердца из измерений биоимпеданса. Время желудочкового выброса (VET) представляет собой измеренный промежуток времени между открыванием и закрыванием клапанов аорты в ходе цикла систола-диастола сокращения сердца, причем измерение этого времени представляет собой промежуточный этап в определении ударного объема сердца (SV). До настоящего времени не существует способа определения времени желудочкового выброса (VET) с достаточной точностью. Более того, известные способы не учитывают тот факт, что VET не является единственным событием. В действительности существует левое VET и правое VET. Уже было показано, что производная по времени сигнала импеданса в действительности пропорциональна пику потока крови аорты, выбрасываемой левым желудочком. Результаты измерения левого VET и правого VET для большинства пациентов обычно очень близки, однако даже небольшое различие межу ними может создавать ошибки в измерении биоимпеданса в соответствии со способами, которые обычно используют в настоящее время.
Более того, классический алгоритм нахождения времени начала выброса выработан и хорошо работает только для здорового пациента в состоянии покоя. Он неточен для пациентов при физической тренировке или в состоянии другой физической нагрузки, а также для пациентов с критическими заболеваниями, таких как пациенты, находящиеся в блоках интенсивной терапии.
Традиционное уравнение для расчета ударного объема сердца (SV) из сигналов биоимпеданса известно как уравнение Кубичека и выглядит следующим образом:
SV=R(L/Z0)2•ΔZ,
в котором SV представляет собой ударный объем сердца, R - удельное сопротивление крови, L - расстояние между внутренним и наружным электродами измерения напряжения, Z0 - средний торакальный импеданс, найденный при помощи внутренних электродов измерения напряжения, а ΔZ представляет собой изменение импеданса, вызванное притоком крови. Кубичек дает следующую оценку значения ΔZ:
ΔZ=(VET)•(dZ/dt)max,
в котором VET представляет собой комбинированное время выброса левого и правого желудочков, а (dZ/dt)max представляет собой максимальное изменение отрицательного наклона производной по времени сигнала импеданса. В большинстве систем текущего контроля биоимпеданса сердца используют некоторый вид уравнения Кубичека.
Однако без дополнительного уточнения уравнение Кубичека зачастую приводит к погрешностям измерения. Это вызвано частично тем фактом, что оба желудочка содействуют изменениям импеданса, так что рассчитанное по Кубичеку время выброса VET не может быть объединено с определенным, а именно с левым решающим желудочком. Вместе с тем оценка ΔZ по Кубичеку становится недейственной, когда наблюдается сильный асинхронизм левого-правого желудочков. В результате расчет SV по Кубичеку часто пропорционален, но не равен действительному ударному объему сердца, и поэтому результат должен быть умножен на некоторый коэффициент поправки. Кроме того, в известных решениях не раскрыт способ уточнения R в соответствии с флуктуациями гематокрита (числа эритроцитов) пациента. Уточнение R особенно важно для пациентов, подвергающихся переливанию крови.
Многие способы биоимпедансной кардиографии требуют, чтобы пациент задерживал свое дыхание во время каждого измерения, так как дыхание создает помехи для сигнала биоимпеданса. Такие способы не годятся для некоторых пациентов и совершенно бесполезны для тех пациентов, которые находятся в бессознательном состоянии или не способны задерживать свое дыхание. Некоторые из недавно появившихся способов предусматривают возможность обработки сигнала для его усиления, идентификации эффектов дыхания и устранения дефектных сигналов, так что в окончательные вычисления погрешности не вносятся. Эффективная обработка сигнала является ключевым средством обеспечения точности при биоимпедансной кардиографии и усовершенствования этой техники являются существенным достижением в данной области.
В соответствии с настоящим изобретением раскрыт способ измерения гемодинамических параметров с использованием новой комбинации биоимпедансной кардиографии и электрокардиографии, что позволяет практикующим врачам получать точную, главным образом непрерывную оценку состояния сердечной деятельности пациента. Сигналы биоимпеданса и электрокардиограммы измеряют в течение временного интервала, преимущественно превышающего десять (10) сокращений сердца.
В устройстве в соответствии с настоящим изобретением использовано несколько точечных электродов, приспособленных для установки на поверхности кожи пациента, и генерирующих электрический ток высокой частоты и малой амплитуды через грудную клетку пациента, причем указанное устройство осуществляет измерение изменений биоимпеданса. Раскрытая конфигурация электродов использует физиологическое расположение электрических силовых линий потенциала в теле пациента.
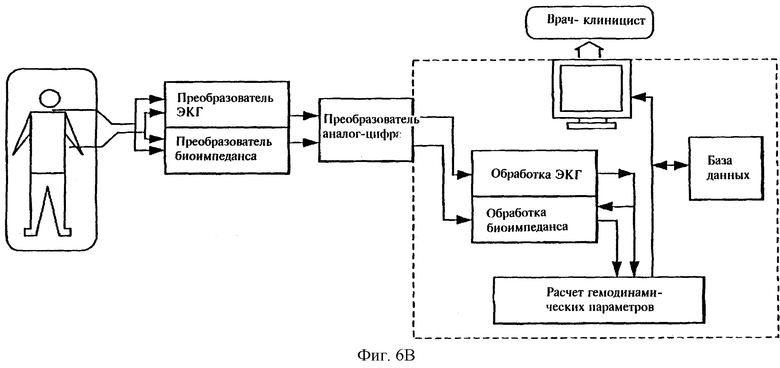
Вместе с тем в способе в соответствии с настоящим изобретением может быть использована электрокардиография для повышения точности измерения времени выброса из измеренного сигнала биоимпеданса. Электрокардиограмма может быть получена в любом стандартном положении, хорошо известном в электрокардиографии. Для уменьшения общего числа электродов на поверхности кожи пациента в соответствии с настоящим изобретением один и тот же набор электродов может быть использован как для измерений биоимпеданса, так и для ЭКГ измерений (см. фиг.6В).
Настоящее изобретение может также предусматривать непрерывное уточнение расчета параметров сердца в соответствии с изменениями числа эритроцитов и в соответствии с разным строением тела различных пациентов, причем настоящее изобретение может быть использовано в самых различных обстоятельствах без потери точности.
Кроме того, в соответствии с настоящим изобретением предусмотрен способ улучшенной обработки сигнала биоимпеданса. В этом способе может быть использована компьютерная система для анализа различными путями как сигнала биоимпеданса, так и электрокардиограммы, для получения точных результатов параметров сердца. Компьютерная система может быть использована для ввода коррекций искажений в характеристиках усиление - фаза - частота, вызванных преобразователями, использованными для измерения биоимпеданса и ЭКГ. Компьютерная система подает синусоидальную испытательную кривую на приемник преобразователя и может затем измерять и регистрировать искажения в характеристиках усиление - фаза - частота, созданные приемником. "Реальные" сигналы биоимпеданса, получаемые в последующем компьютерной системой при помощи преобразователя, могут быть пропущены через фильтры, которые устраняют как искажения характеристик преобразователя, так и артефакты дыхания и перемещения (движения) пациента. Может быть обеспечена корректировка точности характеристики усиление - частота и характеристики фаза - частота в пределах 5%.
Кроме того, в соответствии с настоящим изобретением предусмотрен способ обработки ЭКГ сигнала для определения QRS комплексов (характеристических форм сигнала сокращений сердца) и нахождения положений контрольных точек, используемых для уточнения расчетов сигнала биоимпеданса. Обработка сигнала может предусматривать дискретизацию измеренного ЭКГ сигнала и его фильтрацию для выделения положений QRS комплексов. Может быть произведена регистрация двойных амплитуд и может быть вычислена пороговая амплитуда. Свободные от дефектов QRS комплексы отбирают с использованием пороговой амплитуды. Наконец, может быть проведен дополнительный анализ отобранных событий для определения положений контрольных точек.
Компьютерная система в соответствии с настоящим изобретением может вырабатывать и хранить в памяти производной по времени сигнала биоимпеданса. Кривая, полученная при помощи производной по времени сигнала биоимпеданса, может быть отложена на графике с осью времени, и может отображать повторяющиеся кардиоциклы. Может быть рассчитан спектр мощности сигнала биоимпеданса при помощи дискретного преобразования Фурье, который может быть исследован для оценки частоты сердечных сокращений пациента, а также для нахождения фронтов каждого кардиоцикла. Новый математический алгоритм автосвертки может быть использован для выделения гармоник частоты сердечных сокращений в производной по времени сигнала биоимпеданса.
Волны дыхания могут быть устранены за счет выработки огибающей внутри спектра мощности, в которой должны быть заключены сигналы кардиоцикла, с последующим удалением таких сигналов, которые лежат вне огибающей.
В компьютерной системе может быть использован новый способ получения эффективного времени выброса левого желудочка (ELVET) из сигналов биоимпеданса и сигналов ЭКГ. В частности, точное нахождение времени начала выброса основано на комплексном анализе сигналов биоимпеданса и ЭКГ. Величину ELVET получают в результате детального многооперационного анализа, который предусматривает нахождение различных точек на кривой производной по времени биоимпеданса, базируясь на соответствующих точках на кривой ЭКГ и определяя, какие из этих точек наиболее точно отображают кардиособытия. Этот анализ требует проведения различных математических вычислений, в том числе аппроксимаций дифференциалов производной по времени кривой биоимпеданса.
Здоровые пациенты имеют очень небольшой асинхронизм левого-правого желудочков или асинхронизм между открыванием левого и правого клапанов желудочков. Однако для пациентов с серьезными заболеваниями уравнение Кубичека обычно занижает производную по времени сигнала биоимпеданса по причине асинхронизма левого-правого желудочков. Компьютерная система в соответствии с настоящим изобретением автоматически регулирует сигналы, которые испытывают асинхронизм между открыванием левого и правого клапанов желудочков, и вычисляет правильное время ΔZ, изменений импеданса, вызванных притоком крови.
После вычисления компьютерной системой ELVET и ΔZ она использует усовершенствованную форму уравнения Кубичека для получения ударного объема сердца из ELVET и удельного сопротивления крови, с учетом специфического строения тела пациента и максимального изменения биоимпеданса. Компьютерная система анализирует производную по времени сигнала биоимпеданса для устранения кардиоциклов с некоторыми искажениями (аберрациями).
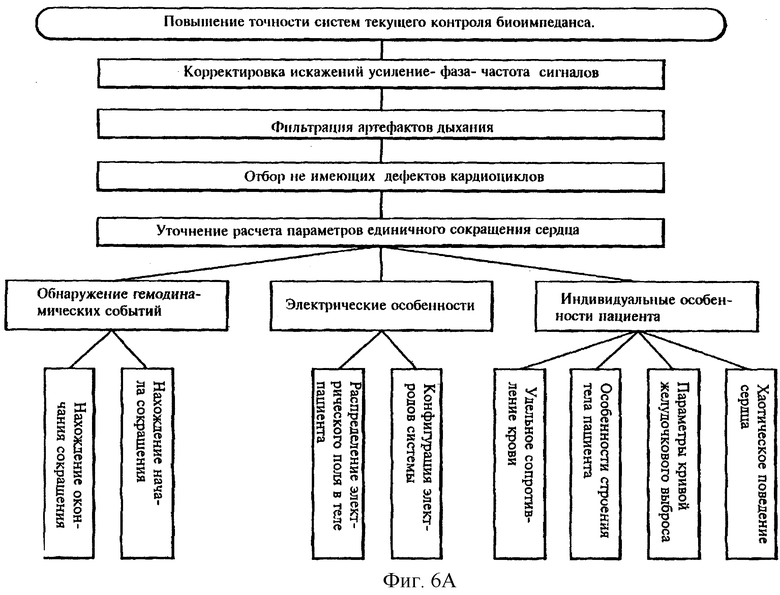
Наконец, настоящее изобретение также включает в себя способ обнаружения действенных кардиоциклов.
На фиг.1 схематично показана установка электродов ленточного типа на теле пациента.
На фиг. 2А, 2В и 2С схематично показана установка в соответствии с настоящим изобретением электродов точечного типа на теле пациента.
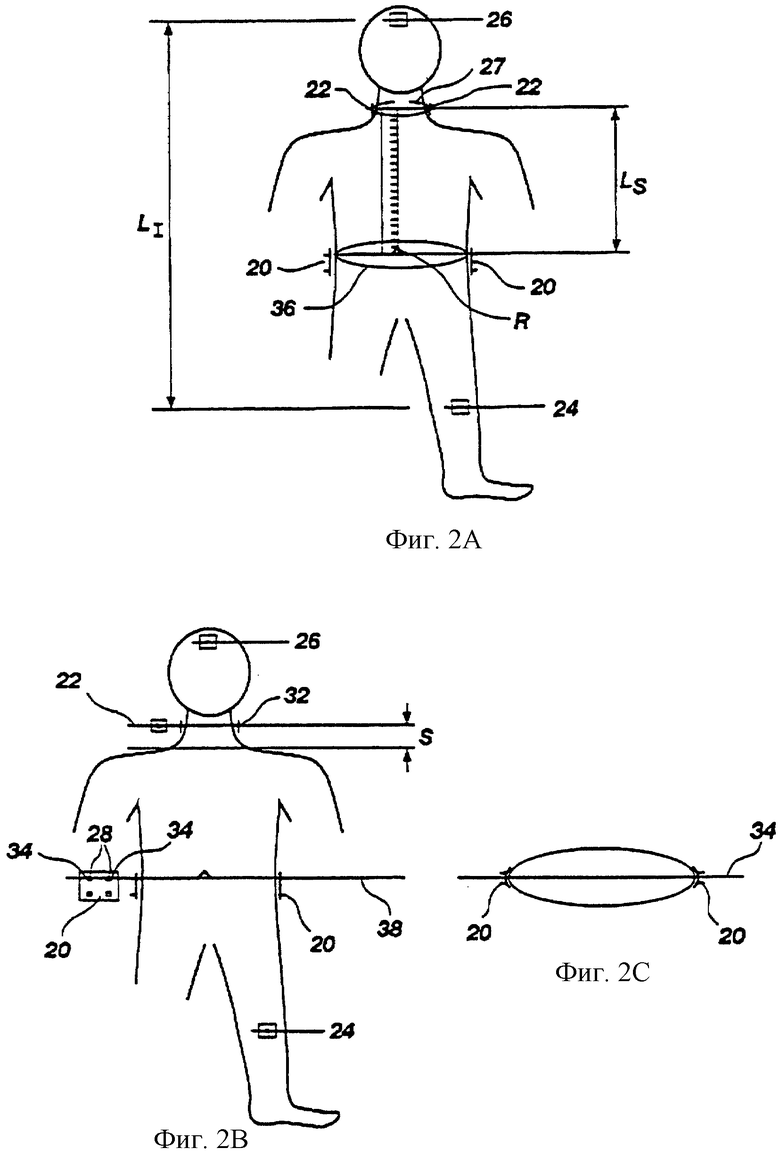
На фиг. 3А показаны представляющие интерес анатомические зоны установки измерительных грудных (торакальных) электродов в соответствии с настоящим изобретением.
На фиг. 3В показано расположение анатомических зон фиг.3А на теле пациента.
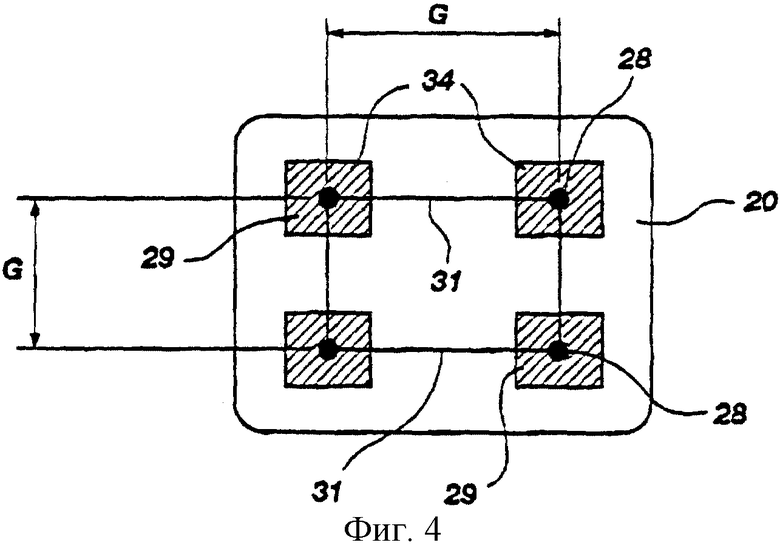
На фиг.4 показана конструкция индивидуального грудного электрода в соответствии с настоящим изобретением.
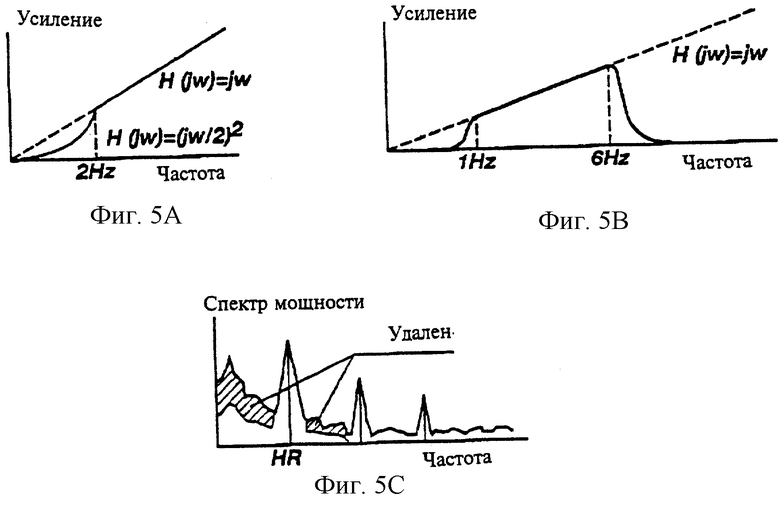
На фиг. 5А показан график характеристик усиление - частота А-фильтра в соответствии с настоящим изобретением, который использован для дифференцирования сигнала и подавления гармоник.
На фиг. 5В показан график характеристики усиление - частота В-фильтра, который использован в соответствии с настоящим изобретением для выделения фронтов кардиоциклов.
На фиг. 5С показан график фильтрации, которая использована для удаления волн дыхания спектра мощности из суммарного (дыхание плюс кардиоволна) спектра мощности в соответствии с настоящим изобретением.
На фиг. 6А приведена блок-схема методологии в соответствии с настоящим изобретением.
На фиг.6В приведена блок-схема обработки сигнала и показано устройство, которое использовано для осуществления способа в соответствии с настоящим изобретением.
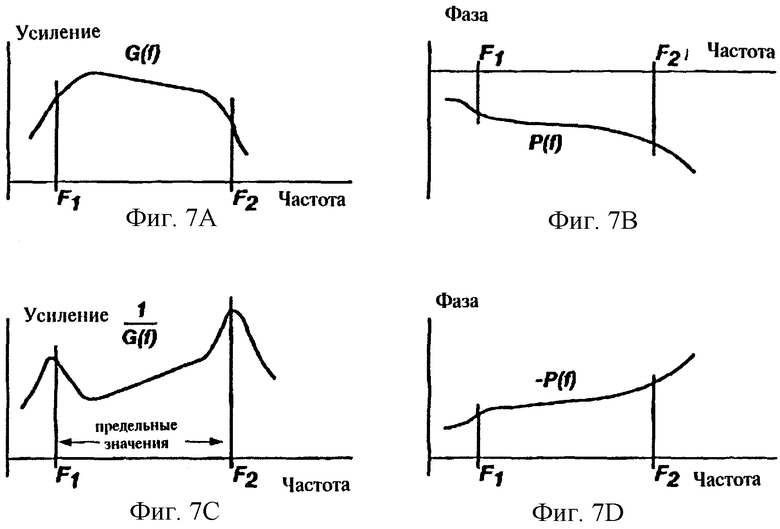
На фиг. 7А показана характеристика усиление - частота G(f) преобразователя биоимпеданса в соответствии с настоящим изобретением.
На фиг. 7В показана характеристика фаза - частота P(f) преобразователя биоимпеданса в соответствии с настоящим изобретением.
На фиг. 7С показана характеристика усиление - частота 1/G(f) восстанавливающего или R-фильтра, соответствующего характеристике фиг.7А и используемого для корректировки GPF в соответствии с настоящим изобретением.
На фиг. 7D показана характеристика фаза - частота - P(f) восстанавливающего или R-фильтра, соответствующего характеристике фиг.7В и используемого для корректировки GPF в соответствии с настоящим изобретением.
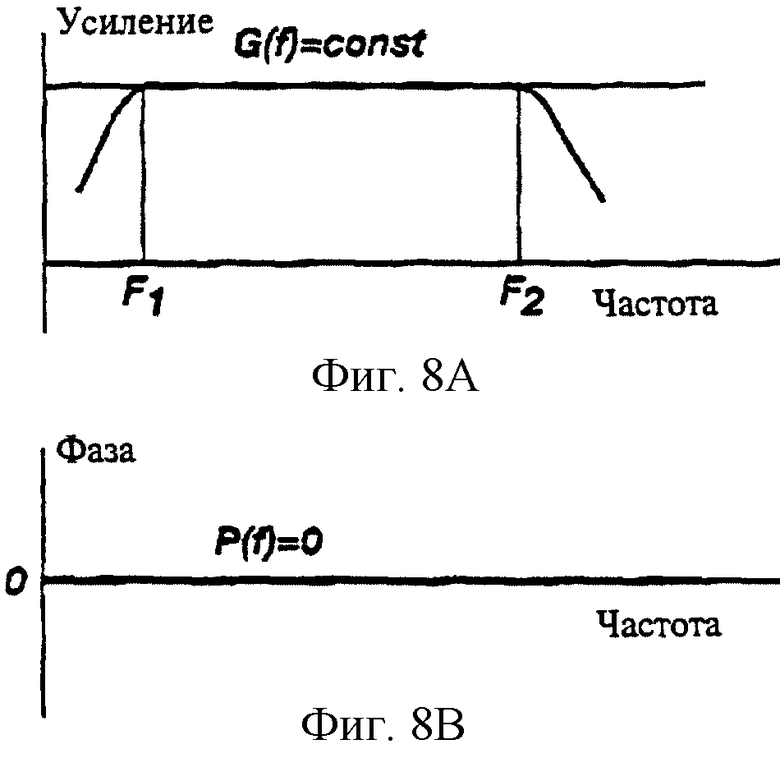
На фиг.8А показана результирующая характеристика усиление - частота G(f) сигнала преобразователя, скорректированного при помощи R-фильтра в соответствии с настоящим изобретением.
На фиг.8В показана результирующая характеристика фаза - частота P(f) сигнала преобразователя, скорректированного при помощи R-фильтра в соответствии с настоящим изобретением.
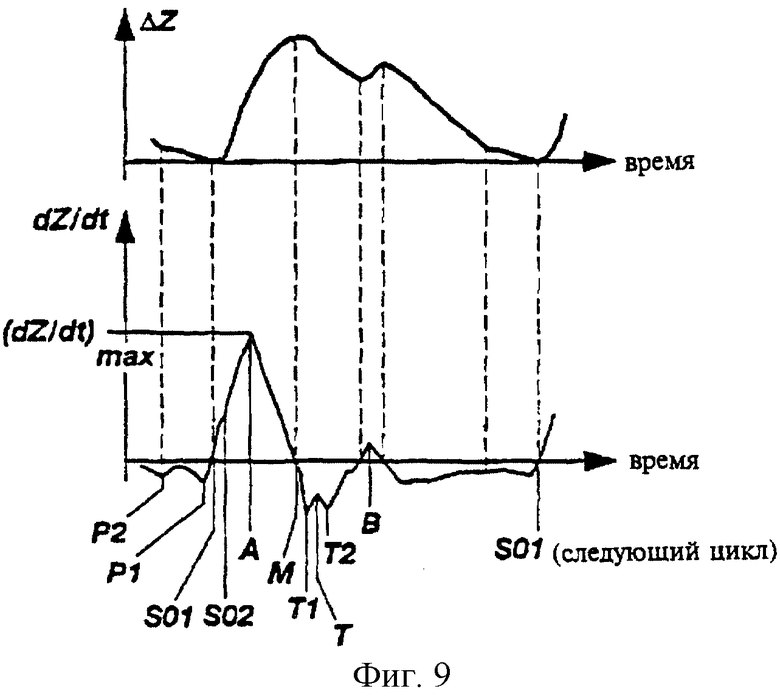
На фиг. 9 показана производная по времени сигнала биоимпеданса, полученная в соответствии с настоящим изобретением, нанесенная на графике с осью времени и отражающая примерные изменения импеданса, вызванные притоком крови (ΔZ) указанного временного промежутка.
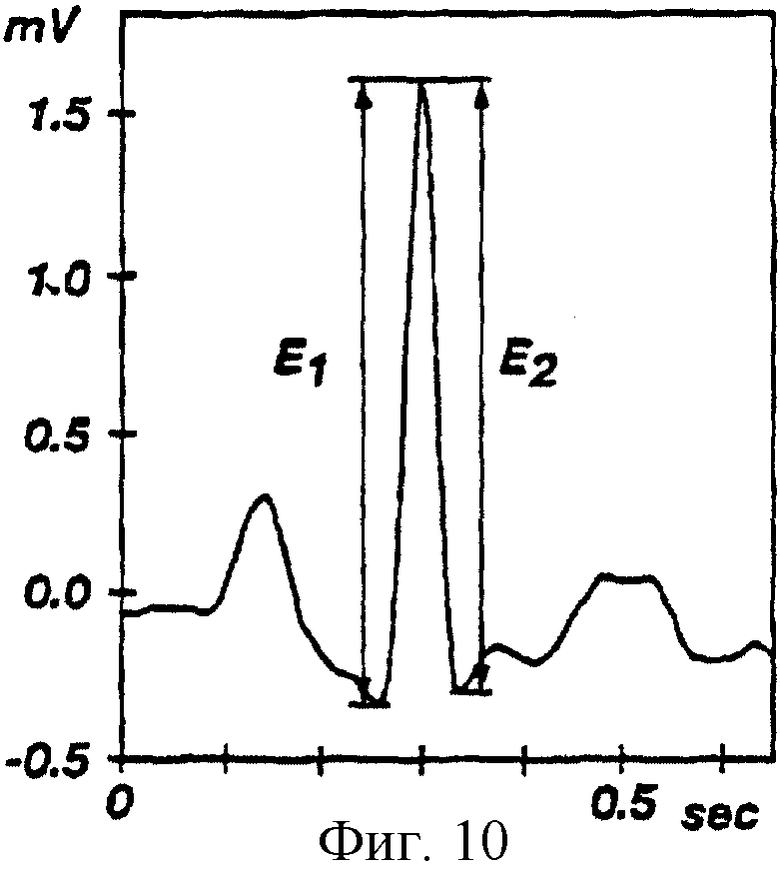
На фиг.10 показан график электрического потенциала, пересекающего сердце пациента, отложенный на графике с осью времени (электрокардиограмма), отображающий двойные амплитуды (E1 - передний фронт, Е2 - задний фронт) QRS комплекса одного сокращения сердца.
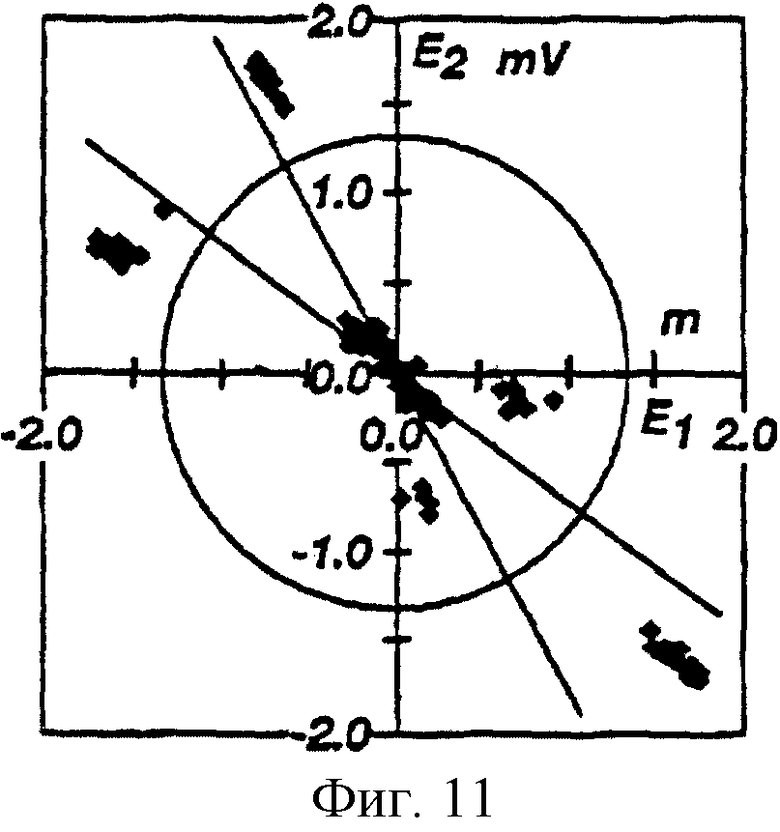
На фиг. 11 показана диаграмма рассеяния всех пиков, измеренных на электрокардиограмме в течение периода 10 секунд. Координатами графика являются Е1 и E2, а QRS комплексы показаны в пунктирном круге в нижнем правом углу.
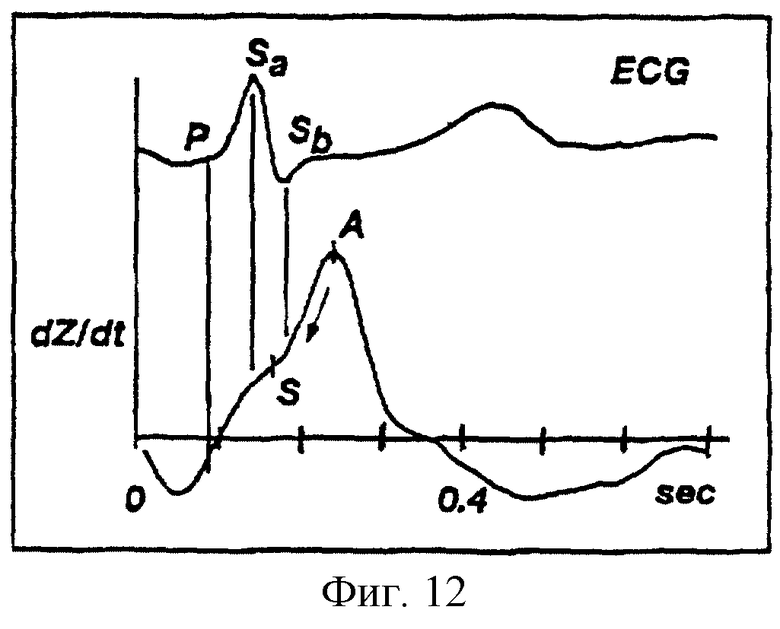
На фиг. 12 показаны ЭКГ сигнал и производная по времени сигнала биоимпеданса, отложенные на графике с осью времени, где указаны контрольные точки Р, Sa и Sb ЭКГ сигнала относительно контрольных точек Q, S и А производной по времени сигнала биоимпеданса.
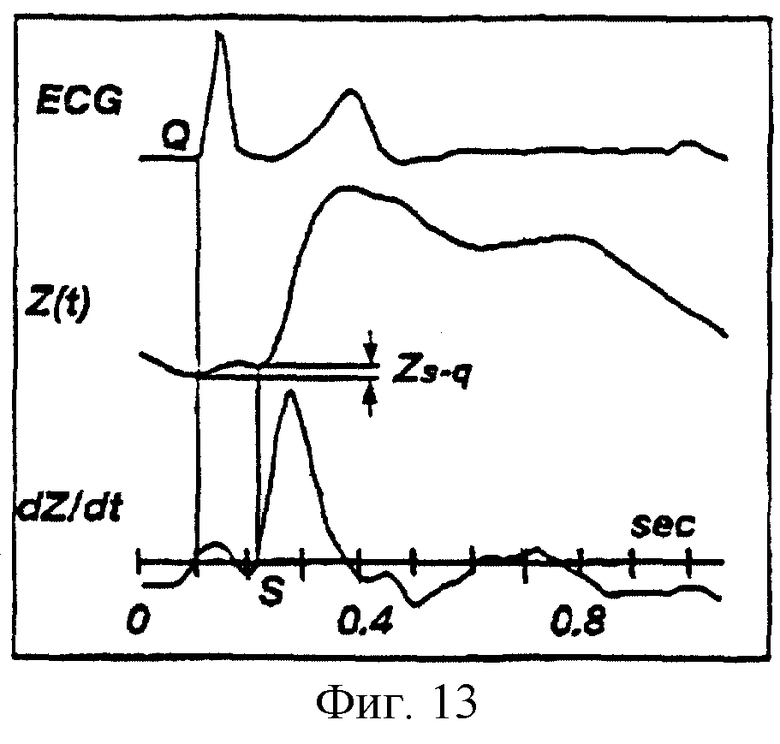
На фиг.13 показаны ЭКГ, биоимпеданс Z(t) и производная по времени сигнала биоимпеданса dZ/dt, отложенные на графике с осью времени, где указана разность ZS-Q биоимпеданса между точками S и Q для здорового пациента.
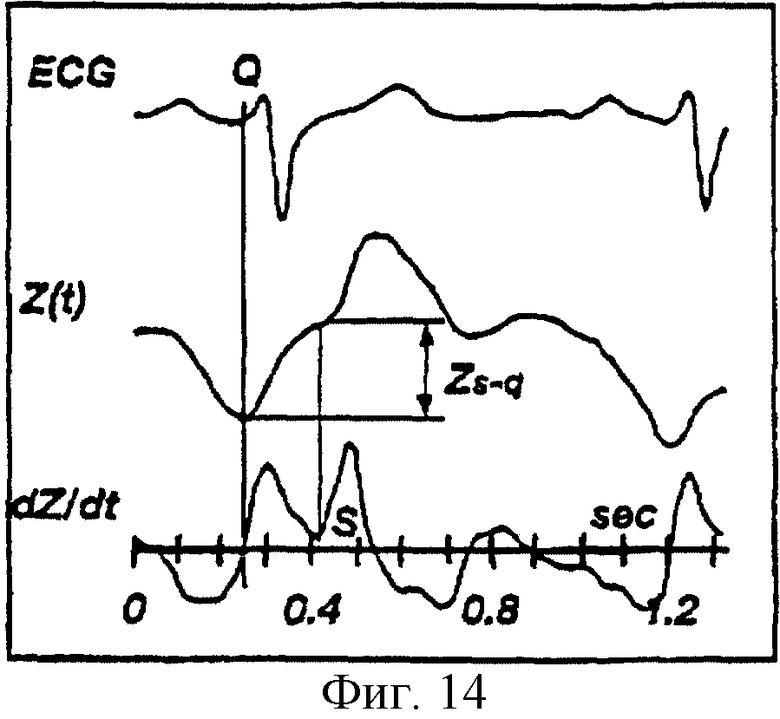
На фиг.14 показаны ЭКГ, биоимпеданс Z(t) и производная по времени сигнала биоимпеданса dZ/dt, отложенные на графике с осью времени, где указана разность ZS-Q биоимпеданса между точками S и Q для пациента с ишемической болезнью сердца.
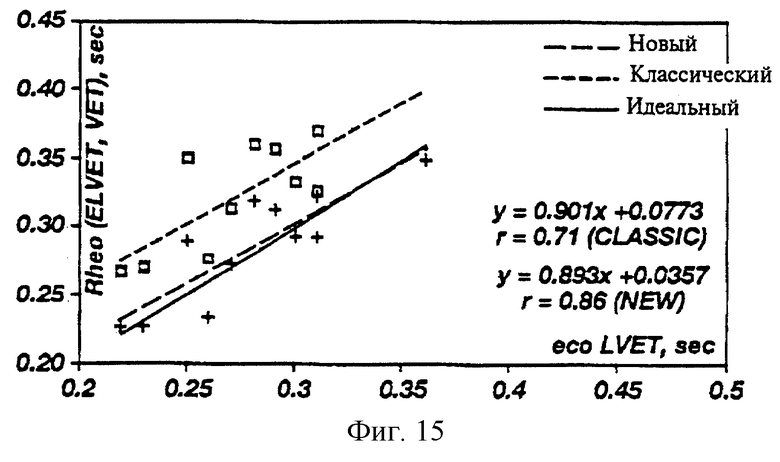
На фиг. 15 приведено графическое отображение корреляции способа определения ELVET в соответствии с настоящим изобретением с идеальным ультразвуковым определением, в сравнении с методологией классического алгоритма Кубичека.
Первая операция в соответствии с настоящим изобретением предусматривает проведение измерений биоимпеданса на сегментах ткани тела пациента. Токовые электроды должны быть установлены в соответствующих точках на поверхности кожи, чтобы вырабатывать (генерировать) электрический ток высокой частоты с малой амплитудой и детектировать (обнаруживать) изменения в генерированном токе после его прохождения через сегменты ткани (фиг. 2А, 2В, 3 и 4). Электроды представляют собой скорее "точечные", а не "ленточные" электроды, чтобы обеспечить максимальную свободную область тела пациента. Преимущественно используют одноразовые точечные электроды. В результате пациент имеет увеличенную свободу перемещения, а практикующие врачи имеют больший доступ к коже пациента для проведения других медицинских процедур, таких как ввод катетеров и назначение анестезии.
В системе биоимпедансных электродов всего используется 6 электродов: два измерительных электрода 20 на уровне мечевидного отростка, два измерительных электрода 22, установленных сбоку на шее, воздействующий токовой электрод 24 на левой ноге и воздействующий токовой электрод 26 на лбу.
В качестве воздействующих электродов 24, 26 могут быть использованы стандартные точечные ЭКГ электроды с контактной площадью 2 см на 2 см.
Верхний воздействующий электрод 26 преимущественно установлен посередине лба, у его средней линии. Нижний воздействующий электрод 24 преимущественно установлен на левом колене или несколько ниже левого колена, например, на левой ступне. Если это необходимо, то нижний воздействующий электрод 24 может быть установлен выше уровня колена, при условии соблюдения следующего соотношения: L>5R, в котором L представляет собой расстояние между воздействующими электродами, a R является радиусом грудной клетки. Левую ногу используют вместо правой ноги для учета анатомической асимметрии сердца. Физиологическое расположение дуги аорты, через которую проходит значительная концентрация электрических силовых линий потенциала, делает левую ногу более подходящей для установки нижнего воздействующего электрода. Установка воздействующих электродов указанным образом гарантирует однородное распределение силовых линий воздействующего тока между измерительными электродами, что помогает в результате свести к минимуму погрешность конечных измерений параметров сердца.
В качестве двух верхних измерительных электродов также могут быть использованы стандартные точечные ЭКГ электроды с контактной площадью 2 см на 2 см. Эти электроды устанавливают симметрично вдоль боковых линий шеи пациента относительно периметра шеи пациента 27, на расстоянии S над основанием шеи. Расстояние S определяют как расстояние между основанием шеи и центром 302 электрода 22, преимущественно это расстояние составляет около 4 см. Считают, что основание шеи находится в точке максимального изгиба боковых линий шеи. За счет установки верхних измерительных электродов 22 в указанной области удается устранить погрешность, которая могла бы возникать из-за нелинейности электрических силовых линий в месте соединения шеи с грудной клеткой.
Каждый из нижних измерительных электродов 20 имеет контактную площадь от 12 см2 до 30 см2. Если бы эта контактная площадь была больше или меньше, то ударный объем сердца (SV) был бы занижен. Контактная площадь менее 12 см2 обеспечивает недостаточную глубину измерения, что создает серьезную проблему для больших (крупных) пациентов, в то время как контактная площадь более 30 см2 вызывает заход измерения в дополнительные анатомические области.
Каждый из индивидуальных грудных электродов 20 преимущественно представляет собой набор из четырех стандартных точечных ЭКГ электродов 28, каждый из которых имеет контактную площадку 29 размерами 2 см на 2 см, причем верхняя пара 34 точечных электродов 28 каждого грудного электрода установлена на уровне 38 мечевидного отростка (см. фиг.2В и 4). Все контактные площадки 29 соединены фольгой или проводами 31. Расстояние G между смежными точечными электродами составляет ориентировочно 5 см. Контактные площадки 29 устанавливают на теле с использованием проводящего геля, если он не является частью собственно измерительного электрода 28. Такое расположение электродов учитывает анатомические характеристики зон I и III тела (см. фиг.3А и 3В) и обеспечивает минимум ошибок, так как измерение проводят на адекватной глубине с учетом возможных изменений строения тела различных пациентов. Описанные грудные электроды 20 устанавливают по бокам с противоположных сторон груди (см. фиг.2А, 2В и 2С) на уровне мечевидного отростка 38. Как это показано на фиг. 3А и 3В, установку производят в зонах II и IV, впереди или позади, плюс или минус 10 см, относительно боковой линии, проходящей через тело на уровне мечевидного отростка 38.
Воздействующие электроды 24, 26 генерируют в теле пациента ток высокой частоты с малой амплитудой, а измерительные электроды 20, 22 измеряют ток после его прохождения через ткани тела. Электрический импеданс ткани легко может быть определен по разности между генерируемым и измеренным токами. Электрический импеданс ткани изменяется с течением времени в результате кровотока, дыхания и других факторов.
В соответствии с настоящим изобретением используют также и ЭКГ сигналы, измеряемые совместно с сигналами биоимпеданса. За исключением проводимой после измерения обработки сигнала для устранения описанных ниже артефактов аппаратных средств измерение ЭКГ сигнала проводят обычным образом, поэтому в дальнейшем оно дополнительно не описывается.
Предварительной операцией в соответствии с настоящим изобретением является определение характеристик усиление - фаза - частота (GPF) аналогового входного устройства (преобразователя ЭКГ или преобразователя импеданса), предназначенных для последующего использования при обработке сигнала.
Компьютерная система, которая может содержать специально запрограммированный компьютер общего назначения, такой как персональный компьютер, получает данные измерений электрического тока от измерительных электродов 20, 22, определяет как импеданс задерживающей сигнал ткани (биоимпеданс), так и электрический потенциал, пересекающий сердце (ЭКГ), в виде функции времени, и, наконец, производит расчет частоты сердечных сокращений (HR), ударного объема сердца (SV) и минутного сердечного выброса (СО). Уравнение для получения SV выглядит следующим образом:
SV=K•P(L/Z0)2•ΔZ,
в котором К представляет собой новый коэффициент масштабирования, Р - удельное сопротивление крови, L - расстояние между электродами измерения напряжения или измерительными электродами 20 и 22, Z0 - средний или базовый торакальный импеданс (найденный при помощи измерительных электродов 20 и 22), а ΔZ представляет собой изменение импеданса, вызванное притоком крови. ΔZ определяют следующим образом:
ΔZ=(ELVET)•(dZ/dt)max+ZS-Q,
в котором ELVET представляет собой эффективное время выброса левого желудочка, (dZ/dt)max представляет собой максимальное абсолютное значение производной по времени сигнала импеданса, полученного от двух измерительных электродов, а ZS-Q представляет собой новый коэффициент корректировки, который учитывает асинхронизм левого-правого желудочков, равный разности биоимпедансов между точками S и Q (см. фиг.13, 14 и сопроводительный текст).
Коэффициент К учитывает вариации строения тела различных пациентов. Для получения значения коэффициента К практикующий врач сначала измеряет рост и вес пациента, а также периметры шеи пациента 27 и грудной клетки 36 с использованием обычных измерительных средств или имеющихся в продаже ультразвуковых измерительных средств. После этого практикующий врач вводит полученные величины в компьютерную систему, которая, в свою очередь, использует эти величины для вычисления эффективной площади поперечного сечения грудной клетки и коэффициента К. Эффективная площадь поперечного сечения грудной клетки (SCHEST) может быть получена из следующего соотношения:
SCHEST=[(PCHEST)2+(PNECK•PCHEST)+(PNECK)2]/12π
в котором PCHEST является периметром грудной клетки пациента 36, а PNECK представляет собой периметр шеи пациента 27. Коэффициент К может быть вычислен следующим образом:
K = K0-K1•[SCHEST/(H
в котором Н - это рост пациента, W - вес пациента, а К0, K1, К2, К3 являются коэффициентами, которые зависят от пола и возраста пациента, и лежат в следующих диапазонах:
К0 ∈ [1-4]; К1 ∈ [3-16]; К2 ∈ [0-1]; К3 ∈ [0,1-2]
Таким образом, настоящее изобретение может быть использовано без потери точности для пациентов с различным строением тела.
Электрическое удельное сопротивление крови человека не является постоянным. Оно различно для различных особей и даже для одного и того же пациента может быть различным в разное время. Удельное сопротивление крови особенно подвержено флуктуациям у пациентов, которым производят переливание крови. В результате точная система биоимпедансной кардиографии должна содержать средства для непрерывной корректировки величины удельного сопротивления в уравнении Кубичека.
Удельное сопротивление крови существенно зависит от гематокрита пациента. Между двумя указанными величинами для капиллярной крови существует следующее соотношение:
Р=13,5+4,29Н
в котором Р - это удельное сопротивление крови, а Н - капиллярный гематокрит. Это соотношение заимствовано из статьи В.И. Аринчина и др. "Учет электрического сопротивления крови улучшает точность грудного тетраполярного реографического метода", Журнал педиатрии (СССР), 1987г., т.7, стр.59-52. Гематокрит может быть измерен при помощи любого известного метода. Данные гематокрита могут быть либо введены в компьютерную систему оператором, либо непосредственно поданы при помощи электронных средств от устройства измерения гематокрита.
В соответствии с настоящим изобретением используется новый способ обработки ЭКГ сигнала (после устранения артефакта аппаратных средств), который включает в себя следующие операции:
(i) аппроксимация сигнала по точкам дискретизации;
(ii) фильтрация сигнала для выделения положений QRS комплексов;
(iii) измерение двойных амплитуд для заданного временного интервала регистрации;
(iv) расчет пороговой амплитуды;
(v) отбор QRS комплексов с вычисленной пороговой амплитудой;
(vi) дополнительный анализ отобранных событий для нахождения положений контрольных точек.
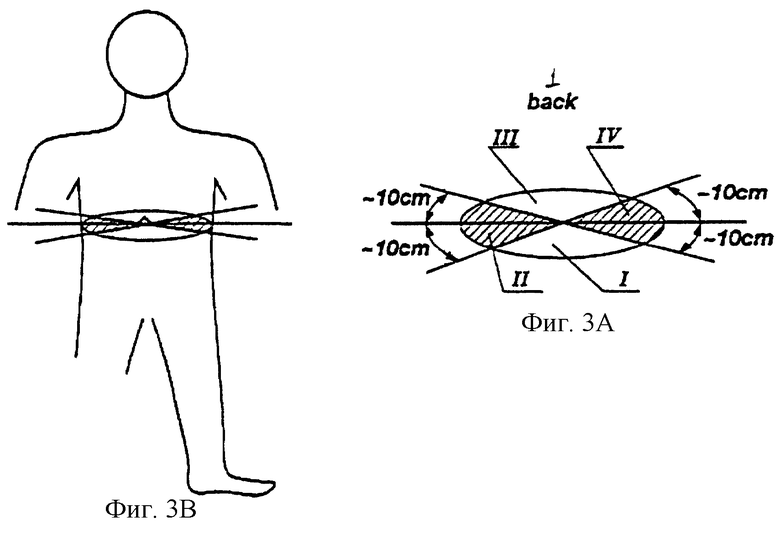
Проведение операции (i) желательно для повышения точности и надежности определения QRS комплексов, вне зависимости от того, что частота дискретизации является очень высокой. На практике такая высокая частота дискретизации нежелательна, как требующая избыточного времени обработки и большой емкости памяти, и непрактична при обработке сигналов с ограниченной мощностью спектра. В соответствии с настоящим изобретением могут быть желательны два подхода аппроксимации. Прежде всего, известно, что любой сигнал s(t) с конечным спектром (который может быть определен наивысшей гармоникой как ωm = 2πfm) полностью описывается его выборками в точках s(n•ΔТ), где ΔТ≤1/2fm представляет собой период дискретизации, а n является целым числом. Точная аппроксимация такого сигнала может быть выражена следующим соотношением: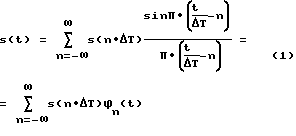
в котором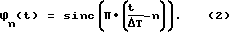
Тот же самый результат может быть получен другим путем за счет первоначального вычисления преобразования Фурье сигнала s(t) и добавки небольшого фазового сдвига Δϕ ко всем гармоникам, так что:
Δϕ/2πf = τ = const, ∀f. (2a)
Затем, после вычисления обратного преобразования Фурье, получают аппроксимированные значения сигнала s(t) в точках, сдвинутых на т относительно исходных выборок. Этот последний подход обладает большей вычислительной эффективностью. Оба подхода позволяют иметь более низкие частоты дискретизации, что ведет к меньшей загрузке памяти, и могут быть использованы для точной аппроксимации исходного сигнала.
Следующей операцией является фильтрация ЭКГ сигнала для выделения положений QRS комплексов. На фиг.10 показан типичный QRS комплекс, а именно пик сигнала с наибольшей измеренной двойной амплитудой в единичном сердечном сокращении. Симметричный цифровой фильтр с конечной импульсной характеристикой (КИХ-фильтр) может быть синтезирован по желательной характеристике усиление - частота (GFСfilter). Желательную характеристику GFСfilter находят из анализа спектра мощности QRS комплексов; она имеет полосу пропускания от 6 Гц до 22 Гц, с максимумом около 12, 5 Гц. С использованием дискретного преобразования Фурье желательную характеристику GFCfilter преобразуют в конечную импульсную характеристику, в соответствии с алгоритмом для синтеза фильтра, описанным В.С. Гутниковым в книге "Фильтрация измеренных сигналов", Ленинград, Энергоатомиздат (СССР), 1990 г., стр.172-181, которая включена здесь в качестве ссылки. Этот фильтр пропускает QRS комплексы и подавляет артефакты дыхания и перемещения в ЭКГ сигнале, так же, как Р и Т волны.
Следующей операцией является расчет порога двойной амплитуды и выбор действенных QRS комплексов. Компьютерная система производит измерение каждого локального пика отфильтрованного ЭКГ сигнала по его переднему (Е1) и заднему (Е2) фронтам амплитуды, см. фиг.10. Для каждого локального пика значение Е1 измеряют от предшествующего пику локального минимума до следующего ближайшего максимума, а значение Е2 измеряют от максимума до следующего ближайшего максимума. На фиг.11 показано распределение (диаграмма рассеяния) пиков по их координатам (Е1, Е2) для временного интервала или периода 10 секунд. На фиг. 11 также показаны QRS комплексы, выделенные пунктирным кругом в нижнем правом углу. Каждый пик характеризуется его вектором (E1, E2) и амплитудой Аi, причем
Аi=[(Е1i)2+(Е2i)2]1/2.
После этого компьютерная система производит поиск отсортированного массива { Аi} для максимальной разности между Аi и Аi+1. Если максимум найден, например, для к-того элемента, то тогда порог амплитуды рассчитывают как Т= (Aк+Ак+1)/2. При этом QRS комплекс считается обнаруженным в точке j, если Аj превышает порог Т. Порог Т принимают для каждого блока 10 секунд или интервала данных ЭКГ в виде Тn=Tak-1+Тk, где Тak-1 представляет собой принятый порог для предыдущего блока данных, Tk представляет собой принятый порог для текущего блока данных, а α является параметром адаптации и лежит в диапазоне от 0 до 1.
Каждый QRS комплекс, найденный при использовании описанной выше "пороговой" методологии, затем дополнительно анализируют в интервале от -50 до +200 мс от положения нахождения QRS комплекса. Для каждого найденного QRS комплекса компьютерная система определяет амплитуду, частоту следования пиков и производную фронтов пиков для нахождения трех контрольных точек (фиг. 12): начала QRS комплекса (точка Р), максимального отклонения от нулевой линии (точка Sa, которая совпадает с пиком R для нормальной ЭКГ) и окончания QRS комплекса (точка Sb). Эти контрольные точки используют для уточнения анализа сигнала биоимпеданса, о чем речь впереди.
В соответствии с настоящим изобретением использован новый способ обработки сигнала биоимпеданса. который включает в себя следующие операции:
(i) цифровая фильтрация и фазовая коррекция;
(ii) определение частоты сердечных сокращений;
(iii) подавление волн дыхания;
(iv) определение кардиоциклов;
(v) нахождение контрольных точек; и
(vi) выбор циклов без мешающих артефактов.
Первая часть электронной фильтрации предусматривает пропускание сигнала через "восстанавливающий" R-фильтр для обеспечения корректировки характеристик усиление - фаза- частота (GPF). R-фильтр компенсирует искажения, вызванные конкретным электронным преобразователем, который был использован для измерения изменений биоимпеданса. Хорошо известно, что GPF характеристики преобразователя биоимпеданса (фиг. 7) могут существенно влиять на форму кривой биоимпеданса. Искажения характеристик должны быть устранены из сигнала. В R-фильтре используется последующая обработка сигнала для корректировки линейных искажений GPF. Этот фильтр построен таким образом, что система преобразователь биоимпеданса плюс R-фильтр имеет GPF характеристики с нулевым фазовым сдвигом и постоянным усилением в заданном диапазоне частот сигнала биоимпеданса, например, от 0, 3 Гц до 30 Гц (см. фиг.8). При этом может быть обеспечена корреляция выходных сигналов различных устройств для определения биоимпеданса. За исключением параметров фильтра и рабочих характеристик, которые указаны как желательные или критичные для R-фильтра и других описанных здесь фильтров, конструкция этих фильтров является стандартной и не представляет трудностей для специалистов, поэтому она не описана здесь более подробно.
Первая операция корректировки GPF предусматривает подключение на вход преобразователя биоимпеданса источника генерируемого электронным образом синусоидального сигнала импеданса, а затем измерение выходного сигнала преобразователя. Генерируемый электронным образом синусоидальный сигнал импеданса имеет амплитуду от 0,1 до 0,2 Ом относительно нулевой линии, например, от 100 до 200 Ом. Такой сигнал получают с использованием преобразователя напряжение - импеданс, который содержит фоторезистор, фотопередатчик (фотодиод), источник питания и компьютерный интерфейс аналог - цифра - аналог (ADA). Согласованная пара фоторезистор - фотопередатчик установлена внутри защищенного от воздействия света корпуса, так что фоторезистор изменяет свой импеданс в соответствии с силой света фотопередатчика. Процесс ADA преобразования включает в себя преобразование цифра - аналог математически моделированной синусоиды с частотой 19 кГц и преобразование аналог - цифра частоты 100 Гц, с разрешающей способностью 12 бит. При помощи интерфейса компьютер вырабатывает набор тестовых синусоидальных сигналов с частотами в диапазоне от 0 Гц до 75 Гц и регистрирует характеристики преобразователя. Преобразователь напряжение - импеданс имеет входной сигнал от 0 В до 5 В, выходной сигнал от - 0,1 до 0,1 Ом с нулевой линией от 100 Ом до 200 Ом (как уже упоминалось ранее). Затем может быть рассчитана GPF характеристика Н(f) преобразователя из спектров исходных тестовых сигналов и результирующих откликов преобразователя, которая может быть представлена в виде графика или сохранена в виде файла ASCII или другого файла в памяти. В системе использована расчетная GPF характеристика Н(f) преобразователя для расчета "восстанавливающего" R-фильтра. GPF характеристика такого фильтра может быть формально записана как 1/Н(f) в некотором частотном диапазоне. R-фильтр имеет также верхнюю и нижнюю частоты среза для обеспечения подавления случайных помех более высокой и низкой частот (см. фиг.7). Фильтрация при помощи R- фильтра осуществляется в частотной области с использованием преобразования Фурье. Предпочтительно использование Гауссовского окна с преобразованием Фурье для устранения граничных эффектов регистрируемого сигнала:
G(t)=exp[-2(at/(2T)2],
в котором 2Т - длительность регистрируемого сигнала, t<Т - время, а "а" представляет собой заданную постоянную, преимущественно в диапазоне 2,5-3. Умножение изображения Фурье регистрируемого сигнала на GPF характеристики R-фильтра приводит к подавлению искажений GPF и обеспечивает дополнительную фильтрацию сигнала. Может быть использовано также обратное преобразование Фурье и деление на Гауссовское окно. Такие же самые операции могут быть использованы во временной области без преобразования Фурье. Сигнал после R-фильтрации именуется "восстановленным" сигналом и используется для дальнейших расчетов.
Необходимо также указать, что в это же время проводят обработку идентифицированных GPF характеристик ЭКГ подключений для устранения аппаратных артефактов ЭКГ сигналов, аналогичную описанной выше для сигнала биоимпеданса. Корректировка GPF как для ЭКГ сигналов, так и для сигналов биоимпеданса обеспечивает истинное соответствие временных интервалов и времен событий между двумя сигналами.
Следующей операцией при обработке сигнала биоимпеданса является определение частоты сердечных сокращений (HR). В соответствии с настоящим изобретением использованы два пути определения HR. Традиционным путем является обнаружение R-пиков ЭКГ сигнала, как это описано ранее, и расчет R-R интервала. Инверсное значение, умноженное на 60, соответствует частоте сердечных сокращений. Если ЭКГ сигнал по какой-либо причине не может быть обработан для обнаружения R-пиков, то используют второй путь. По второму способу производят вычисление спектра мощности "восстановленного " сигнала биоимпеданса при помощи дискретного преобразования Фурье, а затем этот спектр используют для нахождения частоты сердечных сокращений (HR). Очень часто гармоника дыхания является наибольшей в спектре мощности сигнала биоимпеданса. Следовательно, она должна быть подавлена, а отклик частоты HR должен быть выделен. Для этой цели используют специальное преобразование. Прежде всего спектр мощности (PS) "восстановленного" сигнала умножают на характеристику усиление - частота А-фильтра (см. фиг.5А). Этот фильтр дифференцирует сигнал и дополнительно подавляет гармоники ниже определенной частоты, преимущественно выбранной в диапазоне от 1 до 3 Гц, так как гармоники волны дыхания обычно лежат ниже 2 Гц, а гармоники HR лежат выше 0,8 Гц. Спектр мощности чистого кардиосигнала содержит повторяющиеся пики с частотами HR, 2*HR, 3*HR и т.д. Следовательно, приведенная ниже автосвертка спектра мощности будет усиливать гармоники частоты сердечных сокращений (HR):
ASI(f)=PSa(f)•PSa(2f) PSa(3f)...
в которой ASI (i) представляет собой результат автосвертки спектра мощности, а PSa(i) представляет собой мощность данной спектральной линии с частотой i, которая ранее была пропущена через А-фильтр. Предпочтительно иметь указанные выше произведения только для первых трех элементов PSa, потому что чем выше частота, тем ниже отношение сигнал/шум. Компьютерная система использует автосвертку для поиска Mas, максимального значения ASI(i), в диапазоне от 0,6 до 5 Гц. Частоту, объединенную с Mas, можно рассматривать как оценку HR. Затем оценку HR используют для дополнительной фильтрации (см. фиг.5С) и процедур идентификации кардиоцикла.
Аберрации сигнала биоимпеданса, вызванные дыханием, должны быть устранены для повышения точности и обеспечения надлежащей идентификации кардиоциклов. Обычно частота дыхания меньше, чем частота сердечных сокращений, однако волны дыхания создают спектр мощности, который перекрывает спектр мощности, создаваемый кардиоциклами. Таким образом, невозможно полностью удалить спектр мощности волн дыхания из суммарного спектра мощности (см. фиг.5С). Удары сердца представляют собой более стабильный повторяющийся процесс в сравнении с дыханием. Следовательно, можно полагать, что их спектр мощности состоит из множества узких пиков. Все гармоники спектра мощности между основными линиями спектра кардиоволн являются комбинацией боковых наклонов указанных основных спектральных линий и спектра мощности шума. Если подавить эти внутренние гармоники, то подавляется в основном шум, а подавление кардиоволн незначительное. Как это изложено ниже, указанные идеи служат основой для выработки алгоритма фильтрации волн дыхания. После оценки частоты сердечных сокращений (HR) в соответствии с описанным ранее определяют первую и вторую гармоники спектра кардиоволн. Локальные минимумы в спектре мощности, ближайшие к указанным спектральным пикам, рассматриваются как их границы. Все гармоники ниже нижней границы второго пика за исключением гармоник в пределах границ первого пика умножаются на заданную величину, меньшую 1 (как это схематично показано на фиг.5С). Это приводит к устранению амплитуды волны дыхания, так как ее спектр мощности лежит в зоне умножения, однако это только незначительно воздействует на кардиоволны.
Следующей операцией при обработке сигнала биоимпеданса является обнаружение кардиоцикла. В соответствии с настоящим изобретением для этого также используют два пути. Первым путем является установка границ кардиоцикла в соответствии с положениями QRS комплексов в ЭКГ сигнале. Если ЭКГ не может быть обработан, то используют второй путь. При использовании второго пути упомянутый выше "восстановленный" сигнал пропускают через В-фильтр (фиг.5В) для выделения фронтов кардиоциклов. Этот фильтр представляет собой дифференцирующий фильтр с частотными границами, подобными синусоиде. Полоса пропускания В-фильтра адаптирована для частотных гармоник, которые вносят основной вклад на фронте кардиоцикла (преимущественно от 1 до 6 Гц). Зона между локальным минимумом и следующим локальным максимумом сигнала, пропущенного через В-фильтр, рассматривается как фронт цикла, описываемый изменением от пика до пика по времени и изменением от пика до пика по амплитуде. Затем компьютерная система вырабатывает времяамплитудную огибающую за счет анализа первых пяти (5) гармоник спектра мощности сигнала после его пропускания через В-фильтр. Фронты цикла исследуются и некоторые из них маркируются для использования в дальнейшем анализе, если их изменения от пика до пика по времени и изменения от пика до пика по амплитуде лежат внутри времяамплитудной огибающей. Для повышения надежности опознания кардиоциклов компьютерная система производит расчет среднего значения и дисперсии амплитуд от пика до пика (двойных амплитуд) для выбранных районов.
Если отношение дисперсии к среднему значению меньше заданной величины, преимущественно 0,3, то тогда все маркированные фронты передаются на следующий этап обработки, где находят контрольные точки и осуществляют выбор свободных от дефектов кардиоциклов. В противном случае, если отношение дисперсии к среднему значению больше заданной величины, то должен быть проведен дополнительный анализ. Дополнительный анализ предусматривает следующие операции: (i) разделение исследуемых областей на 2 группы в соответствии с их амплитудами от пика до пика, а именно, выше среднего значения ("верхняя группа") и ниже среднего значения ("нижняя группа"); (ii) расчет средних значений M1 и М2, а также дисперсий или стандартных отклонений VI и V2 для каждой группы; (iii) ввод соответствующих значений в следующее неравенство для каждой группы:
М2+a•V2<М1-а•V1,
где а представляет собой заданное значение, преимущественно равное 1, 96, а V1 и V2 представляют собой стандартные отклонения для верхней и нижней группы соответственно; и (iv) если неравенство имеет место, то районы в верхней группе принимают в качестве фронтов кардиоциклов, а районы в нижней группе устраняют из дальнейшего рассмотрения; в противном случае все выбранные районы обрабатывают на следующем этапе.
Компьютерная система идентифицирует некоторые контрольные точки в производной по времени сигнала биоимпеданса для расчета эффективного времени выброса левого желудочка ELVET в качестве предварительной операции определения ударного объема сердца (SV).
В соответствии с настоящим изобретением используют термин ELVET, который отображает только время выброса левого желудочка, а не термин VET по Кубичеку, который отображает комбинацию времен выброса левого и правого желудочков. Известно, что величина производной по времени сигнала биоимпеданса пропорциональна пику кровотока аорты, выброшенному левым желудочком. Поэтому для более точного расчета SV следует использовать LVET. Величину LVET получают в соответствии со следующим соотношением:
LVET=ELVET+LVPT,
где ELVET представляет собой промежуток времени между моментом открывания клапана левого желудочка (S-точка) и моментом начала его закрывания (Т-точка), а LVPT представляет собой время протодиастолы (время, необходимое для закрывания клапана левого желудочка). LVPT не удается достаточно просто обнаруживать при помощи средств гемодинамического текущего контроля по той причине, что изменения кровотока несущественны в течение времени протодиастолы. По этой причине в соответствии с настоящим изобретением используют произведение ELVET и (dZ/dt)max, максимального значения первой производной по времени грудного импеданса, чтобы учесть отсутствие измерения LVPT.
Для расчета ELVET необходимо провести анализ кривой Y(х) производной по времени биоимпеданса, отложенной на графике с осью времени (см. фиг.9). Компьютерная система сначала находит глобальный максимум производной по времени биоимпеданса Y(х) для данного кардиоцикла и обозначает его как точку А. Затем компьютерная система перемещается по времени из точки А во временное положение, которое соответствует точке Sa ЭКГ сигнала и осуществляет поиск отклонений от нормы в сигнале биоимпеданса между указанными двумя точками (фиг. 12). Представляют интерес следующие отклонения от нормы: (1) dZ/dt пересекает нуль; (2) локальный минимум в dZ/dt; и (3) локальный максимум в третьей производной сигнала биоимпеданса, d3Z/dt3. Если отклонений от нормы в сигнале биоимпеданса не обнаружено во временном интервале между точками А и Sa, то цикл считают дефективным и исключают его из дальнейшего рассмотрения. Если обнаружены любые отклонения от нормы справа от Sb, то ближайшее справа отклонение от нормы принимают в качестве времени начала выброса S. В противном случае принимают в качестве времени начала выброса S ближайшее слева от Sb отклонение от нормы. Использование ЭКГ сигнала повышает устойчивость нахождения S в сложных случаях.
Для нахождения конца ELVET (точки Т), компьютерная система прежде всего находит точку Т0, которая может быть первым или вторым локальным минимумом после точки А в производной по времени сигнала биоимпеданса; эту точку обозначают соответственно как Т1 и Т2 (см. фиг.9). Компьютерная система производит выбор между точками Т1 и Т2 после проведения анализа глубины (амплитуды) кривой в каждой точке. Если глубина второго минимума больше заданной части глубины первого минимума, то тогда Т2 выбирают как Т0. В противном случае используют Т1. Для повышения устойчивости нахождения T0 в зашумленных сигналах в соответствии с настоящим изобретением анализируют задний конец Т-волны ЭКГ сигнала. Задний конец Т-волны находят из локального максимума ЭКГ сигнала, ближайшего к QRS комплексу, в промежутке времени графика кривизны ЭКГ сигнала до следующего локального максимума. Если одна из точек T1 или Т2 расположена вне границ обратной Т-волны, то другую точку используют как Т0, вне зависимости от амплитуды. Затем находят "эффективное окончание" желудочкового выброса (точку Т), как ближайший локальный минимум перед точкой Т0 на графике кривой второй производной Y(х). ELVET определяют как временное расстояние между точками S и Т.
Способ определения ELVET в соответствии с настоящим изобретением коррелирует с ультразвуковым определением ELVET с коэффициентом корреляции r= 0,86. Классический алгоритм Кубичека имеет корреляцию всего r=0,71. На фиг. 15 показана корреляция классической и новой методологии с идеалом. В соответствии с изложенным, в отличие от измерения по Кубичеку, в соответствии с настоящим изобретением производят измерение времени выброса левого желудочка, главным образом без учета времени выброса правого желудочка.
Обычно точка начала выброса S совпадает с моментом пересечения нуля производной по времени (dZ/dt) сигнала биоимпеданса (см. фиг.13), однако это не так для пациентов с серьезными заболеваниями (см. фиг.14). Для таких пациентов точка начала выброса часто находится у "площадки" или "отклонения от нормы" первого фронта сигнала биоимпеданса. Характеристика "площадки" или "отклонения от нормы" (также именуемая "предволной") для больных пациентов обычно именуется левым-правым желудочковым асинхронизмом.
Для здоровых пациентов значение импеданса Zq в начале QRS комплекса на ЭКГ ( в точке Q) почти такое же, что и значение Zs в точке S. Разность импедансов между этими точками соответствует Zs-q (см. фиг.13). Однако для больных пациентов разность Zs-q может быть значительной (см фиг.14). Когда разность Zs-q мала, тогда оценка по Кубичеку Z=(dZ/dt)max (VET) достаточно точна. Однако для пациентов с серьезными заболеваниями, имеющих левый-правый желудочковый асинхронизм, оценка по Кубичеку обычно приводит к занижению ΔZ. В результате при проведении расчетов следует учитывать вклад "предволны". В соответствии с настоящим изобретением предусмотрена компенсация занижения ΔZ для больных пациентов за счет добавки разности биоимпедансов Zs-q между точками S и Q к оценке по Кубичеку ΔZ. За счет такой компенсации получают более точную оценку ΔZ и обеспечивают линеаризацию регрессии между значениями биоимпеданса и термодилюционными данными сердца. Таким образом, компьютерная система производит оценку ΔZ в соответствии с соотношением:
ΔZ=(dZ/dt)max•ELVET+Zs-q,
в котором Zs-q представляет собой разность биоимпедансов между точками S и Q.
После того, как компьютерная система находит все контрольные точки, она производит оценку кардиоциклов с некоторыми аберрациями (искажениями). При осуществлении этой процедуры могут быть использованы размытая логика и алгоритмы соответствия. Для этой цели используются различные критерии. Компьютерная система прежде всего подтверждает, что временное расстояние между указанными выше точками для каждого кардиоцикла (например, между точками А, Т и S) не превышает определенных предельных значений. Компьютерная система также проверяет, что разность амплитуд между началом и окончанием кардиоцикла не превосходит заданной величины. Разность амплитуд между началом и окончанием кардиоцикла не должна превосходить заданного процента максимальной амплитуды в течение кардиоцикла. Более того, отношение амплитуды производной по времени сигнала биоимпеданса в точке А к производной по времени сигнала биоимпеданса в точке Т должно быть больше заданной величины, а именно:
Y(A)/Y(Т)>c,
где Y (А) и Y (Т) представляют собой значения производной по времени сигнала биоимпеданса в точках А и В соответственно, а "с" является заданной величиной. Все кардиоциклы, которые успешно проходят эту операцию, рассматриваются как "не очень плохие". После этого компьютерная система производит проверку по "критерию близости" для устранения эффекта случайного шума в сигнале биоимпеданса. Производится расчет трехмерного вектора "близости" с элементами (A1i, A2i, A3i) для каждой пары кардиоциклов во временном блоке 10 сек. Индивидуальные элементы вектора близости определяют с использованием следующих соотношений:
A1i=[Y(Ai)-Y(Aj)]/[Y(Ai)+Y(Aj)]
A2i=(STi-STj)/(STi+STj)
A3i={[Y(Bi)-Y(Ti)]-[Y(Bj)-Y(Tj)]}/{[Y(Bi)-Y(Ti)]+[Y(Bj)-Y(Tj)]},
где Y (x) представляет собой производную по времени биоимпеданса в заданной точке x; А, Т и В - положения контрольных точек в каждом кардиоцикле (см. фиг. 9); ST - промежуток времени между точками S и Т; а i и j - различные кардиоциклы. Компьютерная система производит сравнение всех вычисленных векторов близости и находит те кардиоциклы, в которых амплитуды векторов близости превышают определенные пороги. Сравнение производится с использованием двухпорогового анализа. Если амплитуда вектора близости двух кардиоциклов меньше первого заданного значения L1, то подобие считается "хорошим". В том случае, когда указанная амплитуда превышает L1, но все еще остается меньшей второго заданного значения L2, подобие считается "приемлемым". Если подобие не может считаться "приемлемым" для блока данных 10 сек, то компьютерная система производит сравнение испытуемого кардиоцикла с предыдущими 50 "не очень хорошими" циклами. Если и при этом не находится цикла, подобного рассматриваемому, то указанный цикл считают зашумленным и отбрасывают. Если число "хороших" кардиоциклов достаточно велико, то все "приемлемые" кардиоциклы также отбрасывают и не используют в окончательном вычислении. Указанная методология повышает стабильность вычислений при самых высоких уровнях шума, так как при окончательном вычислении используют только "хорошие" кардиоциклы.
После завершения обработки сигнала биоимпеданса компьютерная система производит окончательный расчет гемодинамических параметров, совместно с вычислением средних значений и дисперсий для всего блока данных. Затем производится расчет частоты сердечных сокращений (HR) и ударного объема сердца (SV) с использованием описанных выше методик, за исключением того, что вместо необработанного сигнала биоимпеданса используют обработанный сигнал биоимпеданса. Минутный сердечный выброс (СО) вычисляют как произведение HR и SV:
СО=SV•HR
Общая методология в соответствии с настоящим изобретением отображена на фиг. 6А. На фиг.6В приведена блок-схема обработки сигнала в соответствии с настоящим изобретением.
Несмотря на то, что был описан предпочтительный вариант осуществления изобретения, совершенно ясно, что настоящее изобретение не ограничивается этим вариантом и в него специалистами в данной области могут быть внесены изменения и дополнения, которые не выходят однако за рамки приведенной далее формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения гемодинамических параметров на основе многоканальной электроимпедансной компьютерной кардиографии | 2021 |
|
RU2778992C1 |
| СПОСОБ ОЦЕНКИ ВЕЛИЧИНЫ СЕРДЕЧНОГО ВЫБРОСА | 2009 |
|
RU2415641C1 |
| Система и способ для безманжетного определения артериального давления | 2017 |
|
RU2759708C1 |
| СПОСОБ НЕПРЕРЫВНОЙ ДИНАМИЧЕСКОЙ ОЦЕНКИ СОКРАТИМОСТИ ЛЕВОГО ЖЕЛУДОЧКА СЕРДЦА ЧЕЛОВЕКА | 2006 |
|
RU2362483C2 |
| СПОСОБ НЕИНВАЗИВНОЙ ДИАГНОСТИКИ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА | 2020 |
|
RU2759069C1 |
| Дистанционный комплекс для анализа электрокардиосигналов | 2018 |
|
RU2698980C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ УДАРНОГО ОБЪЕМА СЕРДЦА | 1996 |
|
RU2134059C1 |
| Аппаратно-программный комплекс электрокардиографических измерений | 2020 |
|
RU2759404C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИНФОРМАТИВНОЙ ЭЛЕКТРОКАРДИОГРАММЫ ПОВЫШЕННОЙ СТАБИЛЬНОСТИ НЕЗАВИСИМОЙ ОТ УГЛА НАКЛОНА ЭЛЕКТРИЧЕСКОЙ ОСИ СЕРДЦА | 2014 |
|
RU2580976C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ФУНКЦИОНАЛЬНОГО РЕЗЕРВА МИОКАРДА | 1993 |
|
RU2091056C1 |
Изобретение относится к медицине, главным образом, к текущему контролю сердечной деятельности в отношении определения частоты сердечных сокращений, ударного объема сердца и минутного сердечного выброса из сигналов торакального биоимпеданса и электрокардиограмм. Искажения амплитудно-фазочастотных сигналов биоимпеданса скорректированы за счет пропускания синусоидальных испытательных сигналов через измерительные электроды для идентификации искажений и их корректировки в ходе реальных измерений. Для выделения гармоник частоты сердечных сокращений использованы производная по времени сигналов биоимпеданса, рассчитанный спектр мощности и новый алгоритм автосвертки. Удалены волны дыхания и другие сигналы, не несущие информации о кардиоциклах пациента. Из сигналов биоимпеданса получено время выброса левого желудочка, а для расчета ударного объема сердца и, в результате, минутного сердечного выброса использована усовершенствованная версия уравнения Кубичека. 8 с. и 57 з.п.ф-лы, 15 ил.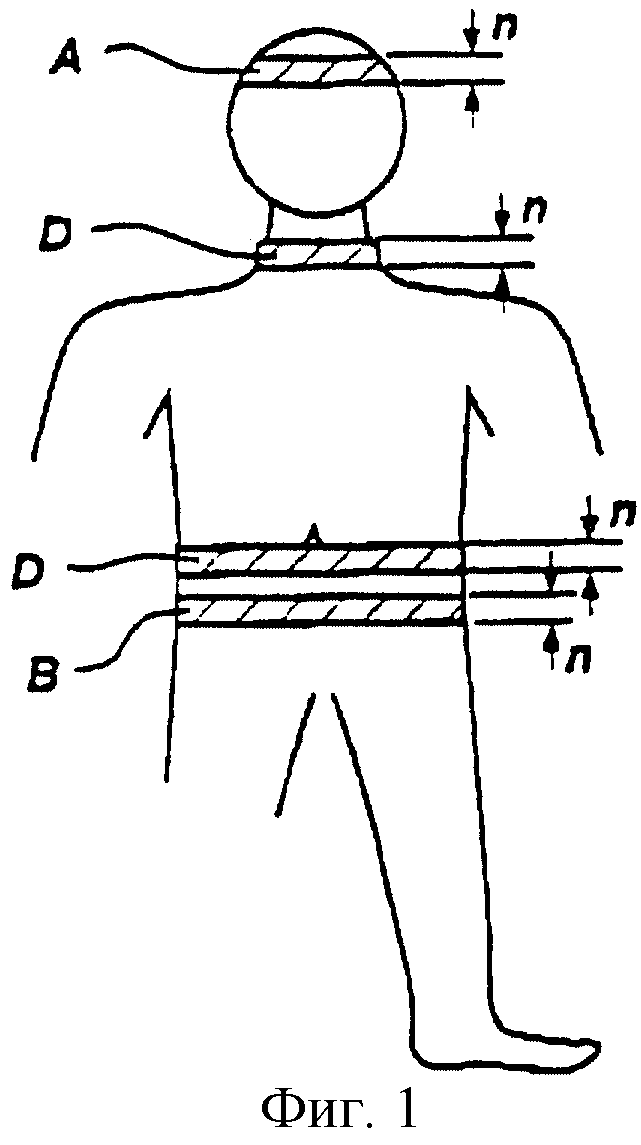
AS(f)= Psa(f) • Psa(2f) • Psa(3f). . . ,
где Psa(i) - мощность спектральной линии с частотой i после пропускания через А-фильтр
и определение величины максимальной амплитуды автосвертки в предопределенном диапазоне частот для определения частоты сердечных сокращений.
SV= KP(L/Z0)2ΔZ,
где К - новый масштабный коэффициент, связанный со строением тела пациента.
K = K0-K1•(SCHEST/(H
где Н - рост; W - вес пациента; К0, К1, К2, К3 - коэффициенты, зависящие от пола и возраста пациента; SCHEST - эффективная площадь поперечного сечения грудной клетки,
SCHEST= (PCHEST2+PNECK•PCHEST+PNECK2)/12π,
где PCHEST - периметр грудной клетки пациента; PNECK - периметр его шеи.
К0 ∈ [1-4] ; К1 ∈ [3-16] ; К2 ∈ [0-1] ; К3 ∈ [0,1-2] .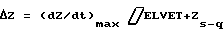
26. Способ исключения искажений в сигнале биоимпеданса подавлением волны дыхания, содержащий вычисление преобразования Фурье сигнала; определение первой и второй частотных гармоник сердечных циклов в расчетном спектре сигнала; оценка ширины каждой гармоники, подавление частотных гармоник ниже нижней границы второй гармоники, за исключением гармоник в пределах границ первой частотной гармоники, и вычисление обратного преобразования Фурье сигнала.
AS1(f)= Psa(f) • Psa(2f) • Psa(3f). . . ,
где Psa(i) - мощность данной спектральной линии с частотой i после пропускания через А-фильтр;
средство для определения максимальной амплитуды автосвертки в предопределенном диапазоне частот для определения частоты сердечных сокращений.
SV= K•P•(L/Z0)2ΔZ,
где К - новый масштабный коэффициент, связанный со строением тела пациента.
K = K0-K•(SCHEST/(H
где Н - рост; W - вес пациента; К0, K1, К2, К3 - коэффициенты, зависящие от пола и возраста пациента; SCHEST - эффективная площадь поперечного сечения грудной клетки
SCHEST= (PCHEST2+PNECK • PCHEST+PNECK2)/12π,
где PCHEST - периметр грудной клетки пациента; PNECK - периметр его шеи.
К0, ∈ [1-4] ; К1 ∈ [3-16] ; К2 ∈ [0-1] ; К3 ∈ [0,1-2] .
ΔZ= (dZ/dt)max • ELVET+Zs-q.
| US 4807638 А, 28.02.1989 | |||
| US 5178154 А, 12.01.1993 | |||
| Способ размножения копий рисунков, текста и т.п. | 1921 |
|
SU89A1 |
Авторы
Даты
2002-12-27—Публикация
1997-04-07—Подача