Изобретение относится в целом к использованию электрических импульсов для увеличения проницаемости клетки, а более конкретно к способу и устройству для применения контролируемых электрических полей для доставки in vivo фармацевтических соединений и генов в клетки с помощью электропорообразующей терапии (ЭПТ), известной так же, как терапия с клеточным порообразованием (ТКП) и электрохимиотерапия (ЭХТ).
В 1970-е гг. было обнаружено, что электрические поля могут использоваться для создания пор в клетках, не вызывая постоянного повреждения. Это открытие обеспечило возможность введения крупных молекул в клеточную цитоплазму. Известно, что гены и другие молекулы, такие как фармакологические соединения, могут включаться в живые клетки посредством процесса, известного как электропорообразование. Гены или другие молекулы смешиваются с живыми клетками в буферной среде, и подаются короткие импульсы сильных электрических полей. Клеточные мембраны временно становятся пористыми, и гены или молекулы поступают в клетки, где они могут изменить геном клетки.
Электропорообразование in vivo в целом ограничено тканью или клетками, которые расположены близко к коже организма, куда могут помещаться электроды. Поэтому ткань, которую иначе можно лечить путем системной доставки препаратов или химиотерапии, такая как опухоль, в целом недоступна для электродов, используемых для электропорообразования. При лечении определенных видов рака с помощью химиотерапии необходимо использовать достаточно большую дозу препарата для уничтожения раковых клеток без уничтожения неприемлемо большого количества нормальных клеток. Если бы химиотерапевтический препарат мог быть введен непосредственно в раковые клетки, эту задачу можно было бы разрешить. Некоторые противораковые препараты, например блеомицин, обычно не могут эффективно проникнуть через мембраны определенных раковых клеток. Однако электропорообразование обеспечивает возможность введения блеомицина в клетки.
Лечение обычно проводится путем инъекции противоракового препарата непосредственно в опухоль и подачей электрического поля на опухоль между парой электродов. Силу поля необходимо подбирать достаточно точно с тем, чтобы происходило электропорообразование клеток опухоли без повреждения, или, по меньшей мере, с минимальным повреждением каких-либо нормальных или здоровых клеток. Это можно обычно легко осуществить при наружных опухолях с помощью наложения электродов на противоположные стороны опухоли так, чтобы электрическое поле было между электродами. Если поле однородное, затем можно измерить расстояние между электродами и на электроды можно подать подходящее напряжение в соответствии с формулой Е=V/d (Е=сила электрического поля в В/см; V= напряжение в вольтах и d=расстояние в см). Если предполагается лечение крупных или внутренних опухолей, нелегко правильно расположить электроды и измерить расстояние между ними. Упомянутая выше основная заявка раскрывает устройство электродов для электропорообразования in vivo, в которой электроды могут вставляться в опухоль. В соответствующем патенте США 5273525 в шприце для инъекции молекул и макромолекул для электропорообразования используются иглы для инъекции, которые также функционируют в качестве электродов. Эта конструкция обеспечивает возможность размещения электродов под поверхностью.
Лечение субъекта с использованием терапии с образованием пор в клетках предоставляет средство, позволяющее избежать повреждающие воздействия, обычно связанные с введением противораковых или цитотоксических средств. Такое лечение позволило бы вводить эти средства для избирательного повреждения или уничтожения нежелательных клеток, в то же самое время избегая окружающие здоровые клетки или ткань.
Первостепенной задачей изобретения является предоставление усовершенствованного устройства, которое может быть удобно и эффективно расположено для создания заданных электрических полей в предварительно выбранной ткани.
В соответствии с первостепенным аспектом изобретения, электродное устройство для применения электропорообразования в части тела пациента включает опорный элемент, множество игольчатых электродов, установленных в выбранных положениях и на выбранных расстояниях друг от друга на указанном опорном элементе для введения в ткань, и средство, включающее генератор сигналов, реагирующий на сигнал указанного расстояния, для подачи на электроды электрического сигнала, пропорционального расстоянию между указанными электродами, для создания электрического поля заданной силы.
Изобретение включает иглы, которые предназначены для инъекции терапевтических веществ в ткань и функционируют в качестве электродов для создания электрических полей для части клеток ткани.
Один вариант реализации изобретения включает устройство для клинической электропорообразующей терапии, которое включает набор игольчатых электродов, имеющий "манипуляционный" элемент, такой как резистор или активный контур, который определяет заданное значение напряжения терапевтического импульса, а также выбираемую схему последовательности включения (устройство, имеющее это приспособление, было названо MedPulserTM). Ряд конструкций аппликатора электродов обеспечивает возможность доступа к различным участкам ткани и их лечения.
Другой вариант реализации изобретения предоставляет лапароскопический игольчатый аппликатор, который предпочтительно комбинируется с эндоскопом для минимально инвазивной электропорообразующей терапии.
Изобретение предоставляет способ лечения с использованием устройства с набором иголок для обработки клеток, в частности опухолевых клеток.
Фиг. 1 представляет собой общий вид в разрезе устройства одного варианта реализации изобретения.
Фиг.2А-2G представляют собой схематические иллюстрации нескольких альтернативных вариантов реализации электродов в соответствии с изобретением.
Фиг. 3 представляет собой блок-схему устройства для лечения в соответствии с изобретением.
Фиг. 4 представляет собой блок-схему компоновки контура устройства для лечения, изображенного на фиг.3.
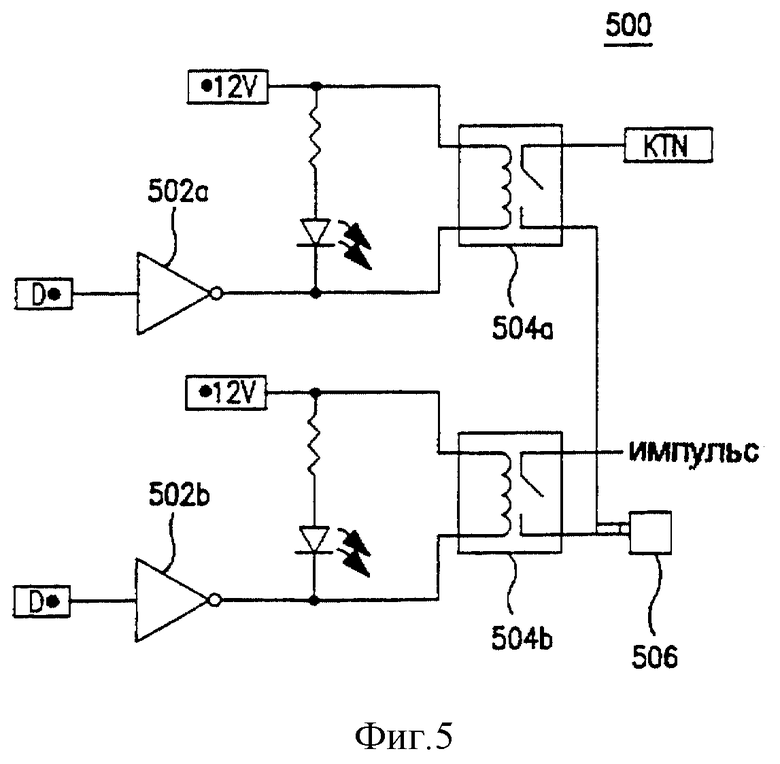
Фиг. 5 представляет собой схематический чертеж элементов избирательного включения контура, показанного на фиг.4.
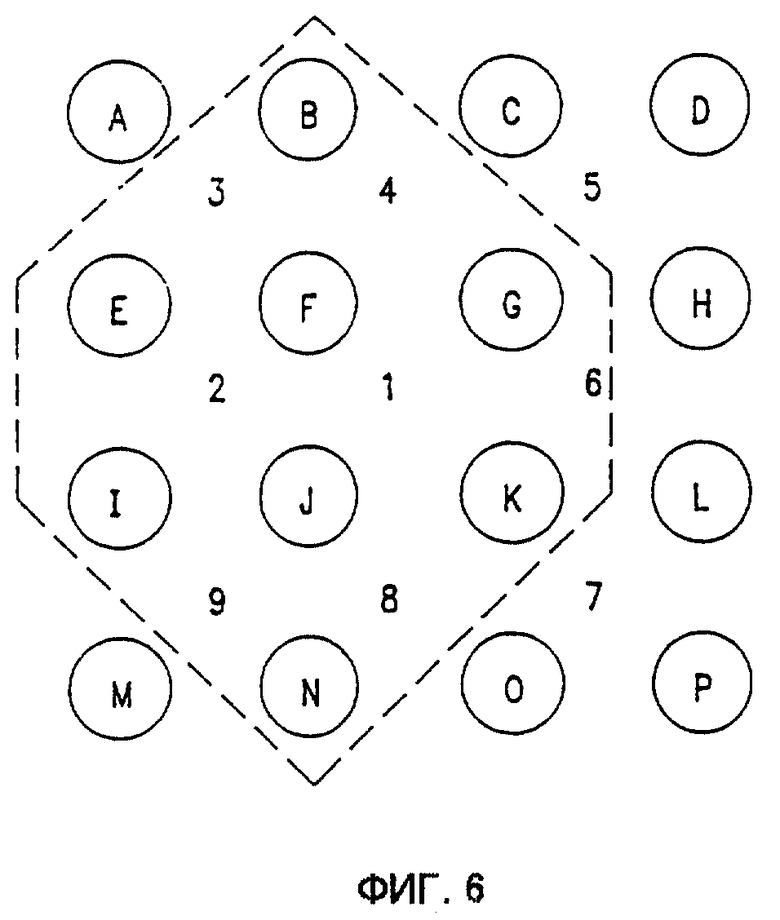
Фиг.6 схематически показывает предпочтительную схему расположения иголок 4 х 4, образующих 9 зон лечения в соответствии с одним вариантом реализации изобретения.
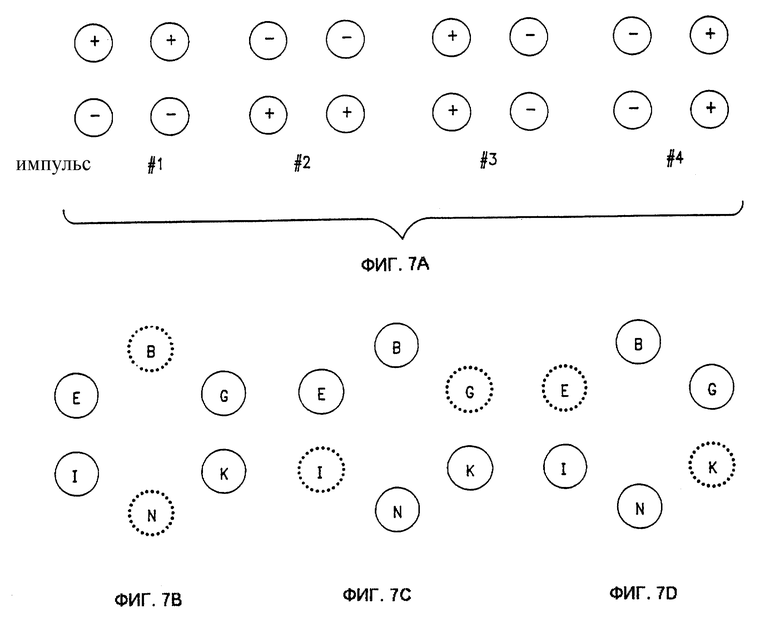
Фиг. 7А показывает последовательность импульсов для зоны лечения 2 х 2 в соответствии с одним вариантом реализации изобретения.
Фиг. 7В-7D показывают последовательность импульсов для 6-игольной схемы расположения в соответствии с одним вариантом реализации изобретения.
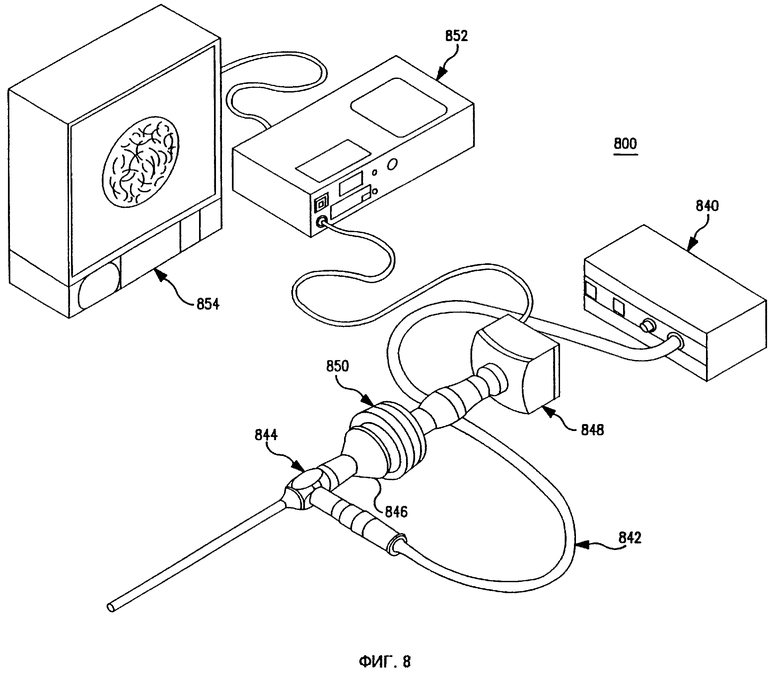
Фиг. 8 представляет собой схему устройства эндоскопического исследования предшествующего уровня техники.
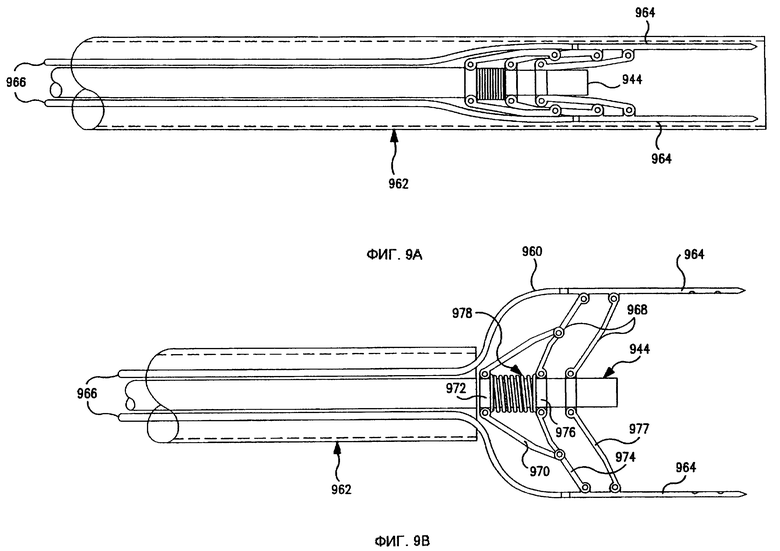
Фиг. 9А-9В показывают в деталях комплект иголок в выдвинутом/отведенном назад состоянии в соответствии с изобретением.
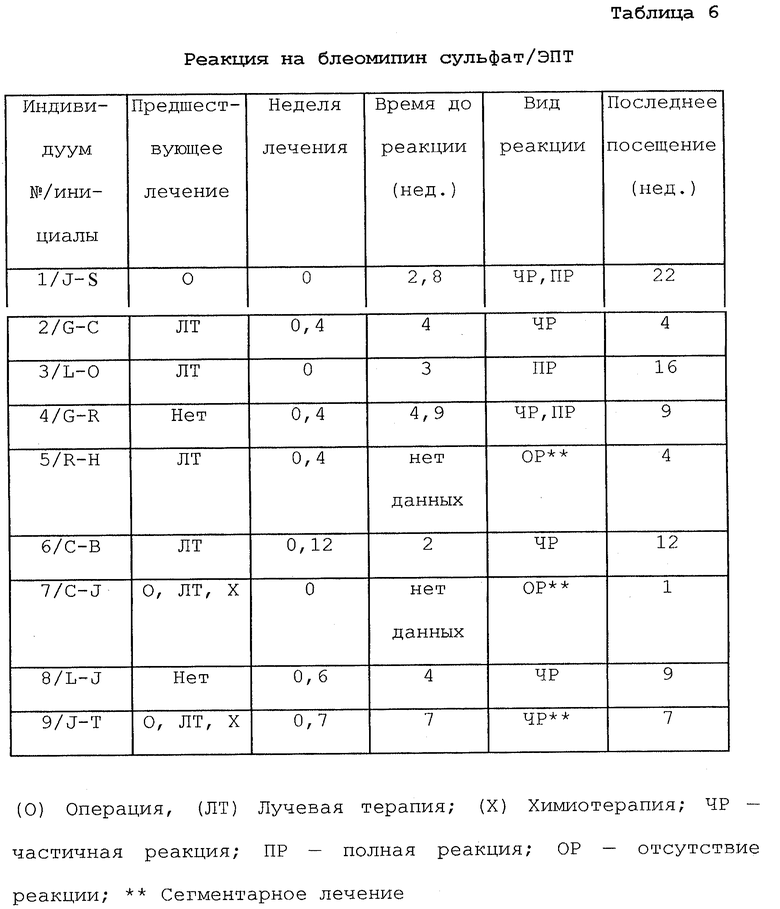
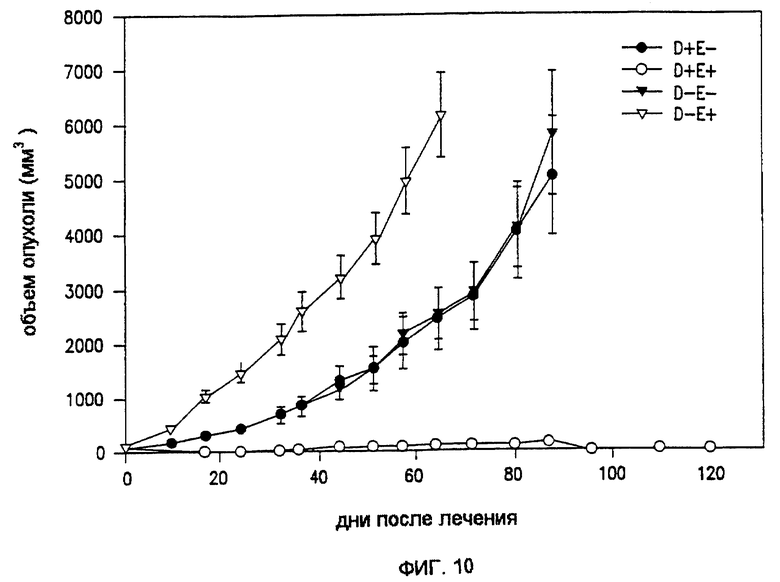
Фиг. 10 показывает объем опухоли до 120 д. ЭПТ блеомицином у безволосых мышей с ксенотрансплантатом Рапс-3 опухоли (D=препарат; Е=электропорообразование) для венозных контрольных групп (D+E-, D-E-, D-E+) и леченой группы (D+E+).
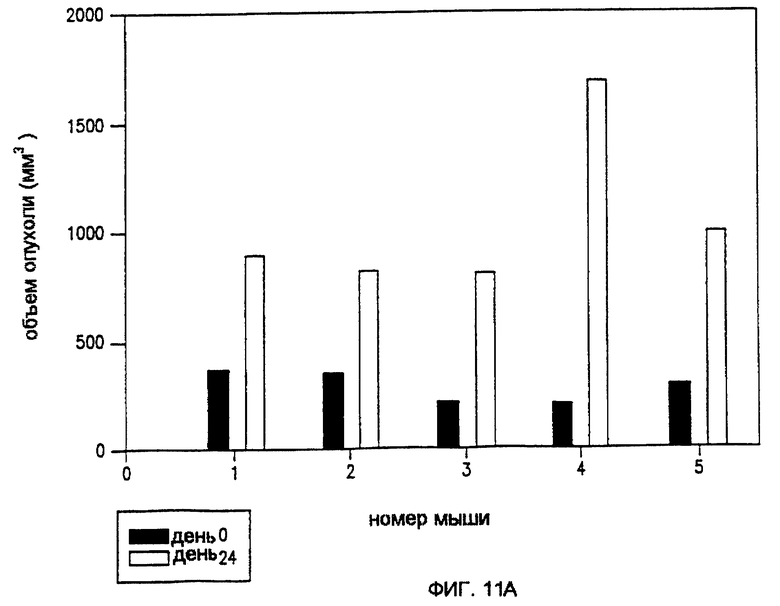
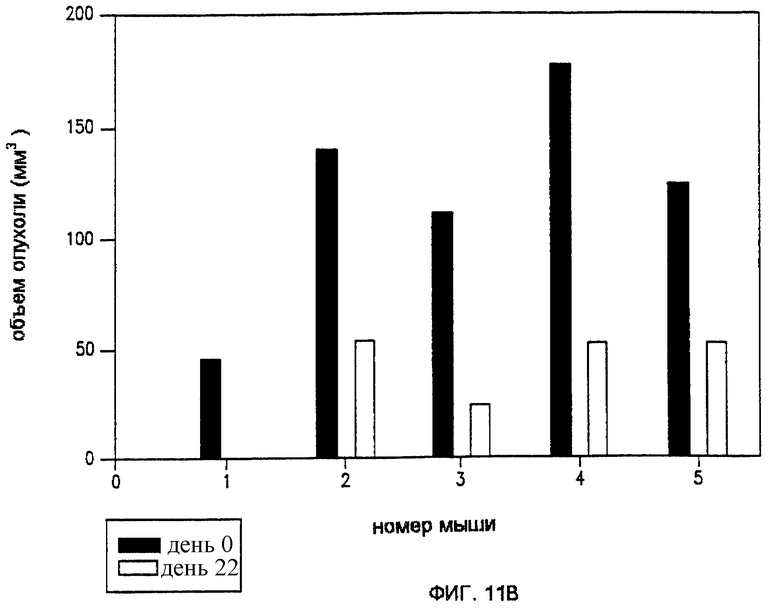
Фиг. 11А и 11В показывают влияние ЭПТ Рапс-3 неокарциностатином соответственно для инъекции препарата перед и после импульса, до 24 д.
Фиг.12 показывает объем опухоли после 34 д. ЭПТ блеомицином у безволосых мышей с ксенотрансплантатом не мелкоклеточной карциномы легких (НМККЛ). Стрелка показывает повторное лечение одной мыши на 27 д. (П=препарат; Е= электропорообразование).
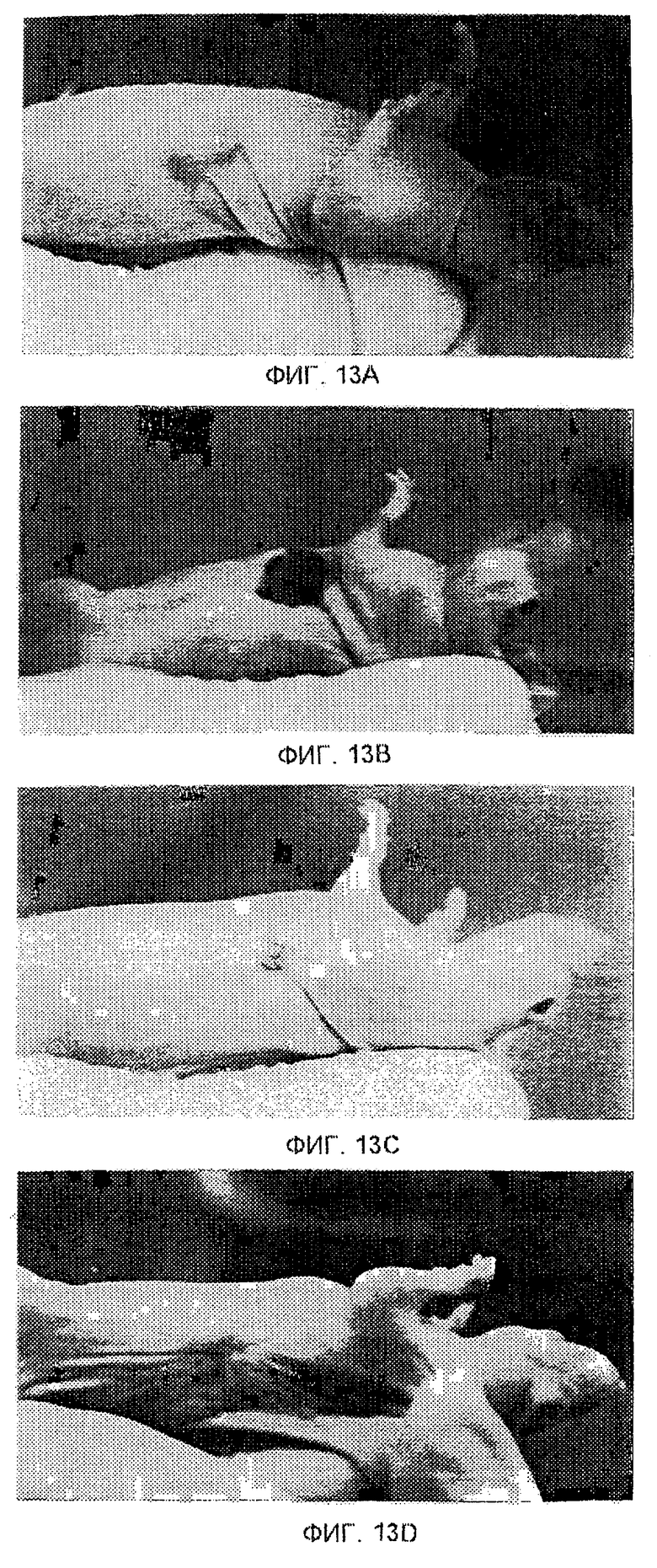
Фиг. 13А-13D показывают последовательность событий, происходящих при лечении ксенотрансплантата опухоли (а) с помощью ЭПТ. Лечение привело к образованию рубца (b), который высох и в конечном итоге отпал (с), оставив чистую зажившую область кожи (d), свободную от опухоли.
Фиг.14А-14С показывают результаты гистологического исследования образцов опухоли, проведенное через 35 д. после лечения. В группе D+E+ выявляются "тени" некротических клеток опухоли (b), в сравнении со смесью жизнеспособных и некротических клеток в группе D+E- (а). Гистологическое исследование образцов из участка опухоли через 120 д. выявляет полное отсутствие опухолевых клеток (с).
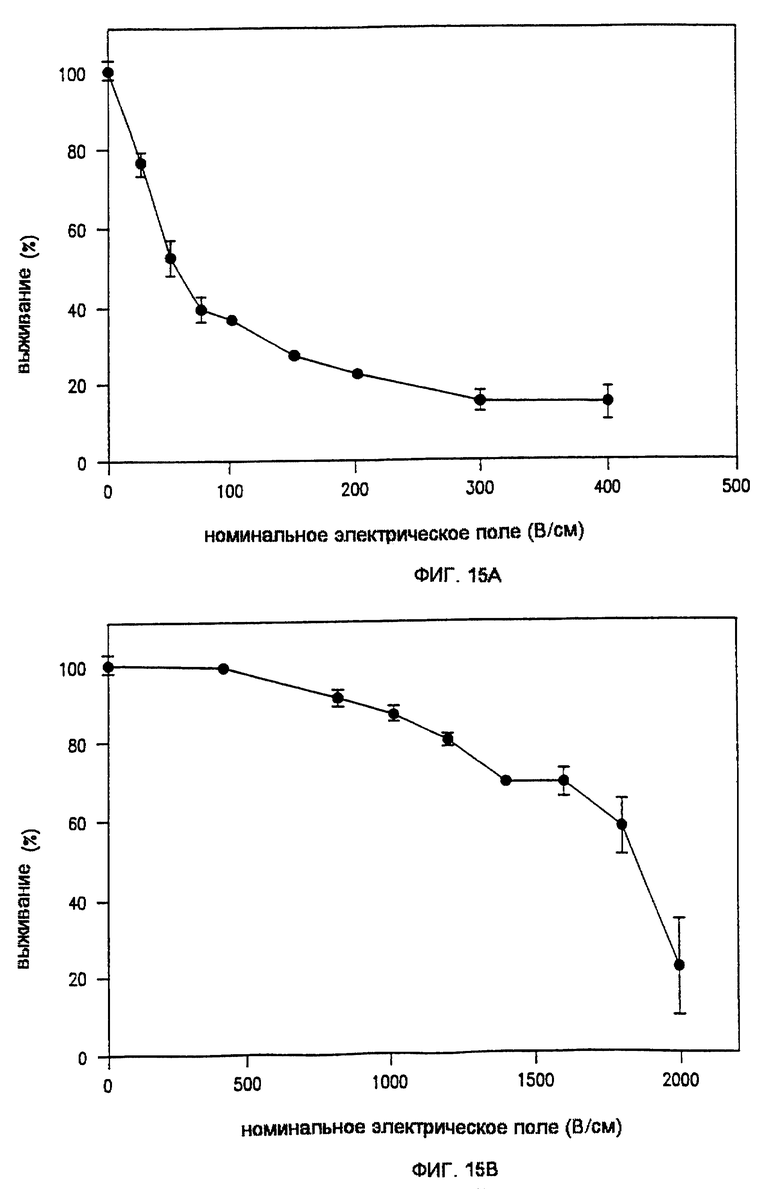
Фиг. 15А и 15В показывают выживание клеток MCF-7 (рака молочной железы) после воздействия ЭПТ соответственно с низким и высоким напряжением.
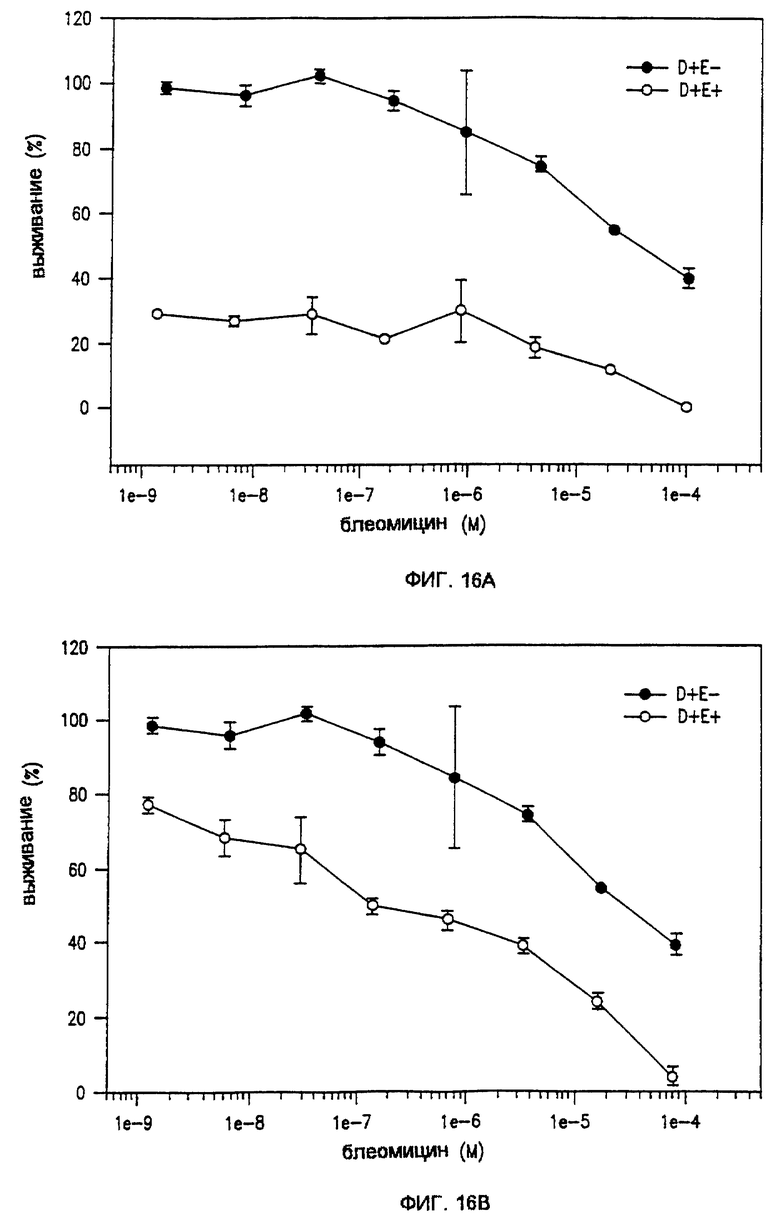
Фиг. 16А и 16В показывают выживание клеток MCF-7 после воздействия ЭПТ соответственно с низким и высоким напряжением с блеомицином.
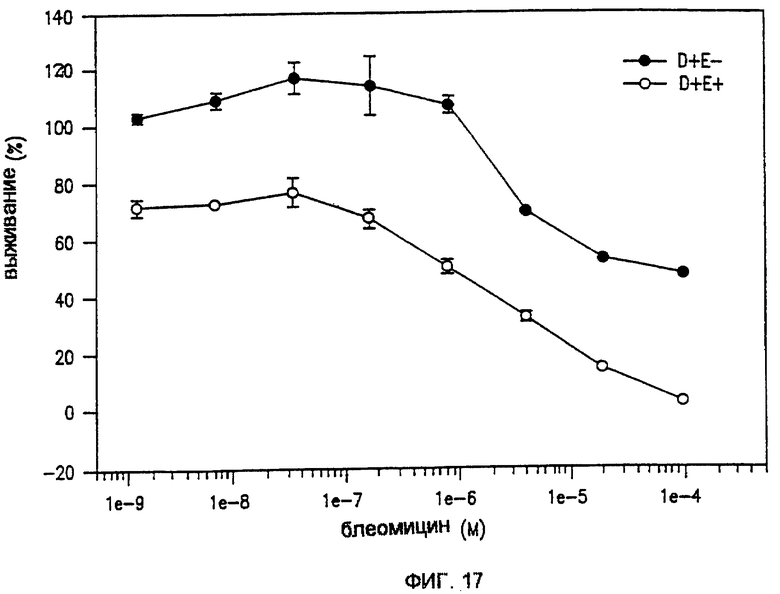
Фиг. 17 показывает эффект на клетки MCF-7 не импульсного и импульсного воздействия с различной концентрацией блеомицина и MedPulserTM.
Одинаковые ссылочные номера и обозначения на различных чертежах указывают одинаковые элементы.
Изобретение предоставляет устройство и способ для лечебного применения электропорообразования. Способ включает инъекцию химиотерапевтического средства или молекулы и введение средства или молекулы в опухоль посредством электропорообразования. В частности, средство или молекула вводится в ткань, и между "игольчатыми" электродами, расположенными в ткани, подаются импульсы напряжения, воздействуя таким образом электрическими полями на клетки ткани. Описанные ниже устройства игольчатых электродов обеспечивают in vitro и in vivo возможность расположения электродов в находящихся под поверхностью опухолях или в прилегающей к ним или другой ткани. Такое терапевтическое лечение называется электропорообразующей терапией (ЭПТ), а также называется электрохимиотерапией. Хотя следующее ниже описание сосредоточено на ЭПТ, изобретение может применяться при других видах лечения, таких как генная терапия определенных органов тела.
Общее обсуждение ЭПТ проводится в одновременно рассматриваемой заявке серии 08/537265, поданной 29 сентября 1995 г., которая является частичным продолжением заявки серии 08/467566, поданной 6 июня 1995 г., которая является частичным продолжением заявки серии 08/042039, поданной 1 апреля 1993 г. , которая в настоящее время аннулирована, все из которых включены сюда в виде ссылки.
Электродные устройства
Фиг. 1 представляет собой схематическое изображение устройства в разрезе, показывающее вид игольчатого устройства 100 в соответствии с одним вариантом реализации изобретения. Игольчатое устройство 100 включает удлиненный трубчатый опорный корпус или стержень 112, который может быть изготовлен из полой трубки из нержавеющей стали или пластика медицинской степени очистки (например, нейлона). Если стержень изготовлен из электропроводного материала, на внешние элементы следует нанести электрическую изоляцию для защиты и пациента, и врача. Стержень 112 включает множество электродных иголок 114 на дистальном конце, соединенных с соответствующими проводниками многожильного проволочного кабеля 116. Электродные иголки 114 могут быть острыми или тупыми, полыми или сплошными и любой желательной длины. Материал электродных иголок 114 должен быть электропроводным, но не должен быть металлом или однородным (т.е. может использоваться композиционная или слоистая структура, такая как пластиковые или керамические иглы, покрытые металлом). Для инъекции терапевтического вещества может использоваться одна или более полых электродных иголок 114. В различных вариантах реализации электродные иголки 114 имеют прямоугольное, шестиугольное или круговое расположение. Однако могут использоваться другие типы.
При использовании многожильный проволочный кабель 116 соединяется с генератором высокого напряжения. В иллюстрируемом варианте реализации отводимый назад щит 118, ограниченный фрикционным уплотнителем 120 около дистального конца, может скользить по всей длине вдоль корпуса стержня 112 для защиты или раскрытия электродных иголок 114.
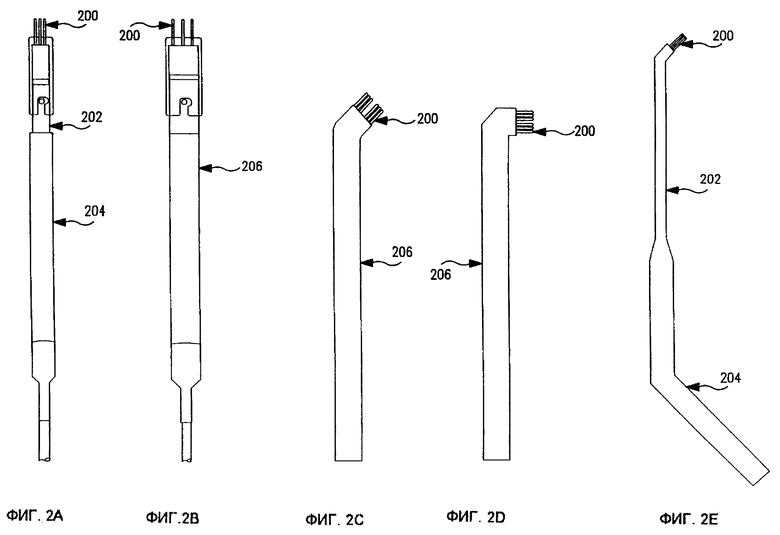
Фиг. 2А-2Е представляют собой схематические иллюстрации нескольких альтернативных вариантов реализации электродов в соответствии с изобретением. Фиг. 2А и 2В показывают электроды с прямым корпусом, имеющие иголки 200, расположенные на различном расстоянии друг от друга. Например, иголки на фиг. 2А располагаются в конфигурацию диаметром 0,5 см, тогда как на фиг. 2В они располагаются в конфигурацию диаметром 1,4 см. Различные размеры корпуса также могут меняться. Например, электрод на фиг. 2А имеет ступенчатую структуру корпуса с передней частью 202 меньшего диаметра относительно задней части 204 большего диаметра. Электрод на фиг. 2В имеет корпус 206 одинакового диаметра. Электроды на фиг. 2А и 2В особенно хорошо приспособлены для лечения мелких поверхностных опухолей.
Фиг. 2С и 2D показывают электроды с расположенной под углом головкой, имеющей игольчатые наконечники 200, установленные под углом относительно корпусов 206 электродов. Фиг.2C показывает игольчатые наконечники под углом приблизительно 45o относительно корпуса 206. Фиг.2D показывает игольчатые наконечники под углом приблизительно 90o относительно корпуса 206. Электроды на фиг. 2C и 2D особенно хорошо приспособлены для лечения опухолей головы и шеи.
Фиг.2Е показывает электрод с двойным углом, имеющий набор игольчатых наконечников 200, расположенных под углом относительно передней части 202 корпуса меньшего диаметра. Задняя часть 204 большего диаметра также расположена под углом. Электрод на фиг.2Е особенно хорошо приспособлен для лечения опухолей гортани, но может также использоваться в других полостях тела.
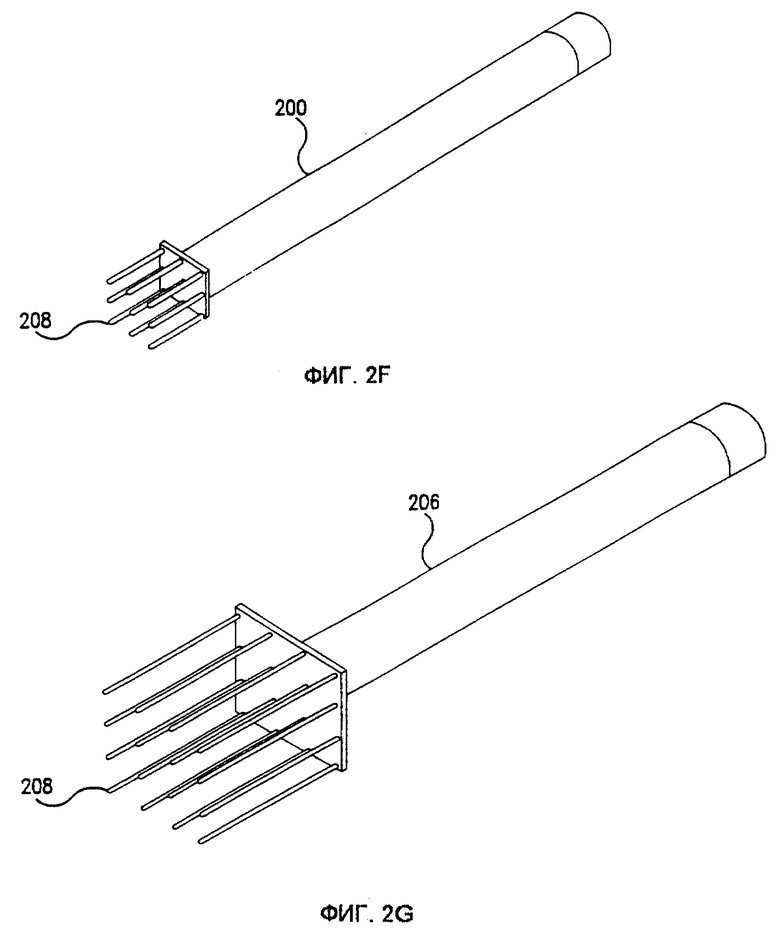
Фиг. 2F показывает электрод, особенно хорошо приспособленный для лечения крупных опухолей. Расстояние между иголками 208 может составлять, например, приблизительно 0,65 см. Фиг.2G показывает электрод, особенно хорошо приспособленный для лечения внутренних опухолей. Расстояние между иголками 208 может составлять, например, приблизительно 1,0 см.
Любые из отдельных элементов конфигурации (например, размер и конфигурация корпуса, угол расположения головки и корпуса и т.д.), показанных на фиг. 2A-2G, могут по желанию комбинироваться. Для удовлетворения потребностей определенного размера и доступа могут использоваться другие конфигурации электродных устройств.
Прибор для ЭПТ
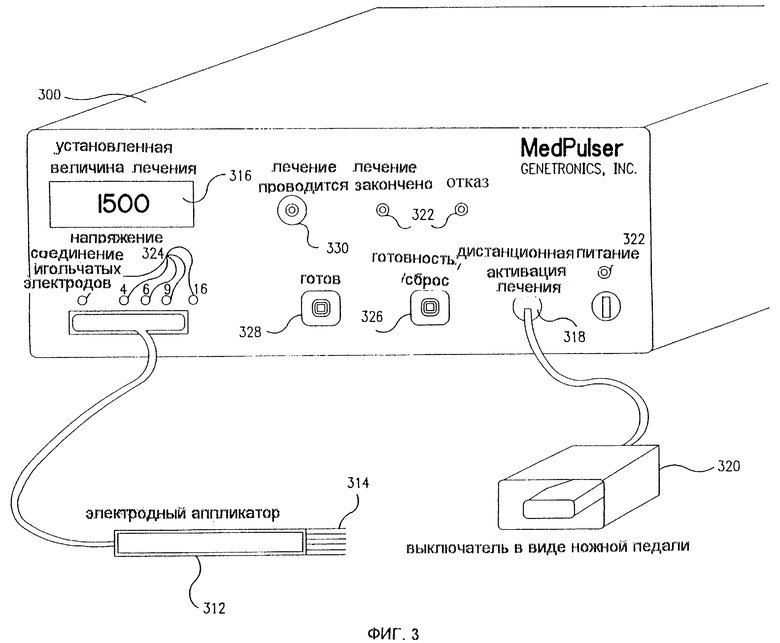
Фиг. 3 представляет собой схему устройства 300 для ЭПТ лечения, реализующего изобретение. Электродный аппликатор 312 съемно соединен посредством адаптера аппликатора 317 с устройством 300, которое избирательно подает импульсы напряжения на выбранные электродные иголки 314 электродного аппликатора 312. Все параметры - длительность импульса, уровень напряжения и тип выходного сигнала адресации или включения электродных иголок устройства 300 - программируемые. Дисплей 316 указывает заданное значение регулируемой величины напряжения лечения. Предоставляется соединение 318 дистанционной активации лечения для размещения выключателя 320 в виде ножной педали, подающего активирующие импульсы на электродный аппликатор 312. Выключатель 320 в виде ножной педали позволяет врачу включать устройство 300, в то же самое время освобождая обе руки для размещения электродного аппликатора 312 в ткани пациента.
Для удобства предоставлены индикаторные лампочки 322 для обнаружения повреждений, контроля включения питания и индикации завершения сеанса лечения. Предоставлены другие индикаторные лампочки 324 для положительной индикации того, что электродный аппликатор 312 соединен с устройством 300 и для индикации типа конфигурации иголок (см. обсуждение ниже). Предоставлена кнопка готовности/сброса 326 для "паузы" в работе прибора и сброса всех функций прибора в состояние по умолчанию. Для подготовки устройства 300 к сеансу лечения предоставляется кнопка готовности 328. Выступающая индикаторная лампочка 330 "идет лечение" показывает, что на электродные иголки 314 подаются импульсы напряжения. Кроме того, устройство 300 может иметь аудиоиндикаторы для таких функций, как нажатие кнопки, состояние отказа, завершение или окончание сеанса лечения, индикация проведения лечения и т.д.
В альтернативном варианте реализации устройство 300 может быть соединено с датчиком обратной связи, который выявляет сердечные сокращения. Подача импульсов около сердца может создать помехи нормальному сердечному ритму. С помощью синхронизации импульсов с безопасными периодами между сокращениями возможность такой помехи уменьшается.
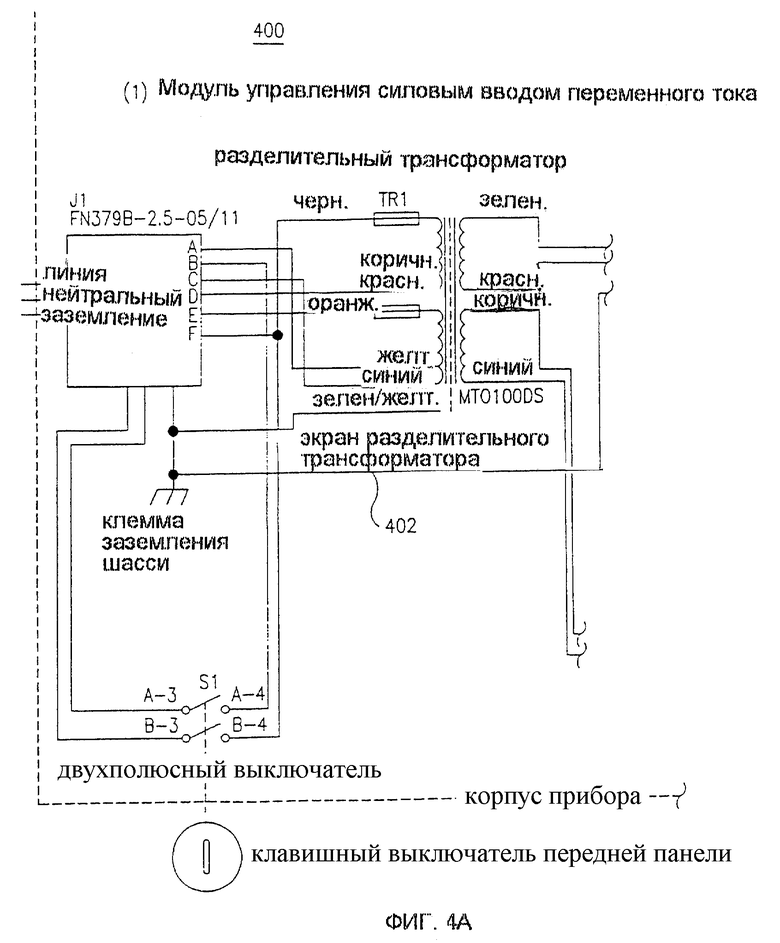
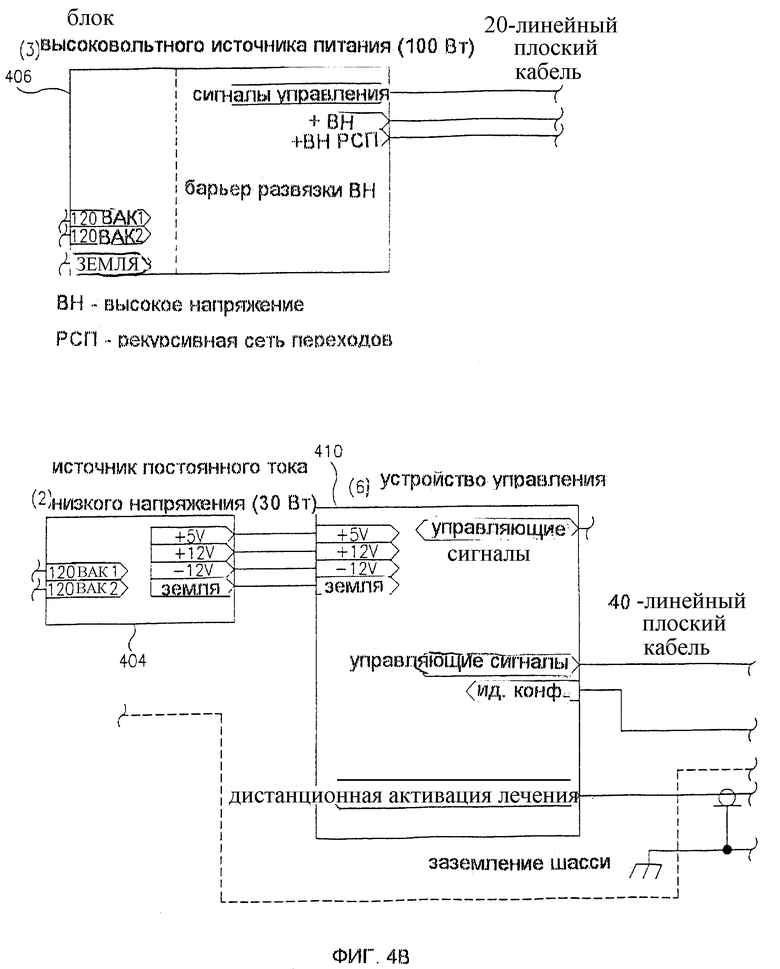
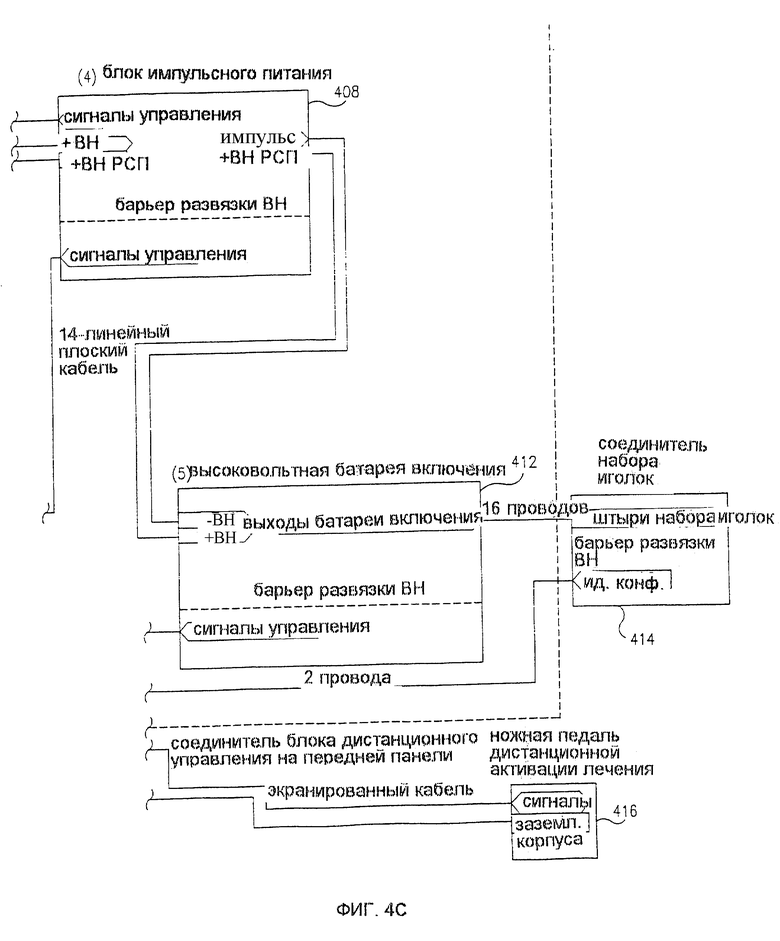
Фиг. 4 представляет собой блок-схему компоновки контура 400 устройства для лечения 300, изображенного на фиг. 3. Модуль 402 управления силовым вводом переменного тока обеспечивает электрически изолированное питание всего устройства 300. Блок подачи постоянного тока низкого напряжения 404 обеспечивает подходящее питание для контрольной схемы устройства 300. Блок электропитания высокого напряжения 406 обеспечивает подходящее высокое напряжение (например, до нескольких тысяч вольт), необходимое для ЭПТ лечения. Выход блока электропитания высокого напряжения 406 соединен с блоком импульсной подачи энергии 408, который генерирует импульсы различной ширины и напряжения под контролем устройства управления 410. Выход блока импульсной подачи энергии 408 соединен через высоковольтную батарею включения 412 с соединителем 414 набора иголок. Соединитель 416 ножной педали дистанционной активации лечения обеспечивает возможность прикрепления выключателя 320 в виде ножной педали.
Высоковольтная батарея включения 412 обеспечивает возможность подачи необходимого для ЭПТ высокого напряжения на выбранные подгруппы электродов в игольчатом устройстве 100. В предшествующих вариантах устройств ЭПТ подача такого напряжения обычно была связана с применением ручного поворотного "распределительного" выключателя, или варианта такого выключателя с электрическим приводом. Однако в настоящем изобретении все включения осуществляются с помощью электронно управляемых реле, обеспечивающих более быстрое и бесшумное включение, более длительную работу и улучшенный и более гибкий контроль типов включения.
Фиг. 5 представляет собой схематический чертеж элементов избирательного включения 500 высоковольтной батареи включения 412 контура, показанного на фиг. 4. Количество таких элементов включения 500 должно, по меньше мере, соответствовать самому большому числу электродов любого прикрепленного игольчатого устройства 100. Каждый элемент включения 500 обеспечивает контроль высокого напряжения, подаваемого на электрод игольчатого устройства 100, и способен обеспечить напряжение на связанный электрод с любой полярностью.
В частности, когда на один инвертирующий входной усилитель 502а подается "отрицательное" контрольное напряжение, связанное, обычно открытое реле 504а закрыто, устанавливая отрицательную возвратную цепь для импульса, подаваемого на парные электроды, которые предполагается соединить посредством соединителя 506 электродов. Аналогичным образом, когда на второй инвертирующий входной усилитель 502b подается "положительное" контрольное напряжение, связанное, обычно открытое реле 504b закрыто, устанавливая цепь для положительного импульса, который предполагается подать на электрод, соединенный посредством электродного соединения 506.
Адресация набора иголок
Устройство 300, изображенное на фиг. 3, предназначено для размещения электродных аппликаторов 312, имеющих различное количество электродных иголок 314. Соответственно, была разработана схема адресации, использующая различные "манипуляционные" резисторы, и которая содержит отображение в виде карты распределения каждой электродной иголки, одной из множества электродных игольчатых конфигураций для определения зоны лечения. В предпочтительном варианте схема адресации иголок обеспечивает возможность адресации по 16 различных иголок, обозначенных от А до Р, образующих по 9 квадратных зон лечения и несколько типов увеличенных зон лечения. Зона лечения включает по меньшей мере 4 иглы в конфигурации противоположных пар, который адресуются во время определенного импульса. Так, каждая зона лечения имеет по меньшей мере четыре стороны. Во время определенного импульса две из иголок зоны лечения имеют положительную полярность, а две - отрицательную полярность. Способ избирательной адресации множества электродных игольчатых конфигураций, каждая из которых включает по меньшей мере четыре электродных иголки, приспособленных для электропорообразующей терапии, содержит этапы отображения в виде карты распределения каждой электродной иголки, одной из множества электродных игольчатых конфигураций с тем, чтобы определить зоны лечения, имеющие по меньшей мере четыре стороны, и подачу импульсов напряжения переменной полярности на противоположные пары электродных иголок, определяющих каждую зону лечения.
Фиг.6 схематически показывает предпочтительную схему расположения иголок 4х4, образующих 9 квадратных зон лечения, пронумерованных от центра с продолжением по часовой стрелке. В предпочтительном варианте реализации эта схема картирования определяет 4-игольные, 6-игольные, 8-игольные, 9-игольные и 16-игольные конфигурации электродов. 4-игольный электрод включает иголки, размещенные в положениях F, G, К и J (зона лечения 1). 9-игольный электрод включает иголки, размещенные в положениях, определяющих зоны лечения 1-4. 16-игольный электрод включает иголки, размещенные в положениях, определяющих зоны лечения 1-9.
Фиг. 7А показывает последовательность импульсов для зоны лечения 2 х 2 в соответствии с одним вариантом реализации изобретения. Как показано, во время любого из четырех импульсов, составляющих цикл, противоположные пары иголок заряжены соответственно положительно и отрицательно. Возможны другие виды таких пар, такие как продвижение по часовой стрелке или против часовой стрелки. Для 9-игольной конфигурации электрода предпочтительный цикл включает 16 импульсов (4 зоны лечения при 4 импульсах каждая). Для 16-игольной конфигурации электрода предпочтительный цикл включает 36 импульсов (9 зон лечения при 4 импульсах каждая).
6-игольный электрод может включать круговую или шестиугольную схему, как показано на фиг. 7B-7D. Альтернативно, 6-игольный электрод может определяться в виде подкомплекта более крупной конфигурации, такой как показано на фиг. 6. Например, со ссылкой на фиг.6, 6-игольный электрод может быть образован в виде прямоугольной конфигурации 2 х 3 иголок, размещенных в положениях, определяющих зоны лечения 1-2 (или любую другую линейную пару зон лечения), или шестиугольное расположение иголок В, G, К, N, I, E (или любой другой набор положений, образующих шестиугольник), определяющее увеличенную зону лечения (показано очерчивающей пунктирной линией на фиг.6). Аналогичным образом, 8-игольный электрод может включать восьмиугольник или подкомплект более крупной схемы, показанной на фиг.6. Например, со ссылкой на фиг.6, 8-игольный электрод может быть образован в виде прямоугольной конфигурации 2 х 4 иголок, размещенных в положениях, определяющих зоны лечения 1, 2 и 6 (или любой другой линейный триплет зон лечения), или восьмиугольное расположение иголок В, С, Н, L, О, N, I, E (или любой другой набор положений, образующих восьмиугольник), определяющее увеличенную зону лечения.
Фиг. 6B-6D показывают шестиугольное расположение и одну возможную последовательность активации. Фиг. 6D показывает первую последовательность, при которой в течение первого импульса иголки G и К являются положительными, а иголки I и Е являются отрицательными, а во время следующего импульса имеют обратную полярность; иголки В и N, показанные пунктирной очерчивающей линией, являются неактивными. Фиг. 6С показывает вторую последовательность, при которой в течение первого импульса иголки К и N являются положительными, а иголки Е и В являются отрицательными, а во время следующего импульса имеют обратную полярность; иголки G и I являются неактивными. Фиг. 6DE показывает третью последовательность, при которой в течение первого импульса иголки N и I являются положительными, а иголки В и G являются отрицательными, а во время следующего импульса имеют обратную полярность; иголки К и Е являются неактивными. Во время цикла последовательностей подается всего 6 импульсов. Аналогичная последовательность активации может использоваться для восьмиугольного расположения.
Независимо от физической конфигурации, в предпочтительных варианта реализации изобретения всегда используются по меньшей мере две включенные пары электродов (например, как показано на фиг.7А) для достижения относительно однородного электрического поля в ткани, подвергающейся ЭПТ. Интенсивность электрического поля должна быть достаточной, чтобы обеспечить возможность включения лечебного средства для воздействия на процесс электропорообразования.
Автоматическая идентификация электродных аппликаторов
Схема картирования, описанная выше, позволяет соединять различные электродные аппликаторы 312 с одним и тем же устройством 300. Поскольку количество электродных иголок 314 может изменяться, изобретение включает средство для автоматической настройки устройства 300 для адресации соответствующего количества электродных иголок 314. В одном варианте реализации каждый электродный аппликатор 312 включает элемент идентификации встроенного типа, такой как "манипуляционный" резистор, который позволяет устройству 300 определить количество электродных иголок 314 и, следовательно, настроиться на соответствие схеме адресования. Когда электродный аппликатор 312 соединен с устройством 300, устройство 300 считывает элемент идентификации типа. Элемент идентификации типа может быть включен в соединитель для электродного аппликатора 312 и иметь доступ посредством общих или выделенных электрических соединений.
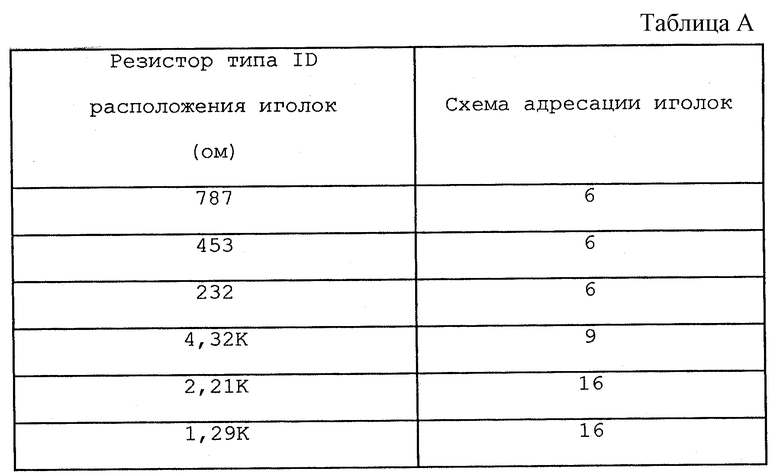
В качестве иллюстративного примера в табл. А представлена карта распределения резисторных величин по ряду электродных иголок 314.
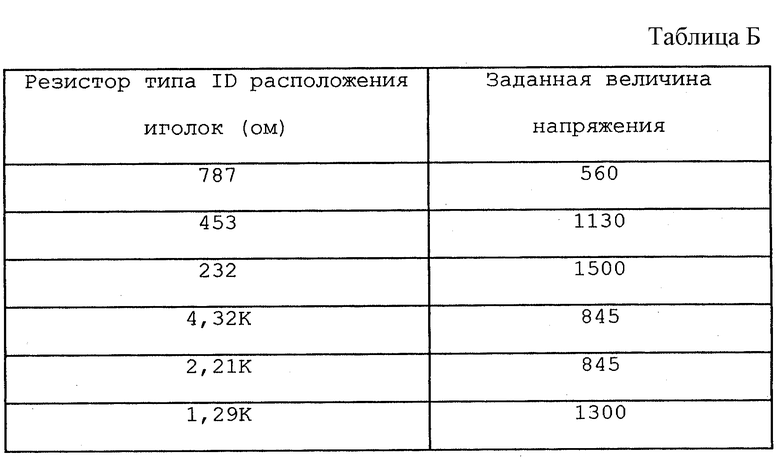
Аналогичная методика может использоваться для автоматической установки напряжения терапии для устройства 300, т.е. каждый электродный аппликатор 312 включает встроенный элемент идентификации напряжения, такой как "манипуляционный" резистор, который позволяет устройству 300 определить соответствующий уровень напряжения для лечебных импульсов для определенного электродного аппликатора 312. Устройство 300 считывает элемент идентификации напряжения, когда электродный аппликатор 312 соединен с устройством 300.
В качестве иллюстративного примера в табл. Б представлена карта распределения резисторных величин по заданным величинам напряжения.
Для идентификации типа и идентификации напряжения могут использоваться те же или другие идентификационные элементы. Тип идентификационного элемента также может меняться. Например, в каждый электродный аппликатор 312 может быть включен электронный контур с хранящимися цифровыми или аналоговыми величинами различных показателей. Примерами информации, которая может кодироваться в электродный аппликатор 312, являются: параметры типа конфигурации иголок, такие как количество иголок, расстояния между иголками, геометрия расположения иголок и/или последовательность включения иголок; параметры электрического импульса, такие как заданная величина напряжения, длительность импульса и/или форма импульса; длительность хранения и срок годности. Если в электродном аппликаторе 312 используется активный контур ввода, который может хранить данные (например, NVRAM), другая информация, которая может кодироваться в электродный аппликатор 312, включает: блокировку по истечении срока годности (т.е. код, который отменяет применение электродного аппликатора 312, если срок его годности истек); учет использования и блокировка (т. е. код, который отменяет использование электродного аппликатора 312, если было достигнуто количество разрешенных использований; когда электродный аппликатор 312 предназначен для одноразового использования, этот признак предотвращает загрязнение в результате повторного использования); историю использования (например, логарифм, который регистрирует количество поданных импульсов, дату и время наложения и т.д.) и выявление кода ошибки (например, для обеспечения возможности возврата электродного аппликатора 312 производителю и анализа типов отказа аппликатора или устройства 300).
Блокировка может определяться продолжительностью периода от первоначального применения аппликатора, а также количеством лечебных сеансов, проведенных с использованием одного устройства. Это может осуществляться с помощью ввода программной отметки времени в активный контур "манипуляционного" элемента одноразового аппликатора после первоначального соединения с устройством и не позволит в последующем его использовать после определенного периода времени. Предел периода времени будет определяться максимальной продолжительностью одной хирургической процедуры на практике.
Кроме того, использование "манипуляционного" элемента может включать информацию по производству и контролю качества. Одним примером такой информации является код серии устройства. Это также может помочь в контроле качества устройства путем запрета использования неисследованного материала, например, устройство конфигурируется для использования только после того, как оно успешно прошло инспекцию производственного теста.
Лапароскопический игольчатый аппликатор
Один вариант реализации изобретения, который может, в частности, применяться для лечения внутренних опухолей, сочетает набор иголок на лапороскопе и устройство эндоскопического исследования для обеспечения возможности минимально инвазивной ЭПТ. Фиг. 8 представляет собой схему устройства эндоскопического исследования 800 предшествующего уровня техники. Свет от источника света 840 известным образом передается через волоконно-оптический световод 842 к эндоскопу 844. Ткань освещается светом, испускаемым из дистального конца эндоскопа 844. Отраженный свет собирается дистальным концом эндоскопа 844 и передается в окуляр 846 или в видеокамеру 848 через оптрон 850. Сигнал от видеокамеры 848 может записываться на видеомагнитофон 852 и/или высвечивается на видеомониторе 854.
Фиг. 9А-9B представляют собой частичное схематическое изображение вида сбоку дистального конца усовершенствованного эндоскопа 844, изображенного на фиг. 8, показывающие в деталях группы иголок 960 в выдвинутом/отведенном назад состоянии в соответствии с изобретением. Смещаемый кожух 962 охватывает эндоскоп 944 и группу иголок 960. Фиг.9А показывает кожух 962 в расправленном положении, полностью покрывающий эндоскоп 944 и группу иголок 960. Фиг.9B показывает кожух 962 в отведенном назад положении, открывающий дистальные концы эндоскопа 944 и группу иголок 960. (Хотя в предпочтительном варианте реализации используется подвижный кожух 962, все, что требуется - это относительное движение между кожухом 962 и эндоскопом 944; следовательно, эндоскоп 944 может рассматриваться как подвижный элемент.)
В предпочтительном варианте реализации группа иголок 960 включает по меньшей мере две электродные иглы 964, каждая из которых соединена с подачей напряжения (не показана), а по меньшей мере одна из которых может быть полой и соединена через трубку 966 с подачей препарата (не показано). Наконечники электродных иголок 964 предпочтительно расположены, простираясь за пределы дистального конца эндоскопа 944 так, что с помощью эндоскопа 944 можно осматривать участок ткани, в то время как электродные иголки 964 вставлены в ткань.
Каждая электродная игла 964 соединена со сжимаемым механизмом 968, прикрепленным по меньшей мере к одной электродной игле для перемещения каждой прикрепленной электродной иглы от зачехленной конфигурации, когда кожух находится в выдвинутом положении, в развернутую конфигурацию, когда кожух находится в отведенном назад положении, в котором электродные иглы имеют большее расстояние относительно друг друга в развернутой конфигурации, чем в зачехленной конфигурации. В иллюстрируемом варианте реализации сжимаемый механизм 968 включает для каждой электродной иглы 964 опорное плечо 970, шарнирно соединенное со смещаемым основанием 972, которое может свободно двигаться вдоль эндоскопа 944 и к плечу первичного расправления 974. Каждое плечо первичного расправления 974 шарнирно соединено с фиксированным основанием 976, которое прикреплено к эндоскопу 944 и к соответствующей электродной игле 964. Плечо вторичного расправления 977, аналогичное по конструкции плечу первичного расправления 974 (но без опорного плеча 970), предоставлено для дополнительной устойчивости электродных иголок 964 при описанной ниже расправленной конфигурации.
Когда кожух 962 находится в расправленном положении, электродные иголки 964 находятся относительно близко друг к другу. Хотя при некоторых видах использования эта степень близости может соответствовать определенным уровням напряжения, при других видах использования электродные иголки 964 должны находиться на большем расстоянии друг от друга.
Соответственно, в предпочтительном варианте реализации, когда кожух 962 смещается в отведенное назад положение, компрессионный элемент 978 (например, пружина) подает напряжение смещения на каждое смещаемое основание 972, направленное в сторону от фиксированного основания 976, заставляя каждое опорное плечо 970 толкать соединенное плечо первичного расправления 974. Эта отводящая назад сила заставляет плечи расправления 974, 977 отгибаться под углом от эндоскопа 944 в расправленную конфигурацию, увеличивая таким образом расстояние между электродными иголками 964, как показано на фиг.9B.
Когда кожух 962 смещается в расправленное положение, кожух 962 сжимает вместе электродные иглы 964, заставляя складываться плечи расправления 974, 977. Это заставляет каждое плечо первичного расплавления 974 толкать соединенное опорное плечо 970. Отводящая назад сила, действующая на каждое опорное плечо 970, заставляет каждое смещаемое основание 972 двигаться по направлению к фиксированному основанию 976 в покрытую кожухом конфигурацию, сжимая компрессионный элемент 978, как показано на фиг.9А.
Для разделения электродных иголок 964 могут использоваться другие сжимаемые механизмы 968, такие как клины (или конус с полой сердцевиной) из сжимаемого эластомерного материала (такого, как поропласт или резина), помещенные между эндоскопом 944 и электродными иголками 964 так, что самая широкая часть клинов находится у дистального конца эндоскопа 944. Когда кожух 962 находится в отведенном назад положении, эластомерный материал больше расширяется в дистальном конце клинов, чем в проксимальном конце клинов, увеличивая таким образом расстояние между электродными иголками 964. Далее, нет необходимости в смещаемости каждой электродной иглы 964 сжимаемым механизмом 968. Например, достаточное разделение между двумя электродными иглами 964 может быть достигнуто, если одна из электродных иголок 964 удерживается в фиксированном положении относительно эндоскопа 944, в то время как другая электродная игла 964 может смещаться между сжатым и расправленным положением; в расправленной конфигурации две электродные иглы 964 будут расположены асимметрично относительно эндоскопа 944.
В любом случае, сжимаемый механизм 968 должен обеспечить электрическую изоляцию между каждой электродной иглой 964 и, следовательно, предпочтительно должен быть изготовлен целиком или частично из диэлектрика, такого как не обладающий электропроводностью пластик.
Хотя предпочтительный вариант реализации лапороскопической группы иголок включает эндоскоп, в некоторых вариантах реализации может использоваться лапороскопическая группа иголок с отдельным эндоскопом. В этой конфигурации опорный стержень может быть замещен на фиг.15А и 15В на эндоскоп 944.
Параметры электрического поля
Природа электрического поля, которое предполагается генерировать, определяется природой ткани, размером выбранной ткани и ее расположением. Желательно, чтобы поле было насколько возможно однородным и имело правильную амплитуду. Избыточная сила поля приводит к лизированию клеток, в то время как маленькая сила поля приводит к снижению эффективности. Возможны различные способы установки и манипуляции электродами, включая, но не ограничивая, способы, описанные в основной заявке. Для помещения во внутреннее положение электродами легко манипулировать с помощью пинцета.
Форма волн электрического сигнала, обеспечиваемого импульсным генератором, может представлять собой экспоненциально угасающий импульс, прямоугольный импульс, серию униполярных осциллирующих импульсов, серию биполярных осциллирующих импульсов или комбинацию любых из этих форм. Номинальная сила электрического поля может составлять от приблизительно 10 В/см приблизительно 20 кВ/см (номинальная сила электрического поля определяется с помощью расчета напряжения между электродными иглами, деленного на расстояние между иглами). Продолжительность импульса может составлять от приблизительно 10 до приблизительно 100 мкс. Может быть любое желаемое количество импульсов, обычно от одного до 100 импульсов в 1 с. Ожидание между группами импульсов может продолжаться любое желательное время, такое как 1 с. Форма волн, сила электрического поля и продолжительность импульса могут также зависеть от типа клеток и типа молекул, которые должны войти в клетки посредством электропорообразования.
Различные показатели, включая силу электрического поля, требуемые для электропорообразования любой известной клетки, в целом доступны из многих научных статей с данными по этому предмету, а также в базе данных, хранимых GENETRONICS, INC. , San Diego, California, правопреемника настоящей заявки. Электрические поля, необходимые для электропорообразования in vivo, такие как ЭПТ, в целом аналогичны по величине полям, требуемым для клеток in vitro. Недавние исследования авторов изобретения показывают, что предпочтительные величины находятся в диапазоне от 10 до приблизительно 1300 В/см. Верхний предел этого диапазона, выше приблизительно 600 В/см, был подтвержден данными научных публикаций о других экспериментах in vivo.
Номинальное электрическое поле может определяться как "высокое" или "низкое". Предпочтительно, при использовании высоких полей номинальное электрическое поле составляет от приблизительно 700 до 1300 В/см, а предпочтительно от приблизительно 1000 до 1300 В/см. Предпочтительно, при использовании низких полей номинальное электрическое поле составляет от приблизительно 10 до 100 В/см, а более предпочтительно, от приблизительно 25 до 75 В/см. В конкретном варианте реализации предпочтительно, чтобы, когда электрическое поле является низким, длительность импульса была большой. Например, когда номинальное электрическое поле составляет приблизительно 25-75 В/см, предпочтительно, чтобы длительность импульса составляла приблизительно 10 мс.
Предпочтительно, в способе лечения изобретения используется устройство изобретения, которое обеспечивает электродное устройство для применения электропорообразования в части тела пациента, включающее опорный элемент, множество игольчатых электродов, установленных на указанный опорный элемент, для введения в ткань в выбранных положениях и на выбранных расстояниях друг от друга, и средство, включающее генератор сигналов, реагирующий на указанное расстояние, для подачи на электроды электрического сигнала, пропорционального расстоянию между указанными электродами, для создания электрического поля заданной силы.
Альтернативно, понятно, что в способе лечения изобретения могут использоваться другие системы (например, для обработки низким напряжением и длинным импульсом), например устройство электропорообразования с прямоугольными импульсами. Например, может использоваться ElectroSquarePorator (T820), имеющийся в продаже у GENETRONICS, INC. of San Diego, California, U.S.A. Устройства для электропорообразования, генерирующие прямоугольные волны, подают контролируемые электрические импульсы, которые быстро нарастают до установленного напряжения, остаются на этом уровне в течение заданного периода времени (длительность импульса), а затем быстро падают до нуля. Этот тип устройства дает лучшую эффективность преобразования для электропорообразования протопласта растений и линий клеток млекопитающих, чем устройство с экспоненциальным угасанием.
ElectroSquarePorator (T820) представляет собой первое имеющееся в продаже устройство электропорообразования, генерирующее прямоугольные волны и способное создавать напряжение до 3000 В. Длительность импульса может устанавливаться от 5 мкс до 99 мс. Импульсы электропорообразования с волнами прямоугольной формы оказывают более щадящее воздействие на клетки, что приводит к повышению жизнеспособности клеток.
ElectroSquarePorator T820 работает и в режиме высокого напряжения (РВН) (100-3000 В), и в режиме низкого напряжения (РНН) (10-500 В). Длительность импульса для РНН составляет приблизительно от 0,3 до 99 мс, а для РВН - от 5 до 99 мкс. T820 обладает возможностью множественной импульсации от приблизительно 1 до 99 импульсов.
Способ лечения
Способ лечения по изобретению включает электротерапию, именуемую здесь так же, как электропорообразующая терапия (ЭПТ), с использованием устройства изобретения для доставки макромолекул в клетку или ткань. Как описано ранее, используемый здесь термин "макромолекула" или "молекула" относится к лекарственным препаратам (например, химиотерапевтическим средствам), нуклеиновым кислотам (например, полинуклеотидам), пептидам и полипептидам, включая антитела. Термин полинуклеотиды включает последовательности ДНК, кДНК и РНК.
Лекарственные препараты, которые предполагается применять в способе изобретения, обычно представляют собой химиотерапевтические средства, оказывающие противоопухолевое или цитотоксическое действие. Такие препараты или средства включают блеомицин, неокарционостатин, сурамин, доксорубицин, карбоплатин, таксол, митомицин С и цисплатин. Специалистам в этой области будут известны другие химиотерапевтические средства (см., например, указатель The Merck Index). Кроме того, в способ изобретения также включены средства, которые являются "действующими на мембраны". Эти средства могут также представлять собой перечисленные выше средства или, альтернативно, средства, которые действуют в первую очередь путем повреждения клеточных мембран. Примеры действующих на мембраны средств включают N-алкилмеламид и пара-хлорбензоат ртути. Химическое строение средства будет определять наиболее подходящее время введения средства относительно подачи электрического импульса. Хотя и не желая ограничиваться определенной теорией, считается, например, что препарат, имеющий низкую изоэлектрическую точку (например, неокарциностатин, ИЭТ=3,78) вероятно будет более эффективен при введении после электропорообразования во избежание электростатического взаимодействия высокозаряженного препарата внутри поля. Кроме того, такие препараты как блеомицин, которые имеют очень отрицательный логарифм Р (причем Р является коэффициентом разделения между октанолом и водой), являются очень крупными по размеру (мол. вес = 1400) и являются гидрофильными, тесно связываясь вследствие этого с липидной мембраной, очень медленно диффундируют в опухолевую клетку и обычно вводятся перед или одновременно с подачей электрического импульса. Кроме того, определенные средства могут потребовать модификации для обеспечения возможности более эффективного входа в клетку. Например, средство, такое как таксол, может модифицироваться для увеличения растворимости в воде, что обеспечит возможность более эффективного входа в клетку. Электропорообразование облегчает вход блеомицина или других аналогичных препаратов в опухолевую клетку с помощью создания пор в клеточной мембране.
В одном варианте реализации изобретение предоставляет способ терапевтического применения электропорообразования в ткани индивидуума для введения молекул в его клетки, включающий предоставление группы электродов, причем по меньшей мере один из электродов имеет конфигурацию иглы для проникновения в ткань; введение игольного электрода в выбранную ткань для введения молекул в ткань; расположение второго электрода из группы электродов в электропроводной связи с выбранной тканью; подачу на электроды импульсов электрических сигналов высокой амплитуды, пропорциональных расстоянию между электродами, для электропорообразования в ткани. Следует понимать, что электропорообразование в ткани может выполняться in vitro, in vivo или ex vivo. Электропорообразование может также выполняться с использованием одиночных клеток, например суспензий одиночных клеток или in vitro или ex vivo в клеточной культуре.
Может быть желательно модулировать экспрессию гена в клетке введением молекулы с помощью способа изобретения. Термин "модулировать" предусматривает подавление экспрессии гена при его избыточной экспрессии или усиление экспрессии, когда он недостаточно экспрессирован. Когда нарушение пролиферации клеток связано с экспрессией гена, могут использоваться последовательности нуклеиновых кислот, которые вмешиваются в экспрессию гена на уровне трансляции. В этом подходе используются, например, антисмысловая нуклеиновая кислота, рибозимы или триплексные средства для блокады транскрипции или трансляции определенной мРНК, или с помощью маскировки этой мРНК антисмысловой нуклеиновой кислотой или триплексным средством, или с помощью расщепления рибозимом.
Антисмысловые нуклеиновые кислоты представляют собой молекулы ДНК или РНК, которые комплементарны по меньшей мере для части молекулы специфичной мРНК (Weintraub, Scientific American, 262:40, 1990). В клетке антисмысловые нуклеиновые кислоты гибридизируются в соответствующую мРНК, образуя двухцепочечную молекулу. Антисмысловые нуклеиновые кислоты вмешиваются в трансляцию мРНК, поскольку клетка не будет транслировать мРНК, которая является двухцепочечной. Предпочтительны антисмысловые олигомеры приблизительно из 15 нуклеотидов, поскольку они легко синтезируются и связаны с меньшей вероятностью возникновения проблем при введении в целевую клетку, чем более крупные молекулы. Использование антисмысловых способов для ингибирования трансляции генов in vitro хорошо известно в предшествующем уровне техники (Marcus-Sakura, Anal. Biochem., 172:289, 1988).
Применение олигонуклетоидов для задержки транскрипции известно в виде триплексной стратегии, поскольку олигомер наматывается вокруг двуспиральной ДНК, образуя трехнитевую спираль. Поэтому эти триплексные соединения могут быть предназначены для распознавания специфичного участка на выбранном гене (Maher, et al., Antisense Res. and Dev., 1(3):227, 1991; Helene, C., Anticancer Drug Design, 6(6):569, 1991).
Рибозимы представляют собой молекулы РНК, обладающие способностью специфично расщеплять другую одноцепочечную РНК образом, аналогичным рестрикционным эндонуклеазам ДНК. Посредством модификации нуклеотидных последовательностей, которые кодируют эти РНК, можно методом генной инженерии создать молекулы, которые распознают специфические нуклеотидные последовательности в молекуле РНК и расщепляют ее (Cech, J.Amer.Med. Assn., 260:3030, 1988). Основное преимущество этого подхода состоит в том, что ввиду специфичности для последовательности инактивируются только мРНК с определенными последовательностями.
Существуют два основных типа рибозимов, а именно типа тетрагимена (Hasselhoff, Nature, 334: 585, 1988) и типа "молотоглава". Рибозимы типа тетрагимена распознают последовательности, которые представляют собой четыре основания по длине, в то время как рибозимы типа "молотоглава" распознают основные последовательности длиной в 11-18 оснований. Чем длиннее распознаваемая последовательность, тем больше вероятность того, что последовательность встретится исключительно в целевых видах мРНК. Следовательно, для инактивации специфических видов мРНК предпочтительнее рибозимы типа молотоглава, чем рибозимы типа тетрагимена, и последовательности распознавания длиной 18 оснований предпочтительнее более коротких последовательностей распознавания.
Изобретение также обеспечивает генетическую терапию для лечения клеточных пролиферативных или иммунологических расстройств, опосредованных определенным геном или его отсутствием. Такая терапия достигла бы своего терапевтического эффекта путем введения специфичного смыслового или антисмыслового полинуклеотида в клетку, имеющую расстройство. Доставка полинуклеотидов может быть достигнута с использованием рекомбинантного вектора экспрессии, такого как химерный вирус, или полинуклеотид может доставляться, например, в виде депротеинизированной ДНК.
Различные вирусные векторы, которые могут использоваться для генной терапии, в соответствии с положениями настоящего изобретения, включают аденовирус, вирус герпеса, вирус коровьей оспы или предпочтительно вирус РНК, такой как ретровирус. Предпочтительно, ретровирусный вектор является производным мышиного или птичьего ретровируса. Примеры ретровирусных векторов, в которые может быть вставлен одиночный инородный ген, включают, но не ограничиваются: вирус мышиного лейкоза Moloney (MoMuLV), вирус мышиной саркомы Harvey (HaMuSV), мышиный вирус опухоли молочной железы (МиМТV) и вирус саркомы Рауша (RSV). Когда индивидуумом является человек, может использоваться такой вектор, как вирус обезьяньего лейкоза гиббонов (GaLV). Ряд дополнительных ретровирусных векторов могут включать множественные гены. Все эти векторы могут переносить или включать ген для отбираемого маркера так, что могут быть выявлены и генерированы трансдуцированные клетки.
Терапевтические пептиды или полипептиды могут также быть включены в способ лечения изобретения. Например, для включения клеткой могут вводиться иммуномоделирующие средства и другие модификаторы биологической реакции. Термин "модификаторы биологической реакции" подразумевает охват веществ, которые участвуют в модификации иммунного ответа. Примеры модификаторов иммунного ответа включают такие соединения, как лимфокины. Лимфокины включают фактор некроза опухолей интерлейкины 1, 2 и 3, лимфотоксин, фактор активации макрофагов, фактор ингибирования миграции, колониестимулирующий фактор и альфа-интерферон, бета-интерферон и гамма-интерферон и их подтипы.
Включены также полинуклеотиды, которые кодируют метаболические ферменты и белки, включая соединения антиангиогенеза, например фактор VIII или фактор IX. Макромолекула изобретения также включает молекулы антител. Используемый здесь термин "антитело" подразумевает включение интактных молекул, а также их фрагментов, таких как Fab и F(ab')2.
Ведение лекарственного препарата, полинуклеотида или полипептида в способе изобретения может осуществляться, например, парентерально с помощью инъекции, быстрой инфузии, всасывания в носоглотке, всасывания через кожу и орально. Например, в случае опухоли химиотерапевтическое или другое средство может вводиться местно, системно или в виде инъекции непосредственно в опухоль. Если, например, препарат вводится непосредственно в опухоль, имеет преимущество производить инъекцию препарата "веерным" способом. Термин "веерный" относится к введению препарата с помощью изменения направления иглы во время инъекции препарата или с помощью множественных инъекций в различных направлениях, подобно раскрытию ручного веера, а не в виде болюса, для обеспечения большего распределения препарата по опухоли. По сравнению с объемом, который обычно используется в предшествующем уровне техники, для обеспечения соответствующего распределения препарата по опухоли желательно увеличить объем раствора, содержащего лекарственный препарат, когда препарат вводится (например, в виде инъекции) в опухоль. Например, в приведенных здесь примерах с использованием мышей специалист в этой области обычно производит инъекцию 50 мкл раствора, содержащего лекарственный препарат, однако результаты значительно улучшаются с помощью увеличения объема до 150 мкл. В клинических исследованиях у людей для обеспечения соответствующей перфузии опухоли производилась инъекция приблизительно 20 мл. Инъекцию предпочтительно следует делать очень медленно вокруг всего основания и веерным способом. Хотя интерстициальное давление в центре опухоли очень высокое, в этой области очень часто имеется некроз опухоли.
Молекула предпочтительно вводится по существу одновременно с электропорообразуюшей обработкой. Термин "по существу одновременно" обозначает, что введение молекулы и электропорообразующая обработка производятся приемлемо близко друг к другу с точки зрения времени. Введение молекулы или терапевтического средства может осуществляться с любым интервалом, в зависимости от таких факторов, как, например, природа опухоли, состояние пациента, размер и химические характеристики молекулы и период полувыведения молекулы.
Препараты для парентерального введения включают стерильные водные или неводные растворы, суспензии и эмульсии. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и пригодные для инъекции органические эфиры, такие как этиолеат. Кроме интертных разбавителей, такие композиции могут также включать адъюванты, увлажнители, эмульсификаторы и суспендирующие средства. Кроме того, для удерживания терапевтического средства в локализованном состоянии перед подачей импульсов могут использоваться сосудосуживающие средства.
С помощью способа изобретения можно обрабатывать любую клетку. Представленные здесь иллюстративные примеры демонстрируют использование способа изобретения для обработки опухолевых клеток, например, поджелудочной железы, легких, головы и шеи, кожных и подкожных раковых опухолей. Лечению с помощью способа электропорообразования изобретения подлежат другие клеточные пролиферативные расстройства. Термин "клеточное пролиферативное расстройство" обозначает популяции злокачественных, а также незлокачественных клеток, которые, как оказывается, часто отличаются от окружающей ткани и морфологически, и генотипически. Злокачественные клетки (т.е. опухоли или рак) развиваются в результате многоэтапного процесса. Способ изобретения может использоваться при лечении злокачественных поражений или других расстройств различных систем органов, в частности, например, клеток в поджелудочной железе, голове и шее (например, гортани, носоглотке, ротоглотке, гортанной части глотки, губ, горла) и легких, а также включая клетки сердца, почек, мышц, молочных желез, толстой кишки, предстательной железы, вилочковой железы, семенников и яичников. Кроме того, с помощью способа лечения изобретения можно также лечить злокачественные поражения кожи, такие как базальноклеточная карцинома или меланома (см. пример 2). Предпочтительно, индивидуумом является человек, однако следует понимать, что изобретение может также использоваться в ветеринарии у животных или млекопитающих.
Еще в одном варианте реализации изобретение предоставляет способ терапевтического применения электропорообразования в ткани индивидуума для повреждения или уничтожения в ней клеток. Способ включает предоставление группы электродов, расположение второго электрода из группы электродов в электропроводной связи с выбранной тканью; и подачу на электроды импульсов электрических сигналов высокой амплитуды, пропорционально расстоянию между электродами, для электропорообразования в ткани. В способе предпочтительно используется низкое напряжение и большая длительность импульса, что исключает необходимость в дополнительных цитотоксических или химиотерапевтических средствах. Предпочтительно, номинальное электрическое поле, например, составляет от приблизительно 25 до 75 В/см, а длина импульса составляет от приблизительно 5 мкс до 99 мс.
Следующие примеры предназначены для иллюстрации, а не ограничения изобретения. Хотя они типичны для тех, которые могут использоваться, альтернативно могут применяться другие процедуры, известные специалистам в этой области.
Следующие примеры иллюстрируют применение ЭПТ в линиях клеток у животных и людей. Пример 1 иллюстрирует ЭПТ в слабо дифференцированных опухолях поджелудочной железы человека (Рапс-3), ксенотрансплантированных подкожно на бок безволосых мышей. Пример 2 показывает результаты клинических испытаний у людей с использованием ЭПТ для лечения базальноклеточных карцином и меланом. Пример 3 показывает результаты клинических испытаний у людей с использованием ЭПТ для лечения опухолей головы и шеи. Пример 4 предоставляет данные in vitro для ЭПТ с использованием низкого напряжения (электрического поля) и импульсов большой длительности. Параметры ЭПТ описаны в примерах; для примера 1 и для клинических испытаний при поражении головы и шеи номинальное электрическое поле было 1300 В/см и 6 импульсов в течение 99-100 мкс, разделенных интервалами 1 с. В клинических испытаниях (пример 2) использовались аналогичные параметры, однако электрическое поле составило 1130 В/см. (Номинальное электрическое поле (В/см) представляет собой напряжение (В) между парами иголок, разделенное на расстояние между парами иголок (см)). Примеры иллюстрируют применение ЭПТ для эффективного уничтожения нежелательных клеточных популяций (например, опухоли) in vitro и in vivo.
Пример 1 - ЭПТ для лечения опухолей in vivo
Одиночная лечебная процедура включала инъекцию блеомицина (0,5 единиц в 0,15 мл солевого раствора) внутрь опухоли с использованием веерного введения, как описано здесь, с последующей подачей шести электрических импульсов волн прямоугольной формы через 10 мин, с использованием электродов из группы иголок, как описано в настоящей заявке, расположенных вдоль окружности круга диаметром 1 см. Для соответствия опухолям различного размера может также использоваться группа иголок, расположенных по кругу различного диаметра (например, 0,5 см, 0,75 см и 1,5 см). Для изменения глубины проникновения иголок в опухоль в центр группы могут вставляться стопоры. Встроенный механизм обеспечивал возможность включения электродов для максимального охвата опухоли импульсным полем. Электрические параметры были следующими: сила поля в центре 780 В/см и 6 импульсов по 99 мкс, разделенных интервалом 1 с.
Результаты показали тяжелый некроз и отек почти у всех мышей в участке лечения. В то время как в группе лечения (D+E+; D=npenapar, Е=электрическое поле) наблюдалось существенное уменьшение объема опухолей (после небольшого первоначального увеличения вследствие отека), у мышей в контрольной группе (D+E-) объем опухолей резко увеличился. Гистологический анализ образцов опухолей показал тени некротических опухолевых клеток в группе D+E+, в сравнении со смесью жизнеспособных и некротических клеток в группе D+E-. Предварительные исследования с немелкоклеточными раковыми опухолями легких человека (НМКРЛ), ксенотрансплантированными безволосым мышам, также дали очень воодушевляющие результаты при лечении ЭПТ с блеомицином.
Линия опухолевых клеток Рапс-3, линии слабо дифференцированных клеток аденокарциномы поджелудочной железы поставлялись AntiCancer, Inc., San Diego. Для экспериментов ЭПТ ткань, взятую у линейных мышей, у которых поддерживалась опухолевая линия, оттаивали и разрезали на очень маленькие кусочки размером приблизительно 1 мм каждый, и 8-10 кусочков ксенотрансплантировали хирургическим способом в подкожный мешок, созданный на левом боку безволосых мышей, и затем ушивали хирургической нитью 6.0. После того как средний размер опухоли достигал приблизительно 5 мм, мыши с пальпируемыми опухолями были разделены методом рандомизации; 10 мышей были включены в контрольную группу (D+E-; D= npenapaT, Е=электрическое поле) и 10 мышей - в группу лечения ЭПТ, а именно инъекции блеомицина с последующей импульсацией (D+E+) от генератора импульсов прямоугольных волн ВТХ Т820. Измеряли размеры опухоли и рассчитывали объем опухоли с использованием формулы
(11/6)а х b х с,
где а, b и с представляют собой соответственно длину, ширину и толщину опухоли. 0,5 единиц блеомицина (Sigma Chemicals) растворяют в 0,15 мл 0,9% NaCi и с помощью веерного введения производят инъекцию в опухоль каждой мыши и в группе контроля (D+E-), и в группе лечения (D+E+). Через 10 мин после инъекции у каждой мыши из группы D+E+ проводят импульсацию с помощью электропорообразующего устройства, генерирующего импульсы прямоугольных волн ВТХ Т820 с использованием набора электродов в виде группы иголок, как описано в настоящем изобретении. Используемые электрические параметры были следующими: сила поля 1300 В/см, 6 импульсов по 99 мкс каждый с интервалом 1 с.
Ежедневно контролировали мышей с учетом смертности и отмечали признаки болезненного состояния. С равными промежутками времени измеряли размеры опухолей и контролировали замедление или ускорение роста опухолей.
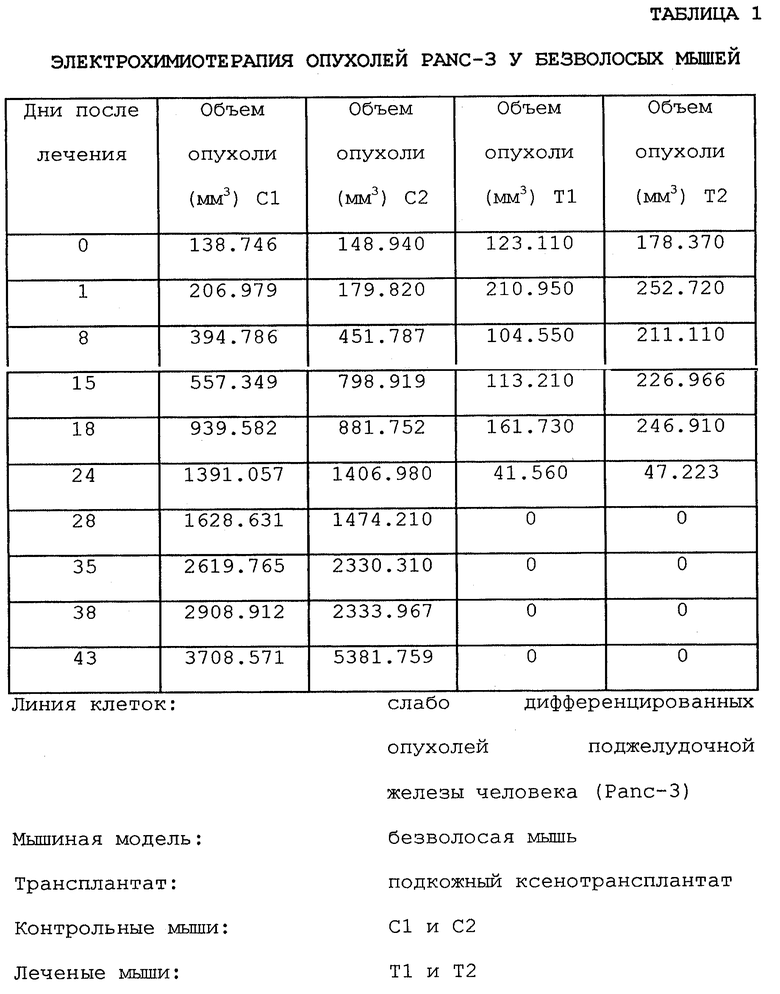
Фиг. 10 показывает результаты ЭПТ различных контрольных и леченых животных с использованием блеомицина и без препарата, а также с использованием импульсации и без ее применения по поводу опухолей Рапс-3. Было резкое различие между нелечеными и лечеными мышами с точки зрения объема опухолей. Приблизительно после 24 д. лечения по существу не было выявляемой опухоли. Результаты, представленные на фиг. 10, суммированы также ниже в табл. 1 до 43 д. Иллюстрация действительной регрессии опухоли последовательно показана на фиг. 13A-13D, а соответствующая гистология на фиг.14A-14C.
Эксперимент с Рапс-3 повторяли с использованием линии клеток немелкоклеточного рака легких (НМКРЛ), 177 (AntiCancer, San Diego, CA). Результаты были аналогичны результатам, обнаруженным при использовании блеомицина и Рапс-3, как показано на фиг. 10. В одном эксперименте опухоль, которая рецидивировала, лечили на 27 д. (фиг. 12), и через 7 д. данных о наличии опухоли не было.
Модели Рапс-3 и НМКРЛ использовались с препаратом неокарциностатин (НКС) с последующей такой же процедурой, как указывалось выше. Как показано на фиг. 11А, введение НКС перед импульсацией методом, аналогичным методу, который использовался для исследований блеомицина, был совсем неэффективен в уменьшении размера опухолей. Считалось, что вследствие низкой изоэлектрической точки НКС, электростатическое взаимодействие препятствовало входу препарата в опухолевую клетку. Поэтому эксперимент повторяли, сначала воздействуя импульсацией, а после импульса - производя инъекцию НКС.
Фиг.11В показывает первоначальный объем опухоли (1), в сравнении с окончательным объемом опухоли (F) на 13 д. у 7 леченых мышей (Мышь ID 1-7). У нескольких мышей (ID 1, 2, 4 и 7) наблюдалось увеличение объема опухоли, но, как оказалось, вследствие отека. Однако, как показано на фиг.20D, когда отдельную группу из 5 мышей исследовали на 23 д., у всех мышей было обнаружено выраженное уменьшение объема опухоли.
Сравнение фиг.11А и 11В показало, что введение НКС после импульсации было более эффективно, чем введение НКС перед импульсацией.
Настоящий пример иллюстрирует, что слабо дифференцированный рак поджелудочной железы (Рапс-3) и немелкоклеточный рак легких (НМКРЛ), ксенотрансплантированные под кожу безволосым мышам, можно эффективно лечить с помощью способа ЭПТ изобретения с использованием блеомицина или НКС и электродов в виде группы иголок. При использовании способа изобретения эффективными могут быть также другие аналогичные химиотерапевтические средства.
Реакция Рапс-3 на ЭХТ блеомицином показана в табл. 2. У 68% (17/25) леченых мышей через 28 д. после лечения наблюдалась полная регрессия опухоли, в то время как через 28 д. после лечения у 20% (5/25) отмечена частичная (>80%) регрессия, у 8% (2/25) реакция не наблюдалась и 4% (1/25) умерли через 20 д. после лечения. Даже через 120 д. после лечения в 64% (16/25) случаев не наблюдалась пальпируемая опухоль. Во время наблюдения репрезентативных животных (2/17) из этой группы в течение 243 д. опухолей не было, после чего животные были гуманно умерщвлены. Однако у 8% мышей через 35 д. после лечения был отмечен повторный рост опухоли, но с гораздо более медленной скоростью.
Гистологические исследования отчетливо показали тяжелый некроз области опухоли у группы, подвергнутой ЭПТ, тогда как в контрольной группе не было очевидного некроза. Было обнаружено, что инъекция препарата в опухоль при большем объеме блеомицина в комбинации с веерным введением для максимально однородного распределения препарата по объему опухоли очень эффективна в сравнении с обычным способом инъекции препарата перед импульсацией.
Результаты in vivo при использовании MedPulserTM
Предварительные эксперименты с использованием MedPulserTM (устройство изобретения) для лечения ксенотрансплантатов опухолей, выращенных подкожно у безволосых мышей, дали обнадеживающие результаты. Приблизительно у 75% мышей, леченных с помощью ЭПТ с использованием MedPulserTM, до 39 д. наблюдения выявлена полная регрессия ксенотрансплантата опухоли поджелудочной железы человека (Panc-4). Лечение ксенотрансплантатов предстательной железы человека (РС-3) также показало полную регрессию опухолей приблизительно в 66% случаев. (До 60 д. после лечения опухоли не наблюдались). При лечении опухолей с помощью ЭПТ эффективна и 4-, и 6-игольная конфигурация.
Сравнение 4- и 6-игольной конфигурации MedPulserTM для экспериментов in vitro с РС-3
Эксперименты проводились для сравнения эффективности 6-игольной с 4-игольной конфигурацией MedPulserTM на РС-3 (линии клеток предстательной железы человека) in vitro. Клетки суспендируют в средах RPMI и равномерно засевают при концентрации 200 000 клеток/мл. В ячейки добавляют блеомицин при 2 х 10-5M (только для D+E- и D+E+). Клетки подвергают электропорообразованию в 24-ячеечных планшетах с использованием электродов с 6-игольной и 4-игольной конфигурацией, соединенных с MedPulser. Параметры электрических импульсов были при 6-игольной конфигурации 6 х 99 мкс, 1129 В, а при 4-игольной конфигурации - 4 х 99 мкс, 848 В. Клетки переносят в 96-ячеечные планшеты и инкубируют в течение 20 ч при 37oС. Выживание клеток определяют с использованием теста ХТТ, который основан на метаболическом превращении ХТТ в формазан и измеряется спектрофотометрически при 450 нм. Только живые клетки превращают ХТТ в формазан. Процентные величины выживания клеток представляют собой относительные величины, рассчитанные по значениям оптической плотности образца, контроля со 100% выживанием клеток (D-E-) и контроля с 0% выживания клеток (D-E- с додецилсульфатом натрия, который лизирует все клетки). Данные выживания клеток представлены в табл.3.
На основании предварительных данных, полученных в экспериментах, можно сделать вывод, что статистически и 4-, и 6-игольная конфигурация, как оказывается, одинаково эффективны в уничтожении опухолевых клеток in vitro.
ПРИМЕР 2 - Клинические испытания по поводу базально-клеточных карцином и меланом
К концу восьминедельного периода нужно было оценить эффективность воздействия блеомицина-ЭПТ на опухоли с использованием тех же критериев реакции опухолей, которые использовались в примере 1.
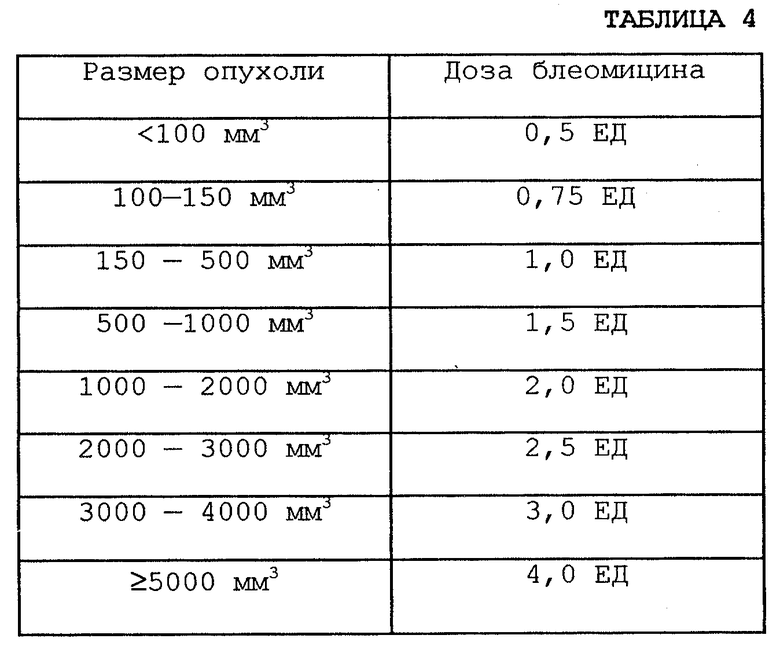
Концентрация вводимого блеомицина была 5 ЕД/мл. Вводили следующие дозировки блеомицина (см. табл.4 в конце описания).
В табл.5 представлены результаты реакций на лечение.
ОЭ = отсутствие эффекта; уменьшение объема опухоли менее, чем на 50%.
ЧР = частичная реакция; уменьшение объема опухоли на 50% или более.
ПР = полная реакция; исчезновение всех показателей наличия опухоли по данным физикального обследования и/или биопсии.
ПРИМЕР 3 - ЭПТ по поводу раковых опухолей головы и шеи
Всех следующих больных лечили внутриопухолевой инъекцией блеомицина и игольными конфигурациями различных диаметров с шестью иглами. Напряжение устанавливалось для достижения номинальной силы электрического поля 1300 В/см (для получения напряжения, которое было задано для подачи на генератор, диаметр игольной конфигурации умножали на 1300). Длительность импульса была 100 мкс.
Методы исследования
Исследование структурировалось в виде одноцентрового клинического исследования возможности применения метода лечения, в котором эффективность процедуры ЭПТ в комбинации с введением блеомицина в очаг поражения сравнивали с традиционным хирургическим способом, облучением и/или системной химиотерапией. В исследование были включены приблизительно 50 пациентов. У всех пациентов перед лечением состояние оценивали с помощью обследования и биопсии. Послеоперационная оценка состояния пациентов осуществлялась еженедельно в течение 4-6 нед. всего в течение 12 мес. Приблизительно через 8-12 нед. после лечения выполняли биопсию участка опухоли. Компьютерная томография или магнитно-резонансная визуализация использовались в соответствии со стандартным контрольным медицинским наблюдением больных раком головы и шеи.
Оценка опухоли включает измерение диаметра опухоли (в см) и оценку ее объема (в см3). Перед введением блеомицина сульфата в опухоль участок опухоли анестезируют 1% лидокаином (ксилокаином) и 1:100,000 адреналина. Концентрация инъецируемого блеомицина сульфата составляет 4 ЕД на 1 мл вплоть до максимальной дозы 5 ЕД на опухоль. Если у одного больного проводится лечение более одной опухоли, не следует вводить общую дозу, превышающую 20 единиц на одного больного. Вводимая доза блеомицина должна составлять 1 ЕД/см3 рассчитанного объема опухоли. Приблизительно через 10 мин после инъекции блеомицина сульфата на опухоль помещают аппликатор и начинают электрическую импульсацию. Каждая подача или инициация электрических импульсов именуется циклом. Применение ЭПТ не является противопоказанием к любому последующему паллиативному лечению, требуемому индивидуумом.
В этом исследовании успех определялся как значительная регрессия опухоли в течение периода 16 нед. или менее без выраженных побочных эффектов, наблюдаемых при традиционном лечении. Существует три возможных исхода в виде реакции на лечение:
- Полная реакция (ПР): Исчезновение всех доказательств наличия опухоли по данным физикального исследования и/или биопсии.
- Частичная реакция (ЧР): уменьшение объема опухоли на 50% или более.
- Отсутствие реакции (ОР): уменьшение объема опухоли менее чем на 50%.
Если опухоль увеличивалась в объеме (на 25% объема опухоли), при наличии показаний в соответствии с желанием больного применяли другое лечение.
Реакция индивидуума на лечение
В табл. 6 представлена реакция индивидуума на лечение. У трех лиц имелась полная реакция (Индивидуум 1, 3 и 4) ; у четырех индивидуумов имелась частичная реакция (Индивидуум 2, 6, 8 и 9) и у двух индивидуумов не было реакции (Индивидуумы 5 и 7) на лечение. Три человека умерли до достижения 12 нед. вследствие прогрессирующего заболевания или осложнений, не связанных с исследуемым лечением (Индивидуум 2, 5 и 7). Один из трех индивидуумов через 4 нед. достиг ЧР (Индивидуум 2). Два человека перед включением в исследование не получали предшествующего стационарного лечения рака по поводу их опухоли (Индивидуумы 4 и 8). У трех человек была опухоль, которая была не полностью доступной для аппликаторного компонента устройства, и поэтому они получали сегментарное лечение (Индивидуумы 5, 7-и 9).
В табл. 6 обобщены результаты клинических исследований с использованием блеомицина сульфата и ЭПТ с применением устройства изобретения MedPulserТМ.
ПРИМЕР 4 - ЭПТ низким напряжением с большой продолжительностью импульса (ННБПИ)
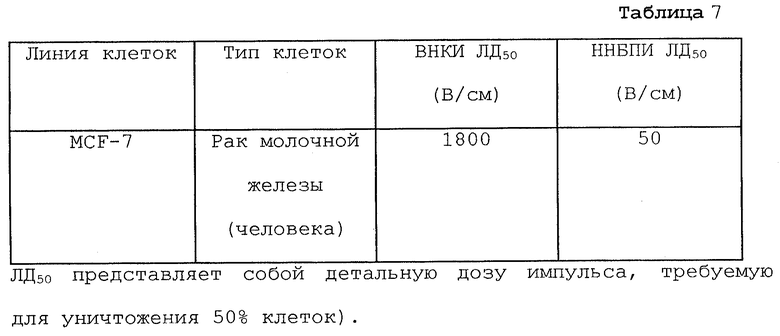
При обычной электрохимиотерапии для лечения опухолей используются импульсы высокого напряжения короткой продолжительности. Было установлено, что параметры электрического поля 1200-1300 В/см и 100 мкс очень эффективны in vitro и in vivo в комбинации с противораковыми препаратами, подобными блеомицину, цисплатину, пепломицину, митомицину С и карбоплатину. Эти результаты относятся к работе in vitro и in vivo. Хотя такие электрические условия хорошо переносятся пациентами в клинических ситуациях, такие виды лечения обычно вызовут мышечные судороги и изредка ощущение дискомфорта у пациентов. Обнаружено, что ощущение дискомфорта связано с индивидуальным восприятием боли пациентом. Часто в одних и тех же условиях эксперимента больные реагируют весьма по-разному. Некоторые из этих проблем можно значительно уменьшить с помощью применения для электрохимиотерапии импульсов низкого напряжения и большой длительности. По имеющимся данным (Т. Nishi et al., Cancer Res. 56: 1050-1055, 1996), самая маленькая сила поля, которую использовали для переноса гена in vivo, составляет 600 В/см. Максимальные величины силы поля, используемые в экспериментах ЭПТ in vitro, показаны в табл. 7, где сила поля, необходимая для уничтожения 50% клеток, составляет ≤50 В/см.
Следующие эксперименты in vitro с клеточными линиями различных опухолей, такими как MCF-7 (рак молочной железы человека), РС-3 (рак предстательной железы человека) и С6 (глиома крыс), показали, что с точки зрения уничтожения опухолевых клеток импульсы низкого напряжения и большой продолжительности одинаково или более эффективны, чем импульсы высокого напряжения и короткой продолжительности. Результаты проиллюстрированы в пределах MCF-7. Подбор длительности импульса показал, что она может находиться в пределах от 4 до 15 мс. Оценка реакции MCF-7 на электропорообразование проводилась и при высоком напряжении/короткой продолжительности импульса (ВНКИ), и при низком напряжении/большой продолжительности импульса (ННБПИ) с использованием теста ХТТ через 70 ч, который основан на метаболическом превращении ХТТ в формазан, который измеряется спектрофотометрически при 450 нм (M.W. Roehm, et al. . An Improved Colorimetric Assay for Cell Proliferation and Viability Utilizing the Tetrazolium Salt XTT, J. Immunol. Methods 142: 2, 257-265, 1991). XTT представляет собой тетразолиевый реактив, 2,3-бис(2-метокси-4-нитро-5-сульфофенил)-5-[(фениламино)карбонил]-2Н-тетразолий гидроксид (XTT), который метаболически восстанавливается в жизнеспособных клетках в водорастворимый продукт формазана. Процентные величины выживания клеток представляют собой относительные величины, рассчитанные с использованием формулы по значениям оптической плотности образца. (Контроль со 100% выживанием клеток (D-E) и контроль с 0% выживания клеток (D-E с додецилсульфатом натрия)). Эксперименты с ВНКИ проводились для обеспечения возможности прямого сравнения с разработанным в настоящее время способом ННБПИ ЭПТ.
Напряжение всего 25 В/см вызвало значительное цитотоксическое действие на клетки. Увеличение электрического поля привело к полному уничтожения клеток. Некоторые клеточные линии, подобные глиоме С6, которые не подвергались существенному воздействию импульсами высокого напряжения, полностью уничтожались импульсами низкого напряжения 20-30 В/см. Эти полученные in vitro результаты отчетливо устанавливают возможность использования ЭПТ формы ННБПИ.
Цитотоксичность препаратов в комбинации с ЭПТ in vitro
Результаты экспериментов ЭПТ in vitro с различными препаратами с использованием MCF-7 и при высоком напряжении, и при низком напряжении описаны ниже.
Клетки получали у АТСС (American Type Tissue Collection, Rockville, MD, USA) и сохраняли с помощью рекомендуемых ими методик. Клетки суспендировали в соответствующей среде и равномерно засевали в планшеты с 24/96 ячейками. Непосредственно в клеточную суспензию добавляли один из следующих препаратов: блеомицин, цисплатин, митомицин С, доксорубицин и таксол добавляли непосредственно в клеточную суспензию при конечной концентрации приблизительно от 1•10-4 (1Е-4) до 1,3•10-9 (1,3Е-9). Электрические импульсы, генерируемые порообразующим устройством с импульсами прямоугольной формы ВТХ Т 820, подавали на клеточные суспензии в микропланшетах с использованием электрода ВТХ в виде комплекта иголок, как описано здесь. В зависимости от эксперимента с помощью выключателя комплекта иголок ЕРТ-196 между двумя противоположными парами шестиугольной конфигурации подавали 6 импульсов длительностью или 100 мкс, или 10 мс и при различных номинальных электрических полях высокого напряжения или низкого напряжения. Микропланшеты инкубировали или в течение 20 ч, или 70 ч и определяли выживание клеток с помощью теста ХТТ. Некоторые результаты представлены на фиг. 15(А), 15(В), 16(A), 16(В) и 17.
Кривые, соответствующие фиг. 17, были получены с использованием MedPulserТМ.
Для режима ННБПИ способ показывает, что выживаемость клеток намного ниже 50%, даже когда на клетки подаются импульсы в отсутствие препаратов; эта процентная доля еще больше снижается, когда импульсы комбинируются с препаратами. Более желательно показать, что эффект скорее оказывают препараты, а не импульсы, и требуется выбор исходных величин выживания на уровне приблизительно 80% при использовании только импульсации. Типичные кривые уничтожения клеток в режиме ННБПИ показаны на фиг.15(А).
Хотя изобретение было описано со ссылкой на предпочтительные в настоящее время варианты реализации, следует понимать, что могут быть внесены различные модификации без отхода от сущности изобретения. Соответственно, изобретение ограничено только следующей формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ С ВВЕДЕНИЕМ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ И ГЕНОВ ПОСРЕДСТВОМ ЭЛЕКТРОПОРАЦИИ | 1996 |
|
RU2168337C2 |
| СИСТЕМА ДЛЯ КЛИНИЧЕСКОГО ПРИМЕНЕНИЯ ЭЛЕКТРОПОРАЦИИ С ОБРАТНОЙ СВЯЗЬЮ, УПРАВЛЯЮЩЕЙ НАПРЯЖЕНИЕМ | 1995 |
|
RU2141853C1 |
| АППЛИКАТОР И СИСТЕМА ДЛЯ ЭЛЕКТРОПОРАЦИИ | 2019 |
|
RU2792194C2 |
| Способ лечения больных с повышенной активностью регуляторных систем | 2015 |
|
RU2617197C1 |
| УСТРОЙСТВО ДЛЯ КОМБИНИРОВАННОЙ ЛАЗЕРНОЙ ДОСТАВКИ ЛЕКАРСТВ | 2001 |
|
RU2224556C2 |
| УСТРОЙСТВО ДЛЯ ЛОКАЛЬНОЙ УВЧ-ГИПЕРТЕРМИИ | 2007 |
|
RU2372116C2 |
| УСТРОЙСТВО ДЛЯ ГИПЕРТЕРМИИ | 2009 |
|
RU2509579C2 |
| СПОСОБ ЛЕЧЕНИЯ МЕТОДОМ ЛОКАЛЬНОЙ ГИПЕРТЕРМИИ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1994 |
|
RU2104066C1 |
| ИГОЛЬЧАТЫЙ ЭЛЕКТРОД | 2002 |
|
RU2308985C2 |
| Устройство для электропорации | 2018 |
|
RU2711511C1 |





Изобретение относится к области медицины. Способ и устройство предназначены для электропорообразующей терапии. С использованием электропорообразующей терапии (ЭПТ) и химиотерапевтического средства была вызвана регрессия опухолей in vivo. В одном варианте реализации способ представляет ЭПТ с использованием низкого напряжения и большой длительности импульса для индуцирования гибели клеток. В одном варианте устройство для клинического электропорообразования включает электрод в виде группы иголок, который определяет заданную величину напряжения импульса лечения. Ряд конструкций электродного аппликатора обеспечивает возможность доступа и лечения разных участков ткани. Другой вариант реализации предоставляет лапароскопический игольный аппликатор, который предпочтительно комбинируется с эндоскопом для минимально инвазивной ЭПТ. Способ и устройство позволяют увеличить прочищаемость клетки при доставке фармацевтических соединений и генов. 14 с. и 54 з. п. ф-лы, 17 ил., 9 табл.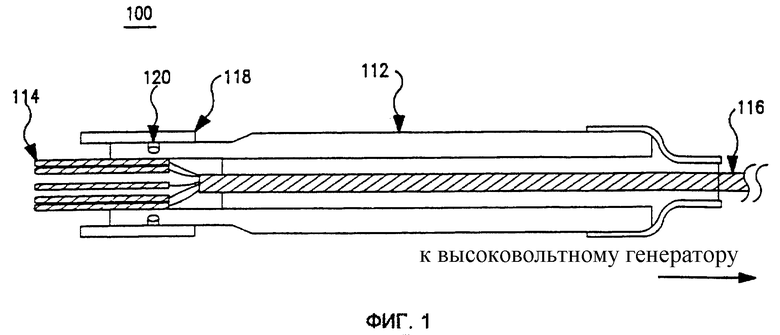
| US 5273525 A, 28.12.1993 | |||
| US 5389069 A, 14.02.1995 | |||
| RU 94032104 А1, 10.06.1996. |
Авторы
Даты
2002-12-27—Публикация
1998-07-31—Подача